EFEK IMUNOSTIMULATOR EKSTRAK ETANOL UMBI
KELADI TIKUS (Typhonium flagelliforme (Lodd) Blume)
TERHADAP RESPON HIPERSENSITIVITAS
TIPE LAMBAT DAN TITER ANTIBODI
SEL IMUN MENCIT JANTAN
SKRIPSI
OLEH:
MUAMMAR ALFAROUQ
NIM 060804052
`
PROGRAM SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
EFEK IMUNOSTIMULATOR EKSTRAK ETANOL UMBI
KELADI TIKUS (Typhonium flagelliforme (Lodd) Blume)
TERHADAP RESPON HIPERSENSITIVITAS
TIPE LAMBAT DAN TITER ANTIBODI
SEL IMUN MENCIT JANTAN
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
MUAMMAR ALFAROUQ
NIM 060804052
PROGRAM SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
EFEK IMUNOSTIMULATOR EKSTRAK ETANOL UMBI KELADI TIKUS (Typhonium flagelliforme (Lodd) Blume) TERHADAP
RESPON HIPERSENSITIVITAS TIPE LAMBAT DAN TITER ANTIBODI SEL IMUN MENCIT JANTAN
OLEH:
MUAMMAR ALFAROUQ NIM 060804052
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal : Juni 2012
Pembimbing I, Panitia Penguji,
Prof. Dr. Urip Harahap, Apt. Prof. Dr. Sumadio Hadisahputra, Apt.
NIP 195301011983031004 NIP 195311281983031002
Pembimbing II, Prof. Dr. Urip Harahap, Apt.
NIP 195301011983031004
Drs. Awaluddin Saragih, M.Si., Apt.
NIP 195008221974121002 Drs. Rasmadin Mukhtar, MS., Apt.
NIP 194909101980031002
Dra. Aswita Hafni Lubis, M.Si., Apt. NIP 195304031983032001
Medan, Juni 2012 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Allah SWT yang Maha Kuasa
yang telah melimpahkan nikmat, rahmat, karunia, dan kasih sayang-Nya, sehingga
penulis dapat menyelesaikan skripsi ini, yang berjudul “Efek imunostimulator
ekstrak etanol umbi keladi tikus (Typhonium flagelliforme (Lodd) Blume.)
terhadap respon hipersensitivitas tipe lambat dan titer antibodi sel imun mencit
jantan”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar
Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Bapak
Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas
Sumatera Utara yang telah memberikan bantuan dan fasilitas selama masa
pendidikan. Penulis juga mengucapkan terima kasih yang sebesar-besarnya
kepada Bapak Prof. Dr. Urip Harahap, Apt., dan Bapak Drs. Awaluddin Saragih,
M.Si., Apt., selaku pembimbing yang telah memberikan banyak waktu,
bimbingan, dan nasehat selama penelitian hingga selesainya penyusunan skripsi
ini. Selain itu, penulis juga mengucapkan terima kasih kepada Bapak Prof. Dr.
Sumadio Hadisahputra., Apt., Bapak Drs. Rasmadin Mukhtar, MS., Apt., dan Ibu
Dra. Aswita Hafni Lubis, M.Si., Apt., selaku penguji yang telah memberikan
evaluasi dan masukan kepada penulis dalam penyusunan skripsi ini. Juga kepada
Ibu Dra. Siti Nurbaya, M.Si., Apt selaku dosen pembimbing akademik penulis
selama menjalani perkuliahan di Fakultas Farmasi USU.
Penulis mengucapkan terima kasih dan rasa sayang yang tak terhingga
segala-galanya, juga kepada kedua adik penulis Maulana Chalid Albanna dan
Fatiya Kamila Hanoum atas doa dan dukungannya dalam penyelesaian skripsi ini.
Penulis juga mengucapkan terima kasih sebesar-besarnya kepada para
sahabat dan rekan-rekan seperjuangan angkatan 2006 : Yogi, Rico, Azhar, Aulia,
Hendra, Gokman, Rian, Roni, Ari, Jon, Jandri, juga kepada semua orang di
Laboratorium Farmakologi Farmasi : Bapak Drs. Saiful Bahri, M.S., Apt, Ibu
Marianne, M.Si., Apt, Abangnda Imam Bagus Sumantri, M.Si, Apt, Dadang Irfan
Husori., Apt, dan Abdi Wira Septama, M.Sc serta adik-adik asisten Puji, Yani,
Aristo, Meliza, Fany, atas semua dukungan dan doa dalam penyelesaian skripsi
ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan,
sehingga penulis mengharapkan kritik dan saran yang bersifat membangun. Akhir
kata, semoga tulisan ini dapat bermanfaat bagi pembaca dan menjadi sumbangan
yang berarti bagi ilmu pengetahuan khususnya dalam bidang ilmu farmasi.
Medan, Juni 2012 Penulis,
EFEK IMUNOSTIMULATOR EKSTRAK ETANOL UMBI KELADI TIKUS (Typhonium flagelliforme (Lodd) Blume) TERHADAP
RESPON HIPERSENSITIVITAS TIPE LAMBAT DAN TITER ANTIBODI SEL IMUN MENCIT JANTAN
ABSTRAK
Sistem imun pada manusia berperan penting untuk mempertahankan kondisi tubuh dari serangan agen-agen penyebab infeksi, seperti mikroorganisme patogen. Dalam keadaan sistem imun tidak mampu bekerja dengan baik, peningkatan sistem imun menjadi sangat penting agar sistem imun tetap bekerja dengan maksimal. Peningkatan sistem imun dapat dilakukan dengan menggunakan imunomodulator, khususnya yang bersifat imunostimulan.
Menurut Wagner (1990), terdapat dua kelas senyawa yang memiliki aktivitas imunostimulasi potensial. Kelas pertama terdiri dari senyawa-senyawa alkaloid, terpenoid, kuinon dan senyawa fenolik sederhana, sedangkan kelas kedua terdiri dari polisakarida, peptida, glikoprotein dan nukleotida. Tumbuhan keladi tikus (Typhonium flagelliforme (Lodd) Blume), suku Araceae, sudah banyak digunakan dalam pengobatan tradisional oleh masyarakat. Berdasarkan hasil skrining fitokimia oleh Nasution (2010) dan Nobakht et al., (2007), diketahui keladi tikus mengandung senyawa alkaloid dan triterpenoid, sehingga diduga umbi keladi tikus memiliki aktivitas stimulasi terhadap sistem imun. Tujuan dari penelitian ini adalah untuk mengetahui adanya efek imunostimulator ekstrak etanol umbi keladi tikus terhadap respon hipersensitivitas tipe lambat dan titer antibodi sel imun pada mencit jantan.
Pada penelitian ini dilakukan uji efek imunostimulator ekstrak etanol umbi keladi tikus terhadap respon hipersensitivitas tipe lambat dan titer antibodi sel imun mencit jantan. Ekstrak etanol umbi keladi tikus diberikan secara oral dengan dosis 100 mg/kg BB, 200 mg/kg BB, 400 mg/kg BB. Siklofosfamida dosis 50 mg/kg BB sebagai kontrol positif, suspensi CMC 1% sebagai kontrol negatif dan sel darah merah domba (Ovis aries) digunakan sebagai antigen.
Berdasarkan hasil pengujian statistik menggunakan ANAVA satu arah, pemberian ekstrak umbi keladi tikus diketahui meningkatkan respon hipersensitivitas tipe lambat dan titer antibodi secara signifikan terhadap kelompok kontrol (p<0,05). Dengan demikian disimpulkan bahwa ekstrak umbi keladi tikus mempunyai efek imunostimulator terhadap respon hipersensitivitas tipe lambat dan titer antibodi sel imun mencit jantan.
THE IMMUNOSTIMULATORY EFFECT OF RODENT TUBER (Typhonium flagelliforme (Lodd) Blume) ETHANOLIC EXTRACT
TO DELAYED TYPE HYPERSENSITIVITY RESPONSE AND IMMUNITY CELLS ANTIBODY TITER OF MALE MICE
ABSTRACT
The immune system in humans holds an important key role in maintaining the body condition from the invasion of infectious agents, such as pathogenic microorganisms. In the event where the immune system is unable to work adequately, the improvement of the immune system becomes very important to keep it working in maximal condition. The improvement of the immune system can be achieved by using immunomodulatory agents, especially those with immunostimulatory properties.
According to Wagner (1990), there are two class of compounds with potential immunostimulatory activity. The first consists of alkaloid compounds, terpenoids, quinones, and simple phenolic compounds, while the second class consists of polysaccharides, peptides, glycoproteins and nucleotides. Rodent tuber plant (Typhonium flagelliforme (Lodd) Blume), fam. Araceae, is widely used in traditional medicine. Based of the result of pythochemical screening by Nasution (2010) and Nobakht et al., (2007), rodent tuber was found to contains alkaloids and triterpenoids, therefore it is suspected the tuber of the plant has stimmulation activity to the immune system. The objective of this study was to observe the immunostimulatory effect of the ethanolic extract of rodent tuber to delayed type hypersensitivity response and immunity cells of male mice.
In this study, the immunostimulatory effect test of rodent tuber ethanolic extract was conducted to delayed type hypersensitivity response and antibody titer of immunity cells of male mice. The rodent tuber ethanolic extract was administered orally with the doses of 100 mg/kg, 200 mg/kg, and 400 mg/kg. Cyclophosphamide with the dose of 50 mg/kg was used as positive control, 1% CMC suspension was used as negative control and sheep (Ovis aries) red blood cells was used as antigens
Based on the result of statistical test using One Way-ANOVA, the administration of rodent tuber ethanolic extract was found to increase the delayed-type hypersensitivity response and antibody titer significantly against the control group (p<0,05). Thus, it is concluded that the ethanolic extract of rodent tuber has immunostimulatory effect to delayed type hypersensitivity response and immunity cells antibody titer of male mice.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
ABSTRAK ... v
ABSTRACT ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 3
1.3. Hipotesis ... 3
1.4. Tujuan Penelitian ... 4
1.5. Manfaat Penelitian ... 4
1.6. Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1. Uraian Tumbuhan... 6
2.1.1. Sistematika Tumbuhan ... 6
2.1.2. Sinonim ... 6
2.1.4. Nama Asing ... 6
2.1.5. Habitat dan Penyebaran ... 7
2.1.6. Morfologi ... 7
2.1.7. Kandungan Kimia ... 7
2.1.8. Khasiat Tumbuhan ... 7
2.2. Ekstraksi ... 7
2.3. Metode-Metode Ekstraksi... 8
2.4. Sistem Imun ... 10
2.4.1. Respon Imun Nonspesifik ... 11
2.4.2. Respon Imun Spesifik ... 12
2.4.3. Imunomodulator ... 17
2.4.4. Siklofosfamida ... 18
2.4.5. Metode Pengujian Efek Imunomodulator ... 19
BAB III METODE PENELITIAN ... 20
3.1. Alat dan Bahan ... 20
3.1.1. Alat-alat ... 20
3.1.2. Bahan-bahan ... 21
3.1.3. Hewan Percobaan ... 21
3.2. Penyiapan Sampel ... 21
3.3. Pemeriksaan Karakterisasi Simplisia ... 22
3.3.1. Pemeriksaan Makroskopik ... 22
3.3.2. Pemeriksaan Mikroskopik ... 22
3.3.3. Penetapan Kadar Air Simplisia ... 22
3.3.5. Penetapan Kadar Sari yang Larut dalam Etanol ... 23
3.3.6. Penetapan Kadar Abu Total ... 24
3.3.7. Penetapan Kadar Abu Tidak Larut Asam ... 24
3.4. Pembuatan Ekstrak Etanol Umbi Keladi Tikus ... 25
3.5. Uji Efek Imunomodulator ... 25
3.5.1. Penyiapan Hewan Percobaan ... 25
3.5.2. Penyiapan Kontrol, Bahan Uji, Larutan Penyangga dan Antigen ... 26
3.5.2.1. Penyiapan CMC 1% ... 26
3.5.2.2. Penyiapan Suspensi Siklofosfamida 0,5% .. 26
3.5.2.3. Penyiapan Suspensi Ekstrak Umbi Keladi Tikus 2% ... 27
3.5.2.4. Penyiapan Phospate Buffered Saline ... 27
3.5.2.5. Penyiapan Sel Darah Merah Domba ... 27
3.5.3. Uji Respon Hipersensitivitas Tipe Lambat ... 28
3.5.4. Uji Titer Antibodi ... 29
3.6. Analisis Data ... 30
BAB IV HASIL DAN PEMBAHASAN ... 31
4.1. Simplisia dan Ekstrak ... 31
4.2. Pengujian Efek Imunomodulator ... 32
4.2.1. Respon Hipersensitivitas Tipe Lambat ... 35
4.2.2. Titer Antibodi ... 38
BAB V KESIMPULAN DAN SARAN ... 42
5.1. Kesimpulan ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Halaman
Tabel 4.1. Hasil Pemeriksaan Karakterisasi Simplisia ... 32
Tabel 4.2. Volume Pembengkakan Kaki Mencit dan Nilai Titer
DAFTAR GAMBAR
Halaman
Gambar 1.1. Diagram Kerangka Pikir Penelitian ... 5
Gambar 4.1. Volume Pembengkakan Kaki Mencit Pada Berbagai
Perlakuan (Rerata ±SEM) ... 36
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Surat Keterangan Sampel Umbi Keladi Tikus ... 46
Lampiran 2 Hasil identifikasi Umbi Keladi Tikus ... 47
Lampiran 3 Gambar Karakteristik Sampel ... 48
Lampiran 4 Gambar Mikroskopik serbuk simplisia umbi keladi tikus, perbesaran 10 x 40 ... 50
Lampiran 5 Perhitungan Hasil Pemeriksaan Karakterisasi Simplisia ... 51
Lampiran 6 Bagan Alur Penelitian ... 56
Lampiran 7 Gambar Alat-alat ... 57
Lampiran 8 Gambar Hewan Percobaan ... 60
Lampiran 9 Pembengkakan Kaki Mencit dan Hemaglutinasi ... 61
EFEK IMUNOSTIMULATOR EKSTRAK ETANOL UMBI KELADI TIKUS (Typhonium flagelliforme (Lodd) Blume) TERHADAP
RESPON HIPERSENSITIVITAS TIPE LAMBAT DAN TITER ANTIBODI SEL IMUN MENCIT JANTAN
ABSTRAK
Sistem imun pada manusia berperan penting untuk mempertahankan kondisi tubuh dari serangan agen-agen penyebab infeksi, seperti mikroorganisme patogen. Dalam keadaan sistem imun tidak mampu bekerja dengan baik, peningkatan sistem imun menjadi sangat penting agar sistem imun tetap bekerja dengan maksimal. Peningkatan sistem imun dapat dilakukan dengan menggunakan imunomodulator, khususnya yang bersifat imunostimulan.
Menurut Wagner (1990), terdapat dua kelas senyawa yang memiliki aktivitas imunostimulasi potensial. Kelas pertama terdiri dari senyawa-senyawa alkaloid, terpenoid, kuinon dan senyawa fenolik sederhana, sedangkan kelas kedua terdiri dari polisakarida, peptida, glikoprotein dan nukleotida. Tumbuhan keladi tikus (Typhonium flagelliforme (Lodd) Blume), suku Araceae, sudah banyak digunakan dalam pengobatan tradisional oleh masyarakat. Berdasarkan hasil skrining fitokimia oleh Nasution (2010) dan Nobakht et al., (2007), diketahui keladi tikus mengandung senyawa alkaloid dan triterpenoid, sehingga diduga umbi keladi tikus memiliki aktivitas stimulasi terhadap sistem imun. Tujuan dari penelitian ini adalah untuk mengetahui adanya efek imunostimulator ekstrak etanol umbi keladi tikus terhadap respon hipersensitivitas tipe lambat dan titer antibodi sel imun pada mencit jantan.
Pada penelitian ini dilakukan uji efek imunostimulator ekstrak etanol umbi keladi tikus terhadap respon hipersensitivitas tipe lambat dan titer antibodi sel imun mencit jantan. Ekstrak etanol umbi keladi tikus diberikan secara oral dengan dosis 100 mg/kg BB, 200 mg/kg BB, 400 mg/kg BB. Siklofosfamida dosis 50 mg/kg BB sebagai kontrol positif, suspensi CMC 1% sebagai kontrol negatif dan sel darah merah domba (Ovis aries) digunakan sebagai antigen.
Berdasarkan hasil pengujian statistik menggunakan ANAVA satu arah, pemberian ekstrak umbi keladi tikus diketahui meningkatkan respon hipersensitivitas tipe lambat dan titer antibodi secara signifikan terhadap kelompok kontrol (p<0,05). Dengan demikian disimpulkan bahwa ekstrak umbi keladi tikus mempunyai efek imunostimulator terhadap respon hipersensitivitas tipe lambat dan titer antibodi sel imun mencit jantan.
THE IMMUNOSTIMULATORY EFFECT OF RODENT TUBER (Typhonium flagelliforme (Lodd) Blume) ETHANOLIC EXTRACT
TO DELAYED TYPE HYPERSENSITIVITY RESPONSE AND IMMUNITY CELLS ANTIBODY TITER OF MALE MICE
ABSTRACT
The immune system in humans holds an important key role in maintaining the body condition from the invasion of infectious agents, such as pathogenic microorganisms. In the event where the immune system is unable to work adequately, the improvement of the immune system becomes very important to keep it working in maximal condition. The improvement of the immune system can be achieved by using immunomodulatory agents, especially those with immunostimulatory properties.
According to Wagner (1990), there are two class of compounds with potential immunostimulatory activity. The first consists of alkaloid compounds, terpenoids, quinones, and simple phenolic compounds, while the second class consists of polysaccharides, peptides, glycoproteins and nucleotides. Rodent tuber plant (Typhonium flagelliforme (Lodd) Blume), fam. Araceae, is widely used in traditional medicine. Based of the result of pythochemical screening by Nasution (2010) and Nobakht et al., (2007), rodent tuber was found to contains alkaloids and triterpenoids, therefore it is suspected the tuber of the plant has stimmulation activity to the immune system. The objective of this study was to observe the immunostimulatory effect of the ethanolic extract of rodent tuber to delayed type hypersensitivity response and immunity cells of male mice.
In this study, the immunostimulatory effect test of rodent tuber ethanolic extract was conducted to delayed type hypersensitivity response and antibody titer of immunity cells of male mice. The rodent tuber ethanolic extract was administered orally with the doses of 100 mg/kg, 200 mg/kg, and 400 mg/kg. Cyclophosphamide with the dose of 50 mg/kg was used as positive control, 1% CMC suspension was used as negative control and sheep (Ovis aries) red blood cells was used as antigens
Based on the result of statistical test using One Way-ANOVA, the administration of rodent tuber ethanolic extract was found to increase the delayed-type hypersensitivity response and antibody titer significantly against the control group (p<0,05). Thus, it is concluded that the ethanolic extract of rodent tuber has immunostimulatory effect to delayed type hypersensitivity response and immunity cells antibody titer of male mice.
BAB I PENDAHULUAN
1.1Latar Belakang
Bangsa Indonesia telah lama mengenal dan menggunakan tanaman berkhasiat
obat sebagai salah satu upaya dalam menanggulangi masalah kesehatan.
Pengetahuan tentang tanaman berkhasiat obat berdasar pada pengalaman dan
keterampilan yang secara turun temurun telah diwariskan dari satu generasi ke
generasi berikutnya (Sari, 2006).
Keadaan kesehatan dan perekonomian masyarakat Indonesia umumnya masih
tertinggal dibandingkan dengan negara lain, sehingga pemenuhan kebutuhan obat
sintetis menjadi terhambat oleh faktor biaya. Rendahnya tingkat kesehatan
masyarakat kita dapat dilihat dari angka kematian masyarakat Indonesia yang
masih berada di urutan pertengahan di antara negara-negara anggota ASEAN,
dengan kisaran angka kematian kasar 6 sampai 10 kematian per 1000 penduduk.
Angka kematian yang tinggi ini disebabkan tingginya jumlah penyakit terutama
oleh paparan mikroorganisme patogen seperti virus, bakteri dan jamur yang ada di
lingkungan sekitar (Depkes RI, 2006).
Pada keadaan normal, paparan mikroorganisme patogen terhadap tubuh dapat
dilawan oleh sistem pertahanan tubuh (sistem imun). Hal ini berhubungan dengan
peran yang ditunjukkan oleh fungsi dan jumlah sel imun. Namun, pada saat fungsi
dan jumlah sel imun kurang memadai, paparan mikroorganisme patogen dapat
menimbulkan berbagai penyakit terutama terkait dengan penyakit infeksi. Oleh
penting sehingga mampu menghadapi serangan zat asing seperti mikroorganisme
patogen. Salah satu cara mempertahankan sistem imun adalah dengan pemberian
imunomodulator, terutama zat yang meningkatkan sistem imun atau
imunostimulator (Bellanti, 1993).
Imunostimulator adalah senyawa yang dapat meningkatkan respon imun.
Imunostimulator dapat mereaktivasi sistem imun dengan berbagai cara seperti
meningkatkan jumlah dan aktivitas sel T, NK-cells dan makrofag serta
melepaskan interferon dan interleukin (Tan dan Rahardja, 2007).
Penggunaan imunostimulator dalam terapi kadang kala mengalami hambatan.
Di antara hambatan yang sering kali muncul adalah mahalnya imunostimulator
yang tersedia di pasaran obat paten, yang mayoritas diimpor dari luar negeri.
Dalam kondisi demikian, sangat perlu dipertimbangkan untuk mendapatkan
imunostimulator dari bahan alam, oleh karena faktor harga dapat ditekan
(Kusmardi, 2007).
Menurut Wagner (1990), terdapat dua kelas senyawa yang memiliki aktivitas
imunostimulasi potensial. Kelas pertama terdiri dari senyawa-senyawa alkaloid,
terpenoid, kuinon dan senyawa fenolik sederhana, sedangkan kelas kedua terdiri
dari polisakarida, peptida, glikoprotein dan nukleotida.
Keladi tikus (Typhonium flagelliforme) termasuk ke dalam suku Araceae.
Pada Materia Medika Indonesia (MMI) belum ditemukan monografi umbi keladi
tikus. Menurut penelitian terdahulu, keladi tikus ini mengandung senyawa
alkaloid, triterpenoid, dan lignan (polifenol) (Harfia, 2006).
Ekstrak polar tanaman ini telah diuji secara in vivo dan diketahui dapat
(Zhong, et.al., 2001). Studi farmakologis yang dilakukan terhadap tikus juga
menunjukkan bahwa ekstrak keladi tikus dapat mencegah hepatokarsinogenesis
(Lai, et.al., 1999). Hasil skrining fitokimia menunjukkan bahwa alkaloid,
flavonoid dan terpenoid merupakan konstituen fitokimia utama dari keladi tikus
(Nobakht, et.al., 2010).
Berdasarkan uraian di atas, maka peneliti tertarik untuk melakukan uji
mengenai efek imunostimulator dari ekstrak etanol umbi keladi tikus terhadap
respon hipersensitivitas tipe lambat dan titer antibodi sel imun mencit jantan.
1.2Perumusan Masalah
Berdasarkan uraian di atas maka perumusan masalah pada penelitian ini
adalah:
a. apakah ekstrak etanol umbi keladi tikus dapat meningkatkan respon
hipersensitivitas tipe lambat pada mencit jantan?
b. apakah ekstrak etanol umbi keladi tikus dapat meningkatkan titer antibodi sel
imun mencit jantan?
1.3Hipotesis
Berdasarkan perumusan masalah di atas, maka dibuat hipotesis sebagai
berikut:
a. ekstrak etanol umbi keladi tikus dapat meningkatkan respon hipersensitivitas
tipe lambat mencit jantan.
b. ekstrak etanol umbi keladi tikus dapat meningkatkan titer antibodi sel imun
1.4Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah sebagai berikut:
a. untuk mengetahui efek imunostimulator ekstrak etanol umbi keladi tikus
dengan meningkatkan respon hipersensitivitas tipe lambat mencit jantan.
b. untuk mengetahui efek imunostimulator ekstrak etanol umbi keladi tikus
dengan meningkatkan titer antibodi sel imun mencit jantan.
1.5Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah sebagai berikut:
a. dapat menjadi dasar pengembangan umbi keladi tikus menjadi suatu sediaan
herbal terstandar dengan efek imunostimulator.
b. dapat menambah inventaris tanaman obat yang berkhasiat sebagai
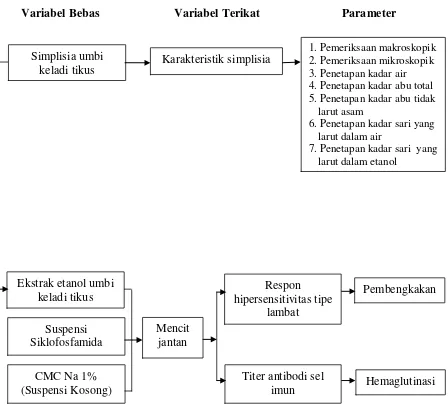
1.6Kerangka Pikir Penelitian
Adapun kerangka pikir penelitian ini ditunjukkan pada Gambar 1.1.
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Diagram Kerangka Pikir Penelitian
Simplisia umbi 3. Penetapan kadar air 4. Penetapan kadar abu total 5. Penetapan kadar abu tidak
larut asam
6. Penetapan kadar sari yang larut dalam air
7. Penetapan kadar sari yang larut dalam etanol
Titer antibodi sel
imun Hemaglutinasi
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan 2.1.1 Sistematika Tumbuhan
Sistematika dari tumbuhan Keladi Tikus adalah sebagai berikut :
Divisio : Spermatophyta
Sub divisio : Gymnospermae
Classsis : Dicotyledonae
Ordo : Arales
Familia : Araceae
Genus : Typhonium
Spesies : Typhonium flagelliforme (Anonim, 2009)
2.1.2 Sinonim
Sinonim : Typhonium divaricatum
Coleus amboinicus Lour (Anonim, 2009)
2.1.3 Nama Daerah
Nama daerah dari tumbuhan Keladi tikus adalah: gofu sepa (Ternate); bira
kecil, daun panta susu, ki babi, trenggiling mentik, ileus, kalamoyang.
2.1.4 Nama Asing
Nama daerah dari tumbuhan Keladi tikus adalah: rodent tuber (Inggris),
2.1.5 Habitat dan Penyebaran
Tumbuh di tempat terbuka pada ketinggian 1000 meter di atas permukaan
laut. Terdapat di Malaysia, Korea bagian selatan, dan Indonesia. Di Indonesia
penyebarannya terdapat di sepanjang pulau Jawa, sebagian Kalimantan dan
Sumatra dan Papua. (Mudahar et.al., 2006).
2.1.6 Morfologi
Tanaman keladi tikus adalah tanaman sejenis talas setinggi 25 cm hingga 30
cm, termasuk tumbuhan semak, menyukai tempat lembab yang tak terkena sinar
matahari langsung. Tanaman berbatang basah ini biasanya tumbuh di tempat
terbuka pada ketinggian 1000 meter di atas permukaan laut. Bentuk daun bulat
dengan ujung runcing berbentuk jantung. Berwarna hijau segar. Umbi berbentuk
bulat rata sebesar buah pala (Mudahar et.al., 2006).
2.1.7 Kandungan Kimia
Tanaman Keladi tikus Typhonium flagelliforme mengandung: Alkaloid,
triterpenoid dan lignan (polifenol).
2.1.8 Khasiat Tumbuhan
Umbi Keladi Tikus berkhasiat sebagai obat borok, luka, koreng, kanker, juga
berkhasiat sebagai antivirus dan anti bakteri (Hariana, 2007)
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair
Hasil dari ekstraksi disebut dengan ekstrak yaitu sediaan kental yang
diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia
hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua
pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian
sehingga memenuhi baku yang telah ditetapkan (Ditjen POM, 1995).
Farmakope Indonesia menetapkan bahwa cairan penyari untuk ekstraksi
adalah air, etanol, dan etanol-air atau eter. Penyarian pada perusahaan obat
tradisional masih terbatas pada penggunaan penyari air, etanol, atau etanol-air
(Ditjen POM, 1989).
2.3 Metode-Metode Ekstraksi
Ekstraksi dengan menggunakan pelarut terdiri dari 2 cara, yaitu:
1. Cara dingin
Ekstraksi menggunakan pelarut dengan cara dingin terdiri dari:
a. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan
menggunakan pelarut dengan beberapa kali pengocokan atau
pengadukan pada temperatur ruangan.
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna yang umumnya dilakukan pada temperatur ruangan.
Proses terdiri dari tahapan pengembangan bahan, tahap maserasi
antara, tahap perkolasi sebenarnya (penetesan/penampungan
2. Cara panas
Ekstraksi menggunakan pelarut dengan cara panas terdiri dari:
a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik
didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang
relatif konstan dengan adanya pendingin balik.
b. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru
yang umumnya dilakukan dengan alat khusus sehingga terjadi
ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan
adanya pendingin balik.
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur kamar (40-50oC).
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas
air (bejana infus tercelup dalam penangas air mendidih, temperatur
terukur 96-98oC) selama waktu tertentu (15-20 menit).
e. Dekok
Dekok adalah infus pada waktu yang lebih lama (30 menit) dan
2.4Sistem Imun
Sistem imun adalah sistem pertahanan tubuh yang terdiri dari sel atau
gabungan sel, molekul-molekul, dan atau jaringan yang berperan dalam penolakan
mikroorganisme penyebab infeksi. Sistem imun berguna sebagai perlindungan
terhadap infeksi molekul lain seperti virus, bakteri, protozoa dan parasit (Salmon,
1989).
Semua makhluk hidup vertebrata mampu memberikan tanggapan dan
menolak benda-benda atau konfigurasi yang dianggap asing oleh tubuhnya.
Kemampuan ini disebabkan oleh sel-sel khusus yang mampu mengenali dan
membedakan konfigurasi asing (non-self) dari konfigurasi yang berasal dari
tubuhnya sendiri (self). Sel khusus tersebut adalah limfosit yang merupakan sel
imunokompeten dalam sistem imun. Konfigurasi asing tersebut dinamakan
antigen atau imunogen, sedangkan proses serta fenomena yang menyertainya
dinamakan respon imun (Subowo, 1993).
Tahap awal mekanisme tubuh dalam mengenal molekul asing adalah tahap
pengenalan. Ada 2 sistem pertahanan tubuh yang berperan dalam hal ini, yaitu:
1. Sistem pertahanan tubuh alamiah (innate immune system) merupakan
sistem kekebalan yang dibawa sejak lahir dan menjadi pertahanan tubuh
paling terdepan dalam menghadapi mikroorganisme penyebab penyakit.
Sel-sel fagosit memegang peranan penting dalam mengenal
mikroorganisme tertentu dan segera menghancurkannya.
2. Sistem pertahanan tubuh yang didapat (adaptive immune system), dalam
hal ini antibodi memegang peranan utama. Dalam mengenal molekul asing
beberapa segmen dari gen sehingga terbentuk suatu reseptor yang spesifik
untuk molekul tertentu (Handojo, 2003).
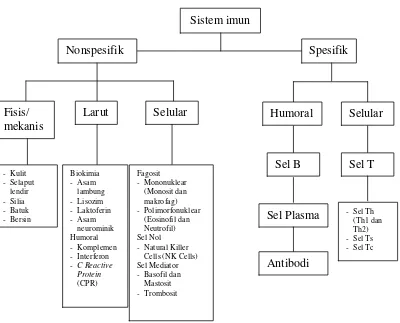
Bila sistem imun bekerja pada zat yang diangap asing, maka ada dua jenis
respon imun yang mungkin terjadi, yaitu respon imun nonspesifik dan respon
imun spesifik (Kresno, 2010).
Gambar 2.1 Diagram Sistem Imun (Baratawidjaja, 2001)
2.4.1 Respon Imun Nonspesifik
Respon imun nonspesifik pada umumnya merupakan imunitas bawaan
(innate immunity), artinya bahwa respon terhadap zat asing yang masuk ke dalam
tubuh dapat terjadi walaupun tubuh belum pernah terpapar pada zat tersebut
melindungi tubuh dari kerusakan yang diakibatkannya, tetapi tidak mampu
mengenali dan mengingat zat asing tersebut. Komponen-komponen utama respon
imun nonspesifik adalah pertahanan fisik, kimiawi, humoral dan selular.
Pertahanan ini meliputi epitel dan zat-zat antimikroba yang dihasilkan
dipermukaannya, berbagai jenis protein dalam darah termasuk
komplemen-komplemen sistem komplemen-komplemen, mediator inflamasi lainnya dan berbagai sitokin,
sel-sel fagosit yaitu sel-sel polimorfonuklear, makrofag dan sel natural killer
(NK) (Kresno, 2010).
2.4.2 Respon Imun Spesifik
Respon imun spesifik merupakan imunitas yang didapat (adaptive immunity)
dimulai dari pengenalan zat asing hingga penghancuran zat asing tersebut dengan
berbagai mekanisme (Subowo, 1993). Dalam respon imun spesifik, limfosit
merupakan sel yang memainkan peranan penting karena sel ini mampu mengenali
setiap antigen yang masuk ke dalam tubuh, baik yang terdapat intraseluler
maupun ekstraseluler. Secara umum, limfosit dibedakan menjadi dua jenis yaitu
limfosit T dan limfosit B. Respon imun spesifik dapat dibagi dalam 3 golongan,
yaitu respon imun seluler, respon imun humoral dan interaksi antara respon imun
selular dengan respon imun humoral (Kresno, 2010).
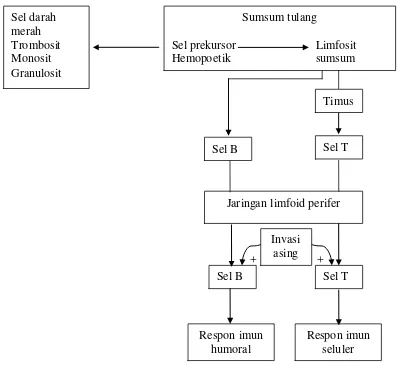
Limfosit T dan B (sel T dan B) berasal dari sel induk yang sama yaitu di
sumsum tulang belakang. Pada masa janin dan anak-anak, limfosit imatur
bermigrasi ke timus dan mengalami pengolahan lebih lanjut menjadi limfosit T.
+ +
Gambar 2.2 Diagram Asal Sel B dan Sel T (Sherwood, 2001)
Sel B berasal dari limfosit yang matang dan berdiferensiasi di sumsum
tulang, sedangkan sel T berasal dari limfosit yang berasal dari sumsum tulang
tetapi matang di timus. Sel T dan B yang matang mengalir melalui darah dan
berdiam di jaringan limfoid perifer dan membentuk koloni. Kedua sel ini akan
berproliferasi setelah mendapat stimulasi dengan adanya invasi asing.
Sel T
Sel T adalah sel yang bertanggung jawab dalam respon imun selular. Sel T
i. Sel Thelper (Sel Th)
Sel Th adalah sel yang membantu meningkatkan perkembangan sel B aktif
menjadi sel plasma, memperkuat aktivitas sel T sitotoksik dan sel T supresor yang
sesuai, dan mengaktifkan makrofag. Sel Th dapat dibedakan menjadi sel Th1 dan
Th2. Sel Th1 berperan sebagai limfosit yang akan melepaskan sitokin yang
bersifat proinflamasi, sedangkan sel Th2 berperan dalam memproduksi antibodi
dengan menstimulasi sel B menjadi sel plasma (Sherwood, 2001).
ii. Sel Tsuppresor (Sel Ts)
Sel Ts adalah sel yang berperan dalam membatasi reaksi imun melalui
mekanisme “check and balance”dengan limfosit yang lain. Sel Ts menekan
aktivitas sel T lainnya dan sel B. Sel Th dan sel Ts akan berinteraksi dengan
adanya metode umpan balik. Sel Th membantu sel Ts beraksi dan sel Ts akan
menekan sel T lainnya. Dengan demikian sel Ts dapat menghambat respon imun
yang berlebihan dan bersifat antiinflamasi (Sherwood, 2001).
iii.Sel Tcytotoxic (Sel Tc)
Sel Tc adalah sel yang mampu menghancurkan sel cangkokan dan sel yang
terinfeksi virus dengan mengeluarkan zat-zat kimiawi sebelum replikasi virus
terjadi (Sherwood, 2001).
Sel B
Sel B terdapat kurang lebih 25% dari jumlah limfosit total (Tan, 2007). Pada
membran sel B terdapat reseptor khas untuk mengikat antigen. Aktivitas sel B
distimulasi dengan adanya sel Th2 menjadi sel plasma dan akan membentuk
Antibodi
Antibodi adalah immunoglobulin (Ig) yang merupakan golongan yang
dibentuk oleh sel plasma yang berasal dari proliferasi sel B akibat adanya kontak
dengan antigen. Menurut perbedaan struktur dan aktivitas biologis, antibodi
dibedakan menjadi 5 subkelas:
Tabel 2.1 Pembagian Subkelas Imunoglobulin
Struktur Subkelas Keterangan
Miu (µ) IgM -Terdapat dalam bentuk pentamer
-Merupakan molekul paling besar
-Berfungsi sebagai reseptor permukaan sel B untuk
tempat antigen melekat dan disekresikan dalam
tahap-tahap awal respon sel.
Gamma (γ) IgG -Merupakan immunoglobulin yang paling banyak di
dalam serum
Epsilon (ε) IgE -Merupakan mediator antibodi untuk respon alergi
-Mampu melekat pada sel mastosit atau basofil yang
melepaskan mediator histamin, heparin,
prostaglandin yang dapat menimbulkan reaksi
hipersensitivitas tipe cepat
Alpha (α) IgA -Ditemukan dalam sekresi sistem pencernaan,
pernafasan, dan genitouria, serta dalam air susu dan
air mata
Delta (δ) IgD -Terdapat di permukaan sel B, tetapi fungsinya masih
2.4.2.1Respon Imun Selular
Respon imun selular merupakan fungsi dari limfosit T. Antigen akan
menyebabkan proliferasi dan diferensiasi sel T menjadi beberapa subpopulasi.
Subpopulasi sel T yang disebut sel T-helper (Th) akan mengenali antigen pada
permukaan sel makrofag atau sel yang terinfeksi melalui T-cell receptors (TCR)
dan molekul major histocompatibility complex (MHC) kelas-II. Sinyal yang
diberikan oleh sel terinfeksi akan menginduksi limfosit untuk memproduksi
berbagai jenis limfokin yang dapat membantu menghancurkan antigen tersebut.
Subpopulasi sel T lain yang disebut sel T-cytotoxic (Tc) akan menghancurkan
antigen melalui MHC kelas-I dengan cara kontak langsung dengan sel (cell to cell
contact). Selain itu, sel Tc memproduksi γ-interferon yang mencegah penyebaran
antigen lebih jauh (Kresno, 2010).
2.4.2.2Respon imun humoral
Respon imun humoral dilakukan oleh sel B dan produknya, yaitu antibodi.
Respon ini diawali dengan diferensiasi limfosit B menjadi suatu populasi sel
plasma yang memproduksi dan melepaskan antibodi spesifik ke dalam darah.
Diferensiasi sel B dibantu oleh sel Th2. Adanya sinyal yang diberikan oleh
makrofag, sel Th2 akan merangsang sel B untuk memproduksi antibodi. Sel
T-supresor juga ikut berperan dalam pengaturan produksi antibodi agar seimbang
dan sesuai dengan kebutuhan. Antibodi yang terbentuk akan berikatan dengan
antigen membentuk kompleks antigen-antibodi yang akan mengaktivasi
komplemen dan mengakibatkan hancurnya antigen tersebut. Pada respon imun
humoral juga terjadi respon primer yang membentuk populasi sel B memory
2.4.2.3Interaksi antara respon imun selular dengan respon imun humoral
Salah satu interaksi antara respon imun selular dengan respon imun humoral
adalah antibody dependent cell mediated cytotoxicity (ADCC). Pada interaksi ini
sitolisis terjadi dengan bantuan antibodi yang berfungsi melapisi antigen sasaran
(opsonisasi), sehingga sel natural killer (NK) dan sel-sel fagosit yang mempunyai
reseptor pada fragmen Fc antibodi tersebut dapat melekat pada antigen sasaran
dan menghancurkan antigen tersebut melalui mekanisme fagositosis (Kresno,
2010).
2.4.3 Imunomodulator
Imunomodulator adalah senyawa tertentu yang dapat meregulasi sistem imun
dengan tujuan menormalkan atau membantu mengoptimalkan sistem imun.
Mekanisme pertahanan spesifik maupun non spesifik umumnya saling
berpengaruh. Imunomodulator dapat dibagi menjadi 2, yaitu imunostimulator dan
imunosupresor.
a. Imunostimulator
Imunostimulator adalah senyawa yang dapat meningkatkan respon imun.
Imunostimulator dapat mereaktivasi sistem imun dengan berbagai cara seperti
meningkatkan jumlah dan aktivitas sel T, NK-cells dan makrofag serta
melepaskan interferon dan interleukin (Tan dan Rahardja., 2007).
Imunostimulator banyak digunakan menjaga kondisi tubuh saat terjadinya
defisiensi imunitas, pada terapi AIDS, infeksi kronik, dan keganasan terutama
b. Imunosupresor
Imunosupresor adalah senyawa yang dapat menurunkan respon imun yang
berlebihan. Imunosupresor mampu menghambat transkripsi dari sitokin dan
memusnahkan sel T (Tan & Rahardja, 2007). Penggunaan klinis imunosupresor di
antaranya adalah pencegah penolakan transplantasi, mengatasi penyakit autoimun
dan mencegah hemolisis rhesus dan neonatus.
2.4.4 Siklofosfamida
Gambar 2.4 Siklofosfamida (Anderson, 1995)
Nama kimia : 2-[Bis(2-kloroetil)amino]tetrahidro-2H-1,3,2- oksazafosforin 2-oksida monohidrat
Rumus molekul : C7H15Cl2N2O2P.H2O Berat molekul : 279,10
Pemerian : serbuk hablur, putih.
Kandungan : tidak kurang dari 97,0% dan tidak lebih dari 103,0% C7H15Cl2N2O2P, dihitung sebagai zat anhidrat.
Kelarutan : Siklofosfamida larut dalam air dan dalam etanol (Depkes RI, 1995).
Siklofosfamida merupakan agen alkilasi yang mempunyai efek
imunosupresif. Siklofosfamida memiliki aktivitas antiproliferasi yang kuat yang
Siklofosfamida memberikan efek pada mencit dengan dosis pemberian
50 mg/kg BB. Siklofosfamida menghambat aksi sel Ts dan sel Th2 sehingga
menekan produksi antibodi oleh sel B. Sel Th1 tidak dipengaruhi oleh
siklofosfamida dan tetap bekerja secara normal. Sel Th1 akan melepaskan sitokin
yang bersifat proinflamasi sehingga akan menarik makrofag ke tempat terjadinya
infeksi. Hal inilah yang menyebabkan terjadinya pembengkakan di tempat infeksi
(Turk, 1989).
2.4.5 Metode Pengujian Efek Imunomodulator
Ada beberapa metode yang digunakan dalam pengujian efek
imunomodulator. Beberapa di antaranya adalah uji respon hipersensitivitas tipe
lambat dan pengukuran antibodi (titer antibodi).
a. Uji Respon Hipersensitivitas Tipe Lambat
Uji respon hipersensitivitas merupakan pengujian efek imunomodulator
terkait dengan respon imun spesifik. Respon hipersensitivitas tipe lambat
merupakan respon imun seluler yang melibatkan aktivasi sel Th yang akan
melepaskan sitokin yang bersifat proinflamasi dan meningkatkan aktivitas
makrofag yang ditandai dengan pembengkakan kaki hewan uji (Roit,1989).
b. Titer Antibodi
Respon imun spesifik dapat berupa respon imun seluler dan respon imun
humoral. Penilaian titer antibodi merupakan pengujian terhadap respon imun
humoral yang melibat pembentukan antibodi. Peningkatan nilai titer antibodi
terjadi karena peningkatan aktivitas sel Th yang menstimulasi sel B untuk
pembentukan antibodi dan peningkatan aktivitas sel B dalam pembentukan
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental yaitu penelitian yang
dilakukan dengan mengadakan manipulasi terhadap objek penelitian serta
menggunakan kelompok kontrol sebagai pembanding, dengan tahapan penelitian
yaitu penyiapan sampel, karakterisasi simplisia, pembuatan ekstrak, penyiapan
hewan percobaan dan pengujian respon hipersensitivitas tipe lambat dan titer
antibodi pada hewan percobaan.
Data hasil penelitian dianalisis secara ANAVA (analisis variansi) dan
dilanjutkan dengan uji Post Hoc Tukey menggunakan program SPSS (Statistical
Product and Service Solution) versi 17.0.
3.1 Alat dan Bahan
3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas
laboratorium, aluminium foil, neraca kasar, neraca listrik (Vibra), seperangkat alat
destilasi penetapan kadar air, perkolator, rotary evaporator (Heidolph VV-300),
mikroskop (Boeco), tanur, mortir dan stamfer, neraca hewan (Presica), spuit 1 ml
(Terumo), oral sonde, pletismometer air raksa, velocity 18R refrigerated
centrifuge (Dynamic), microtube, microtitration plate, pipet mikro (Brand), dan
kertas saring. Gambar alat-alat yang digunakan dapat dilihat pada Lampiran 7,
3.1.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah umbi keladi tikus,
karboksi metil selulosa (CMC), sel darah merah domba (SDMD), natrium klorida
(NaCl), kalium klorida (KCl), dinatrium hidrogen fosfat (Na2HPO4), kalium
dihidrogen fosfat (KH2PO4), aqua bidestilasi, heparin, larutan fisiologis, etanol
96%, toluen, kloroform dan air suling.
3.1.3 Hewan Percobaan
Hewan percobaan yang digunakan dalam penelitian adalah mencit jantan
dengan berat badan ±20-35 gram berumur 2-3 bulan. Sebelum digunakan, mencit
dipelihara selama 2 minggu dalam kandang yang baik untuk menyesuaikan
lingkungannya, dan diberi makan pelet hewan serta air. Gambar hewan percobaan
dapat dilihat pada Lampiran 8, halaman 60.
3.2 Penyiapan Sampel
Sampel dalam penelitian ini adalah berupa serbuk kering umbi keladi tikus,
diperoleh dari saudara Pipi Saputri Nasution dalam penelitian Karakterisasi
Simplisia Skrining Fitokimia Dan Uji Toksisitas Dari Ekstrak Umbi Keladi Tikus
(Typhonium flagelliforme) Dengan Metode Brine Shrimp Lethality Test (BST)
(Nasution, 2010).
Umbi keladi tikus segar diperoleh saudara Pipi dari UPT Materia Medica,
Kota Batu, Jawa Timur. Identifikasi tumbuhan dilakukan di Pusat Penelitian
Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong (Nasution, 2010).
Hasil identifikasi dan gambar sampel dapat dilihat pada Lampiran 3, halaman 48.
3.3 Pemeriksaan Karakterisasi Simplisia
Pemeriksaan karakterisasi simplisia meliputi pemeriksaan makroskopik dan
mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air,
penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan
penetapan kadar abu tidak larut asam (Ditjen POM, 1995; WHO, 1992).
3.3.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan pada serbuk simplisia yang meliput i
pemeriksaan bau, rasa dan warna. Gambar serbuk simplisia dapat dilihat pada
Lampiran 3, halaman 48.
3.3.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia dengan cara
menaburkan serbuk simplisia di atas kaca objek yang telah ditetesi dengan
kloralhidrat dan kaca objek yang telah ditetesi dengan aquadest kemudian ditutup
dengan kaca penutup setelah itu dilihat dibawah mikroskop. Gambar mikroskopik
dapat dilihat pada Lampiran 4, halaman 50.
3.3.3 Penetapan Kadar Air Simplisia
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Alat terdiri dari labu alas 500 ml, alat penampung, pendingin, tabung penyambung
dan tabung penerima.
Cara penetapan:
Labu bulat dimasukkan 200 ml toluena dan 2 ml air suling, didestilasi selama
2 jam. Setelah itu toluena didinginkan dan volume air di dalam tabung penerimaan
dibaca. Kemudian ke dalam labu dimasukkan 5 g serbuk simplisia yang telah
mendidih, kecepatan tetesan diatur, lebih kurang 2 tetes tiap detik, hingga
sebagian besar air tersuling. Kemudian kecepatan penyulingan dinaikkan hingga 4
tetes tiap detik. Setelah 2 jam didestilasi, kemudian toluen dibiarkan dingin,
bagian dalam pendingin dibilas dengan toluena yang telah dijenuhkan. Destilasi
dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin
sampai suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca
dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan
kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung
dalam persen (WHO, 1992). Perhitungan penetapan kadar air dapat dilihat pada
Lampiran 5, halaman 51.
3.3.4 Penetapan Kadar Sari yang Larut dalam Air
Sebanyak 5 gram serbuk yang telah dikeringkan diudara, dimaserasi selama 24
jam dalam 100 ml air kloroform (2,5 ml kloroform dalam air suling 1000 ml)
dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, dibiarkan
selama 18 jam, kemudian disaring. Diuapkan 20 ml filtrat sampai kering dalam
cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa
dipanaskan pada suhu 105°C sampai bobot tetap. Kadar dalam persen sari yang
larut dalam air dihitung terhadap bahan yang telah dikeringkan diudara (Ditjen
POM, 1995). Perhitungan penetapan kadar sari yang larut air dapat dilihat pada
Lampiran 5, halaman 52.
3.3.5 Penetapan Kadar Sari yang Larut dalam Etanol
Sebanyak 5 gram serbuk yang telah dikeringkan diudara, dimaserasi selama 24
jam dalam etanol 96% dalam labu bersumbat sambil sesekali dikocok selama 6
filtrat sampai kering dalam cawan penguap yang berdasar rata yang telah
dipanaskan dan ditara. Sisa dipanaskan pada suhu 105°C sampai bobot tetap.
Kadar dalam persen sari yang larut dalam etanol (96%) dihitung terhadap bahan
yang telah dikeringkan diudara (Ditjen POM, 1995). Perhitungan penetapan kadar
sari yang larut etanol dapat dilihat pada Lampiran 5, halaman 53.
3.3.6 Penetapan Kadar Abu Total
Sebanyak 2 gram serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus porselen yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan
pada suhu 600°C selama 3 jam. Kemudian krus didinginkan dan ditimbang
sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah
dikeringkan diudara (Ditjen POM, 1995). Perhitungan penetapan kadar abu total
dapat dilihat pada Lampiran 5, halaman 54.
3.3.7 Penetapan Kadar Abu Tidak Larut Asam
Abu yang telah diperoleh dalam penetapan abu dididihkan dengan 25 ml asam
klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan,
disaring dengan kertas saring, dicuci dengan air panas, dipijarkan sampai bobot
tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam
asam dihitung terhadap bobot yang dikeringkan diudara (Ditjen POM, 1995).
Perhitungan penetapan kadar abu yang tidak larut dalam asam dapat dilihat pada
3.4Pembuatan Ekstrak Etanol Umbi Keladi Tikus
Sebanyak 500 gram serbuk simplisia dimasukkan kedalam bejana tertutup,
etanol 96% dituangkan ke dalam bejana sampai seluruh simplisia terendam, aduk,
biarkan sekurang-kurangnya selama 3 jam. Pindahkan massa sedikit demi sedikit
kedalam perkolator sambil tiap kali ditekan hati-hati, tuangi cairan penyari
secukupnya sampai cairan mulai menetes dan diatas simplisia masih terdapat
selapis cairan penyari, tutup perkolator, biarkan selama 24 jam. Biarkan cairan
menetes dengan kecepatan 1 ml per menit, tambahkan berulang-ulang cairan
penyari secukupnya hingga selalu terdapat selapis cairan penyari di atas simplisia.
Perkolasi dihentikan setelah tetesan terakhir perkolat tidak berwarna lagi atau
apabila sebanyak 500 mg cairan perkolat diuapkan di atas penangas air tidak
meninggalkan sisa. Perkolat yang diperoleh dipekatkan dengan alat penguap
vakum putar (rotary evaporator). Kemudian dikeringkan dengan menggunakan
freeze dryer dan diperoleh ekstrak kental sebanyak 16,71 g. Alur pembuatan
ekstrak dapat dilihat pada Lampiran 6, halaman 56.
3.5Uji Efek Imunomodulator
Uji efek imunomodulator meliputi penyiapan hewan percobaan, penyiapan
kontrol, bahan uji, larutan penyangga dan antigen, uji respon hipersensitivitas tipe
lambat, dan uji titer antibodi.
3.5.1Penyiapan Hewan Percobaan
Hewan yang digunakan adalah mencit jantan dengan berat 20-35 g dibagi
5 kelompok, 1 kelompok untuk kontrol negatif, 1 kelompok untuk kontrol positif,
Sebelum digunakan sebagai hewan percobaan, semua mencit dipelihara
terlebih dahulu selama kurang lebih satu minggu dalam kandang yang baik pada
suhu ruangan untuk penyesuaian lingkungan, pengontrolan kesehatan dan berat
badan. Mencit diberi makan pelet hewan dan minum air keran. (Shukla et.al.,
2009).
3.5.2Penyiapan Kontrol, Bahan Uji, Larutan Penyangga dan Antigen
Penyiapan kontrol, bahan uji, larutan penyangga dan antigen meliputi
penyiapan CMC 1%, penyiapan suspensi siklofosfamida 0,5%, penyiapan
suspensi ekstrak umbi keladi tikus 2%, penyiapan larutan penyangga phosphate
buffered saline, dan penyiapan sel darah merah domba.
3.5.2.1Penyiapan CMC 1%
Pembuatan suspensi CMC 1% (b/v) dilakukan dengan cara sebagai berikut:
sebanyak 250 mg CMC ditaburkan ke dalam lumpang yang berisi air suling panas
sebanyak 8 ml. Didiamkan selama 15 menit hingga diperoleh masa yang
transparan, digerus hingga berbentuk gel dan diencerkan dengan sedikit air,
kemudian dituang ke dalam labu tentukur 25 ml, ditambah air suling sampai batas
tanda.
3.5.2.2Penyiapan Suspensi Siklofosfamida (SS) 0,5%
Pembuatan suspensi siklofosfamida0,5% (b/v) dilakukan dengan cara sebagai
berikut: sebanyak 250 mg CMC ditaburkan ke dalam lumpang yang berisi air
suling panas sebanyak 8 ml. Didiamkan selama 15 menit hingga diperoleh masa
yang transparan, digerus hingga berbentuk gel. Ditambahkan sebanyak 125 mg
siklofosafamida ke dalam lumpang, kemudian digerus sampai homogen. Dituang
3.5.2.3Penyiapan Suspensi Ekstrak Umbi Keladi Tikus (SEUKT) 2%
Pembuatan suspensi ekstrak umbi keladi tikus 2% (b/v) dilakukan dengan cara
sebagai berikut: sebanyak 250 mg CMC ditaburkan ke dalam lumpang yang berisi
air suling panas sebanyak 8 ml. Didiamkan selama 15 menit hingga diperoleh
masa yang transparan, digerus hingga berbentuk gel. Ditambahkan sebanyak 500
mg ekstrak umbi keladi tikus ke dalam lumpang, kemudian digerus sampai
homogen. Dituang ke dalam labu tentukur 25 ml, ditambah air suling sampai batas
tanda.
3.5.2.4Penyiapan Phosphate Buffered Saline (PBS)
Pembuatan PBS dilakukan dengan cara sebagai berikut: sebanyak 8 gram
NaCl, 0,2 gram KCl, 1,44 gram Na2HPO4, 0,24 gram KH2PO4, dilarutkan dalam
800 ml aqua bidestilasi, kemudian dicek pH dengan indikator pH hingga pH ±7
dan dapat disesuaikan dengan penambahan HCl atau NaOH, tambahkan aqua
bidestilasi hingga 1 L (DeAngelis, 2007).
3.5.2.5Penyiapan Sel Darah Merah Domba (SDMD)
Penyiapan dan pembuatan SDMD didasarkan pada penelitian yang dilakukan
oleh Puri, et.al., (1993). Darah segar dikumpulkan dari domba yang disembelih.
Darah dipisahkan dari plasmanya dengan pemusingan 1900 rpm menggunakan
alat sentrifugasi pada suhu 4oC selama 10 menit. Kemudian supernatan dibuang.
Endapan dicuci dengan PBS sebanyak 2 kali. Setelah pencucian selesai, PBS
dibuang, maka diperoleh SDMD 100%. Ke dalam SDMD 100% ditambahkan
PBS dengan volume yang sama, hingga diperoleh SDMD 50%. Kemudian
diambil 0,2 ml SDMD 50%, tambahkan PBS hingga 10 ml, sehingga diperoleh
3.5.3Uji Respon Hipersensitivitas Tipe Lambat
Efek imunomodulator ekstrak umbi keladi tikus ditentukan dengan mengukur
volume respon hipersensitivitas tipe lambat menggunakan uji pembengkakan
telapak kaki hewan uji (foot paw swelling test) (Lakshmi, et.al., 2003;Ray, et.al.,
1996).
Sebanyak 25 ekor mencit dibagi menjadi 5 kelompok dengan pembagian
sebagai berikut:
Kelompok I diberi suspensi CMC Na 1% (b/v) sebagai kontrol negatif
Kelompok II diberi Suspensi Ekstrak Umbi Keladi Tikus (SEUKT) dengan dosis
100 mg/kg BB
Kelompok III diberi SEUKT dengan dosis 200 mg/kg BB
Kelompok IV diberi SEUKT dengan dosis 400 mg/kg BB
Kelompok V diberi Suspensi Siklofosfamida (SS) dengan dosis 50 mg/kg BB
sebagai kontrol positif
Tiap kelompok diinjeksikan dengan 0,1 ml sel darah merah domba (SDMD)
1% dalam PBS secara intraperitoneal pada hari ke-0. Perlakuan dimulai dari hari
ke-0 dan diberikan satu kali setiap hari selama 7 hari. Pada hari ke-7, sendi kaki
mencit sebelah kanan diberi tanda batas pengukur an volume kaki mencit. Volume
kaki mencit diukur sebagai volume awal (V0). Kemudian mencit diinjeksikan
dengan 0,1 ml suspensi SDMD 1% dalam PBS secara intraplantar pada telapak
kaki sebelah kanan.
Pada hari kedelapan (setelah 24 jam) diukur volume pembengkakan kaki
mencit dengan platismometer air raksa. Pengukuran dilakukan dengan
batas pengukuran. Perubahan volume air raksa terlihat pada kenaikan skala pada
pletismometer sebagai volume waktu tertentu (Vt) kaki mencit. Volume
pembengkakan kaki mencit ditentukan berdasarkan selisih antara volume waktu
tertentu (Vt) dengan volume awal (V0). (Shivaprasad, et.al., 2006). Gambar
pembengkakan kaki mencit dapat dilihat pada Lampiran 9, halaman 61.
3.5.4Uji Titer Antibodi
Tiap kelompok diinjeksikan dengan 0,1 ml sel darah merah domba (SDMD)
1% dalam PBS secara intraperitoneal pada hari ke-0. Perlakuan dimulai dari hari
ke-0 dan diberikan satu kali setiap hari selama 7 hari. Pada hari ke-7, sampel
darah masing-masing mencit diambil melalui pembuluh darah vena di bagian
ekor. Sampel darah dikumpulkan dalam tabung mikro (microtube), kemudian
dilakukan pemusingan 1900 rpm dengan alat sentrifugasi pada suhu 40C selama
10 menit dan diambil serumnya.
Nilai titer antibodi ditentukan dengan teknik hemaglutinasi. 25 µ l serum
diteteskan ke dalam sumur microtitration plate 96 lubang, ditambahkan PBS dan
SDMD dengan volume yang sama, dan diencerkan dua kali lipat (1:2; 1:4; 1:8;
1:16; 1:32; 1:64; 1:128; 1:256; 1:512; 1:1024; 1:2048; 1:4096) kemudian
diinkubasi pada suhu 370C selama 1 jam dan diamati hemaglutinasi secara visual
(Makare, et.al., 2001; Puri, et.al., 1993). Nilai titer antibodi ditentukan
berdasarkan pengenceran terakhir dimana antibodi masih terdeteksi melalui
hemaglutinasi yang terlihat secara visual. Nilai titer antibodi tersebut selanjutnya
ditransformasikan dengan [2log(titer)+1] (Hargono, 2000). Gambar hasil
3.6Analisis Data
Data hasil penelitian dianalisis dengan menggunakan program SPSS versi
17.0. Data ditentukan homogenitas dan normalitasnya untuk menentukan analisis
statistik yang digunakan. Data dianalisis dengan menggunakan uji ANAVA satu
arah (One-Way ANOVA) untuk menentukan perbedaan rata-rata di antara
perlakuan. Jika terdapat perbedaan, dilanjutkan dengan menggunakan uji Post Hoc
Tukey untuk mengetahui variabel mana yang memiliki perbedaan. Berdasarkan
nilai signifikansi, p<0,05 dianggap signifikan. Data ditampilkan dalam rerata ±
BAB IV
HASIL DAN PEMBAHASAN
4.1Simplisia dan Ekstrak
Tumbuhan yang digunakan telah diidentifikasi Pusat Penelitian Biologi
Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong. Hasil identifikasi
tumbuhan dapat dilihat pada Lampiran 2, halaman 47.
Hasil pemeriksaan secara makroskopik yang dilakukan terhadap serbuk
simplisia umbi keladi tikus yaitu berwarna putih kekuningan, rasa sedikit pahit,
dan berbau seperti tikus.
Hasil pemeriksaan secara mikroskopik yang dilakukan terhadap serbuk
simplisia umbi keladi tikus terlihat hilus, butir pati, dan Ca. Oksalat bentuk jarum.
Hasil pemeriksaan mikroskopik dapat dilihat pada Lampiran 4, halaman 50.
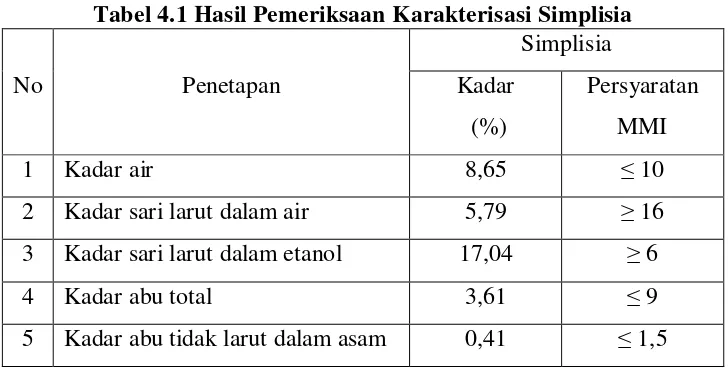
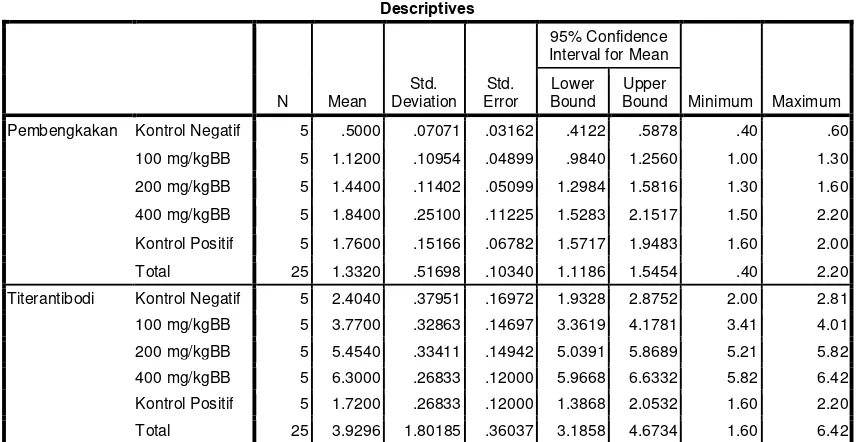
Hasil pemeriksaan karakterisasi simplisia umbi keladi tikus diperoleh kadar air
8,65%, kadar sari yang larut dalam air 5,79%, kadar sari yang larut dalam etanol
17,04%, kadar abu total 3.61% dan kadar abu yang tidak larut dalam asam 0,41%.
Persyaratan umum pada Materia Medika Indonesia (MMI) adalah kadar air tidak
lebih dari 10%, kadar sari yang larut dalam air tidak kurang dari 16%, kadar sari
yang larut dalam etanol tidak kurang dari 6%, kadar abu tidak lebih dari 9%, dan
kadar abu yang tidak larut dalam asam tidak lebih dari 1,5%. Dengan demikian
hasil penetapan kadar air, kadar sari yang larut dalam etanol, kadar abu total dan
kadar abu yang tidak larut asam memenuhi persyaratan pada Materia Medika
Indonesia, sementara hasil penetapan kadar sari yang larut dalam air tidak
banyak mengandung senyawa yang larut dalam lemak daripada senyawa yang
larut dalam air. Data hasil pemeriksaan karakterisasi simplisia ditunjukkan pada
Tabel 4.1.
Tabel 4.1 Hasil Pemeriksaan Karakterisasi Simplisia
No Penetapan
Standarisasi diperlukan karena kandungan bahan aktif yang terkandung dalam
jenis tanaman yang sama dapat bervariasi, dengan standarisasi diharapkan bahan
aktif yang terkandung di dalam bahan baku tersebut cukup konsisten, sehingga
takaran yang digunakan untuk pengujian memiliki kandungan aktif yang setara.
Hasil penyarian 500 g serbuk simplisia umbi keladi tikus dengan pelarut
etanol 96% diperoleh ekstrak kental yang kemudian diuapkan dengan
menggunakan rotary evaporator dan dikeringkan diperoleh 16,71 g ekstrak
(rendemen 3,342%).
4.2Pengujian Efek Imunomodulator
Pengujian efek imunomodulator ekstrak umbi keladi tikus dilakukan dengan
metode respon hipersensitivitas tipe lambat dan titer antibodi yang digunakan
humoral yang melibatkan sel T dan sel B. Menurut Makare, et.al., (2001),
kombinasi kedua metode tersebut mempunyai keuntungan yaitu memungkinkan
dua komponen respon imun diukur pada spesies yang sama dibawah kondisi ideal,
relatif sederhana dan tidak mahal.
Pengujian dilakukan dengan cara menginduksi sel imun mencit dengan sel
darah merah domba (SDMD) sebagai antigen secara intraperitoneal pada hari
ke-0. Respon hipersensitivitas tipe lambat diketahui dari volume pembengkakan kaki
mencit yang diukur pada hari ke-8 setelah sehari sebelumnya sel imun mencit
diinduksikan kembali dengan SDMD secara intraplantar. Pengukuran volume
pembangkakan dilakukan dengan menggunakan alat pletismometer air raksa.
Pengukuran nilai titer antibodi dilakukan pada hari ke-7 dengan menggunakan
metode hemaglutinasi. Hemaglutinasi adalah ikatan antara sel darah merah
sebagai antigen dengan antibodi sehingga menimbulkan suatu gumpalan yang
dapat dilihat. Pada lingkungan yang pH-nya netral, sel darah merah bermuatan
negatif sehingga akan terjadi aksi tolak-menolak antar sel. Oleh karena itu sel
darah merah yang digunakan disuspensikan dalam larutan penyangga dengan pH
±7 (PBS) untuk menjaga agar sel darah merah tetap dalam kondisi pH netral,
sehingga tetap bermuatan negatif.
Hemaglutinasi terbentuk karena adanya ikatan silang antara sel darah merah
dengan antibodi. Antibodi yang mempunyai kemampuan lebih besar untuk
berikatan dengan sel darah merah adalah IgM. IgM mempunyai ukuran yang besar
dan valensi yang tinggi, sehingga dapat melawan rintangan elektrik dan
membentuk ikatan silang dengan sel darah merah sehingga menyebabkan
yang lebih kecil, sehingga kemampuannya melawan rintangan elektrik lebih
lemah dibandingkan dengan IgM (Kuby, 1994). Terkait dengan prinsip
hemaglutinasi di atas, maka dalam penelitian ini sel darah merah yang digunakan
sebagai antigen adalah sel darah merah domba (SDMD) karena memiliki muatan
negatif yang lebih kuat, sehingga kemampuannya untuk berikatan dengan antibodi
semakin kuat. Dengan demikian, hasil hemaglutinasi yang diperoleh dapat
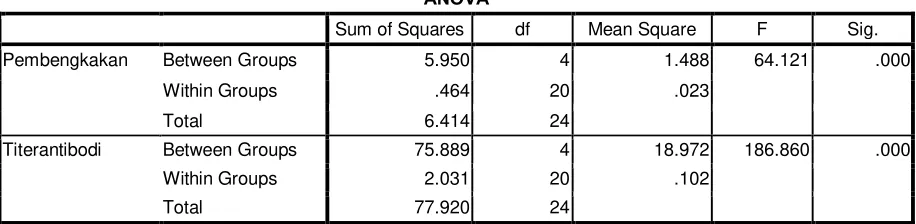
diketahui dengan mudah. Data hasil penelitian dapat dilihat pada Tabel 4.2.
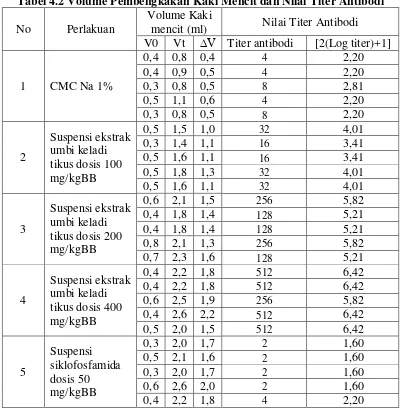
Tabel 4.2 Volume Pembengkakan Kaki Mencit dan Nilai Titer Antibodi
No Perlakuan
Volume Kaki
Suspensi siklofosfamida (SS) digunakan sebagai kontrol positif karena
mekanisme kerja siklofosfamida telah diketahui yaitu menekan populasi sel T
supresor (Shukla, et.al., 2009;Mitsuoka, 1979). Siklofosfamida dapat membunuh
sel pada setiap siklus perkembangannya dan lebih toksik terhadap sel yang sedang
berproliferasi (aktivitas antiproliferatif), termasuk pembentukan antibodi.
(Baratawidjaja dan Rengganis, 2010). Dengan demikian siklofosfamid hanya
berpengaruh pada sel T supresor dan sel B (Turk, 1989).
4.2.1 Respon Hipersensitivitas Tipe Lambat
Respon hipersensitivitas tipe lambat dikenali dengan reaksi imuno-inflamasi
karena makrofag dan sel Th1 berperan besar dalam proses tersebut (Mukherjee,
2010). Reaksi ini ditandai dengan adanya pembengkakan pada tempat terjadinya
induksi antigen.
Pembengkakan terkait langsung dengan cell mediated immunity (CMI), karena
antigen mengaktivasi sel T terutama sel Th1. Aktivasi sel T menyebabkan
pelepasan beberapa sitokin yang bersifat proinflamasi. Sitokin tersebut akan
menarik makrofag ke tempat terjadinya induksi dan mengaktivasinya sehingga
menyebabkan peningkatan aktivitas fagositik untuk melawan antigen yang masuk
(Fulzele, et.al., 2002). Penarikan makrofag ini terjadinya pembengkakan. Semakin
besar pembengkakan menunjukkan semakin tinggi respon hipersensitivitas tipe
lambat sehingga dapat menggambarkan peningkatan aktivitas sistem imun.
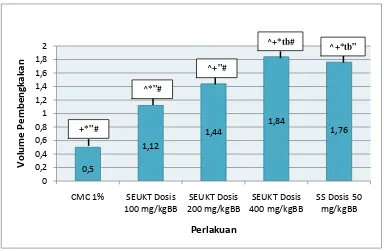
Hasil pengukuran volume pembengkakan kaki kanan mencit sebagai respon
0,5
Gambar 4.1. Volume pembengkakan kaki mencit pada berbagai perlakuan (Rerata ± SEM)
Keterangan:
SEUKT = Suspensi Ekstrak Umbi Keladi Tikus SS = Suspensi Siklofosfamida
^ = berbeda signifikan dengan CMC 1%
+ = berbeda signifikan dengan SEUKT dosis 100 mg/kg BB * = berbeda signifikan dengan SEUKT dosis 200 mg/kg BB
”
= berbeda signifikan dengan SEUKT dosis 400 mg/kg BB # = berbeda signifikan dengan SS dosis 50 mg/kg BBtb
”
= tidak berbeda signifikan dengan SEUKT dosis 400 mg/kg BB tb# = tidak berbeda signifikan dengan SS dosis 50 mg/kg BBPada Gambar 4.1 terlihat bahwa SEUKT dosis 100, 200, dan 400 mg/kg BB,
dan SS dosis 50 mg/kg BB menunjukkan volume pembengkakan yang jauh
berbeda dengan suspensi CMC 1% sebagai kontrol. SEUKT dosis 400 mg/kg BB
dengan volume pembengkakan 1,84 ml menunjukkan volume pembengkakan
yang lebih besar dibandingkan dengan SEUKT dosis 100mg/kg BB, SEUKT
dosis 200mg/kg BB dan SS dosis 50 mg/kgBB yang masing-masing bernilai 1,12,
1,44 dan 1,76 ml. Untuk melihat ada tidaknya perbedaan dari setiap perlakuan
pada tiap kelompok hewan coba, maka dilakukan analisis variansi (ANAVA)
+*”#
^*”#
^+”#
^+*tb#
menggunakan program SPSS versi 17.0 terhadap volume pembengkakan kaki
mencit. Hasil analisis variansi dapat dilihat pada Lampiran 10, halaman 64. Dari
hasil analisis variansi diperoleh harga F hitung>F tabel (F tabel = 2,87). Hal ini
menunjukkan adanya perbedaan yang signifikan antar kelompok perlakuan
terhadap volume pembengkakan kaki mencit dengan nilai signifikansi p<0,05.
Untuk mengetahui kelompok perlakuan mana yang memiliki efek yang sama atau
berbeda antara satu perlakuan dengan perlakuan yang lain dilakukan uji Post Hoc
Tukey terhadap semua perlakuan dimana hasil uji tersebut dapat dilihat pada
Lampiran 10, halaman 65.
Hasil uji Post Hoc Tukey menunjukkan bahwa volume pembengkakan kaki
mencit kelompok perlakuan SEUKT dosis 400 mg/kg BB tidak berbeda signifikan
dengan kelompok perlakuan SS dosis 50 mg/kg BB (kontrol positif). Hal ini
terkait dengan mekanisme kerja siklofosfamid.
Mekanisme kerja siklofosfamida terhadap potensiasi hipersensitivitas tipe
lambat adalah dengan menurunkan populasi sel T supresor (Shukla, et.al.,
2009;Mitsuoka,1979) dan menghambat pembentukan antibodi oleh sel B
(Baratawidjaja dan Rengganis, 2010;Turk,1989). Dengan demikian,
siklofosfamida diketahui hanya berpengaruh pada sel T supresor dan sel B, tetapi
tidak pada sel Th1. Sel Th1 adalah sel yang berperan dalam terjadinya respon
hipersensitivitas tipe lambat. Sel Th1 yang teraktivasi oleh antigen akan
melepaskan sitokin yang bersifat proinflamasi sehingga akan menarik makrofag
ke area induksi. Hal inilah yang menyebabkan terjadinya pembengkakan pada
siklofosfamida dan ekstrak umbi keladi tikus, maka dilakukan uji berikutnya,
yaitu titer antibodi.
Berdasarkan perhitungan statistik di atas, terlihat adanya peningkatan volume
pembengkakan kaki mencit pada kelompok perlakuan SEUKT dosis 100, 200,
400 mg/kg BB terhadap kontrol negatif CMC 1%. Peningkatan volume
pembengkakan kaki mencit merupakan gambaran adanya peningkatan respon
hipersensitivitas tipe lambat mencit tersebut. Peningkatan respon ini
mengindikasikan adanya peningkatan kemampuan sel imun mencit dalam
menanggapi antigen terutama peningkatan respon imun spesifik seluler. Sel yang
berperan dalam respon imun seluler adalah sel T terutama sel Th. Sel Th
memproduksi IFN-γ yang kemudian merekrut dan mengaktivasi makrofag
(Kresno, 2010). Dengan demikian, ekstrak umbi keladi tikus menunjukkan efek
stimulasi terhadap sel T terutama sel Th.
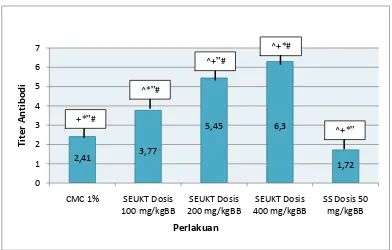
4.2.2 Titer Antibodi
Titer antibodi ditentukan dengan metode hemaglutinasi. Penentuan
hemaglutinasi titer antibodi bertujuan untuk mengetahui respon imun humoral
melawan SDMD. Peningkatan respon imun humoral dibuktikan dengan adanya
peningkatan titer antibodi mencit yang mengindikasikan peningkatan kepekaan sel
T dan sel B terkait dengan produksi antibodi.
Efek pemberian SEUKT dan SS menunjukkan hasil yang berbeda pada titer