DOMBA GARUT
ENNY TANTINI SETIATIN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Dengan ini saya menyatakan bahwa disertasi Ovine Pregnancy-Associated Glycoprotein (ovPAG) sebagai Penanda Kebuntingan pada Domba
Garut adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di setiap akhir bab dalam disertasi ini
Bogor, Maret 2010
Enny Tantini Setiatin
ENNY TANTINI SETIATIN. Ovine Pregnancy-Associated Glycoprotein (ovPAG) as a Marker of Pregnancy on Garut Sheep. Under direction of DONDIN SAJUTHI, BAMBANG PURWANTARA, and CHALID TALIB.
Pregnancy-Associated Glycoprotein (PAG) structurally related to aspartic proteinase, expressed in the outer epithelial cell layer (trophectoderm) of ungulate placenta. Ovine PAG synthesized by mono- and binucleic trophoblast before complete implantation at day 14-15. Of this, ovPAG could be used as a marker for early pregnancy and foetal wellbeing. The research was started with extraction and isolation of PAG from placenta of garut sheep collected at parturation and to characterize their molecular weight. The procedures included extraction of protein at neutral pH (cotyledon was thawed, minced, added PBS, blended and centrifuged), acidic (H3PO41M, pH 4,5; centrifuged) and ammonium sulfate (40% and 80% (NH4)SO4, centrifuged) precipitation ; gel filtration (Sephadex-G75), anion exchanged chromatography (DEAE- cellulose). Cotyledone’s extract was subjected to Sephadex-G75 and DEAE cellulose, and their fractions were measured their absorbances. Sephadex-G75 and DEAE fractions at peak absorbances were assayed for protein concentration (Bichinconinic protein assay). Continuously, these fractions were subjected to monogel SDS-PAGE and stained by Commassie Brilliant Blue. Then, isolate was used to produce polyclonal antibody ( rabbit anti-ovPAG). Polyclonal antibody production was carried out in accordance with Animal Care and Use Committee of PT Indoanilab No: 03-IA-ACUC-08, 15th Nopember 2008. Rabbit anti-ovPAG DN32 gave the best immune response using Modified ELISA technique also could differenciate ovPAG in the urine of pregnant and non pregnant ewes using Western Blot Technique. Simultaneously, modified ELISA was developed started by producing ovine PAG standard, carried out by developing serial dilution at concentration 0,344; 0,172; 0,0688; 0,0344 and 0,0172 ng/ml, continued with intra- and inter-assay validation. Validation of standard showed coefficient variation intra-inter-assay on QC-H and QC-L were 9,97 % and 5,87 %, respectively. Moreover, coefficient variation inter-assay on QC-H and QC-L were 16,95 % and 13,9 %, respectively. Using Western blot technique, protein at 31 kDa molecular weight appeared in pregnant’s urine whereas protein around 71 kDa became a common protein. Modified ELISA technique could differentiate the concentration of ovPAG in between pregnant and non pregnant urine at 55,56 % of nine ewes.
ENNY TANTINI SETIATIN. Ovine Pregnancy-Associated Glycoprotein (ovPAG) sebagai Penanda Kebuntingan pada Domba Garut. Dibimbing oleh DONDIN SAJUTHI, BAMBANG PURWANTARA, and CHALID TALIB.
Pregnancy-associated glycoprotein (PAG) merupakan famili aspartik protease, terdapat di dalam sel trofektoderm plasenta ungulata. OvinePAG
disintesa oleh sel mono- dan binukleat trofoblas sesaat menjelang implantasi pada hari ke 14-15. Oleh karena itu, PAG digunakan sebagai indikator penanda kebuntingan dini dan juga kesehatan fetus. Tujuan penelitia ini adalah ekstrasi dan isolasi ovPAG dalam kotiledon plasenta; memproduksi antibodi poliklonal (Rabbit anti-ovPAG); mendeterminasi ovPAG dalam urine domba bunting, dan pembuatan standar ovPAG. Kegiatan penelitian diawali dengan melakukan ekstraksi dan isolasi PAG dari plasenta domba garut yang dikoleksi pada saat melahirkan dan mengkarakterisasi PAG berdasarkan berat molekulnya. Pada saat melahirkan, kotiledon dikoleksi dari plasenta, disimpan pada -200C sampai seluruh induk domba (n=9 ekor) melahirkan. Selanjutnya kotiledon diekstrak dengan perlakuan presipitasi asam (H3PO41M, pH 4,5 ; sentrifus) dan garam (40% (NH4)SO4 dilanjutkan 80% (NH4)SO4, dan disentrifus). Berikutnya dilakukan isolasi protein melalui gel filtrasi (Sephadex G-75) dan kromatografi pertukaran anion (DEAE-cellulose). Fraksi yang ditampung diukur absorbansinya, fraksi yang memiliki absorbansi tinggi, diukur total proteinnya. Kemudian, dimasukkan dalam monogel SDS-PAGE utuk diukur perkiraan berat molekulnya berdasarkan pita protein yang muncul setelah diwarnai dengan Commassie Brilliant Blue. Isolat yang didapat dipergunakan untuk memproduksi antibodi poliklonal (Rabbit anti-ovPAG) dengan melakukan imunisasi pada kelinci New Zealand White
(n=12 ekor). Pembuatan antibodi poliklonal dilakukan setelah mendapat persetujuan dari Komisi Pengawasan dan Kesejahteraan dan Penggunaan Hewan Percobaan (KPK-PHP) PT INDOANILAB No.:03-IA-ACUC 2008, Tanggal 15 Nopember 2008. Rabbit anti-ovPAG dideterminasi spesifitasnya terhadap
ovPAG dalam urin untuk membedakan domba bunting dan tidak bunting menggunakan teknik Western Blot dan ELISA. ELISA termodifikasi , dikembangkan dengan diawali pembuatan standar ovPAG yang dibuat dengan melakukan pengenceran pada konsentrasi 0,344; 0,172; 0,0688; 0,0344 dan 0,0172 ng/ml, dilanjutkan dengan menghitung koefisien variasi intra- dan inter-asai. Kelinci memberikan respon imun terbaik dari DN32 ( Rabbit anti-ovPAG
DN32). Determinasi Rabbit anti-ovPAG DN32 menggunakan teknik Western Blot
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
(ovPAG) SEBAGAI PENANDA KEBUNTINGAN PADA
DOMBA GARUT
ENNY TANTINI SETIATIN
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Penguji Luar Komisi pada
Ujian Tertutup
:
1.
Dr. drh. M. Agil, M.Sc.Agr.
2. Dr. drh. Diah Iskandriati
Penguji Luar Komisi pada
Ujian Terbuka
:
1.
Ir. Polmer Situmorang, Ph.D.
Alhamdulillaahirobbil ‘alamiin penulis panjatkan ke hadirat Alloh SWT yang banyak memberi kenikmatan dan kemudahan lahir maupun batin. Hanya berkat rahmat,
hidayah dan izinNYA, penulis dalam menyelesaikan disertasi dengan judul “Ovine
Pregnancy-Associated Glycoprotein (ovPAG) sebagai Penanda Kebuntingan pada
Domba Garut”. Disertasi ini ditulis untuk memenuhi salah satu persyaratan dalam memperoleh gelar Doktor pada Sekolah Pascasarjana Institut Pertanian Bogor. Penelitian dilaksanakan di Laboratorium Lapangan Fakultas Peternakan IPB, Unit Rehabilitasi Reproduksi dan Laboratorium Terpadu Fakultas Kedokteran Hewan IPB, Laboratorium Mikrobiologi dan Imunologi PSSP, LPPM-IPB serta PT Indoanilab Bogor, yang penelitiannya dilaksanakan mulai Oktober 2006 sampai dengan Oktober 2009.
Disertasi ini memuat satu bab yang merupakan pengembangan dari naskah artikel yang akan diterbitkan di jurnal ilmiah. Bab 3 berjudul Ekstraksi dan isolasi
ovine pregnancy associated glycoprotein (ovPAG) dari kotiledon plasenta domba garut pada saat melahirkan sedang menunggu penerbitan di Jurnal Ilmu Ternak dan Veteriner 14(3):208-215.
Pada kesempatan yang berbahagia ini penulis menyampaikan terimakasih dan penghargaan yang tak terhingga kepada : Prof. drh. Dondin Sajuthi, M.ST. Ph.D. selaku Ketua Komisi Pembimbing; Dr. drh. Bambang Purwantara, M.Sc. dan Dr. Chalid Talib selaku Anggota Komisi Pembimbing atas kesabaran sumbangan pemikiran; pengarahan; perhatian, dan nasihat mulai dari awal perencanaan; pelaksanaan penelitian serta selesainya penulisan disertasi ini. Penulis mendapatkan karunia terindah karena atas izinNYA, Allah berkenan memberi penulis Para Pembimbing yang tidak hanya membimbing di bidang keilmuan tetapi juga spiritual dan finansial.
Selanjutnya terimakasih dan penghargaan penulis sampaikan kepada Rektor Universitas Diponegoro Semarang (UNDIP); Dekan; Kajur Produksi Ternak; Kolega di Laboratorium Pemuliaan dan Reproduksi Ternak Fakultas Peternakan UNDIP yang telah mengizinkan; memberi semangat; mendoakan, serta memberi bantuan dana penelitian dan penulisan disertasi sehingga penulis dapat melanjutkan studi lanjut Strata 3. Tak lupa penulis sampaikan terimakasih kepada Rektor Institut Pertanian Bogor (IPB); Dekan dan Staf Sekolah Pascasarjana IPB; Dekan Fakultas Kedokteran Hewan IPB; Ketua Program Studi Biologi Reproduksi beserta dosen; teknisi dan petugas administrasi, atas pelayanan yang baik selama penulis mengikuti pendidikan. Ucapan yang sama penulis sampaikan kepada Pengelola Beasiswa Program Pascasarjana (BPPS) Dirjen Dikti Depdiknas; Pengelola Penelitian Kerjasama Kemitraaan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) TA 2007 dan 2009; Hibah Penelitian Program Doktor 2009, dan Dana Bantuan Disertasi UNDIP untuk bantuan perkuliahan dan penulisan disertasi sehingga disertasi ini dapat terselesaikan.
Penghormatan yang sebesar-besarnya penulis sampaikan kepada ibu bapak tercinta Ibunda Moertati (Almh); Ayahanda N.S. Setiakomara (Alm); Ibunda Suryati (Almh) dan Ayahanda Adi Siswoyo (Alm); suami Drs. Mulyo Suprapto, Akt.; anak-anak M. Luthfiadi Setiapratama dan M. Rezky Setiapraptadi, serta saudara-saudara penulis atas segala kasih sayang; pengertian; doa bantuan immateriil dan materiil sehingga dapat menyelesaikan pendidikan dengan baik.
pengerjaan penelitian di lapangan; Dr. drh. Ita Juwita; drh. Wahono Esthi, MS.; Wahyu; Dr. drh. M. Agil, MSc.Agr.; Dr. drh. Hera Maheswari, MSc.; Dr.drh. Puji Astuti, MSc.; Dr. drh. Diah Iskandriati; Uus Saefulloh, SSi. M.Biomed.; Dra. Isti KS; Dra. Maryati, MSi.; Silmi Mariya, SSi.; Rahmita, SKH; drh. Dede; Tri; Ririn; Iin; Dr. Ir. Nuril Hidayati, MSc.; Willy Praira, SSi., selama pengerjaan penelitian di laboratorium. Penulis harus menyampaikan terimakasih dan mohon maaf yang sebesar-besarnya kepada Nani, Wiwid, Ayu, Sri, Dewi, Yanti, Rima dan Yana yang telah membantu secara administrasi.
Kepada rekan-rekan seperjuangan Dr. Ir. Thomas Mata Hine, M.S.; Ir. Bayu Rosadi, M.S., dan Ir. Satya Gunawan, M.S. , yang selalu bersama dalam penyelesaian studi doktor ini. Terima kasih dan maaf penulis sampaikan bagi teman-teman di Wacana Biologi Reproduksi terutama Raden Harry Murti S.Si.; drh. Sri, M.S.; dra. Ekayanti, M.Si.; Tatan Kastaman, S.Si.; Ir. Heri Sujoko, M.S.; Ir. Asri, M.S, dan Ir. Gholib. Kepada rekan-rekan dari Fakultas Peternakan UNDIP yang telah memberikan semangat dan doa, Prof. Dr. Ir. Joelal Achmadi, MSc.; Dr.Ir. Syaiful Anwar, MS.; Ir. Trisetyo Edi, MS. Dr. Ir. Irene Sumeidiana, MS.; Dr.Ir. Sri Wuwuh, MS.; Dr.Ir. Yon Supri Ondho, MS.; Ir. Barep Sutiyono, MS.; Dr.Ir. Seno Jauhari, MSc.; Dr.Ir. Edi Kurnianto, MSc.; Dr.Ir. Sutopo, MSc.; Dr.Ir. Agung Purnomoadi, MSc.; Dr.Ir. Endang Purbowati, MS.; Dr.Ir. Eko Pangestu, MS.; Ir. Heni Rizki, MS.; Ir. Yani; Ir. Susilo Budiyanto, MS.; Ir. Mulyono, MS., Ir. Titik Ekowati, MSc.; Dra. Sunarsih, MSi. Rekan-rekan Genesis, terimakasih dorongan dan doanya. Disertasi ini juga penulis dedikasikan untuk Ir. Bambang Srigandono, M.Sc. (Alm) dan drh. Rita Miranda, M.Sc. (Almh) yang telah mendorong penulis untuk melanjutkan studi S3.
Bogor, Maret 2010
Penulis dilahirkan di Semarang pada 12 September 1961 sebagai anak keempat dari pasangan Moertati (Almh) dan N.S. Setiakomara (Alm). Menikah dengan Drs. Mulyo Suprapto, Akt pada 1993 dan dikaruniai dua orang anak bernama M. Luthfiadi Setiapratama dan M. Rezky Setiapraptadi.
Pendidikan sarjana ditempuh di Fakultas Kedokteran Hewan IPB diselesaikan pada tahun 1986. Pada tahun 1993, penulis diterima pada program S2 Animal and Forage Science, Reading University, UK dan lulus pada tahun 1994. Kesempatan untuk melanjutkan program doktor pada program studi Biologi Reproduksi, Sekolah Pascasarjana IPB diperoleh pada tahun 2004 yang dibiayai oleh Departemen Pendidikan Nasional melalui Program BPPS.
Sejak 1989, penulis terdaftar sebagai Staf di Laboratorium Pemuliaan dan Reproduksi Ternak, Jurusan Produksi Ternak Fakultas Perternakan Universitas Diponegoro sampai saat ini serta staf peneliti Pusat Penelitian Pengembangan Teknologi, Lembaga Penelitian Universitas Diponegoro sampai tahun 2001. Mata kuliah yang diajarkan adalah Dasar Reproduksi Ternak, Ilmu Reproduksi Ternak, Reproduksi dan Inseminasi Buatan, Kesuburan dan Kemajiran Ternak serta Kesehatan Hewan.
Artikel ilmiah yang berkaitan dengan penelitian disertasi serta dipublikasikan adalah :
xv
DAFTAR TABEL xviii
DAFTAR GAMBAR xix
DAFTAR LAMPIRAN xxi
DAFTAR SINGKATAN xxii
PENDAHULUAN ... 1
Latar Belakang ... 1
Kerangka Pemikiran ... 2
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
Hipotesis ... 4
TINJAUAN PUSTAKA ... 5
Aktivitas Reproduksi Domba ... 5
Siklus Estrus... 5
Masa Kebuntingan ... 5
Fertilisasi ... 5
Implantasi ... 6
Penanda Kebuntingan ... 8
Sekresi Plasenta ... 9
Progesteron ... 9
Estrogen ... 10
Pregnancy-Associated Glycoprotein (PAG)... 11
Mekanisme Sintesis Protein Pregnancy-Associated Glycoprotein (PAG)... 12
Isolasi ovPAG... 18
Filtrasi Gel ... ... 18
Kromatografi Pertukaran Anion ... 18
xvi
Pewarnaan Commassie Brilliant Blue ... 21
Pengukuran Konsentrasi Protein ... 21
Antibodi Poliklonal ... 22
Determinasi Rabbit anti-ovPAG menggunakan Metode Western Blot ... 24
Enzyme Linked Immunosorbent Assay (ELISA) ... 25
EKSTRAKSI DAN ISOLASI OVINE PREGNANCY ASSOCIATED GLYCOPROTEIN (ovPAG) DARI KOTILEDON PLASENTA DOMBA GARUT PADA SAAT MELAHIRKAN ... 29
Abstrak ... 29
Abstract ... 29
Pendahuluan ... 30
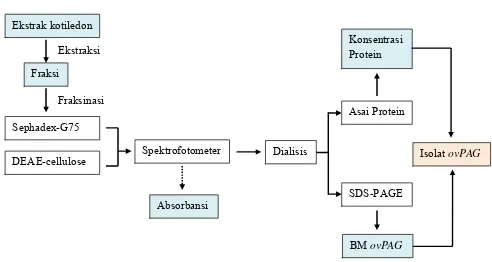
Metode Penelitian ... 33
Hasil dan Pembahasan ... 38
Kesimpulan ... 45
Daftar Pustaka ... 45
PEMBUATAN POLIKLONAL ANTIBODI RABBIT OVINE PREGNANCY-ASSOCIATED GLYCOPROTEIN (Rabbit anti-ov PAG) 48 Abstrak ... 48
Abstract ... 48
Pendahuluan ... 49
Metode Penelitian ... 52
Hasil dan Pembahasan ... 55
Kesimpulan ... 63
xvii (ovPAG) MENGGUNAKAN TEKNIK ENZYME LINKED
IMMUNOSORBENT ASSAY (ELISA) TERMODIFIKASI ... 66
Abstrak ... 66
Abstract ... 66
Pendahuluan ... 67
Metode Penelitian ... 69
Hasil dan Pembahasan ... 71
Kesimpulan ... 74
Daftar Pustaka ... 75
PEMBAHASAN UMUM ... 76
KESIMPULAN DAN SARAN UMUM ... 81
DAFTAR PUSTAKA ... 82
xviii
Halaman
1 Jumlah Fraksi dan Konsentrasi Protein pada Kolom
Sephadex-G75 dan DEAE-cellulose ... 41
2 Isolat ovPAG dan Konsentrassinya yang Diimunisasikan pada
Kelinci New Zealand White ... 52 3 Rerata Konsentrasi ovPAG dalam Urin dan Plasma Domba
Bunting dan Tidak Bunting terhadap Uji Antibodi Positif dan
Negatif ... ... 73
4 Konsentrasi ovPAG dalam Urin Domba Garut Tidak Bunting
xix
Halaman
1 Alur kerangka pemikiran penelitian ovPAG 4
2 Tahapan awal kebuntingan domba ... 8
3 Pola hormon dalam plasma darah domba ... 11
4 Sel binukleat, kontribusinya terhadap plasenta ruminansia yang definitif dan karakteristik endokrinnya ... 13
5 Konsentrasi rata-rata ovPAG dalam plasma (± SEM) selama kebuntingan dan postpartum pada domba (A) Churra dan (B) Merino ... 15
6 Diagram ekspresi ovPAG sepanjang usia kebuntingan ... 17
7 Proses Filtrasi Gel ... 19
8 Proses Kromatografi Pertukaran Anion ... 19
9 Perbedaan respon primer dan sekunder antigen yang disuntikan 24 10 Prosedur Metode Western Blot ... 25
11 Alur kerangka pemikiran penelitian ekstraksi dan isolasi ovPAG... 32
12 Tipe plasenta sinepiteliochorion pada domba ... 34
13 Proses Pembuatan Monogel SDS-PAGE ... 37
14 Kemiringan persamaan linear perhitungan migrasi relatif untuk menentukan berat molekul protein ovine pregnancy-associated glycoprotein (ovPAG) ... 39
15 Pita protein dari isolat hasil ekstraksi kotiledon yang terpapar pada monogel SDS-PAGE dengan pewarnaan Commassie Brilliant Blue ... 40
16 Absorbansi protein dalam fraksi dari kolom Sephadex-G75 (NH4HCO3) dan DEAE-cellulose (Tris-HCl 0,01 M, NaCl 20,40,80,160,320 mM dan 1M) ... 42
xx DEAE-Cellulose ... 44
19 Alur kerangka pemikiran penelitian pembuatan antibodi
poliklonal rabbit anti- ovPAG ... 51 20 Respon imun poliklonal antibodi rabbit anti-ovPAGterhadap
berbagai sumber isolat ovine pregnancy-associated glycoprotein
(ovPAG) ... ... 58 21 Perbandingan potensi DN16 dan DN32 sebagai sumber rabbit
anti-ovPAG ... 59 22 Determinasi rabbit anti-ovPAG negatif (Ab -) maupun positif
(Ab +) terhadap berbagai sumber ovPAG (K, DN32, DN16,
DN8, DT, S) ... 60
23 Determinasi rabbit anti-ovPAG DN32 positif dan negatif terhadap ovPAG dalam urin domba garut bunting dan tidak
bunting ... 62
24 Alur kerangka pemikiran penelitian pengujian ovPAG
menggunakan teknik ELISA Termodifikasi ... 68 25 Kemiringan dan persamaan linear standar DN32 pada tiga
xxi
Halaman
1 Persetujuan Komisi ACUC ... 89
2 Sodium dedocyl sulphate-polyacrylamide gel electrophoresis
(SDS-PAGE) ... 90
3 Pewarnaan Commassie Brilliant Blue ... 91 4 Perhitungan berat molekul protein dalam monogel SDS-PAGE 92
5 Makalah Publikasi ... 93
6 Uji Beda t-student antara Konsentrasi ovPAG dalam Urin
xxii % : persen
(NH4)2SO4 : amonium sulfat
µl : mikroliter
0
C : derajat Celcius
1 CV : 1 column volume
2N H2SO4 : 2 Normalitas asam sulfat
Ab : antibodi
Ag : antigen
AMP : Adenosin mono phosphate
APS : Amonium per sulphate
ATP : adenosin tri phosphate
BCA : bichinconinic acid
BICP : 5-bromo-4-chloro-3-indolyl phosphate disodium salt
BM : berat molekul
boPAG, bPAG : bovine pregnancy-associated glycoprotein caPAG, cPAG : caprine pregnancy-associated glycoprotein CBB : commassie brilliant blue
cDNA : cyclic deoxiribonucleic acid
COOH : karboksil
DEAE : diethylaminoethane
dH2O : deionized water
DN : DEAE-NaCl
DT : DEAE-Tris HCl
ELISA : enzyme linked immuno sorbent assay FCA : Freud’s complete adjuvant
FICA : Freud’s Incomplete adjuvant
g : gravitasi
H2SO4 : asam sulfat
xxiii ICM : inner cell mass
Interferon-τ : Interferon-tau kDa : kilo Dalton
KOH : kalium hidroksida
KPA : kromatografi pertukaran anion
M : molar
Mg2+ : ion magnesium positif 2
ml : mililiter
mM : milimolar
mRNA : massenger ribonucleic acid
MRP : maternal recognition of pregnancy NaCl : natrium chlorida
NBT : nitrotetrazolium blue chlorine-98%
ng : nanogram
NH4HCO3 : amonium bikarbonat
NZW : New Zealand White
OD : optical density OH : hidroksil
ovPAG : ovine pregnancy-associated glycoprotein PAG : pregnancy-associated glygoprotein PBS : phosphate buffer saline
PEG : polietilen glikol
pH : derajat keasaman
QC-H : Quality Control-Hihgh
QC-L : Quality Control-Low
RIA : radio immuno assay
S : Sephadex
SBN : sel binukleik
xxiv TEMED : Tetra methyl ethylene diamine
TMB : 3,3’,5,5’ tetra methyl benzidine dihydrochloride
Tris- HCl : tris-asam chlorida
tRNA : transfer ribonucleic acid
Latar Belakang
Populasi domba di Indonesia saat ini berjumlah 7.549.316 ekor sedangkan
di Jawa Barat mencapai 4.221.806 ekor atau 55,92% populasi nasional.
Pemotongan domba yang tercatat di Jawa Barat pada tahun 2006 mencapai
3.343.365 ekor (Disnak Prov Jabar 2008). Peningkatan populasi domba menjadi
lambat karena di lapangan masih banyak ditemukan pemotongan hewan betina
dalam keadaan bunting. Hal ini terjadi oleh karena belum adanya alat deteksi
kebuntingan pada ruminansia kecil yang mudah dan cepat dilakukan di lapangan.
Belum berkembangnya metode deteksi kebuntingan dini pada ruminansia kecil
secara tidak langsung akan berakibat pada rendahnya efisiensi manajemen
reproduksi.
Metode deteksi kebuntingan pada ruminansia kecil khususnya domba
perkembangannya belum seperti pada hewan besar. Beberapa metode deteksi
kebuntingan pada ternak lain telah diadopsi untuk domba, tetapi hasilnya belum
memuaskan. Penentuan kebuntingan dengan mengamati early pregnancy factor yang dapat dideteksi 24 jam setelah perkawinan dengan metode rossette inhibition sulit diterapkan di lapangan (Jainudeen & Hafez 2000). Aktivitas ovine trophoblast protein 1 (oTP-1) disebut juga ovine interferon tau (oIFN- ) adalah
memperpanjang fase luteal dengan produksi yang sangat tinggi
(Geisert & Malayer 2000; Ezashi & Roberts 2004) hanya berlangsung beberapa
hari antara hari ke 12-21 setelah perkawinan (Roberts et al. 1992; Demmers et al. 2001, Spencer & Bazer 2004). Interferon- terutama berfungsi sebagai sinyal penanda kebuntingan (Gray et al. 2006) serta mempersiapkan endometrium untuk implantasi yang terjadi pada hari ke-18 usia kebuntingan
(Klein et al. 2006; Dunlap et al. 2005).
Progesteron dan estrogen sebagai penanda kebuntingan pernah dilaporkan
oleh Spencer et al. (2004) tetapi konsentrasi kedua hormon tersebut yang tidak berbeda sesaat setelah implantasi. Akibatnya sulit dibedakan antara domba
Senger 1999). Transrectal ultrasonography (USG), merupakan metode yang
aplikatif di lapangan (Pierson & Ginther 1988;
Wodzicka-Tomaszewka et al. 1991; Strmśnik et al. 2002), tetapi diperlukan peralatan dan keahlian khusus serta dilakukan secara invasive yang dapat menyebabkan terjadinya stres (Karen et al 2003a). Selain itu, sekitar 35% kematian embrio dapat terjadi di awal kebuntingan sehingga pemanfaatan USG
untuk deteksi kebuntingan dini akan sulit (Szafranska et al. 2006). Oleh karena itu perlu dikembangkan metode deteksi kebuntingan dini yang aplikatif di
lapangan; akurat; non-invasive (Monfort et al. 1997; Karen et al 2003b; Chelini et al. 2005); cepat, dan aman (Verbeckmoes et al. 2004).
Pregnancy-associated glygoprotein (PAG) merupakan famili aspartik protease yang disekresikan oleh sel binukleat trofoblastik sesaat menjelang
implantasi (Wooding 1992; Sousa et al. 2006). Substansi ini telah berhasil dipurifikasi dari plasenta domba; kambing; sapi; babi; kerbau; zebu, dan dengan
berat molekul berkisar antara 35 – 75,8 kDa bison (El Amiri et al. 2004; Xie et al. 1996; Garbayo et al. 1998; Zoli et al. 1991; Szafranska et al. 2003; Barbato et al. 2008; Sousa et al. 2002; Kiewisz et al. 2008). Konsentrasi PAG dapat terdeteksi dalam darah induk pada awal kebuntingan dengan akurasi 76,6 –
100% (Szafranska et al. 2006). Konsentrasi PAG meningkat sejalan dengan berkembangnya plasenta yang mengindikasikan bahwa perkembangan embrio
berjalan dengan baik. Oleh sebab itu, PAG memiliki fungsi ganda yaitu sebagai indikator kebuntingan maupun kesehatan feto-plasental (Karen et al. 2003b; Boscos et al. 2003; Jonker 2004).
Kerangka Pemikiran
.
Metode deteksi kebuntingan pada ruminansia kecil khususnya domba
belum berkembang dibandingkan dengan ruminansia besar. Pregnancy-Associated Glycoprotein (PAG) merupakan protein yang disekresikan oleh sel binukleid tropoblas dari ternak diawal masa kebuntingan, dan konsentrasinya
terus meningkat hingga mencapai 300-400 ng/ml pada saat sel chorion
potensial sebagai penanda kebuntingan. Substansi ini dapat diisolasi dari plasenta
pada saat melahirkan sehingga tidak ada hewan yang dikorbankan.
Konsentrasinya akan mencapai basal sekitar dua minggu setelah melahirkan,
dengan demikian tidak akan bias dengan PAG bunting dan dapat dideteksi sebelum siklus berikutnya
Selama ini, pengukuran konsentrasi ovPAG masih memanfaatkan teknik RIA, akan tetapi teknik ini menggunakan bahan radioaktif yang saat ini sudah
mulai ditinggalkan. Oleh karena itu perlu dikembangkan suatu teknik untuk
mendeteksi ovPAG yang aplikatif, aman, sederhana, fleksibel, mudah dengan volume sampel yang kecil tetapi mempunyai tingkat akurasi yang tinggi seperti
teknik ELISA.
Berdasarkan kondisi di atas maka dilakukan serangkaian penenlitian yang
dimulai dengan ekstraksi dan isolasi ovPAG dar kotiledon plasenta; dilanjutkan dengan memproduksi antibodi poliklonal pada kelinci (rabbit anti-ovPAG), serta mengembangkan teknik ELISA Termodifikasi agar dapat mengukur konsentrasi
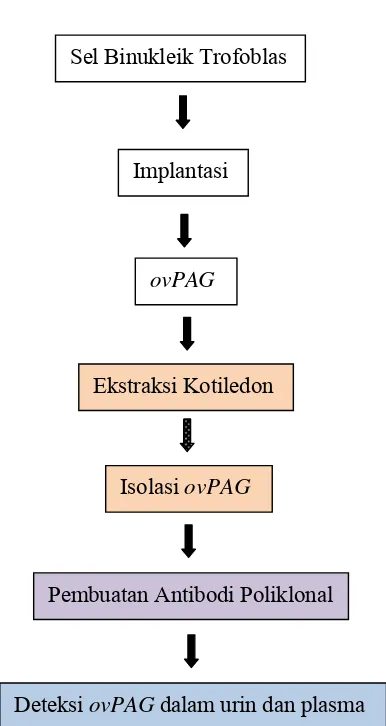
ovPAG dalam urin dan plasma (Gambar 1).
Tujuan Penelitian
Penelitian ini bertujuan untuk : (1) purifikasi ovPAG dalam kotiledon plasenta (2) memproduksi anti bodi poliklonal (Rabbit anti-ovPAG) (3) mendeterminasi ovPAG dalam urin domba bunting (4) menentukan konsentrasi ovPAG terendah dalam urin domba bunting.
Manfaat Penelitian
Hasil penelitian ini diharapkan (1) dapat memurnikan ovPAG yang ada di dalam kotiledon plasenta domba garut berdasarkan berat molekulnya (2) dapat
dikembangkan menjadi penanda deteksi kebuntingan (3) mendapatkan metode
Hipotesis
Ovine Pregnancy-associated glycoprotein (ovPAG) ditemukan pada domba bunting dan dapat diisolasi dari kotiledon plasenta. OvinePAG, berdasarkan berat molekulnya berbeda pada setiap spesies.
Sel Binukleik Trofoblas
Implantasi
ovPAG
Ekstraksi Kotiledon
Isolasi ovPAG
Pembuatan Antibodi Poliklonal
Deteksi ovPAG dalam urin dan plasma
Aktivitas Reproduksi Domba Siklus Estrus
Siklus estrus domba berkisar antara 14-19 hari (Jainudeen et al. 2000).
Domba garut yang dipelihara secara intensif mempunyai siklus estrus antara
17-20 hari sedangkan yang dipelihara secara tradisional adalah 14-30 hari
(Hastono & Masbulan 2001).
Siklus estrus terdiri dari dua fase yaitu fase folikuler dan luteal. Fase
folikuler terbagi menjadi proestrus dan estrus sedangkan fase luteal terbagi
menjadi metesrus dan diestrus. Fase folikeluler paling dominan ditandai dengan
produksi hormon estrogen oleh folikel sedangkan fase luteal didominasi oleh
pertumbuhan korpus luteum yang ditandai dengan diproduksinya progesteron
(Senger 1999).
Masa Kebuntingan
Kebuntingan adalah serangkaian proses fisiologis yang dimulai dari
terjadinya fertilisasi dan diakhiri dengan kelahiran (Jainudeen & Hafez 2000).
Lama kebuntingan pada domba bervariasi bergantung pada bangsanya yaitu
berkisar antara 144 – 153 hari (Johnson & Everitt 2000; Senger 1999) dengan
rata-rata 148 hari.
Fertilisasi
Pembentukan suatu individu baru dimulai dari penggabungan antara
spermatozoa dan ovum yang dikenal dengan fertilisasi yang terjadi di dalam
oviduk. Fertilisasi diakhiri dengan terbentuknya satu sel kompleks yang disebut
embrio. Embrio akan mengalami pembelahan sel sampai terbentuk suatu jaringan
yang berbeda disebut dengan blastosis. Blastosis memiliki dua populasi sel yang
mengelilingi ICM. Embrio akan tumbuh dari perkembangan ICM sedangkan
plasenta dan membran ekstraembrionik tumbuh dari trofektoderm. Interaksi
antara blastosis dan epitel endometrium induk merupakan awal terjadinya
implantasi (Senger 1999: Dey et al. 2004).
Konseptus memasuki uterus pada hari ke-4, blastosit terbentuk pada hari
ke-6 dan menetas dari zona pelusida pada hari ke 8-9 (Gambar 1). Blastosit
berkembang dari bentuk sperikal menjadi tubuler pada hari ke-11 kemudian
mengalami elongasi berbentuk filamen antara hari ke-12 dan 16. Elongasi dari
blastosit menandakan terjadinya implantasi yang melibatkan proses aposisi dan
penempelan (hari 12-15) serta mengalami adesi secara ketat pada hari ke-16
(Spencer et al. 2004).
Pembentukan trofektoderm yang diikuti dengan perkembangan lebih lanjut
menjadi trofoblas merupakan tahapan yang penting untuk dimulainya implantasi
dan terjadinya kebuntingan. Sebelum embrio menempel pada dinding uterus,
embrio akan mengalami tiga tahapan penting yaitu : perkembangan awal embrio,
preimplantasi yang meliputi perkembangan embrio lebih lanjut serta terjadinya
membran ekstraembrionik, dan terbentuknya fetus (telah mempunyai bentuk yang
definitif spesies tertentu) serta plasenta (Senger 1999).
Implantasi
Implantasi pada ruminansia (sapi, domba, kambing) terjadi pada tahap
blastosis. Waktu terjadinya implantasi berbeda-beda pada setiap spesies yaitu
pada babi hari ke-13, sapi hari ke-20, domba hari ke-16 dan kambing hari ke-19
(Dey et al. 2004; Spencer & Bazer 2004). Implantasi merupakan proses yang
sangat rumit dan melibatkan interaksi yang sangat dekat antara blastosit dan
penerimaan uterus terhadap embrio. Tempat terjadinya implantasi terletak pada
area karunkular (Johnson & Everitt 2000; Dey et al. 2004; Lee & DeMayo 2004).
Blastosis berkembang dari embrio tahap awal, morula, sebagai hasil dari
penyatuan dan mengisi blastocoele yang dikelilingi oleh selapis sel embrio atau
trofektoderm (Gambar 2). Trofektoderm terlibat dalam adhesi dengan epitel
endometrium sehingga terjadi implantasi. Penerimaan uterus yang terjadi pada
sangat kondusif untuk menerima blastosis dan implantasi. Interaksi dua arah
antara blastosis dan epitel endometrium induk memicu terjadinya implantasi,
suatu proses dimana pembuluh darah embrio berkomunikasi dengan sirkulasi
darah induk untuk meneguhkan fungsi plasenta dan kebuntingan. Sirkulasi induk
mempunyai barier khusus yang dapat menyeleksi dengan jalan menembus
plasenta untuk melindungi dan memberi makan embrio (Dey et al. 2004;
Wodzicka-Tomaszewka et al. 1991).
Plasentasi pada ruminansia seperti sapi dan domba adalah superfisial, yang
dikenal sebagai kotiledon sinepiteliokhorial (Wooding 1992). Sinepiteliokhorial
adalah sinsisium feto-maternal yang merupakan fusi sel binukleat trofoblas dan
sel epitel uterus. Sedang kotiledon merupakan struktur kasar dari plasenta dan
vili trofoblas yang membentuk kripta karunkel induk. Fusi seluruhnya atau
sebagian kotiledon fetus dengan karunkel induk disebut plasentom yang
merupakan tempat utama terjadinya pertukaran nutrien dan gas dalam plasenta
(Green et al. 1998; Xie et al. 1996).
Domba dengan tipe plasenta sinepiteliochorial akan mengalami
pre-implantasi pada hari ke 8-15 diikuti dengan pemanjangan periode aposisi dan
penempelan. Menurut Spencer et al. (2004), pada domba implantasi dan plasentasi
dimulai pada hari ke 15-16 tetapi prosesnya akan terus berlanjut sampai hari ke
50-60 usia kebuntingan. Keberhasilan implantasi dapat dideteksi paling lambat 14
hari setelah ovulasi atau sekitar hari ke 5-15 (Wilcox et al. 1999;
Johnson & Everitt 2000; Aplin & Kimber 2004).
Sejak terjadinya fertilisasi sampai implantasi, aktivitas ini juga
dipengaruhi oleh aktivitas hormonal terutama progesteron dan estrogen
(Gambar 1). Estradiol mencapai konsentrasi 10 pg/ml pada saat puncak estrus
yang merupakan saat yang paling baik untuk perkawinan, yang konsentrasinya
berfluktuasi sampai terjadi implantasi. Sementara konsentrasi progesteron sejak
terjadinya fertilisasi sampai terbentuk blastosis pada hari ke-8 mengalai
peningkatan konsentrasi sampai mencapai 10 ng/ml. Konsentrasi ini tetap
bertahan sampai terjadinya implantasi. Keberhasilan implantasi dan kebuntingan
didukung oleh adanya interaksi antara progesteron dan estrogen yang disekresikan
Penanda Kebuntingan
Saat yang paling kritis dalam siklus reproduksi ternak ditentukan oleh
kemampuan induk untuk menerima sinyal yang dikirimkan oleh konseptus untuk
menghalangi terjadinya luteolisis dan mempertahankan kebuntingan yang disebut
dengan maternal recognition of pregnancy atau MRP (Senger 1999;
Geisert & Malayer 2000) . Pada ruminansia sinyal penanda kebuntingan yang
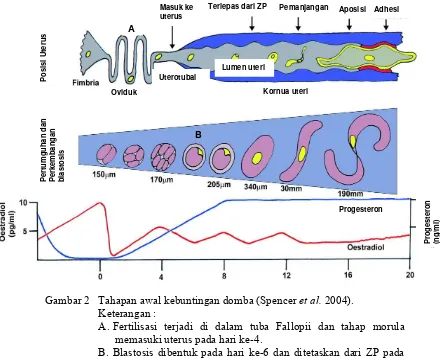
[image:32.612.90.530.87.445.2]utama adalah interferon tau (Johnson & Everitt 2000; Spencer & Bazer 2004). Gambar 2 Tahapan awal kebuntingan domba. Fertilisasi terjadi di dalam tuba
Fallopii dan tahap morula memasuki uterus pada hari ke-4. Blastosis dibentuk pada hari ke-6 dan ditetaskan dari ZP pada hari ke 8-9. Berkembang dari bentuk spherical menjadi tubular pada hari ke-11, perpanjangan ke filamenus pada hari ke 12-15. Perpanjangan blastosis menandakan dimulainya implantasi yang melibatkan aposisi dan penempelan secara cepat pada hari ke 12-15 dan pelekatan secara kuat pada hari ke-16 (Spencer et al. 2004).
P o s isi Uteru s P e rtu m g uha n dan Pe rk e m ba nga n b las to si s Masuk ke uterus
Pemanjangan Aposisi Adhesi
Kornua uteri Lumen uteri
Terlepas dari ZP
Uterotubal
Oviduk
Hari Sesudah Perkawinan
P rog ester on (ng/ ml ) Progesteron
Gambar 2 Tahapan awal kebuntingan domba (Spencer et al. 2004). Keterangan :
A. Fertilisasi terjadi di dalam tuba Fallopii dan tahap morula memasuki uterus pada hari ke-4.
B. Blastosis dibentuk pada hari ke-6 dan ditetaskan dari ZP pada hari ke 8-9. Berkembang dari bentuk spherical menjadi tubular pada hari ke-11, perpanjangan ke filamenus pada hari ke 12-15. C. Perpanjangan blastosis menandakan dimulainya implantasi
yang melibatkan aposisi dan penempelan secara cepat pada hari ke 12-15 dan pelekatan secara kuat pada hari ke-16
A
B
Penanda kebuntingan berbeda-beda sesuai dengan bangsanya akan tetapi
mempunyai fungsi yang sama yaitu mencegah terjadinya luteolisis agar tidak
terjadi abortus. Pada primata (CG); manusia (HCG) maupun kuda (PMSG)
sekresinya berupa choriogonadotrophin. Domba maupun sapi disekresikan
interferon-tau maupun early pregnancy factor yang berfungsi untuk menekan
peningkatan reseptor oksitosin, sedangkan pada babi disekresikan estrogen untuk
menekan sekresi prostaglandin. Substansi penand akebuntingan ini akan menurun
konsentrasinya atau bahkan menghilang pada saat implantasi telah terjadi
bersamaan dengan mulai terbentuknya plasenta.
Pada saat implantasi sempurna, akan diikuti dengan plasentasi yaitu proses
terbentuknya plasenta (chorion, alantois dan amnion). Plasenta berfungsi sebagai
pelindung konseptus dengan jalan mensekresikan cairan plasenta. Sekresi
plasenta berupa steroid (progesteron dan estrogen), laktogen plasenta
(Devlin 2002) serta PAG (Green et al. 1998, Xie et al. 1996). Substansi yang
disekresikan oleh plasenta akan bertahan sampai kebuntingan berakhir.
Sekresi Plasenta Progesteron
Progesteron merupakan hormon penjaga kebuntingan. Keberadaan
progesteron di dalam uterus akan menstimulir dan menjaga fungsi uterus sehingga
dapat dipergunakan untuk tempat perkembangan embrio dini, implantasi,
plasentasi serta keberhasilan perkembangan fetus dan plasenta sampai akhir masa
kebuntingan (Spencer et al. 2004).
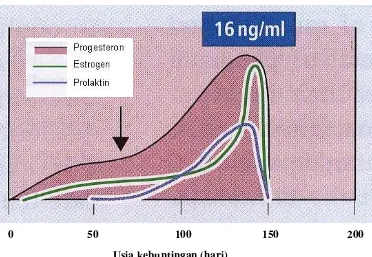
Pada ternak domba, sudah dapat dinyatakan bunting jika konsentrasi
progesteron dalam darah minimal 2,5 ng/ml (Boscos et al. 2003) sedangkan
peneliti lainnya menyatakan bahwa konsentrasi tertinggi progesteron pada fase
luteal pada 2-4 ng/ml dibandingkan dengan saat estrus pada 1,5-0,8 ng/ml
(Ranilla et al. 1994). Peningkatan yang drastis dari 2-4 ng/ml menjadi 12-20
ng/ml terjadi pada kebuntingan hari ke 60-125 (Edqvist & Stabenfeldt 1980),
sama terlihat level progesteron meningkat dengan konsentrasi tertinggi 16 ng/ml
(Johnson & Everitt 2000).
Korpus luteum domba memproduksi progesteron dalam jumlah yang
relatif rendah pada 50 hari pertama kebuntingan, tetapi setelah melewati masa ini
plasenta merespon terhadap lueteinizing hormon maupun prolaktin, untuk
mempersiapkan diri sebagai sumber utama progesteron sampai kebuntingan
berakhir. Hal ini menunjukkan bahwa konsentrasi progesteron baru terukur
setelah hari ke-60 (Schoenecker et al. 2004).
Apabila plasenta telah berfungsi dengan sempurna maka meskipun
dilakukan ovariektomi produksi hormon yang menjaga kebuntingan tetap
disekresikan karena fungsinya telah digantikan oleh plasenta (Gambar 3). Domba
apabila dilakukan ovariektomi setelah hari ke-50 tidak akan menyebabkan
terjadinya abortus (Senger 1999; Johnson & Everitt 2000).
Estrogen
Aktivitas utama estrogen adalah menunjukkan tanda berahi saat estrus,
meningkatkan ukuran uterus, aliran darah uterus, meningkatkan ekspresi reseptor
progesteron terhadap oksitosin, mendorong perkembangan organ fetus,
menstimulir produksi protein hepar induk serta meningkatkan massa jaringan
mammae dan adipose (Hirako et al. 2003; Senger 1999; Johnson & Everitt 2000).
Estrogen merupakan hormon yang selain diproduksi oleh ovarium juga
diproduksi oleh kotiledon fetus bersama-sama dengan karunkula induk
(Teng et al. 2002). Salah satu produk deteksi kebuntingan (DEEA Gestdect®)
dengan memanfaatkan ikatan fenol yang terikat pada gugusestrogen dalam urin,
mempunyai mempunyai akurasi pada domba dan sapi berturut-turut 60-70 % dan
90 % (Samsudewa et al. 2005). Hal ini menunjukan bahwa estrogen terukur
Pregnancy-Associated Glycoprotein (PAG)
Pregnancy-Associated Glycoprotein (PAG) merupakan glikoprotein asam
(pI 4.4-5.4), sebagai anggota famili aspartik proteinase yang memperlihatkan
sekuen yang paling dekat dengan pepsin (Green et al. 2000).
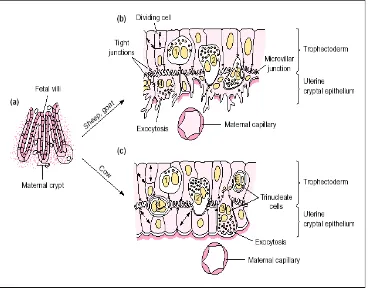
Pregnancy-associated glycoprotein disintesa oleh sel mono- dan binukleat trofoblas (Gambar
3). Sel binukleik (SBN) fetus merupakan sel unik pada ruminansia, sumber utama
protein plasenta seperti laktogen plasenta dan hormon steroid yang
bertanggungjawab terhadap keberhasilan kebuntingan (Atkinson et al. 1993).
Selanjutnya SBN migrasi melalui apical tight junction epitelium chorion,
melintasi microvillar junction fetomaternal, kemudian fusi ke dalam sinsisium
uterus. Sinsisium berhubungan erat dengan sirkulasi darah induk, pada fusi lebih
lanjut granula SBN dilepas oleh proses eksositosis ke dalam sinsisium. Adanya
perpindahan produk plasenta sepanjang kebuntingan kemungkinan erat kaitannya
[image:35.612.134.506.97.354.2]Usia kebuntingan (hari)
Gambar 3 Pola hormon dalam plasma darah domba saat bunting. Garis panah menunjukkan saat dimana ovariektomi (Johnson & Everitt 2000).
dengan keberhasilan proses metabolisme dan atau imunologi antara induk dan
fetus (Wooding 1992). Perubahan pada sistem ini akan menurunkan kapasitas
konseptus dalam memproduksi sinyal biologis yang berkaitan dengan kebuntingan
yang diperlukan untuk perkembangan dan pertumbuhan fetus
(Regnault et al. 1999).
Pada domba, sel-sel ini berdiferensiasi dari sel mononukleik trofektoderm
sesaat sebelum kontak antara epitel uterus dengan plasenta yang umumnya terjadi
pada hari ke-13 (Green et al. 2000) atau ke 14-15 kebuntingan
(Dunlap et al. 2005).
Mekanisme Sintesis Protein Ovine Pregnancy-Associated Glycoprotein (ovPAG)
Asam amino bereaksi dengan ATP membentuk kompleks AMP dan
pirofosfat. Reaksi ini dikatalisis oleh enzim aminoacyl-tRNA synthetase dengan
adanya Mg2+. Enzim yang dipergunakan berbeda untuk setiap asam amino . Pada
pemisahan fosfat grup dari ATP akan melepas banyak energi yang tersimpan
dalam kompleks asam amino AMP. Kompleks asam amino AMP-enzim disebut
asam amino teraktivasi sementara pirofosfat dihidrolisis menjadi dua organik
fosfat ( Zubay 1993; Champe et al. 2008).
Kompleks asam amino AMP-enzim berikatan dengan tempat pengikatan
asam amino ( AA binding site) dari spesifik tRNAnya sementara COOH berikatan dengan OH. Katalisator dari reaksi ini adalah enzim yang sama yaitu yang
menghasilkan tRNA-amino acid complex disebut sebagai charged tRNA.
Sementara AMP dan enzim dilepaskan yang dapat dipergunakan untuk
mengaktivasi dan mengikat molekul tRNA lainnya. Selanjutnya kompleks asam
amino-tRNA bergerak menuju ribosom sebagai tempat sintesa protein. Aktivasi
ribosom oleh mRNA memerlukan Mg2+ pada konsentrasi yang sesuai.
Sel trofoblas menyimpan protein ini dalam granula (Gambar 4) dan
melepaskannya ke dalam organisme induk setelah terjadinya fusi dengan sel epitel
endometrium induk (Dunlap et al. 2006). Molekul mRNA terletak pada sel mono-
maupun binukleat trofoblas. Dengan memanfaatkan antibodi monoklonal
(Garbayo et al. 2008), selanjutnya melalui proses glikolisasi terbentuk PAG
(Klisch et al. 2008). Pregnancy-Associated Glycoprotein dilepaskan dari sel
trofoblas dan terikat pada reseptor sel permukaan spesifik pada sel target induk.
Embrio memulai transkripsi gen spesifik di dalam massa sel bagian dalam
blastosis, mRNA yang mengatur sintesis PAG di dalam trofoblas. Selanjutnya
PAG akan mendorong respon induk melalui reseptor pada endometrium
(Lambert et al. 2005). Variasi derajat glikosilasi pada PAG berbeda-beda
tergantung dari kadar karbohidrat yang berkaitan dengan usia kebuntingan, yang
merupakan faktor penting pada saat menentukan waktu paruhnya dalam plasma
[image:37.612.133.501.298.588.2]induk (Klisch et al. 2005; Sousa et al. 2006).
Gambar 4 Sel binukleat, kontribusinya terhadap plasenta ruminansia yang definitif dan karakteristik endokrinnya (Wooding 1992)
Keterangan : (a) Bagian plasenta matang yang memperlihatkan vili kotiledon fetus memasuki kripta karunkel induk
Pregnancy-Associated Glycoprotein, awalnya dikenal sebagai antigen
plasenta yang ditemukan pada serum induk sapi sesaat setelah implantasi
(Zoli et al. 1992, Sousa et al. 2006). Perkembangan lebih lanjut PAG telah
berhasil dipurifikasi dari plasenta domba; kambing; sapi; babi; kerbau; zebu, dan
bison (El Amiri et al. 2004; Garbayo et al. 1998; Zoli et al. 1991;
Szafranska et al. 2003; Sousa et al. 2002; Kiewisz et al. 2008). Berat molekul
PAG berbeda pada beberapa spesies yaitu domba pada 55-66 kDa
(El Amiri et al. 2004) bahkan mempunyai berat molekul lebih tinggi pada 70 kDa
(Xie et al. 1996); kambing pada 55; 59, dan 62 kDa (Garbayo et al. 1998); sapi
pada 67 kDa (Zoli et al. 1992); babi pada 35-72 kDa (Szafranska et al. 2003);
kerbau pada 59,5-75,8 kDa pada pertengahan kebuntingan dan 57,8-73,3 kDa
pada akhir kebuntingan (Szafranska et al. 2003); zebu pada 51-69 kDa
(Sousa et al. 2002), dan bison pada 50;55;60;67, dan 71 (Kiewisz et al. 2009).
Profil PAG domba garut belum ditemukan oleh karena itu, sebagai
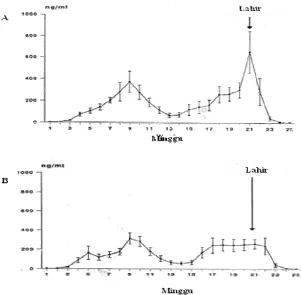
pembanding dipilih domba Merino. Konsentrasi ovPAG pada domba Merino
mulai terukur pada minggu ketiga yang terlihat setara konsentrasinya pada
minggu ke-23atau dua minggu setelah melahirkan (Gambar 5). Setelah minggu
ke-3 , konsentrasinya terus meningkat secara signifikan dan mencapai puncak
pertama pada minggu 9. Kemudian mengalami penurunan sampai minggu
ke-13, tetapi konsentrasinya masih lebih tinggi dari minggu ke-3maupun minggu
ke-23. Selanjutnya konsentrasi ovPAG meningkat kembali dan mencapai puncak
kedua pada minggu ke-17. Mulai minggu ke 17-21konsentrasinya terlihat sama
dan tetap bertahan sampai seminggu setelah melahirkan kemudian menurun dan
mencapai konsentrasi basal sekitar tiga minggu setelah partus (Ranilla et al. 1994)
dibandingkan dengan sapi pada hari ke 80-90 (Haugejorden et al. 2006). Peneliti
ini menemukan bahwa waktu paruh ovPAG dalam plasma adalah 4,5 hari setelah
partus dibandingkan sapi selama 9 hari.
Berdasarkan fluktuasi konsentrasi ovPAG sepanjang usia kebuntingan
maka pada domba mengikuti pola sekresi dua fluktuasi (Szafranska et al. 2006)
yaitu meningkat (300 – 400 ng/ml) di sepanjang dua bulan awal kebuntingan
yaitu ketika sel chorion secara intensif berproliferasi serta terbentuknya plasenta.
meningkat sampai akhir masa kebuntingan yaitu 300 ng/ml pada Merino dan 600
ng/ml pada Churra (Ranilla et al. 1994).
Pregnancy-Associated Glycoprotein dikenal sebagai antigen spesifik yang
disekresikan oleh plasenta sehingga keberadaannya dalam serum dapat
dipergunakan sebagai metode serologis untuk menguji kebuntingan dini pada sapi
dimulai dari 28 hari setelah dikawinkan (Zoli et al. 1992). Pada domba,
konsentrasi ovPAG dapat didiagnosa pada hari ke-22 setelah IB menggunakan
metode RIA (Karen et al. 2003), sedangkan peneliti lain menemukan bahwa
analisis PAG dapat dilakukan pada saat usia kebuntingan dimulai pada minggu
ke-4 setelah IB menggunakan heterologous (anti-caPAG(55+59) antisera
(Ledezma-Torres et al. 2006). Waktu pengukuran yang lebih cepat pada akhirnya
ditemukan oleh Green et al. (2000) menggunakan metode ribonuclease
[image:39.612.139.440.354.649.2]protection assay pada hai ke-13 setelah dikawinkan.
Gambar 5 Konsentrasi rata-rata ovPAG dalam plasama (± SEM) selama kebuntingan dan postpartus pada domba (Ranilla et al. 1994) Keterangan : (A) Churra
Green et al. (2000) melaporkan berdasarkan ekspresi gen pada cDNA
menggunakan analisis filogenetik dengan metode ribonuclease protection assay
(RPA) terdapat 9 ovPAG yang muncul sepanjang lapisan luar epitel. Pada saat
terbentuknya PAG, sekuen DNA mengalami perubahan pada tiga kodon dari CAG
AAT CTC menjadi GAG CCT GTC (Hughes et al. 2003). Ekspresi gen ini erat
kaitannya dengan pembentukan granul dari sel binukleat sehingga dapat
dimanfaatkan sebagai dasar deteksi kebuntingan. Teknik ini sangat sensitif dan
spesifik sehingga dapat mendeteksi keberadaan ovPAG sepanjang usia
kebuntingan (Gambar 6). Prinsip teknik RPA adalah mendeteksi keberadaan
mRNA dengan cara melabel cDNA menggunakan bahan radio aktif. Tangan DNA
yang sekuennya tidak homolog akan gagal berhibridasi dengan mRNA, dengan
pemberian RNAse akan didapat satu sekuen gel yang terdiri dari RNA yang
terlindungi dan tidak. Adanya pita protein yang terlindungi menunjukkan adanya
mRNA yang diidentifikasi berdasarkan ukurannya. Meskipun teknik ini dapat
mendeteksi keberadaan mRNA secara spesifik dan sensitif tetapi selama proses
dapat terjadi denaturasi RNA serta kemungkian terjadinya kontaminasi terhadap
bahan radioaktif yang dipergunakan.
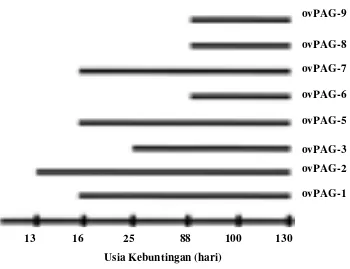
Berdasarkan ekspresi ovPAG (Gambar 5), ovPAG-2 terdeteksi paling cepat yaitu
pada hari ke-13 (Green et al. 2000) atau hari ke-14 sebagai PAG tunggal. Pada
hari ke-16, dapat terdeteksi ovPAG-1; ovPAG-5 dan ovPAG-7 (Green et al. 2000)
serta pada hari ke-17, selain ovPAG-1 juga ditemukan ovPAG-10 dan ovPAG-11
(Garbayo et al. 2008). Setelah kebuntingan hari ke-88 semua ovPAG dapat
terdeteksi. Metode ini memberikan gambaran bahwa ovPAG dapat dideteksi
sebelum memasuki siklus berahi terutama pada ovPAG-1; ovPAG-2; ovPAG-5;
ovPAG-7; ovPAG-10 dan ovPAG-11. Dengan demikian dimungkinkan untuk
melakukan isolasi ovPAG pada semua fase kebuntingan.
Selain bertambahnya usia kebuntingan, konsentrasi PAG dipengaruhi juga
oleh jumlah maupun jenis kelamin fetus. Induk domba dan kambing yang
mengandung 2 fetus mempunyai konsentrasi PAG lebih tinggi dari yang
mengandung fetus satu. Perbedaannya, pada domba konsentrasi PAG meningkat
dimulai dari minggu ke-12 sampai lahir sedangkan pada kambing konsentrasi
dimulai dari minggu ke-12 sampai lahir sedangkan pada kambing konsentrasi
PAG meningkat secara nyata pada saat implantasi seperti yang terjadi pada sapi
(Ranilla et al. 1994; González et al. 2004; Ledezma-Torres et al. 2006). Induk
yang mengandung fetus jantan mempunyai konsentrasi PAG akan lebih tinggi
pada 3 minggu terakhir masa kebuntingan dibandingkan dengan yang
mengandung fetus betina (Ranilla et al. 1994 ). Sedangkan peneliti lain
mengungkapkan bahwa jenis kelamin tidak mempengaruhi konsentrasi ovPAG
tetapi dipengaruhi oleh total berat fetus saat dilahirkan (Vandaele et al. 2003;
Bertolini et al. 2006).
Konsentrasi ovPAG diukur dengan menggunakan semi-purified ovPAG
sebagai standar, tracer maupun imunogen untuk memproduksi antibodi pada
kelinci. Antisera R780 (campuran α-ovPAG(57+59kDa)) dan R805 (campuran α -ovPAG5(58+61kDa) pada metode RIA merupakan antisera homolog yang sesuai
untuk mengukur konsentrasi ovPAG dalam plasma dari hari ke-18 setelah
inseminasi (El Amiri et al. 2007). Konsentrasi PAG dalam air susu maupun
[image:41.612.148.498.82.351.2]plasma darah pada sapi (boPAG) maupun kambing (caPAG) menunjukan Gambar 6 Diagram ekspresi ovPAG sepanjang usia kebuntingan
(Green et al. 2000)
ovPAG-9 ovPAG-8 ovPAG-7 ovPAG-6 ovPAG-5 ovPAG-3 ovPAG-2 ovPAG-1
peningkatan setelah hari ke-28 dan peningkatan konsentrasi secara cepat terjadi
menjelang melahirkan (Gajewski et al. 2008).
Konsentrasi ovPAG dimungkinkan untuk diukur dengan jalan
memproduksi anti-ovPAG. Molekul PAG yang diuji terhadap protein lain
(caPAG maupun ovPAG) memberikan hasil yang spesifik (Perényi et al. 2002;
Green et al. 2000). Perkiraan waktu paruh ovPAG dalam plasma adalah 9 dan 4.5
hari pada sapi dan domba, sedangkan konsentrasi basal baru tercapai pada hari ke
80-90 pada sapi dan hari ke 17-21 domba (Haugejorden et al. 2006).
Isolasi ovPAG
Isolasi ovPAG meliputi pemisahan dan karakterisasi protein. Pemisahan
protein dapat dilakukan menggunakan metode sentrifugasi, presipitasi garam dan
kolom kromatografi. Kolom kromatografi terdiri dari filtrasi gel dan pertukaran
ion (Nelson & Cox 2000; Abbas et al. 2007; Lodish et al. 2000).
Filtrasi Gel
Filtrasi gel merupakan metode yang umum dilakukan untuk menyeleksi
protein berdasarkan ukuran dan bentuk protein (Nelson & Cox 2000;
Lodish et al. 2000). Protein dengan berat molekul besar akan tertahan pada
lapisan serabut yang membentuk gel sedangkan protein yang akan diisolasi akan
lepas dan tertampung dalam fraksi yang dielusi dari kolom (Gambar 7).
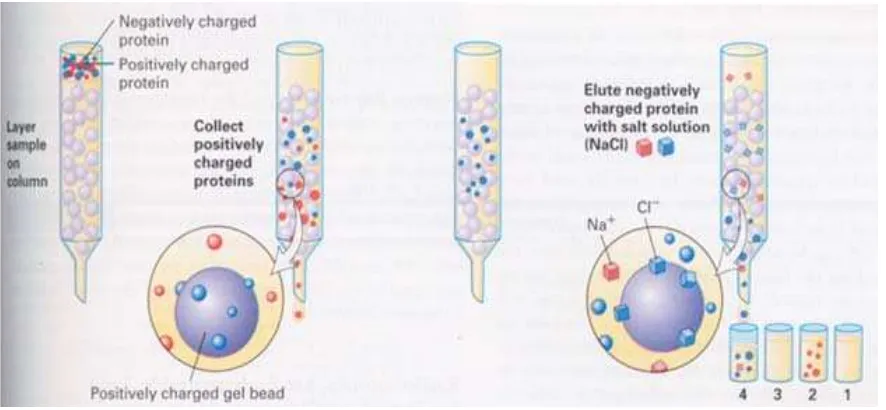
Kromatografi Pertukaran Anion
Kromatografi pertukaran ion (Nelson & Cox 2000; Lodish et al. 2000).
bergantung pada interaksi muatan-muatan ion antara protein dalam sampel
(protein terikat pada molekul ovPAG) dengan muatan imobil dalam resin dari
kolom yang dipilih. Ada dua jenis kromatografi pertukaran ion yaitu kation dan
anion yang ditentukan dari karakter protein atau enzim juga pH bufer yang
digunakan untuk melarutkan enzim. Kekuatan ikatan ion larutan dan total
konsentrasi garam merupakan faktor penentu agar kromatografi pertukaran ion
adanya interaksi antara muatan negatif protein sampel dan muatan positif resin
[image:43.612.142.468.150.406.2]yang dipergunakan sedangkan kromatografi pertukaran kation bekerja sebaliknya.
[image:43.612.104.547.478.683.2]Kromatografi pertukaran anion seperti DEAE (diethylaminoethyl)
mempunyai muatan positif sehingga akan mengikat ion bermuatan negatif. Grup
pertukaran anion akan terikat secara kovalen pada matriks selulosa atau sephadex
(modifikasi serbuk). Protein dapat dielusi dengan konsentrasi garam bertingkat
yang memungkinkan ion untuk berkompetisi pada fase ini. Oleh karena itu,
seluruh hasil elusi (fraksi) harus didialis untuk menghilangkan garam yang
terkandung di dalamnya.
Resin diethylaminoethane merupakan salah satu resin yang umum
dipergunakan sebagai kolom kromatografi pertukaran anion. Matrik resin dalam
kolom DEAE dapat mengikat 10 sampai 100 mg protein per ml dan mempunyai
kemampuan untuk meningkatkan kemampuan dan memisahkan fragmen protein
dari ’slurry’ pembuka. Bufer yang dipergunakan mempunyai pH antara 7-10 dan
larutan yang dipergunakan sebagai ’runnning gradient’ adalah 1 M NaCl. Garam
dalam larutan berkompetisi untuk mengikatan muatan imobil dalam matrik dan
melepas protein dari tempat ikatan pada konsentrasi yang telah dikondisikan.
Variasi konsentrasi garam diperlukan untuk memisahkan muatan protein yang
diisolasi dari protein kontaminan (Gambar 8).
Elektroforesis Gel pada Monogel Sodium Dedocyl Sulfate-Polyacrylamide Gel Electrophoresis (SDS-PAGE)
Protein yang ada dalam fraksi terikat dengan SDS dalam ikatan yang telah
didenaturasi. Selama elektroforesis komplek protein-SDS melewati PAGE.
Protein yang lebih kecil akan lebih mudah melewati pori dan cepat dibandingkan
dengan yang lebih besar. Protein terpisahkan dalam gel berdasarkan ukurannya
sepanjang melewati gel. Pita protein yang terbentuk diwarnai dengan Commassie
Brilliant Blue (El Amiri et al. 2004).
Sodium dedocyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE)
berfungsi untuk menghilangkan protein yang mengkontaminasi enzim yang
dipergunakan untuk purifikasi protein. Protein yang akan dipurifikasi ditambah
mercaptoethanol kemudian dipanaskan dengan tujuan untuk memotong ikatan
disulfid dan denaturasi protein. Sedangkan SDS sebagai suatu deterjen untuk
menyamakan muatan listrik (SDS mengikat stoichiometrically, 1 SDS per 1.4
tersambung, protein akan bermigrasi melalui pori-pori di dalam gel poliakrilamid.
Gel akan memisahkan protein berdasarkan kemampuan protein untuk bergerak
yang setara dengan nilai logaritmik berat molekulnya (Stryer 1995;
Champe et al. 2008).
Pewarnaan Commassie Brilliant Blue
Commassie Brilliant Blue (CBB) merupakan pewarnaan anion yang umum
dipergunakan untuk pewarnaan protein. Struktur CBB adalah non-polar sehingga
biasanya digunakan dalam campuran metanol 40 % dan asam asetat 7 %.
Protein dalam gel difiksir oleh asam asetat dan secara simultan diwarnai.
Zat warna yang berlebih dihilangkan dengan larutan yang sama tanpa ditambah
CBB. Protein terdeteksi dengan terbentuknya pita biru, akan tetapi karena SDS
bersifat anion juga maka untuk menghindari intervensinya pada saat pewarnaan
maka volume larutan harus benar-benar merendam gel.
Pita proteinyang terlihat pada monogel diukur jaraknya untuk menentukan
migrasi relatifnya. Selanjutnya berdasarkan berat molekul standar (Broad Range
Standard®) dapat ditentukan persamaan regresinya dan dari migrasi relatif yang
diperoleh dapat ditentukan estimasi berat molekul protein yang diuji.
Pengukuran Konsentrasi Protein
Bicinchoninic Acid (BCA) Protein Assay merupakan metode deteksi
kolorimetri dan penghitungan total protein, yang dimodifikasi dari metode Lowry.
Prinsip utamanya adalah reduksi Cu2+ menjadi Cu1+ olehprotein dalam medium
alkalin oleh asam bichinconinic. Tahap awal, dikenal sebagai reaksi biuret yaitu
peptida yang mengandung beberapa asam amino berikatan dengan ion Cu1+
membentuk warna biru. Tahap kedua adalah reaksi perubahan warna
menggunakan BCA. Warna kuning terbentuk dari pengikatan dua molekul BCA
dengan satu ion Cu1+ (Pierce ®). Warna yang terbentuk diukur absorbansinya
Antibodi Poliklonal
Antigen adalah molekul yang bereaksi dengan antibodi sedangkan
imunogen merupakan molekul yang dapat memberikan respon imum. Keduanya
mempunyai makna yang sama. Substansi yang mempunyai kemampuan untuk
menghasilkan respon imun yang spesifik, seperti protein. Antigen baru akan
dikenali oleh limfosit B maupun T apabila epitopnya dikenali. Epitop merupakan
sisi aktif antigen yang dapat berikatan dengan reseptor sel B maupun T
(Goldsby et al. 2000) .
Respon imun yang dihasilkan bergantung dosis dan rute penyuntikan
antigen atau imunogen. Respon imun merupakan upaya inang untuk
mempertahankan diri yang prosesnya terdiri atas 1) pengenalan, organisme asing
dikenali oleh sel imun spesifik, 2) aktivasi, mengaktivasi sel imun untuk
memproduksi respon spesifik seperti antibodi, 3) respon, yang secara spesifik
merusak organisme (Goldsby et al. 2000; Lordish et al. 2000 ). Respon imun
primer adalah IgM, antigen reseptor pada sel B, sedangkan IgG adalah respon
imun IgG yang melintas plasenta. Respon imun primer berjalan lambat sekitar
7-10 hari tergantung kemunian dan dosis Ag serta rute penyuntikannya. Ig M
levelnya lebih cepat turun dibadingkan dengan IgG.
Apabila hewan diberi booster dengan antigen yang sama setelah respon
primer, respon imun yang terbentuk cepat (3-5 hari) dan mempunyai level respon
imun yang lebih tinggi dari respon primer. Selama respon sekunder, IgM yang
diproduksi sama dengan setelah kontak dengan Ag (Gambar 9). Sementara, IgG
lebih besar diproduksi dan levelnya tertahan jauh lebih lama dari respon primer
(Abbas et al. 2007; Goldsby et al. 2000).
Pada produksi antibodi diperlukan adjuvant untuk meningkatkan respon
imun terhadap aktivitas sel imunogen. Adjuvant merupakan campuran mineral
oil, linoloid dan mikrobakteria yang telah dilemahkan (Freud’s adjuvant) yang
menstimulasi pembentukan granuloma lokal agar pembentukan antibodi berjalan
dengan baik. Apabila hewan disuntik antigen yang telah ditambah adjuvant
maka normalnya limfosit B akan menghasilkan satu tipe antibodi yang mengenali
Akan tetapi karena secara alami antigen mempunyai beberapa epitop sehingga
apabila antigen disuntikkan pada hewan maka akan menstimulasi beberapa klonal
limfosit yang berbeda dan masing-masing akan menghasilkan antibodi yang
berbeda. Campuran antibodi yang dapat mengenali beberapa epitop pada antigen
yang sama disebut antibodi poliklonal (Goldsby et al. 2000; Abbas et al. 2007).
Kekuatan interaksi antigen dan antibodi bergantung dari seberapa dekat
kecocokan antara antigen dan antibodi. Total kekuatan interaksi nonkovalen
antara tempat terikatnya antigen (single antigen-binding site) pada antibodi
dengan suatu epitop tersebut afinitas antibodi. Semakin tinggi afinitas antibodi,
kemampuan antibodi untuk mengikat semakin kuat dan ikatannya bertahan lama,
sebaliknya semakin rendah afinitas ikatan antibodi dan epitop makin lemah dan
ikatannya mudah lepas. Reaksi silang (cross-reactivity ) terjadi apabila antigen
yang sama muncul pada tipe sel atau jaringan yang berbeda, munculnya epitop
yang identik pada permukaan dua antigen yang tidak identik, dua antigen
memiliki dua epitop sama tetapi tidak identik sehingga bisa terjadi salah satu
epitop akan mengikat lebih kuat daripada epitop lainnya, dua bahan yang berbeda
secara kimiawi seperti protein dan karbohidrat tetapi mempunyai epitop yang
sama atau bisa juga terjadi dua antibodi yang satu memiliki epitop A sedangkan
yang satunya memiliki epitop A dan B (Huebner 2004).
Prosedur pembuatan antibodi poliklonal sangat sederhana dibandingkan
dengan antibodi monoklonal meskipun demikian antibodi yang dihasilkan sangat
bermanfaat. Kelebihan antibodi poliklonal selain metode produksi yang sederhana
juga dapat mengikat semua antigen yang menjadi target reaksi. Sedangkan
kelemahan antibodi poliklonal yang utama adalah karena antibodinya dapat
bereaksi dengan semua epitop yang ada pada antigen yang direaksikan maka akan
mendapatkan reaksi silang yang tinggi. Oleh karena itu hal yang harus
diperhatikan saat memproduksi antibodi poliklonal, isolat yang akan
Determinasi Rabbit anti-ovPAG menggunakan Metode Western Blot
Western Blot (WB) merupakan teknik analisis untuk mendeteksi protein
spesifik yang terkandung dalam ekstrak atau jaringan. Dimulai dengan
elektroforesis untuk memisahkan protein yang kemudian ditransfer ke dalam
membran, umumnya digunakan membran nitroselulose (Gambar 10). Prinsipnya
adalah protein dideteksi menggunakan antibodi spesifik (monoklonal maupun
poliklonal) terhadap protein target (Lodish et al. 2000; Majewska et al. 2005;
[image:48.612.132.512.75.348.2]Bella et al. 2009).
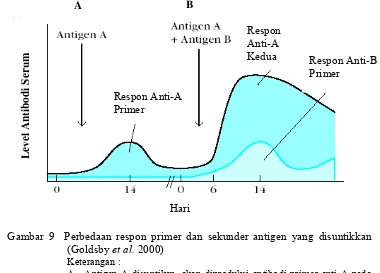
Gambar 9 Perbedaan respon primer dan sekunder antigen yang disuntikkan (humoral response). Hewan disuntik antigen akan memproduksi antibodi primer serum pada konsentrasi rendah dan waktu yang singkat dengan puncak pada hari ke 10-17 . Imunisasi kedua dengan antigen yang sama akan menghasilkan respon imun yang lebih besar dengan puncak yang diperoleh dalam waktu lebih singkat hari ke 2-7 dan lebih lama bertahan (bulanan sampai tahunan daripada antibodi primer (Goldsby et al. 2000)
Hari Lev el A n ti b o di Ser u m Respon Anti-A
Kedua Respon Anti-B
Primer
Respon Anti-A Primer
Gambar 9 Perbedaan respon primer dan sekunder antigen yang disuntikkan (Goldsby et al. 2000)
Keterangan :
A. Antigen A disuntikan, akan diproduksi antibodi primer anti-A pada konsentrasi rendah dan waktu yang singkat dengan puncak pada hari ke 10-17 .
B. Antigen A + Antigen B, akan menghasilkan respon imun yang lebih besar dengan puncak yang diperoleh dalam waktu lebih lama bertahan (bulanan sampai tahunan daripada antibodi primer (anti-A), imun respon antibodi primer anti-B lebih singkat hari ke 2-7
Enzyme Linked Immunosorbent Assay (ELISA)
Enzyme Linked Immunosorbent Assay secara umum dikenal sebagai
ELISA atau EIA. Prinsip dasarnya sama dengan Radio immuno assay (RIA)
tetapi pada ELISA digunakan enzim sedangkan pada RIA menggunakan bahan
radioaktif yang dilabel. Enzim yang dikonjugasikan pada antibodi bereaksi
dengan substrat untuk menghasilkan reaksi warna sehingga disebut sebagai
chromogen substrat. Beberapa enzim yang umum dipakai pada ELISA antara lain
alkalin fosfatase dan horseradish peroxidase (Crowther 2001;
O’Connor et al. 2003; Goldsby et al. 2000).
Keunggulan metode ELISA dibandingkan dengan metode RIA selain
memiliki sensitifitas yang sama juga waktu pengukuran cepat karena diperlukan
kira-kira 15 menit untuk 100 sampel; aman karena tidak memerlukan substansi
[image:49.612.139.509.75.378.2]dipergunakan berbeda (serum, plasma, urine maupun feses), peralatan yang
diperlukan sederhana terutama untuk membaca hasil menggunakan
spektrofotometer (O’Connor et al. 2003; Munro et al. 1991).
Ada bermacam-macam tipe ELISA yang dikembangkan berdasarkan
deteksi kualitatif dan kuantitatif terhadap antigen dan antibodi yang
dikandungnya (Goldsby et al. 2000, Crowther 2001, Pier et al. 2004). Ada tiga
metode yang mendasari semua metode ELISA yaitu Direct ELISA; Indirect
ELISA dan Sandwich ELISA.
Direct ELISA
Teknik Direct ELISA merupakan teknik ELISA yang paling sederhana.
Antigen diencerkan dalam bufer karbonat-bikarbonat atau phosphate buffer saline
(PBS). Bufer yang digunakan tidak mengandung protein lain yang dapat
berkompetisi dengan antigen target yang akan ditempelkan pada fase solid
lempeng ELISA. Setelah diikunbasi, antigen yang tidak terikat pada fase solid
dicuci menggunakan bufer. Antibodi spesifik terhadap antigen (Ab1), dilabel
dengan enzim (konjugasi), ditambahkan dan diinkubasi. Antibodi terkonjugasi
(Ab2) diencerkan dalam bufer yang mengandung substansi yang dapat
menghambat penyerapan protein secara pasif. Substansi yang ditambahkan untuk
berkompetisi dengan pori-pori dalam fase solid yang tidak terisi antigen disebut
dengan bufer penahan atau blocking buffer. Selama inkubasi antibodi akan
berikatan dengan antigen. Antibodi yang tidak berikatan dengan antigen
dihilangkan dengan cara dicuci menggunakan bufer. Kemudin ditambahkan
substrat atau chromogen antispesies. Reaksi ini bertujuan untuk mengembangkan
reaksi warna melalui proses katalisis enzim.
Interaksi antara antigen dan antibodi yang dideteksi dengan menggunakan
konjugat (enzim yang dikonjugasikan ke antibodi), antara lain horseradish
peroxidase dan substrat disebut chromogen karena mempunyai kemampuan untuk
menyerap warna antara lain benzidin akan menimbulkan warna biru. Reaksi
dihentikan apabila sudah terjadi perubahan warna dari biru menjadi kuning
terjadi diukur menggunakan spektrofotometer (ELISA Reader, Biorad®) pada
panjang gelombang 450 nm (O’Connor et al. 2003; Crowther 2001 ).
Indirect ELISA
Tahap awal teknik ini sama dengan Direct ELISA, hanya Ab1 yang
ditambahkan adalah antibodi yang tidak dilabel enzim. Antibodi diencerkan
menggunakan bufer penghambat untuk menjaga adanya penempelan nonspesifik
dari protein antiserum. Diinkubasi dan dicuci untuk menghilangkan kelebihan
antibodi yang tidak terikat agar didapatkan ikatan yang spesifik. Antibodi yang
telah dilabel (Ab2 atau konjugat) berupa antibodi antispesies yang telah
diencerkan dalam bufer, selanjutnya diinkubasi dan dicuci untuk mendapatkan
ikatan yang spesifik. Substrat ditambahkan untuk mengikat konjugat dan setelah
terjadi perubahan warna, reaksi dihentikan. Selanjutnya warna yang terjadi dibaca
pada spektrofometer (O’Connor et al. 2003; Crowther 2001) .
Sandwich ELISA
Teknik ini dibagi menjadi dua yaitu Direct Sandwich dan Indirect
Sandwich ELISA (Crowther 2001, Harlow & Lane 1988).
Direct Sandwich ELISA
Prinsip utamanya adalah memaksimalkan aktivitas antibodi (Ab1) yang
ditempelkan pada fase solid lempeng ELISA untuk menangkap antigen.
Kemudian antigen dideteksi menggunakan serum spesifik yang telah dilabel
enzim (Ab2), diinkubasi dan dicuci. Antibodi yang menangkap antigen (capture
antibody) dan antibodi yang mendeteksi (detecting antibody) bisa sama atau dari
hewan berbeda dari spesies yang sama atau berbeda spesies. Setelah ditambahkan
konjugat (Ab3 ), diinkubasi, konjugat bebas dicuci. Penambahan substrat sampai
warnanya menggunakan spektrofotometer. Antigen yang dipergunakan paling
tidak harus memiliki dua epitop (Crowther 2001; Harlow & Lane 1988).
Indirect Sandwich ELISA
Prinsip utamanya sama hanya antibodi untuk mendeteksi antigen tidak
dilabel enzim. Setelah antigen berikatan dengan antibodi (Ab1) pada fase solid
lempeng ELISA, ditambahkan antibodi (Ab2) yang berasal dari spesies yang
berbeda dengan Ab1. Selama inkubasi terjadi ikatan Ag-Ab, antibodi bebas
dicuci. Konjugat antispesies (Ab3) ditambahkan yang dapat mengikat serum yang
berasal dari spesies yang sama dengan Ab2 tetapi tidak dapat bereaksi dengan
antibodi fase solid ELISA. Penambahan substrat sampai terjadi perubahan warna
kemudian reaksi dihentikan dan diukur kuantitas warnanya menggunakan
spektrofotometer (Crow