ANALISIS KERAGAMAN EKSON 2 DAN EKSON 3 GEN MYOSTATIN
PADA SEMBILAN BANGSA KAMBING LOKAL DI INDONESIA
RISSA HERAWATI BR GINTING
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Analisis Keragaman Ekson 2 dan Ekson 3 Gen Myostatin pada Sembilan Bangsa Kambing Lokal di Indonesia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2016
Rissa Herawati Br Ginting
RINGKASAN
RISSA HERAWATI BR GINTING. Analisis Keragaman Ekson 2 dan Ekson 3 Gen Myostatin pada Sembilan Bangsa Kambing Lokal di Indonesia. Dibimbing oleh ACHMAD FARAJALLAH dan DYAH PERWITASARI.
Kambing lokal Indonesia merupakan ternak ruminansia kecil dengan jumlah bangsa paling tinggi di Asia Tenggara. Kambing merupakan hewan ternak yang paling populer setelah sapi dan ayam di Indonesia. Salah satu yang menjadi masalah dalam upaya produksi ternak kambing lokal Indonesia adalah kualitas bibit unggul yang masih rendah. Identifikasi bangsa kambing lokal Indonesia diperlukan dalam upaya menghasilkan bibit unggul melalui program seleksi.
Salah satu gen yang mengatur pertumbuhan kambing adalah gen myostatin. Gen myostatin menyandikan protein myostatin yang mengontrol pertumbuhan dan diferensiasi otot kerangka. Myostatin yang tidak berfungsi akan mengakibatkan terjadinya hipertropi ataupun hiperplasia. Penelitian ini bertujuan untuk mengidentifikasi keragaman ekson 2 dan ekson 3 gen myostatin serta menentukan hubungan kekerabatan serta hubungan genetik antara sembilan bangsa kambing Indonesia.
Sampel DNA diekstraksi dari darah kambing yang terdiri dari 80 sampel kambing, yaitu kambing Samosir, kambing Muara, kambing Kacang, kambing Kosta, kambing Peranakan Etawah, kambing Burawa, kambing Gembrong, kambing Boer dan kambing Boerka. Metode Polymerase Chain Reaction-Single Strand Conformation Polymorphism (PCR-SSCP) dan sekuensing DNA digunakan untuk mengidentifikasi keragaman daerah ekson 2 dan ekson 3 gen myostatin pada kambing lokal Indonesia.
Hasil amplifikasi dengan PCR daerah ekson 2 dan ekson 3 gen myostatin pada kambing adalah 650 pb. Pensejajaran nukleotida gen myostatin ekson 2 pada sembilan bangsa kambing lokal Indonesia ditemukan mutasi tertentu. Terdapat 12 tipe gen berdasarkan pola migrasi untai tunggal. Berdasarkan hasil sekuensing ditemukan 12 haplotipe pada kambing. Dari hasil pensejajaran nukleotida gen myostatin ekson 3 pada sembilan bangsa kambing lokal Indonesia ditemukan 10 variasi gen myostatin. Variasi yang ditemukan pada ekson 3 mempengaruhi asam amino. Variasi yang ditemukan pada sembilan bangsa kambing menunjukkan bahwa keragaman genetik kambing beragam.
Variasi dan tipe gen myostatin yang ditemukan dalam penelitian ini belum dapat dijadikan penanda bagi kambing lokal yang memiliki parameter pertumbuhan yang tinggi. Hasil penelitian ini diharapkan dapat menjadi dasar dalam melakukan seleksi berdasarkan sifat pertumbuhan kambing dalam populasi yang lebih besar dan beragam.
SUMMARY
RISSA HERAWATI BR GINTING. Variation Analysis of Exon 2 and Exon 3 Myostatin Gene in Nine Local Goat Breeds in Indonesia. Supervised by ACHMAD FARAJALLAH and DYAH PERWITASARI.
Indonesia local goat is small ruminants with the highest number of breeds in Southeast Asia. Goats have become the most popular livestock in Indonesia besides the cattle and the chicken. One of the problems in the production efforts of Indonesia local goat is the low quality of breeds. Identification of Indonesia local goat breed is required in order to produce superior breed through the selection program.
One of the genes that regulate the growth of goat is myostatin gene. Myostatin gene encoding myostatin protein that controls the growth and differentiation of skeletal muscle. The myostatin that does not function well will be resulted the hypertrophy or hyperplasia. This study aimed to identify diversity of exon 2 and exon 3 in myostatin gene and determine genetic relationships among the nine goat breeds in Indonesia.
DNA samples were extracted from the blood of goats consist of 80 samples from Samosir, Muara, Kacang, Costa, Peranakan Etawah, Burawa, Gembrong, Boer and Boerka goats. Polymerase Chain Reaction Single Strand Conformation Polymorphism (PCR-SSCP) and DNA sequencing were used to identify the diversity of exon 2 and exon 3 region myostatin gene in Indonesia local goat.
The results of the PCR amplification of exon 2 and exon 3 region of myostatin genes in goats were 650 bp. A particular mutation in exon 2 was found in nine Indonesia local goat breeds. There were 12 types of genes determined by PCR-SSCP patterns. Sequencing analysis showed 12 haplotypes. Exon 3 of myostatin gene in nine Indonesia local goat breed indicated 10 variation. Futhermore it change the amino acids. Nine goat breed showed variation on their genetic diversity.
Variation and type of the myostatin gene in this study has not applicable yet as marker for the local goats which have high growth parameters. The result of this study is expected to be a basic information in goats selection based on growth character in diverse and large population.
iv
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biosains Hewan
KERAGAMAN EKSON 2 DAN EKSON 3 GEN MYOSTATIN PADA
SEMBILAN BANGSA KAMBING DI INDONESIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
vi
viii
PRAKATA
Puji dan Syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala berkat dan karuniaNya sehingga penulisan tesis ini dapat diselesaikan. Tesis ini disusun dalam rangka memenuhi persyaratan memperoleh gelar Magister Sains pada Program Studi Biosains Hewan (BSH) Sekolah Pascasarjana Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr. Achmad Farajallah dan Ibu Dr. Rd. Rr. Dyah Perwitasari selaku pembimbing yang telah memberikan arahan dan masukan dalam penyusunan karya ini, serta Bapak Dr. Ir. Aron Batubara yang telah membantu dalam memberikan sampel. Ucapan terima kasih juga penulis sampaikan kepada Bapak dan Ibu pengajar Biosains Hewan (BSH) atas semua ilmu, bimbingan, pengalaman, dan nasihat selama ini.
Penulis juga mengucapkan terima kasih kepada Dirjen Pendidikan Tinggi (DIKTI) Indonesia yang telah memberikan dana melalui beasiswa Pendidikan Pasca Sarjana Dalam Negeri (BPPDN) 2014. Ucapan terima kasih untuk rekan-rekan BSH 2014 dan Zoocorner atas kebersamaan, bantuan, dukungan dan motivasi selama perkuliahan dan penelitian berlangsung. Ungkapan terima kasih yang luar biasa, penulis sampaikan kepada ayah, ibu, seluruh keluarga, serta teman-teman atas segala doa, semangat, dukungan dan kasih sayang kepada penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2016
DAFTAR ISI
Metode PCR-SSCP (Polymerase Chain Reaction Single Strand Conformation Polymorphism)
5
ANALISIS KERAGAMAN EKSON 2 GEN MYOSTATIN PADA SEMBILAN BANGSA KAMBING LOKAL DI INDONESIA INDONESIA BERDASARKAN EKSON 3 GEN MYOSTATIN
14
Pendahuluan 14
Bahan dan Metode 15
Hasil dan Pembahasan 16
Amplifikasi PCR pada Ekson 3 Gen Myostatin 16
Identifikasi Variasi Nukleotida Gen Myostatin pada Hasil Sekuensing 16 Hubungan Keragaman Genetik dengan Pertumbuhan Antar Populasi
x
DAFTAR TABEL
1 Frekuensi genotipe dan alel dari gen myostatin pada kambing 11 2 Variasi ekson 2 gen myostatin pada bangsa kambing berdasarkan
nukleotida gen myostatin Capra hircus (ABO77206)
12 3 Variasi nukleotida ekson 3 gen myostatin pada kambing terhadap
nukleotida gen myostatin Capra hircus (EF591039)
17 kambing Samosir, (c) kambing Boerka, (d) kambing Boer (Ginting dan Mahmilia 2008), (e) kambing Muara, (f) kambing Kosta, (g) kambing Gembrong, (h) kambing Peranakan Etawah, (i) kambing Burawa (PKPKP 2011)
2
2 Mekanisme kerja myostatin dalam diferensiasi dan pertumbuhan otot (Langley et al. 2002)
3 3 Fragmen DNA untai tunggal memiliki bentuk yang berbeda dengan yang
normal karena mengalami mutasi (Nataraj et al. 1991)
6 4 Daerah yang mengamplifikasi termasuk bagian dari intron 1, ekson 2,
dan intron 2
8 5 Hasil amplifikasi gen myostatin menggunakan metode PCR pada
kambing Boer (a3, a10), Boerka (b6), Kacang (c5, c6), Gembrong (d2), Burawa (e1); Marker (M)
8 Hasil amplifikasi dari ekson 3 gen myostatin dengan menggunakan PCR pada kambing Kacang (3g); Muara (8a); Gembrong (4a); Peranakan Etawa (6b); Kosta (9g); Samosir (7a, 7b); Burawa (5b); Boer (1l); Boerka (2a); dan M (Marker 100 pb)
16
9 Urutan nukleotida intron 2, ekson 3, dan intron 3 gen myostatin beserta urutan asam aminonya berdasarkan urutan nukleotida Capra hircus (EF432557). Keterangan: Posisi nukleotida dihitung dari basa pertama urutan Luci 5. Simbol panah (↓) menunjukkan batas posisi ekson 3. Kodon penyandi asam amino ditulis dengan tiga huruf
18
10 Pohon filogeni Neighbour-joining gen myostatin ekson 3 pada sembilan bangsa kambing
PENDAHULUAN UMUM
Latar Belakang
Kambing lokal Indonesia merupakan ternak yang populer setelah sapi dan ayam sebagai penghasil susu dan daging. Kambing lokal indonesia terbukti mampu beradaptasi terhadap iklim tropis. Pemeliharaan yang dilakukan oleh para petani masih tradisional, yang mengakibatkan ragamnya tinggi. Oleh karena itu, langkah-langkah strategis perlu dilakukan untuk menyediakan bibit unggul ternak dengan melakukan identifikasi bangsa-bangsa kambing lokal Indonesia.
Myostatin adalah salah satu faktor pertumbuhan yang mengatur pertumbuhan kerangka otot pada hewan dewasa. Myostatin menyandikan gen myostatin yang terdiri atas satu promotor, tiga ekson dan dua intron. Pada kambing gen myostatin terletak pada kromosom ke 2 (EF591039 NC_022294.1). Dari segi efek fisiologis, mutasi myostatin dapat menyebabkan peningkatan jumlah serat otot (hiperplasia) dan peningkatan volume serat otot (hipertropi), atau sebaliknya. Kejadian double musling pada sapi Belgian Blue dan Piedmontese
diketahui akibat mutasi pada daerah penyandi gen myostatin (Alexandra et al.
1997). Beberapa laporan menunjukkan bahwa mutasi pada daerah promotor dan intron gen myostatin tidak memberikan efek yang signifikan pada berat dan bentuk tubuh (Ibeagha-Awemu et al. 2008). Mutasi gen myostatin pada daerah penyandi dilaporkan dapat meningkatkan pertumbuhan massa otot yang melebihi normal (Tay et al. 2004).
Untuk mendapatkan data keragaman genetik sembilan bangsa kambing lokal Indonesia perlu dilakukan identifikasi keragaman ekson 2 dan ekson 3 gen myostatin serta mengetahui hubungan antara sembilan bangsa kambing di Indonesia. Variasi yang ditemukan diharapkan dapat dijadikan sebagai informasi potensi sumberdaya genetik kambing lokal yang ada di Indonesia.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi keragaman ekson 2 dan ekson 3 gen myostatin dengan metode Polymerase Chain Reaction-Single Strand Conformation Polymorphism (PCR-SSCP) dan hubungan genetik antara sembilan bangsa kambing lokal Indonesia.
Manfaat Penelitian
2
TINJAUAN PUSTAKA
Kambing Lokal di Indonesia
Kambing lokal merupakan salah satu ternak ruminansia kecil yang sudah lama dibudidayakan di sektor peternakan. Kambing lokal berkembang dan dikelompokkan berdasarkan daerah tertentu, diantaranya kambing Kosta (Banten), kambing Gembrong (Bali), kambing Jawarandu (Jawa Tengah), kambing Samosir (Samosir), kambing Benggala (Nusa Tenggara Barat), Muara (Sumatera Utara) dan beberapa rumpun kambing lokal lainnya. Kambing Gembrong dan Kosta termasuk ke dalam kelompok jenis kambing dalam status endangered (terancam) (Mahmilia et al. 2004).
Kambing asli (native breed) merupakan ternak yang dikelompokkan berdasarkan sejarah dan terbukti berasal dari negara yang secara kontinu diternakkan di negara tersebut. Kambing Kacang merupakan rumpun kambing asli yang ditemukan di Indonesia (Mahmilia dan Tarigan 2006).
Penyebaran beberapa jenis kambing terdapat di daerah perbukitan atau daerah pegunungan Eropa, Asia, dan Etiopia. Kambing terbagi dalam lima kelompok berdasarkan bentuk dan kelengkungan tanduknya yakni Capra hircus, C. aegagrus, C. falconeri, C. ibex, dan C. cylindricornis. Capra hircus adalah salah satu kambing jinak yang dimanfaatkan oleh para petani (Clutton-Brock 1981). Kambing gunung (Oreamnos americanus) adalah pengelompokkan ternak kambing yang unik berasal dari Amerika utara dan merupakan kelompok kambing dari gunung Ungulata. Kambing gunung adalah salah satu kambing yang hampir semua spesiesnya berwarna putih yang ditemukan di Alaska (Johnson 2008). Kambing liar merupakan rumpun kambing yang sudah dijinakkan, diantaranya adalah kambing Bezoar, kambing Markhol dan kambing Ibex (Shrestha dan Fahmy 2005).
(a) (b) (c)
(d) (e) (f)
(g) (h) (i) Gambar 1 Sembilan bangsa kambing lokal Indonesia (a) kambing Kacang, (b)
kambing Samosir, (c) kambing Boerka, (d) kambing Boer (Ginting dan Mahmilia 2008), (e) kambing Muara, (f) kambing Kosta, (g) kambing Gembrong (h) kambing Peranakan Etawah, (i) kambing Burawa (PKPKP 2011).
Gen Myostatin
4
penting dalam memodifikasi pola ekspresi gen. Perubahan basa Guanin menjadi Adenin pada daerah 3’UTR dari gen myostatin dapat menyebabkan hipertropi otot dan perubahan fenotip pada domba texel (Ibeagha-Awemu et al. 2008). Mutasi gen myostatin di daerah ekson 2 pada sapi Belgian blue dan Piedmontese menyebabkan pertambahan massa otot yang sangat mencolok yang dikenal dengan double muscle. Mutasi delesi 11 nukleotida ekson 3 gen myostatin pada Belgian blue yang menyebabkan frameshift yang menghilangkan daerah aktif pada molekul. Piedmontese mengalami mutasi missense pada ekson 3 gen myostatin yang mengakibatkan substitusi tirosin menjadi sistein. Mutasi pada daerah coding region dari gen myostatin pada domba (Boman et al. 2006), kambing (Zhang et al. 2012), anjing (Mosher et al. 2007), burung merpati (Dybus
et al. 2013), Kelinci (Amalianingsih et al. 2015) diketahui menyebabkan peningkatan massa otot. Mutasi pada daerah intron 2 bersifat polimorfik, dimana mutasi lebih besar ditemukan diantara spesies kambing dan domba (Li et al.
2006).
Mutasi pada promotor, intron, ekson, dan 5’UTR dan 3’UTR pada gen myostatin terjadi apabila myostatin tidak berfungsi di dalam sel yang disebut dengan hipertrofi maupun hiperplasia. Fenomena ini ditemukan pada kasus double muscling pada hewan ternak (Tay et al. 2004). Hipertrofi adalah perbedaan pada ukuran dan bentuk otot, yang dikenal sebagai double muscling. Mutasi ini terjadi pada keturunan Belgian blue dan Piedmontese. Mutasi yang terdapat pada gen myostatin adalah regulator negatif pertumbuhan otot pada sapi (Kambadur et al.
1997). Terlihat pada perbedaan haplotipe gen myostatin pada daerah otot sapi yang mengalami hipertropi di Eropa. Mutasi hipertropi pada otot jarang ditemukan pada populasi (Dunner et al. 2003). Peningkatan massa jaringan disebut hiperplasia. Kurva pertumbuhan menjadi massa atau berat kumulatif diplot terhadap usia adalah sigmoid, yang terdiri dari fase percepatan prapubertas ditambah fase percepatan prapubertas ditambah fase perlambatan pascapubertas (Owens et al. 1993).
Pada pertumbuhan massa otot, dimana myostatin menghambat myogenin sehingga myoblast berdiferensiasi menjadi myotubes. Hal ini menyebabkan myotubes tidak dapat berkembang menjadi serat otot (Kocamis & Killefer 2002). Prekursor Myoblasis Myogenin Myotubes
Keragaman Genetik Kambing
Sumber genetik hewan sangat sedikit diperhatikan terhadap potensi genetiknya. Para petani melakukan mutasi keragaman genetik hewan untuk memilih bibit unggul atau mengembangkan bangsa baru dalam merespon perubahan terhadap lingkungan, mengubah penjualan pasar dan kebutuhan masyarakat (Karugia et al. 2001).
Keragaman genetik disebabkan salah satunya karena adanya mutasi. Mutasi mengacu pada perbedaan dalam urutan DNA antara individu, kelompok, atau populasi. Terdapat dua jenis keragaman genetik yang disebabkan penggantian basa DNA dan penyisipan atau penghapusan pasangan basa. Jenis yang paling sederhana dari polimorfisme genetik adalah Single Nucleotide Polymorphism (SNP) (Yahyaoui 2003). Keragaman genetik antara populasi bangsa kambing lokal tidak menunjukkan hubungan korelasi antara perbedaan genetik dengan jarak geografisnya (Salles et al. 2011). Keragaman genetik tidak hanya terjadi pada antar keturunan tetapi juga di dalam satu keturunan antar populasi maupun di dalam populasi (Handiwirawan dan Subandriyo 2004).
Identifikasi keragaman gen berperan penting dalam mempengaruhi karakter pertumbuhan pada kambing. Salah satu gen yang berperan dalam membantu mengendalikan pertumbuhan dan perkembangan jaringan otot adalah gen myostatin. Varian gen myostatin merupakan hasil dari efisiensi transkripsi yang mempengaruhi konsentrasi dari gen myostatin. Mutasi pada daerah exon 1 gen myostatin pada kambing diketahui dapat menyebabkan peningkatan massa otot sehingga membentuk fenotipe yang berbeda. Mutasi pada gen myostatin dapat menghasilkan protein non fungsional yang menyebabkan kasus double muscling (Zhang et al. 2013). Perbedaan pola dari haplotipe gen myostatin adalah indikator dari sejarah yang memperlihatkan bahwa adanya perbedaan antara populasi keturunan kambing (Li et al. 2005). Delesi pada promotor gen myostatin memberikan efek yang signifikan pada berat dan bentuk tubuh pada kambing (Li et al. 2008). Mutasi daerah 3’-UTR pada domba juga dapat menyebabkan fenotipe IMM (Increased Muscle Mass) (Boman et al. 2006).
Metode PCR-SSCP (Polymerase Chain Reaction-Single Strand Conformational Polymorphism)
Polymerase Chain Reaction (PCR) adalah salah satu teknik ilmiah dalam biologi molekuler untuk memperkuat satu atau beberapa salinan dari urutan DNA sehingga menghasilkan ribuan sampai jutaan salinan dari urutan DNA. Terdapat tiga langkah utama dalam teknik PCR yakni denaturasi, annealing, dan ekstensi. PCR berguna dalam proses penyelidikan dan diagnosis dari suatu penyakit. Kualitatif PCR dapat digunakan untuk mendeteksi tidak hanya gen manusia tetapi juga gen dari bakteri dan virus. PCR dapat mengidentifikasi gen yang telah terlibat dalam perkembangan kanker (Joshi dan Deshpande 2011).
6
proses PCR amplifikasi DNA. Semua rincian untuk penggunaan PCR-SSCP disajikan dalam arah penyakit genetik (Kakavas et al. 2008).
Menurut Nataraj el al. (1991) metode analisis SSCP memiliki beberapa tahap yaitu tahap amplifikasi, tahap denaturasi DNA produk PCR pada suhu 94oC, penambahan formamida dye dan tahap elektroforesis dalam gel poliakrilamida nondenaturasi. Gambar 1 menunjukkan bagaimana perubahan pada fragmen DNA tunggal yang mempengaruhi bentul molekul DNA untai tunggal dan menyebabkan perbedaan laju migrasi saat elektoforesis.
ANALISIS KERAGAMAN EKSON 2 GEN MYOSTATIN PADA 9 BANGSA KAMBING LOKAL DI INDONESIA
PENDAHULUAN
Salah satu mata pencarian petani di Indonesia adalah di sub sektor peternakan diantaranya adalah ternak kambing. Kambing adalah salah satu ternak ruminansia kecil yang telah beradaptasi dan berkembang dengan kondisi geografis setempat. Kambing yang ditemukan di Asia telah menyebar ke seluruh benua dan mendiami hampir semua daerah dingin sampai daerah tropis (Gall 1981). Salah satunya adalah negara Indonesia yang memiliki potensi keanekaragaman hayati tinggi dengan keragaman genetik yang melimpah. Kambing memiliki potensi produktivitas yang tinggi yaitu dimanfaatkan sebagai ternak penghasil daging (Casey dan Webb 2010), susu (Haenlein 2004), atau keduanya (Vasta et al. 2008). Beberapa persilangan dan proses adaptasi membentuk beberapa bangsa kambing lokal yaitu, bangsa kambing Boer, Boerka, Kacang, Gembrong, Burawa, Peranakan Etawa, Samosir, Muara, dan Kosta adalah kambing lokal Indonesia. Setiap kambing akan menghasilkan daging dengan memiliki kualitas karakter yang berbeda. Kualitas daging adalah salah satu karakter ekonomi yang penting pada hewan ternak (Dehnavi et al. 2012).
Salah satu faktor yang mengontrol pertumbuhan adalah myostatin atau
Growth Diffrentiations Factor 8 (GDF8) yang merupakan anggota dari superfamili dari Transforming Growth Factor ᵦ (TGF- ᵦ) yang mengontrol pertumbuhan dan diferensiasi jaringan otot (pertumbuhan otot dan kualitas daging). Myostatin terdiri atas tiga ekson dan dua intron yang disandikan oleh gen myostatin (Weiner 2009). Ekspresi mutasi pada gen myostatin dapat menonaktifkan dan menyebabkan protein non-fungsional yang menyebabkan pembesaran jaringan otot yang melebihi normal baik hipertrofi maupun hiperplasia, kondisi ini ditemukan pada kasus double muscling. Polimorfisme gen myostatin yang ditemukan pada sapi terdapat 14 polimorfisme pada tiga ekson dan empat pada dua intron. Hasil polimorfisme ini diidentifikasi berguna untuk program pemuliaan (Grisolia et al. 2009). Pencarian tipe gen pada kambing lokal di Indonesia adalah cara yang baik untuk meningkatkan kualitas dan mendapatkan bibit unggul (Zhang et al. 2013).
8
BAHAN DAN METODE
Koleksi Sampel
Sampel yang digunakan dalam penelitian ini adalah sampel darah 9 bangsa kambing di Indonesia yang terdiri dari kambing Samosir (2), kambing Muara (4), kambing Kacang (10), kambing Kosta (8), kambing Peranakan Etawah (15), kambing Burawa (13), kambing Gembrong (4), kambing Boer (14) dan kambing Boerka (10). Sampel dikoleksi di Laboratorium Molekuler Bagian Fungsi Hayati dan Perilaku Hewan.
Ekstraksi DNA
Ekstraksi DNA dilakukan dengan menggunakan metode fenol kloroform diikuti oleh presipitasi etanol dengan sedikit modifikasi berdasarkan Sambrook et al. (1989). Sampel darah diawetkan dengan etanol, etanol dihilangkan dengan melakukan pencucian dengan buffer TE 2-3 kali.
Amplifikasi DNA
Amplifikasi ekson 2 gen myostatin dilakukan dengan menggunakan sepasang primer AF80 (forward) 5'-GCTGTTATGAATGAAATGCTAC-3' dan AF81 (reverse) 5'-TTTTATTGGGTACAGGGCTAC-3' berdasarkan nomor urut aksesi AB077206, ukuran amplikon sebesar adalah 650 bp (Gambar 4). Reaksi PCR dalam volume 25 µl, menggunakan PCR kit, Gotaq green master mix. Kondisi PCR yang digunakan pada tahap predenaturasi pada 95°C selama 2 menit, denaturasi pada 95°C selama 45 detik, annealing 57°C selama 1 menit, dan ekstensi pada 72°C selama 1 menit diulang untuk 30 siklus. Kualitas amplikon diperiksa menggunakan PAGE (acrilamide: bisacrylamide ratio 29:1) dan pewarnaan perak (Byun et al. 2009). Jika amplikon menunjukkan sebuah pita tunggal yang jelas maka amplikon akan dianalisis dengan menggunakan metode SSCP.
Intron 1 (133 pb) Intron 2 (143 pb)
AF80 AF81
Gambar 4 Daerah yang diamplifikasi termasuk bagian dari intron 1, ekson 2, dan intron 2.
Analisis Single Strand Conformation Polymorphism (SSCP)
Amplikon yang dimurnikan dengan teknik presipitasi etanol berdasarkan metode Sambrook et al. (1989), kemudian disuspensi pada pewarna formamida (formamida 95%, 10% gliserol, 10% APS, dH2O, dan NaOH 0,2N). Untai ganda
dari molekul amplikon didenaturasi pada suhu 94°C selama 10 menit kemudian didinginkan di icebath. Bentuk dari untai tunggal diperiksa menggunakan
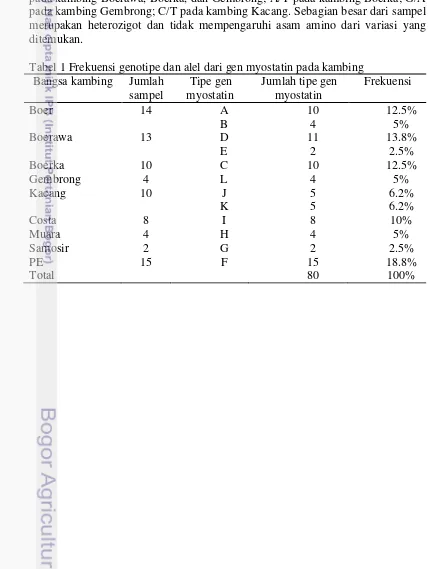
poliakrilamida SSCP PAGE (acrilamide: bisacrylamide ratio 59:1) pada kondisi 100 mV selama 16 jam pada suhu 4°C, kemudian staining dengan menggunakan pewarnaan perak. Tipe gen myostatin ditentukan berdasarkan pola migrasi untai tunggal dan pengukuran jarak pita DNA menggunakan analisis ImageJ (Abramoff et al. 2004).
Sekuensing dan Alignment DNA
Setiap tipe pola gen yang berbeda akan disekuensing. Reaksi sekuensing DNA menggunakan primer yang sama. Proses sequencing dilakukan oleh Perusahaan komersial. Bentuk kromatogram kemudian diedit secara manual dengan menggunakan Bioedit (Hall 2004) dan statistik MEGA 6 (Moleculer Evolutionary Genetic Analysis) (Tamura et al. 2013).
HASIL
Panjang produk yang telah diamplifikasi dari gen myostatin adalah sepanjang 650 pb pada sembilan populasi kambing (Gambar 5). Amplifikasi fragmen dari 650 pb terdiri dari bagian intron 1 (133 pb), ekson 2 (374 pb), dan bagian dari intron 2 (143 pb). Daerah ekson dan intron ditetapkan atas dasar laporan yang diterbitkan dari gen myostatin pada Capra hircus (AB077206).
Gambar 5 Hasil amplifikasi gen myostatin menggunakan metode PCR pada kambing Boer (a3, a10), Boerka (b6), Kacang (c5, c6), Gembrong (d2), Burawa (e1); Marker (M).
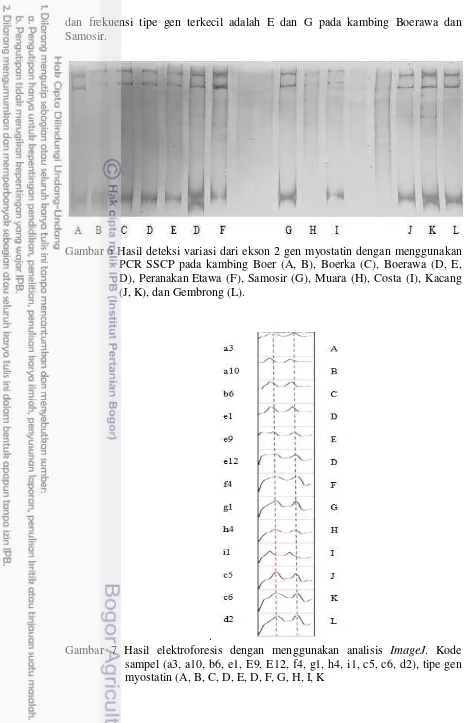
Perbedaan pola migrasi dari untai tunggal DNA pada poliakrilamid 9% dapat dilihat secara spesifik pada hasil elektroforesis dengan menggunakan program ImageJ (Gambar 6). Penyebaran tipe gen myostatin ekson 2 pada kambing Boer, Boerka, Gembrong, Boerawa, Peranakan Etawa, Samosir, Muara, dan Costa berasal dari lokasi Sei Putih (Tabel 1). Pada sembilan bangsa kambing
ditemukan 12 tipe gen yaitu, A, B, C, D, E, F, G, H, I, J, K, dan L (Gambar 7). Frekuensi tipe gen terbesar adalah F pada kambing Peranakan Etawa
650 bp
M a3 a10 b6 c5 c6 d2 e1 1000 bp
10
dan frekuensi tipe gen terkecil adalah E dan G pada kambing Boerawa dan Samosir.
Gambar 6 Hasil deteksi variasi dari ekson 2 gen myostatin dengan menggunakan PCR SSCP pada kambing Boer (A, B), Boerka (C), Boerawa (D, E,
D), Peranakan Etawa (F), Samosir (G), Muara (H), Costa (I), Kacang (J, K), dan Gembrong (L).
.
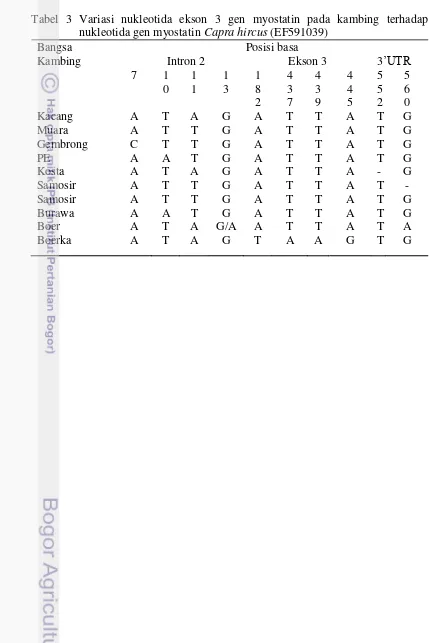
Berdasarkan hasil pensejajaran daerah ekson 2 gen myostatin ditemukan 12 variasi nukleotida (Tabel 2). Variasi ditemukan pada daerah intron 1, ekson 2, dan intron 2 dari gen myostatin. Bentuk variasi yang ditemukan pada gen myostatin adalah substitusi dan indel nukleotida. Variasi delesi intron 1 ditemukan pada kambing Boerawa, Boerka, Kacang, dan Peranakan Etawa pada posisi basa A24-, A25-, A44-, A45-, A50-, dan intron 2 pada posisi basa T601-, T603-, T611-, T612- , A616- dan C618- pada kambing Boerawa, Muara, Boer, Kosta, Samosir, Boerka, dan Peranakan Etawa. Variasi insersi ditemukan pada kambing Boerawa di basa -48A (Tabel 2). Variasi pada puncak kromatogram yang tumpang tindih terdapat pada kambing Boerka, Gembrong dan Kacang, ditemukan pada basa 37 (T/G), 595 (C/T). Ditemukan perubahan basa dari T/G pada kambing Boerawa, Boerka, dan Gembrong; A/T pada kambing Boerka; G/A pada kambing Gembrong; C/T pada kambing Kacang. Sebagian besar dari sampel merupakan heterozigot dan tidak mempengaruhi asam amino dari variasi yang ditemukan.
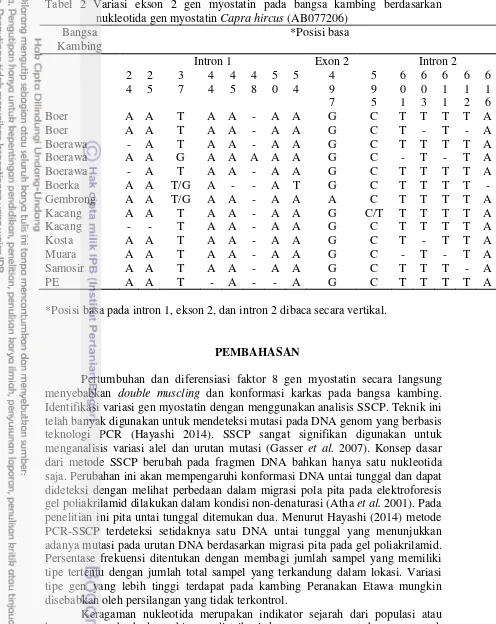
Tabel 1 Frekuensi genotipe dan alel dari gen myostatin pada kambing Bangsa kambing Jumlah
sampel
Tipe gen myostatin
Jumlah tipe gen myostatin
Frekuensi
Boer 14 A 10 12.5%
B 4 5%
Boerawa 13 D 11 13.8%
E 2 2.5%
Boerka 10 C 10 12.5%
Gembrong 4 L 4 5%
Kacang 10 J 5 6.2%
K 5 6.2%
Costa 8 I 8 10%
Muara 4 H 4 5%
Samosir 2 G 2 2.5%
PE 15 F 15 18.8%
12
*Posisi basa pada intron 1, ekson 2, dan intron 2 dibaca secara vertikal.
PEMBAHASAN
Pertumbuhan dan diferensiasi faktor 8 gen myostatin secara langsung menyebabkan double muscling dan konformasi karkas pada bangsa kambing. Identifikasi variasi gen myostatin dengan menggunakan analisis SSCP. Teknik ini telah banyak digunakan untuk mendeteksi mutasi pada DNA genom yang berbasis teknologi PCR (Hayashi 2014). SSCP sangat signifikan digunakan untuk menganalisis variasi alel dan urutan mutasi (Gasser et al. 2007). Konsep dasar dari metode SSCP berubah pada fragmen DNA bahkan hanya satu nukleotida saja. Perubahan ini akan mempengaruhi konformasi DNA untai tunggal dan dapat dideteksi dengan melihat perbedaan dalam migrasi pola pita pada elektroforesis gel poliakrilamid dilakukan dalam kondisi non-denaturasi (Atha et al. 2001). Pada penelitian ini pita untai tunggal ditemukan dua. Menurut Hayashi (2014) metode PCR-SSCP terdeteksi setidaknya satu DNA untai tunggal yang menunjukkan adanya mutasi pada urutan DNA berdasarkan migrasi pita pada gel poliakrilamid. Persentase frekuensi ditentukan dengan membagi jumlah sampel yang memiliki tipe tertentu dengan jumlah total sampel yang terkandung dalam lokasi. Variasi tipe gen yang lebih tinggi terdapat pada kambing Peranakan Etawa mungkin disebabkan oleh persilangan yang tidak terkontrol.
myostatin menunjukkan perbedaan yang signifikan antara bangsa kambing yang berbeda. Terdapat 12 pb indel yang terdeteksi pada sembilan bangsa kambing dan menunjukkan bahwa adanya keragaman. Mutasi substitusi ekson 2 terdapat pada kambing Boerawa, Boerka, Gembrong, dan Kacang. Keragaman mungkin disebabkan karena perbedaan dalam produktivitas keturunan dan tujuan pemuliaan pada kambing. Kambing Boerawa, Boerka, Gembrong, dan Kacang menghasilkan daging yang ditandai dengan pertumbuhan dan sifat unggul dari daging. Peranakan Etawa memiliki frekuensi heterozigot yang tertinggi.
Variasi Indel menunjukkan bahwa keturunan kambing adalah heterozigot. Heterosigositas terdapat pada kambing Burawa menunjukkan bahwa kambing Burawa adalah hasil persilangan. Heterosigositas menggambarkan variasi genetik dalam suatu populasi. Semakin tinggi nilai heterosigositas dalam suatu populasi, semakin tinggi variasi genetik dalam populasi (Ferguson 1980). Distribusi haplotipe sangat berguna untuk menyelidiki hubungan antara populasi. Dalam beberapa haplotipe gen myostatin sapi (MSTN) terlihat lebih spesifik pada jenis tertentu dan hubungan antara haplotipe yang berbeda digunakan untuk menguji hipotesis sebelumnya tentang asal-usul hipertrofi di Eropa (Dunner et al. 2003). Evolusi gen myostatin dan efek mutan masih belum jelas. Sistematis sebagian besar individu dari keturunan yang berbeda untuk mengevaluasi asal dan evolusi, struktur genetik, keragaman populasi dan hubungan keragaman dengan karakter pertumbuhan (Li et al. 2005).
SIMPULAN
14
SEGREGASI SEMBILAN BANGSA KAMBING LOKAL DI INDONESIA BERDASARKAN EKSON 3 GEN MYOSTATIN
PENDAHULUAN
Ternak kambing merupakan salah satu ternak yang memiliki potensi pengembangan yang baik dalam menyuplai kebutuhan. Pengembangan usaha ternak kambing didukung dengan sumber daya ternak kambing lokal yang berkualitas dan adaptif terhadap kondisi lingkungan (Rusdiana et al. 2014). Faktor lingkungan adalah salah satu penyebab perbedaan kambing di Indonesia, sehingga ada fenotipe antara keturunan asli yang berbeda (Sulabda 2012).
Pelestarian dan pengelompokan ternak menurut bangsa kambing dapat dimulai dengan sebutan khusus menurut wilayah, misalnya kambing Samosir di Sumatera Utara, kambing Marica yang ada di Sulawesi Selatan, kambing Benggala di Nusa Tenggara Barat, kambing Muara di Sumatera Utara, kambing Jawarandu di Jawa Tengah, kambing Gembrong di Bali dan jenis kambing lainnya di daerah Indonesia. Pemanfaatan dan tujuan peruntukan kambing mengakibatkan performans pada kambing berbeda. Hal ini mempengaruhi variasi mutasi gen yang terlibat pada pertumbuhan otot.
Salah satu gen yang penting untuk mengatur pertumbuhan massa otot adalah gen myostatin (Gan et al. 2008). Myostatin disandikan oleh gen myostatin yang tersusun atas satu promotor, tiga ekson dan dua intron. Gen myostatin telah digunakan secara luas sebagai penanda fenomena double muscling pada ternak. Mutasi pada gen myostatin dapat menginaktivasi ekspresi dan menghasilkan protein non-fungsional yang mempengaruhi pertumbuhan otot (Zhang et al. 2013). Identifikasi keragaman gen myostatin berperan penting dalam mempengaruhi karakter pertumbuhan pada kambing. Delesi pada promotor gen myostatin memberikan efek yang signifikan pada berat dan bentuk tubuh pada kambing (Li et al. 2008). Mutasi pada daerah intron 2 bersifat polimorfik, dimana mutasi lebih besar ditemukan diantara spesies kambing dan domba daripada sesama spesies (Li et al. 2006). Mutasi pada daerah coding gen myostatin pada domba diketahui menyebabkan peningkatan massa otot sehingga membentuk fenotipe yang berbeda (Boman et al. 2006).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan pada bulan Agustus 2015 sampai dengan Januari 2016 di Laboratorium Molekuler Bagian Fungsi Hayati dan Perilaku Hewan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Koleksi Sampel DNA Kambing
Sampel DNA yang digunakan dalam penelitian ini adalah sampel darah sembilan bangsa kambing yang terdiri dari 80 sampel kambing, yaitu kambing Samosir (2), kambing Muara (4), kambing Kacang (10), kambing Kosta (8), kambing Peranakan Etawah (15), kambing Burawa (13), kambing Gembrong (4), kambing Boer (14) dan kambing Boerka (10). Sampel dikoleksi di Laboratorium Molekuler Bagian Fungsi Hayati dan Perilaku Hewan, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Ekstraksi DNA
Ekstraksi DNA dilakukan dengan menggunakan metode fenol kloroform diikuti oleh presipitasi etanol dengan sedikit modifikasi berdasarkan Sambrook
et al. (1989). Sampel darah diawetkan dengan etanol, etanol dihilangkan dengan melakukan pencucian dengan buffer TE 2-3 kali.
Amplifikasi DNA
Amplifikasi ekson 3 gen myostatin dilakukan dengan menggunakan sepasang primer Luci 5 (forward) 5’ATGTGACATAAGCAAAATGATTAG-3’ dan Luci 6 (reverse) 5’CTTGTGCTTAAGTGACTGTAG-3’ berdasarkan nomor urut aksesi EF591039, ukuran amplikon sebesar adalah 650 pb. Amplifikasi dilakukan dengan menggunakan mesin PCR ESCO 2. Reaksi PCR dalam volume 25 µl, menggunakan PCR kit, Gotaq green master mix. Kondisi PCR yang digunakan pada tahap predenaturasi pada suhu 95°C selama dua menit, denaturasi pada suhu 95°C selama 45 detik, penempelan primer pada suhu 57°C selama satu menit, dan pemanjangan DNA pada suhu 72°C selama satu menit diulang dengan 30 siklus. Kualitas amplikon dideteksi dengan menggunakan PAGE 6% (acrilamide:bisacrylamide ratio 29:1) dan pewarnaan perak (Byun et al. 2009).
Analisis Data Sekuen
Reaksi sekuensing DNA menggunakan primer yang sama. Proses sekuensing dilakukan oleh perusahaan komersial. Bentuk kromatogram kemudian secara manual diedit menggunakan Bioedit versi 7.0.8.0 (Hall 2004) dan disejajarkan dengan urutan nukleotida gen myostatin pada Capra hircus
16
Evolutionary Genetic Analysis) (Tamura et al. 2013). Rekonstruksi pohon filogeni dengan menggunakan metode neighbour-jaoining (Tamura et al. 2004).
HASIL DAN PEMBAHASAN
Amplifikasi PCR pada Gen Myostatin Ekson 3
Ekson 3 gen myostatin telah berhasil mengamplifikasi ekson 3 beserta intron 2 dan 3’UTR yang mengapitnya dengan menggunakan sepasang primer. Berdasarkan hasil yang diperoleh panjang fragmen gen myostatin intron 2, ekson 3, dan 3’UTR adalah 136 pb, 377 pb, 137 pb (Gambar 8). Hasil ini sesuai dengan panjang produk pada sekuens gen myostatin (GenBank dengan kode akses EF591039).
Gambar 8 Hasil amplifikasi dari ekson 3 gen myostatin dengan menggunakan PCR pada kambing Kacang (3g); Muara (8a); Gembrong (4a); Peranakan Etawa (6b); Kosta (9g); Samosir (7a, 7b); Burawa (5b); Boer (1l); Boerka (2a); dan M (Marker 100 pb).
Identifikasi Variasi Nukleotida Gen Myostatin Pada Hasil sekuensing
Variasi gen myostatin pada sembilan bangsa kambing lokal ditemukan pada bagian awal, tengah, dan akhir gen myostatin. Bentuk variasi yang ditemukan pada gen myostatin yaitu delesi, substitusi, dan variasi pada puncak kromatogram yang saling tumpang tindih (Tabel 3). Variasi substitusi intron 2 ditemukan pada kambing Gembrong (A7C, A11T), kambing Peranakan Etawah (T10A, A11T), kambing Burawa (T10A, A11T), kambing Muara (A11T), kambing Samosir (A11T), ekson 3 terdapat pada kambing Boerka (A182T, T437A, T439A, A445G). Variasi pada puncak kromatogram yang saling tumpang tindih pada intron 2 terdapat pada posisi basa ke-13. Variasi delesi 3’UTR ditemukan pada kambing Kosta dan Samosir pada posisi basa T552- dan G560-.
650 pb
Hasil perunutan DNA intron 2 dan 3’UTR tidak ditemukan variasi yang menyebabkan perubahan asam amino yang signifikan karena daerah intron merupakan daerah bukan penyandi yang tidak ikut dalam proses translasi. Pada ekson 3 ditemukan mutasi khusus, dapat dilihat pada perubahan asam amino ke-437 yaitu tyrosin menjadi lisin (Gambar 9).
Tabel 3 Variasi nukleotida ekson 3 gen myostatin pada kambing terhadap nukleotida gen myostatin Capra hircus (EF591039)
18
Gambar 9 Urutan nukleotida intron 2, ekson 3, dan 3’UTR gen myostatin beserta urutan asam aminonya berdasarkan urutan nukleotida Capra hircus
(EF432557). Keterangan: Posisi nukleotida dihitung dari basa pertama urutan Luci 5. Simbol panah (↓) menunjukkan batas posisi ekson 3. Kodon penyandi asam amino ditulis dengan tiga huruf.
Variasi substitusi intron 2, ekson 3 dan delesi 3’ UTR pada gen myostatin kemungkinan disebabkan oleh persilangan antara kambing yang tidak terkontrol. Hal ini mengakibatkan berubahnya performan pada kambing. Mutasi di daerah
coding dapat menyebabkan peningkatan massa otot fenotipe IMM (Increased Muscle Mass), dan mengganggu penerjemahan asam amino yang menyebabkan prematur pada kambing (Boman et al. 2006).
dengan kondisi lokasi yang berbeda dengan kondisi di Sumatera, Jawa, dan Bali serta adanya seleksi yang berhubungan dengan tujuan produksi yang diinginkan oleh peternak.
Sebagian besar dari sampel bersifat heterozigot dan DNA mempengaruhi asam aminonya. Heterozigositas yang terjadi pada populasi bangsa kambing menunjukkan bahwa diantara kambing merupakan hasil dari persilangan. Heterozigositas menggambarkan adanya variasi genetik pada suatu populasi. Populasi dengan keragaman genetik tinggi akan memiliki peluang hidup yang semakin tinggi untuk beradaptasi dengan perubahan lingkungan (Ferguson 1980). Heterozigositas yang tinggi memungkinkan adanya perbaikan kualitas genetik populasi dengan seleksi gen yang menguntungkan.
Keragaman sekuen nukleotida gen myostatin diperoleh dengan perunutan sekuen yang di alignment dan mendeteksi kromatogram dari urutan nukleotida. Evolusi gen myostatin dan efek mutan masih belum diketahui dengan jelas. Sistematik dari sebagian besar individu dari keturunan yang berbeda untuk mengevaluasi asal dan evolusi, struktur genetik, keragaman populasi dan hubungan keragaman dengan ciri pada pertumbuhan (Li et al. 2006).
Hubungan Keragaman Genetik Dengan Pertumbuhan Antar Populasi Bangsa Kambing
Hasil pensejajaran ekson 3 gen myostatin dengan panjang 589 pb pada kambing Boer, Boerka, Kacang, Gembrong, Burawa, Peranakan Etawah, Samosir, Muara, Kosta digunakan untuk konstruksi pohon filogenetik. Konstruksi pohon filogenetik digunakan untuk melihat hubungan kekerabatan antara sembilan bangsa kambing (Gambar 10) dan jarak genetik pada sembilan bangsa kambing yang berasal dari satu lokasi (Sei Putih) (Tabel 4).
20
Tabel 4 Jarak genetik pada sembilan bangsa kambing
Bangsa
Analisis filogenetik dengan menggunakan Neighbour-joining tree
menunjukkan bahwa kambing Burawa memiliki hubungan genetik yang dekat (jarak genetik 0,000) dengan kambing Peranakan etawah, sedangkan kambing Kosta berada dalam satu kelompok dengan Kacang, hal ini menunjukkan keturunan gen dalam kelompok memiliki hubungan genetik yang dekat dengan jarak genetik 0,000. Kambing Samosir terdapat dalam satu kelompok, hal ini menunjukkan bahwa kambing Samosir memiliki hubungan genetik yang dekat (jarak genetik 0,000). Kambing Muara dan Gembrong berada dalam satu kelompok dengan jarak genetik 0,002. Kambing Boerka terpisah dengan kelompok kambing lainnya, hal ini menunjukkan bahwa kambing Boerka tidak memiliki hubungan genetik yang dekat (jarak genetik 0,007) dengan kambing Kacang, Kosta dan Capra hircus, sedangkan kambing Muara dan Samosir (jarak genetik 0,009), Gembrong, Peranakan Etawah, dan Burawa memiliki jarak genetik sebesar 0,010.
Pada nilai hasil uji booststrap dengan pengulangan 1000 kali pada analisis
Neighbour Joining dengan metode dua parameter Kimura menunjukkan bahwa kambing Peranakan Etawah dan Burawa memiliki nilai booststrap tertinggi yaitu 68% kemudian disusul oleh kambing Samosir (12%). Berdasarkan hasil analisis pada kesembilan populasi kambing dapat dikelompokkan berdasarkan keragaman genetik menjadi tujuh kelompok, yaitu kelompok kambing Muara dengan Gembrong, kelompok kambing Samosir, Peranakan etawah dengan Burawa, kelompok kambing Kacang dengan Kosta, kelompok kambing Boer, Kelompok
Capra hircus dan kelompok kambing Boerka.
Indonesia dengan kambing Boer yang berasal dari Afrika selatan sehingga kambing Boerka memiliki variasi yang paling tinggi dibandingkan kambing yang lainnya (Sodiq et al. 2003).
Variasi gen yang timbul dipengaruhi oleh seleksi, mutasi gen, pencampuran dua populasi yang frekuensi gen berbeda, silang dalam (inbreeding), silang luar (outbreeding) dan genetic drift. Ekspresi gen dapat mempengaruhi sifat yang yang muncul. Fenotipik yang muncul dapat dipengaruhi oleh variasi gen pada arah dan besar respon terhadap perubahan lingkungan. Fenotipik yang bersifat ekonomis merupakan sifat kuantitatif yang dikontrol oleh banyak gen dan
masing-masing gen memberikan sedikit kontribusi pada sifat tersebut (Noor 2008).
Dengan demikian, pelestarian terhadap sumberdaya genetik ternak lokal sebagai bagian dari komponen keanekaragaman hayati adalah penting untuk memenuhi kebutuhan pangan, pertanian dan perkembangan sosial masyarakat di masa yang akan datang.
SIMPULAN
22
PEMBAHASAN UMUM
Hasil identifikasi mutasi ekson 2 dan ekson 3 gen myostatin pada sembilan bangsa kambing lokal di Indonesia menunjukkan keragaman yang tinggi. Adanya perbedaan basa-basa nukleotida antara kambing-kambing lokal Indonesia berdasarkan gen myostatin. Identifikasi variasi gen myostatin dapat diidentifikasi dengan menggunakan analisis SSCP. SSCP sangat signifikan digunakan untuk menganalisis variasi alel dan urutan mutasi (Gasser et al. 2007).
Identifikasi varian ekson 2 gen myostatin terdapat 15 varian. Bentuk variasi yang ditemukan adalah substitusi, indel nukleotida, puncak kromatogram yang saling tumpang tindih dan tidak mempengaruhi asam aminonya, sedangkan pada ekson 3 gen myostatin ditemukan sepuluh variasi. Bentuk variasi yang ditemukan adalah substitusi, delesi, puncak kromatogram yang saling tumpang tindih. Variasi yang diidentifikasi pada ekson 3 mempengaruhi asam aminonya. Banyak keragaman baru yang ditemukan menunjukkan tingkat mutasi yang tinggi. Di daerah coding gen myostatin pada sapi Nellore telah diidentifikasi 14 perubahan nukleotida dan 8 perubahan pada perkiraan sekuen yang dibandingkan pada sekuens non double muscled terhadap sapi (Grisolia et al. 2009). Mutasi di daerah coding dapat menyebabkan peningkatan massa otot fenotipe IMM
(Increased Muscle Mass), dan mengganggu penerjemahan asam amino yang menyebabkan prematur pada kambing (Boman et al. 2006). Keragaman ini disebabkan karena perbedaan dalam produktivitas keturunan dan tujuan pemuliaan pada kambing.
Hasil konstruksi pohon filogeni menunjukkan hubungan kekerabatan antara kambing Boer, Boerka, Kacang, Gembrong, Burawa, Peranakan Etawah, Samosir, Muara, dan Kosta. Berdasarkan hasil analisis Neighbour Joining dengan metode dua parameter Kimura pada sembilan populasi kambing dapat dikelompokkan menjadi tujuh kelompok, yaitu kelompok kambing Peranakan etawah dengan Burawa, kelompok kambing Samosir, kelompok kambing Gembrong, kelompok kambing Muara, kelompok kambing Kacang, kelompok kambing Kosta dan Boer, dan kelompok kambing Boerka. Variasi gen yang timbul dipengaruhi oleh seleksi, mutasi gen, pencampuran dua populasi yang frekuensi gen berbeda, silang dalam (inbreeding), silang luar (outbreeding) dan
genetic drift (Noor 2008).
SIMPULAN UMUM
1. Analisis sekuen pada ekson 2 gen myostatin terdapat 15 varian pada sembilan bangsa kambing lokal Indonesia. Variasi yang ditemukan tidak mempengaruhi asam aminonya.
24
mutations in the myostatin gene. Proc Natl Acad Sci 94: 12457-12461. Amalianingsih TI, Brahmantiyo B, Jakaria. 2015. Identification of rabbit
myostatin gene polymorphism. Med Pet 38:77-81.
An XP, Wang JG, Hou JX, Zhou HB, Bai L, Li G, Wang LX, Liu XQ, Xiao WP, Song YX, Cao BY. 2011. Polymorphism identification in the goat MSTN gene and association analysis with growth traits. J Anim Sci. 56:529-535. Atha DH, Kasprzak W, O’Connell CD, Shapiro BA. 2001. Prediction of DNA
single-strand conformation polymorphism: analysis by capillary electrophoresis and computerized DNA modeling. Nucleid Acids Res
29:4643-4653. http://dx.doi.org/10.1093/nar/29.22.4643.
Batubara A. 2011. Studi Keragaman Fenotipik dan Genetik Beberapa Sub Populasi Kambing Lokal Indonesia dan Strategi Pemanfaatannya Secara Berkelanjutan. [Disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Boman IA, Klemetsdal G, Blichfeldt T, Vage ID. 2009. A frameshift mutation in the coding region of the myostatin gene (MSTN) affects carcass conformation and fatness in norwegian white sheep (Ovis aries). Anim Genet 40(4):418. http://dx.doi.org/10.1111/j.1365-2052.2009.01855.x. Byun SO, Fang Q, Zhou H, Hickford JGH. 2009. An effective method for
silver-staining DNA in large numbers of polyacrylamide gels. Anal Biochem 385:174-175. http://dx.doi.org/10.1016/j.ab.2008.10.024.
Casey NH, Webb EC. 2010. Managing goat production for meat quality. Small Ruminant Res 89:218-224. http://dx.doi.org/10.1016/j.smallrumres. 2009. 12 .047.
John, Menissier F. 2003. Haplotype diversity of the myostatin gene among beef cattle breeds. Genet Sel Evol 35:103-118. doi.org/10.1051/gse:20020. Dybus A, Proskura WS, Sadkowski S, Pawlina E. 2013. A single nucleotida
polymorphism in exon 3 of the myostatin gene in different breeds of domestic pigeon (Columba livia var. domestica). Veterinarni Medicina
1:32-38.
Gan SQ, Du Z, Liu SR, Yang YI, Shen M, Wang XH, Yin JL, Hu XX, Fei J, Fan persilangan boer x kacang. Wartazoa 18(3):115-126.
Grisolia AB, Angelo GTD, Porto Neto LR, Siqueira F, Garcia JF. 2009. Myostatin (GDF8) single nucleotide polymorphisms in nellore cattle. Genet and Mol Res 8:822-830.
Hall T. 2004. BioEdit version 7.0.0. Isis Pharmaceuticals, Inc. Hayashi K. 2014. PCR-SSCP: a simple and sensitive method for detection of mutations in the genomic DNA. Genome Res 1:34-38. doi.org/10.1101/gr.1.1.34.
Hayashi K. 2014. PCR-SSCP: a simple and sensitive method for detection of mutations in the genomic DNA. Genome Res 1:1:34-38.
Haenlein GFW. 2004. Goat milk in human nutrition. Small Ruminant Res
51:155-163. http://dx.doi.org/10.1016/j.smallrumnes.2003.08.010.
Ibeagha-Awemu EM, Kgwatalala P, Zhao X. 2008. A critical analysis of production associated DNA polymorphisms in the genes of cattle, goat, sheep, and pig. Mamm Genome 19:591-617. doi.org/10.1007/s00335-008- 9141-x.
Jin XY. 2009. Coding region comparision of myostatin gene between goat and other mammals. China: Qinghai Academy of Animal Science and Veterinary Medicine.
Johnson LJ. 2008. Mountain goat. Alaska department of fish game.
Joshi M, Deshpande JD. 2010. Polymerase chain reaction: methods, principles and application. IJBR 2:81-97.
Kakavas V, Konstantinos, Panagiotis P, Vlachos T, Antonius, Agelos P, Noulas V, Argiris. 2008. PCR-SSCP: A method for the molecular analysis of genetic diseases. Mol Biotechnol 38:155-163.
Kambadur R, Sharma M, Smith TPL, Bass JJ. 1997. Mutations in myostatin (GDF8) in double-muscled belgian blue and piedmontese cattle. Cold Spring Harbor Laboratory Press 7:910-915.
Kocamis H, Killefer J. 2002. Myostatin expression and possible functions in animal muscle growth. Domestic Anim Endocrinol 23:447-454.
Kostaman T, Sutama IK. 2005. Laju pertumbuhan kambing anak hasil persilangan antara kambing boer dengan peranakan etawah pada periode pra-sapih.
JITV 10:106-112.
Langley B, Thomas M, Bishop A, Sharma M, Gilmour S, Kambadur R. 2002. Myostatin inhibits myoblast differentiation by down regulating myoD expression. J Bio Chem 277:49831-49840.
26
Li XL, Wu ZL, Liu ZZ, Gong YF, Zhou RY, Zheng GR. 2006. SNP identification and analysis in part of intron 2 of goat MSTN gene and variation within and among species. J Heredity 97:285-289. doi.org/10.1093/jhered/esj. Li X, Liu Z, Zhou R, Zheng G, Gong Y, Li L. 2008. Deletion of TTTTA in
5’UTR of goat MSTN gene and its distribution in different population groups and genetic effect on bodyweight at different ages. Front Agric China 2:103-109. http://dx.doi.org/10.1007/511703-008-0004-8.
Mahmilia F, Tarigan A. 2006. Karakteristik morfologi dan performans kambing kacang, kambing boer dan hasil persilangannya. LNKP 1: 209-2012. Mosher DS, Quignon P, Bustamante CD, Sutter NB, Mellersh CS, Parker HG,
Ostrander EA. 2007. A mutation in the myostatin gene increases muscle mass and enhances racing performance in heterozygote dogs. PloS Genetics 3:0779-0786.
Nataraj AJ, Glander IO, Kusukawa N, Highsmith WE. 1999. Single strand conformation polymorphism and heteroduplex analysis for gel-based mutation detection. Electrophoresis 20:1177-1185.
Noor RR. 2008. Genetika Ternak. Penebar Swadaya, Jakarta.
[PKPKP] Peternakan Kambing Perah Kota Pekanbaru. 2011. Kambing asli indonesia. Pekanbaru (ID). [diunduh 2016 Agust 13]. Tersedia pada: https://goat/ternak kambing asli indonesia. html.
Rusdiana S, Prahararli L, Adiati U. 2014. Prospek dan strategi perdagangan ternak kambing dalam merebut peluang pasar dunia. Agriekonomika 3(2):204-223.
Salles PA, Santos SC, Rondina D, Weller M. 2011. Genetic variability of six indigenous goat breeds using major histocompatibility complex-associated microsatellite markers. J Vet Sci 12(2): 127-132.
Sambrook JEF, Fritsch, Maniatis T. 1989. Molecular Cloning a Laboratory Manual. 2nd Ed. Cold Spring Harbor Laboratory Press.
Shrestha JNB, Fahmy MH. 2005. Breeding goats for meat production: a review: 1. Genetic resources, management and breed evaluation. Small Ruminant Res 58:93-106.
Sodiq A, Adjisoedarmo S, Tawfik ES. 2003. Reproduction rate of kacang and perankan etawah goats under village production system in indonesia.
Inter Res on Food Security, Natural Resource Management and Rural Development 8: 1-7.
Sulabda IN, Susari NW, Heryani LGS, Puja K. 2012. Genetic diversity of gembrong goat based on DNA microsatellite markers. Global Veterinaria
9(1):113-116.
Sunnucks P, Wilson ACC, Beheregaray LB, Zenger K, French J, Taylor C. 2000. SSCP is not so difficult: the application and utility of single-stranded conformation polymorphism in evolutionary biology and molecular ecology. Molecular Ecology. 9:1699-1710.
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. 2013. MEGA 6: Molecular evolutionary genetics analysis version 6.0. Mol Biol Evol 5:1-3. http://dx.doi.org/10.1093/molbev/mst197.
Tay GK, Iaschi SPA, Bellinge RHS, Chong FN, Hui J. 2004. The development of sequence based typing of myostatin (GDF-8) to identify the double muscling phenotype in the goat. Small Ruminant Res 52:1-12. http://dx.doi.org/10.1016/SO921-4488(03)00248-7.
Vasta V, Nudda A, Cannas A, Lanza M, Priolo A. 2008. Alternative feed resources and their effects on the quality of meat and milk from small ruminants. Science Direct 147:223-246.
Weiner G. 2009. The myostatin gene. Eukaryon. 5:91-94. The development of sequence-based-typing of myostatin (GDF-8) to identify the double muscling phenotype in the goat. Small Ruminant Res 52:1-12.
Yahyaoui MH. 2003. Genetic Polymorphism in Goat. [Thesis]. Bellaterra (ES): Universidad Autonoma de Barcelona.
Zhang C, Zhang W, Luo H, Yue W, Gao M, Jia Z. 2008. A new single nucleotide polymorphism in the IGF-I gene and its association with growth traits in the nanjiang huang goat. J Anim Sci 21:1073-1079. Zhang C, Liu Y, Xu D, Wen Q, Li X, Zhang W, Yang L. 2011. Polymorphism of
myostatin gene (MSTN) in four goat breeds and their effects on Boer goat growth performance. Mol Biol Rep http://dx.doi.org/10.1007/s11033-011-10710.
28