POPULASI MIKROFLORA INTESTINAL, AKTIVITAS
ENZIM PENCERNAAN DAN PERTUMBUHAN IKAN LELE
Clarias sp. YANG DIBERI PROBIOTIK Bacillus megaterium
WAHYU AFRILASARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Populasi mikroflora intestinal, aktivitas enzim pencernaan dan pertumbuhan ikan lele Clarias sp. yang diberi probiotik Bacillus megaterium adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Wahyu Afrilasari
RINGKASAN
WAHYU AFRILASARI. Populasi mikroflora intestinal, aktivitas enzim pencernaan dan pertumbuhan ikan lele Clarias sp. yang diberi probiotik Bacillus
megaterium. Dibimbing oleh ANJA MERYANDINI dan WIDANARNI.
Kegiatan budidaya ikan secara intensif memiliki banyak permasalahan diantaranya kecernaan pakan yang rendah, serangan penyakit yang meningkat dan kualitas air yang menurun. Kecernaan pakan dalam budidaya ikan memiliki peran penting dalam keberhasilan proses budidaya. Kecernaan pakan berpengaruh terhadap pertumbuhan ikan dan biaya produksi dalam proses budidaya. Kecernaan pakan dapat ditingkatkan dengan meningkatkan enzim-enzim pencernaan yang mampu merombak nutrien dalam pakan. Peningkatan enzim-enzim pencernaan dapat dilakukan dengan memanfaatkan bakteri probiotik. Probiotik memiliki kemampuan dalam menghasilkan enzim-enzim pencernaan yang dapat meningkatkan kecernaan pakan dan pertumbuhan ikan. Penelitian ini bertujuan untuk mengevaluasi pengaruh pemberian bakteri probiotik terhadap populasi mikroflora intestinal, aktivitas enzim pencernaan dan pertumbuhan ikan lele.
Bakteri yang digunakan sebagai probiotik adalah Bacillus megaterium PTB 1.4. Bakteri probiotik terlebih dahulu diberi penanda molekuler dengan perlakuan mutan resisten rifampisin. Bakteri probiotik PTB 1.4 diuji viabilitasnya dalam pakan untuk mengetahui kemampuan hidup bakteri tersebut dalam pakan serta uji patogenisitas dengan menyuntikan isolat PTB 1.4 ke ikan uji. Selanjutnya dilakukan aplikasi bakteri probiotik pada ikan lele untuk melihat pengaruh probiotik terhadap ikan lele. Pada aplikasi probiotik terhadap ikan lele digunakan dua kelompok ikan uji yaitu ikan lele normal dan ikan lele gnotobiotik. Uji bioassai bakteri probiotik terhadap ikan lele meliputi analisis populasi mikroflora intestinal, aktivitas enzim pencernaan, kecernaan nutrien dan parameter pertumbuhan (tingkat kelangsungan hidup, laju pertumbuhan spesifik dan rasio konversi pakan).
Hasil mutasi resisten rifampisin pada isolat PTB 1.4 menunjukkan isolat PTB 1.4 RfR (resisten rifampisin) memiliki indeks proteolitik dan amilolitik masing-masing sebesar 1.07 dan 0.58. Isolat PTB 1.4 RfR mencapai fase stasioner pada jam ke-12 pada kurva pertumbuhan. Hasil uji patogenisitas isolat PTB 1.4 dan PTB 1.4 RfR pada ikan lele memiliki tingkat kelangsungan hidup sebesar 100% yang menunjukkan bahwa isolat bakteri PTB 1.4 dan PTB 1.4 RfR tidak bersifat patogen terhadap ikan lele. Bakteri probiotik PTB 1.4 RfR mampu bertahan hidup dalam pakan dengan kepadatan 106 cfu/g setelah penyimpanan selama 10 hari di dalam lemari pendingin.
plus probiotik menunjukkan nilai yang lebih tinggi (5.99×105 cfu/g) dibandingkan dengan ikan lele gnotobiotik plus probiotik (3.29×105 cfu/g). Terdeteksinya bakteri probiotik pada saluran pencernaan ikan baik pada lele normal dan lele gnotobiotik yang diberi perlakuan probiotik menunjukkan bahwa bakteri probiotik memiliki kemampuan berkolonisasi dalam saluran pencernaan ikan.
Pemberian probiotik pada ikan lele normal dan ikan lele gnotobiotik mampu meningkatkan aktivitas enzim protease dan amilase. Aktivitas enzim protease dan amilase pada ikan lele normal plus probioik lebih tinggi (1.32 IU/g saluran pencernaan dan 0.35 IU/g saluran pencernaan) dibandingkan dengan lele normal tanpa probiotik (0.36 IU/g saluran pencernaan dan 0.22 IU/g saluran pencernaan). Sama halnya dengan ikan lele gnotobiotik plus probiotik yang memiliki nilai aktivitas enzim protease dan amilase lebih tinggi (0.96 IU/g saluran pencernaan dan 0.24 IU/g saluran pencernaan) dibandingkan dengan ikan lele gnotobiotik tanpa probiotik (0.32 IU/g saluran pencernaan dan 0.19 IU/g saluran pencernaan). Kecernaan nutrien pakan pada perlakuan probiotik baik pada ikan lele normal maupun ikan lele gnotobiotik memiliki nilai yang lebih tinggi dibandingkan tanpa pemberian probiotik. Kecernaan total dan kecernaan protein pada lele normal plus probiotik lebih tinggi (76.90% dan 93.22%) dibandingkan dengan lele normal tanpa probiotik (73.91% dan 85.28%). Lele gnotobiotik plus probiotik memiliki nilai kecernaan total dan kecernaan protein lebih tinggi (74.43% dan 88.71%) dibandingkan tanpa penambahan probiotik (71.61% dan 86.99%).
Pemberian probiotik mampu meningkatkan pertumbuhan dan rasio konversi pakan baik pada lele normal maupun pada lele gnotobiotik. Pertumbuhan pada lele normal plus probiotik lebih baik (2.69%) dibandingkan dengan lele normal tanpa probiotik (1.98%). Lele gnotobiotik plus probiotik memiliki pertumbuhan yang lebih baik (2.11%) dibandingkan tanpa pemberian probiotik (1.92%). Rasio konversi pakan lele normal plus probiotik (1.05) lebih baik dibandingkan lele normal (1.49) dan gnotobiotik plus probiotik (1.66) lebih baik dibandingkan gnotobiotik tanpa penambahan probiotik (1.77).
Bakteri probiotik PTB 1.4 mampu berkolonisasi pada saluran pencernaan ikan lele. Pemberian bakteri probiotik PTB 1.4 baik pada lele normal dan lele gnotobiotik mampu meningkatkan aktivitas enzim pencernaan, meningkatkan kecernaan nutrien pakan dan mampu meningkatkan pertumbuhan ikan lele serta meningkatkan efisiensi penggunaan pakan.
SUMMARY
WAHYU AFRILASARI. Population of intestinal microflora, digestive enzyme activity and growth of catfish Clarias sp. were given by probiotic
Bacillus megaterium. Supervised by ANJA MERYANDINI and WIDANARNI.
An increase in disease, low digestibility of feed, and a decrease in water quality are several problems in intensive fish farming. Digestibility of feed in aquaculture also has a high impact to the fish growth and production cost, which are affecting to the success of the farming. Actually, this can be improved by developing the activity of digestive enzymes to break down the nutrients in the feed. The effort to increase digestive enzymes activity can be done by using probiotic bacteria. Probiotic has an ability to produce digestive enzymes to improve digestibility and growth of fish. This study aimed to analyze the effect of probiotic bacteria on the population of intestinal microflora, digestive enzyme activities and growth of catfish.
Bacillus megaterium PTB 1.4 was used in this study as probiotic bacteria, which marked with molecular marker by using rifampicin resistance mutants. Then, viability of probiotic bacteria PTB 1.4 was tested in the feed to determine the ability of probiotic’s life and isolate of probiotic bacteria PTB 1.4 was injected to the fish to examine the pathogenicity test. Furthermore, probiotic bacteria PTB 1.4 were applied towards catfish to analyze the effect of these bacteria. Gnotobiotic and normal catfish were used in this experiment, which was consisting of analyzing population of microflora intestinal, digestive enzyme activity, digestibility and parameters of growth (survival rate, specific growth rate, and feed conversion rate).
The result of mutation resistance of rifampicin in isolate PTB 1.4 RfR (rifampicin resistance) showed that an index of proteolytic and amylolytic at 1.07 and 0.58. PTB 1.4 RfR isolate reaches stationer phase on 12 hour in growth curve. Survival rate of PTB 1.4 isolate in pathogenicity test and PTB 1.4 RfR in catfish are 100%, which indicates that the isolate PTB 1.4 and PTB 1.4 RfR were not pathogenic to catfish. Probiotic bacteria PTB 1.4 can survive in feed with density 106 cfu/g after stored in refrigerator for 10 days.
Total bacteria in the digestive tract of normal catfish plus probiotic showed at 32.90×105 cfu/g of the total value, which is lower than the normal catfish without probiotic (36.33×105 cfu/g). The reason is because there is a competition mechanism between probiotic with microflora normal to attach in digestive tract of catfish. The total amount of probiotic bacteria in the gnotobiotic catfish plus probiotic demonstrates at 5.90×105 cfu/g, which is higher than the gnotobiotic catfish without probiotic (2.24×105 cfu/g). Moreover, the total amount of probiotic bacteria in normal catfish plus probiotic showed higher (5.99×105 cfu/g) result compared with normal catfish without probiotic (3.29×105 cfu/g). It reflects that probiotic bacteria have an ability to colonize in the digestive tract of fish.
catfish plus probiotic has higher value of protease and amylase (0.96 IU/g digestive tract and 0.24 IU/g digestive tract) compared with gnotobiotic catfish without probiotic (0.32 IU/g digestive tract and 0.19 IU/g digestive tract).
Digestibility of feed in normal and gnotibiotic catfish plus probiotic is better than without probiotic. Total digestibility and protein digestibility in normal catfish plus probiotic were higher (76.90% and 93.22%) than normal catfish without probiotic (73.91% and 85.28%). The result is also the same to gnotobiotic catfish plus probiotic, which has total digestibility and protein digestibility greater (74.43% and 88.71%) than gnotobiotic catfish without the addition of probiotic (71.61% and 86.99%).
Growth and feed conversion of gnotobiotic catfish and normal catfish can be improved by adding probiotic. It can be seen that growth in normal catfish plus probiotic is higher (2.69%) than normal catfish without probiotic (1.98%). Gnotobiotic catfish plus probiotic has better growth (2.11%) compared with gnotobiotic without probiotic (1.92%). Besides, feed convertion ratio in normal catfish plus probiotic have the ability to digest food better (1.05) than normal catfish (1.49) and gnotobiotic plus probiotic is better (1.66) than gnotobiotic without probiotic (1.77).
Probiotic bacteria PTB 1.4 are able to colonize the digestive tract of catfish. Thus, digestive enzyme activity, digestibility of feed and growth, and feed efficiency can be developed by adding probiotic bacteria PTB 1.4 in normal catfish and gnotobiotic catfish.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
POPULASI MIKROFLORA INTESTINAL, AKTIVITAS
ENZIM PENCERNAAN DAN PERTUMBUHAN IKAN LELE
Clarias sp. YANG DIBERI PROBIOTIK Bacillus megaterium
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji syukur penulis ucapkan kepada Allah SWT yang telah memberikan rahmat dan karunia-Nya kepada penulis, sehingga karya ilmiah ini dapat diselesaikan. Penelitian yang dilaksanakan sejak bulan Oktober 2014 sampai
Agustus 2015 ini berjudul “Populasi mikroflora intestinal, aktivitas enzim pencernaan dan pertumbuhan ikan lele Clarias sp. yang diberi probiotik Bacillus megaterium”. Penelitian ini dilakukan di Laboratorium Bioteknologi Hewan dan Biomedis PPSHB dan Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, FPIK, Institut Pertanian Bogor.
Penulis mengucapkan terimakasih kepada Prof Dr Anja Meryandini, MS dan Dr Ir Widanarni, MSi sebagai komisi pembimbing yang telah banyak membantu dan memberikan bimbingan serta sarannya. Terimakasih penulis ucapkan kepada Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPP-DN) atas beasiswa yang telah diberikan kepada penulis. Terimakasih penulis ucapkan kepada Ketua Program Studi Mikrobiologi Prof Dr Anja Meryandini, MS atas saran-saran dan nasehatnya. Penulis juga ucapkan terimakasih kepada Prof Dr Ir Cece Sumantri, M AgrSc sebagai Kepala Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB yang telah memberikan fasilitas laboratorium, serta kepada seluruh staf-staf dan teknisi PPSHB IPB yang telah banyak memberikan bantuan.
Ungkapan terimakasih juga disampaikan kepada Papa, Ibu, Kak Berty, Abang Oky, Dede, Abang Engky, Abang Arsya serta seluruh keluarga atas doa, semangat dan kasih sayangnya. Penulis mengucapkan terimakasih kepada Bu Dewi, Teteh Pipit dan Pak Pras atas segala bantuan yang telah diberikan kepada penulis selama penelitian. Terimakasih pada teman-teman di laboratorium Ka Tini, Ka Novi, Ka Leni, Ka Yeni, Ka Anik, Ka Fatin dan Ka Ira. Terimakasih kepada Pipit, Mba Astri, Ismi, Ka Gesty, Ka Haezy, Dendi, Ari dan Ka Erni serta teman-teman Mikrobiologi 2013 atas segala bantuan dan semangatnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
Probiotik dalam Akuakultur 2
Mekanisme Aksi dan Manfaat Probiotik 3
Bacillus sebagai Probiotik 4
METODE 5
Waktu dan Tempat Penelitian 5
Pembuatan Mutan Resisten Rifampisin 5
Uji Patogenisitas 6
Uji Viabilitas Bakteri Probiotik pada Pakan 6
Bioassai Bakteri Kandidat Probiotik pada Ikan Lele 7
Parameter Pertumbuhan 10
Tingkat Kelangsungan Hidup 10
Laju Pertumbuhan Spesifik 10
Rasio Konversi Pakan 10
HASIL DAN PEMBAHASAN 11
Hasil 11
Pembahasan 15
SIMPULAN DAN SARAN 21
Simpulan 21
Saran 21
DAFTAR PUSTAKA 22
LAMPIRAN 25
DAFTAR TABEL
1 Hasil uji patogenisitas bakteri probiotik pada ikan lele 12 2 Hasil uji viabilitas bakteri PTB 1.4 RfR dalam pakan setelah
penyimpanan 12
3 Total bakteri dan bakteri probiotik pada saluran pencernaan ikan lele
setelah pemeliharaan 30 hari 13
4 Kecernaan total (Ktn) dan kecernaan protein (Kprot) ikan lele yang diberi
pakan perlakuan 13
5 Tingkat kelangsungan hidup (TKH), laju pertumbuhan spesifik (LPS)
dan rasio konversi pakan (RKP) ikan uji 15
DAFTAR GAMBAR
1 Zona bening yang terbentuk setelah inkubasi 24 jam pada suhu 28 °C pada media TSA yang mengandung, a. 1% susu skim, b. 1% pati 11 2 Kurva pertumbuhan isolat bakteri PTB 1.4 RfR pada media TSA 12 3 Aktivitas enzim pencernaan pada saluran pencernaan ikan lele setelah 30
hari pemeliharaan, a. aktivitas enzim protease, b. Aktivitas enzim amilase 14
DAFTAR LAMPIRAN
1 Komposisi pakan yang digunakan 25
2 Prosedur uji aktivitas protease (Modifikasi dari Walter 1984) 26 3 Prosedur uji aktivitas amilase (Bernfeld 1955) 27
PENDAHULUAN
Latar Belakang
Peningkatan jumlah penduduk menyebabkan terjadinya peningkatan kebutuhan protein hewani untuk memenuhi gizi manusia. Kebutuhan protein hewani dapat dicukupi salah satunya dengan mengkonsumsi ikan. Ikan lele merupakan salah satu produk akuakultur yang memiliki nilai protein hewani cukup tinggi yang dapat digunakan dalam memenuhi kebutuhan protein hewani bagi manusia. Permintaan produk ikan lele yang tinggi diikuti dengan peningkatan produksi budidaya ikan lele secara intensif. Kegiatan budidaya ikan secara intensif memiliki banyak permasalahan diantaranya kecernaan pakan yang rendah, serangan penyakit yang meningkat dan kualitas air yang menurun.
Kecernaan pakan dalam budidaya intensif menjadi salah satu masalah penting. Penggunaan pakan buatan pada budidaya intensif menyebabkan kecernaan pakan rendah. Hal ini dikarenakan kandungan bahan pakan dalam pakan buatan yang sulit dicerna oleh ikan dibandingkan dengan pakan alami yang mudah dicerna oleh ikan pada kegiatan budidaya ekstensif. Kecernaan pakan sangat berpengaruh terhadap pertumbuhan ikan dan biaya produksi. Kecernaan pakan dapat ditingkatkan dengan meningkatkan enzim-enzim pencernaan yang mampu merombak nutrien dalam pakan. Peningkatan enzim-enzim pencernaan dapat dilakukan dengan memanfaatkan bakteri probiotik. Bakteri probiotik memiliki peran yang menguntungkan bagi inangnya diantaranya yaitu sebagai sumber nutrisi dan kontribusi enzimatik untuk proses pencernaan (Balcazar et al. 2006). Beberapa hasil penelitian menyatakan bakteri probiotik mampu berperan dalam meningkatkan enzim pencernaan serta pertumbuhan diantaranya pada udang Fenneropenaeus indicus (Ziaei-Nejad et al. 2006), udang Litopenaeus vannamei (Wang 2007; Zokaeifar et al. 2012), ikan nila Oreochromis sp. (Putra dan Widanarni 2015), abalon Haliotis asinina (Faturrahman et al. 2015) dan ikan kerapu Cromileptes altivelis (Marlida et al. 2014).
Salah satu syarat penting dari kandidat bakteri probiotik adalah berasal dari inang itu sendiri (Balcazar et al. 2006). Bakteri probiotik yang diisolasi dari saluran pencernaan pada spesies yang sama memiliki kelebihan dalam beradaptasi dengan lingkungan saluran pencernaan ketika diaplikasikan pada spesies yang sama. Hamtini et al. (2015) telah melakukan isolasi bakteri yang berasal dari saluran pencernaan ikan lele dan diperoleh isolat PTB 1.4 yang memiliki aktivitas proteolitik dan amilolitik. Isolat PTB 1.4 dapat berperan dalam mendegradasi pakan berdasarkan hasil uji total padatan tersuspensi (TPT) yang telah diujikan pada pakan. Isolat PTB 1.4 teridentifikasi sebagai bakteri Bacillus megaterium
(Hamtini et al. 2015).
Sebagian besar spesies Bacillus merupakan bakteri yang dapat menghasilkan enzim ekstraseluler seperti protease dan amilase (Fleming et al.
1995). Wang (2007) menyatakan bahwa pemberian bakteri fotosintetik dan
2
pertumbuhan. Putra dan Widanarni (2015) menyatakan penambahan Bacillus NP5 pada pakan mampu meningkatkan enzim pencernaan, kecernaan nutrien dan pertumbuhan pada ikan nila.
Berdasarkan hasil penelitian Hamtini et al. (2015), isolat PTB 1.4 tersebut tidak bersifat patogen, memiliki aktivitas proteolitik dan amilolitik serta mampu mendegradasi pakan yang telah diuji secara in vitro, sehingga perlu dilakukan penelitian aplikasi pemberian bakteri probiotik pada hewan uji yaitu ikan lele.
Perumusan Masalah
Kecernaan pakan dalam budidaya ikan memiliki peran penting dalam keberhasilan proses budidaya. Kecernaan pakan berpengaruh terhadap pertumbuhan ikan dan biaya produksi. Kecernaan pakan dapat ditingkatkan dengan meningkatkan enzim-enzim pencernaan yang mampu merombak nutrien dalam pakan. Peningkatan enzim-enzim pencernaan dapat dilakukan dengan memanfaatkan bakteri probiotik. Bakteri Bacillus megaterium PTB 1.4 merupakan bakteri probiotik yang memiliki kemampuan dalam medegradasi pakan serta menghasilkan enzim-enzim pencernaan seperti protease dan amilase yang dapat membantu ikan dalam mencerna pakan. Penggunaan probiotik dalam meningkatkan kecernaan pakan dapat berpengaruh terhadap pertumbuhan ikan. Oleh karena itu, dibutuhkan penelitian aplikasi mengenai pengaruh bakteri probiotik Bacillus megaterium PTB 1.4 terhadap kecernaan pakan dengan mengevaluasi melalui populasi mikroflora intestinal, aktivitas enzim pencernaan dan pertumbuhan ikan lele setelah pemberian probiotik.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengevaluasi pengaruh pemberian bakteri probiotik Bacillus megaterium PTB 1.4 terhadap populasi mikroflora intestinal, aktivitas enzim pencernaan dan pertumbuhan ikan lele.
Manfaat Penelitian
Manfaat dari penelitian ini diharapkan dapat menjadi bahan informasi dan mengembangkan ilmu mikrobiologi khususnya dalam peranan bakteri sebagai probiotik dalam bidang akuakultur yang mampu memberikan pengaruh yang menguntungkan dalam meningkatkan pertumbuhan dan efisiensi pakan pada ikan.
TINJAUAN PUSTAKA
Probiotik dalam Akuakultur
3
hubungan komunitas mikroba yang dapat berasosiasi dengan inang atau lingkungannya dalam meningkatkan penggunaan pakan atau nilai nutrisi, meningkatkan respon imun inang terhadap penyakit ataupun meningkatkan kualitas lingkungan perairan (Verschuere et al. 2000). Pemanfaatan bakteri probiotik dalam akuakultur telah banyak dilakukan pada berbagai stadia dan jenis hewan budidaya baik pada ikan, krustasea maupun moluska. Beberapa penelitian mengenai probiotik dalam akuakultur telah banyak dilakukan diantaranya pada udang Fenneropenaeus indicus (Ziaei-Nejad et al. 2006), udang Litopenaeus vannamei (Wang 2007; Zokaeifar et al. 2012), ikan nila Oreochromis sp. (Putra dan Widanarni 2015), abalon Haliotis asinina (Faturrahman et al. 2015) dan ikan kerapu Cromileptes altivelis (Marlida et al. 2014).
Probiotik dapat diberikan atau ditambahkan pada lingkungan akuatik melalui beberapa cara yaitu penambahan melalui pengkayaan pada pakan hidup (Gomez-Gill et al. 2000), penambahan pada air pemeliharaan (Moriarty 1998) dan penambahan pada pakan buatan (Rengpipat et al. 2000). Probiotik dalam akuakultur memiliki peran dalam meningkatkan pertumbuhan, kecernaan pakan, efisiensi penggunaan pakan dan menjaga kualitas air pemeliharaan (Widanarni et al. 2010).
Probiotik dapat diisolasi dari saluran pencernaan inang. Beberapa penelitian telah melakukan isolasi bakteri dari saluran pencernaan dan diketahui bahwa bakteri probiotik tersebut memiliki kemampuan dalam menghasilkan enzim pencernaan (Wang 2007; Marlida et al. 2014; Putra dan Widanarni 2015; Hamtini
et al. 2015) dan meningkatkan sistem imun (Liu et al. 2012; Chandran et al.
2014). Syarat penting yang harus dimiliki oleh kandidat probiotik diantaranya berasal dari inang itu sendiri (berasal dari saluran pencernaan), aman (tidak bersifat patogen bagi inang), dan mampu bertahan hidup dan berkolonisasi dalam saluran pencernaan inang (resisten atau tahan terhadap asam lambung dan pH rendah) (Balcazar et al. 2006).
Kemampuan mikroorganisme dalam berkolonisasi merupakan salah satu hal penting dalam melakukan seleksi bakteri probiotik yaitu mampu bertahan pada sel epitel saluran pencernaan untuk mengurangi atau menghambat kolonisasi bakteri patogen. Pada umumnya, bakteri probiotik harus memiliki kemampuan dalam memberikan efek yang menguntungkan untuk inang seperti meningkatkan pertumbuhan dan meningkatkan respon imun (Balcazar et al. 2006).
Mekanisme Aksi dan Manfaat Probiotik
Probiotik yang dikatakan mampu memberikan efek yang menguntungkan bagi inang pada umumnya telah diuji baik secara in vitro maupun in vivo melalui suatu mekanisme tertentu. Mekanisme probiotik diantaranya yaitu (i) kompetisi dengan bakteri patogen, (ii) sumber nutrisi dan kontribusi enzimatik untuk proses pencernaan, (iii) penyerapan langsung bahan organik yang dilakukan oleh bakteri probiotik, (iv) peningkatan respon imun terhadap mikroorganisme patogen (Balcazar et al. 2006).
4
patogen melalui kompetisi untuk tempat pelekatan dan nutrisi (Balcazar et al.
2006) atau melalui modulasi respon imun (Aly et al. 2008; Liu et al. 2012). Faktor yang mempengaruhi kolonisasi mikroorganisme pada saluran pencernaan diantaranya dipengaruhi oleh inang yang meliputi kondisi suhu tubuh inang dan aktivitas enzim (Balcazar et al. 2006).
Kemampuan kolonisasi dari bakteri probiotik pada inang diperlukan dalam aplikasi probiotik. Kolonisasi bakteri probiotik dalam saluran pencernaan dimulai dari masuknya bakteri melalui mulut, air dan makanan, selanjutnya bakteri akan melewati saluran pencernaan dan beberapa akan tetap bertahan dan menetap di saluran pencernaan sebagai mikroflora saluran pencernaan. Beberapa bakteri lain yang tidak mampu bertahan di saluran pencernaan akan mati karena tercerna dalam proses pencernaan dan akan dikeluarkan bersamaan dengan feses yang dikeluarkan oleh inang (Nayak 2010).
Probiotik memiliki kemampuan dalam menghasilkan enzim-enzim pencernaan seperti protease, amilase dan lipase. Produksi enzim-enzim pencernaan oleh bakteri probiotik mampu menstimulasi produksi enzim pencernaan endogenus pada inang (Ziae-Nejad et al. 2006; Wang 2007). Peningkatan produksi enzim pencernaan pada inang mampu memberikan pengaruh terhadap kecernaan (Mohapatra et al. 2012), pertumbuhan dan efisiensi penggunaan pakan pada inang (Sun et al. 2010). Selain mampu meningkatkan enzim pencernaan, kecernaan dan pertumbuhan, probiotik juga mampu meningkatkan imunitas inang yang terserang penyakit. Penggunaan probiotik dalam menghambat bakteri patogen telah banyak dilaporkan dimana bakteri probiotik mampu meningkatkan kelangsungan hidup ikan dengan cara meningkatkan sistem imun dari inang yang terserang penyakit (Aly et al. 2008; Liu et al. 2012; Chandran et al. 2014).
Bacillus sebagai Probiotik
Bacillus merupakan bakteri Gram positif yang pada umumnya mudah ditemui pada tanah, air dan sedimen. Bacillus dapat ditemukan di dalam saluran pencernaan ikan melalui asosiasi antara bakteri dengan air pemeliharaan ataupun melalui makanannya. Bacillus mampu menghasilkan endospora ketika berada di lingkungan yang kurang menguntungkan. Spora yang dihasilkan oleh Bacillus
memiliki kelebihan dibandingkan dengan sel vegetatif. Spora mampu tetap stabil dalam jangka waktu yang lama dan pada lingkungan yang tidak menguntungkan bagi kehidupan bakteri serta dapat dimanfaatkan sebagai produk komersial yang berfungsi sebagai agen biologis (Hong et al. 2005). Pembentukan spora ditemukan secara universal pada genus Bacillus sebagai strategi dalam bertahan hidup pada lingkungan (Toldar 2009).
5
bahwa pemberian bakteri Bacillus pumilus dan Bacillus clausii pada ikan kerapu mampu memperbaiki efisiensi pakan serta laju pertumbuhan. Aly et al. (2008) menyatakan bakteri Bacillus subtilis and Lactobacillus acidophilus dapat meningkatkan respon imun pada ikan nila dan dapat menghambat pertumbuhan patogen Aeromonas hydrophila dan Streptococcus iniae serta meningkatkan pertumbuhan ikan nila.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Oktober 2014 hingga Agustus 2015. Penelitian ini dilaksanakan di Laboratorium Bioteknologi Hewan dan Biomedis, Pusat Penelitian Sumberdaya Hayati Bioteknologi (PPSHB) dan Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pembuatan Mutan Resisten Rifampisin
Bakteri probiotik yang digunakan adalah bakteri Bacillus megaterium PTB 1.4. Sebelum digunakan, bakteri probiotik diberi penanda molekuler resisten rifampisin. Pembuatan mutan resisten rifampisin dilakukan dengan cara bakteri probiotik PTB 1.4 dengan kepadatan 1010 cfu/mL pada fase stasioner ditumbuhkan pada media TSA (Triptic Soy Agar) yang mengandung 50 µg/mL rifampisin. Bakteri yang tumbuh pada media TSA, ditumbuhkan kembali pada media TSA yang mengandung 100 µg/mL rifampisin. Bakteri yang tumbuh kemudian dievaluasi aktivitas proteolitik dan amilolitik, serta laju pertumbuhannya.
Pengujian Aktivitas Proteolitik dan Amilolitik
Bakteri probiotik yang telah dibuat mutan resisten rifampisin ditumbuhkan di media TSA yang mengandung 1% susu skim untuk uji protease dan mengandung 1% pati terlarut untuk uji amilase. Aktivitas proteolitik dan amilolitik ditandai dengan adanya zona bening di sekeliling isolat yang ditumbuhkan pada masing-masing media. Indeks proteolitik dan amilolitik diukur dengan menggunakan rumus menurut Lim et al. (1987). Pengujian ini bertujuan untuk mengukur besarnya aktivitas proteolitik dan amilolitik dari isolat PTB 1.4 yang telah dibuat menjadi resisten rifampisin.
6
Kurva Pertumbuhan
Kurva pertumbuhan bakteri probiotik yang telah dimutankan dilakukan untuk melihat pengaruh mutasi terhadap pertumbuhan bakteri. Satu koloni tunggal diinokulasikan kedalam 20 mL media cair TSB (Triptic Soy Broth) dan diinkubasi selama 24 jam pada suhu 28 °C. Sebanyak 10 mL kultur diinokulasikan kedalam 90 mL media TSB steril dan dishaker dengan kecepatan 120 rpm selama 24 jam pada suhu 28 °C. Pengamatan pertumbuhan bakteri dilakukan setiap 2 jam dengan mengukur nilai kerapatan optik pada panjang gelombang 620 nm dan jumlah bakteri dihitung dengan menggunakan teknik TPC (Total Plate Count) yang disebar pada media TSA.
Uji Patogenisitas
Uji patogenisitas dilakukan dengan cara menyuntikan bakteri probiotik PTB 1.4, bakteri probiotik PTB 1.4 RfR (resisten rifampisin), bakteri patogen ikan lele
Aeromonas hydrophila sebagai kontrol positif, masing-masing dengan konsentrasi 108 cfu/mL dan kontrol negatif dengan menggunakan PBS (Phosphate Buffered Saline) yang disuntikan sebanyak 0.1 mL secara intramuskular. Ikan dipelihara dalam akuarium ukuran 60×30×30 cm3 dengan kepadatan 10 ekor per akuarium dengan bobot rata-rata 5.57±0.52 g. Setiap perlakuan terdiri atas 3 ulangan dan diamati selama 14 hari terhadap kelangsungan hidup ikan.
Uji Viabilitas Bakteri Probiotik pada Pakan
Bakteri ditumbuhkan pada media TSB hingga mencapai kepadatan 108 cfu/mL. Bakteri kemudian disentrifugasi pada kecepatan 5000×g selama 30 menit. Endapan yang terbentuk kemudian ditambahkan dengan PBS sebanyak 1 mL dan diresuspensi. Sebanyak 1 mL bakteri probiotik dicampurkan kedalam 100 g pakan kemudian diaduk secara merata dan ditambahkan dengan putih telur sebanyak 2% sebagai perekat. Pakan kemudian dikering anginkan pada suhu ruang.
Uji viabilitas probiotik pada pakan dilakukan pada dua pakan uji yaitu pakan uji gnotoplus dan normalplus. Pakan uji gnotoplus adalah pakan uji yang ditambahkan dengan probiotik 1%, rifampisin 100 µg/mL dan putih telur 2%, sedangkan pakan uji normalplus adalah pakan yang ditambahkan dengan probiotik sebesar 1% dan putih telur 2%.
7
Bioassai Bakteri Kandidat Probiotik pada Ikan Lele
Persiapan kultur bakteri
Bakteri probiotik PTB 1.4 RfR ditumbuhkan pada media TSB, diinkubasi pada suhu 28 °C dan dishaker dengan kecepatan 120 rpm selama 12 jam. Bakteri ditumbuhkan hingga mencapai kepadatan sel 108 cfu/mL.
Persiapan pakan uji
Pakan uji yang digunakan dalam penelitian ini merupakan pakan standar untuk ikan lele dengan kandungan protein 31-33% (Lampiran 1). Pakan standar yang digunakan terlebih dahulu disterilisasi pada suhu 121°C selama 15 menit. Penambahan probiotik dan rifampisin kedalam pakan disesuaikan dengan perlakuan. Kepadatan bakteri probiotik yang dicampurkan kedalam pakan sebesar 1010 cfu/mL. Terdapat empat pakan uji yang digunakan dalam penelitian ini yaitu: pakan uji gnoto (pakan ditambahkan dengan rifampisin 100 µg/mL dan putih telur 2%), pakan uji gnotoplus (pakan ditambahkan dengan probiotik 1%, rifampisin 100 µg/ml dan putih telur 2%), pakan uji normalplus (pakan ditambahkan dengan probiotik sebesar 1% dan putih telur 2%), dan pakan uji normal (pakan ditambahkan putih telur 2% tanpa penambahan probiotik dan rifampisin). Pakan uji yang digunakan dibuat setiap 10 hari pemeliharaan, dan pakan uji disimpan di dalam lemari pendingin dengan suhu 4 °C.
Persiapan hewan uji dan ikan lele gnotobiotik
Ikan uji yang digunakan dalam penelitian ini berasal dari pembudidaya ikan lele yang berada di Bogor. Ikan lele diaklimatisasi selama satu minggu sebelum digunakan sebagai hewan uji dan diberikan pakan standar selama proses aklimatisasi.
Pada uji pengaruh probiotik terhadap ikan lele, digunakan dua perlakuan ikan uji yaitu ikan lele normal dan ikan lele gnotobiotik. Ikan lele gnotobiotik adalah ikan lele yang tidak mengandung bakteri baik pada luar tubuh maupun pada saluran pencernaannya. Pembuatan ikan lele gnotobiotik dilakukan berdasarkan metode Faturrahman (2012). Pembuatan ikan lele gnotobiotik dilakukan dengan cara desinfeksi terhadap peralatan, air pemeliharaan dan akuarium yang digunakan sebagai wadah pemeliharaan dengan larutan klorin 50-100 ppm. Kemudian dimasukkan sebanyak 15 ekor ikan lele kedalam masing-masing akuarium. Selanjutnya air pemeliharaan ikan lele dalam akuarium ditambahkan dengan antibiotik (ampicilin 250 mg/L, rifampisin 125 mg/L, chlorampenikol 250 mg/L) untuk mereduksi bakteri yang ada pada bagian luar tubuh ikan. Selanjutnya ikan lele dipuasakan selama 24 jam dan diberi perlakuan pemberian pakan yang mengandung antibiotik (rifampisin 100 µg/ml) untuk mereduksi bakteri yang terdapat pada saluran pencernaan selama 4 hari. Setelah perlakuan pemberian antibiotik, air pemeliharaan diganti dengan air baru yang juga telah didesinfeksi.
Uji pertumbuhan ikan lele
8
wadah pemeliharaan. Uji pertumbuhan ikan lele dilakukan dengan 4 perlakuan dan 3 ulangan yang masing-masing akuarium berisi 15 ekor ikan lele. Perlakuan dalam penelitian ini terdiri atas perlakuan Gnoto = ikan lele gnotobiotik diberi pakan uji gnoto, Gnotoplus = ikan lele gnotobioik diberi pakan uji gnotoplus, Normalplus = ikan lele normal diberi pakan uji normalplus dan Normal = ikan lele normal diberi pakan uji normal.
Pemeliharaan dilakukan selama 30 hari dan diberi pakan dengan frekuensi pemberian pakan 3 kali dalam sehari secara at satiation. Penyiponan terhadap feses ikan dan sisa pakan yang tidak dikonsumsi dilakukan setiap hari untuk menjaga kualitas air pemeliharaan. Pergantian air sebanyak 50% dilakukan setiap 3 hari sekali selama pemeliharaan.
Populasi Mikroflora Intestinal
Analisis populasi mikroflora intestinal dilakukan dengan menggunakan ikan lele yang sama pada uji pertumbuhan. Setelah 30 hari pemeliharaan, masing-masing perlakuan diambil sebanyak dua ekor ikan untuk diambil bagian saluran pencernaan. Saluran pencernaan ikan lele sebanyak 1 g digerus, kemudian dilakukan serial pengenceran menggunakan larutan NaCl 0.85%. Metode yang digunakan dalam perhitungan mikroflora intestinal adalah dengan menggunakan metode cawan sebar. Hasil sampel yang telah diencerkan disebar pada media TSA untuk mengetahui jumlah total bakteri dan media TSA yang mengandung rifampisin 100 µg/mL untuk mengetahui jumlah bakteri probiotik yang berada pada saluran pencernaan ikan lele pada masing-masing perlakuan.
Analisis Aktivitas Enzim Protease dan Amilase Saluran Pencernaan
Analisis aktivitas enzim protease dan amilase saluran pencernaan dilakukan setelah 30 hari pemeliharaan. Dua ekor ikan dari masing-masing perlakuan diambil dan ditimbang saluran pencernaannya sebanyak 1 g. Saluran pencernaan digerus kemudian ditambahkan dengan bufer fosfat 0.05 M pH 7.5 sebanyak 5 mL dan dihomogenasikan. Sampel disentrifugasi dengan kecepatan 6000×g pada suhu 4 °C selama 30 menit, ekstrak yang didapat selanjutnya dilakukan analisis aktivitas enzim. Analisis aktivitas enzim protease dilakukan berdasarkan metode Walter (1984) yang telah dimodifikasi menggunakan kasein sebagai substrat dan direaksikan dengan reagent Folin. Analisis aktivitas enzim amilase dilakukan berdasarkan metode Bernfeld (1955) menggunakan pati sebagai substrat dan direaksikan dengan 3,5-dinitrosalicylic acid (DNS).
Pengukuran Aktivitas Protease
9
kasar enzim pada tabung blanko dan kontrol serta akuades pada tabung sampel sebanyak 50 µL. Campuran tersebut diinkubasi selama 10 menit pada suhu 37 °C dan disentrifugasi dengan kecepatan 9000×g selama 15 menit. Supernatan yang terbentuk sebanyak 375 µL ditambahkan dengan Na2CO3 1.25 mL dan reagen Folin Cicalteau (1:2) 250 µL (Lampiran 4). Campuran diinkubasi selama 37 °C selama 20 menit. Aktivitas enzim protease diukur dengan spektrofotometer pada panjang gelombang 578 nm. Satu unit aktivitas enzim adalah jumlah enzim yang dibutuhkan untuk menghasilkan 1 µmol tirosin per menit pada kondisi pengukuran.
Pengukuran Aktivitas Amilase
Pengukuran aktivitas amilase dilakukan dengan menggunakan metode Bernfeld (1955) (Lampiran 3). Sebanyak tiga tabung reaksi disediakan dalam pengukuran aktivitas amilase yang terdiri atas sampel, kontrol dan blanko. Tabung sampel ditambahkan dengan 0.5 mL enzim kedalam substrat yang telah dilarutkan dalam bufer fosfat 0.05 M, pH 7.5 sebanyak 0.5 mL, diinkubasi selama 10 menit dan selanjutnya ditambahkan 1 mL reagen asam 3,5-dinitrosalisilat acid (DNS). Tabung kontrol dibuat dengan menggunakan komposisi yang sama tetapi enzim ditambahkan setelah pemberian reagen DNS (Lampiran 4), sedangkan tabung blanko ditambahkan dengan akuades. Tabung sampel, kontrol dan blanko dididihkan selama 5 menit untuk menghentikan reaksi dan hasil yang didapatkan diukur dengan menggunakan spektrofotometer pada panjang gelombang 550 nm. Satu unit aktivitas enzim adalah jumlah enzim yang dibutuhkan untuk menghasilkan 1 µmol gula pereduksi per menit pada kondisi pengukuran.
Analisis Kecernaan
Analisi kecernaan dilakukan dengan menambahkan kromium (Cr2O3) dalam pakan. Penambahan kromium dalam pakan digunakan sebagai indikator kecernaan. Ikan uji yang digunakan dalam analisis kecernaan diberikan pakan perlakuan yang telah mengandung kromium (Cr2O3)sebanyak 0.6%. Feses selama pemeliharaan dikumpulkan dengan cara penyiponan dan disimpan di dalam lemari pendingin hingga dilakukan analisis. Feses yang telah dikumpulkan dikeringkan di dalam oven dengan suhu 110 °C selama 4-6 jam. Selanjutnya dilakukan analisa kandungan kromium dan nutrien yang terdapat dalam feses dengan menggunakan spektrofotometer pada panjang gelombang 350 nm. Nilai kecernaan total dan kecernaan nutrien dihitung dengan persamaan (Takeuchi 1988):
Kecernaan total = 100 – (% Cr2O3 pada pakan / % Cr2O3 pada feses × 100) Kecernaan nutrien = 100 – [((% Cr2O3 pada pakan / % Cr2O3 padafaeces ×
10
Parameter Pertumbuhan
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup dihitung dari jumlah ikan yang hidup pada awal dan akhir pemeliharaan. Parameter tersebut dihitung dengan menggunakan rumus:
Laju pertumbuhan spesifik diamati selama perlakuan. Laju pertumbuhan spesifik ikan dihitung dari data bobot yang didapat pada kegiatan sampling. Laju pertumbuhan spesifik dihitung dengan menggunakan rumus (Huisman 1987):
LPS (%) =
Keterangan: LPS = Laju pertumbuhan spesifik (%)
Wt = Bobot rata-rata individu waktu ke-t (g/ekor) Wo = Bobot rata-rata individu waktu ke-0 (g/ekor) t = Lama pemeliharaan (hari)
Rasio Konversi Pakan
Rasio konversi pakan diamati selama pemeliharaan dengan menghitung jumlah pakan yang dihabiskan selama pemeliharaan. Rasio konversi pakan dihitung dengan menggunakan rumus (Zonneveld et al. 1991):
RKP =
Keterangan: RKP = Rasio konversi pakan
F = Jumlah pakan yang dikonsumsi selama pemeliharaan (g) Wt = Bobot ikan pada akhir pemeliharaan (g)
Wo = Bobot ikan pada awal pemeliharaan (g)
11
HASIL DAN PEMBAHASAN
Hasil
Pembuatan Mutan Resisten Rifampisin
Isolat bakteri PTB 1.4 tipe liar sensitif rifampisin dengan kepadatan sel 108 cfu/mL ditumbuhkan pada media TSA+Rf. Koloni mutan yang tumbuh diuji aktivitas proteolitik dan amilolitik serta laju pertumbuhannya. Isolat PTB 1.4 RfR (resisten rifampisin) memiliki aktivitas proteolitik dan amilolitik yang ditandai dengan adanya zona bening (Gambar 1a, b). Zona bening yang terbentuk merupakan hasil hidrolisis bakteri terhadap media yang ditambahkan susu skim untuk uji protease atau pati untuk uji amilase. Indeks proteolitik dari PTB 1.4 RfR sebesar 1.071 dan indeks amilolitik sebesar 0.581.
a b
Gambar 1 Zona bening yang terbentuk setelah inkubasi 24 jam pada suhu 28 °C pada media TSA yang mengandung, a. 1% susu skim, b. 1% pati
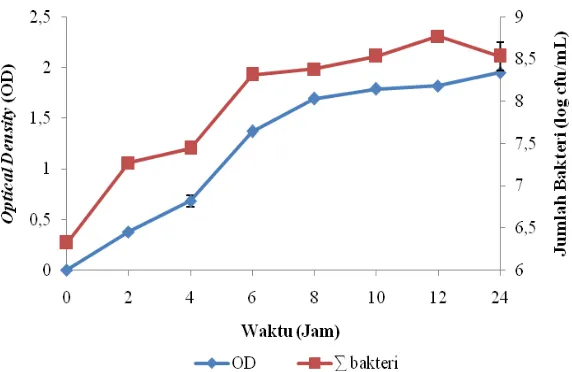
Kurva pertumbuhan bakteri PTB 1.4 RfR dilakukan dengan mengamati jumlah sel bakteri dan kerapatan optik (Optical Density = OD). Kurva pertumbuhan dari bakteri PTB 1.4 RfR memiliki fase lag pada jam ke 0 sampai jam ke 2, fase eksponensial pada jam ke 2 sampai jam ke 12 dan fase stasioner pada jam ke 12 sampai jam ke 24 (Gambar 2).
Uji Patogenisitas
12
Gambar 2 Kurva pertumbuhan isolat bakteri PTB 1.4 RfR pada media TSA Tabel 1. Hasil uji patogenisitas bakteri probiotik pada ikan lele
Perlakuan Tingkat Kelangsungan Hidup (%)
Kontrol negatif 100.0
Kontrol positif 3.3
PTB 1.4 100.0
PTB 1.4 RfR 100.0
Viabilitas Bakteri Probiotik dalam Pakan
Uji viabilitas bakteri probiotik yang terdapat pada pakan selama pengamatan menunjukkan bahwa bakteri probiotik yang ditambahkan kedalam pakan mampu bertahan hidup. Probiotik yang terdapat pada pakan perlakuan gnotoplus dan normalplus mampu mencapai kepadatan 106 cfu/g pakan setelah disimpan didalam lemari pendingin pada suhu 4 °C selama 10 hari (Tabel 2). Tabel 2. Hasil uji viabilitas bakteri PTB 1.4 RfR dalam pakan setelah
penyimpanan Pakan perlakuan
Total bakteri probiotik pada pakan (cfu/g) pada hari ke-
1 5 10
Pakan uji gnotoplus 8.4×106 2.3×106 1.1×106
Pakan uji normalplus 1.2×107 9.4×106 1.1×106
Bioassai Bakteri Probiotik pada Ikan Lele
Populasi Mikroflora Intestinal
13
diantara perlakuan gnoto (2.24±0.41×105 cfu/g) dengan gnotoplus (5.90±2.32×105 cfu/g) dan antara perlakuan normalplus (32.90±4.74×105 cfu/g) dengan normal (36.33±7.51×105 cfu/g). Bakteri probiotik pada saluran pencernaan ikan pada perlakuan normalplus (5.99±0.57×105 cfu/g) berbeda nyata dengan total bakteri probiotik pada saluran pencernaan ikan perlakuan gnotoplus (3.29±0.78×105 cfu/g) (Tabel 3).
Tabel 3. Total bakteri dan bakteri probiotik pada saluran pencernaan ikan lele setelah pemeliharaan 30 hari
Perlakuan Total bakteri (105 cfu/g) Bakteri probiotik (105 cfu/g)
Gnoto 2.24±0.41a -
Gnotoplus 5.90±2.32a 3.29±0.78a
Normalplus 32.90±4.74b 5.99±0.57b
Normal 36.33±7.51b -
Keterangan: huruf yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (uji jarak berganda Duncan; p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Analisis Aktivitas Enzim Protease dan Amilase Saluran Pencernaan
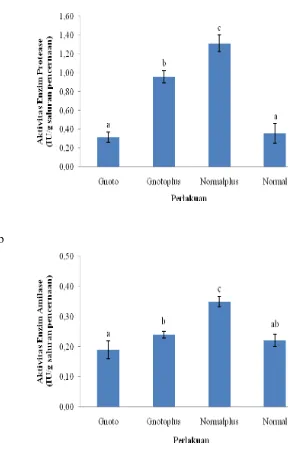
Perlakuan pemberian bakteri probiotik dalam pakan selama 30 hari pemeliharaan memberikan pengaruh terhadap aktivitas enzim pencernaan pada saluran pencernaan ikan uji. Nilai aktivitas enzim protease tertinggi terdapat pada perlakuan normalplus (1.32±0.09 IU/g saluran pencernaan) yang berbeda nyata dengan perlakuan gnotoplus (0.96±0.06 IU/g saluran pencernaan), normal (0.36±0.11 IU/g saluran pencernaan) dan gnoto (0.32±0.05 IU/g saluran pencernaan). Sama halnya dengan aktivitas protease, dimana akitivitas enzim amilase tertinggi terdapat pada perlakuan normalplus (0.35±0.02 IU/g saluran pencernaan) yang berbeda nyata dengan perlakuan gnotoplus (0.24±0.01 IU/g saluran pencernaan), normal (0.22±0.02 IU/g saluran pencernaan) dan gnoto (0.19±0.03 IU/g saluran pencernaan) (Gambar 3a, 3b).
Kecernaan Pakan
Nilai kecernaan pakan yang tinggi menunjukkan bahwa ikan mampu mencerna nutrisi pakan dengan baik. Nilai kecernaan total tertinggi terdapat pada perlakuan normalplus sebesar 76.90±0.98% yang berbeda nyata dengan perlakuan gnoto dan normal namun tidak berbeda nyata dengan perlakuan gnotoplus. Nilai kercernaan protein tertinggi terdapat pada perlakuan normalplus 93.22±0.99% yang berbeda nyata dengan perlakuan lainnya (Tabel 4).
Tabel 4. Kecernaan total (Ktn) dan kecernaan protein (Kprot) ikan lele yang diberi pakan perlakuan
Parameter Perlakuan
14
a
b
Gambar 3 Aktivitas enzim pencernaan pada saluran pencernaan ikan lele setelah 30 hari pemeliharaan. Huruf yang berbeda di tiap bar menunjukkan pengaruh perlakuan yang berbeda nyata secara statistik (p<0.05). (a) Aktivitas enzim protease, (b) Aktivitas enzim amilase
Parameter Pertumbuhan
15
(1.05±0.11) juga diperoleh pada perlakuan normalplus yang berbeda nyata dengan perlakuan lainnya (Tabel 5).
Tabel 5. Tingkat kelangsungan hidup (TKH), laju pertumbuhan spesifik (LPS) dan rasio konversi pakan (RKP) ikan uji
Parameter Perlakuan
Gnoto Gnotoplus Normalplus Normal
TKH (%) 100±0.00a 100±0.00a 100±0.00a 100±0.00a LPS (%) 1.92±0.23a 2.11±0.19a 2.69±0.36b 1.98±0.23a RKP 1.77±0.12a 1.66±0.15a 1.05±0.11b 1.49±0.23a Keterangan: huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (uji jarak berganda Duncan; p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Pembahasan
Saluran pencernaan merupakan ekosistem yang kaya dengan nutrien yang mampu dimanfaatkan oleh bakteri sebagai sumber nutrisi. Bakteri dalam saluran pencernaan ikan memiliki populasi yang beragam dan dapat berkontribusi dalam mencerna makanan, penyerapan nutrien serta memberikan resistensi terhadap penyakit infeksius dengan memproduksi zat-zat antimikroba yang berperan dalam mencegah infeksi bakteri patogen pada tubuh inang. Isolasi bakteri yang berasal dari saluran pencernaan dapat dimanfaatkan sebagai probiotik. Menurut Balcazar
et al. (2006) bakteri probiotik yang baik adalah bakteri yang berasal dari saluran pencernaan inang dan berasal dari spesies yang sama. Probiotik dalam akuakultur merupakan mikroba hidup yang menguntungkan bagi inang dengan memodifikasi hubungan komunitas mikroba yang dapat berasosiasi dengan inang atau lingkungannya dalam meningkatkan penggunaan pakan atau nilai nutrisi, meningkatkan respon imun inang terhadap penyakit ataupun meningkatkan kualitas perairan (Verschuere et al. 2000). Bakteri probiotik yang diisolasi dari saluran pencernaan pada spesies yang sama memiliki kelebihan dalam beradaptasi dengan lingkungan saluran pencernaan ketika diaplikasikan pada spesies yang sama.
Isolat bakteri PTB 1.4 merupakan bakteri Bacillus megaterium yang diisolasi dari saluran pencernaan ikan lele. Bakteri PTB 1.4 memiliki kemampuan dalam menghasilkan enzim-enzim pencernaan yaitu protease dan amilase, dan mampu mendegradasi pakan (Hamtini et al. 2015) serta tidak bersifat patogen.
Bacillus merupakan bakteri yang memiliki kemampuan dalam menghasilkan enzim-enzim pencernaan, antibiotik dan vitamin yang mampu memberikan keuntungan bagi inang. Bakteri probiotik dalam akuakultur telah banyak digunakan dan diketahui memberikan manfaat yang menguntungkan bagi kegiatan budidaya. Kemampuan bakteri PTB 1.4 dalam menghasilkan enzim-enzim pencernaan dan mampu mendegradasi pakan dapat memberikan manfaat dalam mengatasi masalah dalam akuakultur yaitu kecernaan pakan yang berpengaruh terhadap efisiensi penggunaan pakan.
16
pengujian keberadaan bakteri PTB 1.4 dalam uji in vivo, digunakan bakteri PTB 1.4 yang telah dibuat resisten terhadap antibiotik rifampisin. Perlakuan pembuatan mutasi resisten rifampisin pada bakteri PTB 1.4 bertujuan sebagai penanda molekuler yang berfungsi untuk melacak keberadaan bakteri probiotik pada saluran pencernaan ikan lele. Pengujian aktivitas proteolitik dan amilolitik terhadap bakteri PTB 1.4 RfR (resisten rifampsin) dilakukan untuk mengetahui pengaruh mutasi terhadap aktivitas enzim yang dihasilkan dan pertumbuhan bakteri. Berdasarkan hasil pengamatan aktivitas proteolitik dan amilolitik pada isolat PTB 1.4 RfR memiliki indeks aktivitas proteolitik 1.07 dan amilolitik 0.58. Hasil uji proteolitik dan amilolitik pada bakteri isolat PTB 1.4 RfR yang didapatkan tidak berbeda signifikan dengan isolat PTB 1.4 tipe liar dengan nilai indeks proteolitik 0.6 dan amilolitik 0.61 (Hamtini et al. 2015). Hal ini menunjukkan bahwa perlakuan mutan resisten rifampisin bakteri PTB 1.4 tidak memberikan pengaruh terhadap aktivitas proteolitik dan amilolitik dimana bakteri masih memiliki aktivitas dalam menghasilkan enzim seperti tipe liarnya. Faturrahman (2012) dalam penelitiannya melakukan mutasi resisten rifampisin terhadap bakteri probiotik agarolitik menyatakan bahwa perlakuan resistensi antibiotik tidak memberikan pengaruh terhadap aktivitas enzim agarase yang dihasilkan oleh bakteri probiotik.
Zona bening yang terbentuk dalam uji proteolitik dan amilolitik menunjukkan bahwa bakteri PTB 1.4 mampu menghasilkan enzim protease dan amilase. Susu skim yang terdapat pada media mampu terdegradasi dan menghasilkan zona bening. Zona bening pada media susu skim menunjukkan produksi enzim protease oleh bakteri PTB 1.4. Enzim protease merupakan enzim yang mampu menghidrolisis ikatan peptida pada protein menjadi oligopeptida dan asam amino (Fatoni et al. 2008). Amilase merupakan enzim yang mampu memecah karbohidrat menjadi maltosa atau glukosa. Kemampuan Bacillus dalam menghasilkan enzim-enzim pencernaan (protease, amilase, lipase) mampu dihasilkan secara bersamaan. Yanbo dan Zirong (2006), menggunakan Bacillus
sp. sebagai probiotik dimana diketahui mampu menghasilkan enzim-enzim pencernaan yaitu protease, amilase dan lipase yang diproduksi secara bersamaan oleh Bacillus sp. yang mampu meningkatkan pertumbuhan ikan mas.
Pengamatan fase pertumbuhan pada bakteri probiotik dilakukan dengan mengamati jumlah sel dan kerapatan optik (OD). Pengamatan fase pertumbuhan dilakukan untuk menentukan pemanenan sel dalam aplikasi. Isolat PTB 1.4 mencapai fase stasioner pada jam ke- 12. Pengamatan terhadap fase pertumbuhan dilakukan karena berhubungan dengan kemampuan sel dalam memproduksi suatu produk seperti spora dan senyawa metabolit antara lain enzim, antimikrob, vitamin, asam organik, asam lemak serta asam amino. Pada umumnya Bacillus
memproduksi spora pada fase stasioner. Kelebihan Bacillus dalam menghasilkan spora dapat dimanfaatkan dalam aplikasi probiotik dimana probiotik yang digunakan harus memiliki kemampuan bertahan dalam proses produksi dan aplikasi.
17
dengan nilai viabilitas bakteri mencapai 106 cfu/g pakan setelah proses penyimpanan selama 10 hari dalam lemari pendingin. Hal ini menunjukkan bahwa bakteri PTB 1.4 mampu bertahan hidup dalam pakan. Bakteri Bacillus memiliki kelebihan dalam menghasilkan spora sebagai strategi dalam bertahan hidup pada lingkungan yang tidak menguntungkan (Toldar 2009). Pakan memiliki kondisi yang tidak sesuai bagi pertumbuhan sel bakteri. Kemampuan Bacillus dalam menghasilkan spora membantu bakteri bertahan hidup dalam pakan. Pakan dijadikan sebagai tempat bertahan hidup bagi bakteri hingga pakan dapat termakan oleh ikan dan menyebabkan spora bakteri masuk kedalam saluran pencernaan ikan yang kaya akan nutrisi. Spora bakteri pada saluran pencernaan yang kaya akan nutrisi akan menjadi sel vegetatif yang dapat berkolonisasi pada saluran pencernaan inang dan mampu memberikan pengaruh yang menguntungkan bagi inang. Spora merupakan bentuk sel dorman yang akan bergerminasi menjadi sel vegetatif ketika berada pada kondisi yang sesuai dengan kebutuhan nutrisi bakteri untuk tumbuh (Hong et al. 2005).
Bakteri probiotik yang digunakan harus aman atau tidak bersifat patogen terhadap inang (Balcazar et al. 2006). Uji patogenisitas bakteri probiotik terhadap inang dapat dilakukan melalui metode penyuntikan (Verschuere et al. 2000).
Aeromonas hydrophila digunakan sebagai kontrol positif untuk perlakuan pembanding. Bakteri A. hydrophila merupakan bakteri patogen bagi ikan lele yang mampu menyebabkan nekrosis pada bagian tubuh ikan yang disuntikan. Bakteri PTB 1.4 dan PTB 1.4 RfR tidak bersifat patogen berdasarkan hasil uji patogenisitas dengan nilai kelangsungan hidup sebesar 100% dan bersifat aman bagi inang.
Pada bioassai bakteri probiotik digunakan perlakuan antibiotik pada ikan lele yang disebut sebagai ikan lele gnotobiotik dan tanpa perlakuan antibiotik yang disebut sebagai ikan lele normal. Gnotobiotik adalah organisme yang tidak mengandung bakteri baik pada bagian luar maupun pada bagian saluran pencernaan. Perlakuan gnotobiotik digunakan sebagai pendekatan untuk mengetahui pengaruh pemberian bakteri probiotik terhadap inang (Prioult et al. 2003).
Jumlah total bakteri yang terdapat pada saluran pencernaan ikan setelah diberikan pakan yang mengandung probiotik pada perlakuan normalplus menunjukkan adanya penurunan jumlah total bakteri dibandingkan dengan perlakuan normal. Hasil yang sama didapatkan pada penelitian Bagheri et al.
18
pencernaan ikan pada perlakuan normal yang tanpa diberikan probiotik. Hal ini dikarenakan probiotik berfungsi dalam meningkatkan keseimbangan mikroba dalam saluran pencernaan (Fuller 1989).
Bakteri probiotik harus memiliki kemampuan dalam bertahan pada kondisi saluran pencernaan dan mampu berkolonisasi di saluran pencernaan inang. Kondisi saluran pencernaan memiliki kondisi pH yang rendah dan adanya garam empedu menyebabkan tidak semua bakteri mampu bertahan pada kondisi tersebut. Bakteri Bacillus memiliki kemampuan dalam menghasilkan spora pada kondisi yang tidak menguntungkan. Bacillus mampu bertahan dalam saluran pencernaan dengan menghasilkan spora dan kembali menjadi sel vegetatif ketika berada pada kondisi yang memungkinkan untuk hidup dan bereplikasi kembali (Hong et al. 2005). Bakteri PTB 1.4 yang terdapat pada saluran pencernaan ikan pada perlakuan normalplus mampu berkolonisasi sebanyak 18% dari total bakteri, sedangkan pada perlakuan gnotoplus, bakteri PTB 1.4 mampu berkolonisasi sebesar 55% dari total bakteri yang terdapat pada saluran pencernaan ikan. Tingginya persentase bakteri PTB 1.4 pada saluran pencernaan ikan gnotoplus dikarenakan pada ikan gnotoplus telah dilakukan perlakuan pembersihan saluran pencernaan dari bakteri dengan menggunakan perlakuan antibiotik (gnotobiotik). Adanya perlakuan antibiotik ini menyebabkan turunnya populasi mikroflora normal pada saluran pencernaan sehingga bakteri PTB 1.4 lebih mudah dalam berkolonisasi pada saluran pencernaan. Jumlah bakteri probiotik PTB 1.4 yang terdeteksi pada saluran pencernaan menunjukkan bahwa bakteri probiotik PTB 1.4 mampu berkolonisasi di saluran pencernaan ikan, dimana salah satu syarat penting bakteri probiotik adalah memiliki kemampuan dalam berkolonisasi pada saluran pencernaan inang (Balcazar et al. 2006).
Bakteri probiotik memiliki kemampuan dalam menghasilkan enzim-enzim pencernaan yang dapat membantu ikan dalam memanfaatkan nutrien pakan dan pencernaan (Bairagi et al. 2002). Aktivitas enzim saluran pencernaan ikan pada perlakuan normalplus memiliki nilai tertinggi. Sama halnya dengan perlakuan gnotoplus yang menunjukkan nilai aktivitas enzim protease dan amilase yang berbeda nyata dengan perlakuan normal dan gnoto. Aktivitas enzim pada perlakuan gnoto menunjukkan nilai aktivitas enzim endogenus yang berasal dari inang sedangkan nilai aktivitas enzim pada perlakuan normal menunjukkan aktivitas enzim endogenus dan peran dari mikroflora normal saluran pencernaan. Mikroflora dalam saluran pencernaan membantu inang dalam mencerna pakan dengan memproduksi bahan-bahan aktif seperti enzim, asam amino dan vitamin (Sugita et al. 1997). Namun peran dari enzim endogenus dan mikroflora belum dapat memberikan kontribusi yang besar pada nilai aktivitas enzim saluran pencernaan jika dibandingkan dengan perlakuan normalplus dan gnotoplus yang ditambahkan dengan probiotik. Tingginya nilai aktivitas enzim saluran pencernaan ikan pada perlakuan normalplus dan gnotoplus diduga merupakan kontribusi bakteri probiotik PTB 1.4 dan mikroflora saluran pencernaan dalam meningkatkan aktivitas enzim pencernaan dengan cara mensintesis serta menstimulasi produksi enzim-enzim pencernaan. Menurut Ziaei-Nejad et al.
19
mekanisme dari bakteri probiotik dalam menstimulasi sintesis endogenus enzim pencernaan yang diproduksi oleh ikan (Ziaei-Nejad et al. 2006).
Ikan lele gnotobiotik yang diberi perlakuan pakan plus probiotik (gnotoplus) menunjukkan aktivitas enzim protease dan amilase yang lebih tinggi dibandingkan dengan perlakuan ikan lele gnotobiotik tanpa probiotik (gnoto). Hal ini menunjukkan bahwa bakteri PTB 1.4 mampu berkolonisasi pada saluran pencernaan ikan lele gnotobiotik (gnotoplus) sehingga memberikan pengaruh dalam meningkatkan aktivitas enzim pencernaan pada saluran pencernaan ikan. Bates et al. (2006) menyatakan bahwa larva ikan zebra gnotobiotik memiliki kemampuan yang lebih rendah dibandingkan dengan larva ikan zebra normal dalam mengambil atau menyerap makromolekul protein. Hal ini menunjukkan bahwa mikroflora dalam saluran pencernaan juga memiliki peran dalam mensintesis dan menstimulasi enzim-enzim pencernaan serta membantu ikan dalam menyerap nutrisi pakan seperti protein.
Pakan ikan mengandung protein yang cukup tinggi dan merupakan komponen utama dalam pakan serta sebagai sumber energi utama bagi ikan. Pakan yang masuk ke dalam saluran pencernaan ikan akan didegradasi oleh bakteri probiotik dengan menghasilkan enzim-enzim pencernaan seperti protease untuk mendegradasi protein dan amilase untuk mendegradasi karbohidrat. Ketersediaan substrat dalam saluran pencernaan mampu meningkatkan enzim eksogenus dan endogenus dalam saluran pencernaan. Pakan yang masuk ke dalam saluran pencernaan ikan akan dicerna oleh ikan dengan bantuan enzim eksogenus dari bakteri probiotik dan enzim endogenus yang dihasilkan oleh ikan. Nutrisi dalam pakan yang telah dicerna akan diserap oleh ikan.
20
diberi penambahan probiotik dan prebiotik dalam pakan yang mampu meningkatkan kecernaan protein dan kecernaan total sebesar 91.17% dan 66.92% (Marlida et al. 2014). Menurut Watanabe (1988) nilai kecernaan protein ikan dapat mencapai 80-95%, kecernaan pati mencapai 40-60% dan kecernaan lemak 82-97%.
Kemampuan ikan dalam mencerna protein dengan baik dapat meningkatkan pertumbuhan ikan dikarenakan protein merupakan nutrien penting yang terdapat dalam pakan ikan yang berperan sebagai sumber energi utama bagi ikan (Aslamyah 2006). Kemampuan bakteri PTB 1.4 dalam menghasilkan enzim protease dan amilase mampu membantu ikan dalam memecah nutrien dalam pakan menjadi senyawa yang lebih sederhana sehingga mudah diserap oleh ikan dan membantu ikan dalam meningkatkan pertumbuhan.
Aktivitas enzim saluran pencernaan dan kecernaan pakan yang tinggi mampu mempengaruhi pertumbuhan serta efisiensi pakan pada ikan. Pemberian probiotik mampu meningkatkan pertumbuhan sebesar 35% pada perlakuan normalplus dibandingkan dengan normal dan meningkatkan pertumbuhan sebesar 10% pada perlakuan gnotoplus dibandingkan dengan perlakuan gnoto berdasarkan nilai LPS. Hal ini menunjukkan bahwa bakteri probiotik PTB 1.4 berperan dalam meningkatkan pertumbuhan ikan lele melalui pemanfaatan nutrien pakan dengan menghasilkan enzim-enzim pencernaan. Balcazar et al. (2006) menyatakan salah satu mekanisme aksi (mode of action) dari probiotik akuakultur adalah untuk menghasilkan efek yang menguntungkan bagi inang dalam menyediakan nutrisi esensial dan membantu sistem pencernaan inang melalui penyedia enzim-enzim pencernaan. Enzim-enzim pencernaan membantu ikan dalam mendegradasi dan mencerna nutrien dalam pakan, sehingga memudahkan ikan dalam menyerap nutrien dalam pakan. Peningkatan aktivitas enzim dan kecernaan pakan mampu meningkatkan pertumbuhan ikan. Kecernaan pakan yang tinggi selain dapat meningkatkan pertumbuhan, kecernaan dapat meningkatkan efisiensi penggunaan pakan berdasarkan parameter rasio konversi pakan. Rasio konversi pakan pada perlakuan normalplus lebih baik dibandingkan dengan perlakuan normal. Sama halnya dengan perlakuan gnotoplus yang memiliki rasio konversi pakan lebih baik dibandingkan gnoto. Hasil yang sama diperoleh pada ikan nila yang diberi penambahan Bacillus NP5 dalam pakan yang mampu meningkatkan kecernaan dan pertumbuhan ikan (Putra dan Widanarni 2015).
21
SIMPULAN DAN SARAN
Simpulan
Pemberian bakteri probiotik Bacillus megaterium PTB 1.4 dalam pakan ikan lele berperan dalam menjaga keseimbangan populasi mikoflora intestinal, meningkatkan aktivitas enzim pencernaan dan pertumbuhan ikan lele.
Saran
Diperlukan penelitian lebih lanjut mengenai aplikasi bakteri probiotik
22
DAFTAR PUSTAKA
Aly SM, Yousef AGA, Ahlam AAG, Moahmed FM. 2008. Studies on Bacillus subtilis and Lactobacillus acidophilus, as potential probiotic, on the immune response and resistance of tilapia nilotica (Oreochromis niloticus) to challenge infection. J Fish Shellfish Immunol. 25:128-136.
Aslamyah S. 2006. Penggunaan mikroflora saluran pencernaan sebagai probiotik untuk meningkatkan pertumbuhan dan kelangsungan hidup ikan bandeng. [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Bagheri T, Hedayati SA, Yavari V, Alizade M, Farzanfar A. 2008. Growth, survival and gut microbial load of rainbow trout (Onchorhynchus mykiss) fry given diet supplemented with probiotic during the two months of first feeding. Turk J Fish Aquat Sci. 8:43-48.
Bairagi A, Shakar GK, Sen SK, Ray AK. 2002. Enzyme producing bacterial flora isolated from fish digestive tracts. Aquacult Int. 10:109-121.
Balcazar JL, de Blas I, Ruiz-Zarzuela I, Cunningham D, Vandrell D, Muzqiz JL. 2006. The role of probiotic in Aquaculture. [Review]. Vet Microbiol. 114:173-186.
Bates JM, Mittge E, Kuhlman J, Baden KN, Cheesman SE, Guillemin K. 2006. Distinct signals from the microbiota promote different aspects of zebrafish gut differentiation. Dev Biol. 297:374-386.
Bernfeld P. 1955. Amylases αand β: Method Enzymol. 1:149-158.
Chandran MN, Palanisamy I, Subramanian M, Ramasamy R., Santhiyagu P, Grasian I. 2014. Influence of probiotic bacterium Bacillus cereus isolated from gut of wild shrimp Penaeus monodon in turn as a potent growth promoter and immune enhancer in P. monodon. J Fish Shellfish Immunol. 36:38-45.
Fatoni A, Zusfahari, Lestari P. 2008. Isolasi dan karakterisasi protease ekstraseluler dari bakteri dalam limbah cair tahu. J Natur Indones. 10:83-88 Faturrahman. 2012. Potensi bakteri agarolitik sebagai penyedia enzim agarase
untuk memperbaiki pertumbuhan juvenil abalon (Haliotis asinina Linn. 1758). [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Faturrahman, Rohyati IS, Sukiman. 2015. Improved of growth rate of abalone
Haliotis asinine fed pudding probiotic-enriched protein. Proced Environ Sci. 23:315-322.
Fleming AB, Tangney M, Jorgensen PL, Diderrichsen B, Priest FG. 1995. Extracellular enzymes synthesis in a sporulation-deficient strain of Bacillus licheniformis. J Appl Environ Microbiol. 61:3775-3780.
Fuller R. 1989. Probiotic in man and animals. [Review]. J Appl Bacteriol. 23:315-322.
Ganguly S, Prasad A. 2012. Microflora in fish digestive tract plays significant role in digestion and metabolism. Rev Fish Biol Fisheries. 22:11-16
23
Gomez-Gill B, Roque A, Trunbull JF. 2000. The use and selection of probiotic bacteria for use in the culture of larval aquatic organism. Aquacult. 191:259-270. probiotic. FEMS Microbiol Rev. 29:813-835.
Lim G, Tan TK, Rahim NA. 1987. Variations in amylase and protease activities among Rhizopus isolates. Mircen J. 3:319-322.
Liu CH, Chiu CH, Wang SW, Cheng W. 2012. Dietary administration of the probiotic, Bacillus subtilis E20, enhances the growth, innate immune responses, and disease resistance of the grouper, Epinephelus coiodes. J Fish Shellfish Immunol. 33:699-706.
Marlida R. Suprayudi MA, Widanarni, Haris E. 2014. Growth, digestive enzyme activity and health status of humpback grouper (Cromileptes altivelis) fed with synbiotic. Pak J Nutr. 13:319-326.
Moriarty DJW. 1998. Control of luminous Vibrio species in penaeid aquaculture ponds. Aquacult. 164:351-358.
Mohapatra S, Chakraborty T, Prusty AK, Das P, Paniprasad K, Mohanta KN. 2012. Use different microbial probiotic in the diet of rohu, Labeo rohita
fingerlings: effect on growth, nutrient digestibility and retention, digestive enzyme activities and intestinal microflora. Aquacult Nutr. 18:1-11.
Nayak SK. 2010. Probiotic and immunity. [Review]. J Fish Shellfish Immunol. 29:2-14.
Putra AN, Widanarni. 2015. Screening of amylolitic bacteria as candidates of probiotics in tilapia (Oreochromis sp.). Res J Microbiol. 10:1-13.
Prioult G, Fliss I, Pecquet S. 2003. Effect of probiotic bacteria on induction and maintenance of oral tolerance to β-lactoglobulin in gnotobiotic mice. Clin Diagn Lab Immunol. 10:787-792.
Rengpipat S, Rukpratanporn S, Piyatitiratitivorakul S, Menasaveta P. 2000. Immunity enhancement in black tiger shrimp (Penaeus monodon) by a probiont bacterium (Bacillus S11). J Aquacult. 167:301-313.
Sugita H, Matsuo N, Hirose Y, Iwato M, Deguchi Y. 1997. Vibrio sp. strain NM 10, isolated from the intestine of a japanese coastal fish, has an inhibitory effect against Pasteurella piscicida. Appl Environ Microbiol. 63: 4986-4989.
24
Takeuchi T. 1988. Laboratory work-chemical evaluation of dietary nutrients, Di dalam: Watanabe T, editor. Fish Nutrition and Mariculture. Japan: Japan International Cooperation Agency. hlm. 179-233.
Toldar K. 2009. The genus Bacillus. Toldar’s online textbook of bacteriology. http//:www.textbookbacteriology.net/Bacillus.html (September 2015). Verschuere L, Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotik bacteria as
biological control agents in aquaculture. Microbiol Mol Biol Rev. 64:655-671.
Walter HE.1984. Method with haemoglobin, casein, and azocoll as substrate. Di dalam: Bergmeyer, editor. Methods of Enzymatic Analysis. Ed ke-3. Weinheim (JE): Verlag Chemie.
Wang Bo-Yan. 2007. Effect of probiotic on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei. Aquaculture. 269:259-264.
Watanabe T. 1988. Fish Nutrition and Mariculture. JICA Textbook. The general aquaculture course. Department of aquatic biosciences. Tokyo University of Fisheries hlm. 233.
Widanarni, Yuniasari D, Sukenda, Ekasari J. 2010. Nursery culture performance of Litopenaeus vannamei with probiotics addition and different C/N ratio under laboratory condition. Hayati J Biosci. 17:115-119.
Yanbo W, Zirong X. 2006. Effect of probiotic for common carp (Cyprinus carpio) based on growth performance and digestive enzyme activities. Anim Feed Sci Technol. 127:283-292.
Ziaei-Nejad S, Mehran HR, Ghobad AT, Donald LL, Ali RM, Mehdi S. 2006. The effect of Bacillus spp. bacteria used as probiotic on digestive enzyme activity, survival and growth in the Indian white shrimp Fenneropenaeus indicus. Aquaculture 252:516-524.
Zokaeifar H, Jose LB, Chee RS, Mohd SK, Kamaruzaman S, Aziz A, Nagmeh N. 2012. Effect of Bacillus subtilis on the growth performance, digestive enzymes, immune gene expresion and disease resistance of white shrimp,
Litopenaeus vannamei. JFish Shellfish Immunol. 33:683-689.