EKSTRAKSI DAN IDENTIFIKASI SENYAWA BIOAKTIF
LINTAH LAUT (
Discodoris
sp.) SEBAGAI ANTIOKSIDAN
HAFILUDDIN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahawa tesis dengan judul “Ekstraksi dan Identifikasi Senyawa Bioaktif Lintah Laut (Discodoris sp.) sebagai Antioksidan” adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini
Bogor, Februari 2011
ABSTRACT
HAFILUDDIN. Extraction and Identification of Bioactive Compounds Sea Slug (Discodoris sp.) as an antioxidant. Supervised by TATI NURHAYATI dan NURJANAH
One of the commodities produced from the ocean that have a bioactive compounds is a sea slug (Discodoris sp.). That is very interesting to study mainly deals with the nature of both chemical and biochemical characteristics and their use for the field of food and health. The purpose of this study is to determine the nutrient content of sea slug, determine antioxidant activity, and determine the bioactive compounds of sea slug. The experiment was conducted with several stages: sample preparation, extraction bioactive compound, fractionation by TLC and identification of compounds by GC-MS. Sea slug from the island of Madura Pamekasan potential as a source of protein, fat, and minerals. Sea slug has esensial amino acids amount to 5,57% was dominated by leucin of 1,42%. Nonesensial amino acids amount to 6,54% wich was dominated by glutamic acid 2,19%. Saturated fatty acids amounted to 27.53% of sea slug was dominated by palmitic (C16:0) which was 13.36%. Unsaturated fatty acids amounted to 34.66%, which was dominated by the essential fatty acids linolenic (C18:3, n-3) 20.91%. The highest yield of the crude extract was ethanol of 6,97% and contained alkaloid, steroids, saponin, phenols, carbohydrates and reducing sugar compound. The bioactive compounds in the meat of sea slug with ethanol solvent was galoxolide, dibuthyl phthalate, di-n-octhyl phthalate, oleic acid amide, erucylamide, squalene and has an IC50 best antioxidant activity in fraction 5 at
150.92 ppm.
RINGKASAN
HAFILUDDIN. Ekstraksi dan Identifikasi Senyawa Bioaktif Lintah Laut (Discodoris sp.) sebagai Antioksidan. Dibimbing oleh TATI NURHAYATI dan NURJANAH.
Salah satu komoditi yang dihasilkan dari laut yang mempunyai senyawa bioaktif adalah lintah laut (Discodoris sp.). Senyawa bioaktif lintah laut sangat menarik untuk diteliti terutama berkaitan dengan sifat karakteristik kimia maupun biokimianya serta pemanfaatannya untuk bidang pangan dan kesehatan. Menurut pengalaman empiris, lintah laut telah lama digunakan oleh masyarakat pantai sebagai bahan pangan dan obat-obatan.
Penelitian yang komprehensif tentang kandungan gizi dan komponen bioaktif dari lintah laut jenis Discodoris sp. ini masih sangat kurang, khasiat dan manfaatnya secara empiris perlu dibuktikan, sehingga diperlukan penelitian yang lebih lengkap untuk menentukan komposisi gizi, komponen kimia, ekstraksi dan identifikasi senyawa dari lintah laut. Tujuan dari penelitian ini adalah menentukan kandungan gizi lintah laut, menentukan aktivitas antioksidan, dan menentukan senyawa bioaktif lintah laut.
Penelitian dilaksanakan dengan beberapa tahap yaitu (1) pengambilan dan preparasi sampel, analisis yang dilakukan adalah rendemen (Hustiany 2005), analisis proksimat (AOAC 2005) (kadar air, abu, protein, lemak, dan karbohidrat), kandungan asam amino (AACC 1994), asam lemak (AACC 1983), mineral dan logam berat (SNI 01-2896-1998); (2) ekstraksi senyawa biokatif, analisis yang dilakukan adalah fitokimia (Departemen Kesehatan RI 1995), uji antioksidan metode DPPH (Blois 1958 diacu dalam Hanani et al. 2005); (3) fraksinasi lanjutan, analisis yang dlakukan adalah uji antioksidan dengan metode DPPH (Blois 1958 diacu dalam Hanani et al. 2005); (6) identifikasi senyawa aktif, analisis yang dilakukan adalah identifikasi senyawa aktif dengan menyesuaikan dengan senyawa yang ada di labrary GC-MS.
x
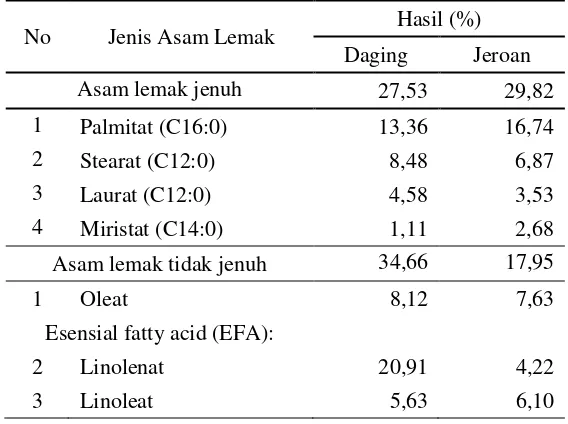
Lintah laut (Discodoris sp.) memiliki asam lemak jenuh (saturated fatty acid/SAFA) sebesar 27,53% (daging) dan 29,82%(jeroan) yang terdiri atas laurat (C12:0) 4,59%, miristat (C14:0) 1,11%, palmitat (C16:0) 13,37%. Asam lemak tidak jenuh (unsaturated fatty acid) sebesar 34,66% (daging) dan 17,95% (jeroan), terdiri atas asam lemak tidak jenuh tunggal (monounsatuted fatty acid/MUFA) yaitu oleat (C18:1,n-9) 8,13% dan asam lemak tidak jenuh jamak (polyunsaturated fatty acid/PUFA) yaitu linoleat (C18:2,n-6) 5,63% dan linolenat (C18:3,n-3) 20,91%. Kandungan mineral lintah laut terdiri atas mineral makro dan mineral mikro. Kandungan mineral tertinggi pada lintah laut yaitu pada jeroan meliputi kalium 206,05 ppm, kalsium 187,66 ppm, magnesium 112,4 ppm dan beberapa mineral mikro. Logam berat yaitu Hg, Cd dan As tidak terdeteksi pada lintah laut.
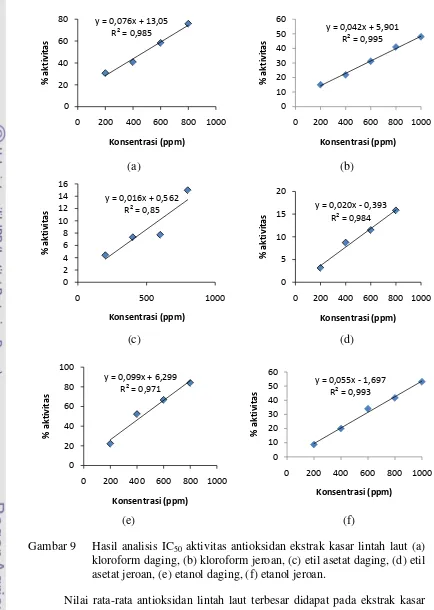
Rendemen ekstrak kasar terbaik pada pelarut etanol sebesar yaitu 5,08% pada daging lintah laut dan 6,97% pada jeroannya. Lintah laut mengandung senyawa alkaloid, steroid, saponin, fenol, karbohidrat dan senyawa gula pereduksi. Nilai aktivitas antioksidan tertinggi diperoleh dari ekstrak kasar daging lintah laut dengan pelarut etanol dengan IC50 sebesar 441,12 ppm.
Fraksinasi menggunakan KLT dan pengamatan dengan sinar UV 254 nm dihasilkan 6 fraksi dengan Rf (Retardation factor) yaitu 0,12; 0,32; 0,49; 0,56; 0,78; dan 0,94. Nilai aktivitas antioksidan masing-masing fraksi tertinggi diperoleh pada fraksi 5 dengan IC50 sebesar 150,92 ppm. Hasil identifikasi
@ Hak Cipta milik Institut Pertanian Bogor Tahun 2011 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulisan ini tanpa mencantumkan atau menyebut sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
EKSTRAKSI DAN IDENTIFIKASI SENYAWA BIOAKTIF
LINTAH LAUT (
Discodoris
sp.) SEBAGAI ANTIOKSIDAN
HAFILUDDIN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
x
Dosen Penguji Luar Komisi:
Judul Tesis : Ekstraksi dan Identifikasi Senyawa Bioaktif Lintah Laut (Discodoris sp.) sebagai Antioksidan
Nama : Hafiluddin
NIM : C351080011
Program Studi : Teknologi Hasil Perairan
Disetujui:
Komisi Pembimbing
Dr. Tati Nurhayati, S.Pi, M.Si.
Mengetahui:
Dr. Ir. Nurjanah, MS. Ketua Anggota
Ketua Program Studi Dekan Sekolah Pascasarjana
Dr. Tati Nurhayati, S.Pi, M.Si.
Tanggal Ujian: 25 Januari 2011
Prof. Dr. Ir. Khairil Anwar Notodiputro, MS.
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas
segala rahmat dan karuniaNya sehingga tesis dengan judul “Ekstraksi dan
Identifikasi Senyawa Bioaktif Lintah Laut (Discodoris sp.) sebagai Antioksidan” ini dapat diselesaikan. Penelitian ini didanai oleh IPB melalui program Penelitian Unggulan IPB Tahun 2009 atas nama Dr. Ir Nurjanah, MS.
Kesuksesan penulis mengikuti pendidikan di Sekolah Pascasarjana IPB ini
tidak lepas dari dukungan berbagai pihak. Penulis menyampaikan banyak terima
kasih yang setulusnya kepada:
1. Ibu Dr. Tati Nurhayati, S.Pi M.Si selaku ketua Komisi Pembimbing dan Ibu
Dr. Ir. Nurjanah, MS sebagai anggota komisi pembimbing atas kesediaan
waktu untuk membimbing, memberikan arahan dan masukan selama
penyusunan tesis ini.
2. Bapak Dr. Ir. Agoes M. Jacoeb, Dip.Biol selaku dosen penguji yang telah
memberikan banyak masukan demi perbaikan tesis ini.
3. Bapak dan Ibu staf pengajar, staf administrasi dan staf laboran Progam Studi
Teknologi Hasil Perairan yang telah banyak membantu dan kerjasama yang
baik selama penulis menempuh studi.
4. Keluarga besar Hafiluddin dan Silviana Indah Junyanti yang telah memberikan
doa dan semangat kepada penulis sampai saat ini.
5. Teman-teman S2 THP IPB baik dari angkatan 2007 (Sefri), angkatan 2008
(Kak Sil, Kak Nikma, Bang Ridho, Teteh Iis, Om Uki, Lilis, Erika dan Pipih),
angkatan 2009 (Untung dkk) dan adik-adik S1 THP atas kerjasama yang baik
selama studi.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Semoga
karya ilmiah ini membawa manfaat bagi seluruh masyarakat Indonesia.
Bogor, Februari 2011
RIWAYAT HIDUP
Penulis dilahirkan di Pamekasan pada tanggal 08 Maret 1980 sebagai anak
keempat dari enam bersaudara pasangan Samsuri dan Halimah. Penulis
menyelesaikan pendidikan sekolah dasar di SDN 2 Bunder pada tahun 1993,
kemudian melanjutkan studi ke SMP Negeri 1 Pademawu dan lulus pada tahun
1996. Pada tahun yang sama penulis menempuh sekolah menengah atas pada
SMA Negeri 2 Pamekasan dan lulus pada tahun 1999. Pendidikan sarjana di
tempuh di Program Studi Teknologi Hasil Perikanan IPB dari tahun 1999-2003.
Pada tahun 2005 penulis diterima sebagai dosen pada Jurusan Ilmu
Kelautan Universitas Trunojoyo Madura. Tahun 2008 penulis berkesempatan
melanjutkan jenjang magister pada Program Studi Teknologi Hasil Perairan IPB.
Penulis menikah dengan Silviana Indah Junyanti pada 11 Februari 2009, dan
dikarunia anak pertama Selina Putri Aufil Fakhira pada 7 Nopember 2009.
DAFTAR ISI
1.1 Latar Belakang ... 1
1.2 Tujuan dan Manfaat Penelitian ... 2
1.3 Hipotesis ... 3
2 TINJAUAN PUSTAKA... 5
2.1 Lintah Laut (Discodoris sp.) ... 5
2.2 Komponen Bioaktif ... 7
2.3 Ekstraksi Senyawa Aktif ... 9
2.4 Antioksidan ... 12
2.5 Kandungan Fitokimia ... 14
2.5.1 Alkaloid ... 14
2.5.2 Steroid/triterpenoid ... 15
2.5.3 Flavonoid ... 15
2.5.4 Saponin ... 16
2.5.5 Fenol hidrokuinon ... 17
2.5.6 Karbohidrat ... 17
2.5.7 Gula pereduksi ... 18
2.5.8 Peptida ... 19
2.5.9 Asam amino ... 19
3 METODOLOGI ... 21
3.1 Waktu dan Tempat ... 21
3.2 Alat dan Bahan ... 21
3.3 Prosedur Penelitian ... 22
3.3.1 Pengambilan dan preparasi sampel ... 22
3.3.2 Ekstraksi lintah laut kering ... 22
3.3.3 Fraksinasi lanjutan ... 24
3.3.4 Identifikasi senyawa aktif ... 25
x
3.4.1 Rendemen (Hustiany 2005) ... 25
3.4.2 Analisis proksimat (AOAC 2005) ... 26
3.4.3 Analisis asam amino (AACC 1994) ... 29
3.4.4 Analisis asam lemak (AACC 1983) ... 31
3.4.5 Analisis mineral dan logam berat (SNI 01-2896-1998) ... 32
3.4.6 Analisis fitokimia (Departemen Kesehatan RI 1995) ... 35
3.4.7 Analisis aktivitas antioksidan (DPPH) (Blois 1958 diacu dalam Hanani et al. 2005) ... 37
3.5 Rancangan Penelitian ... 38
4 HASIL DAN PEMBAHASAN ... 41
4.1 Karakteristik Lintah Laut (Discodoris sp.) ... 41
4.1.1 Rendemen ... 42
4.1.2 Kandungan proksimat lintah laut ... 42
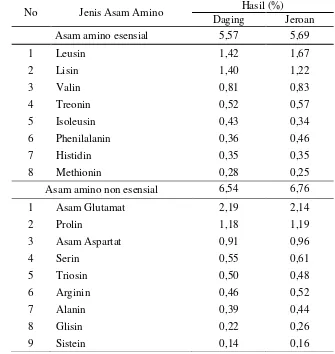
4.1.3 Kandungan asam amino lintah laut ... 45
4.1.4 Kandungan asam lemak lintah laut ... 46
4.1.5 Kandungan mineral lintah laut ... 48
4.2 Ekstraksi Lintah Laut ... 49
4.2.1 Rendemen ... 49
4.2.2 Hasil pengujian senyawa fitokimia ... 51
4.2.3 Aktivitas antioksidan ekstrak kasar lintah laut... 53
4.3 Pemurnian Ekstrak Lintah Laut ... 56
4.3.1 Hasil fraksinasi dengan KLT ... 56
4.3.2 Aktivitas antioksidan hasil fraksinasi... 58
4.3.3 Identifikasi senyawa hasil fraksinasi ... 60
5 KESIMPULAN DAN SARAN ... 67
5.1 Kesimpulan ... 67
5.2 Saran ... 67
DAFTAR TABEL
Halaman 1 Sifat fisika kimia beberapa pelarut yang digunakan dalam ekstraksi
bahan alam ... 11
2 Kondisi dan spesifikasi operasi alat GC-MS ... 26
3 Rendemen lintah laut setelah preparasi ... 42
4 Hasil analisis proksimat lintah laut (Discodoris sp.) ... 43
5 Kandungan asam amino pada lintah laut (Discodoris sp.)... 45
6 Komposisi asam lemak lintah laut (Discodoris sp.) ... 46
7 Hasil analisis kandungan mineral lintah laut (Discodoris sp.) ... 48
8 Rendemen ekstrak lintah laut ... 50
9 Hasil uji fitokimia ekstrak kasar lintah laut (Discodoris sp.) ... 52
10 Perbandingan nilai Rf pada beberapa penelitian lintah laut ... 57
DAFTAR GAMBAR
Halaman 1 Lintah laut (Discodoris sp.) ... 5 2 Beberapa senyawa yang diisolasi dari nudibranch: (1) Nembrotha
kubaryana, (2) Chromodoris petechialis, (3 dan 4) Hypselodoris
infucata ... 8 3 Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan... 13
4 Bagan kerja ekstraksi lintah laut (Discodoris sp.) (Sherif et al. 2008
dengan beberapa modifikasi) ... 23
5 Diagram penelitian ... 39
6 Lintah laut; (a) utuh segar, (b) setelah preparasi (daging dan jeroan),
(c) setelah dikeringkan, dan (d) tepung lintah laut... 41
7 Hasil analisis IC50 aktivitas antioksidan lintah laut (Discodoris sp.) ... 54
8 Hasil analisis IC50 aktivitas antioksidan standar BHT ... 54
9 Hasil analisis IC50 aktivitas antioksidan ekstrak kasar lintah laut (a)
kloroform daging, (b) kloroform jeroan, (c) etil asetat daging, (d) etil
asetat jeroan, (e) etanol daging, (f) etanol jeroan. ... 55
10 Hasil fraksinasi senyawa pada lintah laut menggunakan KLT ... 57
11 Hasil fraksinasi dengan KLT; (a) kromatografi KLT preparatif, (b)
Hasil pengecekan dengan kromatografi lapis tipis ... 58
12 Hasil analisis IC50 aktivitas antioksidan pada masing-masing fraksi ... 58
13 Hasil analisis IC50 aktivitas antioksidan pada standar BHT ... 59
14 Hasil analisis IC50 aktivitas antioksidan pada masing-masing fraksi,
(a) Fraksi 1, (b) fraksi 2, (c) fraksi 3, (d) fraksi 4, (e) fraksi 5, (f)
fraksi 6 ... 60
15 Kromatogram senyawa pada fraksi 5 (F5) lintah laut dengan
DAFTAR LAMPIRAN
Halaman 1 Kromatogram standar asam amino pada HPLC ... 77
2 Kromatogram asam amino daging lintah laut pada HPLC ... 78
3 Kromatogram asam amino jeroan lintah laut pada HPLC ... 79
4 Contoh perhitungan asam amino glutamat pada daging lintah laut ... 80
5 Kromatogram standar asam lemak pada GC... 81
6 Kromatogram asam lemak daging lintah laut pada GC ... 82
7 Kromatogram asam lemak jeroan lintah laut pada GC ... 83
8 Contoh perhitungan asam lemak lenolenat pada daging lintah laut... 84
9 Hasil analisis sidik ragam aktivitas antioksidan ekstrak kasar lintah laut ... 85
10 Hasil analisis sidik ragam aktivitas antioksidan masing-masing fraksi ... 86
11 Kromatogram GC-MS secara umum senyawa pada lintah laut ... 87
12 Hasil identifikasi senyawa galoksolid lintah laut pada GS-MS ... 88
13 Hasil identifikasi senyawa dibutil ftalat lintah laut pada GS-MS ... 89
14 Hasil identifikasi senyawa dioktil ftalat lintah laut pada GS-MS ... 90
15 Hasil identifikasi senyawa oleilamida lintah laut pada GS-MS ... 91
16 Hasil identifikasi senyawa erusilamid lintah laut pada GS-MS ... 92
1 PENDAHULUAN
1.1 Latar Belakang
Lebih dari 70% permukaan bumi ini diliputi oleh lautan dan kehidupan
yang asli di bumi ini terdapat dalam laut. Dalam ekosistem laut terdapat coral reef, para ahli mengestimasi bahwa kekayaan biologinya sama banyaknya dengan hutan hujan tropis. Organisme laut jenis sponge, soft coral, moluska tanpa cangkang atau hewan bertubuh lunak tergolong sesil atau bergerak lambat dan
umumnya mempunyai pertahanan fisik yang kurang karena tidak memiliki
pelindung kulit atau duri, organisme tersebut melakukan mekanisme pertahanan
kimia yaitu mensintesis racun yang digunakan untuk melawan predator.
Kondisi alam dan iklim Indonesia yang tidak fluktuatif membuat laut di
Indonesia memiliki potensi sumberdaya dengan keanekaragaman hayati yang
sangat besar. Sumberdaya laut tersebut belum terdayagunakan secara optimal.
Pemanfaatan sumberdaya laut selain sebagai sumber pangan, juga berpotensi
sebagai sumber senyawa bioaktif yang lebih bernilai ekonomis.
Produk alami laut menarik perhatian ilmuwan dari berbagai bidang ilmu,
yaitu kimia, farmakologi, biologi dan ekologi. Pemikiran ini didukung dengan
fakta bahwa sebelum tahun 1995 terdapat 6.500 produk alami laut telah diisolasi,
sedangkan jumlah tersebut sekarang meningkat menjadi lebih dari 19.000
senyawa. Salah satu contoh senyawa baru ditemukan dari laut dan digunakan
sebagai obat, yaitu prialt (ziconotida) sebagai analgesik kuat untuk penyakit yang sudah kronis dan yondelis (trabectedin atau E-743) sebagai antitumor (Sherif et al. 2008).
Salah satu komoditi yang dihasilkan dari laut dan mempunyai senyawa
bioaktif adalah lintah laut (Discodoris sp.). Senyawa bioaktif lintah laut sangat menarik untuk diteliti terutama berkaitan dengan sifat karakteristik kimia maupun
biokimianya serta pemanfaatannya untuk bidang pangan dan kesehatan. Menurut
pengalaman empiris, lintah laut telah lama digunakan oleh masyarakat pantai di
daerah Pamekasan Madura yang dikenal dengan nama lokal ”kok-okok” karena
lintah laut tubuhnya bisa memanjang dan mengkerut apabila disentuh. Lintah laut
payudara bagi orang hamil dan menyusui. Lintah laut juga digunakan sebagai
jamu untuk menyembuhkan penyakit punggung dan meningkatkan stamina.
Beberapa penelitian tentang lintah laut telah dilakukan, yaitu isolasi
senyawa steroid dari lintah laut dan ditemukan 7 jenis senyawa metabolit yang
salah satu diantaranya adalah senyawa androgen (Ibrahim 2001). Peneliti lain
mengungkapkan bahwa lintah laut mengandung asam lemak jenuh dan tidak jenuh
serta sterol pada fraksi nonpolar (Witjaksono 2005). Hasil uji fitokimia dari
ekstrak metanol lintah laut diperoleh kelompok alkaloid, steroid, asam amino,
saponin dan fenol berperan sebagai antioksidan dengan rendemen yang terbesar,
yaitu 5,12% serta aktivitas antioksidan 89,44% dibandingkan dengan pelarut yang
lain (Nurjanah et al. 2010). Lintah laut jenis Discodoris sp. telah dimanfaatkan sebagai formulasi minuman fungsional dan mempunyai aktivitas antioksidan
(Naiu 2010).
Beberapa penelitian tentang senyawa bioaktif dari nudibranch masih
terbatas pada penemuan senyawa yang belum diketahui aktivitasnya, yaitu
Fontana (2001) berhasil mengisolasi senyawa bioaktif dari nudibranch berupa
isokuinolin alkaloid, pentasiklik skalaran, furanoseskuiterpenoid. Wojnar (2008)
mengisolasi senyawa terpen, makrolid, peptida dari golongan nudibranch. Mollo
(2008) berhasil mengisolasi senyawa apigenin, genkwanin, chrisoeriol, syphonosid dari golongan opisthobranchia.
Penelitian yang komprehensif tentang kandungan gizi dan komponen
bioaktif dari lintah laut jenis Discodoris sp. ini masih sangat kurang, khasiat dan manfaatnya secara empiris perlu dibuktikan, sehingga diperlukan penelitian yang
lebih lengkap untuk menentukan komposisi gizi, komponen kimia, ekstraksi dan
identifikasi senyawa dari lintah laut.
1.2 Tujuan dan Manfaat Penelitian
Tujuan dari penelitian ini antara lain adalah:
1) Menentukan kandungan gizi lintah laut
2) Menentukan aktivitas antioksidan lintah laut
Hasil dari penelitian ini diharapkan dapat memberikan informasi dan
pemanfaatan lintah laut dalam bidang pangan maupun dalam bidang kesehatan.
1.3 Hipotesis
Hipotesis yang harus diuji dari penelitian ini adalah pada spesies lintah
laut (Discodoris sp.) di perairan pantai Kabupaten Pamekasan Madura mengandung komponen bioaktif yang berfungsi sebagai antioksidan dan pada
2 TINJAUAN PUSTAKA
2.1 Lintah Laut (Discodoris sp.)
Lintah laut (Discodoris sp.) merupakan anggota dari kelompok ordo nudibranchia. Kata nudibranch berasal dari Bahasa Latin ”nudus” yang berarti
telanjang dan bahasa Yunani ”brankhia” yang berarti insang. Kelompok hewan ini
memiliki corak dan warna yang beraneka ragam, namun beberapa jenis dari
hewan ini mempunyai kemampuan kamuflase yang handal sehingga cukup sulit
untuk ditemukan (Sorowako 2008).
Menurut Wojnar (2008) lintah laut diklasifikasikan sebagai berikut:
kingdom : Animal
filum : Molusca
kelas : Gastropoda
sub kelas : Opistobranchia
ordo : Nudibranchia
sub ordo : Doridina
famili : Dorididae
genus : Discodoris sp.
Gambar 1 Lintah laut (Discodoris sp.)
Lintah laut (Discodoris sp.) memiliki tubuh yang berwarna coklat kehitam-hitaman dengan bintik putih dan garis pada bagian atas badannya.
Permukaan tubuhnya licin dan tidak dilindungi oleh lapisan pelindung.
Insang-insangnya berjumbaian di punggung, selain itu hewan ini memiliki kepala
kecil hanya bisa melihat sedikit selain membedakan terang dan gelap (Sorowako
2008).
Daerah penyebaran genus Discodoris secara umum terdapat di daerah tropis dan subtropis, Samudera Hindia dan Pasifik khususnya di zona intertidal
atau daerah pasang surut (Rudman 1999). Organisme ini hidup dan menempel
rapat pada batu-batuan yang berlumpur ataupun berpasir serta menghasilkan
lendir (mukus) untuk mencegah dari kekeringan pada tubuhnya. Pada bagian
bawah tubuhnya dapat bergerak dan menempel pada subtrat sehingga gerakannya
lambat.
Discodoris sp. adalah spesies yang banyak ditemukan di Kepulauan Philipina, Papua New Geunia, Indonesia, Okinawa, Afrika Selatan, dan Australia.
Biasanya terdapat di perairan dangkal berpasir serta terumbu karang hingga di
dasar laut dalam lebih dari satu kilometer dalamnya, nudibranch berkembang biak
baik di perairan hangat maupun dingin dan bahkan di sekeliling
cerobong-cerobong vulkanis yang menyembur di laut dalam (Holland 2009).
Lintah laut termasuk jenis hewan hermaprodit, artinya hewan yang
mempunyai alat kelamin ganda yaitu jantan dan betina terdapat dalam satu
individu. Ketika organisme ini siap untuk kawin akan bermigrasi ke daerah pantai
yang berbatu dan ditumbuhi subur oleh tanaman alga dan rumput laut dan
menyemprotkan telur dan sperma sekaligus di sekitar bebatuan tersebut.
Telur-telur tesebut akan dibiarkan melayang di sekitar bebatuan dengan maksud agar
terhindar dari predator dan telur dibiarkan menetas sendiri (Rudman 1999 diacu
dalamWitjaksono 2005).
Discodoris sp. merupakan hewan herbivora, makanan utamanya adalah plankton, alga (alga merah, alga coklat dan alga hijau), rumput laut, sponge.
Juvenil akan tumbuh menjadi populasi yang pesat bila mendapatkan makanan
yang melimpah disekitar daerah bebatuan yang subur dengan tumbuhan alga dan
rumput laut.
Nudibranch atau dikenal sebagai lintah laut, merupakan golongan
invertebrata laut bertubuh lunak. Nudibranch termasuk dalam golongan moluska
tidak memiliki cangkang dan sedikit memiliki mekanisme pertahanan fisik,
lemahnya pertahanan fisik tersebut, nudibranch melakukan adaptasi terhadap
lingkungan melalui perubahan anatomi dan fisiologi. Beberapa opistobranch aktif
pada malam hari, mengerutkan tubuhnya ketika diserang, dan mampu
berkamuflase secara efektif dengan berbagai warna yang menyerupai habitatnya
(Grcovik et al. 2005).
2.2 Komponen Bioaktif
Senyawa bioaktif dapat diperoleh dengan cara isolasi, identifikasi, struktur
ilusidasi dan mempelajari karakteristik produk kimia yang dihasilkan dari
organisme hidup. Sejak jaman Mesopotamia kuno, ketika sejarah menunjukkan
kultivasi dari poppy (Papaver somniferum) untuk diekstraksi sebagai opium, senyawa alam mulai menunjukkan perannya yang penting bagi kehidupan
manusia khususnya dalam bidang kedokteran (Wojnar 2008). Senyawa metabolit
sekunder dikembangkan dalam dunia kedokteran mulai dari sebagai ilmu racun,
meliputi antitumor, sitotoksin, antiinflamantori sampai proses metabolismenya di
dalam sel (Martin et al. 2000).
Metabolit sekunder diproduksi oleh organisme hidup yang didefinisikan
sebagai senyawa produk alami yang tidak termasuk dalam pertumbuhan,
perkembangan, dan reproduksi yang normal pada organisme dan tidak begitu
penting dalam hidup. Senyawa yang dihasilkan dari metabolit sekunder tergolong
dalam bikokimia yang tidak mengalami perubahan sampai fungsinya diperlukan.
Senyawa metabolit sekunder digunakan sebagai alat interaksi antar organisme,
dan sering juga digunakan sebagai pertahanan, sistem imun, antifungi, antibakteri
dan sitotoksik alami (Wojnar 2008).
Beberapa senyawa metabolit khususnya struktur dan aktivitas biologisnya
telah berhasil diisolasi dari hewan-hewan laut. Senyawa metabolit tersebut
mempunyai potensi sebagai obat. Senyawa bioaktif yang menarik diteliti
umumnya diisolasi dari spons laut, ubur-ubur, bintang laut, timun laut, terumbu
karang, moluska, echinodermata, dan krustasean. Senyawa bioaktif yang telah
diisolasi dari hewan laut yaitu steroid, terpenoid, isoprenoid, nonisoprenoid,
Nudibranch merupakan golongan moluska tidak bercangkang yang selalu
berwarna cerah dan indah sebagai pertahanan terhadap serangan predator.
Nudibranch merupakan binatang yang indah yang umumnya mengandung
sejumlah besar senyawa produk alam untuk membantu pertahanan terhadap
serangan predator. Gambar 2 merupakan senyawa yang telah berhasil diisolasi,
yaitu tetrapyrole dari Nembrotha kubaryana, nakafuran-8 dan nakafuran-9 dari Hypselodoris infucata, spongiane-16-one dari Chromodoris petechialis. Senyawa ini sebelumnya ditemukan dalam organisme laut lainnya yang mendukung
hubungan antara makanan dan senyawa metabolit yang dihasilkan dalam
nudibranch (Karuso dan Schewer 2002).
Gambar 2 Beberapa senyawa yang diisolasi dari nudibranch: (1) Nembrotha kubaryana, (2) Chromodoris petechialis, (3 dan 4) Hypselodoris infucata
Golongan invertebrata laut diketahui sebagai sumber dari senyawa bioaktif
yang memiliki potensi bagi dunia kedokteran, meskipun tidak sebagian besar obat
dikembangkan dari laut. Beberapa senyawa yang telah diujicobakan secara klinis,
yaitu obat antikanker. Penelitian tentang produk alam dari laut dalam 3 dekade
terakhir telah menghasilkan banyak senyawa kimia dan biologis yang sangat (4) nakafuran-9
(1) tertrapyrole (2) spongiane-16-one
menarik. Salah satunya adalah asam kainat, asam okadiat, tetradotoksin,
manoalida, palitoksin dan sebagainya (Higa et al. 2001).
Senyawa metabolit yang ada pada spons juga ditemukan dalam beberapa
nudibranch, meskipun hubungannya dengan spons tidak selalu ditemukan dalam
daerah geografis yang sama dengan nudibranch. Di dalam saluran pencernaan
Anisodoris nobilis terdapat metabolit kardiaktif 1-metilisoguan. Beberapa senyawa yang juga terdapat dalam nudibranch yaitu pigmen yang diperoleh dari
spons yang digunakan sebagai mekanisme pertahanan kimia secara pasif dan
sebagai upaya kamuflase (Faulkner dan Ghiselin 1983).
Beberapa senyawa bioaktif telah ditemukan pada nudibranch Jorunna funebris, yaitu isokuinolin alkaloid (N-formil-1,2-dihidroreneirol asetat, asetil renierol, mimosamisin). Glossodoris atromarginata mengandung senyawa bioaktif deoksoskalarin, sesterterpen heteronemi dan skalaran. Hypselodoris kanga mempunyai kandungan senyawa bioaktif furanoseskuiterpenoid dan furodisinin. Chromodoris mandapamensis mempunyai kandungan senyawa bioaktif spongiadiol (Fontana et al. 2001). Produk bahan alam yang diisolasi dari nudibranch Dendrodoris denisoni, yaitu cinnamolide, olepopuane, metoksi asetat, dan poligodial (Grkovic et al. 2005).
Senyawa bioaktif pada nudibranch umumnya diperoleh dari makanannya,
berbagai macam senyawa yang berhasil diisolasi dari lintah laut hampir sama
dengan senyawa metabolit yang ada pada spons dan spesies lainnya yang
merupakan makanan dari nudibranch. Senyawa yang telah diisolasi yaitu terpen
(isocyanopupukeanane) dari nudibranch Phyllidia varicosa dan juga ditemukan pada spons Hymeniacidon sp. Makrolid telah berhasil diisolasi dari nudibranch Hexabranchus sanguineus dan juga pada spons Halichondria, Mycale dan Jaspis. Senyawa peptida berhasil diisolasi dari opistobranch Dolabella auricularia dan pada sianobakteri Symploca. Senyawa peptida tersebut yaitu dolastatin 10 yang terbukti mempunyai aktivitas antitumor pada manusia (Wojnar 2008).
2.3 Ekstraksi Senyawa Aktif
Ekstraksi merupakan salah satu cara pemisahan satu atau lebih komponen
dipisahkan dengan ekstraksi dapat berupa padatan atau cairan. Metode ekstraksi
yang digunakan tergantung pada beberapa faktor, yaitu tujuan yang ingin dicapai
dari ekstraksi, skala ekstraksi, sifat-sifat komponen yang akan diekstrak dan
sifat-sifat pelarut yang digunakan. Ada beberapa metode umum ekstraksi yang
dapat dilakukan, yaitu ekstraksi dengan pelarut, distilasi, supercritical fluid extraction (SFE), pengepresan mekanik dan sublimasi. Diantara metode-metode yang telah diaplikasikan, metode yang banyak digunakan adalah distilasi dan
ekstraksi menggunakan pelarut (Houghton dan Raman 1998).
Pemilihan metode ekstraksi bergantung pada sumber bahan alam dan
senyawa yang ingin diisolasi. Beberapa tujuan dari ekstraksi adalah untuk
mengetahui senyawa bioaktif, mengetahui keberadaan senyawa dalam organisme,
hubungan struktur senyawa dalam organisme, identifikasi seluruh senyawa
bioaktif yang ada pada organisme (Sarker et al. 2006). Tujuan dari isolasi dan purifikasi bahan alam yaitu untuk memisahkan senyawa aktif dari biomassa, untuk
mengisolasi senyawa metabolit atau karakterisasi beberapa senyawa dengan uji
fitokimia (Seidel 2006).
Metode ekstraksi dengan teknik maserasi digunakan karena relatif
sederhana dan mudah tetapi menghasilkan produk yang baik meskipun memiliki
kekurangan, yaitu pengerjaan lama dan pengekstrakan kurang sempurna (Meloan
1999). Seidel (2006) mengemukakan bahwa beberapa metode ekstraksi
menggunakan pelarut organik atau air telah dikembangkan dalam ekstraksi bahan
alam. Maserasi merupakan metode yang mudah dan umum dilakukan. Metode
maserasi memiliki kekurangan, yaitu prosesnya memerlukan waktu yang lama,
memerlukan volume pelarut yang banyak, beberapa senyawa tidak dapat diekstrak
secara efisien dan sedikit larut dalam suhu ruang.
Senyawa yang terbawa pada proses ekstraksi adalah senyawa yang
mempunyai polaritas sesuai dengan pelarutnya. Perbandingan bahan dan pelarut
dapat mempengaruhi hasil ekstraksi. Ketaren (1986) berpandapat bahwa jenis dan
mutu pelarut yang digunakan sangat menentukan keberhasilan proses ekstraksi,
pelarut yang digunakan harus dapat melarutkan zat yang diinginkannya,
Sifat penting yang harus diperhatikan dalam pemilihan pelarut adalah
kepolaran senyawa yang dilihat dari gugus polarnya (gugus OH, COH, dan
lain-lain). Derajat polaritas tergantung pada tahapan dielektrik, makin besar
tahapan dielektrik semakin polar pelarut tersebut (Nur dan Adijuwana 1989).
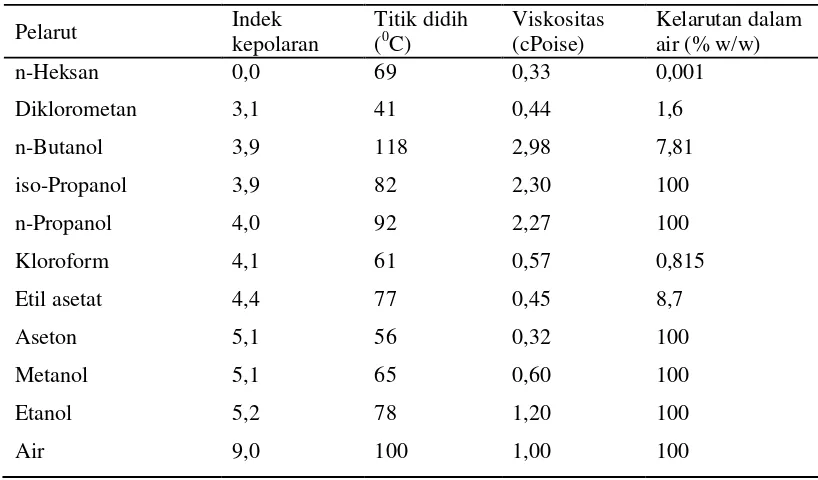
Beberapa pelarut organik dan sifat fisiknya dapat dilihat pada Tabel 1.
Tabel 1 Sifat fisika kimia beberapa pelarut yang digunakan dalam ekstraksi bahan
alam
Sumber : Seidel diacu dalam Sarker et al. (2006)
Pelarut yang bersifat polar, mampu mengekstrak senyawa alkaloid
kuartener, komponen fenolik, karotenoid, tanin, gula, asam amino, dan glikosida
(Harborne 1987). Hasil ekstrak yang diperoleh akan tergantung pada beberapa
faktor, yaitu kondisi alamiah senyawa tersebut, metode ekstraksi yang digunakan,
ukuran partikel sampel, kondisi dan waktu penyimpanan, lama waktu ekstraksi,
dan perbandingan jumlah pelarut terhadap jumlah sampel (Darusman et al. 1995). Pemilihan pelarut tersebut berdasarkan sifat kepolarannya dan kandungan
kimia bahan yang akan diekstrak. Dengan mengetahui sifat metabolit yang akan
diekstrak dapat dipilih pelarut yang sesuai berdasarkan kepolaran zatnya.
Ekstraksi ini dilakukan berdasarkan prinsip like dissolve like, yaitu pelarut polar akan melarutkan senyawa polar dan pelarut nonpolar akan melarutkan senyawa
2.4 Antioksidan
Antioksidan merupakan senyawa yang dapat menghambat spesies oksigen
reaktif/spesies nitrogen reaktif (ROS/RNS) dan juga radikal bebas sehingga
antioksidan dapat mencegah penyakit-penyakit yang dihubungkan dengan radikal
bebas seperti karsinogenesis, kardiovaskuler dan penuaan (Rohman dan Riyanto
2005).
Antioksidan digunakan untuk melindungi komponen-komponen makanan
yang bersifat tidak jenuh (mempunyai ikatan rangkap), terutama lemak dan
minyak. Meskipun demikian, antioksidan dapat pula digunakan untuk melindungi
komponen-komponen lain, yaitu vitamin dan pigmen yang juga banyak
mengandung ikatan rangkap di dalam strukturnya (Siagian 2002).
Sumber-sumber antioksidan dapat dikelompokkan menjadi dua kelompok,
yaitu antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesis reaksi
kimia) dan antioksidan alami (antioksidan hasil ekstraksi bahan alami). Beberapa
contoh antioksidan sintetik yang diijinkan penggunaanya untuk makanan dan
telah sering digunakan, yaitu butil hidroksi anisol (BHA), butil hidroksi toluen
(BHT), propil galat, tert-butil hidoksi quinon (TBHQ) dan tokoferol.
Antioksidan-antioksidan tersebut merupakan Antioksidan-antioksidan alami yang telah diproduksi secara
sintesis untuk tujuan komersial (Rohman dan Riyanto 2005).
Antioksidan yang baik akan bereaksi dengan radikal asam lemak segera
setelah senyawa tersebut terbentuk. Mekanisme antioksidan dalam menghambat
oksidasi atau menghentikan reaksi berantai pada radikal bebas dari lemak yang
teroksidasi, dapat disebabkan oleh 4 macam mekanisme reaksi (Ketaren 1986),
yaitu: pelepasan hidrogen dari antioksidan, pelepasan elektron dari antioksidan,
addisi lemak ke dalam cincin aromatik pada antioksidan, dan pembentukan
senyawa kompleks antara lemak dan cincin aromatik dari antioksidan.
Diantara berbagai jenis antioksidan yang ada, mekanisme kerja serta
kemampuannya sebagai antioksidan sangat bervariasi. Seringkali, kombinasi
beberapa jenis antioksidan memberikan perlindungan yang lebih baik (sinergisme)
terhadap oksidasi dibandingkan dengan satu jenis antioksidan saja (Siagian 2002).
Berdasarkan mekanisme kerjanya, antioksidan dapat digolongkan menjadi
(pemecah rantai), yaitu antioksidan yang dapat bereaksi dengan radikal lipida lalu
mengubahnya ke bentuk yang lebih stabil. Suatu molekul antioksidan dapat
disebut sebagai antioksidan primer (AH), jika dapat mendonorkan atom
hidrogennya secara cepat ke radikal lipida (RO˙) dan radikal turunan antioksidan
tersebut (A˙) lebih stabil dibanding radikal lipida, atau mengubahnya ke bentuk
yang lebih stabil. Beberapa contoh antioksidan primer adalah superoksida dismutase (SOD), Butylated Hidroxyanisol (BHA), Butylated Hidroxytoluene (BHT) dan tokoferol (Oktay et al. 2003).
Antioksidan yang sering digunakan umumnya tergolong dalam senyawa
fenolik. Senyawa-senyawa tersebut bertindak sebagai antioksidan melalui
kemampuannya untuk bereaksi dengan radikal bebas (terutama radikal peroksi,
ROO•). Dalam hal ini, senyawa fenolik bertindak sebagai donor hidrogen atau sebagai akseptor radikal peroksi.
Metode yang umum digunakan untuk menguji aktivitas antioksidan suatu
bahan adalah dengan menggunakan radikal bebas diphenylpicrylhydrazyl (DPPH). DPPH adalah radikal bebas yang bersifat stabil dan beraktivitas dengan cara
mendelokalisasi elektron bebas pada suatu molekul, sehingga molekul tersebut
tidak reaktif sebagaimana radikal bebas yang lain. Proses delokalisasi ini
ditunjukkan dengan adanya warna ungu (violet) pekat yang dapat dikarakterisasi
pada pita absorbansi dalam pelarut etanol pada panjang gelombang 520 nm
(Molyneux 2004). Struktur DPPH dan DPPH tereduksi hasil reaksi dengan
antioksidan dapat dilihat pada Gambar 3.
Diphenylpicrylhydrazyl (radikal bebas) Diphenylpicrylhydrazine (non radikal) Gambar 3 Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan
Pengukuran kapasitas antioksidan dengan metode DPPH menggunakan
spektrofotometer dengan panjang gelombang 517 nm. Larutan DPPH berwarna
berubah menjadi kuning cerah. Penurunan absorbansi akan menunjukkan adanya
aktivitas scavenging dengan berkurangnya warna ungu (Molyneux 2004).
Parameter untuk menginterpretasikan hasil pengujian dengan metode
DPPH adalah IC50 (inhibition concentration). IC50 merupakan konsentrasi larutan
substrat atau sampel yang akan menyebabkan reduksi terhadap aktivitas DPPH
sebesar 50% (Molyneux 2004).
2.5 Kandungan Fitokimia
Analisis fitokimia adalah analisis yang mencakup pada aneka ragam
senyawa organik yang dibentuk dan ditimbun oleh makhluk hidup, yaitu
mengenai struktur kimia, biosintesis, perubahan serta metabolismenya,
penyebaran secara alamiah dan fungsi biologinya (Harborne 1987).
2.5.1 Alkaloid
Alkaloid adalah senyawa organik siklik yang mengandung atom N,
umumnya merupakan bagian dari cincin heterosiklik (gugus amina dan amida)
dan bersifat basa. Senyawa tersebut dapat diperoleh dari ekstraksi kulit kayu,
akar, daun, batang dan buah pada tumbuhan (Solmons 2004). Sifat kebasaan
alkaloid dipengaruhi oleh struktur molekul, keberadaan, dan letak gugus fungsi
lain. Alkaloid umumnya berbentuk padatan kristal dan berasa pahit (Sarker dan
Nahar 2007).
Biosentesis alkaloid diketahui berasal dari sejumlah kecil asam amino
yaitu ornitin dan lisin yang menurunkan alkaloid alisiklik, fenilalanin dan tirosin
yang menurunkan alkaloid jenis isokuinolin, dan triftofan yang menurunkan
alkaloid indol. Keberadaan alkaloid yang sangat beraneka ragam menyebabkan
senyawa ini lebih sering didapatkan langsung dari tumbuhan dibandingkan dari
produk sentesis (Kaufman et al. 1999).
Beberapa contoh senyawa alkaloid yang telah umum dikenal dalam bidang
farmakologi, yaitu nikotin (stimulan pada syaraf otonom), morfin (analgesik),
kodein (analgesik dan obat batuk), atropin (obat tetes mata), skopolamin (sedatif
(pengobatan simptomatis disfungsi ereksi), mitraginin (analgesik dan antitusif),
serta vinblastin (antineoplastik dan obat kanker) (Putra 2007).
2.5.2 Steroid/triterpenoid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualen. Senyawa ini berstruktur siklik yang rumit, kebanyakan berupa
alkohol, aldehida atau asam karboksilat. Mereka berupa senyawa tanpa warna,
berbentuk kristal, seringkali bertitik leleh tinggi dan aktif optik (Harborne 1987).
Hasil penelitian Setzer (2008) menunjukkan bahwa sejumlah produk
triterpenoid alami memiliki aktivitas antitumor karena memiliki kemampuan
menghambat kinerja enzim topoisomerase II, dengan cara berikatan dengan sisi
aktif enzim yang nantinya akan mengikat DNA dan membelahnya. Hal ini
menyebabkan enzim menjadi terkunci dan tidak dapat mengikat DNA.
Triterpenoid dapat digolongkan menjadi sekurang-kurangnya empat
golongan senyawa, yaitu triterpena, steroid, saponin dan glikosida jantung.
Triterpena tertentu terkenal karena rasanya, terutama kepahitannya. Senyawa
triterpenoid yang terdapat pada tumbuhan tingkat tinggi adalah fitosterol yang
terdiri dari sitosterol, stigmaterol dan kaempesterol (Harborne 1987).
Steroid merupakan golongan dari senyawa triterpenoid. Senyawa ini dapat
diklasifikasikan menjadi steroid dengan atom karbon tidak lebih dari 21, seperti
sterol, sapogenin, glikosida jantung dan vitamin D. Steroid alami berasal dari
berbagai transformasi kimia dua triterpena yaitu lanosterol dan sikloartenol.
Senyawa steroid dapat digunakan sebagai bahan dasar pembuatan obat (Harborne
1987). Hasil penelitian Silva et al. (2002) menunjukkan bahwa komponen steroid yang diekstrak dari daun Agave attenuata memiliki aktivitas anti-inflamasi.
2.5.3 Flavonoid
Flavonoid merupakan senyawa yang larut dalam air. Senyawa ini dapat
diekstraksi dengan etanol 70% dan tetap ada dalam lapisan air setelah ekstrak ini
dikocok dengan eter minyak bumi. Flavonoid berupa senyawa fenol, oleh karena
itu warnanya berubah bila ditambah basa atau amonia (Harborne 1987).
Flavonoid merupakan salah satu golongan fenol alam terbesar yang banyak
antioksidan alami, mencegah bergabungnya oksigen dengan zat lain sehingga
tidak menimbulkan kerusakan pada sel-sel tubuh (Liu dan Guo 2006).
Flavonoid mengandung cincin aromatik yang terkonjugasi, oleh karena itu
menunjukkan pita serapan kuat pada daerah spektrum UV dan spektrum tampak.
Flavonoid terdapat dalam tumbuhan, terikat pada gula sebagai glikosida dan
aglikon flavonoid. Diperkirakan 2% dari seluruh karbon yang difotosentesis oleh
tumbuhan dirubah menjadi flavonoid atau senyawa yang berkaitan dengannya
(Markam 1988). Penggolongan jenis flavonoid dalam jaringan tumbuhan
mula-mula didasarkan pada telaah sifat kelarutan dan reaksi warna. Terdapat
sekitar sepuluh kelas flavonoid, yaitu antosianin, proantosianidin, flavonol,
flavon, glikoflavon, biflavon, khalkon, auron, flavanon, dan isoflavon (Harborne
1987).
Flavonoid sangat efektif untuk digunakan sebagai antioksidan
(Astawan dan Kasih 2008), hasil penelitian Bernardi et al. (2007) menunjukkan bahwa seluruh komponen flavonoid yang diisolasi dari Hypericum ternum memiliki aktivitas antioksidan.
2.5.4 Saponin
Saponin adalah glikosida triterpena dan sterol yang telah terdeteksi dalam
lebih dari 90 suku tumbuhan. Glikosida adalah suatu kompleks antara gula
pereduksi (glikon) dan bukan gula (aglikon). Glikon bersifat mudah larut dalam
air dan glikosida-glikosida mempunyai tegangan permukaan yang kuat (Winarno
2008). Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun,
serta dapat dideteksi berdasarkan kemampuannya membentuk busa. Pencarian
saponin dalam tumbuhan telah dirangsang oleh kebutuhan akan sumber sapogenin
yang mudah diperoleh dan dapat diubah di laboratorium menjadi sterol hewan
yang berkhasiat penting (misalnya kortison, estrogen kontraseptif dan lain-lain).
Banyak saponin yang mempunyai satuan gula sampai lima dan komponen
yang umum adalah asam glukuronat. Pembentukan busa yang mantap sewaktu
mengekstraksi tumbuhan atau waktu memekatkan ekstrak tumbuhan merupakan
bukti terpecaya akan adanya saponin. Saponin jauh lebih polar daripada sapogenin
Komponen saponin berperan dalam mereduksi kolesterol dan melawan
kanker kolon. Saponin juga memiliki aktivitas antimikroba, merangsang sistem
imun, dan mengatur tekanan darah (Astawan dan Kasih 2008). Hasil penelitian
Cui et al. (2004) menunjukkan bahwa ekstrak air dari tumbuhan herbal Dioscorea nipponica Mak. biasa digunakan sebagai obat penyakit kardiovaskular (penyakit jantung, hyperlipaemia, dan tonsilitis).
2.5.5 Fenol hidrokuinon
Kuinon adalah senyawa berwarna dan mempunyai kromofor dasar, seperti
kromofor pada benzokuinon, yang terdiri atas dua gugus karbonil yang
berkonjugasi dengan dua ikatan rangkap karbon-karbon. Untuk tujuan identifikasi,
kuinon dapat dipilah menjadi empat kelompok, yaitu benzokuinon, naftokuinon,
antrakuinon dan kuinon isoprenoid. Tiga kelompok pertama biasanya
terhidroksilasi dan bersifat senyawa fenol serta mungkin terdapat in vivo dalam bentuk gabungan dengan gula sebagai glikosida atau dalam bentuk kuinon tanpa
warna, kadang-kadang juga bentuk dimer. Dengan demikian, diperlukan hidrolisis
asam untuk melepaskan kuinon bebasnya (Harborne 1987).
Senyawa kuinon yang terdapat sebagai glikosida mungkin larut sedikit
dalam air, tetapi umumnya kuinon lebih mudah larut dalam lemak dan akan
terekstraksi dalam tumbuhan bersama-sama dengan karotenoid dan klorofil.
Reaksi yang khas adalah reduksi bolak-balik yang mengubah kuinon menjadi
senyawa tanpa warna, kemudian warna kembali lagi bila terjadi oksidasi oleh
udara. Reduksi dapat dilakukan menggunakan natrium borohidrida dan oksidasi
ulang dapat terjadi hanya dengan mengocok larutan tersebut di udara
(Harborne 1987).
2.5.6 Karbohidrat
Karbohidrat berasal dari kata ”karbo” yang berarti unsur karbon dan
”hidrat” yang berarti air, yang berarti unsur C mengikat molekul H2O dengan
rumus kimia CH2O. Biomolekul karbohidrat adalah makromolekul senyawa
organik dengan BM beberapa ribu, sehingga rumus kimia karbohidrat menjadi
(CH2O)n. (Hawab 2003).
Karbohidrat merupakan komponen organik kompleks yang dibentuk
dalam respirasi. Karbohidrat berperan dalam penyimpanan energi (pati),
transportasi energi (sukrosa), serta pembangun dinding sel (selulosa). Karbohidrat
berperan dalam interaksi hewan dan tumbuhan, perlindungan dari luka dan
infeksi, serta detoksifikasi dari substansi asing (Harborne 1987).
Karbohidrat mempunyai struktur, ukuran dan bentuk molekul yang
berbeda-beda. Karbohidrat umumnya aman untuk dikonsumsi (tidak beracun).
Rumus kimia karbohidrat umumnya Cx(H2O)y (Fennema 1996). Berdasarkan
berat molekul, panjang pendeknya rantai hidrokarbon, serta komplikasi
makromolekulnya, Hawab (2003) menggolongkan karbohidrat dibedakan menjadi
beberapa kelompok, yaitu monosakarida yang disebut juga gula sederhana dengan
jumlah atom C 3 sampai 7, disakarida yang mengandung 2 residu monosakarida,
oligosakarida yang memiliki 3 sampai 7 residu monosakarida, dan polisakarida
yang memiliki banyak unit monosakarida.
2.5.7 Gula pereduksi
Gugus fusngional monosakarida yaitu gugus aldehid dan gugus keton yang
berfungsi sebagai pereduktif. Reaksi antara monosakarida dan peroksida
menghasilkan monosakarida. Beberapa pereaksi peroksida yang dapat digunakan
untuk uji monosakarida ialah uji fehling, molisch, benedict, dan barfoed. Tidak
semua monosakarida bersifat pereduksi, tergantung aktivitas gugus fungsionalnya.
Monosakarida yang masih bersifat pereduksi disebut gula pereduksi (Hawab
2003).
Sifat sebagai reduktor pada monosakarida dan beberapa disakarida
disebabkan oleh adanya gugus aldehida atau keton bebas dalam molekul
karbohidrat. Sifat ini dapat digunakan untuk keperluan identifikasi karbohidrat
maupun analisis kuantitatif. Pereaksi benedict berupa larutan yang mengundang
kuprisulfat, natrium karbonat dan natrium sitrat. Glukosa dapat mereduksi ion
Cu2+ dari kuprisulfat menjadi ion Cu2+ yang kemudian mengendap sebagai Cu2O.
Adanya natrium karbonat dan natrium sitrat membuat pereaksi benedict bersifat
basa lemah. Endapan yang terbentuk dapat berwarna hijau, kuning atau merah
bata. Warna endapan ini tergantung pada konsentrasi karbohidrat yang diperiksa
2.5.8 Peptida
Peptida merupakan pembentukan dua atau lebih residu asam amino yang
berikatan satu sama lain dan membentuk ikatan peptide. Ikatan ini dibentuk
dengan pelepasan gugus OH pada gugus karboksil asam amino dan gugus H dari
asam amino yang lain, serta membentuk satu molekul H2O. Reaksi terbentuknya
ikatan peptide dan menghasilkan molekul H2O disebut reaksi kondensasi. Dua
molekul asam amino yang diikat oleh sebuah ikatan peptida disebut dipeptida, tiga
molekul asam amino yang diikat oleh dua ikatan peptida disebut tripeptida, dan
begitu seterusnya (Hawab 2003).
Hidrolisis ikatan peptida dapat dilakukan dengan menggunakan asam kuat
(HCl 6M), basa kuat (NaOH 2M) atau enzim tertentu. Metode hidrolisis yang
paling sering dilakukan adalah hidrolisis asam (Bailey 1992). Pepetida
merupakan senyawa yang bersifat zwitterion, netral dan tidak memiliki muatan
pada titik isoelektriknya. Berdasarkan konstanta keasamannya, peptida kurang
bersifat zwitterionik dibandingkan dengan asam amino (Shallenberger 1993).
Peptida berkontribusi pada pembentukan flavor baik yang diinginkan
maupun yang off-flavor, mulai dari dipeptida hingga molekul yang mengandung
banyak residu asam amino dengan berat molekul ribuan (Weir 1992).
2.5.9 Asam amino
Menurut Lehninger (1988), semua asam amino yang ada pada protein
memiliki ciri yang sama, yaitu memiliki gugus karboksil dan gugus amino yang
diikat pada atom karbon yang sama. Masing-masing asam amino berbeda satu
sama lainnya pada rantai samping (gugus R), yang bervariasi dalam struktur,
ukuran, muatan listrik dan kelarutan dalam air.
Kalisifikasi asam amino dapat dilakukan berdasarkan beberapa kategori.
Menurut Belitz dan Grosch (2009), asam amino dikalisifikasikan berdasarkan
kemampuan rantai samping dalam melakukan reaksi intra dan intermolekul.
Kalisifikasi tersebut membagi asam amino menjadi tiga bagian, yaitu asam amino
non polar dan tidak bermuatan (glisin, alanin, valin, leusin, isoleusin, prolin,
fenilalanin, triptofan, dan methionin); asam amino polar dan tidak bermuatan
(serin, sistein, tirosin, asparagin, dan glutamine); asam amino bermuatan (asam
Menurut Lehninger (1988), berdasarkan polaritasnya asam amino
dibedakan menjadi tiga bagian, yaitu asam amino hidrofilik (asam aspartat, asam
glutamat, asparagin, glutamin, lisin, arginin, dan histidin), asam amino hidrofobik
(fenilalanin, leusin, isoleusin, methionin, valin, dan triptofan), adan asam amino
antara (prolin, treonin, serin, sistein, alanin, glisin, dan tirosin).
Beberapa asam amino memiliki kontribusi dalam pembentukan cita rasa.
Asam amino pembentuk rasa dikelompokkan dalam tiga grup, yaitu asam amino
yang memiliki bentuk rasa L dan D-enantimorf yang tidak memiliki rasa atau
tidak jelas rasanya, asam amino dengan sensasi rasa yang kompleks yang sulit
untuk dikenali dalam bentuk murninya, dan asam amino dengan rasa berbeda.
L-triptofan mendekati rasa pahit, D-L-triptofan 35 kali lebih manis daripada sukrosa,
sedangkan L- dan D-fenilalanin, serta L- dan D-tirosin hampir sama. Glisin
memiliki rasa manis yang terendah diantara asam amino. Asam glutamat pada
ekstrak sintesis tidak hanya memberikan rasa gurih, tetapi meningkatkan
keseluruhan sensasi sebagai hasil kesinambungan yang menyampaikan, ketebalan,
3 METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada Bulan Juni 2009 sampai November 2010,
bertempat di Laboratorium bagian Preparasi Bahan Baku Hasil Perairan,
Laboratorium Biokimia Hasil Perairan, Laboratorium Mikrobiologi Hasil
Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu
Kelautan, Institut Pertanian Bogor. Laboratorium Penelitian Kimia Organik
Departemen Kimia FMIPA IPB. Balai Besar Penelitian dan Pengembangan
Pascapanen Pertanian Cimanggu Bogor. PUSLABFOR BARESKRIM POLRI
Jakarta.
3.2 Alat dan Bahan
Alat yang digunakan pada penelitian ini adalah alat tulis, alat-alat gelas,
alat ekstraksi dan uji kimia antara lain : rotari evaporator Buchi Rotavapor R-205, spektrofotometer UV-VIS Hitachi U-2800, Kromatografi Lapis Tipis silika gel 60 F 254, AAS Shimazu-7000, HPLC Varian 940-LC, GC-MS AGILENT
TECHNOLOGIES.
Bahan yang digunakan pada penelitian ini berupa lintah laut. Bahan
ekstraksi terdiri atas: kloroform, etil asetat dan etanol. Bahan analisis proksimat
antara lain: tablet kjeltab, natrium hidroksida, asam borat, larutan bromocresol
green 0,1%, larutan metil merah 0,1%, alkohol 96%, asam klorida 0,02 N dan
akuades digunakan untuk analisis protein. Asam klorida 6 N, metanol, natrium
asetat, trietilamin, pikoitosianat, asetonitril 60% dan buffer fosfat 0,1 M
digunakan untuk analisa asam amino. Asam klorida 1 N, asam nitrat, asam sulfat,
asam perklorat, molibdat-vanadat, digunakan untuk analisis mineral. Bahan untuk
analisis logam berat, seperti merkuri klorida, batu didih, vanadium pentaoksida.
Bahan analisis asam lemak berupa natrium hidroksida, metanol, natrium klorida
3.3 Prosedur Penelitian
Penelitian ini dibagi dalam beberapa tahap, yaitu pengambilan dan
preparasi sampel, ekstraksi senyawa bioaktif dari lintah laut, fraksinasi senyawa
bioaktif, dan identifikasi senyawa bioaktif.
3.3.1 Pengambilan dan preparasi sampel
Tahap pertama penelitian ini dimulai dari pengambilan dan preparasi
sampel serta persiapan bahan dan alat untuk pengujian kandungan gizi dan
ekstraksi senyawa aktif. Sampel diambil dari pantai dan mangrove dengan tipe
sedimen berlumpur di daerah Pamekasan Madura. Lintah laut diambil ketika
kondisi air laut mulai surut. Setelah terkumpul, lintah laut dicuci dengan air laut
untuk membersihkan dari kotoran lumpur, kemudian dikeluarkan isi perutnya
dengan cara membelahnya secara melintang dari oral menuju aboral. Lintah laut
dicuci kembali sampai bersih dengan air mengalir, kemudian dikeringkan sekitar
3-4 hari dengan sinar matahari. Setelah kering lintah laut dihaluskan dengan
mortal dan blender.
Penanganan sampel segar dilakukan dengan membawa lintah laut dalam
keadaan hidup yang sudah dicuci dengan air laut, kemudian dibungkus dengan
kain basah dan dimasukkan ke dalam wadah. Melalui cara ini, lintah laut bisa
bertahan hidup sampai 5-7 hari.
Analisis yang dilakukan pada tahap ini adalah: analisis rendemen
(Hustiany 2005), analisis proksimat meliputi: kadar air, kadar abu, kadar protein,
kadar lemak dan karbohidrat (AOAC 2005), analisis asam amino (AACC 1994),
analisis asam lemak (AACC 1983), analisis mineral dan logam berat (SNI
01-2896-1998).
3.3.2 Ekstraksi lintah laut kering
Ekstraksi lintah laut dilakukan dengan fraksinasi bertingkat dengan
berbagai perbedaan kepolaran pelarut. Bubuk lintah yang dihasilkan ditimbang
sebanyak 50 gram, kemudian dimasukkan ke dalam labu takar dan ditambahkan
dengan 100 ml kloroform. Campuran dikocok dengan bantuan shaker selama 24 jam kemudian disaring. Fraksinasi menggunakan pelarut kloroform dilakukan
labu dan dievaporasi sampai pekat. Fraksi ini merupakan fraksi dengan tingkat
kepolaran rendah.
Gambar 4 Bagan kerja ekstraksi lintah laut (Discodoris sp.) (Sherif et al. 2008 dengan beberapa modifikasi)
Residu dari fraksinasi kloroform kemudian dilarutkan dengan pelarut etil
asetat. Residu hasil fraksinasi dengan kloroform ditambahkan dengan 100 ml
pelarut etil asetat. Selanjutnya campuran dikocok dengan shaker selama 24 jam dan kemudian disaring. Fraksinasi dengan pelarut etil asetat dilakukan sebanyak
3 kali atau hingga larutan menjadi jernih. Hasil penyaringan ditampung dalam Tepung lintah laut
50 g
Maserasi dengan kloroform 100 ml, 24 jam, suhu ruang
Maserasi dengan etil asetat 100 ml, 24 jam, suhu ruang
Maserasi dengan etanol 100 ml, 24 jam, suhu ruang
labu dan dievaporasi sampai pekat. Fraksi ini merupakan fraksi dengan tingkat
kepolaran sedang.
Fraksinasi terakhir menggunakan pelarut etanol. Residu hasil fraksinansi
dengan etil asetat ditambahkan dengan pelarut etanol sebanyak 100 ml.
Campuran dikocok dengan shaker selama 24 jam dan kemudian disaring.
Fraksinasi dengan pelarut etanol dilakukan sebanyak 3 kali atau hingga larutan
menjadi jernih. Hasil penyaringan ditampung dalam labu dan dievaporasi sampai
pekat. Fraksi ini merupakan fraksi dengan tingkat kepolaran tinggi.
Larutan hasil fraksinasi bertingkat tersebut dikeringkan dengan evaporator
pada suhu 40 0C. Fraksi-fraksi yang diperoleh kemudian dikeringkan dengan freezedryer. Kandungan zat aktif pada masing-masing fraksi dihitung bobotnya. Prosedur lengkap dari proses ekstraksi dapat dilihat pada Gambar 4. Analisis
yang dilakukan pada tahap ekstraksi ini meliputi: analisis rendemen, analisis
fitokimia (Departemen Kesehatan RI 1995), dan analisis antioksidan (Blois 1958
diacu dalam Hanani et al. 2005).
3.3.3 Fraksinasi lanjutan
Fraksi yang memiliki aktivitas antioksidan terbaik kemudian dipisahkan
dengan kromatografi lapis tipis. Fase diam yang digunakan adalah silika gel 60
F254.
Pelaksanaan kromatografi preparatif dilakukan dengan mencari pelarut
terbaik terlebih dahulu menggunakan kromatografi lapis tipis. Eluen yang
digunakan yaitu heksan, kloroform, etil asetat, metanol dan etanol. Pencarian
eluen terbaik dimulai dengan menggunakan eluen tunggal sampai dengan eluen
campuran atau perbandingan.
Sebanyak 5 ml eluen dimasukkan ke dalam chamber dan ditutup, kemudian dibiarkan beberapa menit sampai larutan menjadi jenuh. Ekstrak kasar
yang terpilih dilarutkan dalam pelarutnya, kemudian ditotolkan pada garis bagian
bawah yang ditandai pada plat kromatografi lapis tipis dengan menggunakan pipa
kapiler dan dikeringkan beberapa menit. Kemudian dimasukkan ke dalam
lapis tipis dikeluarkan dan dikeringkan. Selanjutnya plat dilihat hasilnya dengan
menggunakan sinar UV 254 nm.
Setelah ditemukan eluen terbaik, dilanjutkan dengan kromatografi
preparatif. Prosedur yang dilakukan hampir sama dengan KLT namun dengan
ukuran yang lebih besar. Pembuatan preparat dengan menggunakan silika gel 60
F 254 yang dipasang pada lempeng kaca dengan ukuran 20x20 cm. Eluen terbaik
yang diperoleh disiapkan sebanyak 20 ml dan dimasukkan ke dalam chamber. Larutan sampel ditotolkan pada plat KLT dan dimasukkan ke dalam chamber, setelah dilihat hasilnya dengan sinar UV 254 nm, kemudian setiap fraksi atau
masing-masing Rf (Retardation factor) yang dihasilkan dikerok dan dikumpulkan. Hasil pengerokan dilarutkan dengan pelarut yang sama dengan sampel terpilih.
Pada fraksi atau Rf yang diperoleh dicek dengan kromatografi lapis tipis (KLT).
Jika pada lempeng KLT masing-masing fraksi hanya terdapat 1 bercak, maka
dimungkinkan pemisahan sudah hampir sempurna dan diharapkan diperoleh
senyawa tunggal.
Analisis yang dilakukan pada masing-masing fraksi (Rf) yang diperoleh
yaitu analisis antioksidan dengan metode DPPH menurut Blois (1958) diacu
dalamHanani et al. (2005).
3.3.4 Identifikasi senyawa aktif
Fraksi terpilih dengan nilai aktivitas antioksidan terbaik dilanjutkan
dengan melihat komponen senyawa yang terdapat di dalamnya yaitu
menggunakan GC-MS. Kromatografi Gas-Spektrometri Massa dilakukan untuk
mendapatkan bobot molekul dan pola fragmentasi dari senyawa murni tersebut.
Kondisi operasi dari GC-MS disajikan pada Tabel 2.
Analisis yang dilakukan pada tahap identifikasi senyawa aktif ini yaitu
memilih senyawa yang memiliki puncak tinggi dan dicocokkan dengan senyawa
yang ada pada library GC-MS dengan kemiripan >90%.
3.4 Analisis
3.4.1 Rendemen (Hustiany 2005)
Rendemen adalah persentase bagian tubuh yang dapat dimanfaatkan.
jeroannya, kemudian dijemur menggunakan panas matahari. Daging dan jeroan
lintah laut yang telah kering ditimbang kembali untuk mengetahui penurunan
berat setelah dikeringkan. Rendemen merupakan persentase perbandingan antara
bagian yang digunakan dengan berat utuh lintah laut segar.
%
Tabel 2 Kondisi dan spesifikasi operasi alat GC-MS
3.4.2 Analisis proksimat (AOAC 2005)
Analisis proksimat yang dilakukan meliputi uji kadar air dan abu dengan
metode oven, uji kadar lemak menggunakan metode sokhlet, dan uji kadar protein
menggunakan metode kjedahl.
(1) Analisis kadar air (AOAC 2005)
Analisis kadar air dilakukan dengan menggunakan metode oven.
Prinsipnya adalah menguapkan molekul air (H2O) bebas yang ada dalam sampel.
Kemudian sampel ditimbang sampai didapat bobot konstan yang diasumsikan Kondisi GC Spesifikasi dan program pengaturan
Tipe kolom Agilent 19091J-433, tipe HP-5, 0,25 mm x 30 m x 0,25 µm
Diameter 250 µm Suhu maksimum 350 0C Film thickness: 0,25 µm Model aliran: konstan
Kecepatan aliran: 1 mL/menit Instrumen GC-MS Agilent 19091J-433
Gas pembawa: helium
Injektor Pompa sampel: 6
Volume: 1 µl
Ukuran Springe: 10 µl
Inlet Mode split
Suhu 270 0C
Kecepatan split: 19,8 ml/menit Total aliran: 23,8 ml/menit Gas: helium
Tekanan: 8,67 psi
Oven Suhu awal 70 0C
semua air yang terkandung dalam sampel sudah diuapkan. Selisih bobot sebelum
dan sesudah pengeringan merupakan banyaknya air yang diuapkan.
Prosedur analisis kadar air sebagai berikut: cawan yang akan digunakan
dioven terlebih dahulu selama 30 menit pada suhu 100-105 0C, kemudian didinginkan dalam desikator untuk menghilangkan uap air dan ditimbang (A).
Sampel ditimbang sebanyak 2 g dalam cawan yang sudah dikeringkan (B)
kemudian dioven pada suhu 100-105 0C selama 6 jam lalu didinginkan dalam desikator selama 30 menit dan ditimbang (C). Tahap ini diulangi hingga dicapai
bobot yang konstan. Kadar air dihitung dengan rumus:
%
(2) Analisis kadar abu (AOAC 2005)
Analisis kadar abu dilakukan menggunakan metode oven. Prinsipnya
adalah pembakaran atau pengabuan bahan-bahan organik yang diuraikan menjadi
air (H2O) dan karbondioksida (CO2) tetapi zat anorganik tidak terbakar. Zat
anorganik ini disebut abu.
Prosedur analisis kadar abu sebagai berikut: cawan yang akan digunakan
dioven terlebih dahulu selama 30 menit pada suhu 100-105 0C, kemudian didinginkan dalam desikator untuk menghilangkan uap air dan ditimbang (A).
Sampel ditimbang sebanyak 2 g dalam cawan yang sudah dikeringkan (B)
kemudian dibakar di atas nyala pembakar sampai tidak berasap dan dilanjutkan
dengan pengabuan di dalam tanur bersuhu 550-600 0C sampai pengabuan sempurna. Sampel yang sudah diabukan didinginkan dalam desikator dan
ditimbang (C). Tahap pembakaran dalam tanur diulangi sampai didapat bobot
yang konstan. Kadar abu dihitung dengan rumus:
%
(3) Analisis kadar lemak (AOAC 2005)
Analisis kadar lemak dilakukan dengan metode sokhlet. Prinsipnya adalah
lemak yang terdapat dalam sampel diekstrak dengan menggunakan pelarut lemak
Prosedur analisis kadar lemak sebagai berikut: labu lemak yang akan
digunakan dioven selama 30 menit pada suhu 100-105 0C, kemudian didinginkan dalam desikator untuk menghilangkan uap air dan ditimbang (A). Sampel
ditimbang sebanyak 2 gram (B) lalu dibungkus dengan kertas saring, ditutup
dengan kapas bebas lemak dan dimasukkan ke dalam alat ekstraksi sokhlet yang
telah dihubungkan dengan labu lemak yang telah dioven dan diketahui bobotnya.
Pelarut heksan atau pelarut lemak lain dituangkan sampai sampel terendam dan
dilakukan refluks atau ektraksi lemak selama 5-6 jam atau sampai palarut lemak
yang turun ke labu lemak berwarna jernih. Pelarut lemak yang telah digunakan,
disuling dan ditampung setelah itu ekstrak lemak yang ada dalam labu lemak
dikeringkan dalam oven bersuhu 100-105 0C selama 1 jam, lalu labu lemak didinginkan dalam desikator dan ditimbang (C). Tahap pengeringan labu lemak
diulangi sampai diperoleh bobot yang konstan. Kadar lemak dihitung dengan
rumus:
(4) Analisis kadar protein (AOAC 2005)
Analisis kadar protein dilakukan dengan metode kjeldahl. Prinsipnya
adalah oksidasi bahan-bahan berkarbon dan konversi nitrogen menjadi amonia
oleh asam sulfat, selanjutnya amonia bereaksi dengan kelebihan asam membentuk
amonium sulfat. Amonium sulfat yang terbentuk diuraikan dan larutan dijadikan
basa dengan NaOH. Amonia yang diuapkan akan diikat dengan asam borat.
Nitrogen yang terkandung dalam larutan ditentukan jumlahnya dengan titrasi
menggunakan larutan baku asam.
Prosedur analisis kadar protein sebagai berikut: sampel ditimbang
sebanyak 0,1-0,5 g, dimasukkan ke dalam labu kjeldahl 100 ml, ditambahkan
dengan 1/4 buah tablet kjeltab, kemudian didekstruksi (pemanasan dalam keadaan
mendidih) sampai larutan menjadi hijau jernih dan SO2 hilang. Larutan dibiarkan
dingin dan dipindahkan ke labu 50 ml dan diencerkan dengan akuades sampai
tanda tera, dimasukkan ke dalam alat destilasi, ditambahkan dengan 5-10 ml
NaOH 30-33% dan dilakukan destilasi. Destilat ditampung dalam larutan 10 ml
larutan metil merah 0,1% dalam alkohol 95% secara terpisah dan dicampurkan
antara 10 ml bromcresol green dengan 2 ml metil merah) kemudian dititrasi dengan larutan HCl 0,02 N sampai larutan berubah warnanya menjadi merah
muda. Kadar protein dihitung dengan rumus:
%
Keterangan: A = volume HCl untuk titrasi blanko B = volume HCl untuk titasi sampel (ml)
C = normalitas HCl yang digunakan (0,02374 N) D = bobot sampel (mg)
FK = faktor konversi (6,25 untuk produk perikanan)
3.4.3 Analisis asam amino (AACC 1994)
Komposisi asam amino ditentukan dengan High Performance Liquid Chromatography (HPLC). Sebelum digunakan, perangkat HPLC harus dibilas dulu dengan eluen yang akan digunakan selama 2-3 jam. Begitu pula dengan
syringe yang akan digunakan juga harus dibilas dengan akuades. Analisis asam amino menggunakan HPLC terdiri atas 4 tahap, yaitu (1) tahap pembuatan
hidrolisat protein; (2) tahap pengeringan; (3) tahap derivatisasi; dan (4) tahap
injeksi serta analisis asam amino.
(1) Tahap pembuatan hidrolisat protein
Tahap preparasi sampel adalah pembuatan hidrolisat protein. Prosedurnya
sebagai berikut: sampel ditimbang sebanyak 0,2 gram dan dihancurkan. Sampel
yang telah hancur ditambahkan dengan HCl 6 N sebanyak 5-10 ml, kemudian
dipanaskan dalam oven pada suhu 100 0C selama 24 jam. Hal ini dilakukan untuk menghilangkan gas atau udara yang ada pada sampel agar tidak mengganggu
kromatogram yang dihasilkan, selain itu pemanasan dilakukan untuk
mempercepat reaksi hidrolisis. Setelah pemanasan selesai, hidrolisat protein
disaring dengan milipore berukuran 45 mikron.
(2) Tahap pengeringan
Hasil saringan diambil sebanyak 30 µl larutan pengering. Larutan
pengering dibuat dari campuran antara metanol, natrium asetat, dan trietilamim