1 PENDAHULUAN
1.1 Latar Belakang
Meningkatnya ilmu dan teknologi pengolahan yang ada, telah mengubah pola komsumsi manusia terhadap kebutuhan sandang dan pangannya. Manusia cenderung lebih memilih sesuatu yang bersifat instan atau langsung dapat dinikmati tanpa waktu yang lama. Pola komsumsi tersebut memaksa produsen untuk mengganti bahan tambahan yang bersifat alami menjadi bahan tambahan yang bersifat sintetik atau buatan. Bahan tambahan sintetik digunakan karena sifatnya yang relatif murah dan tidak membutuhkan jumlah yang banyak, apabila dibandingkan bahan tambahan alami yang sifatnya relatif mahal. Hal tersebut tidak dibenarkan apabila melihat dampak negatif yang ditimbulkan jika penambahan bahan tambahan sintetik masuk ke dalam tubuh secara terus menerus.
Bahan tambahan antioksidan banyak digunakan oleh produsen untuk menghemat biaya dan waktu produksi. Bahan tambahan antioksidan yang sering digunakan adalah butylated hydroxytoluene atau lebih dikenal dengan BHT. Antioksidan BHT ini banyak digunakan dalam pangan, kesehatan maupun kecantikan. Penggunaan BHT secara terus menerus akan terakumulasi di dalam tubuh dan dapat menyebabkan penyakit karsinogenik. Antioksidan alami flavonoid, alkaloid, steroid/triterpenoid yang berasal dari tumbuhan sangat dibutuhkan untuk menggantikan antioksidan sintetik BHT.
Tumbuhan yang dapat dijadikan pengganti antioksidan sintetik adalah api-api (Avicennia marina (Forks.)Vierh.). Api-api merupakan salah satu tumbuhan yang hidup di wilayah hutan mangrove. Pohon api-api mempunyai bentuk yang khusus dalam penyesuaian diri terhadap lingkungan mangrove dan mempunyai mekanisme fisiologis dalam mengontrol garam (Nybakken 1992). Pohon api-api banyak tumbuh di daerah yang paling dekat dengan laut, dengan substrat agak berpasir, keadaan tanah berlumpur agak lembek, dan biasa berasosiasi dengan Sonneratia sp. yang dominan tumbuh pada lumpur dalam yang kaya bahan organik (Bengen 2001).
tumbuhan termasuk daun, akar, kayu, kulit, bunga, buah dan biji. Flavonoid bersifat polar karena mengandung sejumlah hidroksil yang tak tersulih atau suatu gula (Markham 1988 dalam Silaban 2009). Flavonoid dalam buah-buahan, sayuran, teh, tanaman obat, telah menarik perhatian terbesar dan telah dipelajari secara ekstensif, karena sangat efektif untuk dijadikan antioksidan dengan toksisitas lebih rendah dari antioksidan sintetik misalnya BHA dan BHT (Pekkarinenetet al. 1999dalamCaiet al.2010).
Penelitian pada daun api-api (Avicennia marina (Forsk.) Vierh) pernah dilakukan oleh Afzal et al. (2011) mengenai manfaat dari ekstrak daun api-api sebagai antifungi dan penyakit alergi kulit. Yusuf (2010) juga melakukan penelitian pada kulit batang api-api (Marina marina Nesh) yang ternyata mengandung senyawa triterpenoid yang efektif dijadikan antimikroba. Begitu pula penelitian yang dilakukan oleh Purnobasuki (2004), api-api (Avicennia officinalis) mengandung senyawa saponin yang berkhasiat sebagai aktivitas sitotoksik, antimikroba, dan antiperadangan. Penelitian tentang kandungan flavonoid sebagai antioksidan pada daun dan kulit batang Avicennia marina (Forks.)Vierh. belum dilakukan, sehingga perlu dilakukan penelitian lebih lanjut untuk mengetahui kandungan flavonoid yang terkandung dalam daun dan kulit batang api-api yang dapat digunakan sebagai pengganti antioksidan sintetik.
1.2 Tujuan
2 TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Api-api (Avicennia marina(Forks.)Vierh.) Api-api merupakan salah satu tumbuhan mangrove yang termasuk kedalam Famili Avicenniaceae/Verbenaceae. Api-api banyak ditemukan di ekosistem mangrove yang terletak paling luar atau dekat dengan lautan. Hidup di tanah berlumpur agak lembek atau dangkal, dengan substrat berpasir, sedikit bahan organik dan kadar garam tinggi (Afzal et al. 2011). Klasifikasi Avicennia marina(Forks.)Vierh. menurut Bengen (2001) adalah sebagai berikut:
Kingdom : Plantae Filum : Thacheophyta Kelas : Magnoliopsida Ordo : Sapindales Famili : Avicenniaceae Genus :Avicennia
Spesies :Avicennia marina(Forks.)Vierh. (Gambar 1)
Gambar 1 Pohon api-api (Avicennia marina(Forks.)Vierh.)
Sumber: Wibowoet. al(2009)
bunga yang pendek dan pucat. Buah berbentuk kotak, berkatup, berbiji satu serta berkecambah sebelum rontok (Bandaranayake 1999).
Beberapa jenis tumbuhan yang tergolong dalam Genus Avicennia menghasilkan bahan-bahan yang dapat digunakan untuk keperluan pengobatan, pangan, pakan, perumahan dan farmasi. Tumbuhan api-api ini banyak mengandung senyawa aktif, yaitu triterpenoid, steroid, alkaloid, senyawa flavonoid, saponin, dan tanin (Yusuf 2010). Api-api termasuk pepohonan semak hingga medium dengan ketinggian 2 – 5 meter dan banyak ditemukan di ujung aliran sungai atau di area pasang terendah. Cukup toleran dengan salinitas yang cukup tinggi dan pertumbuhan optimal terdapat pada salinitas 0-30 (Afzal et al.2011). Spesies ini ditemukan dari daerah hilir hingga pertengahan perairan payau di semua kawasan pasang surut berlumpur hampir mendekati pantai (Bengen 2000).
Api-api biasa dimanfaatkan oleh penduduk sekitar untuk dijadikan obat berbagai penyakit. Batang api-api dijadikan obat rematik dan cacar. Getah kulit batang dijadikan obat sakit gigi, bagian buah dijadikan obat untuk sariawan (Bayu 2009). Mangrove sejati ini banyak mengandung senyawa aktif yang dapat dimanfaatkan secara maksimal. Daun dan kulit batang api-api mengandung senyawa aktif alkaloid, triterpenoid, saponin, tanin, glikosida, dan flavonoid yang sangat potensial digunakan sebagai antioksidan, antimikroba, antifungi, dan antibiotik (Wibowoet al.2009).
2.2 Antioksidan
Antioksidan merupakan senyawa yang mempunyai struktur molekul yang
dapat memberikan elektronnya kepada molekul radikal bebas dan dapat
memutuskan reaksi berantai dari radikal bebas. Antioksidan berdasarkan
fungsinya dikelompokkan menjadi antioksidan primer, antioksidan sekunder,
antioksidan tersier,oxygen scavenger, danchelators(Kumalaningsih 2006).
paparan radikal bebas berlebihan, maka tubuh akan membutuhkan antioksidan eksogen (berasal dari luar) dari asupan makanan maupun vitamin (Waji dan Sugrani 2009).
Sumber utama antioksidan dapat dibagi menjadi empat, yaitu enzim misal superoxide dismutase, glutation peroksidase, dan katalase; molekul-molekul besar (albumin, seruloplasmin, dan ferritin); molekul-molekul kecil (asam askorbat, glutation, tokoperol, karotenoid, polifenol); beberapa hormon yang juga berfungsi sebagai sumber antioksidan, yaitu esterogen, angiotensin, melatonin, dan lain-lain (Prioret al.2005dalamRohmanet al.2006).
2.2.1 Fungsi antioksidan
Fungsi utama antioksidan adalah untuk memperkecil terjadinya proses oksidasi dari lemak dan minyak, oksidasi radikal bebas, memperkecil terjadinya proses kerusakan dalam makanan, memperpanjang masa pemakaian dalam industri makanan, meningkatkan stabilitas lemak yang terkandung dalam makanan serta mencegah hilangnya kualitas sensori dan nutrisi (Kuncahyo dan Sunardi 2007). Antioksidan dapat menghambat oksidasi dengan cara bereaksi dengan radikal bebas reaktif membentuk radikal bebas tak reaktif yang relatif stabil
(Oktariana 2007). Musthafa dan Lawrence (2000) menjelaskan bahwa antioksidan
juga berfungsi untuk menetralisir atau menekan dampak negatif yang diakibatkan
radikal bebas.
Antioksidan pada umumnya mengandung struktur inti yang sama, yaitu
mengandung cincin benzena tidak jenuh disertai gugusan hidroksi atau gugusan
amino (Cahyadi 2008). Mekanisme antioksidan dalam menghambat oksidasi atau
menghentikan reaksi berantai radikal bebas dari lemak yang teroksidasi terdiri
atas empat tahap (Ritaet al.2009), yaitu:
1) pelepasan hidrogen dari antioksidan
2) pelepasan elektron dari antioksidan
3) adisi lemak (molekul teroksidasi) ke dalam cincin aromatik antioksidan
4) pembentukan senyawa kompleks antara lemak (molekul teroksidasi) dan
cincin aromatik antioksidan.
Antioksidan yang sangat umum digunakan adalah senyawa fenol atau
peroksida. Efektivitas antioksidan p-amino-fenol dan fenolat tergantung adanya
gugus hidroksil bebas karena ester dan esternya tidak mempunyai pengaruh.
Efisiensi fenolat dapat ditingkatkan dengan alkilasi pada posisi 2, 4, dan 6
(Cahyadi 2008).
Antioksidan akan kehilangan potensi jika tidak mempunyai kemampuan
untuk mengikat hidrogen atau elektron. Beberapa jenis antioksidan, terutama
golongan fenolat bersifat menguap pada suhu kamar. Kemampuan antioksidan
berkurang akibat degradasi molekul, terutama pada suhu yang semakin
meningkat. Antioksidan berdasarkan penggabungan sifat sinergis dikelompokkan menjadi dua kategori, yaitu antioksidan dengan jumlah fenol yang sangat banyak dan antioksidan dengan jumlah asam yang sangat banyak(Ketaren 2008).
2.2.2 Jenis-jenis antioksidan
Antioksidan berdasarkan sumbernya dibagi kedalam dua kelompok, yaitu
antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesis reaksi kimia)
dan antioksidan alami (antioksidan hasil ekstraksi bahan alami tanpa ada
penambahan senyawa kimia) (Kuncahyo dan Sunardi 2007).
2.2.2.1 Antioksidan sintetik
Antioksidan sintetik sudah banyak digunakan untuk menggantikan
antioksidan alami, karena sifatnya yang mudah dicari dan mudah didapatkan.
Antioksidan sintetik yang banyak digunakan adalah senyawa-senyawa fenol yang
biasanya agak beracun dan memiliki efek samping (Siagian 2002). Penggunaan
antioksidan ini harus memenuhi beberapa syarat, yaitu tidak berbahaya bagi
kesehatan, tidak menimbulkan warna yang tidak diinginkan, penggunaannya
efektif dalam konsentrasi rendah (0,01-0,02 %), dapat terkonsentrasi pada
permukaan/lapisan lemak (lipofilik), mudah didapat, ekonomis, serta dapat
bertahan dalam kondisi pengolahan pangan pada umumnya (Belitzet al.2009)
Empat macam antioksidan yang sering digunakan dalam produk makanan
adalah butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT),
Antioksidan BHT akan memberikan efek sinergis yang baik jika digunakan bersama antioksidan BHA, oleh karena itu BHT banyak ditambahkan pada produk pangan sebagai antioksidan yang berfungsi untuk mencegah ketengikan. Antioksidan BHT berbentuk kristal padat putih, stabil pada kondisi penggunaan serta penyimpanan yang normal, dan digunakan secara luas karena relatif murah (Herawati dan Akhlus 2006). Struktur kimia dari BHT dapat dilihat pada Gambar 2.
Gambar 2 Struktur kimiabutylated hydroxytoluene(BHT)
(Sumber: Herawati dan Akhlus 2006)
Antioksidan BHT memilki nilai IC50 yang sangat kuat pada konsentrasi 5,85 ppm (Jacoebet al.2011). Penggunaan BHT secara terus menerus pada bahan makanan diduga dapat menyebabkan kanker dan mutasi gen pada manusia, oleh karena itu penggunaan BHT sudah mulai dilarang di beberapa negara antara lain Jepang, Rumania, Swedia, dan Australia (Ritaet al.2009).
2.2.2.2 Antioksidan alami
Antioksidan alami umumnya mempunyai gugus hidroksi dalam struktur molekulnya. Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan spesies oksigen reaktif, mampu menghambat terjadinya penyakit degeneratif serta mampu menghambat peroksidase lipid pada makanan. Meningkatnya minat untuk mendapatkan antioksidan alami terjadi beberapa tahun terakhir ini (Kumalaningsih 2006).
alami berasal dari tumbuhan. Senyawa antioksidan alami umumnya adalah senyawa fenolik atau polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin, tokoferol, dan asam-asam organik polifungsional (Pratt dan Hudson 1990).
2.3 Uji Aktivitas Antioksidan
Senyawa antioksidan dapat diketahui keberadaanya menggunakan uji
aktivitas antioksidan. Salah satu uji aktivitas antioksidan yang paling sering
digunakan adalah metode 1,1-diphenyl-2-picrylhydrazyl (DPPH). Metode ini sering digunakan untuk memperkirakan efisiensi kinerja dari substansi yang
berperan sebagai antikosidan. Metode pengujian ini berdasarkan pada kemampuan
substansi antioksidan tersebut dalam menetralisir radikal bebas DPPH (Molyneux
2004).
Kristal DPPH yang sudah dilarutkan akan berperan sebagai radikal bebas dan bereaksi dengan senyawa antioksidan, sehingga 1,1-diphenyl-2-picrylhydrazyl akan berubah menjadidiphenilpycrilhydrazineyang bersifat non-radikal dan tidak berbahaya. Reaksi tersebut terjadi apabila radikal bebas bereaksi dengan senyawa antioksidan secara maksimal. Meningkatnya jumlah diphenilpycrilhydrazine ditandai dengan berubahnya warna ungu pada larutan menjadi warna kuning pucat (Molyneux 2004). Mekanisme perubahan warna ungu menjadi kuning pada radikal DPPH dapat dilihat pada Gambar 3.
Gambar 3 Mekanisme perubahan warna DPPH akibat pengaruh anitoksidan
(Sumber: Yuhernita dan Juniarti 2011)
konsentrasi yang menyebabkan hilangnya 50% aktivitas DPPH. Data yang diperoleh kemudian diolah ke dalam persamaan regresi linier(Molyneux 2004).
2.4 Ekstraksi Senyawa Bioaktif
Ekstraksi merupakan suatu proses penarikan komponen zat aktif dalam bahan menggunakan pelarut tertentu dan paling banyak digunakan. Ekstraksi dapat diartikan sebagai suatu proses penarikan atau pemisahan komponen bioaktif suatu bahan menggunakan pelarut yang sesuai dan dipilih, sehingga komponen yang diinginkan dapat larut (Ansel 1989). Proses ekstraksi bertujuan untuk mendapatkan bagian-bagian tertentu dari bahan yang mengandung komponen-komponen aktif (Harborne 1984).
Faktor-faktor yang menentukan hasil ekstraksi adalah waktu ekstraksi, perbandingan antara jumlah sampel dan pelarut, ukuran bahan dan suhu ekstraksi. Semakin lama waktu ekstraksi, maka proses tumbukan atau sentuhan antara bahan dan pelarut semakin besar. Hal ini dapat mengoptimalkan komponen bioaktif yang dipisahkan atau dikeluarkan dari bahan. Perbandingan antara jumlah bahan dan pelarut berpengaruh terhadap efisiensi ekstraksi, jumlah pelarut yang berlebihan tidak akan mengekstrak lebih banyak, namun dalam jumlah tertentu pelarut dapat bekerja secara optimal. Selama proses ekstraksi terjadi perpindahan antara pelarut yang mengalir ke dalam sel bahan dan mengakibatkan zat yang terkandung dalam bahan akan larut sesuai dengan kelarutannya (Voight 1994).
Metode ekstraksi yang paling banyak digunakan pada tumbuhan adalah metode maserasi. Maserasi merupakan metode perendaman tanpa adanya pengadukan dan dilakukan pada suhu ruang. Maserasi merupakan cara yang sederhana dengan cara merendam sampel dalam pelarut. Pelarut menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif sehingga zat aktif tersebut larut akibat adanya perbedaan konsentrasi antara larutan zat aktif dengan pelarut (Guenter 1987dalamKhunaifi 2010).
Ekstraksi dapat dikelompokkan menjadi dua, yaitu ekstraksi sederhana dan ekstraksi khusus (Harborne 1987). Ekstraksi sederhana terdiri atas:
b) Perkolasi, yaitu metode ekstraksi secara berkesinambungan;
c) Reperkolasi, yaitu metode perkolasi dimana hasilnya digunakan untuk melarutkan sampel sampai senyawa kimianya terlarut;
d) Diakolasi, yaitu perkolasi dengan penambahan udara. Ekstraksi khusus terdiri atas:
a) Sokletasi, yaitu metode ekstraksi secara berkesinambungan untuk melarutkan sampel kering menggunakan pelarut bervariasi;
b) Arus balik, yaitu metode ekstraksi secara berkesinambungan dimana sampel dan pelarut saling bertemu melalui gerakan aliran yang berlawanan;
c) Ultrasonik, yaitu metode ekstraksi menggunakan alat yang menghasilkan frekuensi bunyi atau getaran antara 25-100 KHz.
2.5 Metabolit Sekunder
Metabolit sekunder adalah hasil akhir dari suatu proses metabolisme. Metabolit sekunder sangat bervarisai dalam jumlah dan jenisnya dari setiap organisme. Beberapa dari senyawa metabolit sekunder tersebut diantaranya dapat memberikan efek fisiologis dan farmakologis seperti senyawa aktif atau komponen bioaktif. Zat metabolit sekunder dapat diketahui jenisnya antara lain kumarin, salanin, liatriol, nimbin, dan azadirachtin (Copriadyet al.2005).
2.6 Komponen Bioaktif
Komponen bioaktif merupakan suatu senyawa fungsional yang terdapat dalam bahan pangan dan dapat memberikan pengaruh biologis maupun fisiologis. Alkohol aromatik, misalnya total fenol, polifenol dan komponen asam, merupakan kelompok besar dari komponen bioaktif (Kannan et al. 2009). Penapisan komponen bioaktif dapat dilakukan dengan cara uji fitokimia yang meliputi komponen alkaloid, steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, dan tanin. Uji fitokimia bertujuan untuk menentukan ciri senyawa aktif yang dapat dimanfaatkan maupun senyawa aktif penyebab efek racun dengan cara ekstrak kasar (Harborne 1987). Senyawa fitokimia bukanlah senyawa yang termasuk ke dalam zat gizi, namun dengan mengkonsumsi bahan pangan yang mengandung senyawa ini dapat memberikan pengaruh yang positif bagi kesehatan tubuh (Astawan dan Kasih 2008).
2.6.1 Alkaloid
Senyawa alkaloid merupakan senyawa organik yang paling banyak ditemukan di alam. Alkaloid bersifat basa yang mengandung satu atau lebih atom nitrogen dalam bagian siklik (Harborne 1987). Alkaloid biasanya tidak berwarna, bersifat optis aktif, berbentuk kristal, namun terkadang ditemukan dalam bentuk cairan pada suhu ruang, dan terasa pahit di lidah (Harborne 1984).
Senyawa alkaloid, yakni indol memiliki kemampuan untuk menghentikan reaksi radikal bebas atau antioksidan secara efisien. Senyawa radikal turunan dari senyawa amina ini memiliki tahap terminasi yang sangat lama (Yuhernita dan Juniarti 2011). Alkaloid kerap kali bersifat racun bagi manusia, namun ada sebagian yang memiliki aktivitas fisiologis pada kesehatan manusia sehingga dapat digunakan secara luas dalam dunia pengobatan dan kesehatan (Harborne 1984). Fungsi alkaloid dari beberapa penelitian misal hasil penelitian Porto et al. (2009), menunjukan adanya aktivitas antioksidan serta perlindungan dari radiasi sinar UV. Penelitian Yuhernita dan Juniarti (2011) juga menunjukkan adanya aktivitas antioksidan yang tinggi dengan adanya alkaloid sebagai hasil dari metabolit sekunder.
2.6.2 Steroid/triterpenoid
Triterpenoid merupakan senyawa dengan kerangka karbonilnya berasal dari enam satuan isoprene. Senyawa ini berstruktur siklik, kebanyakan berupa alkohol, aldehida atau asam karboksilat. Triterpenoid tidak berwarna, berbentuk kristal, memiliki titik lebur yang tinggi dan merupakan komponen aktif yang sulit dikarakterisasi. Triterpenoid umumnya terasa pahit apabila terkena lidah. Keberadaan triterpenoid dapat diketahui dengan uji menggunakan pereaksi Liebermann-Burchard, yang ditandai hasil positif dengan memberikan warna biru-hijau pada sampel (Harborne 1984).
Steroid merupakan turunan dari golongan senyawa triterpenoid. Steroid alami berasal dari berbagai transformasi kimia dari triterpena yaitu lanosterol dan saikloartenol. Senyawa steroid dapat digunakan sebagai bahan dasar pembuatan obat (Harborne 1987). Golongan triterpenoid/steroid ditemukan hampir pada semua jenis tanaman mangrove. Golongan ini memiliki banyak manfaat, yaitu antiradang, antiinflamasi, antikarsinogenik, dan pengontrol diabetes dalam fase uji klinis (Bayu 2009).
2.6.3 Flavonoid
A
C
B
antioksidan dengan menghambat peroksidasi dari lipid dan berpotensi menginaktifkan oksigen triplet (Bayu 2009). Pada tanaman, flavonoid memiliki beragam fungsi, diantaranya dapat berfungsi sebagai antioksidan, antimikrobial, fotoreseptor, dan skrining cahaya. Flavonoid terutama dalam bentuk turunan glikosilat bertanggung jawab atas pemberian warna pada daun, bunga, dan buah (Simamora 2011). Struktur dasar flavonoid dapat dilihat pada Gambar 4.
Gambar 4 Struktur dasar flavonoid
(Sumber: Kumaret al.2011a)
Flavonoid merupakan salah satu golongan fenol alam terbesar, mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6-C3-C6, yaitu dua cincin aromatis yang dihubungkan oleh satuan tiga karbon yang dapat atau tidak dapat membentuk cincin ketiga. Flavonoid sering terdapat sebagai glikosida. Flavonoid merupakan kandungan khas tumbuhan hijau yang terdapat pada bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, bunga, buah dan biji. Flavonoid bersifat polar karena mengandung sejumlah hidroksil yang tidak terikat bebas atau suatu gula (Markham 1988dalamSilaban 2010).
Tabel 1 Sifat berbagai golongan flavonoid
Golongan Penyebaran Ciri khas
Flavonoid
Antosianin pigmen bunga merah, biru larut dalam air, panjang dalam daun dan jaringan lain gelombang 515-545 nm Proantosianidin tanwarna, dalam galih, dan menghasilkan antosianidin
daun tumbuhan berkayu
Flavonol tersebar luas dalam daun terdapat bercak kuning bila disinari UV (350-386 nm) Flavon seperti flavonol terdapat bercak coklat bila disinari UV (330-350 nm) Glikoflavon seperti flavonol mengandung gula dengan
ikatan C-C, tidak seperti flavon biasa
Biflavonil terbatas hanya pada bercak redup pada
gimnospermae kromatogram BAA
Khalkon dan auron pigmen bunga kuning dengan ammonia berwarna merah (370-410 nm)
Flavanon terdapat dalam daun berwarna merah kuat dengan
dan buah Mg/HCl, pahit
Isoflavon dalam akar, hanya terdapat tidak ada uji warna yang khas dalam satu suku
(Sumber: Harborne 1987)
Flavonoid terdapat dalam semua tumbuhan berpembuluh misalnya isoflavon dan biflavonol yang hanya terdapat pada beberapa suku tumbuhan, tetapi beberapa kelas, yakni flavon dan flavonol tersebar di semua tumbuhan. Flavonoid terdapat dalam tumbuhan sebagai campuran, jarang sekali ditemukan dalam bentuk tunggal dalam jaringan. Selain itu, sering pula ditemukan campuran flavonoid dengan berbeda kelas (Harborne 1967).
katekin. Senyawa tersebut memiliki kemampuan mencegah kanker yang diduga melalui sifatnya sebagai antioksidan, penangkap radikal bebas, dan kemampuannya menonaktifkan kation polivalen. Sumber-sumber flavonoid lebih banyak dihasilkan oleh sayur, buah-buahan, kacang, bunga, daun teh dan lain-lain (Kumaret al.2011a).
Flavonoid dalam tumbuhan memberikan manfaat yang besar bagi tumbuhan tersebut. Flavonoid pada daun mengatur fungsi fisiologis agar dapat bertahan dari gangguan hewan pemakan tumbuhan, infeksi bakteri, dan melindungi dari sinar UV serta membantu dalam proses fotosintesis, transfer energi, respirasi. Pigmen seperti antosianin juga memberikan warna pada daun (Kumar et al. 2011b). Selain bagi tumbuhan, manusia pun dapat ikut merasakan manfaat adanya flavonoid dalam makanan yang mereka konsumsi.
Flavonoid memiliki kemampuan antioksidan yang mampu mentransfer sebuah elektron ke senyawa radikal bebas dan membentuk kompleks dengan logam. Kedua mekanisme itu membuat flavonoid memiliki beberapa efek, diantaranya menghambat peroksidasi lipid, menekan kerusakan jaringan oleh radikal bebas dan menghambat beberapa enzim (Harborne 1987). Hubungan antara total fenol dan senyawa flavonoid dengan aktivitas antioksidan pada tumbuhan terutama buah-buahan adalah semakin meningkatnya konsentrasi total fenol atau senyawa flavonoid, maka semakin tinggi pula tingkat aktivitas antioksidan dari tumbuhan tersebut (Erukainure 2011).
Flavonoid melakukan aktivitas antioksidan dengan cara menekan pembentukan spesies oksigen reaktif, baik dengan cara menghambat kerja enzim maupun dengan mengikat logam yang terlibat dalam produksi radikal bebas. Mekanisme kerja flavonoid sebagai antioksidan sebagai berikut:
2) Sejumlah senyawa flavonoid efisien dalam mengikat logam, diantaranya logam besi bebas dan tembaga bebas yang dapat meningkatkan pembentukan spesies oksigen reaktif.
3) Flavonoid mempunyai nilai potensial reduksi yang rendah, sehingga mudah mereduksi radikal superoksida, peroksil, alkoksil, dan hidroksil. Peredaman radikal bebas oleh flavonoid dicantumkan dalam Gambar 5.
Gambar 5 Struktur dasar senyawa flavonoid (A), Proses peredaman radikal bebas oleh senyawa flavonoid (B)
(Sumber: Kumaret al.2011a)
2.6.4 Saponin
Saponin adalah golongan glikosida dan sterol yang apabila dihidrolisis secara sempurna akan menghasilkan gula dan satu fraksi non-gula yang disebut sapogenin atau genin. Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun serta dapat dideteksi berdasarkan kemampuannya dalam membentuk busa dan menghemolisis darah (Silaban 2009). Hemolisis darah merah oleh saponin ini merupakan hasil interaksi antara saponin dengan senyawa-senyawa yang terdapat pada permukaan membran sel, seperti kolesterol, protein dan fosfolipid. Saponin larut dalam air, sedikit larut atau tidak sama sekali dalam etanol dan metanol pekat yang dingin (Harborne 1984).
menunjukkan bahwa ekstrak saponin mampu digunakan untuk mengatasi penyakit kardiovaskuler seperti penyakit jantung, tonsillitis, danhyperlipaemia.
2.6.5 Fenol hidrokuinon
Fenol merupakan komponen fenolat dengan struktur aromatik yang berikatan dengan satu atau lebih gugus hidroksil, beberapa mungkin digantikan dengan gugus metil atau glikosil. Komponen fenolat bersifat larut air selama komponen tersebut berikatan dengan gula membentuk glikosida, dan biasanya terdapat dalam vakuola sel. Flavonoid merupakan kelompok yang terbesar di antara komponen fenolat alami yang strukturnya telah diketahui, tetapi fenol monosiklik sederhana, fenilpropanoid dan fenolat quinon terdapat dalam jumlah sedikit (Harborne 1984).
Kuinon adalah senyawa bewarna dan mempunyai kromofor dasar, antara lain kromofor pada benzokuinon, yang terdiri atas dua gugus karbonil yang berkonjugasi dengan dua ikatan rangkap karbon-karbon. Tujuan identifikasi, quinon dapat dibagi menjadi empat kelompok, yaitu benzoquinon, naftaquinon, antraquinon, dan isoprenoid quinon. Tiga kelompok pertama umumnya terhidrolisis bersifat fenol, sedangkan isoprenoid quinon terdapat pada respirasi seluler (ubiquinon) dan fotosintesis (plastoquinon) (Harborne 1984).
2.6.6 Tanin
3 METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari sampai April 2012. Pengambilan sampel dilakukan di Pantai Ekowisata Mangrove, Pantai Kapuk, Muara Karang, Jakarta Utara. Proses persiapan sampel, analisis fitokimia, dan analisis aktivitas antikosidan dilakukan di Laboratorium Bahan Baku Teknologi Hasil Perairan. Analisis proksimat (kadar air, abu, protein, dan lemak) dilakukan di Laboratorium Mikrobiologi Hasil Perairan dan Laboratorium Biokimia Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Uji kadar flavonoid total dilakukan di Laboratorium Kimia Analitik, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
3.2 Bahan dan Alat
Bahan baku yang digunakan dalam penelitian ini adalah bagian daun dan kulit batang tumbuhan api-api (Avicennia marina) yang diperoleh dari Pantai Ekowisata Mangrove, Pantai Kapuk, Muara Karang, Jakarta Utara. Sampel daun api-api berasal dari pucuk daun dengan batasan antara ranting kedua dan kelima secara acak, dengan warna daun seragam yang kemudian dihomogenkan, sedangkan sampel kulit batang api-api diambil dengan ketinggian 160 cm di atas permukaan laut dengan batang tumbuhan api-api berdiameter 5-10 cm, warna batang daun putih kehijauan.
Satu jenis pelarut yang digunakan dalam ekstraksi adalah metanol sebagai pelarut polar. Bahan kimia yang dipakai dalam uji aktivitas antioksidan adalah metode l,l-diphenyl-2-picrylhydrazyl (DPPH), butylated hydroxytoluena (BHT) sebagai standar, dan methanol pro analisis sebagai pelarut. Bahan untuk uji fitokimia, yaitu H2SO4, akuades, kloroform p.a, anhidra asetat, asam sulfat pekat, HCl 2 N, pereaksi Dregendorff, pereaksi Wagner, pereaksi Meyer, serbuk magnesium, alkohol, HCl 37 %, etanol 95 %, etanol 70 %, FeCl35, AlCl310 %, natrium asetat 1M.
tabung Kjeldahl, buret, mortar, kertas saring Whatman 42, alumunium foil, kompor listrik, corong kaca, pipet mikro, pipet tetes, gelas ukur, gelas piala, rotary vacuum evaporator, vortex, inkubator, penangas air, spektrofotometer UV-VIS, orbital shaker, kapas bebas lemak, tabung soxhlet, plastik, homogenizer, botol vial,waterbath,syringedan alat penguji DPPH.
3.3 Prosedur Penelitian
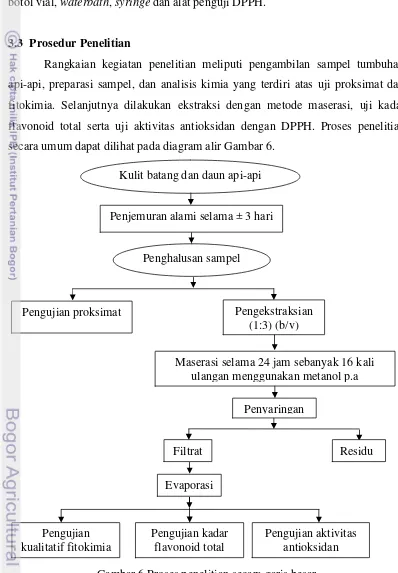
Rangkaian kegiatan penelitian meliputi pengambilan sampel tumbuhan api-api, preparasi sampel, dan analisis kimia yang terdiri atas uji proksimat dan fitokimia. Selanjutnya dilakukan ekstraksi dengan metode maserasi, uji kadar flavonoid total serta uji aktivitas antioksidan dengan DPPH. Proses penelitian secara umum dapat dilihat pada diagram alir Gambar 6.
Gambar 6 Proses penelitian secara garis besar Kulit batang dan daun api-api
Penjemuran alami selama ± 3 hari
Penghalusan sampel
Pengujian proksimat Pengekstraksian
(1:3) (b/v)
Maserasi selama 24 jam sebanyak 16 kali ulangan menggunakan metanol p.a
Penyaringan
Evaporasi
Pengujian kadar flavonoid total
Pengujian aktivitas antioksidan Pengujian
kualitatif fitokimia
3.3.1 Pengambilan dan preparasi sampel
Penelitian ini diawali dengan pengambilan sampel pohon api-api (Avicennia marina) dari Pantai Ekowisata Mangrove, Pantai Kapuk, Muara Karang, Jakarta Utara. Setelah sampel daun dan kulit batang pohon api-api diperoleh lalu dibawa dengan plastik ber-sealer, agar terhindar dari udara luar. Kemudian sampel dikeringkan di bawah sinar matahari selama kurang lebih 3 hari dengan paparan sinar matahari langsung dan diangin-anginkan pada malam hari untuk menjaga komponen aktif tidak ikut menguap saat pengeringan. Selanjutnya dilakukan preparasi untuk memisahkan perbagian kulit batang dan daun pohon api-api (Jacoebet al.2011).
Setelah proses pengeringan, sampel dihancurkan sampai menjadi bagian-bagian kecil atau serbuk agar memudahkan proses penapisan dan proses pengekstraksian. Untuk menjaga stabilitas dari kualitasnya, sampel disimpan dalam lemari pendingin yang dibungkus dengan plastik ber-sealer agar tetap terjaga dan terhindar dari kontaminan.
3.3.2 Analisis proksimat
Analisis proksimat dilakukan untuk mengetahui kandungan gizi secara kasar (crude) yang meliputi kadar air menggunakan metode oven, abu menggunakan tanur, protein menggunakan metode Kjeldahl dan lemak menggunakan metode sokhlet.
a) Analisis kadar air (AOAC 2005)
Perhitungan kadar air :
% Kadar air = B - C x 100% B - A
Keterangan : A = Berat cawan kosong (gram)
B = Berat cawan yang diisi dengan sampel (gram)
C = Berat cawan dengan sampel yang sudah dikeringkan (gram)
b) Analisis kadar abu (AOAC 2005)
Analisis kadar abu yaitu untuk mengetahui jumlah abu yang terdapat pada suatu bahan terkait dengan mineral dari bahan yang dianalisis.
Cawan abu porselen dibersihkan dan dikeringkan di dalam oven bersuhu sekitar 105 0C selama 30 menit. Cawan abu porselen tersebut dimasukkan ke dalam desikator (30 menit) dan kemudian ditimbang. Sampel sebanyak 5 gram ditimbang dalam cawan porselen. Selanjutnya dibakar di atas kompor listrik sampai tidak berasap dan dimasukkan ke dalam tanur pengabuan dengan suhu 600 o
C selama 7 jam. Cawan dimasukkan di dalam desikator dan dibiarkan sampai dingin dan kemudian ditimbang.
% Kadar abu = C - A x 100% B - A
Keterangan : A = Berat cawan abu porselen kosong (gram)
B = Berat cawan abu porselen dengan sampel (gram)
C = Berat cawan abu porselen + sampel setelah dikeringkan (gram) c) Analisis kadar protein (AOAC 2005)
Analisis protein, yaitu untuk mengetahui kandungan dari protein kasar (crude protein) pada suatu bahan. Tahapan yang dilakukan dalam analisis protein terdiri dari tiga tahap, yaitu destruksi, destilasi, dan titrasi.
1) Tahap destruksi
2) Tahap destilasi
Larutan yang telah jernih didinginkan kemudian ditambah 50 ml akuades dan 20 ml NaOH 40 %, lalu didestilasi. Hasil destilasi ditampung dalam erlenmeyer 125 ml yang berisi 25 ml asam borat (H3BO3) 2 % yang mengandung indikator bromcherosol green 0,1 % dan methyl red 0,1% dengan perbandingan 2:1. Destilasi dilakukan dengan menambahkan 50 ml larutan NaOH-Na2S2O3 ke dalam alat destilasi hingga tertampung 40 ml destilat di dalam erlenmeyer dengan hasil destilat berwarna hijau kebiruan.
3) Tahap titrasi
Titrasi dilakukan dengan menggunakan HCl 0,09 N sampai warna larutan pada erlenmeyer berubah warna menjadi merah muda. Volume titran dibaca dan dicatat. Perhitungan kadar protein api-api adalah sebagai berikut:
% Nitrogen = (ml HCl sampel–ml HCl blanko) x N HCl x 14 x 100% mg berat awal
% Kadar Protein = % nitrogen x faktor konversi (6,25)
d) Analisis kadar lemak (AOAC 2005)
Kadar lemak ditentukan dengan rumus sebagai beikut.
Keterangan : W1= Berat sampel (gram)
W2= Berat labu lemak tanpa lemak (gram) W3= Berat labu lemak dengan lemak (gram)
3.3.3 Ekstraksi dari tumbuhan api-api (Avicennia marina(Forks.)Vierh.) Tahap ekstraksi dilakukan secara tunggal dengan teknik maserasi menggunakan pelarut metanol pro analisis. Sampel tumbuhan api-api ditimbang sebanyak 25 gram masing-masing untuk daun dan kulit batang dari hasil pengeringan dan dimasukkan dalam erlenmeyer. Pelarut metanol ditambahkan sampai sampel terendam dengan perbandingan bahan dan pelarut adalah 1:3 (b/v), lalu Erlenmeyer ditutup dengan kapas dan alumunium foil. Sampel dimaserasi menggunakanorbital shaker selama 24 jam. Setelah 24 jam, larutan ekstrak yang diperoleh disaring dengan kertas saring Whatman 42 untuk memisahkan filtrat dan residu yang dihasilkan. Maserasi dilakukan berulang sebanyak 16 kali. Hasil penggabungan filtrat yang didapat dievaporasi pada suhu 37oC.
Filtrat yang diperoleh hasil evaporasi disimpan dalam botol ekstrak untuk dianalisis, yaitu uji fitokimia kualitatif, uji kadar flavonoid total dan uji aktivitas antioksidan dengan metode DPPH. Sebelum dilakukan pengujian aktivitas antioksidan ekstrak kasar yang diperoleh dilakukan perhitungan untuk nilai rendemen hasil ekstrakan.
3.3.4 Uji komponen fitokimia (Harborne 1987)
Uji fitokimia dilakukan untuk menentukan komponen bioaktif yang terdapat pada ekstrak kasar pohon api-api untuk masing-masing perlakuan. Uji fitokimia yang dilakukan terdiri dari uji alkaloid, steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, dan tanin. Metode uji ini berdasarkan Harborne (1987).
a) Uji alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi
Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
b) Uji steroid/triterpenoid
Sejumlah sampel dilarutkan dalam 2 ml kloroform 99,98 % dalam tabung reaksi. Asetat pekat diencerkan menggunakan air dan alkohol ditambahkan sebanyak 10 tetes kemudian ditambahkan asam sulfat pekat 3 tetes ke dalam campuran tersebut. Hasil uji positif mengandung steroid dan triterpenoid yaitu dengan terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
c) Uji flavonoid
Sejumlah sampel ditambah serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran asam klorida 37 % dan etanol 95 % dengan volume yang sama) dan 4 ml alkohol kemudian campuran dikocok. Hasil uji positif sampel mengandung flavonoid ditunjukkan dengan terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
d) Uji fenol hidrokuinon (pereaksi FeCl3)
Sejumlah sampel diekstrak dengan 20 ml etanol 70 %. Larutan yang dihasilkan diambil sebanyak 1 ml kemudian ditambah 2 tetes larutan FeCl3 5 %. Hasil uji positif sampel mengandung fenol hidrokuinon ditunjukkan dengan terbentuknya warna hijau atau hijau biru.
e) Tanin
Sejumlah sampel ditambahkan FeCl3kemudian campuran dihomogenkan. Reaksi positif ditunjukkan dengan terbentuknya warna merah pada campuran. f) Uji Saponin
absorbansi blanko–absorbansi sampel absorbansi blanko
3.3.5 Uji kadar flavonoid total
Sebanyak 0,5 ml ekstrak yang telah diencerkan dengan etanol p.a (1:10 g/ml) ditambah 1,5 ml etanol p.a; 0,1 ml AlCl310 %; 0,1 ml natrium asetat 1 M; dan 2,8 ml akuades. Campuran larutan tersebut dibiarkan selama 30 menit dan diukur absorbansinya pada 417 nm. Kuersetin digunakan untuk membuat kurva kalibrasi. Kandungan total flavonoid dalam ekstrak etanol diekspresikan sebagai mg kuersetin/gram serbuk kering.
3.3.6 Uji aktivitas antioksidan
Uji aktivitas antioksidan yang dilakukan menggunakan metode DPPH berdasarkan kemampuan sampel yang digunakan dalam mereduksi radikal bebas stabil l,l-diphenyl-2-picrylhydrazyl (DPPH). Blanko dibuat dari larutan methanol dengan konsentrasi 200, 400, 600, dan 800 ppm. Sebanyak 0,01 mg ekstrak api-api dibutuhkan untuk membuat larutan stok dengan konsentrasi 200, 400, 600, dan 800 ppm. Sebanyak 0,0004 mg butylated hydroxytoluena (BHT) sebagai standar ditimbang lalu ditambah 50 ml metanol dengan konsentrasi 2, 4, 6, dan 8 ppm. Selanjutnya 0,0098 mg DPPH diencerkan dengan 25 ml metanol. Selanjutnya pemberian DPPH pada larutan stok dan BHT untuk masing-masing konsentrasi. Campuran dihomogenkan dan diinkubasi pada suhu 37 oC selama 30 menit. Serapan yang dihasilkan diukur dengan spektrofotometer UV-Visible pada panjang gelombang 517 nm.
Persentase penghambatan aktivitas radikal bebas diperoleh dari nilai absorbansi sampel. Persamaan regresi diperoleh dari hubungan antara konsentrasi sampel dan presentase penghambatan aktivitas radikal bebas. Aktivitas antioksidan dari masing-masing sampel dan antioksidan pembanding BHT dinyatakan dengan persen inhibisi, yang dihitung dengan formulasi sebagai berikut:
% inhibisi = x 100 %
diperoleh dengan memasukkan y=50 serta nilai A dan B yang telah diketahui. Nilai x sebagai IC50dapat dihitung dengan persamaan : y = A + B Ln (x)
Y = persen inhibisi
4 HASIL DAN PEMBAHASAN
4.1 Karakteristik Api-api (Avicennia marina(Forks.)Vierh.)
Pohon api-api (Avicennia marina (Forks.)Vierh.) merupakan tumbuhan sejati yang hidup di kawasan mangrove. Morfologi tumbuhan api-api yang diambil dari Pantai Ekowisata Mangrove, Pantai Kapuk, Muara Karang, Jakarta Utara dapat dilihat pada Gambar 7.
Gambar 7 Daun pohon api-api yang diambil dan dijadikan sebagai sampel Daun api-api yang didapat pada bagian atas berwarna hijau muda dan bagian bawah berwarna abu-abu keperakan. Bentuknya elips dengan panjang rata-rata daun yang didapat berkisar 5-10 cm. Daun api-api memiliki ruas atau tulang daun yang sejajar dan teratur. Teksurnya tidak lunak apabila disentuh dengan tangan. Kulit batang api-api yang digunakan berwarna cokelat muda, tipis dan berserat. Pada bagian dalam terlihat warna yang lebih cerah, yaitu putih kehijauan dan sedikit berair (Lampiran 1).
4.2 Kandungan Gizi
Kandungan gizi pada daun dan kulit batang api-api dapat diketahui melalui uji proksimat. Analisis proksimat merupakan suatu analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan, termasuk di dalamnya kandungan air, abu, lemak, dan protein. Tumbuhan api-api banyak dimanfaatkan oleh masyarakat sekitar baik sebagai sumber makanan maupun untuk kesehatan. Tumbuhan berdaun sejati ini memiliki nilai gizi yang cukup tinggi untuk dijadikan sumber makanan. Berikut hasil data proksimat dari tumbuhan api-api dapat dilihat pada Gambar 8.
Gambar 8 Hasil data proksimat tumbuhan api-api (Avicennia marina (Forks.)Vierh.); Daun; Kulit batang
1) Kadar air
2) Kadar abu
Hasil pengukuran kadar abu menggunakan bobot kering pada daun dan kulit batang api-api menunjukkan bahwa daun api-api mengandung mineral atau zat anorganik sebesar 14,91 % dan kulit batang api-api memiliki kadar abu sebesar 9,6 % (Lampiran 2). Hasil tersebut tidak jauh berbeda dengan hasil penelitian Wibowo et al.(2009) bahwa kadar abu pada daun api-api sebesar 15,61 %. Hasil serupa dikemukakan oleh Jacoeb et al. (2011), yaitu sebesar 13,97 %. Tinggi dan rendahnya kadar abu pada tumbuhan dapat disebabkan oleh perbedaan habitat dan lingkungan yang berbeda satu sama lainnya. Setiap lingkungan perairan dapat menyediakan sumber mineral yang berbeda-beda bagi organisme akuatik yang hidup didalamnya. Tumbuhan api-api merupakan tumbuhan sejati yang hidupnya hanya mampu di wilayah mangrove atau estuari. Bengen (2000) menjelaskan bahwa wilayah estuari merupakan wilayah perairan dimana terjadi peralihan atau pencampuran antara air tawar dan air laut yang menyebabkan banyaknya mineral yang terkandung di dalamnya.
3) Kadar protein
Hasil pengukuran bobot kering kadar protein menunjukkan bahwa daun api-api dan kulit batangnya memiliki kadar protein sebesar 11,04 % dan 6,4 % (Lampiran 2). Hasil tersebut sedikit berbeda menurut Wibowoet al.(2009) bahwa protein api-api sebesar 17,31 %. Berbeda halnya dengan hasil penelitian Jacoebet al. (2011) yang menyatakan bahwa daun api-api memiliki kandungan protein sebesar 11,53 %. Perbedaan tersebut dapat dipengaruhi adanya beberapa faktor, yaitu habitat, umur, dan laju metabolisme. Daun memiliki kadar protein yang tinggi karena di daun terjadi proses fotosintesis yang membutuhkan banyak jaringan serta organ yang bekerja. Kulit batang cenderung memiliki kadar protein yang rendah dari daun dikarenakan kulit batang hanya terdapat jaringan sistem pembuluh yang bertitik beratkan pada kerja sistem angkut mineral, unsur hara dan menjaga kesetimbangan akibat adanya garam.
4) Kadar lemak
Ekstrak
Daun Kulit Batang Standar (warna)
al.(2011), yaitu kadar lemak daun api-api sebesar 2,45 %. Berbeda halnya dengan penelitian Wibowo et al. (2009), yaitu sebesar 1,16 %. Perbedaan tersebut dibenarkan oleh Yunizal et al. (1998) bahwa kadar lemak yang rendah dapat disebabkan karena kandungan air dalam daun dan kulit batang pohon api-api sangat tinggi, sehingga secara proporsional persentase kadar lemak akan turun drastis. Faktor lain seperti umur, habitat, dan perbedaan lokasi pengambilan sampel juga menjadi faktor penting yang dapat mempengaruhi kadar lemak suatu bahan.
4.3 Komponen Bioaktif Ekstrak Kasar
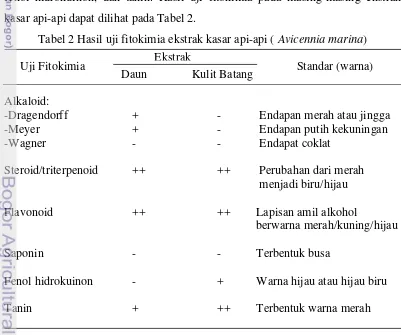
Hasil ekstraksi komponen bioaktif api-api menunjukkan bahwa ekstrak kasar menggunakan pelarut metanol berwarna coklat kehijauan dan berbau khas ekstrak tumbuhan. Rendemen ekstrak kasar yang dihasilkan cukup tinggi untuk daun 17,53 % dan kulit batang api-api 12,07 % (Lampiran 2). Uji fitokimia yang dilakukan dalam penelitian ini meliputi uji alkaloid, steroid, flavonoid, saponin, fenol hidrokuinon, dan tanin. Hasil uji fitokimia pada masing-masing ekstrak kasar api-api dapat dilihat pada Tabel 2.
Tabel 2 Hasil uji fitokimia ekstrak kasar api-api (Avicennia marina)
Alkaloid:
-Dragendorff + - Endapan merah atau jingga
-Meyer + - Endapan putih kekuningan
-Wagner - - Endapat coklat
Steroid/triterpenoid ++ ++ Perubahan dari merah
menjadi biru/hijau
Flavonoid ++ ++ Lapisan amil alkohol
berwarna merah/kuning/hijau
Saponin - - Terbentuk busa
Fenol hidrokuinon - + Warna hijau atau hijau biru
Tanin + ++ Terbentuk warna merah
Keterangan: (-) hasil negatif; (+) hasil ada namun tidak pekat; (++) hasil ada dan pekat
a) Alkaloid
Komponen alkaloid didefinisikan sebagai substansi dasar yang memiliki satu atau lebih atom nitrogen yang bersifat basa dan tergabung dalam suatu sistem siklis, yaitu cincin heterosiklik (Harborne 1984). Alkaloid ditemukan pada daun api-api, namun tidak ditemukan pada kulit batang api-api. Alkaloid umumnya larut pada pelarut organik (non polar), sedangkan beberapa kelompok pseudoalkaloid dan protoalkaloid larut dalam air (polar) (Lenny 2006). Penelitian ini dilakukan dengan pelarut metanol (polar) yang justru menunjukkan adanya kandungan alkaloid pada daun api-api walaupun hasil yang ditunjukkan (Tabel 2) tidak terlalu pekat, hal ini menunjukkan bahwa daun api-api tidak mengandung alkaloid (sesungguhnya) yang bersifat racun, tetapi hanya mengandung protoalkaloid dan pseudoalkaloid saja. Alkaloid tidak dihasilkan pada kulit batang api-api dengan ditandai hasil negatif pada Tabel 2.
b) Steroid/triterpenoid
Hasil uji fitokimia untuk daun dan kulit batang api-api menunjukkan adanya senyawa steroid/triterpenoid, ditunjukkan oleh hasil yang cukup pekat (Tabel 2). Steroid/triterpenoid dapat diketahui keberadaanya dengan perkursor kolesterol yang bersifat non polar (Harborne 1984). Hasil pada Tabel 2 menunjukkan adanya senyawa steroid/triterpenoid walaupun menggunakan pelarut metanol yang bersifat polar, hal ini dapat terjadi mengingat metanol merupakan pelarut polar yang dapat mengekstrak komponen lainnya, meskipun bersifat non polar ataupun semipolar. Schmidt dan Steinhart (2001) menyatakan bahwa kandungan steroid pada ekstrak polar dan non polar tidak menunjukkan hasil yang berbeda nyata.
c) Flavonoid
Sampel
% Inhibisi
IC50(ppm)
Ekstrak Daun 18,75 19,55 20,23 21,48 Ekstrak Kulit Batang 7,84 9,25 10,00 10,34
200 400 600 800
(ppm)
pada lapisanaqueous (Harborne 1984). Flavonoid merupakan senyawa aktif yang potensial dan sangat efektif untuk digunakan sebagai antioksidan (Astawan dan Kasih 2008), dan hal ini pun terbukti dari hasil penelitian Simamora (2011) yang menunjukkan bahwa seluruh komponen flavonoid yang diisolasi dari buah apel memiliki aktivitas antioksidan yang cukup kuat.
d) Tanin
Hasil pengujian fitokimia untuk uji tanin menunjukkan bahwa daun dan kulit batang api-api sama-sama mengandung tanin. Hasil uji tanin untuk daun terlihat ada, namun tidak pekat apabila dibandingkan dengan hasil yang ditunjukkan oleh kulit batang api-api (Tabel 2). Tanin di dalam tumbuhan dapat berfungsi sebagai penyamak apabila jaringan rusak, karena sifat tanin yang mampu menyambung silangkan protein. Sebagian besar tumbuhan yang banyak bertanin dihindari oleh hewan pemakan tumbuhan, karena rasanya yang pahit. Fungsi utama tanin di dalam tumbuhan adalah penolak hewan pemakan tumbuhan (Harborne 1987). Tumbuhan api-api termasuk tumbuhan mangrove yang memiliki rasa pahit dan banyak digunakan penduduk sekitar untuk obat nyamuk.
4.4 Aktivitas Antioksidan
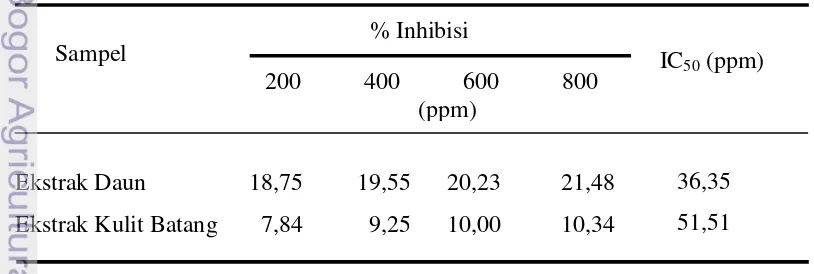
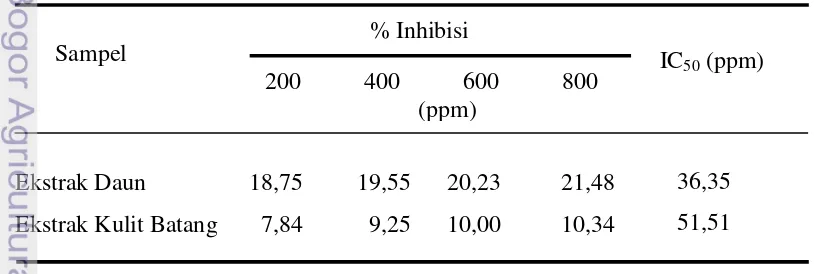
Hasil uji aktivitas antioksidan dengan DPPH menggunakan spektrofotometer pada panjang gelombang 517 nm menunjukkan bahwa daun dan kulit batang api-api memiliki aktivitas antioksidan. Hasil uji aktivitas antioksidan ekstrak daun dan ekstrak kulit batang api-api dapat dilihat pada Tabel 3.
Tabel 3 Hasil uji aktivitas antioksidan ekstrak daun dan ekstrak kulit batang api-api (Avicennia marina)
Tabel 3 menunjukkan bahwa persen inhibisi tertinggi, baik daun maupun kulit batang api-api dimiliki oleh konsentrasi tertinggi, yaitu 800 ppm dan nilai terendah untuk persen inhibisi dimiliki oleh konsentrasi terendah, yaitu 200 ppm. Hal ini menunjukkan bahwa semakin tinggi konsentrasi yang digunakan, semakin tinggi pula daya hambat yang dilakukan sebagai aktivitas antioksidan. Nilai IC50 yang dihasilkan oleh ekstrak daun lebih rendah dari ekstrak kulit batang, yaitu 36,35 ppm untuk daun dan 51,51 ppm untuk kulit batang. Ekstrak daun lebih banyak menghilangkan 50 % aktivitas DPPH apabila dibandingkan dengan ekstrak kulit batang. Molyneux (2004) menyatakan bahwa nilai IC50 adalah konsentrasi yang menyebabkan hilangnya 50 % aktivitas DPPH.
Kedua ekstrak kasar daun dan kulit batang pohon api-api memiliki kekuatan penghambat yang berbeda-beda satu sama lainnya. Hubungan aktivitas antioksidan antara ekstrak kasar daun dan ekstrak kasar kulit batang api-api dengan persen inhibisinya dapat dilihat pada Gambar 9.
Gambar 9 Grafik perbandingan aktivitas antioksidan antara ekstrak kasar daun dan kulit batang api-api dengan persen inhibisinya;
Daun; Kulit Batang
Gambar 9 menunjukkan daun api-api memiliki aktivitas yang cukup baik bila dibandingkan kulit batang. Hal ini diduga karena adanya kandungan senyawa aktif yang cukup banyak terdapat dalam daun, seperti alkaloid, steroid/triterpenoid, dan flavonoid (Tabel 2).
Sampel
% Inhibisi
IC50(ppm)
Larutan BHT 22,05 37,73 49,66 58,30 3,17
2 4 6 8
(ppm)
antioksidan. Larutan BHT yang digunakan dalam penelitian ini menghasilkan nilai IC50 sebesar 3,17 ppm. Nilai IC50 BHT ini tidak jauh berbeda dengan nilai yang diperoleh Jacoeb et al. (2011) dalam penelitiannya, dan tetap menunjukkan bahwa antioksidan BHT merupakan antioksidan dengan aktivitas yang sangat kuat (<50 ppm). Hasil uji aktivitas antioksidan larutan BHT dapat dilihat pada Tabel 4.
Tabel 4 Hasil uji aktivitas antioksidan larutan BHT
Tabel 4 menunjukkan hasil larutan BHT memiliki persen inhibisi tertinggi pada konsentrasi tertinggi, yaitu 8 ppm dan persen inhibisi terendah pada konsentrasi terendah, yaitu 2 ppm. Hal ini menunjukkan bahwa semakin tinggi konsentrasi yang digunakan, semakin tinggi pula daya hambat yang dilakukan sebagai aktivitas antioksidan. Nilai IC50BHT sebesar 3,17 ppm, merupakan nilai terbaik apabila dibandingkan dengan nilai IC50ekstrak daun dan kulit batang api-api (Tabel 3). Pengujian aktivitas antioksidan BHT ini menghasilkan hubungan antara konsentrasi BHT dengan persen inhibisinya, yang dapat dilihat pada Gambar 10.
tinggi pula persen inhibisi atau daya hambatnya. Ekstrak daun dan kulit batang pohon api-api pada Gambar 9 sama-sama menunjukkan hasil yang serupa dengan larutan BHT pada Gambar 10, grafik akan bergerak naik ke atas dengan naiknya konsentrasi yang digunakan. Nilai IC50yang ditunjukkan pada Tabel 3 untuk daun dan kulit batang api-api, serta larutan BHT pada Tabel 4 sama-sama menunjukkan bahwa ketiga ekstrak tersebut memiliki aktivitas antioksidan yang cukup kuat (<50 ppm), sehingga dapat disimpulkan bahwa ekstrak daun dan kulit batang api-api dapat digunakan sebagai antioksidan alami pengganti antioksidan sintetik seperti antioksidan BHT.
4.5 Kandungan Flavonoid Api-api sebagai Antioksidan
Hasil penelitian menunjukkan daun dan kulit batang pohon api-api mengandung senyawa aktif flavonoid (Tabel 2) yang efektif digunakan sebagai antioksidan. Hal ini terlihat jelas dengan adanya aktivitas antioksidan yang ditunjukkan oleh ekstrak kasar pada Gambar 9 dan Tabel 3, ekstrak kasar daun dan kulit batang api-api memiliki nilai IC50 yang cukup tinggi. Wibowo et al. (2009) menyatakan bahwa Avicennia marina terutama bagian daun dan kulit batang mengandung senyawa flavonoid, hal ini dibuktikan dengan adanya perubahan warna yang cukup pekat pada uji fitokimia.
dengan melihat kadar total flavonoid yang terkandung di dalamnya. Kadar total flavonoid yang terkandung di beberapa tanaman ditunjukkan pada Tabel 5.
Tabel 5 menunjukkan bahwa kandungan flavonoid yang terkandung dalam daun api-api lebih tinggi bila dibandingkan tanaman Aegle marmelos, seledri dan tempuyung, namun lebih rendah dari tanaman jati belanda. Kadar total flavonoid kulit batang api-api juga lebih tinggi dari kulit batang Aegle marmelos.Perbedaan hasil tersebut dikarenakan adanya perbedaan jenis tanaman, habitat, umur tanaman, jumlah sampel yang diekstrak, dan lamanya pengekstraksian.
Tabel 5 Kadar total flavonoid beberapa tanaman (%)
Keterangan: a Mujeebet al.(2010) b Rafiet al.(2006) c Widyastuti (2010)
Hasil beberapa penelitian tersebut sama-sama menunjukkan bahwa kadar total flavonoid yang terkandung dalam bahan memiliki korelasi terhadap aktivitas antioksidannya. Tanaman jati belanda memiliki aktivitas antioksidan tertinggi bila dibandingkan api-api, Aegle marmelos, seledri dan tempuyung. Hal ini sesuai dengan kadar total flavonoid yang terkandung di dalam tanaman jati belanda yang lebih tinggi dari tanaman lainnya.
Adanya senyawa flavonoid yang mempunyai gugus hidroksi tersubstitusi terhadap gugus –OH dan –OR, maka flavonoid cocok dijadikan sebagai antioksidan (Waji dan Sugrani 2009). Golongan flavonoid terbesar di dalam daun api-api adalah antosianin, flavonol, flavon, dan glikoflafon. Antosianin merupakan pigmen pewarna daun yang paling penting dan larut dalam air (polar) (Harborne 1987). Hal ini terlihat jelas pada saat dilakukan proses ekstraksi, daun api-api mengeluarkan warna hijau tua yang cukup pekat (Lampiran 5), warna hijau tersebut diduga karena terdapat banyak pigmen antosianin yang ikut larut pada saat ekstraksi berlangsung. Golongan flavonoid lainnya tersebar luas dan membantu penyerapan sinar matahari dalam proses fotosintesis.
Bagian tanaman
Jenis tanaman
Api-api Aegle marmelosa Seledrib Jati Belandac Tempuyungc
Daun 1,18 0,824 0,51 3,0480 0,7537
-Flavonol yang terkandung dalam daun dan kulit batang api-api mengandung kuersetin dan glikosida. Kuersetin berperan dalam menangkap radikal bebas dan mengkhelat ion logam transisi, hal ini ditunjukkan dari aktivitas antikosidan yang dilakukannya. Daun dan kulit batang pohon api-api menunjukkan aktivitas antioksidan yang sangat baik, terlihat adanya perubahan warna yang dapat dilihat secara kasat mata. Warna yang ditunjukkan adalah warna kuning setelah diberi radikal bebas DPPH (Lampiran 3). Warna kuning menunjukkan reaksi antara radikal bebas yang terikat dengan senyawa antioksidan (Molyneux 2004). Mekanisme perubahan warna DPPH yang terjadi akibat adanya reaksi penangkapan radikal bebas oleh senyawa antioksidan dapat dilihat pada Gambar 3.
Senyawa polifenol misalnya flavonoid memiliki aktivitas antioksidan yang berkaitan erat dengan struktur rantai samping dan juga substitusi pada cincin aromatiknya. Kemampuannya untuk bereaksi dengan radikal bebas DPPH dapat mempengaruhi kekuatan antioksidannya. Aktivitas peredaman radikal bebas senyawa flavonoid yang terkandung dalam daun dan kulit batang pohon api-api diduga akibat pengaruh jumlah dan posisi hidrogen fenolik dalam molekul inti flavonoidnya. Akibat pengaruh jumlah dan posisi hidrogen fenolik itulah yang mengakibatkan daun dan kulit batang api-api memiliki aktivitas antioksidan yang sangat tinggi.
Flavonoid dalam daun dan kulit batang pohon api-api mengandung banyak atom hidrogen yang mampu menggantikan atau mengkhelat logam radikal bebas pemicu spesies pembentuk kanker. Pengkhelatan logam radikal bebas oleh flavonoid dapat dilihat pada Gambar 12.
F-OH + R F-O + RH
Gambar 11 Mekanisme pengkhelatan logam radikal bebas oleh flavonoid
(Sumber: Kumaret al.2011a)
terhindar dari pemicu penyakit degeneratif seperti kanker. Tingginya aktivitas antioksidan yang dimiliki terbukti dengan adanya perubahan warna dari ungu menjadi kuning, hal itu menandakan banyaknya gugus hidroksil yang mampu mengikat logam radikal bebas.
5 KESIMPULAN DAN SARAN
5.1 Kesimpulan
Penghitungan bobot kering didapatkan daun pohon api-api mengandung air 69,2 %, abu 14,91 %, protein 11,04 %, dan lemak 2,21 %. Sedangkan kulit batang pohon api-api mengandung air 55 %, abu 9,6 %, protein 6,4 %, dan lemak 1,55 %. Ekstrak kasar daun mengandung senyawa bioaktif alkaloid, steroid/triterpenoid, flavonoid, dan tanin. Ekstrak kasar kulit batang mengandung steroid/triterpenoid, flavonoid, fenol hidrokuinon, dan tanin.
Kadar flavonoid total daun 1,18 % dan kulit batang 0,67 %. Nilai IC50 ekstrak daun pohon api sebesar 36,35 ppm dan ekstrak kulit batang pohon api sebesar 51,51 ppm. Adanya kandungan flavonoid yang tinggi pada daun api-api serta nilai IC50 yang rendah, menunjukkan bahwa daun api-api memiliki aktivitas antioksidan yang cukup kuat bila dibandingkan dengan kulit batang api-api. Hal tersebut membuktikan bahwa daun api-api dapat digunakan sebagai antioksidan dan menjadi antioksidan pengganti BHT, karena sama-sama memiliki aktivitas antioksidan yang kuat (<50 ppm). Selain sebagai antioksidan, flavonoid dalam daun dan kulit batang api-api dapat digunakan sebagai antimikrobial, antifungial, antiinflamasi dan obat-obatan yang dapat dimanfaatkan dalam bidang kesehatan, farmasi serta kecantikan seperti kosmetika.
5.2 Saran
SENYAWA AKTIF ANTIOKSIDAN
SILVIA HANDAYANI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
SILVIA HANDAYANI. C34080083. Kandungan Flavonoid Kulit Batang dan Daun Pohon Api-api (Avicennia marina (Forks.)Vierh.) sebagai Senyawa Aktif Antioksidan. Dibimbing oleh NURJANAH dan RUDDY SUWANDI.
Api-api merupakan tumbuhan yang banyak dimanfaatkan oleh masyarakat untuk makanan maupun obat-obatan, tanaman ini diambil dari Pantai Ekowisata Mangrove, Pantai Kapuk, Muara Karang, Jakarta Utara. Tujuan dilakukannya penelitian ini adalah untuk menentukan komponen bioaktif, kadar flavonoid total, dan aktivitas antioksidan daun dan kulit batang pohon api-api. Pengujian yang dilakukan meliputi ekstraksi komponen bioaktif, analisis proksimat, uji aktivitas antioksidan dengan metode DPPH, uji kadar flavonoid total dan uji fitokimia.
SENYAWA AKTIF ANTIOKSIDAN
SILVIA HANDAYANI C34080083
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Aktif Antioksidan
Nama : Silvia Handayani
NRP : C34080083
Program Studi : Teknologi Hasil Perairan
Menyetujui,
Dosen Pembimbing I Dosen Pembimbing II
Dr. Ir. Nurjanah, MS Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP.1959 1013 1986 01 2 002 NIP.1958 0511 1985 03 1 002
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP.1958 0511 1985 03 1 002
Dengan ini saya menyatakan bahwa skripsi dengan judul “Kandungan Flavonoid Kulit Batang dan Daun Pohon Api-api (Avicennia marina (Forks.)Vierh.) sebagai Senyawa Aktif Antioksidan” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi negeri manapun. Sumber informasi yang digunakan atau dikutip dari karya yang telah diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka pada bagian akhir skripsi ini.
Syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT, karena berkat rahmat serta hidayah-Nya, penulis dapat menyelesaikan penyusunan skripsi ini dengan baik.
Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan Gelar Sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Skripsi
hasil penelitian ini berjudul ”Kandungan Flavonoid Kulit Batang dan Daun Pohon
Api-api (Avicennia marina(Forks.)Vierh.) sebagai Senyawa Aktif Antioksidan”. Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu penulis selama penyusunan skripsi ini, terutama kepada :
1. Dr. Ir. Nurjanah, MS dan Dr. Ir. Ruddy Suwandi, MS, M.Phil. selaku dosen pembimbing, atas segala bimbingan dan pengarahan yang diberikan kepada penulis.
2. Dr. Ir. Ruddy Suwandi, MS, M.Phil. selaku Ketua Departemen Teknologi Hasil Perairan.
3. Dr. Ir. Agoes Mardiono Jacoeb, Dipl.-Biol. selaku Ketua Program Studi S1 Departemen Teknologi Hasil Perairan.
4. Keluarga penulis yang selalu memberi semangat, materi, doa dan motivasi selama penyusunan skripsi ini.
5. Asisten mata kuliah Pengetahuan Bahan Baku Industri Hasil Perairan 2011-2012.
6. Laboran Laboratorium Pengetahuan Bahan Baku Indurtri Hasil Perairan yang banyak membantu selama penelitian.
7. Fitri, Fitriany, Hilma, Dwilina, Aulia, Ningrum, Euis, Anggraeni, Iis, Hana, Dwisari, Riviani, Yunisha yang sudah membantu saat penulis melakukan penelitian dan memberi semangat baik dalam suka maupun duka.
8. Sahabat Teknologi Hasil Perairan 45 terhebat yang selalu menemani penulis selama kuliah sampai pembuatan skripsi ini selesai.
moril dalam penyusunan skripsi.
Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak kekurangannya. Oleh karena itu, penulis mengharapkan saran dan kritik yang bersifat membangun dari berbagai pihak dalam proses penyempurnaan skripsi ini. Semoga tulisan ini bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Januari 2013
Penulis dilahirkan di Jakarta pada tanggal 22 Februari 1989 sebagai anak kedua dari Ibu Naila dan Bapak Hermansyah. Penulis memulai jenjang pendidikan formal di SDN Kalibata 04 Pagi Jakarta Selatan (tahun 1995-2001), selanjutnya penulis melanjutkan pendidikannya di SMPN 41 Jakarta (tahun 2001-2004), kemudian penulis melanjutkan ke jenjang yang lebih tinggi ke sekolah menengah atas di SMAN 38 Jakarta dan lulus pada tahun 2007. Penulis melanjutkan pendidikannya di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Selama masa perkuliahan, penulis aktif dalam berbagai organisasi dan kepanitiaan, yaitu Himpunan Mahasiswa Teknologi Hasil Perairan, kepanitiaan
“HACCP 2010” sebagai anggota divisi acara. Penulis juga aktif sebagai asisten
praktikum mata kuliah Pengetahuan Bahan Baku Industri Hasil Perairan 2011-2012 dan asisten praktikum mata kuliah Teknologi Pengolahan Hasil Perairan 2011-2012. Penulis juga aktif pada kegiatan diluar akademik antara lain menjadi anggota Green TV IPB sebagai presenter tahun 2011-2012.
Nomor Halaman 1. Sifat berbagai golongan flavonoid. ...14 2. Hasil uji fitokimia ekstrak kasar api-api (A. marina(Forks.)Vierh.)...30 3. Hasil uji aktivitas antioksidan ekstrak daun dan
Nomor Halaman 1. Pohon api-api (Avicennia marina(Forks.)Vierh.) ...3 2. Struktur kimiabutylated hydroxytoluene(BHT) ...7 3. Mekanisme perubahan warna DPPH akibat pengaruh antioksidan ...8 4. Struktur dasar flavonoid...13 5. Struktur dasar senyawa flavonoid dan proses peredaman
radikal bebas oleh senyawa flavonoid ...16 6. Proses penelitian secara garis besar ...19 7. Pohon api-api yang diambi dan dijadikan sebagai sampel ...27 8. Hasil data proksimat tumbuhan api-api (A. marina(Forks.)Vierh.) ...28 9. Grafik perbandingan aktivitas antioksidan antara ekstrak kasar
daun dan kulit batang api-api dengan persen inhibisinya ...33 10. Grafik hubungan konsentrasi BHT dengan persen inhibisi...34 11. Mekanisme pengkhelatan logam radikal bebas
Nomor Halaman 1. Gambar sampel pohon api-api (Avicennia marina(Forks.)Vierh.) ...46 2. Perhitungan analisis proksimat dan rendemen ekstrak ...47 3. Gambar hasil uji fitokimia daun dan kulit batang api-api
(Avicennia marina(Forks.)Vierh.), serta perubahan warna
1 PENDAHULUAN
1.1 Latar Belakang
Meningkatnya ilmu dan teknologi pengolahan yang ada, telah mengubah pola komsumsi manusia terhadap kebutuhan sandang dan pangannya. Manusia cenderung lebih memilih sesuatu yang bersifat instan atau langsung dapat dinikmati tanpa waktu yang lama. Pola komsumsi tersebut memaksa produsen untuk mengganti bahan tambahan yang bersifat alami menjadi bahan tambahan yang bersifat sintetik atau buatan. Bahan tambahan sintetik digunakan karena sifatnya yang relatif murah dan tidak membutuhkan jumlah yang banyak, apabila dibandingkan bahan tambahan alami yang sifatnya relatif mahal. Hal tersebut tidak dibenarkan apabila melihat dampak negatif yang ditimbulkan jika penambahan bahan tambahan sintetik masuk ke dalam tubuh secara terus menerus.
Bahan tambahan antioksidan banyak digunakan oleh produsen untuk menghemat biaya dan waktu produksi. Bahan tambahan antioksidan yang sering digunakan adalah butylated hydroxytoluene atau lebih dikenal dengan BHT. Antioksidan BHT ini banyak digunakan dalam pangan, kesehatan maupun kecantikan. Penggunaan BHT secara terus menerus akan terakumulasi di dalam tubuh dan dapat menyebabkan penyakit karsinogenik. Antioksidan alami flavonoid, alkaloid, steroid/triterpenoid yang berasal dari tumbuhan sangat dibutuhkan untuk menggantikan antioksidan sintetik BHT.
Tumbuhan yang dapat dijadikan pengganti antioksidan sintetik adalah api-api (Avicennia marina (Forks.)Vierh.). Api-api merupakan salah satu tumbuhan yang hidup di wilayah hutan mangrove. Pohon api-api mempunyai bentuk yang khusus dalam penyesuaian diri terhadap lingkungan mangrove dan mempunyai mekanisme fisiologis dalam mengontrol garam (Nybakken 1992). Pohon api-api banyak tumbuh di daerah yang paling dekat dengan laut, dengan substrat agak berpasir, keadaan tanah berlumpur agak lembek, dan biasa berasosiasi dengan Sonneratia sp. yang dominan tumbuh pada lumpur dalam yang kaya bahan organik (Bengen 2001).
tumbuhan termasuk daun, akar, kayu, kulit, bunga, buah dan biji. Flavonoid bersifat polar karena mengandung sejumlah hidroksil yang tak tersulih atau suatu gula (Markham 1988 dalam Silaban 2009). Flavonoid dalam buah-buahan, sayuran, teh, tanaman obat, telah menarik perhatian terbesar dan telah dipelajari secara ekstensif, karena sangat efektif untuk dijadikan antioksidan dengan toksisitas lebih rendah dari antioksidan sintetik misalnya BHA dan BHT (Pekkarinenetet al. 1999dalamCaiet al.2010).
Penelitian pada daun api-api (Avicennia marina (Forsk.) Vierh) pernah dilakukan oleh Afzal et al. (2011) mengenai manfaat dari ekstrak daun api-api sebagai antifungi dan penyakit alergi kulit. Yusuf (2010) juga melakukan penelitian pada kulit batang api-api (Marina marina Nesh) yang ternyata mengandung senyawa triterpenoid yang efektif dijadikan antimikroba. Begitu pula penelitian yang dilakukan oleh Purnobasuki (2004), api-api (Avicennia officinalis) mengandung senyawa saponin yang berkhasiat sebagai aktivitas sitotoksik, antimikroba, dan antiperadangan. Penelitian tentang kandungan flavonoid sebagai antioksidan pada daun dan kulit batang Avicennia marina (Forks.)Vierh. belum dilakukan, sehingga perlu dilakukan penelitian lebih lanjut untuk mengetahui kandungan flavonoid yang terkandung dalam daun dan kulit batang api-api yang dapat digunakan sebagai pengganti antioksidan sintetik.
1.2 Tujuan
2 TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Api-api (Avicennia marina(Forks.)Vierh.) Api-api merupakan salah satu tumbuhan mangrove yang termasuk kedalam Famili Avicenniaceae/Verbenaceae. Api-api banyak ditemukan di ekosistem mangrove yang terletak paling luar atau dekat dengan lautan. Hidup di tanah berlumpur agak lembek atau dangkal, dengan substrat berpasir, sedikit bahan organik dan kadar garam tinggi (Afzal et al. 2011). Klasifikasi Avicennia marina(Forks.)Vierh. menurut Bengen (2001) adalah sebagai berikut:
Kingdom : Plantae Filum : Thacheophyta Kelas : Magnoliopsida Ordo : Sapindales Famili : Avicenniaceae Genus :Avicennia
Spesies :Avicennia marina(Forks.)Vierh. (Gambar 1)
Gambar 1 Pohon api-api (Avicennia marina(Forks.)Vierh.)
Sumber: Wibowoet. al(2009)