I. PENDAHULUAN
1.
LATAR BELAKANG
Temulawak (Curcuma xanthorrhiza Roxb.) merupakan salah satu jenis temu-temuan yang termasuk dalam marga Zingiberaceae. Masyarakat mengenal temulawak sebagai ramuan obat tradisional. Bagian tanaman temulawak yang banyak dimanfaatkan adalah bagian rimpang. Rimpang temulawak mengandung senyawa felandren, kamfer, turmenol, tolilmetilkarbinol, xanthorrizol, kurkumin, pati dan resin (Aliadi et.al, 1996). Zat warna kuning kurkumin pada temulawak bekerja sebagai kolekinetik, sedangkan minyak atsirinya (felandren, kamfer, turmenol, tolilmetilkarbinol dan xanthorrizol) berfungsi sebagai pencegah gangguan fungsi empedu yang biasa dikenal dengan istilah koleretik (Departemen Kesehatan RI, 1989).
Dewasa ini produksi temulawak tidak hanya dilakukan untuk memenuhi kebutuhan dalam negeri, tetapi juga untuk memenuhi kebutuhan ekspor tanaman obat ke luar negeri. Produk temulawak yang diekspor umumnya berupa temulawak segar dan temulawak kering. Aktivitas ekspor temulawak yang menitikberatkan pada temulawak segar dan temulawak kering berakibat pada sering ditolaknya ekspor temulawak Indonesia oleh negara importir. Negara importir menilai bahwa pengiriman temulawak segar dan temulawak kering berdampak signifikan terhadap penurunan mutu temulawak, sehingga temulawak ekspor akan memiliki mutu yang rendah.
Faktor penyebab terjadinya penurunan mutu temulawak yaitu pengeriputan, perkecambahan, dan pencemaran mikroba akibat kurangnya perhatian terhadap kondisi sanitasi pada saat pengeringan dan pengepakan. Selain itu, umumnya temulawak yang di ekspor dalam bentuk segar mengalami perubahan bau (off flavor). Hal ini dikarenakan temulawak mengandung enzim-enzim, terutama enzim lipase, yang dapat merubah lemak menjadi asam lemak bebas penyebab ketengikan.
Penurunan mutu temulawak dapat dihindari dengan cara melakukan ekstraksi sehingga dihasilkan oleoresin temulawak. Di samping menghindari penurunan mutu, produksi ekstrak temulawak juga dapat memberikan keuntungan dalam hal pembiayaan dikarenakan minimnya kebutuhan biaya produksi. Alasan inilah yang mendorong para pelaku industri untuk meningkatkan pendapatan perusahaan mereka melalui produksi ekstrak temulawak.
Ekstrak temulawak dapat diperoleh melalui ekstraksi sederhana, ekstraksi khusus dan perendaman rajangan atau bubuk temulawak ke dalam air panas. Ekstraksi melalui perendaman dinilai kurang efektif, mengingat bahwa kurkumin yang terkandung dalam temulawak memiliki sifat tidak larut dalam air. Dengan demikian ekstraksi kurkumin tidak dapat terjadi secara optimal dan mengalami kerusakan akibat tingginya suhu air. Jika dibandingkan dengan metode perendaman, metode ekstraksi sederhana dan ekstraksi khusus merupakan perlakuan yang lebih baik
2.
TUJUAN
II. TINJAUAN PUSTAKA
2.1.
BOTANI TEMULAWAK
Berdasarkan klasifikasinya temulawak merupakan tanaman yang termasuk dalam: Kingdom : Plantae
Divisi : Spermathophyta Subdivisi : Angiospermae Kelas : Monocotyledone Ordo : Zingiberales Famili : Zingiberaceae
Genus : Curcuma
Spesies : Curcuma xanthorrhiza Roxb.
Temulawak merupakan terna berbatang semu dengan tinggi kurang lebih dua meter dan berwarna hijau atau coklat gelap. Temulawak memiliki akar rimpang berwarna hijau gelap yang terbentuk sempurna dengan percabangan yang kuat. Batang temulawak memiliki dua hingga sembilan lembar daun berwarna hijau atau coklat keungunan yang berbentuk memanjang. Ciri lain dari temulawak adalah perbungaan lateral, tangkai ramping, sisik berbentuk garis dan berbulu halus, bentuk bulir bulat memanjang dan memiliki daun pelindung yang banyak, serta mahkota bunga berbentuk tabung berwarna putih atau kekuningan.
Di wilayah Jawa, temulawak dapat ditemukan di pekarangan rumah, tegalan, serta dapat juga tumbuh liar di hutan jati. Temulawak dapat ditanam pada tanah berat berstruktur liat, tetapi untuk memperoleh hasil yang baik maka temulawak perlu ditanam pada tanah yang subur dan baik tata perairannya, yakni dengan curah hujan antara 1500 - 4000 mm per tahun (Depkes RI, 1993). Sudarman dan Harsono (1980) menyatakan bahwa temulawak dapat tumbuh hingga ketinggian 1800 m diatas permukaan laut. Temulawak juga dapat tumbuh pada tanah berkapur, tanah ringan berpasir atau tanah liat.
Temulawak merupakan tumbuhan asli Indonesia yang berasal dari Pulau Jawa dan kemudian menyebar ke wilayah Indonesia lainnya. Mengacu pada Supriadi (2001), temulawak turut pula dikenal dengan beberapa nama daerah, seperti tetemulawak (Sumatera), kunyitetumbu (Aceh) koneng gede
(Jawa Barat) dan temu lobak (Madura).
2.2.
KOMPOSISI KIMIA TEMULAWAK
Menurut Sinambela (1985) dalam Widyasari (2000), semua bagian temulawak umumnya berkhasiat namun bagian yang dinilai paling berharga adalah bagian rimpang. Rimpang menjadi bagian tanaman yang paling berharga karena kandungan kimia yang terkandung di dalamnya sangat bermanfaat sebagai sumber bahan pangan, bahan baku industri, dan bahan baku obat.
Rimpang temulawak mengandung zat kuning kurkumin, minyak atsiri, pati, protein, lemak
(fixed oil), selulosa dan mineral (Ketaren,1988). Dalam Sidik et al. (1995) dinyatakan bahwa fraksi
pati merupakan kandungan kimia paling banyak yang terdapat dalam rimpang temulawak. Pati tersebut berbentuk serbuk berwarna putih kekuningan serta memiliki bentuk bulat telur hingga lonjong dengan salah satu ujungnya berbentuk persegi. Pati temulawak terdiri dari abu, protein, lemak, karbohidrat, serat kasar, kalium, natrium, kalsium, magnesium, besi, mangan dan kadmium. Dengan kandungan tersebut pati temulawak dapat dikembangkan sebagai bahan makanan.
Kandungan kimia dalam rimpang temulawak dibedakan atas fraksi pati, fraksi kurkuminoid dan fraksi minyak atsiri (Sidik et al, 1995). Fraksi kurkuminoid merupakan komponen yang memberi warna kuning pada rimpang temulawak. Adanya kandungan kurkuminoid pada temulawak turut pula diungkapkan dalam hasil penelitian Suwiyah (1991). Hasil penelitian tersebut menunjukkan bahwa temulawak mengandung zat kurkuminoid yang memberikan warna kuning pada rimpang temulawak dan memiliki khasiat medis. Lebih lanjut Sidik et al. (1995) menyatakan bahwa Komponen kurkuminoid (C25H32O6) dalam temulawak meliputi kurkumin (C21H20O6) dan
desmetoksikurkumin (C20H18O6). Kurkumin memiliki bobot molekul sebesar 368 g/mol, sedangkan
desmetoksikurkumin memiliki bobot molekul sebesar 338 g/mol.
Komponen kurkuminoid digunakan sebagai zat warna dalam makanan, minuman dan kosmetika. Selain itu komponen kurkuminoid diketahui memiliki berbagai aktifitas biologis dalam spektrum yang lebih luas. Kurkuminoid dari rimpang temulawak tidak mengandung bisdesmetoksikurkumin sehingga temulawak lebih efektif untuk sekresi empedu dibandingkan dengan rimpang kunyit. Hal ini disebabkan oleh aktivitas kurkumin dan desmetoksikurkumin yang berlawanan dengan aktivitas bisdesmetoksikurkumin untuk sekresi empedu. Struktur kurkumin dan desmetoksikurkumin masing-masing terdapat pada Gambar 2 dan Gambar 3.
Gambar 2. Struktur kurkumin
Dalam Sidik et al. (1995) diterangkan bahwa kandungan kurkuminoid pada temulawak menjadikan tanaman ini sebagai anti inflamasi. Anti inflamasi adalah aktivitas menekan atau mengurangi peradangan. Manfaat lain dari rimpang tanaman ini adalah sebagai obat jerawat, meningkatkan nafsu makan, anti kolesterol, anemia, anti oksidan, pencegah kanker, anti mikroba dan meningkatkan kerja ginjal. Temulawak memiliki aktivitas diuretika yang berfungsi mempercepat pembentukan urin sehingga meningkatkan kinerja ginjal.
Menurut Liang et al. (1985), kurkuminoid rimpang temulawak berkhasiat menetralkan racun, menghilangkan rasa nyeri sendi menghilangkan sekresi empedu, menurunkan kadar kolesterol darah, mencegah terjadinya pembekuan lemak dalam sel hati, serta sebagai antioksidan. Penggunaan temulawak dalam ramuan obat tradisional yaitu sebagai bahan utama (remedium cardinale), bahan penunjang (remedium adjuvans), korigensia warna (corrigentia coloris) serta korigensia aroma
(corrigentia odoris).
Fraksi minyak atsiri yang terkandung dalam rimpang temulawak terdiri dari senyawa turunan
monoterpen dan seskuiterpen. Senyawa turunan monoterpen, terdiri dari 1.8 sineol, borneol, α –
felandren dan kamfor, sedangkan senyawa turunan seskuiterpen terdiri dari β – kurkumin,
sikloisoprenmirsen, xanthorrizhol, bisa kuronepoksida, tumeron, α – atlanton, ar – kurkumen,
zingiberen, β – bisabolen, bisakuron A,B,C, ar – tumeron dan germaken. Fraksi minyak atsiri rimpang temulawak mempunyai aktifitas biologik dengan spektrum luas yang dalam berapa hal bekerja sinergetik dengan fraksi kurkuminoid (Sidik et al, 1995).
Kadar kurkumin dalam kurkuminoid rimpang temulawak adalah 58 - 71%, sedangkan kadar desmetoksikurkumin bernilai antara 29 - 42%. Wijayakusuma (2002) menyampaikan bahwa rimpang temulawak mengandung pati, abu, protein, serat, kurkumin, glikosida, toluil metil karbinol, L-sikloiprenmirsen, essoil, kalium oksalat, serta minyak atsiri yang terdiri dari felandren, kamfer, borneol, tumerol, xantorizol dan sineal. Menurut Rismunandar (1988) dalam Widyasari (2000), kandungan kurkumin dalam rimpang temulawak mencapai 1,4 – 4 %. Berdasarkan Purseglove (1981) dalam Widyasari (2000), pigmen kurkumin larut dalam pelarut polar seperti etanol 95%. Keseluruhan komposisi rimpang temulawak dijelaskan secara terperinci pada Tabel 1.
Tabel 1. Komposisi Rimpang Temulawak
Komposisi Kadar (% Basis Kering)
Air Pati Lemak Minyak atsiri Kurkumin Protein Serat kasar Abu
75,18 27,62 5,38 10,96
1,93 6,44 6,89 3,96 Sumber : Suwiah (1991)
Analisis kurkuminoid dapat dilakukan dengan beberapa cara, antara lain spektroskopi sinar tampak, titrasi volumetrik dan kromatografi. Analisis kuantitatif dengan sinar tampak dilakukan berdasarkan reaksi pembentukan rubrokurkumin atau rososianin pada panjang gelombang 530 nm (Sidik et al. 1992). Berdasarkan metode yang dikeluarkan oleh ASEAN pada tahun 1993, analisis kuantitatif dengan sinar tampak dapat pula dilakukan dengan menggunakan panjang gelombang 420 nm.
2.3.
EKSTRAKSI
Ekstraksi adalah proses penarikan komponen aktif dari suatu campuran padatan dan/atau cairan dengan menggunakan pelarut tertentu. Proses ini merupakan langkah awal yang penting dalam penelitian tanaman obat, karena preparasi ekstrak kasar tanaman merupakan titik awal untuk isolasi dan pemurnian komponen kimia yang terdapat dalam tanaman (Mandal et al. 2007). Bombardelli (1991) menyatakan bahwa ekstraksi senyawa aktif dari tanaman obat adalah pemisahan secara fisik atau kimiawi dengan menggunakan cairan atau padatan dari bahan padat.
Perlakuan pendahuluan sebelum ekstraksi sangat penting untuk mempermudah proses ektraksi. Perlakuan pendahuluan ini tergantung dari sifat senyawa yang terdapat dalam bahan yang akan diekstraksi (Robinson, 1995). Perlakuan pendahuluan untuk bahan yang mengandung minyak adalah dengan pengeringan dan pengecilan ukuran bahan. Pengeringan dilakukan sampai kadar air tertentu lalu dilanjutkan dengan penggilingan untuk mempermudah proses ekstraksi, serta mempermudah kontak antar bahan dengan pelarut sehingga ekstraksi berlangsung dengan baik (Harbone, 1996)
Ekstraksi bahan alam, terutama yang akan digunakan untuk obat, dapat dilakukan dengan cara perebusan, penyeduhan, maserasi, perkolasi atau cara lain yang sesuai dengan sifat bahan alam yang diekstraksi. Dalam suatu pemisahan yang ideal oleh ekstraksi pelarut, seluruh zat yang diinginkan akan berakhir dalam suatu pelarut sedangkan zat-zat yang tidak diinginkan berada pada pelarut yang lain. Ekstraksi ganda merupakan salah satu teknik pemisahan yang lebih akurat dibandingkan ekstraksi tunggal Ekstraksi pelarut adalah metode yang efektif untuk mengekstrak kurkuminoid (Jayaprakasha et al, 2005). Di antara banyak pelarut organik, pelarut etanol adalah salah satu pelarut yang cocok untuk memisahkan kurkuminoid yang optimal (Photitirat et al, 2004).
Pemilihan pelarut merupakan faktor yang menentukan dalam ekstraksi. Pelarut yang digunakan dalam ekstraksi harus dapat menarik komponen aktif dari campuran. Hal-hal penting yang harus diperhatikan dalam memilih pelarut adalah selektivitas, sifat pelarut, kemampuan untuk mengekstraksi, tidak bersifat racun, mudah diuapkan dan harganya relatif murah (Gamse, 2002). Perendaman suatu bahan dalam pelarut dapat meningkatkan permeabilitas dinding sel dalam tiga tahapan, yaitu masuknya pelarut kedalam dinding sel tanaman atau pembengkakan sel, kemudian senyawa yang terdapat dalam dinding sel akan terlepas dan masuk ke dalam pelarut, diikuti oleh difusi senyawa yang terekstraksi oleh pelarut keluar dari dinding sel.
Disampaikan oleh Purseglove et al. (1981) bahwa ekstraksi rimpang temulawak untuk memperoleh oleoresin dapat dilakukan dengan menggunakan pelarut polar. Etilen diklorida merupakan pelarut polar yang paling banyak digunakan, tetapi etanol merupakan pelarut yang paling aman dan tidak beracun (Somaatmadja, 1981). Etanol mempunyai polaritas yang tinggi, sehingga dapat mengekstrak oleoresin lebih banyak daripada pelarut lain seperti aseton dan heksana. Etanol merupakan etil alkohol dengan rumus kimia C2H5OH, yaitu cairan yang tidak berwarna, mudah
menguap, berbau merangsang, dan mudah larut dalam air.
Tabel 2. Jenis-jenis pelarut dan titik didihnya*
Jenis Pelarut Titik Didih
(oC) Aseton
Metanol Hexana Etil Asetat Etil Alkohol Etilen Diklorida
56.5 64.7 69.0 77.1 78.4 83.5 *Scheflan dan Jacobs, 1953
Proses pemisahan pelarut merupakan tahapan yang sangat penting dalam ekstraksi. Teknik pemisahan pelarut menentukan kandungan sisa pelarut yang dapat mempengaruhi mutu ekstrak yang dihasilkan. Pelarut yang memiliki titik didih yang rendah beresiko kehilangan pelarut yang lebih besar akibat proses penguapan, sedangkan pelarut yang memiliki titik didih tinggi harus dipisahkan pada suhu yang lebih tinggi. Produk yang baik harus bebas dari sisa pelarut karena sisa pelarut selain dapat mengurangi kualitas produk juga dapat mempengaruhi aroma produk. United State Food and Drug Administration (US-FDA) memberikan batasan jumlah sisa pelarut yang diperkenankan terdapat dalam produk seperti Tabel 3.
Tabel 3. Residu pelarut yang ditetapkan US-FDA dalam produk*
Jenis Pelarut Residu (ppm)
Aseton Metanol Hexana Etil Asetat Etil Alkohol Etilen Diklorida
30 50 25 50 30 30 *Farrel, 1985
Berdasarkan fase yang terlibat, terdapat dua jenis ekstraksi, yaitu ekstraksi cair-cair dan ekstraksi padat-cair. Pada ekstraksi padat-cair terjadi pemindahan komponen dari padatan ke pelarut melalui tiga tahapan, yaitu difusi pelarut ke pori-pori padatan, pelarutan solut oleh pelarut di dalam pori tersebut, dan pemindahan larutan dari pori menjadi larutan ekstrak. Proses ekstraksi padat-cair dipengaruhi oleh banyak faktor, antara lain waktu ekstraksi, suhu yang digunakan, pengadukan, dan banyaknya pelarut yang digunakan (Harborne, 1996).
Menurut List (1989), perendaman suatu bahan dapat meningkatkan permeabilitas dinding sel melalui masuknya pelarut kedalam dinding sel sehingga membuat sel membengkak. Pembengkakan sel dapat menyebabkan senyawa yang terdapat dalam dinding sel tanaman akan terlepas dan masuk ke dalam pelarut. Hal ini menyebabkan difusi senyawa yang terekstraksi oleh pelarut keluar dari dinding sel tanaman.
Harborne (1996) mengatakan bahwa metode ekstraksi dapat dikelompokan menjadi dua yaitu ekstraksi sederhana dan ekstraksi khusus. Ekstraksi sederhana meliputi maserasi, perkolasi, reperkolasi, evakolasi, dan dialokasi. Ekstraksi khusus meliputi sokletasi, arus balik dan ultrasonik.
filtrat digabungkan pada tahap akhir ( List, 1989). Pada proses perkolasi, ekstraksi dilakukan dengan menggunakan pelarut segar. Hanya pelarut segar yang digunakan dalam proses ini sehingga membutuhkan waktu yang lama dan jumlah pelarut yang banyak. Proses reperkolasi menggunakan pelarut segar dan hasil perkolasi pertama yang digabungkan untuk ekstraksi berikutnya ( List, 1989).
Gambar 4. Diagram perbandingan metode perkolasi dengan reperkolasi
Berdasarkan hasil penelitian Moestafa (1976), ekstraksi oleoresin dengan cara perkolasi selama tiga jam menghasilkan oleoresin lebih tinggi daripada ekstraksi soxhlet selama delapan jam. Salah satu penyebab tingginya oleoresin menggunakan cara perkolasi karena mengalami proses pengadukan. Pengadukan yang baik akan meningkatkan kecepatan pelarutan dan meningkatkan intensitas kontak partikel bahan dengan pelarut (Erle, 1966). Oleoresin yang diperoleh dipengaruhi oleh lama ekstraksi, suhu dan jenis pelarut yang digunakan. Penggunaan suhu tinggi dapat mempercepat proses ekstraksi dan menyebabkan kerusakan terhadap komponen yang terkandung dalam bahan. Oleh karena itu penggunaan suhu dalam proses ekstraksi harus diperhatikan agar tidak merusak komponen oleoresin bahan. Pemanasan yang melebihi suhu 100oC akan menyebabkan penguraian komponen penyusun oleoresin, sehingga akan menimbulkan perubahan bau dan minyak atsiri banyak yang menguap (Sabel dan Warren, 1973).
Pada kondisi proses ekstraksi terdapat beberapa hal yang dapat mempengaruhi oleoresin yang dihasilkan yaitu penyiapan bahan sebelum ekstraksi, kondisi proses ekstraksi dan proses pemisahan pelarut dari hasil ekstraksi. Menurut Sutianik (1999) persiapan bahan mencakup pengeringan bahan sampai kadar air tertentu dan penggilingan, hal ini dimaksudkan untuk mempermudah proses ekstraksi yang dilakukan. Kadar air yang tinggi akan menyebabkan oleoresin yang terekstrak mengandung komponen larut dalam air seperti gula, sehingga menyebabkan perubahan aroma dan rasa.
Bahan yang diekstrak masih mengandung pelarut yang digunakan untuk melarutkan oleoresin, untuk itu maka pelarut harus dipisahkan dari oleoresin. Pemisahan pelarut dari oleoresin merupakan tahapan yang sangat penting karena pemisahan pelarut akan menentukan kandungan sisa pelarut yang masih tertinggal dalam oleoresin, sisa pelarut ini dapat mempengauhi mutu oleoresin ( Lestari, 2006).
2.4.
ANALISIS KUANTITATIF MENGGUNAKAN HPLC
High Performance Liquid Chromatography (HPLC) adalah sistem pemisahan dengan kecepatan dan efisiensi yang tinggi. Hal ini dikarenakan kemajuan teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sangat sensitif dan beragam. Peralatan penting yang terdapat dalam HPLC meliputi reservoir pelarut, pompa, injektor, kolom dan detektor. Proses pemisahan komponen sampel terjadi pada bagian kolom. Pemisahan komponen campuran dalam kolom dilakukan berdasarkan perbedaan penyerapan masing-masing komponen pada permukaan fase diam. Zat-zat
Pelarut segar
Bahan
Ekstrak
Bahan
Ekstrak
Pelarut segar Reperkolat
III. BAHAN DAN METODE
3.1. BAHAN DAN ALAT
3.1.1
Bahan Baku
Bahan baku yang digunakan adalah temulawak (Curcuma xanthorrhiza Roxb.) berumur sembilan bulan yang telah diiris dan dikeringkan. Temulawak tersebut diperoleh dari Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat Tradisional yang berlokasi di Tawangmangu.
3.1.2
Bahan Kimia
Bahan kimia yang digunakan adalah etanol teknis 70% , kloroform P, etanol 95%, H2SO4, NaOH, aseton, HCl, air destilat, etanol p.a, air bebas ion HPLC grade, dan berbagai
bahan kimia lain untuk analisis pengujian.
3.1.3
Alat
Peralatan yang digunakan meliputi erlenmeyer, shaker, perkolator, pompa, pipet volumetrik, neraca analitik, desikator, rotary evaporator, labu uap, gelas ukur, lemari asam,
grinder, cawan porselein, peralatan HPLC, tanur, pompa vakum serta berbagai macam
peralatan lainnya.
3.2.
METODE PENELITIAN
3.2.1
Penelitian Pendahuluan
Pada penelitian pendahuluan, dilakukan karakterisasi sifat fisika-kimia temulawak bubuk (kadar air, kadar abu total, kadar sari larut air, kadar sari larut etanol, kadar lemak, kadar serat kasar, serta kadar protein) dan penentuan waktu ekstraksi.
Sebelum dilakukan ekstraksi, rimpang temulawak yang telah kering digiling dengan menggunakan hammer mill dengan ukuran 20 mesh. Proses ekstraksi dilakukan sesuai suhu ruang yaitu 25oC dengan waktu 5, 10, 20, 40, 60, 80, 100, dan 120 menit. Penelitian pendahuluan ini berfungsi untuk menentukan washing time untuk mengekstrak temulawak.
3.2.2
Penelitian Utama
Berdasarkan pada penelitian pendahuluan, hasil washing time yang diperoleh digunakan sebagai acuan untuk menentukan waktu yang digunakan pada penelitian utama. Kesimpulan yang diperoleh dari penelitian pendahuluan mengenai washing time ekstraksi temulawak adalah selama 120 menit.
kental yang diperoleh dianalisis menggunakan alat HPLC (high performance liquid
chromatography).
Pada ekstraksi dengan metode maserasi, bahan diekstraksi langsung sesuai dengan jam yang telah ditentukan, kemudian disaring dan pelarutnya diuapkan dengan rotary evaporator
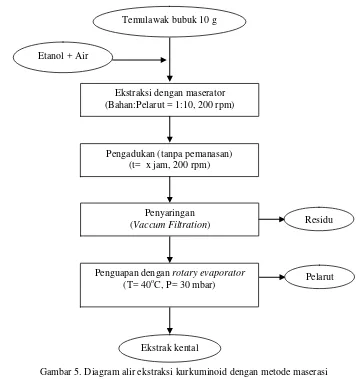
hingga tidak terdapat pelarut yang menetes. Pada metode ekstraksi remaserasi, bahan sebanyak 10 gram diekstraksi dengan pelarut sebanyak 100 ml selama dua jam, setelah itu disaring dan residu hasil saringan digunakan kembali untuk ekstraksi kedua. Pada ekstrasi remaserasi turut pula digunakan pelarut sebanyak 100 ml. Dengan demikian pada ekstraksi dengan metode remaserasi akan dibutuhkan pelarut dua kali lebih banyak dibandingkan dengan metode maserasi. Diagram alir untuk metode maserasi dan remaserasi masing-masing terdapat pada Gambar 5. dan Gambar 6.
Gambar 5. Diagram alir ekstraksi kurkuminoid dengan metode maserasi Temulawak bubuk 10 g
Etanol + Air
Ekstraksi dengan maserator (Bahan:Pelarut = 1:10, 200 rpm)
Pengadukan (tanpa pemanasan) (t= x jam, 200 rpm)
Penyaringan
(Vaccum Filtration)
Penguapan dengan rotary evaporator
(T= 40oC, P= 30 mbar)
Ekstrak kental
Residu
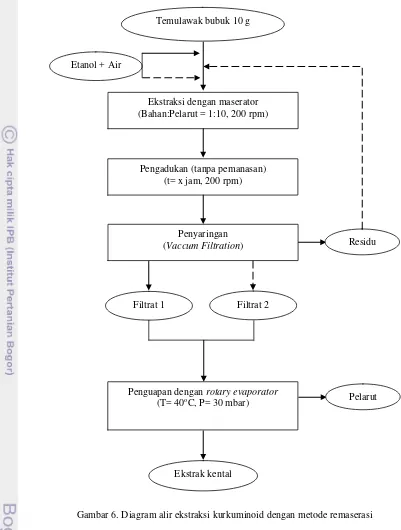
Gambar 6. Diagram alir ekstraksi kurkuminoid dengan metode remaserasi Temulawak bubuk 10 g
Etanol + Air
Ekstraksi dengan maserator (Bahan:Pelarut = 1:10, 200 rpm)
Pengadukan (tanpa pemanasan) (t= x jam, 200 rpm)
Penyaringan
(Vaccum Filtration)
Penguapan dengan rotary evaporator
(T= 40oC, P= 30 mbar)
Ekstrak kental
Residu
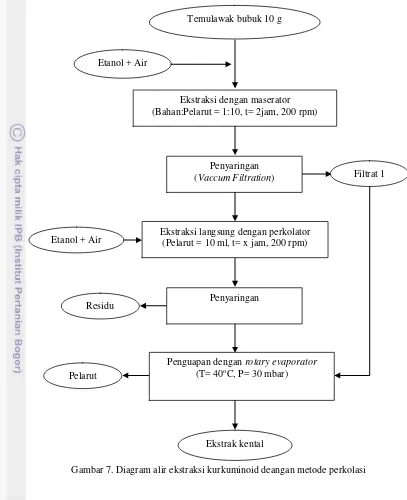
Gambar 7. Diagram alir ekstraksi kurkuminoid deangan metode perkolasi Penguapan dengan rotary evaporator
(T= 40oC, P= 30 mbar)
Ekstrak kental Pelarut
Penyaringan Temulawak bubuk 10 g
Etanol + Air
Ekstraksi dengan maserator (Bahan:Pelarut = 1:10, t= 2jam, 200 rpm)
Penyaringan
(Vaccum Filtration)
Ekstraksi langsung dengan perkolator (Pelarut = 10 ml, t= x jam, 200 rpm)
Filtrat 1
Etanol + Air
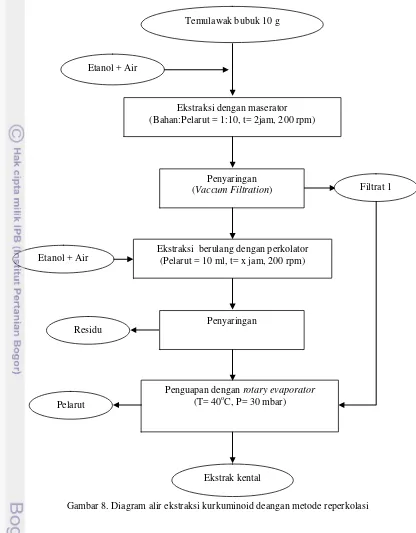
Gambar 8. Diagram alir ekstraksi kurkuminoid deangan metode reperkolasi Temulawak bubuk 10 g
Etanol + Air
Ekstraksi dengan maserator (Bahan:Pelarut = 1:10, t= 2jam, 200 rpm)
Penyaringan
(Vaccum Filtration)
Ekstraksi berulang dengan perkolator (Pelarut = 10 ml, t= x jam, 200 rpm)
Filtrat 1
Etanol + Air
Penguapan dengan rotary evaporator
(T= 40oC, P= 30 mbar)
Ekstrak kental Pelarut
IV. HASIL DAN PEMBAHASAN
4.1.
PENELITIAN PENDAHULUAN
4.1.1.
Analisis Kandungan Senyawa Kimia
Pada tahap ini dilakukan analisis proksimat terhadap kandungan kimia yang terdapat dalam temulawak kering yang akan menjadi sampel ekstraksi kurkumin. Analisis proksimat yang dilakukan meliputi kandungan kadar air, kadar pati, kadar lemak, kadar minyak atsiri, kadar protein, kadar serat kasar serta kadar abu. Tabel 4. menunjukkan hasil analisis proksimat terhadap rimpang temulawak yang digunakan dalam penelitian.
Tabel 4. Kadar proksimat rimpang temulawak kering
Komposisi Kadar
(%)
Air Pati Lemak Minyak atsiri Protein Serat kasar Abu
14.97 58.56 7.45 Tidak terukur*
7.07 7.63 5.07
Keterangan: * Nilai relatif sangat kecil
Rimpang temulawak merupakan tanaman herbal yang mengandung air, pati, lemak, protein, abu serat, minyak atsiri dan kurkuminoid. Kandungan kimia tersebut menjadi alasan kuat penggunaan temulawak sebagai sumber bahan pangan, bahan baku obat, dan bahan baku industri. Dalam rimpang temulawak terdapat senyawa minyak atsiri yang merupakan pemberi aroma pada temulawak. Menurut Herman (1995) kadar minyak atsiri yang terdapat dalam temulawak bernilai 3-12%, tetapi pada penelitian ini kadar minyak atsiri rimpang temulawak tidak dapat dihitung. Tidak terukurnya kadar minyak atsiri pada rimpang temulawak dapat disebabkan oleh beberapa hal, antara lain proses pengeringan yang terlalu lama, suhu pengeringan yang terlalu tinggi, ukuran bahan, serta proses penyimpanan.
Proses pengeringan yang terlalu lama berakibat pada hilangnya minyak atsiri yang terkandung dalam bahan. Minyak atsiri memiliki sifat mudah menguap dan suhu pengeringan yang terlalu tinggi dapat menyebabkan kerusakan pada minyak atsiri. Pada penelitian ini lama waktu pengeringan tidak ditentukan, sedangkan suhu pengeringan ditetapkan sebesar 50oC. Pengeringan dihentikan pada saat temulawak dirasa sudah cukup kering. Setelah proses pengeringan, bahan dihaluskan dengan menggunakan hammer mill 20 mesh. Semakin halus ukuran bahan maka kemungkinan hilangnya minyak atsiri akan semakin tinggi. Namun demikian, pengecilan ukuran sampel berpengaruh terhadap peningkatan luas permukaan contoh sehingga ekstraksi akan menjadi lebih optimal.
Abu berasal dari mineral-mineral yang terkandung dalam temulawak seperti Kalium (K), Natrium (Na), Magnesium (Mg), Besi (F), Mangan (Mn), dan Kadmium (Cd). Kadar abu total dari bahan yang digunakan adalah sebesar 5.07%. Syarat abu total yang ditetapkan FDA adalah 3-7%. Nilai abu total merupakan acuan untuk mengetahui kemurnian bahan yang digunakan, dalam hal ini berarti bahwa kandungan mineral yang terdapat dalam bahan telah memenuhi standar yang ditetapkan. Perbedaan nilai kandungan kimia yang terdapat pada rimpang temulawak dipengaruhi oleh beberapa faktor seperti umur rimpang, tempat tumbuh, alat serta metode analisis yang digunakan. Rimpang temulawak memiliki kandungan kurkuminoid terbesar pada saat berumur sembilan bulan sejak masa tanam.
Untuk mendapatkan kualitas produk yang lebih stabil diperlukan alternatif pengolahan. Pembuatan ekstrak temulawak yang berasal dari temulawak segar merupakan salah satu upaya untuk mempertahankan kualitas aroma, memperpanjang umur simpan serta mempermudah proses pengemasan dan penyimpanan. Nilai tambah lain dari ekstrak temulawak adalah nilai jual yang lebih tinggi dibandingkan bentuk segarnya. Selain itu, teknologi proses yang diperlukan untuk memperoleh ekstrak temulawak relatif sederhana sehingga dapat dilakukan oleh pengusaha kecil.
4.1.2.
Penentuan Washing TimeWashing time merupakan waktu yang dibutuhkan oleh pelarut untuk mengeluarkan
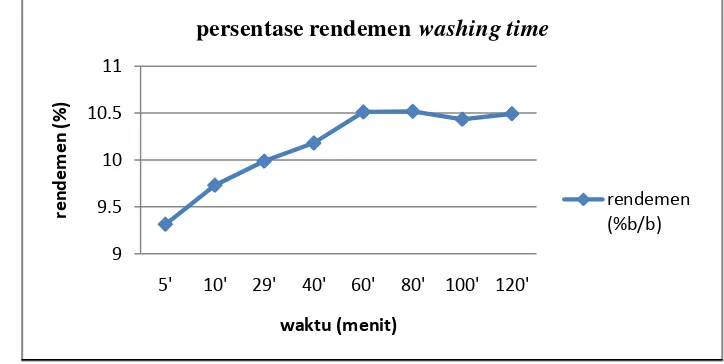
senyawa yang terdapat di luar sel. Penentuan washing time dalam penelitian ini dimulai dari 5, 10, 20, 30, 40, hingga 120 menit. Berdasarkan hasil washing time (Gambar 9), diketahui bahwa waktu dua jam telah mencukupi untuk pencucian sampel. Oleh karena itu dalam proses ekstraksi, waktu yang digunakan adalah kelipatan dari waktu washing time yang bernilaidua jam. Mengacu pada hasil tersebut maka waktu ekstraksi yang digunakan adalah 4 jam, 6 jam, 8 jam hingga 24 jam.
Gambar 9. Persentase rendemen washing time
Terdapat dua proses utama pada ekstraksi temulawak yaitu washing out dan difusi (List, 1989). Pada proses washing out terjadi penarikan senyawa-senyawa yang terdapat diluar sel, dimana saat dilakukan pengecilan ukuran, sebagian sel akan pecah dan senyawa yang keluar akibat kerusakan sel tersebut akan ditarik oleh pelarut selama proses washing out. Setelah mengalami washing out, ekstraksi akan memasuki proses difusi. Pada proses ini pelarut harus menembus dinding sel terlebih dahulu sehingga senyawa lebih susah ditarik. Pelarut dapat
9 9.5 10 10.5 11
5' 10' 29' 40' 60' 80' 100' 120'
ren
d
em
en
(%
)
waktu (menit)
persentase rendemen
washing time
melewati dinding sel karena adanya gradient konsentrasi, sehingga senyawa yang memiliki kelarutan yang sama akan larut dan ditarik oleh pelarut. Pelarut akan membawa senyawa tersebut keluar dari sel hingga senyawa yang terdapat dalam sel ditarik sempurna. Pelarut akan berhenti menarik senyawa jika keadaan pelarut sudah jenuh dan tidak lagi memiliki gradient
konsentrasi.
Gambar 10. Mekanisme penarikan senyawa (List, 1989)
4.2.
EKSTRAKSI RIMPANG TEMULAWAK
Ekstraksi adalah proses penarikan komponen aktif dari suatu campuran padatan dan/atau cairan dengan menggunakan pelarut tertentu. Proses ini merupakan langkah awal yang penting dalam penelitian tanaman obat, karena preparasi ekstrak kasar tanaman merupakan titik awal untuk isolasi dan pemurnian komponen kimia yang terdapat dalam tanaman (Mandal et al, 2007). Ekstraksi senyawa aktif dari tanaman obat merupakan pemisahan secara fisik atau kimiawi dengan menggunakan cairan atau padatan dari bahan padat.
Pada ekstraksi kurkuminoid temulawak untuk bahan baku obat-obatan, pemilihan jenis pelarut merupakan salah satu faktor yang sangat menentukan keamanan serta tinggi rendahnya hasil ekstraksi kurkuminoid. Penelitian ini menggunakan etanol sebagai pelarut. Pertimbangan yang mendasari pengambilan keputusan tersebut adalah adanya pendapat Purseglove et al. (1981) yang menyatakan bahwa ekstraksi rimpang temulawak untuk memperoleh oleoresin dapat dilakukan dengan menggunakan pelarut polar. Di antara banyak pelarut organik, pelarut etanol adalah salah satu pelarut yang cocok untuk memisahkan kurkuminoid secara optimal. Kadar etanol yang digunakan adalah sebesar 70% sesuai dengan standard yang ditetapkan oleh Badan Pemeriksa Obat dan Makanan.
4.2.1.
Metode Maserasi
Maserasi yaitu metode ekstraksi dengan cara merendam sampel dengan larutan penyari dengan atau tanpa pengadukan. Maserasi dibedakan menjadi tiga jenis yaitu maserasi sederhana, kinetika maserasi, dan maserasi dengan pengguanan tekanan. Maserasi sederhana didefinisikan sebagai metode ekstraksi dimana sampel direndam menggunakan pelarut dalam kurun waktu tertentu dengan atau tanpa pengadukan pada suhu ruang. Kinetika maserasi dan maserasi dengan tekanan tidak jauh berbeda dengan maserasi sederhana. Titik perbedaan kinetika maserasi terletak pada dilakukannya pengadukan berkecepatan konstan, sedangkan perbedaan pada maserasi dengan tekanan terletak pada kondisi tekanan yang digunakan dalam ekstraksi (bukan tekanan ruang), sehingga proses tersebut lebih efektif.
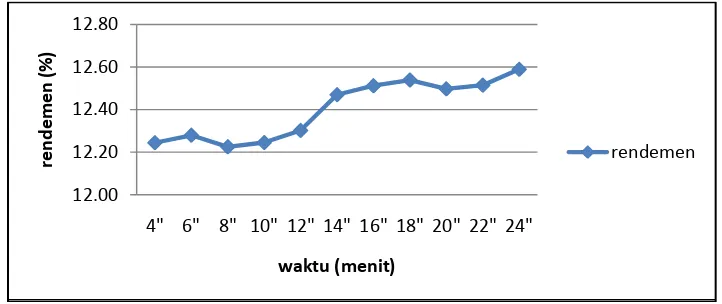
Metode maserasi yang digunakan dalam penelitian ini cenderung mengarah pada kinetika maserasi karena menggunakan pengadukan yang konstan, yakni 200 rpm. Berdasarkan hasil penelitian untuk metode maserasi, diperoleh nilai rendemen pada interval 12.20% hingga 12.60% (Lampiran 3), dimana rendemen tertinggi diperoleh pada lama waktu maserasi 24 jam yaitu sebesar 12.59%. Nilai rendemen terendah diperoleh pada lama waktu maserasi 8 jam yaitu sebesar 12.22%. Hasil ekstraksi dengan metode maserasi selengkapnya dapat dilihat pada Gambar 11 dan Lampiran 3.
Gambar 11. Rendemen metode maserasi.
Pada perbandingan terhadap masing-masing lama waktu yang digunakan tidak terlihat perbedaan yang begitu nyata. Perbedaan waktu yang cukup jauh hanya menghasilkan selang rendemen sebesar 0.4 %. Oleh karena itu penentuan lama waktu ekstraksi pada metode maserasi cukup dilakukan pada waktu 4 jam dengan hasil rendemen sekitar 12.2%.
4.2.2.
Metode Remaserasi
Secara umum metode remaserasi tidak jauh berbeda dengan metode maserasi. Perbedaan metode remaserasi terletak pada digunakannya sebagian pelarut untuk maserasi, dimana setelah penyaringan akan dilakukan pengunaan kembali terhadap komponen residu untuk kedua kalinya dengan sisa pelarut yang ada untuk kemudian disaring kembali. Setelah itu kedua filtrat digabungkan pada tahap akhir. Metode remaserasi ini menggunakan jumlah pelarut dua kali lebih banyak dibanding metode maserasi, karena pelarut yang digunakan bukan sebagian dari perbandingan yang telah ditetapkan. Metode remaserasi merupakan hasil modifikasi dari literatur, dimana untuk melakukan metode remaserasi digunakan perbandingan tetap sebesar 1:10, baik pada maserasi pertama maupun maserasi kedua.
12.00 12.20 12.40 12.60 12.80
4" 6" 8" 10" 12" 14" 16" 18" 20" 22" 24"
ren
d
em
en
(%
)
waktu (menit)
Metode remaserasi yang digunakan dalam penelitian ini menghasilkan rendemen ekstrak antara 15.60% - 16.70%. Perbandingan nilai tertinggi dan nilai terendah dalam metode remaserasi adalah sebesar 1.10%, sedangkan perbandingan rendemen metode maserasi dan remaserasi adalah sebesar 4%. Perbedaan ini terjadi karena adanya perbedaan jumlah pelarut yang digunakan, total pelarut yang digunakan pada proses maserasi adalah 100 ml sedangkan pada proses remaserasi adalah 200 ml. Meskipun demikian, pada dasarnya perbedaan pelarut tersebut tidak memberikan pengaruh signifikan terhadap perolehan rendemen. Rendemen tertinggi pada metode remaserasi diperoleh pada lama ekstraksi 24 jam (16.69%), sedangkan rendemen terendah diperoleh pada lama ekstraksi 4 jam (15.66%). Hasil perolehan rendemen keseluruhan pada metode remaserasi dapat dilihat pada Gambar 12 dan Lampiran 4.
Gambar 12. Rendemen metode remaserasi
Grafik perolehan rendemen memperlihatkan bahwa jumlah rendemen dari 12 jam hingga 24 jam tidak mengalami peningkatan yang signifikan. Dengan perbandingan waktu yang cukup lama, perolehan nilai rendemen tertinggi dan terendah hanya berselang 1 % sehingga dengan ekstraksi selama 4 jam pada metode remaserasi telah dapat mencukupi dan menarik bahan secara keseluruhan.
4.2.3.
Metode Perkolasi
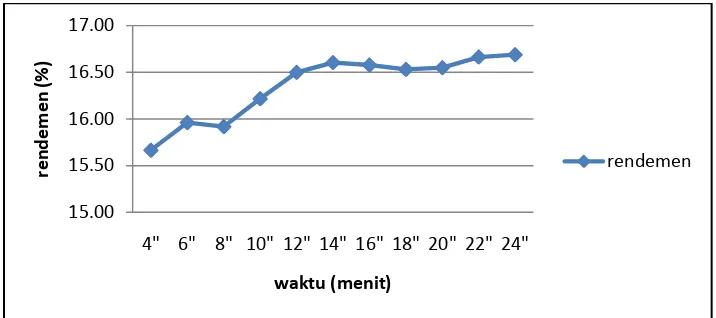
Metode perkolasi menggunakan pelarut segar untuk mengekstrak sampel. Pelarut tersebut dialirkan melalui alat yang disebut perkolator. Pelarut bersentuhan dengan sampel secara kontinu sehingga metode ini membutuhkan pelarut yang sangat banyak. Namun, kecepatan alir bahan pada perlakuan ini diatur sedemikian rupa agar pelarut sebanyak 100 ml habis digunakan sesuai dengan waktu yang ditentukan. Semakin lama waktu ekstraksi maka kecepatan alir pelarut semakin kecil dan kontak dengan bahan menjadi lebih lama. Oleh karena itu, semakin lama waktu perkolasi maka rendemen yang diperoleh akan semakin tinggi. Kecepatan alir yang terlalu tinggi dapat mengakibatkan tercucinya pelarut sebelum sampai ke dalam sel bahan. Jumlah rendemen yang diperoleh pada metode perkolasi dapat dilihat pada Gambar 13 dan Lampiran 5.
15.00 15.50 16.00 16.50 17.00
4" 6" 8" 10" 12" 14" 16" 18" 20" 22" 24"
ren
d
em
en
(%
)
waktu (menit)
Gambar 13. Rendemen metode perkolasi.
Rendemen metode perkolasi bernilai antara 12.50% - 15.00%, dengan selang rendemen sebesar 2.5%. Angka tersebut menunjukkan selang rendemen yang lebih tinggi dibandingkan dengan selang rendemen pada metode maserasi dan remaserasi. Rendemen tertinggi (14.90%) diperoleh pada waktu perkolasi 24 jam dan rendemen terendah (12.60%) diperoleh pada waktu perkolasi 4 jam. Sama halnya dengan metode remaserasi, peningkatan rendemen setelah 12 jam terlihat tidak signifikan. Perbedaan sebesar 2.5% antara rendemen terendah dan rendemen tertinggi relatif cukup tinggi dalam skala industri, tetapi jika dilihat berdasarkan waktu pengerjaannya maka ekstraksi selama 4 jam telah cukup untuk mengekstrak keseluruhan bahan.
4.2.4.
Metode Reperkolasi
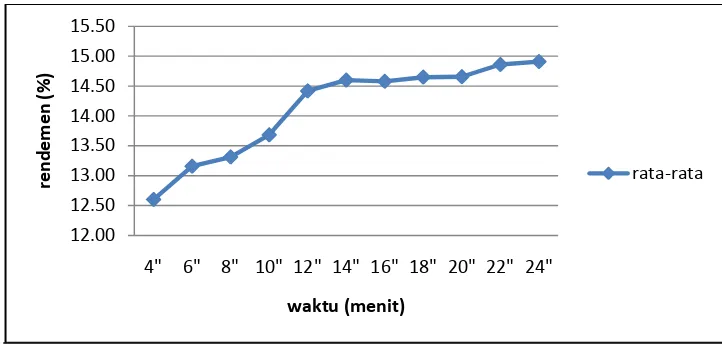
Pada metode reperkolasi, pelarut yang digunakan tidak selalu segar seperti metode perkolasi. Pelarut disirkulasikan terus-menerus menggunakan pompa yang terhubung dengan perkolator. Sirkulasi secara kontinu dilakukan agar pelarut yang belum jenuh masih dapat menarik senyawa yang terdapat dalam bahan. Pompa akan membantu pelarut naik lagi ke atas sehingga penyaringan dapat dilakukan berulang. Pada metode ini kecepatan alir pelarut tidak bisa ditentukan. Kecepatan alir pelarut disesuaikan dengan kekuatan pompa dan lebar pipa perkolator. Gambar 14 dan Lampiran 6. menunjukkan rendemen yang diperoleh untuk masing-masing waktu ekstraksi dengan metode reperkolasi.
Gambar 14. Rendemen metode reperkolasi
12.00 12.50 13.00 13.50 14.00 14.50 15.00 15.50
4" 6" 8" 10" 12" 14" 16" 18" 20" 22" 24"
re
n
d
e
m
e
n
(%
)
waktu (menit)
rata-rata
14.50 15.00 15.50 16.00
4" 6" 8" 10" 12" 14" 16" 18" 20" 22" 24"
re
n
d
e
m
e
n
(%
)
waktu (menit)
Pada gambar di atas terlihat bahwa rendemen reperkolasi memiliki nilai antara 15% - 16%. Rendemen tertinggi diperoleh pada waktu ekstraksi 14 jam dan rendemen terendah diperoleh pada waktu ekstraksi empat jam. Dalam hal ini waktu reperkolasi terlama tidak memberikan hasil rendemen terbesar. Terdapat beberapa faktor yang memungkinkan terjadinya kondisi tersebut seperti kehilangan bahan saat proses penyaringan, proses penguapan yang terlalu lama dan beberapa hal lainnya. Selang rendemen pada metode reperkolasi tidak pula terlihat signifikan karena tidak mencapai 1%. Sama halnya dengan metode sebelumnya, waktu ekstraksi 4 jam telah cukup untuk mengekstrak seluruh senyawa yang terdapat dalam bahan. Rendemen yang diperoleh dengan metode ini lebih tinggi dibandingkan metode perkolasi karena kontak bahan dengan pelarut pada metode ini lebih tinggi dibandingkan pada metode perkolasi. Besarnya kontak antara pelarut dengan bahan pada metode ini menyababkan pelarut dapat berdifusi lebih baik dibandingkan pada metode perkolasi.
4.2.5
Perbandingan Rendemen Seluruh Metode Ekstraksi
Rendemen ekstrak temulawak dari keempat metode tersebut di atas berselang antara 12% hingga 17%, dimana rendemen terendah diperoleh pada ekstraksi dengan metode maserasi. Dihasilkannya rendemen terndah pada metode maserasi disebabkan oleh minimnya jumlah pelarut. Berdasarkan Gambar 15 dapat dilihat bahwa pada selang rendemen antara nilai tertinggi dan terendah pada metode maserasi tidak terlalu jauh. Dengan demikian dapat dikatakan bahwa pelarut telah mencapai titik jenuh. Sedikitnya jumlah pelarut yang digunakan pada metode maserasi berakibat semakin cepatnya pelarut tersebut mencapi titik jenuh. Metode maserasi hanya menggunakan pelarut sebanyak 100 ml. Jumlah tersebut hanya setengah dari jumlah pelarut yang digunakan pada metode remaserasi.
Metode remaserasi yang memiliki jumlah pelarut lebih banyak memperoleh nilai rendemen yang lebih tinggi dibandingkan metode maserasi. Pada ekstraksi dengan metode remaserasi, residu pelarut yang digunakan merupakan pelarut baru sehingga pelarut belum mengalami kejenuhan dan memiliki kemampuan mengekstrak lebih tinggi. Larutan jenuh adalah larutan yang mengandung jumlah terlarut berlebihan sedemikian rupa, pada suhu tertentu, sehingga kelebihan itu tidak dapat lagi melarut. Jenuh berarti pelarut telah seimbang dengan zat terlarutnya, atau jika larutan tidak dapat lagi melarutkan zat terlarut yang ditambahkan. Hal tersebut menjadi pertanda bahwa konsentrasi telah mencapai titik maksimal.
Berdasarkan perbandingan antar metode dapat disimpulkan bahwa nisbah pelarut dengan bahan dan pengadukan dapat mempengaruhi jumlah rendemen. Metode maserasi menggunakan perbandingan 1:10 dengan pengadukan. Metode remaserasi turut pula dilakukan dengan perbandingan 1:10, tetapi proses ekstraksi pada remaserasi dilakukan dua kali dengan dua kali pengadukan dan jumlah pelarut dua kali lebih banyak (200 ml). Metode perkolasi dilakukan dengan jumlah pelarut keseluruhan sebesar 200 ml, namun pengadukan hanya dilakukan sekali pada waktu maserasi. Ekstraksi dengan perkolator tidak mengalami pengadukan, sehingga pelarut hanya sekali melewati bahan dan tidak dapat bekerja maksimal untuk menarik senyawa yang terdapat dalam residu bahan.
perkolasi. Meskipun menghasilkan rendemen lebih banyak dibandingkan metode perkolasi, metode reperkolasi tidak dapat menghasilkan rendemen lebih banyak dibandingkan metode remaserasi. Melalui penggunaan jumlah pelarut yang sama dengan metode perkolasi dan reperkolasi, aktivitas pengadukan dua kali lipat pada metode remaserasi dapat menarik senyawa lebih banyak dibandingkan ketiga metode lainnya.
Gambar 15. Perbandingan rendemen metode ekstraksi
Perhitungan analisis varian menggunakan SAS 9.1 (Lampiran 7) menunjukkan nilai
p-value uji kurang dari alpha 5%. Nilai tersebut mengindikasikan bahwa pemberian perlakuan
metode ekstraksi dan waktu berpengaruh terhadap jumlah rendemen. Kendati berpengaruh, interaksi antara metode dengan waktu tidak menunjukkan perbedaan yang signifikan karena
p-value yang bernilai lebih besar dari alpha 5%.
Perhitungan analisis varian dilanjutkan oleh uji Duncan, yakni dengan mengelompokkan metode berdasarkan perbedaan signifikan. Melalui uji Duncan diketahui bahwa metode maserasi, remaserasi, perkolasi dan reperkolasi memiliki perbedaan yang signifikan terhadap jumlah rendemen yang dihasilkan. Hasil uji Duncan mengindikasikan bahwa peringkat jumlah rendemen secara berurutan dari tingkat tertinggi hingga tingkat terkecil ditempati oleh metode remaserasi, reperkolasi, perkolasi, dan maserasi. Uji Duncan menghasilkan huruf Duncan yang berbeda untuk setiap metode yaitu A untuk remaserasi, B untuk reperkolasi, C untuk perkolasi, dan D untuk maserasi. Huruf A merepresentasikan nilai tertinggi, sebaliknya nilai D merepresentasikan nilai terendah.
Uji Duncan turut pula menyatakan bahwa komponen lama waktu ekstraksi antara 12 jam hingga 24 jam tidak berbeda signifikan karena uji. Uji Duncan memberi nilai A pada kelompok selang waktu tersebut. Senada dengan kelompok selang waktu sebelumnya, kelompok selang waktu ekstraksi antara 10 jam hingga 20 jam tidak pula menunjukkan perbedaan yang nyata dan memberi nilai B bagi kelompok selang waktu tersebut. Berdasarkan uji Duncan, kelompok selang waktu ekstraksi 6 jam hingga 10 jam juga tidak berbeda nyata antara satu dengan yang lain. Uji Duncan mengelompokkannya dengan huruf Duncan C. Pada selang tersebut terdapat pengecualian terhadap waktu ekstraksi 4 jam hingga 8 jam dimana selang waktu tersebut memperoleh huruf Duncan D.
Hasil analisis uni Duncan memberi kesimpulan bahwa ekstraksi 4 jam berbeda dengan ekstraksi 10 jam dan ekstraksi 10 jam berbeda dengan ekstraksi 22 jam. Tetapi jika dilihat berdasarkan nilai tengah keseluruhan data maka akan terlihat bahwa perbedaan antara nilai tertinggi (14.93) dengan nilai terendah (13.90) hanya berselisih satu angka. Oleh karena itu
10.00 11.00 12.00 13.00 14.00 15.00 16.00 17.00 18.00
4" 6" 8" 10" 12" 14" 16" 18" 20" 22" 24"
re
n
d
e
m
e
n
(%
)
waktu (menit)
Remaserasi
maserasi
perkolasi
untuk efisiensi waktu dan tenaga, ekstraksi selama 4 jam sudah cukup untuk diterapkan dalam industri yang membutuhkan ekstraksi sebagai salah satu prosesnya.
4.3.
ANALISIS KUANTITATIF KURKUMINOID MENGGUNAKAN
HPLC
Kadar kurkumin yang teresktraksi ditentukan dengan membandingkan luas area antara peak
kurkumin standar dengan luas area peak kurkumin sampel. Oleh karena itu data luas area peak
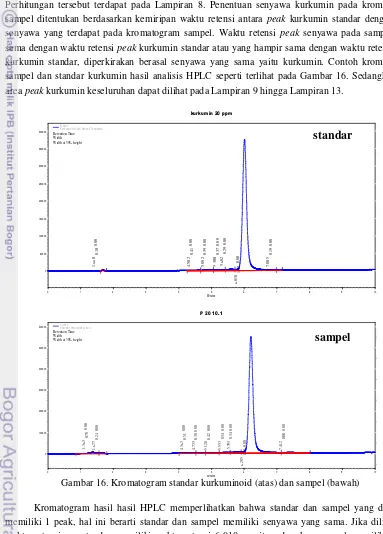
kurkumin standar hasil analisis HPLC dirubah terlebih dahulu kedalam bentuk regresi linear, Perhitungan tersebut terdapat pada Lampiran 8. Penentuan senyawa kurkumin pada kromatogram sampel ditentukan berdasarkan kemiripan waktu retensi antara peak kurkumin standar dengan peak
senyawa yang terdapat pada kromatogram sampel. Waktu retensi peak senyawa pada sampel yang sama dengan waktu retensi peak kurkumin standar atau yang hampir sama dengan waktu retensi peak
kurkumin standar, diperkirakan berasal senyawa yang sama yaitu kurkumin. Contoh kromatogram sampel dan standar kurkumin hasil analisis HPLC seperti terlihat pada Gambar 16. Sedangkan luas area peak kurkumin keseluruhan dapat dilihat pada Lampiran 9 hingga Lampiran 13.
Gambar 16. Kromatogram standar kurkuminoid (atas) dan sampel (bawah)
Kromatogram hasil hasil HPLC memperlihatkan bahwa standar dan sampel yang dianalisis memiliki 1 peak, hal ini berarti standar dan sampel memiliki senyawa yang sama. Jika dilihat dari waktu retensinya, standar memiliki waktu retensi 6.010 menit, sedangkan sampel memiliki waktu
kurkumin 20 ppm
Minutes
0 1 2 3 4 5 6 7 8 9 10
0 50000 100000 150000 200000 250000 300000 350000 400000 uAU 0 50000 100000 150000 200000 250000 300000 350000 400000 1 .6 6 8 0 .1 8 0 .0 0 4 .5 8 2 0 .4 1 0 .0 0 5 .0 0 2 0 .3 9 0 .0 0 5 .3 8 8 0 .3 7 0 .0 0 5 .6 0 2 0 .2 9 0 .0 0 6 .0 1 0 1 .2 7 0 .0 0 7 .0 0 5 0 .1 9 0 .0 0 K-2501
Kurkuminoid dan ekstrak Temulawa Retention Time Width Width at 50% height
P 20 10.1
Minutes
0 1 2 3 4 5 6 7 8 9 10
0 100000 200000 300000 400000 500000 600000 uAU 0 100000 200000 300000 400000 500000 600000 1 .3 6 30 .7 0 0 .0 0 1 .6 7 7 0 .2 4 0 .0 0 4 .3 6 3 0 .5 1 0 .0 0 4 .7 3 30 .3 0 0 .0 0 5 .1 2 0 0 .4 2 0 .0 0 5 .5 3 30 .3 4 0 .0 0 5 .7 9 30 .3 4 0 .0 0 6 .2 0 51 .2 3 0 .0 0 7 .4 1 20 .8 8 0 .0 0 K-2501 Ekstrak Temulawak 260810
Retention Time Width Width at 50% height
standar
retensi 6.205. Hal ini semakin memperjelas bahwa sampel mengandung senyawa yang sama dengan standar.
Seperti telah disebutkan sebelumnya bahwa kurkuminoid pada temulawak terdiri dari kurkumin dan desmetoksikurkumin. Desmetoksikurkumin memiliki komposisi yang lebih rendah dibandingkan kurkumin, tetapi dalam hasil HPLC hanya terbentuk 1 peak. Hal tersebut mengindikasikan bahwa dalam sampel hanya terdapat kurkumin, sedangkan desmetosikurkumin berjumlah sangat sedikit sehingga hanya terbentuk 1 peak.
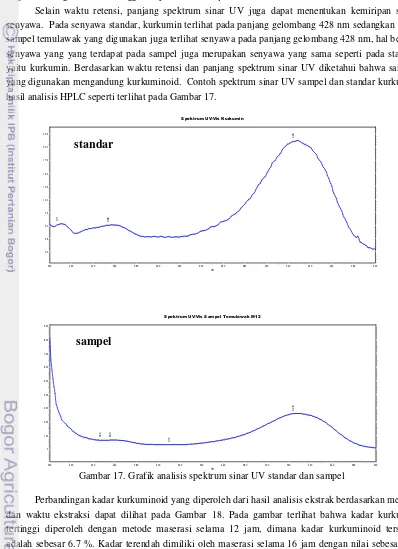
Selain waktu retensi, panjang spektrum sinar UV juga dapat menentukan kemiripan suatu senyawa. Pada senyawa standar, kurkumin terlihat pada panjang gelombang 428 nm sedangkan pada sampel temulawak yang digunakan juga terlihat senyawa pada panjang gelombang 428 nm, hal berarti senyawa yang yang terdapat pada sampel juga merupakan senyawa yang sama seperti pada standar yaitu kurkumin. Berdasarkan waktu retensi dan panjang spektrum sinar UV diketahui bahwa sampel yang digunakan mengandung kurkuminoid. Contoh spektrum sinar UV sampel dan standar kurkumin hasil analisis HPLC seperti terlihat pada Gambar 17.
Gambar 17. Grafik analisis spektrum sinar UV standar dan sampel
Perbandingan kadar kurkuminoid yang diperoleh dari hasil analisis ekstrak berdasarkan metode dan waktu ekstraksi dapat dilihat pada Gambar 18. Pada gambar terlihat bahwa kadar kurkumin tertinggi diperoleh dengan metode maserasi selama 12 jam, dimana kadar kurkuminoid tersebut adalah sebesar 6.7 %. Kadar terendah dimiliki oleh maserasi selama 16 jam dengan nilai sebesar 0.6 %. Kondisi ini sangat jauh berbeda dengan maserasi selama 12 jam yang memiliki kadar kurkuminoid
Spektrum UV-Vis Kurkumin
nm
200 220 240 260 280 300 320 340 360 380 400 420 440 460 480 500
0.0 2.5 5.0 7.5 10.0 12.5 15.0 17.5 20.0 22.5
m
AU
0.0 2.5 5.0 7.5 10.0 12.5 15.0 17.5 20.0 22.5
428
211 258
Spektrum UV-Vis Sampel Temulawak M12
nm
200 220 240 260 280 300 320 340 360 380 400 420 440 460 480 500
0 100 200 300 400 500 600 700 800 900
m
AU
0 100 200 300 400 500 600 700 800 900
428
259
314
250
standar
tertinggi. Perbedaan ini tidak berarti bahwa ekstrak yang diperoleh dari hasil maserasi 16 jam tidak memiliki kurkuminoid. Pada maserasi selama 16 jam terdapat pula kurkuminoid, tetapi kadar kurkuminoid yang diperoleh berada dibawah kadar kurkuminoid yang digunakan sebagai standar.
Gambar 18. Grafik perbandingan kadar kurkumin
Hasil analisis HPLC pada Gambar 18 memperlihatkan bahwa metode maserasi dengan lama ekstraksi 16 jam memiliki peak yang sama dengan peak senyawa standar. Selain itu peak tertinggi juga terbentuk pada menit ke 6.100. Oleh karena itu dapat dipastikan bahwa maserasi 16 jam mengandung kurkumin, tetapi dengan nilai yang berada di bawah standar.
Pada menit ke 1.362 terdapat peak lain yang cukup tinggi. Hal ini memberikan indikasi adanya senyawa lain dalam sampel. Senyawa tersebut tidak diketahui dan diduga bukan merupakan senyawa desmetoksikurkumin. Analisis tersebut mengacu pada penelitian Aan (2003) yang menyebutkan bahwa peak kurkumin dan peak desmetoksikurkumin memiliki waktu retensi yang tidak jauh berbeda serta letak yang berdekatan. Oleh karena itu peak yang terbentuk pada menit awal tersebut diduga mengandung senyawa pengganggu yang dapat menurunkan kadar kurkumin. Kondisi serupa juga terlihat pada beberapa metode (Lampiran 10), dimana hasil HPLC yang memiliki peak pada menit pertama memiliki kadar kurkumin yang rendah pula.
Gambar 19. Grafik kromatogram maserasi 16 jam
-1.00 0.00 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00
4' 6' 8' 10' 12' 14' 16' 18' 20' 22' 24'
k ad ar k u rk u m in o id ( % ) waktu (jam) maserasi remaserasi perkolasi reperkolasi
M 16 10.0
Minutes
0 1 2 3 4 5 6 7 8 9 10
0 10000 20000 30000 40000 50000 uAU 0 10000 20000 30000 40000 50000 1 .3 6 2 0 .6 4 0 .0 0 1 .5 8 7 0 .2 5 0 .0 0 4 .2 7 20 .4 6 0 .0 0 4 .6 2 20 .3 0 0 .0 0 5 .0 3 30 .5 1 0 .0 0 5 .6 4 7 0 .6 5 0 .0 0 6 .1 0 0 0 .8 2 0 .0
0 7.2
1 8 0 .6 7 0 .0 0 K-2501 Ekstrak Temulawak 260810
Penambahan waktu ekstraksi yang digunakan seharusnya mampu meningkatkan kadar ekstrak kurkumin. Kondisi ini tidak sesuai dengan perolehan hasil yang bersifat fluktuatif sehingga kadar kurkumin tidak bertambah seiring dengan bertambahnya waktu ekstraksi. Hasil pengolahan data dengan metode Kruskal Wallis juga menyatakan bahwa metode dan waktu tidak memberi pengaruh signifikan terhadap kadar kurkumin karena p-value lebih besar dari alpha 5%, sehingga tidak ada perbedaan terhadap kadar kurkumin. Situasi demikian kemungkinan terjadi akibat adanya degradasi kurkumin oleh cahaya selama proses ekstraksi berlangsung. Semakin lama waktu ekstraksi yang digunakan, maka kemungkinan terjadinya degradasi pada proses ekstraksi akan semakin besar.
V. KESIMPULAN DAN SARAN
5.1.
KESIMPULAN
Penelitian pendahuluan terdiri dari analisis proksimat dan washing time. Analisis proksimat terhadap komposisi kimia yang terkandung dalam temulawak menunjukkan komposisi sebagai berikut: air 14.97%, pati 58.56%, lemak 7.45%, protein 7.07%, serat kasar 7.63%, dan abu 5.07%. Kadar minyak atsiri pada temulawak tidak dapat terukur karena berjumlah sangat minim. Pengukuran
washing time menunjukkan bahwa waktu pencucian yang akan digunakan berdurasi selama 2 jam.
Metode ekstraksi yang digunakan selama penelitian meliputi maserasi, remaserasi, perkolasi dan reperkolasi dengan waktu ekstraksi 4 – 24 jam dan selisih waktu 2 jam. Berdasarkan hasil rendemen diketahui bahwa metode remaserasi menghasilkan jumlah rendemen tertinggi pada kisaran nilai 15.60% - 16.70%, dimana waktu ekstraksi tidak berbeda signifikan terhadap rendemen. Metode maserasi merupakan metode yang menghasilkan rendemen terendah dengan kisaran nilai 12.20% - 12.60%, Pada metode ini lama waktu ekstraksi juga tidak memberikan perbedaan yang signifikan terhadap jumlah rendemen.
Hasil analisis kadar kurkumin temulawak dengan perhitungan Kruskal Wallis mengindikasikan tidak adanya perbedaan signifikan antara perlakuan terhadap kadar kurkumin yang diperoleh. Berdasarkan perhitungan luas area peak standar dengan peak sampel, diketahui bahwa kadar kurkuminoid tertinggi pada metode maserasi selama 12 jam, yakni dengan 6.7 %. Kadar kurkuminoid terendah diperoleh pada metode maserasi selama 16 jam dengan nilai 0.6 %. Keseluruhan analisis tersebut menunjukkan bahwa metode ekstraksi terbaik adalah metode remaserasi selama 4 jam dengan hasil rendemen sebesar 15.60% dan kadar kurkuminoid sebesar 6.5 %.
5.2.
SARAN
PERBANDINGAN METODE MASERASI, REMASERASI,
PERKOLASI DAN REPERKOLASI TERHADAP RENDEMEN
EKSTRAK TEMULAWAK
(Curcuma xanthorrhiza
Roxb.
)
SKRIPSI
DIANITA LAILA FAUZANA
F34063115
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
DAFTAR PUSTAKA
Aan. 2003. Pengaruh Waktu, Suhu dan Nisbah Pelarut Pada Ekstraksi Kurkuminoid dari Temulawak dengan Pelarut Aseton [skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Bogor.
AOAC. 1984. Official Methods of Analysis of The Association of Official Analytical Chemical. AOAC Inc. Washington
AOAC. 1999. Official Methods of Analysis of The Association of Official Analytical Chemical. AOAC Inc. Washington
ASEAN. 1993. Standard of ASEAN Herbal Medicine. Vol:1. ASEAN countries. Jakarta.
Balittro. 2005. Temulawak (Curcuma xanthorriza Roxb). Balai Penelitian Tanaman Rempah dan Obat. Bogor
Bombardelli E. 1991. Technologies for the Processing of Medical Plant. CRC Press. Florida
BPOM. 2004. Monografi Ekstrak Tumbuhan Obat Indonesia Volume I. Badan Pengawas Obat dan Makanan. Jakarta
Departemen Kesehatan RI. 1989. Fademenkum Bahan Obat Alam. Departemen Kesehatan Republik Indonesia. Jakarta
Departemen Kesehatan RI. 1989. Materia Medika Indonesia. Jilid V. Departemen Kesehatan Republik Indonesia. Jakarta
Departemen Kesehatan RI. 1993. Tanaman Obat Keluarga (TOGA). Ed Ke-4. Departemen Kesehatan RI. Jakarta.
Departemen Kesehatan RI. 2000. Standar-standar Pedoman Pelaksanaan Uji Klinik Obat Tradisional. Departemen Kesehatan Republik Indonesia. Jakarta
Farrel K.T. 1985. Spices, Condiments and Seasonings. The AVI Publishing Company Inc. New York. Gamse T. 2002. Liquid-Liquid Extraction and Solid-Liquid Extraction. Graz University of
Technology
Gritter RJ, Bobbit JM. dan Schwarting AE. 1991. Pengantar Kromatografi. Ed. Ke-2. Terjemahan Kosasih Padmawinata. Institut Teknologi Bandung. Bandung
Harborne JB. 1996. Metode Fitokimia. Ed. Ke-2. Terjemahan Kosasih Padmawinata. Institut Teknologi Bandung. Bandung.
Herman AS. 1985. Berbagai Macam Penggunaan Temulawak Dalam Makanan dan Minuman. Proseding Simposium Nasional Temulawak. Universitas Padjajaran. Bandung
Jayaprakasha GK, Rao LJM and Sakariyah KK. 2002. Improved HPLC Method for The Determination
of Curcumin, Demethoxycurcumin and Bisdemethoxycurcumin. J. Agric. Food Chem., 50,
3668-3672.
Liang OB, Apsarton Y, Widjaja T dan Puspa S. 1985. Beberapa Aspek Isolasi, Identifikasi, dan Penggunaan Komponen-komponen Curcuma Xanthorrhiza Roxb. Dan Curucuma Domestica
Val. Di dalam: Simposium Nasional Temulawak, Bandung: Lembaga Penelitian Universitas Padjajaran. Hlm 85-103.
List PH dan Schmidt PC. 1989. Phytopharmaceutical Technology. CRC Press Inc. Boston.
Mandal V, Yogesh MH. 2007. Microwave assisted Extraction – An Innovative and Promising
Extraction Tool for Medicinal Plant Research. Pharmacognosy Rev 1: 7-18.
Moestofa. 1976. Isolasi Oleoresin Lada Hitam. Di dalam Proceeding Seminar Minyak Atsiri II. 20-22 April 1976. Departemen Perindustrian. Balai Penelitian Kimia, Bogor.
Photitirat W, Wandee G. 2004. Variation of Bioactive component in Curcuma longa in Thailand. Current Sci 91:1397-1400
Pothitirat W, and Gritsanapan W. 2006. Variation of Bioactive Components in Curcuma longa in
Thailand. Current Science, 91(10), 1397-1400.
Purseglove JW, Brown EG, Green GL dan Robbins SRG. 1981. Spices Vol.II. Longman. New York. Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi. Institut Teknologi Bandung. Bandung. Sabel W dan Waren. 1973. Theory and Practice of Oleoresin Extraction. Di dalam. Proceeding of the
Conference of Spices. Tropical Product Institute. London
Scheflan L, Jacob MB. 1953. The Handbook of Solvents. D. Van Nostrand Co. New York.
Sidik, Moelyono MW dan Ahmad Muhtadi. 1995. Temulawak (Curcuma xanthorriza). Yayasan Pengembangan Obat Bahan Alam Phytomedica.
Sinambela JM. 1985. Fitoterapi, Fitostandar dan Temulawak. Prosiding Simposium Nasional Temulawak. Universitas Padjajaran. Bandung
Somaatmadja D. 1981. Prospek Perkembangan Industri Oleoresin di Indonesia. BBIHP no. 201. Supriadi D. 2008. Optimalisasi Ekstraksi Kurkuminoid Temulawak (Curcuma xanthorriza Roxb.)
[skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Bogor. Sutianik. 1999. Pengaruh Suhu Pengeringan dan Ukuran Bahan Terhadap Rendemen dan Mutu
Oleoresin Jahe (Zingiber officinale, Roscoe). Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Bogor.
Suwiyah. 1991. Pengaruh Perlakuan Bahan dan Jenis Pelarut yang Digunakan Pada Pembuatan Temulawak Instant (Curcuma xanthorriza Roxb) Terhadap Rendemen dan Mutunya. Fakultas Teknologi Pertanian. Institut Pertanian Bogor. Bogor
Tonnesen HH, Karlsen J. 1985. Studies on Curcumin and Curcuminoids Alkaline Degradation of
Curcumin. Z. Lebens. Forcsh. 180:132-134
Widyasari EM. 2000. Pengaruh Proses Pengeringan Terhadap Aktivitas Antibakteri Ekstrak Rimpang Temulawak (Curcuma xanthorriza Roxb). Skripsi. Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor. Bogor
PERBANDINGAN METODE MASERASI, REMASERASI,
PERKOLASI DAN REPERKOLASI TERHADAP RENDEMEN
EKSTRAK TEMULAWAK
(Curcuma xanthorrhiza
Roxb.
)
SKRIPSI
DIANITA LAILA FAUZANA
F34063115
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
COMPARISON BETWEEN MACERATION, REMACERATION,
PERCOLATION AND REPERCOLATION METHOD ON YIELD
EXTRACTION VALUE OF JAVA TURMERIC
(
CURCUMA XANTHORRHIZA
ROXB)
Dianita Laila Fauzana, Chilwan Pandji and Chaidir
Department of Agroindustrial Engineering, Faculty of Agricultural technology, Bogor Agricultural University, IPB Darmaga campus, PO BOX 220, Bogor, West Java,
Indonesia.
Phone 62 818 02961155, e-mail: dianita_laila_f@yahoo.com
ABSTRACT
This research focusing to analyze the best type of simple extraction method for industry that optimize the output based on oleoresin proporsition. This research comparing four type of simple extraction method including maceration, remaceration, percolation, and repercolation. This research was divided in two parts. The first part called as pre-research and the second part is the main research. The pre-research gave information that the sample of java turmeric consist of water (14.97%), starch (58.56%), fat (7.45%), protein (7.07%), crude fiber (7.63%), total ash (5.07%) and needs two hours of washing time. The main research gave information about yield percentage of each type of method. Maceration method produce 12.20% to 12.60% of yield. Remaceration method produce 15.60% to 16.70% of yield. Percolation method produce 12.50% to 15.00% of yield, and repercolation method produce 15% to 16% of yield. Statistical calculations using SAS 9.1 indicated that the difference of time was insignificant to yield value. HPLC (High Performance Liquid Chromatography) analysis indicated that the retention time of all sample was according to the six minutes of curcumin standard retention time. The highest curcumin value produced in 12 hours length of maceration (6.7 %) and the lowest curcumin produced in 16 hours length of maceration (0.6 %). The lowest curcumin caused by curcumin degradation that happened as long as the extraction process. Based on this research, the best extraction method was four hours length of maceration. It has 15.60% yield with 6.5 % of curcumin.
DIANITA LAILA FAUZANA. F34063115. Perbandingan Metode Maserasi, Remaserasi, Perkolasi dan Reperkolasi Terhadap Rendemen Ekstrak Temulawak (Curcuma Xanthorrhiza
Roxb). Di bawah bimbingan Chilwan Pandji dan Chaidir. 2010.
RINGKASAN
Temulawak merupakan salah satu tanaman dari marga Zingiberaceae yang biasa digunakan sebagai ramuan obat tradisional. Zat aktif yang terdapat dalam temulawak dapat bekerja sebagai kolekinetik (merangsang gerak saluran empedu) dan koleretik (peningkatan sekresi empedu oleh hati). Temulawak yang diekspor umumnya berupa temulawak segar dan temulawak kering. Namun temulawak yang diekspor seringkali tidak memenuhi persyaratan ekspor sehingga negara pengimpor menolak temulawak asal Indonesia karena mutu yang rendah. Faktor penyebab terjadinya penurunan mutu temulawak yaitu pengeriputan, perkecambahan, dan pencemaran mikroba akibat kurangnya perhatian terhadap kondisi sanitasi pada saat pengeringan dan pengepakan. Penurunan mutu temulawak dapat dihindari dengan cara memproduksi temulawak dalam bentuk ekstrak.
Ekstrak temulawak dapat diperoleh melalui ekstraksi sederhana dan ekstraksi khusus. Ekstraksi sederhana terdiri dari maserasi, perkolasi, reperkolasi, evakolasi dan dialokasi. Dalam skala industri ekstraksi sederhana dinilai lebih efektif dibandingkan dengan ekstraksi khusus karena proses yang dilakukan lebih sederhana dan tidak membutuhkan peralatan berteknologi tinggi, sehingga biaya produksi dapat ditekan.
Tujuan dari penelitian ini adalah mengetahui dan menganalisis jenis metode sederhana yang terbaik yang dapat mengoptimalkan hasil dalam skala industri berdasarkan rendemen dan kadar oleoresin dalam ekstrak. Metode ekstraksi sederhana yang dibandingkan adalah maserasi, remaserasi, perkolasi dan reperkolasi. Penelitian dilaksanakan dengan dua tahap yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan bertujuan untuk mengetahui karakterisasi temulawak dan menentukan washing time temulawak. Sedangkan penelitian utama bertujuan untuk mengetahui metode dan waktu terbaik yang dapat menghasilkan ekstrak temulawak secara optimal.
Dari hasil penelitian karakterisasi rimpang temulawak kering didapatkan kadar air sebesar 14.97 persen; kadar pati 58.56 persen; kadar lemak 7.45 persen; kadar protein 7.07 persen; kadar serat kasar 7.63 persen; kadar abu 5.07 persen, dan kadar minyak atsiri tidak terukur. Sedangkan washing time yang diperoleh adalah 2 jam.
Pada penelitian utama diketahui bahwa rendemen ekstrak pada metode maserasi 12.20 persen sampai 12.60 persen; metode remserasi 15.60 persen sampai 16.70 persen; metode perkolasi 12.50 persen sampai 15.00 persen; metode reperkolasi 15 persen sampai 16 persen. Berdasarkan hasil perhitungan statistik menggunakan SAS 9.1 diketahui bahwa perbedaan waktu tidak berpengaruh nyata terhadap rendemen.
Hasil analisis menggunakan HPLC (High Performance Liquid Chromatography) menunjukkan bahwa waktu retensi seluruh sampel berkisar pada waktu retensi standar (kurkumin) yang digunakan yaitu pada kisaran waktu 6 menit. Kadar kurkumin tertinggi diperoleh dengan metode maserasi selama 12 jam dengan kadar sebesar 6.7 %, sedangkan kadar terendah dimiliki oleh maserasi selama 16 jam dengan nilai sebesar 0.61% karena berada dibawah nilai kurva standar. Situasi demikian diduga terjadi akibat adanya degradasi kurkumin oleh cahaya selama proses ekstraksi berlangsung.
PERBANDINGAN METODE MASERASI, REMASERASI,
PERKOLASI DAN REPERKOLASI TERHADAP RENDEMEN
EKSTRAK TEMULAWAK
(Curcuma xanthorrhiza
Roxb.
)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian,
Institut Pertanian Bogor
Oleh
DIANITA LAILA FAUZANA
F34063115
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Perbandingan Metode Maserasi, Remaserasi, Perkolasi dan Reperkolasi Terhadap Rendemen Ekstrak Temulawak (Curcuma Xanthorrhiza Roxb).
Nama : Dianita Laila Fauzana
NIM : F34063115
Menyetujui,
Mengetahui : Ketua Departemen,
(Prof. Dr. Ir. Nastiti Siswi Indrasti) NIP: 19621009 198903 2 001
Tanggal Lulus : 6 Desember 2010 Dosen Pembimbing I,
(Drs. Chilwan Pandji Apt. MSc) NIP: 19491209 198011 1 001
Dosen Pembimbing II,
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Perbandingan Metode Maserasi, Remaserasi, Perkolasi dan Reperkolasi terhadap Rendemen Ekstrak Temulawak (Curcuma xanthorrhiza Roxb.) adalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Desember 2010 Yang membuat pernyataan
© Hak cipta milik Dianita Laila Fauzana, tahun 2010 Hak cipta dilindungi
RIWAYAT HIDUP
Penulis dilahirkan di Agam, Sumatera Barat pada tanggal 10 Mei 1988. Putri dari pasangan Bapak Dahnil Chan dan Ibu Zuniarti Harun. Pada tahun 2000, penulis menyelesaikan pendidikan sekolah dasar di SDN 17 Lubuk Basung. Penulis menyelesaikan pendidikan sekolah menengah pertama di MTsN 1 Lubuk Basung pada tahun 2003. Kemudian penulis melanjutkan pendidikan di SMAN 2 Lubuk Basung dan lulus pada tahun 2006. Setelah lulus sekolah menengah atas, penulis melanjutkan pendidikan S1 di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama masa kuliah penulis aktif menjadi asisten praktikum mata kuliah Teknologi Pengemasan, Distribusi dan Transportasi (2008), asisten praktikum mata kuliah Teknologi Pati, Gula, dan Sukrokimia (2009), asisten praktikum mata kuliah Teknologi Minyak Atsiri, Rempah, dan Fitofarmaka (2010) dan asisten praktikum mata kuliah Teknologi Bahan Penyegar (2010). Penulis juga aktif di sejumlah organisasi dan kepanitiaan, diantaranya Himpunan Mahasiswa teknologi Industri (Himalogin) dan Badan Eksekutif Mahasiswa Keluarga Mahasiswa IPB (BEM-KM IPB)
Penulis melaksanakan praktek lapangan pada Tahun 2009 dengan topik “Proses Produksi dan Perancangan Dasar Secondary Inspection di PT. Goodyear Indonesia Bogor”. Untuk menyelesaikan pendidikan di Departemen Teknologi Industri Pertanian, penulis melakukan penelitian yang
KATA PENGANTAR
Puji syukur dan terima kasih penulis haturkan kehadirat Allah SWT karena dengan rahmat, kuasa, dan hidayah-Nya penulis dapat menyelesaikan penelitian dan menyusun skripsi yang berjudul
”Perbandingan Metode Maserasi, Remaserasi, Perkolasi dan Reperkolasi Terhadap Rendemen Ekstrak Temulawak (Curcuma xanthorrizha Roxb.)” yang disusun berdasarkan hasil penelitian sejak Juni – September 2010. Penelitian ini dilakukan di Laboratorium Teknologi Farmasi dan Medika, Badan Pengkajian dan Penerapan Teknologi, Pusat Penelitian Ilmu Pengetahuan dan Teknologi Serpong.
Dengan telah selesainya penelitian hingga tersusunnya skripsi ini, penulis ingin menyampaikan penghargaan dan terima kasih yang sebesar-besarnya kepada:
1. Drs. Chilwan Pandji Apt. MSc selaku dosen pembimbing akademik atas segala bimbingan, masukan, serta saran yang telah diberikan kepada penulis
2. Dr. Chaidir, Apt selaku dosen pembimbing pendamping atas saran dan batuan moril yang diberikan
3. Ir. Sugiarto, MSi Selaku dosen penguji atas segala masukannya
4. Orang tua, kakak, serta seluruh keluarga besar penulis atas segala doa dan motivasinya 5. Seluruh dosen, l