APLIKASI BERBAGAI DOSIS PROBIOTIK
Bacillus
NP5 MELALUI
PAKAN UNTUK PENCEGAHAN INFEKSI
Aeromonas hydrophila
PADA IKAN MAS
Cyprinus carpio
DIAN EKA RAMADHANI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Aplikasi Berbagai Dosis Probiotik Bacillus NP5 Melalui Pakan untuk Pencegahan Infeksi
Aeromonas hydrophila pada Ikan Mas Cyprinus carpio adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Dian Eka Ramadhani
ABSTRAK
DIAN EKA RAMADHANI. Aplikasi Berbagai Dosis Probiotik Bacillus NP5 Melalui Pakan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Mas
Cyprinus carpio. Dibimbing oleh SUKENDA dan WIDANARNI.
Penelitian ini bertujuan untuk menguji kinerja bakteri probiotik Bacillus
NP5 dengan dosis berbeda terhadap tingkat kelangsungan hidup dan kinerja perumbuhan ikan mas yang diinfeksi A. hydrophila. Ikan mas yang digunakan sebanyak 15 ekor/akuarium dengan bobot rata-rata 4,52±0,29 g/ekor dipelihara dalam akuarium bervolume 96 L selama 30 hari. Pemberian probiotik pada pakan sebanyak 1% (v/w) dan ditambah 2% (v/w) putih telur sebagai perekat. Perlakuan dalam penelitian ini yaitu kontrol negatif dan kontrol positif (K- dan K+ tanpa probiotik), A (probiotik 106 CFU/g pakan), B (probiotik 108 CFU/g pakan), dan C (probiotik 1010 CFU/g pakan). Setiap perlakuan terdiri dari 3 ulangan. Pada hari ke-32, perlakuan K+, A, B, dan C diinjeksi A. hydrophila dengan konsentrasi 107 CFU/ml secara intramuskular sedangkan K- diinjeksi dengan PBS (Phosphate Buffer Saline) lalu dilakukan pengamatan kematian selama 14 hari. Perlakuan C (1010 CFU/g pakan) menunjukkan hasil terbaik dengan nilai kelangsungan hidup setelah perlakuan probiotik dan setelah uji tantang 100%, laju pertumbuhan harian 2,56%, dan rasio konversi pakan 1,55 yang berbeda nyata (P<0,05) dengan kontrol.
Kata kunci: Probiotik, Bacillus NP5, ikan mas.
ABSTRACT
DIAN EKA RAMADHANI. Applications Various Dosage Probiotic of Bacillus
NP5 in Feed for Preventionof Aeromonas hydrophila Infection at Common Carp Cyprinus carpio. Supervised by SUKENDA and WIDANARNI.
This study aimed to test the performance of probiotic bacteria Bacillus
NP5 with different dosage on survival rate and growth rate which infecting by A. hydrophila. Common carp used as much as 15 fish/aquarium in the average body weight of 4,52±0,29 g/fish maintained in an aquarium with volume 96 L of water for 30 days. The probiotic supplementation in feed was as much as 1% (v/w) plus 2% (v/w) egg white as binder. The treatments in this research including negative control and positive control (K- and K + without probiotic added), A (probiotic 106 CFU/g feed), B (probiotic 108 CFU/g feed), and C (probiotics 1010 CFU/g feed). Each treatment consisted of three replications. At day 32, treatment of K +, A, B, and C were injected A. hydrophila with concentration is 107 CFU/mlwith intramuscular method, while K- injected with PBS (Phosphate Buffer Saline) and then observed mortality for 14 days. Treatment C (1010 CFU/g feed) showed the best results with survival rate after probiotic treatment and after the challenge test 100%, daily growth rate 2,56% and feed convertion ratio 1,55 was significantly higher (P<0,05) than control.
2
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
APLIKASI BERBAGAI DOSIS PROBIOTIK
Bacillus
NP5 MELALUI
PAKAN UNTUK PENCEGAHAN INFEKSI
Aeromonas hydrophila
PADA IKAN MAS
Cyprinus carpio
DIAN EKA RAMADHANI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
4
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Aplikasi Berbagai Dosis Probiotik Bacillus NP5 Melalui Pakan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Mas Cyprinus carpio. Penelitian ini dilakukan pada bulan Januari-Maret 2014 di Laboratorium Kesehatan Ikan dan
Teaching Farm Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Dalam kesempatan ini, penulis mengucapkan terima kasih kepada :
1. Bapak Dr Ir Sukenda, MSc dan Ibu Dr Ir Widanarni, MSi selaku dosen pembimbing skripsi atas arahan, masukan, semangat, dan motivasi yang telah diberikan dalam penyusunan skripsi ini.
2. Ibu Dr Ir Mia Setiawati, MSi selaku Komisi Pendidikan dan Bapak Dr Ir Kukuh Nirmala, MSc selaku dosen penguji yang telah banyak memberikan arahan dan masukan dalam penyusunan skripsi ini.
3. Bapak Dr Ir Tatag Budiardi, MSi selaku dosen pembimbing akademik yang telah memberikan arahan, bimbingan, semangat, dan motivasi selama penulis menempuh pendidikan di BDP.
4. Keluargaku tercinta Bapak Sarjono, Ibu Hermin Sudiarti, Mas Eno, Mba Tika, Mba Santi, Raka dan Rika serta keluarga besar yang telah banyak memberikan dukungan, semangat dan motivasi kepada penulis.
5. Bapak Ranta, Mba Dewi, Mba Diah, Mba Eno, Bapak Wasjan, Kang Adna, Kang Abe, Bapak Mar, Bapak Manawan, Bapak Henda, Mba Yuli, Kak Rahman, serta semua staf Departemen Budidaya Perairan.
6. Syarif Amrulla, Amal, Dede, Evy, Oob, Novi, beserta teman-teman LKI lainnya, BDP 47, BDP 48 dan BDP 49 yang telah memberikan dukungan, motivasi serta kenangan yang indah selama penulis menempuh pendidikan di BDP.
7. Eka, Ara, Kiki, Izma, Mba Lid, Sri, dan teman-teman Wisma Pelangi semuanya yang telah memberikan dukungan, motivasi, semangat, dan kenangan yang indah selama penulis mengerjakan skripsi ini.
Penulis berharap skrisi ini dapat bermanfaat untuk banyak orang.
Bogor, Juli 2014
5
DAFTAR ISI
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
METODE ... 2
Materi Uji ... 2
Persiapan Wadah dan Ikan Uji ... 2
Persiapan Probiotik ... 2
Penghitungan Total Bakteri ... 3
Persiapan Pakan Uji ... 3
Persiapan Uji Tantang ... 3
Rancangan Percobaan ... 4
Parameter Uji ... 4
Tingkat Kelangsungan Hidup ... 4
Laju Pertumbuhan Harian ... 5
Rasio Konversi Pakan ... 5
Hematologi Ikan ... 5
Total Kelimpahan Bakteri dan Bacillus NP5 RfR di Usus ... 6
Kualitas Air ... 7
Prosedur Analisis Data ... 7
HASIL DAN PEMBAHASAN ... 7
Hasil ... 7
Tingkat Kelangsungan Hidup ... 7
Laju Pertumbuhan Harian ... 8
Rasio Konversi Pakan ... 8
Hematologi Ikan ... 9
Total Kelimpahan Bakteri di Usus ... 10
Total Kelimpahan Bacillus NP5 RfR di Usus ... 11
Kualitas Air ... 12
Pembahasan ... 12
SIMPULAN DAN SARAN ... 14
Simpulan ... 14
Saran ... 15
DAFTAR PUSTAKA ... 15
LAMPIRAN ... 17
6
DAFTAR TABEL
1 Parameter kualitas air ... 7
2 Kisaran kualitas air media selama pemeliharaan... 12
DAFTAR GAMBAR
1 Kelangsungan hidup ikan mas pada perlakuan probiotik berbagai dosis, sebelum dan setelah uji tantang dengan A. hydrophila ... 72 Laju pertumbuhan harian ikan mas pada perlakuan probiotik berbagai dosis selama 30 hari pemeliharaan ... 8
3 Rasio konversi pakan pada perlakuan probiotik berbagai dosis selama 30 hari pemeliharaan ... 9
4 Total eritrosit ikan mas pada perlakuan probiotik berbagai dosis dan setelah uji tantang dengan A. hydrophila ... 9
5 Total leukosit ikan mas pada perlakuan probiotik berbagai dosis dan setelah uji tantang dengan A. hydrophila ... 10
6 Total kelimpahan bakteri di usus sebelum dan setelah perlakuan probiotik berbagai dosis ... 11
7 Total kelimpahan bakteri probiotik Bacillus NP5 RfR di dalam usus ikan mas setelah perlakuan probiotik berbagai dosis. ... 11
DAFTAR LAMPIRAN
1 Prosedur pembuatan media Trypticase Soy Agar (TSA) dan Trypticase Soy Broth (TSB) ... 172 Prosedur pembuatan dosis bakteri probiotik Bacillus NP5 ... 17
3 Prosedur pembuatan larutan Phosphate Buffer Saline (PBS) ... 18
4 Prosedur pembuatan pakan dengan penambahan probiotik ... 18
5 Hasil Total Plating Count (TPC) kultur segar probiotik dari H0-H30 ... 19
6 Hasil Total Plating Count (TPC) pakan ... 19
7 Hasil LD50 untuk menentukan dosis uji tantang ... 19
8 Analisis statistik terhadap tingkat kelangsungan hidup (SR) ikan mas pada perlakuan probiotik berbagai dosis dan setelah uji tantang dengan A. hydrophila ... 20
9 Analisis statistik terhadap laju pertumbuhan harian (LPH) ikan mas setelah pemberian probiotik selama 30 hari ... 20
10 Analisis statistik terhadap rasio konversi pakan (FCR) ikan mas setelah pemberian probiotik selama 30 hari ... 21
11 Analisis statistik terhadap total eritrosit ikan mas pada perlakuan probiotik berbagai dosis dan setelah uji tantang dengan A. hydrophila ... 21
12 Analisis statistik terhadap total leukosit ikan mas pada perlakuan probiotik berbagai dosis dan setelah uji tantang dengan A. hydrophila ... 22
13 Analisis statistik terhadap total kelimpahan bakteri di usus ikan mas setelah pemberian probiotik selama 30 hari ... 23
PENDAHULUAN
Ikan mas Cyprinus carpio merupakan salah satu komoditas unggulan perikanan budidaya di Indonesia. Menurut Direktorat Jenderal Perikanan Budidaya (2013) capaian produksi ikan mas pada tahun 2012 yaitu 375.200 ton dan meningkat menjadi 399.078 ton pada tahun 2013. Budidaya ikan mas ini berkembang pesat seiring dengan permintaan ikan mas yang semakin meningkat. Namun sejalan dengan perkembangan tersebut terdapat kendala dalam budidaya ikan mas, salah satunya yaitu penyakit Motile Aeromonad Septicemia (MAS) yang disebabkan oleh bakteri A. hydrophila. Infeksi dari A. hydrophila dapat menyebabkan kematian pada stadia larva hingga dewasa (Plumb 1994). Kage et al. (1992) dalam penelitiannya menyatakan bahwa Japanese catfish mengalami kematian 90-100% selama 7 hari akibat infeksi A. hydrophila. Penyakit ini juga masih berlangsung di Indonesia hingga sekarang.
Metode yang dilakukan untuk menanggulangi penyakit tersebut umumnya menggunakan antibiotik. Namun penggunaan antibiotik ini dapat menimbulkan risiko yaitu populasi bakteri menjadi resisten terhadap antibiotik yang diberikan dan adanya transmisi bakteri resisten dari lingkungan akuakultur ke manusia (FAO 2005). Hal tersebut juga akan menimbulkan dampak negatif pada keamanan pangan. Oleh karena itu diperlukan alternatif yang aman untuk mengatasi masalah tersebut. Salah satu alternatif yang dapat digunakan untuk mengatasi masalah tersebut adalah dengan aplikasi probiotik.
Probiotik merupakan mikroba hidup yang ketika diberikan dalam jumlah cukup dapat memberikan pengaruh menguntungkan bagi kesehatan inang (Nayak 2010) dan dapat meningkatkan keseimbangan mikroba dalam saluran pencernaan (Fuller 1989). Beberapa studi melaporkan bahwa probiotik dapat meningkatkan kinerja pertumbuhan dan respons imun ikan nila (Wang et al. 2008), serta tingkat kelangsungan hidup dan aktivitas enzim pencernaan larva Penaeus vannamei
(Zhou et al. 2009). Bakteri probiotik yang digunakan dalam penelitian ini adalah
Bacillus NP5. Bakteri tersebut merupakan bakteri yang berasal dari saluran pencernaan ikan nila Oreochromis niloticus yang telah teruji efektif mampu meningkatkan kinerja pertumbuhan (Putra 2010) dan meningkatkan respons imun ikan nila terhadap infeksi Streptococcus agalactiae (Tanbiyaskur 2011). Namun bakteri ini belum diketahui potensinya jika diterapkan pada ikan mas.
2
METODE
Materi Uji
Persiapan Wadah dan Ikan Uji
Wadah yang digunakan dalam penelitian ini adalah akuarium yang berukuran 80 x 60 x 40 cm3 sebanyak 15 buah dengan volume 96 L. Masing-masing akuarium diberi aerasi dan heater untuk menjaga kestabilan oksigen terlarut dan suhu. Sebelum digunakan, akuarium dicuci bersih dan dikeringkan selama satu hari. Kemudian didesinfeksi dengan klorin dosis 30 ppm selama satu hari dan dinetralkan dengan Na-Tiosulfat dosis 15 ppm selama satu hari lalu diaerasi kuat dan selanjutnya akuarium siap digunakan.
Ikan yang digunakan dalam penelitian ini adalah ikan mas yang berasal dari petani di daerah Cibanteng dengan bobot rata-rata 4,52±0,29 g/ekor dan dipelihara dengan kepadatan 15 ekor/akuarium. Bagian sisi akuarium dilapisi dengan plastik hitam agar ikan tidak stres dengan adanya gangguan dari luar akuarium. Sebelum perlakuan, ikan diadaptasikan dengan pakan komersil dan lingkungan selama dua minggu, kemudian ikan dipuasakan selama satu hari sebelum diberi pakan perlakuan. Untuk menjaga kualitas air selama pemeliharaan ikan, akuarium disifon setiap hari dan dilakukan pergantian air sebanyak 30% dari total volume akuarium setiap 3 hari sekali.
Persiapan Probiotik
Probiotik yang digunakan dalam penelitian ini adalah Bacillus NP5 yang berasal dari saluran pencernaan ikan nila (Putra 2010). Bakteri Bacillus NP5 yang digunakan diberi penanda resisten antibiotik rifampicin sebagai penanda molekuler untuk memonitor keberadaan bakteri tersebut dalam usus ikan. Selanjutnya bakteri yang telah resisten antibiotik rifampicin disebut dengan NP5 RfR. Bakteri Bacillus NP5 RfR diperoleh dengan menyebar biakan cair bakteri NP5 pada media TSA (Trypticase Soy Agar) yang telah diberi rifampicin 50 µg/ml. Koloni yang tumbuh kemudian dikultur kembali untuk mendapatkan isolat murni NP5 RfR. Selanjutnya dilakukan karakterisasi bakteri dengan pewarnaan gram dan uji biokimia.
3
eppendorf ke-2 dipipet sebanyak 100 µl lalu dimasukkan ke dalam eppendorf ke-3 yang telah diisi dengan PBS (Phosphate Buffer Saline) dan kepadatan yang dicapai pada tahap ini yaitu 108 CFU/ml. Prosedur pembuatan larutan PBS ada pada Lampiran 3. Langkah yang sama tersebut terus dilakukan hingga mendapatkan kepadatan bakteri 106 CFU/ml. Setelah itu eppendorf dengan kepadatan 1010 CFU/ml, 108 CFU/ml, dan 106 CFU/ml diambil untuk dilakukan ke tahap persiapan pakan uji. Prosedur pembuatan pakan dengan penambahan bakteri probiotik Bacillus NP5 ada pada Lampiran 4. Hasil kultur bakteri probiotik Bacillus NP5 diamati kepadatan bakterinya pada awal, tengah dan akhir penelitian untuk memastikan kepadatan bakteri pada kultur segar adalah 1010 CFU/ml (Lampiran 5). Selanjutnya pakan yang telah dicampur dengan bakteri probiotik Bacillus NP5 diuji viabilitasnya pada waktu 15 menit setelah dicampur di pakan, pada pukul 08.00, 13.00 dan 17.00 untuk memastikan bakteri masih ada dalam pakan saat waktu pemberian pakan. Hasil uji viabililtas bakteri probiotik
Bacillus NP5 di pakan dapat dilihat pada Lampiran 6.
Penghitungan Total Bakteri
Penghitungan total bakteri digunakan untuk mengetahui kepadatan bakteri pada kultur segar, pakan uji, dan usus ikan uji. Metode yang digunakan adalah
Total Plating Count (TPC). Pengenceran dilakukandengan menambahkan 0,9 ml PBS (Phosphate Buffer Saline) dan 0,1 ml suspensi bakteri lalu dimasukkan dalam eppendorf. Selanjutnya dari pengenceran pertama diambil sebanyak 0,1 ml dan dimasukkan ke dalam media pengencer kedua yang berisi 0,9 ml PBS sampai media pengencer terakhir. Setiap pengenceran divortex sebelum dimasukkan ke dalam media pengencer berikutnya agar homogen. Kemudian pada pengenceran 10-7-10-10 masing-masing disebar sebanyak 50 µl ke dalam media TSA cawan yang dibuat dengan dua ulangan tiap pengenceran.
Persiapan Pakan Uji
Pakan yang digunakan dalam penelitian ini adalah pellet komersil dengan kandungan protein 30-33%. Sebanyak 1% (v/w) kultur segar bakteri probiotik
Bacillus NP5 RfR dan 2% (v/w) putih telur dicampur di dalam botol film kemudian dituangkan ke dalam pakan dan diaduk hingga merata. Pada pakan kontrol positif dan negatif juga diberikan putih telur 2%. Setelah itu pakan dikering-anginkan selama 15 menit untuk mengurangi kelembaban pakan. Selanjutnya pakan siap diberikan untuk ikan uji. Pemberian pakan dilakukan sebanyak tiga kali sehari dengan metode ad satiation atau sekenyangnya pada pukul 08.00, 12.00, dan 17.00 WIB selama 30 hari. Pakan masing-masing perlakuan dan ulangan disimpan dalam refrigerator suhu 4oC untuk menjaga viabilitas bakteri probiotik Bacillus NP5.
Persiapan Uji Tantang
4
bertujuan untuk mendapatkan koloni tunggal. Lalu dilakukan identifikasi dengan pewarnaan Gram dan uji biokimia. Proses ini dilakukan sebanyak 2 kali.
Setelah didapatkan bakteri A. hydrophila yang lebih virulen, dilakukan LD50. LD50 merupakan dosis yang dapat menyebabkan populasi ikan mati
sebanyak 50% dan prosedur ini penting dilakukan untuk mengetahui konsentrasi bakteri yang digunakan untuk uji tantang. Produksi bakteri A. hydrophila untuk uji LD50 terlebih dahulu dikultur pada media TSB 10 ml dan di inkubasi dalam
waterbath shaker pada suhu 29oC dan kecepatan 140 rpm selama 24 jam. Kemudian suspensi bakteri dicuci menggunakan PBS sebanyak 2 kali. Ikan yang digunakan untuk LD50 berukuran 6 g. Dosis injeksi sebanyak 0.1 ml/ekor dengan
konsentrasi bakteri 105 CFU/mlsampai 108 CFU/ml. LD50 ini dilakukan dengan
dua kali ulangan dan pengamatan dilakukan dengan menghitung jumlah ikan yang masih hidup dan mati sampai hari ke-7. Jika selama 7 hari belum ada kematian 50% populasi pada ikan maka dilanjutkan pengamatan hingga 14 hari. Selanjutnya dilakukan penghitungan untuk mengetahui nilai LD50 yaitu konsentrasi yang dapat
menyebabkan ikan mati sebanyak 50% dari populasi (Reed & Muench 1938). Hasil LD50 ada pada Lampiran 7.
Uji tantang dilakukan pada hari ke-32 dengan kepadatan ikan 8 ekor/ akuarium. Dosis penyuntikan yaitu 0,1 ml/ekor dengan kepadatan bakteri 107 CFU/ml. Pengamatan uji tantang dilakukan selama 14 hari.
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian adalah Rancangan Acak Lengkap (RAL) yang terdiri dari 5 perlakuan dan 3 ulangan. Adapun perlakuannya sebagai berikut :
Kontrol positif (K+) : Pemberian pakan tanpa penambahan probiotik dan diinjeksi tantang dengan A. hydrophilla
Kontrol negatif (K-) : Pemberian pakan tanpa penambahan probiotik dan diinjeksi tantang dengan PBS (Phosphate Buffer Saline) Perlakuan A : Pemberian pakan dengan probiotik sebanyak 106 CFU/g
pakan dan diinjeksi dengan A. hydrophilla
Perlakuan B : Pemberian pakan dengan probiotik sebanyak 108 CFU/g pakan dan diinjeksi dengan A. hydrophilla
Perlakuan C : Pemberian pakan dengan probiotik sebanyak 1010 CFU/g pakandan diinjeksi dengan A. hydrophilla
Parameter Uji
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup (Survival Rate/SR) merupakan perbandingan antara jumlah individu pada akhir pemeliharaan dengan jumlah individu pada awal pemeliharaan. Tingkat kelangsungan hidup dapat dihitung menggunakan rumus sebagai berikut (Effendi 2004):
SR (%) =
5 Keterangan :
Nt = jumlah individu pada akhir pemeliharaan (hari ke-t) No = jumlah individu pada awal pemeliharaan (hari ke-0)
Laju Pertumbuhan Harian
Pengukuran laju pertumbuhan harian dilakukan dengan menimbang bobot ikan mas setiap 10 hari sekali selama pemeliharaan. Laju pertumbuhan harian dapat dihitung dengan rumus sebagai berikut (Huisman 1987):
[ √ o t ] x
Keterangan :
LPH = Laju Pertumbuhan harian (%)
Wt = Bobot rata-rata pada akhir perlakuan (g) Wo = Bobot rata-rata pada awal perlakuan (g) t = Periode pemeliharaan (hari)
Rasio Konversi Pakan
Rasio konversi pakan atau Feed Convertion Ratio (FCR) selama pemeliharaan dihitung menggunakan rumus (Zonneveld et al. 1991) :
t m o
Keterangan :
FCR = konversi pakan F = jumlah pakan (g)
Bt = Biomassa ikan mas pada akhir pemeliharaan (g) Bm = Biomassa ikan mas yang mati saat pemeliharaan (g) Bo = Biomassa ikan mas pada awal pemeliharaan (g)
Hematologi Ikan
Pengamatan hematologi ikan dilakukan sebanyak 2 kali yaitu 30 hari setelah perlakuan probiotik dan 14 hari setelah uji tantang. Pengamatan hematologi dilakukan dengan menyiapkan syringe, eppendorf, dan antikoagulan Na-sitrat 3,8% untuk pengambilan darah. Pengambilan darah ikan melalui vena caudal menggunakan syringe yang telah dibilas dengan antikoagulan, kemudian darah ikan dimasukkan ke dalam eppendorf yang telah dibilas dengan antikoagulan. Antikoagulan berfungsi untuk mencegah pembekuan darah. Parameter hematologi ikan yang diamati adalah total eritrosit dan total leukosit (Blaxhall dan Daisley 1973).
1. Total Eritrosit
6
digoyangkan membentuk angka 8 selama 5 menit. Setelah itu, tetesan darah pertama dibuang dan tetesan darah berikutnya diletakkan pada haemocytometer
yang telah ditutup dengan gelas objek. Penghitungan dilakukan dibawah mikroskop dengan perbesaran 400 kali dan jumlah eritrosit dihitung sampling pada 5 kotak. Berikut ini adalah rumus penghitungan total eritrosit:
2. Total Leukosit
Pengamatan total leukosit pertama dilakukan dengan menyiapkan pipet bulir putih, haemocytometer, hand counter, dan gelas objek. Selanjutnya pengamatan dilakukan dengan cara darah dihisap menggunakan pipet bulir putih sampai skala 0,5, selanjutnya dilakukan pengenceran dengan larutan Turk sampai skala maksimum 11. Kemudian ujung pipet ditutup menggunakan jari tangan dan digoyangkan membentuk angka 8 selama 5 menit. Setelah itu, tetesan darah pertama dibuang dan tetesan darah berikutnya diletakkan pada haemocytometer
yang telah ditutup dengan gelas objek. Penghitungan dilakukan dibawah mikroskop dengan perbesaran 400 kali dan jumlah leukosit dihitung sampling pada 5 kotak. Berikut ini adalah rumus penghitungan jumlah leukosit :
Total Kelimpahan Bakteri dan Bacillus NP5 RfR di Usus
Pengamatan total kelimpahan bakteri di usus dilakukan sebelum perlakuan probiotik (H1) dan setelah perlakuan probiotik (H30). Sedangkan pada pengamatan total kelimpahan bakteri Bacillus NP5 di usus dilakukan setelah perlakuan probiotik (H30). Sebelum pengamatan terlebih dahulu disiapkan media TSA, TSA+Rif, PBS, dan peralatan aseptik. Metode penghitungan total kelimpahan bakteri dan Bacillus NP5 di usus menggunakan metode Total Plating Count (TPC). Preparasi selanjutnya dilakukan dengan mengambil usus dari tubuh ikan dan memasukkannya dalam eppendorf. Selanjutnya usus digerus menggunakan penggerus steril. Kemudian usus yang telah digerus tersebut diambil sebanyak 0,1 ml menggunakan syringe dan dimasukkan ke dalam 0.9 ml PBS (1:10), lalu dilakukan pengenceran berseri dari 10-1 sampai 10-10. Setiap pengenceran dilakukan homogenisasi dengan cara divortex. Masing-masing pengenceran tersebut dituang sebanyak 50 µl pada media TSA (untuk total kelimpahan bakteri di usus) dan TSA yang mengandung rifampicin 50 µg/ml (TSA+Rif) untuk total kelimpahan bakteri Bacillus NP5 di usus. Kemudian disebar dengan batang penyebar hingga merata. Kultur ini dilakukan dengan dua ulangan. Selanjutnya diinkubasi dalam incubator suhu ruang selama 24 jam. Setelah itu dilakukan penghitungan total bakteri menggunakan rumus berikut ini (Reynolds dan Mark 2005):
∑ Sel darah merah = a e o
5 x 25 x , x faktor pengencer
∑ Sel darah putih
=
a e o5 x 25 x , x faktor pengencer
Total kelimpahan bakteri = rata rata jumlah koloni U
7
Kualitas Air
Pengamatan kualitas air yang dilakukan adalah pada awal dan akhir pemeliharaan. Parameter kualitas air yang diukur adalah suhu, oksigen terlarut (DO), pH dan amonia. Berikut adalah parameter kualitas air beserta alat ukurnya. Tabel 1 Parameter kualitas air
Parameter Satuan Alat ukur
Suhu oC Termometer
Oksigen terlarut (DO) mg/L DO meter
pH - pH meter
Amonia mg/L Spektrofotometer
Prosedur Analisis Data
Data yang diperoleh ditabulasikan menggunakan Microsoft Excel 2010. Kemudian dilakukan uji ANOVA, lalu uji lanjut Duncan dengan tingkat kepercayaan 95% untuk mengetahui beda nyata tiap perlakuan menggunakan
SPSS Statistic 17,0. Sedangkan data kualitas air dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Hasil
Tingkat Kelangsungan Hidup
Penghitungan kelangsungan hidup ikan mas dilakukan setelah 30 hari perlakuan probiotik berbagai dosis dan setelah 14 hari uji tantang dengan A. hydrophila. Tingkat kelangsungan hidup ikan mas ditampilkan pada Gambar 1 berikut ini.
Keterangan :
*Huruf superscript yang berbeda pada grafik yang sama menunjukkan hasil yang berbeda nyata (P<0.05) ** K+ (kontrol positif), K- (kontrol negatif), A (probiotik dosis 106 CFU/g pakan), B (probiotik dosis 108 CFU/g pakan)
dan C (probiotik dosis 1010 CFU/g pakan)
Gambar 1 Kelangsungan hidup ikan mas pada perlakuan probiotik berbagai dosis, sebelum dan setelah uji tantang dengan A. hydrophila
8
Kelangsungan hidup ikan mas setelah perlakuan probiotik berbagai dosis selama 30 hari berkisar 89-100% dan tidak berbeda nyata tiap perlakuan (P>0,05; Lampiran 8). Kelangsungan hidup ikan mas setelah 14 hari diinfeksi dengan A. hydrophila berkisar 50-100%. Perlakuan probiotik menghasilkan tingkat kelangsungan hidup 78-100% sedangkan pada kontrol positif hanya 50%. Perlakuan probiotik dosis 1010 CFU/g pakan menunjukkan tingkat kelangsungan hidup tertinggi yaitu 100% dan berbeda nyata dengan kontrol positif (P<0,05; Lampiran 8).
Laju Pertumbuhan Harian
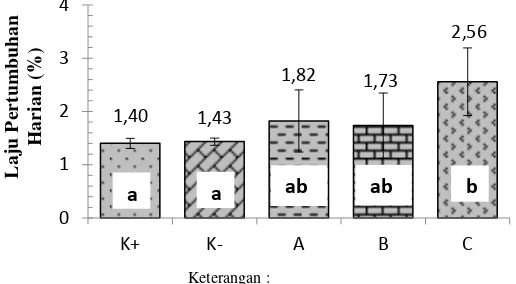
Penghitungan laju pertumbuhan harian ikan mas dilakukan pada hari ke-30 setelah pemberian probiotik berbagai dosis. Nilai laju pertumbuhan harian ikan mas ditampilkan pada Gambar 2 berikut ini.
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0.05)
** K+ (kontrol positif), K- (kontrol negatif), A (probiotik dosis 106 CFU/g pakan), B (probiotik dosis 108 CFU/g pakan)
dan C (probiotik dosis 1010 CFU/g pakan)
Gambar 2 Laju pertumbuhan harian ikan mas pada perlakuan probiotik berbagai dosis selama 30 hari pemeliharaan
Laju pertumbuhan harian ikan mas pada perlakuan probiotik berbagai dosis berkisar antara 1,73-2,56%. Perlakuan probiotik dosis 1010 CFU/g pakan menunjukkan hasil yang berbeda nyata dengan kontrol positif dan negatif (P<0,05; Lampiran 9).
Rasio Konversi Pakan
9
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0.05)
** K+ (kontrol positif), K- (kontrol negatif), A (probiotik dosis 106 CFU/g pakan), B (probiotik dosis 108 CFU/g pakan)
dan C (probiotik dosis 1010 CFU/g pakan)
Gambar 3 Rasio konversi pakan pada perlakuan probiotik berbagai dosis selama 30 hari pemeliharaan
FCR ikan mas pada perlakuan probiotik berbagai dosis berkisar antara 1,55-2,46. Perlakuan probiotik dosis 106 CFU/g pakan, 108 CFU/g pakan, dan 1010 CFU/g pakan menunjukkan hasil yang berbeda nyata dengan kontrol positif dan negatif (P<0,05; Lampiran 10).
Hematologi Ikan Total Eritrosit
Penghitungan total eritrosit dilakukan setelah 30 hari perlakuan probiotik berbagai dosis dan setelah 14 hari uji tantang dengan A. hydrophila. Total eritrosit dapat dilihat pada Gambar 4 berikut ini.
Keterangan :
*Huruf superscript yang berbeda pada grafik yang sama menunjukkan hasil yang berbeda nyata (P<0.05) ** K+ (kontrol positif), K- (kontrol negatif), A (probiotik dosis 106 CFU/g pakan), B (probiotik dosis 108 CFU/g pakan)
dan C (probiotik dosis 1010 CFU/g pakan)
Gambar 4 Total eritrosit ikan mas pada perlakuan probiotik berbagai dosis dan setelah uji tantang dengan A. hydrophila
10
Total eritrosit ikan mas setelah 30 hari perlakuan probiotik berbagai dosis berkisar antara 1,42-2,45 x 106 sel/mm3. Perlakuan probiotik dosis 1010 CFU/g pakan menunjukkan hasil yang berbeda nyata dengan kontrol positif, negatif dan perlakuan probiotik dosis 106 CFU/g pakan (P<0.05; Lampiran 11). Setelah 14 hari diinfeksi dengan A. hydrophila, kisaran total eritrosit turun menjadi 0,89-1,33 x 106 sel/mm3. Perlakuan probiotik dosis 108 CFU/g pakan menunjukkan hasil yang tidak berbeda nyata terhadap semua perlakuan (P>0,05; Lampiran 11).
Total Leukosit
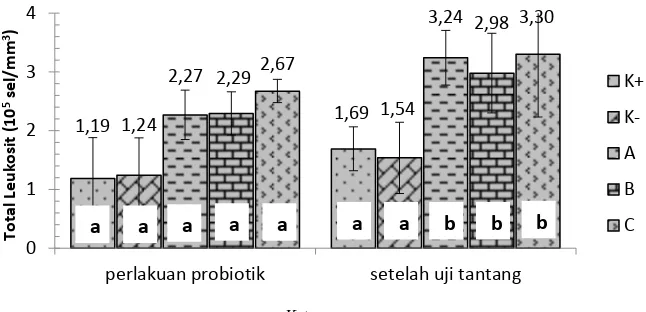
Total leukosit dihitung setelah 30 hari perlakuan probiotik berbagai dosis dan setelah 14 hari uji tantang dengan A. hydrophila.Total leukosit ditampilkan pada Gambar 5 berikut ini.
Keterangan :
*Huruf superscript yang berbeda pada grafik yang sama menunjukkan hasil yang berbeda nyata (P<0.05) ** K+ (kontrol positif), K- (kontrol negatif), A (probiotik dosis 106 CFU/g pakan), B (probiotik dosis 108 CFU/g pakan)
dan C (probiotik dosis 1010 CFU/g pakan)
Gambar 5 Total leukosit ikan mas pada perlakuan probiotik berbagai dosis dan setelah uji tantang dengan A. hydrophila
Total leukosit setelah 30 hari perlakuan probiotik berbagai dosis berkisar 1,19-2,67 x 105 sel/mm3. Perlakuan probiotik berbagai dosis menunjukkan total leukosit tidak berbeda nyata tiap perlakuan (P>0,05; Lampiran 12). Setelah 14 hari diinfeksi dengan A. hydrophila, kisaran total leukosit meningkat menjadi 1,54-3,30 x 105 sel/mm3. Perlakuan probiotik 106 CFU/g pakan, 108 CFU/g pakan, dan 1010 CFU/g pakan menunjukkan hasil yang berbeda nyata dengan kontrol positif dan negatif (P<0,05; Lampiran 12).
Total Kelimpahan Bakteri di Usus
11
Keterangan :
*Huruf superscript yang berbeda pada grafik yang sama menunjukkan hasil yang berbeda nyata (P<0.05) ** K+ (kontrol positif), K- (kontrol negatif), A (probiotik dosis 106 CFU/g pakan), B (probiotik dosis 108 CFU/g pakan)
dan C (probiotik dosis 1010 CFU/g pakan)
Gambar 6 Total kelimpahan bakteri di usus sebelum dan setelah perlakuan probiotik berbagai dosis
Total kelimpahan bakteri sebelum perlakuan probiotik pada semua perlakuan adalah 107 CFU/g. Setelah 30 hari perlakuan probiotik, total kelimpahan bakteri di usus berkisar 107-1012 CFU/g. Perlakuan probiotik dosis 1010 CFU/g pakan menunjukkan hasil tertinggi dan berbeda nyata terhadap semua perlakuan (P<0,05; Lampiran 13).
Total Kelimpahan Bacillus NP5 RfR di Usus
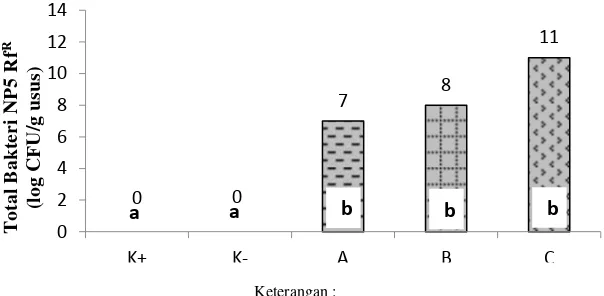
Total kelimpahan bakteri Bacillus NP5 RfR di usus dihitung setelah 30 hari perlakuan probiotik berbagai dosis. Total kelimpahan Bacillus NP5 RfR di usus ditampilkan pada Gambar 7 berikut ini.
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0.05)
** K+ (kontrol positif), K- (kontrol negatif), A (probiotik dosis 106 CFU/g pakan), B (probiotik dosis 108 CFU/g pakan)
dan C (probiotik dosis 1010 CFU/g pakan)
Gambar 7 Total kelimpahan bakteri probiotik Bacillus NP5 RfR di dalam usus ikan mas setelah perlakuan probiotik berbagai dosis.
12
Perlakuan probiotik dosis 106 CFU/g pakan, 108 CFU/g pakan, dan 1010 CFU/g pakan menunjukkan hasil yang berbeda nyata dengan kontrol positif dan negatif (P<0,05; Lampiran 14). Pada kontrol tidak ditemukan adanya bakteri yang tumbuh pada media TSA yang mengandung antibiotik rifampicin.
Kualitas Air
Pengamatan kualitas air dilakukan pada awal dan akhir perlakuan. Hasil pengamatan kualitas air disajikan pada Tabel 2 berikut ini.
Tabel 2 Kisaran kualitas air media selama pemeliharaan Parameter
Tingkat kelangsungan hidup merupakan ukuran keberhasilan suatu populasi pada waktu tertentu selama pemeliharaan. Berdasarkan hasil yang diperoleh (Gambar 1) pemberian probiotik Bacillus NP5 dengan dosis 106 CFU/g pakan, 108 CFU/g pakan, dan 1010 CFU/g pakan melalui pakan pada pemeliharaan ikan mas menghasilkan kelangsungan hidup yang tidak berbeda nyata (P>0,05) terhadap semua perlakuan dengan kisaran nilai 89-100%. Walaupun tidak berbeda nyata (P>0,05) kelangsungan hidup ikan mas 100% terdapat pada perlakuan probiotik dosis 1010 CFU/g pakan. Setelah diuji tantang dengan bakteri A. hydrophila selama 14 hari, tingkat kelangsungan hidup ikan mas yang diberi probiotik menunjukkan hasil yang lebih baik dan berbeda nyata (P<0.05) dengan kontrol positif. Penambahan bakteri probiotik Bacillus NP5 menghasilkan tingkat kelangsungan hidup 78-100% sedangkan pada kontrol positif hanya 50% (P<0,05). Perlakuan probiotik dosis 1010 CFU/g menghasilkan kelangsungan hidup 100%. Pemberian probiotik Bacillus NP5 melalui pakan diduga mampu menekan infeksi bakteri A. hydrophila dalam tubuh ikan mas melalui aktivitas antagonistik dan peningkatan respons imun sehingga dapat meningkatkan tingkat kelangsungan hidup ikan mas. Putra (2010) dalam penelitiannya menyatakan bahwa bakteri probiotik Bacillus NP5 telah diuji memiliki aktivitas antagonistik terhadap pertumbuhan bakteri A. hydrophila. Hasil penelitian Tanbiyaskur (2011) menunjukkan bahwa pemberian probiotik Bacillus NP5 dalam pakan ikan nila mampu menekan infeksi Streptococcus agalactiae melalui peningkatan respons imun sehingga dapat meningkatkan tingkat kelangsungan hidup ikan nila. Li et al.
13 pakan, cara preparasi probiotik, dan spesies probiotik yang digunakan (Nayak 2010).
Pertumbuhan merupakan pertambahan bobot atau panjang dalam waktu tertentu. Pemberian bakteri probiotik Bacillus NP5 dalam pakan menghasilkan laju pertumbuhan harian yang lebih tinggi dibandingkan kontrol. Laju pertumbuhan harian tertinggi dihasilkan oleh perlakuan probiotik dosis 1010 CFU g pakan-1 yaitu 2,56 % dan berbeda nyata (P<0,05) dengan perlakuan kontrol (Gambar 2). Laju pertumbuhan harian pada perlakuan ini tertinggi diduga karena aktivitas enzim pencernaan (amilase dan protease) yang lebih tinggi sehingga mampu meningkatkan kecernaan pakan. Putra (2010) menyatakan bahwa bakteri
Bacillus NP5 merupakan bakteri probiotik yang dapat menghasilkan enzim amilase dan protease. Enzim tersebut diduga dapat berperan sebagai enzim
exogeneous yang membantu enzim endogenous ikan mas dalam melakukan hidrolisis makromolekul pakan (karbohidrat dan protein) menjadi molekul yang lebih sederhana (monosakarida dan asam amino). Molekul sederhana tersebut akan mudah diserap oleh tubuh ikan melalui dinding usus dan disebarkan ke seluruh tubuh melalui sistem peredaran darah yang kemudian dapat dimanfaatkan sebagai sumber energi untuk pertumbuhan. Hasil penelitian Muhammad (2013) menunjukkan bahwa pemberian probiotik Bacillus NP5 dalam pakan juga diduga mampu meningkatkan enzim amilase dan protease dalam saluran pencernaan udang vaname sehingga pakan dapat lebih banyak digunakan untuk pertumbuhan.
FCR merupakan nilai yang menunjukkan pemanfaatan pakan sehingga nutrien pakan dapat diserap oleh tubuh untuk pertumbuhan. Hasil penelitian menunjukkan bahwa nilai FCR pada perlakuan probiotik dosis 1010 CFU/g pakan, 108 CFU/g pakan, dan 106 CFU/g pakan lebih baik serta berbeda nyata (P<0,05) dengan kontrol (Gambar 3). Nilai FCR yang rendah menunjukkan pemanfaatan pakan yang lebih baik untuk pertumbuhan. Tanbiyaskur (2011) dan Muhammad (2013) juga menyatakan bahwa pemberian probiotik Bacillus NP5 dalam pakan ikan nila dan udang vaname dapat menurunkan FCR dan berbeda nyata (P<0.05) dengan kontrol. Penambahan bakteri probiotik Bacillus NP5 dalam pakan diduga mampu meningkatkan aktivitas enzim dalam saluran pencernaan, sehingga kecernaan pakan dapat meningkat. Oleh karena itu pakan yang diberikan pada ikan mas dapat dimanfaatkan secara optimal untuk pertumbuhan.
14
hydrophila ini memiliki produk ekstraseluler seperti hemolysins dan proteases
yang berperan dalam mekanisme patogenitasnya (Plumb 1994).
Leukosit merupakan salah satu pertahanan terdepan dan jumlahnya dapat meningkat cepat ketika terjadi infeksi. Hasil penelitian menunjukkan bahwa total leukosit tertinggi dihasilkan oleh perlakuan dosis probiotik 1010 CFU/g pakandan tidak berbeda nyata (P<0,05) dengan perlakuan lainnya. Setelah diuji tantang dengan A. hydrophila, secara keseluruhan total leukosit meningkat pada semua perlakuan. Total leukosit setelah uji tantang yang tertinggi dihasilkan oleh perlakuan probiotik dosis 1010 CFU/g pakanyaitu 3,30 x 105 sel/mm3 dan berbeda nyata (P<0,05) terhadap kontrol positif dan negatif. Peningkatan total leukosit diduga karena leukosit ini menjadi perlindungan utama dalam menghambat infeksi patogen (Talpur dan Ikhwanuddin 2013). Hasil penelitian Talpur et al.
(2014) juga menunjukkan bahwa pemberian probiotik L. acidophilus pada
Channa stirata dapat meningkatkan leukosit setelah diuji tantang dengan A. hydrophila.
Total kelimpahan bakteri di usus mengalami peningkatan pada akhir perlakuan dengan nilai tertinggi terdapat pada perlakuan probiotik dosis 1010 CFU/ g pakan yaitu 1,80 x 1012 CFU/g usus dan berbeda nyata (P<0,05) dengan kontrol. Peningkatan jumlah bakteri ini diduga karena adanya penambahan bakteri probiotik dalam usus ikan. Muhammad (2013) dalam penelitiannya juga menyatakan bahwa penambahan bakteri probiotik Bacillus NP5 dalam pakan dapat meningkatkan total kelimpahan bakteri di usus udang vanname dan berbeda nyata (P<0,05) dengan kontrol. Total kelimpahan bakteri probiotik Bacillus NP5 di usus menunjukkan dominansi atau kolonisasi bakteri tersebut dalam usus ikan mas. Hasil penelitian diketahui bahwa total kelimpahan bakteri probiotik Bacillus
NP5 tertinggi terdapat pada perlakuan probiotik dosis 1010 CFU/g pakan yaitu 1,9 x 1011 CFU/g usus. Hal ini menunjukkan bahwa 10,56 % komposisi dari total kelimpahan bakteri di usus merupakan bakteri probiotik Bacillus NP5.
Kualitas air selama pemeliharaan ikan mas masih dalam kisaran optimum. Dengan demikian diasumsikan bahwa perubahan kelangsungan hidup, LPH, FCR, dan hematologi ikan mas bukan disebabkan oleh kualitas air.
SIMPULAN DAN SARAN
Simpulan
15
Saran
Perlu dilakukan penelitian lanjutan dalam skala lapang pemberian pakan dengan dosis probiotik Bacillus NP5 1010 CFU/g pakan untuk menguji pengaruhnya terhadap kinerja produksi ikan mas.
DAFTAR PUSTAKA
Arafad I. 2000. Peranan suhu media terhadap kehidupan benih ikan mas (Cyprinus carpio) ukuran 3-5 cm [skripsi]. Bogor (ID): Institut Pertanian Bogor. Blaxhall PC and Daisley KW. 1973. Routine haematological methods for use with
fish blood. J Fish Biol. 5: 577-581.
Boyd CE. 1988. Water Quality in Warm Water Fish Ponds. Volume ke-4. United States America (US): Auburn University Agricultural Experiment Station. 359 p.
Direktorat Jenderal Perikanan Budidaya. 2013. Statistik menakar target ikan air tawar tahun 2013. Kementrian Kelautan dan Perikanan. Jakarta.
Effendi I, 2004. Pengantar Akuakultur. Penebar Swadaya. Depok.
FAO.2005. Responsible use of antibiotics in aquculture (Ed. Serrano, P.H.), Italy (IT): FAO Fisheries Technical 469p.
Fuller R. 1989. Probiotics in man and animals. J Applied Bacteriology [review].
United Kingdom (GB): Institut of Food Research. 66: 365-378.
Huisman EA. 1987. Principles of Fish Production. Department of Fish Culture and Fisheries, Wageningen Agriculture University, Netherland.
Kage T, Takahashi R, Barcus I, Hayashi F. 1992. Aeromonas hydrophila, a causative agent of mass mortality in cultured Japanese catfish larvae (Silurus asotus). Fish Pathol. 27: 57.
Li J, Beiping T, Kangsen M. 2009. Dietary probiotic Bacillus OJ and isomaltooligosaccharides influence the intestine microbial populations, immune responses and resistance to white spot syndrome virus in shrimp (Litopenaeus vannamei). Aquaculture. 291: 35-40.
Minelli EB, Benini A. 2008. Relationship between number of bacteria and their probiotics effects. Microb Ecol Health Dis. 20: 180-3.
Muhammad A. 2013. Aplikasi probiotik dengan dosis berbeda untuk pencegahan infeksi IMNV (Infectious Myonecrosis Virus) pada udang vaname
Litopenaeus vannamei [skripsi]. Bogor (ID) : Institut Pertanian Bogor. Nayak SK. 2010. Probiotics and Imunity: A Fish Perspective [review]. Fish &
Shellfish Immunology. 29: 2-14.
Plumb JA. 1994. Health Maintenance of Cultured Fishes: Principal Microbial Disease. United States of America (US). CRC Pr.
Putra AN. 2010. Kajian probiotik prebiotik dan sinbiotik untuk meningkatkan kinerja pertumbuhan ikan nila Oreochromis niloticus [tesis]. Bogor (ID): Institut Pertanian Bogor.
Reed LJ, Muench H. 1938. A simple method of estimating fifty percent endpoints.
The American Journal of Hygiene 27: 493-497.
16
Sawyer CN, McCarty PL. 1978. Chemistry for Environmental Engineering. Third edition. Tokyo (JP). McGraw-Hill Book Company. 532 p.
Talpur AD, Ikhwanuddin M. 2013. Azadirachta indica (neem) leaf dietary effects on the immunity response and disease resistance of Asian seabass Lates calcarifer challenged with Vibrio harveyi. Fish & Shellfish Immunology. 34: 254-264.
Talpur AD, Munir MB, Mary A, Hashim R. 2014. Dietary probiotics and prebiotics improved food acceptability, growth performance, haematology and immunological parameters and disease resistance against Aeromonas hydrophila in snakehead (Channa striata) fingerlings. Aquaculture: 01 (13) p 14-20. doi: 10.016/aquaculture.01.013.
Tanbiyaskur. 2011. Efektivitas pemberian probiotik, prebiotik, dan sinbiotik melalui pakan untuk pengendalian infeksi Sterptococcus agalactiae pada ikan nila Oreochromis niloticus [tesis]. Bogor (ID): Institut Pertanian Bogor.
Wang YB, Zi-Qiang T, Jiang-Tao Y, Wei-fen L. 2008. Effect of probiotic,
Enteroccus faecium, on tilapia (Oreochromis niloticus) growth performance and immune response. Aquaculture. 227: 203-207.
Wardoyo STH. 1991. Kriteria kualitas air untuk keperluan pertanian dan perikanan. Training Analisis Dampak Lingkungan. PPLH-UNDP-PUSDI-PSL IPB. Bogor (ID). hlm 35-40.
Zhou XX, Yan-Bo W, Wei-fen L. 2009. Effect of probiotic on larvae shrimp (Penaeus vannamei) based on water quality, survival rate, and digestive enzyme activities. Aquaculture. 287: 349-353.
17
LAMPIRAN
Lampiran 1 Prosedur pembuatan media Trypticase Soy Agar (TSA) dan
Trypticase Soy Broth (TSB) Media TSA dan TSB dalam 1 L
TSB 30 g
Bacto Agar* 17 g Akuades 1 L
*: hanya digunakan dalam pembuatan TSA Cara Pembuatan :
Terlebih dahulu siapkan erlenmeyer, alumunium foil dan karet untuk penutup. Khusus pembuatan TSA, akuades dan bahan yang telah ditimbang terlebih dahulu dipanaskan dalam penangas air hingga larut (erlenmeyer dalam keadaan tertutup rapat dengan alumunium foil). Selanjutnya disterilkan dengan autoklaf pada suhu 121oC dan tekanan 1 atm selama 15 menit. Setelah itu media siap digunakan. Pembuatan TSB tidak ditambahkan dengan bacto agar dan langsung disterilkan dengan autoclave.
Lampiran 2 Prosedur pembuatan dosis bakteri probiotik Bacillus NP5
1010 CFU/ml 109 CFU/ml 108 CFU/ml 107 CFU/ml 106 CFU/ml
0,1 ml 0,1 ml 0,1 ml 0,1 ml
0,1 ml suspensi bakteri dengan 0,9 ml PBS
18
Lampiran 3 Prosedur pembuatan larutan Phosphate Buffer Saline (PBS) PBS dalam 200 ml
NaCl 1,6 g NaH2PO4 0,3 g
K2HPO4 0,04 g
KCL 0,04 g
Akuades 200 ml Cara Pembuatan :
Terlebih dahulu siapkan erlenmeyer, alumunium foil dan karet untuk penutup. Akuades dan bahan yang telah ditimbang di homogenkan sebentar hingga larut, kemudian tutup rapat mulut erlenmeyer dengan alumunium foil dan diikat kencang dengan karet. Selanjutnya disterilkan dengan autoklaf pada suhu 121oC dan tekanan 1 atm selama 15 menit. Setelah itu PBS siap digunakan.
Lampiran 4 Prosedur pembuatan pakan dengan penambahan probiotik
A B C pakan kontrol putih telur
1% (106) 1% (108) 1% (1010) (2% dari total pakan)
Dicampur ke dalam pakan dikering-anginkan 15 menit menimbang pakan
19 Lampiran 5 Hasil Total Plating Count (TPC) kultur segar probiotik dari H0-H30
Lampiran 6 Hasil Total Plating Count (TPC) pakan
Lampiran 7 Hasil LD50 untuk menentukan dosis uji tantang Kepadatan
Kepadatan 107 CFU/ml dapat menyebabkan populasi ikan mas mati 50% sehingga dosis terebut dapat digunakan untuk uji tantang.
1,14 1,14 1,04 1,00
15 menit jam 08.00 jam 13.00 jam 17.00
20
Lampiran 8 Analisis statistik terhadap tingkat kelangsungan hidup (SR) ikan mas pada perlakuan probiotik berbagai dosis dan setelah uji tantang dengan A. hydrophila
ANOVA
Tingkat kelangsungan hidup ikan mas pada perlakuan probiotik berbagai dosis
Sumber Keragaman JKT db KT F Hitung Sig.
Perlakuan 243,600 4 60,900 ,553 ,702
Galat 1101,33 10 110,133
Total 1344,93 14
Uji lanjut Duncana,,b
Perlakuan N α = 0,05
1
A 3 89,00
K+ 3 89,00
B 3 93,33
K- 3 93,33
C 3 100,00
ANOVA
Tingkat kelangsungan hidup ikan mas setelah uji tantang
Sumber Keragaman JKT db KT F Hitung Sig.
Perlakuan 4457,733 4 1114,433 7,208 ,005
Galat 1546,000 10 154,600
Total 6003,733 14
Uji lanjut Duncana,,b
Perlakuan N α = 0,05
1 2
K+ 3 50,00
B 3 78,33
A 3 87,67
K- 3 91,67
C 3 100,00
Lampiran 9 Analisis statistik terhadap laju pertumbuhan harian (LPH) ikan mas setelah pemberian probiotik selama 30 hari
ANOVA
Sumber Keragaman JKT db KT F Hitung Sig.
Perlakuan 2,622 4 ,656 2,885 ,079
Galat 2,272 10 ,227
21 Uji lanjut Duncana,,b
Perlakuan N α = 0,05
1 2
K+ 3 1,3967
K- 3 1,4333
B 3 1,7333 1,7333
A 3 1,8233 1,8233
C 3 2,5567
Lampiran 10 Analisis statistik terhadap rasio konversi pakan (FCR) ikan mas setelah pemberian probiotik selama 30 hari
ANOVA
Sumber Keragaman JKT db KT F Hitung Sig.
Perlakuan 2,092 4 ,523 5,758 ,011
Galat ,908 10 ,091
Total 3,000 14
Uji lanjut Duncana,,b
Perlakuan N α = 0,05
1 2
C 3 1,5533
B 3 1,7700
A 3 1,7933
K- 3 2,4367
K+ 3 2,4600
Lampiran 11 Analisis statistik terhadap total eritrosit ikan mas pada perlakuan probiotik berbagai dosis dan setelah uji tantang dengan A. hydrophila
ANOVA
Total eritrosit pada perlakuan probiotik berbagai dosis
Sumber Keragaman JKT db KT F Hitung Sig.
Perlakuan 1,892 4 ,473 4,064 ,033
Galat 1,164 10 ,116
Total 3,055 14
Uji lanjut Duncana,,b
Perlakuan N α = 0,05
1 2
K+ 3 1,4233
K- 3 1,5533
A 3 1,7033
B 3 1,8267 1,8267
22 ANOVA
Total eritrosit setelah uji tantang
Sumber Keragaman JKT db KT F Hitung Sig.
Perlakuan 0,335 4 0,84 0,818 0,542
Galat 1,023 10
Total 1,358 14
Uji lanjut Duncana,,b
Perlakuan N α = 0,05
1
C 3 0,8933
K+ 3 1,0467
B 3 1,1833
K- 3 1,2067
A 3 1,3300
Lampiran 12 Analisis statistik terhadap total leukosit ikan mas pada perlakuan probiotik berbagai dosis dan setelah uji tantang dengan A. hydrophila
ANOVA
Total leukosit pada perlakuan probiotik berbagai dosis
Sumber Keragaman JKT db KT F Hitung Sig.
Perlakuan 5,486 4 1,372 2,172 ,146
Galat 6,316 10 ,632
Total 11,802 14
Uji lanjut Duncana,,b
Perlakuan N α = 0,05
1
K+ 3 1,1867
K- 3 1,2400
A 3 2,2700
B 3 2,2933
C 3 2,6733
ANOVA
Total leukosit setelah uji tantang
Sumber Keragaman JKT db KT F Hitung Sig.
Perlakuan 8,961 4 2,240 4,838 ,020
Galat 4,630 10 ,463
23 Uji lanjut Duncana,,b
Perlakuan N α = 0,05
1 2
K- 3 1,5367
K+ 3 1,6900
B 3 2,9767
A 3 3,2400
C 3 3,3000
Lampiran 13 Analisis statistik terhadap total kelimpahan bakteri di usus ikan mas setelah pemberian probiotik selama 30 hari
ANOVA
Sumber Keragaman JKT db KT F Hitung Sig.
Perlakuan 32,000 4 8,000 80,000 ,000
Galat ,500 5 ,100
Total 32,500 9
Uji lanjut Duncana,,b
Perlakuan N α = 0,05
1 2 3 4
K- 2 7,0000
K+ 2 8,5000
A 2 9,0000
B 2 11,0000
C 2 12,0000
Lampiran 14 Analisis statistik terhadap total kelimpahan bakteri probiotik
Bacillus NP5 RfR di usus ikan mas setelah pemberian probiotik selama 30 hari
ANOVA
Sumber Keragaman JKT db KT F Hitung Sig.
Perlakuan 203,600 4 50,900 13,757 ,007
Galat 18,500 5 3,700
Total 222,100 9
Uji lanjut Duncana,,b
Perlakuan N α = 0,05
1 2
K- 2 ,0000
K+ 2 ,0000
A 2 7,0000
B 2 8,5000
24
RIWAYAT HIDUP
Penulis dilahirkan di Lampung pada tanggal 06 Maret 1992 dari Bapak Sarjono dan Ibu Hermin Sudiarti sebagai anak ketiga dari tiga bersaudara. Penulis memulai pendidikan di Sekolah Dasar Negeri 8 Metro Pusat pada tahun 1998-2004. Kemudian penulis melanjutkan di Sekolah Menengah Pertama Yos Sudarso Metro pada tahun 2004-2007. Selanjutnya penulis melanjutkan di Sekolah Menengah Atas Negeri 5 Metro pada tahun 2007-2010.
Penulis diterima sebagai mahasiswa Institut Pertanian Bogor tahun 2010 melalui jalur Undangan Seleksi Masuk IPB (USMI) pada program studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Pada tahun 2010 penulis pernah menjadi pengurus Art Dormitory Club periode 2010-2011, anggota aktif Taekwondo IPB tahun 2010/2011 dan Karate IPB tahun 2013. Pada tahun 2012 penulis pernah mengikuti magang di BBPBL Lampung dengan memilih komoditas ikan kobia dan pada tahun 2013 melaksanakan Praktik Lapangan Akuakultur di Tambak Pinang Gading Lampung dengan memilih komoditas udang vaname. Penulis juga pernah menjadi asisten praktikum mata kuliah Nutrisi Ikan pada tahun ajaran 2012/2013, Penyakit Organisme Akuatik pada tahun ajaran 2013/2014, dan Manajemen Kesehatan Organisme Akuatik pada tahun ajaran 2013/2014. Selain itu penulis merupakan salah satu anggota penerima dana DIKTI pada PKM-P (2014) yang berjudul “Mikrotik : Mikrokapsul Probiotik untuk Peningkatan Produksi Budidaya Ikan Lele (Clarias sp.)”.
Tugas akhir dalam menyelesaikan pendidikan tinggi di Institut Pertanian Bogor untuk mendapatkan gelar Sarjana Perikanan berjudul Aplikasi Berbagai Dosis Probiotik Bacillus NP5 Melalui Pakan untuk Pencegahan Infeksi