APLIKASI PROBIOTIK, PREBIOTIK DAN SINBIOTIK
MELALUI PAKAN UNTUK PENCEGAHAN INFEKSI
Aeromonas hydrophila
PADA IKAN MAS
Cyprinus carpio
DIAH NOVIKA SARI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul “Aplikasi Probiotik, Prebiotik dan Sinbiotik Melalui Pakan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Mas Cyprinus carpio” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Diah Novika Sari
ABSTRAK
DIAH NOVIKA SARI. Aplikasi Probiotik, Prebiotik dan Sinbiotik Melalui Pakan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Mas Cyprinus carpio. Dibimbing oleh WIDANARNI dan SUKENDA.
Penyakit motile aeromonad septicemia (MAS) merupakan kendala yang sering dialami dalam budidaya ikan mas. Salah satu alternatif yang dapat dilakukan untuk mengatasi kendala tersebut yaitu dengan aplikasi probiotik, prebiotik dan sinbiotik. Penelitian ini bertujuan untuk menguji efektivitas pemberian bakteri probiotik, prebiotik dan sinbiotik terhadap kelangsungan hidup dan pertumbuhan ikan mas yang diinfeksi dengan A. hydrophila. Sebanyak 15 ekor ikan mas dengan bobot rata-rata 5,09±0,09 g dipelihara di akuarium dengan volume 96 L. Perlakuan yang diberikan yaitu kontrol negatif (K-), kontrol positif (K+) tanpa penambahan probiotik, prebiotik dan sinbiotik, perlakuan penambahan 1% probiotik (A), perlakuan penambahan 2% prebiotik (B) dan perlakuan penambahan sinbiotik (C; 1% probiotik dan 2% prebiotik). Setelah 30 hari, semua perlakuan (kecuali K-) diuji tantang dengan menyuntikkan A. hydrophila
sebanyak 100 μL/ekor pada konsentrasi 107
CFU/ml secara intramuskular dan diamati mortalitasnya selama 14 hari. Hasil penelitian menunjukkan bahwa penambahan sinbiotik memberikan kelangsungan hidup yang lebih tinggi (100%) dibandingkan dengan perlakuan kontrol positif (45,83%) serta memberikan pengaruh yang lebih baik terhadap pertumbuhan ikan mas.
Kata kunci: Aeromonas hydrophila, ikan mas, probotik, prebiotik, sinbiotik
ABSTRACT
DIAH NOVIKA SARI. Application of Dietary Probiotic, Prebiotic and Synbiotic of Infected by Aeromonas hydrophila on Common Carp Cyprinus
carpio.Supervised by WIDANARNI and SUKENDA.
Motile aeromonad septicemia often becomes problem for common carp culture. One of the solution is using probiotic, prebiotic and synbiotic. This study aimed to test effectiveness of probiotic, prebiotic and synbiotic application on the survival rate and growth of common carp that infected by A. hydrophila. Fifteen fish with mean weight 5,09±0,09 g cultured in 96 L. The treatment in this study were negative (K-) and positive control (K+) without treatment probiotic, prebiotic and synbiotic, 1% probiotic supplementation (A), 2% prebiotic supplementation (B) and treatment synbiotic supplementation (C; 1% probiotic and 2% prebiotic). Rearing was carried out for 30 days, and then all treatment (except K-) were injected intramuscullar (im) with 100 μL A. hydrophila at a concentration 107 CFU/ml and then the mortality was observed for 14 days. The result showed that the supplementation of synbiotic (C) increased survival of common carp (100%) higher than control (45,83%) and gave positive influence growth of common carp.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
APLIKASI PROBIOTIK, PREBIOTIK DAN SINBIOTIK
MELALUI PAKAN UNTUK PENCEGAHAN INFEKSI
Aeromonas hydrophila
PADA IKAN MAS
Cyprinus carpio
DIAH NOVIKA SARI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Aplikasi Probiotik, Prebiotik dan Sinbiotik Melalui Pakan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Mas Cyprinus carpio
Nama : Diah Novika Sari
NIM : C14100095
Disetujui oleh
Dr Ir Widanarni, MSi Pembimbing I
Dr Ir Sukenda, MSc Pembimbing II
Diketahui oleh
Dr Ir Sukenda, MSc Ketua Departemen
PRAKATA
Puji syukur kehadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Aplikasi Probiotik, Prebiotik dan Sinbiotik Melalui Pakan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Mas Cyprinus carpio”. Penelitian ini dilakukan pada bulan April sampai Juni 2014 di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Dalam kesempatan ini, penulis mengucapkan terima kasih kepada Ibu Dr Ir Widanarni, MSi dan Bapak Dr Ir Sukenda, MSc selaku dosen pembimbing skripsi yang telah banyak memberikan bimbingan selama pengerjaan penelitian ini. Ibu Dr Ir Mia Setiawati, MSi selaku dosen penguji dan Ibu Dr Sri Nuryati, SPi MSi selaku komisi pendidikan dalam ujian sidang penulis yang telah memberikan banyak kritik dan saran untuk perbaikan dan kesempurnaan dalam penulisan skripsi ini. Bapak Dr Ir Nur Bambang P U, MSi selaku dosen pembimbing akademik yang telah banyak memberikan masukan, semangat dan motivasi. Keluargaku tercinta ayahanda Sugeng Sutrisno, ibunda Mardiah H. Latif, Nazimuddin, SPi, Alfian Sodikin, Diah Khairunisa serta keluarga besar yang telah banyak memberikan semangat dan motivasi kepada penulis. Sahabat tercinta Asty Kafriaty dan Komalasari Marzuki yang selalu memberi dukungan dan saran tiada henti. Bapak Ranta yang telah banyak mendukung dalam penelitian ini, Bapak Wasjan, Mba Retno, Bapak Marjanta, Mba Yuli, Bapak Asep, Ka Rahman dan semua staf Departemen Budidaya Perairan, serta keluarga besar BDP 47 Aziz, Manova, Haris, Evy, Tiwi, Nadia, Enrika, Indri, Ike, Septi N, Dian, Amal, Netty, Zahra, Fira, Lilis, Sepriadi, Alit, Dede, Oob, Septi Dwi, kak Yanti, kak Dewi, kak Dwi, kak Dendi, kak Jenni, kak Arief rekan-rekan BDP 44, 45, 46, 47, 48 dan 49 yang telah banyak memberikan pengalaman-pengalaman indah selama penulis menempuh pendidikan di Institut Pertanian Bogor.
Penulis berharap penelitian yang dituangkan dalam sebuah skripsi ini dapat memberikan banyak manfaat sesuai dengan yang diharapkan.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
METODOLOGI ... 2
Materi Uji ... 2
Penyediaan Bakteri Probiotik ... 2
Ekstraksi Oligosakarida/Prebiotik ... 2
Perhitungan Total Padatan Terlarut ... 2
Pengujian secara In Vivo... 3
Persiapan Wadah dan Ikan Uji ... 3
Uji In Vivo ... 3
Parameter pengamatan ... 4
Tingkat Kelangsungan Hidup (SR) ... 4
Laju Pertumbuhan Harian (LPH) ... 4
Konversi Pakan (FCR) ... 4
Hematologi Ikan ... 5
Total Eritrosit ... 5
Total Leukosit ... 5
Total bakteri NP5 di usus ... 5
Total bakteri di usus ... 5
Kualitas air ... 6
Analisis Data ... 6
HASIL DAN PEMBAHASAN ... 6
Hasil ... 6
Tingkat kelangsungan hidup ... 6
Laju pertumbukan harian ... 7
Rasio konversi pakan ... 7
Hematologi Ikan ... 7
Total Eritrosit ... 7
Total Leukosit ... 8
Total bakteri NP5 di usus ... 9
Pembahasan... 10
KESIMPULAN DAN SARAN ... 12
Kesimpulan ... 12
Saran ... 13
DAFTAR PUSTAKA ... 13
LAMPIRAN ... 16
RIWAYAT HIDUP ... 20
DAFTAR GAMBAR
1 Tingkat kelangsungan hidup ikan mas pada perlakuan kontrol, probiotik, prebiotik dan sinbiotik selama 30 hari pemeliharaan ... 62 Laju pertumbuhan harian ikan mas pada perlakuan kontrol, probiotik, prebiotik dan sinbiotik selama 30 hari pemeliharaan ... 7
3 Rasio konversi pakan ikan mas pada perlakuan kontrol, probiotik, prebiotik dan sinbiotik selama 30 hari pemeliharaan ... 7
4 Total eritrosit ikan mas pada perlakuan kontrol, probiotik, prebiotik dan sinbiotik selama 30 hari pemeliharaan dan setelah uji tantang ... 8
5 Kadar leukosit ikan mas pada perlakuan kontrol, probiotik, prebiotik dan sinbiotik selama 30 hari pemeliharaan dan setelah uji tantang ... 8
DAFTAR TABEL
1 Satuan dan alat ukur parameter kualitas air ... 62 Total bakteri Bacillus NP5 diusus pada ikan mas setelah 30 hari pemeliharaan ... 9
3 Total bakteri usus ikan mas pada awal dan setelah 30 hari perlakuan ... 9
4 Kualitas air ikan mas selama pemeliharaan ... 9
DAFTAR LAMPIRAN
1 Data statistik uji lanjut Duncan tingkat kelangsung hidup ikan mas selama 30 hari pemeliharaan dan setelah uji tantang ... 162 Data statistik uji lanjut Duncan laju pertumbuhan harian ikan mas selama 30 hari pemeliharaan ... 17
3 Data statistik uji lanjut Duncan rasio konversi pakan ikan mas selama 30 hari pemeliharaan ... 17
4 Data statistik uji lanjut Duncan total eritrosit ikan mas selama 30 hari pemeliharaan dan setelah uji tantang ... 18
PENDAHULUAN
Ikan mas Cyprinus carpio merupakan salah satu komoditas unggulan nasional yang telah diupayakan peningkatan produksinya dari 375.200 ton pada tahun 2012 menjadi 399.078 ton pada tahun 2013 (KKP 2013). Seiring dengan peningkatan produksi ikan mas maka sistem budidaya intensif telah banyak dilakukan. Namun kendala yang sering dialami dalam kegiatan produksi dengan sistem budidaya intensif adalah adanya wabah penyakit yang disebabkan oleh bakteri, parasit, jamur dan virus. Salah satu penyakit yang sering menyerang ikan mas adalah Motile Aeromonad Septicemia (MAS) yang disebabkan oleh infeksi bakteri Aeromonas hydrophila. Ikan yang terserang penyakit MAS umumnya memiliki ciri-ciri nafsu makan berkurang dan timbul luka di tubuh. Penyakit ini bersifat akut yang dapat menyebabkan kematian ikan 80-90% (Cipriano 2001). Pengobatan yang umum diberikan adalah dengan menggunakan antibiotik. Namun, penggunaan antibiotik telah dilarang karena dapat meninggalkan residu pada ikan yang berdampak negatif apabila dikonsumsi manusia, dan penggunaan dalam jangka panjang dapat menimbulkan resistensi pada bakteri (Lewis 2001). Salah satu alternatif yang dapat dilakukan untuk pencegahan penyakit MAS adalah dengan menggunakan probiotik, prebiotik dan sinbiotik.
Fuller (1989) menyatakan bahwa probiotik merupakan makanan tambahan dalam bentuk mikroba hidup yang memberi pengaruh menguntungkan bagi inang dengan meningkatkan keseimbangan mikroba dalam saluran pencernaan. Probiotik dapat meningkatkan dan mengoptimalkan peran mikroflora dalam saluran pencernaan sehingga dapat menekan jumlah patogen dalam tubuh inang serta meningkatkan sistem imun inang. Prebiotik merupakan bahan pangan yang tidak dapat dicerna oleh inang seperti inulin, fruktooligosakarida (FOS), mannanoligosakarida (MOS), galaktoligosakarida (GOS) yang merupakan turunan oligosakarida. Bahan-bahan tersebut berpotensi untuk mempengaruhi komposisi mikroflora yang ada di tubuh inang (Delgado et al. 2011).
2
METODOLOGI
Materi Uji
Penyediaan Bakteri Probiotik
Bakteri probiotik yang digunakan dalam penelitian ini adalah Bacillus
NP5 yang diisolasi dari saluran pencernaan ikan nila (Putra 2010). Penyediaan bakteri probiotik diawali dengan menumbuhkan bakteri NP5 pada media
Trypticase Soy Agar (TSA) miring yang diinkubasi selama 24 jam dalam inkubator dengan suhu 370C. Bakteri NP5 diberi penanda resistensi terhadap rifampisin (RfR) agar keberadaannya dapat dimonitor pada usus ikan mas. Setelah itu dilakukan kultur bakteri NP5 dalam 10 ml media Trypticase Soy Broth (TSB) yang diinkubasi selama 18 jam di dalam waterbath shaker pada suhu 290C dengan kecepatan 140 rpm. Hasil kultur bakteri NP5 diperoleh nilai Total Plate Count
(TPC) sebesar 1010 CFU mL-1. Selanjutnya, dilakukan pemisahan antara sel bakteri dengan media dengan cara suspensi bakteri dimasukkan sebanyak 1 ml ke dalam tabung mikro dan disentrifugasi dengan kecepatan 6.000 rpm selama lima menit. Supernatan dibuang kemudian padatan sel bakteri ditambah larutan
Phosphate Buffer Saline (PBS) sebanyak 1 ml lalu dihomogenkan dengan vortex. Suspensi bakteri disentrifugasi kembali dengan kecepatan 6.000 rpm selama lima menit. Larutan PBS tersebut dibuang, kemudian padatan sel bakteri ditambah larutan PBS baru sebanyak 1 ml dan dihomogenkan dengan vortex dan suspensi bakteri probiotik dapat dicampurkan ke dalam pakan.
Ekstraksi Oligosakarida/Prebiotik
Prebiotik yang digunakan dalam penelitian ini diekstraksi dari ubi jalar varietas sukuh (Ipomoea batatas L.). Ekstraksi prebiotik dilakukan dengan menggunakan metode ekstraksi etanol 70% sebagai pelarutnya (Muchtadi 1989). Sebanyak 10 g tepung kukus ubi jalar varietas sukuh dilarutkan ke dalam etanol 70% sebanyak 100 ml dan diaduk dengan menggunakan magnetic stirer selama 18 jam pada suhu ruang. Setelah proses ekstraksi selesai kemudian larutan disaring menggunakan vacuum pump dengan kertas saring steril. Filtrat yang diperoleh dipekatkan dengan menggunakan evaporator vacuum pada suhu 400C. Hasil dari pemekatan ekstraksi ubi jalar tersebut selanjutnya diencerkan dengan menggunakan akuades steril hingga mencapai kadar TPT (Total Padatan Terlarut) sebesar 5% (Marlis 2008).
Perhitungan Total Padatan Terlarut
3
terlarut dihitung berdasarkan hasil perbandingan berat ekstrak setelah dikeringkan dengan berat ekstrak sebelum dikeringkan.
Keterangan:
a = berat cawan sebelum diisi ekstrak oligosakarida b = berat cawan setelah diisi ekstrak oligosakarida
c = berat cawan setelah diisi ekstrak oligosakarida dan dioven 24 jam Pengujian secara In Vivo
Persiapan Wadah dan Ikan Uji
Wadah yang digunakan pada penelitian ini adalah akuarium berukuran 80x60x40 cm3 sebanyak 15 buah. Sebelum digunakan, akuarium dicuci dan dikeringkan, kemudian didesinfeksi selama 24 jam dengan klorin 30 ppm dan dibilas hingga bersih. Setiap akuarium diisi air sebanyak 96 liter/akuarium dan diklorin 30 ppm selama 24 jam, kemudian dinetralisir dengan tiosulfat 15 ppm dan diberi aerasi kuat. Bagian luar dinding akuarium ditutup dengan plastik hitam agar ikan tidak mengalami stres. Sumber ikan mas yang digunakan berasal dari petani ikan mas dan berasal dari satu pemijahan, memiliki bobot rata-rata 5,09±0,09 g dan panjang rata-rata 6,87±0,16 cm, dipelihara dengan kepadatan 15 ekor/akuarium. Sebelum diberi perlakuan, ikan diadaptasikan terlebih dahulu terhadap lingkungan selama 7 hari, kemudian ikan dipuasakan selama 1 hari sebelum diberi pakan perlakuan.
Uji In Vivo
Pakan uji yang digunakan pada penelitian ini merupakan pakan komersil dengan kadar protein 33,36%. Selanjutnya pakan ditambahkan probiotik, prebiotik dan sinbiotik dengan dosis sesuai masing-masing perlakuan. Penelitian ini terdiri dari 5 perlakuan dengan masing-masing 3 ulangan, yaitu:
K- : Pemberian pakan kontrol dan diinjeksi dengan PBS (Pophate Buffer Saline)
K+ : Pemberian pakan kontrol dan diinjeksi dengan A. hydrophila
A : Pemberian pakan dengan penambahan probiotik 1% dan diinjeksi dengan A. hydrophila
B : Pemberian pakan dengan penambahan prebiotik 2% dan diinjeksi dengan A. hydrophila
C : Pemberian pakan dengan penambahan sinbiotik dan diinjeksi dengan A. hydrophila
4
menggunakan feeding rate 11% dan feeding frequency tiga kali sehari (8.00, 12.00, 16.00 WIB) selama 30 hari pemeliharaan. Pergantian air dilakukan setiap dua hari sekali sebanyak 50% dan penyiponan dilakukan setiap sore hari. Sampling bobot dilakukan setiap 10 hari. Selain itu juga dilakukan pengukuran suhu setiap hari pada pagi dan sore hari, sedangkan pengukuran DO, pH dan TAN dilakukan pada awal dan akhir pemeliharaan. Sampling bobot ikan dilakukan setiap 10 hari. Pengamatan uji tantang dilakukan selama 14 hari setelah diinjeksi dengan A. hydrophila.
Parameter pengamatan
Tingkat Kelangsungan Hidup (SR)
Kelangsungan hidup ikan diamati setiap hari dari awal hingga akhir perlakuan. Tingkat kelangsungan hidup ikan dihitung pada akhir perlakuan dengan menggunakan rumus (Effendie 1997):
Keterangan :
SR = Tingkat kelangsungan hidup (%) Nt = Jumlah ikan pada akhir perlakuan No = Jumlah ikan pada awal perlakuan Laju Pertumbuhan Harian (LPH)
Laju pertumbuhan harian dihitung menggunakan rumus (Huisman 1987): [ √ ]
Keterangan :
Wt = Bobot rata-rata ikan pada akhir perlakuan (gram) Wo = Bobot rata-rata ikan pada awal perlakuan (gram) t = Lama perlakuan
Konversi Pakan (FCR)
Konversi pakan dihitung dengan menggunakan rumus (Effendie 1997):
Keterangan :
FCR = Konversi pakan
5
Hematologi Ikan
Total Eritrosit
Total eritrosit dihitung berdasarkan Blaxhall dan Daisley (1973) dengan cara sampel darah dihisap dengan pipet bulir merah sampai skala 0,5. Kemudian ditambahkan larutan Hayem’s dengan cara dihisap sampai skala 101 dan campuran tersebut dihomogenkan dengan cara pipet diputar membentuk angka delapan selama 3-5 menit. Setelah itu, dua tetesan pertama dari dalam pipet dibuang dan tetesan selanjutnya dikeluarkan di atas hemasitometer yang sudah ditutup dengan kaca penutup. Selanjutnya dilakukan perhitungan sel darah merah pada 5 kotak besar hemasitometer di bawah miroskop. Total sel darah merah didapatkan berdasarkan rumus:
Σ eritrosit = Σ sel eritosit terhitung x (pengencer/volume)
Total Leukosit
Total leukosit dihitung berdasarkan Blaxhall dan Daisley (1973) dengan cara sampel darah dihisap dengan pipet bulir putih sampai skala 0,5. Kemudian ditambahkan larutan Turk’s dengan cara dihisap sampai skala 11, kemudian campuran tersebut dihomogenkan dengan cara pipet diputar membentuk angka delapan selama 3-5 menit. Setelah itu dua tetesan pertama dari dalam pipet dibuang, dan tetesan selanjutnya dikeluarkan ke atas hemasitometer yang sudah ditutup dengan kaca penutup. Selanjutnya dilakukan perhitungan sel darah putih pada 5 kotak besar hemasitometer di bawah miroskop. Total sel darah putih didapatkan berdasarkan rumus:
Σ leukosit = Σ sel leukosit terhitung x (pengencer/volume) Total bakteri NP5 di usus
Kemampuan bakteri probiotik dalam mendominasi pada saluran pencernaan ditentukan berdasarkan jumlah bakteri NP5 yang ada diusus yang telah diberi penanda rifampisin. Organ usus diambil sebanyak 1 gram kemudian digerus sampai homogen dalam 9 ml larutan PBS. Setelah homogen dengan larutan PBS, diambil sebanyak 0,1 gram kemudian dilakukan pengenceran bertingkat pada 0,9 ml PBS dan disebar dalam cawan petri sebanyak 50µl dan disebar merata menggunakan batang penyebar pada media TSA yang telah ditambahkan rifampisin dengan dua ulangan dan diinkubasi selama 24 jam. Jumlah koloni bakteri Bacillus NP5 dihitung berdasarkan rumus :
TBC =
Keterangan:
TBC = Total Bacterial Count (cfu/ml) K = Jumlah koloni
A = Volume inokulasi dalam media pengencer (ml) B = Pada pengenceran keberapa koloni bakteri dihitung Total bakteri di usus
6
probiotik, prebiotik dan sinbiotik dalam menstimulir pertumbuhan bakteri dalam usus. Cara kerja untuk perhitungan koloni bakteri diusus sama dengan perhitungan koloni bakteri Bacillus NP5 di usus dengan menggunakan media TSA. Kualitas air
Parameter kualitas air yang diukur dalam penelitian meliputi suhu, pH, DO, dan TAN. Satuan dan alat pengukuran dari parameter kualitas air yang diukur disajikan pada Tabel 1.
Tabel 1 Satuan dan alat ukur parameter kualitas air
Parameter Satuan Alat Ukur
Rancangan percobaan berupa rancangan acak lengkap dengan 5 perlakuan dan 3 ulangan. Data dianalisis menggunakan SPSS 18,0 dan dilakukan uji lanjut dengan uji Duncan, sedangkan parameter kualitas air, total bakteri NP5 di usus dan total bakteri usus dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Hasil
Tingkat kelangsungan hidup
Kelangsungan hidup ikan mas selama 30 hari pemeliharaan dengan perlakuan probiotik, prebiotik dan sinbiotik berkisar 97%-100% dan tidak menunjukkan nilai yang berbeda nyata (P>0,05) antar perlakuan. Setelah uji tantang dengan bakteri A. hydrophila, tingkat kelangsungan hidup ikan mas tertinggi diperoleh pada perlakuan C (sinbiotik) dan berbeda nyata (P<0,05) dengan perlakuan K+, A dan B (Gambar 1) dan (Lampiran1).
Keterangan :
* Huruf superscript yang berbeda pada grafik yang sama menunjukkan hasil yang berbeda nyata (P<0,05)
**K- (kontrol negatif), K+ (kontrol positif), A (probiotik 1%), B (prebiotik 2%), C (sinbiotik) Gambar 1 Tingkat kelangsungan hidup ikan mas pada perlakuan kontrol,
7
Laju pertumbukan harian
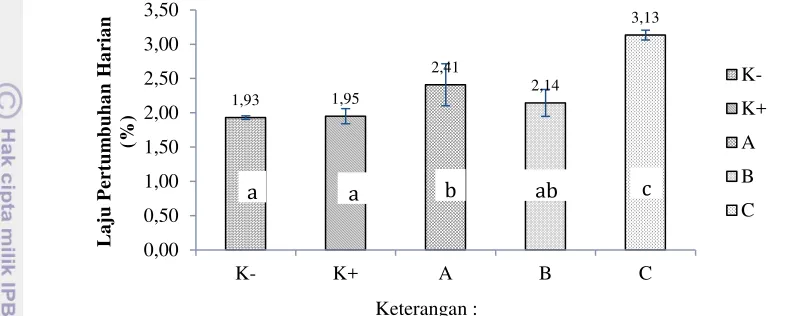
Laju pertumbuhan harian ikan mas selama 30 hari pemeliharaan dengan perlakuan probiotik, prebiotik dan sinbiotik pada perlakuan C sebesar 3,13% memberikan hasil terbaik dan berbeda nyata (P<0,05) dengan perlakuan K-, K+, A dan B (Gambar 2) dan (Lampiran2).
Keterangan :
* Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K- (kontrol negatif), K+ (kontrol positif), A (probiotik 1%), B (prebiotik 2%), C (sinbiotik) Gambar 2 Laju pertumbuhan harian ikan mas pada perlakuan kontrol, probiotik,
prebiotik dan sinbiotik selama 30 hari pemeliharaan Rasio konversi pakan
* Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K- (kontrol negatif), K+ (kontrol positif), A (probiotik 1%), B (prebiotik 2%), C (sinbiotik)
Gambar 3 Rasio konversi pakan ikan mas pada perlakuan kontrol, probiotik, prebiotik dan sinbiotik selama 30 hari pemeliharaan
8
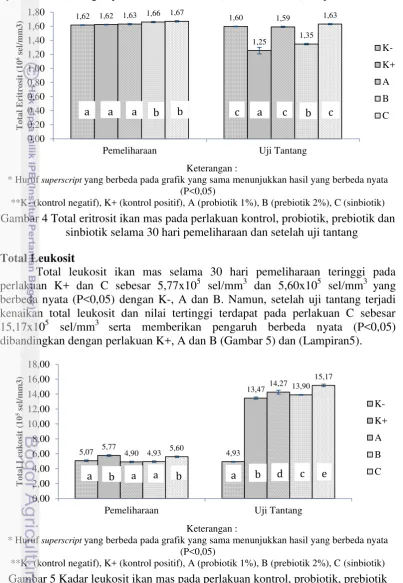
nyata (P<0,05) dengan perlakuan A, K- dan K+. Namun, setelah uji tantang dengan bakteri A. hydrophila, total eritrosit mengalami penurunan dan nilai terendah terdapat pada perlakuan K+ sebesar 1,25x106 sel/mm3 serta berbeda nyata (P<0,05) dengan perlakuan A, B dan C (Gambar 4) dan (Lampiran4).
Keterangan :
* Huruf superscript yang berbeda pada grafik yang sama menunjukkan hasil yang berbeda nyata (P<0,05)
**K- (kontrol negatif), K+ (kontrol positif), A (probiotik 1%), B (prebiotik 2%), C (sinbiotik) Gambar 4 Total eritrosit ikan mas pada perlakuan kontrol, probiotik, prebiotik dan
sinbiotik selama 30 hari pemeliharaan dan setelah uji tantang Total Leukosit
Total leukosit ikan mas selama 30 hari pemeliharaan teringgi pada perlakuan K+ dan C sebesar 5,77x105 sel/mm3 dan 5,60x105 sel/mm3 yang berbeda nyata (P<0,05) dengan K-, A dan B. Namun, setelah uji tantang terjadi kenaikan total leukosit dan nilai tertinggi terdapat pada perlakuan C sebesar 15,17x105 sel/mm3 serta memberikan pengaruh berbeda nyata (P<0,05) dibandingkan dengan perlakuan K+, A dan B (Gambar 5) dan (Lampiran5).
Keterangan :
* Huruf superscript yang berbeda pada grafik yang sama menunjukkan hasil yang berbeda nyata (P<0,05)
**K- (kontrol negatif), K+ (kontrol positif), A (probiotik 1%), B (prebiotik 2%), C (sinbiotik) Gambar 5 Kadar leukosit ikan mas pada perlakuan kontrol, probiotik, prebiotik
9
Total bakteri NP5 di usus
Total bakteri Bacillus NP5 diusus ikan mas setelah 30 hari pemeliharaan menunjukkan perlakuan C memiliki nilai lebih tinggi (1,71x1010 CFU g-1) dibandingkan dengan perlakuan A (1,37x108 CFU g-1) seperti disajikan pada Tabel 2.
Tabel 2 Total bakteri Bacillus NP5 diusus pada ikan mas setelah 30 hari pemeliharaan
Total bakteri usus ikan mas pada awal dan setelah 30 hari perlakuan yang tertinggi terdapat pada perlakuan C (3,23x1011 CFU g-1) dan terendah terdapat pada perlakuan K- (2,41x107 CFU g-1) seperti disajikan pada Tabel 3.
Tabel 3 Total bakteri usus ikan mas pada awal dan setelah 30 hari perlakuan
Perlakuan Total Bakteri Usus (CFU g-1)
Awal Akhir
Kisaran kualitas air selama perlakuan disajikan pada Tabel 4 dibawah ini. Nilai kualitas air yang diperoleh masih dalam kisaran normal untuk pemeliharaan ikan mas.
Tabel 4 Kualitas air ikan mas selama pemeliharaan
10
Pembahasan
Tingkat kelangsungan hidup ikan mas selama pemeliharaan diamati mulai dari perlakuan pemberian probiotik (A), prebiotik (B) dan sinbiotik (C) serta setelah uji tantang dengan bakteri patogen A. hydrophila. Hasil pengamatan menunjukkan bahwa tingkat kelangsungan hidup ikan mas setelah pemeliharaan dengan pemberian bakteri probiotik, prebiotik dan sinbiotik melalui pakan tidak berbeda nyata dengan perlakuan kontrol (P>0,05). Namun, setelah uji tantang dengan bakteri patogen A. hydrophila, terjadi kematian yang tinggi pada perlakuan K+. Perlakuan C (sinbiotik) memberikan nilai kelangsungan hidup yang lebih tinggi dibandingkan perlakuan lainnya sebesar 100%. Selanjutnya berturut-turut pada perlakuan A sebesar 87,50%, perlakuan B sebesar 75,00% dan perlakuan K+ sebesar 45,83%. Berdasarkan uji statistik, kelangsungan hidup perlakuan A, B dan C memberikan pengaruh berbeda nyata dengan perlakuan K+ (P<0,05) (Lampiran 1). Kelangsungan hidup yang tinggi pada perlakuan C (sinbiotik) diduga karena adanya penambahan probiotik NP5 dan prebiotik yang dapat meningkatkan respon imun untuk melawan patogen yang masuk kedalam tubuh sehingga dapat meningkatkan kelangsungan hidup ikan mas. Hal ini sesuai dengan pernyataan Zhou et al. (2009) yang menyatakan bahwa probiotik dalam akuakultur dapat bermanfaat dalam memperbaiki kualitas air, memperbaiki nutrisi inang dengan menghasilkan enzim-enzim pencernaan, mencegah serangan penyakit, meningkatkan kelangsungan hidup serta dapat meningkatkan respon imun ikan. Pada perlakuan A, probiotik diduga berperan secara tidak langsung dalam mereduksi serangan patogen. Probiotik bekerja dengan memperbaiki komposisi mikroflora normal di dalam saluran pencernaan sehingga akan menstimulir perbaikan respon imun ikan terhadap serangan patogen. Hal ini sesuai dengan pernyataan Irianto (2003) yang menjelaskan bahwa mikroflora normal pada saluran pencernaan memiliki fungsi perlindungan yang penting untuk menekan bakteri patogen dan virus, menstimulir daya tahan serta merubah aktivitas metabolik usus. Selain itu, mikroflora normal juga dapat menekan bakteri patogen karena terjadinya kompetisi dalam nutrisi dan tempat pelekatan pada usus. Sedangkan pada perlakuan B, prebiotik diduga dapat memberikan peran dalam menstimulus sistem imun, serta menghambat patogen masuk ke dalam tubuh sehingga dapat meningkatkan kelangsungan hidup. Hal ini sesuai dengan penelitian Tanbiyaskur (2011) bahwa penambahan prebiotik yang diekstraksi dari ubi jalar varietas sukuh dapat memberikan kelangsungan hidup yang lebih baik pada ikan nila pasca diinfeksi S. agalactiae.
11
meningkatkan kesehatan inang (Gibson 2004; Manning et al. 2004). Rasio konversi pakanadalah suatu ukuran yang menyatakan rasio jumlah pakan yang dibutuhkan untuk menghasilkan 1 kg daging ikan (Effendi 2004). Rasio konversi pakan terendah terdapat pada perlakuan C sebesar 1,29 dan berbeda nyata (P<0,05) terhadap perlakuan A, B, K+ dan K- (Lampiran 3). Nilai FCR yang rendah dikarenakan pakan yang dimakan oleh ikan dapat dimanfaatkan dengan baik sehingga nutrien pakan dapat diserap tubuh dan dapat meningkatkan pertumbuhan. Hal ini diduga bahwa penambahan sinbiotik dalam pakan mampu meningkatkan kinerja pencernaan ikan dalam memanfaatkan pakan secara optimal. Peningkatan kinerja dalam pencernaan ikan ini terjadi karena jumlah bakteri yang menguntungkan dalam pencernaan meningkat karena kombinasi dari probiotik dan prebiotik. Menurut Zhang et al. (2010), pertumbuhan organisme akuatik yang diberi pakan dengan probiotik dapat meningkat karena adanya peningkatan enzim dalam saluran pencernaan, seperti aktivitas enzim (protease dan amilase) yang dapat meningkatkan kecernaan pakan.
Darah merupakan cairan yang dialirkan melalui saluran vaskuler, membawa bahan-bahan penting untuk kehidupan seluruh sel dalam tubuh dan menampung buangan hasil metabolisme untuk diangkut ke organ ekskresi (Dellman dan Brown 1989). Perubahan gambaran darah dapat menentukan kondisi ikan atau status kesehatannya (Wedemeyer et al. 1990). Beberapa parameter yang dapat memperlihatkan perubahan kondisi tubuh pada darah yaitu total eritrosit dan total leukosit. Eritrosit ikan umumnya berbentuk bulat atau oval dan memiliki inti terletak dibagian tengah serta terlihat jernih kebiruan dengan pewarnaan giemsa (Chinabut et al. 1991). Berdasarkan hasil penelitian, total eritrosit ikan mas setelah pemeliharaan dengan pemberian bakteri probiotik, prebiotik dan sinbiotik dalam pakan tertinggi pada perlakuan C sebesar 1,67±0,01 (106sel/mm3) dan B sebesar 1,66±0,01 (106sel/mm3), berbeda nyata (P<0,05) dengan perlakuan A, K+ dan K- masing-masing sebesar 1,63±0,01 (106sel/mm3), 1,62±0,01 (106sel/mm3) selama pemberian probiotik, prebiotik dan sinbiotik masih dalam kisaran normal. Sedangkan, penurunan total eritrosit setelah uji tantang diduga terjadi karena adanya kerusakan pada ginjal akibat infeksi A. hidrophila. Menurut Nabib dan Pasaribu (1989) rusaknya ginjal dapat menyebabkan kemampuan ikan memproduksi eritrosit menurun. Selain itu, bakteri A. hidrophila merupakan bakteri yang dapat menghasilkan enzim hemolisin sehingga dapat melisis eritrosit inangnya. Hal ini dijelaskan oleh Cipriano (2001) bahwa faktor virulensi bakteri ini adalah enterotoksin dan hemolisin.
12
(105sel/mm3) dan 13,90±0,06 (105sel/mm3) serta memberikan pengaruh yang berbeda nyata (P<0,05) dibandingkan dengan K+ sebesar 13,47±0,15 (105sel/mm3) (Lampiran 5). Sakai et al. (1995) menyatakan peningkatan jumlah leukosit dapat terjadi sebagai akibat meningkatnya aktivitas pembelahan sel. Pemicu peningkatan aktivitas pembelahan sel ini dapat disebabkan karena terjadinya infeksi bakteri patogen. Infeksi bakteri A. hydrophila menyebabkan ikan mengirimkan leukosit dalam jumlah yang lebih banyak ke areal infeksi sebagai upaya pertahanan tubuh terhadap serangan bakteri. Sel-sel leukosit tersebut bekerja sebagai sel yang memfagosit bakteri agar tidak berkembang serta menyebarkan faktor virulensinya di dalam tubuh inang. Hal inilah yang menyebabkan sering ditemukan jumlah total leukosit meningkat setelah infeksi bakteri patogen.
Keberhasilan pemberian probiotik terlihat pada populasi bakteri didalam saluran pencernaan ikan mas yang digambarkan dengan total bakteri di usus (Tabel 3). Total bakteri usus setelah pemeliharaan tertinggi terdapat pada perlakuan C sebesar 3,23x1011 CFU g-1. Total Bacillus NP5 yang terdapat pada perlakuan C juga menghasilkan nilai yang lebih tinggi yaitu sebesar 1,71x1010 CFU g-1 (Tabel 2). Nilai total bakteri usus ini ditemukan juga pada ikan mas sebesar 1,0±4,5x1011 CFU g-1 (Uddin et al. 2012). Hal ini diduga bahwa probiotik mampu berkompetisi dengan bakteri lainnya serta dapat mendominasi di dalam saluran pencernaan. Jumlah bakteri usus ikan mas yang diperoleh pada perlakuan probiotik, prebiotik, dan sinbiotik diduga menjadikan perubahan fisiologis dan biologis dalam gastrointestinal serta perubahan morfologi epitel usus. Menurut Merrifield et al. (2010), banyaknya mikrofili dan tingkat kepadatannya yang tinggi serta luas penyerapan area pencernaan juga berpengaruh dalam meningkatkan efisiensi pencernaan yang ada dalam tubuh. Dari hasil penelitian menunjukkan bahwa bakteri probiotik mampu memanfaatkan prebiotik dengan baik untuk menstimulir pertumbuhannya di dalam usus ikan. Berdasarkan penelitian Putra (2010) menunjukkan bahwa uji secara in vitro ekstrak oligosakarida sebagai prebiotik, mampu menstimulir pertumbuhan bakteri probiotik NP5 yang diperoleh dari saluran pencernaan ikan nila. Sedangkan, prebiotik di dalam usus akan difermentasi oleh bakteri probiotik. Hasil dari proses fermentasi ini adalah Short Chain Fatty Acid (SCFA) berupa asam laktat, asam asetat, propionat dan butirat (Merrifield et al. 2010).
Kualitas air berkaitan dengan komoditas perikanan yang dibudidayakan. Parameter kualitas air yang diamati meliputi suhu, pH, DO dan TAN. Parameter kualitas air selama perlakuan berada pada kisaran normal untuk pemeliharaan ikan mas (Effendi 2003 dan SNI 2013).
KESIMPULAN DAN SARAN
Kesimpulan
13
pasca uji tantang 100%, laju pertumbuhan harian 3,13%, konversi pakan 1,29 dan respon imun yang lebih baik dibandingkan kontrol setelah diinfeksi A. hydrophila.
Saran
Perlu dilakukan penelitian lanjutan dalam aplikasi sinbiotik skala semi lapang dan lapangan untuk kinerja produksi ikan mas.
DAFTAR PUSTAKA
Ai Q, Xu H, Mai KS, Xu W, Wang J, Zhang WB. 2011. Effect of dietary supplementation of Bacillus subtilis and fructooligosaccharide on growth performance, survival, non-specific immune response and disease resistance of juvenile large yellow croaker, Larimichthys crocea.
Aquaculture 317: 155-161.
Apriyantono, A., Fardiaz, D., Puspitasari, N.L., Sedarnawati, Budiyanti. 1989. Petunjuk laboratorium pengujian pangan. IPB Press, Bogor.
Blaxhall, P.C. and Daisley, K.W., 1973. Routine haematological methods for use with fish blood. Journal of Fish Biology 5: 577-581.
Chinabut S, Limsuwan C, Sawat PK. 1991. Histology of the walking catfish Clarias batrachus. Department of Fisheries: Thailand.
Cipriano, RG. 2001. Aeromonas hydrophila and motile aeromonad septicemia of Fish. Fish Disease leaflet of the US fish and wildlife sevice. US Department of the Interion. 68:1-24.
Daniels, CL, Merrifield DL, Boothoryd DP, Davies SJ, Factor JR, Arnold KE. 2010. Effect of dietary Bacillus spp. And mannan oligosaccharides (MOS) on European lobster (Homarus gammarus L) larvae growth performance, gut morphology and gut microbiota. Aquaculture 304: 49-57.
Delgado, GTC., Tamashiro, WMSC., Junior, MRM., Moreno, YMF., Pastore, GM. 2011. The putative effect of prebiotics as immunomodulatory agents. Food Research International. 44: 3167-3173.
Dellman, HD., Brown, EM. 1989. Buku Teks Histologi Veteriner. Hartono, penerjemah. Jakarta (ID): UI Pr. Terjemahan dari: Textbook of Veteriner Histology.
Effendie, M.I. 1997. Biologi perikanan. Yayasan Pustaka Nusantara.
Effendi, H. 2003. Telaah Kualitas Air: Bagi Pengelolaan Sumber Daya dan Lingkungan Perairan. Jakarta (ID): Kanisius.
Effendi, I. 2004. Pengantar akuakultur. Penebar Swadaya, Depok.
Fujaya, Y. 2004. Fisiologi Ikan: Dasar Pengembangan Teknologi Perikanan. Jakarta (ID): Rineka Cipta.
Fuller R. 1989. Probiotic in man and animals. J of Applied Bacteriology [review]. United Kingdom (GB): Institut of Food Research. 66: 365-378.
Gibson, GR. 2004. Fibre and effects on probiotics (diet prebiotic concept).
14
Huisman, E.A., 1987. Principles of fish production. Department of Fish Culture and Fisheries, Wageningen Agriculture University. Wageningen. Netherland.170p.
Irianto, A. 2003. Probiotik Akuakultur. Gadjah Mada University Press, Yogyakarta.
[KKP] Kementrian Kelautan dan Perikanan. 2013. Statistika Menakar Target Ikan Air Tawar. [Internet]. [Diacu 2014 Mei 16]. Tersedia pada :http//www.djpb.kkp.go.id/berita.php?id=847.
Lagler KF, Bardach JE, Miller RR, Pasino DRM. 1997. Ichthyology. John Willey and Sons Inc. New York. 295 ps.
Lewis K. 2001. Riddle of biofilm resistance. Antimicrob Agents Chemother. 45:999-1007.
Li JQ, Tan BP, Mai KS. 2009. Dietary probiotic Bacillus OJ and isomaltooligosaccharides influence the intestine microbial populations, immune responses and resistance to white spot syndrome virus in shrimp (Litopenaeus vannamei). Aquaculture 291: 35–40.
Lin S, Mao S, Guan Y, Luo Lin, Luo Li, Pan Y. 2012. Effect of dietary chitosan oligosaccharides and Bacillus coagulans on the growth, innate immunity and resistence of koi (Cyprinus carpio koi).Aquaculture 342-343: 36-41. Manning TS, Rastall R, Gibson G. 2004. Prebiotics and lactic acid bacteria. Di
dalam: Salminen S, Wright A dan Ouwehand A, editor. Lactic Acid Bacteria Microbiological and Functional Aspects 3: 2004; New York. Marcel Dekker, Inc.hlm 407-418.
Marlis, A. 2008. Isolasi oligosakarida ubi jalar Ipomea batata L. dan pengaruh pengolahan terhadap potensi prebiotiknya. [Tesis]. Program Pascasarjana, Institut Pertanian Bogor. Bogor.
Mazurkiewicz J, Przybyl A, Golski J. 2008. Usability of fermacto prebiotic in feeds for common carp (Cyprinus carpio L.) fry. Nauka Przyr. Technol. 2(3):1-9.
Merrifield DL et al. 2010. The current status and future focus of probiotic and prebiotic applications for salmonids. J. Aquaculture 302 : 1-18.
Mahious, A.S., Getesoupe, F.J., Hervi, M., Metailler, R., Ollevier, F. 2006. Effect of dietary inulin and oligosaccharides as prebiotics for weaning turbot,
Psetta maxima (Linnaeus, C.1758). Journal of Aquaculture International 14 (3): 219-229.
Muchtadi, D., 1989. Evaluasi nilai gizi pangan. Depdikbud, Dirjen Dikti. PAU IPB.
Nabib R, Pasaribu FH. 1989. Patologi dan Penyakit Ikan. Bogor (ID): IPB Pr. Nayak SK. 2010. Probiotics and immunity: A fish perspective. J. Fish & shellfish
Immunology. 29 : 2-14.
Putra, A.N. 2010. Aplikasi probiotik, prebiotik dan sinbiotik untuk meningkatkan kinerja pertumbuhan ikan nila Oreochromis niloticus. [Tesis]. Program Pascasarjana, Institut Pertanian Bogor. Bogor.
Ringo E, Olsen RE, Gifstad TO, Dalmo RA, Amlund H, Hemre GI. 2010. Prebiotics in aquaculture: a review. Aquaculture Nutrition.16(2):117-136. Sakai M, Atsuta, S, Kobayashi M. 1995. The activation of leucocytes in Rainbow
15
disease in Asian aquaculture.25-29thOctober 1993.Manila Fisheries Society.hlm 427-432.
Schrezenmeir, J., Vrese, M., 2001. Probiotics, prebiotics and synbiotic-approaching a definition. Clinical Nutrition Journal, 361-364.
SNI [Standar Nasional Indonesia]. 2013. Pembesaran ikan mas (Cyprinus carpioL) strain majalaya di karamba jaring apung (KJA). Badan Standarisasi Nasional.
Takashima F, Hibiya T. 1995. An Atlas of Fish Histology : Normal and Pathological Features. Tokyo: Kodansa LTD. pp 195.
Tanbiyaskur, 2011.Efektivitas pemberian probiotik, prebiotik dan sinbiotik melalui pakan untuk pengendalian infeksi Streptococcus agalactiae pada ikan nila (Oreochromis niloticus).[Tesis]. Sekolah Pascasarjana, Institut Pertanian Bogor. Bogor.
Verschuere, L., Rombaut G., Sorgeloos P.,Verstraete W. 2000. Probiotic bacteria as biological control agents in aquaculture. Journal of Microbiology and Molecular Biology Reviews 64: 655-671.
Wang, B.Y. 2007. Effect of probiotics on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei. Journal of Aquaculture 269: 259-264.
Wedemeyer GA, Barton BA, Mc Leay DJ. 1990. Stress and acclimation. Di dalam: Schreck CB, Moyle PB, editor. Methods for fish biology. Bethesda. USA: American Fisheries Society. hlm:45-477.
Zhang Qin, Ma H, Mai K, Zhang W, Liufu Z, Xu W. 2010. Interaction of dietary
Bacillus subtilis and fructooligosaccharide on the growth performance, non-specific immunity of se cucumber, Apostichopus japonicas. Fish and Shellfish Immunology. 29: 204-211.
16
LAMPIRAN
Lampiran 1 Data statistik uji lanjut Duncan tingkat kelangsung hidup ikan mas selama 30 hari pemeliharaan dan setelah uji tantang
Tingkat kelangsungan hidup selama 30 hari pemeliharaan
Duncana ULANGAN
N
Subset for alpha = 0.05
1
dimension1
1.00 3 97.7767
2.00 3 97.7767
3.00 3 100.0000
4.00 3 100.0000
5.00 3 100.0000
Sig. .326
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
Tingkat kelangsungan hidup setelah uji tantang
Duncana ULANGAN
N
Subset for alpha = 0.05
1 2 3 4
dimension1
2.00 3 45.8333
4.00 3 75.0000
3.00 3 87.5000
1.00 3 100.0000
5.00 3 100.0000
Sig. 1.000 1.000 1.000 1.000
17
Lampiran 2 Data statistik uji lanjut Duncan laju pertumbuhan harian ikan mas selama 30 hari pemeliharaan
Laju pertumbuhan harian ikan mas selama 30 hari pemeliharaan
Duncana ULANGAN
N
Subset for alpha = 0.05
1 2 3
1.00 3 1.9296
2.00 3 1.9494
4.00 3 2.1430 2.1430
3.00 3 2.4078
5.00 3 3.1331
Sig. .180 .091 1.000
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3.000.
Lampiran 3 Data statistik uji lanjut Duncan rasio konversi pakan ikan mas selama 30 hari pemeliharaan
Rasio konversi pakan ikan mas selama 30 hari pemeliharaan
Duncana ULANGAN
N
Subset for alpha = 0.05
1 2
5.00 3 1.2867
3.00 3 1.6767
1.00 3 1.6967
4.00 3 1.6967
2.00 3 1.7233
Sig. 1.000 .752
Means for groups in homogeneous subsets are displayed.
18
Lampiran 4 Data statistik uji lanjut Duncan total eritrosit ikan mas selama 30 hari pemeliharaan dan setelah uji tantang
Total eritrosit ikan mas selama 30 hari pemeliharaan
Duncana
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
Total eritrosit ikan mas setelah uji tantang
Duncana
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3.000.
Lampiran 5 Data statistik uji lanjut Duncan total leukosit ikan mas selama 30 hari pemeliharaan dan setelah uji tantang
Total leukosit ikan mas selama 30 hari pemeliharaan
Duncana
19
Total leukosit ikan mas setelah uji tantang
Duncana ULANGAN
N
Subset for alpha = 0.05
1 2 3 4 5
1.00 3 4.9333
2.00 3 13.4667
4.00 3 13.9000
3.00 3 14.2667
5.00 3 15.1667
Sig. 1.000 1.000 1.000 1.000 1.000
20
RIWAYAT HIDUP
Penulis dilahirkan di Purwodadi pada tanggal 10 November 1992 dari ayah Sugeng Sutrisno dan ibu Mardiah H. Latif. Penulis adalah anak pertama dari tiga bersaudara. Tahun 1998 penulis lulus dari TK Bambu Kuning, Tahun 2004 penulis lulus dari SDN Bambu Kuning, Tahun 2007 penulis lulus dari SMPN 1 Cibinong, Tahun 2010 penulis lulus dari SMK Negeri 1 Bima dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) dan diterima di Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Pada tahun 2009 penulis pernah mengikuti magang di tambak udang vaname, Lamere, Bima, NTB. Pada tahun 2013 penulis melaksanakan Praktik Lapangan Akuakultur di tambak udang vaname Pinang Gading, Bakauheni, Lampung. Penulis juga menjadi asisten praktikum Dasar-dasar Mikrobiologi Akuatik pada tahun ajaran 2012/2013, asisten praktikum Manajemen Kesehatan Organisme Akuatik tahun ajaran 2013/2014 serta aktif dalam Organisasi Mahasiswa Daerah (OMDA) kota Bima, NTB. Tugas akhir dalam pendidikan tinggi diselesaikan dengan menulis skripsi yang berjudul “Aplikasi Probiotik, Prebiotik dan Sinbiotik Melalui Pakan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Mas