TOKSISITAS NIKLOSAMIDA TERHADAP PERTUMBUHAN,
KONDISI HEMATOLOGI DAN HISTOPATOLOGI
JUVENIL IKAN MAS (Cyprinus carpio)
YOSMANIAR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
IPB
2009
YO
SMANI
A
R
C1510
6023
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul: Toksisitas niklosamida Terhadap Pertumbuhan, Kondisi Hematologi dan Histopatologi Juvenil Ikan Mas (Cyprinus carpio) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dandicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2009
ABSTRACT
YOSMANIAR. Toxicity of Niclosamide on the Growth, Hematology and Histophatologi Conditions of juvenile Common Carp (Cyprinus carpio). Under direction of EDDY SUPRIYONO, KUKUH NIRMALA, and SUKENDA
Niclosamide as pesticide extensively used for eliminating golden apple snail (Pomacea sp) in paddy field. This study aimed to determine effect of accute and sublethal niclosamide toxicity on the growth, hematology and histopathology conditions of common carp (Cyprinus carpio) juvenil. This research was conducted at Research Station for Enviroment and Toxicology Cibalagung, Bogor. Parameter observed was the mortality of juvenile and water quality. Preliminary research was performed by finding concentration range, lethal time, accute toxicity to take LC50 of 24; 48; 72; dan 96 hours. Data obtained was analyzed using LC50 probit analysis program. Sublethal toxicity of niclosamide used sixteen glass aquaria of 70 x 50 x 60 cm in size at 40 L water volume were used in this experiment completed with aeration system and stocked with 20 juvenil per each. The test fish were satiation fed during the treatment. By using completely experimental randomized design with four treatments and four replications of different nilosamide concentrations: 0.00; 0.01; 0.03; 0.05 mg/L for 12 weeks. Specific growth rate measured and tissue sample were collected (gill, liver, kidney) fourth; eightth and twelfth weeks of exposure time. Blood sample were collected at the beginning; fourth; eighth and twelfth weeks of exposure time. Result of the experiments indicated that the accute toxicity (LC 50) of niclosamide of juvenile common carp (Cyprinus carpio) were on follows: 24 ; 48; 72; and 96 hours wich are 0.195 (0.174 – 0.220); 0.152 (0.137 – 0.169); 0.117 (0.106 – 0.128); dan 0.099 (0.094 – 0.104) mg/L. The niclosamide is extremely toxic (classification A). The research resulted that sublethal concentration of 0.03 mg/L niclosamide significantly effected (P< 0.05) to decreasing specific growth rate (0.62 %). The sublethal concentration in 0.01mg/l increasing of hematocrit and hemoglobin while in concentration of niclosamide 0.03 mg/l to increasing erythrocyte cells and decreasing leucocyte cells. On the sublethal concentration of 0,01 mg/L niclosamide the gill, liver and kidney juvenile of common carp (Cyprinus carpio) show hyperplasia, haemorage and necrosis
Keywords: Toxicity, niclosamide, growth, hematology, histopathology, common carp
RINGKASAN
YOSMANIAR. Toksisitas Niklosamida Terhadap Pertumbuhan, Kondisi Hematologi dan Histopatologi Juvenil Ikan Mas (CyprinuCarpio). Dibimbing oleh EDDY SUPRIYONO, KUKUH NIRMALA dan SUKENDA
Penggunaan pestisida dalam bidang pertanian (sawah) yang semakin meningkat telah menimbulkan dampak negatif bagi menurunnya kualitas lingkungan perairan, karena pada umumnya sebagai tempat pembuangan limbah cair pertanian yang masih mengandung residu pestisida. Akibat kegiatan tersebut maka lingkungan perairan tawar yang merupakan sumber air untuk kegiatan budidaya perikanan berpotensi tercemar oleh berbagai bahan aktif yang terkandung dalam formulasi pestisida.
Keong mas merupakan hama yang dalam aktifitasnya memotong pangkal batang padi yang masih muda. Pengendalian secara kimia yang umum dilakukan petani Indonesia yaitu dengan menggunakan pestisida jenis moluskisida dengan bahan aktif niklosamida. Moluskisida niklosamida digunakan untuk membunuh hama keong mas tapi juga memiliki potensi untuk membunuh ikan, dimana di beberapa negara di Asia penggunaannya sudah dilarang karena berdampak negatif terhadap lingkungan akuatik . Salah satu jenis ikan air tawar yang berpotensi tecemar adalah ikan mas (Cyprinus carpio) karena biasanya dibudidayakan di kolam, karamba, karamba jaring apung dan sawah.
Tujuan penelitian ini adalah untuk mengetahui pengaruh toksisitas akut dan subletal moluskisida niklosamida terhadap kondisi pertumbuhan, hematologi dan histopatologi juvenil ikan mas (Cyprinus carpio). Penelitian dilakukan dalam 4 tahap yang meliputi: uji ambang batas, uji waktu letal, toksisitas akut dan toksisitas subletal terhadap pertumbuhan, kondisi hematologi (kadar hematokrit, kadar hemoglobin, jumlah eritrosit dan jumlah leukosit) dan histopatologi (insang, hati dan ginjal). Penelitian dilakukan selama 6 bulan di Instalasi Riset Lingkungan Perikanan Budidaya dan Toksikologi Cibalagung Bogor, menggunakan wadah akuarium kaca.
Bahan uji yang digunakan adalah formulasi moluskisida dengan bahan aktif niklosamida (C13H8Cl2N2O4 ) yang berbentuk pekatan dan bewarna kuning kecoklatan. Hewan uji adalah juvenil ikan mas (CyprinuCarpio) dengan 2,92 ± 0,02 g/ekor. Sebelum digunakan ikan diadaptasi selama 12 hari di laboratorium, ikan diberi pakan pelet komersial dengan kandungan protein ± 40%
Pada uji subletal niklosamida diaplikasikan 3 konsentrasi moluskisida niklosamida sebesar 10, 30, 50% dari nilai LC50-96 jam dengan nilai konsentrasi, yaitu: 0,00 (kontrol); 0,01; 0,03; dan 0,05 mg/L dalam air. Ikan mas dipelihara dengan kepadatan 20 ekor dalam volume air 40 L. Selama pemaparan ikan uji diberi pakan secara at satiation serta dilakukan pergantian air setiap 48 jam dengan konsentrasi bahan uji yang sama. Pengambilan sampel darah untuk hematologi, adalah: minggu ke 0 (satu jam setelah aplikasi), minggu ke 4, minggu ke 8 dan mingu ke 12. Pengukuran bobot ikan dan pengambilan sampel untuk histologi dilakukan pada minggu ke 4; minggu ke 8 dan minggu ke 12. Lama penelitian 12 minggu. Peubah yang diukur adalah; Laju pertumbuhan, kondisi hematologi dan histopatologi. Untuk mengetahui kelayakan media pemeliharaan dilakukan pengukuran sifat fisika-kimia air meliputi: pH, O2 terlarut, CO2 dan ammonia.
Data uji ambang batas dan uji waktu letal dianalisa secara deskriptif, selanjutnya untuk data uji toksisitas akut dianalisis dengan program “probit analysis”. Data yang diperoleh dari uji toksisitas subletal menggunakan rancangan acak lengkap (RAL), analisa data pengaruh perlakuan terhadap pertumbuhan dan hematologi menggunakan anova yang dilanjutkan dengan uji Tukey apabila berbeda nyata. Pengolahan data menggunakan program SPSS versi 13.
Analisis data uji toksisitas subletal yaitu pertumbuhan, hematologi, pengukuran kadar hematokrit dengan menempatkan darah pada tabung mikrohematokrit dan disentrifus. Pengukuran kadar hemoglobin dengan metoda Sahli. Penghitungan jumlah eritrosit dan leukosit mengunakan hemositometer dan mikroskop. Untuk data histopatologi dianalisis secara deskriptif.
Hasil penelitian menunjukkan bahwa Nilai konsentrasi ambang bawah moluskisida niklosamida (LC0-48 jam) sebesar 0,06 mg/L dan nilai ambang atas (L100-24 jam) sebesar 0,25 mg/l. Nilai waktu letal moluskisida niklosamida di dalam air yaitu selama 48 jam pada konsentrasi 0,25 mg/L. Nilai LC 50- 24 ; 48; 72; dan 96 jam moluskisida niklosamida terhadap ikan mas adalah 0,195 (0,174 – 0,220); 0,152 (0,137 – 0,169); 0,117 (0,106 – 0,128); dan 0,099 (0,094 – 0,104) mg/L. Niklosamida kategori pestisida sangat berbahaya (golongan A).
Konsentrasi subletal moluskisida niklosamida berpengaruh nyata terhadap kondisi hematologi, yaitu peningkatan hematokrit dan hemoglobin pada konsentrasi 0.01 mg/L dan peningkatan jumlah eritrosit pada konsentrasi 0,03 mg/L, dan penurunan leukosit pada konsentrasi 0.03 mg/L.Tingkat konsentrasi subletal molukisida niklosamida mengakibatkan kerusakan pada insang, hati dan ginjal pada konsentrasi 0,01 mg/L.Konsentrasi subletal moluskisida niklosamida berpengaruh nyata terhadap penurunan pertumbuhan terjadi mulai pada konsentrasi 0,03 mg/L .
© Hak Cipta milik IPB, tahun 2009
Hak Cipta di lindungi Undang-undang
TOKSISITAS NIKLOSAMIDA TERHADAP PERTUMBUHAN,
KONDISI HEMATOLOGI DAN HISTOPATOLOGI
JUVENIL IKAN MAS (Cyprinus Carpio)
YOSMANIAR
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sain pada
Program Studi Ilmu Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Toksisitas Niklosamida Terhadap Pertumbuhan, Kondisi Hematologi dan Histopatologi Juvenil Ikan Mas (Cyprinus carpio)
Nama : Yosmaniar NRP : C 151060231
Disetujui Komisi Pembimbing
Dr. Ir. Eddy Supriyono, MSc Ketua
Dr. Ir. Kukuh Nirmala, MSc Dr. Ir. Sukenda, MSc Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
PRAKATA
Alhamdulillahi Rabbill´aalamin. Puji dan syukur kehadirat Allah SWT, yang telah memberikan rahmat dan hidayah- Nya sehingga penulis dapat menyelesaikan. tesis ini. Tesis dengan judul “Toksisitas Niklosamida Terhadap Pertumbuhan, Kondisi Hematologi dan Histopatologi Juvenil Ikan Mas (Cyprinus carpio)” disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada program Studi Ilmu Perairan Pascasarjana Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir.Eddy Supriyono, MSc sebagai Ketua Komisi Pembimbing, Bapak Dr. Ir. Kukuh Nirmala, MSc dan Bapak Dr. Ir.Sukenda, MSc sebagai Anggota Komisi Pembimbing, yang telah meluangkan waktu dan pemikiran untuk mengarahkan dan membimbing penulis, serta Bapak Dr. Tatag Budiardi sebagai Penguji Luar Komisi Pembimbing yang telah memberikan masukan dan saran. Ucapan terima kasih penulis ucapkan kepada Bapak Drs. Sutrisno, Bapak Ir. Imam Taufik, MSi, teknisi dan laboran serta teman - teman dari Program Studi Air yang telah membantu penulis.
Bogor, Februari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Pekanbaru pada tanggal 14 Oktober 1964 dari ayah B. K Rusli dan ibu Baidar. Penulis merupakan putri ke dua dari lima bersaudara. Pendidikan formal yang diselesaikan SD Seruni, SMP Negeri 4 dan SMA Negeri 4 di Pekanbaru. Pendidikan Strata satu di Fakultas Perikanan Universitas Bung Hatta Padang dan lulus tahun 1988.
DAFTAR ISI
Halaman
DAFTAR TABEL... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN... viii
PENDAHULUAN Latar Belakang ... 1
Pendekatan masalah ... 3
Tujuan dan Manfaat Penelitian ... 3
Hipotesis ... 4
TINJAUAN PUSTAKA Pestisida ... 5
Pestisida Dalam Lingkungan Perairan ... 6
Niklosamida ... 7
Toksisitas Subletal Niklosamida Terhadap Pertumbuhan... 14
Toksisitas Subletal Niklosamida Terhadap Hematologi ... 15
Toksisitas Subletal Niklosamida Terhadap Histopatologi ... 17
Toksisitas Subletal
Pertumbuhan Ikan ... 23
Kondisi Hematologi ... 25
Kondisi Histopatologi ... 29
Kualitas Air ... 31
Pembahasan... 32
KESIMPULAN DAN SARAN... 41
DAFTAR PUSTAKA ... 42
DAFTAR TABEL
Halaman
1. Klasifikasi pestisida berdasarkan toksisitasnya terhadap ikan... 7
2. Data mortalitas (%) ikan mas pada uji ambang batas konsentrasi
niklosamida……… ………… ... 20
3. Nilai LC 50 moluskisida niklosamida terhadap ikan mas setiap
waktu Pemaparan ... 22
4. Pertumbuhan ikan mas pada berbagai konsentrasi subletal
moluskisida niklosamida setelah 12 minggu pemaparan ... 23
5. Rata-rata hematokrit, hemoglobin, eritrosit dan leukosit Ikan mas
setelah 12 minggu ... 25
6. Kondisi Histopatologi insang, hati, dan ginjal juvenil ikan mas yang
terpapar moluskisida niklosamida setelah 12 minggu ... 29
7. Kisaran sifat fisika-kimia air pada uji toksisitas letal dan subletal
DAFTAR GAMBAR
Halaman
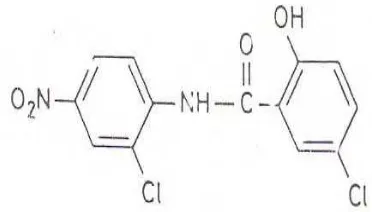
1. Rumus bangun Niklosamida ... 7
2. Mortalitas (%) ikan mas pada uji waktu letal untuk konsentrasi
0,25 mg/L (LC100-24 jam) ... 21
3. Nilai LC 50 moluskisida niklosamida terhadap ikan mas pada
setiap waktu pemaparan ... 22
4. Pertambahan bobot rata-rata ikan mas selama 12 minggu
pemaparan moluskisida niklosamida ... 24
5. Laju pertumbuhan spesifik mas selama 12 minggupemaparan
moluskisida niklosamida... 24
6. Kader hematokrit juvenil ikan mas yang terpapar
moluskisida niklosamida selama 12 minggu ... 26
7. Kadar hemoglobin juvenil ikan mas yang terpapar moluskisida
niklosamida selama 12 minggu... 26
8. Jumlah eritrosit juvenil ikan mas yang terpapar moluskisida
niklosamida selama 12 minggu Rata-rata hematokrit... 27
9. Jumlah leukosit juvenil ikan mas yang terpapar moluskisida
niklosamida selama 12 minggu Rata-rata hematokrit... 28
10. Kondisi histopatologi insang juvenil ikan mas yang terpapar
moluskisida niklosamida selama 12 Minggu ... 30
11. Kondisi histopatologi hati dan ginjal juvenil ikan mas yang terpapar
DAFTAR LAMPIRAN
Halaman
1. Kelangsungan hidup (%) ikan mas pada uji toksisitas letal
(jam) ... 47
2. Analisa probit (Wallace, 1982) untuk menentukan LC50-24 jam moluskisida niklosamida terhadap ikan
Mas... 48
3. Analisa probit (Wallace, 1982) untuk menentukan LC 50-48 jam moluskisida niklosamida terhadap
ikan mas ... 48
4. Analisa probit (Wallace, 1982) untuk menentukan LC 50-72 jam moluskisida niklosamida terhadap
ikan mas ... 49
5. Analisa probit (Wallace, 1982) untuk menentukan LC 50-96 jam moluskisida niklosamida terhadap
Ikan mas ... 49
6. Bobot rata-rata ikan mas (g/ekor) yang dipaparkan dengan Berbagai konsentrasi subletal moluskisida niklosamida
selama12 minggu ... 50
7. Bobot ikan mas (g/ekor) yang dipaparkan dengan berbagai Konsentrasi subletal moluskisida niklosamida selama
12 minggu (Transformasi logaritma natural) ... 51
8. Laju pertumbuhan spesifik(%) ikan mas yang dipaparkan dengan berbagai konsentrasi subletalmoluskisida niklosamida
selama 12 minggu ... 52
9. Kadar hematokrit ikan mas yang dipaparkan dengan berbagai Konsentrasi subletal moluskisida niklosamida selama
10.Kadar hemoglobin ikan mas yang dipaparkan dengan berbagai konsentrasi subletal moluskisida niklosamida
selama12 minggu ... 54
11.Jumlah eritrosit ikan mas yang dipaparkan dengan berbagai konsentrasi subletal moluskisida niklosamida selama
12 minggu ... 55
12.Jumlah leukosit ikan mas yang dipaparkan dengan berbagai konsentrasi subletal moluskisida niklosamida selama
12 minggu (sel/mm3) ... 56
13.Analisis statistik terhadap laju pertumbuhan spesifik mas
Setelah 12 minggu pemaparan ... 57
14.Analisis statistik terhadap data hematologi (hematokrit, Hemoglobin, eritrosit) subletal ikan mas setelah
PENDAHULUAN
Latar Belakang
Penggunaan pestisida dalam bidang pertanian (sawah) yang semakin meningkat telah menimbulkan dampak negatif bagi menurunnya kualitas lingkungan perairan, karena pada umumnya sebagai tempat pembuangan limbah cair pertanian yang masih mengandung residu pestisida. Akibat kegiatan tersebut maka lingkungan perairan tawar yang merupakan sumber air untuk kegiatan budidaya perikanan berpotensi tercemar oleh berbagai bahan aktif yang terkandung dalam formulasi pestisida.
Keong mas merupakan hama yang dalam aktifitasnya memotong pangkal batang padi yang masih muda (Kurniawati et al., 2008). Pengendalian secara kimia yang umum dilakukan petani Indonesia yaitu menggunakan pestisida jenis moluskisida dengan bahan aktif niklosamida (IRRI. 2004). Moluskisida niklosamida digunakan untuk membunuh hama keong mas tapi juga dapat membunuh ikan, sehingga di beberapa negara di Asia penggunaannya sudah dilarang karena berdampak negatif terhadap lingkungan akuatik (Cuong, 2002; Wada, 2004). Sedangkan di Amerika niklosamida biasa digunakan sebagai kontrol populasi ikan lamprey laut (Petromyzon marinus) pada aliran anak sungai danau Great (Schreier et al, 2000).
Ikan mas termasuk komoditas ekonomis perikanan budidaya air tawar yang biasanya dibudidayakan di kolam sawah, karamba, karamba jaring apung dan sawah. Produksi ikan mas Indonesia tahun 2006 sebesar 247.633ton terdiri dari budidaya di kolam (105.135 ton), karamba (20.822 ton), karamba jaring apung (75.402 ton) dan sawah (46.274 ton) (Ditjen Perikanan Budidaya, 2007)
Potensi penggunaan niklosamida diprediksi akan meningkat, hal ini berkaitan dengan semakin luasnya areal sawah yang diserang oleh hama keong mas. Pada tahun 1997 luas serangan keong mas pada sawah di Indonesa sebesar 3.630 Ha sedangkan pada tahun 2007 sudah mencapai 22.110 Ha dan Jawa Barat paling tinggi luas serangannya yaitu mencapai 6.829 Ha (Direktorat Perlindungan Tanaman Pangan, 2008). Estimasi penggunaan niklosamida di sawah per hektar dengan ketinggian air 10 cm sebesar 0,5 mg/L dan yang masuk ke perairan sebesar 50 % yaitu 0,25 mg/L, sedangkan efektifitas pemakaiannya hanya berlangsung selama dua hari. Walaupun demikian belum ada data dari penelitian pestisida pertanian yang umum di perairan (sawah).
Menurut Abel (1989), pengaruh toksisitas subletal suatu toksikan terhadap organisme yang daya racunnya tidak menyebabkan kematian secara tidak langsung pada organisme, tetapi menyebabkan gangguan pertumbuhan, reproduksi, kebiasaan makan. Pengaruh bahan pencemar, (termasuk niklosamida) dapat diamati melalui pengukuran fisiologis maupun biokimia. Pengamatan yang dapat dilakukan antara lain hematologi (kadar hematokrit, kadar hemoglobin, jumlah eritrosit dan jumlah leukosit), serta histopatologi (insang, hati dan ginjal) (Heat, 1987).
Pendekatan Masalah
Moluskisida niklosamida digunakan di sawah untuk memberantas hama keong mas. Luas serangannya semakin meningkat dari tahun ke tahun sehingga penggunaan niklosamida semakin meningkat. Penggunaan niklosamida berpotensi mengakibatkan pencemaran di lingkungan perairan karena digunakan sebagai sumber air untuk kegiatan budidaya perikanan air tawar dapat tercemar dan berdampak negatif terhadap hewan akuatik. Untuk itu perlu penelitian dampak penggunaan niklosamida dengan hewan uji ikan mas karena penggunaan bahan ini akan menggangu proses fisiologi ikan dan akan berpengaruh terhadap pertumbuhan
Beberapa permasalahan niklosamida dalam penelitian ini yang berhubungan dengan toksisitas moluskisida terhadap ikan mas adalah sebagai berikut: a) Seberapa besar toksisitas akut moluskisida niklosamida terhadap ikan mas; b); Bagaimana pengaruh subletal moluskisida niklosamida terhadap pertumbuhan ikan mas; c) Bagaimana pengaruh subletal moluskisida niklosamida terhadap kondisi hematologis ikan mas yang meliputi kadar hematokrit, kadar hemoglobin, jumlah sel eritrosit, dan jumlah sel leukosit. d) Bagaimana pengaruh subletal moluskisida niklosamida terhadap kondisi histopatologi ikan mas yang meliputi organ insang, hati, dan ginjal.
Tujuan Penelitian dan Manfaat Penelitian
Hipotesis
TINJAUAN PUSTAKA
Pestisida
Pestisida merupakan serangkaian senyawa alamiah maupun sintetis berbagai unsur kimia yang memiliki kemampuan untuk membunuh organisme pengganggu, terutama ditujukan untuk jenis-jenis tertentu. Penggunaan pestisida di bidang pertanian, terutama di negara-negara berkembang mencakup lebih dari 90 % konsumsi pestisida domestik (Kusno, 1995).
Menurut Lodang (1994), penggunaan pestisida disamping dapat memberikan keuntungan juga dapat menimbulkan kerugian. Keuntungan yang didapat antara lain: 1) dapat meningkatkan produksi pertanian dan hasil yang cepat; 2) aplikasi di lapangan relatif mudah; 3) dapat digunakan pada areal yang luas dalam waktu yang relatif singkat; 4) dapat diaplikasikan setiap waktu, dengan memperhatikan keadaan cuaca; 5) dapat diperoleh dengan mudah; 6) harga relatif murah dan memberikan keuntungan ekonomi. Kerugian yang ditimbulkan dari penggunaan pestisida adalah:1) mempertinggi resistensi hama; 2) membunuh makhluk lain yang bukan sasaran; 3) gangguan toksik pada manusia bertambah sehubungan dengan bertambahnya volume dan intensitas penggunaan; 4) produk pertanian akan mengandung residu pestisida yang akan mengancam kesehatan para konsumen, terutama petani dan keluarganya; 5) kontaminasi global akibat mobilitas yang tingi, terutama oleh pestisida yang persisten; 6) mengganggu keseimbangan dalam rantai makanan sehingga akan menganggu ekosistem secara keseluruhan; 7) bertambahnya resiko efek sinergik interaksi antara bermacam-macam pestisida; 8) kemungkinan akan terjadi efek genetik jangka panjang akibat dosis subletal pestisida persisten.
pestisida cukup beracun untuk mempengaruhi seluruh kelompok taksonomi biota, termasuk makhluk bukan sasaran, sampai batas tertentu bergantung pada faktor fisiologi dan ekologi: 2) banyak pestisida yang dapat bertahan terhadap degradasi lingkungan akibatnya dapat bertahan dalam suatu daerah yang diberi perlakuan, sehingga keefektifannya dapat diperkuat. Sifat ini memberikan pengaruh jangka panjang dalam ekosistem alamiah.
Pestisida Dalam Lingkungan Perairan
Perairan adalah sebagai suatu tempat penampungan utama bagi residu pestisida yang persisten. Pencemaran pestisida terhadap sumberdaya dan lingkungan perairan mengakibatkan kematian hewan dan biota akuatik lainnya, penurunan produktifitas, penurunan kualitas lingkungan dan kualitas ikan.
Masuknya pestisida ke dalam perairan melalui berbagai jalur, antara lain: pemakaian langsung untuk membasmi hama tanaman, buangan limbah perkotaan dan industri, limpasan dari areal persawahan, pencucian melalui tanah, penimbunan aerosol dan partikulat, curah hujan dan penyerapan fase uap pada antar fase udara-air (Connel dan Miller, 1995). Di dalam lingkungan, pestisida diserap oleh berbagai komponen lingkungan kemudian berpindah tempat (Tarumingkeng, 1992). Komponen lingkungan seperti unsur-unsur hayati, suhu, air atau udara kemudian mengubah bahan aktif pestisida melalui proses kimia dan biokimia menjadi bahan lain yang masih beracun atau bahan yang toksisitasnya telah hilang sama sekali.
Penyerapan residu pestisida yang terdapat dalam perairan oleh hewan air dapat terjadi melalui berbagai cara, seperti mengkonsumsi makanan yang telah terkontaminasi, pengambilan dari air melalui membran insang, difusi kultikular serta penyerapan langsung dari sedimen (Livingstone, 1977). Penyerapan residu pestisida bergantung pada besarnya residu, sifat fisika-kimia, sifat bioakumulatif dan toksisitasnya, maka keracunan yang ditimbulkannya dapat bersifat letal maupun subletal (Kusno, 1995).
Berkaitan dengan bahaya yang ditimbulkan oleh pestisida terhadap ikan, Komisi Pestisida (1983) dan Koesoemadinata, (2003) mengklasifikasikan pestisida berdasarkan pada nilai LC50-96 jam seperti pada Tabel 1.
Tabel 1. Klasifikasi pestisida berdasarkan toksisitasnya terhadap ikan
Tingkat LC50-96 jam (ppm) Evaluasi toksisitas
A B C D
< 1 1 – 10 10 – 100
> 100
Sangat tinggi Tinggi Sedang Rendah
Komisi pestisida (1983) dan Koesoemadinata, (2003)
Niklosamida
Gambar 1. Rumus bangun niklosamida (Worthing, 1987)
Toksisitas subletal
Pengaruh toksisitas subletal pestisida secara tidak langsung dapat menyebabkan penurunan kesempatan untuk menyelamatkan diri atau perkembang biakan dalam populasi alamiah. Pengaruh yang spesifik adalah banyak dan beragam, serta berhubungan dengan spektrum yang luas tanggapan fisiologis dan perilaku, seperti perubahan dalam produksi enzim, laju pertumbuhan, perkembang biakan (Hurlbert, 1975; McEwen dan Stephenson, 1975 dalam Connel dan Miller, 1995). Menurut Schmittou (1991), tekanan lingkungan yang disebabkan oleh pengaruh pestisida yang bersifat subletal juga merupakan faktor eksternal yang akan menyebabkan direduksinya pertumbuhan ikan.
Pengaruh toksisitas subletal suatu toksikan terhadap organisme yang daya racunnya tidak menyebabkan kematian secara langsung pada organisme, tetapi menyebabkan gangguan pertumbuhan, reproduksi, kebiasaan makan (Abel, 1989). Pengamatan yang dapat dilakukan antara lain pertumbuhan, hematologi (kadar hematokrit, kadar hemoglobin, jumlah eritrosit dan jumlah leukosit) dan histopatologi (insang, hati dan ginjal) (Heat, 1987).
Pertumbuhan
Aziz (1989) menyatakan pertumbuhan ikan merupakan suatu pola kejadian yang kompleks dan melibatkan banyak faktor yang berbeda. Selanjutnya menurut Effendi (1979) pertumbuhan adalah perubahan ukuran, baik panjang, berat maupun volume, sehubungan dengan perubahan waktu.
Dengan demikian ikan muda akan mengalami pertumbuhan yang lebih cepat dibandingkan dengan ikan tua. Ikan tua tetap mengalami pertumbuhan, walaupun berlangsung secara lambat (Effendi, 1979). Selanjutnya dikatakan bawa pertumbuhan ikan dipengaruhi faktor internal dan eksternal. Faktor internal merupakan faktor yang meliputi: genetik, seks, umur, daya tahan terhadap penyakit dan parasit. Faktor eksternal meliputi: kompetisi pada populasi, makanan, tingkatan trofik, energi matahari dan keadaan fisika-kima lingkungan.
Hematologi
Darah pada ikan berfungsi membawa ion-ion anorganik (Na+, Mg+2, Cl-) dan senyawa organik seperti hormon, vitamin, dan beberapa protein plasma. Protein plasma berperan dalam respon kekebalan tubuh, penyangga perubahan pH darah dan pengaturan tekanan osmotik (Bond, 1979).
Fungsi darah pada ikan untuk mengedarkan zat makanan hasil pencernaan dan oksigen ke sel-sel tubuh serta membawa hormon dan enzim ke organ yang memerlukannya. Beberapa parameter yang dapat memperlihatkan perubahan pada darah adalah kadar hematokrit (Ht), kadar hemoglobin (Hb), jumlah sel darah merah (leukosit) dan jumlah sel darah putih (leukosit)) (Lagler et al., 1977).
Hematokrit
Hematokrit (Ht) merupakan perbandingan antara volume sel darah merah dengan plasma darah (Bond, 1979). Menurunnya kadar hematokrit dapat sebagai indikasi rendahnya protein dalam pakan, defisiensi vitamin atau ikan dapat infeksi, sedangkan meningkatnya kadar hematokrit menunjukkan ikan dalam keadaan stress (Wedemeyer & Yasutake, 1977 dan Anderson & Siwick, 1983). Hematokrit dalam darah ikan mas pada kondisi normal adalah sebanyak 27,1% (Peter dan Cech, 1990
dalam Affandi dan Tang, 2002)
Hemoglobin (Hb)
Hemoglobin berkaitan dengan eritrosit yaitu kadar atau kandungan eritrosit matang dalam aliran darah. Rendahnya Hb menunjukkan ikan anemia, sedangkan tingginya Hb berkaitan dengan kondisi stres (Blaxhall, 1972)
Kadar hemoglobin dalam darah ikan teleostei berkisar antara 37-100% Hb setara dengan 14 gram dalam 100 ml darah dan dalam keadaan sakit akut kadar Hb pada ikan akan turun hingga 27 % (Lucky, 1977). Angka (1983), kadar hemoglobin pada ikan mas dewasa adalah 8,61 ± 0,43 - 10,86 ± 48 (gram per 100 cc volume darah), sedangkan menurut Peter dan Cech, (1990) dalam Affandi dan Tang (2002) kadar Hb dalam darah ikan mas 6,40.
Eritrosit
Warna eritrosit merah kekuningan, bentuk lonjong, kecil dan berukuran 7-36 mikron (Lagler et al., 1977). Darah ikan sebagian besar terdiri dari sel-sel darah merah yang jumlahnya diperkirakan mencapai 4 juta sel/mm3. Sel darah merah ikan memiliki inti sel yang ukurannya bervariasi antar spesies. Sel darah merah tersebut mengandung hemoglobin dan berfungsi membawa oksigen dari insang ke berbagai jaringan (Moyle dan Cech, 1981).
Menurut Angka (1990) volume sel darah merah 100cc volume darah pada ikan mas dewasa berkisar 30,92 ± 0,43% dan 37,4 ± 1,67% dan jumlah sel darah merah per 1cc darah ikan mas (1,61 ± 0,06) x 106 sel sampai (2,04 ± 0,09) x 106 sel. Eritrosit yang terdapat dalam darah ikan mas dalam kondisi normal adalah 1,43 sel x 106/mm3 (Peter dan Cech, 1990 dalam Affandi dan Tang 2002).
Leukosit
Menurut Angka (1990), jumlah sel leukosit dalam 1cc darah merah ikan berkisar antara (14,70 ± 0,32) x 103 sel – (19,35 ± 0,42) x 103 sel. Affandi dan Tang (2002), sel darah putih pada ikan tidak berwarna dengan jumlah berkisar 20.000 – 150.000 butir, dan dibedakan menjadi dua golongan, yaitu: agranulosit dan granulosit. agranulosit digolongkan menjadi limfosit, monosit dan trombosit, seangkan granulosit dibagi menjadi basofil, eoseonofil dan neutrofil.
Histopatologi adalah metode yang sensitif dan secara biologis bernilai untuk mengukur efek stres lingkungan terhadap hewan (jaringan), Perubahan histopatologi ini sebagai indikator penting faktor stres lingkungan yang dialami sebelumya dimana perubahannya secara biokimia dan fisiologi. Perubahan ini bisa digunakan untuk meramal efek yang mungkin terjadi seperti pertumbuhan, reproduksi, menghindarkn diri dari predator, dan stabilisasi populasi yang terjadi pada tingkat yang lebih tinggi (MacKim, 1985; Meyer dan Hendricks 1985 dalam Hinton dan Laurtn, 1990)
Insang merupakan organ osmoregulasi, yaitu melakukan berbagai fungsi fisiologis, meliputi peredaran gas, regulasi ion, mempertahankan keseimbangan asam basa, dan ekskresi bahan buangan senyawa nitrogen, selain itu insang terus menerus berhadapan polutan di lingkungan medium (Hinton and Laurtn, 1990).
Hati penting dalam nutrisi dan pertahanan tubuh sebagai respon terhadap toksikan asal luar tubuh, selain itu merupakan aspek penting bagi nutrisi meliputi simpanan lemak dan karbohidrat (Hinton and Laurtn, 1990).
Ginjal berfungsi untuk filtrasi dan mengekskresikan bahan yang tidak dibutuhkan termasuk polutan (niklosamida). Ginjal merupakan organ osmoregulasi, walaupun ginjal juga berfungsi dalam immunitas sel. Ginjal ikan menerima sebagian besar darah postbranchial, dan luka ginjal sebagai indikator polusi lingkungan (Hinton and Laurtn, 1990).
Kualitas air
Suhu berpengaruh secara langsung maupun tidak langsung seperti terhadap aktifitas enzim, tingkat metabolisme maupun kadar oksigen. Tingkat penyerapan racun dapat lebih tingi dengan adanya kenaikan suhu (Macek et al., dalam Arianti, 2002). Bahan polutan cenderung lebih beracun pada air dengan tingkat kesadahan rendah dan nilai pH yang stabil, sedangkan pada kesadahan tingi cenderung menurunkan toksisitas dari polutan.
stres pada ikan sehingga ketahanan ikan terhadap pestisida akan menurun, akibatnya kan mempengaruhi toksisitas pestisida terhadap ikan (Arianti, 2002) Rendahnya oksigen terlarut dalam tubuh ikan akan meningkatkan toksisitas pestisida terhadap ikan. Boyd (1990) mengemukakan bahwa keberadaan amonia akan mereduksi masuknya oksigen ke dalam tubuh ikan, hal ini disebabkan insangnya yang rusak.
METODE PENELITIAN
Waktu dan Tempat
Penelitian dilakukan dari bulan Maret hingga Agustus 2008, bertempat di Instalasi Riset Lingkungan Perikanan Budidaya dan Toksikologi Cibalagung-Bogor. Analisis hematologi dan histopatologi di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan IPB.
Bahan dan Alat
Bahan yang dipergunakan selama penelitian adalah sebagai berikut:
a. Benih ikan mas yang berasal Desa Ciherang, dengan bobot 2,5-3,0 gram. b. Molusikisida Snaildown produksi Agricon dengan kandungan bahan aktif niklosamida 250 EC.
c. Pakan ikan, berupa pelet dengan kandungan protein 40 % (pakan stater udang). d. Aceton p.a sebagai pelarut dan KMnO4 (PK) 20 mg/l sebagai desifektan pada wadah pengujian sebelum penelitian dilaksanakan.
e. Bahan kimia untuk analisa kualitas air.
f. Bahan kimia untuk histopatologi dan hematologi. g. Penyiapan larutan uji dengan membuat larutan induk Peralatan yang digunakan dalam penelitian ini, yaitu:
b. Blower yang digunakan utuk airasi media uji.
c. Peralatan untuk pembuatan berbagai konsentrasi perlakuan, yaitu: gelas ukur, pipet, labu ukur dan bulp.
d. Peralatan untuk perhitungan dan pengamatan parameter darah, yaitu: jarum suntik, tabung dan sentrifius mikrohematokrit, skala hematokrit, hemositometer, pipet, gelas objek dan penutup, serta mikroskop.
e. Peralatan untuk histopatologi, yaitu: peralatan bedah, botol contoh, larutan fiksasi (Bouins), larutan pencuci (NaCl fisiologis),.
f. Timbangan digital dengan ketelitian 0,01 gram.
g. Peralatan untuk pengukuran kualitas air, yaitu: termometer, pH meter, DO meter,spektrofotometer.
Pelaksanaan Penelitian
Ambang Batas
Uji ambang batas bertujuan untuk menentukan kisaran letal ambang atas (LC10024 jam) dan konsentrasi letal ambang bawah (LC0-48 jam) (Busvine, 1971). Nilai ambang batas daya racun letal moluskisida terhadap ikan mas dengan deret konsentrasi uji: 0,00; 0,06; 0,10; 0,20; 0,25mg/L. Penghitungan konsentrasi larutan uji ditentukan dengan mengacu pada persamaan berikut:
V1.N1 = V2.N2 ………. (1)
Keterangan:
N1 = konsentrasi niklosamida dalam larutan stok
N2 = konsentrasi niklosamida yang diinginkan dalam media air
V1 = volume larutan stok yang akan dimbil
V2 = volume media air penelitian yang diinginkan
Waktu letal
pada tahap pengujian selanjutnya. Konsentrasi moluskisida niklosamida dianggap tidak stabil apabila kematian ikan mencapai 80% yang didentik dengan penurunan konsentrasi bahan kimia tersebut mencapai ≤ 20% dari kondisi awal (Koesoemadinata, 2003).
Pengujian dilakukan dengan mengaplikasikan tingkat konsentrasi nilai LC100 -24 jam dengan 3 kali ulangan untuk waktu pengamatan 0; 12; -24; 36; 48 jam. Penentuan konsentrasi larutan uji ditentukan dengan mengacu pada persamaan 1. Larutan niklosamida 0,25 mg/L disebar merata pada permukan air untuk ke empat wadah kemudian diaduk dengan pengaduk kaca, selanjutnya dimasukkan ikan pada waktu 0 jam, 12 jam, 24 jam, 36 jam. Pengamatan dilakukan setiap 12 jam. Selama uji stabilitas tidak dilakukan pergantian air
Toksisitas akut
Pengujian toksisitas akut untuk mencari nilai LC50 dari moluskisida niklosamida terhadap ikan mas yang ditentukan dengan metode uji hayati (bioassay) (Busvine, 1971), untuk menentukan Median Lethal Concentration (LC50) yang besarnya berada antara nilai ambang atas dan ambang bawah yang dapat ditentukan dengan persamaan 2 dan 3 dengan deretan konsentrasi: 0.00; 0,08; 0,10; 0,12; 0,14; 0,17; 0,20 mg/L.
Log (N/n) = k log (a/n) ……… (2)
a/n=b/a=c/b=d/c=e/d=f/e ……… (3)
Keterangan:
N = konsentrasi ambang atas n = konsentrasi ambang bawah K = Jumlah konsentrasi yang diuji (6)
a, b, c, d, e, f adalah konsentrasi yang diuji dengan nilai a sebagai konsentrasi terkecil
wadah-akuarium kaca yang berukuran 40 x 20 x 20 cm. Masing- masing wadah-akuarium dilengkapi saluran pemasukan dan pengeluaran serta penampungan air pengganti. Banyaknya ikan uji setiap wadah 10 ekor dengan waktu pemaparan selama 24, 48, 72, dan 96 jam dengan peubah yang diukur adalah mortalitas ikan.
Toksisistas Subletal Niklosamida TerhadapPertumbuhan
Pengujian dilakukan dengan metode uji hayati penggantian media uji (renewal test), yaitu melakukan pergantian air pemeliharaan setiap 48 jam dengan konsentrasi niklosamida yang sama untuk masing-masing perlakuan. Sebagai perlakuan digunakan 4 konsentrasi, yaitu 0, 10, 30, dan 50 % dari nilai LC50 96 jam, masing-masing perlakuan diulang 4 kali. Wadah yang digunakan berupa 16 unit akuarium kaca yang berukuran. 70 x 50 x 60 cm. Jumlah ikan yang diuji sebanyak 20 ekor/wadah dengan waktu pemaparan 12 minggu. Pengukuran untuk pertumbuhan adalah bobot ikan yang dilakukan minggu ke 4, 8, dan 12 untuk setiap perlakuan.
Selama penelitian ikan uji diberi pakan secara at satiation menggunakan pakan pelet komersial dengan kandungan protein 40 %. Pengukuran parameter fisika kimia air dilakukan sebelum dan sesudah ganti konsentrasi media pemeliharaan yaitu: suhu air, pH, 02 terlarut, CO dan amonia.
Toksisitas Subletal Niklosamida Terhadap Hematologi
Ikan mas yang telah dipaparkan dalam setiap perlakuan pada pengujian subletal niklosamida terhadap pertumbuhan, yang dilakukan pada 1 jam pertama (minggu ke 0), minggu ke 4, minggu ke 8, dan minggu ke 12, masing-masing diambil satu ekor untuk satu akuarium (unit penelitian). Pengambilan darah dilakukan dengan menggunakan jarum suntik steril pada bagian vena caudalis ikan uji. Jarum suntik tersebut sebelum digunakan terlebih dahulu dibasahi dengan Na-Sitrat 3,8% yang berfungsi sebagai antikoagulan. Sampel darah diambil untuk pengukuran parameter hematologis, yaitu kadar hematokrit, kadar hemoglobin, eritrosit dan jumlah leukosit.
Kadarhematokrit diukur dengan metode Anderson dan Siwicki (1993).Darah dihisap dengan menggunakan tabung mikrohematokrit berlapis heparin yang berfungsi mencegah pembekuan darah dalam tabung, sampai volume darah mencapai ¾ bagian tabung kemudian salah satu ujung tabung disumbat dengan critosea untuk selanjutnya disentrifius dengan kecepatan 4000 rpm selama 5 menit. Pengukuran kadar hematokrit dilakukan dengan membandingkan volume benda darah terhadap volume seluruh darah dengan menggunakan skala hematokrit dan dinyatakan dalam persentase hematokrit (%Ht).
Kadar Hemoglobin
Kadar hemoglobin diukur menurut metoda Sahli dengan Sahlinometer (Wedemeyer dan Yasutake, 1977). Darah dihisap menggunakan pipet Sahli hingga mencapai skala 20 m 3, kemudian dipindahkan kedalam tabung Hb yang berisi HCl 0,1 N sampai skala 10 (kuning). Kemudian tunggu selama 3-5 menit agar Hb bereaksi dengan HCl membentuk asam hemarin, kemudian aduk dan tambahkan akuades hingga warnanya sama dengan standar. Pembacaan skala dilakukan dengan melihat tinggi permukaaan larutan yang dikocok dengan skala lajur g% yang menunjukkan banyaknya Hb dalam gram setiap 100 ml darah dan dinyatakan dalam persentase (%Hb).
Jumlah Eritrosit
Jumlah eritrosit dihitung menurut metoda Blaxhall dan Daisley (1973).Sampel darah diencerkan dengan larutan Hayem untuk menghancurkan sel darah putih agar jumlah sel darah merah dapat dihitung. Pengenceran dilakukan dengan menggunakan pipet pencampur berskala maksimum 11 yang dilengkapi pengaduk.
yang dilengkapi gelas penutup hingga memenuhi seluruh permukaan yang berskala, selanjutnya dilakukan penghitungan dibawah mikroskop.
Jumlah Leukosit
Jumlah leukosit dihitungdengan metoda Blaxhall dan Daisley (1973). Sampel darah diencerkan dengan larutan Turks untuk menghancurkan sel darah merah agar jumlah sel darah putih dapat dihitung. Untuk mengencerkan leukosit digunakan pipet berskala maksimal 11 yang dilengkapi pengaduk. Mula-mula darah dihisap hingga skala 1, kemudian dilanjutkan dengan menghisap larutan Turks hingga skala 11. Pencampuran dilakukan dengan mengaduk pipet selam 15 menit agar darah tercampur secara merata. Setelah pencampuran selesai, teteskan kedalam hemositometer yang dilengkapi gelas penutup hingga memenuhi seluruh permukaan yang berskala, selanjutnya dilakukan penghitungan leukosit dibawah mikroskop.
Toksisitas Subletal Niklosamida Terhadap Histopatologi
Ikan mas yang telah dipaparkan dalam setiap perlakuan pada uji subletal terhadap pertumbuhan, masing-masing diambil satu ekor per unit penelitian untuk sampel organ dalamnya, yaitu: insang, hati dan ginjal untuk pengamatan histopatologis, yang dilakukan pada minggu ke-4, minggu ke-8, dan minggu ke-12.
Pembuatan Preparat Histopatologi
Fiksasi jaringan dan Parafinisasi
a. Fiksasi : untuk mencegah pembusukan jaringan, maka jaringan yang telah diambil kemudian direndam dalam larutan fiksatif selama 3 x 24 jam. Larutan fiksatif yang digunakan ialah larutan Bouins.
b. Dehidrasi : mengeluarkan cairan dari dalam sel dengan cara merendam dalam bahan kimia dimulai dari konsentrasi rendah ke konsentrasi tinggi.
c. Clearing : mengeluarkan alkohol dan memasukkan xylol (parafin larut dalam xylol ; tidak larut dalam alkohol)
Setelah didehidrasi jaringan tersebut direndam Alkohol xylol (1:1) ½ jam, dilanjutkan dengan xylol 3 kali masing-masing ½ jam.
d. Impregnasi ; penggantian xylol dengan paraffin
Cara direndam dalam parafin dengan titik cair 58-60oC;dalam oven yang dipanaskan pada 65-70oC, Xylol paraffin (1:1) ¾ jam.
e. Embedding : memasukan paraffin ke dalam sel
Jaringan tersebut direndam dengan parafin 3 kali masing-masing ¾ jam.
f. Blocking : mencetak jaringan sehingga mudah untuk dipotong
Pemotongan jaringan
Dilakukan dengan mikrotom, ketebalan sayatan 4 mikrometer ;untuk jaringan lunak setelah dipotong dimasukan ke air suam-suam kuku (+ 400C) sehingga pita potongan jaringan mengapung dan bisa dipotong untuk selanjutnya ditata dalam gelas objek.
Pewarnaan jaringan
a. Hidrasi : mengeluarkan paraffin
Direndam dengan Xylol sebanyak 2 kali masing-masing 3 menit, lalu alkohol 100 % sebanyak 2 kali masing-masing 3 menit, dilanjutkan dengan alkohol 95%, 90%, 80%, 70%, 50% masing-masing 3 menit dan kemudian dicuci dengan akuades 2 kali
b. Pewarnaan H-E
Direndam dengan Hematoksilin 7 menit, dicuci dengan air 7 menit, dilanjutkan dengan Eosin 3 menit dan dicuci dengan akuades.
c. Dehidrasi: mengeluarkan air
Lalu ditutup dengan gelas penutup yang sudah di tetesi dengan entelan, dikeringkan dalam oven pada suhu 40oC selama 24 jam.
Selanjutnya dilakukan pengamatan preparat histologis dengan mikroskop dan dianalisa secara deskriptif.
Analisis Data
Data komulatif mortalitas ikan mas pada pengujian definitif menggunakan analisis probit (Wallace, 1982) dengan bantuan program “probit analysis” untuk menentukan nilai LC 50 pada waktu pemaparan 24, 48, 72, dan 96 jam, sedangkan untuk analis data sifat fisika-kimia air (suhu, pH, oksigen terlarut, karbondioksida, amoniak) dilakukan secara deskriptif untuk mengetahui kelayaknya sebagai media uji.
Pertumbuhan individu ikan mas selama waktu pemaparan dalam uji toksisitas subletal dihitung berdasarkan model laju pertumbuhan harian individu menurut rumus Ricker (1975):
SGR = (lnWt –ln Wo)/∆t x 100% ……….(4)
Keterangan:
SGR = laju pertumbuhan harian individu (%)
Wt = bobot rata-rata individu pada akhir pengamatan (g) Wo = bobot rata-rata individu pada awal pengamatan (g)
∆t = waktu pemaparan
HASIL DAN PEMBAHASAN
Hasil
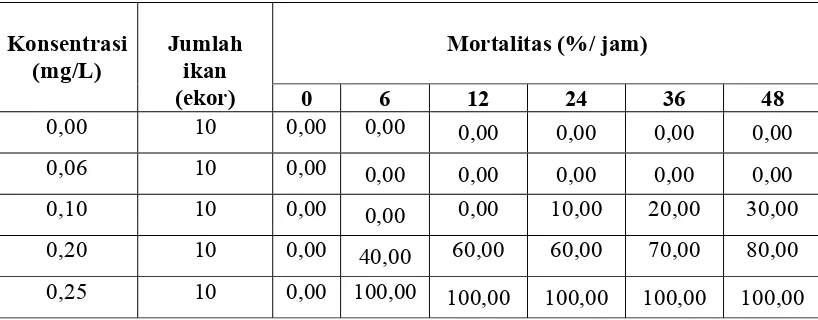
Ambang Batas
Dari uji yang dilakukan diperoleh nilai konsentrasi ambang bawah (LC0-48 jam) sebesar 0,06 mg/L, yaitu konsentrasi tertinggi dari moluskisida niklosamida yang tidak mematikan ikan mas dalam waktu 48 jam dan nilai ambang atas (L100-24 jam) sebesar 0,25 mg/l, yaitu konsentrasi terendah moluskisida niklosamida yang dapat mematikan 100 % ikan mas dalam waktu 24 jam (Tabel 2)
Tabel 2. Data mortalitas (%) ikan mas pada uji ambang batas konsentrasi niklosamida
Mortalitas (%/ jam) Konsentrasi
(mg/L)
Jumlah ikan
(ekor) 0 6 12 24 36 48
Waktu Letal
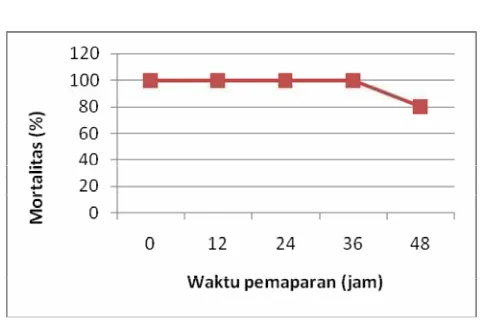
Dari data hasil pengukuran uji waktu letal terhadap niklosamida pada air pemeliharaan ikan mas nilai ambang atas (L100-24 jam) sebesar 0,25 mg/l diperoleh bahwa pergantian air dilakukan setelah 48 jam, karena kematian ikan sebesar 80 %. (Gambar 2).
Gambar 2. Mortalitas (%) ikan mas pada uji waktu letal untuk konsentrasi niklosamisa 0,25mg/L (LC 100-24 jam)
Toksisitas Akut
Dari nilai kisaran ambang atas-bawah dan melalui perhitungan dengan menggunakan persamaan (2 dan 3), maka uji toksisitas letal dilakukan pada konsentrasi sebagai berikut: 0,00 (kontrol); 0,08; 0,10; 0,12; 0,14; 0,17 dan 0,20 mg/L. Pengamatan gejala klinis yang timbul dan pencatatan terhadap kelangsungan hidup ikan dilakukan pada waktu 2, 4, 6 , 8, 10, 12, 24, 36, 48, 60, 72, 84 dan 96 jam setelah aplikasi.
Selanjutnya kelangsungan hidup ikan 0% pada pengamatan jam ke 84 untuk konsentrasi 0,20 mg/L, dan untuk konsentasi 0,17mg/L terjadi pada jam ke- 96. Pada kontrol tidak terlihat gejala klinis akibat keracunan dan tidak ditemukan ikan yang mati sampai waktu pemaparan 96 jam, hal ini menunjukkan bahwa media pemeliharaan (air) dan kondisi ikan selama pengujian dalam kondisi baik. Data kelangsungan hidup ikan mas selama uji toksisitas akut moluskisida niklosamida (Lampiran 1).
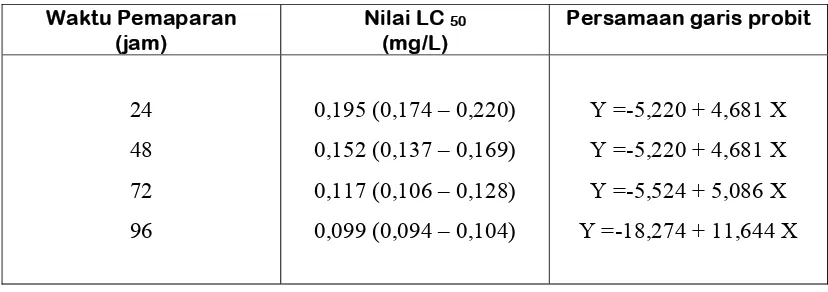
Tabel 3. Nilai LC 50 moluskisida niklosamida terhadap ikan mas pada setiap waktu Pemaparan
Waktu Pemaparan (jam)
Nilai LC 50 (mg/L)
Persamaan garis probit
24 48 72 96
0,195 (0,174 – 0,220) 0,152 (0,137 – 0,169) 0,117 (0,106 – 0,128) 0,099 (0,094 – 0,104)
Y =-5,220 + 4,681 X Y =-5,220 + 4,681 X Y =-5,524 + 5,086 X Y =-18,274 + 11,644 X
Gambar 3. Nilai LC 50 moluskisida niklosamida terhadap ikan mas pada setiap waktu pemaparan
Toksisitas Subletal
Pertumbuhan Ikan
Pengaruh subletal perlakuan moluskisida niklosamida terhadap laju pertumbuhan spesifik (SGR) ikan mas secara statistik bahwa konsentrasi 0,03 mg/L dan 0,05 mg/L beda nyata dibanding dengan konsentrasi 0,00 mg/L(kontrol) dan 0,01 mg/L(Tabel 4)
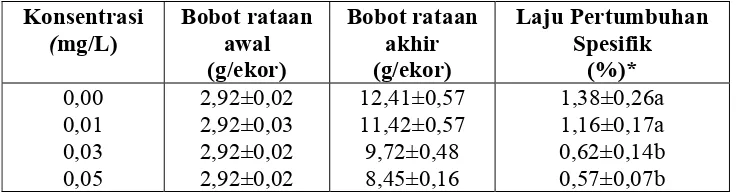
Tabel 4. Pertumbuhan ikan mas pada berbagai konsentrasi subletal moluskisida niklosamida setelah 12 minggu pemaparan
Konsentrasi
*) Angka pada kolom sama yang diikuti huruf sama, menunjukkan tidak beda nyata (P>0,05)
natural (ln) untuk menghitung laju pertumbuhan spesifik dari masing-masing perlakuan (Lampiran 7 dan 8).
Gambar 4. Pertambahan bobot rata-rata ikan mas selama 12 minggu pemaparan niklosamida moluskisida
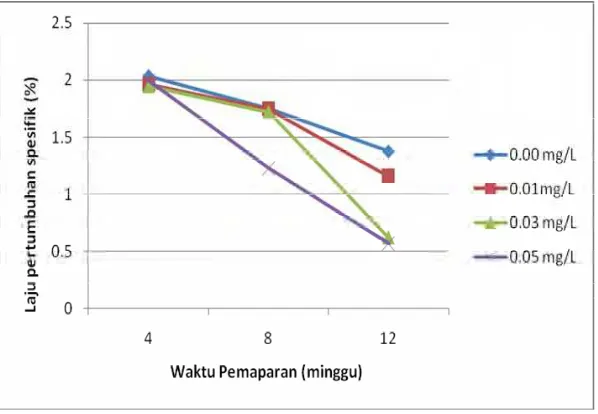
Dari Gambar 5 memperlihatkan bahwa sampai minggu ke 4 belum terlihat pengaruh moluskisida niklosamida terhadap penurunan laju pertumbuhan spesifik ikan mas untuk semua perlakuan dan pengaruhnya mulai terlihat terhadap perlakuan pada minggu ke 8 untuk konsentrasi 0,05 mg/L. Selanjutnya pada minggu ke 12 penurunan laju pertumbuhan spesifik ikan mas terlihat nyata pada konsentrasi 0,03 mg/L dan 0,05 mg/L. Untuk mengetahui pengaruh antar perlakuan digunakan uji Tukey (Lampiran 13)
Kondisi Hematologi
Data hematologi yang meliputi kadar hematokrit, hemoglobin, jumlah eritrosit dan leukosit dengan konsentrasi subletal niklosamida 0,00 (kontrol); 0,01; 0,03; 0,05 mg/L yang dipaparkan selama 12 minggu dapat dilihat pada Tabel 5; dan Gambar 6, 7, 8 dan 9 serta Lampiran 9, 10, 11, dan 12. Hasil anlisa statistik (Lampiran 13) menunjukkan bahwa pengaruh subletal moluskisida niklosamida pada ikan mas berpengaruh nyata (P< 0,05) terhadap kadar hematokrit (Ht), hemoglobin (Hb), eritrosit dan leukosit.
Tabel 5. Rata-rata hematokrit, hemoglobin, eritrosit dan leukosit ikan mas setelah 12 minggu pemaparan moluskisida niklosamida
Konsentrasi
*) Angka pada kolom sama yang diikuti huruf sama, menunjukkan tidak beda nyata (P>0,05)
Gambar 6. Kadar hematokrit juvenil ikan mas yang terpapar moluskisida niklosamida selama 12 minggu
Dari hasil analisis statistik diperoleh kadar hemoglobin pada konsentrasi subletal moluskisida niklosamida 0,01; 0,03; 0,05 mg/L. berbeda nyata (P< 0,05) dengan konsentrasi 0,00 mg/L (kontrol). Konsentrasi 0,01 dan 0,03 mg/L berbeda nyata (P< 0,05) dengan konsentrasi moluskisida niklosamida 0,05 mg/L. Hal ini menunjukkan bahwa pada konsentrasi subletal moluskisida niklosamida 0,01 mg/L dapat meningkatkan kadar hemoglobin dalam darah ikan mas.
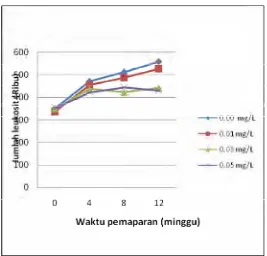
Gambar 8. Jumlah eritrosit juvenil ikan mas yang terpapar moluskisida niklosamida selama 12 minggu
Gambar 9. Jumlah leukosit juvenil ikan mas yang terpapar moluskisida niklosamida selama 12 minggu
Kondisi Histopatologi
Kondisi histopatologi insang, hati, dan ginjal akibat terpapar moluskisida niklosamida, Pengamatan histologi insang, hati, dan ginjal yang terpapar moluskisida niklosamida tertera pada Tabel 6
Tabel 6. Kondisi histopatologi insang, hati, dan ginjal juvenil ikan mas yang terpapar moluskisida niklosamida selama 12 minggu
Waktu pengamatan (Minggu ke) Konsentrasi
(mg/L)
Organ
4 8 12
Insang normal normal normal Hati normal normal normal 0,00
Ginjal normal normal normal Insang hipertropi hiperplasia - Hiperplasia
Keterangan: 1= fusi;
2= hipertropi
3= hiperplasi
4= nekrosis
Gambar 10. Kondisi histopatologi insang juvenil ikan mas yang terpapar moluskisida niklosamida selama 12 minggu
Keterangan:
1= hemoragi 2= nekrosis
Gambar 10. Kondisi histopatologi hati dan ginjal juvenil ikan mas yang terpapar moluskisida niklosamida selama 12 minggu
1 2
3
4
1
2 2
Kualitas air
Pengukuran sifat fisika-kimia air terdiri atas: suhu, pH, oksigen terlarut, kandungan CO2 bebas dan amonia total selama penelitian berlangsung, baik pada toksisitas akut maupun pada uji sub letal. Data fisika-kimia air tercantum pada Tabel 6. Dari data tersebut diketahui bahwa sifat fisika-kimia air selama penelitian berlangsung dalam kondisi baik dengan konsentrasi kisaran yang masih didalam nilai ambang batas (NAB) untuk perikanan.
Tabel 7. Kisaran sifat fisika-kimia air pada uji toksisitas akut dan subletal moluskisida niklosamida terhadap ikan mas
Parameter
1) Menurut Boyd (1982) 2) Menurut Boyd (1988)
Pembahasan
Dari uji waktu letal dapat diketahui kestabilan niklosamida berdasarkan kelangsungan hidup ikan uji yang akan digunakan sebagai acuan untuk menentukan priode pergantian air pada pengujian berikutnya. Pergantian air dimaksudkan untuk menjaga kestabilan konsentrasi larutan uji selama penelitian berlansung. Hasil uji waktu letal diperoleh bahwa pergantian konsentrasi dilakukan setiap 48 jam sebanyak 100 %. Sistim pergantian air semi statis ini merupakan alternatif yang dapat digunakan untuk meningkatkan akurasi hasil pengujian toksisitas. Menurut Kanazawa (1981), metode semi-statis merupakan pendekatan metode baku yaitu metode continuous-flow yang umumnya digunakan untuk mempertahankan konsentrasi bahan kimia agar stabil selama pengujian.
Hasil pengamatan pada uji toksisitas akut menunjukkan bahwa gejala klinis akibat keracunan kelihatan pada ikan setelah waktu pemaparan 6 jam terutama pada konsentrasi 0,20 mg/L dan 0,17 mg/L. Gejala yang timbul hampir sama dengan hasil penelitian Schoettger (1970) dimana ikan berenang tidak teratur dengan sesekali menghetak dan kejang-kejang serta mengeluarkan lendir yang berlebihan dari permukan tubuhnya, warna kulit memucat dan frekuensi pergerakkan operkulum menjadi lebih sering tetapi tidak beraturan. Gejala tersebut merupakan tanggapan yang terjadi pada saat zat-zat fisika atau kimia menggangu proses sel atau subsel dalam makhluk hidup sampai suatu batas yang menyebabkan kematian secara langsung (Connel dan Miller, 1995)
Hasil analisa probit moluskisida niklosamida diketahui bahwa nilai LC50 -96 jam terhadap ikan mas sangat rendah yaitu sebesar 0,099 mg/L (0,094 – 0,104) (Tabel 3). Berdasarkan Komisi Pestisida (1983) dan Koesoemadinata, (2003), menunjukkan bahwa toksisitas moluskisida niklosamida terhadap ikan mas diklasifikasi ke dalam golongan A yaitu pestisida yang memiliki toksisitas sangat tinggi (Tabel 1). Apabila dibandingkan dengan nilai LC50 96 jam niklosamida terhadap ikan nila sebesar 0,8570 mg/L (0,7843-0,9366) (Yosmaniar, 2008) nilainya sedikit berbeda tapi masih masuk kategori yang sama.
Selanjutnya EPA (1999) menyatakan bahwa niklosamida sangat toksik terhadap ikan seperti pada ikan rainbow trout ( Oncorhyncus mykiss) dengan nilai LC
50 96 jam sebesar 0,03 mg/L dan ikan lamprey laut (Petromyzon marinus) dengan nilai LC 50 96 jam yaitu 0,049 mg/L selain itu juga toksik terhadap organisma air lainnya. Dari hal yang disebutkan di atas membuktikan bahwa pengunaan niklosamida sangat berbahaya bagi ikan.
Dari Gambar 3 memperlihatkan bahwa sampai minggu ke 4 belum terlihat pengaruh moluskisida niklosamida terhadap penurunan laju pertumbuhan spesifik ikan mas untuk semua perlakuan dan pengaruhnya mulai terlihat terhadap perlakuan pada minggu ke 8 untuk konsentrasi 0,05 mg/L. Selanjutnya pada minggu ke 12 penurunan laju pertumbuhan spesifik ikan mas terlihat nyata pada konsentrasi 0,03 mg/L dan 0,05 mg/L.
Pengaruh subletal moluskisida niklosamida mulai pada konsentrasi 0,03 mg/L dapat menurunkan laju pertumbuhan spesifik ikan mas yang merupakan tekanan lingkungan bagi ikan mas dan dapat menghambat pertumbuhan meskipun selama penelitian berjalan tidak terdapat mortalitas. Schmittou (1991) bahwa tekanan lingkungan yang disebabkan oleh pengaruh pestisida yang bersifat subletal juga merupakan faktor eksternal yang akan menyebabkan direduksinya pertumbuhan ikan.
mengganti bagian sel yang rusak akibat kontaminasi dengan niklosamida. Pengaruh bioakumulasi insektisida endosulfan selama 12 minggu pemaparan pada benih ikan mas mereduksi pertumbuhan (Taufik, 2005).
Darah merupakan bagian penting dari sistem transpor dan merupakan faktor internal yang secara tidak langsung berpengaruh terhadap pertumbuhan, Karena darah berfungsi untuk mengedarkan zat makanan hasil pencernaan dan oksigen ke sel-sel tubuh serta membawa hormon dan enzim ke organ yang memerlukannya. Darah ikan tersusun dari sel-sel yang tersuspensi dalam plasma dan diedarkan keseluruh jaringan tubuh melalui sistem tertutup. Cairan darah ikan antara lain mengandung nutrient dan sisa metabolisme. Sel dan cairan darah mempunyai peran fisiologis yang sangat penting. Beberapa parameter yang dapat memperlihatkankan perubahan pada darah adalah kadar hematokrit (Ht), kadar hemoglobin (Hb), jumlah sel darah merah (eritrosit) dan jumlah sel darah putih leukosit) (Lagler et al., 1977)
Pengaruh subletal dari perlakuan moluskisida niklosamida terhadap kadar hematokrit ikan mas pada konsentrasi 0,01 mg/L (41,3%) atau lebih dapat meningkatkan prosentase hematokrit darah ikan mas. Penggunaan niklosamida setelah 1 jam (minggu ke 0) dan minggu ke 4 pada Gambar 6 menunjukkan konsentrasi 0,01 dan 0,00 mg/L belum berpengaruh terhadap kadar hematokrit apabila dibandingkan dengan konsentrasi 0,03 dan 0,05 mg/L. Pada akhir penelitian pengaruh pemaparan niklosamida menunjukkan peningkatan terhadap hematokrit.
Hematokrit dalam darah ikan mas pada kondisi normal adalah sebanyak 27,1% (Peter dan Cech, 1990 dalam Affandi dan Tang, 2002). Meningkatnya kadar hematokrit menunjukkan ikan dalam keadaan stress (Wedemeyer & Yasutake, 1977 dan Anderson & Siwick, 1983).
Angka (1983), kadar hemoglobin pada ikan mas dewasa adalah 8,61 ± 0,43 - 10,86 ± 48 (gram per 100 cc volume darah), sedangkan menurut Peter dan Cech, (1990)
dalam Affandi dan Tang (2002) kadar Hb dalam darah ikan mas 6,40.
Penggunaan niklosamida setelah 1 jam (minggu ke 0) pada Gambar 7 pada perlakuan konsentrasi niklosamida 0,01; 0,03 dan 0,05 mg/L memberikan berpengaruh yang relatif sama terhadap hemoglobin dibanding kontrol. Pada akhir penelitian, konsentrasi niklosamida 0,01 dan 0,03mg/L memberikan pengaruh yang hampir sama terhadap hemoglobin.
Blaxhall (1972), tingginya nilai hemoglobin berkaitan dengan kondisi ikan yang stres, begitu juga dengan nilai eritrosit dan hematokrit yang tinggi menunjukkan dalam kondisi stres (Wedemeyer dan Yasutake, 1977).
Dampak dari peningkatan nilai nilai hematokrit, hemoglobin dan ertirosit akibat terpapar niklosamida dapat dilihat dari hasil histologi yang menunjukkan pecahnya pembuluh darah pada hati dan ginjal yaitu untuk konsentrasi 0,01; 0,03; 0,05 mg/L sudah terlihat pada minggu ke 4 dan berlanjut sampai minggu ke 12 yang akhirnya mengakibatkan kematian sel.
Peningkatan kadar hematokrit dan hemoglobin eritosit dalam darah ikan mas dengan bertambahnya konsentrasi (Tabel 5) dipengaruhi oleh kontaminasi, absorbsi dan akumulasi moluskisida niklosamida yang menyebabkan stres pada ikan mas sehingga hormon-hormon stres seperti kortisol dan epinephrine masuk kedalam peredaran darah dan menyebabkan kontraksi limpa meningkat.
Fungsi utama sel darah merah adalah dalam pengangkutan oksigen. El-Deen dan Rongers (1992) peningkatan kontraksi limpa akan mengakibatkan terjadi pelepasan sel-sel darah merah sehingga nilai hematokrit, hemoglobin dan eritosit juga turut meningkat. Dengan meningkatnya nilai hematokrit, hemagolobin dan eritosit maka ikan akan memaksimalkan pengikatan oksigen yang masuk ke dalam jaringan darah
dibanding dengan konsentrasi niklosamida 0,01 mg/L dan 0,00 mg/L (kontrol). Hal ini menunjukkan bahwa pada konsentrasi subletal moluskisida niklosamida 0,03 mg/L dapat meningkatkan jumlah eritosit dalam darah ikan mas.
Dari Gambar 4 dapat dilihat bahwa jumlah eritrosit setelah 1 jam ( 0 minggu) setelah pemaparan niklosamida relatif sama. Pada akhir penelitian konsentrasi niklosmida 0,05 menunjukkan peningkatan jumlah eritrosit yang paling besar diantara perlakuan. jumlah sel darah merah per 1cc darah ikan mas (1,61 ± 0,06) x 106 sel sampai (2,04 ± 0,09) x 106 sel. Eritrosit yang terdapat dalam darah ikan mas dalam kondisi normal adalah 1,43 sel x 106/mm3 (Peter dan Cech, 1990 dalam Affandi dan Tang 2002). Menurut Angka (1990), jumlah sel leukosit dalam 1cc darah merah ikan berkisar antara (14,70 ± 0,32) x 103 sel – (19,35 ± 0,42) x 103 sel. Affandi dan Tang (2002)
Bertambahnya jumlah eritrosit diduga berkaitan dengan kerusakan sel-sel darah akibat pengaruh radikal bebas, sebab menurut Wijaya (1976) dalam Yuda (1999) suatu bahan toksik atau racun dapat menyebabkan kerusakan jaringan yang pada gilirannya dapat menimulkan pelepasan protein heme, yang akan bereaksi dengan peroksidase dan melepaskan ion Fe++. Dengan adanya ion tersebut akan terjadi reaksi fenton dan menghasilkan radikal bebas (OH) yang sangat reaktif. Akibat akhir dari reaksi ini dapat mengakibatkan kerusakan membran sel yang parah dan membahayakan kehidupan sel.
Jumlah leukosit ikan mas berkurang secara nyata dibanding dengan kontrol seiring peningkatan konsentrasi subletal niklosamida. Pengurangan jumlah leukosit sebagai respon terhadap stres yang merupakan karakteristik semua jenis vertebrata (Heat, 1987). Respon tersebut dipengaruhi oleh hormon kortikosteroid dan bersifat non spesifk, sebagai akibat adanya suatu stressor baik yang berasal dari dalam maupun dari luar faktor lingkungan
dengan peroksidase dan melepaskan ion Fe++. Dengan adanya ion tersebut akan terjadi reaksi fenton dan menghasilkan radikal bebas (OH) yang sangat reaktif. Akibat akhir dari reaksi ini dapat mengakibatkan kerusakan membran sel yang parah dan membahayakan kehidupan sel.
Pengaruh subletal dari perlakuan moluskisida niklosamida terhadap jumlah leukosit darah ikan mas secara statistik menunjukkan bahwa konsentrasi 0,03 (4,40 x 106)dan 0,05 mg/L perpengaruh nyata (P< 0,05) terhadap penurunan jumlah leukosit dibanding dengan konsentrasi 0,00 mg/L (kontrol) dan 0,01 mg/L. Hal ini menunjukkan bahwa pada konsentrasi subletal moluskisida niklosamida 0,03 mg/L dapat menurunkan jumlah leukosit dalam darah ikan mas. Menurut Angka (1990), jumlah sel leukosit dalam 1cc darah merah ikan berkisar antara (14,70 ± 0,32) x 103 sel – (19,35 ± 0,42) x 103 sel. Affandi dan Tang (2002)
Dari Gambar 9 dapat dilihat bahwa pada penggunaan niklosamida setelah 1 jam (minggu ke 0) jumlah leukosit relatif sama, selanjutnya pada minggu ke 4 juga hampir sama, selanjutnya pada minggu ke 12 pengaruh perlakuan niklosamida untuk konsentrasi 0,03 dan 0,05 mg/L menunjukkan penurunan yang relatif sama. Pengurangan jumlah leukosit sebagai respon terhadap stres yang meupakan karakteristik semua jenis vertebrata (Heat, 1987). Dimana respon tersebut dipengaruhi oleh hormon kortikosteroid dan bersifat non spesifik, sebagai akibat adanya suatu stressor baik yang berasal dari dalam maupun dari luar faktor lingkungan.
Secara umum pengaruh subletal pemaparan moluskisida niklosamida selama 12 minggu terhadap hematologi menunjukkan peningkatan secara nyata pada konsentrasi niklosamida 0,01 mg/L untuk kadar hematokrit dan kadar hemoglobin dan konsentrasi niklosamida 0,03 untuk jumlah eritrosit pada ikan mas. Sedangkan pengaruh perlakuan moluskisida niklosamida pada konsentrasi 0,03 dapat menurunkan jumlah leukosit secara nyata pada ikan mas.Sedangkan pengaruh
Insang mudah rusak karena langsung kontak dengan air. Letak insang, struktur dan mekanisme kontak dengan lingkungan menjadikan insang sangat rentan terhadap perubahan kondisi lingkungan (Irianto, 2005). Kerusakan struktur organ insang yang ringan akan mengganggu seperti kesulitan bernafas. Berkaitan dengan hal ini dapat dilihat dari hasil histopatologi dimana pada konsentrasi 0,01 mg/L niklosamida setelah minggu ke 8 pada insang terjadi hiperplasia dan kematian sel (nekrosis), selanjutnya pada hati dan ginjal terdapat perdarahan (haemorage) dan kematian sel (nekrosis) pada miggu ke 4
Insang merupakan organ respirasi utama pada ikan, epitel insang merupakan bagian utama untuk pertukaran gas. Insang ikan mas yang terpapar niklosamida akan menghalangi penerimaan oksigen. Perubahan yang umum terjadi pada insang ikan mas adalah fusi, hipertropi, hiperplasia, dan nekrosis sel-sel epitel lamela insang seperti pada Gambar 6 kerusakan struktur yang sangat ringan sekalipun dapat menganggu osmoregulasi pada ikan mas.
Robert (2001), hiperplasia pada insang terjadi pada tingkat iritasi yang lebih rendah dan biasanya disertai peningkatan jumlah sel-sel mukus di dasar lamela dan mengakibatkan fusi dari lamela. Ruang interlamela yang merupakan saluran air dan ruang produksi mukus dapat tersumbat akibat hiperplasia Hiperplasia mengakibatkan penebalan jaringan epitelium yang terletak di ujung filamen. Hiperplasia dan fusi merupakan hal yang umum akibat terpapar oleh pestisida (termasuk niklosmida). Hal ini biasanya memperlihatkan pemishan antara sel epitelium dan sistim yang mendasari sel tiang yang dapat mengarah kepada hancurnya keutuhan dari struktur lamela sekunder dan dapat menyebabkan peningkatan sel klorid. (Olurin et al, 2006). Nekrosis ditandai oleh infiltrasi sel-sel granuler eosinofilik dan kondisi ini dapat mengurangi efisiensi difusi gas (Hoole et al, 2001)
Ginjal ikan menerima sebagian besar darah postbranchial dan luka yang terjadi pada organ ginjal sebagai indikator polusi lingkungan. Selanjutnya hasil histopatologi pada ginjal ditemukan nekrosis terjadi pada semua perlakuan konsentrasi niklosamida (0,01; 0,03; 0,05mg/L) mulai mingu ke 4, ke 8 dan ke 12.
Suhu air sangat penting karena tidak hanya mempengaruhi aktivitas metabolik dan tingkah laku organisme dan pemaparan polutan (bahan pencemar). Secara umum toksisitas dari polutan akan meningkat sejalan dengan peningkatan suhu air (Mason, 1992). Selama penelitian dilaksanakan, baik pada uji akut maupun uji subletal, suhu air relatif stabil yang berkisar antara 26-270C (Tabel 6). Nilai ini masuk dalam kisaran Nilai Ambang Batas (NAB) untuk kehidupan ikan mas. Kestabilan suhu air pada penelitian ini juga memenuhi kriteria yang ditetapkan oleh Komisi Pestisida (1983) yaitu fluktuasinya tidak lebih dari 20C selama penelitian.
Nilai pH akan berpengaruh terhadap degradasi pestisida, yaitu laju degradasi akan lambat pada pH di bawah 6,0. Nilai pH air selama penelitian adalah antara 7,5-8,0 (Tabel 6). Kondisi ini sangat mendukung karena menurut pH air yang baik untuk budidaya ikan pada kolam air tenang adalah sekitar 7,0-8,8.
Konsentrasi oksigen terlarut pada uji akut berkisar 6,5-7,4 mg/l, sedangkan pada uji subletal sebesar 6,5-7,8 mg/l (Tabel 6). Konsentrasi oksigen terlarut seperti ini menurut Chapman (1992) termasuk kedalam kisaran yang baik bagi pemeliharaan ikan. Sejumlah polutan akan menjadi lebih toksik pada konsentrasi oksigen yang rendah karena pada kondisi tersebut proses respirasi akan meningkat sehingga racun terekspos terhadap tubuh ikan juga semakin besar (Mason, 1992).
KESIMPULAN DAN SARAN
Kesimpulan.Dari penelitian yang sudah dilakukan dapat disimpulkan, bahwa:
1. Nilai konsentrasi ambang bawah moluskisida niklosamida (LC0-48 jam) sebesar 0,06 mg/L dan nilai ambang atas (L100-24 jam) sebesar 0,25 mg/l. 2. Nilai waktu letal moluskisida niklosamida di dalam air yaitu selama 48 jam
pada konsentrasi 0,25 mg/L.
3. Nilai LC 50- 24 ; 48; 72; dan 96 jam moluskisida niklosamida terhadap ikan mas adalah 0,195 0,174 – 0,220); 0,152 (0,137 – 0,169);0,117 (0,106 – 0,128); dan 0,099 (0,094 – 0,104) mg/L. Niklosamida kategori sangat berbahaya (golongan A)
4. Konsentrasi subletal moluskisida niklosamida berpengaruh nyata terhadap kondisi hematologi, yaitu peningkatan hematokrit dan hemoglobin pada konsentrasi 0.01 mg/L dan jumlah eritrosit 0,03 mg/L, dan penurunan leukosit pada konsentrasi 0.03 mg/L
5. Tingkat konsentrasi subletal molukisida niklosamida mengakibatkan kerusakan pada insang, hati dan ginjal pada konsentrasi 0,01 mg/L
6. Konsentrasi subletal moluskisida niklosamida berpengaruh nyata terhadap penurunan pertumbuhan terjadi mulai pada konsentrasi 0,03 mg/L
Saran
DAFTAR PUSTAKA
Abel PD. 1989. Water Pollution Biology. Chichester Ellis Horwood Limited.. 231 hal Affandi R, Tang UM. 2002. Fisiologi hewan air. Unri Press. Pekanbaru, Riau,
Indonesia. 217 h.
Anderson DP, Siwicki AK. 1993. Basic hematology and serology for fidh health program. Paper presented in second symposium on diseases in asian aqauaculture “Aquatc Animal Healt and the Enviroment” Phuket Thailand 25-29 th Oktober. Oktober 1993;25-29
Angka SL. 1990. The pathology of walking catfish, Clarian batrachus, infected intraperitoneally with Aeromonas hydrophila. EFS.
APHA, AWWA, WPCF. 2005. Toxicity test method for aquatic organism Standard metod for the examination of water and wastewater. Washington DC Sixteen edition. American public health association.. P 689-726
Arianti FD. 2002. Toksisitas insektisida endosulfan terhadap ikan nila (Oreochromis niloticus) dalam lingkungan air tawar. [Tesis]. Bogor. Program Pascasarjana. Institut Pertanian Bogor. 87 hal
Aziz KA. 1989. Pendugaan stok populasi ikan tropis. Institut Pertanian Bogor. 88 hal.
Blaxall PC. 1972. Hematological assessment of the health of fresh water fish, A Riview of selected literature. Journal Fish Biology 4: 593 - 604
Bond CE. 1979. Biology of fish. W.B. Philadelphia Saunders Company.. 512 hal. Boyd, CE. 1982. Water quality management in aquaculture and fisheries science.
Amsterdam. Elsevier Scientific Publishing Company. 312 hal.
Boyd, CE. 1988. Water quality in warmwater fish pond. Alabama. Faurth Printing. Auburn Aniversity Agricultural Experiment Station. USA. 359 hal.
Boyd CE. 1990. Water quality in pond for aquaculture. Alabama. Brimingham Publishing Co., 482 hal.
Busvine JR.1971. A critical review of techniques for testing insecticides. Cammon wealth Agricultural Boureou. 345 hal
Connel DW, Miller GJ. 1995. Kimia dan ekotoksikologi pencemaran. Jakarta Penerbit Univ. Indonesia,. ha1331-341.
Cuong DN. 2002. Golden apple snail (GAS) in Vietnam:introduction, impact and
Management. In: Wada T,Yusa Y, Joshi RC, eds. Proceedings of the Meeting of the Special Working Group on the Golden Apple Snail(Pomacea
spp.) at the Seventh International Congress on Medical and Applied Malacology, Los Baños, Laguna,SEAMEO Regional Center for Graduate Study and Research in Agriculture. Los Baños, Laguna: SEAMEORegional Center for Graduate Study and Research in Agriculture. p 49-54.
Direktorat Perlindungan Tanaman Pangan. 2008. Luas tambah serangan keong mas 1997 – 2007. Data belum dipublikasi. Jakarta. Direktorat Perlindungan Tanaman Pangan. Departemen pertanian
Ditjen Perikanan Budidaya. 2007. Statistik Perikanan Budidaya Indonesia No 8.tahun 2006. Jakarta. Direktorat Jenderal Perikanan Budidaya. Departemen Kelautan dan Perikanan. 131 hal
Edwards CA. 1976. Persistent pesticides in the environment. Ohio. CRC Press. 170 hal.
Effendi HI. 1979. Metode biologi perikanan. Bogor.Yayasan Dewi Sri. 112 hal.
Effendi H. 2000). Telaah kualitas air bagi pengelola sumberdaya dan lingkungan. Fakultas Perikanan dan Kelautan. Bogor. Institut Pertanian Bogor. 257 hal
El-Deen MAS, Rogers WA. 1992. Accute Toxicity and some Hematological Changes in Grasscarp Expossed to Diquat. J. Aquatic Animal Healt 4: 277-280
EPA1999. Registration Eligibility Decision (RED) 3- Trifluoro- methyl 4- nitro phenol and niclosamide. United States Enviromenttal Protection Agency.
Heath AG. 1987. Water pollution and fish physiology. Florida. CRC Ress Inc. Boca Raton,. 245 hal.
Hinton D E, Laurtn DJ. 1990. Integrative Histopathological Approaches to Detecting Effects of Environmental Stressors on Fishes. American Fisheries
Society Symposium 8:51-66
Hoole D, Bucke D, Burgerss, Wellby. 2001. Diseases of carp ad other cyprinid Fishes. Blackwell Science. USA. 264 pp