ISOLASI DAN SELEKSI BAKTERI BERPOTENSI SEBAGAI
PEMICU PERTUMBUHAN TANAMAN
RINA AMALIYAH
DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi yang berjudul Isolasi dan Seleksi Bakteri Berpotensi Sebagai Pemicu Pertumbuhan Tanaman adalah benar karya saya dengan arahan dari komisi pembimbing (Fahrizal Hazra dan Enny Widyati) dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini. Penelitian pada skipsi ini sebagian merupakan bagian dari kegiatan yang di danai dari DIPA Puslitbang Peningkatan Produtivitas Hutan Tahun 2013 sehingga data – data yang terkait menjadi milik Puslitbang Peningkatan Produtivitas Hutan.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2014
Rina Amaliyah
ABSTRAK
RINA AMALIYAH. Isolasi dan Seleksi Bakteri Berpotensi Sebagai Pemicu Pertumbuhan Tanaman. Dibimbing oleh FAHRIZAL HAZRA dan ENNY WIDYATI.
Penelitian ini bertujuan untuk mendapatkan isolat bakteri berpotensi yaitu; bakteri pelarut fosfat (BPF), perombak selulosa (BPS), dan pemfiksasi N2 (Azospirillum). Tahapan penelitian meliputi isolasi dan pemurnian; seleksi BPF (uji kualitatif, kuantitatif), BPS (indeks selulolitik), Azospirillum (metode Kjeldahl); pengujian bakteri (uji antagonisme bakteri, uji hipersensitivitas, dan uji hemolitik). Hasil penelitian menunjukkan bahwa isolat BPF terbaik dengan nilai Indeks Pelarutan (IP) dan P-Larut tertinggi adalah isolat BPF3.2.1 dan BPF2.1.1. Isolat BPS terbaik dalam memproduksi selulose dengan nilai Indes Selulilitik (IS) tertinggi adalah isolat BPS2.1.1 dan BPS3.5. Isolat Azospirillum yang terbaik dan mampu memfiksasi N2 adalah isolat AZ3.2 dan AZ2.4. Terjadi sifat antagonis antara BPS3.5 terhadap isolat BPF2.1.1 dan AZ3.2. Semua isolat tidak bersifat patogen terhadap tanaman. Namun, isolat AZ3.2 dan BPS2.1.1 berpotensi patogen terhadap hewan.
Kata kunci: antagonistik, Azospirillum, BPF, BPS, patogenitas
ABSTRACT
RINA amaliyah. Isolation and Selection of Bacteria Trigger Potential For Plant Growth. Guided by Fahrizal Hazra and Enny Widyati.
This study aims to collect bacterial isolates potentially such as; solubilizing bacterial phosphate, cellulose decomposer, and N2 fixer (Azospirillum). Stages of research include the isolation and purification; Selection BPF (qualitative test, quantitative), CPM (cellulolytic index), Azospirillum (Kjeldahl method); bacterial testing (hypersensitivity test, hemolytic test, bacterial antagonism test). The results showed that the best BPF isolates with the biggest IP and the P-value was BPF3.2.1 and BPF2.1.1 isolates. The best isolates of best CPM in producing cellulose with highest is value was BPS2.1.1 and BPS3.5 isolates. The best Azospirillum isolates which able to fix N2 was AZ3.2 and AZ2.4 isolates. Isolates BPS3.5 BPF2.1.1 and AZ3.2 indicated to show have antagonistic when were grow in the same plate . All isolates were not pathogenic to plants. However, isolates AZ3.2 and BPS2.1.1 potentially pathogenic to animals.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Ilmu Tanah dan Sumberdaya Lahan
ISOLASI DAN SELEKSI BAKTERI BERPOTENSI SEBAGAI
PEMICU PERTUMBUHAN TANAMAN
RINA AMALIYAH
DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi :Isolasi dan Seleksi Bakteri Berpotensi Sebagai Pemicu Pertumbuhan Tanaman
Nama :Rina Amaliyah NIM :A14100072
Disetujui oleh
Ir Fahrizal Hazra, MSc Pembimbing I
Dr Enny Widyati Pembimbing II
Diketahui oleh
Dr Ir Baba Barus, MSc Ketua Departemen
PRAKATA
Puji syukur atas kehadirat Tuhan Yang Maha Esa yang telah memberikan nikmat serta anugrah-Nya sehingga penulis dapat menyelesaikan penelitian penyusunanan karya ilmiah yang berjudul Isolasi dan Seleksi Bakteri Berpotensi Sebagai Pemicu Pertumbuhan Tanaman.
Penulis mengucapkan terima kasih kepada Ir Fahrizal Hazra, MSc dan Dr Enny Widyati selaku pembimbing skripsi atas bimbingan, nasehat, arahan dan motivasi yang diberikan selama penelitian dan penulisan karya ilmiah ini. Ucapan terima kasih kepada dosen penguji saya, Dr Ir Arief Hartono, MSc. Agr atas saran dan arahan yang mendukung skripsi saya. Ungkapan terima kasih juga disampaikan kepada ibunda tercinta Nurkholillah, abang dan kakak tersayang (Ahmad Fauzi, Arpan, Hikmah, Ummu Atiyah) yang selalu memberikan do’a, kasih sayang, kesabaran dan dukungan baik moril ataupun materil; Alm. Muhammad Amru selaku ayah tercinta yang semasa hidupnya selalu memberikan dukungan kepada saya; Dimas Pratama selaku orang terdekat atas waktu, motivasi, perhatian dan dukungan baik moril dan materil; Staf Laboratorium Bioteknologi Tanah dan Kesuburan Tanah IPB (Pak Jito, Bu Jul, Bu Jeti, Mbak Asti,Bu Asih, Pak ade, pak sukoyo, pak ole, mas Bela, bu yani) atas bantuan dan bimbingan menjalani penelitian ini; Kak Annisa (MLS46) yang banyak membantu selesainya penelitian saya; Kakak – Kakak Pasca Sarjana (Kak Winda, Kak Yuni, Kak Putro, Kak Titik, Kak Joko) yang memberikan bimbingan dan bantuan menjalani penelitian ini; sahabat seperjuangan (Rita, Nika, Yolla, Yanuar, Tri) serta seluruh sahabat dan saudara Tanah 47 atas canda tawa, motivasi, dukungan, kebersamaan, bantuan dan perhatiannya yang diberikan kepada penulis.
Semoga penelitian dan karya ilmiah ini dapat bermanfaat.
Bogor, Desember 2014
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 2
Praktek Pertanian dan Kesuburan Tanah 2
Bakteri Pelarut Fosfat 3
Bakteri Selulolitik 3
Azospirillum 4
Interaksi Antar Mikroorganisme 4
Hasil Penelitian Penggunaan Bakteri Berpotensi 5
METODELOGI 6
Waktu dan Tempat 6
Bahan 6
Alat 6
Prosedur Percobaan 6
HASIL DAN PEMBAHASAN 9
Isolasi dan Pemurnian 9
Seleksi Bakteri Pelarut Fosfat 11
Seleksi Bakteri Perombak Selulosa 13
Seleksi Azospirillum 14
Uji Antagonisme Bakteri 15
Uji Hipersensitivitas 16
Uji Aktivitas Hemolitik 17
Perhitungan Total Populasi Bakteri Berpotensi 18
SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
LAMPIRAN 23
RIWAYAT HIDUP 26
DAFTAR TABEL
1 Penamaan sampel tanah yang diisolasi 7
2 Hasil isolasi BPF, BPS, dan Azospirillum dari tiga lokasi pengambilan
contoh tanah 9
3 Hasil uji kualitatif BPF berdasarkan nilai indeks pelarutan 11 4 Hasil uji kualitatif dan uji kuantitatif bakteri pelarut fosfat 12 5 Hasil uji kemampuan BPS berdasarkan nilai indeks selulolitik (IS) 13 6 Hasil uji kemampuan Azospirillum menambat Nitrogen dengan metode
kjeldahl 14
7 Hasil pengamatan karakteristik makroskopis bakteri berpotensi 15 8 Hasil uji antagonisme bakteri berpotensi yang dikombinasikan secara in
vitro 16
9 Hasil uji aktivitas hemolisis bakteri berpotensi 18 10 Hasil uji total bakteri berpotensi pada inokulum cair 18
DAFTAR GAMBAR
1 Ilustrasi penetapan indeks pelarutan bakteri pelarut fosfat 8 2 Ilustrasi metode uji antagonisme antar bakteri 9 3 Contoh koloni bakteri isolat bakteri pelarut fosfat 10 4 Contoh koloni bakteri isolat bakteri perombak selulosa 10
5 Contoh koloni bakteri isolat Azospirillum 11
6 Contoh isolat BPF3.2.1 dalam uji kualitatif 12
7 Contoh isolat BPS3.5 yang mampu membentuk zona bening di
sekeliling koloni 13
8 Contoh tahap pengujian antagonisme antar bakteri dalam satu cawan
isolat 1 adalah BPF2.1.1 16
9 Hasil uji hipersensitivitas terhadap tanaman tembakau menunjukkan gejala negatif untuk semua isolat bakteri pelarut fosfat dan Azospirillum 17 10 Hasil uji hipersensitivitas terhadap tanaman tembakau menunjukkan
gejala negatif untuk semua isolat bakteri perombak selulosa 17
DAFTAR LAMPIRAN
1 Analisis Kesuburan tanah di Sepintun Jambi 21
2 Analisis Kesuburan Tanah di Sungai Banir Jambi 21 3 Analisis Kesuburan Tanah di Bangko Kuning Jambi 22
4 Komposisi media pikovskaya (1000 ml) 22
5 Komposisi media CMC (1000 ml) 22
6 Komposisi media NFB semi - padat (1000 ml) 23
7 Komposisi media LB (1000 ml) 23
PENDAHULUAN
Latar Belakang
Aktivitas mikroorganisme tanah dapat berguna bagi pertumbuhan tanaman dan mempengaruhi kesuburan tanah, karena mampu memperlancar siklus unsur hara dan menyuplai hormon serta enzim yang dibutuhkan tanaman (Agus 1997). Pupuk organik hayati bukan merupakan pupuk yang secara tidak langsung meningkatkan kesuburan tanah setelah ditambahkan ke dalam tanah. Pupuk organik hayati menambahkan nutrisi melalui proses alami, seperti fiksasi nitrogen di atmosfer, mengubah fosfor menjadi bahan yang terlarut, dan merangsang pertumbuhan tanaman melalui sintesis zat yang mampu memacu pertumbuhan tanaman (Chusnia et al. 2012).
Penggunaan pupuk organik hayati yang dikombinasikan dengan penggunaan pupuk kimia dapat memberikan pengaruh yang lebih besar dalam meningkatkan ketersediaan unsur hara di dalam tanah. Menurut Maryanto dan Ismangil (2010), pemberikan pupuk organik hayati yang dikombinasikan dengan batuan fosfat alam mampu meningkatkan P tersedia tanah dan P total serta pemberiannya dapat meningkatkan bobot kering tanaman dan tinggi tanaman.
Penelitian untuk mencari mikoorganisme tanah yang mampu meningkatkan ketersediaan unsur hara dalam tanah sangat diperlukan mengingat pemanfaatan mikroorganisme tesebut dapat menjadi salah satu alternatif untuk intensifikasi lahan pertanian. Namun, keberadaan bakteri berpotensi yang mampu meningkatkan pertumbuhan tanaman, terkadang belum seluruhnya disimpan dalam bentuk stock culture. Sehingga, terkadang ketika digunakan kembali kualitas bakteri mengalami penurunan. Maka dari itu, penelitian kali ini diawali dengan melakukan isolasi dari tanah. Penelitian ini menggunakan tiga jenis bakteri yang berpotensi dijadikan pupuk organik hayati, ketiganya ditentukan berdasarkan seleksi dan pengujian yang dilakukan secara in vitro. Bakteri berpotensi yang digunakan antara lain bakteri pelarut fosfat (BPF), perombak selulosa (BPS), dan pemfiksasi N2 (Azospirillum).
2
Tujuan Penelitian
Penelitian ini bertujuan untuk (1) Mendapatkan isolat BPF, BPS, dan Azospirillum. (2) Menyeleksi isolat BPF, BPS, dan Azospirillum. (3) Menguji antagonisme antar bakteri serta patogenitas bakteri terhadap tanaman dan hewan.
TINJAUAN PUSTAKA
Praktek Pertanian dan Kesuburan Tanah
Kegiatan pertanian konvensional secara umum hanya berorientasi pada hasil yang maksimal dengan memanfaatkan bahan kimia berupa pupuk secara terus
menerus. Pemupukan merupakan salah satu upaya untuk meningkatkan
ketersediaan unsur hara yang dibutuhkan oleh tanaman (Salikin 2003). Namun, penggunaan pupuk kimia secara terus menerus menyebabkan ekosistem biologi tanah tidak seimbang dan peranan pupuk tidak efektif untuk tanaman, karena terjadi residu zat pembawa (carrier) di dalam tanah (Sutanto 2006). Penilaian status kesuburan tanah biasanya didasarkan kandungan Nitrogen (N), Fosfor (P), dan Kalium(K), karena unsur makro ini dibutuhkan dalam jumlah banyak oleh tanaman (Gilman 1983). Selanjutnya ketersediaan unsur hara dipengaruhi oleh faktor tanah seperti; tekstur, kapasitas tukar kation, kandungan bahan organik, dan pH tanah (FAO 1988).
Dalam hal penyediaan dan penyerapan unsur hara bagi tanaman, aktivitas mikroorganisme diperlukan untuk menjaga ketersediaan tiga unsur hara yang penting bagi tanaman antara lain; nitrogen (N), fosfat (P), dan kalium (K). Menurut Sari (2010) nitrogen berfungsi meningkatkan pertumbuhan tanaman, menunjang pertumbuhan daun, meningkatkan kadar protein dalam tubuh tanaman, meningkatkan kualitas tanaman, dan daun tanaman berwarna lebih hijau. Kekurangan unsur N dapat menyebabkan khlorosis dimana daun muda berwarna kuning.
Unsur fosfat (P) adalah unsur esensial kedua setelah N yang berperan penting dalam fotosintesis dan perkembangan akar. Pemakaian pupuk fosfor hampir tidak kalah banyaknya dibandingkan dengan pemakaian pupuk nitrogen. Efisiensi pemakaian pupuk tersebut ditingkat petani sangat rendah. Petani cenderung memberi fosfat setiap musim tanam, tanpa mengetahui bahwa pupuk fosfat yang diberikan mampu memberi residu pada penanaman berikutnya (Anwar et al. 2009). Namun, jumlah P yang terfiksasi lebih besar dari pada yang hilang melalui panen (Ismail 2013). Pada tanah masam, P bersenyawa dalam bentuk-bentuk Al—P dan Fe—P, sedangkan pada tanah alkali (basa) P akan membentuk senyawa Ca—P dengan kalsium membentuk senyawa kompleks yang sukar larut (Simanungkalit et al. 2006).
3 perombak selulolsa, dan bakteri pemfiksasi N2 (Azospirillum) menjadi hal penting untuk membantu ketersediaan hara di dalam tanah yang dibutuhkan tanaman.
Bakteri Pelarut Fosfat
Ketersediaan P dalam tanah jarang yang dapat melebihi 0.01 % dari total P dalam tanah. Hal tersebut disebabkan sebagian besar bentuk P terikat oleh koloid tanah sehingga tidak tersedia bagi tanaman yang disebabkan tingginya kemasaman tanah (Simanungkalit et al. 2006). Peningkatan ketersediaan fosfat bagi tanaman diusahakan dengan pengunaan pupuk fosfat anorganik maupun organik. Namun, sejumlah besar fosfat bentuk tersedia dari pupuk langsung diubah kedalam bentuk tidak terlarut dan pemanfaatan pupuk menjadi kurang efektif (Omar 1998). Upaya untuk mengatasi masalah ini adalah dengan pemanfaatan mikroorganisme pelarut fosfat melalui pembuatan pupuk organik hayati (bio”organic”fertilizer).
Bakteri pelarut fosfat (BPF) merupakan kelompok mikroorganisme tanah yang mempunyai kemampuan melarutkan P yang terfiksasi dalam tanah dan mengubahnya menjadi bentuk tersedia sehingga dapat diserap oleh tanaman. Pelarutan fosfat disebabkan oleh adanya sekresi asam organik bakteri tersebut seperti asam formiat, asetat, propionat, laktat, glikolat, fumarat, tartarat, ketobutirat, suksinat dan sitrat (Rao 1994). Menurut Lestari (1994), proses utama pelarutan senyawa fosfat sukar larut adalah produksi asam organik oleh mikroorganisme dan sebagian asam anorganik yang dapat berinteraksi dengan senyawa P sukar larut serta melarutkan fosfor dari komplek Al-P, Fe-P, Mn-P dan Ca-P. Bentuk P yang dapat diserapkan oleh tanaman dan merupakan hasil pelarutan P adalah H2PO4- dan jumlahnya dalam larutan tanah akan bertambah (Ma’ashum et al. 2003). Bakteri pelarut fosfat seperti Pseudomonas, Bacillus, Escherichia, Actinomycetes hampir dapat diisolasi dari dalam tanah dan mampu melarutkan fosfat. Menurut Hilda (2000) dari beberapa strain bakteri ternyata genus Pseudomonas dan Bacillus mempunyai kemampuan yang tinggi dalam melarutkan fosfat.
Bakteri Selulolitik
Mikroorganisme perombak bahan organik memegang peranan penting karena sisa organik yang telah mati diurai menjadi unsur yang dikembalikan ke dalam tanah (N, P, K, Ca, Mg, dan lain-lain) sebagai hara yang dapat digunakan kembali oleh tanaman. Pada umumnya mempunyai kemampuan yang lebih baik dibanding bakteri dalam mengurai sisa-sisa tanaman (hemiselulosa, selulosa, dan lignin). Umumnya mikroorganismea yang mampu mendegradasi selulosa juga mampu mendegradasi hemiselulosa (Alexander 1977).
Bakteri selulolitik mensintesis seperangkat enzim kompleks selulase yang mampu menghidrolisis selulosa (Ibrahim&El-diwany 2007). Mikroorganisme perombak selulosa seperti Trichoderma reesei, T. harzianum, T. koningii, Phanerochaeta crysosporium, Cellulomonas, Pseudomonas, Thermospora, Aspergillus niger, A. terreus, Penicillium, dan Streptomyces dapat dijadikan sebagai pupuk hayati bagi tanaman.
4
glukosa (2C). CMC-ase merupakan salah satu komponen kompleks enzim selulase yang menyerang secara acak bagian dalam struktur selulosa. Aktivitas CMC-ase koloni fungi selulolitik pada media CMC-agar membentuk zona bening di bawah dan sekitar koloni (Ericson1996).
Setiap bakteri selulolitik menghasilkan kompleks enzim selulase yang berbeda-beda, tergantung dari gen yang dimiliki dan sumber karbon yang digunakan. Aktivitas enzim dipengaruhi oleh pH karena sifat ionik gugus karboksil dan gugus amino mudah dipengaruhi oleh pH. Perubahan pH atau pH yang tidak sesuai akan menyebabkan daerah katalitik dan konformasi enzim berubah. Selain itu, perubahan pH juga menyebabkan denaturasi enzim dan mengakibatkan hilangnya aktivitas enzim (Girinda 1993).
Azospirillum
Kurang lebih 80% kandungan udara adalah N. Namun, N di udara tersebut ditambat oleh mikroorganisme dan terlebih dahulu diubah bentuknya agar langsung dimanfaatkan oleh tanaman untuk pertumbuhannya. Azospirillum dapat meningkatkan efisiensi penyerapan nitrogen dari udara dan menurunkan kehilangan akibat pencucian, denitrifikasi atau bentuk kehilangan lain. Infeksi yang disebabkan oleh Azospirillum tidak menyebabkan perubahan morfologi perakaran, meningkatkan jumlah rambut akar, menyebabkan percabangan akar lebih berperan dalam penyerapan hara. Azosprillum mempunyai potensi cukup besar untuk dikembangkan sebagai pupuk organik hayati. Azospirillum bersifat mikroaerofilik sehingga dapat dipisahkan di media semi padat yang mengandung malat. Bakteri ini merupakan bagian dari bakteri gram negatif dan mengandung granula poli-β-hidroksi butirat. Azosprillum mampu memfiksasi nitrogen, hal ini telah diverifikasi melalui uji reduksi asetilen dan pengambilan gas 15N2 yang dapat diukur dengan menggunakan metode Kjeldahl. Bakteri ini mampu menghasilkan zat pengatur tumbuh tanaman seperti IAA, auksin dan giberelin (Rao 1994)
Menurut Anas (1997), terdapat dua spesies Azospirillum yang sudah diusulkan yaitu A.lipoferum dan A.brasilense. A.lipoferum mampu menggunakan glukosa sebagai sumber C untuk tumbuhnya pada medium bebas N yang mengandung biotin. Sel berukuran 1.4 – 1.7 µm pada media malat semia padat bebas Nitogen (N). A.brasiense, tidak mampu menggunakan glukosa sebagai sumber C untuk tumbuh pada media semi padat yang bebas Nitrogen. Ukuran sel 10 µm, pendek, viroid, mobil, bentuk S dapat terjadi bila sudah tua.
Interaksi Antar Mikroorganisme
5 mutualistik ataupun protokooperatif. Bentuk interaksi kebalikannya, dikenal dengan pola kehidupan antagonistik, dimana satu mikroorganisme merugikan mikroorganisme lain. Pengaruh antagonistik berbagai mikroorganismeia dalam kehidupan dan perkembangannya di dalam tanah berlangsung sebagai akibat dari perubahan ketersediaan nutrisi, perubahan faktor lingkungan dan ketergantungan hidup mikroorganisme tertentu atas yang lain (Ma’ashum et al 2003).
Persaingan dalam memperoleh nutrisi, sebagaimana yang terjadi antara bakteri dan fungi merupakan contoh umum dari pengaruh antagonistik dalam pola hidup kompetisi, seperti inokulum yang diintrodusir ke dalam tanah (Azospirillum) dengan strain strain Azospirillum yang terdapat di dalam tanah. Pengaruh antagonistik diantara tipe mikroorganismeia akibat perubahan lingkungan dapat dicontohkan dengan dihasilkannya senyawa spesifik oleh mikroorganisme tertentu yang bersifat toksik bagi mikroorganisme lain (Ma’ashum et al 2003).
Hasil Penelitian Penggunaan Bakteri Berpotensi
Menurut Maman dan Dibyo (2013), inokulasi mikroorganisme pelarut fosfat yang dikombinasikan dengan pemberian NPK mampu meningkatkan tinggi tanaman dan bobot biomassa benih kakao sampai umur 12 MSP. Selain itu, inokulasi BPF seperti Pseudomonas mampu meningkatkan pertumbuhan tanaman gandum, jagung, kapas (Egarmberdiyeva et al. 2006). Pemberian pupuk hayati dan batuan fosfat alam (BFA) meningkatkan kandungan P tersedia tanah dan P total. Terdapat pengaruh interaksi antara BFA dan pupuk hayati terhadap nilai pH tanah. Interaksi optimal untuk meningkatkan pH tanah terdapat pada aras 800 kg BFA per ha dan 200 liter pupuk organik hayati per hektar (Maryanto dan Ismangil 2010).
6
METODELOGI
Waktu dan Tempat
Penelitian ini dilakukan antara bulan Desember 2013 hingga Agustus 2014. Penelitian dilakukan di Laboratorium Bioteknologi Tanah dan Laboratorium Kimia dan Kesuburan Tanah Departemen Ilmu Tanah, Fakultas Pertanian, Institut Pertanian Bogor. Sampel tanah diambil dari tiga lokasi Provinsi Jambi yaitu Sungai Banir, Bangko Kuning dan Sepintun.
Bahan
Sampel tanah yang sudah dikering udarakan. Selanjutnya dibutuhkan media pikovskaya, Carboxil Methyl Cellulose (CMC) 1%, Nitrogen Free Bromtimol (NFB), Luria Bertani (LB), Nutrient Agar (NA), Nutrient Broth (NB), Blood Agar. Larutan fisiologis (LF) 0.85% NaCl, benih jagung manis varietas SD3 IPB. Selanjutnya diperlukan juga bahan kimia untuk keperluan analisis kimia tanah dan seleksi mikroorganisme.
Alat
Alat yang digunakan dalam penelitian ini antara lain berbagai macam peralatan gelas (cawan petri, erlenmeyer, tabung reaksi) autoklaf, refrigenerator, ruang laminar, UV Spectrophotometer merk Shimazu, pH meter, oven, inkubator, jarum oose, eksikator, Shaker, alat Kjeldahl, buret.
Prosedur Percobaan
Isolasi dan Pemurnian
Isolasi mikroorganisme tanah. Sebanyak sepuluh gram tanah dimasukkan ke dalam 90 ml larutan fisiologis. Selanjutnya diencerkan secara seri sampai tingkat pengenceran 105. Pada tingkat pengenceran 10-3 dan 10-4 diambil sebanyak 1 ml suspensi dari masing-masing pengenceran kemudian dimasukkan ke dalam cawan petri secara aseptis. Setelah itu, tuangkan media pikovskaya untuk isolasi BPF dan media CMC untuk isolasi BPS lalu ratakan dengan memutar media secara perlahan agar media homogen. Isolasi dan penghitungan bakteri Azospirillum dilakukan dengan menggunakan metode Most Probable Number (MPN) menggunakan 3 seri tabung yang terdiri dari 9 tabung reaksi yang berisi media semi solid NFB. Sebanyak 1 ml suspensi sampel tanah dari pengenceran 10-3 dimasukkan ke dalam tiap tabung pada seri tabung pertama, 1 ml pada seri tabung kedua, 1 ml pada seri tabung ketiga. Inkubasi selama 3 – 5 hari untuk BPF dan BPS dalam inkubator dan Azospirillum inkubasi selama selama 7 hari dalam kondisi suhu ruangan. Pengamatan BPF ditunjukkan dengan terbentuknya zona bening di sekeliling koloni. Isolat BPS ditunjukkan dengan adanya zona bening di sekeliling koloni setelah ditambahkan indikator Congo Red (CR) 0.1%. Isolat Azospirillum ditunjukkan dengan terbentuknya pellikel di media NFB.
7 Pemurnian. Hasil isolasi dipindahkan pada media yang sama dengan metode agar gores dua kuadran, kemudian diinkubasi selama 3 – 5 hari. Pemurnian dillakukan untuk mendapatkan biakan murni dengan mengambil koloni yang homogen dan terpisah lalu menggoreskan pada media selektif padat yang baru. Isolat murni yang didapat, ditumbuhkan pada media agar miring pikovskaya untuk BPF, CMC untuk BPS, dan NA untuk Azospirillum dan isolat yang tumbuh di media agar miring atau dapat disebut stock culture, di pindahkan ke dalam lemari pendingin (refrigenerator) pada suhu 50C untuk keperluan selanjutnya dengan penyimpanan yang lebih lama.
Penamaan Isolat
Untuk memudahkan penamaan dipergunakan singkatan nama lokasi dan jenis bakteri yang diisolasi. Penamaan kode isolat tersaji pada Tabel 1.
Tabel 1. Penamaan sampel tanah yang diisolasi
Lokasi Sumber Isolat Kode Isolat BPF Kode Isolat BPS Kode Isolat Azospirillum
Bangko Kuning BPF1 BPS1 AZ1
Sepintun BPF2 BPS2 AZ2
Sungai Banir BPF3 BPS3 AZ3
Seleksi Isolat
Setelah isolasi dilakukan seleksi untuk memperoleh dua isolat terbaik dari BPF, BPS dan Azospirillum.
a. Seleksi bakteri pelarut fosfat (BPF)
Isolat dalam stock culture diremajakan terlebih dahulu dalam media pikovskaya. Seleksi BPF dilakukan dua tahap yaitu uji kualitatif dan uji kuantitatif.
Uji kualitatif. Isolat hasil peremajaan ditumbuhkan pada media pikovskaya. Hal ini dilakukan untuk mengetahui pelarutan (Ca3(PO)4)2 oleh BPF yang dicirikan dengan terbentuknya zona bening di sekeliling koloni. Kemudian, ditetapkan nilai Indeks Pelarutan (IP). Iluastrasi penetapan uji kualitatif tersaji pada Gambar 1 (Windi 2012).
Uji kuantitatif. Isolat BPF hasil peremajaan ditumbuhkan dalam 50 ml medium pikovskaya cair steril dan dikocok menggunakan shaker pada kecepatan 50 rpm secara berkala selama 7 hari. Setelah masa inkubasi berakhir, dilakukan penyaringan medium menggunakan kertas saring. Hasil penyaringan digunakan untuk menententukan kandungan P terlarut dengan metode Olsen (Mukhlis 2007).
b. Seleksi bakteri perombak selulosa (BPS)
8
c. Seleksi Azospirillum
Seleksi dilakukan dengan menggunakan metode Kjeldahl untuk mengetahui jumlah Nitrogen (N) yang mampu ditambat oleh Azospirillum. Hasil peremajaan ditumbuhkan dalam media NFB cair steril sebanyak 50 ml. Kemudian, dikocok menggunakan shaker pada kecepatan 50 rpm secara berkala selama 7 hari. Setelah masa inkubasi selesai, dilakukan penyaringan. Pipet hasil penyaringan sebanyak 5 ml dan masukkan ke dalam tabung destruksi. Tambahkan H2SO4 5 ml, selenium, dan parafin cair. Kemudian destruksi selama 30 menit. Hasil destruksi dimasukkan ke dalam tabung destilasi. Tambahkan aquades 100 ml dan NaOH 50% sebanyak 50 ml. Proses destilasi hasilnya ditampung asam borat (H3BO3) yang sudah ditambah indikator Conway. Hasil akhirnya diperoleh dengan melakukan titrasi dari hasil destilasi. Titrasi dihentikan ketika warna yang semula berwarna hijau berubah menjadi warna merah muda. Dilakukan perhitungan %N-total yang mampu ditambat oleh Azospirillum.
Uji Antagonisme Antar Mikroorganisme
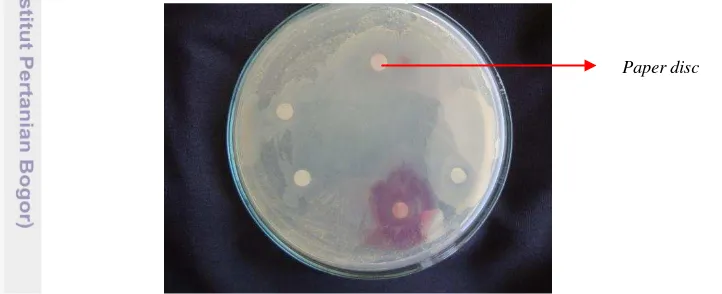
Persiapan isolat dilakukan dengan melakukan peremajaan isolat yang akan diuji dari stock culture menggunakan media pikovskaya untuk BPF dan media CMC untuk BPS dan Azospirillum media Nutrient Broth (NB), kemudian shaker selama 48 jam. Hasil pertumbuhan bakteri tersebut dinamakan larutan uji. Hasil peremajaan isolat, digoreskan kembali ke media NA menggunakan cotton swab. Lalu paper disc dimasukkan ke dalam larutan uji (isolat 2) dan diletakkan ke media NA yang sudah digoreskan isolat dengan cotton swab (isolat 1). Kemudian, inkubasi pada suhu 350 C. Sebagai contoh isolat AZ2 yang digorekan pada media NA, maka isolat BPF2, BPF1, BPS2 sebagai isolat 2 yang dicelupan dalam larutan uji. Reaksi positif antagonis akan terlihat dengan adanya zona bening di sekitar paper disc. Pengamatan dilakukan setelah masa inkubasi selama 72 jam. Ilustrasi penetapan uji antagonis tersaji pada Gambar 2 (Sari 2014).
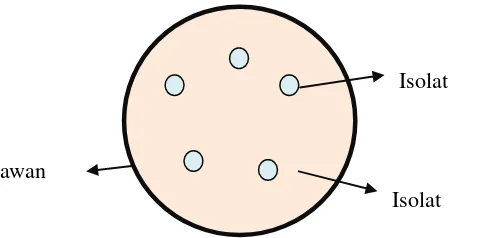
Gambar 1. Ilustrasi Penetapan Indeks Pelarutan (IP) (a)diameter koloni, (b)diameter zona bening
9
Isolat
Cawan
Isolat
Gambar 2. Ilustrasi uji antagonis antar mikroorganisme
Uji Hipersensitivitas
Pengujian ini dilakukan untuk melihat potensi bakteri sebagai patogen pada tanaman. Hasil peremajaan, lalu dipindahkan ke dalam media LB dan dikocok selama 24 jam. Inokulasi pada daun tanaman tembakau menggunakan syringe tanpa jarum sebanyak 1 ml tanpa meninggalkan luka pada daun tanaman dan dikeringanginkan. Setiap strain diinokulasikan pada daun yang berbeda. Pengamatan dilakukan selama 48 jam setelah penyuntikkan. Kontrol negatif dalam pengujian ini dilakukan dengan menggunakan aquades steril.
Uji Aktivitas Hemolitik
Pengujian ini dilakukan untuk menguji patogenitas terhadap hewan dan manusia. Kultur isolat ditumbuhkan pada media Blood Agar yang telah dicampur dengan darah domba 5%, dan inkubasi selama 24 - 48 jam pada suhu ruang. Isolat yang mampu menghemolisis sel darah merah ditandai dengan terbentuknya zona bening di sekeliling koloni yang menunjukkan bahwa isolat tersebut berpotensi menyebabkan patogen terhadap hewan dan manusia.
HASIL DAN PEMBAHASAN
Isolasi dan Pemurnian
Berdasarkan hasil isolasi tiga lokasi diperoleh 55 isolat BPF, 35 isolat BPS, dan 40 isolat Azospirillum. Hasil isolasi tersaji pada Tabel 2. Isolat tersebut dipilih secara visual berdasarkan karakteristik yang terbentuk dari masing – masing koloni bakteri.
Tabel 2 Hasil isolasi BPF, BPS, dan Azospirillum dari tiga lokasi pengambilan contoh tanah
Sampel Tanah Jumlah Isolat Bakteri
BPF BPS Azospirillum
Bangko Kuning 11 8 20
Sepintun 19 15 12
Sungai Banir 25 12 18
10
BPF ditunjukkan dengan terbentuknya zona bening di sekeliling koloni. Isolat BPS ditunjukkan dengan adanya zona bening di sekeliling koloni setelah ditambahkan indikator Congo Red (CR) 0.1%. Isolat Azospirillum ditunjukkan dengan terbentuknya pellikel di media NFB.
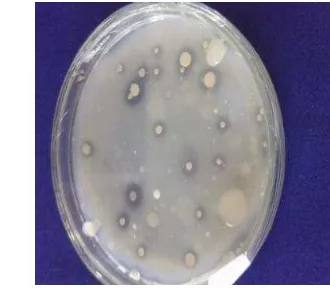
BPF dengan jumlah isolat 55, selanjutnya ditumbuhkan kembali dalam media pikovskaya dan dipilih secara visual berdasarkan zona bening yang terbentuk di sekeliling koloni bakteri seperti yang terlihat pada Gambar 3. Setiap bakteri memiliki kemampuan yang berbeda – beda dalam melarutkan fosfat dalam bentuk (Ca3(PO)4)2 di dalam media. Dari 55 isolat yang ditumbuhkan kembali dalam media pikovskaya 10 diantaranya tidak tumbuh, 13 diantaranya tidak dapat dilihat kemampuannya karena terkontaminasi.
BPS dengan jumlah 35, selanjutnya ditumbuhkan kembali dalam media CMC dan dipilih secara visual berdasarkan zona bening yang terbentuk setelah ditambahkan indikator Congo Red, seperti yang terlihat pada Gambar 4. Dari 35 isolat yang ditumbukan kembali dalam media CMC, 7 diantaranya terkontaminasi dan 7 diantaranya tidak tumbuh.
Azospirillum dengan jumlah isolat 40, selanjutnya ditumbuhkan kembali dalam media NFB dan dipilih berdasarkan pellikel yang terbaik yang terbentuk di media NFB. Dari 40 isolat yag ditumbuhkan kembali pada media NFB, 2 diantaranya tidak tumbuh, 8 diantaranya pellikel tidak utuh, dan 3 diantaranya terkontaminasi.
Gambar 3 Contoh koloni bakteri isolat bakteri pelarut fosfat
11
Selanjutnya dilakukan proses pemurnian (purification). Pemurnian dilakukan sebanyak 2-3 kali sampai diperoleh koloni tunggal sesuai yang diharapkan tanpa adanya kontaminan. Hasil proses pemurnian diperoleh 22 isolat BPF, 18 isolat BPS, dan 20 isolat Azospirillum. Hasil pemurnian tersebut selanjutnya akan dilakukan seleksi sesuai dengan karakteristik bakteri.
Seleksi Bakteri Pelarut Fosfat
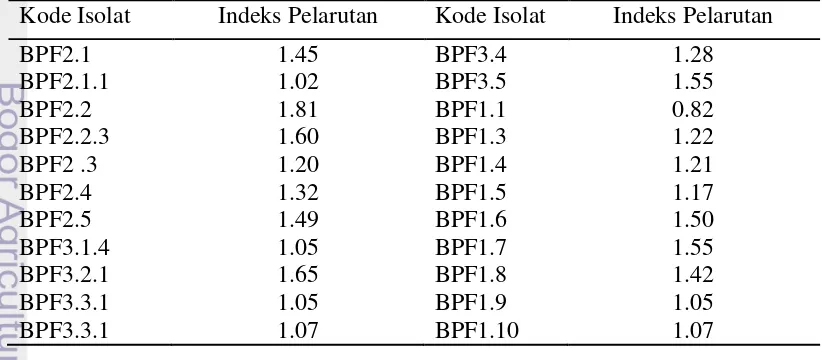
Sebanyak 22 isolat bakteri pelarut fosfat (BPF) diperoleh dari hasil isolasi dan pemurnian. Kemudian isolat tersebut akan diseleksi dengan dua tahap yaitu uji kualitatif dan uji kuantitatif. Tahap pertama yaitu uji kualitatif dilakukan dengan menentukan Indeks Pelarutan (IP) yang dibentuk oleh BPF. Indeks pelarutan merupakan perbandingan antara diameter zona bening dengan diameter koloni bakteri. Zona bening (holozone) yang terbentuk di sekeliling koloni karena mikroorganismea pelarut fosfat mampu mensekresikan asam – asam organik yang dapat mengubah P yang tidak larut menjadi larut (Gonggo dan Yuni 2006). Hasil uji kualitatif tersaji pada Tabel 3.
Tabel 3 Hasil uji kualitatif BPF berdasarkan nilai indeks pelarutan
Kode Isolat Indeks Pelarutan Kode Isolat Indeks Pelarutan
BPF2.1 1.45 BPF3.4 1.28
BPF2.1.1 1.02 BPF3.5 1.55
BPF2.2 1.81 BPF1.1 0.82
BPF2.2.3 1.60 BPF1.3 1.22
BPF2 .3 1.20 BPF1.4 1.21
BPF2.4 1.32 BPF1.5 1.17
BPF2.5 1.49 BPF1.6 1.50
BPF3.1.4 1.05 BPF1.7 1.55
BPF3.2.1 1.65 BPF1.8 1.42
BPF3.3.1 1.05 BPF1.9 1.05
BPF3.3.1 1.07 BPF1.10 1.07
Berdasarkan Tabel 3 menunjukkan bahwa nilai IP tertinggi adalah isolat BPF2.2 dengan nilai IP 1.81. Hal tersebut menunjukkan bahwa isolat BPF2.2
12
mampu melarutkan fosfat yang berasal dari (Ca3(PO4)2) lebih tinggi dibandingkan dengan bakteri lain dalam media dengan sumber P yang sama. Sedangkan bakteri yang memiliki nilai IP terendah adalah BPF1.1 dengan nilai IP 0.82.
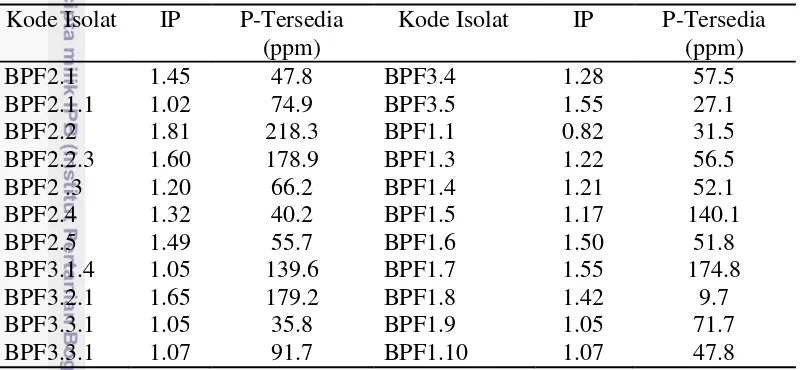
Tahap kedua seleksi BPF adalah uji kuantitatif. Pengujian ini perlu dilakukan dalam tahap penyeleksian kemampuan BPF dalam melarutkan fosfat agar lebih tepat dan akurat. Menurut Isroi (2008), pengujian secara kuantitatif lebih sensitif daripada pengujian dengan indeks pelarutan fosfat. Oleh karena itu, uji kuantitatif penting dilakukan untuk mendapatkan dua isolat BPF yang terbaik memiliki nilai IP tertinggi dan daya larut P tertinggi. Hasil uji kualitatif dan uji kuantitatif BPF disajikan pada Tabel 4.
Tabel 4 Hasil uji kualitatif dan uji kuantitatif bakteri pelarut fosfat Kode Isolat IP P-Tersedia
(ppm)
Kode Isolat IP P-Tersedia (ppm)
BPF2.1 1.45 47.8 BPF3.4 1.28 57.5
BPF2.1.1 1.02 74.9 BPF3.5 1.55 27.1
BPF2.2 1.81 218.3 BPF1.1 0.82 31.5
BPF2.2.3 1.60 178.9 BPF1.3 1.22 56.5
BPF2 .3 1.20 66.2 BPF1.4 1.21 52.1
BPF2.4 1.32 40.2 BPF1.5 1.17 140.1
BPF2.5 1.49 55.7 BPF1.6 1.50 51.8
BPF3.1.4 1.05 139.6 BPF1.7 1.55 174.8
BPF3.2.1 1.65 179.2 BPF1.8 1.42 9.7
BPF3.3.1 1.05 35.8 BPF1.9 1.05 71.7
BPF3.3.1 1.07 91.7 BPF1.10 1.07 47.8
Tabel 4 menunjukkan bahwa isolat BPF yang secara kualitatif memiliki nilai IP tinggi, tidak selalu berbanding lurus dengan kemampuan BPF dalam melarutkan P dalam media cair (uji kuantitatif). Isolat BPF yang memiliki nilai IP tertinggi dan daya larut P paling tinggi adalah isolat BPF2.2 dengan P-larut 218.3 ppm. Hal ini menunjukkan isolat tersebut memiliki daya larut P tertinggi dengan sumber fosfat berasal dari (Ca3(PO4)2) dibandingkan dengan BPF lain dalam media cair ataupun padat dengan sumber P yang sama. BPF yang memiliki daya larut P terendah adalah isolat BPF1.9 dengan P-larut 9.7 ppm dan nilai tersebut tidak berbanding lurus dengan nilai indeks pelarutan fosfat yang bernilai 1.42.
13 Secara umum, seluruh isolat yang diuji memiliki kemampuan melarutkan fosfat pada media pikovskaya dengan nilai yang lebih tinggi dibandingkan dengan kontrol (tanpa penambahan bakteri), dimana nilai P-tersedia dalam kontrol sebesar 1.0 ppm. Berdasarkan hasil penelitian didapatkan dua isolat terbaik yaitu isolat BPF2.2 dan isolat BPF3.2.1, kedua isolat BPF tersebut memiliki nilai IP paling tinggi dan berbanding lurus dengan daya larut P dalam media cair pikovskaya.
Seleksi Bakteri Perombak Selulosa
Hasil dari isolasi dan pemurnian diperoleh 18 isolat Bakteri Perombak Selulosa (BPS) yang berpotensi dalam merobak selulosa. Seleksi BPS terbaik dilakukan dengan menguji BPS menggunakan media agar spesifik Carboxy methyl cellulose (CMC). Pengujian dilakukan dengan melihat kemampuan BPS dalam mendegradasi selulosa pada media CMC. Hasil pengujian indeks selulolitik tersaji pada Tabel 5.
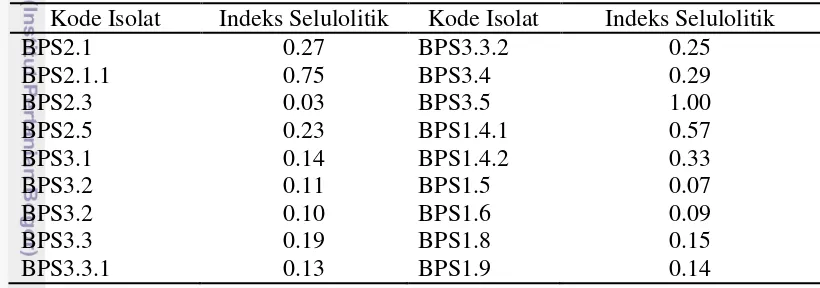
Tabel 5 Hasil uji kemampuan BPS berdasarkan nilai indeks selulolitik (IS) Kode Isolat Indeks Selulolitik Kode Isolat Indeks Selulolitik
BPS2.1 0.27 BPS3.3.2 0.25
BPS2.1.1 0.75 BPS3.4 0.29
BPS2.3 0.03 BPS3.5 1.00
BPS2.5 0.23 BPS1.4.1 0.57
BPS3.1 0.14 BPS1.4.2 0.33
BPS3.2 0.11 BPS1.5 0.07
BPS3.2 0.10 BPS1.6 0.09
BPS3.3 0.19 BPS1.8 0.15
BPS3.3.1 0.13 BPS1.9 0.14
Isolat yang mampu mendegradasi selulosa ditandai dengan adanya zona bening di sekitar koloni yang diperjelas dengan dengan menggunakan indikator Congo Red 0.1%. Tabel 5 menunjukkan bahwa dari hasil pengujian selulolitik dua isolat yang memiliki nilai IS paling tinggi adalah BPS2.1.1 yaitu 0.75 dan BPS3.5 yaitu 1.00. Isolat yang memiliki IS paling rendah adalah BPS3.1 yaitu 0.03.
14
Perbedaan nilai indeks selulolitik disebabkan karena jenis isolat yang berbeda yang memiliki kemampuan menghasilkan selulase yang berbeda pula dalam menghidrolisis substrat CMC. Menurut Goenadi et al (1993), bahwa bakteri memiliki kemampuan yang berbeda – beda dalam mendegradasi selulosa tergantung dari jenis strain bakteri tersebut. Zona bening yang terbentuk di sekeliling koloni BPS tersebut pada CMC menunjukkan adanya enzim endo-β -,4-glukanase (CMC-ase) yang dapat memutuskan ikatan β-1,4 pada serat selulosa tersebut secara acak dan semakin tinggi nisbah tersebut menunjukkan semakin tinggi aktivitas spesifik enzim selulasenya, khususnya enzim endo-β-,4-glukanase (Ma’ashum 2003). Berdasarkan hasil penelitian didapatkan dua isolat terbaik yaitu isolat BPS2.1.1 dan isolat BPS3.5 kedua isolat BPF tersebut mampu merombak selulosa lebih baik dibandingkan isolat lainnya.
Seleksi Azospirillum
Azospirillum merupakan bakteri yang mempunyai potensi cukup besar untuk dikembangkan sebagai pupuk hayati yang mampu memicu pertunbuhan tanaman. Hasil isolasi dan pemurnian diperoleh 20 isolat yang selanjutnya diuji dengan menggunakan metode Kjeldahl. Pengujian dilakukan untuk mendapatkan dua isolat Azospirillum terbaik, hasil pengujian disajikan pada Tabel 6.
15 yaitu isolat AZ2.4 dan isolat AZ3.2. Kedua isolat BPF tersebut mampu menambat N2 lebih baik dibandingkan dengan isolat lain.
Selanjutnya, enam bakteri berpotensi hasil seleksi diamati bentuk morfologi koloni dari masing – masing bakteri. Enam isolat bakteri tersebut akan dilakukan uji lebih lanjut untuk mendapatkan bakteri berpotensi yang dapat digunakan sebagai bio”organic”fertilizer.
Tabel 7 Hasil pengamatan karakteristik makroskopis bakteri berpotensi
Kode Isolat Bentuk koloni Warna koloni Tepian Elevasi
BPF2.1.1 Circular Putih susu Entire Convex
BPF3.2.1 Circular Putih
Kekuningan Bergelombang Convex
BPS3.5 Irreguler Transparan Entire Flat
BPS2.1.1 Circular Kuning Entire Convex
AZ3.2 Irreguler Kuning muda Bergelombang Flat
AZ2.4 Irreguler Putih Bergelombang Convex
Morofologi yang berbeda dapat menunjukkan strain bakteri yang berbeda. Isolat BPF2.1.1 memiliki bentuk koloni circular (bulat), dengan tepian entire (rata) dan elevasi convex (cembung) dan warna putih susu. Bentuk koloni isolat BPF2.1.1 berbeda dengan karakteristik BPF3.2.1, dimana terdapat perbedaan warna koloni putih kekuningan dengan bentuk koloni circular (bulat), tepian bergelombang dan elevasi convex (cembung). Isolat BPS3.5 memiliki bentuk Irreguler (tidak beraturan), dengan tepi entire (rata) dan elevasi datar (flat), serta berwarna transparan. Isolat BPS2.1.1 memiliki bentuk koloni circular (bulat), dengan tepi entire (rata) dan elevasi convex (cembung). Karakteristik Azospirillum dapat diamati dengan menggoreskan bakteri di media NFB agar. Koloni isolat AZ3.2 dan AZ2.4 memiliki bentuk koloni Irreguler (tidak beraturan), dengan tepian bergelombang. Namun, keduanya memiliki perbedaan pada karakteristik warna dan elevasi. Isolat AZ3.2 memiliki warna kuning muda dengan elevasi flat (datar), sedangkan isolat AZ2.4 memiliki warna putih dan elevasi convex (cembung). Perbedaan karakteristik tersebut sejalan dengan perbedaan kemampuan bakteri berpotensi pada saat pengujian, sehingga bakteri berpotensi digunakan sebagai pupuk organik hayati dengan strain yang bervariasi.
Uji Antagonisme Bakteri
16
Tabel 8 Hasil uji antagonisme bakteri berpotensi yang dikombinasikan secara in vitro
Keterangan: + menunjukkan sifat antagonis
Tabel 8 menunjukkan isolat BPS3.5 bersifat antagonis terhadap isolat BPF2.1.1 dan AZ3.2 namun, saat uji kebalikannya tidak bersifat antagonis. Kemudian isolat AZ3.2 bersifat antagonis terhadap BPS3.5, namun saat uji kebalikannya tidak terjadi sifat antagonis.
Sifat antagonis yang dilakukan menggunakan paper disc ditunjukkan dengan zona bening yang terbentuk di sekeliling paper disc dikarenakan salah satu bentuk mempertahankan diri dan tidak kompatibel dengan perkembangan bakteri lain bahkan cenderung menghambat pertumbuhan bakteri lain. Hal ini menunjukkan bahwa isolat BPS3.5 ketika akan dijadikan pupuk hayati majemuk, maka tidak dapat digabungkan dengan isolat BPF2.1.1 dan AZ3.2. Hubungan timbal balik yang antagonistik (berlawanan) yang sering terjadi diantara mikroorganismea tanah dapat disebabkan oleh berbagai hal, seperti nutrisi (Mulyani 1991).
Uji Hipersensitivitas
Setelah dilakukan uji antagonis antar bakteri, maka dilakukan pengujian terhadap daun tembakau untuk melihat reaksi hipersensitivitas terhadap tanaman. Hasil uji hipersensitivitas tersaji pada Gambar 9 dan 10.
Kode Isolat1
Kode isolat 2
BPF2.1.1 BPF3.2.1 BPS3.5 BPS2.1.1 AZ3.2 AZ2.4
BPF2.1.1 - - - - -
BPF3.2.1 - - - - -
BPS3.5 + - - + -
BPS2.1.1 - - - - -
AZ3.2 - - + - -
AZ2.4 - - - - -
Gambar 8 Contoh tahap pengujian antagonisme antar bakteri dalam satu cawan isolat 1 adalah BPF2.1.1
17
Uji hipersensitivitas dilakukan menggunakan tanaman tembakau karena tanaman ini merupakan tanaman model yang telah diketahui secara lengkap sekuen gennya termasuk gen yang menyandikan resistensi tanaman, juga ruang di antara pembuluh daunnya lebar sehingga relatif mudah untuk menginfiltrasikan suspense isolat. Pada Gambar 9 menunjukkan bahwa isolat BPF2.1.1, BPF3.2.1, AZ2.4, AZ3.2A, yang diuji tidak menimbulkan atau gejala penyakit baik pada bagian yang inokulasi maupun bagian tanaman yang lain.
Pada gambar 10 menunjukkan bahwa BPS2.1.1, BPS3.5 yang diuji tidak menimbulkan atau gejala penyakit baik pada bagian yang inokulasi maupun bagian tanaman yang lain. Gejala negatif ditunjukkan dengan tidak adanya kerusakan jaringan daun tanaman atau tidak muncul gejala nekrosis di jaringan daun tanaman yang sudah diinokulasikan isolat bakteri. Hal ini menunjukkan bahwa bakteri yang diuji tidak termasuk dalam kelompok patogen terhadap tumbuhan. Sehingga keenam bakteri tersebut dapat dimanfaatkan lebih lanjut untuk pupuk organik hayati. Respon hipersensitif menurut Klement et al. (1990) diartikan sebagai reaksi pertahanan yang cepat dari tanaman menghadapi patogen yang disertai kematian sel yang cepat atau nekrosis jaringan di daerah yang diinjeksi dengan suspensi bakteri.
Uji Aktivitas Hemolitik
Agar darah domba (ADD) adalah media standar sebagai media pertumbuhan untuk mengidentifikasi jenis bakteri dan sebagai media untuk tes sensitivitas Gambar 9 Hasil uji hipersensitivitas terhadap tanaman tembakau menunjukkan
gejala negatif untuk semua isolat bakteri pelarut fosfat dan Azospirillum
18
antibiotik dari berbagai bakteri patogen (Abdat 2010). Hasil uji aktivitas hemolitik menggunakan media Blood agar tersaji pada Tabel 9.
Tabel 9 Hasil uji aktivitas hemolisis bakteri berpotensi
Kode Isolat Hari ke-
Keterangan: + menunjukkan gejala positif zona bening di sekeliling koloni
Tabel 9 menunjukkan bahwa pada pengamatan 24 jam, isolat yang menunjukkan gejala positif adalah BPS2.1.1. Pengamatan pada inkubasi 48 jam menunjukkan gejala positif pada isolat dengan kode BPS2.1.1 dan AZ3.2. Hal itu menunjukkan bahwa isolat tersebut mampu melisiskan darah yang terkandung dalam media blood agar dengan kandungan darah domba 5% karena terbentuknya zona bening di sekeliling koloni sehingga berpotensi patogen terhadap hewan. Hemolisis karena infeksi terjadi akibat respon inflamasi yang memproduksi sitokin proinflamasi, mengaktivasi komplemen, komponen komplemen C5-C9 membentuk MAC (membrane attack complex) menyebabkan cedera membran sel yang berakibat lisis sel.13 (Bauman 2007). Empat isolat lainnya menunjukkan gejala negatif atau tidak terbentuk adanya zona bening di sekeliling koloni. Hasil pengujian ini menunjukkan bahwa isolat BPS3.5, BPF2.1.1, BPF3.2.1, dan AZ2.4 aman jika digunakan sebagai bio“organic”fertilizer.
Perhitungan Total Populasi Bakteri Berpotensi
Pengujian total populasi bakteri tersaji pada Tabel 10. Tabel 10 menunjukkan total populasi bakteri berpotensi yaitu BPF dengan total bakteri 8 x 107 CFU/ml untuk isolat BPF2.1.1, sedangkan total populasi BPF3.2.1 jumlah total bakteri 6 x 107 CFU/ml.
Tabel 10 Hasil uji total bakteri berpotensi pada inokulum cair
Kode Isolat Jumlah Sel (CFU/ml)
19
SIMPULAN DAN SARAN
Simpulan
1. Isolat BPF memiliki ciri – ciri zona bening yang terbentuk di sekeliliing koloni. Isolat BPS memiliki ciri – ciri zona bening di sekeliling koloni setelah ditanmbahkan indikator congo red. Isolat Azospirillum memiliki ciri – ciri terbentuknya pelikel.
2. Isolat BPF terbaik dengan nilai indeks pelarutan dan P-Larut tertinggi adalah isolat BPF3.2.1 dan BPF2.1.1. Isolat BPS terbaik dalam memproduksi selulosa dengan nilai indeks selulolitik tertinggi adalah isolat BPS2.1.1 dan BPS3.5. Isolat Azospirillum yang terbaik dan mampu memfiksasi N2 adalah isolat AZ3.2 dan AZ2.4.
3. Terjadi sifat antagonis antara BPS3.5 terhadap isolat BPF2.1.1 dan AZ3.2. Semua isolat tidak bersifat patogen terhadap tanaman. Namun, isolat AZ3.2 dan BPS2.1.1 berpotensi patogen terhadap hewan.
Saran
Perlu dilakukan uji efektivitas di lapangan atau rumah kaca untuk mengetahui lebih jauh pengaruh isolat terhadap pertumbuhan tanaman di tanah. Selain itu, perlu dilakukan uji lanjut terkait hormon yang mampu dihasilkan oleh empat isolat dan enzim yang dihasilkan mikroorganisme.
DAFTAR PUSTAKA
Abdat A. 2010. Pertumbuhan Streptocpccis pneumonia Pada Agar Darah Manusia dan Agar Darah Domba [skripsi]. Semang (ID): Universitas Diponogoro. Alexander M. 1977. Intoduction to soil Microbiology. New York (USA):
Academic Press.
Ahmad N, Jha KK. 1982. Effect Of Phosphate Solubilizer On Dry Matter Yield and Phosphorus Uptake By Soybean. J.Indian Soc.Soil.Sci. 30 : 105- Anwar K, Susilawati A. 2009. Penggunaan Fosfat Alam sebagai Pupuk Alternatif
untuk Meningkatkan Produksi Padi pada Tanah Masam di Kalimantan Selatan. Seminar Nasional Padi. 1: 917-928.
Agus C. 1997. Respirasi Tanah pada Lantai hutan mangium. Buletin Kehutanan. 2: 23-35.
Bauman R. 2007. Microbiology. With diseases by taxonomy. Edisi ke- 2. New York (USA): Pearson Ed. Publ. p 437-57.
20
Egamberdiyeva D, Jureiva D, Poberejskaya S, Myachina O, Teryuhova P, Seydalieva L, Aliev A. 2006. Improvement of Wheat and Cotton Growth and Nutrient Uptake by Phosphate Solubilizing Bacteria. 26th Southern Conservation. Tillage Conference. 58 – 66.
Eriksson KEL, Blanchette RA, Ander P. 1989. Microbial and Enzymatic Degradation of Wood and Wood Components. Springer- Verlag Heildeberg. New York.
FAO. 1988. Soil and Plant Analysis. FAO Soil Billetin 38(1). Roma. 241p
Gholami A, Shahsavani S, Nezrat S. 2009. The Effect of Plant Growth Promoting Rhizobacteria (PGPR) on Germination, Seedling Growth and Yield of Maize. Proceedings of World Academy of Science, Engineerring and Technology. Vol.3(7). P : 2070-3740.
Gillman GP.1983. Nutrient Availability in Acid Soils of the Tropics Following Clearing and Cultivation. Proceesings of the International Workshop on Soils. Research to resolve selected problems of soils in the tropics. Townsville, Queensland Australia. 12-16-September. 189p.
Girindra. 1993. Biokimia I. Jakarta (ID): PT Gramedia Pustaka p. 91-113.
Goenadi DH, Saraswati R, Lestari Y. 1993. Kemampuan Melarutkan Fosfat dari Berbagai Isolat Bakteri Asal Tanah dan Pupuk Kandang Sapi. Menara Perkebunan 61 (2): 44-49.
Gonggo H, Yuni I. 2006. Peran pupuk N dan P terhadap Serapan N, Efisiensi N dan Hasil Tanaman Jahe di Bawah Tegakan Tanaman Karet. Jurnal Ilmu-Ilmu Pertanian Indonesia. Volume 8 (1) : 61-68.
Hasibuan BE, Ritonga MD. 1981. Ilmu Tanah Umum. Fakultas Pertanian USU. Medan.
Hardman and Gunsolus. 1998. Corn growth and development. Extension Service. University of Minesota. p.5
Herman M, Pranowo D. 2013. Pengaruh Mikroorganismea Pelarut Fosfat Terhadap Pertumbuhan Dan Serapan Hara P Benih Kakao (Theobroma cacao L.). Buletin RISTRI 4(2): 129 – 138.
Hilda R, Faga R. 2000. Phosphate solubilizing bacteria and their role in plant growth promotion. Departement of Microbiology, Cuban Research Institute On Sugarcane By-Products (ICIDCA), P.O.Box 4026, CP 11000, Havana, Cuba. http://www.molecular-plant-biotechnology. Diakses tanggal 4 Agustus 2014.
Ibrahim ASS, El-diwany AL. 2007. Isolation and idrentification of new cellulases producing thermophilic bacteria from an Egyptian hot spring and some properties of the crudge enxyme. J Appl Sci 1:473 – 478.
Ismail F. 2013. Pengaruh Pupuk Fosfor Terhadap Pertumbuhan Jagung Hibrida di Kelurahan Dulomo Utara Kecamatan Kota Utara Kota Gorontalo. [Skripsi]. Gorontalo(ID): Fakultas Pertanian.
Kefalogianni I, Anggelis G. 2002. Modelling growth and biochemical activities of Azospirillum spp. Appl. Microbiol Biotechnol. 58 :352-357.
Lee C. 2007. Corn growth and development. www.uky.edu/ag/grain crops.
21 Lestari P. 1994. Pengaruh Fungi Pelarut Fosfat terhadap Serapan Hara P dan Pertumbuhan Tanaman Jagung (Zea Mays L). [Skripsi].Bogor.Fakultas Pertanian, Institut Pertanian Bogor.
Klement Z, Rudolph K, Sands DC. 1990. Methods in Phytobacteriology. Akademiai Kiodo. Bundapest
Ma’ashum mansur, Soedarsono joedoro, Susilowati endang. 2003. Biologi Tanah. Jakarta (ID): CPIU Pasca IAEUP.
Maryanto J, Ismangil. 2010. Pengaruh Pupuk Hayati dan Batuan Fosfat Alam Terhadap Ketersediaan Fosfor dan Pertumbuhan Stroberi pada Tanah Andisol. Jurnal Hortikultura Indonesia. Vol 1 (2): 66-73.
McWilliams, D.A., D.R. Berglund, and G.J. Endres. 1999. Corn growth and management quick guide.www.ag.ndsu.edu.
Menzuan, Handayani IP, Inoriah E. 2002. Penerapan Formulasi Pupuk Hayati Untuk Budidaya Padi Gogo: Studi Rumah Kaca. Jurnal Ilmu – Ilmu Pertanian Indonesia. Volume 4(1): 27 – 34.
Mukhlis. 2007. Analisis Tanah Tanaman. Medan (ID): USU Press.
Mulyani M, Kartasapoetra AG, Sastroatmodjo S. 1991. Mikroorganismeiologi Tanah. Jakarta (ID): Rineka Cipta.
Noor A. 2003. Pengaruh Fosfat Alam dan Kombinasi Bakteri Pelarut Fosfat dengan Pupuk Kandang terhadap P tersedia dan Pertumbuhan Kedelai pada Ultisol. Buletin Agronomi. 3 (3) : 100-106.
Nurmegawati W, Makruf E, Sugandi, D dan Rahman T. 2007. Tingkat kesuburan dan rekomendasi pemupukan N, P, dan K tanah sawah Kabupaten Bengkulu selatan. Balai Pengkajian Teknologi Pertanian. Bengkulu. Rahni NM. 2012. Efek Fitohormon PGPR Terhadap Pertumbuhan Tanaman
Jagung (Zea Mays). Jurnal Agribisnis dan Pengembangan Wilayah. Vol 3(2).
Rao NS, Subba. 1994. Mikroorganisme Tanah dan Pertumbuhan. Universitas Indonesia UI Press: Jakarta.
Sari Nurila K. 2014. Uji Efektivitas Bakteri Pemicu Tumbuh Tanaman Penyusun Pupuk Hayati Probio. [Skripsi]. Bogor (ID). Fakultas Pertanian, Institut Pertanian Bogor.
Sutanto, R. 2006. Penerapan Pertanian Organik (Pemasyarakatan dan Pengembangannya). Yogyakarta (ID): Penerbit Kanisius.
Sutopo L. 2002. Teknologi Benih. 5th Ed. Jakarta (ID): PT. Raja Grafindo Persada. Syafrudin, Nurhayati, Wati R. 2012. Pengaruh Jenis Pupuk Terhadap
Pertumbuhan dan Hasil Beberapa Varietas Jagung Manis. Jurnal Floratek. Vol 7: 107 – 114.
22
Widawati S, Suliasih. 2006. Populasi Bakteri Pelarut P (BPF) di Cikini, Gunung Botol dan Ciptarasa serta Kemampuannya dalam melarutkan P Terikat di Media Pikovskaya Padat. Jurnal Biodiversitas. 7 (2) : 109 - 113.
23
LAMPIRAN
Lampiran 1 Analisis Kesuburan tanah di Sepintun Jambi
Lampiran 2 Analisis Kesuburan Tanah di Sungai Banir Jambi
No. Parameter Kode Sampel
S1 S2 S3 S4 S5
1. pH tanah 3.89 4.01 4.55 4.60 4.35
2. Kada Air (%) 42.25 29.53 19.33 19.19 34.95
3. P (ppm) 20,19 23,63 21,98 22,28 23,18
4. C-Organik (%) 4.76 7.50 5.06 4.02 9.16
5. Nitrogen Total (%) 0.26 0.45 0.25 0.19 0.31
6. Basa - Basa Ca (me/100 g) 3,59 4,02 5,05 5,35 5,28
Mg (me/100 g) 0,63 0,86 0,92 0,98 1,30
K (me/100 g) 0,47 0,49 0,49 0,51 0,51
Na (me/100g) 0,38 0,45 0,46 0,47 0,47
7. KTK (me/100 g) 11,39 14,30 15,76 16,51 14,02
8. Kejenuhan Basa (%) 44,44 40,76 43,88 44,30 47,28
9. Tekstur Pasir (%) 10.08 9.74 29.53 44.34 20.21
Debu (%) 66.35 34.35 12.66 6.06 33.61
Liat (%) 23.56 55.91 57.82 49.60 46.18
No. Parameter Kode Sampel
SB1 SB2 SB3 SB4 SB5
1. pH tanah 4.46 4.31 4.09 4.21 4.68
2. Kada Air (%) 10.62 18.20 43.27 28.21 13.25
3. P (ppm) 21,98 23,48 18,99 23,18 20,49
4. C-Organik (%) 1.76 3.01 8.68 2.95 3.28
5. Nitrogen Total (%) 0.13 0.28 0.42 0.31 0.29
6. BaSa - BaSa Ca (me/100 g) 4,89 4,41 4,98 5,52 5,52
Mg (me/100 g) 1,28 0,99 1,08 1,27 1,27
K (me/100 g) 0,48 0,46 0,50 0,52 0,52
Na (me/100g) 0,41 0,37 0,42 0,45 0,45
7. KTK (me/100 g) 11,39 14,30 15,76 16,51 14,02
8. Kejenuhan BaSa (%) 44,44 40,76 43,88 44,30 47,28
9. Tekstur PaSir (%) 53.90 47.25 5.65 41.91 63.39
Debu (%) 11.44 11.72 25.71 30.94 15.51
24
Lampiran 3 Analisis Kesuburan Tanah di Bangko Kuning Jambi
Lampiran 4 Komposisi media pikovskaya (1000 ml)
Bahan Kimia Jumlah
Lampiran 5 Komposisi media CMC (1000 ml)
Bahan Kimia Jumlah
Indikator Congo Red untuk pewarnaan
25 Lampiran 6 Komposisi media NFB semi - padat (1000 ml)
Bahan Kimia Jumlah
Asam malat 5 g
K2HPO4 0.5 g
MgSO4.7H2O 0.2 g
NaCl 0.1 g
CaCL2. 2H2O 0.02 g
Larutan unsur mikro 2 ml
Bromtimol Blue 2 ml
Larutan vitamin 2 ml
Agar 1.75 g
Aquades 1000 ml
pH menjadi 6.8 dengan KOH
Lampiran 7 Komposisi media LB (1000 ml)
Bahan Kimia Jumlah
Nal 5 g
Tripton 10 g
Yeast extract 5 g
Aquades 1000 ml
Lampiran 8 Komposisi media NA (1000 ml)
Bahan Kimia Jumlah
Nutrient Agar 28 g
26
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 31 Maet 1992 dari pasangan Alm.Muhammad Amru dan Nurkholilah. Penulis adalah putri kelima dari lima bersaudara.
Pendidikan SMP diselesaikan di SMP Negeri 3 Bogor pada tahun 2007. Selanjutnya, tahun 2010 menyelesaikan pendidikan di SMA Kornita IPB Bogor dan pada tahun yang sama penulis lolos seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima sebagai mahasiswa Ilmu Tanah dan Sumberdaya Lahan (ITSL) Fakultas Pertanian.
ABSTRAK
RINA AMALIYAH. Isolasi dan Seleksi Bakteri Berpotensi Sebagai Pemicu Pertumbuhan Tanaman. Dibimbing oleh FAHRIZAL HAZRA dan ENNY WIDYATI.
Penelitian ini bertujuan untuk mendapatkan isolat bakteri berpotensi yaitu; bakteri pelarut fosfat (BPF), perombak selulosa (BPS), dan pemfiksasi N2 (Azospirillum). Tahapan penelitian meliputi isolasi dan pemurnian; seleksi BPF (uji kualitatif, kuantitatif), BPS (indeks selulolitik), Azospirillum (metode Kjeldahl); pengujian bakteri (uji antagonisme bakteri, uji hipersensitivitas, dan uji hemolitik). Hasil penelitian menunjukkan bahwa isolat BPF terbaik dengan nilai Indeks Pelarutan (IP) dan P-Larut tertinggi adalah isolat BPF3.2.1 dan BPF2.1.1. Isolat BPS terbaik dalam memproduksi selulose dengan nilai Indes Selulilitik (IS) tertinggi adalah isolat BPS2.1.1 dan BPS3.5. Isolat Azospirillum yang terbaik dan mampu memfiksasi N2 adalah isolat AZ3.2 dan AZ2.4. Terjadi sifat antagonis antara BPS3.5 terhadap isolat BPF2.1.1 dan AZ3.2. Semua isolat tidak bersifat patogen terhadap tanaman. Namun, isolat AZ3.2 dan BPS2.1.1 berpotensi patogen terhadap hewan.
Kata kunci: antagonistik, Azospirillum, BPF, BPS, patogenitas
ABSTRACT
RINA amaliyah. Isolation and Selection of Bacteria Trigger Potential For Plant Growth. Guided by Fahrizal Hazra and Enny Widyati.
This study aims to collect bacterial isolates potentially such as; solubilizing bacterial phosphate, cellulose decomposer, and N2 fixer (Azospirillum). Stages of research include the isolation and purification; Selection BPF (qualitative test, quantitative), CPM (cellulolytic index), Azospirillum (Kjeldahl method); bacterial testing (hypersensitivity test, hemolytic test, bacterial antagonism test). The results showed that the best BPF isolates with the biggest IP and the P-value was BPF3.2.1 and BPF2.1.1 isolates. The best isolates of best CPM in producing cellulose with highest is value was BPS2.1.1 and BPS3.5 isolates. The best Azospirillum isolates which able to fix N2 was AZ3.2 and AZ2.4 isolates. Isolates BPS3.5 BPF2.1.1 and AZ3.2 indicated to show have antagonistic when were grow in the same plate . All isolates were not pathogenic to plants. However, isolates AZ3.2 and BPS2.1.1 potentially pathogenic to animals.
PENDAHULUAN
Latar Belakang
Aktivitas mikroorganisme tanah dapat berguna bagi pertumbuhan tanaman dan mempengaruhi kesuburan tanah, karena mampu memperlancar siklus unsur hara dan menyuplai hormon serta enzim yang dibutuhkan tanaman (Agus 1997). Pupuk organik hayati bukan merupakan pupuk yang secara tidak langsung meningkatkan kesuburan tanah setelah ditambahkan ke dalam tanah. Pupuk organik hayati menambahkan nutrisi melalui proses alami, seperti fiksasi nitrogen di atmosfer, mengubah fosfor menjadi bahan yang terlarut, dan merangsang pertumbuhan tanaman melalui sintesis zat yang mampu memacu pertumbuhan tanaman (Chusnia et al. 2012).
Penggunaan pupuk organik hayati yang dikombinasikan dengan penggunaan pupuk kimia dapat memberikan pengaruh yang lebih besar dalam meningkatkan ketersediaan unsur hara di dalam tanah. Menurut Maryanto dan Ismangil (2010), pemberikan pupuk organik hayati yang dikombinasikan dengan batuan fosfat alam mampu meningkatkan P tersedia tanah dan P total serta pemberiannya dapat meningkatkan bobot kering tanaman dan tinggi tanaman.
Penelitian untuk mencari mikoorganisme tanah yang mampu meningkatkan ketersediaan unsur hara dalam tanah sangat diperlukan mengingat pemanfaatan mikroorganisme tesebut dapat menjadi salah satu alternatif untuk intensifikasi lahan pertanian. Namun, keberadaan bakteri berpotensi yang mampu meningkatkan pertumbuhan tanaman, terkadang belum seluruhnya disimpan dalam bentuk stock culture. Sehingga, terkadang ketika digunakan kembali kualitas bakteri mengalami penurunan. Maka dari itu, penelitian kali ini diawali dengan melakukan isolasi dari tanah. Penelitian ini menggunakan tiga jenis bakteri yang berpotensi dijadikan pupuk organik hayati, ketiganya ditentukan berdasarkan seleksi dan pengujian yang dilakukan secara in vitro. Bakteri berpotensi yang digunakan antara lain bakteri pelarut fosfat (BPF), perombak selulosa (BPS), dan pemfiksasi N2 (Azospirillum).
2
Tujuan Penelitian
Penelitian ini bertujuan untuk (1) Mendapatkan isolat BPF, BPS, dan Azospirillum. (2) Menyeleksi isolat BPF, BPS, dan Azospirillum. (3) Menguji antagonisme antar bakteri serta patogenitas bakteri terhadap tanaman dan hewan.
TINJAUAN PUSTAKA
Praktek Pertanian dan Kesuburan Tanah
Kegiatan pertanian konvensional secara umum hanya berorientasi pada hasil yang maksimal dengan memanfaatkan bahan kimia berupa pupuk secara terus
menerus. Pemupukan merupakan salah satu upaya untuk meningkatkan
ketersediaan unsur hara yang dibutuhkan oleh tanaman (Salikin 2003). Namun, penggunaan pupuk kimia secara terus menerus menyebabkan ekosistem biologi tanah tidak seimbang dan peranan pupuk tidak efektif untuk tanaman, karena terjadi residu zat pembawa (carrier) di dalam tanah (Sutanto 2006). Penilaian status kesuburan tanah biasanya didasarkan kandungan Nitrogen (N), Fosfor (P), dan Kalium(K), karena unsur makro ini dibutuhkan dalam jumlah banyak oleh tanaman (Gilman 1983). Selanjutnya ketersediaan unsur hara dipengaruhi oleh faktor tanah seperti; tekstur, kapasitas tukar kation, kandungan bahan organik, dan pH tanah (FAO 1988).
Dalam hal penyediaan dan penyerapan unsur hara bagi tanaman, aktivitas mikroorganisme diperlukan untuk menjaga ketersediaan tiga unsur hara yang penting bagi tanaman antara lain; nitrogen (N), fosfat (P), dan kalium (K). Menurut Sari (2010) nitrogen berfungsi meningkatkan pertumbuhan tanaman, menunjang pertumbuhan daun, meningkatkan kadar protein dalam tubuh tanaman, meningkatkan kualitas tanaman, dan daun tanaman berwarna lebih hijau. Kekurangan unsur N dapat menyebabkan khlorosis dimana daun muda berwarna kuning.
Unsur fosfat (P) adalah unsur esensial kedua setelah N yang berperan penting dalam fotosintesis dan perkembangan akar. Pemakaian pupuk fosfor hampir tidak kalah banyaknya dibandingkan dengan pemakaian pupuk nitrogen. Efisiensi pemakaian pupuk tersebut ditingkat petani sangat rendah. Petani cenderung memberi fosfat setiap musim tanam, tanpa mengetahui bahwa pupuk fosfat yang diberikan mampu memberi residu pada penanaman berikutnya (Anwar et al. 2009). Namun, jumlah P yang terfiksasi lebih besar dari pada yang hilang melalui panen (Ismail 2013). Pada tanah masam, P bersenyawa dalam bentuk-bentuk Al—P dan Fe—P, sedangkan pada tanah alkali (basa) P akan membentuk senyawa Ca—P dengan kalsium membentuk senyawa kompleks yang sukar larut (Simanungkalit et al. 2006).
2
Tujuan Penelitian
Penelitian ini bertujuan untuk (1) Mendapatkan isolat BPF, BPS, dan Azospirillum. (2) Menyeleksi isolat BPF, BPS, dan Azospirillum. (3) Menguji antagonisme antar bakteri serta patogenitas bakteri terhadap tanaman dan hewan.
TINJAUAN PUSTAKA
Praktek Pertanian dan Kesuburan Tanah
Kegiatan pertanian konvensional secara umum hanya berorientasi pada hasil yang maksimal dengan memanfaatkan bahan kimia berupa pupuk secara terus
menerus. Pemupukan merupakan salah satu upaya untuk meningkatkan
ketersediaan unsur hara yang dibutuhkan oleh tanaman (Salikin 2003). Namun, penggunaan pupuk kimia secara terus menerus menyebabkan ekosistem biologi tanah tidak seimbang dan peranan pupuk tidak efektif untuk tanaman, karena terjadi residu zat pembawa (carrier) di dalam tanah (Sutanto 2006). Penilaian status kesuburan tanah biasanya didasarkan kandungan Nitrogen (N), Fosfor (P), dan Kalium(K), karena unsur makro ini dibutuhkan dalam jumlah banyak oleh tanaman (Gilman 1983). Selanjutnya ketersediaan unsur hara dipengaruhi oleh faktor tanah seperti; tekstur, kapasitas tukar kation, kandungan bahan organik, dan pH tanah (FAO 1988).
Dalam hal penyediaan dan penyerapan unsur hara bagi tanaman, aktivitas mikroorganisme diperlukan untuk menjaga ketersediaan tiga unsur hara yang penting bagi tanaman antara lain; nitrogen (N), fosfat (P), dan kalium (K). Menurut Sari (2010) nitrogen berfungsi meningkatkan pertumbuhan tanaman, menunjang pertumbuhan daun, meningkatkan kadar protein dalam tubuh tanaman, meningkatkan kualitas tanaman, dan daun tanaman berwarna lebih hijau. Kekurangan unsur N dapat menyebabkan khlorosis dimana daun muda berwarna kuning.
Unsur fosfat (P) adalah unsur esensial kedua setelah N yang berperan penting dalam fotosintesis dan perkembangan akar. Pemakaian pupuk fosfor hampir tidak kalah banyaknya dibandingkan dengan pemakaian pupuk nitrogen. Efisiensi pemakaian pupuk tersebut ditingkat petani sangat rendah. Petani cenderung memberi fosfat setiap musim tanam, tanpa mengetahui bahwa pupuk fosfat yang diberikan mampu memberi residu pada penanaman berikutnya (Anwar et al. 2009). Namun, jumlah P yang terfiksasi lebih besar dari pada yang hilang melalui panen (Ismail 2013). Pada tanah masam, P bersenyawa dalam bentuk-bentuk Al—P dan Fe—P, sedangkan pada tanah alkali (basa) P akan membentuk senyawa Ca—P dengan kalsium membentuk senyawa kompleks yang sukar larut (Simanungkalit et al. 2006).
3 perombak selulolsa, dan bakteri pemfiksasi N2 (Azospirillum) menjadi hal penting untuk membantu ketersediaan hara di dalam tanah yang dibutuhkan tanaman.
Bakteri Pelarut Fosfat
Ketersediaan P dalam tanah jarang yang dapat melebihi 0.01 % dari total P dalam tanah. Hal tersebut disebabkan sebagian besar bentuk P terikat oleh koloid tanah sehingga tidak tersedia bagi tanaman yang disebabkan tingginya kemasaman tanah (Simanungkalit et al. 2006). Peningkatan ketersediaan fosfat bagi tanaman diusahakan dengan pengunaan pupuk fosfat anorganik maupun organik. Namun, sejumlah besar fosfat bentuk tersedia dari pupuk langsung diubah kedalam bentuk tidak terlarut dan pemanfaatan pupuk menjadi kurang efektif (Omar 1998). Upaya untuk mengatasi masalah ini adalah dengan pemanfaatan mikroorganisme pelarut fosfat melalui pembuatan pupuk organik hayati (bio”organic”fertilizer).
Bakteri pelarut fosfat (BPF) merupakan kelompok mikroorganisme tanah yang mempunyai kemampuan melarutkan P yang terfiksasi dalam tanah dan mengubahnya menjadi bentuk tersedia sehingga dapat diserap oleh tanaman. Pelarutan fosfat disebabkan oleh adanya sekresi asam organik bakteri tersebut seperti asam formiat, asetat, propionat, laktat, glikolat, fumarat, tartarat, ketobutirat, suksinat dan sitrat (Rao 1994). Menurut Lestari (1994), proses utama pelarutan senyawa fosfat sukar larut adalah produksi asam organik oleh mikroorganisme dan sebagian asam anorganik yang dapat berinteraksi dengan senyawa P sukar larut serta melarutkan fosfor dari komplek Al-P, Fe-P, Mn-P dan Ca-P. Bentuk P yang dapat diserapkan oleh tanaman dan merupakan hasil pelarutan P adalah H2PO4- dan jumlahnya dalam larutan tanah akan bertambah (Ma’ashum et al. 2003). Bakteri pelarut fosfat seperti Pseudomonas, Bacillus, Escherichia, Actinomycetes hampir dapat diisolasi dari dalam tanah dan mampu melarutkan fosfat. Menurut Hilda (2000) dari beberapa strain bakteri ternyata genus Pseudomonas dan Bacillus mempunyai kemampuan yang tinggi dalam melarutkan fosfat.
Bakteri Selulolitik
Mikroorganisme perombak bahan organik memegang peranan penting karena sisa organik yang telah mati diurai menjadi unsur yang dikembalikan ke dalam tanah (N, P, K, Ca, Mg, dan lain-lain) sebagai hara yang dapat digunakan kembali oleh tanaman. Pada umumnya mempunyai kemampuan yang lebih baik dibanding bakteri dalam mengurai sisa-sisa tanaman (hemiselulosa, selulosa, dan lignin). Umumnya mikroorganismea yang mampu mendegradasi selulosa juga mampu mendegradasi hemiselulosa (Alexander 1977).
Bakteri selulolitik mensintesis seperangkat enzim kompleks selulase yang mampu menghidrolisis selulosa (Ibrahim&El-diwany 2007). Mikroorganisme perombak selulosa seperti Trichoderma reesei, T. harzianum, T. koningii, Phanerochaeta crysosporium, Cellulomonas, Pseudomonas, Thermospora, Aspergillus niger, A. terreus, Penicillium, dan Streptomyces dapat dijadikan sebagai pupuk hayati bagi tanaman.