45 Gambar 1. Seledri yang akan dianalisis
Gambar 2. Air Demineral yang Gambar 3. Air Mineral yang
47 Gambar 4. Alat Spektrofotometri Sinar Tampak
1. Larutan Sampel + Asam Sulfanilat + NED -> Merah Ungu (+)
Gambar 5. Uji Kualitatif Nitrit dengan Larutan Sampel + Asam Sulfanilat + NED
Keterangan :
Sampel : Larutan sampel tanpa penambahan pereaksi
Baku : Larutan baku nitrit dengan penambahan pereaksi Asam Sulfanilat dengan N-(1-naftil) etilendiamin dihidroklorida Sampel 1 : Larutan sampel yang direbus dengan air mineral dan
demineral pada 2 menit
Sampel 2 : Larutan sampel yang direbus dengan air mineral dan demineral pada 4 menit
49
2. Larutan Sampel + H2SO4 (p) + KMnO4 -> warna KMnO4 hilang
Gambar 6. Uji kualitatif nitrit dengan Larutan Sampel + H2SO4 (p) + KMnO4
Larutan sampel + Zn + NaOH kemudian dipanaskan -> uap NH3 yang dapat membirukan lakmus merah (+)
a. Sampel yang direbus dengan b. Sampel yang direbus dengan air demineral selama 2 menit air demineral selama 4 menit
c. Sampel yang direbus dengan d. Sampel yang direbus dengan air demineral selama 6 menit air mineral selama 2 menit
51
Gambar 8. Uji Kualitatif Nitrat dengan Larutan sampel + Difenilamin + H2SO4 (p) Larutan sampel + Difenilamin + H2SO4 (p) -> biru (+)
a. Sampel yang direbus dengan b. Sampel yang direbus dengan air demineral selama 2 menit air mineral selama 2 menit
c. Sampel yang direbus dengan d. Sampel yang direbus dengan air demineral selama 4 menit air mineral selama 4 menit
e. Sampel yang direbus dengan f. Sampel yang direbus dengan air demineral selama 6 menit air mineral selama 6 menit
dipipet 4 mL
dimasukkan ke dalam labu tentukur 50 mL ditambahkan 2,5 mL asam sulfanilat, setelah lima menitditambahkan 2,5 mL N-(1-naftil) etilendiamin
dihidDemineralklorida dilarutkan dan
dicukupkan dengan air suling
diukur serapan pada
λ 540 nm setiap menit
selama 60 menit dipipet 4 mL
dimasukkan ke dalam labu tentukur 50 mL ditambahkan 2,5 mL asam sulfanilat, setelah lima menit ditambahkan 2,5 mLN-(1-naftil) etilendiamin
dihidDemineralklorida dilarutkan dan
dicukupkan dengan air suling
diukur serapan
maksimum pada λ 400 -800 nm
Kalibrasi Nitrit Baku Natrium Nitrit
ditimbang 100 mg
dimasukkan ke dalam labu tentukur 100 mL
dilarutkan dan dicukupkan dengan air suling sampai garis tanda
LIB I Nitrit (C = 10 μg/mL)
dipipet 1 mL
dimasukkan ke dalam labu tentukur 100 mL
dilarutkan dan dicukupkan dengan air suling sampai garis tanda
LIB II Nitrit (C = 10 μg/mL)
dipipetmasing-masing sebanyak 2,3,4,5, dan 6 mL
dimasukkan ke dalam labu tentukur 50 mL ditambahkan 2,5 mL asam sulfanilat, setelah lima menit
ditambahkan 2,5 mL N-(1-naftil) etilendiamin dihidDemineralklorida dilarutkan dan
dicukupkan dengan air suling
diukur masing-masing
serapan pada λ 540 nm
pada menit ke-12 dibuat kurva kalibrasi Waktu Kerja
Serapan Maksimum
53
Ditimbang ± 40 g yang telah di dipotong Dimasukkan kedalam panci stainless yang berisi air sebanyak 500 ml
Direbus selama 2 menit, 4 menit, dan 6 menit
ditimbang 10 g
dimasukkan ke dalam beaker glass 250 mL ditambahkan air suling panas (±80ºC) sampai volume 150 mL
diaduk hingga homogen
dipanaskan di atas penangas air hingga 15 menit sambil diaduk
didinginkan pada suhu kamar
dipindahkan secara kuantitatif ke dalam labu tentukur 250 mL
ditambahkan air suling sampai garis tanda dihomogenkan
disaring
dibuang 10 mL filtrat pertama Filtrat
Sampel
Sampel perebusan
Sampel perebusan
dipipet 10 ml
dimasukkan kedalam labu 50 ml
ditambahkan 2,5 m asam sulfanilat, dikocok, dan setelah lima menit ditambahkan 2,5 ml N-(1-naftil) etilendiamin dihidroklorida
dicukupkan dengan air suling sanpai garis tanda diukur serapan pada λ 540 nm pada menit ke-12
Nilai Absorbansi dihitung Kadar Nitrit
55 dihitung Sampel Perebusan
ditimbang 10 g
dimasukkan ke dalam beaker glass 250 ml ditambahkan air suling panas (±80ºC) sampai volume 150 ml
diaduk hingga homogen
dipanaskan di atas penangas air hingga 15 menit sambil diaduk
didinginkan pada suhu kamar
dipindahkan secara kuantitatif ke dalam labu tentukur 250 ml
ditambahkan air suling sampai garis tanda dihomogenkan
disaring
dibuang 10 ml filtrat pertama
dipipet 10 ml dan dimasukkan ke dalam labu tentukur 50 ml
ditambahkan sedikit logam Zn (1 g) dan didiamkan 10 menit
ditambahkan 2,5 ml asam sulfanilat, dikocok dan setelah lima menit ditambahkan 2,5 ml N-(1-naftil) etilendiamin dihidroklorida
dicukupkan dengan air suling
diukur serapan pada λ 540 nm pada menit ke-12 Nilai Absorbansi
Filtrat
Kadar Nitrat
dipipet sebanyak 50 ml
dimasukkan kedalam labu tentukur 250 ml
ditambahkan 1 ml asam sulfanilat, dikocok, dan setelah lima menit ditambahkan 1 ml N-(1-naftil) etilendiamin
dihidroklorida
dicukupkan dengan air suling sanpai garis tanda diukur serapan pada λ 540 nm pada menit ke-12
dihitung
dipipet sebanyak 50 ml
dimasukkan kedalam labu tentukur 250 ml
ditambahkan sedikit logam Zn (1 g) dan didiamkan 10 menit
ditambahkan 1 ml asam sulfanilat, dikocok, dan setelah lima menit ditambahkan 1 ml N-(1-naftil) etilendiamin dihidroklorida
dicukupkan dengan air suling sanpai garis tanda diukur serapan pada λ 540 nm pada menit ke-12
dihitung Sampel
Nilai Absorbansi
Kadar Nitrit
Sampel
Nilai Absorbansi
57
Gambar 9. Kurva Serapan Konsentrasi 0,8 µ g/mL
Gambar 10. Kurva Serapan Maksimum Nitrit Baku pada Panjang Gelombang 540 nm
59
47 0,4441
48 0,4443
49 0,4443
50 0,4443
51 0,4441
52 0,4443
53 0,4441
54 0,4443
55 0,4443
56 0,4441
57 0,4441
58 0,4440
59 0,4441
60 0,4441
Kalibrasi Serapan Nitrit pada Panjang Gelombang 540 nm No. Konsentrasi (μg/mL) (X) Absorbansi (Y)
1. 0,0000 0,000
Perhitungan Persamaan Regresi
61 Y�= aX�+b
b= Y�- aX�=(0,3778)-(0,5534)(0,666667) = 0,0089
Maka, persamaan garis regresi adalah Y = 0,5534 X + 0,0089 Perhitungan Koefisien Korelasi (r)
r = (∑XY)-(∑X)(∑Y)/n
��(∑X2)-(∑X)2/n��(∑Y2)-(∑Y)2/n�
r = (2,0278) – (4)(2,267) /6
��(3,6)-(4)2/6��1,1424-(2,267)2/6�
r = 0,5165 0,5165268
r = 0,99998
Maka, koefisien korelasi dari data kalibrasi serapan nitrit pada panjang gelombang 540 nm adalah 0,99998
Nitrat
Persamaan garis regresi adalah Y = 0,5534 X + 0,0089
No. X Y Yi Y-Yi (Y-Yi)2
1. 0,0000 0 0,0089 -0,0089 7,9210 x 10-5
2. 0,4000 0,237 0,2303 0,0067 2,2090 x 10-5 3. 0,6000 0,350 0,3410 0,0090 8,1000 x 10-5 4. 0,8000 0,458 0,4517 0,0063 3,969 x 10-5 5. 1,0000 0,557 0,5624 -0,0054 2,916 x 10-5 6. 1,2000 0,667 0,6730 -0,0060 3,6000 x 10-5
Σ(Y-Yi)2 2,8715 x 10-4
Simpangan Baku = �∑�Y-Yi�2 n-2 = �
2,8715 x 10-4
6-2 =0,00847μg/g = 0,00847 mg/kg Batas Deteksi = 3 ×SB
slope =
3 ×0,00847
0,5534 =0,0459μg/g = 0,0459 mg/kg Batas Kuantitas = 10 ×SB
slope =
10 × 0,00847
63 Berat sampel yang digunakan = 10,0120 g Absorbansi analisis nitrit (540 nm) = 0,1211
Persamaan regresi pada absorbansi maksimum dengan panjang gelombang
nitrit pada λ 540 nm: Y = 0,5534 X + 0,0089
Konsentrasi Nitrit : Y = 0,5534X + 0,0089
0,1211 = 0,5534X + 0,0089
X = 0,2027
Kadar Nitrit dalam sampel = X x V x Fp
Berat Sampel
X : kadar nitrit sesudah pengenceran (μg /mL)
V : volume larutan pengenceran (mL)
Fp : faktor pengenceran
Kadar Nitrit dalam sampel = 0,2027μg/mL x 250mL × 5 10,0120 g
= 25,3071 μg/g
= 25,3071 mg/kg
Dengan cara yang sama dapat dihitung kadar nitrit pada semua sampel.
Berat sampel yang digunakan = 10,0120 g Absorbansi analisis nitrit (540 nm) = 0,2982
Persamaan regresi pada absorbansi maksimum dengan panjang gelombang
nitrit pada λ 540 nm: Y = 0,5534 X + 0,0089
Konsentrasi Nitrit: Y = 0,5534 X + 0,0089
0,2982 = 0,5534 X + 0,0089
X = 0,5227
Kadar Nitrit dalam sampel = X x V x Fp Berat Sampel
X : kadar nitrit sesudah pengenceran (μg /mL)
V : volume larutan pengenceran (mL)
Fp : faktor pengenceran
Kadar Nitrit dalam sampel = 0,5227 μg/mL x 250 mL × 5 10,0120 g
= 65,2677 μg/g
= 65,2677 mg/kg
Kadar nitrit dari reduksi nitrat = Kadar total nitrit sesudah reduksi – Kadar nitrit sebelum reduksi
= 65,2677 mg/kg – 25,3071 mg/kg
65
Karena hasil pembacaan alat spekttrofotometer untuk nitrat adalah sebagai nitrit. Oleh sebab itu hasil pembacaan harus dikonfersikan.
NO2 NO3
=
MR MR
NO2 NO3
=
46 62
NO3
=
62 46NO3 = 1,3478NO2
Kadar nitrat = kadar nitrit dari reduksi nitrat x 1,3478 = 39,9606 mg/kg x 1,3478
= 53,8588 mg/kg
Dengan cara yang sama dapat dihitung kadar nitrit pada semua sampel.
No. Absorban JumLah Nitrit (μg/g) (X-X) (X-X)2
67
Kadar nitrit dalam Seledri pada 0 menit (Daun Segar)
μ = � ± (tα/2, dk) x SB/√n)
= 25,5784μg/g ± (4,0321 x 0,1738/√6)
= 25,5784 ± 0,2860 μg/g
No. Absorban Jumlah Nitrat (μg/g) (X-X) (X-X )2
69 Kadar Nitrat dalam Seledri pada 0 menit
μ = � ± (tα/2, dk) x SB/√n)
= 52,1771 μg/g ± (4,0321 x 1,2278/√6)
= 52,1771± 2,0210 μg/g
No. Absorban Jumlah Nitrit (μg/g) (X-X) (X-X )2
71
Kadar nitrit pada Seledri yang direbus dengan Air Mineral selama 2 menit
μ = � ± (tα/2, dk) x SB/√n)
= 21,3099μg/g ± (4,0321 x 0,1927/√6)
= 21,3099± 0,3172 μg/g
No. Absorban Jumlah Nitrit (μg/g) (X-X) (X-X )2
73
Kadar nitrit pada seledri yang direbus dengan Air Mineral selama 4 menit
μ = � ± (tα/2, dk) x SB/√n)
= 15,4132 μg/g ± (4,0321x 0,0849/√6)
= 15,4132 ± 0,1397 μg/g
No. Absorban Jumlah Nitrit (μg/g) (X-X) (X-X )2
75
Kadar nitrit pada Seledri yang direbus dengan Air Mineral selama 6 menit
μ = � ± (tα/2, dk) x SB/√n)
= 13,3912μg/g ± (4,0321x 0,3932/√6)
= 13,3912± 0,6472 μg/g
No. Absorban JumLah Nitrit (μg/g) (X-X) (X-X )2
Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1= 5, maka t(α/2,dk) = 4,0321.Data diterima jika t hitung < t tabel
77
Kadar nitrit pada seledri yang direbus dengan Air Demineral selama 2 menit
μ = � ± (tα/2, dk) x SB/√n)
= 15,4561 μg/g ± (4,0321x 0,5615/√6)
= 15,4561 ± 0,9242 μg/g
79
Kadar nitrit pada Seledri yang direbus dengan Air Demineral selama 4 menit:
μ = � ± (tα/2, dk) x SB/√n)
= 12,7626 μg/g ± (4,0321x 0,2471/6)
= 12,7626 ± 0,4067 μg/g
No. Absorban Jumlah Nitrat (μg/g) (X-X) (X-X )2
81
Kadar Nitrit pada Seledri yang direbus dengan Air Demineral selama 6 menit:
μ = � ± (tα/2, dk) x SB/√n)
= 11,8591 μg/g ± (4,0321x 0,0806/√6) = 11,8591 ± 0,1326 μg/g
No. Absorban Jumlah Nitrat (μg/g) (X-X) (X-X )2
83
Kadar nitrat pada Seledri yang direbus dengan Air Mineral selama 2 menit:
μ = � ± (tα/2, dk) x SB/√n)
= 32,7354 μg/g ± (4,0321 x 1,7312/√6) = 32,7354 ± 2,8497 μg/g
No. Absorban Jumlah Nitrat (μg/g) (X-X) (X-X )2
85
Kadar Nitrat pada Seledri yang direbus dengan Air Mineral selama 4 menit:
μ = � ± (tα/2, dk) x SB/√n)
= 24,7531 μg/g ± (4,0321x 0,8341/√6) = 24,7531 ± 1,3730 μg/g
87
Kadar nitrat pada Seledri yang direbus dengan Air Mineral selama 6 menit:
μ = � ± (tα/2, dk) x SB/√n)
= 22,2026 μg/g ± (4,0321 x 0,3294/√6)
= 22,2026± 0,5422 μg/g
No. Absorban Jumlah Nitrat
89
Kadar Nitrat pada Seledri yang direbus dengan Air Demineral selama 2 menit:
μ = � ± (tα/2, dk) x SB/√n)
= 31,0070 μg/g ± (4,0321 x 0,4781/√6)
= 31,0070 ± 0,7869 μg/g
No. Absorban Jumlah Nitrat
91
Kadar Nitrat pada Seledri yang direbus dengan Air Demineral selama 4 menit:
μ = � ± (tα/2, dk) x SB/√n)
= 25,4049 μg/g ± (4,0321 x 0,3108/√6)
= 25,4049± 0,5116 μg/g
Seledri yang direbus dengan Air Demineral selama 6 menit No. Absorban Jumlah Nitrat
93
Kadar Nitrat pada Seledri yang direbus dengan Air Demineral selama 6 menit:
μ = � ± (tα/2, dk) x SB/√n)
= 16,3490 μg/g ± (4,0321 x 0,9955/√6)
= 16,3490 ± 1,6386 μg/g
direbus dengan Air Demineral selama 6 menit 1. Hasil Analisis Nitrit Setelah Penambahan Larutan Standar Nitrit
Sampel
2. Hasil Analisis Nitrat Setelah Penambahan Larutan Standar Nitrat
95
dengan Menggunakan Seledri yang direbus dengan Air Demineral selama 6 menit
Volume sampel yang digunakan = 10 mL Absorbansi analisis (Y) :
Nitrit (540 nm) = 0,1075 Nitrat (540 nm) = 0,1771
Persamaan regresi pada panjang gelombang maksimum Nitrit dan Nitrat
(λ=540 nm) : Y = 0,5534 X + 0,0089
Konsentrasi Nitrit: Y = 0,5534 X + 0,0089 0,1075 = 0,5534 X + 0,0089
X = 0,1781
Konsentrasi Nitrat:Y = 0,5534 X + 0,0089 0,1771 = 0,5534 X + 0,0089
X = 0,3039
1. Perhitungan Uji PeDeminerallehan Kembali Nitrit Kadar = Konsentrasi nitrit (µg/mL)
Berat sampel(g) x volume (mL) x Faktor pengenceran = 0,1781 µg/mL × 250 mL × 5
10,1203 g
= 22,0067 µg/g (CF)
Kadar nitrit sampel sebelum ditambah larutan baku (CA) = 11,7366 µ g/g Kadar larutan baku yang ditambahkan (C*A)
C*A = Konsentrasi baku yang ditambahkan
Berat Sampel × mL yang ditambahkan = 10 µg/mL
10,1203 g× 10 mL = 9,8811 µg/g
= �22,0067-11,7366� µg/g
9,8811 µg/g × 100% = 103,93 %
2. Perhitungan Uji Perolehan Kembali Nitrat Kadar nitrit =Konsentrasi nitrat (µg/mL)
Berat sampel(g) x volume (mL)x Faktor pengenceran = 0,3039 µg/mL × 250 mL × 5
10,0243 g
= 37,9003 µg/g
Kadar nitrit dari reduksi nitrat = Kadar total nitrit sesudah reduksi – Kadar nitrit sebelum reduksi
= 37,9003 μg/g– 11,7366 μg/g
= 26,1637 μg/g
Karena hasil pembacaan alat spektrofotometer untuk nitrat adalah sebagai nitrit. Oleh sebab itu hasil pembacaan harus dikonfersikan.
NO2
Kadar nitrat = kadar nitrit dari reduksi nitrat x 1,3478
= 26,1637 μg/g x 1,3478 = 35,2634 µg/g (CF )
97 C*A = Konsentrasi baku yang ditambahkan
Berat sampel × mL yang ditambahkan = 100 µg/mL
10,0243 g × 2 mL = 19,9515 µg/g
Maka persen perolehan kembali nitrat = CF - CA CA*
× 100 %
=�35,2634-17,8297� µg/g
19,9515 µg/g × 100% = 87,58%
No. Persen PeDeminerallehan Kembali
(Xi) (Xi - X� ) (Xi - X� ) 2
1 103,93 1,46 2,1316
2 102,62 0,15 0,0225
3 102,85 0,38 0,1444
4 101,29 -1,18 1,3924
5 103,03 0,56 0,3136
6 101,12 -1,35 0,1225
X
�= 102,47 ∑ = 4,127
SD = �∑(Xi-X�)2 n-1
= �4,127 5
= 0,9085
RSD = SD
X�x 100% = 0,9085
99
Deviation, RSD) Persen Perolehan Kembali Nitrat
No. Persen Perolehan Kembali (Xi) (Xi - X� ) (Xi - X� )2
1 87,58 -6,23 38,8129
2 90,31 -3,5 12,2500
3 92,87 -0,94 0,88360
4 95,25 1,44 2,07360
5 97,96 4,15 17,2225
6 98,86 5,05 25,5025
X
�= 93,81 ∑ = 96,7451
SD = �∑(Xi-X�)2 n-1
= �96,7451 5
= 4,3987
RSD = SD
X�x 100% = 4,3987
93,81x 100%
= 4,68%
101 Nitrit dan Nitrat
1. Sampel seledri segar (0 menit)
2. Sampel yang direbus dengan Air Mineral
Nitrit Pada Daun Segar Nitrat Pada Daun Segar
Nitrit Dengan Perebusan Dengan Air Mineral Selama 2 menit
Nitrat Dengan Perebusan Dengan Air Mineral Selama 2 menit
Nitrit Dengan Perebusan Dengan Air Mineral Selama 4 menit
Nitrat Dengan Perebusan Dengan Air Mineral Selama 4 menit
3. Sampel yang direbus dengan Air Demineral
Nitrit Dengan Perebusan Dengan Air Demineral Selama 2 menit
Nitrat Dengan Perebusan Dengan Air Demineral Selama 2 menit
Nitrit Dengan Perebusan Dengan Air Demineral Selama 4 menit
103 Nitrit Dengan Perebusan Dengan Air
Demineral Selama 6 menit
Nitrat Dengan Perebusan Dengan Air Demineral Selama 6 menit
Gambar 12. Hasil Pembacaan Spektrofotometer Absorbansi dan Konsentrasi Nitrit dan Nitrat
105 Gambar 13. Hasil Identifikasi Tumbuhan
Anggreini, P. (2016). Pemeriksaan Kadar Nitrat dan Nitrit dalam Bayam (Amaranthus Hybridus) secara Spektrofotometri Sinar Tampak. Skripsi. Medan: Fakultas Farmasi USU. Halaman 5.
Benhard, A. (2010). The Nitrogen Cycle : Processes, Players, and Human Impact.
Nature Education Knowledge 2(2) : 12.
Bryan, N.S., dan Lancaster, J.R. (2011). Nitric Oxide Signaling in Health and Disease. Dalam: Bryan, N. S., dan Loscalzo, J. (2011). Nitrite and Nitrate in Human Health and Disease. Nutrition and Health. Halaman 169-170. Chen, M. (2008). Nitrate and Nitrite in Vegetables and Infant Feeding.Food
Safety Focus. Hongkong. Halaman 3.
Chou, S., Jen-Chien, C., dan Deng-Fwu, H. (2003). A High Performance Liquid Chromatography Method for Determining Nitrate and Nitrit Levels in Vegetables. Jurnal of Food and Drug Analysis. 11(3): 223 dan 227.
Chowdhury, A., dan Das, A. (2013). Nitrate Accumulation and Vegetable Quality.
International Journal of Science and Research. ISSN (online) :
2319-7064.
Corre,W.J., dan Breimer, T. (1979). Nitrate and Nitrite in vegetables. Dalam: Ziarati, P., dan Arbabi-Bidgoli, S. (2014). Investigation of Cooking Method on Nitrate and Nitrite Contents in Crops and Vegetables and Assess the Associatied Health Risk. IJPAES. ISSN 2231-4490.
Dias J.S. (2012). Nutritional quality and health benefits of vegetables: AReview. Food Nutrion Sci; 3:1354-1374.DOI: 10.4236/fns.2012.310179.
EFSA. (2008). Nitrate in Vegetables. Scientific Opinion of The Panel on Contaminants in The Food Chain.The EFSA Journal. 689 : 1-79.
Ermer, J., dan McB Miller, J.H. (2005). Method Validation in Pharmaceutical
Analysis. A Guide to Best Practice. Weinheim: Willey-VCH. Halaman
251-272.
Gandjar, I.G., dan Rohman, A. (2012). Analisis Obat Secara Spektrofotometri dan
Kromatografi. Yogyakarta: Pustaka Pelajar. Hal. 64 dan 92.
Harahap, Y.I. (2009). Penentuan Kadar Nitrit pada beberapa Air Sungai di Kota Medan dengan Metode Spektrofotometri (Visible). Ilmiah Karya. Medan: Fakultas Matematika dan Ilmu Pengetahuan Alam USU. Halaman 30.
42
Perhitungannya.Majalah Ilmu Kefarmasian. 1(3): 117 - 135. Herbarium Medanense. (2016). Hasil Identifikasi. Medan: FMIPA USU.
Hess, J. (2000). Meat and Meat products. Dalam: Horwitz, W. (2000). Official Methods of Analysis of AOAC International.Edisi XVII. Virginia : AOAC Inc. Halaman 8.
Hill, M.J. (1996). Nitrates and Nitrites from Food and Water in Relation to Human Disease. Dalam: Hill, M. (1996). Nitrates and Nitrites in Food
and Water. Cambridge: Woodhead Publishing Limited. Halaman 164.
Huarte-Mendicoa J.C., Astiasarán, I., dan Bello, J.(1997).Nitrate and nitrite levels
in fresh and frozen broccoli.Effectof freezing and cooking. Food
Chemistry;58(1-2):39–42.
Jaworska, G. (2005). Content of nitrates, nitrites, and oxalates in New Zealand spinach. Dalam: Özdestan, Ö dan Üren, A. (2011). Effects of Boiling Parameters on the Level of Nitrate, Nitrite and Colour Values of Wild Radish (Raphanus raphanistrum).GIDA 2011 36 (4): 193-200.
Jobgen, W.S., Jobgen, S.C., Li, H., Meininger, C.J., dan Wu, G. (2007). Analysis of Nitrate and Nitrite in Biological Samples Using High-Performance Liquid Chromatography. Jurnal of Chromatography B, 851 71-82.
Keeton, J.T., Osburn, W.N., Hardin, M.D., dan Bryan, N.S. (2009). A National Survey of the Nitrite/Nitrate Concentrations in Cured Meat Products and Non-meat Foods Available at Retail - NPB. Research Report Human
Nutrition. 08: 63.
Masfria., Muchlisyam., Nurmadjuzita., Nurbaya, S., Pardede, T.R., Dalimunte, C. A., Permata, Y.M. (2013). Buku Ajar Analisis Farmasi Kualitatif. Medan: USU Press. Halaman 34-35.
Matondang, N.S. (2015). Penentuan Kadar Nitrit dan Nitrat dalam Kornet Daging Sapi dan Daging Sapi Asap secara Spektrofotometri Sinar Tampak.
Skripsi. Medan: Fakultas Farmasi USU. Halaman 22.
Nejatzadeh-Barandozi, F.,dan Golami-Borujeni, F. (2013). Nitrate and nitrite in leek and spinach from Urmia district and their changes as affected by boiling. International Journal of Environmental Health Engineering.2013;2:46.
Özdestan, Ö dan Üren, A. (2011). Effects of Boiling Parameters on the Level of Nitrate, Nitrite and Colour Values of Wild Radish (Raphanus
raphanistrum).GIDA201136 (4): 193-200.
Kesehatan Republik Indonesia.
Pinem, L.J. (2007). Perbedaan Lingkungan dan Masa Tanam Seledri (Apium
graveolens L.) Terhadap Senyawa Bioaktif Apigenin. Skripsi. Bogor:
Program Studi Biokimia FMIPA IPB. Halaman 12.
Raczuk, J., Wadas, W., dan Glozak, K. (2014). Nitrates and Nitrites in Selected Vegetables Purchased at Supermarkets in Siedlce, Poland. Rocz Panstw
Zakl Hig 2014. 65(1): 16, 18-19.
Razaei, M., Fani, A., Moini, A.L., Mirzajani, P., Malekirad, A.A., dan Rafiei, M. (2014). Determining Nitrate and Nitrite Content in Beverages, Fruits, vegetables, and Stews Marketed in Arak, Iran. International Scholarly
Research Notices. Halaman 1-5.
Rohman, A. (2007). Kimia Farmasi Analisis.Yogyakarta:Pustaka Pelajar. Hal. 242.
Shokrzadeh, M., Shokravie, M., Ebadi A.G., Babaee, Z., dan Tarighati, A. The Measurement of Nitrate and Nitrite Content in Leek and Spinach Sampled from Central Cities of Mazandaran State of Iran. American-Eurasian
Journal Agriculture and Environment Science. 2 (2): 170.
Silalahi, J. (2005). Masalah Nitrit dan Nitrat dalam Makanan. Medika Jurnal
Kedokteran Indonesia. 31(7): 460 – 46.
Silalahi, J., Dalimunthe, C.A., dan Dewi, S.S. (2007). Pemeriksaan Kadar Nitrit dan Nitrat di Dalam Air Minum yang Berasal dari Sumur di Beberapa Daerah Sumatera Utara. Medika Jurnal Kedokteran Indonesia. Halaman 306-309.
SNI. (2006). Air Minum Dalam Kemasan.Standar Nasional Indonesia. SNI 01-3553-2006. Badan Standarisasi Nasional. Halaman 1.
Sudjana. (2005). Metode Statistika. Edisi VI. Bandung: Tarsito. Halaman 93, 168. Sun, J., Zhang, X., Broderick, M., dan Fein, H. (2003). Measurement of Nitric
Oxide Production in Biological Systems by Using Griess Reaction Assay.
Sensors, 3,276-284.
Svehla, G. (1979).Vogel’sTextbook Of Macro And Semimicro Qualitative Inorganic Analysis. Penerjemah: Setiono, L., dan Pudjaatmaka, A. H. (1985). Vogel: Buku Teks Analisis Anorganik Kualitatif Makro dan
Semimikro.Edisi V. Jakarta: PT. Kalman Media Pustaka.Halaman 332 dan
44
Nitrates and Nitrites In Foods and Water. Cambridge: Woodhead
Publishing Limited. Halaman 97, 101-105.
Watson, D. G. (1999). Pharmaceutical Analysis: A Textbook for Pharmacy
Students and Pharmaceutical Chemists. UK: University of Strathclyde,
Glaslow. Halaman 13.
WHO. (2011). Nitrate Nitrite in Drinking-Water. World Health Organization, 20 Avenu Appia, 1211 Geneva 27, Switzerland. Halaman 7-9.
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah metode penelitian eksperimental yaitu untuk mengetahui pengaruhlamanya waktu perebusan jenis air yang digunakan terhadap kandungan nitrat dan nitrit dalam seledri .
3.1 Lokasi dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kimia Farmasi Kualitatif, Fakultas Farmasi, Universitas Sumatera Utara pada Februari-April 2016.
3.2 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah satu unit alat spektrofotometer uv-vis (UV mini- 1240 Shimadzu) (Gambar alat dapat dilihat pada Lampiran 2 halaman 32), neraca analitik (Boeco Germany), penangas air, kertas saring, kertas perkamen, kertas lakmus, tissue, bola karet, spatula, termometer, plat tetes, tabung reaksi, penjepit tabung, batang pengaduk, lumpang dan alu serta alat-alat gelas sesuai dengan kebutuhan.
3.3 Bahan-bahan
18
Sampel yang digunakan dalam penelitian ini adalah Seledri atau yang biasa disebut dengan daun sop. Metode pengambilan sampel dilakukan dengan cara sampling purposif yang dikenal juga sebagai sampling pertimbangan, dimana sampel ditentukan atas dasar pertimbangan bahwa sampel yang diambil dapat mewakili populasi (Sudjana, 2005). Sampel diperoleh dari Pajak Sore Padang Bulan Medan.
3.5 Prosedur Penelitian
3.5.1 Pembuatan Pereaksi
Pereaksi yang digunakan dalam penelitian ini adalah larutan asam asetat 15% (v/v), larutan N-(1-naftil) etilendiamin dihidroklorida, dan larutan asam sulfanilat. Larutan asam asetat 15% (v/v) dibuat dengan cara diencerkan 75 mL asam asetat glasial dengan air suling dalam labu tentukur 500 mL (Hess, 2000; Matondang, 2015).
Larutan N-(1-naftil) etilendiamin dihidroklorida dibuat dengan cara dilarutkan 0,350 g N-(1-naftil) etilendiamin dihidroklorida di dalam 250 mL asam asetat 15% (v/v). Disaring dengan kertas saring dan disimpan dalam botol berwarna coklat (Hess, 2000; Matondang, 2015).
Larutan asam sulfanilat dibuat dengan dilarutkan 0,850 g asam sulfanilat di dalam 250 mL asam asetat 15% (v/v). Disaring dengan kertas saring dan disimpan dalam botol berwarna coklat (Hess, 2000; Matondang, 2015).
Diambil sebagian sampel yang telah dihaluskan kemudian dimasukkan dalam beaker glass, ditambahkan air suling secukupnya, dipanaskan di atas penangas air beberapa saat sambil diaduk-aduk, kemudian didinginkan dan disaring. Lalu dilakukan identifikasi yaitu:
1. Dimasukkan filtrat ke dalam plat tetes, ditambahkan larutan asam sulfanilat dan larutan NED akan terbentuk warna ungu merah (Svehla, 1985).
2. Dimasukkan filtrat kedalam tabung reaksi, ditambahkan 2 tetes H2SO4 pekat dan 1 tetes KMNO4 maka warna ungu dari KMNO4 akan hilang (Masfria, dkk., 2013).
3. Dimasukkan filtrat kedalam tabung reaksi, ditambahkan larutan difenil amin dalam H2SO4 pekat akan terbentuk warna biru (Masfria, dkk., 2013).
3.5.3 Identifikasi Nitrat
Diambil sebagian sampel yang telah dihaluskan kemudian dimasukkan dalam beaker glass, ditambahkan air suling secukupnya, dipanaskan di atas penangas air beberapa saat sambil diaduk-aduk, kemudian didinginkan dan disaring. Lalu dilakukan identifikasi yaitu:
1. Filtrat sampel dipanaskan dengan serbuk Zn dan NaOH akan terbentuk NH3, yang akan membirukan lakmus merah (Masfria, dkk., 2013).
20
Serbuk natrium nitrit sebanyak 100 mg dimasukkan ke dalam labu tentukur 100 mL dan dilarutkan dalam air suling, kemudian dicukupkan volumenya sampai garis tanda (C = 1000 μg/mL) (LIB I). Dipipet 1 mL LIB I dan dimasukkan ke dalam labu tentukur 100 mL kemudian diencerkan dengan air
suling sampai garis tanda (C = 10 μg/mL) (LIB II) (Matondang, 2015). 3.6 Penetapan Kadar Nitrit dan Nitrat
3.6.1 Penentuan Panjang Gelombang Maksimum Nitrit Baku
Dilakukan pemipetan sebanyak 4 mL LIB II nitrit dan dimasukkan ke dalam labu tentukur 50 mL, ditambahkan 2,5 mL pereaksi asam sulfanilat dan dikocok, setelah 5 menit, ditambahkan 2,5 mL pereaksi N-(1-naftil) etilendiamin dihidroklorida dan dicukupkan dengan air suling sampai garis tanda kemudian dihomogenkan, diukur serapan pada panjang gelombang 400 − 800 nm dengan
blanko air suling (C = 0,8 μg/mL). Kurva serapan selanjutnya digunakan untuk penentuan waktu kerja dan penentuan kadar nitrit dalam sampel (Matondang, 2015).
3.6.2 Penentuan Waktu Kerja Nitrit Baku
Dilakukan pemipetan LIB II nitrit sebanyak 4 mL dan dimasukkan ke dalam labu tentukur 50 mL, ditambahkan 2,5 mL pereaksi asam sulfanilat dan dikocok, setelah 5 menit, ditambahkan 2,5 mL pereaksi N-(1-naftil) etilendiamin dihidroklorida dan dicukupkan dengan air suling sampai garis tanda kemudian dihomogenkan, diukur serapan pada panjang gelombang 540 nm setiap menit
selama 60 menit dengan blanko air suling (C = 0,8 μg/mL). Waktu kerja
(Matondang, 2015).
3.6.3 Penentuan Kurva Kalibrasi Nitrit Baku
Dari LIB II dengan konsentrasi 10μg/mL, dipipet masing-masing sebanyak 2 mL, 3 mL, 4mL, 5 mL, dan 6 mL (0,4 μg/mL; 0,6 μg/mL; 0,8 μg/mL; 1,0 μg/mL; 1,2 μg/mL). Masing-masing dimasukkan kedalamlabu tentukur50 mL,kemudian ditambahkan 2,5 mL pereaksi asam sulfanilat dan dikocok. Setelah 5 menit, ditambahkan 2,5 mL pereaksi N-(1-naftil) etilendiamin dihidroklorida dan dicukupkan dengan air suling sampai garis tanda kemudian dihomogenkan. Diukur serapan pada menit ke-12 pada panjang gelombang 540 nm. Kurva kalibrasi selanjutnya digunakan untuk penentuan kadar nitrit dan nitrat dalam sampel (Hess, 2000; Matondang, 2015).
3.6.4 Proses Perebusan Seledri
Seledri segar (± 40 g) dimasukkan kedalam panci stainles. Direbus dengan 2 air yang berbeda yaitu air mineral dan demineral sebanyak 500 mL selama 2, 4 dan 6 menit.
3.6.5 Penentuan Kadar Nitrit dalam Seledri (Apium graveolens L.)
Penentuan kadar nitrit dalam sayur selada menurut Association Official
Methods Of Analytical Chemists (AOAC)edisi XVII, (2000). Sampel yang telah
22
10 mL filtrat dan dimasukkan ke dalam labu tentukur 50 mL, ditambahkan 2,5 mL pereaksi asam sulfanilat dan dikocok. Setelah 5 menit, ditambahkan 2,5 mL pereaksi N-(1-naftil) etilendiamin dihidroklorida dan dicukupkan dengan air suling sampai garis tanda kemudian dihomogenkan. Diukur serapan pada menit ke-12 dan panjang gelombang 540 nm (Hess, 2000; Matondang, 2015; Shokrzadeh,et al., 2007).
Kadar nitrit dalam sampel dapat dihitung dengan persamaan regresi Y = aX+b. Rumus perhitungan kadar nitrit:
K = X x V x Fp Berat Sampel (g)
Keterangan: Y = Absorban
K = Kadar nitrit dalam sampel (μg/g)
X = Kadar nitrit dalam larutan sampel sesudah pengenceran V = Volume larutan sampel sebelum pengenceran (mL) Fp = Faktor pengenceran
3.6.6 Penentuan Kadar Nitrat dalam Seledri (Apium graveolens L.)
Sampel yang telah dihaluskansebanyak 10 g dimasukkan ke dalam beaker
glass 250 mL. Kemudian ditambah air suling panas (± 80ºC) sampai volume 150
mL. Diaduk hingga homogen dengan batang pengaduk dan dipanaskan diatas penangas air selama 15 menit sambil diaduk. Didinginkan pada suhu kamar dan dipindahkan secara kuantitatif ke dalam labu tentukur 250 mL. Ditambahkan air suling sampai garis tanda, dihomogenkan dan disaring, filtrat pertama sekitar 10 mL dibuang. Dipipet 10 mL filtrat dan dimasukkan ke dalam labu tentukur 50 mL, ditambahkan sedikit logam Zn (1 g) didiamkan 10 menit, kemudian ditambahkan 2,5 mL pereaksi asam sulfanilat dan dikocok. Setelah 5 menit, ditambahkan 2,5 mL pereaksi N-(1-naftil) etilendiamin dihidroklorida dan
Diukur serapan pada menit ke-12 dan panjang gelombang 540 nm. Kadar nitrat dalam sampel dapat dihitung dengan persamaan regresi Y = aX+b (Hess, 2000; Matondang, 2015; Shokrzadeh,et al., 2007).
Rumus perhitungan kadar nitrat:
K = X x V x Fp Berat Sampel (g)
Keterangan: Y = Absorban
K = Kadar nitrat dalam sampel (μg/g)
X = Kadar nitrat dalam larutan sampel sesudah pengenceran V = volume larutan sampel sebelum pengenceran (mL) Fp = Faktor pengenceran
Kadar nitrit dari reduksi nitrat = Kadar total nitrit sesudah reduksi – Kadar nitrit sebelum reduksi.
Karena hasil pembacaan alat spektrofotometer untuk nitrat adalah sebagai nitrit, oleh sebab itu hasil pembacaan harus dikonfersikan.
Kadar nitrat = kadar nitrit dari reduksi nitrat x ��������
��������
3.6.7 Penentuan Kadar Nitrit dalam Air Mineral
24 dengan prosedur diatas.
3.6.8 Penentuan Kadar Nitrat dalam Air Mineral
Sampel sebanyak 50 ml dimasukkan kedalam labu tentukur 250 ml, ditambahkan sedikit logam Zn (1 g) didiamkan 10 menit, kemudian ditambahkan 1mL pereaksi asam sulfanilat dan dikocok. Setelah 5 menit, ditambahkan 1mL pereaksi N-(1-naftil) etilendiamin dihidroklorida dan dicukupkan dengan air suling sampai garis tanda kemudian dihomogenkan. Diukur serapan pada menit ke-12 dan panjang gelombang 540 nm.Rumus perhitungan kadar nitrit dalam air dapat dilihat pada prosedur 3.6.6. Kadar nitrat pada air demineral sebelum dan sesudah perebusan dilakukan sama dengan perebusan diatas.
3.7 Uji Validasi Metode Analisis 3.7.1 Uji Perolehan Kembali
Uji perolehan kembali nitrit dan nitrat dapat dilakukan dengan menambahkan larutan baku ke dalam sampel kemudian dianalisis dengan perlakuan yang sama pada sampel (prosedur 3.6.5 untuk nitrit dan prosedur 3.6.6 untuk nitrat). Larutan baku untuk nitrit ditambahkan sebanyak 10 mL dengan konsentrasi 10 μg/mL dan untuk nitrat sebanyak 2 mL dengan konsentrasi 100
μg/mL (Matondang,2015).
Menurut Harmita (2004) persen perolehan kembali dapat dihitung dengan rumus: % perolehan kembali = CF −CA
CA∗ × 100 % Keterangan:
CF = Konsentrasi analit dalam sampel setelah penambahan bahan baku CA = Konsentrasi analit dalam sampel sebelum penambahan bahan baku C*A = Konsentrasi bahan baku yang ditambahkan ke dalam sampel
Menurut Sudjana (2005) berdasarkan hasil perolehan kembali nitrit dan nitrat ditentukan standar deviasi nitrit dan nitrat. Untuk menghitung standar deviasi (SD) digunakan rumus:
SD = �∑(X−X�)2 n−1
Keterangan : X = Kadar kandungan zat dalam sampel
X
� = Kadar kandungan zat rata-rata sampel n = JumLah pengulangan
Berdasarkan nilai standar deviasi yang didapat, dihitung simpangan baku relatif nirit dan nitrat. Simpangan baku relatif dapat dihitung dengan rumus di bawah ini:
RSD =��
� x 100%
Keterangan: � = Kadar kandungan rata-rata zat dalam sampel SD = Standar deviasi
RSD =Relative Standard Deviation, Simpangan Baku Relatif
3.7.3 Penentuan Batas Deteksi dan Batas Kuantitas
Batas deteksi atau Limit of Detection (LOD) adalah jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko (Harmita, 2004).
Rumus perhitungan batas deteksi: ����/�
�����
Batas kuantitas atau limit of quantitation (LOQ) adalah kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004). Batas kuantitas dapat dihitung dengan rumus sebagai berikut:
Batas kuantitasi = 10���/�
26
Untuk menentukan apakah data diterima atau ditolak digunakanrumus: t hitung =� X−X�
SD /√n�
Dengan dasar penolakan apabila t hitung ≥ t tabel. Menurut Sudjana (2005) untuk mencari kadar sebenarnya dengan %, α 1/2 , dk = n-1, dapat digunakan rumus :
µ = X�± (t (α/2, dk) x SD/√n ) Keterangan : µ : kadar sebenarnya
X� : kadar analit dalam sampel SD : standar deviasi
dk : derajat kebebasan (dk = n-1)
t : harga t tabel sesuai dengan dk = n-1
α : tingkat kepercayaan n : jumlah pengulanga
HASIL DAN PEMBAHASAN
4.1 Identifikasi Nitrit dan Nitrat dalam Seledri
Uji kualitatif untuk nitrit telah dilakukan dengan berbagai pereaksi identifikasi yaitu dengan asam sulfanilat dan NED; H2SO4 (p) dan KMnO4 serta Difenilamin dan H2SO4 (p).Uji kualitatif untuk nitrat dilakukan dengan pereaksi identifikasi yaitu dengan Zn dan NaOH dan Difenilamin dan H2SO4 (p). Identifikasi nitrat dan nitrit dapat dilihat pada Tabel 4.1.
Tabel 4.1Identifikasi Nitrit dan Nitrat dalam Seledri
NO
28
yang berbeda, dimana semakin cerah intensitas warna yang dihasilkan maka semakin tinggi kadar nitrit yang diperoleh. Dari Tabel 4.1 juga dapat dilihat bahwa sampel seledri mengandung nitrat karena semua reaksinya positif. Gambar hasil identifikasi nitrit dan nitrat dalam seledri dapat dilihat pada Lampiran 3 dan 4halaman 47-49.
4.2 Kurva Serapan Nitrit
Panjang gelombang maksimum dipeoleh dengan cara membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi tertentu. Penentuan kurva serapan maksimum dilakukan pada panjang gelombang 400 − 800 nm (Rohman, 2007)). Pengukuran serapan
nitrit dilakukan pada konsentrasi 0,8 μg/mL. Kurva serapan nitrit pada konsentrasi
0,8 μg/mL dapat dilihat pada Gambar 4.1.
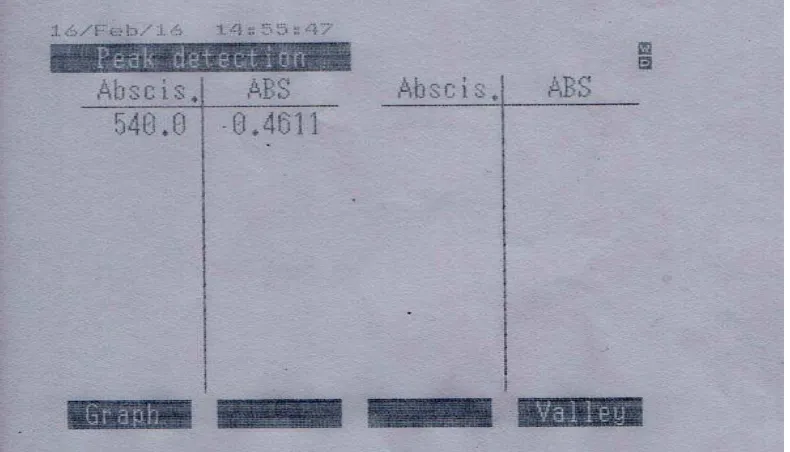
Gambar 4.1 Kurva Serapan nitrit pada konsentrasi 0,8 μg/mL
Berdasarkan Gambar 4.1, serapan nitrit adalah pada panjang gelombang 540 nm. Panjang gelombang tersebut sesuai dengan panjang gelombang nitrit
digunakanuntuk penentuan waktu kerja dan penentuan kadar nitrit maupun nitrat dalam sampel.
4.3 Waktu Kerja
Penentuan waktu kerja nitrit dilakukan untuk mengetahui waktu dimana senyawa tersebut memiliki nilai serapan paling stabil saat diukur dengan spektrofotometri sinar tampak (Rohman, 2007). Penentuan waktu kerja nitrit dilakukan pada konsentrasi 0,8 µg/mL diukur setiap menit selama 60 menit dimulai pada menit ke-3. Tabel waktu kerja dapat dilihat pada Lampiran 10 halaman 57. Kurva waktu kerja nitrit dapat dilihat pada Gambar 4.2.
Gambar 4.2 Kurva waktu kerja nitrit
Berdasarkan Gambar 4.2, diperoleh waktu yang paling stabil adalah menit ke-11 sampai menit ke-14 dengan konsentrasi 0,8 μg/mL dimana pada menit tersebut absorbansi stabil. Waktu kerja yang digunakan yaitu pada menit ke-12. Penentuan waktu kerja selanjutnya digunakan untuk penentuan kadar nitrit dan nitrat dalam sampel.
0,4420 0,4430 0,4440 0,4450 0,4460 0,4470 0,4480 0,4490
5 15 25 35 45 55
30 4.4.1 Kurva Kalibrasi
Kurva Kalibrasi adalah suatu seri larutan baku dari zat yang akan dianalisis dengan berbagai konsentrasi diukur, kemudian dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi (Gandjar dan Rohman, 2007). Bila hukum Lambert-Beer terpenuhi maka kurva kalibrasi ini
adalah 0,4 μg/mL; 0,6 μg/mL; 0,8 μg/mL; 1,0 μg/mL dan 1,2 μg/mL. Kurva kalibrasi nitrit dapat dilihat pada Gambar 4.3 dibawah ini.
Gambar 4.3 Kurva kalibrasi nitrit baku
Dari Gambar 4.3, diperoleh hubungan yang linier antara konsentrasi dengan absorbansi. Persamaan garis regresi yang diperoleh yaitu Y = 0,5534X + 0,0089 dengan koefisien korelasi (r) sebesar 0,9999. Nilai r > 0,99 menunjukkan adanya korelasi linier antara X dan Y (Watson, 1999).
Batas deteksi dan batas kuantitasi dapat dihitung dari persamaan regresi yang diperoleh dari kurva kalibrasi. Perhitungan batas deteksi dan batas kuantitasi tersebut dapat dilihat pada Lampiran 12 halaman61. Batas deteksi nitrit dan nitrat adalah 0,0459 mg/kgsedangkan batas kuantitasinitrit dan nitrat adalah0,1530 mg/kg.
Batas deteksi merupakan parameter uji batas yang dilakukan untuk mendeteksi jumlah terkecil analit dalam sampel yang masih memberikan respon signifikan dengan blanko sedangkan batas kuantitasi merupakan kuantitas terkecil analit yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
4.5Pengaruh Lama Perebusan dan Jenis Air yang digunakan Terhadap Kadar Nitrat dan Nitrit Dalam Seledri
32
yang direbus dengan Air Mineral dan Demineral No Sampel dan Cara
Gambar 4.4Grafik pengaruh perebusan dengan air mineral terhadap kadar nitrat dan nitrit dalam seledri
Gambar 4.5 Grafik pengaruh perebusan dengan air demineral terhadap kadar nitrat dan nitrit dalam seledri
Gambar 4.6 Grafik Pengaruh perebusan seledri dengan air mineral dan demineralterhadap kandungan nitrit
34
Gambar 4.7 Grafik Pengaruh perebusan seledri dengan air mineral dan demineral terhadap kandungan nitrat
Dari Tabel 4.2, Gambar 4.4, Gambar 4.5, Gambar 4.6, dan Gambar 4.7 dapat dilihat bahwa adanya perbedaan kadar nitrat dan nitrit dalam air perebusan yang berbeda dan pengaruh lamanya perebusan. Pada perebusan dengan air mineral, kadar nitrat akan menurun dengan bertambahnya waktu perebusan demikian juga pada nitrit. Namun, kadar nitrat penurunanya lebih besar sebanyak 24% dari menit ke-2 hingga menit yang ke-4 (dari 32,75 menjadi 24,75).
menit adalah 52,17 mg/kg dan 25,87 mg/kg (Lampiran 15) maka dengan pengaruh perebusan dapat menurunkan kadar nitrat dan nitrit. Dari data diatas juga dapat dilihat bahwa terdapat perbedaan kadar nitrat dan nitrit yang direbus dengan air demineral dan air mineral. Dimana, kadar nitrat dan nitrit pada air mineral lebih tinggi dibandingkan pada air demineral. Hal ini mungkin dipengaruhi oleh tidak adanya kandungan nitrat dan nitrit dalam air demineral, namun perbedaannya tidak begitu besar antara air mineral dan demineral .
Kadar nitrat dan nitrit pada air mineral sebelum perebusan telah analisisyaitu 10,88 mg/L dan 2,71 mg/L. Setelah perebusan kadar nitrat dan nitrit juga diukur yaitu 41,45 mg/L dan 14,16 mg/L. Pada air demineral tidak mengandung nitrat dan nitrit. Setelah perebusan kadar nitrat dan nitrit air demineral adalah 37,11 mg/L dan 11,48 mg/L. dari data ini dapat dilihat bahwa kadar nitrat dan nitrit dalam air perebusan kedua air tersebut meningkat disebabkan oleh larutnya nitrat dan nitrit didalam air rebusan tersebut.
36
nitrat lebih tinggi daripada kadar nitrit. Hal ini disebabkan karena lebih dari 90% nitrogen diserap tanaman dalam bentuk nitrat.Menurut Hill (1996) kadar nitrat pada seledri adalah 50-5300 mg/kg.
Proses perebusan memang cenderung menurunkan kadar nitrat karena nitrat larut dan mudah tercuci ke dalam air, tetapi perlu diperhatikan pada air rebusan sayuran karena kadar nitrat pada air rebusan akan meningkat. Hal ini penting untuk tidak menggunakan sayur air rebusan untuk digunakan dalam membuat makanan bayi, dan perlu diperhatikan untuk makanan seperti sup, mie kuah (Nejatzadeh-Barandozi dan Golami-Borujeni,2013).
Penggunaan nitrit perlu dibatasi karena nitrit dapat bereaksi dengan amin-amin primer dan sekunder membentuk nitrosamin-amine. Nitrit bereaksi dengan senyawa amin, khususnya amin sekunder membentuk senyawa nitroso yang bersifat karsinogenik. Nitrosamin terbentuk melalui reaksi kimia antara agen nitrosasi dan senyawa amin yang mudah dinitrosasi. Pada umumnya bahan baku pembentuk nitrosamin adalah amin sekunder dan tersier. Senyawa pembentuk nitrosamine adalah N2O3 yang mudah terbentuk dari nitrit dalam suasana asam (Silalahi,2005). Namun demikian, studi terbaru menunjukkan bahwa diet yang mengandung nitrat dan nitrit yang kaya sayuran bermanfaat bagi kesehatan karena konversi mereka untuk oksidasi nitrat mencegah penyakit jantung dan infeksi mikroba, mengurangi hipertensi, memberikan perlindungan lambung dan berfungsi sebagai bantuan gizi untuk menjaga jantung yang optimal kesehatan (Raczuk, et al., 2014).
vitamin yang terdapat dalam sayuran akan rusak oleh karena lamanya perebusan. Vitamin C yang terdapat didalam sayuran dapat menghambat sintesis nitrosamin dan menurunkan resiko methaemoglobinaemia (Raczuk, et al.,2014).
4.6 Uji Validasi
Parameter validasi yang diuji adalah akurasi (kecermatan), presisi (keseksamaan), batas deteksi dan batas kuantitasi. Akurasi dinyatakan dalam persen perolehan kembali (% recovery) yang ditentukan dengan menggunakan metode penambahan baku (standard addition method). Uji presisi dilakukan dengan menggunakan parameter Relative Standard Deviation (RSD) (Harmita, 2004).
4.6.1 Uji Akurasi
38
baku pada seledri yang direbus dengan Air Demineral selama 6 menit Kadar Nitrit Seledri pada
perebusan dengan Air Demineral selama 6
menit(µg/g)
Kadar Nitrat Seledri pada perebusan dengan Air Demineral selama 6 menit
(µg/g)
Berdasarkan tabel di atas diperoleh rata-rata persen perolehan kembali untuk nitrit dan nitrat adalah102,47% dan 93,81% secara berturut-turut. Contoh perhitungan dan hasil uji perolehan kembali kadar nitrit dan nitrat pada sampel seledri pada perebusan dengan air demineral selama 6 menit dapat dilihat pada Lampiran 26 dan 27. Persen perolehan kembali tersebut menunjukkan kecermatan atau akurasi yang baik pada saat pemeriksaan nitrit dan nitrat dalam sampel dengan metode perhitungan secara persamaan regresi. Hasil uji perolehan kembalitersebut memenuhi syarat akurasi yang telah ditetapkan, yaitu berada pada rentang 80% – 120% (Ermer dan McB Miller,2005).
40
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang dilakukan, maka dapat disimpulkan:
a. Terdapat pengaruh lamanya perebusan dan jenis air yang digunakan terhadap kandungan nitrat dan nitrit pada seledri, dimana kandungan nitrat dan nitrit semakin menurun dari menit ke-2 hingga menit ke-6 pada air mineral maupun air demineral .
b. Penurunan kadar nitrat dan nitrit dengan perebusan dengan air demineral lebih tinggi dibandingkan pada air mineral. Pada menit ke-6 kandungan nitrat dan nitrit yang terdapat pada seledri yang direbus dengan air demineral adalah 16,3490 mg/kg dan 11,8591 mg/kg sedangkan pada air mineral kandungan nitrat dan nitritnya adalah 22,2026 mg/kg dan 13,3912 mg/kg.
5.2 Saran
Disarankan kepada penelitian selanjutnya untuk meneliti kadar nitrat dan nitrit pada sayuran lainnya dengan metode yang berbeda.
TINJAUAN PUSTAKA 2.1 Siklus Nitrogen
Nitrogen merupakan komponen penting dari protein, materi genetik, klorofil, dan molekul organik penting lainnya. Semua organisme membutuhkan nitrogen untuk hidup. Meskipun nitrogen sangat berlimpah di atmosfer sebagai gas dinitrogen (N2), sebagian besar tidak dapat diakses oleh sebagian besar organisme. Hanya ketika nitrogen dikonversi dari gas dinitrogen menjadi amonia (NH3) menjadi tersedia untuk produsen utama, seperti tanaman (Bernhard, 2010). Siklus nitrogen dapat dilihat pada Gambar 2.1.
Sumber : Anggreini (2016)
6
Proses mengubah N2 menjadi NH3disebut fiksasi nitrogen. gas N2 adalah senyawa yang sangat stabil karena kekuatan ikatan rangkap tiga antara atom nitrogen, dan membutuhkan sejumlah besar energi untuk memecah ikatan ini. Seluruh proses membutuhkan delapan elektron dan setidaknya enam belas molekul ATP. Sebagian besar fiksasi nitrogen dilakukan oleh kelompok prokariota (Bernhard, 2010).
N
2+ 8 H
++ 8e
-2 NH
3+ H
2b. Amonifikasi
Ketika suatu organisme mengeluarkan limbah atau mati, nitrogen dalam jaringan adalah berupa nitrogen organik (asam amino misalnya, DNA). Berbagai jamur dan prokariota kemudian menguraikan jaringan dan melepaskan nitrogen anorganik kembali ke ekosistem sebagai amonia proses ini dikenal sebagai amonifikasi. Amonia tersebut kemudian digunakan untuk penyerapan oleh tanaman dan mikroorganisme lainnya untuk pertumbuhan (Bernhard, 2010).
c. Nitrifikasi
Nitrifikasi adalah proses yang mengubah amonia menjadi nitrit dan kemudian menjadi nitrat dan merupakan langkah penting dalam siklus nitrogen secara global.Ada dua langkah yang berbeda dari nitrifikasi yang dilakukan oleh jenis mikroorganisme yang berbeda. Langkah pertama adalah oksidasi amonia menjadi nitrit, yang dilakukan oleh mikroba yang dikenal sebagai amonia-oksidasi. oksidasi amonia aerobik mengkonversi amonia menjadi nitrit. Langkah kedua dalam nitrifikasi adalah oksidasi nitrit (NO2-) menjadi nitrat (NO3-).
Nitrobacter, Nitrococcus, dan Nitrospina (Bernhard, 2010; Hill, 1996). d. Asimilasi
Asimilasi merupakan proses pemanfaatan nitrat dalam proses fotosintesis. Asimilasi terjadi melalui penyerapan nitrogen dalam bentuk ion nitrat dan amonium dari dalam tanah oleh tanaman. Melalui suatu proses, senyawa ion nitrogen tersebut kemudian direaksikan hingga terbentuk berbagai unsur organik seperti asam amino, asam nukleat dan bahkan ada senyawa ion nitrogen yang di sisipkan ke dalam klorofil(Bernhard, 2010; Anggreini, 2016).
e. Denitrifikasi
Denitrifikasi adalah proses yang mengubah nitrat menjadi gas nitrogen kembali ke atmosfer. Gas dinitrogen (N2) adalah produk akhir utama dari denitrifikasi. Beberapa bakteri denitrifikasi termasuk spesies dari genus Bacillus, Paracoccus, dan Pseudomonas(Bernhard, 2010).
2.2Sumber nitrit dan nitrat dalam pangan
8
Konsentrasi nitrat dalam sayuran sangat bervariasi, mulai dari sekitar 1 untuk 10000mg / kg berat segar. Kandungan nitrat dalam sayuran sangat variatif, dapat dilihat pada Tabel 2.1. Kadar nitrat yang terbesar yaitu dengan kadar lebih besar dari 2500 mg/kg adalah bit, seledri, selada, bayam dan lobak (Walters, 1996).
Tabel 2.1 Rentang kadar nitrat dan dari berbagai sayuran
Jenis Sayur
Rentang Kadar Nitrat
(mg/kg)
Rentang Kadar
Nitrit (mg/kg) Kelas
Asparagus 3-700 0,2-0,9 1
Sumber: Walters, (1996); Keeton, et al.,(2009); Anggreini, (2016)
2.2.2 Air
Nitrat dalam air minum berasal dari berbagai sumber, dipengaruhi oleh aktivitas manusia dan begitu bervariasi antara daerah dan waktu. Faktor utama adalah curah hujan, limbah atau kotoran hewan, fiksasi biologis dalam tanah dan berbagai praktik pertanian (Hill, 1996). Konsentrasi nitrat dalam air biasanya rendah (0-18 mg/l), tetapi dapat mencapai tingkat tinggi akibat dari cemaran pertanian, kontaminasi dengan kotoran manusia atau hewan (WHO, 2011).
air minum, kadar nitrit dan nitrat maksimal adalah 3 mg/l dam 50 mg/l. 2.2.3 Pengawetan Daging
Nitrit dapat berfungsi sebagai pengawet dan pemberi warna cerah pada daging. Sebagai pengawet, nitrit mampu menghambat pertumbuhan beberapa bakteri, terutama Clostridium botulinum (Silalahi, 2005).
Berdasarkan Permenkes No. 722/Menkes/Per/IX/1988, batas maksimum penggunaan nitrit dan nitrat sebagai bahan tambahan pangan pada daging olahan dan daging awetan yaitu 125 mg/kg dan 50 mg/kg, sedangkan penggunaan nitrat pada daging olahan dan daging awetan memiliki batas maksimum yakni 500 mg/kg (Permenkes RI., 1988).
2.3 Faktor yang mempengaruhi kadar nitrit dan nitrat dalam sayuran
Faktor-faktor yang mempengaruhi penyerapan NO3 dan akumulasi dalam sayuran, yaitu faktor genetik, faktor lingkungan: kelembaban atmosfer, kadar air substrat, suhu,radiasi, penyinaran dan faktor pertanian: dosis nitrogen, ketersediaan nutrisi lain,penggunaan herbisida, penyimpanan (Corre and Breimer, 1979).Faktor utama yang berkontribusi terhadap kandungan nitrat dalam sayuran dapat dinyatakan sebagai berikut: faktor genetik 10%, periode tumbuh 15%, kondisi tanah 20%, pemupukan 30% dan kondisi cuaca 25% (Raczuk, et al., 2014).
10
ketika kentang dikupas direbus dalam air (Chowdhury dan Das, 2015).
Dalam makanan, nitrat sangat stabil secara kimia pada range pH tertentu. Nitrat dapat direduksi menjadi nitrit, walaupun hanya kontak dengan logam seperti peralatan aluminium pada proses perebusan (Walters, 1996).
2.4Efek Nitrit dan Nitrat Tubuh Manusia 2.4.1 Efek Negatif
Sumber utama toksisitas nitrit adalah pembentukan methaemoglobin (Met-Hb)dari oksihemoglobin (oxy-Hb). Hemoglobin (Hb) adalah kompleks yang mengandung besi dalam eritrosit dengan peran utama untuk transportasi oksigen, bergabung dengan oksigen untuk membentuk oxy-Hb. Berbagai senyawa pengoksidasi bereaksi dengan oxy-Hb untuk membentuk Met-Hb (berwarna cokelat).Methaemoglobin adalah hemoglobin yang di dalamnya ferro (Fe2+) telah diubah menjadi ferri (Fe3+) dan kemampuannya untuk mengangkut oksigen telah berkurang dan menyebabkan warna darah menjadi coklat. Ketika Met-Hb kurang dari 10% dari total Hb biasanya tidak ada gejala; di atas 10% menyebabkan sianosis di mana kulit berwarna rona abu-abu kebiruan dan darah terasa berwarna cokelat. Gejala awal adalah kelelahan, tetapi ketika proporsi yang tinggi akan menyebabkan koma dan kematian; tingkat mematikan berlaku jika kadar methaemoglobin mencapai 60% (Hill, 1996).
Kiese dan Weger pada tahun 1969 melakukan studi dari toksisitas nitrit secara intravena. Ketika relawan diberi 4mg NaN02 per kg berat badan tingkat methaemoglobin mencapai maksimal 7%; 12 mg/kg mencapai 25% methaemoglobin. Dengan asumsi hubungan antara dosis-respons adalah linear dan
dosis secara i.v yang mematikan adalah 1,5-2,5 g untuk orang dewasa rata-rata 60-70 kg berat badan. Natrium nitrit kadang-kadang digunakan untuk bunuh diri (Hill, 1996).
Pada kondisi tertentu, nitrit bereaksi dengan senyawa amina, khususnya amina sekunder, membentuk senyawa nitroso yang bersifat karsinogenik. Reaksi ini terjadi pada suasana asam.Tingginya kasus kanker hati dan lambung di Jepang serta China diduga karena mereka banyak mengonsumsi cumi-cumi yang banyak mengandung dimetilena (Silalahi, 2005) . Selain sebagai sumber nitrat, sayur juga merupakan sumber utama asam askorbat (vitamin C). Asam askorbat dapat menghambat sintesis nitrosamin dan menurunkan resiko methaemoglobinemia (Raczuk, et al., 2014).
12
Hasil antara dari denitrifikasi mikroba dalam siklus nitogen adalah Nitrogen Monoksida (NO) (Bryan dan Lancaster Jr, 2011). NO juga disebut nitrogen oksida atau nitrat oksida (nitric oxide) adalah suatu gas tak berwarna, tanpa oksigen larut didalam air.Sintesis nitrogen oksida di endotelium vaskular berperan sebagai vasodilator yang penting untuk mengatur tekanan darah. Dalam sistem saraf pusat, nitrogen oksida adalah suatu neurotransmiter yang mendukung berbagai fungsi seperti pembentukan memori (Silalahi, 2005).
NO juga dihasilkan oleh makrofag dan neutrofil sebagai bagian dari respon kekebalan tubuh manusia (Bryan dan Loscalzo, 2011). Karena nitrogen oksida memiliki sifat sitotoksis dan dibentuk oleh makrofag yang aktif, nitrogen oksida tampaknya berperan dalam imunitas nonspesifik (Silalahi, 2005).
2.5Seledri
Menurut Herbarium Medanese (2016) , klasifikasi tanaman seledri adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Apiales
Famili : Apiaceae Genus : Apium
Species : Apium graveolens L.
Nama daerah untuk seledri adalah saladri, seleri, sederi, daun sop, daun soh (Jawa), salada (Sunda) (Hariana, 2011). Seledri merupakan tanaman sayuran
mempunyai tinggi sekitar 50 cm ini mempunyai batang yang tidak berkayu, bersegi, beralur, beruas, bercabang, dan berwarna hijau pucat. Menurut Soewito pada tahun 1989 seledri terbagi menjadi 3 jenis, yaitu
(1) Seledri daun (Apium graveolens L var. Secalinum Alef)
Seledri jenis ini lebih suka tumbuh di tanah yang agak kering. Bagian seledri yang digunakan adalah daunnya, cara memetiknya ialah dicabut.
(2) Seledri potong (Apium graveolens L var. Sylvestre Alef)
Seledri ini lebih suka tumbuh di tanah yang mengandung pasir atau kerikil dengan kandungan air yang banyak tetapi tidak sampai tergenang. Tanah yang berlumpur tidak menguntungkan bagi tanaman seledri ini, cara memetiknya ialah dipotong.
(3) Seledri berumbi (Apium graveolens L var. Rapaceum Alef)
Jenis ini tumbuh di tanah yang gembur dan banyak mengandung air. Bentuk batangnya membesar seperti umbi tetapi yang digunakan adalah bagian daunnya. Seledri daun (Apium graveolens L var. Secalinum Alef) merupakan jenis seledri yang paling banyak dibudidayakan di Indonesia (Pinem, 2007).
14
Rentang kadar nitrat dalam seledri adalah 50-5300 mg/kg (Walters, 1996). Kadar nitrat dan nitrit pada seledri bervariasi pada berbagai kota di Amerika Serikat, yakni pada kota Chicago, Dallas, Los Angeles, New York dan Raleigh berturut-turut adalah 229,713 mg/kg dan 0,232 mg/kg; 2052,329 mg/kg dan 0,43 mg/kg; 2651,405 mg/kg dan 0,132 mg/kg; 87,669 mg/kg dan 0,042 mg/kg; 2200,651 mg/kg dan 0,075 mg/kg (Keeton, et al., 2009).
2.5.2 Pengaruh Lama Perebusan dan Jenis Air yang digunakan terhadap Kadar Nitrat dan Nitrit dalam Seledri
Studi yang telahdilakukan menunjukkan pengurangan kadar nitrat (16-79%) ketika sayuran seperti kacang polong, kubis, buncis, wortel, kentang bayam, dan seledri direbus dalam air(Chowdhury dan Das, 2015). Menurut Barandozi dan Borujeni (2013) pada bawang perai dan bayam yang direbus dengan air demineral menunjukkan penurunan kadar nitrat dan nitrit pada bayam dan bawang perai. Ditemukan bahwa antara 23% dan 61% dari nitrat yang terkandung dalam sayuran segar hilang ketika sayuran tersebut direbus. Perebusan mengurangi kadar nitrat karena nitrat dan nitrit larut dan memiliki kecenderungan untuk mudah terbawa kedalam air rebusan (Huarte, et al., 1997).
2.6 Penetapan Kadar Nitrit dan Nitrat
Metode yang digunakan dalam menentukan kadar nitrit dan nitrat yaitu kolorimetri, HPLC, GC, dan spektrofotometri sinar tampak. Metode lain yang digunakan adalah kemiluminesen, prinsipnya didasarkan pada reduksi nitrit menjadi NO oleh kalium iodida atau reduktor lain yang lebih kuat dan reaksi berikutnya antara NO dengan ozon membentuk NO2- (Hill, 1996; Jobgen, et al., 2007).
lnaphthylethylenediamine telah banyak digunakan untuk pengukuran nitrit dan nitrat, dengan mereduksi nitrit (Hill, 1996).
Pada spektrofotometri sinar tampak adalah gabungan dengan metode kolorimetri, dimana sampel sebelumnya direaksikan dengan pereaksi yang akan menghasilkan warna pada larutan sampel (Hess, 2000).
2.6.1 Metode spektrofotometri sinar tampak
Spektrofotometri UV-Vis adalah pengukuran panjang gelombang dan intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Prinsip dasar analisis kuantitatif suatu senyawa dengan spektrofotometri UV-Vis adalah Hukum Lambert-Beer(Gandjar dan Rohman, 2012).
Hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan. Dalam hukum Lambert-Beer berlaku persamaan : A = abc
A adalah absorban; a adalah absorptivitas (suatu konsentrasi yang tidak tergantung padakonsentrasi, tebal kuvet dan intensitas radiasi yang mengenai larutan sampel); b adalah tebal kuvet; c adalah konsentrasi (Rohman,2007).
16 Sumber : (Sun, et al., 2003)
Metode spektrofotometri berdasarkan kolorimetri dalam penetapan kadar nitrat dan nitrit telah digunakan secara luas pada sayuran dengan reaksi azo asam sulfanilat dan naftil etilen diamin dihidroklorida (Özdestan dan Üren, 2011; Barandozi dan Borujeni, 2013; Rezaei, et al., 2014). Untuk penentuan kadar nitrat sendiri, dilakukan dengan terlebih dahulu mereduksinya menjadi nitrit. Reduksi nitrat menjadi nitrit, dilakukan dengan cara direduksi dengan logam Zn(Hill, 1996; Vogel, 1990) maupun dengan campuran kadmium, natrium tartrat dan asam tartrat (Özdestan dan Üren, 2011; Silalahi, et al., 2007). Nitrat juga dapat direduksi dengan serbuk Zn dan HCl atau asam asetat (Masfria, dkk., 2013).Selanjutnya, nitrit yang terbentuk dianalisis melalui reaksi pada Gambar 2.2 diatas.
PENDAHULUAN
1.1 Latar Belakang
Sayuran tidak diragukan lagi pentingnya bagi gizi manusia. Mengkonsumsi banyak sayuran memberikan banyak zat yang diperlukan untuk kesehatan seperti mineral, vitamin (A, C, B1, B6, B9, E), dan serat (Dias,2012). Meskipun banyak manfaat gizi dari makan sayuran, tetapi juga mengandung zat-zat yang mempengaruhi kesehatan manusia seperti nitrat dan nitrit (EFSA ,2008). Konsentrasi nitrat bervariasi, mulai dari 1 sampai 10.000 mg/kg berat basah, sementara tingkat nitrit dalam sayuran segar yang sangat rendah (<2 mg/kg) (Chou,et al., 2003).
Nitrat terjadi secara alami di lingkungan dan tanaman. Nitrat dalam sayuran dapat dikonversi menjadi nitrit oleh bakteri atau aktivitas enzim ( Chen,2010). Nitrat di metabolisme dalam tanaman oleh enzim nitrat reduktase. Enzim nitrat reduktase ini berguna untuk mengubah nitrat menjadi nitrit. Setiap tumbuhan memerlukan nitrat, karena sangat membantu pertumbuhan dan proses fotosintesis (Hill,1996).
Kandungan nitrit dalam buah-buahan relatif rendah, sedangkan dalam sayuran beragam dan relative tinggi. Sayuran seperti selada dan daun sup (seledri) mengandung nitrat 1500-1700 mg/kg. jumLah asupan yang diizinkan (Acceptable
Daily Intake = ADI ) oleh FAO/WHO untuk berat badan 60 kg adalah 220 mg
2
bahwa nitrit menyebabkan methemoglobinemia dan dengan amina sekunder dan tersier, menghasilkan nitrosamine karsinogenik (Jaworska,2005).
Ada beberapa faktor yang mempengaruhi penyerapan NO3- dan akumulasi dalam sayuran, misalnya faktor genetik, faktor lingkungan: kelembaban atmosfer, kadar air substrat, suhu,radiasi, penyinaran dan faktor pertanian: dosis nitrogen, ketersediaan nutrisi lain,penggunaan herbisida, penyimpanan, dll (Corre and Breimer,1979). Penelitian yang dilakukanoleh Barandozi dan Borujeni (2013) pada bawang perai dan bayam yang direbus dengan air demineral menunjukkan penurunan kadar nitrat dan nitrit pada bayam dan bawang perai. Ditemukan bahwa antara 23% dan 61% dari nitrat yang terkandung dalam sayuran segar hilang ketika direbus, mereka menemukan juga bahwa air rebusan dari sayuran mengandung kadar nitrat yang tinggi sehingga perlu diperhatikan untuk makanan seperti sup, mie kuah. Pada penelitian sebelumnya tidak ada yang membandingkan kadar nitrat dan nitrit yang direbus dengan air mineral dan air demineral. Air mineral adalah air minum dalam kemasan yang mengandung mineral dalam jumlah tertentu tanpa menambahkan mineral sedangkan air demineral adalah air yang diperoleh melalui proses pemurnian seperti destilasi, deionisasi, reverse osmosis dan proses setara (SNI, 2006).
Berdasarkan uraian di atas, tujuan dari penelitian ini adalah untuk mengetahui pengaruh lamanya perebusan dengan air Demineral dan air Mineral terhadap kandungan nitrat dan nitrit. Pada penelitian ini digunakan metode spektrofotometri sinar tampak karena memiliki kelebihan dimana alat yang digunakan lebih sensitif sehingga diperoleh hasil yang lebih akurat.
Berdasarkan latar belakang diatas, maka perumusan masalah pada penelitian ini adalah:
a. Bagaimana pengaruh lama perebusan dan jenis air yang digunakanterhadap kadar nitrat dan nitrit dalam seledri?
b. Apakah pengaruh perebusan dengan air Demineral lebih tinggi penurunannya dibandingkan dengan air Mineral?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian ini adalah:
a. Pengaruh lamanya perebusan dan jenis air yang digunakan terhadap kandungan nitrat dan nitrit semakin menurun.
b. Penurunan kadar nitrat dan nitrit menggunakan air Demineral lebih tinggi dibandingkan dengan menggunakan air Mineral.
1.4 Tujuan Penelitian
Tujuan dilakukannya penelitian ini adalah:
a. Untuk mengetahui pengaruh lamanya perebusan dan jenis air yang digunakanterhadap kandungan nitrat dan nitrit.
4
Manfaat dilakukannya penelitian ini adalah:
a. Dapat mengetahui pengaruh lamanya perebusan dan jenis air yang digunakan terhadap kandungan nitrat dan nitrit.
b. Dapat membandingkan penurunan kadar nitrat dan nitrit yang direbus dengan air Demineral dan air Mineral.