ANALISIS KUALITATIF DAN KUANTITATIF EKSTRAK HEKSANA, ASETON, METANOL DAN
AIR DARI SELEDRI (Apium graveolens L.)
SKRIPSI SARJANA FARMASI
Oleh :
FARADILLA OKTAVIANI
No. BP 1411012073
Dosen Pembimbing :
1. Prof. Dr. H. Harrizul Rivai, MS.
2. Dr. Hj. Roslinda Rasyid, M.Si, Apt.
FAKULTAS FARMASI UNIVERSITAS ANDALAS
PADANG
2018
ii
iii
iv
v
KATA PENGANTAR Bismillahirrahmanirrahin
Alhamdulillahirrabbil’alamin, segala puji dan syukur penulis ucapkan atas kehadirat Allah SWT, karena berkat rahmat dan karunia-Nya penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul “Analisis Kualitatif dan Kuantitatif dari Ekstrak Heksana, Aseton, Metanol dan Air Herba Seledri (Apium graveolens L,)”. Selesainya penelitian dan skripsi ini tidak lepas dari doa dan dukungan yang diberikan oleh orang-orang terkasih. Pada kesempatan ini perkenankan penulis menyampaikan ucapan terimakasih kepada:
1. Bapak Prof. Dr. Harrizul Rivai, MS. selaku Pembimbing I yang telah memberikan arahan, bimbingan, nasehat, semangat dan dukungan kepada penulis selama menjalankan perkuliahan, penelitian dan penulisan skripsi.
2. Ibu Dr. Hj. Roslinda Rasyid,M.Si, Apt. selaku Pembimbing II yang telah memberikan arahan, bimbingan, semangat, dukungan kepada penulis selama menjalankan perkuliahan, penelitian dan penulisan skripsi ini.
3. Ibu Dr. Rustini, M.Si, Apt , Bapak Dr. Yufri Aldi, M.Si, Apt dan Ibu Dr.
Rahmi Nofita R. M, Si, Apt selaku dosen penguji ujian sarjana yang telah memberikan saran dan masukan dalam penelitian dan penulisan skripsi.
4. Bapak dan Ibu pembahas pada seminar proposal dan hasil yang telah banyak memberikan masukan dan arahan dalam penelitian dan penulisan skripsi
vi
5. Ibu Dian Ayu Juwita, S.Farm., M.Farm., Apt. selaku penasihat akademik yang telah memberikan arahan, bimbingan, semangat, dukungan kepada penulis selama menjalankan perkuliahan
6. Bapak dan Ibu staf pengajar, analis laboratoium, dan karyawan-karyawati Fakultas Farmasi Universitas Andalas yang telah memberikan ijin penelitian, dukungan dan bantuan kepada penulis hingga skripsi ini selesai.
7. Orang tua penulis dan semua pihak yang telah memberikan motivasi, dukungan dan bantuan selama penelitian dan penulisan skripsi ini yang tidak dapat penulis sebutkan satu persatu
Semoga Allah SWT selalu melimpahkan rahmat dan karunia-Nya kepada semua pihak yang telah membantu penulis. Aamiin. Dalam penulisan skripsi ini, penulis menyadari masih banyak terdapat kekurangan dan jauh dari sempurna.
Oleh karena itu, penulis dengan senang hati menerima kritik dan saran yang membangun dari semua pihak. Semoga skripsi ini dapat bermanfaat bagi kemajuan ilmu pengetahuan pada masa yang akan datang.
Padang, Oktober 2018
Penulis
vii
Analisis Kualitatif dan Kuantitatif Ekstrak Heksana, Aseton, Metanol dan Air dari Seledri (Apium graveolens L.)
ABSTRAK
Herba seledri (Apium graveolens L.) merupakan tumbuhan dari famili apiaceae yang umum digunakan oleh masyarakat sebagai pelengkap makanan.
Tidak hanya itu, herba seledri juga digunakan oleh masyarakat sebagai obat secara tradisional. Hanya saja pemanfaatannya belum maksimal. Karena itu perlu dilakukan analisis terhadap kandungan senyawa kimia dari herba seledri ini sebagai tahap pengembangan informasi untuk mengolah herba seledri sebagai tumbuhan obat. Penelitian ini bertujuan untuk mengetahui kandungan dan kadar dari senyawa herba seledri dalam bentuk ekstrak yang diekstraksi dengan menggunakan empat pelarut yang berbeda kepolarannya. Ekstrak herba seledri dibuat dengan teknik maserasi untuk mendapatkan ekstrak heksana, aseton dan metanol sedangkan untuk mendapatkan ekstrak air digunakan metode infusa.
Ekstrak yang didapatkan diuji secara kualitatif dengan pereaksi warna menggunakan reagen kimia yang sesuai. Berdasarkan hasil yang didapat untuk ekstrak aseton, metanol dan air memiliki kandungan metabolit sekunder yang hampir sama yaitu alkaloid, flavonoid, tanin, fenol, glikosida dan saponin.
Sedangkan ekstrak heksan hanya menunjukkan kandungan yang positif pada alkaloid, steroid dan terpenoid. Pengujian kuantitatif untuk saponin dan alkaloid dilakukan dengan metode gravimetri dimana hasil yang didapatkan untuk kadar alkaloid terbesar terdapat dalam ekstrak heksana yaitu 0,346% dan kadar saponin paling besar terdapat dalam ekstrak air yaitu 0,215%. Uji kuantitatif fenol, flavonoid dan tanin dilakukan dengan spektrofotometri ultraviolet-visible dimana kadar fenol paling tinggi terdapat dalam ekstrak aseton yaitu 0,992% sedangkan kadar flavonoid dan tanin paling besar terdapat didalam ekstrak metanol yaitu 0,354 % dan 0,141 % secara berturut-turut.
Kata kunci: Herba seledri (Apium graveolens L), analisis kualitatif, analisis kuantitatif, gravimetri, spektrofotometri Ultraviolet-Visibel
viii
Qualitative And Quantitative Anaysis Of Hexane, Asetone, Methanol, And Water Extract From Celery (Apium graveolens L.)
ABSTRACT
Celery herb (Apium graveolens L.) is a plant of the Apiaceae family which is commonly used by the community as a complement to food. Not only that, it turns out that celery herb is also used by community as a traditional medicine. But the utilization of celery is less than optimal. Therefore, it is necessary to analyze the content of chemical compounds from celery herbs to develope information to process celery herbs as medicinal plants. The purpose of this research is to find out to component of chemical compound conteined in each extract using four solvent with different polarity and determine the total level of secondary metabolite in each extract. Celery herb extract was made using maseration technique to obtain hexane, acetone and methanol extract while water extract was obtained with infusion method. Extract obtained qualitatively tested with color reagents using suitable chemical reagents. Based on the result obtained for acetone extract, methanol and water have the same content of secondary metabolite, which is alkaloids, flavonoids, tannins, phenols, glicosydes and saponin. Extract of hexane only shows a positive content on alkaloids, steroids, and terpenoids. Quantitative testing for saponins and alkaloids was carried out by gravimetric method where the highest alkaloid content was found in hexane extract is 0.346 % and the most saponin contents was found in water extract is 0.215%. Quantitative test of phneol, flavonoid and tannin were tested with ultraviolet-visible spechtrofotometry where the highest phenol content was found in acetone extract is 0.992% , the higest flavonoid content was in methanol extract is 0.354% while the higest levels of tannin were found in extract methanol is 0.141%.
Keywords: Celery Herb (Apium graveolens L), qualitative analysis, quantitative analysis, gravimetric, Ultraviolet-Visible spectrophotometry
ix DAFTAR ISI
Halaman
COVER i
PERNYATAAN ORISINILITAS DAN PENYERAHAN HAK
CIPTA ii
LEMBARAN PENGESAHAN iii
PERTAHANAN SKRIPSI iv
KATA PENGANTAR v
ABSTRAK vii
ABSTRACT viii
DAFTAR ISI ix
DAFTAR LAMPIRAN xiii
DAFTAR TABEL xiv
DAFTAR GAMBAR xv
I. PENDAHULUAN 1
II. TINJAUAN PUSTAKA 4
2.1. Tinjauan Botani Seledri (Apium graveolens L.) 4
2.1.1 Taksonomi Tumbuhan 4
2.1.2 Nama Lain 4
2.1.3 Deskripsi 5
2.2. Kandungan Kimia Seledri 6
2.3. Tinjauan Farmakologi Seledri 7
2.3.1 Penggunaan Secara Tradisional 7
2.3.2 Uji Praklinis 8
2.3.3 Uji Klinis 9
2.4. Ekstraksi 10
2.4.1 Defenisi Ekstraksi 10
2.4.2 Ekstrak 10
2.4.3 Metode Ekstraksi 11
x
2.4.4 Pelarut Ekstraksi 13
2.5. Metode Identifikasi Senyawa 15
2.5.1 Protein dan asam amino 15
2.5.2 Asam Lemak 16
2.5.3 Karbohidrat 16
2.5.4 Flavonoid 17
2.5.5 Alkaloid 18
2.5.6 Saponin 19
2.5.7 Fenol 20
2.5.8 Tanin 20
2.5.9 Fitosterol 21
2.5.10 Glikosida 21
2.6. Penetapan Kadar Senyawa 22
2.6.1 Flavonoid 22
2.6.2 Alkaloid 23
2.6.3 Saponin 24
2.6.4 Fenol 24
2.6.5 Tanin 24
III. PELAKSANAAN PENELITIAN 26
3.1. Waktu dan Tempat Pelaksanaan Penelitian 26
3.2. Alat dan Bahan 26
3.2.1 Alat 26
3.2.2 Bahan 26
3.3. Prosedur Penelitian 27
3.3.1 Pengambialan Sampel 27
3.3.2 Karakterisasi Sampel 27
3.3.2.1 Pemeriksaan Organoleptis 27
3.3.2.2 Susut Pengeringan 27
3.3.2.3 Penetapan Kadar Abu Total 28
3.3.2.4 Penetapan Kadar Abu Tidak Larut Asam 29 3.3.2.5 Penetapan Kadar Sari Larur Air 29
xi
3.3.2.6 Penetapan Kadar Sari Larut Etanol 29 3.3.3 Penyiapan Ektrak Seledri (Apium Graveolens L.) 30
3.3.3.1. Ekstrak Heksan 30
3.3.3.2. Ekstrak Aseton 30
3.3.3.3. Ekstrak Metanol 31
3.3.3.4. Ekstrak Air 31
3.3.4 Penyiapan Reagen 32
3.3.5 Analisis Kualitatif 34
3.3.5.1 Protein dan Asam Amino 34
3.3.5.2 Uji Minyak dan Lemak 34
3.3.5.3 Uji Karbohidrat 35
3.3.5.4 Uji Flavonoid 35
3.3.5.5 Uji Alkaloid 36
3.3.5.6 Uji Steroid dan Terpenoid 37
3.3.5.7 Uji Fenolat dan Tanin 37
3.3.5.8 Uji Saponin 38
3.3.5.9 Uji Glikosida 38
3.3.6 Pengujian Kuantitatif 39
3.3.6.1 Penetapan Kadar Alkaloid Total 39 3.3.6.2 Penetapan Kadar Saponin Total 39 3.3.6.3 Penetapan Kadar Fenolik Total 40 3.3.6.4 Penetapan Kadar Flavonoid Total 41
3.3.6.5 Penetapan Kadar Tanin Total 43
IV. HASIL DAN PEMBAHASAN 45
4.1. Hasil Penelitian 45
4.1.1. Pengambilan Sampel 45
4.1.2. Karakterisasi Sampel 45
4.1.2.1. Pemeriksaan Organoleptis 45
4.1.2.2. Susut Pengeringan 45
4.1.2.3. Kadar Abu Total 45
4.1.2.4. Kadar Abu Tidak Larut Asam 46
xii
4.1.2.5. Kadar Sari Larur Air 46
4.1.2.6. Kadar Sari Larut Etanol 46
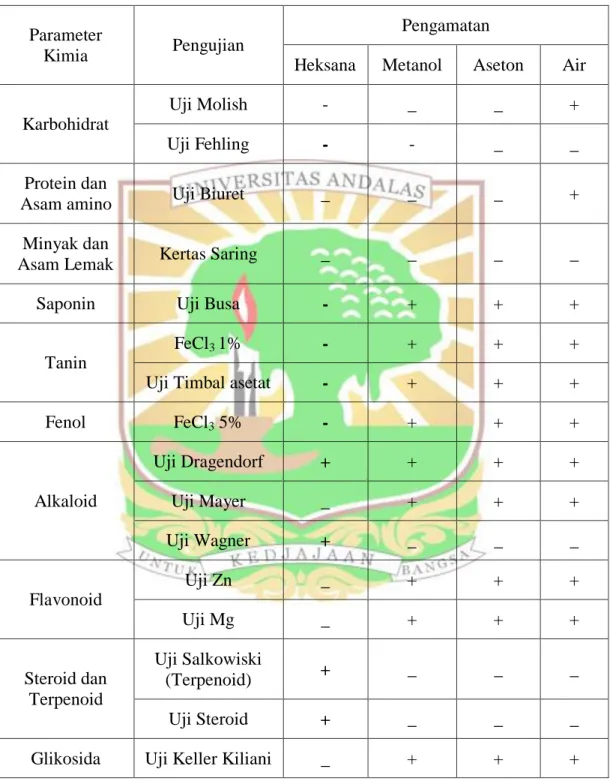
4.1.3. Analisis Kualitatif 47
4.1.3.1. Protein dan Asam Amino 47
4.1.3.2. Uji Minyak dan Lemak 47
4.1.3.3. Uji Karbohidrat 47
4.1.3.4. Uji Flavonoid 48
4.1.3.5. Uji Alkaloid 48
4.1.3.6. Uji Steroid dan Terpenoid 49
4.1.3.7. Uji Fenolat dan Tanin 49
4.1.3.8. Uji Saponin 49
4.1.3.9. Uji Glikosida 50
4.1.4. Pengujian Kuantitatif 50
4.1.4.1. Penetapan Kadar Alkaloid Total 50 4.1.4.2. Penetapan Kadar Saponin Total 50 4.1.4.3. Penetapan Kadar Fenolat Total 50 4.1.4.4. Penetapan Kadar Flavonoid Total 51
4.1.4.5. Penetapan Kadar Tanin Total 51
4.2. Pembahasan 51
V. KESIMPULAN DAN SARAN 69
5.1. Kesimpulan 69
5.2. Saran 70
DAFTAR PUSTAKA 71
LAMPIRAN 75
xiii
DAFTAR LAMPIRAN
Lampiran Halaman
1 Skema kerja 75
2 Karakterisasi simplisia 77
3 Analisis kualitatif 79
4 Penetapan kadar senyawa alkaloid total 80
5 Penetapan kadar senyawa saponin total 98
6 Penetapan kadar senyawa fenolik total 99
7 Penetapan kadar senyawa flavonoid total 102
8 Penetapan kadar senyawa tanin total 105
9 Contoh perhitungan data hasil penelitian 106
xiv
DAFTAR TABEL
Tabel Halaman
1. Hasil susut pengeringan 77
2. Hasil kadar abu total 77
3. Hasil kadar abu tidak larut asam 77
4. Hasil kadar sari larut air 77
5. Hasil kadar sari larut etanol 78
6. Hasil analisis kualitatif 79
7. Hasil penetapan kadar alkaloid total ekstrak heksana, aseton,
metanol dan air herba seledri (Apium graveolens L.) 97 8. Hasil penetapan kadar saponin total ekstrak heksana, aseton,
metanol dan air herba seledri (Apium graveolens L.) 98 9. Data absorban asam galat-Folin Ciocalteau dengan berbagai
konsentrasi pada panjang gelombang 766 nm 99
10. Hasil penetapan kadar fenolat total ekstrak aseton, metanol dan
air herba seledri (Apium gravolens L.) 101
11. Data absorban kuersetin-alumunium klorida dengan berbagai
konsentrasi pada panjang gelombang 435 nm 102 12. Hasil penetapan kadar flavonoid total ekstrak aseton, metanol
dan air herba Seledri (Apium gravolens L.)
104 13. Data absorban pembanding katekin pada panjang gelombang
279 dan 300 nm
105 14. Data kadar tanin total pada ekstrak aseton dan metanol herba
seledri (Apium graveolens L.) 105
xv
DAFTAR GAMBAR
Gambar Halaman
1. Herba seledri 5
2. Uji Molish 80
3. Uji Fehling 81
4. Uji Biuret 82
5. Uji minyak dan lemak dengan kertas saring 83
6. Uji minyak dan lemak dengan asam sulfat 25 % 84
7. Uji saponin 85
8. Uji tanin dengan besi (III) klorida 86
9. Uji tanin dengan timbal (II) asetat 87
10. Uji fenolat 88
11. Uji flavonoid ekstrak heksana herba seledri (Apium graveolens L.)
89 12. Uji flavonoid ekstrak aseton herba seledri (Apium graveolens L.) 89 13. Uji flavonoid ekstrak metanol herba seledri (Apium graveolens
L.)
90 14. Uji flavonoid ekstrak air herba seledri (Apium graveolens L.) 90
15. Uji Dragendorff 91
16. Uji Wagner 92
17. Uji Mayer 93
18. Uji terpenoid 94
19. Uji steroid 95
20. Uji glikosida 96
21. Spektrum ultraviolet-visibel asam galat-Folin Ciocalteau pada konsentrasi 100 µg/ml
99 22. Kurva kalibrasi asam galat-Folin Ciocalteu pada panjang
gelombang 766 nm
100 23. Spektrum ultraviolet-visibel kuersetin-aluminium klorida pada
konsentrasi 60 µg/ml
102 24. Kurva kalibrasi kuersetin-aluminium klorida pada panjang
gelombang 435 nm
103
1 BAB I PENDAHULUAN
Seledri (Apium graveolens L.) merupakan tanaman dari famili Apiaceae yang secara umum banyak dimanfaatkan sebagai sayur dan lalap untuk pelengkap makanan terutama bagian daun dan batang (Agoes, 2012). Ternyata tidak hanya sebagai pelengkap bahan masakan, tumbuhan ini juga digunakan sebagai obat oleh masyarakat untuk mengatasi beberapa penyakit (Arifin et al., 2013). Seledri (Apium graveolens L.) digunakan sebagai pemacu enzim pencernaan atau sebagai penambah nafsu makan, peluruh air seni dan penurun tekanan darah. Disamping itu digunakan juga untuk mengurangi rasa sakit pada rematik dan pirai (Agoes, 2012).
Tumbuhan seledri sudah digunakan dalam bidang pengobatan selama ribuan tahun dan semua bagian dari tumbuhan ini dapat dimanfaatkan seperti batang, daun, biji dan akar. Dalam pengobatan Ayurveda di India, biji seledri digunakan untuk mengobati gejala kedinginan, flu, retensi air, gangguan pencernaan, berbagai jenis atritis serta beberapa jenis penyakit hati dan limpa (Fazal & Sangla, 2012). Pada pengobatan tradisional Arab dan Islam, daun tumbuhan seledri atau yang dikenal dengan nama “Karafs”, banyak digunakan untuk mengatasi beberapa gangguan seperti gangguan pada pencernan dan hati batu ginjal serta bisa juga digunakan untuk diuretik, mengatasi masalah haid dan batu ginjal (Al-Asmari et al., 2017).
Beberapa penelitian juga sudah mengungkapkan aktivitas farmakologi dari tumbuhan seledri ini. Aktivitas dari herba seledri yang telah ditemukan seperti
2
memiliki efek sebagai anti hipertensi dan diuretik kuat (Kementerian Kesehatan Republik Indonesia, 2011). Selain itu tumbuhan ini memiliki aktifitas sebagai antimikroba, antibakteri, antioksidan (Eissa et al., 2015; Ibrahim, 2016) antiinflamasi (Arzi et al., 2014), antikolesterol (Juheini, 2002) dan antigout (Iswatini et al., 2012).
Banyaknya khasiat dalam suatu obat tidak lain disebabkan adanya kandungan senyawa kimia yang akan bekerja di dalam tubuh sehingga dapat mengobati penyakit. Karena itulah sangat penting untuk mengkaji kandungan senyawa yang terdapat dalam tumbuhan yang berkhasiat obat untuk menghubungkan dengan aktivitasnya (Cartika, 2016). Begitu juga dengan seledri, banyaknya manfaat yang terdapat di dalam seledri disebabkan karena adanya senyawa aktif yang terdapat di dalam seledri.
Kandungan utama yang ditemukan di tumbuhan seledri ialah senyawa flavonoid Apiin (Mencherini et al., 2007) dan Apigenin (Ko et al., 1991) yang banyak berperan dalam memberikan efek terapi pada seledri yaitu penurunan tekanan darah. Selain flavonoid juga terdapat kandungan golongan senyawa lain seperti tanin, saponin dan steroid (Din et al., 2015). Pada masing-masing bagian tumbuhan ini juga terdapat perbedaan kandungan senyawa kimia. Pada akar seledri terdapat kandungan falcarinol, falcarindiol dan polyetylene 8-O- methyfalcarindiol. Pada bagian batang mengandung senyawa seperti apiuman, d- galacturonoic acid, 1-rhamnose, dan d-galctose. Sedangkan pada bagian daun terdapat 28 komponen minyak atsiri yang diantaranya terdiri dari 1-dodecanol, 9- octadecen-12-ynoic acid, metil ester dan tetradecence ( Al-Asmari et al., 2017).
3
Banyaknya khasiat dan perbedaan kandungan senyawa yang terdapat di dalam bagian tumbuhan seledri, mendorong peneliti untuk melihat perbedaan kandungan senyawa herba seledri jika dibuat dalam bentuk ekstrak. Pelarut merupakan faktor penting dalam ekstrak. Perbedaan tingkat kepolaran pelarut (polar, semi polar dan non polar) yang digunakan dapat menghasilkan komponen senyawa kimia yang berbeda pada ekstrak. Tidak hanya mempengaruhi kandungan tetapi juga mempengaruhi jumlah atau kadar senyawa didalam ekstrak (Firdiyani et al., 2015).
Pada penelitian yang dilakukan sebelumnya menunjukkan adanya kandungan flavonoid, tanin, saponin dan steroid didalam Apium graveolens L. yang diteliti dari ekstrak menggunakan pelarut etanol, metanol, heksana. Tetapi perbedaan kadar hanya dilihat dari kandungan flavonoid dan fenolat (Din et al., 2015).
Penelitian lain menunjukkan adanya perbedaan kandungan pada ekstrak air dan etanol dari seledri dimana di dalam ekstrak air terdapat kandungan tanin, flavonoid dan alkaloid. Sedangkan di dalam ekstrak etanol terdapat kandungan tanin, flavonoid, steroid, triterpenoid dan alkaloid (Iswantini et al., 2012).
Berdasarkan latar belakang tersebut, belum ada penelitian yang meneliti perbedaan kandungan dan kadar senyawa yang terdapat dalam herba seledri dalam bentuk ekstrak yang menggunakan pelarut heksana, aseton, metanol dan air. Oleh karena itu, peneliti tertarik untuk melakukan analisa kualitatif dan kuantitatif terhadap senyawa kimia dari masing masing ekstrak heksana, aseton, metanol dan air dari herba seledri (Apium graveolens L.).
4 BAB II
TINJAUAN PUSTAKA
2.1 Tinjauan Botani Seledri (Apium graveolens L.) 2.1.1 Taksonomi Tumbuhan
Taksonomi dari Apium graveolens L. adalah sebagai berikut (Fazal &
Sangla, 2012) :
Kingdom : Plantae
Divisi : Spermathopyta Subdivisi : Angiospermae Kelas : Magnoliopsida Subkelas : Rosidae
Ordo : Apiales
Familia : Apiaceae Genus : Apium
Spesies : Apium graveolens L.
2.1.2 Nama Lain
Seledri (Indonesia); Sledri (Jawa); Saladri (Sunda); Daun sop;
(Melayu), Bladsledrij (Belanda); Qin (China); Ajmud (Hindi); Celery, Marsh persley (Inggris); Oranda mitsuba (Jepang); Sedano (Italia); Phak khao puen (Thailand) (Latief, 2012).
5 2.1.3 Deskripsi
Apium graveolens L. merupakan jenis tumbuhan herba yang berasal dari Eropa Selatan. Apium graveolens L. ini dikenal dengan nama Saladri di Sunda dan dikenal dengan nama Seledri di daerah Jawa (Agoes, 2012). Seledri memiliki tinggi 50 cm dengan bau aromatik yang khas (Kementerian Kesehatan Republik Indonesia, 2011).
Gambar 1. Herba Seledri (Kementerian Kesehatan Repubik Indonesia, 2011) Batangnya persegi, beralur, beruas, tidak berambut, bercabang banyak dan berwarna hijau. Daun seledri majemuk menyirip ganjil dengan anak daun 3-7 helai. Anak daun 1- 2,7 cm, helaian daun tipis dan rapuh, pangkal dan daun runcing, tepi beringgit, panjang 2-7,5 dan lebar 2-5 cm, pertulangan menyirip,
a b
c
(a) Bagian tubuh lengkap Seledri (Apium graveolens L.) (b) Daun Seledri (Apium graveolens L.)
(c) Akar Seledri (Apium graveolens L.)
6
berwarna hijau keputihan. Bunga berbentuk payung 8-12 buah (Kementerian Kesehatan RI, 2011).
2.2 Kandungan Kimia Seledri
Kandungan utama yang ditemukan di tumbuhan seledri ialah senyawa flavonoid berupa Apiin (Mencherini et al., 2007) dan Apigenin (Ko et al., 1991).
Selain golongan flavonoid juga terdapat golongan senyawa lain seperti tanin, saponin dan steroid (Din et al., 2015). Pada masing-masing bagian tumbuhan ini juga terdapat perbedaan kandungan senyawa kimia. Pada akar seledri terdapat kandungan falcarinol, falcarindiol, panaxidol dan polyetylene 8-O- methyfalcarindiol. Pada bagian batang mengandung senyawa seperti apiuman, d- galacturonoic acid, 1-rhamnose, 1-arabinose, dan d-galctose. Sedangkan pada bagian daun terdapat 28 komponen minyak atsiri yang diantaranya terdiri dari 1- dodecanol, 9-octadecen-12-ynoic acid, methyl ester dan tetradecence (Al-Asmari et al., 2017).
Kandungan gizi dalam setiap 100 g herba Seledri mengandung air 93 mL, protein 0,9 g, lemak 0,1 g, karbohidrat 4 g, serat 0,9 g, kalsium 50 mg, besi 1 mg, fosfor 40 mg, yodium 150 mg, kalium 400 mg, magnesium 85 mg, vitamin A 130 IU, vitamin C 15 mg, riboflavin 0,05 mg, tiamin 0,03 mg, nikotinamid 0,4 mg.
Akar seledri mengandung asparagin, manit, minyak atsiri, pentosan, glutamin, dan tirosin. Ekstrak diklorometan akar seledri mengandung senyawa poliasetilen falkarinol, falkarindiol, panaksidiol dan 8-O-metilfalkarindiol. Biji mengandung apiin, minyak atsiri, apigenin, alkaloid. Senyawa yang memberi bau aromatik
7
adalah ftalides (3-butilftalid & 5,6-dihidro turunan sedanenolid) (Kementerian Kesehatan Republik Indonesia, 2016).
Herba seledri mengandung senyawa 15 komponen senyawa fenolat yaitu asam galat, asam protokatekin, katekol, asam klorogenik, asam syringic, asam p- coumaric, asam ferulic, asam salysilic, asam cinnamic, chrysin, pyrogallol, asam ellagic, katekin dan asam caffeic. Flavonoid yang terdapat didalam herba seledri antara lain apignen, hesperitin, luteolin, quercetrin dan rosmarinic (Sorour et al., 2015).
Seledri juga mengandung minyak atsiri. Hasil penyulingan dari biji seledri didapatkan bahwa terdapat kandungan limonen (80%) sebagai kandungan utama nya. Selain itu kandungan minyak atsiri lain yang terdapat pada Seledri adalah a- p-dimethylstyrere, n-pertyl benzene, caryophyllene, a-selinene, n-butyl phthalide, Sedanenolide bersama dengan sablnene, b-elemne, trans-1 2- epoxy limonene, linalool, isovalaric acid, cis-dihydrocarvone, trans-dihydrocarvone, trepinene-4-ol, 1-cis –p menth-2,8-diene-1-ol, trans-p-menth-2,8-diene-1-ol, alpha-terpineol, carvone, trans-8-diene 1-ol, perialdehyde, dan thymol (Fazal & Singla, 2012).
2.3 Tinjauan Farmakologi Seledri (Apium graveolens L.) 2.3.1 Penggunaan Secara Tradisional
Dalam pengobatan Ayurveda, biji seledri digunakan dalam mengatasi gangguan seperti flu, retensi air, gangguan pencernaan, berbagai jenis atritis, serta beberapa jenis penyakit hati dan limpa (Fazal & Sangla, 2012). Pada pengobatan tradisional Arab dan Islam, seledri atau yang dikenal dengan nama “Karafs” ini
8
digunakan untuk mengatasi beberapa masalah pada bagian pencernaan dan hati.
Selain itu juga berperan sebagai diuretik serta mengatasi masalah haid dan batu ginjal (Al-Asmari et al., 2017).
Seledri merupakan tanaman yang banyak tumbuh di Indonesia.
Penggunaan seledri sendiri sudah sangat luas di masyarakat. Masyarakat biasa menggunakan herba seledri segar sebagai lalapan ataupun obat. Herba seledri sudah lama digunakan oleh masyarakat Tiongkok secara tradisional untuk menurunkan tekanan darah (Hidayat & Rodame, 2015).
Secara tradisional herba seledri sudah digunakan untuk mengobati masalah seperti masuk angin, mual, diare, tekanan darah tinggi, vertigo, rematik, asam urat, alergi dan batuk (Hidayat & Rodame, 2015). Selain itu seledri juga dimanfaatkan untuk mengobati penyakit seperti pendarahan, diuretik, peluruh haid, peluruh kentut (karminatif), obat cacing dan obat penenang (Fazal & Sangla, 2012).
2.3.2 Uji Praklinis
Berdasarkan data uji praklinis seledri yang sudah ada diketahui bahwa dengan pemberian infusa daun seledri 20; 40% dosis 8 mL/ekor pada tikus putih dengan pembanding furosemida dosis 1,4 mg/ekor, dapat memperbanyak urin secara bermakna. Pada penelitian lain, pemberian perasan daun seledri dapat menurunkan tekanan darah kucing sebesar 13-17 mmHg. Sementara ekstrak daun seledri menurunkan darah kucing sebesar 10-30 mmHg (Kementerian Kesehatan Republik Indonesia, 2016). Sari herba seledri menunjukkan adanya aktivitas antikolesterol yang dilakukan pada tikus putih dengan dosis 0.14 g/200 g bb/ hari ;
9
0.72g/200g bb/hari dan 3,6 g/200g/hari (Juheini, 2002). Ekstrak hidroalkoholik dari biji Seledri menunjukkan adanya persamaan efek anti-inflamasi pada dosis 100 mg/kg dengan efek anti-inflamasi dari aspirin dengan dosis 300 mg/kg yang telah di ujikan pada tikus (Arzi et al., 2014). Pemberian seduhan seledri dapat menurunkan kadar asam urat pada Tikus Putih Jantan Hiperurisemia mulai dari dosis 50 mg/ekor/ hari dan efeknya meningkat seiring dengan peningkatan dosis (Deviandra et al., 2013). Pada penelitian yang dilakukan terhadap Jamur Pityrosporum ovale penggunaan shampo ekstrak etanol seledri (Apium graveolens L.) memperlihatkan adanya daya anti ketombe yang baik pada konsentrasi 10%
(Mahataranti et al., 2012).
2.3.3 Uji Klinis
Uji klinis dilakukan pada penelitian yang melibatkan 49 penderita hipertensi yang diberi tingtur (setara 2 g/mL ekstrak herba seledri) 3 kali sehari 30-45 tetes. Hasil memberikan efek terapetik pada 26,5%, efek moderat pada 44,9% dan tidak memberikan efek pada 28,6%. Penambahan madu dan sirup pada jus herba seledri segar dengan dosis 40 mL/ 3 x sehari menunjukkan efektivitas pengobatan pada 14 dari 16 kasus hipertensi sedangkan 2 kasus tidak efektif (Kementerian Kesehatan Republik Indonesia, 2016).
10 2.4 Ekstraksi
2.4.1 Definisi Ekstraksi
Ekstraksi adalah suatu prosedur standar dalam proses pemisahan senyawa aktif yang berkhasiat obat dari jaringan tumbuhan dan hewan dengan menggunakan pelarut tertentu. Selama ekstraksi pelarut berdifusi kedalam tumbuhan dan melarutkan senyawa yang sama tingkat kepolarannya. Tujuan prosedur standar dari ekstraksi adalah untuk mendapatkan bagian yang berkhasiat dan menghilangkan bahan yang tidak diinginkan dalam pengobatan. Hasil dari ekstraksi ini didapatkan ekstrak cairan atau tinctura yang dapat berupa campuran kompleks dari banyak metabolit tumbuhan obat seperti alkaloid, glikosida, terpenoid, flavonoid dan lignan (Tiwari et al., 2011).
2.4.2 Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan jalan mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai. Kemudian, semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlukan sedemikian sehingga memenuhi baku yang telah ditetapkan. Pelarut yang digunakan dalam ekstraksi harus dipilih berdasarkan kemampuannya melarutkan zat aktif dalam jumlah maksimum dan seminimum mungkin bagi unsur yang tidak diinginkan (Departemen Kesehatan Republik Indonesia, 2000).
11 2.4.3 Metode Ektraksi
Ekstraksi dengan menggunakan pelarut terbagi menjadi 2 cara yaitu (Departemen Kesehatan Republik Indonesia, 2000) :
a. Cara Dingin 1. Maserasi
Maserasi adalah proses pengesktrakan simplisia menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Secara teknologi termasuk ektraksi dengan prinsip metode pencapaian konsentrasi pada kesimbangan. Maserasi kinetik berarti dilakukan pengadukan yang kontinu (terus menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraktion) yang umumnya dilakukan pada temperatur ruangan. Proses pada perkolasi terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perlokasi sebenarnya (penetasan atau penampungan ekstrak, terus menerus sampai diperoleh ekstrak (perkolat) yang jumLahnya 1-5 kali bahan.
b. Cara Panas 1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif
12
konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
2. Sokhlet
Sokhlet adalah ekstraksi menggunaakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingan balik.
3. Digeti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi pada temperatur ruangan (kamar) yaitu secara umum dilakukan pada temperatur 40-50oC.
4. Infus
Infus adalah ekstraksi dengan menggunakan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-98oC).
5. Dekok
Dekok adalah metode ektraksi yang sama seperti infus tetapi pada waktu yang lebih lama (≥ 30menit) dan temperatur sampai titik didih.
13 2.4.4 Pelarut Ekstraksi
Beberapa jenis pelarut yang digunakan untuk ekstraksi antara lain (Tiwari et al., 2011) :
1. Air
Air merupakan pelarut universal yang digunakan untuk ekstrak tumbuhan dengan aktivitas antimikroba. Meskipun secara tradisional air banyak digunakan tetapi ekstrak tumbuhan menggunakan pelarut organik telah ditemukan memberikan aktivitas antimikroba yang lebih konsisten daripada penggunakan air. Air juga dapat melarutkan flavonoid (kebanyakan antosianin) yang tidak mempunyai efek yang signifikan sebagai antimikroba. Selain itu air dapat melarutkan fenolat yang penting sebagai antioksidan.
2. Aseton
Aseton dapat melarutkan kebanyakan komponen hidrofilik dan lipofilik dari tumbuhan. Aseton dapat dicampur dengan air, berupa zat yang dapat menguap, memiliki toksisitas yang rendah dan sangat berguna untuk ekstrak khususnya antimikroba. Telah dilaporkan bahwa ekstrak air-aseton lebih baik melarutkan tanin dan fenolat lainnya daripada air-metanol. Kedua aseton dan methanol dapat melarutkan saponin yang berfungsi sebagai antimikroba.
3. Alkohol
Aktivitas ekstrak etanol lebih tinggi dibandingkan dengan ekstrak air. Hal ini dapat dikaitkan dengan jumlah polifenol dalam jumlah yang lebih banyak di dalam etanol dibandingkan dengan ekstrak air. Ini berarti menunjukkan bahwa etanol lebih efisien di dinding sel dan dapat mendegradasi senyawa yang memiliki
14
sifat nonpolar sehinggga menyebabkan polifenol dilepaskan dari sel. Selain itu terjadinya penurunan polifenol dalam ekstrak air dianggap berasal dari polifenol oksidase yang dapat mendegradasi polifenol didalam air sementara didalam metanol enzim ini tidak aktif. Etanol ditemukan lebih mudah berpenetrasi dalam membran sel untuk mengekstrak komponen intraseluler pada tumbuhan. Metanol lebih polar dari pada etanol. Tetapi metanol lebih bersifat sitotoksik dibandingkan etanol.
4. Kloroform
Kloroform merupakan senyawa non polar yang dapat melarutkan senyawa-senyawa non polar. Senyawa yang dapat ditarik oleh kloroform seperti terpenoid.
5. Eter
Eter biasanya pelarut yang digunakan secara selektif untuk ekstraksi golongan senyawa seperti kumarin dan asam lemak.
6. Diklorometan
Pelarut diklorometan merupakan salah satu pelarut yang dapat digunakan dalam prosedur ekstraksi. Diklorometan digunakan secara selektif hanya untuk mengekstraksi terpenoid.
15 2.5 Metode Identifikasi Senyawa
2.5.1 Protein dan Asam Amino
Identifikasi asam amino dengan menggunakan pereaksi warna antara lain (Hanani, 2015) :
a. Larutan 0,1 ninhidrin-aseton
Larutan pereaksi dibuat segar dan dilakukan dengan sedikit pemanasan.
Umumnya asam amino memberikan warna ungu hingga biru keabu-abuan, kecuali prolin yang memberikan warna kuning. Pereaksi ini dapat digunakan sebagai larutan deteksi pada identifikasi menggunakan KLT. Apabila digunakan untuk deteksi pada KLT, pengamatan dilakukan dibawah sinar tampak. Warna akan timbul setelah didiamkan beberapa jam pada suhu kamar atau dengan pemanasan setelah dilakukan penyemprotan.
b. Larutan ninhidrin-kadmium asetat
Adanya asam amino ditunjukkan dengan timbulnya bercak merah pada latar belakang putih, sedangkan asam amino nonprotein memberikan warna hijau, coklat atau merah tua. Untuk deteksi pada kromatografi, lempeng atau kertas yang mengandung asam amino dicelup ke dalam larutan di atas, dibiarkan semalam dalam kondisi gelap dalam bejana tertutup yang berisi asam sulfat.
c. Pereaksi Sakaguchi
Pereaksi ini spesifik untuk arginin dan turunannya.
16 d. Pereaksi Feron
Pereaksi ini spesifik untuk senyawa guanidin, yaitu kanavanin dan seaminokanavanin yang merupakan asam amino nonprotein yang banyak terdapat dalam biji berbagai jenis Leguminosae.
2.5.2 Asam Lemak
Dalam identifikasi asam lemak dapat dilakukan dengan beberapa pereaksi warna, yaitu (Hanani, 2015):
a. Larutan 2’,7’-diklorofluoresensi 0,2% dalam etanol, menimbulkan fluoresensi warna hijau muda pada latar belakang ungu pada sinar ultraviolet b. Larutan 0,5% Rodamin B atau 6G pada etanol, menimbulkan warna kuning
atau ungu kebiruan pada latar belakang merah muda
c. Asam sulfat 25%, pengamatan dilakukan pada pemanasan dan terbentuk warna coklat muda. Pada glikolipid terdapat coklat merah, sedangkan sulfolipid terbentuk merah terang
2.5.3 Karbohidrat
Pemeriksaan karbohidrat dengan menggunakan reaksi kimia bisa dilakukan dengan 3 cara yaitu uji Molish, uji Benedict dan uji Fehling. Sampel yang digunakan berupa filtrat dari ekstrak, dimana ekstrak yang akan digunakan dilarutkan dengan 5 mL air suling, kemudian disaring dan didapatkan filtrat (Tiwari et al, 2011)
17 a. Uji Molish
Filtrat yang didapat tadi diteteskan dengan 2 tetes larutan α-naphthol ke dalam tabung reaksi. Hasilnya akan terbentuk 2 lapisan dan jika diantara 2 lapisan terdapat cincin berwarna violet berarti menandakan adanya karbohidrat.
b. Uji Benedict
Filtrat ditambahkan dengan reagen Benedict. Apabila terbentuk endapan berwarna orange kemerahan menunjukkan adanya gula pereduksi.
c. Uji Fehling
Filtrat dihidrolisa dengan HCl kemudian dinetralkan dengan basa. Sampel dipanaskan dengan penambahan reagen Fehling A dan B. Apabila terbentuk endapan merah menunjukkan adanya gula pereduksi.
2.5.4 Flavonoid
Identifikasi menggunakan reaksi warna dilakukan dengan beberapa macam pereaksi flavonoid, yaitu (Hanani, 2015; Tiwari et al.,2011) :
a. Uji Shinoda
Larutan uji diuapkan hingga kering, ditambahkan 2-3 tetes etanol, kemudian ditambahkan serbuk magnesium dan beberapa tetes asam klorida 5 M. Warna merah hingga merah lembayung yang timbul menandakan adanya senyawa flavonol, flavononol dan dihidroflavonol.
b. Uji dilakukan seperti diatas, tetapi serbuk Mg diganti dengan Zn. Hanya senyawa dihidroflavonol yang menimbulkan warna merah hingga merah lembayung. Flavanol dan flavonoid tidak berwarna dan warna merah muda lemah.
18 c. Reaksi Wilson-Taubock
Larutan uji 1 mL diuapkan, kemudian ditambah aseton beberapa tetes, lalu ditambahkan sedikit serbuk asam borat dan asam oksalat, selanjutnya dikeringkan.
Residu dilarutkan dalam 10 mL eter yang kemudian dilihat pada sinar ultraviolet (365 nm). Warna hijau kuning yang timbul menunjukkan adanya senyawa flavonoid.
d. Penambahan Larutan Besi (III) Klorida.
Flavonoid yang memiliki gugus hidroksil bebas pada cincin A dan B akan menimbulkan warna hijau biru setelah penambahan larutan ini.
e. Larutan uji diuapkan, dan dilarutkan dalam 1 mL etanol, lalu ditambahkan 10 mg natrium borohidrida dan 2 tetes asam klorida 2 N. Setelah 1 menit, larutan uji ditambahkan beberapa tetes asam klorida pekat. Warna lembayung menunjukkan adanya flavonon.
f. Uji Timbal Asetat
Ekstrak ditambahkan beberapa tetes timbal asetat. Terbentuknya endapan berwarna biru menunjukkan adanya flavonoid.
2.5.5 Alkaloida
Alkaloid pada tanaman banyak terdapat dalam bentuk turunan amin primer, sekunder, tersier maupun kuartener. Sifat kebasaan alkaloid ditentukan oleh keempat jenis amin tersebut. Alkaloid bersifat basa sangat lemah, contohnya purin yang memiliki nilai pKa pada pH 10-12, basa lemah (alkaloida kinin) pada pH 7-10, sedangkan kebasaan yang sedang (alkaloid opium) pH 3-7.
19
Identifikasi dari alkaloid dengan reaksi warna yaitu ekstrak dilarutkan dalam asam klorida dan disaring, kemudian dilakukan pengujian yaitu (Tiwari et al., 2011:
a. Uji Mayer
Filtrat ditambahkan reagen Mayer (mercuric potassium iodide). Adanya endapan kuning yang terbentuk menunjukkan adanya alkaloida.
b. Uji Wagner
Filtrat ditambahkan dengan reagen Wagner (iodine dalam potassium iodide) Jika terbentuk endapan coklat/ kemerahan menunjukkan adanya alkaloid.
c. Uji Dragendroff
Filtrat diuji dengan reagen Dragendorff (Larutan potassium bismuth iodide).
Adanya endapan jingga menunjukkan adanya alkaloid.
d. Uji Hager
Filtrat ditambahkan reagen hager (Larutan asam pikrat jenuh). Pembentukan endapan kuning menunjukkan adanya alkaloid.
2.5.6 Saponin
Identifiikasi saponin dapat dilakukan dengan cara (Tiwari et al., 2011) a. Uji Buih
Ekstrak diencerkan dengan air suling 20 mL dan dikocok selama 15 menit.
Adanya lapisan busa yang terbentuk setinggi 1 cm menunjukkan adanya saponin dalam sampel.
20 b. Uji Busa
Sebanyak 0,5 gram ekstrak dikocok dengan menggunakan 2 mL air. Jika busa yang terbentuk dapat bertahan selama 10 menit maka menunjukkan adanya saponin.
2.5.7 Fenol
Identifikasi fenol dapat ditentukan dengan cara senyawa fenol memberikan warna hijau hingga biru hitam dengan penambahan larutan garam besi (III) klorida dalam air atau etanol. Penambahan larutan brom (9,6 mL brom dan 30 mL kalium bromida dalam sejumLah air hingga 100 mL) akan terbentuk endapan putih yang segera larut dan akan terjadi endapan kembali apabila ditambahkan pereaksi berlebih. Pereaksi warna yang umum digunakan untuk identifikasi antara lain Folin Ciocalteau, vanilin asam klorida pekat, vanilin asam sulfat pekat dan Gibbs (2,6-diklorokuinon-klorimida 2% dalam kloroform) (Hanani, 2015). Selain itu fenol juga bisa diuji dengan uji ferri klorida dengan cara ekstrak ditetesi dengan 3-4 tetes larutan besi (III) klorida, jika terbentuk warna hitam kebiruan menunjukkan adanya fenol (Tiwari et al., 2011).
2.5.8 Tanin
Tanin dapat diekstraksi dengan menggunakan air, alkohol atau aseton dan dapat ditentukan dengan adanya gugus fenol atau karboksilat. Larutan tanin mengendap dengan penambahan logam berat alkaloida dan gelatin (protein) (Hanani, 2015). Pengujian dengan gelatin menunjukkan hasil positif jika sampel ditambahkan 1% larutan gelatin dalam 10% natrium klorida maka akan menimbulkan endapan putih yang menunjukkan adanya tanin (Tiwari et al.,
21
2011). Identifikasi lain menggunakan larutan fenazon yang menghasilkan endapan pada larutan tanin yang telah diberi natrium asam fosfat (Hanani, 2015).
2.5.9 Fitosterol
Fitosterol diidentifikasi dengan menggunakan uji Salkwoski dan Lieberman-Bunchard (Tiwari et al., 2015)
a. Uji Salkwoski
Uji ini dilakukan dengan cara ekstrak dari tumbuhan di tambahkan kloroform dan disaring. Filtrat ditambahkan beberapa tetes asam sulfat pekat kemudian kocok lalu diamkan, pembentukan warna kuning keemasan menunjukan adanya senyawa triterpenoid.
b. Uji Lieberman Bunchard
Pengerjaan dari uji ini dengan cara menambahkan kloroform pada ekstrak tumbuhan dan saring. Filtrat yang didapat ditetesi dengan beberapa asetat anhidrat, dipanaskan lalu dinginkan. Kemudian tambahkan asam sulfat pekat.
Apabila terbentuk cincin berwarna coklat yang menghubungkan 2 lapisan menunjukkan adanya fitosterol.
2.5.10 Glikosida
Pengujian kandungan glikosida dalam ekstrak dilakukan dengan cara ekstrak di hidrolisa dengan HCl encer dan kemudian baru diuji dengan pengujian glikosida. Campuran didinginkan dan dilakukan penambahan benzen. Lapisan benzen dipisahkan dan diuji dengan larutan amonia. Pembentukan warna rosa- pink menunjukkan adanya anthranol glikosida (Tiwari et al., 2011).
22 2.6 Penetapan kadar senyawa
2.6.1 Flavonoid
Penetapan kadar flavonoid total dengan menggunakan spektrofotometer dengan pereaksi larutan aluminium klorida. Cara pengerjaannya ada 2 jenis yaitu (Hanani, 2015) :
a. Serbuk simplisia ditimbang dengan seksama 200 mg atau ekstrak yang setara dengan 200 mg serbuk simplisia., lalu dimasukkan kedalam labu alas bulat.
Sebanyak 1 mL larutan hexametilentetramin 0,5 % b/v (HMT), 29 mL aseton dan 2 mL asam klorida P ditambahkan kemudian direfluks selama 30 menit lalu disaring. Filtrat dimasukkan kedalam labu ukur 100 mL. Ampas direfluks kembali dengan 20 mL aseton selama 30 menit, lalu disaring dan filtrat diukur dalam labu tentukur. Volume dicukupkan dengan aseton sampai tanda batas. Sebanyak 20 mL larutan dimasukkan kedalam corong pisah, ditambah 20 mL air dan diekstraksi 3 kali masing- masing dengan menggunakan etil asetat. Larutan etil asetat dimasukkan kedalam labu tentukur 50 mL, lalu dicukupkan hingga tanda batas dengan etil asetat pekat. Larutan disebut larutan uji.
Pengenceran larutan uji dilakukan dengan cara memipet 10 mL larutan uji dan masukkan kedalam labu tentukur 25 mL. Lalu ditambah dengan asam asetat glasial 5% v/v dalam metanol hingga tanda batas. Pembuatan larutan uji dengan aluminium klorida dilakukan dengan cara memipet 10 mL larutan uji dan dimasukkan kedalam 25 mL labu tentukur, kemudian ditambah dengan 1 mL larutan aluminium klorida 2% dalam asam asetat glasial P dan larutan asetat glasial 5%v/v dalam metanol hingga tanda batas.
23
Pembuatan larutan pembanding tanpa larutan alumunium klorida dilakukan dengan cara larutan pembanding flavonoid 0,1 % dalam etil asetat. Pengenceran dilakukan hingga didapat serapan yang mendekati larutan uji. Pembuatan larutan pembanding dengan larutan alumunium klorida dilakukan dengan cara menambahkan aluminium klorida pada pembanding. Pengukuran dengan menggunakan spektrofotometer dilakukan 30 menit setelah penambahan larutan aluminium klorida pada panjang gelombang yang sesuai
Kadar flavonoid dihitung dengan menggunakan rumus:
% =
x
b. Metode Chang
Metode ini merupakan penetapan kadar flavonoid dengan menggunakan pembanding kuersetin. Pengerjaannya dilakukan dengan serbuk simplisia 5 gram dimasukkan ke dalam erlenmeyer, ditambah 15 mL metanol, lalu dipanaskan 10 menit diatas penangas air. Setelah dingin, larutan disaring. Dibuat campuran 0,1 mL aluminium triklorida 10%, 0,1 mL natrium asetat (1 M) dan 2.8 mL air suling, Campuran dimasukkan ke dalam ekstrak metanol, dan dibiarkan bereaksi selama 30 menit dalam suhu ruangan. Serapan diukur kedalam panjang gelombang 425 nm.
2.6.2 Alkaloid
Penetapan kadar alkaloid dapat ditentukan secara gravimetri (meskipun cara ini sudah jarang dilakukan) titrimetri, spektrofotometri, dan kromatografi cair kinerja tinggi. Alkaloid yang bersifat basa cukup kuat dapat dititrasi dengan titrasi
24
asam basa, sedangkan alkaloid yang bersifat basa lemah lebih baik ditentukan dengan titrasi bebas air (Hanani, 2015).
2.6.3 Saponin
Penetapan kadar saponin dilakukan dengan penambahan suspensi darah, dengan suasana dapar fosfat pH 7,4. Kadar saponin dalam ekstrak dapat ditetapkan dengan melakukan berbagai pengenceran filtrat dan diamati kadar yang masih menghasilkan hemolisis total, lalu dibandingkan dengan saponin pembanding (Hanani, 2015).
2.6.4 Fenol
Penetapan kadar fenol dalam simplisia umumnya ditentukan mengguanakan pereaksi Folin Ciocalteau yang menghasilkan kadar fenol total.
Sebagai pembanding dapat digunakan asam galat sehingga kadar fenol dinyatakan setara dengan asam galat. Absorbsi diukur pada panjang geombang 760 nm.
Metode lain yang dapat digunakan adalah dengan pembentukan senyawa kompleks dengan nitrit-natrium molibdat yang memiiki absorbsi maksimum pada panjang gelombang 505 nm (Hanani, 2015).
2.6.5 Tanin
Penetapan kadar tanin total dalam suatu simplisia dapat dilakukan dengan cara-cara seperti titrimetri atau spektofotometri. Dalam melaksanakan pengujian kuantitatif pada tanin harus diperhatikan adanya senyawa fenol lain yang dapat mengganggu kadar tanin. Penetapan dengan menggunakan spektrofotometri dapat
25
dilakukan dengan menambahkan pereaksi Folin Ciocalteau, larutan natrium karbonat jenuh pada ekstrak, kemudian dibiarkan bereaksi selama 25-30 menit.
Serapan dapat diukur dengan panjang gelombang 660 nm dan dapat digunakan pembanding berupa asam tanat. Selain itu juga dapat digunakan titrimetri dengan menggunakan larutan KMnO4 dan indikator indigosulfonat dengan perubahan warna dari biru menjadi kuning terang (Hanani,2015).
26 BAB III
PELAKSANAAN PENELITIAN
3.1 Waktu dan Tempat Pelaksanaan Penelitian
Penelitian ini telah dilaksanakan pada bulan Februari – September 2018 di Laboratorium Kimia Farmasi Kualitatif Fakultas Farmasi Universitas Andalas, Laboratorium Kimia Farmasi Kuantitatif Fakultas Farmasi Universitas Andalas dan Laboratorium Sentral Fakultas Farmasi Universitas Andalas.
3.2 Alat dan Bahan 3.2.1 Alat
Timbangan digital (Shimadzu-AUX 220, Jepang), Spektrofotometri Ultraviolet-Visibel (Shimadzu- UV 1700, Jepang), Rotary Vacum Evaporator (Buchi R-215) blender (Philips), Kertas saring whatman 42, alat gelas standar laboratorium lainnya.
3.2.2 Bahan
Herba seledri (Apium Graveolens L), Hexane (Brataco), Aseton (Brataco), Metanol (Brataco), Etanol (Merck), 1-Butanol (Merck), Dietil Eter (Merck), Etil Asetat (Merck), Sodium klorida (Merck), Aquadest, Asam Sulfat Pekat (Merck), Sodium Hidroksida (Merck), Copper (II) Sulfat (Merck), 1-naftol (Merck), Kalium Natrium Tartrat (Merck), Amonia (Merck), Aluminium Klorida(Merck), Serbuk Magnesium (Merck), Serbuk Seng (Merck), Asam Klorida (Merck), Kloroform (Merck), Asetat Anhidrida (Merck), Iodida (Merck), Kalium Iodida (Merck), Besi (III) Klorida (Merck), Timbal (II) Asetat (Merck),
27
Asetat Glasial (Merck), Bismut (II) Nitrat (Merck), Asam Nitrat (Merck), Folin Ciocalteau (Merck), Raksa (II) Klorida (Merck), Isopropil Alkohol (Merck), Natrium Sulfat Anhidrat (Merck), Natrium Karbonat (Merck) dan Natrium Asetat (Merck).
3.3 Prosedur Penelitian 3.3.1 Pengambilan Sampel
Herba seledri (Apium graveolens L) dibeli di daerah Padang luar, Kabupaten Agam sebanyak 5 Kg. Pengeringan dilakukan dengan cara kering angin di Kebun Tanaman Obat Fakultas Farmasi Universitas Andalas. Kemudian dilakukan penghalusan menggunakan blender.
3.3.2 Karakterisasi Simplisia 3.3.2.1 Pemeriksaan Organoleptis
Pengamatan secara organoleptis dilakukan untuk mengetahui karakteristik dari serbuk simplisia. Pengamatan yang dilakukan meliputi bentuk, warna, dan bau dari serbuk simplisia (Departemen Kesehatan Republik Indonesia, 2008)
3.3.2.2 Susut Pengeringan
Kurs porselin dipanaskan pada suhu 105ᵒC selama 30 menit dan ditara.
Kemudian ditimbang sebanyak 2 gram serbuk simplisia dan dimasukkan kedalam kurs yang sudah ditara. Setelah itu kurs yang berisi serbuk simpisia dimasukkan
28
kedalam oven, lalu dipanaskan pada suhu 105ᵒC selama 5 jam. Setelah dipanaskan krus dimasukkan kedalam desikator selama 15 menit dan ditimbang kembali. Proses pengeringan dilanjutkan dan ditimbang kembali selama 1 jam hingga berat konstan. Pengerjaan diulangi sebanyak 2 kali. (Departemern Kesehatan Rerpublik Indonesia, 2000)
Perhitungan susut pengeringan dilakukan menggunakan rumus, sebagai berikut Susut pengeringan = ( ) x 100%
Keterangan: A= Berat kurs porselin kosong (g) B = Berat kurs porselin + simplisia (g)
C = Berat kurs porselin + simplisia yang telah dikering (g) 3.3.2.3 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk simplisia dimasukkan kedalam kurs silikat yang telah dipijar dan ditara. Serbuk simplisia dipijar perlahan-lahan hingga arang habis kemudian didinginkan dan ditimbang, dipijarkan hingga bobot tetap. Kadar abu total dihitung terhadap berat bahan uji, dinyatakan dalam %b/b. Pengerjaan diulangi sebanyak 2 kali. (Departemen Kesehatan Republik Indonesia, 2013).
Kadar Abu =
x 100%
Keterangan : A = Berat krus + simplisia sebelum pemijaran (g) B = Berat krus + simplisa setelah pemijaran (g) C = Berat kurs kosong (g)
29
3.3.2.4 Penetapan Kadar Abu Tidak Larut Asam
Didihkan abu yang diperoleh pada penetapan kadar abu total dengan 25 mL asam klorida 2 N selama 5 menit. Bagian yang tidak larut dalam asam dikumpukan dan disaring melalui kertas saring bebas abu. Kemudian dicuci dengan air panas dan dipijarkan dalam kurs hingga bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap berat bahan uji dinyatakan dalam % b/b (Departemen Kesehatan Republik Indonesia, 2013).
Kadar abu tidak larut asam =
x 100%
3.3.2.5 Penetapan Kadar Sari Larut Air
Ditimbang sebanyak 5 g serbuk simplisia dan dimasukkan ke dalam labu bersumbat. Kemudian kedalam labu ditambahkan 100 mL air jenuh kloroform dan dikocok berkali-kali selama 6 jam pertama kemudian dibiarkan selama 18 jam.
Setelah didiamkan sari disaring. Filtrat diambil sebanyak 20 mL kemudian diuapkan hingga kering dalam cawan dangkal beralas datar yang telah dipanaskan 105ᵒC hingga bobot tetap. Pengulangan dilakukan sebanyak 2 kali. Kadar dihitung dalam % sari larut air. (Departemen Kesehatan Republik Indonesia, 2013).
Kadar Sari Larut Air =
x
x 100 % 3.3.2.6 Penentapan Kadar Sari Larut Etanol
Ditimbang sebanyak 5 g serbuk simplisia dan dimasukkan ke dalam labu bersumbat kemudian ditambahkan 100 mL etanol, dikocok berkali-kali selama 6
30
jam pertama dan dibiarkan selama 18 jam. Sari disaring dengan cepat untuk menghindari terjadinya penguapan etanol. Diambil sebanyak 20 mL fitrat lalu filtrat diuapkan hingga kering dalam cawan dangkal beralas datar yang telah dipanaskan pada suhu105ᵒC hingga bobot tetap. Pengerjaan diulangi sebanyak 2 kali. Kadar dihitung dalam % sari larut etanol (Departemen Kesehatan Republik Indonesia, 2013)
Kadar Sari Larut Etanol = x
x 100%
3.3.3 Penyiapan Ekstrak Seledri (Apium graveolens L) 3.3.3.1. Ekstrak Heksana
Sebanyak 50 gram serbuk simpisia, dimasukkan kedalam erlenmeyer.
Sampel diekstraksi dengan metode maserasi dengan menggunakan pelarut n- heksana. n-Heksana ditambahkan sebanyak 500 mL. Selama 6 jam pertama sampel diaduk menggunakan orbital shaker, kemudian didiamkan selama 18 jam (Departemen Kesehatan Republik Indonesia, 2008). Maserat dipisahkan dengan kertas saring. Proses diulangi sebanyak 2 kali pengulangan dengan pelarut yang sama. Sehingga total maserat didapatkan kurang lebih 1,5 L. Maserat yang diperoleh diuapkan sampai volumenya 500 mL menggunakan rotary evaporator dengan tekanan rendah (Departemen Kesehatan Republik Indonesia, 1995).
Sehingga nanti didapatkan ekstrak cair dari herba seledri.
31 3.3.3.2. Ekstrak Aseton
Sebanyak 50 gram serbuk simplisia dimasukkan ke dalam erlenmeyer.
Sampel diekstraksi dengan metode maserasi dengan menggunakan pelarut aseton.
Pelarut ditambahkan sebanyak 500 mL. Sampel dimaserasi selama 24 jam dimana pada 6 jam pertama sampel diaduk menggunakan orbital shaker, kemudian didiamkan selama 18 jam (Departemen Kesehatan Republik Indonesia, 2008).
Maserat disaring menggunakan kertas saring. Proses diulangi sebanyak 2 kali pengulangan dengan pelarut yang sama. Sehingga total maserat didapatkan kurang lebih 1,5 L. Maserat yang diperoleh diuapkan sampai volumenya 500 mL menggunakan rotary evaporator dengan tekanan rendah (Departemen Kesehatan Republik Indonesia, 1995). Sehingga nanti didapatkan ekstrak cair dari herba seledri.
3.3.2.3 Ekstrak Metanol
Sebanyak 50 gram serbuk simplisia, dimasukkan kedalam erlenmeyer.
Sampel diekstraksi dengan metode maserasi dengan menggunakan pelarut metanol. Pelarut ditambahkan sebanyak 500 mL. Sampel dimaserasi selama 24 jam dimana pada 6 jam pertama sampel diaduk menggunakan orbital shaker, kemudian didiamkan selama 18 jam (Departemen Kesehatan Republik Indonesia, 2008). Maserat disaring dengan menggunakan kertas saring. Proses diulangi sebanyak 2 kali pengulangan dengan pelarut yang sama. Sehingga total maserat didapatkan kurang lebih 1,5 L. Maserat yang diperoleh diuapkan sampai volumenya 500 mL menggunakan rotary evaporator dengan tekanan rendah
32
(Departemen Kesehatan Republik Indonesia, 1995). Sehingga nanti didapatkan ekstrak cair dari herba seledri.
3.3.2.4 Ekstrak Air
Infusa dibuat dengan cara 50 gram serbuk simplisia dimasukkan ke dalam 500 mL akuades dalam erlenmeyer. Erlenmeyer diletakkan dalam gelas beker berisi air dan dipanaskan di atas hot plate selama 15 menit dihitung mulai suhu 90oC sambil sesekali diaduk. Setelah 15 menit, air rebusan yang telah dingin disaring dengan menggunakan kain flanel ke dalam labu ukur 500 mL. Untuk mencukupi kekurangan air, ditambahkan akuades yang mendidih melalui ampasnya hingga volume mencapai 500 mL (Departemen Kesehatan Republik Indonesia, 1995).
3.3.3 Penyiapan Reagen a. Pembuatan Pereaksi Biuret
Larutan A: NaOH 40% (ditimbang 40 g natrium hidroksida dilarutkan dengan air sampai 100 mL).
Larutan B : CuSO4 1% (ditimbang sebanyak 1 g tembaga (II) sulfat dilarutkan dengan air sampai 100 mL) (Rivai et al., 2010).
b. Pembuatan Reagen Molisch
Sebanyak 3 gram 1-naftol ditimbang dan dilarutkan dengan etanol 96%
sampai 100 mL (Rivai et al., 2010).
33 c. Pembuatan pereaksi Fehling
Fehling A: Ditimbang sebanyak 6.9 gram tembaga (II) sulfat kemudian dilarutkan dengan air suling sampai 100 mL dan ditambahkan 2 tetes asam sulfat pekat.
Fehling B: Ditimbang sebanyak 36,4 gram kalium natrium-tatrat dan 10 gram natrium sulfat kemudian dilarutkan dengan air suling sampai 100 mL (Rivai et al., 2010).
d. Pembuatan Pereaksi besi (III) klorida 1%
Ditimbang sebanyak 1 g kristal besi (III) klorida kemudian dilarutkan dengan air sampai 100 mL (Rivai et al., 2010).
e. Pembuatan Pereaksi Dragendorff
Sebanyak 8 gram bismuth (III) nitrat ditimbang, dilarutkan dalam 20 mL asam nitrat pekat. Dilarutkan 27,2 gram kalium iodida dalam 50 mL aquadest pada wadah lain. Larutan yang jernih diambil dan diencerkan dengan akuades hingga volume larutan 100 mL (Departemen Kesehatan Republik Indonesia, 1995).
f. Pembuatan Pereaksi Mayer
Sebanyak 1,36 gram raksa (II) klorida ditimbang dan dilarutkan dalam aquades hingga diperoleh volume larutan 60 mL. Sebanyak 5 gram kalium iodida ditimbang, dilarutkan dalam 10 mL aquades pada wadah yang berbeda, kemudian kedua larutan dicampurkan dalam satu wadah. Campuran larutan tersebut ditambahkan dengan aquadest hingga diperoleh volume larutan sebanyak 100 mL (Departemen Kesehatan Republik Indonesia, 1995).
34 g. Pembuatan Pereaksi Wagner
Sebanyak 4 gram kalium iodida dilarutkan dalam akuades, kemudian 2 gram iodium dilarutkan dalam larutan kalium iodida dan dicukupkan dengan akuades 100 mL (Departemen Kesehatan Republik Indonesia, 1995).
l. Pembuatan Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 gram timbal (II) asetat dilarutkan dalam akuades bebas CO2
hingga 100 mL (Departemen Kesehatan Republik Indonesia, 1995).
3.3.4 Analisis Kualitatif
Setiap ekstrak herba seledri ( Apium graveolens L) dianalisis untuk melihat adanya variasi fitokimia seperti steroid, triterpenoid, saponin, alkaloid, karbohidrat, flavonoid, glikosida dan fenolat melalui prosedur fitokimia standar (Rivai et al., 2010).
3.3.4.1 Protein dan asam amino
Sebanyak 1 mL larutan NaOH 40% ditambahkan 2 tetes larutan CuSO4
1% akan menghasilkan warna biru kemudian ditambahkan ke dalam 1 mL ekstrak. Terbentuknya warna merah muda atau ungu violet menunjukkan adanya protein (Rivai et al., 2010).
3.3.4.2 Uji Minyak dan lemak
a. Sebanyak 0,5 mL ekstrak, ditekan diantara kertas saring kemudian kertas saringnya tersebut diamati, terlihatnya kertas saring yang tembus pandang
35
menandakan adanya minyak. Sebagai pembanding digunakan minyak zaitun (Rivai et al., 2010).
b. Sebanyak 1 mL ekstrak, ditambah dengan asam sulfat 25 %. Pengamatan dilakukan dengan pemanasan dan positif ditandai dengan terbentuknya warna coklat muda. Pada glikolipid terbentuk warna coklat kemerahan, sedangkan sulfolipid terbentuk merah terang. (Hanani,2015)
3.3.4.3 Uji Karbohidrat a. Uji Molish
Sebanyak 1 mL ekstrak dimasukkan ke dalam tabung reaksi, ditambahkan 5 tetes reagen Molish dan dikocok. Kemudian ditambahkan 2 mL asam sulfat pekat dengan hati-hati, terbentuknya cincin berwarna ungu pada batas cairan menunjukkan adanya karbohidrat.
b. Uji Fehling
Pada 1 mL ekstrak, ditambahkan sama banyak larutan Fehling A dan Fehling B, kemudian dipanaskan, terbentuknya endapan merah bata menunjukkan adanya gula pereduksi. Dalam hal-hal tertentu reduksi terjadi di dekat titik didih dan ditunjukkan oleh endapan merah bata (Rivai et al., 2010).
3.3.4.4 Uji Flavonoid
Sebanyak 10 mL ekstrak cair diuapkan pelarutnya hingga kering.
Kemudian ditambahkan dengan 10 mL metanol P dan direfluks selama 10 menit. Hasil disaring dengan menggunakan kertas saring saat masih panas. Filtrat diencerkan dengan 10 mL air dan kemudian didinginkan. Setelah dingin,
36
ditambahkan petroleum eter dan kocok secara hati-hati kemudian didiamkan.
Lapisan metanol diuapkan pada suhu 400C dibawah tekanan. Sisa di larutkan dengan 5 mL etil asetat, lalu disaring.
a. Sebanyak 1 mL larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam 1-2 mL etanol 96%, ditambahkan 0,5 g serbuk seng dan 2 mL asam klorida 2 N, didiamkan selama satu menit. Ditambahkan 10 mL asam klorida pekat, jika dalam waktu 2-5 menit terjadi warna merah yang intensif maka positif (-) menunjukkan adanya flavonoida dan apabila tidak terbentuk warna merah, maka menunjukkan hasil negatif (-) untuk senyawa flavonoid.
b. Sebanyak 1 mL larutan percobaaan diuapkan hingga kering, sisanya dilarutkan dalam 1 mL etanol 96%, ditambahkan 0,1 g magnesium dan 10 tetes asam klorida pekat, terjadi warna merah jingga sampai merah ungu intensif maka positif (+) menunjukkan adanya flavonoida dan apabila tidak terbentuk warna merah jingga sampai merah ungu, maka menunjukkan hasil negatif (-) untuk senyawa flavonoid (Departemen Kesehatan Republik Indonesia, 1995).
3.3.4.5 Uji Alkaloid
Sebanyak 10 mL ekstrak di uapkan hingga kering, sisa kering dari ekstrak ditambahkan 1 mL asam klorida 2N dan 9 mL air kemudian dipanaskan diatas penangas air selama 2 menit. Didinginkan lalu disaring. Filtrat kemudian digunakan untuk percobaan berikut.
a. Diambil 0,5 mL filtrat, lalu ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan putih atau kuning
37
b. Diambil 0,5 mL filtrat, lalu ditambahkan 2 tetes pereaksi Wagner, akan menunjukkan endapan coklat
c. Diambil 0,5 mL filtrat, lalu ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk endapan coklat atau jingga kecoklatan
Alkaloid positif jika terjadi endapan atau kekeruhan paling sedikit dua dari tiga percoban (Departemen Kesehatan Republik Indonesia, 1995).
3.3.4.6 Steroid dan Terpenoid a. Steroid
Sebanyak 2 mL ekstrak ditambahkan asam asetat anhidrat 2 mL. Kemudian ditambahkan dengan 2 mL asam sulfat pekat secara hati-hati pada dinding tabung. Perubahan warna dari violet ke hijau atau biru menunjukkan adanya steroid.
b. Terpenoid
Sebanyak 5 mL ekstrak dicampur dengan 2 mL kloroform dan 3 mL asam sulfat pekat secara hati-hati pada dinding tabung. Adanya warna coklat kemerahan diantara lapisan yang terbentuk menunjukkan adanya terpenoid (Ajiboye, et al., 2013)
3.3.4.7 Fenolat dan Tanin a. Uji Fenolat
Ekstrak diambil sebanyak 1 mL dan ditambahkan 1-2 tetes larutan pereaksi besi (III) klorida 1%. Larutan akan terjadi warna biru atau hijau kehitaman menunjukkan adanya senyawa fenolat.
38 b. Uji Tanin
Ekstrak diambil sebanyak 2 mL kemudian ditambahkan larutan pereaksi besi (III) klorida 1%. Larutan akan terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin. Ekstrak diambil sebanyak 2 mL kemudian ditambahkan pereaksi timbal (II) asetat, adanya endapan putih menunjukkan positif tanin ( Rivai et al., 2010)
3.3.4.8 Saponin
Sebanyak 10 mL ekstrak cair diuapkan di penagas air hingga kering.
Sisa kering ditambahkan dengan 10 mL air panas, didinginkan kemudian dikocok kuat selama 10 detik. Apabila terbentuk busa yang mantap selama tidak kurang dari 10 menit, setinggi 1-10 cm dan ketika dilakukan penambahan 1 tetes asam klorida 2N buih tidak hilang menandakan bahwa adanya saponin (Departemen Kesehatan Republik Indonesia, 1995).
3.3.4.9 Uji Glikosida
Sebanyak 10 mL ekstrak diuapkan di penangas air, kemudian ditambahkan dengan 30 mL campuran (7 bagian volume etanol 95% dan 3 bagian volume air) dan ditambahkan asam klorida 2 N hingga pH ±2 kemudian direfluks selama 10 menit, didinginkan dan disaring. Pada 20 mL filtrat ditambahkan 25 mL air suling dan 25 timbal (II) asetat 0.4 M, dikocok, didiamkakan selama 5 menit lalu disaring. Filtrat disari sebanyak 3 kali, tiap kali penyarian digunakan 20 mL campuran kloroform-isopropanol (3:2). Pada kumpulan sari ditambahkan natrium sulfat anhidrat P, disaring, dan diuapkan pada suhu tidak lebih dari 50ᵒC.
39
Sisa dilarutkan dalam 2 mL metanol P. Kemudian diambil 1 mL larutan percobaan dimasukkan kedalam tabung reaksi, diuapkan diatas penangas air. Pada sisa ditambahkan 2 mL air dan 2 tetes pereaksi Molish, ditambahkan dengan hati hati 2 mL asam sulfat pekat. Jika terbentuk cincin berwarna ungu pada batas kedua cairan menunjukkan adanya glikosida (Departemen Kesehatan Republik Indonesia, 1995).
3.3.5 Pengujian Kuantitatif Senyawa 3.3.5.1 Penetapan Kadar Alkaloid Total
Sebanyak 20 mL sampel ekstrak cair dilarutkan dengan 100 mL metanol P dan 10 mL amoniak P, kemudian dipanaskan diatas penangas air selama 30 menit. Penyarian diulangi sebanyak 2 kali menggunakan jenis dan pelarut yang sama. Ditambahkan 50 mL asam klorida 1 N LP pada kumpulan filtrat, diuapkan hingga volume kurang dari 25 mL, disaring dalam corong pisah.
Filtrat dibasakan dengan amoniak P sampai pH ± 10, disari 3 kali dengan 25 mL kloroform. Fase kloroform dikumpulkan dan diuapkan pada suhu 50ᵒC, kemudian dikeringkan pada suhu 100ᵒC hingga bobot tetap. Sisa pengeringan dihitung sebagai alkaloid total (Departemen Kesehatan Republik Indonesia, 2008).
3.3.5.2 Penentapan Kadar Saponin Total
Sebanyak 50 mL ekstrak yang telah dikeringkan pelarutnya ditambah dengan 25 mL etanol 20%. Sampel dipanaskan diatas waterbath selama 4 jam dengan pengadukan secara kontiniu pada suhu 55ᵒC. Campuran disaring dan