ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT JERUK
TELUR BUAYA (Citrus medica L.) SECARA GC-MS DAN UJI
ANTIOKSIDAN DENGAN METODE DPPH
SKRIPSI
GRIGNARD NATANAEL SILALAHI
120822013
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT JERUK
TELUR BUAYA (Citrus medica L.) SECARA GC-MS DAN UJI
ANTIOKSIDAN DENGAN METODE DPPH
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
GRIGNARD NATANAEL SILALAHI
120822013
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Analisis komponen kimia minyak atsiri kulit jeruk
telur buaya (Citrus medica L.) secara GC-MS dan uji antioksidan dengan metode DPPH
Katagori : Skripsi
Nama : Grignard Natanael Silalahi
Nomor Induk Mahasiswa : 120822013
Program Studi : Sarjana (S1) Kimia
Dapartemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas
Sumatera Utara
Disetujui di
Medan, Juni 2015
Komisi Pembimbing
Pembimbing 2, Pembimbing 1,
Dr. Lamek Marpaung, M.Phil,Ph.D Drs. Albert Pasaribu,M.Sc
NIP. 195208281982031001 NIP.196408101991031002
Disetujui Oleh
Dapartemen Kimia FMIPA USU Ketua,
PERNYATAAN
ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT JERUK
TELUR BUAYA (Citrus medica L.) SECARA GC-MS DAN UJI
ANTIOKSIDAN DENGAN METODE DPPH
SKRIPSI
Saya mengakui bahwa ini adalah hasil karya saya sendiri. Kecuali beberapa kutipan
dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2015
Grignard Natanael Silalahi
PENGHARGAAN
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa, yang telah memberi segalanya dan juga memampukan penulis untuk menyelesaikan skripsi ini sebagai salah satu syarat untuk menyelesaikan pendidikan sarjana sains di Fakultas MIPA USU. Adapun judul skripsi ini adalah “ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT JERUK TELUR BUAYA (Citrus medica L.)SECARA GC-MS DAN UJI ANTIOKSIDAN DENGAN METODE DPPH.
Ada pun rasa terima kasih yang ingin penulis sampaikan kepada :
1. Bapak Dr. Sutarman, M.Sc selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
2. Ibu Dr. Rumondang Bulan, MS dan Bapak Drs. Albert Pasaribu, M.Sc selaku Ketua dan Sekretaris Departemen Kimia FMIPA USU.
3. Bapak Dr. Darwin Yunus, MS selaku Ketua Bidang Kimia Ekstensi FMIPA USU. 4. Bapak Drs. Albert Pasaribu,M.Sc selaku pembimbing 1 dan kepada Bapak
Dr. Lamek Marpaung, M.Phil,Ph.D selaku pembimbing ke 2 yang telah meluangkan waktu selama penulis melakukan penelitian dan memberikan bimbingan dalam penyusunan skripsi ini hingga selesai.
5 Bapak dan Ibu Staf pengajar FMIPA USU serta pegawai Departemen Kimia FMIPA USU.
6. Sahabat-sahabat penulis Novita Marpaung, Juwita, William, Echo, Trisno, Renal, Sony, Yusven, Martina, Yulia, Ria, Adelia, Echa, Bebes, Imar, Tumiar, Ida, Elvi serta rekan-rekan mahasiswa khususnya Kimia Ekstensi 2012 yang tidak dapat saya sebutkan namanya satu- persatu
Akhirnya, penulis mengucapkan terima kasih yang sebesar-besarnya kepada Kedua orang tua tercinta Ayahanda Drs.Haposan Silalahi dan Ibunda Hulda Sihombing serta saudara penulis Roy Sondi Silalahi, Florence Silalahi dan Fito Silalahi yang telah memberikan semangat serta perhatian yang cukup besar selama masa penyelesaian skripsi ini dan perkuliahan penulis. Penulis menyadari bahwa skripsi ini masih jauh dari sempurna karena keterbatsan penulis. Semoga skripsi ini dapat bermanfaat bagi penelitian dan ilmu pengetahuan.
ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT JERUK TELUR BUAYA (Citrus medica L.) SECARA GC-MS DAN UJI
ANTIOKSIDAN DENGAN METODE DPPH
ABSTRAK
Minyak atsiri kulit jeruk telur buaya(Citrus medica L) telah diisolasi dengan metode hidrodestilasi menggunakan alat Sthal. Kulit jeruk telur buaya dihidrodestilasi selama ±4-5 jam menghasilkan minyak atsiri 0,3064% (b/b). Komponen kimia minyak atsiri kulit jeruk telur buaya dianalisis menggunakan GC-MS menunjukkan ada 14 senyawa dimana komponen utamanya adalah 1-limonene (70,46%). Uji aktivitas antioksidan dilakukan dengan metode DPPH (2,2-diphenyl-1-picryl-hydrazil).Nilai IC50 yaitu
873,39g/L.
ANALYSIS OF THE RIND OF JERUK TELUR BUAYA (Citrus medica L.) ESSENTIAL OIL COMPONENTS WITH GC-MS
AND TEST DPPH ANTIOXIDANT METHOD
ABSTRACT
Essential oils of the rind of jeruk telur buaya (Citrus medica L) has been isolated with hydrodestillation method using Stahl. It hydrodestilled for ± 4-5 hours to produce essential oil 0.3064% (w/w). The chemical components of essential oil of rind of jeruk telur buaya were analyzed by GC-MS showed there are 14 compounds in which the main components are 1-limonene (70,46%). Antioxidant activity test has been done with DPPH (2,2-diphenyl-1-picryl-hydrazil) method with IC50 values 873.39
mg/L.
DAFTAR ISI
1.3. Pembatasan Masalah 2
1.4. Tujuan Penelitian 2
1.5. Manfaat Penelitian 2
1.6. Lokasi Penelitian 3
1.7. Metodologi Penelitian 3
BAB 2. TINJAUAN PUSTAKA
2.1. Tanaman Jeruk Telur Buaya (Citrus medica L.) 4
2.2. Minyak Atsiri 5
2.2.1. Komposisi Minyak Atsiri 6
2.2.2. Biosintesa Minyak Atsiri 7
2.2.3. Metode Isolasi 11
2.3. Analisa Komponen Kimia Minyak Atsiri dengan GC-MS 13
2.3.1. Kromatografi Gas 14
2.3.2. Spektroskopi Massa 16
2.4. Antioksidan 19
2.4.1. Pengertian Antioksidan 19
2.4.2. Pengolongan Antioksidan 20
2.4.3. Metode Pengukuran Aktivitas Antioksidan 21
BAB 3. METODE PENELITIAN
3.1. Alat-alat 22
3.3. Prosedur Penelitian 23
3.3.1. Penyediaan Sampel 23
3.3.2. Isolasi Minyak Atsiri Kulit Jeruk Telur Buaya dengan 23 Alat Destilasi Stahl
3.3.3. Analisis Minyak Atsiri Kulit Jeruk Telur Buaya 23 dengan GC-MS
3.3.4. Uji Antioksidan Minyak Atsiri Kulit Jeruk Telur Buaya 24 Dengan Metode DPPH
3.3.4.1. Pembuatan Larutan DPPH 0.3 mM 24
3.3.4.2. Pembuatan Variasi Konsentrasi Minyak 25 Atsiri Kulit Jeruk Telur Buaya
3.3.4.3. Uji Aktivitas Antioksidan 25
3.3.4.3.1 Larutan Blanko 25
3.3.4.3.2 Uji Aktivitas Antioksidan 25
Kulit Jeruk Telur Buaya
3.4. Bagan Penelitian 26
3.4.1. Isolasi Minyak Atsiri Kulit Jeruk Telur Buaya 26 Dengan Destilasi Stahl
3.4.2. Uji Sifat Antioksidan Minyak Atsiri Kulit Jeruk Telur 27 Dengan Metode DPPH
3.4.2.1. Pembuatan Larutan DPPH 0.3 mM 27
3.4.2.2. Pembuatan Variasi Konsentrasi Minyak Atsiri 28
3.4.2.3. Uji Aktivitas Antioksidan 29
BAB 4. HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian 30
4.1.1. Penentuan Kadar Minyak Atsiri 30
4.1.2. Hasil Analisa dengan GC-MS 30
4.1.3. Hasil Uji Antioksidan Minyak Atsiri Kulit Jeruk 33 Telur Buaya
4.2. Pembahasan 34
4.2.1. Minyak Atsiri dari Hasil Destilasi dengan Alat Stahl 34 4.2.2. Analisis Spektrum Massa Minyak Atsiri Kulit Jeruk 34
Telur Buaya
4.2.3. Uji Aktivitas Antioksidan Minyak Atsiri 45
Kulit Jeruk Telur Buaya
BAB 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan 47
5.2. Saran 47
DAFTAR TABEL
Nomor Tabel Judul Halaman
Tabel 4.1. Minyak Atsiri daun jeruk telur buaya yang 30
diperoleh dengan Metode hidrodestilasi
Tabel 4.2. Hasil Analisis GC-MS minyak atsiri kulit jeruk telur 32 buaya sesuai dengan standart Library Wiley
Tabel 4.3. Senyawa utama Hasil Analisa GC-MS minyak atsiri 32 kulit jeruk telur buaya
Tabel 4.4. Hasil Pengukuran Absorbansi Minyak Atsiri kulit jeruk 33 telur buaya
DAFTAR GAMBAR
Nomor Gambar Judul Halaman
Gambar 2.1. Tumbuhan Jeruk Telur Buaya 4
Gambar 2.2. Biosintesisa Terpenoid 9
Gambar 2.3. Perubahan senyawa monoterpen 10
Gambar 2.4. Reaksi biogenesis beberapa seskuiterpena 11
Gambar 2.5. Diagram sebuah spektrometer massa 17
Gambar 2.6. Diagram sebuah spektrometer massa 21
Gambar 2.7. Mekanisme Penghambatan Radikal DPPH 21
Gambar 4.1. Kromatogram Hasil Analisa GC-MS minyak atsiri 31 kulit jeruk telur buaya
Gambar 4.2. Grafik aktivitas antioksidan minyak atsiri kulit jeruk 33 telur buaya
Gambar 4.3. Spektrum massa senyawa 1-Limonen 35
Gambar 4.4. Pola Fragmentasi Senyawa 1-Limonen 36
Gambar 4.5. Senyawa Z-Citral 37
Gambar 4.6. Pola Fragmentasi Senyawa Z-Citral 38
Gambar 4.7. Senyawa beta-Myrcene 39
Gambar 4.8. Pola Fragmentasi Senyawa beta-Myrcene 40
Gambar 4.9. Reaksi DPPH dengan turunan fenol 41
DAFTAR LAMPIRAN
Nomor Lampiran Judul Halaman
Lampiran 1. Taksonomi Tumbuhan Jeruk Telur Buaya dari 50
Herbarium Bogoriense LIPI Bogor
Lampiran 2.1 Pohon Jeruk Telur Buaya 51
Lampiran 2.2 Buah Jeruk Telur Buaya 51
Lampiran 3. Gambar Alat Stahl 52
Lampiran 4. Grafik % Peredaman Vs Konsentrasi (ppm) 53
Lampiran 5. Pembuatan Variasi Konsentrasi Minyak Atsiri Jeruk 54 Telur Buaya
Lampiran 6. Hasil Uji Aktivitas Antioksidan Minyak Atsiri Kulit 55 Jeruk Telur Buaya
Lampiran 7. Perhitungan IC50 Minyak Atsiri 56
Lampiran 8. Pembuatan Larutan DPPH 0,3mM 57
ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT JERUK TELUR BUAYA (Citrus medica L.) SECARA GC-MS DAN UJI
ANTIOKSIDAN DENGAN METODE DPPH
ABSTRAK
Minyak atsiri kulit jeruk telur buaya(Citrus medica L) telah diisolasi dengan metode hidrodestilasi menggunakan alat Sthal. Kulit jeruk telur buaya dihidrodestilasi selama ±4-5 jam menghasilkan minyak atsiri 0,3064% (b/b). Komponen kimia minyak atsiri kulit jeruk telur buaya dianalisis menggunakan GC-MS menunjukkan ada 14 senyawa dimana komponen utamanya adalah 1-limonene (70,46%). Uji aktivitas antioksidan dilakukan dengan metode DPPH (2,2-diphenyl-1-picryl-hydrazil).Nilai IC50 yaitu
873,39g/L.
ANALYSIS OF THE RIND OF JERUK TELUR BUAYA (Citrus medica L.) ESSENTIAL OIL COMPONENTS WITH GC-MS
AND TEST DPPH ANTIOXIDANT METHOD
ABSTRACT
Essential oils of the rind of jeruk telur buaya (Citrus medica L) has been isolated with hydrodestillation method using Stahl. It hydrodestilled for ± 4-5 hours to produce essential oil 0.3064% (w/w). The chemical components of essential oil of rind of jeruk telur buaya were analyzed by GC-MS showed there are 14 compounds in which the main components are 1-limonene (70,46%). Antioxidant activity test has been done with DPPH (2,2-diphenyl-1-picryl-hydrazil) method with IC50 values 873.39
mg/L.
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Hampir seluruh tanaman penghasil minyak atsiri yang saat ini tumbuh di wilayah
Indonesia sudah dikenal oleh sebahagian masyarakat. Bahkan beberapa jenis tanaman
minyak atsiri menjadi bahan yang sangat penting dalam kehidupan sehari-hari.
Minyak atsiri dihasilkan dari bagian jaringan tanaman tertentu seperti akar, batang,
kulit, daun, buah atau biji. Sifat minyak atsiri yang menonjol antara lain mudah
menguap pada suhu kamar, mempunyai rasa getir, berbau wangi sesuai dengan aroma
tanaman yang menghasilkan dan umumnya larut dalam perarut organik (Lutony,
1994).
Ditinjau dari segi kimia fisika, minyak atsiri hanya mengandung dua golongan
senyawa, yaitu oleoptena dan stearoptena. Oleoptena adalah bagian hidrokarbon di
dalam minyak atsiri dan berwujud cairan. Umumnya senyawa golongan oleoptena ini
terdiri dari senyawa monoterpena, sedangkan stearoptena adalah senyawa hidrokarbon
teroksigenasi yang umumnya berwujud padat. Stearoptena ini umumnya terdiri atas
senyawa turunan oksigen dari terpena.
Pada dasarnya semua minyak atsiri mengandung campuran senyawa kimia dan
biasanya campuran tersebut sangat kompleks. Beberapa tipe senyawa organik
mungkin terkandung dalam minyak atsiri, seperti hidrokarbon, alkohol, oksidasi, ester,
aldehida, dan eter. (Agusta,2000)
Jeruk (Citrus sp.) adalah tanaman tahunan berasal dari Asia Tenggara,
terutama Cina. Sejak ratusan tahun yang lampau, tanaman ini sudah terdapat di
Citrus medica adalah sebuah spesies jeruk yang umumnya memiliki kulit tebal
dan bagian dalam yg kecil-kecil. Asalnya, pohon ini berasal dari Asia tenggara. Saat
ini banyak tumbuh di Sisilia, Maroko,Crete, Corsica, juga di Puerto Rico. Pohon ini
dapat tumbuh hingga 3 meter (Jones, 1992).
Penelitian terdahulu terhadap tumbuhan kulit jeruk yang memiliki kesamaan
genus dengan jeruk telur buaya dapat dilihat sebagai berikut:
- Kurnia Nirmala Tanjung dkk telah melakukan penelitian terhadap uji efektivitas
ekstrak kulit lemon (Citrus medica limonum) terhadap daya hambat pertumbuhan
Aeromona hydrophila secara in vitro (Nirmala dkk,2008).
Berdasarkan hasil penulusuran studi kepustakaan diperoleh informasi bahwa
penelitian komponen minyak atsiri kulit jeruk telur buaya masih terbatas, oleh sebab
itu peneliti tertarik untuk menganalisis komponen kimia minyak atsiri kulit jeruk telur
buaya secara gas chromatography – mass spectrometry (GC-MS) dan uji antioksidan dengan metode DPPH (2,2-diphenyl-1-picryl-hydrazil).
1.2. Permasalahan
1. Komponen utama senyawa kimia minyak atsiri apa sajakah yang terkandung dari
tanaman jeruk telur buaya secara GC-MS.
2. Bagaimanakah sifat antioksidan minyak atsiri kulit jeruk telur buaya.
1.3. Tujuan Penelitian
1. Untuk menentukan komponen kimia minyak atsiri yang terkandung didalam jeruk
telur buaya dengan analisis GC-MS.
2. Untuk menguji aktivitas antioksidan dari minyak atsiri jeruk telur buaya dengan
metode DPPH.
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi di bidang kimia organik bahan
alam mengenai kimia minyak atsiri serta memberi informasi tentang sifat antioksidan
1.6. Lokasi Penelitian
Penelitian untuk isolasi minyak atsiri dengan metode hidrodestilasi stahl dilakukan di
Laboratorium Kimia Bahan Alam FMIPA USU Medan, untuk analisis GC-MS
dilakukan di Laboratorium Kimia Organik FMIPA UGM Yogyakarta, untuk uji
aktifitas antioksidan minyak atsiri dilakukan di salah satu perusahaan swasta di kota
Medan, untuk uji taksonomi tumbuhan jeruk telur buaya dilakukan di LIPI Bogor.
1.7. Metodologi Penelitian
Penelitian yang dilakukan bersifat eksperimen laboratorium. Kulit jeruk telur buaya
yang diperoleh dari desa Salang Baru, Kota Kuta Cane, Kecamatan Aceh Tenggara,
dipotong kecil kecil lalu dikering-anginkan dan diisolasi melalui proses hidrodestilasi
dengan alat Stahl kemudian minyak yang diperoleh dianalisis komponen kimianya
menggunakan alat GC-MS, dilakukan uji aktivitas antioksidan dengan menggunakan
BAB 2
TINJAUAN PUSTAKA
2.1. Tanaman Jeruk Telur Buaya
Berdasarkan taksonominya, tumbuhan jeruk telur buaya termasuk dalam :
Kingdom : Magnoliophyta
Devisi : Magnoliopsida
Ordo : Sapindales
Famili : Rutaceae
Genus : Citrus
Species : Citrus medica L
Nama Lokal : Jeruk Telur Buaya (LIPI Bogor, 2014).
Citrus medica adalah sebuah spesies jeruk yang umumnya memiliki kulit tebal
dan bagian dalam yg kecil-kecil. Asalnya, pohon ini berasal dari Asia tenggara. Saat
ini banyak tumbuh di Sisilia, Maroko,Crete, Corsica, juga di Puerto Rico. Pohon ini
dapat tumbuh hingga 3 meter. Sedangkan buahnya dapat mencapai diameter 25 cm
dan berat hingga 4 kg. Bulir dari buah ini jarang dimanfaatkan. Kulitnya banyak
digunakan sebagai bahan tambahan untuk memasak. Kulit tersebut juga dapat dibuat
menjadi selai, juga nenbuat minyak nabati (Jones, 1992).
2.2. Minyak Atsiri
Minyak atsiri atau disebut juga minyak eteris adalah minyak yang bersifat mudah
menguap, yang terdiri dari campuran zat yang mudah menguap, dengan komposisi
dan titik didih yang berbeda-beda.
Pada mulanya istilah minyak atsiri atau minyak eteris adalah istilah yang
digunakan untuk minyak mudah menguap dan diperoleh dari tanaman dengan cara
penyulingan uap. Definisi ini, dimaksudkan untuk membedakan minyak/lemak dengan
minyak atsiri yang berbeda tanaman penghasilnya. Definisi ini akan lebih lengkap jika
kedalam kelompok ini dicantumkan pula minyak yang mudah menguap dengan
metode ekstaksi yaitu dengan cara menggunakan penyulingan uap (Guenther, 2006).
Ditinjau dari sumber alami minyak atsiri, substansi mudah menguap ini dapat
dijadikan sebagai ciri khas dari suatu jenis tumbuhan karena setiap tumbuhan
menghasilkan minyak atsiri dengan aroma yang berbeda. Dengan kata lain, setiap
jenis tumbuhan menghasilkan minyak atsiri yang spesifik. Memang ada beberapa
minyak atsiri yang memiliki aroma yang mirip, tetapi tidak persis sama, dan sangat
tergantung pada komponen kimia penyusun minyak tersebut (Agusta, 2000).
Istilah essensial dipakai pada minyak atsiri karena minyak atsiri mewakili dari
bau tanaman asalnya. Dalam keadaan segar dan murni tanpa pencemaran, minyak
atsiri umumnya tidak berwarna. Namun pada penyimpanan lama minyak atsiri dapat
teroksidasi dan membentuk resin serta warnanya berubah menjadi lebih tua (gelap).
Untuk mencegah supaya tidak berubah warna, minyak atsiri harus terlindungi dari
pengaruh cahaya, misalnya disimpan dalam bejana gelas yang gelap. Bejana tersebut
dengan oksigen udara, ditutup rapat serta disimpan di tempat yang kering dan sejuk
(Gunawan dan Mulyani, 2004).
Minyak yang terdapat di alam terbagi menjadi 3 golongan yaitu minyak
mineral (mineral oil), minyak nabati dan hewani yang dapat dimakan (edible fat) dan
minyak atsiri (essential oil). Dalam tanaman, minyak atsiri mempunyai 3 fungsi,
yaitu:
1. membuat proses penyerbukan dengan menarik jenis serangga atau hewan,
2. mencegah kerusakan tanaman oleh serangga atau hewan dan
3. sebagai cadangan makanan dalam tanaman.
Minyak atsiri dalam industri digunakan untuk pembuatan kosmetik, parfum,
antiseptik, obat-obatan “flavoring agent”dalam bahan pangan atau minuman dan sebagai pencampur rokok kretek (Ketaren, 1985).
Minyak atsiri dihasilkan dari bagian jaringan tanaman tertentu seperti akar,
batang, kulit, daun, bunga, buah, biji. Sifat minyak atsiri yang menonjol antara lain
mudah menguap pada suhu kamar, mempunyai rasa getir, berbau wangi sesuai dengan
aroma tanaman yang menghasilkannya, dan umumnya larut dalam pelarut organik.
Istilah yang digunakan untuk menyebut minyak atisri misalnya dalam bahasa inggris
disebut essential oil, ethereal oils dan volatile oil (Lutony, 1994)
2.2.1. Komposisi Minyak Atsiri
Pada umumnya variasi komposisi minyak atsiri disebabkan oleh perbedaan jenis
tanaman penghasil, kondisi iklim, tanah tempat tumbuh, umur panenan, metode
ekstraksi yang dipergunakan dan cara penyimpanan minyak (Ketaren, 1985).
Minyak atsiri umumnya terdiri dari berbagai campuran persenyawaan kimia
yang terbentuk dari unsur carbon (C) , hidrogen (H), oksigen (O) serta beberapa
persenyawaan kimia yang mengandung unsur nitrogen (N) dan belerang (S). Pada
umumnya komponen kimia dalam minyak atsiri dibagi 2 golongan yaitu :
1. Golongan hidrokarbon
Persenyawaan yang termasuk golongan hidrokarbon terbentuk dari unsur hidrogen (H)
dan carbon (C). Jenis hidrokarbon yang terdapat dalam alam dan minyak atsiri
diterpen (4 unit isoprene) dan politerpen serta paraffin, olefin dan hidrokarbon
tidak jenuh umumnya tersusun dari terpen. Komponen lainnya terdiri dari
persenyawaan fenol, asam organik yang terikat dalam bentuk ester misalnya
lakton,kumarin dan turunan furan misalnya quinines.
Pada umumnya sebagian besar minyak atsiri terdiri dari campuran
persenyawaan golongan hidrokarbon dan oxygenated hidrocarbon. Disamping itu
minyak atsiri mengandung resin dan lilin dalam jumlah kecil yang merupakan
komponen tidak dapat menguap (Ketaren, 1985).
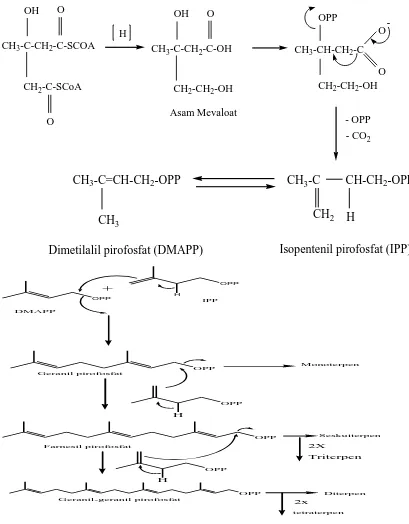
2.2.2. Biosintesis Minyak Atsiri
Berdasarkan proses biosintesisnya atau pembentukan komponen minyak atsiri di
dalam tumbuhan, minyak atsiri dapat dibedakan menjadi dua golongan. Golongan
pertama adalah turunan terpena yang terbentuk dari asam asetat melalui jalur
biosintesis asam mevalonat. Golongan kedua adalah senyawa aromatik yang terbentuk
dari biosintesis asam sikimat melalui jalur fenil propanoid (Agusta, 2000). Mekanisme
dari tahap-tahap reaksi biosintesis terpenoid yaitu asam asetat yang telah diaktifkan
oleh koenzim A melalui kondensasi jenis Claisen menghasilkan asam asetoasetat.
Senyawa yang dihasilkan ini dengan koenzim A melakukan kondensasi sejenis aldol
menghasilkan rantai karbon bercabang sebagaimana ditemukan pada asam mevalonat.
Reaksi-reaksi berikutnya ialah fosforilasi, eliminasi asam fosfat dan dekarboksilasi
menghasilkan IPP (Isopentenil Pirofosfat) yang selanjutnya berisomerisasi menjadi
DMAPP (Dimetilalil Pirofosfat) oleh enzim isomerase. IPP sebagai unit isoprene aktif
bergabung secara kepala ke ekor dengan DMAPP dan penggabungan ini merupakan
langkah pertama dari polimerisasi isopren untuk menghasilkan terpenoid.
Penggabungan ini terjadi karena serangan elektron dari ikatan rangkap IPP terhadap
pirofosfat. Serangan ini menghasilkan geranil pirofosfat (GPP) yakni senyawa antara
bagi semua senyawa monoterpen.
Sintesa terpenoid sangat sederhana sifatnya. Ditinjau dari segi teori reaksi
organik sintesa ini hanya menggunakan beberapa jenis reaksi dasar. Reaksi-reaksi
selanjutnya dari senyawa antara GPP, FPP, dan GGPP untuk menghasilkan senyawa
-senyawa terpenoid satu per satu hanya melibatkan beberapa jenis reaksi sekunder
pula. Reaksi –reaksi sekunder ini lazimnya addalah hidrolisa, siklisasi, oksidasi, reduksi, dan reaksi-reaksi spontan yang dapat berlangsung dengan mudah dalam
suasana netral dan pada suhu kamar, seperti isomerisasi, dehidrasi, dekarboksilasi, dan
sebagainya. Berikut ini adalah reaksi biosintesa terpenoid dapat dilihat pada gambar
2.2.
CH3-C-SCoA
Asetil koenzim A Asetoasetil koenzim A
+ CH3-C-SCoA
O
CH3-C-SCoA
O O O O
OH O
Dimetilalil pirofosfat (DMAPP) Isopentenil pirofosfat (IPP) CH3-C=CH-CH2-OPP
Gambar 2.2. Biosintesisa Terpenoid (Achmad, 1986)
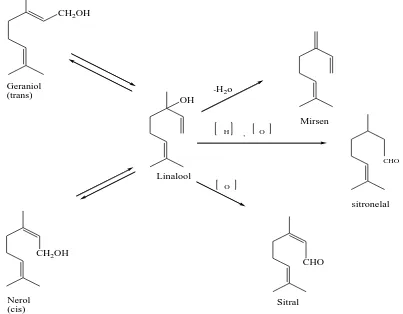
Untuk menjelaskan hal diatas dapat diambil beberapa contoh monoterpen. Dari
segi biogenetik, perubahan geraniol, nerol, dan linalool dari satu menjadi yang lain
berlangsung sebagai akibat reaksi isomerisasi. Ketiga alkohol ini, yang berasal dari
misalnya dehidrasi menghasilkan mirsena, oksidasi menjadi sitral dan oksidasi reduksi
menghasilkan sitronelal.
Berikut ini contoh perubahan senyawa monoterpen
CH2OH
Gambar 2.3. Perubahan senyawa monoterpen (Achmad, 1986).
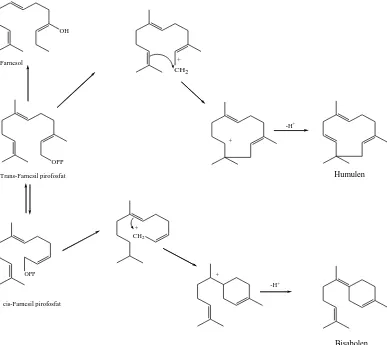
Senyawa-senyawa seskuiterpen diturunkan dari cis-farsenil pirofosfat dan
trans-farsenil pirofosfat melalui reaksi siklisasi dan reaksi sekunder lainnya. Kedua
isomer farsenil pirofosfat ini dihasilkan in vivo melalui mekanisme yang sama seperti
isomerisasi antara geraniol dan nerol.
OH
Gambar 2.4 Reaksi biogenesis beberapa seskuiterpena (Achmad, 1986).
2.2.3. Metode Isolasi
Destilasi dapat didefinisikan sebagai cara penguapan dari suatu zat dengan perantara
uap air dengan proses pengembunnan berdasarkan perbedaan titik didihnya. Destilasi
merupakan metode yang paling berfungsi untuk menghasilkan dua zat yang berbeda,
tetapi tergantung beberapa faktor, termasuk juga perbedaan tekanan uap air (bekaitan
dengan perbedaan titik didihnya) dari komponen-komponen tersebut. Destilasi
melepas uap air pada sebuah zat yang tercampur kaya dengan komponen yang mudah
Dalam tanaman Minyak Atsiri, terdapat dalam kelenjar minyak atau pada bulu
- bulu kelenjar. Minyak Atsiri hanya akan keluar setelah uap menerobos jaringan -
jaringan tanaman yang terdapat dalam permukaan Proses difusi berlangsung sangat
lambat, maka untuk mempercepat proses difusi sebelum melakukan penyulingan
terlebih dahulu bahan tanaman harus diperkecil dengan cara dipotong - potong atau
digerus. Pemotongan atau penggerusan merupakan upaya untuk mengurangi ketebalan
bahan hingga difusi terjadi. Peningkatan difusi akan mempercepat penguapan dan
penyulingan minyak atsiri. Peristiwa terpenting yang terjadi dalam proses penyulingan
dengan metode hidrodestilasi ini adalah terjadinya difusi minyak atsiri dan air panas
melalui membran bahan yang disuling, terjadinya hidrolisa terhadap beberapa
komponen minyak atsiri dan terjadinya dekomposisi yang disebabkan oleh panas
(Guenther, 1987).
Beberapa jenis bahan tanaman sumber minyak atsiri perlu dirajang terlebih
dahulu sebelum disuling. Hal ini untuk memudahkan proses penguapan minyak yang
terdapat didalamnya karena perajangan ini menyebabkan kelenjar minyak dapat
terbuka selebar mungkin. Tujuan lainnya agar minyak menjadi lebih tinggi dan waktu
penyulingan lebih singkat (Lutony, 1994).
Adapun metode-metode penyulingan minyak atsiri dapat dibagi menjadi :
1. Penyulingan dengan air
Pada metode ini, bahan tanaman yang akan disuling mengalami kontak langsung
dengan air mendidih. Bahan dapat mengapung diatas air atau terendam secara
sempurna, tergantung berat jenis dan bahan yang disuling. Ciri khas model ini yaitu
adanya kontak langsung antara bahan dan air mendidih. Oleh karena itu sering disebut
penyulingan langsung. Penyulingan dengan cara langsung ini dapat menyebabkan
banyaknya mutu minyak yang hilang (tidak tersuling) dan terjadi pula penurunan
mutu minyak yang diperoleh.
2. Penyulingan dengan uap
Model ini disebut juga penyulingan uap atau penyulingan tak langsung. Pada
prinsipnya, model ini sama dengan penyulingan langsung. Hanya saja air penghasil
uap tidak diisikan bersama-sama dalam ketel penyulingan. Uap yang digunakan
berupa uap jenuh atau uap lewat panas dengan tekanan lebih dari 1 atmosfer.
Pada model penyulingan ini, bahan tanaman yang akan disuling diletakkan diatas rak
-rak atau saringan berlubang. Kemudian ketel penyulingan diisi dengan air sampai
permukaan tidak jauh dari bagian bawah saringan. Ciri khas model ini yaitu uap selalu
dalam keadaan basah, jenuh, dan tidak terlalu panas. Bahkan tanaman yang disuling
hanya berhubungan dengan uap dan tidak dengan air panas (Lutony, 1994).
Sistem penyulingan ini baik digunakan untuk mengekstraksi minyak dari
biji-bijian,akar dan kayu-kayuan yang umumnya mengandung komponen minyak yang
bertitik didih tinggi dan tidak baik dilakukan terhadap bahan yang mengandung
minyak atsiri yang mudah rusak oleh pemanasan dan air (Ketaren, 1985).
2.3. Analisis Komponen Kimia Minyak atsiri dengan GC-MS
GS-MS merupakan metode pemisahan senyawa organik yang menggunakan dua
metode analisa senyawa yaitu Kromatografi gas (GC) untuk menganalisis jumlah
senyawa secara kuantitatif dan Spektrometri massa (MS) untuk mengetahui massa
molekul relatif dan pola frakmentasi senyawa yang dianalisis (Pavia at al, 2001).
Analisa komponen minyak atsiri merupakan masalah yang cukup rumit karena
minyak atsiri mengandung campuran senyawa dan sifatnya yang mudah menguap
pada suhu kamar. Setelah ditemukan Kromatografi Gas (GC), kendala dalam analisis
komponen minyak atsiri mulai dapat diatasi. Pada penggunaan GC, efek penguapan
dapat dihindari bahkan dihilangkan sama sekali. Perkembangan teknologi
instrumentasi yang pesat akhirnya dapat menghasilkan suatu alat yang merupakan
gabungan dua sistem dengan prinsip dasar yang berbeda satu sama lain tetapi saling
melengkapi, yaitu gabungan antara kromatografi gas dan spektrometer massa.
Kromatografi gas berfungsi sebagai alat pemisah berbagai campuran komponen dalam
sampel sedangkan spektrometer massa berfungsi untuk mendeteksi masing-masing
komponen yang telah dipisahkan pada kromatografi gas (Agusta, 2000).
2.3.1. Kromatografi Gas
Kromatografi gas merupakan teknik instrumental yang dikenalkan pertama kali pada
tahun 1950-an. Kromatografi gas merupakan metode yang dinamis untuk pemisahan
gas anorganik dalam suatu campuran (Rohman, 2009). Dalam kromatografi gas, fase
bergeraknya adalah gas dan zat terlarut terpisah sebagai uap. Pemisahan tercapai
dengan partisi sampel antara fase gas bergerak dan fase diam berupa cairan dengan
titik didih tinggi (tidak mudah menguap) yang terikat pada zat padat penunjangnya
(Khopkar, 2003).
Dalam teknik kromatografi, semua pemisahan tergantung pada gerakan relatif
dari masing-masing komponen diantara fase tersebut. Senyawa atau komponen yang
tertahan (terhambat) lebih lemah oleh fase diam akan bergerak lebih cepat dari pada
komponen yang tertahan lebih kuat. Perbedaan gerakan antara komponen yang satu
dengan yang lainnya disebabkan oleh perbedaan dalam adsorbsi, partisi, kelarutan
atau penguapan diantara kedua fase. Jika perbedaan-perbedaan ini cukup besar, maka
akan terjadi pemisahan secara sempurna (Yazid, 2005). Instrumentasi dari alat GC
antara lain :
1. Gas pembawa
Gas pembawa yang paling sering dipakai adalah helium (He), argon (Ar), nitrogen
(N2), hidrogen (H2), dan karbondioksida (CO2). Keuntungannya adalah karena semua
gas ini tidak reaktif dan dapat dibeli dalam keadaaan murni dan kering yang dikemas
dalam tangki tekanan tinggi. Pemilihan gas pembawa tergantung pada detektor yang
dipakai. Gas pembawa harus memenuhi sejumlah persyaratan, antara lain harus inert
(tidak bereaksi dengan sampel, pelarut sampel, material dalam kolom), murni dan
mudah diperoleh (Agusta, 2000).
2. Sistem injeksi
Lubang injeksi didesain untuk memasukkan sampel secara cepat dan efisien. Pada
dasarnya, ada 4 jenis injektor pada kromatografi gas, yaitu :
a. Injeksi langsung (direct injection), yang mana sampel yang diinjeksikan akan
menguap dalam injektor yang panas dan 100% sampel masuk menuju kolom.
b. Injeksi terpecah (split injection), yang mana sampel yang diinjeksikan diuapkan
dalam injektor yang panas dan selanjutnya dilakukan pemecahan.
c. Injeksi tanpa pemecahan (splitness injection), yang mana hampir semua sampel
diuapkan dalam injektor yang panas dan dibawa ke dalam kolom karena katup
d. Injeksi langsung ke kolom (on column injecton), yang mana ujung sempit
dimasukkan langsung ke dalam kolom (Rohman, 2009).
3. Kolom
Kolom merupakan tempat terjadinya pemisahan karena di dalamnya terdapat fase
diam. Oleh karena itu, kolom merupakan komponen sentral pada kromatografi gas.
Ada 3 jenis kolom pada kromatografi gas yaitu kolom kemas (pecking column), kolom
kapiler (capillary column) dan kolom preparatif (preparative column) (Roman, 2009).
Pipa kolom dapat dibuat dari tembaga, baja nirkarat, alumunium, dan kaca yang
berbentuk lurus, lengkung atau melingkar (Mcnair dan Bonelli, 1998).
4. Fase Diam
Fase diam disapukan pada permukaan dalam medium, seperti tanah diatom dalam
kolom atau dilapiskan pada dinding kapiler. Berdasarkan bentuk fisiknya, fase diam
umum digunakan pada kolom adalah fase diam padat dan fase diam cair. Berdasarkan
sifatnya fase diam dibedakan berdasarkan kepolarannya, yaitu nonpolar, sedikit polar,
setengah polar (semi polar) dan sangat polar. Berdasarkan sifat minyak atsiri yang non
polar sampai sedikit polar, untuk keperluan analisis sebaiknya digunakan kolom
dalam fase diam bersifat sedikit polar. Jika dalam analisis minyak atsiri digunakan
kolom yang lebih polar, sejumlah puncak yang dihasilkan menjadi lebar (lebih tajam)
dan sebagai puncak tersebut juga membentuk ekor. Begitu juga dengan garis dasarnya
tidak rata dan terlihat bergelombang. Bahkan kemungkinan besar komponen yang
bersifat tidak akan terdeteksi sama sekali (Agusta, 2000).
5. Suhu
Suhu merupakan salah satu faktor utama yang menentukan hasil analisis kromatografi
gas dan spektrometri massa. Umumnya yang sangat menentukan adalah pengaturan
suhu injektor dan kolom. Kondisi analisis yang cocok sangat bergantung pada
6. Detektor
Detektor merupakan perangkat yang diletakkan pada ujung kolom tempat keluar fase
gerak (gas pembawa) yang membawa komponen hasil pemisahan. Detektor pada
kromatografi gas adalah suatu sensor elektronik yang berfungsi mengubah sinyal gas
pembawa dan komponen-komponen didalamnya menjadi sinyal elektroinik. Sinyal
elektronik detektor akan sangat berguna untuk analisis kuatitatif terhadap
komponen-komponen yang terpisah diantara fase diam dan fase gerak (Roman, 2009).
2.3.2. Spektroskopi Massa
Pengunaan kromatografi gas dapat dipadukan dengan spektroskopi massa. Paduan
keduanya dapat menghasilkan data lebih akurat dalam mengidentifikasi senyawa yang
dilengkapi dengan struktur molekulnya (Pavia, 2006).
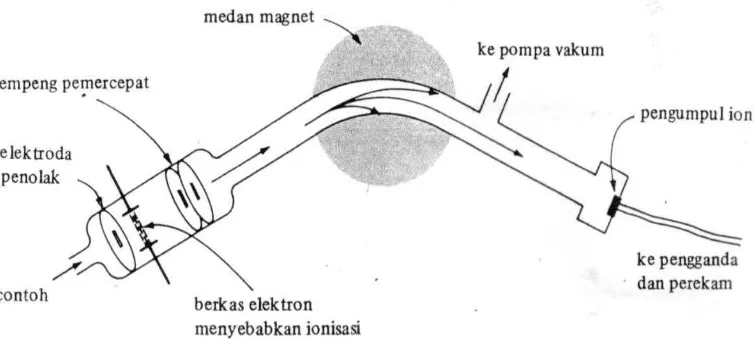
Spektroskopi massa mampu menghasilkan berkas ion dari suatu zat uji,
memilah ion tersebut menjadi spektrum yang sesuai dengan perbandingan massa
terhadap muatan dan merekam kelimpahan relatif tiap jenis ion yang ada (Pavia at al,
2001). Dalam alat spektroskopi massa sampel dimasukkan, diuapkan dan diumpankan
dalam suatu aliran yang berkesinambungan kedalam kamar pengionan. Kamar
pengionan (serta instrumentasi keseluruhan) dijaga agar tetap dalam keadaan vakum
untuk meminimalkan tabrakan dan reaksi antara radikal, molekul udara dan lain-lain.
Didalam kamar ini, sampel melewati suatu aliran elektron berenergi tinggi, yang
menyebabkan ionisasi beberapa molekul sampel menjadi ion-ion molekul. Setelah
terbentuk, semua ion molekul dapat mengalami fragmentasi dan penataan ulang.
Proses-proses ini berjalan sangat cepat. Partikel yang berumur panjang dapat dideteksi
oleh pengumpul ion dan hanya produk-produk fragmentasinya yang menunjukkan
peak (Fessenden,1986).
Setelah radikal-radikal ion dan partikel-partikel lain itu terbentuk, mereka
diumpankan melewati dua elektroda, lempeng percepatan ion, yang mempercepat
partikel bermuatan positif. Dari lempeng percepatan, partikel bermuatan positif
menuju ke tabung analisator, dimana partikel-partikel ini dibelokkan oleh medan
magnet sehingga lintasannya melengkung.
Jari-jari lintasan melengkung bergantung pada kecepatan partikel, yang pada
partikel. Pada kuat medan dan voltase yang sama, partikel dengan m/e tinggi akan
memiliki jari-jari yang lebih besar, sedangkan yang m/e nya rendah akan mempunyai
jari-jari yang lebih kecil.
Gambar 2.5. Diagram sebuah spektrometer massa
Arus uap dari pembocor molekul masuk kedalam kamar pengionan ditembak
pada kedudukan tegak lurus oleh berkas elektron yang dipancarkan dari filament
panas. Satu dari proses yang disebabkan oleh tabrakan tersebut adalah ionisasi dari
molekul yang berupa uap dengan kehilangan satu elektron dan terbebtuk ion molekul
bermuatan positif. Karena molekul senyawa organik mempunyai elektron berjumlah
genap maka proses pelepasan satu elektron menghasilkan ion radikal yang
mengandung satu elektron tidak berpasangan.
+
- 2e M
M
+e
Proses lain, molekul yang berupa uap tersebut menangkap sebuah electron
membentuk ion radikal bermuatan negatif dengan kemungkinan terjadi jauh lebih
kecil dari pada ion radikal bermuatan positif (Sudjadi, 1985).
Spektrometer massa pada umumnya digunakan untuk :
1. Menentukan massa suatu molekul
2. Menentukan rumus molekul dengan menggunakan Spektrum Massa Beresulusi
Tinggi (High Resolution Mass Spectra )
Ketika uap suatu senyawa dilewatkan dalam ruang ionisasi spektrometer
massa, maka zat ini dibombardir atau ditembak dengan elektron. Elektron ini
mempunyai energi yang cukup untuk melemparkan elektron dalam senyawa sehingga
akan memberikan ion positif, ion ini disebut dengan ion molekul (M+). Ion molekul
cenderung tidak stabil dan terpecah menjadi fragmen-fragmen yang lebih kecil.
Frgamen-fragmen ini yang akan menghasilkan diagram batang (Dachriyanus, 2004).
Spektrometer mampu menganalisa cuplikan yang jumlahnya sangat kecil dan
menghasilkan data yang berguna mengenai struktur dan identitas senyawa organik.
Jika efluen dari kromatografi gas diarahkan ke spektrometer massa, maka informasi
mengenai struktur untuk masing-masing puncak pada kromatogram dapat diperoleh,
karena laju aliran yang rendah dan ukuran cuplikan yang kecil, cara ini paling mudah
diterapkan pada kolom kromatografi gas dan terkromatografi sehingga semua
komponennya terpisah. Spektrum massa diukur secara otomatis pada selang waktu
tertentu atau pada maksimum atau tengah-tengah puncak ketika keluar dari kolom.
Kemudian data disimpan didalam komputer, dan dari padanya dapat diperoleh hasil
kromatogram disertai integrasi semua puncak. Disamping itu, kita dapat memperoleh
spektrum massa masing-masing komponen. Spektrum ini dapat dipakai pada
identifikasi senyawa yang pernah diketahui dan sebagai sumber informasi struktur dan
bobot molekul senyawa baru (Gritter, 1991).
2.4. Antioksidan
2.4.1. Pengertian Antioksidan
Antioksidan merupakan senyawa pemberi elektron (elektron donor) atau reduktan.
Senyawa ini memiliki berat molekul kecil, tetapi mampu mengaktivasi
berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal.
Antioksidan dapat diperoleh,
1. Dari luar tubuh (eksogen) dengan cara melalui makanan dan miuman yang
2. Dari dalam tubuh (endogen) yakni dengan enzim superoksida dismutasi (SOD),
gluthatione, perxidasi dan katalase yang diperoduksi oleh tunuh sebagai
antioksidan ( Kosasih, 2004)
Tubuh manusia tidak mempunyai cadangan antioksidan dalam jumlah
berlebih, sehingga jika terjadi paparan radikal berlebih maka tubuh membutuhkan
antioksidan eksogen. Adanya kekhawatiran akan kemungkinan efek samping yang
belum diketahui dari antioksidan sintetik menyebabkan antioksidan alami alternatif
yang sangat dibutuhkan (Sunarni, 2005).
Senyawa antioksidan memengang peranan penting dalam pertahanan tubuh
terhadap perubahan buruk yang disebabkan radikal bebas. Radikal bebas diketahui
dapat menginduksi penyakit kanker, arteriosklerosis dan penuaan, disebabkan oleh
kerusakan jaringan karena oksidasi.
Radikal bebas adalah merupakan atom atau gugus atom apa saja yang
memiliki satu atau lebih elektron tak berpasangan. Karena jumlah elektron ganjil,
maka tidak semua elektron dapat berpasangan sehingga bersifat sangat reaktif. Jika
jumlahnya sedikit, radikal bebas dapat dinetralkan oleh sistem enzimatik tubuh,
namun jika berlebih akan memicu efek patologis Radikal bebas merupakan
merupakan agen pengoksidasi kuat yang dapat merusak sistem pertahanan tubuh
dengan akibat kerusakan sel dan penuaan dini karena elektron yang tidak berpasangan
selalu mencari pasangan elektron dalam makromolekul biologi, Protein lipida dan
DNA dari sel manusia yang sehat lah merupakan sumber pasangan elektron yang baik
(Kosasih, 2004).
2.4.2. Pengolongan Antioksidan
Berkaitan dengan fungsinya, senyawa antioksidan diklasifikasikan dalam tiga tipe
antioksidan, yaitu :
1. Primary Antioksidan
Termasuk:
SOD (Superoxide Dismutase) GPX (Glutathion Perokxide)
Antioksidan primer ini bekerja untuk mencegah terbentuknya senyawa radikal bebas
yang ada menjadi molekul yang berkurang dampak negatifnya, sebelum radikal bebas
ini sempat bereaksi. Contoh antioksidan ini adalah enzim SOD yang berfungsi sebagai
pelindung hancurnya sel-sel dalam tubuh serta mencegah proses peradangan karena
radikal bebas.
2. Secondary Antioksidants
Antioksidan ini berfungsi menangkap senyawa serta mencegah terjadinya reaksi
berantai. Contoh: antioksidan sekunder: vitamin E, vitamin C, betakaroten, asam urat,
bilirubin dan albumin.
3. Tertiary Antioksidants
Antioksidan jenis ini memperbaiki kerusakan sel-sel dan jaringan yang disebabkan
radikal bebas. Contoh enzim yang memperbaiki DNA pada inti sel adalah mentionin
sulfoksidan reduktase. Adanya enzim-enzim perbaikan DNA ini berguna untuk
mencegah penyakit misalnya kanker (Kosasih, 2004).
Komponen fenolik merupakan kelompok molekul yang besar dan beragam,
yang terdiri dari golongan aromatik pada metabolit sekunder tumbuh-tumbuhan.
Fenolik dapat diklasifikasikan ke dalam komponen yang tidak larut seperti lignin dan
komponen yang larut seperti asam fenolik, phenylpropanoids, flavonoid dan kuinon.
Setiap tumbuh-tumbuhan memiliki struktur komponen fenolik yang berbeda. Ada
komponen fenolik yang memliki gugus –OH banyak dan ada pula komponen fenolik yang memiliki gugus –OH yang sedikit. Gugus –OH berperan dalam proses transfer elektron untuk menstabilkan dan meredam radikal bebas (Harborne dan Williams
2000).
2.4.3. Metode Pengukuran Aktivitas Antioksidan
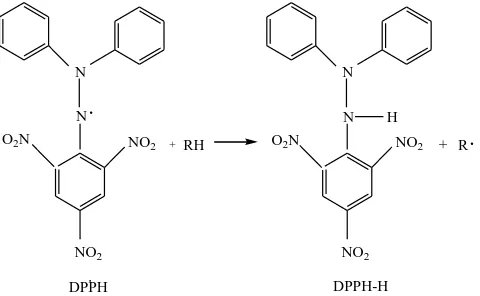
Pengukuran aktivitas antioksidan dilakukan dengan tiga metode yaitu ;
1. Metode DPPH (2,2-diphenyl-1-picryl-hydrazil)
Pengukuran aktivitas antioksidan dapat dilakukan dengan beberapa cara. Salah satu
metode pengukan yang sering digunakan adalah metode DPPH. DPPH adalah
(2,2-diphenyl-1-picryl-hydrazil) yang merupakan suatu radikal bebas yang stabil karena
mekanisme delokalisasi elektron bebas oleh molekulnya, sehingga molekul ini tidak
lainnya. Delokalisasi juga memberi efek warna ungu yang dalam panjang gelombang
515 nm dalam pelarut etanol (Hirota et al, 2003). Zat ini berperan sebagai penangkap
elektron atau penengkap radikal hidrogen bebas. Hasilnya adalah molekul yang
bersifat stabil. Jika suatu senyawa antioksidan direaksikan dengan zat ini maka
senyawa antioksidan tersebut akan menetralkan radikal bebas dari DPPH (Bintang,
2002). Berikut ini dapat dilihat resonansi DPPH dan reaksi DPPH dengan atom H
netral yang berasal dari senyawa-senyawa yang bersifat antioksidan :
N N NO2 +
Gambar 2.6. Struktur kestabilan radikal bebas DPPH (Ionita, 2003)
N
Gambar 2.7 Mekanisme Penghambatan Radikal DPPH
Pengukuran aktivitas antioksidan dilakukan dengan inkubasi DPPH dengan
ekstrak antioksidan selama 30 menit sehingga menghasilkan larutan ungu yang lebih
pudar kemudian dilakukan pengukuran panjang gelombang 515 nm. Aktivitas
antioksidan diperoleh dari nilai absorbansi yang selanjutnya akan digunakan untuk
menghitung persentase inhibis 50% (IC50) yang menyatakan konsentrasi senyawa
antioksidan yang menyebabkan 50% dari DPPH kehilangan karakter radikal bebasnya.
Semakin tinggi kadar senyawa antioksidan dalam sampel maka akan semakin rendah
Ketika larutan DPPH dicampurkan dengan bahan yang dapat memberi sebuah atom
hidrogen, molekul DPPH akan tereduksi sehingga intensitas warna ungu akan
berkurang (Molyneux, 2004)
2. Metode FRAP (Ferric Reducting Antioxidant Power)
Metode FRAP (Benzie & Stain, 1996) mengunakan Fe (TPTZ)23+ kompleks
besi-ligan 2,4,6-tripiridil-triazin sebagai pereaksi. Kompleks biru Fe (TPTZ)23+ akan
berfungsi sebagai zat pengoksidasi dan akan mengalami reduksi menjadi Fe (TPTZ)22+
yang berwarna kuning dengan reaksi sebagai berikut :
Fe (TPTZ)23+ + AROH Fe (TPTZ)22+ + H+ + AR = O
3. Metode Cuprac ( Cupric Ion Reducting Antioxidant Capacity)
Metode Cuprac (Apak et al, 2007) menggunakan bis (neokuproin) tembaga (II)
Cu(Nc)22+ sebagai pereaksi kromogenik. Pereaksi Cu(Nc)22+ yang berwarna kuning
dengan reaksi :
BAB 3
Gelas Erlenmeyer 250 mL Pyrex
Labu destilasi 1000 mL Pyrex
Labu Takar 25, 100 mL Pyrex
Neraca Analitis Mettler AE2000
Tabung reaksi Pyrex
DPPH (2,2-diphenil-1-picryhydrazyl) p.a. Aldrich
Eter
3.3. Prosedur Penelitian
3.3.1. Penyedian Sampel
Bahan yang digunakan dalam penelitian adalah kulit jeruk telur buaya yang diperoleh
dari desa Salang Baru, Kota Kuta Cane, Kecamatan Aceh Tenggara.
3.3.2. Isolasi Minyak Atsiri Kulit Jeruk Telur Buaya dengan Alat Destilasi Stahl
Kulit jeruk telur buaya dibersihkan lalu diiris kecil-kecil. Kulit jeruk telur buaya
ditimbang sebanyak 500 gram dan dimasukkan kedalam labu alas bulat volume 2000
mL kemudian ditambahkan air suling 500 mL, dipasang alat hidrodestilasi, dan
dipanaskan selama 5-6 jam diatas penangas minyak hingga minyak atsiri menguap.
Destilat yang diperoleh merupakan campuran minyak dengan air yang selanjutnya,
kemudian minyak atsiri yang masih tercampur bersama air diekstraksi dengan eter.
Ektrak eter yang masih tercampur dengan minyak atsiri ditambahkan dengan Na2SO4
anhidrous, kemudian disaring, fitrat hasil saringan diuapkan hingga diperoleh minyak
atsiri sebagai residu yang selanjutnya disimpan dilemari pendingin. Minyak atsiri
yang diperoleh dianalisa komponen kimianya menggunakan alat GC-MS dan uji
ativitas antioksidan dengan metode DPPH.
3.3.3. Analisis Minyak Atsiri Kulit Jeruk Tekur Buaya dengan GC-MS
Cuplikan dimasukkan kedalam gerbang pada sebuah alat GC-MS. Selajutnya kondisi
disesuaikan dengan kondisi dibawah ini kemudian diamati kromatogram yang
dihasilkan oleh rekorder dan mass rekorder serta mass spekta masing-masing
senyawa.
Kondisi alat GC-MS yaitu :
Model aliran control : Pressure
Tekanan : 13,0 kPa
Total aliran : 80 mL/min
Aliran kolom : 0,52 mL/min
Kecepatan linier : 26,3 cm/sec
Aliran pembersih : 3,0 mL/min
Pembagian pemecah : 147,4
GCMS-QP2010
Suhu sumber ion : 250°C
Suhu interfase : 300°C
Waktu pemecahan pelarut : 1,60 min
Detektor gain mode : Relative
Detektor gain : 0,00 Kv
3.3.4.1. Pembuatan Larutan DPPH 0,3 mM
Larutan DPPH 0.3 mM dibuat dengan melarutkan 11,83 mg serbuk DPPH dengan
etanol p.a dalam labu takar 100 mL, kemudian dihomogenkan.
3.3.4.2. Pembuatan Variasi Konsentrasi Minyak Atsiri Kulit Jeruk Telur Buaya
Minyak atsiri kulit jeruk telur buaya dibuat larutan induk 1000 ppm dengan
Kemudian dari larutan induk 1000 ppm dibuat larutan 100 ppm. Kemudian dari
larutan 100 ppm dibuat lagi variasi konsentrasi 10, 20, 30, dan 40 ppm untuk uji
aktivitas antioksidan.
3.3.4.3. Uji Aktivitas Antioksidan
3.3.4.3.1. Larutan Blanko
Sebanyak 1 mL larutan DPPH 0.3 mM ditambahkan 2,5 mL etanol p.a, dihomogenkan
dalam tabung reaksi dan dibiarkan selama 30 menit pada ruang gelap. Lalu, diukur
absorbansi pada panjang gelombang maksimum 515 nm.
3.3.4.3.2. Uji Aktifitas Antioksidan Kulit Jeruk Telur Buaya
Sebanyak 1 mL larutan DPPH 0.3 mM ditambahkan 2,5 mL minyak atsiri kulit jeruk
telur buaya, dihomogenkan dalam tabung reaksi dan dibiarkan selama 30 menit pada
ruang gelap. Setelah itu, diukur absorbansi pada panjang gelombang maksimum 515
nm. Dilakukan dengan perlakuan yang sama untuk variasi konsentrasi 20, 30, dan 40
3.4. Bagan Penelitian
3.4.1. Isolasi Minyak Atsiri Kulit Jeruk Telur Dengan Destilasi Sthal
dimasukkan kedalam labu Sthal 2 liter
ditambahkan air suling 500 mL
dirangkai alat Sthal
dipanaskan hingga minyak keluar dengan uap air
dimasukkan kedalam gelas Erlenmeyer
diekstraksi dengan eter dalam corong pemisah
ditambahkan Na2SO4 Anhidrous
disaring
diuapkan pada suhu 40 °C 500 g kulit jeruk telur buaya
Destilat
Lapisan Atas Lapisan Bawah
Fitrat Residu
Minyak Atsiri
3.4.2. Uji Sifat Antioksidan Minyak Atsiri Kulit Jeruk Telur Buaya dengan
Metode DPPH
3.4.2.1. Pembuatan Larutan DPPH 0,3 mM
dimasukkan kedalam labu takar 100 mL
ditambahkan etanol p.a hingga garis batas
dihomogenkan 11,83 mg serbuk DPPH
3.4.2.2. Pembuatan Variasi Konsentrasi Minyak Atsiri
dimasukkan kedalam labu takar 25 mL
ditambahkan etanol p.a hingga garis batas dihomogenkan
dipipet 2,5 mL larutan induk 1000 ppm
dimasukkan kedalam labu takar 25 mL
ditambahkan etanol p.a hingga garis batas dihomogenkan
dibuat variasi konsentrasi 10,20,30,40 ppm
dipipet 2,5 mL dipipet 5 mL dipipet 7,5 mL dipipet10 mL dengan pipet dengan pipet dengan pipet dengan pipet
volum volum volum volum
dimasukkan dimasukkan dimasukkan dimasukkan
kedalam labu kedalam labu kedalam labu kedalam labu
takar 25 mL takar 25 mL takar 25 mL takar 25 mL
diencerkan diencerkan diencerkan diencerkan
dengan etanol dengan etaniol dengan etanol dengan etanol p.a hingga garis p.a hingga garis p.a hingga garis p.a hingga garis
dihomogenkan dihomogenkan dihomogenkan dihomogenkan
0.025 g minyak atsiri kulit jeruk telur buaya
25 mL larutan induk 1000 ppm
25 mL larutan induk 100 ppm
3.4.2.3. Uji Aktivitas Antioksidan
a. Uji Blanko
dimasukkan kedalam tabung reaksi
ditambahkan 2,5 mL etanaol p.a
dihomogenkan
dibiarkan selama 30 menit pada ruang gelap
diukur absorbansi pada panjang gelombang 515
nm
b. Uji Sampel
dimasukkan kedalam tabung reaksi
ditambahkan 2,5 mL minyak atsiri 10 ppm
dihomogenkan
dibiarkan selama 30 menit pada ruang gelap
diukur absorbansi pada panjang gelombang 515
nm
Dilakukan perlakuan yang sama untuk variasi konsentrasi 20,30,40 ppm. 1 mL Larutan DPPH 0.3 mM
Hasil
Hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Penentuan Kadar Minyak Atsiri
Minyak atsiri kulit jeruk telur buaya diperoleh dengan metode hidrodestilasi
menggunakan alat Stahl. Hasilnya seperti yang ditunjukkan pada tabel 4.1
Tabel 4.1.Minyak Atsiri daun jeruk telur buaya yang diperoleh dengan Metode
hidrodestilasi
Berat Sampel (g) Hasil minyak atsiri (g) Kadar (%)
500 g 1,5321 0,3064
4.1.2. Hasil Analisis dengan GC-MS
Minyak atsiri yang dihasilkan secara hidrodestilasi dianalisis dengan Gas
Tabel 4.2. Hasil Analisis GC-MS minyak atsiri kulit jeruk telur buaya sesuai dengan
1 CH4N2O2 0,78 1,983 78,44,40 Carbamohyroximic
2 C2H4O 1,03 2,037 56,44,41 Acetaldehyde
3 C2H6O 1,55 2,082 45,42 Dimethyl Ether
4 C4H10O 12,87 2,150 74,59,45 Ethyl Ether 5 C4H8O2 1,63 2,432 88,70,61,43 Acetic ethyl ester 6 C6H14O2 4,43 4,478 117,103,,89,73,61,45 1,2 Diethoxyethane 7 C10H16O 1,33 9,809 136,121,107,93,79,69,53,
41
Beta-myrcene
8 C10H16 70,46 11,504 136,121,107,93,79,68,53, 39
Limonene
9 C10H16 0,74 11,563 136,121,105,98,79,67,53, 41
1,3,6-Octatriene
10 C10H16 0,74 11,881 136,121,105,98,79,67,53, 41
Beta Ocimene
11 C10H16O 0,91 14,754 152,137,119,108,94,81,6 7,43,41
Trans Limonene Oxide
12 C10H16O 0,51 14,907 196,152,137,119,108,94, 81,67,43,41
2-methyl-5-(1-methylethenyl) 13 C10H16O 1,34 18,250 152,137,119,109,81,69,5
3,41
Z-citral
14 C10H16O 1,67 19,163 137,119,109,81,69,53,41 2,6-Octadienal
4.1.3. Hasil Uji Aktivitas Antioksidan Minyak Atsiri Kulit Jeruk Telur Buaya
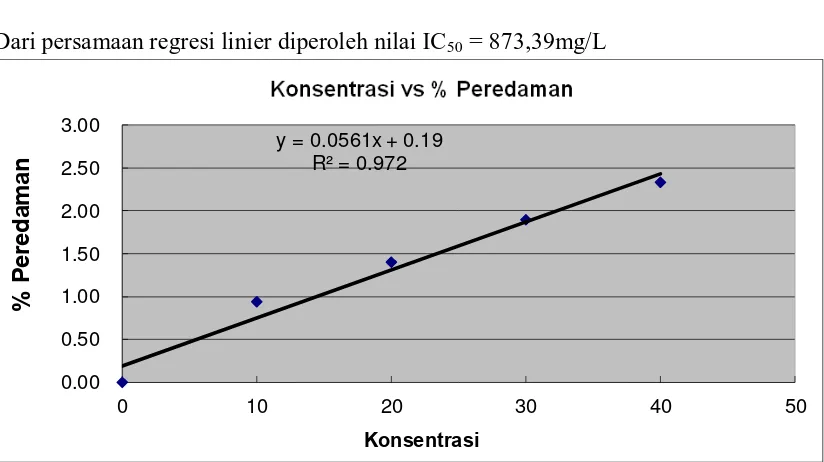
Minyak atsiri kulit jeruk telur buaya dilakukan uji aktivitas antioksidan dengan
metode DPPH radikal bebas untuk diperoleh nilai IC50 dengan dilakukan pengamatan
secara spektrofotometer UV-Visible pada panjang gelombang maksimum 515 nm.
Tabel 4.4. Hasil Pengukuran Absorbansi Minyak Atsiri kulit jeruk telur buaya
Sampel Absorbansi % Peredaman
Blanko 0,8631 -
10 ppm 0,8550 0,94
20 ppm 0,8510 1,40
30 ppm 0,8468 1,89
40 ppm 0,8430 2,33
Dari persamaan regresi linier diperoleh nilai IC50 = 873,39mg/L
Gambar 4.2. Grafik aktivitas antioksidan minyak atsiri kulit jeruk telur buaya
4.2. Pembahasan
4.2.1. Minyak Atsiri dari Hasil Destilasi dengan Alat Stahl
Dari hasil penelitian yang telah dilakukan diperoleh Minyak Atsiri kulit jeruk
telur buaya (Citrus medica L) sebanyak 1,5321 g dari sebanyak 500 g kulit jeruk telur
buaya. Jadi kadar Minyak Atsiri kulit jeruk telur buaya adalah % yang diperoleh dari
perhitungan berikut :
Minyak Atsiri, berdasarkan hasil penelitian kulit jeruk telur buaya (Citrus medica L)
didapatkan minyak atsiri sebanyak 0,3064%. Kadar minyak atsiri tumbuhan
dipengaruhi oleh kondisi iklim, tanah tempat tumbuh, umur panen, bagian organ yang
disuling, perlakuan bahan sebelum ekstraksi, metode yang digunakan, perlakuan
terhadap minyak atsiri setelah ekstraksi (Ketaren, 1986).
4.2.2. Analisis Spektrum Massa Minyak Atsiri Kulit Jeruk Telur Buaya
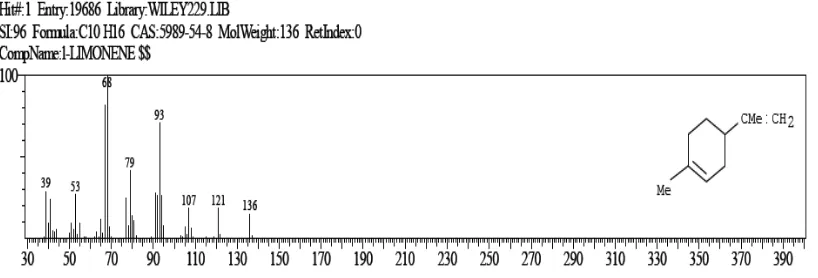
1. Puncak dengan RT 11,504 menit merupakan senyawa dengan rumus molekul
C10H16. Data spectrum menunjukkan pucak ion molekul pada m/e 136 diikuti
puncak-puncak fragmentasi pada m/e 121,107,93,79,68,53,39. Dengan membandingkan data
spektrum yang diperoleh dengan data spektrum Library Wiley yang lebih mendekati
adalah 1-Limonen sebanyak 70,46% dengan spektrum gambar 4.3.
a.
Gambar 4.7. Spektrum massa senyawa 1-Limonen dengan RT 11,504
Keterangan a. Senyawa 1-Limonen dari Sampel
Selanjutnya pola fragmentasi dari senyawa 1-Limonen tersebut secara hipotesa seperti
2. Puncak dengan RT 18,25 menit merupakan senyawa dengan rumus molekul
C10H16O. Data spectrum menunjukkan puncak ion molekul pada m/e 152 diikuti
puncak-puncak fragmentasi pada m/e 119,109,94,81,69,53,41. Dengan
membandingkan data spektrum yang diperoleh dengan data spektrum Library Wiley
yang lebih mendekati adalah golongan seskuiterpen yaitu Z-Citral sebanyak 1,34%
dengan spektrum gambar 4.5.
a.
b.
Gambar 4.5. Senyawa Z-Citral pada sampel dengan RT 18,250
Keterangan a. Senyawa Z-Citral dari sampel
Selanjutnya pola fragmentasi dari senyawa Z-Citral tersebut secara hipotesa seperti
Gambar 4.6. Pola Fragmentasi Senyawa Z-Citral
3. Puncak dengan RT 9,809 menit merupakan senyawa dengan rumus molekul C10H16.
Data spektrum menunjukkan puncak ion molekul pada m/e 136 diikuti
puncak-puncak fragmentasi pada m/e 121,107,93,79,69,53,41. Dengan membandingkan
spektrum yang diperoleh dengan data spektrum Library Wiley, yang lebih mendekati
adalah beta-Myrcene sebanyak 1,33 % dengan spektrum gambar 4.7.
b
Gambar 4.7 Senyawa beta-Myrcene dari sampel dengan RT 9,809%
Keterangan a. beta-Myrcene dari sampel
Selanjutnya Pola fragmentasi dari senyawa beta-Myrcene tersebut secara hipotesis
4.2.3. Uji Aktivitas Antioksidan Kulit Jeruk Telur Buaya
Uji aktivitas antioksidan kulit jeruk telur buaya dapat dilakukan dengan metode
DPPH dengan menggunakan alat spektrofotometri UV Visible. Senyawa-senyawa
polifenol mengandung gugus hidroksil yang dapat bertindak sebagai donor hidrogen
terhadap radikal bebas dan dapat dilihat pada gambar 4.8 (Silalahi, 2006).
N
Gambar 4.8 Reaksi DPPH dengan turunan fenol
Pada tabel 4.4 menunjukkan telah terjadi peredaman radikal bebas DPPH yang ditandai dengan menurunnya absorbansi radikal bebas DPPH setelah penambahan minyak atsiri kulit jeruk telur buaya dengan persamaan Least Square diperoleh nilai IC50 873,39mg/L. Menurut Armala,(2009), tingkat antioksidan senyawa uji
menggunakan metode DPPH dapat digolongkan menurut IC50.
Pada uji DPPH, peredaman radikal DPPH diikuti dengan pemantauan penurunan
absorbansi pada panjang gelombang maksimum yang terjadi karena pengurangan
radikal oleh antioksidan atau reaksi dengan spesi radikal (R.) yang ditandai dengan
berubahnya warna ungu pada larutan menjadi warna kuning pucat, data yang sering
dilaporkan sebagai IC50 merupakan konsentrasi antioksidan yang dibutuhkan untuk
50% peredaman radikal DPPH pada periode waktu tertentu (15 – 30 menit) (Pokorny et al, 2001). DPPH merupakan suatu molekul radikal bebas yang distabilkan oleh
N
Gambar 4.9 Kestabilan radikal bebas DPPH
Tingkat kekuatan senyawa antioksidan menggunakan metode DPPH dapat dilihat pada
tabel 4.6
Tabel 4.5. Tingkat Kekuatan Antioksidan Dengan Metode DPPH
Dari literatur dapat diketahui bahwa jika nilai IC50 yang dihasilkan lebih dari
dari 150, maka senyawa tersebut dapat dikatakan memiliki aktivitas antioksidan yang
dalam kategori lemah. Oleh karena itu berdasarkan perhitungan yang diperoleh yaitu
nilai IC50 minyak atsiri kulit jeruk telur buaya 873,39mg/L dan dapat dikatakan
bahwa sampel kulit jeruk telur buaya memiliki aktivitas antioksidan yang lemah.
Berdasarkan hasil GC-MS menunjukkan bahwa senyawa yang terkandung di dalam
minyak atsiri jeruk telur buaya yang diduga berpotensi sebagai antioksidan adalah
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Analisa GC-MS minyak atsiri dari kulit jeruk telur buaya menghasilkan 14
senyawa, dimana komponen utamanya adalah 1-limonen (70,46%).
2. Aktivitas antioksidan dari minyak atsiri kulit jeruk telur buaya dengan uji DPPH
diperoleh IC50 yaitu 873,39mg/L.
5.2. Saran
Perlu dilakukan penelitian lebih lanjut terhadapat antioksidan dari komponen utama
DAFTAR PUSTAKA
Agusta, A. 2000. Minyak Atsiri Tumbuhan Tropika Indonesia. Penerbit ITB . Bandung.
Achmad, S. 1986. Kimia Organik Bahan Alam. Universitas Terbuka . Jakarta.
Armala, M. 2009. Daya Antioksidan Fraksi Air Ekstrak Herba Kenikir (Cosmos Caudatus H.B.K.) dan Profil KLT, Skripsi,39, Fakultas Farmasi Universitas Islam Indonesia, Yogyakarta.
Bintang, M. 2002. Teknik Penelitian Biokimia. Erlangga Medical Series. Jakarta.
Dachriyanus. 2004. Analisis Struktur Senyawa Organik Secara Spektroskopi. Andalas University Press. Padang.
Fessenden, R.J. 1986. Kimia Organik. Jilid I. Penerjemahan Aloysis Hadyana Pudjatmaka. Penerbit Erlanga. Jakarta.
Gritter, R.J. 1991. Pengantar Kromatografi. Terjemahan Kosasih Padmawinata. Penerbit ITB. Bandung.
Guenther, E. 2006. Minyak Atsiri. Jilid I. Penerjemah Ketaren S. Penerbit UI Press. Jakarta.
Gunawan, D dan Mulyani, S. 2004. Ilmu Obat Alam (Farmakologi). Jilid I. Penerbit Penebar Swadaya. Jakarta.
Harborne, J.B. and C.A. Williams. 2000. Advances in flavonoid research since 1992. Phytochemistry.
Ionita, P. 2003. Is DPPH Stable Free Radical a Good Scavenger for Oxygen Active Species. Chem. Romania.
Ketaren, S. 1985. Pengantar Tehnologi Minyak Atsiri. UI Press. Jakarta.
Khopkar, S.M. 2003. Konsep Dasar Kimia Analitik. UI-Press. Jakarta.
Kosasih, E.N. 2004. Peran Antioksidan Pada Lanjut Usia. Pusat Kajian Nasional Masalah Lanjut Usia. Jakarta.
Lutony, T.L. 1994. Produksi dan Perdagangan Minyak Atsiri. Bandung : Penerbit Penebar Swadaya. Jakarta.
Molyneux, P. 2004. The Use of The Stable Free Radical diphenylpicrylhydrazil (DPPH) for Estimating Antioksidant Activity. Songklankrin J.Sci. Techol
Mosquera. 2007. Antioxidant Activity of Twenty Five Plants from Colombian Biodiversity. Rio de Janeiro . Mem Inst oswaldo Cruz, Vol 102
Pasto, D.J. 1992. Experiments and Techniques in Organic Chemistry. Prentice Hall, Englewood Cliffs. New Jersey.
Pavia, D. L. Lampman,G.M and Kriz,G.S. 2001. Introction for Spectroscopy. Third edition. Brooks Cole/Thomson. United state.
Rohman, A. 2009. Kromatografi Untuk Analisis Obat. Graha Ilmu. Yogyakarta.
Sharififar, F, Mozaffarian V. and Moradkhani S. 2007. Comparison of Antioxidant and Free Radical Scavenging Activities of The Essential Oils From Flower and Fruits of Otostegia persica. Biss.Pakk. J. Biol.
Silalahi J. 2006. Antioksidan dalam Diet dan KKarsiogenesis. Cermin Dunia Kedokteran.
Sudjadi, 1985. Penentuan Struktur Senyawa Organik. Ghalia Indonesia. Jakarta.
Sunarni, T. 2005. Aktivitas Antioksidan Penangkap Radikal Bebas Beberapa Kecambah dari Biji Tanaman Familia Papilionaceae. Jurnal Farmasi Indonesia 2.
Lampiran 1. Taksonomi Tumbuhan Jeruk Telur Buaya dari Herbarium
Lampiran 2. Tumbuhan Jeruk Telur Buaya
Lampiran 4. Grafik % Peredaman Vs Konsentrasi (ppm)
y = 0.0561x + 0.19 R² = 0.972
0.00 0.50 1.00 1.50 2.00 2.50 3.00
0 10 20 30 40 50
%
P
e
r
e
d
a
m
a
n
Lampiran 5. Pembuatan Variasi Konsentrasi Minyak Atsiri Jeruk Telur Buaya
Pembuatan larutan 1000 ppm
= , � �
Dibuat Konsentrasi sampel 100 ppm dari larutan induk 1000 ppm dalam labu takar 25 ml
V1.N1 = V2.N2
V1.1000 = 25.100
V1 = 2,5 mL
Dari konsentrasi sampel 100 ppm dibuat konsentrasi 10,20,30, dan 40 ppm
Lampiran 6. Hasil Uji Aktivitas Antioksidan Minyak Atsiri Kulit Jeruk Telur
Buaya
% � � = � −��� ��
� � %
Konsentrasi 10 ppm
% � � = , − ,
, � % = , %
Konsentrasi 20 ppm
% � � = , − ,
, � % = , %
Konsentrasi 30 ppm
% � � = , , − , � % = , %
Konsentrasi 40 ppm
% � � = , , − , � % = , %
Peredaman radikal bebas oleh minyak atsiri kulit jeruk telur buaya
Sampel Absorbansi % Peredaman
Balnko - -
10 ppm 0,8550 0,94%
20 ppm 0,8510 1,40%
30 ppm 0,8468 1,89%
Lampiran 7. Perhitungan IC50 Minyak Atsiri
X Y XY X2
0 0 0 0
10 0,94 9,4 100
20 1,40 28,0 400
30 1,89 56,7 900
40 2,33 93,2 1600
∑X = 100 ∑Y = 6,56 ∑XY = 187,3 ∑X2 = 3000
X = Konsentrasi (ppm)
Y = % Peredaman
= Σ Σ − Σ– Σ Σ = , − − , = ,
= ,
= Σ ΣΣ − Σ− Σ Σ
= , − − , =
= ,
Jadi persamaan garis regresi Y = 0,056X + 0,19
Nilai IC50 :
50 = 0,056 X + 0,19
0,056X = 49,81
Lampiran 8. Pembuatan Larutan DPPH 0,3mM
mM = n/V
0,3mM = � � �
�
= � ,� � � 0,3mM = � ,� � x 10
massa = 11,8299g
Lampiran 9. Standart Library minyak atsiri