BAB 2
TINJAUAN PUSTAKA
2.1. Tanaman Jeruk Telur Buaya
Berdasarkan taksonominya, tumbuhan jeruk telur buaya termasuk dalam :
Kingdom : Magnoliophyta
Devisi : Magnoliopsida
Ordo : Sapindales
Famili : Rutaceae
Genus : Citrus
Species : Citrus medica L
Nama Lokal : Jeruk Telur Buaya (LIPI Bogor, 2014).
Citrus medica adalah sebuah spesies jeruk yang umumnya memiliki kulit tebal
dan bagian dalam yg kecil-kecil. Asalnya, pohon ini berasal dari Asia tenggara. Saat
ini banyak tumbuh di Sisilia, Maroko,Crete, Corsica, juga di Puerto Rico. Pohon ini
dapat tumbuh hingga 3 meter. Sedangkan buahnya dapat mencapai diameter 25 cm
dan berat hingga 4 kg. Bulir dari buah ini jarang dimanfaatkan. Kulitnya banyak
digunakan sebagai bahan tambahan untuk memasak. Kulit tersebut juga dapat dibuat
menjadi selai, juga nenbuat minyak nabati (Jones, 1992).
2.2. Minyak Atsiri
Minyak atsiri atau disebut juga minyak eteris adalah minyak yang bersifat mudah
menguap, yang terdiri dari campuran zat yang mudah menguap, dengan komposisi
dan titik didih yang berbeda-beda.
Pada mulanya istilah minyak atsiri atau minyak eteris adalah istilah yang
digunakan untuk minyak mudah menguap dan diperoleh dari tanaman dengan cara
penyulingan uap. Definisi ini, dimaksudkan untuk membedakan minyak/lemak dengan
minyak atsiri yang berbeda tanaman penghasilnya. Definisi ini akan lebih lengkap jika
kedalam kelompok ini dicantumkan pula minyak yang mudah menguap dengan
metode ekstaksi yaitu dengan cara menggunakan penyulingan uap (Guenther, 2006).
Ditinjau dari sumber alami minyak atsiri, substansi mudah menguap ini dapat
dijadikan sebagai ciri khas dari suatu jenis tumbuhan karena setiap tumbuhan
menghasilkan minyak atsiri dengan aroma yang berbeda. Dengan kata lain, setiap
jenis tumbuhan menghasilkan minyak atsiri yang spesifik. Memang ada beberapa
minyak atsiri yang memiliki aroma yang mirip, tetapi tidak persis sama, dan sangat
tergantung pada komponen kimia penyusun minyak tersebut (Agusta, 2000).
Istilah essensial dipakai pada minyak atsiri karena minyak atsiri mewakili dari
bau tanaman asalnya. Dalam keadaan segar dan murni tanpa pencemaran, minyak
atsiri umumnya tidak berwarna. Namun pada penyimpanan lama minyak atsiri dapat
teroksidasi dan membentuk resin serta warnanya berubah menjadi lebih tua (gelap).
Untuk mencegah supaya tidak berubah warna, minyak atsiri harus terlindungi dari
pengaruh cahaya, misalnya disimpan dalam bejana gelas yang gelap. Bejana tersebut
dengan oksigen udara, ditutup rapat serta disimpan di tempat yang kering dan sejuk
(Gunawan dan Mulyani, 2004).
Minyak yang terdapat di alam terbagi menjadi 3 golongan yaitu minyak
mineral (mineral oil), minyak nabati dan hewani yang dapat dimakan (edible fat) dan
minyak atsiri (essential oil). Dalam tanaman, minyak atsiri mempunyai 3 fungsi,
yaitu:
1. membuat proses penyerbukan dengan menarik jenis serangga atau hewan,
2. mencegah kerusakan tanaman oleh serangga atau hewan dan
3. sebagai cadangan makanan dalam tanaman.
Minyak atsiri dalam industri digunakan untuk pembuatan kosmetik, parfum,
antiseptik, obat-obatan “flavoring agent”dalam bahan pangan atau minuman dan
sebagai pencampur rokok kretek (Ketaren, 1985).
Minyak atsiri dihasilkan dari bagian jaringan tanaman tertentu seperti akar,
batang, kulit, daun, bunga, buah, biji. Sifat minyak atsiri yang menonjol antara lain
mudah menguap pada suhu kamar, mempunyai rasa getir, berbau wangi sesuai dengan
aroma tanaman yang menghasilkannya, dan umumnya larut dalam pelarut organik.
Istilah yang digunakan untuk menyebut minyak atisri misalnya dalam bahasa inggris
disebut essential oil, ethereal oils dan volatile oil (Lutony, 1994)
2.2.1. Komposisi Minyak Atsiri
Pada umumnya variasi komposisi minyak atsiri disebabkan oleh perbedaan jenis
tanaman penghasil, kondisi iklim, tanah tempat tumbuh, umur panenan, metode
ekstraksi yang dipergunakan dan cara penyimpanan minyak (Ketaren, 1985).
Minyak atsiri umumnya terdiri dari berbagai campuran persenyawaan kimia
yang terbentuk dari unsur carbon (C) , hidrogen (H), oksigen (O) serta beberapa
persenyawaan kimia yang mengandung unsur nitrogen (N) dan belerang (S). Pada
umumnya komponen kimia dalam minyak atsiri dibagi 2 golongan yaitu :
1. Golongan hidrokarbon
Persenyawaan yang termasuk golongan hidrokarbon terbentuk dari unsur hidrogen (H)
diterpen (4 unit isoprene) dan politerpen serta paraffin, olefin dan hidrokarbon
aromatik.
2. Oxygenated hydrocarbon
Komposisi kimia dari golangan persenyawaan ini termasuk dari unsur carbon (C),
hidrogen (H) dan oksigen (O). Persenyawaan yang termasuk dalam golongan ini
adalah persenyawaan alkohol, aldehid, keton, dalam ester dan eter. Ikatan atom
karbon yang terdapat dalam molekulnya dapat terdiri dari ikatan jenuh dan ikatam
tidak jenuh umumnya tersusun dari terpen. Komponen lainnya terdiri dari
persenyawaan fenol, asam organik yang terikat dalam bentuk ester misalnya
lakton,kumarin dan turunan furan misalnya quinines.
Pada umumnya sebagian besar minyak atsiri terdiri dari campuran
persenyawaan golongan hidrokarbon dan oxygenated hidrocarbon. Disamping itu
minyak atsiri mengandung resin dan lilin dalam jumlah kecil yang merupakan
komponen tidak dapat menguap (Ketaren, 1985).
2.2.2. Biosintesis Minyak Atsiri
Berdasarkan proses biosintesisnya atau pembentukan komponen minyak atsiri di
dalam tumbuhan, minyak atsiri dapat dibedakan menjadi dua golongan. Golongan
pertama adalah turunan terpena yang terbentuk dari asam asetat melalui jalur
biosintesis asam mevalonat. Golongan kedua adalah senyawa aromatik yang terbentuk
dari biosintesis asam sikimat melalui jalur fenil propanoid (Agusta, 2000). Mekanisme
dari tahap-tahap reaksi biosintesis terpenoid yaitu asam asetat yang telah diaktifkan
oleh koenzim A melalui kondensasi jenis Claisen menghasilkan asam asetoasetat.
Senyawa yang dihasilkan ini dengan koenzim A melakukan kondensasi sejenis aldol
menghasilkan rantai karbon bercabang sebagaimana ditemukan pada asam mevalonat.
Reaksi-reaksi berikutnya ialah fosforilasi, eliminasi asam fosfat dan dekarboksilasi
menghasilkan IPP (Isopentenil Pirofosfat) yang selanjutnya berisomerisasi menjadi
DMAPP (Dimetilalil Pirofosfat) oleh enzim isomerase. IPP sebagai unit isoprene aktif
bergabung secara kepala ke ekor dengan DMAPP dan penggabungan ini merupakan
langkah pertama dari polimerisasi isopren untuk menghasilkan terpenoid.
Penggabungan ini terjadi karena serangan elektron dari ikatan rangkap IPP terhadap
pirofosfat. Serangan ini menghasilkan geranil pirofosfat (GPP) yakni senyawa antara
bagi semua senyawa monoterpen.
Sintesa terpenoid sangat sederhana sifatnya. Ditinjau dari segi teori reaksi
organik sintesa ini hanya menggunakan beberapa jenis reaksi dasar. Reaksi-reaksi
selanjutnya dari senyawa antara GPP, FPP, dan GGPP untuk menghasilkan senyawa
-senyawa terpenoid satu per satu hanya melibatkan beberapa jenis reaksi sekunder
pula. Reaksi –reaksi sekunder ini lazimnya addalah hidrolisa, siklisasi, oksidasi,
reduksi, dan reaksi-reaksi spontan yang dapat berlangsung dengan mudah dalam
suasana netral dan pada suhu kamar, seperti isomerisasi, dehidrasi, dekarboksilasi, dan
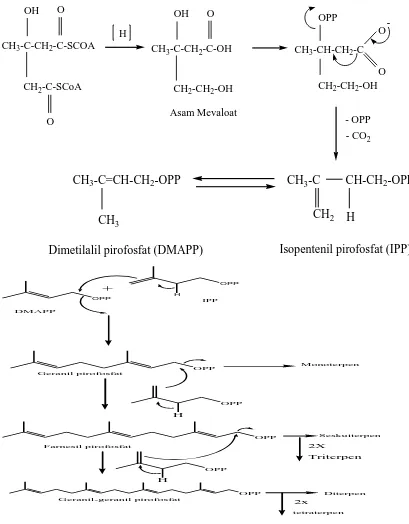
sebagainya. Berikut ini adalah reaksi biosintesa terpenoid dapat dilihat pada gambar
2.2.
CH3-C-SCoA
Asetil koenzim A Asetoasetil koenzim A
+ CH3-C-SCoA
O
CH3-C-SCoA
O O O O
OH O
CH3-C-CH2-C-SCOA
CH2-C-SCoA
O
H
OH O
CH3-C-CH2-C-OH
CH2-CH2-OH
Asam Mevaloat
CH3-CH-CH2-C OPP
CH2-CH2-OH
- OPP - CO2
O -O
CH3
CH3-C
CH2 H
CH-CH2-OPP
Dimetilalil pirofosfat (DMAPP) Isopentenil pirofosfat (IPP) CH3-C=CH-CH2-OPP
OPP H OPP DMAPP IPP + OPP Monoterpen H OPP OPP Seskuiterpen Geranil pirofosfat Farnesil pirofosfat OPP H 2X Triterpen OPP Diterpen 2x tetraterpen Geranil-geranil pirofosfat
Gambar 2.2. Biosintesisa Terpenoid (Achmad, 1986)
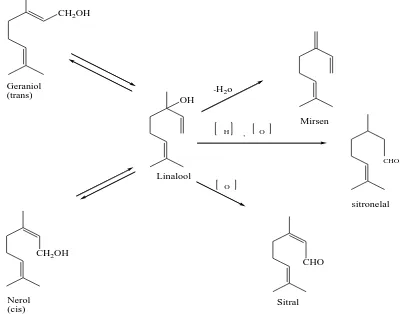
Untuk menjelaskan hal diatas dapat diambil beberapa contoh monoterpen. Dari
segi biogenetik, perubahan geraniol, nerol, dan linalool dari satu menjadi yang lain
berlangsung sebagai akibat reaksi isomerisasi. Ketiga alkohol ini, yang berasal dari
misalnya dehidrasi menghasilkan mirsena, oksidasi menjadi sitral dan oksidasi reduksi
menghasilkan sitronelal.
Berikut ini contoh perubahan senyawa monoterpen
CH2OH
Geraniol (trans)
OH
-H2o
Mirsen
CHO
Sitronelal
H , O
Linalool
CH2OH
Nerol (cis)
O
CHO
Sitral
Gambar 2.3. Perubahan senyawa monoterpen (Achmad, 1986).
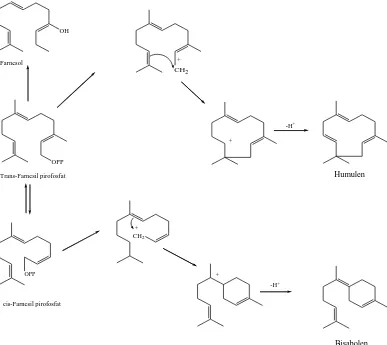
Senyawa-senyawa seskuiterpen diturunkan dari cis-farsenil pirofosfat dan
trans-farsenil pirofosfat melalui reaksi siklisasi dan reaksi sekunder lainnya. Kedua
isomer farsenil pirofosfat ini dihasilkan in vivo melalui mekanisme yang sama seperti
isomerisasi antara geraniol dan nerol.
OH
Farnesol
OPP Trans-Farnesil pirofosfat
CH2 +
+
OPP
cis-Farnesil pirofosfat
CH2
+
+
-H+
-H+
Humulen
Bisabolen
Gambar 2.4 Reaksi biogenesis beberapa seskuiterpena (Achmad, 1986).
2.2.3. Metode Isolasi
Destilasi dapat didefinisikan sebagai cara penguapan dari suatu zat dengan perantara
uap air dengan proses pengembunnan berdasarkan perbedaan titik didihnya. Destilasi
merupakan metode yang paling berfungsi untuk menghasilkan dua zat yang berbeda,
tetapi tergantung beberapa faktor, termasuk juga perbedaan tekanan uap air (bekaitan
dengan perbedaan titik didihnya) dari komponen-komponen tersebut. Destilasi
melepas uap air pada sebuah zat yang tercampur kaya dengan komponen yang mudah
Dalam tanaman Minyak Atsiri, terdapat dalam kelenjar minyak atau pada bulu
- bulu kelenjar. Minyak Atsiri hanya akan keluar setelah uap menerobos jaringan -
jaringan tanaman yang terdapat dalam permukaan Proses difusi berlangsung sangat
lambat, maka untuk mempercepat proses difusi sebelum melakukan penyulingan
terlebih dahulu bahan tanaman harus diperkecil dengan cara dipotong - potong atau
digerus. Pemotongan atau penggerusan merupakan upaya untuk mengurangi ketebalan
bahan hingga difusi terjadi. Peningkatan difusi akan mempercepat penguapan dan
penyulingan minyak atsiri. Peristiwa terpenting yang terjadi dalam proses penyulingan
dengan metode hidrodestilasi ini adalah terjadinya difusi minyak atsiri dan air panas
melalui membran bahan yang disuling, terjadinya hidrolisa terhadap beberapa
komponen minyak atsiri dan terjadinya dekomposisi yang disebabkan oleh panas
(Guenther, 1987).
Beberapa jenis bahan tanaman sumber minyak atsiri perlu dirajang terlebih
dahulu sebelum disuling. Hal ini untuk memudahkan proses penguapan minyak yang
terdapat didalamnya karena perajangan ini menyebabkan kelenjar minyak dapat
terbuka selebar mungkin. Tujuan lainnya agar minyak menjadi lebih tinggi dan waktu
penyulingan lebih singkat (Lutony, 1994).
Adapun metode-metode penyulingan minyak atsiri dapat dibagi menjadi :
1. Penyulingan dengan air
Pada metode ini, bahan tanaman yang akan disuling mengalami kontak langsung
dengan air mendidih. Bahan dapat mengapung diatas air atau terendam secara
sempurna, tergantung berat jenis dan bahan yang disuling. Ciri khas model ini yaitu
adanya kontak langsung antara bahan dan air mendidih. Oleh karena itu sering disebut
penyulingan langsung. Penyulingan dengan cara langsung ini dapat menyebabkan
banyaknya mutu minyak yang hilang (tidak tersuling) dan terjadi pula penurunan
mutu minyak yang diperoleh.
2. Penyulingan dengan uap
Model ini disebut juga penyulingan uap atau penyulingan tak langsung. Pada
prinsipnya, model ini sama dengan penyulingan langsung. Hanya saja air penghasil
uap tidak diisikan bersama-sama dalam ketel penyulingan. Uap yang digunakan
Pada model penyulingan ini, bahan tanaman yang akan disuling diletakkan diatas rak
-rak atau saringan berlubang. Kemudian ketel penyulingan diisi dengan air sampai
permukaan tidak jauh dari bagian bawah saringan. Ciri khas model ini yaitu uap selalu
dalam keadaan basah, jenuh, dan tidak terlalu panas. Bahkan tanaman yang disuling
hanya berhubungan dengan uap dan tidak dengan air panas (Lutony, 1994).
Sistem penyulingan ini baik digunakan untuk mengekstraksi minyak dari
biji-bijian,akar dan kayu-kayuan yang umumnya mengandung komponen minyak yang
bertitik didih tinggi dan tidak baik dilakukan terhadap bahan yang mengandung
minyak atsiri yang mudah rusak oleh pemanasan dan air (Ketaren, 1985).
2.3. Analisis Komponen Kimia Minyak atsiri dengan GC-MS
GS-MS merupakan metode pemisahan senyawa organik yang menggunakan dua
metode analisa senyawa yaitu Kromatografi gas (GC) untuk menganalisis jumlah
senyawa secara kuantitatif dan Spektrometri massa (MS) untuk mengetahui massa
molekul relatif dan pola frakmentasi senyawa yang dianalisis (Pavia at al, 2001).
Analisa komponen minyak atsiri merupakan masalah yang cukup rumit karena
minyak atsiri mengandung campuran senyawa dan sifatnya yang mudah menguap
pada suhu kamar. Setelah ditemukan Kromatografi Gas (GC), kendala dalam analisis
komponen minyak atsiri mulai dapat diatasi. Pada penggunaan GC, efek penguapan
dapat dihindari bahkan dihilangkan sama sekali. Perkembangan teknologi
instrumentasi yang pesat akhirnya dapat menghasilkan suatu alat yang merupakan
gabungan dua sistem dengan prinsip dasar yang berbeda satu sama lain tetapi saling
melengkapi, yaitu gabungan antara kromatografi gas dan spektrometer massa.
Kromatografi gas berfungsi sebagai alat pemisah berbagai campuran komponen dalam
sampel sedangkan spektrometer massa berfungsi untuk mendeteksi masing-masing
komponen yang telah dipisahkan pada kromatografi gas (Agusta, 2000).
2.3.1. Kromatografi Gas
Kromatografi gas merupakan teknik instrumental yang dikenalkan pertama kali pada
tahun 1950-an. Kromatografi gas merupakan metode yang dinamis untuk pemisahan
gas anorganik dalam suatu campuran (Rohman, 2009). Dalam kromatografi gas, fase
bergeraknya adalah gas dan zat terlarut terpisah sebagai uap. Pemisahan tercapai
dengan partisi sampel antara fase gas bergerak dan fase diam berupa cairan dengan
titik didih tinggi (tidak mudah menguap) yang terikat pada zat padat penunjangnya
(Khopkar, 2003).
Dalam teknik kromatografi, semua pemisahan tergantung pada gerakan relatif
dari masing-masing komponen diantara fase tersebut. Senyawa atau komponen yang
tertahan (terhambat) lebih lemah oleh fase diam akan bergerak lebih cepat dari pada
komponen yang tertahan lebih kuat. Perbedaan gerakan antara komponen yang satu
dengan yang lainnya disebabkan oleh perbedaan dalam adsorbsi, partisi, kelarutan
atau penguapan diantara kedua fase. Jika perbedaan-perbedaan ini cukup besar, maka
akan terjadi pemisahan secara sempurna (Yazid, 2005). Instrumentasi dari alat GC
antara lain :
1. Gas pembawa
Gas pembawa yang paling sering dipakai adalah helium (He), argon (Ar), nitrogen
(N2), hidrogen (H2), dan karbondioksida (CO2). Keuntungannya adalah karena semua
gas ini tidak reaktif dan dapat dibeli dalam keadaaan murni dan kering yang dikemas
dalam tangki tekanan tinggi. Pemilihan gas pembawa tergantung pada detektor yang
dipakai. Gas pembawa harus memenuhi sejumlah persyaratan, antara lain harus inert
(tidak bereaksi dengan sampel, pelarut sampel, material dalam kolom), murni dan
mudah diperoleh (Agusta, 2000).
2. Sistem injeksi
Lubang injeksi didesain untuk memasukkan sampel secara cepat dan efisien. Pada
dasarnya, ada 4 jenis injektor pada kromatografi gas, yaitu :
a. Injeksi langsung (direct injection), yang mana sampel yang diinjeksikan akan
menguap dalam injektor yang panas dan 100% sampel masuk menuju kolom.
b. Injeksi terpecah (split injection), yang mana sampel yang diinjeksikan diuapkan
dalam injektor yang panas dan selanjutnya dilakukan pemecahan.
c. Injeksi tanpa pemecahan (splitness injection), yang mana hampir semua sampel
diuapkan dalam injektor yang panas dan dibawa ke dalam kolom karena katup
d. Injeksi langsung ke kolom (on column injecton), yang mana ujung sempit
dimasukkan langsung ke dalam kolom (Rohman, 2009).
3. Kolom
Kolom merupakan tempat terjadinya pemisahan karena di dalamnya terdapat fase
diam. Oleh karena itu, kolom merupakan komponen sentral pada kromatografi gas.
Ada 3 jenis kolom pada kromatografi gas yaitu kolom kemas (pecking column), kolom
kapiler (capillary column) dan kolom preparatif (preparative column) (Roman, 2009).
Pipa kolom dapat dibuat dari tembaga, baja nirkarat, alumunium, dan kaca yang
berbentuk lurus, lengkung atau melingkar (Mcnair dan Bonelli, 1998).
4. Fase Diam
Fase diam disapukan pada permukaan dalam medium, seperti tanah diatom dalam
kolom atau dilapiskan pada dinding kapiler. Berdasarkan bentuk fisiknya, fase diam
umum digunakan pada kolom adalah fase diam padat dan fase diam cair. Berdasarkan
sifatnya fase diam dibedakan berdasarkan kepolarannya, yaitu nonpolar, sedikit polar,
setengah polar (semi polar) dan sangat polar. Berdasarkan sifat minyak atsiri yang non
polar sampai sedikit polar, untuk keperluan analisis sebaiknya digunakan kolom
dalam fase diam bersifat sedikit polar. Jika dalam analisis minyak atsiri digunakan
kolom yang lebih polar, sejumlah puncak yang dihasilkan menjadi lebar (lebih tajam)
dan sebagai puncak tersebut juga membentuk ekor. Begitu juga dengan garis dasarnya
tidak rata dan terlihat bergelombang. Bahkan kemungkinan besar komponen yang
bersifat tidak akan terdeteksi sama sekali (Agusta, 2000).
5. Suhu
Suhu merupakan salah satu faktor utama yang menentukan hasil analisis kromatografi
gas dan spektrometri massa. Umumnya yang sangat menentukan adalah pengaturan
suhu injektor dan kolom. Kondisi analisis yang cocok sangat bergantung pada
6. Detektor
Detektor merupakan perangkat yang diletakkan pada ujung kolom tempat keluar fase
gerak (gas pembawa) yang membawa komponen hasil pemisahan. Detektor pada
kromatografi gas adalah suatu sensor elektronik yang berfungsi mengubah sinyal gas
pembawa dan komponen-komponen didalamnya menjadi sinyal elektroinik. Sinyal
elektronik detektor akan sangat berguna untuk analisis kuatitatif terhadap
komponen-komponen yang terpisah diantara fase diam dan fase gerak (Roman, 2009).
2.3.2. Spektroskopi Massa
Pengunaan kromatografi gas dapat dipadukan dengan spektroskopi massa. Paduan
keduanya dapat menghasilkan data lebih akurat dalam mengidentifikasi senyawa yang
dilengkapi dengan struktur molekulnya (Pavia, 2006).
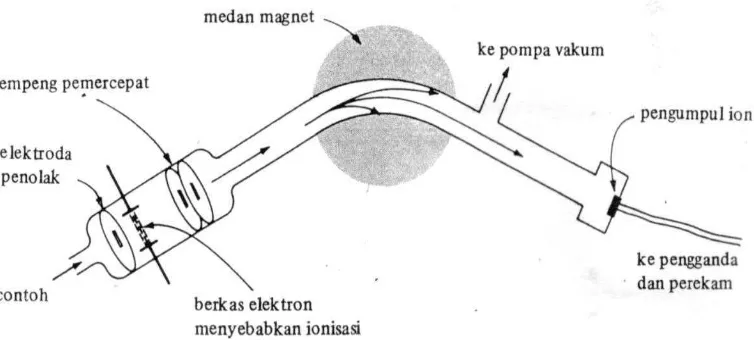
Spektroskopi massa mampu menghasilkan berkas ion dari suatu zat uji,
memilah ion tersebut menjadi spektrum yang sesuai dengan perbandingan massa
terhadap muatan dan merekam kelimpahan relatif tiap jenis ion yang ada (Pavia at al,
2001). Dalam alat spektroskopi massa sampel dimasukkan, diuapkan dan diumpankan
dalam suatu aliran yang berkesinambungan kedalam kamar pengionan. Kamar
pengionan (serta instrumentasi keseluruhan) dijaga agar tetap dalam keadaan vakum
untuk meminimalkan tabrakan dan reaksi antara radikal, molekul udara dan lain-lain.
Didalam kamar ini, sampel melewati suatu aliran elektron berenergi tinggi, yang
menyebabkan ionisasi beberapa molekul sampel menjadi ion-ion molekul. Setelah
terbentuk, semua ion molekul dapat mengalami fragmentasi dan penataan ulang.
Proses-proses ini berjalan sangat cepat. Partikel yang berumur panjang dapat dideteksi
oleh pengumpul ion dan hanya produk-produk fragmentasinya yang menunjukkan
peak (Fessenden,1986).
Setelah radikal-radikal ion dan partikel-partikel lain itu terbentuk, mereka
diumpankan melewati dua elektroda, lempeng percepatan ion, yang mempercepat
partikel bermuatan positif. Dari lempeng percepatan, partikel bermuatan positif
menuju ke tabung analisator, dimana partikel-partikel ini dibelokkan oleh medan
magnet sehingga lintasannya melengkung.
partikel. Pada kuat medan dan voltase yang sama, partikel dengan m/e tinggi akan
memiliki jari-jari yang lebih besar, sedangkan yang m/e nya rendah akan mempunyai
jari-jari yang lebih kecil.
Gambar 2.5. Diagram sebuah spektrometer massa
Arus uap dari pembocor molekul masuk kedalam kamar pengionan ditembak
pada kedudukan tegak lurus oleh berkas elektron yang dipancarkan dari filament
panas. Satu dari proses yang disebabkan oleh tabrakan tersebut adalah ionisasi dari
molekul yang berupa uap dengan kehilangan satu elektron dan terbebtuk ion molekul
bermuatan positif. Karena molekul senyawa organik mempunyai elektron berjumlah
genap maka proses pelepasan satu elektron menghasilkan ion radikal yang
mengandung satu elektron tidak berpasangan.
+
- 2e M
M
+e
Proses lain, molekul yang berupa uap tersebut menangkap sebuah electron
membentuk ion radikal bermuatan negatif dengan kemungkinan terjadi jauh lebih
kecil dari pada ion radikal bermuatan positif (Sudjadi, 1985).
Spektrometer massa pada umumnya digunakan untuk :
1. Menentukan massa suatu molekul
2. Menentukan rumus molekul dengan menggunakan Spektrum Massa Beresulusi
Tinggi (High Resolution Mass Spectra )
Ketika uap suatu senyawa dilewatkan dalam ruang ionisasi spektrometer
massa, maka zat ini dibombardir atau ditembak dengan elektron. Elektron ini
mempunyai energi yang cukup untuk melemparkan elektron dalam senyawa sehingga
akan memberikan ion positif, ion ini disebut dengan ion molekul (M+). Ion molekul
cenderung tidak stabil dan terpecah menjadi fragmen-fragmen yang lebih kecil.
Frgamen-fragmen ini yang akan menghasilkan diagram batang (Dachriyanus, 2004).
Spektrometer mampu menganalisa cuplikan yang jumlahnya sangat kecil dan
menghasilkan data yang berguna mengenai struktur dan identitas senyawa organik.
Jika efluen dari kromatografi gas diarahkan ke spektrometer massa, maka informasi
mengenai struktur untuk masing-masing puncak pada kromatogram dapat diperoleh,
karena laju aliran yang rendah dan ukuran cuplikan yang kecil, cara ini paling mudah
diterapkan pada kolom kromatografi gas dan terkromatografi sehingga semua
komponennya terpisah. Spektrum massa diukur secara otomatis pada selang waktu
tertentu atau pada maksimum atau tengah-tengah puncak ketika keluar dari kolom.
Kemudian data disimpan didalam komputer, dan dari padanya dapat diperoleh hasil
kromatogram disertai integrasi semua puncak. Disamping itu, kita dapat memperoleh
spektrum massa masing-masing komponen. Spektrum ini dapat dipakai pada
identifikasi senyawa yang pernah diketahui dan sebagai sumber informasi struktur dan
bobot molekul senyawa baru (Gritter, 1991).
2.4. Antioksidan
2.4.1. Pengertian Antioksidan
Antioksidan merupakan senyawa pemberi elektron (elektron donor) atau reduktan.
Senyawa ini memiliki berat molekul kecil, tetapi mampu mengaktivasi
berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal.
Antioksidan dapat diperoleh,
1. Dari luar tubuh (eksogen) dengan cara melalui makanan dan miuman yang
2. Dari dalam tubuh (endogen) yakni dengan enzim superoksida dismutasi (SOD),
gluthatione, perxidasi dan katalase yang diperoduksi oleh tunuh sebagai
antioksidan ( Kosasih, 2004)
Tubuh manusia tidak mempunyai cadangan antioksidan dalam jumlah
berlebih, sehingga jika terjadi paparan radikal berlebih maka tubuh membutuhkan
antioksidan eksogen. Adanya kekhawatiran akan kemungkinan efek samping yang
belum diketahui dari antioksidan sintetik menyebabkan antioksidan alami alternatif
yang sangat dibutuhkan (Sunarni, 2005).
Senyawa antioksidan memengang peranan penting dalam pertahanan tubuh
terhadap perubahan buruk yang disebabkan radikal bebas. Radikal bebas diketahui
dapat menginduksi penyakit kanker, arteriosklerosis dan penuaan, disebabkan oleh
kerusakan jaringan karena oksidasi.
Radikal bebas adalah merupakan atom atau gugus atom apa saja yang
memiliki satu atau lebih elektron tak berpasangan. Karena jumlah elektron ganjil,
maka tidak semua elektron dapat berpasangan sehingga bersifat sangat reaktif. Jika
jumlahnya sedikit, radikal bebas dapat dinetralkan oleh sistem enzimatik tubuh,
namun jika berlebih akan memicu efek patologis Radikal bebas merupakan
merupakan agen pengoksidasi kuat yang dapat merusak sistem pertahanan tubuh
dengan akibat kerusakan sel dan penuaan dini karena elektron yang tidak berpasangan
selalu mencari pasangan elektron dalam makromolekul biologi, Protein lipida dan
DNA dari sel manusia yang sehat lah merupakan sumber pasangan elektron yang baik
(Kosasih, 2004).
2.4.2. Pengolongan Antioksidan
Berkaitan dengan fungsinya, senyawa antioksidan diklasifikasikan dalam tiga tipe
antioksidan, yaitu :
1. Primary Antioksidan
Termasuk:
SOD (Superoxide Dismutase) GPX (Glutathion Perokxide)
Antioksidan primer ini bekerja untuk mencegah terbentuknya senyawa radikal bebas
yang ada menjadi molekul yang berkurang dampak negatifnya, sebelum radikal bebas
ini sempat bereaksi. Contoh antioksidan ini adalah enzim SOD yang berfungsi sebagai
pelindung hancurnya sel-sel dalam tubuh serta mencegah proses peradangan karena
radikal bebas.
2. Secondary Antioksidants
Antioksidan ini berfungsi menangkap senyawa serta mencegah terjadinya reaksi
berantai. Contoh: antioksidan sekunder: vitamin E, vitamin C, betakaroten, asam urat,
bilirubin dan albumin.
3. Tertiary Antioksidants
Antioksidan jenis ini memperbaiki kerusakan sel-sel dan jaringan yang disebabkan
radikal bebas. Contoh enzim yang memperbaiki DNA pada inti sel adalah mentionin
sulfoksidan reduktase. Adanya enzim-enzim perbaikan DNA ini berguna untuk
mencegah penyakit misalnya kanker (Kosasih, 2004).
Komponen fenolik merupakan kelompok molekul yang besar dan beragam,
yang terdiri dari golongan aromatik pada metabolit sekunder tumbuh-tumbuhan.
Fenolik dapat diklasifikasikan ke dalam komponen yang tidak larut seperti lignin dan
komponen yang larut seperti asam fenolik, phenylpropanoids, flavonoid dan kuinon.
Setiap tumbuh-tumbuhan memiliki struktur komponen fenolik yang berbeda. Ada
komponen fenolik yang memliki gugus –OH banyak dan ada pula komponen fenolik
yang memiliki gugus –OH yang sedikit. Gugus –OH berperan dalam proses transfer
elektron untuk menstabilkan dan meredam radikal bebas (Harborne dan Williams
2000).
2.4.3. Metode Pengukuran Aktivitas Antioksidan
Pengukuran aktivitas antioksidan dilakukan dengan tiga metode yaitu ;
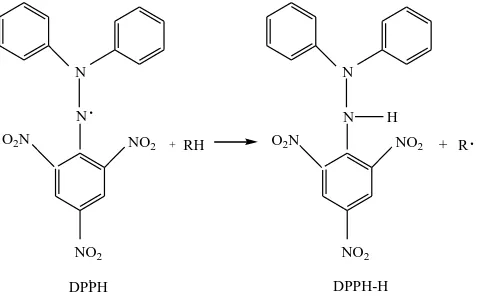
1. Metode DPPH (2,2-diphenyl-1-picryl-hydrazil)
Pengukuran aktivitas antioksidan dapat dilakukan dengan beberapa cara. Salah satu
metode pengukan yang sering digunakan adalah metode DPPH. DPPH adalah
(2,2-diphenyl-1-picryl-hydrazil) yang merupakan suatu radikal bebas yang stabil karena
lainnya. Delokalisasi juga memberi efek warna ungu yang dalam panjang gelombang
515 nm dalam pelarut etanol (Hirota et al, 2003). Zat ini berperan sebagai penangkap
elektron atau penengkap radikal hidrogen bebas. Hasilnya adalah molekul yang
bersifat stabil. Jika suatu senyawa antioksidan direaksikan dengan zat ini maka
senyawa antioksidan tersebut akan menetralkan radikal bebas dari DPPH (Bintang,
2002). Berikut ini dapat dilihat resonansi DPPH dan reaksi DPPH dengan atom H
netral yang berasal dari senyawa-senyawa yang bersifat antioksidan :
N N NO2 +
O2N
O2N
N N NO2
O2N
O2N
H
N N NO2
O2N
O2N
-Gambar 2.6. Struktur kestabilan radikal bebas DPPH (Ionita, 2003)
N
NO2
NO2
+RH
N
NO2 N
NO2 H
DPPH DPPH-H
N
+ R
O2N O2N
Gambar 2.7 Mekanisme Penghambatan Radikal DPPH
Pengukuran aktivitas antioksidan dilakukan dengan inkubasi DPPH dengan
ekstrak antioksidan selama 30 menit sehingga menghasilkan larutan ungu yang lebih
pudar kemudian dilakukan pengukuran panjang gelombang 515 nm. Aktivitas
antioksidan diperoleh dari nilai absorbansi yang selanjutnya akan digunakan untuk
menghitung persentase inhibis 50% (IC50) yang menyatakan konsentrasi senyawa
antioksidan yang menyebabkan 50% dari DPPH kehilangan karakter radikal bebasnya.
Semakin tinggi kadar senyawa antioksidan dalam sampel maka akan semakin rendah
Ketika larutan DPPH dicampurkan dengan bahan yang dapat memberi sebuah atom
hidrogen, molekul DPPH akan tereduksi sehingga intensitas warna ungu akan
berkurang (Molyneux, 2004)
2. Metode FRAP (Ferric Reducting Antioxidant Power)
Metode FRAP (Benzie & Stain, 1996) mengunakan Fe (TPTZ)23+ kompleks
besi-ligan 2,4,6-tripiridil-triazin sebagai pereaksi. Kompleks biru Fe (TPTZ)23+ akan
berfungsi sebagai zat pengoksidasi dan akan mengalami reduksi menjadi Fe (TPTZ)22+
yang berwarna kuning dengan reaksi sebagai berikut :
Fe (TPTZ)23+ + AROH Fe (TPTZ)22+ + H+ + AR = O
3. Metode Cuprac ( Cupric Ion Reducting Antioxidant Capacity)
Metode Cuprac (Apak et al, 2007) menggunakan bis (neokuproin) tembaga (II)
Cu(Nc)22+ sebagai pereaksi kromogenik. Pereaksi Cu(Nc)22+ yang berwarna kuning
dengan reaksi :