PENGARUH PEMBERIAN TEPUNG KEDELAI
KAYA ISOFLAVON, SENG DAN VITAMIN E
TERHADAP FERTILITAS TIKUS JANTAN
SEBAGAI HEWAN MODEL
SUSSI ASTUTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Pengaruh Pemberian
Tepung Kedelai Kaya Isoflavon, Seng dan Vitamin E terhadap Fertilitas Tikus Jantan sebagai Hewan Model adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2009
Sussi Astuti
NRP. F261020051
SUSSI ASTUTI. The Effects of Isoflavone-riched Soybean Flour, Zinc (Zn) and Vitamin E on Fertility of Male Rats as Animal Model. Under direction of DEDDY MUCHTADI as chairman and MADE ASTAWAN, BAMBANG PURWANTARA, and TUTIK WRESDIYATI as members.
The objectives of this research were to (1) evaluate the effects of isoflavone-riched soybean flour, zinc (Zn) and vitamin E on fertility of male rats, (2) evaluate the effects of isoflavone-riched soybean flour with different levels of isoflavone on fertility of male rats.
Prior the in vivo experiment, isoflavone-riched soybean flour was defatted using n-hexane. Quantitative analysis of isoflavone on the defatted-soybean flour was conducted by HPLC, while antioxidant activity on the defatted-soybean flour was conducted by DPPH method. Total isoflavone on the defatted-soybean flour (TKI-RL) was considered as the basic concentration that used to calculate isoflavone dosages for the in vivo experiment.
Male and female weaning Sprague Dawley rats (21 days old) were used as the animal model in the experiment. On the 1st stage of the experiment, the male rats were given basic diets containing isonitrogen and isocalories with 15% of dietary protein from casein. Thirty male Sprague Dawley weaning rats (21 days old) were divided into six groups and treated with isoflavone-riched soybean flour, Zn and vitamin E in different combination. Isoflavone-riched soybean flour (3mg/day) was given by oral administration, whereas Zn and vitamin E were mixed with the basic diet. The treatment was conducted for 2 month. On the other hand, thirty female Sprague Dawley rats were only given the basic diets containing 15% of dietary protein from casein to observe the fertility of malerats. After 2 months, both male and female rats were mixed (1:1). Vagina swabs on the female rats were taken every morning to evaluate the conception rate and to detect spermatozoa by Giemsa dyes. Once the spermatozoa detected on the female rats (the 1st day of pregnancy, D1), the male rats were sacrificed by dislocation of cervical bones (dislocasio cervicalis), then all the parameters were tested. On the day 15th of pregnancy, the female rats were sacrificed (D15), the conception rates and total fetus were counted.
On the 2nd stage of the experiment, male rats were given basic diets containing isonitrogen and isocalories with 10% dietary protein from casein. Twenty five male of Sprague Dawley rats were divided into five groups and treated with isoflavone-riched soybean flour by oral administration with different levels (dosage). The treatment was conducted for 2 months. On the other hand, twenty five female Sprague Dawley rats were only given the basic diets containing 10% of dietary protein from casein for 2 months to observe the fertility of male rats. After 2 months, both male and female rats were mixed (1:1). Vagina swabs on the female rats were taken every morning to evaluate the conception rate and to detect spermatozoa by Giemsa dyes. Once the spermatozoa detected on the female rats (the 1st day of pregnancy, D1), the male rats were sacrificed by dislocation of cervical bones (dislocasio cervicalis), then all the parameters were tested. On the day 15th of pregnancy, the female rats were sacrificed (D15), the conception rates and total fetus were counted.
indicated that total concentration of isoflavone (daidzein, genistein, and glisitein) was 2.35 g/100g dried-matter, and the IC50 was 51.96 μg/ml. The result of the 1st
stage of the experiment revealed the synergisms effects between isoflavone-riched soybean flour with Zn and vitamin E on the male rats. The effects observed were the reduction of testical MDA level, recovery of testical SOD activities, stability the content of Cu,Zn-superoxide dismutase (Cu,Zn-SOD) in spermatocytes and early spermatids cells of seminiferous tubules by immunohistochemical technique, increasing of sperm concentration and rate of motility, increasing of serum testosterone and total spermatogenic cells in the seminiferous tubules of testes. In general, complete treatment of isoflavone-riched soybean flour, Zn and vitamin E on male rats resulted in better fertility in comparison with single treatment and the other combination. However, combination the three components did not affect significantly on relative weight of testes, as well as to the conception rate and the number of fetus on female rats. The best fertility of male rats was on the group given isoflavone 3 mg/day, Zn 6.14 mg/kg diet and vitamin E 100 mg/kg diet.
The results of the 2nd stage of the experiment showed that the treatment of TKI-RL on the male rats given isoflavone with dosage of 0 mg/day, 1.5 mg/day, 3 mg/day, 4.5 mg/day, and 6 mg/day did not affect significantly on spermatozoa abnormality. Treatment of isoflavone 6 mg/day resulted in infertility (copulation rate and conception rate on female rats were 100% and 0%, respectively). The higher dosage of isoflavone caused the increasing of concentration of the serum testosterone and Leydig cells of the male rats. The best treatment resulted in the best fertility was on the group given isoflavone 1.5 mg/day indicated by the increasing of relative weight of testes, rate of motility, sperm concentration and total spermatogenic cells in the seminiferous tubules of testes, inhibiting the formation of lipid peroxide which was indicated by decreasing the testical MDA level, recovery of testical SOD activities, and stability the content of Cu,Zn-SOD in the spermatocyte and early spermatid cells as indicated by immunohistochemical technique.
Key words : isoflavone-riched soybean flour, Zn, vitamin E, fertility, male rats
SUSSI ASTUTI. Pengaruh Pemberian Tepung Kedelai Kaya Isoflavon, Seng dan Vitamin E terhadap Fertilitas Tikus Jantan sebagai Hewan Model. Di
bawah bimbingan DEDDY MUCHTADI sebagai Ketua Komisi, serta MADE
ASTAWAN, BAMBANG PURWANTARA, dan TUTIK WRESDIYATI sebagai Anggota Komisi.
Penelitian ini bertujuan untuk (1) mengevaluasi pengaruh pemberian kombinasi tepung kedelai kaya isoflavon, Zn dan vitamin E terhadap fertilitas tikus jantan sebagai hewan model, (2) mengevaluasi pengaruh tepung kedelai kaya isoflavon pada berbagai tingkatan dosis isoflavon terhadap fertilitas tikus jantan sebagai hewan model.
Pada penelitian pendahuluan dilakukan pengurangan lemak terhadap tepung kedelai kaya isoflavon menggunakan pelarut n-heksana. Selanjutnya, dilakukan analisis kuantitatif senyawa isoflavon (HPLC) dan pengujian aktivitas antioksidan terhadap tepung kedelai kaya isoflavon rendah lemak (TKI-RL) yang diperoleh. Kandungan total isoflavon pada TKI-RL dijadikan sebagai dasar perhitungan untuk perlakuan pemberian TKI-RL sesuai dengan dosis isoflavon yang telah ditetapkan.
Uji in vivo menggunakan tikus putih jantan dan betina strain Sprague Dawley umur sapih (21 hari). Pada uji in vivo Tahap I, tikus jantan mendapat ransum basal kasein yang disusun secara isonitrogen dan isokalori dengan kadar protein ransum sebesar 15%. Tiga puluh ekor tikus jantan strain Sprague Dawley dibagi dalam enam kelompok, yaitu : (1) Kontrol negatif / K-, tanpa cekok TKI-RL, Zn dan vitamin E ; (2) Cekok aquades, tanpa TKI-RL, dengan Zn dan vitamin E (ZE); (3) Cekok RL (I); (4) Cekok RL dan Zn (IZ); (5) Cekok TKI-RL dan vitamin E (IE); dan (6) Cekok TKI-TKI-RL, Zn dan vitamin E (IZE). Tepung kedelai kaya isoflavon dengan dosis isoflavon 3 mg/ekor/hari diberikan secara oral, sedangkan Zn 6.14 mg/kg ransum dan vitamin E 100 mg/kg ransum dicampur dalam ransum basal kasein. Perlakuan diberikan selama dua bulan. Tiga puluh ekor tikus betina strain Sprague Dawley umur sapih (21 hari) diberi ransum basal kasein selama dua bulan dengan kadar protein ransum 15%, untuk mengobservasi fertilitas tikus jantan. Setelah dua bulan perlakuan, tikus jantan digabung dengan tikus betina (1:1). Setiap pagi terhadap tikus betina dilakukan usap vagina dengan pewarnaan Giemsa untuk mengetahui kondisi estrus dan mendeteksi ada tidaknya spermatozoa. Setelah terdeteksi adanya spermatozoa pada vagina tikus betina (dihitung sebagai H1 kebuntingan), tikus jantan dikorbankan dengan dipatahkan tulang leher (dislocasio cervicalis), kemudian dilakukan pengamatan terhadap berbagai parameter yang diuji. Tikus betina dikorbankan pada umur kebuntingan 15 hari (H15) untuk pengamatan terhadap angka konsepsi dan jumlah fetus.
Setelah dua bulan perlakuan, tikus jantan digabung dengan tikus betina (1:1). Setiap pagi terhadap tikus betina dilakukan usap vagina dengan pewarnaan Giemsa untuk mengetahui kondisi estrus dan mendeteksi ada tidaknya spermatozoa. Setelah terdeteksi adanya spermatozoa pada vagina tikus betina (dihitung sebagai H1 kebuntingan), tikus jantan dikorbankan dengan dipatahkan tulang leher (dislocasio cervicalis), kemudian dilakukan pengamatan terhadap berbagai parameter yang diuji. Tikus betina dikorbankan pada umur kebuntingan 15 hari (H15) untuk pengamatan terhadap angka konsepsi dan jumlah fetus.
Data diolah dengan sidik ragam menggunakan Rancangan Acak Lengkap (RAL) untuk mengetahui pengaruh perlakuan terhadap parameter yang diuji. Untuk mengetahui perbedaan antar perlakuan, data yang menunjukkan pengaruh nyata selanjutnya diuji dengan Duncan Multiple Range Test (DMRT).
Hasil analisis kuantitatif senyawa isoflavon pada TKI-RL dengan HPLC menunjukkan kadar total isoflavon (daidzein, genistein, dan glisitein) sebesar 2.35g/100g(bk), sedangkan nilai IC50 TKI-RL sebesar 51.96 μg/ml. Hasil uji in
vivo Tahap I menunjukkan bahwa terjadi interaksi secara sinergis antara tepung kedelai kaya isoflavon, Zn dan vitamin E pada tikus jantan yang menyebabkan : menurunnya kadar MDA testis, aktivitas SOD testis dipertahankan tetap tinggi, kandungan Cu,Zn-superoxide dismutase (Cu,Zn-SOD) tubuli seminiferi testis pada sel spermatosit dan spermatid awal melalui deteksi secara imunohistokimia dipertahankan tetap tinggi; meningkatnya motilitas spermatozoa, konsentrasi spermatozoa, kadar hormon testostreron serum, serta jumlah sel spermatogenik pada tubuli seminiferi testis.
Pemberian tepung kedelai kaya isoflavon, Zn dan vitamin E pada tikus jantan secara lengkap memberikan fertilitas yang paling baik dibanding pemberian tunggal atau dua kombinasi diantaranya. Pemberian tepung kedelai kaya isoflavon, Zn dan vitamin E pada tikus jantan tidak berpengaruh terhadap berat testis, serta angka kebuntingan dan jumlah fetus pada tikus betina. Perlakuan yang menunjukkan fertilitas tikus jantan terbaik adalah pemberian secara lengkap : tepung kedelai kaya isoflavon dengan dosis isoflavon 3 mg/ekor/hari, Zn 6.14 mg/kg ransum, dan vitamin E 100 mg/kg ransum, yang menghasilkanberat testis relatif 0.55±0.03%, motilitas spermatozoa 79.5±1.12%, konsentrasi spermatozoa 1636.90 ±87.95 juta/ml, abnormalitas spermatozoa 9.00±0.70%, serta kadar hormon testosteron serum 3.49±0.31 ng/ml. Hasil pengamatan terhadap sel spermatogenik menghasilkan : jumlah sel spermatogonia, spermatosit, spermatid awal, spermatid akhir dan total sel spermatogenik masing-masing sebesar 37.56±4.48, 67±4.72, 287.11±31.75, 227.22±29.78, dan 618.89±47.38. Pengukuran terhadap kadar MDA testis sebesar 1.89± 0.06 nmol/g, sedangkan aktivitas SOD testis sebesar 882.4±19.24 U/g. Profil Cu,Zn-superoxide dismutase (Cu,Zn-SOD) tubuli seminiferi testis pada sel spermatosit dan spermatid awal yaitu positif kuat (+++) sebesar 194.78±15.79, positif sedang/ lemah (++/+) 115.22±9.24 dan negatif (-) 41.89±7.44. Angka konsepsi dan jumlah fetus pada tikus betina masing-masing sebesar 100% dan 11±0.71 ekor.
hormon testosteron serum dan jumlah sel Leydig pada tikus jantan.
Perlakuan yang menunjukkan fertilitas tikus jantan terbaik adalah pemberian tepung kedelai kaya isoflavon pada dosis isoflavon 1.5 mg/ekor/hari, yang mengakibatkan : meningkatnya beberapa parameter seperti berat testis, motilitas spermatozoa, konsentrasi spermatozoa, dan jumlah sel spermatogenik pada tubuli seminiferi testis; terhambatnya pembentukan peroksidasi lipid yang diperlihatkan dengan menurunnya kadar MDA testis; aktivitas enzim SOD testis dipertahankan tetap tinggi; kandungan Cu,Zn-SOD tubuli seminiferi testis pada sel spermatosit dan spermatid awal melalui deteksi secara imunohistokimia dipertahankan tetap tinggi.
Pemberian tepung kedelai kaya isoflavon dengan dosis isoflavon 1.5 mg/ekor/hari menghasilkan : berat relatif testis 0.5894±0.03%, motilitas spermatozoa 77.5±2.50%, konsentrasi spermatozoa 1393.75±30.62 juta/ml, abnormalitas spermatozoa 8.99±1.29, butiran sitoplasma 8.92±1.08%, kadar hormon testosteron serum 2.96±0.45 ng/ml; jumlah sel Leydig 70.22±9.34; jumlah sel spermatogonia, spermatosit, spermatid primer, spermatid sekunder dan total sel spermatogenik masing-masing sebesar 48.44±4.82, 60.00±3.43, 221.56± 16.12, 164.33±17.94, dan 494.33±32.94; kadar MDA testis 2.29±0.05 nmol/g serta aktivitas enzim SOD testis 729.4±23.73 U/g. Profil Cu,Zn-superoxide dismutase (Cu,Zn-SOD) tubuli seminiferi testis pada sel spermatosit dan spermatid awal yaitu, positif kuat (+++) sebesar 166.78±6.92, positif sedang/ lemah (++/+) 85.22±9.24 dan negatif (-) 32.33±5.27. Angka konsepsi dan jumlah fetus pada tikus betina masing-masing sebesar 100% dan 10.2±0.45 ekor.
Kata kunci : tepung kedelai kaya isoflavon, seng (Zn), vitamin E, fertilitas, tikus jantan
© Hak Cipta milik IPB, tahun 2009 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
KAYA ISOFLAVON, SENG DAN VITAMIN E
TERHADAP FERTILITAS TIKUS JANTAN
SEBAGAI HEWAN MODEL
SUSSI ASTUTI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr. Ir. Dahrul Syah, M.Sc. Agr.
Seng dan Vitamin E terhadap Fertilitas Tikus Jantan sebagai Hewan Model
Nama : Sussi Astuti
NRP : F261020051
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Deddy Muchtadi, M.S. Prof. Dr. Ir. Made Astawan, M.S. Ketua Anggota
Dr. Drh. Bambang Purwantara, M.Sc Dr. Drh. Tutik Wresdiyati Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pangan
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S
Segala puji bagi Allah SWT yang telah memberi rahmat dan berkah-Nya sehingga penulisan disertasi yang berjudul "Pengaruh Pemberian Tepung Kedelai Kaya Isoflavon, Seng dan Vitamin E terhadap Fertilitas Tikus Jantan sebagai Hewan Model" dapat diselesaikan. Disertasi ini dibuat sebagai salah satu syarat mahasiswa pascasarjana program S3 untuk meraih gelar Doktor pada Program Studi Ilmu Pangan, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan penghargaan dan ucapan terimakasih yang sangat tulus dan mendalam kepada yang terhormat Ketua Komisi Pembimbing Bapak Prof. Dr. Ir. Deddy Muchtadi, M.S. atas bimbingan, arahan, dukungan moril dan bantuan bahan baku utama dalam penelitian ini, Anggota Komisi Pembimbing Bapak Prof. Dr. Ir. Made Astawan, M.S. atas saran, diskusi dan bimbingannya, Bapak Dr. Drh. Bambang Purwantara, M.Sc. atas saran, diskusi dan bimbingannya, Ibu Dr. Drh. Tutik Wresdiyati atas bimbingan, diskusi dan dukungan moril, serta menyediakan bahan untuk pengamatan histologis dan deteksi imunohistokimia kepada penulis. Peran semua komisi pembimbing sungguh sangat berarti sehingga penelitian ini akhirnya dapat diselesaikan.
Penulis juga menyampaikan terima kasih kepada Bapak Prof. Dr. dr. Ichramsjah A. Rachman SpOG(K), dan Ibu Prof. Dr. Ir. Latifah K. Darusman, M.S. yang telah meluangkan waktu, menyampaikan saran dan masukan sebagai penguji luar komisi pada ujian terbuka, serta Bapak Dr. Ir. Dahrul Syah, M.Sc. Agr. atas segala saran dan masukan selaku penguji luar komisi pada ujian tertutup.
Ucapan terima kasih penulis sampaikan kepada Ketua Program Studi Ilmu Pangan Sekolah Pascasarjana Institut Pertanian Bogor beserta para Staf Pengajar di lingkungan Sekolah Pascasarjana Institut Pertanian Bogor, khususnya pada Program Studi Ilmu Pangan yang telah memberikan curahan ilmu dan pengalamannya selama penulis menempuh pendidikan di IPB.
kepada penulis untuk mengikuti Program Doktor di IPB.
Penulis mengucapkan terimakasih kepada Dr. Iis Arifiantini, M.Si. yang telah memberikan bantuan teknis pada saat pelaksanaan pembedahan. Kepada para sahabat, kolega kerja dan teknisi yang tidak dapat penulis sebutkan satu persatu, baik yang berada di laboratorium PAU Biotek, Seafast Centre, FKH dan Program Studi Ilmu Pangan, serta Departemen Ilmu dan Teknologi Pangan, penulis mengucapkan terimakasih atas persahabatan dan kerjasama yang telah terjalin dengan baik.
Kepada ayahanda Bapak Abd. Rachman (almarhum) dan Ibunda Hj. Subaidijah, penulis menyampaikan rasa hormat dan terimakasih yang mendalam atas didikan, doa restu, dorongan dan motivasi serta bantuan moril dan materiil sehingga memberikan dukungan yang luar biasa bagi penulis dalam menempuh pendidikan doktor ini. Penulis juga menyampaikan terimakasih kepada mertua Ibu Hj. Akmaliyah serta seluruh keluarga khususnya kakak, adik, kakak ipar dan adik ipar atas doa dan dukungannya selama penulis mengikuti pendidikan di IPB. Rasa terimakasih yang tulus penulis sampaikan kepada suami tercinta Dr. Ir. Muhammad Irfan Affandi, M.Si., ananda Muhammad Riza Darmawan, Safira Nuril Izzah, dan Muhammad Rafi Naufal, yang telah setia dan sabar mendampingi dengan penuh pengertian dan pengorbanan selama penulis mengikuti program S3 ini.
Akhirnya semua budi baik yang diberikan kepada penulis semoga diterima dan diberi balasan berlipat ganda oleh Allah SWT. Tak lupa permohonan maaf bila penulis melakukan kesalahan, baik yang disengaja maupun tidak. Semoga disertasi ini bermanfaat bagi khasanah ilmu pengetahuan. Amin.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Jember pada tanggal 24 Agustus 1967 sebagai anak ketiga dari pasangan Abd. Rachman dan Hj. Subaidijah. Pendidikan sarjana ditempuh di Jurusan Teknologi Pertanian Fakultas Pertanian Universitas Brawijaya Malang, lulus pada tahun 1991. Pada tahun 1996, penulis melanjutkan studi di Program Studi Ilmu Pangan Program Pascasarjana IPB dan menyelesaikannya pada tahun 1999. Pada tahun 2002, dengan Beasiswa TPSDP UNILA penulis mendapatkan kesempatan melanjutkan studi ke program doktor Program Studi Ilmu Pangan Sekolah Pascasarjana IPB.
Sejak tahun 1993 penulis bekerja sebagai staf pengajar pada Jurusan Teknologi Hasil Pertanian Fakultas Pertanian Universitas Lampung sampai sekarang. Penulis pernah menjadi Kepala Laboratorium Pengolahan Pangan Jurusan Teknologi Hasil Pertanian Universitas Lampung Tahun 2000-2002.
Selama mengikuti program S3, sebagian hasil penelitian disertasi penulis telah diseminarkan pada Seminar Nasional XIII PERSADA BOGOR, 9 Agustus 2007, serta Seminar dan Lokakarya Perkembangan Terkini tentang Tempe & Produk Makanan Berbasis Kedelai, Forum Tempe-Bogor, 28-29 Agustus 2008. Beberapa artikel ilmiah yang telah diselesaikan antara lain :
1. Kadar peroksida lipid dan aktivitas superoksida dismutase (SOD) testis tikus yang diberi tepung kedelai kaya isoflavon, seng (Zn), dan vitamin E (The effects of isoflavone-riched soybean flour, zinc (Zn ) and vitamin E on lipid peroxide
level and superoxide dismutase (SOD) activity of rat testes). Majalah Kedokteran Bandung 40(2), Edisi Juli 2008 (Terakreditasi B), in press
2. Pengaruh pemberian tepung kedelai kaya isoflavon, seng (Zn) dan vitamin E terhadap kualitas spermatozoa tikus jantan (The effects of isoflavone-riched soybean flour, zinc (Zn) and vitamin E on the quality of spermatozoa of male rats). Media Peternakan, Fakultas Peternakan IPB, (Terakreditasi B),
in press
3. Pengaruh pemberian tepung kedelai kaya isoflavon, seng (Zn) dan vitamin E
(Terakreditasi B), submitted
4. Pengaruh pemberian tepung kedelai kaya isoflavon terhadap kadar peroksida lipid, aktivitas superoksida dismutase (SOD) testis dan profil Cu,Zn-SOD tubuli seminiferi testis tikus (The effects of isoflavone-riched soybean flour on lipid peroxide level, superoxide dismutase (SOD) activity, and profile of Cu,Zn-superoxide dismutase (Cu,Zn-SOD) in the seminiferous tubules of male rats testes). Jurnal Teknologi dan Industri Pangan, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian IPB, (Terakreditasi B), submitted
Halaman
DAFTAR TABEL iv
DAFTAR GAMBAR v
DAFTAR LAMPIRAN vi
PENDAHULUAN UMUM
Latar Belakang 1 Tujuan Penelitian 5
Tujuan Umum 5
Tujuan Khusus 5
Manfaat Penelitian 6
Hipotesis 6
Metode Penelitian 6
TINJAUAN PUSTAKA
Isoflavon Kedelai 9
Aktivitas Senyawa Isoflavon pada Hewan Jantan dan Pria 11
Estrogen pada Hewan Jantan 12
Mineral Seng (Zn) 14
Vitamin E 17
Radikal Bebas dan Sistem Pertahanan Tubuh 19
Hubungan Spesies Oksigen Reaktif dengan Kualitas
Spermatozoa 22
KADAR PEROKSIDA LIPID, AKTIVITAS SUPEROKSIDA DISMUTASE (SOD) TESTIS DAN PROFIL Cu,Zn-SOD TUBULI SEMINIFERI TESTIS TIKUS YANG DIBERI TEPUNG KEDELAI KAYA ISOFLAVON, SENG (Zn), DAN VITAMIN E
Abstrak 26
Abstract 26
Pendahuluan 27
Bahan dan Metode 28
Bahan Penelitian 28
Metode Penelitian 29
Hasil dan Pembahasan 33
Kesimpulan 42
Daftar Pustaka 42
PENGARUH PEMBERIAN TEPUNG KEDELAI KAYA ISOFLAVON, SENG (Zn) DAN VITAMIN E TERHADAP KUALITAS SPERMATOZOA TIKUS JANTAN
Abstrak 45
Abstract 45
Pendahuluan 46
Bahan dan Metode 47
Bahan Penelitian 47
Metode Penelitian 48
Hasil dan Pembahasan 51
Kesimpulan 57
DAN VITAMIN E TERHADAP KADAR HORMON TESTOSTERON SERUM DAN JUMLAH SEL SPERMATOGENIK PADA TUBULI SEMINIFERI TESTIS TIKUS JANTAN
Abstrak 60
Abstract 60
Pendahuluan 61
Bahan dan Metode 62
Bahan Penelitian 62
Metode Penelitian 62
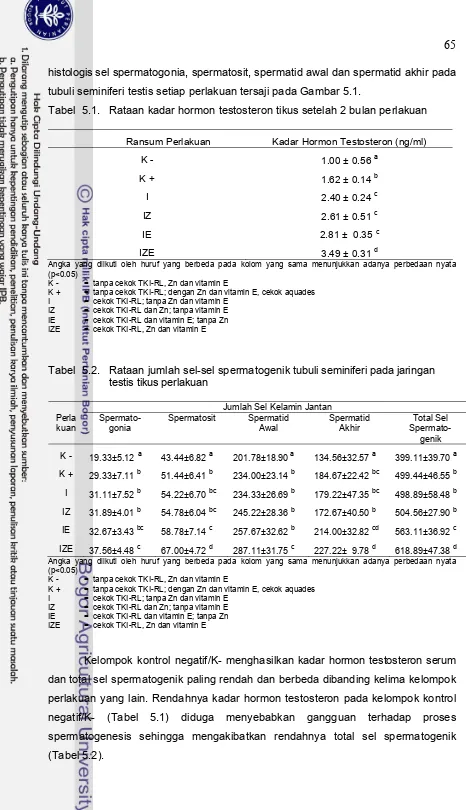
Hasil dan Pembahasan 64
Kesimpulan 69
Daftar Pustaka 70
KADAR PEROKSIDA LIPID, AKTIVITAS SUPEROKSIDA DISMUTASE (SOD) TESTIS DAN PROFIL Cu,Zn-SOD TUBULI SEMINIFERI TESTIS TIKUS YANG DIBERI TEPUNG KEDELAI KAYA ISOFLAVON
Abstrak 72
Abstract 72
Pendahuluan 73
Bahan dan Metode 74
Bahan Penelitian 74
Metode Penelitian 75
Hasil dan Pembahasan 77
Kesimpulan 84
Daftar Pustaka 84
KUALITAS SPERMATOZOA TIKUS JANTAN YANG DIBERI TEPUNG KEDELAI KAYA ISOFLAVON
Abstrak 87
Abstract 87
Pendahuluan 88
Bahan dan Metode 90
Bahan Penelitian 90
Metode Penelitian 90
Hasil dan Pembahasan 93
Kesimpulan 101
Daftar Pustaka 102
KADAR HORMON TESTOSTERON SERUM, JUMLAH SEL LEYDIG DAN JUMLAH SEL SPERMATOGENIK PADA TUBULI SEMINIFERI TESTIS TIKUS YANG DIBERI TEPUNG KEDELAI KAYA ISOFLAVON
Abstrak 105
Abstract 105
Pendahuluan 106
Bahan dan Metode 107
Bahan Penelitian 107
Metode Penelitian 108
Hasil dan Pembahasan 110
Kesimpulan 116
KESIMPULAN DAN SARAN UMUM 141
DAFTAR PUSTAKA 143
Halaman
3.1 Hasil analisis kuantitatif senyawa isoflavon pada TKI-RL 33 3.2 Profil kandungan Cu,Zn-SOD sel spermatosit dan spermatid awal
pada tubuli seminiferi testis tikus perlakuan 37
4.1 Rataan kualitas spermatozoa tikus setelah 2 bulan perlakuan 52
4.2 Angka konsepsi dan jumlah fetus pada tikus betina 56
5.1 Rataan kadar hormon testosteron tikus setelah 2 bulan perlakuan 65 5.2 Rataan jumlah sel-sel spermatogenik tubuli seminiferi pada
jaringan testis tikus perlakuan 65
6.1 Profil kandungan Cu,Zn-SOD sel spermatosit dan spermatid awal tubuli seminiferi pada jaringan testis tikus pada berbagai variasi
dosis isoflavon 80
7.1 Rataan kualitas spermatozoa tikus setelah 2 bulan perlakuan 94
7.2 Angka konsepsi dan jumlah fetus pada tikus betina 100
8.1 Rataan kadar hormon testosteron serum dan jumlah sel
Leydig setelah 2 bulan perlakuan 110
8.2 Rataan jumlah sel-sel spermatogenik tubuli seminiferi pada jaringan testis tikus perlakuan dengan berbagai variasi dosis
isoflavon 114
Halaman
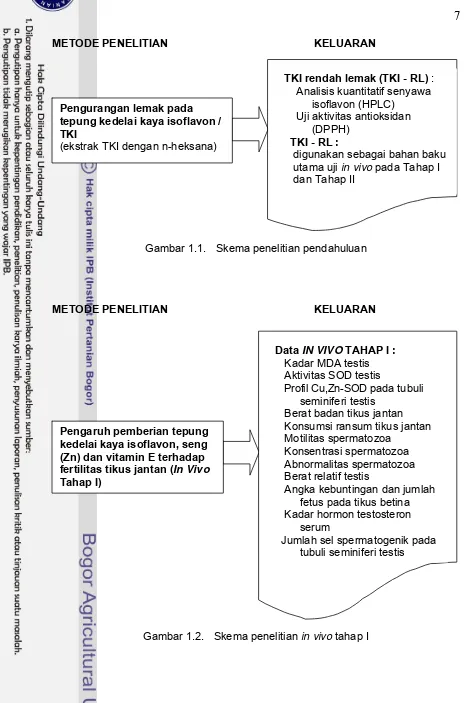
1.1 Skema penelitian pendahuluan 7
1.2 Skema penelitian in vivo tahap I 7
1.3 Skema penelitian in vivotahap II 8
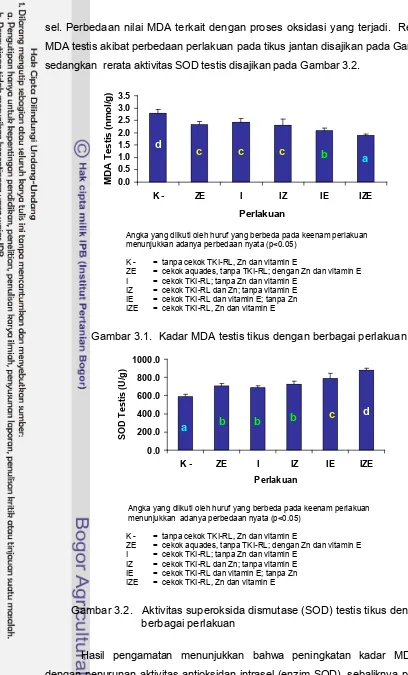
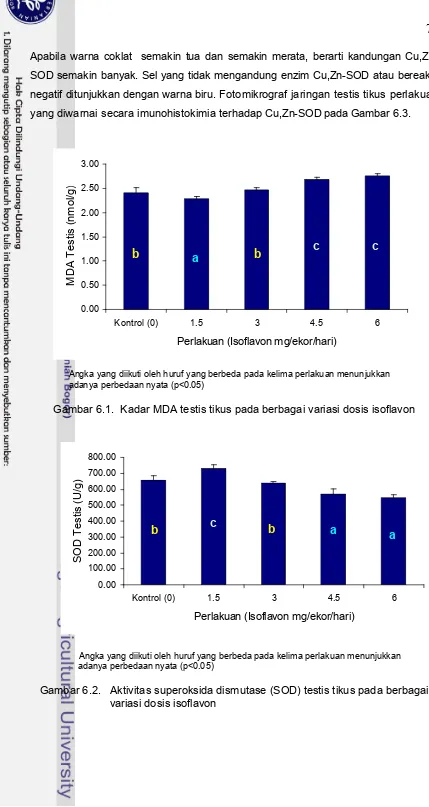
3.1 Kadar MDA testis tikus dengan berbagai perlakuan 35
3.2 Aktivitas superoksida dismutase (SOD) testis tikus dengan
berbagai perlakuan 35
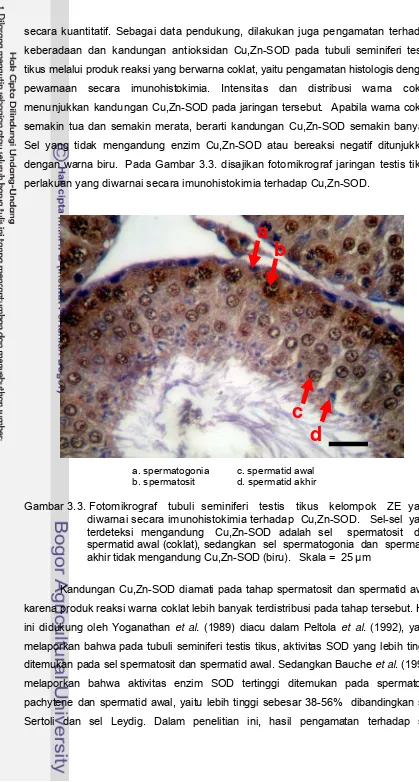
3.3 Fotomikrograf jaringan testis tikus perlakuan yang diwarnai
secara imunohistokimia terhadap Cu,Zn-SOD 36
4.1 Berat badan tikus selama perlakuan 51
5.1 Fotomikrograf tubuli seminiferi pada testis tikus perlakuan
(Pewarnaan HE) 66
6.1 Kadar MDA testis tikus pada berbagai variasi dosis isoflavon 78 6.2 Aktivitas superoksida dismutase (SOD) testis tikus pada berbagai
variasi dosis isoflavon 78
6.3 Fotomikrograf jaringan testis tikus perlakuan yang diwarnai secara
imunohistokimia terhadap Cu,Zn-SOD 79
7.1 Berat badan tikus jantan pada berbagai variasi dosis isoflavon 93
8.1 Fotomikrograf sel Leydig pada testis tikus perlakuan 111
8.2 Fotomikrograf tubuli seminiferi pada testis tikus perlakuan
Halaman
1 Kromatogram HPLC TKI-RL 154
2 Perhitungan kandungan senyawa isoflavon TKI-RL 155
3 Contoh perhitungan dosis isoflavon untuk cekok 155
4 Perhitungan penambahan ZnSO4.7H20 156
5 Perhitungan penambahan Zn elemental 156
6 Perhitungan penambahan vitamin E 157
7 Prosedur pembuatan sediaan histologi 158
8 Prosedur pewarnaan Hematoxylin Eosin (HE) 158
9 Prosedur pewarnaan Cu,Zn-SOD secara Imunohistokimia 159
10 Analisis ragam pengaruh jenis ransum terhadap kadar MDA testis
(nmol/g) (In VivoTAHAP I) 160
11 Analisis ragam pengaruh jenis ransum terhadap aktivitas SOD testis
(U/g) (In VivoTAHAP I) 160
12 Analisis ragam pengaruh jenis ransum terhadap jumlah sel spermatosit dan spermatid awal yang memberikan reaksi positif
kuat terhadap kandungan Cu,Zn-SOD (In Vivo TAHAP I) 160 13 Analisis ragam pengaruh jenis ransum terhadap jumlah sel
spermatosit dan spermatid awal yang memberikan reaksi positif
sedang/lemah terhadap kandungan Cu,Zn-SOD (In Vivo TAHAP I) 160 14 Analisis ragam pengaruh jenis ransum terhadap jumlah sel
spermatosit dan spermatid awal yang memberikan reaksi negatif
terhadap kandungan Cu,Zn-SOD (In Vivo TAHAP I) 160
15 Analisis ragam pengaruh jenis ransum terhadap motilitas
spermatozoa (%)(In VivoTAHAP I) 161
16 Analisis ragam pengaruh jenis ransum terhadap konsentrasi
spermatozoa (juta/ml) (In VivoTAHAP I) 161
17 Analisis ragam pengaruh jenis ransum terhadap abnormalitas
spermatozoa (%)(In Vivo TAHAP I) 161
18 Analisis ragam pengaruh jenis ransum terhadap berat relatif testis
(In VivoTAHAP I) 161
19 Analisis ragam pengaruh jenis ransum terhadap kadar hormon
spermatogonia (In Vivo TAHAP I) 162 21 Analisis ragam pengaruh jenis ransum terhadap jumlah sel
spermatosit (In VivoTAHAP I) 162
22 Analisis ragam pengaruh jenis ransum terhadap jumlah sel
spermatid awal (In VivoTAHAP I) 162
23 Analisis ragam pengaruh jenis ransum terhadap jumlah sel
spermatid akhir (In VivoTAHAP I) 162
24 Analisis ragam pengaruh jenis ransum terhadap jumlah total sel
spermatogenik (In VivoTAHAP I) 162
25 Analisis ragam pengaruh jenis ransum terhadap jumlah fetus pada
tikus betina (In VivoTAHAP I) 163
26 Analisis ragam pengaruh dosis isoflavon terhadap kadar MDA testis
(nmol/g) (In VivoTAHAP II) 163
27 Analisis ragam pengaruh dosis isoflavon terhadap aktivitas SOD
testis (U/g) (In VivoTAHAP II) 163
28 Analisis ragam pengaruh dosis isoflavon terhadap jumlah sel spermatosit dan spermatid awal yang memberikan reaksi positif
kuat terhadap kandungan Cu,Zn-SOD (In Vivo TAHAP II) 163 29 Analisis ragam pengaruh dosis isoflavon terhadap jumlah sel
spermatosit dan spermatid awal yang memberikan reaksi positif
sedang/lemah terhadap kandungan Cu,Zn-SOD (In Vivo TAHAP II) 163 30 Analisis ragam pengaruh dosis isoflavon terhadap jumlah sel
spermatosit dan spermatid awal yang memberikan reaksi negatif
terhadap kandungan Cu,Zn-SOD (In Vivo TAHAP II) 164
31 Analisis ragam pengaruh dosis isoflavon terhadap motilitas
spermatozoa (%)(In VivoTAHAP II) 164
32 Analisis ragam pengaruh dosis isoflavon terhadap konsentrasi
spermatozoa (juta/ml) (In VivoTAHAP II) 164
33 Analisis ragam pengaruh dosis isoflavon terhadap abnormalitas
spermatozoa (%)(In Vivo TAHAP II) 164
34 Analisis ragam pengaruh dosis isoflavon terhadap butiran
sitoplasma (%)(In Vivo TAHAP II) 164
35 Analisis ragam pengaruh dosis isoflavon terhadap berat relatif testis
testosteron serum (ng/ml) (In VivoTAHAP II) 165 37 Analisis ragam pengaruh dosis isoflavon terhadap jumlah sel
Leydig (In VivoTAHAP II) 165
38 Analisis ragam pengaruh dosis isoflavon terhadap jumlah sel
spermatogonia (In VivoTAHAP II) 165
39 Analisis ragam pengaruh dosis isoflavon terhadap jumlah sel
spermatosit (In VivoTAHAP II) 165
40 Analisis ragam pengaruh dosis isoflavon terhadap jumlah sel
spermatid awal (In Vivo TAHAP II) 166
41 Analisis ragam pengaruh dosis isoflavon terhadap jumlah sel
spermatid akhir (In VivoTAHAP II) 166
42 Analisis ragam pengaruh dosis isoflavon terhadap jumlah total sel
spermatogenik (In Vivo TAHAP II) 166
43 Analisis ragam pengaruh dosis isoflavon terhadap jumlah fetus pada
Latar Belakang
Persoalan infertilitas (gangguan kesuburan) merupakan masalah kompleks, melibatkan dua pihak, dapat disebabkan oleh gangguan pada pria maupun wanita. Menurut Moeloek (1990), sekitar 40-60% kejadian infertilitas disebabkan oleh gangguan pada pria. Spermatozoa membutuhkan senyawa spesies oksigen reaktif (reactive oxygen species, ROS) pada konsentrasi rendah untuk menginduksi proses kapasitasi dan reaksi akrosom (Sikka 2004), serta berikatan dengan zona pelusida (Sanocka & Kurpisz 2004) sehingga proses fertilisasi dapat berlangsung dengan baik.
Pembentukan ROS secara berlebihan akan memicu stres oksidatif, berpotensi mengakibatkan toksik, dan merupakan mediator penting terhadap berkurangnya fungsi dan kualitas spermatozoa (Aitken & Clarkson 1987). Pembentukan ROS yang berlebih dapat dihubungkan dengan penurunan motilitas, morfologi abnormalitas, penurunan kapasitas penetrasi spermatozoa dengan oosit, serta penurunan fertilitas (Potts et al. 1999).
Stres oksidatif adalah suatu kondisi yang berhubungan dengan peningkatan kecepatan kerusakan sel akibat induksi oksigen dan turunannya (senyawa spesies oksigen reaktif/ROS). Kerusakan sel disebabkan oleh ketidakseimbangan antara pembentukan ROS dan aktivitas pertahanan antioksidan (scavenger). Kondisi yang berhubungan dengan stres meliputi status penyakit kronis, penuaan, terekspos toksin (Sikka et al. 1995). Menurut Saleh & Agarwal (2002), infeksi, inflamasi, serta kasus infertilitas dapat meningkatkan proses oksidasi dan menyebabkan kerusakan sel.
Spermatozoa memiliki sistem pertahanan enzimatik maupun non-enzimatik untuk menetralkan pengaruh toksik senyawa ROS pada spermatozoa, sehingga ROS hanya terdapat dalam jumlah kecil yang diperlukan untuk menjaga fungsi spermatozoa tetap normal. Antioksidan yang ditemukan dalam semen manusia meliputi antioksidan enzimatik dan antioksidan non-enzimatik. Antioksidan enzimatik meliputi superoksida dismutase (SOD) untuk dismutasi radikal anion superoksida, serta katalase dan glutation peroksidase untuk detoksifikasi H2O2.
Peningkatan radikal bebas pada jaringan testis yang memproduksi spermatozoa dapat menyebabkan kerusakan membran spermatozoa, sehingga mengubah kestabilan dan fungsi membran. Integritas serta fluiditas membran yang baik diperlukan untuk berlangsungnya proses kapasitasi, reaksi akrosom serta terjadinya fusi antara membran spermatozoa dengan membran ovum sehingga fertilisasi berlangsung dengan sempurna. Kemampuan spermatozoa untuk mengadakan fertilisasi harus didukung oleh membran spermatozoa yang memiliki integritas (keutuhan) dan fluiditas (kelenturan) optimum. Penyebab utama kerusakan membran spermatozoa diduga akibat proses peroksidasi lipid pada membran yang terbentuk dari reaksi berantai antara radikal bebas dengan asam lemak tidak jenuh (Halliwell & Gutteridge 1999; Sanocka & Kurpisz 2004). Di samping mengganggu stabilitas membran, peroksidasi lipid dilaporkan dapat mengacaukan aktivitas enzim membran seperti ATP-ase, sehingga mengakibatkan terganggunya regulasi kation intraseluler seperti Ca2+ yang memegang peranan sangat penting dalam motilitas spermatozoa (Sevanian et al. 1988; Aitken et al.
1993).
Menurut Sikka (2004), terdapatnya radical scavenger diduga akan
membersihkan radikal bebas pada jaringan-jaringan yang memproduksi spermatozoa dan menstimulasi ekspresi Cu,Zn-SOD yang dapat melindungi sel dari stres oksidatif. Bahan pangan yang mengandung antioksidan, yang berperan sebagai scavenger radikal bebas dilaporkan Sikka (2004) dapat menekan proses oksidasi, peroksidasi lipid dan kerusakan sel spermatozoa, serta mencegah kondisi stres oksidatif sehingga diduga dapat mengurangi kasus infertilitas. Di samping itu, konsumsi bahan pangan yang mengandung antioksidan dilaporkan juga dapat meningkatkan status antioksidan.
Kedelai merupakan sumber antioksidan alami, mengandung komponen bioaktif isoflavon, dan termasuk salah satu golongan flavonoid. Aktivitas antioksidan flavonoid ditentukan oleh jumlah dan posisi gugus hidroksil aromatik yang mampu mendonorkan ion hidrogen (Toda & Shirataki 1999; Su et al. 2004), dan sebagai scavenger radikal bebas yang terbentuk selama terjadi peroksidasi lipid (Arora et al. 1998; Amic et al. 2002). Tiga struktur penting senyawa flavonoid yang diduga memiliki kemampuan sebagai antioksidan dan sebagai scavenger
radikal hidroksil dan peroksil; menstabilkan kedua radikal tersebut, serta membentuk radikal flavonoid yang relatif lebih stabil. Struktur molekul isoflavon memiliki susunan meta 5,7-dihidroksil pada cincin A, gugus 4-okso yang berkonjugasi dengan ikatan rangkap C2-C3 pada cincin C, serta gugus 4’-hidroksil
pada cincin B (Arora et al. 1998; Pokorny et al. 2001). Dengan struktur kimia tersebut, isoflavon mempunyai kemampuan untuk berperan sebagai donor ion hidrogen dan memiliki potensi sebagai antioksidan.
Isoflavon kedelai dikenal sebagai fitoestrogen karena struktur molekul isoflavon kedelai mirip dengan struktur molekul estrogen. Hal ini menyebabkan isoflavon kedelai dapat berikatan dengan reseptor estrogen (RE), namun afinitas RE ligan tersebut lebih rendah dibanding estrogen endogen (Miksicek 1994). Sel epitel dari jaringan reproduksi seperti kelenjar susu, ovari dan testis merupakan subyek dari aksi isoflavon (Anderson & Graner 2000). Aksi biologis fitoestrogen adalah kemampuannya untuk bertindak sebagai estrogen agonis yang dapat berikatan dengan RE dan menstimulasi respon estrogen, atau bertindak sebagai estrogen antagonis yang dapat berikatan dengan RE namun menghambat respon estrogen (Helferich et al. 2001; Ruggiero et al. 2002). Wang & Kurzer (1998) diacu dalam Robertson et al. (2002) menyatakan bahwa aksi spesifik fitoestrogen dengan keberadaan estrogen endogen tergantung pada konsentrasinya, di mana aksi agonis terlihat ketika estrogen terdapat pada konsentrasi rendah, sedangkan aksi antagonis terlihat ketika estrogen terdapat pada konsentrasi tinggi. Pendapat serupa juga dikemukakan Brzozowski et al. (1997), bahwa isoflavon bersifat antagonis ketika kadar estrogen tinggi, sebaliknya isoflavon bersifat agonis ketika kadar estrogen rendah.
Studi pengaruh isoflavon kedelai terhadap kualitas spermatozoa dan hormon steroid pada pria telah dilakukan oleh Habito et al. (2000), Mitchell et al.
(2001) dan Nagata et al. (2001). Dilaporkan bahwa konsumsi isoflavon kedelai pada dosis 40 mg/hari, 48 mg/hari dan 70 mg/hari tidak mempengaruhi kualitas spermatozoa dan konsentrasi hormon reproduksi pria umur 18-46 th.
kandungan isoflavon tepung tempe dalam ransum sebesar 2.77 ± 0.19 mg/ekor/hari.
Sebaliknya, pemberian isoflavon dalam bentuk isolat isoflavon murni pada konsentrasi tinggi terhadap fertilitas mencit jantan dilaporkan memberikan pengaruh negatif. Martin (1983) menyatakan bahwa pemberian genistein pada konsentrasi 9 mg/ekor/hari menyebabkan kecenderungan atropi testis. Atanassova
et al. (2000) melaporkan perubahan berat testis, penyusutan dimensi tubuli seminiferi dan terganggunya spermatogenesis setelah tikus diberi genistein melalui injeksi pada dosis 4 mg/kg berat badan/hari. Sedangkan Fritz et al. (2003) melaporkan penurunan aktivitas aromatase testis tikus akibat pemberian genistein melalui jalur diet konsumsi secara normal pada dosis 250 mg/kg diet (± 5 mg /ekor/hari). Berdasarkan data tersebut, terlihat bahwa hasil penelitian mengenai pengaruh isoflavon kedelai terhadap kualitas spermatozoa dan hormon steroid pada pria masih menimbulkan kontroversi. Oleh karena itu, masih perlu diungkap peran isoflavon kedelai terhadap fertilitas pria dengan menggunakan model tikus jantan.
Salah satu produk olahan kedelai yang dapat digunakan sebagai ingredient
dalam bentuk kapsul atau tablet adalah tepung kedelai kaya isoflavon, mengandung kadar isoflavon sebesar 3%, dihasilkan dari biji kedelai tanpa proses kimia atau penambahan bahan tambahan pangan, serta mempunyai rasa dan aroma yang disukai (Indiana Soybean Board 1998). American Dietetic Association (ADA) menyatakan bahwa konsumsi pangan alami akan memberikan pengaruh positif bagi kesehatan apabila dikonsumsi secara teratur pada dosis yang efektif. Indiana Soybean Board (1998) menyarankan konsumsi isoflavon per hari sebesar 30-40 mg, sehingga 1-1.5 g tepung kedelai kaya isoflavon telah dapat memenuhi dosis yang direkomendasikan per hari. Sedangkan menurut Cassidy et al. (1994), konsentrasi isoflavon sebesar 50 mg per hari sudah cukup untuk memperoleh pengaruh klinis/biologis dalam tubuh. Hal ini sejalan dengan laporan beberapa peneliti sebelumnya bahwa konsentrasi isoflavon tersebut sesuai dengan konsumsi hasil olahan kedelai masyarakat Jepang dengan makanan tradisionalnya, dan merupakan angka di mana pengaruh endokrin pada wanita premenopause dapat diamati.
degenerasi epitel tubuli seminiferi dan menghentikan produksi spermatozoa (Regina & Traber 1999), menghambat spermatogenesis dan menyebabkan degenerasi sel germinal (Bensoussan et al. 1998). Vitamin E juga berperan sebagai antioksidan sehingga mampu melindungi spermatozoa terhadap kerusakan peroksidatif dan penurunan motilitas spermatozoa (Iwasaki & Gagnon 1992; Therond 1996; Hsu et al. 1998).
Sejauh ini, pengaruh isoflavon kedelai yang dikombinasikan dengan Zn dan vitamin E; serta pengaruh isoflavon yang terkandung dalam tepung kedelai kaya isoflavon pada berbagai tingkatan dosis secara in vivo terhadap fertilitas belum pernah dilaporkan. Oleh karena itu, untuk mengevaluasi pengaruhnya terhadap berbagai parameter yang diuji digunakan tikus jantan sebagai hewan model.
Tujuan Penelitian
Tujuan Umum
Penelitian ini bertujuan untuk mengevaluasi pengaruh pemberian kombinasi tepung kedelai kaya isoflavon, Zn dan vitamin E; serta mengevaluasi pengaruh tepung kedelai kaya isoflavon pada berbagai tingkatan dosis isoflavon terhadap fertilitas tikus jantan sebagai hewan model.
Tujuan Khusus
Tujuan khusus penelitian adalah untuk mengevaluasi pengaruh kombinasi tepung kedelai kaya isoflavon, Zn dan vitamin E; serta mengevaluasi pengaruh pemberian tepung kedelai kaya isoflavon pada berbagai tingkatan dosis isoflavon terhadap :
1. Kadar malonaldehida (MDA) testis
2. Aktivitas superoksida dismutase (SOD) testis
3. Profil antioksidan Cu,Zn-SOD secara imunohistokimia pada sel spermatogenik tubuli seminiferi testis
4. Berat relatif testis, motilitas spermatozoa, konsentrasi spermatozoa, butiran sitoplasma dan abnormalitas spermatozoa
5. Angka kebuntingan dan jumlah fetus pada tikus betina yang dikawinkan dengan tikus jantan perlakuan
6. Kadar hormon testosteron serum
Manfaat Penelitian
Memberikan informasi manfaat isoflavon untuk meningkatkan fertilitas tikus jantan.
Hipotesis
1. Kombinasi tepung kedelai kaya isoflavon, Zn dan vitamin E pada ransum tikus jantan memberikan pengaruh :
1. Meningkatkan berat relatif testis, motilitas spermatozoa, dan konsentrasi spermatozoa; meningkatkan kadar hormon testosteron serum; meningkatkan jumlah sel spermatogenik pada tubuli seminiferi testis; serta meningkatkan angka kebuntingan dan jumlah fetus pada tikus betina
2. Menurunkan abnormalitas spermatozoa dan kadar MDA testis 3. Mempertahankan aktivitas SOD testis tetap tinggi.
4. Memperbaiki profil Cu,Zn-SOD pada tubuli seminiferi testis.
2. Terdapat dosis optimum isoflavon yang terkandung dalam tepung kedelai kaya isoflavon yang memberikan pengaruh pada tikus jantan :
1. Meningkatkan berat relatif testis, motilitas spermatozoa, dan konsentrasi spermatozoa; meningkatkan kadar hormon testosteron serum; meningkatkan jumlah sel spermatogenik pada tubuli seminiferi testis; serta meningkatkan angka kebuntingan dan jumlah fetus pada tikus betina
2. Menurunkan abnormalitas spermatozoa, persentase butiran sitoplasma dan kadar MDA testis.
3. Mempertahankan aktivitas SOD testis tetap tinggi.
4. Memperbaiki profil Cu,Zn-SOD pada tubuli seminiferi testis.
Metode Penelitian
Penelitian terdiri dari tiga tahap sebagai berikut :
1. Pengurangan lemak pada tepung kedelai kaya isoflavon (TKI)
2. Pengaruh pemberian tepung kedelai kaya isoflavon, seng dan vitamin E terhadap fertilitas tikus jantan (Uji in vivo Tahap I)
METODE PENELITIAN KELUARAN
Gambar 1.1. Skema penelitian pendahuluan
METODE PENELITIAN KELUARAN
Gambar 1.2. Skema penelitian in vivo tahap I Pengurangan lemak pada
tepung kedelai kaya isoflavon / TKI
(ekstrak TKI dengan n-heksana)
TKI rendah lemak (TKI - RL) : Analisis kuantitatif senyawa isoflavon (HPLC)
Uji aktivitas antioksidan (DPPH)
TKI - RL :
digunakan sebagai bahan baku utama uji in vivo pada Tahap I dan Tahap II
Pengaruh pemberian tepung kedelai kaya isoflavon, seng (Zn) dan vitamin E terhadap fertilitas tikus jantan (In Vivo Tahap I)
Data IN VIVO TAHAP I : Kadar MDA testis Aktivitas SOD testis
Profil Cu,Zn-SOD pada tubuli seminiferi testis
Berat badan tikus jantan Konsumsi ransum tikus jantan Motilitas spermatozoa
Konsentrasi spermatozoa Abnormalitas spermatozoa Berat relatif testis
Angka kebuntingan dan jumlah fetus pada tikus betina Kadar hormon testosteron serum
METODE PENELITIAN KELUARAN
Gambar 1.3. Skema penelitian in vivo tahap II Pengaruh pemberian tepung
kedelai kaya isoflavon pada berbagai tingkatan dosis isoflavon terhadap fertilitas tikus jantan (In Vivo Tahap II)
DATA IN VIVO TAHAP II : Kadar MDA testis
Aktivitas SOD testis
Profil Cu,Zn-SOD pada tubuli seminiferi testis
Berat badan tikus jantan Konsumsi ransum tikus jantan Motilitas spermatozoa
Konsentrasi spermatozoa Abnormalitas spermatozoa Butiran sitoplasma
Berat relatif testis
Angka kebuntingan dan jumlah fetus pada tikus betina Kadar hormon testosteron serum
II. TINJAUAN PUSTAKA
Isoflavon Kedelai
Flavonoid adalah suatu golongan metabolit sekunder yang dihasilkan oleh tanaman. Isoflavon termasuk golongan flavonoid dan merupakan kelompok terbesar dalam golongan tersebut. Pada umumnya, senyawa isoflavon terdapat dalam kacang-kacangan atau leguminosa (Harborne 1992). Flavonoid dilaporkan Arora et al. (1998) dan Nijveldt et al. (2001) mempunyai kemampuan sebagai antioksidan dan mencegah terjadinya kerusakan akibat radikal bebas, melalui mekanisme flavonoid untuk bertindak sebagai penangkap radikal bebas secara langsung. Aktivitas antioksidan flavonoid ditentukan oleh jumlah dan posisi gugus hidroksil yang mampu mendonorkan ion hidrogen dan berperan untuk menetralkan radikal bebas (Toda & Shirataki 1999; Su et al. 2004), serta sebagai scavenger
radikal bebas yang terbentuk selama terjadi peroksidasi lipid (Arora et al. 1998; Amic et al. 2002).
Kemampuan menangkap radikal bebas dari senyawa flavonoid disebabkan oleh adanya keterlibatan gugus hidroksil bebas pada cincin B untuk mendonorkan atom H dan berperan sebagai scavenger radikal bebas, konjugasi ikatan rangkap pada C2-C3 dengan gugus 4-okso pada cincin C yang berperan untuk delokalisasi
elektron dan meningkatkan kapasitas scavenging radikal (Sugihara et al. 2001; Amic et al. 2002); gugus 3-hidroksil pada cincin C dan gugus 5-hidroksil pada cincin A yang terkonjugasi dengan gugus 4-okso pada cincin C (Pokorny et al. 2001). Flavonoid efektif sebagai scavenger radikal hidroksil dan radikal peroksil (Lee et al.
2004). Konfigurasi gugus hidroksil pada cincin B senyawa flavonoid dilaporkan berperan sebagai scavenger radikal bebas (Heim et al. 2002; Sugihara et al. 2001). Dikemukakan lebih lanjut bahwa gugus hidroksil pada cincin B dapat mendonorkan ion hidrogen dan mendonorkan sebuah elektron pada radikal hidroksil dan peroksil; menstabilkan radikal tersebut serta membentuk radikal flavonoid yang relatif lebih stabil. Tiga struktur penting senyawa isoflavon yang memiliki kemampuan sebagai antioksidan dan sebagai penangkap radikal bebas adalah struktur o-dihidroksil pada cincin B; konjugasi ikatan rangkap C2-C3 dengan gugus 4-okso pada cincin C; serta meta 5,7-dihidroksil pada cincin A (Saija
et al. 1995; Oteiza et al. 2005).
bentuk bebas yang dihasilkan oleh pelepasan glukosa dari glikosida. Proses degradasi glikosida menjadi aglikon seperti genistein, daidzein dan glisitein dikatalis oleh enzim glukosidase dalam usus halus (Matsuura & Obata 1993). Isoflavon dalam bentuk aglikon lebih mudah diserap oleh usus halus sebagai bagian dari misel yang dibentuk oleh empedu. Sirkulasi isoflavon dalam darah bersifat kompleks, karena sebagian larut lemak dan sebagian berikatan dengan protein dengan kekuatan yang lemah. Isoflavon kemungkinan didistribusikan melalui darah ke hati, atau didaur ulang sebagai bagian dari cairan empedu dan sirkulasi enterohepatik. Ekskresi akhir isoflavon terjadi pada feses dan urin (Schmidl & Labuza 2000).
Daidzein dapat diubah menjadi equol oleh bakteri intestinal. Ueno et al.
(2001) diacu dalam Setchell et al. (2002) mengidentifikasi bakteri pada feses manusia dewasa Jepang yang sehat setelah mengkonsumsi 70 g tofu. Tiga strain bakteri yang dilaporkan mampu mengkonversi daidzein menjadi equol secara in vitro adalah bakteri gram positif strain Streptococcus intermedius spp. dan
Ruminococcus productus spp., serta bakteri gram negatif Bacteroides ovatus spp. Equol dilaporkan mempunyai aktivitas estrogenik lebih tinggi dibandingkan komponen isoflavon yang lain, dan memiliki afinitas yang tinggi terhadap reseptor estrogen. Sekali terbentuk, equal relatif stabil dan akan dimetabolisme melalui sistem enzim fase II yaitu glukoronidasi melalui konjugasi dengan asam glukoronat. Terdapat variasi yang besar antar individu terhadap kemampuan individu untuk memproduksi equol. Dilaporkan bahwa sekitar 30 – 50% manusia dewasa tidak mampu mengekskresi equol dalam urin ketika konsumsi harian produk pangan berbasis kedelai ditingkatkan. Hal ini menunjukkan bahwa populasi dewasa tersebut tidak mampu mengkonversi daidzein menjadi equol. Fenomena ini menyebabkan ada dua terminologi untuk menggambarkan perbedaan ke dua populasi tersebut yaitu, mampu memproduksi equol (equol producers) dan tidak mampu memproduksi equol (non-equol producers) (Setchell et al. 2002).
menyatakan bahwa equol tidak ditemukan dalam plasma bayi yang diberi susu formula berbasis kedelai, sehingga diduga bahwa bakteri yang bertanggung jawab terhadap produksi equol tidak berkembang pada awal-awal kehidupan bayi.
Aktivitas Senyawa Isoflavon pada Hewan Jantan dan Pria
Isoflavon sering disebut sebagai fitoestrogen atau estrogen nabati karena mempunyai struktur hampir sama dengan estrogen, dan memiliki kemampuan untuk berikatan dengan reseptor estrogen. Reseptor estrogen berikatan secara tepat dengan estrogen untuk mengawali respon pada jaringan reproduksi dan jaringan lainnya (Schmidl & Labuza 2000). Sel epitel dari jaringan reproduksi seperti kelenjar susu, ovari dan testis merupakan subyek dari aksi isoflavon (Anderson & Graner 2000).
Pengaruh senyawa isoflavon kedelai dalam bentuk isolat isoflavon murni terhadap kesuburan mencit jantan dilaporkan oleh Martin (1983). Hasil yang diperoleh memperlihatkan bahwa pemberian genistein pada konsentrasi 9 mg/ekor/hari menunjukkan kecenderungan atropi testis pada mencit. Pada tikus jantan di mana konsentrasi estradiol dalam darahnya lebih rendah dibandingkan tikus betina, paparan estrogen eksogen mungkin akan menyebabkan gangguan. Safe (2000) melaporkan bahwa gangguan akibat senyawa estrogen pada jantan meliputi penurunan konsentrasi testosteron, mengganggu perkembangan testis dan saluran reproduksi serta perubahan terhadap proses spermatogenesis dan fertilitas. Studi yang telah dilakukan oleh Atanasssova et al. (2000) memperlihatkan terjadinya perubahan terhadap morfologi testis dan proses spermatogenesis setelah tikus diberi genistein (isolat isoflavon murni) melalui injeksi pada dosis 4 mg/kg berat badan/hari. Fritz et al. (2002) dan Fritz et al. (2003) mengungkapkan bahwa pemberian genistein mulai umur sapih sampai masa puber pada tikus meningkatkan konsentrasi testosteron dan menurunkan aktivitas aromatase testis tikus. Hasil-hasil penelitian yang telah dilakukan tersebut menunjukkan adanya pengaruh negatif yang ditimbulkan oleh senyawa isoflavon pada konsentrasi tertentu terhadap fertilitas.
konsentrasi spermatozoa dan berat testis yang lebih tinggi pada tikus jantan yang mendapat ransum tepung tempe dan tepung kedelai sebagai sumber proteinnya dibandingkan kontrol yang mendapat sumber protein kasein. Pada studi tersebut, dengan memperhitungkan jumlah tepung kedelai dan tepung tempe dalam ransum yang dikonsumsi tikus jantan, kandungan isoflavon dalam ransum tepung kedelai sebesar 0.79 ± 0.05 mg/ekor/hari, sedangkan pada ransum tepung tempe sebesar
2.77 ± 0.19 mg/ekor/hari.
Percobaan pemberian isolat protein kedelai terhadap primata jantan berumur 1.3-4.1 tahun juga telah dilakukan oleh Anthony et al. (1996). Dilaporkan bahwa pemberian isolat protein kedelai dalam pakan selama 6 bulan pada jumlah yang sama (200 g/kg diet) tetapi dengan dosis isoflavon yang berbeda tidak menimbulkan pengaruh negatif terhadap sistem reproduksi melalui pengamatan terhadap konsentrasi hormon testosteron dan berat organ reproduksi.
Di samping itu, studi pengaruh isoflavon terhadap kualitas spermatozoa dan hormon steroid pada pria telah dilaporkan oleh Habito et al. (2000); Mitchell et al.
(2001); dan Nagata et al. (2001). Habito et al. (2000) menyatakan bahwa konsentrasi estradiol, testosteron, dan dihidrotestosteron tidak berbeda pada pria dengan umur 35-62 tahun yang mengkonsumsi dua produk olahan kedelai dengan kandungan isoflavon 70 mg/hari selama 1 bulan. Mitchell et al. (2001) melaporkan bahwa tidak ada pengaruh pada testis terhadap volume ejakulat, konsentrasi dan motilitas spermatozoa, serta perubahan terhadap konsentrasi estradiol, testosteron, FSH dan LH pria muda umur 18-35 th yang mengkonsumsi isoflavon kedelai 40 mg/hari selama 2 bulan. Nagata et al. (2001) juga menyatakan bahwa tidak terdapat perubahan pada konsentrasi estradiol dan testosteron pada pria dengan umur rata-rata 32,4 tahun yang mengkonsumsi susu kedelai (mengandung 48 mg isoflavon) selama 2 bulan.
Estrogen pada Hewan Jantan
Menurut Kuiper et al. (1997), estrogen dilaporkan mempengaruhi
membentuk sel khusus. Awalnya, hanya satu jenis RE yang dikenal yaitu REα,
namun akhirnya ditemukan jenis lain yaitu REβ (Kuiper et al. 1996).
Terdapat perbedaan distribusi jaringan dan affinitas ligand binding dari REα
dan REβ, sehingga menjelaskan aksi selektif dari estrogen pada jaringan yang
berbeda. Hasil pengamatan Kuiper et al. (1997) terhadap distribusi REα dan REβ
menunjukkan bahwa ekspresi REβ tertinggi ditemukan pada ovari dan prostat,
ekspresi REβ moderat pada testis, uterus, kandung kemih, dan paru-paru,
sedangkan ekspresi REβ terendah pada kelenjar pituitari, epididimis, timus, dan
otak. Hasil pengamatan terhadap ekspresi REα tertinggi terlihat pada epididimis,
testis, kelenjar pituitari, uterus, ginjal dan adrenal, dimana ekspresi REβ memperlihatkan ekspresi moderat atau tidak terlihat.
Dalam aliran darah sebagian estrogen berikatan dengan protein SHBG (Sex Hormone Binding Globulin), sedangkan estrogen dalam plasma yang bebas hanya 2%. Estrogen dalam bentuk bebas (tidak terikat) mampu menembus sel dan aktif secara biologis. Estrogen merupakan senyawa steroid yang mampu mengubah aktifitas biologis sel melalui pengikatannya dengan reseptor estrogen yang sebagian terdapat dalam membran plasma dan inti sel. Potensi estrogen sangat bergantung pada afinitasnya terhadap reseptor estrogen, lamanya berikatan dengan reseptor dan banyaknya hormon bebas yang dapat menembus membran sel. Estrogen sangat larut dalam lemak, oleh sebab itu mudah menembus membran sel, selanjutnya berikatan dengan RE yang sebagian terdapat dalam membran plasma membentuk kompleks ligand-reseptor. Kompleks ligand-reseptor kemudian berdifusi masuk ke dalam inti sel dan berikatan dengan DNA. Ikatan ligand-reseptor-DNA kemudian mengawali transkripsi gen mRNA, selanjutnya mensintesis protein spesifik yang mempunyai pengaruh fisiologis pada jaringan target (Ruggiero et al. 2002).
ketika kadar estrogen tinggi, sebaliknya isoflavon bersifat agonis ketika kadar estrogen rendah.
Biosintesis estrogen dikatalis oleh sitokrom P450 aromatase. Walaupun estrogen diproduksi dalam jumlah kecil pada testis, namun estrogen dilaporkan berperan penting pada sistem reproduksi jantan (Revelli et al. 1998) dan spermatozoa (Luconi et al. 2001). Konsentrasi estrogen dalam aliran darah pada jantan umumnya rendah dengan kisaran 2-180 pg/ml, tergantung masing-masing spesies. Estrogen juga ditemukan dalam semen dan tergantung spesies, dengan konsentrasi estrogen berkisar antara 14-900 pg/ml (Hess 2003). Ekspressi RE-ß ditemukan pada sel benih (Hess 2003), serta sel Leydig dan sel Sertoli (Sharpe 1998; Carreau et al. 1999).
Aktivitas aromatase, yaitu enzim yang mengkonversi androgen menjadi estrogen pada rodensia ditemukan dalam sel Sertoli (O’Donnell et al. 2001), serta sel Leydig dan sel germinal, yaitu di daerah badan Golgi pada spermatid awal dan pada flagella spermatid akhir (Nitta et al. 1993). Lebih lanjut Nitta et al. (1993) melaporkan bahwa penghambatan aktivitas aromatase menurunkan pematangan spermatid pada tubuli seminiferi testis tikus, sehingga diduga bahwa estrogen berperan penting dalam mengontrol spermatogenesis. Robertson et al. (1999)
diacu dalam Adeoya-Osiguwa et al. (2003) menyatakan bahwa defisiensi
aromatase pada mencit menyebabkan tertahannya proses awal spermiogenesis.
Mineral Seng (Zn)
Seng (Zn) terdapat dalam jaringan manusia/hewan dan diperlukan untuk aktivitas lebih dari 90 macam enzim yang ada hubungannya dengan proses metabolisme karbohidrat dan energi, degradasi dan sintesis protein, sintesis asam nukleat, biosintesis heme, transpor CO2 dan reaksi-reaksi lain. Beberapa enzim
yang membutuhkan Zn sebagai kofaktor adalah karbonik anhidrase, alkohol dehidrogenase, karboksipeptidase, glutamat dehidrogenase, laktat dehidrogenase, Cu,Zn-superoksida dismutase dan alkalin fosfatase. Karena Zn berperan dalam reaksi-reaksi yang luas, kekurangan Zn akan berpengaruh banyak terhadap jaringan tubuh terutama pada saat pertumbuhan (Linder 2006).
dismutase (Cu,Zn-SOD) yang merupakan garis pertahanan pertama terhadap aktivasi senyawa spesies oksigen reaktif (reactive oxygen species, ROS) melalui dismutasi radikal anion superoksida. Klotz et al. (2003) menyatakan bahwa Cu dan Zn secara bersama-sama terlibat sebagai sistem pertahanan antioksidan dalam sitosol terhadap aksi oksidan. Berdasarkan aksi Zn tersebut, defisiensi Zn diduga dapat meningkatkan terjadinya kerusakan oksidatif pada jaringan. Defisiensi Zn dilaporkan juga mampu meningkatkan peroksidasi lipid pada mikrosom hati yang diukur melalui peningkatan produksi malonaldehida (Taylor et al. 1988).
Pengaruh Zn yang paling nyata adalah dalam metabolisme, fungsi dan pemeliharaan kulit, pankreas dan organ-organ reproduksi pria (Linder 2006). Selain ketersediaan ion an organik Cu dan Mn, Zn merupakan faktor eksogen dari nutrisi yang dilaporkan mempengaruhi motilitas spermatozoa (Hafez & Hafez 2000). Kualitas spermatozoa dihubungkan dengan motilitas serta tergantung pada ketersediaan Zn. Bukti temuan beberapa kasus infertilitas pada pria memperlihatkan bahwa suplementasi Zn mampu menekan kasus ini (Chesters 1997). Suplementasi Zn secara oral dilaporkan mampu meningkatkan motilitas spermatozoa pasien astenozoospermia atau oligozoospermia (Hunt et al. 1992). Terjadinya peningkatan jumlah spermatozoa dan motilitas dilaporkan sebagai akibat suplementasi Zn secara oral pada pasien infertil (Oteiza et al. 1995).
Spermatozoa membutuhkan Zn dari seminal plasma selama terjadi ejakulasi (Chesters 1997). Sekresi semen merupakan salah satu sumber kehilangan Zn, di mana ejakulasi semen mengandung sampai 1 mg Zn (Shils et al. 1994). Menurut Vernet et al. (2001), Zn merupakan salah satu unsur utama dalam seminal plasma dan spermatozoa. Dilaporkan bahwa ejakulat spermatozoa tikus mengandung sekitar 1.055µg Zn/satu juta sel.
Menurut Prasad (1991), defisiensi Zn mengakibatkan selera makan menurun, pertumbuhan terhambat, konsumsi pangan menurun, kelainan pada kulit, serta menurunnya status kesehatan dan sistem kekebalan tubuh. Defisiensi Zn juga akan mempengaruhi produksi dan sekresi testosteron, insulin dan kortikosteroid (Corah 1996); hipogonadisme, menurunnya konversi testosteron ke DHT, serta terhambatnya kematangan seksual (dewasa kelamin) pada pria (Prasad 1991; Oteiza et al. 1995).
mengakibatkan hipogonadisme, yaitu suatu respon terhadap defisiensi Zn yang ditunjukkan dengan menurunnya konsentrasi testosteron pada serum; serta berkontribusi terhadap disfungsi organ reproduksi pejantan seperti terjadinya infertilitas.
Kegagalan fungsi testis akibat defisiensi Zn dalam jangka waktu yang lama dilaporkan terjadi pada manusia, rodensia, babi dan ruminansia (Chesters 1997). Menurut Taneja et al. (1995), perubahan patologis akibat defisiensi Zn pada mamalia akan mengakibatkan testis mengecil, menghambat perkembangan spermatozoa dan penipisan sel Leydig yang memproduksi hormon testosteron. Sintesis testosteron oleh sel Leydig dihubungkan dengan kecukupan Zn dalam diet pria dewasa (Prasad 1991). Prasad et al. (1967) diacu dalam Halsted et al. (1974) melaporkan bahwa konsentrasi Zn dalam jaringan testis tikus yang mendapat ransum normal sebesar 176 mg/kg (bk), sedangkan tikus yang mendapat ransum defisien Zn sebesar 132 mg/kg (bk). Defisiensi Zn pada tikus jantan dilaporkan Rogers (1979) berpengaruh terhadap gagalnya fungsi reproduksi, atropi testis dan hipoplasia prostat. Perubahan degeneratif ini berkorelasi dengan metabolisme asam nukleat dan kelainan hormonal termasuk testosteron (Taneja et al. 1995).
Defisiensi Zn dilaporkan mengganggu perkembangan testis dan menghentikan proses spermatogenesis. Hal ini dihubungkan dengan penyusutan tubuli seminiferi dan reduksi sel Leydig (Chesters 1997). Menurut Shils et al. (1994), defisiensi Zn menyebabkan reduksi ukuran testis dan atropi pada epitel seminiferi. Akibat disfungsi testis tersebut akan menganggu proses spermatogenesis dan produksi testosteron. Kerusakan utama yang mendasari disfungsi testis diduga merupakan gangguan sel Leydig (Hunt et al. 1992).
Zn adalah mikromineral yang relatif kurang beracun (non toksik) di antara mineral lain (Halsted et al. 1974; Chesters 1997). Tidak ada pengaruh negatif yang pernah ditemukan setelah seseorang berminggu-minggu mengkonsumsi lebih dari 10 kali anjuran kecukupan gizi. Namun, konsumsi tablet ZnSO4 atau suplemen Zn
lain dapat menyebabkan rasa tidak enak bila dikonsumsi tidak bersamaan dengan waktu makan. Defisiensi Zn dapat terjadi karena kurangnya konsumsi atau dayaguna yang rendah, penyerapan yang kurang baik atau tingkat pengeluaran dari tubuh yang meningkat (Linder 2006).
fitat. Namun, pertumbuhan maksimal akan dicapai pada intake Zn sekitar 10 sampai 20 mg/kg diet. Kandungan Zn terendah ditemukan pada kulit, sedangkan kandungan tertinggi terdapat pada testis (Rogers 1979). Konsentrasi Zn dalam ransum hewan sebesar 20 mg/kg diet memperlihatkan kecukupan Zn untuk diabsorbsi (Chesters 1997).
Taneja et al. (1995) melakukan suplementasi Zn sulfat pada konsentrasi 20 μg ZnSO4.7H2O/g diet dalam ransum rendah lemak dan tinggi lemak untuk melihat
pengaruhnya terhadap testis mencit. Ae-son & Chung (1996) melakukan suplementasi Zn sulfat sebesar 22 mg/kg diet dalam ransum kontrol tikus jantan, serta ransum yang defisien Zn untuk mengetahui metabolisme steroid, serta reseptor androgen dan estrogen pada hati tikus. Suplementasi Zn sulfat pada
konsentrasi 25 μg ZnSO4.7H2O/g diet dalam ransum tikus yang diberikan secara ad
libitum, serta ransum yang defisien Zn dengan konsentrasi Zn sebesar 0.5 μg ZnSO4.7H2O/g diet juga telah dilakukan oleh Oteiza et al. (1995) untuk melihat
pengaruh Zn terhadap kerusakan oksidatif pada protein, lipid dan DNA testis tikus. Kynaston et al. (1988) diacu dalam Arsyad (2001) melaporkan adanya perubahan yang bermakna terhadap motilitas spermatozoa pasien dengan asthenozoospermia dan/atau oligozoospermia setelah pemberian Zn sulfat 2x220 mg/hari selama 3 bulan.
Vitamin E
Menurut Landvik et al. (2002), α-tokoferol memiliki aktivitas biologis paling tinggi dan paling efektif dari komponen vitamin E karena melindungi asam lemak tidak jenuh dalam membran sel yang berperan penting terhadap fungsi dan struktur
Fungsi vitamin E yang utama adalah sebagai antioksidan di dalam tubuh, di mana vitamin E dapat bertindak sebagai penangkap radikal bebas dalam membran. Vitamin E mempunyai kemampuan melindungi asam lemak tidak jenuh ganda dengan cara mencegah terjadinya reaksi oleh radikal bebas yang menyebabkan kerusakan membran dalam organel subseluler (Shils et al. 1994) atau merusak struktur dan fungsi membran sel (Landvik et al. 2002). Sebagai antioksidan pemutus rantai utama dalam jaringan tubuh, vitamin E merupakan garis pertahanan pertama terhadap peroksidasi lipid dan melindungi membran sel pada tahap awal dari serangan radikal bebas (Landvik et al. 2002). Peran biologik utama vitamin E adalah memutuskan rantai proses peroksidasi lipid dengan menyumbangkan satu atom hidrogen dari gugus OH pada cincinnya ke radikal bebas, sehingga terbentuk radikal vitamin E yang stabil dan tidak merusak (Almatsier 2002).
Menurut Mayes (1995), vitamin E tampaknya merupakan baris pertama pertahanan terhadap proses peroksidasi asam-asam lemak tidak jenuh ganda yang terdapat dalam fosfolipid membran seluler dan subseluler. Tokoferol bertindak sebagai antioksidan dengan memutuskan berbagai reaksi rantai radikal bebas sebagai akibat kemampuannya untuk memindahkan hidrogen fenolat kepada radikal bebas peroksil dari asam lemak tak jenuh ganda yang telah mengalami peroksidasi. Radikal bebas fenoksi yang terbentuk kemudian bereaksi dengan radikal bebas peroksil selanjutnya.
Kekurangan vitamin E pada tikus dilaporkan menyebabkan gangguan reproduksi, yaitu degenerasi ovarium pada tikus betina dan penghambatan spermatogenesis pada tikus jantan, sehingga vitamin E disebut sebagai vitamin antisterilitas (Schunack et al. 1990). Linder (2006) menyatakan bahwa vitamin E dibutuhkan dalam produksi spermatozoa. Defisiensi vitamin E pada monyet, kelinci dan tikus dilaporkan menyebabkan degenerasi epitel tubuli seminiferi sehingga produksi spermatozoa berhenti (Machlin 1991; Regina & Traber 1999), serta menghambat spermatogenesis dan menyebabkan degenerasi sel germinal (Bensoussan et al. 1998).
Menurut Therond (1996), persentase motilitas spermatozoa secara
terhadap spermatozoa dari kerusakan peroksidatif dan penurunan motilitas (Iwasaki & Gagnon 1992; Kessopoulou et al. 1995; Taylor 2001). Pada pasien astenospermia, pemberian vitamin E secara oral secara signifikan menurunkan konsentrasi MDA dalam spermatozoa dan meningkatkan motilitas spermatozoa (Suleiman et al. 1996). Studi secara in vitro memperlihatkan bahwa suplementasi vitamin E mampu menetralisir penurunan motilitas yang disebabkan oleh spermatozoa yang tidak sempurna, serta mampu meningkatkan fusi spermatozoa dengan oosit (Taylor 2001). Hasil-hasil penelitian yang telah dilakukan tersebut memperkuat dugaan bahwa vitamin E melindungi membran terhadap senyawa spesies oksigen reaktif dan peroksidasi lipid.
Kebutuhan vitamin E dalam ransum tikus/hari sebesar 30 IU/kg ransum Satuan internasional unit (IU) setara dengan 1 mg α-tokoferol asetat yang digunakan untuk pengukuran aktivitas biologis dari vitamin E (Machlin 1991). Corwin dan Gordon (1982) melaporkan bahwa pemberian vitamin E sebesar 5 mg/100 g ransum dapat meningkatkan respon imun limfosit terhadap mitogen sebanyak 2.5 kali, sedangkan pada pemberian 50 mg/100 g ransum terjadi peningkatan sebanyak 8 kali. Huang & Fwu (1993) melakukan pemberian vitamin E sebesar 50 mg/kg ransum dengan kadar protein ransum bervariasi, yaitu sebesar 6 %, 8 %, 12 % dan 20 %. Defisiensi protein dalam ransum akan menurunkan aktivitas gluthation peroksidase dan superoksida dismutase hati dan sel darah merah tikus, serta meningkatkan kadar peroksidasi lipid hati, limpa, jantung, ginjal, dan paru-paru tikus.
Radikal Bebas dan Sistem Pertahanan Tubuh
Pada keadaan normal, secara fisiologis sel memproduksi radikal bebas sebagai konsekuensi logis pada reaksi biokimia dalam kehidupan aerobik. Organisme aerobik memerlukan oksigen untuk menghasilkan ATP, yaitu suatu senyawa yang merupakan sumber energi bagi makhluk hidup melalui fosforilasi oksidatif yang terjadi dalam mitokondria. Pada proses tersebut terjadi reduksi O2
menjadi H2O yang memerlukan pengalihan 4 elektron. Namun, dalam keadaan
sebagai respon normal dari rantai peristiwa biokimia dalam tubuh, dalam sel (intrasel) maupun ekstrasel, dan (2) secara eksogen, radikal bebas didapat dari polutan lingkungan, asap rokok, obat-obatan, dan radiasi ionisasi atau sinar ultra violet (Supari 1996; Langseth 2000).
Radikal bebas adalah sebuah atom atau molekul yang mempunyai satu atau lebih elektron tidak berpasangan pada orbital terluarnya (Clarkson & Thompson 2000). Radikal bebas bersifat tidak stabil dan mempunyai reaktivitas yang tinggi, sehingga dapat merebut elektron dari molekul lain dalam upaya mendapatkan pasangan elektronnya. Molekul yang kehilangan elektron ini dapat bersifat reaktif, terutama asam lemak tidak jenuh yang kemudian ditransformasikan menjadi radikal bebas yang sangat reaktif (Nabet 1996). Jika radikal bebas tidak diinaktivasi, reaktivitas radikal bebas ini dapat menimbulkan perubahan kimiawi dan merusak seluruh tipe makromolekul seluler seperti karbohidrat, protein, lipid, dan asam nukleat (Langseth 2000). Di samping radikal bebas (free radical), dikenal juga istilah reactive oxygen species (ROS), yaitu molekul yang bukan hanya merupakan radikal oksigen, tetapi juga beberapa turunan oksigen yang non radikal (Halliwell & Gutteridge 1999). Radikal bebas dan senyawa ROS dalam tubuh dapat menyebabkan oksidasi lipid, oksidasi protein, DNA strand break, modifikasi basa DNA, dan modulasi ekspresi genetik (Lee et al. 2004). Beberapa senyawa ROS yang penting dalam kehidupan makhluk hidup adalah : yang tergolong radikal bebas seper