UIN SYARIF HIDAYATULLAH JAKARTA
MODIFIKASI STRUKTUR SENYAWA ETIL
P-METOKSISINAMAT MELALUI PROSES
NITRASI-ESTERIFIKASI DENGAN 1-BUTANOL SERTA UJI
AKTIVITAS SEBAGAI ANTIINFLAMASI
SKRIPSI
INDAH NUNIK NUGRAINI 1111102000101
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
MODIFIKASI STRUKTUR SENYAWA ETIL
P-METOKSISINAMAT MELALUI PROSES
NITRASI-ESTERIFIKASI DENGAN 1-BUTANOL SERTA UJI
AKTIVITAS SEBAGAI ANTIINFLAMASI
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
INDAH NUNIK NUGRAINI 1111102000101
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
✁
Nama : Indah Nunik Nugraini
Program Studi : Strata-1-Farmasi
Judul : Modifikasi Struktur Senyawa Etil P-metoksisinamat Melalui Proses Nitrasi-Esterifikasi dengan 1-Butanol Serta Uji Aktivitas Sebagai Antiinflamasi
Etil p-metoksisinamat (EPMS) merupakan salah satu metabolit sekunder yang terdapat pada tanaman kencur (Kaempferia galanga Linn) dalam jumlah yang relatif besar dan memiliki aktivitas sebagai antiinflamasi. Penelitian ini bertujuan untuk melakukan modifikasi struktur senyawa etil p-metoksisinamat dan melihat pengaruh hasil modifikasi terhadap aktivitas antiinflamasinya. Modifikasi senyawa etil p-metoksisinamat (EPMS) melalui proses nitrasi-esterifikasi dengan 1-butanol telah dilakukan untuk mengeksplorasi lebih jauh hubungan struktur aktivitas senyawa turunan EPMS terhadap antiinflamasi. Sebelum dimodifikasi, EPMS terlebih dahulu diubah menjadi asam p-metoksisinamat (APMS) melalui reaksi hidrolisis. Modifikasi senyawa APMS dilakukan secara dua tahap, pertama melalui reaksi nitrasi dengan asam nitrat 65 % untuk memasukkan gugus NO2 pada cincin benzen dan yang kedua melalui reaksi esterifikasi dengan 1-butanol untuk mensubstitusi gugus karboksilat dengan 4 rantai karbon sehingga menghasilkan senyawa butil 4-metoksi 6-nitrosinamat dengan rendemen 10,7241 %. Berdasarkan uji aktivitas antiinflamasi yang dilakukan dengan menggunakan metode inhibisi denaturasi protein BSA didapatkan bahwa senyawa butil 4-metoksi 6-nitrosinamat aktif sebagai agen antiinflamasi pada konsentrasi 0,1-10 ppm, namun aktivitas antiinflamasinya tidak lebih tinggi dari pada etil p-metoksisinamat. Sementara, senyawa APMS tidak memiliki aktivitas antiinflamasi. Dengan demikian, hubungan struktur aktivitas antiinflamasi terhadap senyawa hasil modifikasi menunjukkan bahwa gugus ester pada turunan senyawa EPMS memiliki peran penting terhadap aktivitas antiinflamasi.
✁
Name : Indah Nunik Nugraini
Programme Study : Strata-1-Pharmacy
Title : Modification of Ethyl P-methoxycinnamate Compound Through Nitration-Esterification Process with 1-Butanol and Antiinflammatory Activity Test
Ethyl p-metoxycinnamate (EPMC) is one of secondary metabolite which is found in kencur (Kaempferia galanga Linn) in relatively large quantity and has antiinflammatory activity. The aims of this study were to modify ethyl p -metoxycinnamate acid structure and determine the modification effect toward its antiinflammatory activity. Modification of ethyl p-methoxycinnamate compound through nitration-esterification process with 1-Butanol had been done to explore structure activity relationship against the antiinflammatory. Before being modified, EPMC was converted to be p-metoxycinnamate acid (PMCA) by hidrolysis reaction. In this research, there are two processes of reaction to modify PMCA. First, nitration of PMCA with nitric acid 65 % to subtitute NO2 group in benzene ring, and the second is esterification with 1-butanol to subtitute carboxylate group with esther 4 carbon chain produces butyl 4-methoxy 6-nitrocinnamate compound in 10,7241 % yield. Based on antiinflammatory activity assays using inhibition of bovine serum albumine (BSA) denaturation method found that butyl 4-methoxy 6-nitrocinnamate was active as an inflammatory agent, however its anti-inflammatory activity was not higher than ethyl p-metoxycinnamate. While, the p -metoxycinnamate acid compound did not have anti-inflammatory activity. Thus, the relationship of anti-inflammatory activity toward modified compound indicates that the ester group in EPMC derivatives have an important role in anti-inflammatory activity.
✁
Segala puji dan syukur kehadirat Allah SWT yang senantiasa mencurahkan segala rahmat-Nya kepada kita semua, khususnya penulis dalam menyelesaikan skripsi yang berjudul “Modifikasi Struktur Senyawa Etil p-Metoksisinamat Melalui Proses Nitrasi-Esterifikasi Dengan 1-Butanol Serta Uji Aktivitas Sebagai Antiinflamasi”. Penulisan skripsi ini dilakukan dalam
rangka memenuhi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Dalam penulisan skripsi ini tentu banyak berbagai kesulitan dan halangan yang menyertai, sehingga penulis tidak terlepas dari doa, bantuan, dan bimbingan berbagai pihak. Oleh karena itu, saya mengucapkan terima kasih kepada:
1. Ibu Ismiarni Komala, M.Sc., Ph.D., Apt. sebagai Pembimbing I sekaligus Dosen Pembimbing Akademik yang telah memberikan ilmu, nasehat, waktu, tenaga, dan dukungan moral maupun material selama masa perkuliahan, penelitian, hingga penulisan skripsi.
2. Ibu Ofa Suzanti Betha, M.Si., Apt. sebagai Pembimbing II yang telah membimbing dan memberikan masukan terhadap proses penulisan skripsi. 3. Bapak Dr. H Arif Sumantri, SKM., M.Kes. selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
4. Bapak Yardi, Ph.D., Apt. atas dedikasi dan profesionalitas beliau sebagai ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
5. Bapak dan Ibu staf pengajar, serta karyawan yang telah memberikan bimbingan dan bantuan selama menempuh pendidikan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
✂
7. Kakak Sigit Sulistyawan yang selalu memberikan semangat dan Adik Adji Setia Negara yang selalu tersenyum memberikan keceriaan dan semangat untuk meraih cita.
8. Kakak-kakak dan teman-teman seperjuangan di Laboratorium PHA, Kingdom EPMS: Kak Ivo, Kak Fikri, Nova, Indri, Ali, Aziz, Reza, Sutar, Mida, Aditya, dan Bahtiar atas bantuan dan dukungan yang telah diberikan. 9. Teman-teman di Program Studi Farmasi 2011: Nindya, Elsa, Puji, Subhan,
Andis, Annisa, Aditya, Fitri, Beryl serta teman-teman Farmasi 2011 beng-beng atas semangat dan kebersamaan kita selama perkuliahan berlangsung. 10.Teman-teman BEM FKIK 2012-2014 dan FUN (FKIK Untuk Negeri)
sebagai keluarga kecil yang selalu memberikan doa dan semangat kebersamaan selama masa kuliah.
11.Arif Setiyawan yang selalu hadir memberi semangat dan dukungan tanpa henti, yang selalu menemani suka duka, yang selalu memotivasi dan menginspirasi.
12.Semua pihak yang telah membantu penulis selama melakukan penelitian dan penulisan.
Semoga semua bantuan yang telah diberikan mendapatkan balasan dari Allah SWT. Penulis menyadari bahwa penulisan skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, kritik dan saran yang bersifat membangun akan penulis nantikan. Semoga skripsi ini dapat bermanfaat bagi pengembangan ilmu pengetahuan.
✂
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini :
Nama : Indah Nunik Nugraini
NIM : 1111102000101
Program Studi : Strata-1 Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan Jenis Karya : Skripsi
demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
MODIFIKASI STRUKTUR SENYAWA ETIL P-METOKSISINAMAT MELALUI PROSES NITRASI-ESTERIFIKASI DENGAN 1-BUTANOL
SERTA UJI AKTIVITAS SEBAGAI ANTIINFLAMASI
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta. Demikian pernyataan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Jakarta Pada tanggal : 30 Juni 2015
Yang menyatakan,
✂
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
LEMBAR PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
KATA PENGANTAR ... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS ... x
DAFTAR ISI ... iii
1.3Tujuan Penelitian ... 4
1.4Manfaat Penelitian ... 4
1.5Hipotesis ... 5
2.2.1 Isolasi Senyawa Etil p-Metoksisinamat ... 10
2.3 Hidrolisis ... 11
2.4 Nitrasi ... 14
2.5 Esterifikasi ... 16
2.6 Spesifikasi Asam Nitrat dan Etanolamin ...18
2.6.1 Asam Nitrat ... 18
2.6.2 1-Butanol ... 18
2.7 Gelombang Mikro ... 19
2.7.1 Prinsip Umum ... 19
2.7.2 Mekanisme Pemanasan ... 19
2.7.3 Instrumentasi Oven Gelombang Mikro ... 20
2.8 Identifikasi ... 21
2.8.1 Kromatografi ... 21
a. Kromatografi Lapis Tipis ... 21
b. Kromatografi Kolom ... 23
2.8.2 Spektrofotometri ... 24
✂
2.9.1 Definisi Inflamasi ... 28
2.9.2 Mekanisme Inflamasi ... 29
2.9.3 Obat-Obat Antiinflamasi ... 30
a. Antiinflamasi Steroid ... 30
b. Antiinflamasi Non Steroid ... 30
2.9.4 Natrium Diklofenak ... 31
2.10 Uji Antiinflamasi ... 31
2.10.1 Bovine Serum Albumin (BSA) ... 32
BAB 3 METODOLOGI PENELITIAN ... 34
3.1 Tempat dan Waktu ... 34
3.3 Prosedur Penelitian ... 35
3.3.1 Modifikasi Etil p-metoksisinamat ... 35
a. Hidrolisis Etil p-metoksisinamat ... 35
b. Nitrasi Asam p-metoksisinamat ... 35
c. Esterifikasi Senyawa Hasil Reaksi Nitrasi ... 36
3.3.2 Pemurnian dengan Kromatografi Kolom ... 36
3.3.3 Identifikasi Senyawa ... 36
a. Identifikasi Organoleptis ... 36
b. Pengukuran Titik Leleh ... 36
c. Identifikasi senyawa menggunakan FTIR ... 37
d. Identifikasi senyawa menggunakan GCMS ... 37
e. Identifikasi senyawa menggunakan H1-NMR dan C13 -NMR ... 37
3.3.4 Uji In Vitro Antiinflamasi ... 37
a. Pembuatan Reagen untuk Uji Antiinflamasi ... 37
b. Pengujian Aktivitas Senyawa Hasil Modifikasi Terhadap Denaturasi BSA ... 39
BAB 4 HASIL DAN PEMBAHASAN ... 41
4.1 Modifikasi Struktur Asam p-metoksisinamat ... 41
4.1.1 Reaksi Hidrolisis Etil p-metoksisinamat ... 42
4.1.2 Reaksi Nitrasi Asam p-metoksisinamat ... 45
4.1.3 Reaksi Esterifikasi Senyawa Hasil Nitrasi ... 46
4.2 Identifikasi Senyawa Hasil Modifikasi... 49
4.2.1 Senyawa Hasil Hidrolisis Etil p-metoksisinamat ... 50
4.2.2 Hasil Nitrasi APMS ... 52
4.2.3 Senyawa Hasil Esterifikasi (Senyawa B) ... 53
✂
5.2 Saran ... 63
✂ ✁
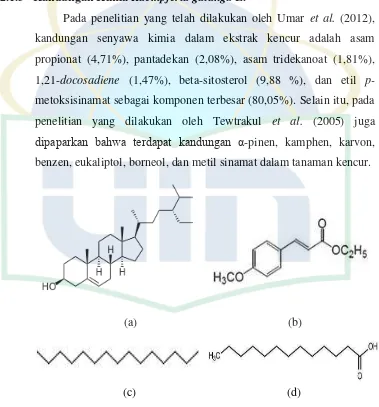
Struktur Senyawa dari (a) beta-sitosterol (b) etil p-metoksisinamat (c) pentadekan (d) asam tridekanoat ... Jalur sikimat untuk menghasilkan etil p-metoksisinamat ... Prisnsip Reaksi Hidrolisis ... Mekanisme Reaksi Hidrolisis pada Ester ... Mekanisme Reaksi Hidrolisis Ester dengan Katalis Basa ... Mekanisme Hidrolisis Etil p-metoksisinamat ... Struktur Asam p-metoksisinamat ... Mekanisme Reaksi Nitrasi dengan HNO3 dan H2SO4 pada Senyawa Aromatik ... Struktur Senyawa 1-Butanol ... Instrumentasi Oven Microwave ... Skema Kromatografi Lapis Tipis... Mekanisme Inflamasi ... Mekanisme Reaksi Hidrolisis EPMS ... Pola Spot KLT Hasil Hidrolis ... Reaksi Nitrasi APMS ... Residu Hasil Penyaringan pada Reaksi Nitrasi APMS ... Reaksi Esterifikasi Senyawa Hasil Nitrasi ... Pola Spot KLT Setelah Reaksi Esterifikasi ... KLT Senyawa Hasil Esterifikasi Setelah Pemurnian ... Identifikasi Senyawa Modifikasi dengan KLT ... Senyawa Hasil Hidrolisis EPMS ... Pola Fragmentasi GCMS Asam p-metoksisinamat ... Struktur Asam p-metoksisinamat ... Hasil Reaksi Nitrasi yang Mengandung Senyawa A ...
Pola KLT Hasil Reaksi Nitrasi APMS ... Senyawa B ... Spektrum IR Senyawa B ... Fragmentasi GCMS Senyawa B ... Pola Kromatogram GCMS Senyawa B ... Spektrum H-NMR Senyawa B ... Struktur Senyawa Hasil Esterifikasi dan Etil 4-metoksi 6-nitro sinamat ... Grafik Persen Inhibisi Denaturasi Protein BSA ...
✂ ✁ Tabel 4.1
Tabel 4.2
Tabel 4.3
Spektrum IR Senyawa Esterifikasi Hasil Nitrasi ... Data Pergeseran Kimia (!) Spektrum 1H-NMR Senyawa Hasil Esterifikasi... Hasil Uji Aktivitas Antiinflamasi ...
55
✂ ✁
Lampiran 1. Kerangka Penelitian ...69
Lampiran 2. Skema Identifikasi Senyawa Hasil Modifikasi ... 70
Lampiran 3. Alat dan Bahan Penelitian ... 71
Lampiran 4. Alur Kerja Reaksi Esterifikasi ... 73
Lampiran 5. Perhitungan Reaksi ... 75
Lampiran 6. Optimasi Reaksi Hidrolisis ... 76
Lampiran 7. Optimasi Reaksi Nitrasi ... 77
Lampiran 8. Optimasi Reaksi Esterifikasi ... 78
Lampiran 9. Gambar Senyawa ... 79
Lampiran 10. Spektrum GCMS Asam p-metoksisinamat ... 80
Lampiran 11. Spektrum IR Hasil Esterifikasi ... 82
Lampiran 12. Spektrum GCMS Hasil Esterifikasi ... 83
Lampiran 13. Spektrum H1-NMR Hasil Esterifikasi ... 85
Lampiran 14. Spektrum C13-NMR Hasil Esterifikasi ... 89
Lampiran 15. Hasil Perhitungan Uji Antiinflamasi ... 93
✂ ✁
DAFTAR ISTILAH
APMS Asam p-metoksisinamat
COX Cyclooxigenase (Siklooksigenase) DSC Differential Scanning Calorimeter EPMS Etil p-metoksisinamat
g Gram
GCMS Gas Chromatography Mass Spectrofotometry IC Inhibitor Concentration
IR Infra Red
KLT Kromatografi Lapis Tipis
UIN Syarif Hidayatullah Jakarta 1.1 Latar Belakang
Indonesia adalah negara megabiodiversity yang kaya akan tanaman
obat, dan sangat potensial untuk dikembangkan, namun pengelolaannya
belum dilakukan secara maksimal. Kekayaan alam flora di Indonesia
meliputi 30.000 jenis tumbuhan dari total 40.000 jenis tumbuhan di dunia.
940 jenis diantaranya merupakan tumbuhan berkhasiat obat (jumlah ini
merupakan 90% dari jumlah tumbuhan obat di Asia). Namun berdasarkan
hasil penelitian, dari sekian banyak jenis tanaman obat, baru 20-22% yang
dibudidayakan. Sedangkan sekitar 78% diperoleh melalui pengambilan
langsung (eksplorasi) dari hutan (Masyhud, 2010).
Butuh adanya strategi untuk mengurangi ketergantungan terhadap
bahan baku obat dari tanaman. Termasuk diantaranya adalah upaya untuk
meningkatkan penelitian dan pengembangan terhadap potensi alam
Indonesia terkait isolasi, sintesis, maupun modifikasi lebih lanjut untuk
mendapatkan hasil dan aktivitas obat yang lebih baik dengan biaya yang
layak secara ekonomi, kemudian berkembang untuk mendapatkan obat
dengan efek samping yang minimal (aman digunakan), bekerja selektif,
masa kerja lebih lama, dan meningkatkan kenyaman pemakaian obat
(Kemristek RI, 2009)
Kencur (Kaempferia galanga L) sebagai salah satu tanaman obat
memiliki prospek baik untuk dikembangkan. Salah satu alasan
pengembangan tanaman kencur adalah kandungan bahan aktif yang
beragam dan cukup tinggi yang mampu mencegah maupun mengobati
berbagai penyakit (Siswanto et al., 2010).
Adapun berbagai pengujian aktivitas terhadap ekstrak kencur telah
dilakukan oleh beberapa peneliti terdahulu. Ekstrak minyak atsiri kencur
telah diteliti memiliki aktivitas antibakteri dan antijamur (Tewtrakul et al.,
UIN Syarif Hidayatullah Jakarta
2005). Ekstrak etanol rimpang kencur memiliki daya hambat yang baik
terhadap jamur Trichophyton mentagrophytes dan Cryptococcus
neoformans yang merupakan jamur penyabab penyakit kurap pada kulit dan
penyakit paru (Gholib, 2009). Selain itu, ekstrak etanol kencur dapat
berperan sebagai antiinflamasi dan analgesik (Vittalrao, 2011) dan sebagai
penyembuh luka (Tara, 2006).
Umar et al. (2012) telah meneliti kandungan yang terdapat dalam
ekstrak kencur. Adapun senyawa metabolit sekunder yang terdapat dalam
ekstrak kencur adalah etil p-metoksisinamat (80,05%), beta-sitosterol
(9,88%), asam propionate (4,7%), pentadekan (2,08%), asam tridekanoat
(1,81%), dan 1,21-docosadiene (1,47%). Menurut data tersebut, jelas bahwa
etil p-metoksisinamat adalah komponen utama (major coumpound) dalam
ekstrak kencur.
Etil p-metoksisinamat berperan penting terhadap berbagai aktivitas
yang dimiliki oleh tanaman kencur. Dalam studi in vitro, etil
p-metoksisinamat secara non-selektif mampu menghambat aktivitas COX-1
dan COX-2, dengan masing-masng nilai IC50 1,12 μM dan 0,83 μM. Hasil
ini memvalidasi aktivitas antiinflamasi kencur yang dihasilkan oleh
penghambatan COX-1 dan COX-2 (Umar et al., 2012). Penelitian terbaru
oleh Ju Ko et al. (2014) menunjukkan bahwa etil p-metoksisinamat mampu
menghambat pembentukan melanin sehingga memungkinkan untuk menjadi
salah satu alternatif pengobatan pada kasus hiperpigmentasi.
Senyawa etil p-metoksisinamat, yang merupakan salah satu senyawa
utama dalam rimpang kencur, telah mendorong para ahli kimia medisinal
untuk melakukan pengembangan terhadap senyawa tersebut. Diantaranya,
sintesis oktil p-metoksisinamat sebagai sunblock melalui reaksi
transesterifikasi (Suzana, 2011), modifikasi etil p-metoksisinamat sebagai
agen kemopreventif pada fibrosarkoma tikus (Ekowati et al., 2012), dan
modifikasi etil p-metoksisinamat melalui reaksi hidrolisis dapat
UIN Syarif Hidayatullah Jakarta
Salah satu hal yang mendasari penulis untuk melakukan modifikasi
terhadap senyawa etil p-metoksisinamat adalah karena senyawa turunan
sinamat tersebut mempunyai gugus fungsi reaktif seperti olefin dan ester
yang mudah ditransformasikan menjadi gugus fungsi lain, sehingga
senyawa etil p-metoksisinamat merupakan senyawa yang potensial sebagai
bahan dasar sintesis (Surbakti, 2008). Selain itu, senyawa etil
p-metoksisinamat juga relatif mudah diisolasi dari ekstrak tanaman kencur.
Bentuk modifikasi yang akan dilakukan adalah dengan menambahkan
gugus nitro (NO2) pada cincin benzen etil p-metoksisinamat melalui reaksi
nitrasi dan mensubstitusi gugus karboksilat dengan gugus butil ester melalui
reaksi esterifikasi menggunakan 1-butanol. Pemilihan reaksi didasarkan
pada teori bahwa penambahan gugus NO2 dan rantai karbon pada bagian
ester menunjukkan efek induksi negatif yang dapat mempengaruhi
keelektronegatifan suatu senyawa dengan demikian akan memberikan
perubahan sifat kimia fisika senyawa dan mempengaruhi aktivitas
biologisnya (Siswandono, 2008), sehingga ini menjadi menarik untuk
dilakukan.
Menurut penelitian sebelumnya oleh Rakesh et al., (2015)
menunjukkan bahwa turunan senyawa modifikasi quinazolinone yang
memiliki gugus Cl dan NO2 mampu menghasilkan agen antiinflamasi yang
lebih baik dari aspirin (Rakesh et al., 2015). Sedangkan, penambahan gugus
butil melalui reaksi esterifikasi dapat meningkatkan lipofilisitas senyawa,
dengan demikian akan terjadi perbedaan polaritas yang mungkin dapat
mempengaruhi aktivitas antiinlamasi. Inilah dasar yang memperkuat
pemilihan reaksi nitrasi-esterifikasi dalam penelitian ini.
Penelitian modifikasi struktur EPMS melalui reaksi nitrasi telah
dilakukan oleh Mufidah (2014), namun hal tersebut menyebabkan terjadinya
degradasi sinamat. Selain itu, peneliti telah melakukan studi pendahuluan
reaksi nitrasi dari asam p-metoksisinamat. Oleh karena itu, penelitian ini
menggunakan turunan asam dari etil p-metoksisinamat sebagai starting
UIN Syarif Hidayatullah Jakarta
Uji antiinflamasi hasil modifikasi senyawa dilakukan secara in vitro
menggunakan metode inhibisi denaturasi Bovine Serum Albumine (BSA).
Pengujian ini dipilih karena mudah, hanya menggunakan sampel dalam
jumlah sedikit, memiliki waktu analisis yang cepat dan merupakan uji
pendahuluan yang dilakukan sebagai skrining awal aktivitas antiinflamasi
(Mufidah, 2014).
1.2. Rumusan Masalah
a. Apakah gugus fungsi pada senyawa etil p-metoksisinamat dapat
ditransformasi melalui reaksi nitrasi-esterifikasi dengan 1-butanol?
b. Bagaimana hubungan struktur senyawa hasil transformasi gugus fungsi
etil p-metoksisinamat terhadap aktivitas antiinflamasi?
1.3. Tujuan Penelitian
a. Melakukan modifikasi struktur senyawa etil p-metoksisinamat melalui
reaksi nitrasi-esterifikasi.
b. Menganalisis hubungan struktur aktivitas antiinflamasi senyawa hasil
modifikasi yang dihasilkan dari transformasi gugus fungsi etil
p-metoksisinamat.
1.4. Manfaat Penelitian
a. Mendapatkan senyawa turunan etil p-metoksisinamat yang diharapkan
mampu memberikan informasi baru mengenai hubungan struktur
aktivitas senyawa turunan etil p-metoksisinamat sebagai agen
antiinflamasi.
b. Hasil dari penelitian ini diharapkan mampu memberikan informasi
untuk proses modifikasi struktur dan uji aktivitas dari senyawa etil
UIN Syarif Hidayatullah Jakarta
1.5. Hipotesis
Penambahan gugus nitro dan butil ester pada senyawa etil
UIN Syarif Hidayatullah Jakarta 2.1 Tumbuhan Kencur
Gambar 2.1 Rimpang kencur (Kaempferia galanga L)
Tumbuhan kencur (Kaempferia galanga L) diperkirakan berasal dari
India. Meskipun demikian, kencur sudah menyebar luas di berbagai negara
terutama di benua Asia (Rukmana, 1994). Kencur merupakan tanaman tropis
yang banyak tumbuh di berbagai daerah di Indonesia sebagai tanaman yang
dipelihara. Bagian tanaman yang sering digunakan adalah rimpang yang
mempunyai aroma yang khas dan lembut sehingga mudah membedakannya
dengan jenis Zingiberaceae lain.
Daun kencur berbentuk bulat lebar, tumbuh mendatar diatas permukaan
tanah dengan jumlah daun tiga sampai empat helai. Permukaan daun sebelah
atas berwarna hijau sedangkan sebelah bawah berwarna hijau pucat. Panjang
daun berukuran 10-12 cm dengan lebar 8-10 cm mempunyai sirip daun yang
tipis dari pangkal tanpa tulang induk daun yang nyata (Backer, 1986).
Rimpang kencur terdapat di dalam tanah bergerombol dan
bercabang-cabang dengan induk rimpang di tengah. Kulit ari berwarna coklat dan bagian
dalam putih berair dengan aroma yang tajam. Rimpang yang masih muda
berwarna putih kekuningan dengan kandungan air yang lebih banyak dan
rimpang yang lebih tua ditumbuhi akar pada ruas rimpang berwarna putih
kekuningan (Backer, 1986).
UIN Syarif Hidayatullah Jakarta
Bunga kencur berwarna putih berbau harum terdiri dari empat helai
daun mahkota. Tangkai bunga berdaun kecil-kecil sepanjang 2-3 cm, tidak
bercabang, dapat tumbuh lebih dari satu tangkai, panjang tangkai 5-7 cm
berbentuk bulat dan beruas-ruas. Putik menonjol ke atas berukuran 1-1,5 cm,
tangkai sari berbentuk corong pendek. Bunga kencur termasuk ke dalam
bunga majemuk sempurna (lengkap), karena mempunyai bunga jantan, bunga
betina, mahkota, dan kelopak bunga yang terletak dalam satu anak bunga
(Haryudi, 2008).
2.1.1 Klasifikasi (USDA)
Kingdom : Plantae
Subkingdom : Trecheobionta
Super divisi : Spematophyta
Divisi : Magnoliophyta
Kelas : Liliopsida
Sub Kelas : Commenlinidae
Ordo : Zingiberales
Famili : Zingiberaceae
Genus : Kaempferia
Spesies : Kaempferia galanga Linn.
2.1.2 Tempat Tumbuh
Kencur merupakan temu kecil yang tumbuh subur di daerah
dataran rendah atau pegunungan yang tanahnya gembur (Armando,
2009). Produksi, mutu, dan kandungan bahan aktif di dalam rimpang
kencur ditentukan oleh varietas cara budidaya dan lingkungan tempat
tumbuhnya (Muhlisah, 1999).
Kencur dapat tumbuh di berbagai tempat di dataran rendah
hingga pegunungan dengan ketinggian daerah antara 80 – 700 m dari
permukaan laut. Tanaman ini menghendaki tanah yang subur dan
gembur. Kencur tumbuh lebih baik pada tempat yang sedikit
UIN Syarif Hidayatullah Jakarta
pada ketinggian lebih dari 600 m dpl. mempunyai resiko
pertumbuhan yang kurang baik. Selain itu, peta curah hujan di Jawa
menunjukkan bahwa kencur dapat beradaptasi di daerah yang basah (9
bulan basah) maupun yang sedang (5-6 bulan basah dan 5-6 bulan
kering) dan mencakup areal kira-kira 60% dari luas pulau Jawa
(Roemantyo, 1996).
2.1.3 Kandungan Kimia Kaempferia galanga L.
Pada penelitian yang telah dilakukan oleh Umar et al. (2012),
kandungan senyawa kimia dalam ekstrak kencur adalah asam
propionat (4,71%), pantadekan (2,08%), asam tridekanoat (1,81%),
1,21-docosadiene (1,47%), beta-sitosterol (9,88 %), dan etil
p-metoksisinamat sebagai komponen terbesar (80,05%). Selain itu, pada
penelitian yang dilakukan oleh Tewtrakul et al. (2005) juga
dipaparkan bahwa terdapat kandungan α-pinen, kamphen, karvon,
benzen, eukaliptol, borneol, dan metil sinamat dalam tanaman kencur.
(a) (b)
(c) (d)
Gambar 2.2 Struktur Senyawa dari (a) beta-sitosterol (b) etil p-metoksisinamat (c)
UIN Syarif Hidayatullah Jakarta
2.1.4 Manfaat Kaempferia galanga L.
Kencur merupakan jenis tanaman obat potensial yang dapat
dimanfaatkan sebagai bahan baku minuman untuk kesehatan,
obat-obatan dan penyedap masakan, serta dapat juga dimanfaatkan sebagai
kosmetik (Haryudin et al., 2008). Dalam ramuan obat tradisional
(jamu) kencur dipakai sebagai obat luar (topikal) maupun obat dalam
(oral). Jamu yang mengandung kencur digunakan untuk pengobatan
antara lain antiinflamasi, antimikroba, analgesik dan antipiretik
(Suwito, 2005).
2.2 Senyawa Etil p-metoksisinamat
Etil p–metoksisinamat (C12H14O3) termasuk turunan asam sinamat,
dimana asam sinamat adalah turunan senyawa fenil propanoat. Senyawa
EPMS berbentuk kristal berwarna putih dengan berat molekul 206,24 g/mol
dan memiliki titik lebur 55-56oC (Bangun, 2011). EPMS sebelumnya
dimanfaatkan sebagai bahan tabir surya (Windono et al., 1997), namun
dewasa ini telah diteliti lebih lanjut bahwa EPMS merupakan senyawa isolat
kencur yang memiliki aktivitas sebagai antiinflamasi non selektif
menghambat COX-1 dan COX-2 secara in vitro. Etil p-metoksisinamat
(EPMS) mampu menghambat induksi edema karagenan pada tikus dengan
MIC 100 mg/kg dan juga berdasarkan hasil uji in vitro EPMS secara
non-selektif menghambat aktivitas COX-1 dan COX-2 dengan nilai IC 50
masing-masing 1,12 μM dan 0,83 μM (Umar et al., 2012).
Etil p-metoksisinamat adalah salah satu produk alam yang terdapat
pada kencur (Kaempferia galanga) dalam jumlah yang relatif besar. Isolasi
dan pemurnian etil p-metoksisinamat dapat dilakukan dengan mudah, selain
itu etil p-metoksisinamat mempunyai gugus fungsi yang reaktif sehingga
sangat mudah ditransformasikan menjadi gugus fungsi lain (Barus, 2009).
EPMS merupakan salah satu senyawa turunan asam sinamat dengan
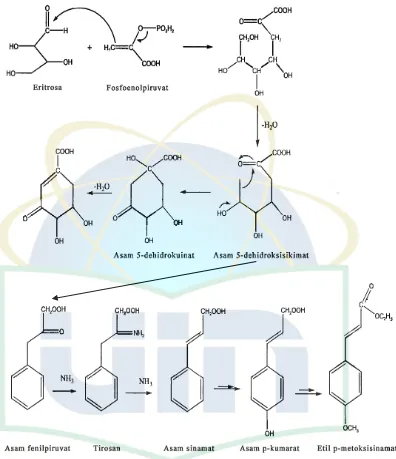
demikian jalur biosintesis senyawa EPMS adalah melalui jalur biosintesis
UIN Syarif Hidayatullah Jakarta Gambar 2.3 Jalur sikimat untuk menghasilkan etil p-metoksisinamat
2.2.1 Isolasi Senyawa Etil p-metoksisinamat
EPMS termasuk ke dalam senyawa ester yang mengandung
cincin benzene dan gugus metoksi yang bersifat nonpolar dan juga
gugus karbonil yang mengikat etil yang bersifat sedikit polar sehingga
dalam ekstraksinya dapat menggunakan pelarut-pelarut yang
mempunyai variasi kepolaran yaitu etanol, etil asetat, metanol, air dan
UIN Syarif Hidayatullah Jakarta
kepolaran antara pelarut dengan senyawa yang diekstrak, keduanya
harus memiliki kepolaran yang sama atau mendekati sama. EPMS
adalah suatu ester yang mengandung cincin benzen dan gugus metoksi
yang bersifat non polar dan mengandung gugus karbonil yang
mengikat etil yang bersifat agak polar menyebabkan senyawa ini
mampu larut dalam beberapa pelarut dengan kepolaran bervariasi.
Hasil penelitian pada pemilihan pelarut pada suhu kamar didapat
bahwa heksan adalah pelarut yang paling sesuai ditandai dengan
persen hasil isolasi tertinggi yaitu 2,111 % yang diikuti dengan etanol
yatu 1,434 %, dan etil asetat 0,542% sedangkan dengan aquades tidak
terdapat kristal (Taufikkurohmah et al., 2008).
2.3 Hidrolisis
Hidrolisis adalah perubahan atau transformasi kimia dimana molekul
organik berupa RX akan bereaksi dengan air menghasilkan sebuah struktur
dengan ikatan kovalen OH seperti dijelaskan pada gambar 2.4. Hidrolisis
adalah contoh dari kelas reaksi terbesar dalam reaksi kimia disebut sebagai
reaksi perpindahan nukleofilik di mana nukleofil menyerang atom elektrofilik.
Proses hidrolitik mencakup beberapa jenis mekasnime reaksi yang dapat
didefinisikan oleh jenis pusat reaksi dimana terjadi hidrolisis. Mekanisme
reaksi yang paling sering ditemui adalah substitusi nukleofilik, baik secara
langsung maupun tidak langsung dan eliminasi-adisi nukleofilik (Larson and
Weber, 1994).
Gambar 2.4 Prisnsip Reaksi Hidrolisis (Larson and Weber, 1994)
Reaksi hidrolisis dapat terjadi dengan katalis basa atau asam,
mekanisme reaksi hidrolisis sendiri dikelompokkan berdasarkan tipe reaksi
dasar seperti substitusi nukleofilik, gugus fungsi yang ditransformasikan
dengan reaksi substitusi nukleofilik, substitusi asil nukleofilik, gugus fungsi
UIN Syarif Hidayatullah Jakarta
untuk turunan asam karboksilat masuk ke dalam kategori yakni gugus fungsi
yang ditransformasikan dengan reaksi substitusi asil nukleofilik.
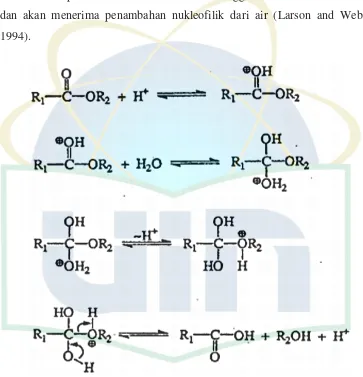
Mekanisme hidrolisis pada gambar 2.5 diinisiasi oleh protonasi pada
karbon oksigen. Protonasi menyebabkan keadaan terpolarisasi pada gugus
karbonil melepaskan elektron dari karbon sehingga bersifat lebih elektrofilik
dan akan menerima penambahan nukleofilik dari air (Larson and Weber,
1994).
Gambar 2.5 Mekanisme Reaksi Hidrolisis pada Ester
(Larson and Weber, 1994)
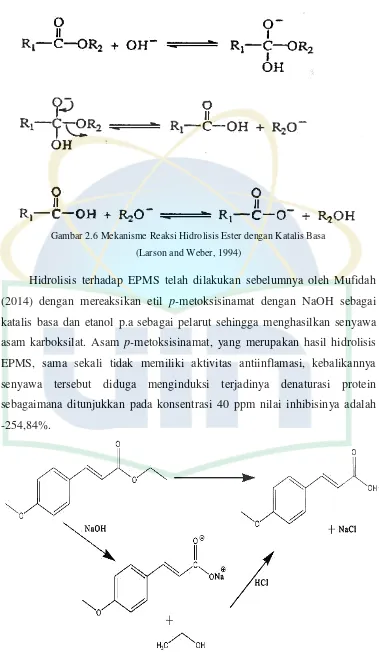
Hidrolisis ester dengan katalis basa melalui mekanisme penambahan
nukleofilik OH (Gambar 2.6) secara langsung kepada gugus karbonil.
Hidrolisis ester berkatalis basa terjadi karena ion OH merupakan nukleofil
UIN Syarif Hidayatullah Jakarta Gambar 2.6 Mekanisme Reaksi Hidrolisis Ester dengan Katalis Basa
(Larson and Weber, 1994)
Hidrolisis terhadap EPMS telah dilakukan sebelumnya oleh Mufidah
(2014) dengan mereaksikan etil p-metoksisinamat dengan NaOH sebagai
katalis basa dan etanol p.a sebagai pelarut sehingga menghasilkan senyawa
asam karboksilat. Asam p-metoksisinamat, yang merupakan hasil hidrolisis
EPMS, sama sekali tidak memiliki aktivitas antiinflamasi, kebalikannya
senyawa tersebut diduga menginduksi terjadinya denaturasi protein
sebagaimana ditunjukkan pada konsentrasi 40 ppm nilai inhibisinya adalah
-254,84%.
UIN Syarif Hidayatullah Jakarta
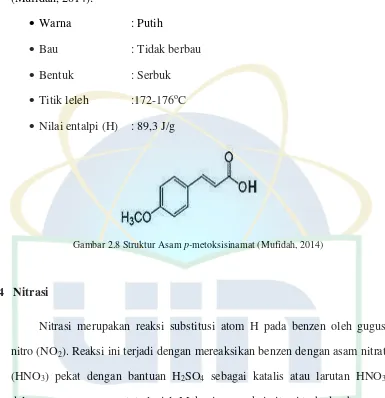
Senyawa hasil hidrolisis etil p-metoksisinamat memiliki karakteristik berikut
(Mufidah, 2014):
Warna : Putih
Bau : Tidak berbau
Bentuk : Serbuk
Titik leleh :172-176oC
Nilai entalpi (H) : 89,3 J/g
Gambar 2.8 Struktur Asam p-metoksisinamat (Mufidah, 2014)
2.4 Nitrasi
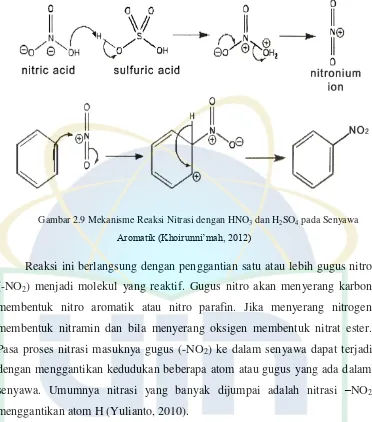
Nitrasi merupakan reaksi substitusi atom H pada benzen oleh gugus
nitro (NO2). Reaksi ini terjadi dengan mereaksikan benzen dengan asam nitrat
(HNO3) pekat dengan bantuan H2SO4 sebagai katalis atau larutan HNO3
dalam suasana asam asetat glasial. Mekanisme reaksi nitrasi terhadap benzene
ditunjukkan pada Gambar 2.7.
Nitrasi dari benzen awalnya dipengaruhi oleh pembentukan elektrofilik
kuat yaitu ion nitronium, yang mana ini terjadi karena interaksi antara 2 asam
kuat yaitu asam sulfat dan asam nitrat. Asam sulfat lebih kuat dan dapat
memprotonasi asam nitrat pada gugus OH sehingga molekul dari air dapat
berpisah. Selanjutnya benzene menyerang muatan positif atom nitrogen dari
elektrofil, yang mana ikatan N=O lepas pada waktu yang sama. Hal ini diikuti
UIN Syarif Hidayatullah Jakarta Gambar 2.9 Mekanisme Reaksi Nitrasi dengan HNO3 dan H2SO4 pada Senyawa
Aromatik (Khoirunni’mah, 2012)
Reaksi ini berlangsung dengan penggantian satu atau lebih gugus nitro
(-NO2) menjadi molekul yang reaktif. Gugus nitro akan menyerang karbon
membentuk nitro aromatik atau nitro parafin. Jika menyerang nitrogen
membentuk nitramin dan bila menyerang oksigen membentuk nitrat ester.
Pasa proses nitrasi masuknya gugus (-NO2) ke dalam senyawa dapat terjadi
dengan menggantikan kedudukan beberapa atom atau gugus yang ada dalam
senyawa. Umumnya nitrasi yang banyak dijumpai adalah nitrasi –NO2
menggantikan atom H (Yulianto, 2010).
Metode reaksi nitrasi dengan menggunakan iradiasi microwave
baru-baru ini mulai menjadi perhatian para ahli. Metode “Cold Microwave” biasa
digunakan untuk reaksi nitrasi karena memiliki beberapa keuntungan, yaitu
waktu reaksi yang cepat, reaksi nitrasi dapat berlangsung tanpa adanya asam
sulfat, dan dapat memberikan hasil yang lebih spesifik (single product) akibat
dari reagen yang didinginkan terlebih dahulu sebelum pencampuran
(Bose,2009).
Nitrating agent merupakan reaktan elektrofilik, dimana reaksi akan
terjadi pada atom karbon dari cincin aromatik yang mempunyai kepadatan
elektron terbesar. Gugus NO2 yang masuk dapat membentuk posisi ortho,
UIN Syarif Hidayatullah Jakarta
Subtituen meta menyebabkan kepadatan elektron menjadi lebih besar
dibandingkan substituen ortho dan para, sehingga yield produk nitrasi akan
didominasi isomer meta (Yulianto, 2010).
2.5 Esterifikasi
Reaksi esterifikasi asam karboksilat adalah reaksi pembentukan ester
dengan bahan dasar asam karboksilat. Ester asam karboksilat ini merupakan
suatu senyawa yang mengandung gugus –COOR dengan R yang berbentuk
alkil maupun aril (Fessenden & Fessenden, 2006).
Katalis memainkan peranan penting terhadap keberlangsungan reaksi
esterifikasi. Katalis yang digunakan dalam reaksi esterifikasi dapat berupa
katalis asam atau katalis basa dan berlangsung secara reversibel (Supardjan,
2004). Untuk memperoleh rendemen tinggi dari ester tersebut, kesetimbangan
harus digeser ke arah sisi ester dengan menambahkan salah satu pereaksi
secara berlebih. Kereaktifan asam karboksilat hanya memainkan peranan
kecil dalam laju pembentukan ester (Fessenden & Fessenden, 2006).
Kereaktifan asam karboksilat terhadap esterifikasi:
Variabel-Variabel yang Mempengaruhi Reaksi Esterifikasi
Reaksi esterifikasi dipengaruhi oleh beberapa variabel.
Variabel-variabel yang dimaksud antara lain (Hakim dan Irawan, 2010):
a. Waktu Reaksi
Semakin lama waktu reaksi maka kemungkinan kontak antar zat
semakin besar sehingga akan menghasilkan konversi yang besar. Jika
kesetimbangan reaksi sudah tercapai maka dengan bertambahnya waktu
UIN Syarif Hidayatullah Jakarta
b. Perbandingan Zat Pereaksi
Dikarenakan sifatnya yang reversibel, maka salah satu reaktan
harus dibuat berlebih agar optimal dalam pembentukan produk ester
yang diinginkan.
c. Pengadukan
Pengadukan akan menambah ferkuensi tumbukan antara molekul
zat pereaksi dengan zat yang bereaksi semakin baik sehingga
mempercepat reaksi dan reaksi terjadi sempurna. Hal ini sesuai dengan
persamaan Arrhenius :
Keterangan:
k = Konstanta laju reaksi
A = Faktor frekuensi atau faktor pre-eksponensial
Ea = Energi Aktivasi (kL/mol)
R = Tetapan gas universal (0,0821 atm/mol.K atau 8,314 J/mol.K)
T = Temperatur atau suhu (K)
Semakin besar tumbukan, maka semakin besar pula harga
konstanta laju reaksi, sehingga reaksi dapat berjalan lebih optimal.
d. Suhu
Dikarenakan sifat dari reaksi yang isotermis, maka suhu dapat
mempengaruhi harga konstanta laju reaksi. Semakin tinggi suhu yang
dioperasikan maka semakin banyak konversi yang dihasilkan. Hal ini
sesuai dengan persamaan Arrhenius, bila suhu naik maka harga k
semakin besar, sehingga reaksi berjalan cepat dan hasil konversi
semakin besar.
e. Katalisator
Sifat reaksi esterifikasi yang lambat membutuhkan katalisator
agar berjalan lebih cepat. Katalisator berfungsi untuk mengurangi
energi aktivasi pada suatu reaksi, sehingga pada suhu tertentu harga
UIN Syarif Hidayatullah Jakarta
2.6 Spesifikasi Asam Nitrat dan 1-Butanol
2.6.1 Asam Nitrat
Meledak dalam solvent etanol
Viskositas (25oC) : 0,761 Cp
Panas peleburan (Hfus) : 10,48 Kj/mol
Panas pembentukan (Hf) : -174,10 Kj/mol
Panas penguapan (25oC) : 39,04 Kj/mol
Energi bebas pembentukan (25oC) : -80,71 Kj/mol
Entropy (25oC) : 155,60 J/molK
(Kirk Orthmer, 1996., Yulianto, 2010)
Sifat Kimia
Asam Nitrat adalah suatu asam monobasa yang kuat, yang mudah
bereaksi dengan alkali, oksida dan senyawa basa dalam bentuk
garam. Asam nitrat merupakan senyawa yang berperan yang
berperan dalam proses nitrasi, yaitu sebagai nitrating agent.
Komponen yang dinitrasi adalah benzen, baik dengan adanya asam
UIN Syarif Hidayatullah Jakarta
2.6.2 1-Butanol
Sifat Fisika
Rumus kimia : C4H10O
Organoleptis : tak berwarna, cairan kental, bau khas
Berat molekul : 74,12 g/mol
1-Butanol merupakan senyawa organik yang memiliki ikatan
hidrogen sehingga senyawa ini mempunyai titik didih yang tinggi
(Halimatuddahliana, 2004).
Gambar 2.12 Struktur Senyawa 1-Butanol
2.7 Gelombang Mikro
2.7.1 Prinsip Umum
Gelombang mikro merupakan gelombang elektromagnet.
Gelombang elektromagnet itu sendiri merupakan suatu gelombang
yang tidak memerlukan medium perambatan, dengan kecepatan
rambat 3X108 m/detik. Gelombang elektromagnet terdiri dari
komponen medan listrik (E) dan medan magnet (B) yang saling
tegak lurus. Gelombang ini memiliki daerah frekuensi yang sangat
besar, yaitu 109-1022 Hz. Sebagian besar spektrum gelombang
UIN Syarif Hidayatullah Jakarta
2.7.2 Mekanisme Pemanasan
Pemanasan suatu materi dengan menggunakan gelombang
elektromagnetik berfrekuensi tinggi ditimbulkan dari interaksi
komponen medan listrik gelombang elektromagnetik dengan partikel
yang memiliki muatan dalam materi sehingga menghasilkan
polarisasi dipolar. Selain itu, terdapat faktor konduksi yang berperan
dalam pemanasan terutama pada suhu tinggi (Chem-team, 2004).
Fenomena yang berperan dalam pemanasan dengan gelombang
mikro adalah adanya konduksi ion. Dalam pengaruh suatu medan
listrik, ion-ion yang terdapat dalam sampel yang dipanaskan akan
bergerak dan saling bergesekan sehingga menimbulkan panas.
Migrasi ion ini dipengaruhi oleh ukuran muatan dan konduktivitas
ion terlarut. Faktor yang mempengaruhi konduksi ion adalah
konsentrasi, mobilitas ion, dan temperatur larutan (Neas, E.D & M.J.
Collins, 1988).
2.7.3 Instrumentasi Oven Gelombang Mikro (Belinda, 2011)
Instrumentasi gelombang mikro yang digunakan untuk
pemanasan terdiri dari enam komponen utama, yaitu:
Magnetron, merupakan tabung hampa elektronik penghasil
gelombang mikro. Fungsinya adalah memancarkan gelombang
mikro ke sebuah kincir yang terbuat dari logam yang disebut
stirrer.
Pengarah gelombang (wave guide)
Cavity, merupakan tempat dimana sampel akan diiradiasi
dengan gelombang mikro. Berdasarkan jenis cavity, instrumen
gelombang mikro terdiri dari dua macam reaktor utama, yaitu
reactor monomade/single mode dan multimode.
Stirrer, alat ini akan berputar selama magnetron memancarkan
gelombang mikro sehingga gelombang tersebut terpancarkan
dan terdistribusi secara merata ke dalam ruang pemanasan dari
UIN Syarif Hidayatullah Jakarta Sirkulator
Turntable
Gambar 2.11 Instrumentasi Oven Microwave (Belinda, 2011)
2.8 Identifikasi
2.8.1 Kromatografi
Kromatografi didefinisikan sebagai prosedur pemisahan zat
terlarut oleh suatu proses nitrasi migrasi diferensial dinamis dalam
sistem yang terdiri dari dua fase atau lebih, salah satu diantaranya
bergerak secara berkesinambungan dalam arah tertentu dan
didalamnya zat-zat itu menunjukkan perbedaan mobilitas disebabkan
adanya perbedaan dalam adsorpsi, partisi, kelarutan, tekanan uap,
ukuran molekul atau kerapatan muatan ion. Dengan demikian
masing-masing zat dapat diidentifikasi atau ditetapkan dengan metode analitik
(Departemen Kesehatan, 1995).
a. Kromatografi Lapis Tipis
Kromatografi lapis tipis adalah metode pemisahan
fisikokimia. Lapisan yang memisahkan, yang terdiri atas bahan
berbutir-butir (fase diam), ditempatkan pada penyangga berupa
pelat gelas, atau lapisan yang cocok. Campuran yang akan dipisah
berupa larutan ditotolkan dalam bentuk bercak atau pita (awal).
Setelah pelat atau lapisan ditaruh di dalam bejana tertutup rapat
yang berisi larutan pengembang yang cocok (fase gerak),
UIN Syarif Hidayatullah Jakarta
Selanjutnya senyawa yang tidak berwarna harus ditampakkan
(dideteksi) (Stahl Egon dalam Khoirunni’mah, 2012).
Diantara berbagai jenis teknik kromatografi, kromatografi
lapis tipis adalah yang paling banyak digunakan untuk analisis
obat di laboratorium farmasi. Metode ini hanya memerlukan
investasi kecil untuk perlengkapan dan menggunakan waktu yang
singkat untuk menyelesaikan analisis (15-60 menit), memerlukan
jumlah cuplikan yang sangat sedikit (kira-kira 0,1 g). Selain itu,
hasil palsu yang disebabkan oleh komponen sekunder tidak
mungkin terjadi, kebutuhan ruangan minimum, dan
penanganannya sederhana (Stahl Egon dalam Khoirunni’mah,
2012).
Prinsip KLT yaitu perpindahan analit pada fase diam karena
pengaruh fase gerak. Proses ini disebut elusi. Semakin kecil
ukuran rata-rata partikel fase diam dan semakin sempit kisaran
ukuran fase diam, maka semakin baik kinerja KLT dalam hal
efeisiensi dan resolusinya. Fase gerak yang dikenal sebagai
pelarut pengembang akan bergerak sepanjang fase diam karena
pengaruh kapiler pada pengembangan ke atas (ascending), atau
karena pengaruh gravitasi pada pengembangan secara menurun
(descending) (Rohman, 2007).
Menurut Farmakope Indonesia IV, tatalaksana identifikasi
senyawa dengan KLT adalah sebagai berikut: Totolkan larutan uji
dan larutan baku menurut cara yang tertera pada masing-masing
monografi dengan jarak antara lebih kurang 1,5 cm dan lebih
kurang 2 cm dari tepi bawah lempeng, dan biarkan mengering
(tepi bawah lempeng adalah bagian lempeng yang pertama kali
dilalui oleh alat saat membuat lapisan pada waktu melapiskan zat
penjerap). Beri tanda pada jarak 10 cm hingga 15 cm di atas titik
penotolan. Tempatkan lempeng pada rak penyangga hingga
UIN Syarif Hidayatullah Jakarta
dalam bejana kromatografi. Pelarut dalam bejana harus mencapai
tepi bawah lapisan penjerap tetapi titik penotolan jangan sampai
terendam. Letakkan tutup bejana pada tempatnya dan biarkan
sistem hingga pelarut merambat 10 cm hingga 15 cm di atas titik
penotolan, umumya diperlukan waktu lebih kurang 15 menit
hingga 1 jam. Keluarkan lempeng dari bejana, buat tanda batas
rambat pelarut, keringkan lempeng di udara dan amati bercak
mula-mula dengan cahaya ultraviolet gelombang pendek (254
nm) dan kemudian dengan cahaya ultraviolet gelombang panjang
(365 nm). Ukur dan catat jarak tiap bercak yang diamati.
Tentukan harga Rf untuk bercak utama. Jika diperlukan, semprot
bercak dengan pereaksi tertentu, amati dan bandingkan
kromatogram zat uji dengan kromatogram baku pembanding
(Departemen Kesehatan, 1995).
Gambar 2.12 Skema Kromatografi Lapis Tipis (Mufidah, 2014)
b. Kromatografi Kolom
Tujuan kromatografi kolom adalah memisahkan komponen
cuplikan menjadi pita atau fraksi yang lebih sederhana, ketika
cuplikan itu bergerak melalui kolom. Zat penyerap dalam keadaan
UIN Syarif Hidayatullah Jakarta
tabung kuwarsa dengan ukuran tertentu dan mempunyai lubang
pengalir tertentu dengan ukuran tertentu (Departemen Kesehatan,
1979).
Zat penjerap atau fase diam yang digunakan bisa berupa
aluminium oksida yang telah diaktifkan, silika gel, tanah diatome
terkalsinasi, atau tanah silika yang dimurnikan dalam keadaan
kering atau dalam campuran air, dimampatkan ke dalam tabung
kromatografi kaca atau kuarsa. Zat uji yang dilarutkan dalam
jumlah kecil pelarut, dituangkan ke dalam kolom dan dibiarkan
mengalir ke dalam zat penjerap. Zat berkhasiat diadsorpsi dari
larutan secara kuantitatif oleh bahan penjerap berupa pita sempit
pada permukaan atas kolom. Dengan penambahan pelarut lebih
lanjut melalui kolom, oleh gaya gravitasi atau dengan memberi
tekanan, masing-masing zat bergerak turun dalam kolom dengan
kecepatan tertentu, sehingga terjadi pemisahan dan diperoleh
kromatogram (Departemen Kesehatan, 1995).
Fraksi yang diperoeh dari kolom kromatografi ditampung dan
dimonitor dengan kromatografi lapis tipis. Fraksi-fraksi yang
memiliki pola kromatogram yang sama digabung kemudian
pelarutnya diauapkan sehingga akan diperoleh beberapa fraksi.
Noda pada plat KLT dideteksi dengan lampu UV panjang
gelombang 254/365 nm untuk senyawa-senyawa yang
mempunyai gugus kromofor, dengan penampak noda seperti
larutan iod, FeCl3, dan H2SO4 dalam metanol 10% (Stahl, 1969).
2.8.2 Spektrofotometri
Spektrofotometri merupakan pengukuran suatu interaksi antara
radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia.
Teknik yang sering digunakan dalam analisis farmasi meliputi
spektrofotometri serapan ultraviolet, cahaya tampak, infamerah dan
UIN Syarif Hidayatullah Jakarta
a. Spektrofotometri IR
Spektrofotometri inframerah merupakan alat untuk merekam
spektrum di daerah inframerah terdiri dari suatu sistem optik dengan
kemampuan menghasilkan cahaya monokromatik di daerah 4000
cm-1 hingga 625 cm-1 (lebih kurang 2,5 πm hingga 16πm) dan suatu
metode untuk mengukur perbandingan intensitas perbandingan
cahaya yang ditransmisikan cahaya datang (Departemen Kesehatan,
1995).
Setiap molekul memiliki karakteristik spektrum inframereah
yang berbeda-beda baik dalam posisi maupun intensitas pita
absorbsinya. Spektrum yang diperoleh merupakan hubungan antara
bilangan gelombang (cm-1) dan persen transmitan. Spektrum IR
digunakan untuk mengidentifikasi gugus fungsi (Departemen
Kesehatan, 1995).
Absorpsi molekul pada inframerah terjadi ketika molekul
tereksitasi ke tingkat energi yang lebih tinggi. Suatu molekul hanya
menyerap frekuensi (energi) tertentu dari radiasi inframerah.
Kegunaan spektroskopi IR adalah sebagai sidik jari suatu molekul
dan untuk menentukan informasi struktural dari suatu molekul.
Absorpsi dari tiap tipe ikatan (N-H, C-H, O-H, C-X, C=O, C-O, C-C,
C=C, dan sebagainya) umumnya ditemukan hanya dalam porsi yang
sedikit dari area vibrasi inframerah. Rentang kecil dari absorpsi
dapat didefinisikan untuk tiap ikatan (Pavia et al., 2001).
b. Spektrofotometri UV-Vis
Spektrofotometri serap merupakan pengukuran interaksi antara
radiasi elektromagnetik panjang geombang tertentu yang sempit dan
mendekati monokromatik, dengan molekul atau atom dari suatu zat
kimia. Hal ini didasarkan pada kenyataan bahwa molekul selalu
mengabsorpsi cahaya elektromagnetik jika frekuensi cahaya tersebut
sama dengan frekuensi getaran dari molekul tersebut. Elektron yang
UIN Syarif Hidayatullah Jakarta
daerah frekuensi yang sesuai dengan cahaya ultraviolet dan cahaya
tampak (UV-Vis) (Roth et al., 1994).
Spektrum absorpsi daerah ini adalah sekitar 220 nm sampai
880 nm dan dinyatakan sebagai spektrum elektron. Suatu spektrum
ultraviolet meliputi daerah bagian ultraviolet (190-380 nm),
spektrum Vis (Visible) bagian sinat tampak (380-780 nm).
Prinsip spektroskopi absorpsi adalah semakin besar angka
meolekul yang mampu menyerap cahaya dari panjang gelombang
yang diberikan, semakin besar perluasan absorpsi cahaya. Selan itu,
semakin efektif suatu molekul menyerap cahaya dari panjang
gelombang yang diberikan, semakin besar perluasan absorpsi (Pavia
et al., 2001).
Pengukuran dengan alat spektrofotometer UV-Vis didasarkan
pada hubungan antara berkas radiasi elektromagnetik yang
ditransmisikan (diteruskan) atau yang diabsorpsi dengan tebalnya
cuplikan dengan konsentrasi dari komponen penyerap. Hubungan
tersebut diyatakan dalam Hukum Lambert-Beer (Sastroamidjojo,
1985):
Instrumentasi dari spektrofotometer UV-Vis ini dapat
diuraikan sebagai berikut:
1. Sumber energi cahaya yang berkesinambungan yang meliputi
daerah spektrum yang mana alat tersebut dirancang untuk
UIN Syarif Hidayatullah Jakarta
2. Monokromator, yakni sebuah piranti untuk memencilkan pita
sempit panjang gelombang dari spektrum lebar yang
dipancarkan oleh sumber cahaya.
3. Wadah untuk sampel (dalam hal ini digunakan kuvet).
4. Detektor, yang berupa transduser yang merubah energi cahaya
menjadi suatu sinyal listrik.
5. Amplifier (pengganda) dan rangkaian yang perubah energi
cahaya menjadi suatu sinyal listrik.
6. Suatu sistem baca dimana diperagakan besarnya sinyal listrik
yang ditangkap.
c. Spektrofotometri Resonansi Magnetik
Resonansi magnetik nuklir (Nuclear Magnetic Resonance)
adalah metode spektrofotometri yang bahkan lebih penting bagi ahli
kimia organik dari spektrofotometri inframerah. Banyak inti dapat
dipelajari dengan teknik NMR, tetapi hidrogen dan karbon yang
paling umum tersedia. Jika spektrofotometri inframerah (IR)
digunakan untuk mengidentifikasi gugus fungsi, NMR memberikan
informasi mengenai jumlah atom magnetis yang berbeda dari jenis
yang dipelajari (Mufidah, 2014).
NMR dapat menentukan jumlah masing-masing jenis yang
berbeda dari inti hidrogen serta memperoleh informasi mengenai
sifat dasar dari lingkungan terdekat dari masing-masing jenis.
Informasi yang sama dapat ditentukan untuk inti karbon. Kombinasi
IR dan data NMR seringkali cukup untuk menentukan secara benar
struktur molekul yang tidak diketahui (Pavia et al., 2008).
Prinsip dasar spektroskopi NMR yakni inti dari setiap isotop
tertentu memiliki gerakan berputar di sekililing sumbunya.
Perputaran patrikel berenergi atau sirkulasinya, menimbulkan
kejadian megnetis sepanjang sumbu magnetisnya dapat sejajar atau
UIN Syarif Hidayatullah Jakarta
Instrumen NMR terdiri atas komponen-komponen sebagai
berikut (Willard et al., 1988):
a. Magnet
Merupakan suatu alat tambahan yang berguna untuk
menstabilkan medan magnet.
b. Probe sampel
Tempat meletakkan sampel dan tempat terjadinya resonansi.
c. Sumber dan detektor radiasi radioaktif
Merekam perubahan magnetisasi sampel dan peluruhannya yang
disebabkan oleh pengaruh waktu.
d. Rekorder data
Memberikan informasi berupa sinyal yang dikirim ke suatu
komputer untuk diproses, diakumulasi lalu ditransformasikan
secara otomatis (Atta-ur-Rahman, 1986., Willards et al., 1988).
2.9 Inflamasi
2.9.1 Definisi Inflamasi
Inflamasi adalah reaksi kompleks dalam jaringan ikat vaskular
yang terjadi karena rangasangan eksogen dan endogen. Inflamasi
merupakan respon normal, pelindung terhadap cedera jaringan yang
disebabkan oleh trauma fisik, bahan kimia berbahaya atau agen
mikrobiologis, yang berupaya menonaktifkan atau menghancurkan
organisme asing, menghilangkan iritasi yang merupakan tahap
pertama perbaikan jaringan (Sen et al., 2010).
Proses inflamasi biasanya mereda pada proses penyelesaian atau
penyembuhan, tetapi kadang-kadang berubah menjadi radang yang
parah, yang mungkin jauh lebih buruk dari penyakit ini dan dalam
kasus ekstrim juga dapat berakibat fatal. Kemerahan, suhu yang
meningkat, pembengkakan, nyeri, dan hilangnya fungsi adalah tanda
klasik dari inflamasi. Inflamasi dapat diprovokasi oleh berbagai agen
berbahaya, bahan asing, toksin, infeksi, bahan kimia, patogen, reaksi
UIN Syarif Hidayatullah Jakarta
2.9.2 Mekanisme Inflamasi
Proses inflamasi dimulai dari stimulus yang akan
mengakibatkan kerusakan sel, sebagai reaksi terhadap kerusakan sel,
maka sel tersebut akan melepaskan beberapa fosfolipid yang
diantaranya adalah asam arakidonat. Setelah asam arakidonat tersebut
bebas, kemudian akan diaktifkan oleh beberapa enzim, diantaranya
siklooksigenase dan lipooksigenase. Enzim tersebut merubah asam
arakidonat ke dalam bentuk yang tidak stabil (hidroperoksid dan
endoperoksid) yang selanjutnya dimetabolisme menajdi leukotrien,
prostaglandin, prostasiklin, dan tromboksan. Bagian prostaglandin dan
leukotrien bertanggung jawab terhadap gejala-gejala peradangan
(Katzung, 2006).
Gambar 2.13 Mekanisme Inflamasi (Katzung, 2006) LTB4 LTC4/D4/E4
UIN Syarif Hidayatullah Jakarta
2.9.3 Obat-Obat Antiinflamasi
Obat-obat antiinflamasi adalah golongan obat yang memiliki
aktivitas menekan atau mengurangi peradangan. Aktivitas ini dapat
dicapai melalui berbagai cara. Salah satunya ialah menghambat
pelepasan prostaglandin dari sel-sel tempat pembentukannya. Obat
antiinflamasi sangat efektif menghilangkan rasa nyeri dan dan
pembengkakan akibat adanya inflamasi dengan menekan produksi
prostaglandin dan metabolisme asam arakidonat dengan cara
penghambatan siklooksigenase dan lipooksigenase pada kaskade
inflamasi sehingga fungsi otot dan sendi membaik (Setyarini, 2009).
Berdasarkan mekanisme kerjanya obat-obatan antiinflamasi
dibagi menjadi dua golongan, yaitu:
a. Antiinflamasi Steroid
Obat golongan ini bekerja dengan cara menghambat
fosfolipase, suatu enzim yang bertanggung jawab terhadap
pelepasan asam arakidonat dari membran lipid. Termasuk
golongan obat ini adalah: prednison, hidrokortison, deksametason,
dan betametason (Katzung, 2006).
b. Antiinflamasi Non Steroid (AINS)
Obat AINS bekerja dengan cara menghambat enzim
siklooksigenase sehingga konversi asam arakidonat menjadi
prostaglandin menjadi terganggu. Termasuk golongan obat ini
adalah: aspirin, ibuprofen, indometasin, diklofenak, fenil butazon,
dan piroksikam (Katzung, 2006).
Efek samping utama yang dimiliki oleh obat antiinflamasi
non steroid (AINS) adalah iritasi lambung yang mengarah pada
UIN Syarif Hidayatullah Jakarta
2.9.4 Natrium Diklofenak
Natrium dikofenak merupakan obat antiinflamasi non steroid
yang termasuk ke dalam kelompok preverencially selective COX
inhibitor. Obat ini bekerja menghambat aktivitas enzim
siklooksigenase yang berperan dalam metabolisme asam arakidonat
menjadi prostaglandin yang merupakan salah satu mediator
inflamasi (Kertia, 2009). Natrium diklofenak merupakan turunan
fenilasetat yang daya antiradangnya paling kuat dengan efek
samping yang kurang dibandingkan dengan obat lainnya (seperti
indometasin, piroksikam) (Tjay, 2002). Absorpsi obat ini melalui
saluran cerna berlangsung cepat dan terikat 99% pada protein
plasma dengan jumlah obat yang mengalami efek lintas pertama
sebesar 40-50%. Walaupun waktu paruh singkat yakni 1-3 jam, Na
diklofenak diakumulasi di cairan sinovilia yang menjelaskan efek
terapi di sendi jauh lebih panjang dari waktu paruh obat tersebut.
Efek samping yang lazim terjadi ialah mual, gastritis, eritema kulit,
dan sakit kepala. Dosis orang dewasa 100-500 mg sehari terbagi
dua atau tiga dosis (Gunawan, 2008).
2.10 Uji Antiinflamasi
Beberapa metode in vitro dapat digunakan dalam mengetahui potensi
atau aktivitas antiinflamasi dari suatu obat, kandungan kimia dan preparat
herbal. Teknik-teknik yang bisa digunakan antara lain adalah pelepasan
fosforilasi oksidatif (ATP biogenesis terkait dengan respirasi),
penghambatan denaturasi protein, stabilisasi membran eritrosit, stabilisasi
membran lisosomal, tes fibrinolitik dan agregasi trombosit (Oyedapo et al.,
2010). Selain itu uji antiinflamasi secara in vitro juga bisa dilakukan
dengan melihat efek inhibisi pada siklooksigenase menggunakan kit
UIN Syarif Hidayatullah Jakarta
Dalam pengembangan AINS, prinsip denaturasi dalam uji
antiinflamasi sering digunakan seperti pada uji antiinflamasi dengan
albumin telur (Chandra, 2012) dan uji dengan bovine serum albumin
(BSA) (Williams et al., 2008). Denaturasi protein pada jaringan adalah
salah satu penyebab penyakit inflamasi dan atritis. Produksi dari
antigen-auto pada penyakit atritis dapat mengakibatkan denaturasi protein secara in
vivo. Oleh karena itu, penggunaan suatu agen tertentu yang bisa mencegah
denaturasi protein akan bermanfaat pada pengembangan obat antiinflamasi
(Chatterjee et al., 2012).
Denaturasi protein adalah sebuah proses dimana protein kehilangan
struktur tersier dan struktur sekunder oleh senyawa eksternal, seperti asam
kuat atau basa kuat, garam anorganik terkonsentrasi, pelarut organik, dan
pemanasan. Pada umumnya protein kehilangan fungsi biologisnya ketika
didenaturasi. Misalnya, enzim kehilangan aktivitas mereka karena substrat
tidak dapat lagi mengikat pada gugus aktifnya (Verma et al., 2011).
Beberapa AINS seperti indometasin, ibufenak, asam flufenamik, dan
asam salisilat memiliki kemampuan dalam mencegah denaturasi BSA yang
dipanaskan pada pH patologis yakni 6,2-6,5. Selain itu beberapa ekstrak
dan komponen murni tumbuhan seperti ekstrak Boehmeria jamaicensis
(Urb), fenil propanoid, eugenol, polisulfid, dibenzil trisulfid dapat
menghambat denaturasi BSA, memiliki aktivitas sebagai antioksidan dan
merupakan kandidat obat antiinflamasi. Pada uji BSA, jika senyawa
sampel menghambat denaturasi dengan persen inhibisi > 20% maka
dianggap memiliki aktivitas antiinflamasi dan layak untuk dikembangkan
lebih lanjut (Williams et al., 2008).
2.10.1 Bovine Serum Albumine (BSA)
Albumin memiliki berat molekul relatif rendah, yang larut
dalam air, mudah mengkristal, dan mengandung asam amino.
BSA adalah rantai polipepetida tunggal yang terdiri dari sekitar
UIN Syarif Hidayatullah Jakarta
mengandung 17 jembatan rantai disulfida dan 1 kelompok
sulfihidril. Serbuk BSA disimpan pada suhu 2-8oC. Stabilitas
larutan BSA sangat baik. Bahkan, albumin sering digunakan
sebagai stabilisator untuk protein terlarut lainnya (misalnya,
enzim labil). Namun, albumin mudah digumpalkan oleh
pemanasan. Ketika dipanaskan sampai 50oC atau di atasnya,
albumin cukup pesat membentuk agregat hidrofobik yang tidak
kembali ke monomer pada saat pendinginan. Pada suhu yang
lebih rendah agregasi juga terjadi, tetapi pada tingkat yang relatif
UIN Syarif Hidayatullah Jakarta 3.1 Tempat dan Waktu Penelitian
3.1.1 Tempat
Penelitian ini dilaksanakan di Laboratorium Obat dan Pangan
Halal, Laboratorium Kimia Obat, dan Laboratorium Farmakognosi
dan Fitokimia, Program Studi Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan UIN Syarif Hidayatullah Jakarta.
3.1.2 Waktu
Penelitian ini dilaksanakan pada bulan November 2014 sampai
dengan Juni 2015.
3.2 Alat dan Bahan
3.2.1 Alat
Digital water bath (SB-100 Eyela), spektrometri IR (Shimadzu),
spektrofotometer UV-Vis (Hitachi), Spektrometri 1H-NMR (500 Hz,
JEOL), Differential Scanning Calorimeter (Shimadzu), refrigerator,
Gas Chromatography Mass Spectrometer (GCMS QP2010
Shimadzu), vacuum rotary evaporator (SB-1000 Eyela), timbangan
analitik, Plat aluminium TLC silica gel 60 F254 (Merck),
microwave, erlenmeyer, gelas piala, rak, labu reaksi, statif, penangas,
corong, pipet eppendorf, blender, termometer, chamber KLT,
mikropipet, batang pengaduk, pinset, spatula, pH meter, pengaduk
magnetik, kertas saring, kapas, aluminium foil, vial, dan botol.
3.2.2 Bahan
Senyawa etil p-metoksisinamat yang merupakan isolat dari
tanaman kencur (Kaempferia galanga L.), natrium hidroksida
(Merck), asam klorida 15%, asam nitrat p.a (JT Baker), asam sulfat
98% (Merck), Bovine Serum Albumin (Sigma), silika gel 60
(0,063-0,200 mm) (Merck), metanol p.a (Merck), etanol p.a (Merck) dan
UIN Syarif Hidayatullah Jakarta
natrium klorida (Merck), 1-butanol (Merck). Pelarut dan bahan
pembantu lain seperti aquades, etil asetat, n-heksan, metanol, dan air
es.
3. 3 Prosedur Penelitian
3.3.1 Modifikasi Senyawa Asam p-metoksisinamat
a. Hidrolisis Etil p-metoksisinamat
Metode hidrolisis etil p-metoksisinamat mengacu pada cara
kerja yang telah dilakukan oleh Mufidah (2014) dengan
modifikasi. Sebanyak 1,5 g (0,036 mol) NaOH dilarutkan dengan
100 mL etanol p.a dalam gelas kimia dengan pengadukan
menggunakan pengaduk magnetik sambil dipanaskan di atas hot
plate dengan suhu 60-70oC. Kemudian ditambahkan senyawa
EPMS sebanyak 5 g (0,024 mmol) ke dalamnya. Proses hidrolisis
dilakukan selama 3 jam. Pengecekan reaksi dilakukan dengan
menggunakan KLT dengan eluen heksan-etil asetat (4:1). Hasil
reaksi dilarutkan dengan 200 mL aquades hingga larut sempurna,
kemudian ditambahkan 15% HCl untuk membentuk endapan
hingga tidak ada lagi endapan putih yang terbentuk atau pH filtrat
mencapai 4. Setelah itu dilakukan penyaringan dengan kertas
saring untuk mendapatkan endapan/residu tersebut. Residu yang
didapatkan merupakan senyawa hasil hidrolisis yang kemudian
dikeringanginkan.
b. Nitrasi Asam p-metoksisinamat
Metode nitrasi mengacu pada cara kerja yang telah
dilakukan oleh Bose (2006) dengan modifikasi. Sebanyak 2,5
gram (0,014 mol) APMS dilarutkan dengan 10 mL (0,22 mol)
HNO3 65% yang telah didinginkan dalam erlenmeyer yang berada
dalam gelas kimia berisi es sehingga membentuk ice jacket.
Kemudian diiradiasi dengan menggunakan microwave oven 450
watt selama 2 menit. Setelah itu ditambahkan 100 mL aquades