PENGARUH EKSTRAK DAUN KUMIS KUCING (
Orthosiphon
stamineus
Benth) DAN BUNGA KENOP (
Gomphrena globosa
L.)
TERHADAP PROLIFERASI SEL LIMFOSIT TIKUS
ZILFIA NORA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis Pengaruh Ekstrak Daun Kumis Kucing (Orthosiphon stamineus Benth) dan Bunga Kenop (Gomphrena globosa
L.) terhadap Proliferasi Sel Limfosit Tikus adalah karya saya sendiri dibawah bimbingan Prof. Dr. Ir. Deddy Muchtadi, MS dan Dr. Ir. Nurheni Sri Palupi, M.Si dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, April 2007
Zilfia Nora
ABSTRAK
ZILFIA NORA. Pengaruh Ekstrak Daun Kumis Kucing (Orthosiphon stamineus Benth) dan Bunga Kenop (Gomphrena globosa L.) terhadap Proliferasi Sel Limfosit Tikus. Dibimbing oleh DEDDY MUCHTADI dan NURHENI SRI PALUPI.
Daun kumis kucing (Orthosiphon stamineus Benth) dan bunga kenop (Gomhprena globosa L) merupakan salah satu tumbuhan berkhasiat obat yang telah dimanfaatkan sejak lama dalam pengobatan tradisional. Selama ini penggunaan daun kumis kucing dan bunga kenop untuk pengobatan dilakukan berdasarkan pengalaman secara empiris selain itu belum banyak penelitian yang dilakukan terhadap dua komoditas tersebut. Penelitian ini bertujuan untuk menentukan metode pengeringan terbaik dalam pembuatan bubuk daun kumis kucing dan bunga kenop dan mengetahui pengaruh ekstrak kedua produk ini terhadap proliferasi sel limfosit secara in vivo, in vitro dan in vivo-in vitro.
Penelitian ini terdiri dari tiga tahap; (1) tahap pertama adalah pembuatan bubuk daun kumis kucing dan bunga kenop, (2) tahap kedua adalah ekstraksi daun kumis kucing dan bunga kenop dengan parameter analisis sifat fisik (warna bubuk dan ekstrak secara visual) dan kimia (total fenol, aktivitas antioksidan dan proksimat), dan (3) tahap ketiga adalah pengujian biologis dengan parameter analisis pengaruh minuman ekstrak bubuk daun kumis kucing dan bunga kenop terhadap; (a) Berat badan tikus, (b) Proliferasi sel limfosit secara in vivo, (c) Proliferasi sel limfosit secara in vitro, dan (d) Proliferasi sel limfosit secara in vivo-in vitro.
Metode terbaik untuk pengeringan daun kumis kucing adalah pengeringan matahari (2-3 hari) dengan kadar total fenol ekstrak bubuk sebesar 22.74±0.03 mg/g berat kering dan Trolox Equivalent Antioxidant Capacity (TEAC) sebesar 1364.88±0.01 mM trolox/g berat kering. Sementara metode terbaik untuk pengeringan bunga kenop adalah pengeringan oven 50oC (10-12 jam) dengan kadar total fenol (3.08±0.02 mg/g berat kering) dan TEAC (110.46±0.03 mM trolox/g berat kering) lebih rendah daripada daun kumis kucing. Proses pengeringan ternyata dapat menurunkan kadar total fenol dan aktivitas antioksidan kedua produk tersebut dibandingkan bahan segar.
Proliferasi limfosit secara in vivo-in vitro menunjukkan bahwa ekstrak daun kumis kucing dapat meningkatkan proliferasi sel limfosit tikus, namun respon proliferasi limfosit yang tertinggi ditunjukkan kelompok tikus yang mendapat perlakuan in vivo dosis 0.4 g/ekor/hari. Pemberian ekstrak bubuk daun kumis kucing secara in vitro dari dosis 0.6, 1.2, 2.4, 4.8, 9.6, 19.2 dan 38.4 mg/ml medium RPMI meningkatkan IS sebesar 0.99±0.09, 1.24±0.20, 1.29±0.05, 1.89±0.15, 2.86±0.75, 3.04±0.14 dan 4.47±0.46, sedangkan kelompok tikus yang diberi minuman ekstrak dosis 0.8 g/ekor/hari peningkatan IS lebih rendah yaitu sebesar 0.92±0.11, 1.02±0.06, 1.12±0.06, 1.30±0.11, 1.74±0.10, 2.26±0.17 dan 3.27±0.12.
PENGARUH EKSTRAK DAUN KUMIS KUCING (
Orthosiphon
stamineus
Benth) DAN BUNGA KENOP (
Gomphrena globosa
L.)
TERHADAP PROLIFERASI SEL LIMFOSIT TIKUS
ZILFIA NORA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pengaruh Ekstrak Daun Kumis Kucing (Orthosiphon stamineus
Benth) dan Bunga Kenop (Gomphrena globosa L.) terhadap Proliferasi Sel Limfosit Tikus
Nama : Zilfia Nora NRP : F251030081
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Deddy Muchtadi, MS Dr. Ir. Nurheni Sri Palupi, M.Si
Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga tesis yang berjudul ”Pengaruh Ekstrak Daun Kumis Kucing (Orthosiphon stamineus Benth) dan Bunga Kenop (Gomphrena globosa L.) terhadap Proliferasi Sel Limfosit Tikus” ini dapat diselesaikan. Penelitian ini dilaksanakan sejak bulan Mei 2005 sampai Januari 2006.
Terima kasih penulis ucapkan kepada Prof. Dr. Ir. Deddy Muchtadi, MS dan Dr. Ir. Nurheni Sri Palupi, M.Si selaku pembimbing, atas segala bimbingan dan arahannya. Ucapan terimakasih disampaikan juga kepada Dr. Ir. Endang Prangdimurti, M.Si selaku dosen penguji yang telah meluangkan waktu untuk memberikan kritik dan saran demi kesempurnaan tesis ini. Di samping itu, penghargaan penulis sampaikan kepada Ir. Didah Nur Faridah, M.Si selaku ketua tim Research Grant Hibah Kompetisi B tahun 2005 atas segala bantuannya selama pelaksanaan dan pendanaan penelitian ini.
Ungkapan terima kasih tak terhingga penulis haturkan kepada Papa, Mama, Uni dan adik-adik atas kasih sayang, untaian doa dan dukungannya. Ucapan terimakasih disampaikan kepada “my best friends” (Diah & mas Ropi, Rina, Santi & mas Ari, Bu Epi & keluarga) atas kebersamaan, bantuan dan dorongan semangatnya selama penelitian dan penulisan tesis ini.
Terima kasih juga untuk rekan-rekan di Program Studi Ilmu Pangan khususnya angkatan 2003 atas kebersamaan dan bantuannya selama ini. Semua laboran di Departemen Ilmu dan Teknologi Pangan yang telah banyak membantu serta Mbak Bamby, Inggrid dan Andreas (tim kumis kucing dan bunga kenop) atas bantuan dan kerjasamanya selama penelitian ini. Semoga karya ilmiah ini bermanfaat.
Bogor, April 2007
RIWAYAT HIDUP
Penulis dilahirkan di Batusangkar, Kabupaten Tanah Datar, Sumatera Barat pada tanggal 10 November 1980 dari ayah Fauzi Djalaludin, S.Sos dan Ibu Yusmaniar. Penulis merupakan putri kedua dari empat bersaudara.
DAFTAR ISI
Pengeringan Bahan Pangan ... 11
Polifenol sebagai Antioksidan... 13
Respon Imun ... 14
Limfosit ... 15
Proliferasi Limfosit ... 17
Kultur Sel Limfosit ... 19
METODOLOGI PENELITIAN ... 22
Bahan dan Alat ... 22
Metode Penelitian ... 23
Tahap 1 Pembuatan Bubuk Daun Kumis Kucing dan Bunga Kenop ... 23
Tahap 2 Ekstraksi Daun Kumis Kucing dan Bunga Kenop dengan Parameter Analisis Sifat Fisik dan Kimia sehingga Diperoleh Ekstrak Terbaik ... 25
Tahap 3 Pengujian Biologis ... 30
Rancangan Percobaan ... 39
HASIL DAN PEMBAHASAN ... 40
Karakteristik Fisik Daun Kumis Kucing dan Bunga Kenop ... 40
Karakteristik Kimia Daun Kumis Kucing dan Bunga Kenop ... 44
SIMPULAN DAN SARAN ... 67
Simpulan ... 67
Saran ... 68
DAFTAR PUSTAKA ... 69
DAFTAR TABEL
Halaman
1 Komposisi dan jumlah normal sirkulasi masing- masing elemen
seluler pada darah manusia, mencit dan tikus ... 16 2 Bahan-bahan yang ditanam ke dalam kultur sel ... 37 3 Dosis ekstrak daun kumis kucing dan bunga kenop dari
konsumsi normal perhari ... 38 4 Hasil analisa proksimat bubuk daun kumis kucing kering matahari
dan bunga kenop kering oven... 51 5 Jumlah ekstrak yang diminum dari rata-rata jumlah konsumsi
DAFTAR GAMBAR
Halaman
1 Tanaman kumis kucing (Orthosiphon stamineus Benth) ... 5
2 Tanaman bunga kenop (Gomphrena globosa L.) ... 8
3 Struktur kimia komponen gomphrenin dan isogomphrenin ... 10
4 Diagram alir tahapan penelitian ... 24
5 Tahapan pengujian proliferasi sel limfosit secara in vivo, in vitro dan in vivo-in vitro ... 31
6 Ekstrak bubuk minuman perlakuan ... 32
7 Bubuk daun kumis kucing... 40
8 Ekstrak bubuk daun kumis kucing ... 42
9 Bubuk bunga kenop... 43
10 Ekstrak bubuk bunga kenop ... 43
11 Total fenol ekstrak daun kumis kucing dan bunga kenop segar, bubuk kering matahari dan kering oven ... 44
12 Aktivitas antioksidan ekstrak daun kumis kucing dan bunga kenop segar, bubuk kering matahari dan kering oven ... 47
13 Tikus Spraque dawley yang diberi minum ekstrak bubuk daun kumis kucing dan bunga kenop ... 52
14 Pertambahan berat badan selama masa perlakuan pada setiap kelompok tikus ... 53
15 Peningkatan indeks stimulasi (IS) proliferasi limfosit tikus (in vivo) yang diberi minuman ekstrak bubuk daun kumis kucing dan bunga kenop dengan berbagai dosis selama 8 minggu... 55
16 Peningkatan indeks stimulasi (IS) proliferasi limfosit tikus secara in vitro dengan berbagai dosis ekstrak daun kumis kucing dan bunga kenop. PWM, Con-A dan LPS adalah kontrol untuk stimulasi sel T dan B ... 59
17 Peningkatan indeks stimulasi (IS) proliferasi limfosit tikus setelah perlakuan secara in vivo selama 2 bulan dan secara in vitro dengan berbagai dosis ekstrak daun kumis kucing ... 62
DAFTAR LAMPIRAN
Halaman
1 Perhitungan dosis dasar jumlah penggunaan daun kumis kucing
dan bunga kenop segar untuk membuat ekstrak ... 78 2 Perhitungan dosis dasar jumlah penggunaan bubuk daun
kumis kucing dan bunga kenop kering matahari dan oven
untuk membuat ekstrak ... 79 3 Komposisi Ransum Tikus ... 80 4 Perhitungan dosis ekstrak bubuk daun kumis kucing sebagai
minuman untuk tikus percobaan ... 81 5 Perhitungan dosis ekstrak bubuk bunga kenop sebagai minuman
untuk tikus percobaan ... 83 6 Konversi dosis antar spesies untuk penetapan dosis pada
suatu spesies hewan/manusia ... 85 7 Komposisi media RPMI-1640 ... 86 8 Perhitungan konsentrasi ekstrak daun kumis kucing dan bunga
kenop yang digunakan dalam kultur sel limfosit tikus ... 87 9 Absorbansi dan kurva standar asam tanat ... 89 10 Absorbansi dan kurva standar trolox ... 90 11a Perbandingan total fenol pada 0 dan 24 jam antara ekstrak daun
kumis kucing segar, pengeringan matahari dan pengeringan oven ... 91 11b Analisis sidik ragam kandungan total fenol ekstrak daun kumis
kucing segar, bubuk kering matahari dan oven selama penyimpanan .... 91 11c Uji beda rataan untuk membandingkan perlakuan lamanya
penyimpanan terhadap total fenol daun kumis kucing ... 91 12a Perbandingan total fenol pada 0 dan 24 jam antara ekstrak
bunga kenop segar, pengeringa n matahari dan pengeringan oven ... 92 12b Analisis sidik ragam kandungan total fenol ekstrak bunga
kenop segar, bubuk kering matahari dan oven selama penyimpanan ... 92 12c Uji beda rataan untuk membandingkan perlakuan lamanya
penyimpanan terhadap total fenol bunga kenop ... 92 13a Perbandingan aktivitas antioksidan pada 0 jam dan 24 jam
antara ekstrak daun kumis kucing segar, pengeringan
matahari dan pengeringan oven ... 93 13b Analisis sidik ragam aktivitas antioksidan daun kumis
13c Uji beda rataan untuk membandingkan perlakuan lamanya
penyimpanan terhadap aktivitas antioksidan daun kumis kucing ... 93 14a Perbandingan aktivitas antioksidan pada 0 dan 24 jam antara ekstrak
bunga kenop segar, pengeringan matahari dan pengeringan oven ... 94 14b Analisis sidik ragam aktivitas antioksidan bunga kenop selama
penyimpanan ... 94 14c Uji beda rataan untuk membandingkan perlakuan lamanya
penyimpanan terhadap aktivitas antioksidan bunga kenop ... 94 15a Data perhitungan pertambahan berat badan dan jumlah
konsumsi minuman perlakuan pada tikus ... 95 15b Analisis sidik ragam pengaruh konsumsi minuman perlakuan
terhadap pertambahan berat badan tikus ... 96 15c Uji beda rataan untuk membandingkan perlakuan
pemberian minuman terhadap pertambahan berat badan tikus ... 96 16a Jumlah sel limfosit yang diberi perlakuan in vivo selama 8 minggu ... 97 16b Analisis sidik ragam proliferasi sel limfosit secara in vivo ... 97 16c Uji beda rataan perlakuan terhadap absorbansi dan indeks stimulasi
proliferasi sel limfosit secara in vivo ... 97 17a Indeks stimulasi proliferasi sel limfosit in vitro ... 98 17b Hasil analisis ragam pengaruh ekstrak daun kumis kucing
terhadap proliferasi sel limfosit secara in vitro ... 98 17c Hasil analisis beda Duncan pengaruh ekstrak daun kumis kucing
terhadap proliferasi sel limfosit secara in vitro ... 99 17d Hasil analisis ragam pengaruh ekstrak bunga kenop terhadap
proliferasi sel limfosit secara in vitro ... 99 17e Hasil analisis ragam pengaruh mitogen terhadap proliferasi
sel limfosit secara in vitro ... 99 18a Indeks stimulasi proliferasi sel limfosit secara in vivo-in vitro
dengan penambahan ekstrak daun kumis kucing pada kelompok tikus yang diberi minuman ekstrak bubuk daun kumis kucing
dosis 0.4 dan 0.8 g/ekor/hari ... 100 18b Hasil analisis ragam pengaruh ekstrak daun kumis kucing
terhadap proliferasi sel limfosit secara in vivo-in vitro pada kelompok tikus yang diberi minuman ekstrak bubuk daun
kumis kuc ing dosis 0.4 g/ekor/hari ... 100 18c Hasil analisis beda Duncan pengaruh ekstrak daun kumis kucing
terhadap proliferasi sel limfosit secara in vivo-in vitro pada kelompok tikus yang diberi minuman ekstrak bubuk daun
18d Hasil analisis ragam pengaruh ekstrak daun kumis kucing terhadap proliferasi sel limfosit secara in vivo-in vitro pada kelompok tikus yang diberi minuman ekstrak bubuk daun
kumis kuc ing dosis 0.8 g/ekor/hari ... 101 18e Hasil analisis beda Duncan pengaruh ekstrak daun kumis kucing
terhadap proliferasi sel limfosit secara in vivo-in vitro yang diberi minuman ekstrak bubuk daun kumis kucing
dosis 0.8 g/ekor/hari ... 101 18f Hasil analisis ragam pengaruh mitogen terhadap proliferasi
sel limfosit in vivo-in vitro pada kelompok tikus yang diberi minuman ekstrak bubuk daun kumis kucing
dosis 0.4 g/ekor/hari ... 102 18g Hasil analisis ragam pengaruh mitogen terhadap proliferasi
sel limfosit secara in vivo-in vitro pada kelompok tikus yang diberi minuman ekstrak bubuk daun kumis kucing
dosis 0.8 g/ekor/hari ... 102 19a Indeks stimulasi proliferasi sel limfosit secara in vivo-in vitro
dengan penambahan ekstrak bunga kenop pada kelompok tikus yang diberi minuman ekstrak bubuk bunga kenop
dosis 0.6 dan 0.8 g/ekor/hari ... 103 19b Hasil analisis ragam pengaruh ekstrak bunga kenop terhadap
proliferasi sel limfosit secara in vivo-in vitro pada kelompok tikus yang diberi minuman ekstrak bubuk bunga kenop
dosis 0.6 g/ekor/hari ... 103 19c Hasil analisis beda Duncan pengaruh ekstrak bunga kenop
terhadap proliferasi sel limfosit secara in vivo-in vitro pada kelompok tikus yang diberi minuman ekstrak bubuk bunga kenop
dosis 0.6 g/ekor/hari ... 104 19d Hasil analisis ragam pengaruh ekstrak bunga kenop terhadap
proliferasi sel limfosit secara in vivo-in vitro pada kelompok tikus yang diberi minuman ekstrak bubuk bunga kenop
dosis 1.2 g/ekor/hari ... 104 19e Hasil analisis ragam pengaruh mitogen terhadap proliferasi
sel limfosit secara in vivo-in vitro pada kelompok tikus yang diberi minuman ekstrak bubuk bunga kenop
dosis 0.6 g/ekor/hari ... 104 19f Hasil analisis ragam pengaruh mitogen terhadap proliferasi
sel limfosit secara in vivo-in vitro pada kelompok tikus yang diberi minuman ekstrak bubuk bunga kenop
PENDAHULUAN
Latar Belakang
Pentingnya hidup sehat dengan bahan alami mendorong meningkatnya kesadaran masyarakat untuk menggunakan produk-produk yang alami. Hal ini seiring dengan berkembangnya pemikiran “back to nature”. Pengobatan modern mengakibatkan ketergantungan yang tinggi bagi penderita terhadap obat-obat sintetis. Disamping itu mahalnya harga obat sintetis dan bahaya yang ditimbulkannya pada pemakaian dalam jangka panjang membuat banyak orang beralih menggunakan tanaman obat untuk terapi pengobatan penyakit tertentu.
Kondisi tersebut mendorong berkembangnya penelitian terhadap tanaman obat terutama pada segi farmakologi maupun fitokimia berdasarkan penggunaannya oleh sebagian masyarakat dengan khasiat yang teruji secara empiris. Berdasarkan data Badan Kesehatan Dunia (WHO) sekitar 80% penduduk dunia mengandalkan obat tradisional untuk pertolongan pertama dengan pengobatan menggunakan ekstrak tanaman atau komponen bioaktifnya (Bruneton 1995).
Indonesia memiliki beragam tanaman termasuk didalamnya tanaman yang dapat digunakan untuk pengobatan. Kekayaan sumberdaya hayati Indonesia kedua terbesar di dunia setelah Brazil. Berdasarkan Mahendra dan Fauzi (2005), tercatat sekitar 30.000 jenis tanaman berbunga dan sekitar 9.606 spesies diketahui berkhasiat obat, 940 jenis tanaman obat sudah ditemukan tetapi baru 80 jenis yang sudah diproduksi untuk pembuatan obat.
batuk, obat sesak nafas (asma), peluruh dahak (ekspektoran), obat radang mata, disentri, panas pada anak, penambah nafsu makan dan bronkhitis kronis. Bahan-bahan tersebut cukup potensial unt uk dikembangkan menjadi pangan fungsional. Penelitian sebelumnya terhadap beberapa tanaman obat telah membuktikan bahwa beberapa tanaman obat seperti sari jahe, ekstrak cincau hijau, ekstrak tanaman secang memiliki khasiat dalam meningkatkan respon imun tubuh terhadap penyakit. Sari jahe mempunyai potensi menurunkan stres oksidatif dan melindungi sel imun dari stres oksidatif, senyawa oleoresin, gingerol dan shagoal dari rimpang jahe (Zingiber officinale Roscoe) memberi efek proteksi terhadap limfosit (Nurrahman 1998; Tejasari 2000). Pandoyo (2000) melaporkan ekstrak air cincau hijau (Cyclea barbata L. Miers) dan ekstrak heksan akar cenderung memperlihatkan pengaruh imunostimulan pada konsentrasi rendah. Selanjutnya Puspaningrum (2003) menambahkan bahwa ekstrak tanaman secang (Caesalpinia sappan Linn) tidak bersifat toksik terhadap sel limfosit dan sel kanker K-562, bahkan dapat menstimulasi sel pada konsentrasi tinggi.
Daun kumis kucing (Orthosiphon stamineus Benth) dan bunga kenop (Gomphrena globosa L) merupakan salah satu tumbuhan berkhasiat obat yang banyak terdapat di Indonesia dan telah dimanfaatkan sejak lama dalam pengobatan tradisional. Potensi daun kumis kucing dan bunga kenop dengan senyawa bioaktifnya untuk menstimulasi peningkatan respon imun pada manusia perlu diteliti lebih lanjut. Kemampuan sel imun seperti limfosit untuk berproliferasi atau membentuk klon secara tidak langsung menunjukkan tingkat kekebalan tubuh seseorang terhadap penyakit. Salah satu cara pengujian yang dapat dilakukan adala h dengan mengkultur sel limfosit. Oleh karena itu perlu dilakukan penelitian mengenai “Pengaruh Ekstrak Daun Kumis Kucing (Orthosiphon stamineus Benth) dan Bunga Kenop (Gomphrena globosa L.) terhadap Proliferasi Sel Limfosit Tikus ”.
Tujuan Penelitian Penelitian ini bertujuan untuk:
2. Mengetahui pengaruh ekstrak daun kumis kucing dan bunga kenop terhadap proliferasi sel limfosit tikus secara in vivo, in vitro dan in vivo-in vitro
sehingga diketahui dosis konsumsi yang efektif.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai sifat imunomodulator ekstrak daun kumis kucing dan bunga kenop sehingga berpotensi dikembangkan sebagai minuman yang dapat meningkatkan sistem imun.
Hipotesis Penelitian Hipotesis yang diajukan dalam penelitian ini adalah:
1. Proses pengeringan dapat menurunkan kandungan senyawa fenolik daun kumis kucing dan bunga kenop.
TINJAUAN PUSTAKA
Botani Kumis Kucing (Orthosiphon stamineus Benth)
Kumis kucing (Orthosiphon stamineus Benth) merupakan salah satu tanaman obat-obatan yang sudah terkenal di dalam dan di luar negeri. Tanaman ini diduga berasal dari daerah Afrika, kemudian menyebar ke wilayah Georgia (Kaukasus), Kuba, Asia dan Australia. Penyebaran kumis kucing di Asia meliputi Indonesia, India, Malaysia, Vietnam dan Thailand (Mahendra dan Fauzi 2005).
De Padua et al (1999) menjelaskan bahwa kumis kucing tumbuh di Pulau Jawa sejak tahun 1928. Selanjutnya tanaman ini menyebar ke pulau-pulau lain seperti Sumatera dan Sulawesi. Sentra produksi kumis kucing yaitu Jawa Tengah (Ambarawa, Kopeng dan Blora), Jawa Barat (Sukabumi dan Bogor), Jawa Timur, Sumatera Barat, Sumatera Utara, Aceh dan Sulawesi Utara.
Kumis kucing termasuk tanamantahunan yang tumbuh pada ketinggian 100-150 cm. Batang berbentuk persegi empat agak beralur, berwarna hijau keunguan, bercabang dengan akar yang kuat. Sedangkan bentuk daun tunggal, bundar telur, elips atau memanjang, berambut halus, tepi bergerigi, ujung dan pangkal runcing, tipis dengan panjang 2-10 cm, lebar 1-5 cm dan berwarna hijau. Tanaman ini dapat tumbuh di dataran rendah hingga dataran tinggi. Bagian tanaman yang dipanen untuk dimanfaatkan sebagai obat adalah daunnya.
Klon kumis kucing yang ditanam di Indonesia adalah klon berbunga putih dan ungu seperti pada Gambar 1. Menurut Dalimartha (2000) dan Anonim (2005a) bunga kumis kucing berupa tandan yang keluar di ujung cabang, berwarna ungu pucat, putih dan ada juga yang biru, benang sari lebih panjang dari tabung bunga. Buah berbentuk kotak, bulat telur dan berwarna hijau setelah tua berwarna cokelat. Bijinya kecil dan berwarna hitam.
(a) (b)
Gambar 1 Tanaman kumis kucing (Orthosiphon stamineus Benth); (a) Kumis kucing berbunga putih, (b) Kumis kucing berbunga ungu
(Anonim 2005b).
Kandungan Kimia Daun Kumis Kucing
Dalimartha (2000) menjelaskan bahwa daun kumis kucing mengandung banyak komponen bioaktif seperti ortosiphonin glikosida (glikosides orthosiphonins), polifenol (polyphenols), minyak atsiri (atsiri oil), minyak lemak (fat oil), saponin, sapofonin, garam kalium (potassium salt (0.6-3.5%)), mioinositol, dan sinensetin. Ditambahkan oleh de Padua et al (1999), kumis kucing mengandung 12% mineral dengan kandungan paling tinggi potassium (600-700 mg per 100 g daun segar), 0.2% lipophilic flavones, sinensetin, flavonol glicosides, turunan
caffeic acid (terutama rosmarinic acid dan 2,3-dicaffeoyltartaric acid), inositol,
phytosterol (β-sitosterol), saponin dan 0.7% essential oil.
Olah et al (2003) menemukan komponen utama daun dan ekstrak alkohol kumis kucing adalah senyawa polifenol aktif polymethoxylated flavonoid dan turunan caffeic acid. Identifikasi lebih lanjut menunjukkan adanya kandungan
caffeic acid, cichoric acid, rosmarinic acid, sinensetine dan eupatorin. Menurut Loon et al (2005), penentuan tiga jenis flavonoid dari kumis kucing di dalam plasma mencit dengan metode HPLC dan dideteksi dengan sinar ultraviolet menghasilkan sinensetin, eupatorin dan 3’-hydroxy-5,6,7,4’ tetramethoxyflavone.
(orthochromene A), dua isopimarane baru jenis diterpenes (orthosiphonone A dan
orthosiphonone B) dan dua pimarane baru jenis diterpenes (neoorthosiphol A dan
neoorthosiphol B) serta delapan senyawa lainnya yang telah diketahui dan ditemukannya senyawa utama methylripariochromene dari air rebusan daun kumis kucing. Schmidt dan Bos (1986) menambahkan bahwa minyak essensial (essential oil) dari daun kumis kucing mengandung senyawa β-caryophyllene, β -elemene, α-humulene, β-bourbonene, 1-octen-3-ol dan caryophyllene oxide.
Khasiat Daun Kumis Kucing
Daun kumis kucing berkhasiat sebagai peluruh urine (diuretik), antiradang (anti-inflammasi), menghilangkan panas dan lembab, serta menghancurkan batu kandung kemih (Dalimartha 2000). Menurut Anonim (2000) dalam pengobatan tradisional daun kumis kucing dipercaya memiliki sifat antialergi, antihipertensi, anti-inflammasi dan diuretik serta digunakan juga untuk mengobati gout, diabetes dan rematik.
Van deer Veen et al (1979) melaporkan bahwa senyawa kalium (potassium), inositol dan lipophilic flavones yang terdapat pada daun kumis kucing mempunyai sifat diuretik dan bakteriostatik. Sedangkan de Padua et al (1999) menyatakan sifat diuretik daun kumis kucing diberikan oleh senyawa kalium (potassium), inositol dan 3’-hydroxy-5,6,7,4’ tetramethoxyflavone, sifat anti bakteri karena adanya senyawa turunan caffeic acid dan saponin serta lipophilic flavonoid
sebagai antitumor dan anti- inflammasi yang menghambat proses cyclo-oxygenase
dan lipoxygenase.
Khasiat daun kumis kucing sebagai diuretikum dilaporkan oleh Sari (1985), efek maksimal terhadap sifat diuretikum dari rata-rata 1 ml infus dengan kandungan 5%, 10% dan 20% daun kumis kucing berturut-turut adalah 275.22%; 376.64% dan 646.12%. Penelitian lebih lanjut pada kelinci membuktikan daun kumis kucing dapat mengatasi gangguan saluran urin karena adanya kandungan
kalium yang berfungsi sebagai pelarut batu ginjal dan batu saluran kemih.
serta ekskresi sodium dari kandung kemih. Adapun Garnadi (1998) menambahkan bahwa potensi diuretikum daun kumis kucing lebih baik dari pada batangnya dan daun muda lebih efektif sebagai diuretikum dibandingkan daun tua. Selain itu Nirdnoy dan Muangman (1991) menyatakan bahwa penelitian farmakologis yang dilakukan terhadap responden sehat yang meminum teh kumis kucing dapat mencegah asam urat dan terbentuknya batu yang mengandung asam urat dalam kandung kemih.
Anonim (2000) menyatakan bahwa senyawa bioaktif sinensetin pada daun kumis kucing menunjukkan aktivitas antibakteri dengan konsentrasi terendah penghambatan (MIC/ Minimal Inhibitory Concentration) 7.8-23.4 mg/ml. Hal ini didukung oleh Sofiani (2003) yang melaporkan bahwa senyawa sinensetin daun kumis kucing memberikan daya hambat lebih tinggi terhadap bakteri S. epidermis dari pada E. coli. Ditambahkan de Padua et al (1999) bahwa kandungan sinensetin yang tertinggi (0.4%) terdapat dalam daun kumis kucing tua dari bunga berwarna blue-violet dan yang terendah (0.1%) dalam daun kumis kucing muda dari bunga berwarna putih.
Yuvadee et al (1990) melakukan penelitian mengenai toksisitas (LD50) daun
kumis kucing, dimanapemberian dosis 1 g/kg berat badan dapat menjadi lethal untuk tikus dan mencit setelah satu injeksi intraperitoneal, tetapi tidak ditemukan adanya pengaruh yang mematikan atau merugikan dengan pemberian makan sampai 5 g/kg berat badan. Ini memperlihatkan bahwa daun kumis kucing mempunyai toksisitas yang rendah ketika diberikan secara oral pada hewan percobaan. Padilla et al (1996) menyatakan ekstrak air daun kumis kucing tidak toksik pada dosis 2000 mg/kg (2 g/kg). Selanjutnya Anonim (2002) menyatakan bahwa batas toksisitas akut
Orthosiphon stamineus dengan menggunakan dosis 5 g/kg berat badan selama 14 hari menunjukkan semua tikus Spraque Dawley tetap hidup.
Botani Bunga Kenop (Gomphrena globosa L.)
Gomphrena globosa merupakan salah satu jenis tanaman yang berasal dari famili Amaranthaceae. Tanaman ini banyak dijumpai di Panama dan Guatemala, tetapi di Indonesia juga telah banyak dibudidayakan. Nama daerah dari bunga kenop adalah bunga kenop, kembang puter, ratnapakaja (Sumatera dan Melayu), bunga kancing, adas-adasan (Jawa), taimantulu (Sulawesi) dan ratna (Bali) (Dalimartha 2000).
(a) (b)
(c) (d)
Gambar 2 Tanaman bunga kenop (Gomphrena globosa L.); (a) Bunga kenop putih, (b) Bunga kenop merah jambu, (c) Bunga kenop orange, dan (d) Bunga kenop merah tua keunguan (Anonim 2006).
rata, berwarna hijau, berambut kasar yang berwarna putih di permukaan atas dan berambut halus di permukaan bawah. Bunga tunggal dan berbentuk bulat seperti bola dengan beberapa warna seperti putih, merah jambu, orange, dan merah tua keunguan. Sedangkan buahnya kotak berbentuk segitiga yang dibungkus lapisan tipis berwarna putih dan berbiji satu (Gambar 2).
Kandungan Kimia Bunga Kenop
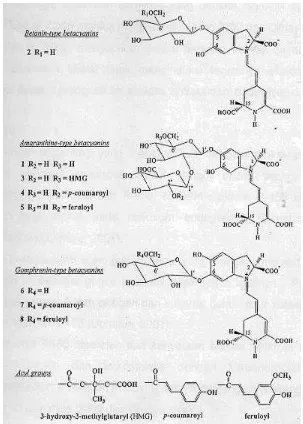
Bunga kenop memiliki kandungan kimia yang khas yaitu Gomphrenin I, Gomphrenin II, Gomphrenin III, Gomphrenin V, Gomphrenin VI, amaranthin, minyak atsiri, flavon, atau saponin (Dalimartha 2000). Cai et al (2001) melaporkan bahwa bunga Amaranthaceae banyak mengandung komponen pigmen alami betasianin. Pada bunga kenop kandungan betasianin sebesar 1.3 mg/g bunga segar. Betasianin ini terdiri dari komponen gomphrenin I (betanidin 6-O-ß-glukosida) sebesar 16.9%, isogomphrenin I (isobetanidin 6-O-ß-glukosida) sebesar 8.8%, gomphrenin II (betanidin 6-O-(6’-O-E-4-coumarooyl)-ß-glukosida) sebesar 11.1%, isogomphrenin II (isobetanidin 6-O-(6’-O-E-4-coumarooyl)-ß-glukosida sebesar 3.5%, gomphrenin III (betanidin 6-O-(6’-O-E-4-feruroyl)-ß-glukosida sebesar 40.8%, isogomphrenin III (isobetanidin 6-O-(6’-O-E-4-feruroyl)-ß-glukosida) sedangkan komponen yang paling sedikit adalah amaranthine. Struktur kimia gomphrenin disajikan pada Gambar 3.
Pigmen betasianin dikenal juga dengan nama betalain. Betalain adalah grup komponen warna yang mendekati warna visual flavono id yaitu kuning dan antosianin yaitu kemerah- merahan. Betalain terdapat juga pada buah kaktus, bunga bougenville dan amaranthus. Lebih kurang 70 jenis betalain yang telah dikenal dan semuanya mempunyai struktur yang sama yaitu 1,7-diazohepta-methyn (Cai etal 2001).
menambahkan bahwa betasianin merah (betanin dan amaranthin) bersifat tahan terhadap panas dalam sistem buffer, tetapi bersifat tidak stabil pada suhu diatas 40oC dan bersifat lebih stabil pada suhu 40oC tanpa adanya udara dan cahaya.
Gambar 3 Struktur kimia komponen gomphrenin dan isogomphrenin (Cai et al 2001).
Khasiat Bunga Kenop
Stintzing et al (2004) melakukan penelitian terhadap Amaranthus spinosus L., tanaman yang biasa digunakan sebagai obat di Afrika menunjukkan adanya kandungan betalain yang diidentifikasi sebagai amaranthin dan isoamaranthin. Selain itu tanaman ini juga mengandung hidroksisinamat, quersetin dan kaempferol glikosida yang kesemuanya merupakan senyawa fenolik. Kapiszewska et al (2005) melakukan pengujian terhadap kandungan polifenol Amaranthus sp. yang menunjukkan bahwa penambahan ekstrak Amaranthus sp. dengan konsentrasi polifenol sampai dengan 0.2 mug/ml dapat meningkatkan perlindungan terhadap stress oksidatif oleh H2O2 yang menginduksi kerusakan DNA dari limfosit.
Pengujian ekstrak air Amaranthus sp. terhadap sel splenosit mencit BALB/c menunjukkan kemampuan ekstrak ini untuk menstimulasi proliferasi sel splenosit. Sel B yang diisolasi dapat distimulasi juga oleh ekstrak ini. Pemurnian ekstrak air dari Amaranthus sp menghasilkan protein (GF1) dengan berat molekul 313 kDa. GF1 mempunyai aktivitas imunostimulasi 309 kali ekstrak air yang belum dimurnikan. Hasil penelitian ini menunjukkan bahwa ekstrak air Amaranthus sp
mempunyai aktivitas imunostimulasi yang secara langsung menstimulasi aktivitas proliferasi sel B dan proliferasi sel T secara in vitro (Lin et al 2005).
Pengeringan Bahan Pangan
Pengeringan adalah suatu cara untuk mengeluarkan atau menghilangkan sebagian besar air dari suatu bahan dengan menggunakan energi panas. Kandungan air bahan dikurangi sampai batas tertentu dimana mikroba tidak dapat tumbuh lagi pada bahan tersebut. Pengeringan mempunyai keuntungan yaitu bahan menjadi tahan lama disimpan dan volume bahan menjadi lebih kecil sehingga mempermudah dan menghemat ruang pengangkutan dan pengepakan (Muchtadi 1997). Pengembangan daun kumis kucing dan bunga kenop agar nilai ekonomisnya meningkat dapat dilakukan dalam bentuk produk teh daun kumis kumis kucing dan bunga kenop.
pada pH, waktu, kerja enzim, oksigen dan cahaya. Selain itu pengeringan dapat pula meningkatkan kualitas dan nilai nutrisi suatu produk pangan dan pakan seperti rasa yang lebih enak dan daya cerna serta perubahan metabolik yang meningkat.
Berbagai cara pengeringan telah banyak dilakukan dalam proses pengolahan hasil pertanian dan bahan pangan. Salah satu metode pengeringan yang banyak dipakai dinegara berkembang adalah pengeringan matahari. Pengeringan dengan matahari adalah suatu metode pengeringan tradisional yang paling sering dilakukan dan lebih praktis. Metode ini sebagian besar digunakan untuk pengeringan buah-buahan seperti anggur dan prune kering (Jayaraman dan Das Gupta 1995).
Pengeringan daun kumis kucing secara alami dengan bantuan sinar matahari dilakukan dengan mengangin-anginkan daun terlebih dahulu selama 24 jam agar stomata daunnya menutup sehingga tidak terjadi penguapan zat-zat yang terkandung didalamnya, selanjutnya daun kumis kucing di jemur dibawah sinar matahari langsung. Bila matahari bersinar penuh, lama pengeringan sekitar 2-3 hari atau setelah kadar airnya berkisar 7%. Sementara pengeringan dengan oven dapat dilakukan dengan suhu 60oC selama 3-6 jam (Mahendra dan Fauzi 2005).
Masalah yang mungkin timbul pada pengeringan dengan sinar matahari adalah terjadinya hujan atau cuaca mendung, kontaminasi oleh debu, serangga, burung dan binatang lainnya, kurangnya pengawasan sehingga terjadi pengeringan melewati batas dan kemungkinan terjadi pembusukan baik secara kimiawi, enzimatis atau mikrobiologis karena waktu pengeringan yang lama (Jayaraman dan Das Gupta 1995). Selain itu dapat terjadi loss tambahan lainnya selama penyimpanan karena terjadi ketidakseragaman pengeringan (Imre 1995).
Menurut Fellow (1990), ketika udara panas berada di atas suatu produk pangan, panas akan langsung ditransfer pada permukaan produk. Pengeringan makanan merupakan suatu proses yang lambat. Waktu yang dibutuhkan untuk proses pengeringan dapat mencapai 6 sampai 8 jam bahkan lebih dan ditentukan juga oleh jenis produk (Parker 2002).
pengeringan; (3) Sifat-sifat dari lingkungan alat pengering (suhu, kelembaban dan kecepatan udara); dan (4) Karakteristik alat pengering (efisiensi pemindahan panas).
De Padua et al (1999) menyatakan bahwa daun kumis kucing yang berkualitas bagus berwarna hijau, mempunyai aroma yang bagus, kadar air dibawah 14%, rasa pahit, kadar abu sekitar 10%, kadar kontaminasi kurang dari 2% dan tidak mengandung serangga atau jamur. Daun kumis kucing yang berwarna kehitam-hitaman disebabkan oleh kelebihan panas selama pengeringan atau terjadinya kontak dengan wadah logam.
Polifenol Sebagai Antioksidan
Halliwell dan Gutteridge (2001) menjelaskan bahwa antioksidan adalah suatu substansi yang menghentikan atau menghambat kerusakan oksidatif terhadap suatu molekul target. Ditambahkan Pratt (1992) berdasarkan sumbernya, antioksidan dibagi menjadi antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesis reaksi kimia) dan antioksidan alami (antioksidan hasil ekstraksi bahan alami). Beberapa contoh antioksidan sintetik seperti Butil Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT), Propil Galat (PG) dan Tert-Butil Hidroksi Quinon (TBHQ) sedangkan sumber antioksidan alami banyak terdapat pada tumbuhan dan umumnya merupakan senyawa fenolik atau polifenolik yang berupa golongan flavonoid, turunan asam sinamat, kumarin, tokoferol dan asam-asam organik polifungsional yang letaknya tersebar di seluruh bagian tumbuhan baik di kayu, biji, buah, daun, akar, bunga maupun serbuk sari.
Ho et al (1997) menjelaskan flavonoid terdiri atas katekin, proantosianin, flavon, flavonol dan glikosida. Berdasarkan laporan Su et al (2003) flavonoid dikenal mempunyai aktivitas antioksidan dan kemampuan mengikat logam (metal chelating). Aktivitas antioksidan flavonoid meningkat dengan bertambahnya grup hidroksil pada cincin A dan B. Polifenol dan flavonoid merupakan antioksidan yang sangat kuat dan aktivitasnya berhubungan dengan struktur kimianya. Fuhrman (2002) menyatakan bahwa polifenol tumbuhan bersifat multifungsi dan bertindak sebagai senyawa pereduksi, antioksidan pendonor atom hidrogen, penangkap singlet oksigen dan beberapa polifenol juga bertindak sebagai antioksidan penangkap ion logam.
dihasilkan dalam pembentukan hidroperoksida alkil (ROOH) seperti ditunjukkan reaksi berikut :
ROO* + PPH ROOH + PP*
Radikal polifenol fenoksil (PP*) yang dihasilkan dapat distabilkan oleh atom hidrogen donor dan pembentukan quinones, atau oleh reaksi dengan radikal lain termasuk radikal fenoksil lainnya, sehingga dapat memutus inisiasi rantai reaksi yang baru (Fuhrman 2002).
Cai et al (2003) menyatakan aktivitas antioksidan pigmen betalain dari beberapa tanaman yang termasuk famili Amaranthaceae dengan menggunakan metode DPPH (1,1-diphenyl-2-picryhydrazyl) menunjukkan adanya aktivitas antioksidan yang kuat untuk semua tanaman yang diteliti (3.4-8.4 µM). Gomphrenin jenis betasianin (3.7 µM) dan betaxanthin (4.2 µM) menunjukkan aktivitas antioksidan yang sangat kuat, 3-4 kali lebih kuat dari asam askorbat (13.9 µM), rutin (6.1 µM) dan katekin (7.2 µM). Penelitian ini juga mempelajari hubungan antara struktur kimia dengan aktivitas antioksidan betalain. Aktivitas antioksidan dari betalain biasanya meningkat dengan meningkatnya jumlah gugus hidroksil dan juga tergantung dari posisi gugus hidroksil dan glikosilasi dari aglikon dalam molekulnya. Sejalan dengan pendapat Fukumoto dan Mazza (2000) bahwa aktivitas antioksidan biasanya meningkat dengan adanya peningkatan jumlah gugus hidroksil dan menurun dengan adanya glikosilasi.
Respon Imun
Respon imun merupakan sistem interaktif komplek dari beragam jenis sel imunokompeten yang bekerjasama dalam proses identifikasi dan eliminasi mikroorganisme patogen dan zat-zat berbahaya lainnya yang masuk ke dalam tubuh. Semakin baik respon imun tubuh, semakin baik status kesehatan seseorang (Roitt dan Delves 2001).
Respon imun menjalankan tiga fungsi yaitu pertahanan (defense), homeostatis dan pengawasan (surveillance). Fungsi pertahanan bertujuan untuk melawan invasi mikroorganisme dan senyawa asing lainnya. Fungsi homeostatis untuk mempertahankan dari jenis sel tertentu dan memusnahkan sel-sel yang rusak. Sedangkan fungsi pengawasan bertujuan untuk memonitor jenis-jenis sel yang abnormal atau sel mutan (Bellanti 1993).
Limfosit
Darah adalah suspensi yang terdiri dari sel-sel dan plasma, yaitu larutan yang mengandung berbagai molekul organik dan anorganik. Sel-sel darah terdiri dari sel darah merah (eritrosit), sel darah putih (leukosit) dan butir pembeku (platelets) atau trombosit. Sel darah putih atau leukosit (bahasa Yunani leuko = putih) penampakannya bening, tidak berwarna, bentuknya lebih besar dari sel darah merah akan tetapi jumlahnya kecil. Bellanti (1993) menyatakan jumlah sel darah putih normal sekitar 4000-11.000 sel/µm darah manusia.
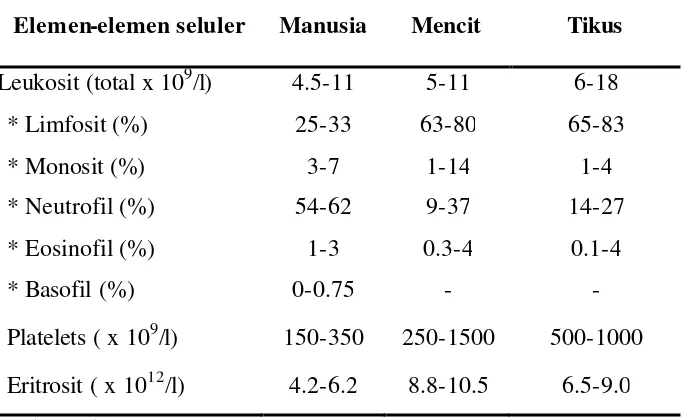
Roitt dan Delves (2001) menyatakan leukosit disebut juga sel darah putih yang merupakan salah satu sel dalam sistem pertahanan tubuh dan apabila dibandingkan dengan eritrosit, leukosit memiliki ukuran molekul yang lebih besar dan bergerak bebas. Ditambahkan Baratawidjaja (2002) leukosit terdiri dari 75% sel granulosit dan 25% sel agranulosit yang terbentuk di dalam sumsum tulang belakang. Roitt dan Delves (2001) menjelaskan yang termasuk kelompok agranulosit adalah sel limfosit dan monosit, sedangkan basofil, neutrofil dan eosinofil termasuk dalam kelompok yang granulosit (bergranula). Komposisi dan jumlah normal sirkulasi masing-masing elemen seluler pada darah manusia, mencit dan tikus disajikan pada Tabel 1.
dalam pengembangan imunitas seluler. Menurut Kresno (1991), sel limfosit mampu mengenal setiap jenis antigen, baik antigen yang terdapat intraselular maupun ekstra selular misalnya dalam cairan tubuh atau dalam tubuh.
Tabel 1 Komposisi dan jumlah normal sirkulasi masing- masing elemen seluler pada darah manusia, mencit dan tikus
Elemen-elemen seluler Manusia Mencit Tikus
Leukosit (total x 109/l) 4.5-11 5-11 6-18 * Limfosit (%) 25-33 63-80 65-83
* Monosit (%) 3-7 1-14 1-4
* Neutrofil (%) 54-62 9-37 14-27
* Eosinofil (%) 1-3 0.3-4 0.1-4
* Basofil (%) 0-0.75 - -
Platelets ( x 109/l) 150-350 250-1500 500-1000 Eritrosit ( x 1012/l) 4.2-6.2 8.8-10.5 6.5-9.0
Sumber: Delves (1994)
Menurut Kresno (1991) sel limfosit berdiferensiasi menjadi sel T dan sel B. Sel T berfungsi dalam imunitas seluler yang sebagian besar terdapat dalam sirkulasi darah, yaitu berjumlah 65-85% dan berasal dari sel hematopoetik di sumsum tulang belakang yang kemudian pindah ke timus dan menjadi dewasa. Pada proses pendewasaannya sel ini berdifferensiasi menjadi sel T-helper (Th) yang berfungsi untuk membantu pembentukan antibodi, sel T-supressor (Ts) menekan pembentukan antibodi dan sel T-cytotoxic (Tc) berfungsi membunuh sel-sel yang terinfeksi patogen intrasel-selular. Roitt dan Delves (2001) menambahkan bahwa sel T dapat berproliferasi menjadi sel T memori dan berbagai sel effektor yang mensekresi berbagai limfokin. Limfokin ini berpengaruh pada aktivasi sel B, sel Tc, sel NK dan sel lain yang terlibat dalam respon imun.
asam amino. Peptida ini akan berikatan dengan molekul protein pada permukaan
Antigen Presenting Cells (APC) yang bertugas mencocokkan dan mempresentasikan antigen kepada sel T, peptida tersebut dikenal sebagai molekul
Major Histocompatibility Complex (MHC). Sel Th berikatan dengan peptida pada MHC kelas II pada APC yang memiliki antigen ekstraselular seperti bakteri, tetapi telah terinternalisasi ke dalam sel. Hal ini membuat sel Th teraktivasi sehingga terjadi sekresi interleukin yang menstimulasi pembelahan dan diferensiasi sel B, sehingga sel B mampu menghasilkan antibodi untuk melawan antigen. Sel Tc
teraktivasi oleh MHC kelas I pada membran sel berinti yang terinfeksi virus. Dengan demikian, sel Tc akan mampu menbunuh sel yang terinfeksi tersebut (Roitt dan Delves 2001).
Proliferasi Limfosit
Tejasari (2000) menjelaskan bahwa proliferasi limfosit merupakan fungsi biologis mendasar limfosit, yaitu proses diferensiasi dan pembelahan (mitosis) sel. Limfosit adalah sel tunggal yang bertahan baik saat dikultur dalam media sederhana dan secara konsisten tetap dalam tahap diam dan tidak membelah sampai ditambahkan mitogen, respon proliferatif kultur limfosit menggambarkan fungsi limfosit dan status imun individu. Menurut Zakaria et al (1992) Perhitungan jumlah limfosit pada kontrol yang hanya mengandung media dan serum janin sapi saja dan membandingkannya dengan jumlah limfosit media yang diberi bahan uji, maka dapat diketahui aktivitas dari senyawa pemacu proliferasi limfosit yang ada pada bahan uji.
Mitogen adalah agen yang mampu menginduksi pembelahan sel baik sel T maupun sel B dalam persentase yang tinggi. Mitogen merupakan sumber ligan polipeptida yang berperan pada pelepasan sinyal dari tempat yang berdekatan parakrin dan diterima oleh reseptor membran plasma. Beberapa mitogen merupakan faktor pertumbuhan yang mengaktivasi tirosin kinase. Sinyal permulaan oleh mitogen mengakibatkan adanya urutan-urutan sinyal lain yang berpengaruh terhadap berbagai faktor transkripsi dan berpengaruh terhadap aktivitas gen di dalam sel (Decker 2001).
pokeweed (PWM) dan fitohemaglutinin (PHA). Mitogen ini tidak spesifik dan mempunyai daya mengaktifkan sejumlah sel limfosit tanpa memandang reaktifitas antigenik sel-sel yang bersangkutan. Hal ini dapat terjadi karena adanya gangguan pada membran yang dirangsang oleh ikatan silang makromolekul sehingga dapat merangsang limfosit untuk membelah.
Bellanti (1993) menyatakan mitogen PHA dan Con-A dapat merangsang transformasi blast subpopulasi sel T. Ditambahkan Kresno (1991) sebanyak 50-60% sel T mampu memberikan respon terhadap stimulasi PHA dan Con-A. Selanjutnya Kuby (1992) menyatakan PWM dapat berikatan dengan di-N-acetylchitobiose dan bersifat mitogenik terhadap sel T dan sel B.
Con-A berasal dari tanaman jack bean (Canavalia ensiformis), PHA berasal dari kacang merah (Phaseolus vulgaris) dan PWM berasal dari tumbuhan pokeweed (Phytolacca americana). Con-A adalah mitogen asal lektin legum yang bersifat sebagai imunomodulator karena dapat merangsang proliferasi limfosit, fungsinya pada sistem biologis adalah sebagai perekam informasi yang diikuti dengan produksi informasi sel. Lektin fitohemaglutinin (PHA) adalah protein non enzimatik yang berikatan dengan karbohidrat secara reversibel. Fungsi biologis dari lektin adalah kemampuan mengenal dan berikatan dengan struktur karbohidrat spesifik, khusus nya berikatan dengan oligosakarida. Lektin terdiri dari enam famili yang telah dikenal antara lain lektin legum, lektin sereal, lektin jenis P, C, S dan pentraxis (Letwin dan Quimby 1987).
Tidak semua mitogen adalah lektin. Lipopolisakarida (LPS) merupakan komponen dinding sel bakteri gram negatif yang dapat juga berfungsi sebagai mitogen sel B. Aktivitas mitogenik LPS berasal dari bagian lipidnya yang berinteraksi dengan membran plasma sehingga menghasilkan aktivasi selular (Kuby 1992).
Faridah (1996) melaporkan proliferasi limfosit dapat dilihat dari nilai Indeks Stimulasi (IS) yaitu rasio count per minute (cpm) sel yang dikultur dengan stimulan (mitogen/antigen) terhadap cpm sel yang hanya dikultur dengan medium pertumbuhan saja (tanpa stimulan/kontrol). Nilai IS menunjukkan kemampuan limfosit yang secara tidak langsung menggambarkan respon imunologik seseorang. Semakin tinggi nilai IS semakin tinggi pula respon imunologiknya. Pada kelompok remaja yang banyak mengkonsumsi makanan jajan tercemar dengan status gizi yang rendah ternyata dapat menurunkan respon imunologik yang ditandai dengan nilai IS limfosit yang rendah.
Zakaria et al (1992) menyatakan bila sel dikultur dengan senyawa mitogen, maka limfosit akan berproliferasi secara tidak spesifik. Begitu juga, jika limfosit dikultur dengan antigen spesifik, misalnya kasein susu, maka kemampuan limfosit untuk merespon secara spesifik dapat diukur. Kresno (1991) mengatakan bahwa respon terhadap mitogen dianggap menyerupai respon limfosit terhadap antigen, sehingga uji proliferasi dengan rangsangan mitogen, banyak dipakai untuk menguji fungsi limfosit. Zakaria (1996) melaporkan berbagai jenis bahan pangan seperti jahe, kunyit, bawang putih telah diketahui dan diteliti memiliki aktivitas imunostimulan antara lain meningkatkan kemampuan proliferasi limfosit.
Kultur Sel Limfosit
Doyle dan Griffiths (1997) menyatakan kultur sel limfosit secara in vitro
merupakan suatu cara untuk mengembangbiakkan atau menumbuhkan sel limfosit di luar tubuh hewan atau manusia. Lingkungan dan bahan makanan untuk pertumbuhan sel secara in vitro diusahakan menyerupai keadaan sel secara in vivo. Oleh karena itu diperlukan suatu media pertumbuhan yang berisi asam-asam amino, vitamin, garam- garam anorganik, glukosa dan serum. Menurut Freshney (1994) media pertumbuhan yang digunakan disesuaikan dengan jenis sel yang akan ditumbuhkan namun sampai saat ini media yang paling baik untuk kultur sel limfosit adalah Roswell Park Memorial Institute (RPMI)-1640 yang merupakan media sintetis yang kaya nutrisi.
tekanan osmosis, tekanan CO2 dan O2 sehingga kondisi fisiologis dari kultur
relatif konstan, kultur dapat terekspos secara langsung dengan pereaksi pada konsentrasi rendah, beberapa jenis sel yang dibiakkan dapat disimpan dalam nitroge n cair. Namun teknik ini juga memiliki beberapa kelemahan antara lain (1) Kultur sel harus dilakukan dalam kondisi yang steril karena sel hewan tumbuh lebih lambat dari kontaminan, (2) Untuk pertumbuhan sel dalam kultur dibutuhkan lingkungan yang kompleks seperti di dalam tubuh, (3) Sel yang tumbuh akan mengalami perubahan sifat karena beberapa sifat dari sel akan hilang atau berubah seperti laju pertumbuhan dan kemampuan untuk berdiferensiasi dalam tiap populasi berbeda (sel menjadi tidak stabil).
Serum yang biasa digunakan untuk kultur adalah FetalBovine Serum (FBS). Fungsi dari serum ini adalah sebagai protein pembawa hormon untuk menstimulasi pertumbuhan sel, faktor yang membantu terjadinya pelengketan sel dari jaringan ataupun cairan tubuh. Kultur sel limfosit manusia biasanya menggunakan serum manusia. Komponen serum sebagian besar adalah protein dan komponen lainnya seperti polipeptida, hormon-hormon, mineral dan bahan makanan seperti asam amino, glukosa, lemak, asam keto, etanolamin, fosfoetanol amin dan hasil- hasil metabolit lainnya (Freshney 1994).
Untuk pertumbuhan sel limfosit diperlukan kondisi nilai pH 7.4, gas CO2 5%
dengan suhu 37 + 0.5oC. Penambahan HEPES ( N-2-hydroxyethylpiperazine-N’-2-ethanesulfonic acid) pada media adalah sebagai buffer dan NaHCO3 berfungsi
untuk mempertahankan keseimbangan nilai pH. Kebutuhan gas oksigen sebesar 95% dan ketebalan medium kultur tidak boleh lebih dari 2-5 mm (0.2-0.5 ml/cm2) karena dapat mempengaruhi difusi oksigen kedalam sel (Freshney 1994).
mikroba yang daya tahannya lebih besar. Agen antifungi yang banyak digunakan adalah amfoterisin B (2.5 µg/ml) dan nystatin (25 µg/ml).
Doyle dan Griffiths (1997) menyatakan pengujian proliferasi sel dapat dilakukan dengan pewarnaan MTT ( 3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl-tetrazolium bromide). Prinsip metode MTT adalah konversi MTT menjadi senyawa formazan yang berwarna ungu oleh aktivitas enzim suksinat dehidrogenase dari mitokondria sel hidup yang kemudian diukur absorbansinya dengan Spectrophotometer Microplate Reader. James et al (1994) menjelaskan enzim suksinat dehidrogenase merupakan enzim yang disintesa oleh semua sel pada mitokondria. Kandungan suksinat dehidrogenase relatif konstan di antara berbagai sel dengan tipe spesifik, sehingga jumlah formazan yang terbentuk proporsional terhadap jumlah sel limfosit yang hidup.
Selain metode MTT, penghitungan sel dapat pula dilakukan dengan metode
tryphane blue. Metode ini menggunakan prinsip penyerapan zat warna melalui membran sel, pewarna tryphane blue hanya dapat mewarnai jika membran sel rusak. Oleh karena itu pewarna tryphane blue dapat digunakan untuk membedakan sel hidup dan sel mati atau rusak. Sel hidup tidak akan berwarna (terang) dan berbentuk bulat, sedangkan sel mati akan berwarna biru dan mengkerut (Doyle dan Griffiths 1997).
METODOLOGI PENELITIAN
Bahan dan Alat
Bahan
Bahan dasar yang digunakan adalah daun kumis kucing berbunga putih (Orthosiphon stamineus Benth) dan bunga kenop merah tua keunguan (Gomphrena globosa L.) yang diperoleh dari perumahan dosen dan taman bunga Institut Pertanian Bogor, Darmaga. Hewan percobaan yang digunakan untuk pengujian biologis adalah tikus jantan jenis Sprague Dawley dengan ciri-ciri berwarna putih, berkepala kecil, ekor lebih panjang dari pada badan dan berumur 1.5 bulan dengan berat rata-rata berkisar antara 150-200 g. Tikus tersebut diperoleh dari Badan Penelitian dan Pengembangan Kesehatan, Pusat Penelitian dan Pengembangan Gizi dan Makanan (BALITBANG-GIZI) Departemen Kesehatan Bogor.
Bahan-bahan yang digunakan pada analisis kimia daun kumis kucing dan bunga kenop adalah HCl (Merck, Jerman), H2SO4 pekat (Kanto Chemical, Jepang), HgO
(Merck, Jerman), K2SO4 (Kanto Chemical, Jepang), NaOH-Na2S2O3 (Merck, Jerman),
H3BO3 (Kanto Chemical, Jepang), heksan, metilen merah (Kanto Chemical, Jepang),
metilen biru (Kanto Chemical, Jepang), etanol 95% (Merck, Jerman), air bebas ion, Folin-ciocalteau (Sigma, USA), Na2CO3 (Merck, Jerman), standar asam tanat (Merck,
Jerman), buffer asetat 100mM (Merck, Jerman), DPPH (1,1-diphenyl-2-picryl hydrazyl) (Sigma, USA), trolox (Sigma, USA), metanol p.a (Merck, Jerman).
Bahan-bahan kimia yang digunakan pada kultur sel limfosit antara lain bubuk
Roswell Park Memorial Institute (RPMI)-1640 (Gibco, USA) sebagai medium pertumbuhan sel limfosit, antibiotik penicillin-streptomisin (Sigma, USA), mitogen [Concanavalin-A (Con-A), Lipopolisakarida S. thyphosa (LPS), Pokeweed (PWM) (Sigma, USA)] sebagai stimulan, NH4Cl (Merck, Jerman), tryphan blue (Wako,
Jepang), NaHCO3 (Merck, Jerman), aquabidest (Ikapharmindo Putramas, Jakarta),
Alat
Peralatan yang digunakan untuk pengeringan dan ekstraksi daun kumis kucing dan bunga kenop antara lain: oven, hot plate, kertas saring Whatman No. 41, timbangan analitik, saringan vakum, gelas piala dan aluminium foil. Sedangkan untuk keperluan analisis parameter meliputi: tabung reaksi, labu lemak, alat ekstraksi soxhlet, desikator, tanur, stop-watch, cawan petridish, labu Kjeldahl, pH-meter, alat destilasi, freeze drier, spektrofotometer, vorteks, kandang plastik, botol minum dan wadah ransum, gunting, pisau bedah, papan bedah, syringe bervolume 20 ml dan 10 ml.
Adapun alat yang digunakan untuk kultur sel antara lain sentrifus (Kokusan H-26F), laminar flow hood, inkubator (5% CO2, suhu 37oC) [Sanyo]), mikroskop
elektron (Olympus), hemasitometer (Bright-Line), membran milipore 0.20 µm
(Sartorius), tabung sentrifus steril (Nunc), multiplate microwell 96 (Costar), pipet pasteur, mikro pipet, tip biru dan kuning, Spectrofotometric ELISA Plate Reader.
Metode Penelitian
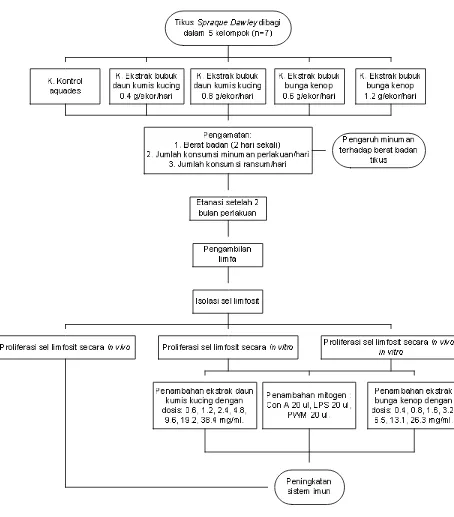
Untuk mencapai tujuan yang dikehendaki maka pelaksanaan penelitian ini dilakukan dalam 3 tahapan kegiatan, yaitu: (1) Tahap 1: Pembuatan bubuk daun kumis kucing dan bunga kenop (2) Tahap 2: Ekstraksi daun kumis kucing dan bunga kenop dengan parameter analisis sifat fisik dan sifat kimia sehingga diperoleh ekstrak terbaik (3) Tahap 3: Pengujian biologis dengan parameter analisis pengaruh minuman ekstrak bubuk daun kumis kucing dan bunga kenop terhadap; (a) Berat badan tikus, (b) Proliferasi sel limfosit secara in vivo, (c) Proliferasi sel limfosit secara in vitro, dan (d) Proliferasi sel limfosit secara in vivo-in vitro. Secara ringkas pelaksanaan penelitian ini disajikan dalam bentuk diagram alir seperti pada Gambar 4.
Tahap 1 Pembuatan Bubuk Daun Kumis Kucing dan Bunga Kenop
Pembuatan Bubuk Daun Kumis Kucing dan Bunga Kenop
Gambar 4 Diagram alir tahapan penelitian
Tahap I
Tahap I
Bubuk daun kumis kucing dan bunga kenop dibuat dengan mensortasi bahan segar kemudian ditimbang dan dicuci bersih dengan air mengalir sebanyak dua kali, selanjutnya dilakukan pengeringan. Pengeringan dilakukan dengan dua metode ya itu pengeringan matahari dan oven sampai mencapai kadar air akhir 7%. Nilai ini mengacu pada SNI-01-3836-2000 bahwa kadar air teh kering dalam kemasan adalah maksimal 8%. Pengeringan dengan sinar matahari dilakukan dengan menghamparkan daun kumis kucing dan bunga kenop diatas wadah lebar yang dialasi kertas dan dijemur secara langsung di bawah sinar matahari selama 2-3 hari untuk daun kumis kucing dan 3-4 hari untuk bunga kenop serta dibolak-balik setiap 4 jam sekali agar pengeringan yang dihasilkan lebih merata, sedangkan pengeringan oven dilakukan pada suhu 50oC selama 3-4 jam untuk daun kumis kucing dan 10-12 jam untuk bunga kenop. Daun kumis kucing dan bunga kenop yang telah kering, dihaluskan menggunakan blender menjadi bubuk berukuran 40 mesh.
Tahap 2 Ekstraksi Daun Kumis Kucing dan Bunga Kenop dengan Parameter Analisis Sifat Fisik dan Sifat Kimia sehingga Diperoleh
Ekstrak Terbaik
Ekstraksi Daun Kumis Kucing Dan Bunga Kenop Segar (Aquarini 2006) Daun kumis kucing dan bunga kenop segar yang dikonversikan kedalam dosis untuk pencegahan penyakit, diekstrak dengan perbandingan produk dan air sebesar 1.1835 g : 220 ml untuk daun kumis kucing (berdasarkan dosis untuk infeksi kandung kemih dan batu dalam kandung kemih) dan 3.6720 g : 80 ml untuk bunga kenop (berdasarkan dosis untuk pengobatan asthma bronchial) (Lampiran 1). Kemudian dihaluskan dengan mortar dan diseduh dengan akuades mendidih selama 5 menit. Selanjutnya disaring menggunakan pompa vakum dengan kertas saring Whatman
no.41 sehingga diperoleh ekstrak daun kumis kucing dan bunga kenop segar.
(berdasarkan dosis untuk pengobatan asthma bronchial) dan didiamkan selama 5 menit. Hasil seduhan disaring menggunakan pompa vakum dengan kertas saring
Whatman no. 41 sehingga diperoleh ekstrak bubuk daun kumis kucing dan bunga kenop. Pembuatan ekstrak ini dilakukan dengan perbandingan yang sama, baik untuk bubuk pengeringan oven maupun bubuk pengeringan matahari (Lampiran 2).
Parameter Analisis
Analisis Sifat Fisik
Dilakukan secara visual oleh peneliti sendiri dengan membandingkan warna bubuk dan ekstrak hasil pengeringan matahari, pengeringan oven dan bahan segar sebagai kontrol sehingga diperoleh produk terbaik dari kedua metode pengeringan yang memiliki warna bubuk dan warna ekstrak paling bagus.
Analisis Sifat Kimia
Analisis sifat kimia dilakukan dengan pengujian kadar total fenol dan aktivitas antioksidan ekstrak daun kumis kucing dan bunga kenop segar, bubuk kering matahari dan oven pada saat setelah diekstrak (0 jam) dan setelah penyimpanan selama 24 jam di suhu ruang (25oC) pada ruang gelap. Sehingga di peroleh ekstrak terbaik yang memiliki kadar total fenol dan aktivitas antioksidan yang paling tinggi diantara dua metode pengeringan dengan ekstrak segar sebagai kontrol. Selanjutnya ekstrak terbaik dari hasil pengujian sifat fisik dan kimia di uji kadar proksimat bubuknya yang meliputi kadar air, lemak, abu, protein dan karbohidrat dan digunakan untuk pengujian biologis. Prosedur lengkapnya sebagai berikut:
Pengujian Total Fenol dengan Metode Folin-Ciocalteu Colorimetric (Shetty et al 1995)
Sebanyak 1 ml ekstrak sampel (daun kumis kucing/bunga kenop) dimasukkan kedalam tabung reaksi yang sudah berisi 1 ml etanol 95%, selanjutnya ditambahkan 5 ml air bebas ion dan 0.5 ml Folin-ciocalteu reagent 50%, kemudian divortek dan didiamkan 5 menit selanjutnya ditambahkan 1 ml Na2CO3 5%, lalu divortek dan disimpan dalam ruang gelap selama 60 menit.
panjang gelombang 725 nm. Kurva standar dipersiapkan dengan menggunakan asam tanat dalam etanol 95%. Larutan standar asam tanat dibuat denga n konsentrasi 5, 10, 25, 50 dan 100 mg/ml air bebas ion. Total fenol dihitung berdasarkan kurva standar asam tanat yang diperoleh pada Lampiran 9.
Pengujian Aktivitas Antioksidan dengan Metode Trolox Equivalent Antioxidant Capacity (TEAC) (Kubo etal 2002)
Larutan buffer asetat 100 mM (pH 5.5) sebanyak 1,5 ml dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan 2.805 ml etanol dan 0.15 ml senyawa radikal bebas DPPH (1,1-diphenyl-2-picryl hydrazyl) 3 mM dalam metanol lalu divortek. Sebanyak 0.045 ml ekstrak sampel (bubuk daun kumis kucing/ bunga kenop) dimasukkan ke dalam tabung reaksi tersebut kemudian di vortek dan disimpan dalam ruang gelap pada suhu kamar (25oC) selama 20 menit. Absorbansi sampel dibaca pada panjang gelombang 517 nm. Untuk blanko digunakan 0.045 ml akuades sebagai pengganti sampel, sedangkan untuk kontrol DPPH diganti dengan metanol dan sampel diganti akuades. Penurunan absorbansi pada larutan yang berisi sampel menunjukkan adanya aktivitas scavenging atau aktivitas antioksidan. Sebagai standar digunakan Trolox (6-hidroxy
-2,5,8-tetramethly chroman-2-carboxylic acid) yaitu sejenis vitamin E yang larut air dengan konsentrasi 0.00, 1.25, 2.50, 5.00 mM. Aktivitas antioksidan dihitung berdasarkan kurva standar trolox yang diperoleh pada Lampiran 10 dan hasil akhir dinyatakan dalam konsentrasi milimolar TEAC (Trolox Equivalent Antioxidant Capacity).
Analisis Proksimat (Apriyantono et al 1989)
Kadar Air : Metode Oven
Cawan aluminium dikeringkan dalam oven pada suhu 100-102oC selama 15 menit, didinginkan dalam desikator selama 10 menit lalu ditimbang (W1). Sampel
ditimbang sebanyak 5 g (W2). Kemudian cawan berisi sampel dikeringkan dalam
100%
Kadar Protein : Metode Mikro-Kjeldahl
Sampel sebanyak 0.5–3 g dimasukkan ke dalam labu Kjeldahl ditambahkan 1.9 ± 0.1 K2SO4, 40 ± 10 mg HgO dan 2.0 ± 0.1 ml H2SO4 pekat, kemudian
didestruksi dengan pemanasan sampai larutan berwarna jernih. Larutan hasil destruksi diencerkan dan didestilasi dengan penambahan 8-10 ml NaOH-Na2S2O3.
Destilat ditampung dalam 5 ml larutan H3BO3 dan 2-4 tetes indikator (campuran 2
bagian metil merah 0.2% dalam alkohol dan 1 bagian metilen blue 0.2% dalam alkohol). Kemudian dilakukan destilasi sampai tertampung kira-kira 50 ml destilat dalam erlenmeyer, lalu dititrasi dengan HCl 0.02 N sampai terjadi perubahan warna menjadi abu-abu. Dari hasil titrasi ini total nitrogen dapat diketahui, kadar protein sampel dihitung dengan mengalikan total nitrogen dengan faktor konversi.
100%
Kadar Lemak : Metode Ekstraksi Soxhlet
Labu lemak dikeringkan dalam oven (110oC selama 1 jam). Kemudian didinginkan dalam desikator dan ditimbang hingga bobot tetap (Wlabu). Sampel
sebanyak 5 g (Wsampel) di bungkus dengan kertas saring dimasukkan dalam labu
didinginkan dalam desikator dan dilakukan penimbangan labu beserta lemaknya hingga diperoleh bobot yang tetap (Wlemak). Kadar lemak ditentukan dengan rumus:
100%
Cawan porselin yang sudah diketahui bobot tetapnya (Wcawan) dimasukkan
sampel yang telah ditimbang sebanyak 5 g (Wcawan-sampel awal). Sampel diarangkan
di atas bunsen dengan nyala api kecil hingga asapnya hilang, selanjutnya dimasukkan kedalam tanur pada suhu 500 hingga 600oC sampai menjadi abu yang berwarna putih. Cawan yang berisi abu didinginkan dalam desikator dan dilakukan penimbangan hingga diperoleh bobot tetap (Wcawan-abu). Kadar abu
ditentukan dengan rumus:
Kadar Karbohidrat (by difference)
Kadar karbohidrat dapat dihitung dengan menggunakan rumus: Kadar karbohidrat (% bb) =
100% - ( % K.air + % K.abu + % K.protein + % K.lemak)
Kadar karbohidrat (% bk) =
Tahap 3 Pengujian Biologis
Pengujian biologis untuk melihat pengaruh pemberian minuman ekstrak bubuk daun kumis kucing dan bunga kenop terpilih terhadap proliferasi sel limfosit secara in vivo, in vitro dan in vivo-in vitro menggunakan limfosit hewan. Hewan percobaan yang digunakan adalah tikus jantan spesies Rattus novergicus strain Sprague-Dawley
berumur kurang lebih 1.5 bulan dengan berat rata-rata antara 150-200 g sebanyak 35 ekor. Kandang yang digunakan adalah kandang pemeliharaan biasa yang ditempatkan dalam ruangan dengan lama masa terang dan gelap masing- masing 12 jam. Komposisi ransum standar yang diberikan berdasarkan AOAC (1990) disajikan pada Lampiran 3. Prosedur pengujian secara rinci dijelaskan pada Gambar 5.
Pelaksanaan kegiatan dimulai dengan mempersiapkan 35 ekor tikus dan dibagi menjadi 5 kelompok perlakuan dengan masing- masing kelompok berjumlah 7 ekor tikus. Perbedaan berat awal rata-rata tikus antar kelompok tidak lebih dari 5 g dan perbedaan dalam satu kelompok yang sama maksimal 10 g. Perlakuan percobaan dikelompokkan sebagai berikut:
Kelompok I : Tikus yang diberi minum aquades sebagai kontrol
Kelompok II : Tikus yang diberi minuman ekstrak bubuk daun kumis kucing dosis 0.4 g
Kelompok III : Tikus yang diberi minuman ekstrak bubuk daun kumis kucing dosis 0.8 g
Kelompok IV : Tikus yang diberi minuman ekstrak bubuk bunga kenop dosis 0.6 g Kelompok V : Tikus yang diberi minuman ekstrak bubuk bunga kenop dosis 1.2 g
Sebelum diberi perlakuan, tikus diadaptasikan terlebih dahulu dengan ransum standar dan diberi minum akuades secara ad libitum selama satu minggu. Pengukuran berat badan selama masa adaptasi dilakukan dua kali di awal dan di akhir masa adaptasi.
Gambar 5 Tahapan pengujian proliferasi sel limfosit secara in vivo, in vitro dan
in vivo-in vitro
Hasil konversi ke tikus kemudian dijadikan dasar untuk membuat
minuman perlakuan setiap hari. Dosis bubuk daun kumis kucing dan bunga
kenop yang digunakan ada dua, yaitu dosis rendah (diberi kode 1) dan dosis
tinggi (diberi kode 2). Bubuk daun kumis kucing dosis rendah sebesar 0.4
g/ekor/hari 16.78 g/70 kg BB manusia sementara bubuk bunga kenop dosis rendah sebesar 0.6 g/ekor/hari setara dengan 13.35 g/70 kg BB manusia dan dosis tinggi sebesar 1.2 g/ekor/hari setara dengan 26.70 g/70 kg BB manusia. Penentuan dosis rendah dan dosis tinggi (0.4 dan 0.8 g untuk daun kumis kucing serta 0.6 dan 1.2 g untuk bunga kenop) berdasarkan hasil penelitian Aquarini (2006) pada limfosit manusia bahwa ekstrak daun kumis kuc ing dapat meningkatkan proliferasi limfosit sampai dosis 0.8 g dan bunga kenop pada dosis 1.2 g yang setara dengan 4 kali dosis normal pada manusia.
Perhitungan kesetaraan dosis bubuk daun kumis kucing dan bunga kenop berdasarkan Laurence dan Bacharach (1964) pada Lampiran 3 dan 4. Ekstrak bubuk daun kumis kucing dan bunga kenop dosis rendah dan tinggi disajikan pada Gambar 6.
(a) (b)
Gambar 6 Ekstrak bubuk minuman perlakuan; (a) daun kumis kucing dosis 0.4 dan 0.8 g bubuk/ekor/hari, (b) bunga kenop dosis 0.6 dan 1.2 g bubuk/ekor/hari
Proses pembuatan minuman perlakuan diawali dengan penimbangan sampel bubuk daun kumis kucing dan bunga kenop, kemudian diseduh dengan akuades mendidih dan didiamkan selama 5 menit. Kemudian disaring menggunakan kertas saring Whatman no. 41. Pemberian minuman dilakukan secara ad libitum
sebanyak 40 ml berdasarkan hasil rata-rata sisa minum tikus percobaan selama masa adaptasi. Penimbangan berat badan tikus dilakukan dua hari sekali, sisa ransum ditimbang setiap hari dan sisa minum diukur setiap hari. Diakhir masa perlakuan tikus dietanasi dan diambil limfanya untuk melihat proliferasi sel limfositnya. Secara rinci prosedur pengujian biologis, sebagai berikut:
a. Persiapan Pereaksi dan Media Kultur Pembuatan larutan NH4Cl 0.85%
Bubuk NH4Cl sebanyak 0.85 g dilarutkan dalam 100 ml aquabidest dan
diaduk hingga homogen. Kemudian larutan tersebut disterilisasi dengan membran sterilisasi 0.20 µm.
Pembuatan Phosphate Buffer Saline (PBS)
Satu tablet PBS dilarutkan dalam 200 ml aquabidest dan diatur hingga mencapai pH 7.4. Kemudian larutan tersebut disterilisasi dengan membran sterilisasi 0.20 µm.
Pembuatan Indikator Tryphane Blue 0.20%
Bubuk Tryphane Blue sebanyak 0.05 g dilarutkan dalam 20 ml PBS dan diaduk hingga homogen.
Pembuatan Larutan Media RPMI-1640 sebagai Medium Kultur Sel Limfosit
Medium yang digunakan untuk kultur dan pemeliharaan sel limfosit adalah RPMI-1640 bubuk 16.2 g yang telah mengandung L-glutamin dan 0.25 mM HEPES. Komposisi lengkap medium RPMI-1640 dapat dilihat pada Lampiran 7. Bubuk ini dilarutkan dengan air bebas pirogen sehingga diperoleh 1 liter larutan medium RPMI-1640. Kemudian ditambahkan 2 g NaHCO3 dan 1%
penisilin-streptomisin. Medium selanjutnya disterilisasi dingin dengan membran filter 0.20 µm dan digunakan sebagai medium pertumbuhan dan medium pencuci. Untuk medium kultur sel limfosit digunakan medium RPMI-1640 dengan penambahan
fetal bovine serum (FBS) 10% steril. Pembuatan medium dan tahap-tahap selanjutnya dalam isolasi sel limfosit dilakukan di dalam laminar flow yang steril dengan sistem pengaliran udara laminar. Sebelum digunakan, laminar flow ini disinari dahulu dengan sinar UV selama 15 menit.
Pembuatan MTT 0.5%
Pembuatan Larutan HCl-isopropanol 0.04 N
HCl 37% p.a (pekat) dipipet sebanyak 23.4 µl dan ditambahkan 8.97 ml isopropanol p.a dan diaduk hingga homogen sehingga didapatkan larutan HCl-isopropanol 0.04 N. Larutan ini harus dibuat segar tiap akan digunakan.
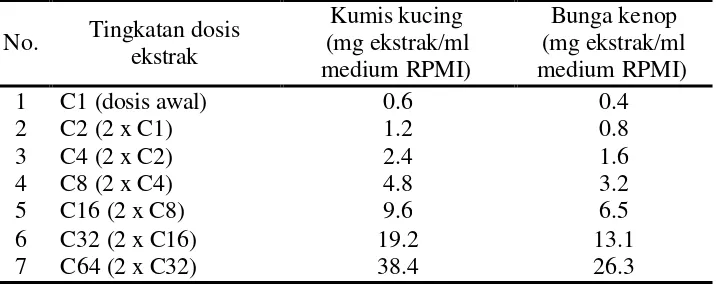
Pembuatan Larutan Ekstrak Daun Kumis Kucing dan Bunga Kenop serta Mitogen
Persiapan ekstrak daun kumis kucing dan bunga kenop dilakukan dengan terlebih dahulu membuat larutan stock ekstrak. Larutan stock dibuat dengan cara mengekstraksi bubuk hasil pengeringan terbaik sesuai dengan dosis untuk pencegahan penyakit. Hasil ekstraksi disaring menggunakan saringan vakum dengan kertas saring Whatman No. 41. Setelah itu hasil ekstraksi dikeringbekukan dengan freeze dryer. Tabung freeze dryer ditimbang (X1), setelah itu hasil ekstrak
dimasukkan ke dalam tabung freeze dryer selama 48 jam dan ditutup dengan aluminium foil untuk menghindari terjadinya oksidasi. Hasil freeze dryer (X2)
ditimbang untuk menentukan rendemen. Re ndemen didapatkan dari perhitungan: Berat bubuk sampel awal (g) = W1
Rendemen yang diperoleh, digunakan untuk membuat larutan stock ekstrak dan menjadi dasar untuk perhitungan dosis yang akan dimasukkan ke dalam kultur sel. Perhitungan selengkapnya dapat dilihat pada Lampiran 8. Pembuatan larutan stock ekstrak dan mitogen sebagai berikut :
Pembuatan larutan ekstrak (daun kumis kucing dan bunga kenop)
Sampel hasil freeze dryer sebanyak 1 g dilarutkan dengan medium RPMI-1640, kemudian dimasukkan ke dalam labu takar 5 ml. Medium RPMI-1640 ditambahkan sampai tanda tera, sehingga didapatkan larutan stock dengan konsentrasi 200 mg/ml.
Pembuatan larutan LPS dan Con-A