KARAKTERISASI DAN SKRINING FITOKIMIA SERTA
UJI EFEKTIVITAS ANTIDIARE EKSTRAK ETANOL BIJI
ASAM JAWA (
Tamarindus indica
L.) TERHADAP MENCIT
JANTAN DENGAN METODE TRANSIT INTESTINAL
SKRIPSI
OLEH:
NERLY JULI PRANITA SIMANJUNTAK
NIM 121524140
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI DAN SKRINING FITOKIMIA SERTA
UJI EFEKTIVITAS ANTIDIARE EKSTRAK ETANOL BIJI
ASAM JAWA (
Tamarindus indica
L.) TERHADAP MENCIT
JANTAN DENGAN METODE TRANSIT INTESTINAL
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NERLY JULI PRANITA SIMANJUNTAK
NIM 121524140
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI DAN SKRINING FITOKIMIA SERTA UJI
EFEKTIVITAS ANTIDIARE EKSTRAK ETANOL BIJI ASAM
JAWA (
Tamarindus indica
L.) TERHADAP MENCIT JANTAN
DENGAN METODE TRANSIT INTESTINAL
OLEH:
NERLY JULI PRANITA SIMANJUNTAK NIM 121524140
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada Tanggal: 11 Oktober 2014
Pembimbing I, Panitia Penguji,
Dr. Edy Suwarso, S.U., Apt. Prof. Dr. Karsono, Apt. NIP 130935857 NIP 195409091982011001
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas segala limpahan berkat, rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, yang berjudul “Karakterisasi dan Skrining Fitokimia serta Uji Efektivitas Antidiare Ekstrak Etanol Biji Asam Jawa (Tamarindus indica L.) Terhadap Mencit Jantan Dengan Metode Transit Intestinal.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara Medan, yang telah memberikan fasilitas sehingga penulis dapat menyelesaikan pendidikan. Bapak Dr. Edy Suwarso, S.U., Apt., dan Bapak Dr. Panal Sitorus, M.Si., Apt., selaku pembimbing yang telah membimbing dan memberikan petunjuk serta saran-saran selama penelitian hingga selesainya skripsi ini. Bapak Dr. Karsono, Apt., dan ibu Dra. Azizah Nasution, M.Sc., Ph.D., Apt., serta ibu Dra. Aswita Hafni Lubis, M.Si., Apt., selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi ini. Bapak dan Ibu staff pengajar Fakultas Farmasi USU Medan yang telah mendidik selama perkuliahan dan bapak Hari Ronaldo Tanjung, S.Si., M.Sc., Apt., selaku penasehat akademik yang selalu memberikan bimbingan kepada penulis selama perkuliahan. Ibu Marianne, S.Si, M.Si., Apt., selaku kepala Laboratorium Farmakologi dan Toksikologi USU serta Dra. Suwarti Aris, M.Si., Apt., selaku kepala Laboratorium Farmakognosi USU yang telah memberikan izin dan fasilitas untuk penulis sehingga dapat mengerjakan dan menyelesaikan penelitian.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih
jauh dari kesempurnaan, oleh karena itu penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya penulis berharap semoga skripsi ini dapat
memberi manfaat bagi kita semua.
Medan, Oktober 2014 Penulis,
KARAKTERISASI DAN SKRINING FITOKIMIA SERTA UJI EFEKTIVITAS ANTIDIARE EKSTRAK ETANOL BIJI ASAM JAWA (Tamarindus indica L.) TERHADAP MENCIT JANTAN DENGAN METODE
TRANSIT INTESTINAL
ABSTRAK
Tanaman asam jawa secara tradisional banyak digunakan dalam pengobatan. Salah satu bagian tanaman yang digunakan adalah bijinya untuk asma, bronchitis, kusta, tuberculosis, luka, sakit perut, diare, disentri, vertigo dan diabetes. Senyawa aktif yang terdapat dalam biji asam jawa adalah senyawa tannin, asam lemak, flavonoid, saponin, alkaloid dan glikosida. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia dan ekstrak, skrining fitokimia, serta uji efek antidiare ekstrak etanol biji asam jawa terhadap mencit jantan dengan metode transit intestinal.
Ekstraksi dilakukan secara maserasi dengan pelarut etanol 80%. Ekstrak yang diperoleh dibuat suspensi dengan konsentrasi 2% kemudian diuji efek antidiare terhadap mencit jantan dengan dosis 50 mg/kg bb, 150 mg/kg bb dan 450 mg/kg bb dengan oleum ricini digunakan sebagai penginduksi diare dan suspensi norit 5% sebagai marker. Metode uji antidiare yang digunakan adalah metode intestinal transit
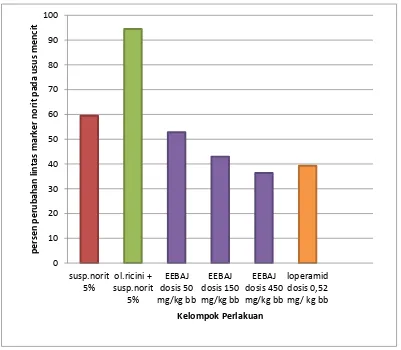
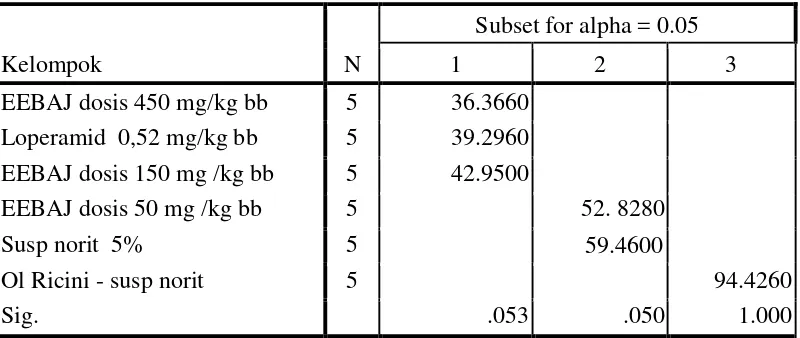
yaitu dengan cara menghitung persen lintasan yang dilewati norit pada usus mencit. Hasil karakterisasi serbuk simplisia biji asam jawa diperoleh kadar air 8,98%, kadar sari larut air 11,77 %, kadar sari larut etanol 24,87%, kadar abu total 1,3% dan kadar abu tidak larut asam 0,80%. Hasil karakterisasi ekstrak etanol biji asam jawa diperoleh kadar air 3,98%, kadar abu total 6,38% dan kadar abu tidak larut asam 0,92%. Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol biji asam jawa terdapat senyawa golongan flavonoida, saponin, steroida-terpenoida, glikosida dan tanin. Hasil pengamatan efek antidiare ekstrak etanol biji asam jawa dosis 50 mg/kg bb memberikan efek antidiare paling lemah sedangkan dosis 450 mg/kg bb memberikan efek antidiare paling kuat. Peningkatan dosis ekstrak etanol biji asam jawa menunjukkan peningkatan efek antidiare. Hasil analisis statistik menunjukkan pemberian suspensi ekstrak etanol biji asam jawa 2% dengan dosis 150 mg/kg bb dan 450 mg/kg bb pada mencit jantan menunjukkan efek antidiare yang efektif karena tidak berbeda nyata dengan loperamid 0,52 mg/kg bb yang menunjukkan efek antidiare pada uji beda rata-rata Duncan (P > 0,05).
CHARACTERIZATION AND SCREENING PHYTOCHEMICAL AND TEST ANTIDIARRHEAL EFFECTS OF ETHANOL EXTRACT OF
TAMARIND SEEDS (Tamarindus indica L.) IN MALE MICE WITH
METHOD INTESTINAL TRANSIT
ABSTRACT
Tamarind plant traditionally is widely used in the treatment. The part of the plant was used seed for asthma, bronchitis, leprosy, tuberculosis, sores, abdominal pain, diarrhea, dysentery, vertigo and diabetes. The active compound contained in tamarind seeds are phenolic compounds, tannins, fatty acids, flavonoids, saponins, alkaloids and glycosides. The purpose of this study is to investigate the characteristic of simplex and extracts, phytochemical screening and testing antidiarrheal effects of ethanol extract of tamarind seeds on male mice with intestinal transit method.
Extraction was done by maceration with 80% ethanol. The extract was made suspension with a concentration of 2% then tested antidiarrheal effects on adult mice male at a doses of 50 mg/kg bw, 150 mg / kg bw and 450 mg/kg bw with castor oil was used as an inducer of diarrhea and suspension norit 5% was used a marker. Antidiarrheal test method was used the method of intestinal transit by way of calculating the percent of trajectories that passed norit the intestine of mice.
The results of characterization of simplex tamarind seeds was water content 8.98%, water-soluble extract content of 11.77%, the levels of ethanol soluble extract 24.87%, total ash content 1.3% and acid insoluble ash content of 0.80%. The results of characterization of the ethanol extract of tamarind seeds obtained water content of 3.98%, total ash content and acid insoluble ash content of 0.92%. Results of phytochemical screening of simplex and ethanol extract tamarind seeds were compounds flavonoida, saponins, steroid-terpenoida, glycosides and tannins. Observations antidiarrheal effects of ethanol extract of tamarind seeds dose of 50 mg/kg bw weakest antidiarrheal effect while the 450 mg/kg bw most potent antidiarrheal effect. Increasing doses of ethanol extract of tamarind seeds showed the that increase antidiarrheal effects. Statistical analysis showed administration of ethanol extract tamarind seeds suspension 2% at a dose of 150 mg/kg bw and 450 mg/kg bw in adult mice male showed an effective antidiarrheal effects were not significantly different as loperamide 0.52 mg/kg bw which shows the effect antidiarrheal in different test average Duncan (P > 0.05).
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... v\
ABSTRACT ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.1 Klasifikasi tanaman asam jawa ... 6
2.1.2 Nama daerah ... 6
2.2 Simplisia dan Ekstrak ... 8
2.2.1 Simplisia ... 8
2.2.2 Ekstrak ... 8
2.3 Uraian Saluran Pencernaan ... 10
2.3.1 Rongga Mulut ... 11
2.3.2 Lambung ... 11
2.3.3 Usus halus ... 12
2.3.3.1 Gerak peristaltik Usus ... 12
2.3.4 Usus besar ... 13
2.3.5 Kolon ... 14
2.4 Uraian Diare ... 15
2.4.1 Jenis-jenis diare ... 16
2.4.2 Obat antidiare ... 19
2.5 Oleum Ricini ... 21
BAB III METODE PENELITIAN ... 22
3.1 Alat dan Bahan ... 22
3.1.1 Alat-alat ... 22
3.1.2 Bahan-bahan ... 22
3.2 Hewan Percobaan ... 23
3.3 Pembuatan Larutan Pereaksi ... 23
3.3.1 Pereaksi Besi (III) klorida 1% ... 23
3.3.2 Pereaksi Bouchardat ... 23
3.3.3 Pereaksi Dragendorf ... 23
3.3.5 Pereaksi Molish ... 24
3.3.6 Pereaksi Asam Klorida 2 N ... 24
3.3.7 Pereaksi Asam Sulfat 2 N ... 24
3.3.8 Pereaksi Natrium Hidroksida 2 N ... 24
3.3.9 Kloralhidrat ... 24
3.3.10 Pereaksi Lieberman Bourchard ... 24
3.3.11 Pereaksi Timbal (II) Asetat 0,4 M ... 25
3.4 Prosedur dan Pembuatan Simplisia ... 25
3.4.1 Pengambilan Bahan ... 25
3.4.2 Identifikasi Tumbuhan ... 25
3.4.3 Pengolahan Bahan Tumbuhan ... 25
3.5 Pemeriksaan Karakterisasi Simplisia ... 25
3.5.1 Pemeriksaan Makroskopik ... 25
3.5.2 Pemeriksaan Mikroskopik ... 26
3.5.3 Penetapan Kadar air ... 26
3.5.4 Penetapan Kadar Sari Larut Air ... 26
3.5.5 Penetapan Kadar Sari Larut Etanol ... 27
3.5.6 Penetapan Kadar Abu Total ... 27
3.5.7 Penetapan Kadar Abu Tidak Larut Asam ... 27
3.6 Skrining Fitokimia ... 28
3.6.1 Pemeriksaan Flavonoid ... 28
3.6.2 Pemeriksaan Alkaloid ... 28
3.6.3 Pemeriksaan Saponin ... 29
5.2 Saran ... 47
DAFTAR TABEL
Halaman
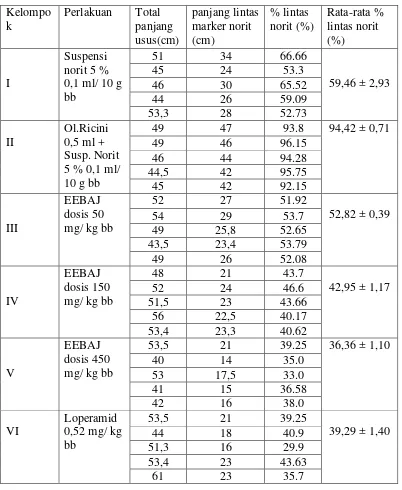
Tabel 4.1 Hasil karakterisasi serbuk simplisia biji asam jawa ... 38 Tabel 4.2 Hasil karakterisasi ekstrak etanol biji asam jawa ... 39 Tabel 4.3 Hasil skrining fitokimia serbuk dan ekstrak ... 39 Tabel 4.4 Persentase lintasan marker norit pada usus tikus kondisi normal,
diare yang diinduksi dengan oleum ricini 0,1 ml/10 gram bb dan diberi suspensi loperamid 0,52 mg/kg bb serta suspensi EEBAJ 2% ... 43
DAFTAR GAMBAR
Halaman
Gambar 1.1 Kerangka pikir penelitian ... 5 Gambar 4.1 Grafik persentase perubahan lintasan marker norit pada usus
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil Identifikasi Tumbuhan Biji Asam Jawa ... 51
2 Rekomendasi Persetujuan etik Penelitian Kesehatan ... 52
3 Gambar pohon asam jawa, biji asam jawa dan serbuk simplisia biji asam jawa ... 53
4 Hasil pemeriksaan mikroskopik ... 55
5 Bagan Kerja Penelitian ... 56
6 Perhitungan hasil pemeriksaan karakterisasi serbuk simplisia Biji asam jawa ... 57
7 Perhitungan hasil pemeriksaan karakterisasi ekstrak etanol Biji asam jawa ... 62
8 Bagan pengerjaan uji efek antidiare pada mencit ... 65
9 Gamabar mencit jantan ... 66
10 Gambar posisi mencit setelah dibedah ... 67
11 Usus halus yang dilintasi marker norit ... 68
12 Volume maksimum sesuai jalur pemberian dan konversi dosis 69 13 Perhitungan volume pemberian suspensi ... 72
14 Contoh perhitungan dosis loperamid HCl ... 74
15 Data analisis statistik SPSS ... 75
KARAKTERISASI DAN SKRINING FITOKIMIA SERTA UJI EFEKTIVITAS ANTIDIARE EKSTRAK ETANOL BIJI ASAM JAWA (Tamarindus indica L.) TERHADAP MENCIT JANTAN DENGAN METODE
TRANSIT INTESTINAL
ABSTRAK
Tanaman asam jawa secara tradisional banyak digunakan dalam pengobatan. Salah satu bagian tanaman yang digunakan adalah bijinya untuk asma, bronchitis, kusta, tuberculosis, luka, sakit perut, diare, disentri, vertigo dan diabetes. Senyawa aktif yang terdapat dalam biji asam jawa adalah senyawa tannin, asam lemak, flavonoid, saponin, alkaloid dan glikosida. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia dan ekstrak, skrining fitokimia, serta uji efek antidiare ekstrak etanol biji asam jawa terhadap mencit jantan dengan metode transit intestinal.
Ekstraksi dilakukan secara maserasi dengan pelarut etanol 80%. Ekstrak yang diperoleh dibuat suspensi dengan konsentrasi 2% kemudian diuji efek antidiare terhadap mencit jantan dengan dosis 50 mg/kg bb, 150 mg/kg bb dan 450 mg/kg bb dengan oleum ricini digunakan sebagai penginduksi diare dan suspensi norit 5% sebagai marker. Metode uji antidiare yang digunakan adalah metode intestinal transit
yaitu dengan cara menghitung persen lintasan yang dilewati norit pada usus mencit. Hasil karakterisasi serbuk simplisia biji asam jawa diperoleh kadar air 8,98%, kadar sari larut air 11,77 %, kadar sari larut etanol 24,87%, kadar abu total 1,3% dan kadar abu tidak larut asam 0,80%. Hasil karakterisasi ekstrak etanol biji asam jawa diperoleh kadar air 3,98%, kadar abu total 6,38% dan kadar abu tidak larut asam 0,92%. Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol biji asam jawa terdapat senyawa golongan flavonoida, saponin, steroida-terpenoida, glikosida dan tanin. Hasil pengamatan efek antidiare ekstrak etanol biji asam jawa dosis 50 mg/kg bb memberikan efek antidiare paling lemah sedangkan dosis 450 mg/kg bb memberikan efek antidiare paling kuat. Peningkatan dosis ekstrak etanol biji asam jawa menunjukkan peningkatan efek antidiare. Hasil analisis statistik menunjukkan pemberian suspensi ekstrak etanol biji asam jawa 2% dengan dosis 150 mg/kg bb dan 450 mg/kg bb pada mencit jantan menunjukkan efek antidiare yang efektif karena tidak berbeda nyata dengan loperamid 0,52 mg/kg bb yang menunjukkan efek antidiare pada uji beda rata-rata Duncan (P > 0,05).
CHARACTERIZATION AND SCREENING PHYTOCHEMICAL AND TEST ANTIDIARRHEAL EFFECTS OF ETHANOL EXTRACT OF
TAMARIND SEEDS (Tamarindus indica L.) IN MALE MICE WITH
METHOD INTESTINAL TRANSIT
ABSTRACT
Tamarind plant traditionally is widely used in the treatment. The part of the plant was used seed for asthma, bronchitis, leprosy, tuberculosis, sores, abdominal pain, diarrhea, dysentery, vertigo and diabetes. The active compound contained in tamarind seeds are phenolic compounds, tannins, fatty acids, flavonoids, saponins, alkaloids and glycosides. The purpose of this study is to investigate the characteristic of simplex and extracts, phytochemical screening and testing antidiarrheal effects of ethanol extract of tamarind seeds on male mice with intestinal transit method.
Extraction was done by maceration with 80% ethanol. The extract was made suspension with a concentration of 2% then tested antidiarrheal effects on adult mice male at a doses of 50 mg/kg bw, 150 mg / kg bw and 450 mg/kg bw with castor oil was used as an inducer of diarrhea and suspension norit 5% was used a marker. Antidiarrheal test method was used the method of intestinal transit by way of calculating the percent of trajectories that passed norit the intestine of mice.
The results of characterization of simplex tamarind seeds was water content 8.98%, water-soluble extract content of 11.77%, the levels of ethanol soluble extract 24.87%, total ash content 1.3% and acid insoluble ash content of 0.80%. The results of characterization of the ethanol extract of tamarind seeds obtained water content of 3.98%, total ash content and acid insoluble ash content of 0.92%. Results of phytochemical screening of simplex and ethanol extract tamarind seeds were compounds flavonoida, saponins, steroid-terpenoida, glycosides and tannins. Observations antidiarrheal effects of ethanol extract of tamarind seeds dose of 50 mg/kg bw weakest antidiarrheal effect while the 450 mg/kg bw most potent antidiarrheal effect. Increasing doses of ethanol extract of tamarind seeds showed the that increase antidiarrheal effects. Statistical analysis showed administration of ethanol extract tamarind seeds suspension 2% at a dose of 150 mg/kg bw and 450 mg/kg bw in adult mice male showed an effective antidiarrheal effects were not significantly different as loperamide 0.52 mg/kg bw which shows the effect antidiarrheal in different test average Duncan (P > 0.05).
BAB I
PENDAHULUAN
1.1 Latar belakang
Masyarakat Indonesia telah lama mengenal dan menggunakan tumbuhan obat
sebagai salah satu upaya menanggulangi masalah kesehatan. Pengetahuan tentang tumbuhan obat berdasarkan pengalaman dan keterampilan secara turun-temurun, telah diwariskan dari satu generasi ke generasi berikutnya. Penggunaan bahan alam
sebagai obat tradisional di Indonesia telah dilakukan nenek moyang kita sejak berabad-abad yang lalu (Sari, 2006).
Tanaman asam jawa (Tamarindus indica L.) secara tradisional banyak digunakan dalam pengobatan. Salah satu bagian tanaman yang digunakan adalah bijinya untuk asma, bronkitis, kusta, tuberkulosis, luka, sakit perut, diare, disentri,
vertigo dan diabetes. Senyawa aktif yang terdapat dalam biji asam jawa adalah senyawa tannin, asam lemak, flavonoid, saponin, alkaloid dan glikosida. (Suralkar, et al., 2013). Di daerah Jawa Timur cara penggunaan biji asam jawa terlebih dahulu
direndam dan direbus dengan air atau diolah menjadi tepung mengobati disentri dan diare. Selain itu tepungnya juga digunakan untuk membuat kue atau roti. Kulit biji
mengandung phlobatannnin sekitar 35% dan biji mengandung albuminoid serta pati (Nuraini, 2011).
Biji asam jawa mengandung tanin dan senyawa polifenol seperti katekin dan
banyak jenis procyanidin, terutama oligomer procyanidin tetramer sekitar 30,2%, procyanidin heksamer 23,8%, procyanidin trimer 18,1%, procyanidin pentamer
luteolin dan naringenin (Sudjaroen, 2005; Deepti, et al., 2013). Senyawa katekin dan
epikatekin merupakan jenis tanin yang berkhasiat sebagai antidiare (Wiryowidagdo, 2007). Tanin bekerja sebagai adstringen yang dapat menciutkan selaput lendir usus
sehingga digunakan sebagai obat antidiare (Tan dan Rahardja, 2007).
Diare adalah keadaan frekuensi dan likuiditas buang air besar yang abnormal.
Keadaan diare terjadi adanya suatu perubahan dalam buang air besar, baik frekuensi yang menjadi lebih sering (lebih dari 4 kali pada bayi dan lebih dari 3 kali untuk anak dan dewasa dalam satu hari) maupun konsistensinya yang menjadi lebih cair
(Sukandar, et al., 2008). Keadaan diare terdapat gangguan dari resorpsi, sedangkan sekresi getah lambung-usus dan motilitas usus meningkat. Diare juga merupakan
suatu gejala dari penyakit-penyakit tertentu atau gangguan lain. Kasus ini banyak terjadi di negara-negara berkembang dengan standar hidup yang rendah, dimana dehidrasi akibat diare merupakan salah satu penyebab kematian pada anak-anak (Tan
dan Rahardja, 2007). Salah satu metode pengujian antidiare adalah metode transit intestinal yaitu untuk mengukur perjalanan norit sebagai parameter motilitas usus . Berdasarkan tinjauan patofisiologinya, salah satu mekanisme penyebab diare adalah
gangguan motilitas usus (Vogel, 2002).
Berdasarkan uraian diatas, maka peneliti tertarik untuk melakukan uji
aktivitas antidiare ekstrak biji asam jawa (Tamrindus indica L.) suku leguminosae terhadap mencit jantan dengan metode transit intestinal.
1.2 Perumusan Masalah
Berdasarkan uraian di atas maka perumusan masalah pada penelitian ini
a.apakah karakteristik simplisia dan ekstrak etanol biji asam jawa dapat
ditentukan ?
b.apa sajakah golongan senyawa kimia yang terdapat pada simplisia dan ekstrak
etanol biji asam jawa?
c.apakah ekstrak etanol biji asam jawa dapat memberikan efek antidiare pada
mencit jantan?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka dibuat hipotesis sebagai berikut:
a. karakteristik simplisia dan ekstrak etanol biji asam jawa dapat ditentukan. b. golongan senyawa kimia yang terdapat pada serbuk simplisia dan ekstrak
etanol biji asam jawa yaitu golongan alkaloid, flavonoid, tannin, saponin,
glikosida dan steroid/ triterpenoid.
c. ekstrak etanol biji asam jawa dapat memberikan efek sebagai antidiare pada mencit jantan.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah:
a. untuk mengetahui karakteristik simplisia dan ekstrak etanol biji asam jawa b. untuk mengetahui golongan senyawa kimia yang terdapat pada serbuk
simplisia dan ekstrak etanol biji asam jawa.
1.5 Manfaat Penelitian
Manfaat yang diperoleh dari penelitian ini adalah:
a. meningkatkan pemanfaatan biji asam jawa sebagai obat diare.
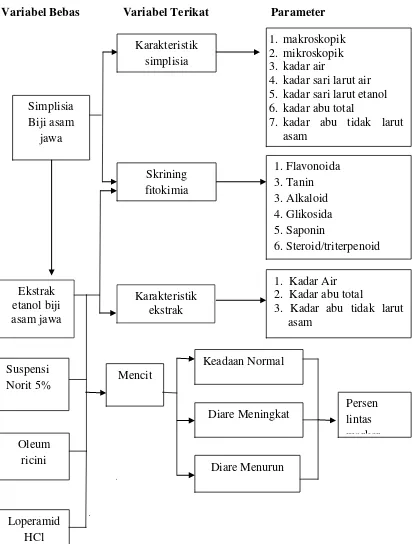
1.6 Kerangka Pikir Penelitian
Adapun kerangka pikir penelitian ini ditunjukkan pada Gambar 1.1.
Variabel Bebas Variabel Terikat Parameter
\
Gambar 1.1 Diagram Kerangka Pikir Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Asam jawa tergolong kedalam jenis pohon dan berumur panjang (menahun).
Pohon buah tropis ini asli dari savana Afrika tetapi sekarang sudah banyak ditemukan di negara-negara tropis dan di Asia terdapat di Indonesia. Dapat hidup di tempat bersuhu sampai 47°C, tapi sangat sensitif terhadap es. Umumnya tumbuh di daerah bercurah hujan 500 – 1.500 mm/tahun, bahkan tetap hidup pada curah hujan
350 mm jika diberi irigasi saat penanaman.
2.1.1 Klasifikasi tanaman asam jawa
Klasifikasi taksonomi tanaman asam jawa (Bhadoriya, et al., 2011) adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Subdivisi : Angiospermae
Kelas : Dicotyledoneae Ordo : Fabales
Suku : Leguminosae Genus : Tamarindus
Jenis : Tamarindus indica L.
2.1.2 Nama daerah
Nama daerah asam jawa: asam jawa, kayu asam (sumatera), tangkal asem, wit asam (jawa), asam jawa (Kalimantan), celangi (nusa tenggara), asam jawi, camba
(Sulawesi), asam jawaka (Maluku) (Nuraini, 2011).
2.1.3 Kandungan kimia tumbuhan
Biji asam jawa mengandung tanin dan senyawa polifenol seperti katekin dan banyak jenis procyanidin, terutama oligomer procyanidin tetramer sekitar 30,2%, procyanidin heksamer 23,8%, procyanidin trimer 18,1%, procyanidin pentamer
17,6%, procyanidin B2 5,5%, epikatekin 4,8%, taxifolin, apigenin, eriodictyol, luteolin dan naringenin (Sudjaroen, 2005; Deepti, et al., 2013). Daging buah asam
jawa mengandung 8 - 14% asam tartarat, 30 - 40% gula serta sejumlah kecil asam sitrat dan kalium bitaetrat sehingga berasa sangat masam. Daun asam jawa mengandung erpenoid, saponin, flavonoid dan asam-asam organik
2.1.4 Morfologi tumbuhan
Asam jawa merupakan pohon dengan tinggi batang mencapai 15 - 25 m, bercabang banyak , berkayu keras. Daun majemuk menyirip genap, panjang 5 - 13
cm, terdapat 10 - 15 pasang anak daun yang duduknya berhadapan dan bertangkai sangat pendek, hamper duduk. Helaian anak daun bentuknya bulat panjang, ujung
dan pangkal membulat, bagian tepi rata. Kedua permukaan daun halus dan licin, berwarna hijau dengan warna sisi bawah lebih muda, panjang 1 - 2,5 cm, lebar 0,5 - 1 cm. bunga dalam berbentuk tandan yang panjangnya 2 - 16 cm, terdiri atas 6 - 30
kuntum bunga yang letaknya hamper duduk, berwarna kuning berurat merahkeluar dari ketiak daun atau ujung percabangan. Buah polong, bertangkai, bulat panjang
kerap menyempit, kulit dinding luar rapuh dan berwarna coklat muda. Daging buah
berwarna kuning sampai coklat kekuningan dan rasanya asam. Dalam satu buah terdapat 1 - 12 biji yang memiliki panjang sampai 18 mm, bentuk tidak teratur,
warna kemerah-merahan, coklat tua atau hitam mengkilap. Inti biji :lurus ada putih lembaga (Nuraini, 2011).
2.2 Simplisia dan Ekstrak
2.2.1 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain, berupa bahan yang
telah dikeringkan. Simplisia dibedakan menjadi simplisia nabati, simplisia hewani dan simplisia pelikan (mineral). Simplisia nabati adalah simplisia yang berupa tumbuhan utuh, bagian tumbuhan atau eksudat tumbuhan (Ditjen POM, 2000).
2.2.2 Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, kemudian semua
atau hampir semua pelarut diuapkan dan masa atau serbuk yang tersisa diperlakukan sedemikian sehingga memenuhi standar yang telah ditetapkan (Ditjen POM, 1995).
Ekstraksi adalah kegiatan penarikan kandungan kimia dengan menggunakan pelarut yang sesuai. Menurut Ditjen POM (2000) metode ekstraksi dengan menggunakan pelarut dapat dibagi kedalam dua cara, yaitu:
a. Cara dingin, yaitu:
1. Maserasi adalah proses pengekstraksian simplisia dengan menggunakan pelarut
(kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian
konsentrasi pada keseimbangan. Maserasi kinetic berarti dilakukan pengadukan yang kontinu (terus-menerus). Remaserasi berarti dilakukan pengulangan
penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
2. Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap
perkolasi sebenarnya (penetesan/penampungan ekstrak) terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1 - 5 kali bahan.
b. Cara panas
1. Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya
pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3 - 5 kali sehingga dapat termasuk proses ekstraksi sempurna.
2. Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru, yang umumnya
dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
3 Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40 - 50°C.
4 Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangans air mendidih, temperatur terukur 90°C) selama 15
5 Dekok adalah infus pada waktu yang lebih lama (≥ 30 menit) dan temperatur
sampai titik didih air.
2.3 Uraian Saluran Pencernaan
Sistem gastrointestinal merupakan pintu gerbang masuknya zat makanan,
vitamin, mineral dan cairan ke dalam tubuh. Protein, lemak dan karbohidrat kompleks diuraikan menjadi unit-unit yang dapat diserap (dicerna), terutama di usus halus dan hasilnya menembus mukosa dan masuk ke dalam limfe atau darah
(penyerapan). Pencernaan zat makanan melibatkan kerja sejumlah besar enzim pencernaan yang dibantu oleh asam klorida yang disekresi oleh lambung dan empedu
yang disekresi oleh hepar (Ganong, 2008).
Saluran cerna berfungsi untuk menyerap zat makanan, zat-zat penting, garam dan air serta mengekskresi bagian makanan yang tak diserap dan sebagian hasil akhir
metabolisme. Dengan proses pencernaan yaitu proses penguraian dengan bantuan enzim, diubah protein, karbohidrat dan lemak, menjadi bentuk yang dapat diserap (Mutschler, 1991).
Makanan dicerna menjadi bubur (chimus) di dalam lambung yang kemudian diteruskan ke usus halus untuk diuraikan lebih lanjut oleh enzim-enzim pencernaan.
Setelah zat-zat gizi diabsorpsi oleh villi ke dalam darah, sisa chimus yang terdiri dari 90% air dan sisa makanan yang sukar dicernakan, diteruskan ke usus besar (kolon). Bakteri-bakteri yang biasanya selalu berada disini (flora) mencernakan lagi sisa-sisa
laun isi usus menjadi lebih padat dan dikeluarkan dari tubuh sebagai tinja (Tan dan
Rahardja, 2007).
2.3.1 Rongga mulut
Rongga mulut merupakan awal dari saluran cerna dan tempat makanan (padat) dikunyah menjadi halus dan dicampur dengan ludah. Pada saat mengunyah yang
berperan penting adalah gigi, otot pengunyah, lidah, pipi, dasar mulut dan langit-langit. Proses menelan dimulai secara sadar dan kemudian berlanjut secara reflex, makanan yang dilapisi ludah akan masuk melalui faring ke esofagus (Tan dan
Rahardja, 2007).
2.3.2 Lambung
Anatomi lambung manusia dibedakan atas beberapa bagian yaitu bagian kardia (daerah bermuaranya esofagus), fundus, korpus, antrum (pembesaran sebelum akhir lambung) dan pylorus. Makanan dicerna dalam lambung, tercampur dengan asam,
mukus dan pepsin, kemudian dikeluarkan ke dalam duodenum dengan kecepatan yang stabil dan terkendali. Mukosa lambung banyak mengandung kelenjar, di daerah pilorus dan kardia, kelenjar tersebut mensekresikan mukus. Di korpus lambung dan
fundus, kelenjar juga mengandung sel parietal yang mensekresikan asam klorida dan sel peptik yang mensekresikan pepsinogen. Sekret-sekret ini bercampur dengan
mukus (Ganong, 2008).
Apabila makanan masuk ke lambung, fundus dan bagian atas korpus akan melemas dan mengakomodasi makanan dengan sedikit peningkatan tekanan.
Peristaltik kemudian dimulai di bawah korpus yang mencampur dan menghaluskan makanan serta memungkinkan makanan dalam bentuk setengah cair mengalir sedikit
2.3.3 Usus halus
Di usus halus, isi usus tercampur dengan sekresi sel-sel mukosa, getah pancreas dan empedu. Pencernaan yang dimulai dari mulut dan lambung,
diselesaikan di lumen dan sel-sel mukosa usus tempat produk pencernaan diserap, bersamaan dengan sebagian besar vitamin dan cairan. Dalam usus halus terdapat
sekitar 9 liter air setiap hari yang terdiri dari 2 liter dari makanan dan 7 liter dari sekresi saluran cerna, tetapi hanya 1 - 2 liter yang sampai ke kolon. Sel mukosa di usus halus yang disebut dengan enterosit, memiliki sejumlah besar mikrovili yang
menutupi permukaan apikalnya. Di dalam mikrovili ini banyak terdapat enzim (Ganong, 2008).
Usus halus terdiri atas duodenum, jejenum dan ileum. Bagian pertama duodenum terkadang disebut duodenal cup atau bulb, daerah ini menerima isi lambung yang bersifat asam yang mengalir melalui pilorus. Berdasarkan
kesepakatan, 40% bagian atas usus halus sebelah distal duodenum disebut jejenum dan 60% sisanya disebut ileum walaupun tidak terdapat batasan anatomi yang jelas diantara keduanya. Katup ileosekum menandai titik berakhirnya ileum di kolon. Usus
halus berukuran lebih pendek pada keadaan hidup dibandingkan pada keadaan mati karena setelah kematian, otot di sebagian besar saluran cerna melemas sehingga
jarak yang diukur saat otopsi menjadi lebih panjang. Jarak dari pilorus ke katup ileosekum pada manusia hidup dikatakan sepanjang 285 cm (Ganong, 2008).
2.3.3.1Gerak peristaltik usus
Usus halus mencerna dan menyerap kimus dari lambung melalui serangkaian kontraksi otot polos, yaitu peristaltik dan segmentasi. Pada peristaltik, kontraksi ini
lumen (kimus) dan terjadi di semua bagian saluran cerna mulai dari esofagus sampai
rektum. Kontraksi ini mendorong kimus ke arah usus besar. Aktivitas peristaltik dapat meningkat atau menurun melalui input autonom (Ganong, 2008).
Kontraksi segmentasi merupakan kontraksi berbentuk cincin yang muncul dalam interval yang relatif teratur di sepanjang usus lalu menghilang dan digantikan
oleh serangkaian kontraksi cincin lain di segmen-segmen di antara kontraksi-kontraksi sebelumnya. Kontraksi ini mendorong kimus maju mundur dan meningkatkan pajanannya pada permukaan mukosa. Kontraksi segmentasi dipicu
oleh peningkatan lokal influx Ca2+ disertai gelombang peningkatan konsentrasi Ca2+ yang menyebar (Ganong, 2008).
Pada kontraksi segmentasi, memperlambat waktu transit di usus halus sehingga waktu transit sebenarnya lebih lama pada keadaan kenyang daripada keadaan puasa. Hal ini memungkinkan kimus berkontak lebih lama dengan enterosit sehingga
absorpsi meningkat. Gelombang peristaltik yang sangat kuat (peristaltic rush), tidak terjadi pada orang normal tetapi timbul pada usus yang mengalami obstruksi (Ganong, 2008).
2.3.4 Usus besar
Usus besar merupakan bagian akhir dari proses pencernaan yang dapat dibagi
menjadi cecum (usus buntu sekum), colon dan rectum. Diusus besar dengan pengentalan isi usus terbentuk feses. Pada sisi sebelah atas bermuara ileum dan melalui katup ileosekal isi usus halus akan masuk sedikit demi sedikit kedalam usus
2.3.5 Kolon
Fungsi utama kolon adalah penyerapan air, natrium dan mineral lainnya sehingga membuat tinja menjadi semi padat. Diameter kolon lebih besar daripada
diameter usus halus dan panjangnya sekitar 100 cm pada orang dewasa hidup dan sekitar 150 cm pada saat otopsi. Bagian ileum yang terdapat katup ileosekum
menonjol sedikit ke dalam sekum sehingga peningkatan tekanan kolon akan menutupnya sedangkan peningkatan tekanan ileum akan menyebabkan katup ileosekum terbuka. Jadi, katup ini mencegah refluks isi kolon ke dalam ileum. Katup
ini tertutup dalam keadaan normal. Setiap kali gelombang peristaltik mencapainya, katup ini terbuka sebentar dan memungkinkan sebagian kimus ileum masuk ke dalam
sekum (Ganong, 2008).
Kolon mengandung bakteri dalam jumlah besar meliputi Escherichia coli (E.coli), Enterobacter aerogenes, Bacteriodes fragilis. Sejumlah besar bakteri keluar
melalui tinja (Ganong, 2008). E. coli adalah anggota flora normal usus yang berperan penting dalam sintesis vitamin K, konversi pigmen-pigmen empedu, asam-asam empedu dan penyerapan zat-zat makanan. Bakteri ini menguraikan zat organik dalam
makanan menjadi zat anorganik, yaitu CO2, H2O, energi dan mineral (Ganiswarna, 1995).
E. coli menjadi patogen jika jumlah bakteri ini dalam saluran pencernaan meningkat atau berada di luar usus. E. coli menghasilkan enterotoksin yang menyebabkan beberapa kasus diare. E. coli berasosiasi dengan enteropatogenik
menghasilkan enterotoksin pada sel epitel. Toksin yang dihasilkan oleh E. coli
2.4 Uraian Diare
Diare secara umum didefinisikan sebagai bentuk tinja abnormal (cair) yang disertai dengan peningkatan frekuensi buang air besar yakni lebih dari tiga kali per
hari (Mutschler, 1991). Kandungan cairan merupakan penentu utama volume dan konsistensi feses dan air umumnya 70% sampai 85% dari berat feses total.
Kandungan cairan feses menggambarkan keseimbangan antara sekresi air dan elektrolit dan absorpsi di sepanjang saluran gastrointestinal. Diare merupakan kondisi ketidak seimbangan absorpsi dan sekresi air dan elektrolit (Sukandar, dkk.,
2008). Selama masa diare, terjadi peningkatan motilitas saluran cerna yang disertai peningkatan sekresi dan penurunan absorpsi cairan, yang mengakibatkan kehilangan
elektrolit (khususnya Na+) dan air (Rang, et al., 2007).
Pada diare infeksi, umumnya infeksi terdapat pada usus besar dan ujung distal ileum, menyebabkan mukosa teriritasi dan kecepatan sekresinya bertambah dan
pergerakan dinding usus biasanya meningkat (Guyton, 1990). Diare yang disebabkan oleh kolera, toksinnya langsung merangsang sekresi elektrolit dan cairan berlebihan pada ileum distalis dan kolon. Jika sejumlah besar Na+, K+ dan air keluar dari kolon
dan usus halus ke dalam tinja diare, akan menyebabkan terjadinya dehidrasi, kolaps kardiovaskular, hipovalemia dan akhirnya syok. Oleh karena itu, dasar pengobatan
yang penting adalah mengganti cairan elektrolit secepat kehilangannya (Guyton, 1990).
Terdapat 4 mekanisme patofisiologi yang mengganggu keseimbangan air dan
elektrolit yang mengakibatkan terjadinya diare (Sukandar, dkk., 2008) yaitu:
1. Perubahan transport ion aktif yang disebabkan oleh penurunan absorpsi
2. Perubahan motilitas usus
3. Peningkatan osmolaritas luminal
4. Peningkatan tekanan hidrostatik jaringan
2.4.1 Jenis-jenis diare
Berdasarkan penyebabnya dapat dibedakan beberapa jenis diare sebagai
berikut:
a. Diare akibat virus yang disebabkan antara lain oleh rotavirus dan adenovirus. Virus melekat pada sel mukosa usus dan menjadi rusak sehingga kapasitas
absorpsi menurun dan sekresi air dan elektrolit memegang peranan. Diare yang terjadi dapat bertahan terus sampai beberapa hari setelah virus lenyap dengan
sendirinya, biasanya dalam 3 - 6 hari.
b. Diare bakterial invasif (bersifat menyerbu). Kuman pada keadaan tertentu menjadi invasif ke dalam mukosa, dimana terjadi perbanyakan diri sambil membentuk
toksin. Enterotoksin ini dapat diserap ke dalam darah dan menimbulkan gejala hebat, seperti demam tinggi, nyeri kepala dan kejang-kejang. Selain itu mukosa usus yang telah dirusak mengakibatkan mencret berdarah dan berlendir. Penyebab
dari pembentuk enterotoksin ialah bakteri E. coli spec, Shigella, Salmonella dan Campylobacter. Diare ini bersifat “self-limiting”, artinya akan sembuh dengan
sendirinya dalam ± 5 hari tanpa pengobatan, setelah sel-sel yang rusak diganti dengan sel-sel mukosa baru.
c. Diare parasit, akibat protozoa seperti Entamoeba hystolica dan Giardia lamblia,
lainnya dapat berupa nyeri perut, demam, anoreksia, nausea, muntah-muntah dan
rasa letih.
d. Akibat penyakit, misalnya colitis ulcerosa, p. Crohn, Irritable Bowel Syndrom
(IBS), kanker kolon dan infeksi HIV. Juga akibat gangguan-gangguan seperti alergi terhadap makanan/minuman, protein susu sapi, serta intoleransi untuk
laktosa karena defisiensi enzim laktase.
e. Akibat obat, yaitu digoksin, kinidin, garam-Mg, litium, sorbitol, β-bloker, ACE inhibitors, reserpin, sitostatik dan antibiotik berspektrum luas. Semua obat ini dapat menimbulkan diare “baik” tanpa kejang perut dan perdarahan. Adakalanya
juga akibat penyalahgunaan laksansia dan penyinaran dengan sinar X
(radioterapi).
f. Akibat keracunan makanan. Keracunan makanan didefinisikan sebagai penyakit yang bersifat infeksi atau toksis dan diperkirakan atau disebabkan oleh
mengkonsumsi makanan tercemar. Penyebab utamanya adalah tidak memadainya kebersihan pada waktu pengolahan, penyimpanan dan distribusi dari makanan/minuman dengan akibat pencemaran meluas (Tan dan Rahardja, 2007).
Berdasarkan mekanisme patofisiologinya, pengelompokan diare secara klinis (Sukandar, dkk., 2008) yaitu:
a. Secretory diarrhea, terjadi ketika zat meningkatkan sekresi atau mengurangi penyerapan air dalam jumlah besar dan elektrolit. Zat yang menyebabkan kelebihan sekresi termasuk peptida intestinal vasoaktif (VIP) merangsang sekresi
b. Osmotic diarrhea, disebabkan oleh absorpsi zat-zat yang mempertahankan cairan
intestinal.
c. Exudative diarrhea, disebabkan oleh penyakit infeksi saluran pencernaan yang
mengeluarkan mukus, protein atau darah ke dalam saluran pencernaan.
d. Motilitas usus dapat berubah dengan mengurangi waktu kontak di usus halus,
pengosongan usus besar yang prematur dan pertumbuhan bakteri yang berlebihan. Berdasarkan waktu terjadinya, pengelompokan diare (Navaneethan dan Giannella, 2011) antara lain:
a. Diare akut
Diare ini berlangsung selama kurang dari dua minggu. Penyebabnya adalah
infeksi bakteri, virus, atau parasit, keracunan atau alergi terhadap makanan, reaksi obat seperti magnesium yang terdapat pada antasida, antibiotik, misoprostol, H2 reseptor bloker dan proton pum inhibitor.
b. Diare persisten
Diare ini berlangsung selama dua sampai empat minggu. Diare persisten merupakan kelanjutan dari diare akut, yang umumnya disebabkan karena infeksi
bakteri, virus, atau parasite. c. Diare kronik
Diare ini berlangsung selama lebih dari empat minggu. Penyebabnya adalah
irritable bowel syndrome (IBS), inflammatory bowel disease (IBD), kanker kolon, malabsorpsi lemak atau karbohidrat. karena penyakit kanker kolon dan rektum atau
penyakit yang berhubungan dengan gastrointestinal.
2.4.2 Obat antidiare
1. Kemoterapeutika untuk terapi kausal, yakni membrantas bakteri penyebab diare
seperti antibiotika, sulfonamida dan senyawa kinolon (Tan dan rahardja, 2007). 2. Obtipansia untuk terapi simtomatis yang dapat menghentikan diare. Ada beberapa
cara antara lain: a. Obat antimotilitas
Dua obat yang dipakai secara luas untuk mengendalikan diare adalah difenoksilat dan loperamid. Keduanya merupakan analog meperidin dan memiliki efek seperti opioid pada usus, mengaktifkan reseptor opioid presinaptik di dalam
sistem saraf enterik untuk menghambat pelepasan asetilkolin dan menurunkan peristaltik. Efek samping termasuk rasa mengantuk, kejang perut dan pusing. Karena
obat ini dapat menyebakan megakolon yang toksik, maka tidak digunakan pada anak-anak atau pasien dengan kolitis berat (Mycek, 2001). Loperamid adalah opioid yang paling tepat untuk efek lokal pada usus karena tidak mudah menembus ke
dalam otak. Oleh karena itu loperamid hanya mempunyai sedikit efek sentral dan tidak mungkin menyebabkan ketergantungan (Neal, 2006). Waktu paruhnya adalah 7 - 14 jam. Loperamid tidak diserap dengan baik melaui pemberian oral dan
penetrasinya ke dalam otak tidak baik. Sifat ini menunjang selektivitas kerja loperamid. Sebagian obat diekskresikan bersama tinja. Loperamid tersedia dalam
bentuk tablet 2 mg dan sirup 1 mg/5 ml dan digunakan dengan dosis 4 - 8 mg per hari (Dewoto, 2007).
b. Obat antikolinergik
Penggunaan agen antikolinergik untuk pengobatan diare didasarkan pada kemampuannya untuk mengurangi motilitas saluran usus. Dosis efektif yang
tingginya insiden efek samping. Agen antikolinergik memiliki margin sempit dari
segi keamanan, terutama pada anak-anak. Donnagel merupakan produk antidiare yang banyak digunakan, yang mengandung campuran alkaloid belladonna dan
adsorben kaolin dan pektin (Mycek, 2001). c. Obat adsorben
Obat-obat adsorben seperti kaolin, pektin, norit yang diaktifkan (karbon aktif) dan atapulgit, digunakan secara luas untuk mengendalikan diare. Diduga obat-obat ini bekerja dengan mengabsorpsi toksin intestinal dan mikroorganisme, atau dengan
melapisi atau melindungi mukosa intestinal. Obat-obat ini kurang efektif dibandingkan dengan obat-obat antimotilitas dan dapat mengganggu absorpsi obat
lain (Mycek, 2001). d. Adstringensia
Obat yang menciutkan selaput lendir usus, misalnya asam samak (tanin) dan
tannalbumin, garam-garam bismuth dan aluminium (Tan dan Kirana, 2007). 3. Spasmolitika
Merupakan zat-zat yang dapat melepaskan kejang-kejang otot yang sering kali
mengakibatkan nyeri perut pada diare, antara lain papaverin (Tan dan Rahardja, 2007).
2.5 Oleum Ricini
Oleum ricini atau castor oil atau minyak jarak, berasal dari Ricinus comunis,
suatu trigliserida ricinoleat dan asam lemak tidak jenuh. Di dalam usus halus minyak lemak terhidrolisis oleh enzim lipase menjadi gliserin dan asam risinoleat. Asam
sebagai emolien. Sebagai pencahar, obat ini tidak banyak digunakan lagi karena
banyak obat yang lebih aman. Minyak jarak menyebabkan kolik, dehidrasi yang disertai gangguan elektrolit. Obat ini merupakan bahan penginduksi diare secara
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental dengan tahapan penelitian yaitu penyiapan bahan tumbuhan, skrining fitokimia simplisia, karakterisasi
simplisia, pembuatan ekstrak, skrining ekstrak, karakterisasi ekstrak, penyiapan hewan percobaan dan pengujian efek antidiare secara oral pada hewan percobaan. Data-data hasil penelitian dianalisis secara ANAVA (analisis variansi) dan
dilanjutkan dengan uji beda Duncan menggunakan program SPSS (Statistical Product and Service Solution) versi 16.0.
Penelitian ini dilakukan di Laboratorium farmakognosi dan Laboratorium farmakologi Fakultas Farmasi Universitas Sumatera Utara, Medan.
3.1 Alat dan Bahan
3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas
laboratorium, aluminium foil, kertas saring, lampu spritus, lemari pengering, mikroskop (Boeco), mortir dan stamfer, neraca hewan (Presica), neraca kasar, neraca
listrik (Vibra), oral sonde, perkolator, rotary evaporator (Heidolph VV-300), seperangkat alat destilasi penetapan kadar air, spuit 1 ml (Terumo), stopwatch, seperangkat alat bedah hewan dan meja bedah.
3.1.2 Bahan-bahan
loperamid HCl (tablet imodium®), karboksi metil selulsa (CMC), oleum ricini, norit,
kloralhidrat, kloroform, toluene, etanol 80%.
3.2 Hewan Percobaan
Hewan percobaan yang digunakan dalam penelitian adalah mencit putih
jantan dengan berat badan 20 - 30 gram berumur 2 - 3 bulan. Sebelum digunakan, mencit dipelihara selama 2 minggu dalam kandang yang baik untuk menyesuaikan diri dengan lingkungannya dan diberi makan pelet hewan serta minum air.
3.3 Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi terdiri dari asam klorida 2N, asam sulfat 2N, besi (III) klorida 1%, Bouchardat, Dragendorff, kloralhidrat, Mayer, Molish, natrium hidroksida 2N dan timbal (II) asetat 0,4M (Depkes RI,1995). Liebermann-Burchard
menurut Harborne (1987).
3.3.1 Besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml
kemudian disaring.
3.3.2 Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air suling, ditambahkan iodium sebanyak 2 g dan dicukupkan dengan air sulisng hingga 100 ml.
3.3.3 Dragendorff
Sebanyak 0,85 g bismut (III) nitrat ditimbang, kemudian dilarutkan dalam 100 ml asam asetat glasial ditambahkan 40 ml air suling. Kemudian pada wadah lain
kedua larutan sama banyak. Kemudian ditambahkan 20 ml asam asetat glasial dan
diencerkan dengan air suling hingga 100 ml.
3.3.4 Mayer
Sebanyak 1,35 g raksa (II) klorida dilarutkan dalam 60 ml air suling. Kemudian pada wadah lain sebanyak 5 g kalium iodida dilarutkan dalam 10 ml air lalu
dicampurkan keduanya dan ditambahkan air suling hingga 100 ml.
3.3.5 Molish
Sebanyak 3 g α-naftol ditimbang, kemudian dilarutkan dalam asam nitrat 0,5
N hingga volume 100 ml.
3.3.6 Asam klorida 2 N
Sebanyak 7,3 ml asam klorida pekat dilarutkan dalam air suling hingga volume 100 ml.
3.3.7 Asam sulfat 2 N
Sebanyak 9,8 ml asam sulfat pekat kemudian diencerkan dengan air suling hingga 100 ml.
3.3.8 Natrium hidroksida 2 N
Sebanyak 8,002 g kristal natrium hidroksida dilarutkan dalam air suling hingga 100 ml.
3.3.9 Kloralhidrat
Sebanyak 50 g kloralhidrat dilarutkan dalam 20 ml air.
3.3.10 Liebermann-Bouchard
3.3.11 Timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air bebas karbondioksida hingga 100 ml.
3.4 Prosedur Pembuatan Simplisia
3.4.1 Pengambilan Bahan
Pengumpulan bahan dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Sampel yang digunakan adalah biji
asam jawa. Biji yang digunakan adalah biji buah asam jawa yang sudah masak. Sampel diambil dari Jl.Tridharma USU Medan, Sumatera Utara.
3.4.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi-LIPI Bogor.
3.4.3 Pengolahan bahan tumbuhan
Biji asam jawa dikumpulkan dari buah asam jawa yang sudah masak, dicuci bersih lalu ditiriskan. Kemudian ditimbang. Setelah itu bahan tumbuhan dikeringkan
di lemari pengering pada suhu 40°C sampai kering lalu diserbuk dengan alat grinder dan disimpan di tempat kering.
3.5 Karakteristik Simplisia
3.5.1 Pemeriksaan makroskopik
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap biji asam jawa dengan cara menaburkan serbuk biji asam jawa diatas kaca preparat lalu diteteskan larutan
kloralhidrat kemudian ditutup dengan kaca penutup dan diamati di bawah mikroskop dengan perbesaran 10 × 40.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode azeotropi (destilasi toluen). Cara penetapan: ke dalam labu alas bulat dimasukkan 200 ml toluena dan 2 ml
aquades, didestilasi selama 2 jam. Setelah toluena didinginkan dan volume air pada tabung penerima dibaca. Kemudian kedalam labu dimasukkan 5 g serbuk simplisia
yang telah ditimbang seksama, dipanaskan hati – hati selama 15 menit. Setelah toluena mendidih, kecepatan tetesan diatur, kurang lebih 2 tetes tiap detik, hingga sebagian air tersuling, kemudian naikkan kecepatan penyulingan hingga 4 tetes tiap
detik. Setelah semua tersuling, bagian dalam pendingin dibilas dengan toluena yang telah jenuh. Penyulingan dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Setelah air dan toluena memisah sempurna,
volume dibaca. Selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa (Ditjen POM, 1995).
3.5.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam akuades sampai 1 liter) dengan menggunakan botol
bersumbat warna coklat sambil sekali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 - 24 jam dan disaring, sejumlah 20 ml filtrat pertama diuapkan
dalam oven pada suhu 105ºC sampai diperoleh bobot tetap. Kadar sari yang larut
dalam air dihitung terhadap bahan yang telah dikeringkan diudara (Ditjen POM, 1995).
3.5.5 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk dimaserasi selama 24 jam dalam 100 ml etanol 96%
dengan menggunakan botol bersumbat berwarna coklat sambil sekali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 - 24 jam dan disaring. Sejumlah 20 ml filtrat pertama diuapkan hingga kering dalam cawan yang telah
dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 105ºC sampai diperoleh bobot tetap. Kadar sari larut dalam etanol dihitung terhadap bahan yang
telah dikeringkan diudara (Ditjen POM, 1995).
3.5.6 Penetapan kadar abu total
Lebih kurang 2 g zat yang telah digerus dan ditimbang seksama, dimasukkan
kedalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus porselen bersama isinya dipijarkan perlahan–lahan hingga arang habis, didinginkan, ditimbang sampai diperoleh bobot yang tetap. Kadasr abu dihitung terhadap bahan
yang telah dikeringkan diudara (Ditjen POM, 1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dengan 25 ml asam klorida encer selama 5 menit, dikumpulkan bagian yang tidak larut dalam asam, disaring dengan kertas saring, lalu dicuci dengan air panas. Kemudian residu
dan kertas saring dipijarkan sampai diperoleh bobot tetap, didinginkan dan ditimbang beratnya. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah
3.6 Skrining Fitokimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan senyawa golongan, flavonoid, alkaloid, saponin, tannin, glikosida dan steroid/triterpenoid.
3.6.1 Pemeriksaan Flavonoid
Serbuk simplisia ditimbang 0,5 g, lalu ditambahkan 10 ml metanol, direfluks
selama 10 menit, disaring panas-panas dengan kertas saring. Filtrat diencerkan dengan 10 ml air suling, setelah dingin ditambahkan 5 ml petroleum eter, dikocok hati-hati, lalu didiamkan sebentar. Lapisan metanol diambil, diuapkan pada
temperatur 40ºC, sisanya dilarutkan dalam 5 ml etil asetat, disaring. Filtratnya digunakan untuk uji flavonoid dengan cara berikut:
sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 1-2 ml etanol 96%, lalu ditambah 0,1 g serbuk Mg dan 10 tetes asam klorida pekat. Jika terjadi warna merah jingga sampai warna merah unggu menunjukkan adanya flavonoid. Jika
terjadi warna kuning jingga menunjukkan adanya flavon, kalkon dan auron (Ditjen POM, 1995).
3.6.2 Pemeriksaan Alkaloid
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit,
didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk tes alkaloid. Diambil 3 tabung reaksi, lalu ke dalamnya dimasukkan 0,5 ml filtrat. Pada masing-masing tabung reaksi:
a. ditambahkan 2 tetes pereaksi Mayer b. ditambahkan 2 tetes pereaksi Bouchardat
Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari tiga percobaan
diatas (Ditjen POM, 1995).
3.6.3 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi, ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat selama 10
detik, jika terbentuk buih yang mantap setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Ditjen POM, 1995).
3.6.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu disaring,
filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Ditjen POM, 1995).
3.6.5 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia ditimbang kemudian disari dengan 30 ml campuran etanol 96% dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks selama
2 jam, didinginkan dan disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat
disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Pada kumpulan sari lapisan isopropanolol diuapkan pada suhu tidak lebih dari 50ºC. Sisanya dilarutkan dalam 2 ml metanol untuk larutan percobaan 0,1
asam sulfat pekat melalui dinding tabung terbentuknya cincin berwarna ungu pada
batas kedua cairan menunjukkan adanya ikatan gula (Ditjen POM, 1995).
3.6.6 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap dan pada sisanya ditambahkan 20
tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi Liebermann-Burchard). Apabila terbentuk warna ungu atau merah yang berubah menjadi biru hijau menunjukkan adanya steroida/triterpenoida (Harborne, 1987).
3.7 Pemeriksaan Karakterisasi Ekstrak
Pemeriksaan karakterisasi ekstrak meliputi penetapan kadar air, penetapan kadar abu total, penetapan kadar abu tidak larut dalam asam (Kemenkes RI, 2011).
3.7.1 Penetapan kadar air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi toluen). Alat terdiri dari labu alas bulat 500 ml, pendingin, tabung penyambung dan tabung penerima 5 ml berskala 0,05 ml, alat penampung dan pemanas listrik.
Cara kerja:
Dimasukkan 200 ml toluen dan 2 ml air suling ke dalam labu alas bulat, lalu
didestilasi selama 2 jam. Setelah itu, toluen dibiarkan mendingin selama 30 menit dan dibaca volume air pada tabung penerima dengan ketelitian 0,05 ml (volume I). Kemudian ke dalam labu alas bulat tersebut dimasukkan 5 g ekstrak yang telah
ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan tetesan diatur lebih kurang 2 tetes tiap detik sampai sebagian
Setelah 2 jam didestilasi (semua air terdestilasi), bagian dalam pendingin dibilas
dengan toluen yang telah dijenuhkan. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen
memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml (volume II). Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam
bahan yang diperiksa. Kadar air dihitung dalam persen (Ditjen POM, 1995).
3.7.2 Penetapan kadar abu total
Sebanyak 2 g ekstrak dimasukkan dalam krus porselin yang telah dipijar dan
ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, jika arang masih tidak dapat dihilangkan, ditambahkan air panas, saring melalui kertas
saring bebas abu. Pijarkan sisa dan kertas saring dalam krus yang sama. Masukkan filtrat ke dalam krus, uapkan, pijarkan hingga bobot tetap, timbang. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.7.3 Penetapan kadar abu tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan,
disaring melalui kertas saring bebas abu, cuci dengan air panas, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam
asam dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.8 Pembuatan Ekstrak Etanol Biji Asam Jawa
Metode ekstraksi yang digunakan adalah maserasi. Langkah pembuatan ekstrak etanol biji asam jawa adalah sebagai berikut : Ekstrak dibuat dengan cara
simplisia biji asam jawa (450 g) dengan derajat halus yang cocok dimasukkan
kedalam bejana, kemudian dituangi dengan 75 bagian cairan etanol 80% (3,375 ml), ditutup dan dibiarkan selama 5 hari terlindung dari cahaya, sambil berulang-ulang
diaduk. Setelah 5 hari sari saring, ampas diperas. Ampas ditambah cairan penyari secukupnya diaduk dan disaring, sehingga diperoleh seluruh sari sebanyak 100
bagian (4500 ml). Bejana ditutup, dibiarkan ditempat sejuk, terlindung dari cahaya, selama 2 hari. Kemudian endapan dipisahkan. Hasil maserat yang diperoleh dikumpulkan dan dipekatkan dengan bantuan alat rotary evaporator sehingga
diperoleh ekstrak kental (Depkes, 1979).
3.9 Percobaan Efek Antidiare
Percobaan efek antidiare meliputi penyiapan hewan percobaan, bahan uji, obat pembanding (Loperamid HCl), Oleum Ricini dan pengujian efek antidiare.
3.9.1 Penyiapan Hewan Percobaan
Hewan yang digunakan adalah mencit putih jantan dengan berat 20 - 30 g dibagi 6 kelompok, 1 kelompok untuk normal, 1 kelompok untuk kontrol negatif, 1
kelompok untuk kontrol positif dan 3 kelompok uji. Tiap kelompok terdiri dari 5 ekor mencit. Sebelum digunakan sebagai hewan percobaan, semua mencit dipelihara
3.9.2 Penyiapan bahan dan pengujian efek antidiare
Penyiapan kontrol dan bahan uji meliputi penyiapan CMC-Na 0,5%, penyiapan suspensi loperamid HCl dan penyiapan suspensi ekstrak etanol biji asam
jawa.
3.9.2.1 Pembuatan CMC-Na 0,5%
Pembuatan suspensi CMC-Na 0,5% (b/v) dilakukan dengan cara sebagai berikut: sebanyak 500 mg CMC-Na ditaburkan kedalam lumpang yang berisi air panas sebanyak 10 ml. Didiamkan selama 15 menit hingga diperoleh massa yang
transparan, digerus hingga berbentuk gel dan diencerkan dengan sedikit air, kemudian dituang ke dalam labu tentukur 100 ml, ditambahkan air suling sampai
batas tanda.
3.9.2.2 Pembuatan suspensi tablet loperamid HCl
Tablet Imodium® mengandung 2 mg loperamid HCl, ditimbang sebanyak 20
tablet. Tablet digerus dan diambil serbuk sebanyak 29,21 mg. serbuk dimasukkan ke dalam kemudian lumpang dan ditambahkan suspensi CMC-Na 0,5% sedikit demi sedikit sambil digerus homogen lalu ditambahkan suspensi CMC-Na 0,5% hingga 10
ml.
3.9.2.3 Pembuatan suspensi ekstrak etanol biji asam jawa 2 %
Pembuatan suspensi ekstrak biji asam jawa 2% (b/v) dilakukan dengan cara sebagai berikut: sebanyak 200 mg ekstrak biji asam jawa dimasukkan kedalam lumpang, ditambahkan suspensi CMC-Na 0,5% secukupnya kemudian digerus
3.9.2.4 Pengujian efek antidiare
Mencit dibagi menjadi 6 kelompok, masing-masing kelompok terdiri dari 5 ekor mencit.
Kelompok I : kelompok kontrol, hewan diberi suspensi norit 5% sebanyak 0,1 ml/10 g bb
Kelompok II : hewan diberikan oleum ricini 0,5 ml (kondisi diare) Kelompok III : hewan diberikan suspensi EEBAJ dosis 50 mg/kg bb Kelompok IV : hewan diberikan suspensi EEBAJ dosis 150 mg/kg bb
Kelompok V : hewan diberikan suspensi EEBAJ dosis 450 mg/kg bb Kelompok VI : hewan diberikan suspensi loperamid dosis 0,52 mg/kg bb
MENIT KE 0 :
Kelompok I : kelompok kontrol, hewan diberi suspensi norit 5% sebanyak 0,1 ml/10 g bb
Kelompok II : hewan diberikan oleum ricini 0,5 ml (Mamoon dan Azam, 2012)
Kelompok III : hewan diberikan suspensi EEBAJ dosis 50 mg/kg bb
Kelompok IV : hewan diberikan suspensi EEBAJ dosis 150 mg/kg bb Kelompok V : hewan diberikan suspensi EEBAJ dosis 450 mg/kg bb Kelompok VI : hewan diberikan suspensi loperamid dosis 0,52 mg/kgbb
MENIT KE 60 :
Kelompok I : hewan dikorbankan dengan cara dislokasi tulang leher
Kelompok II : hewan diberikan norit 5% sebanyak 0,1 ml/10 g bb Kelompok III, IV, V dan VI:
MENIT KE 120
Kelompok II : hewan dikorbankan dengan cara dislokasi tulang leher Kelompok III, IV, V dan VI:
hewan diberikan norit 5% sebanyak 0,1 ml/10 g bb (Chitme, dkk., 2004). MENIT KE 180
Kelompok III, IV, V dan VI:
hewan dikorbankan dengan cara dislokasi tulang leher.
Setelah hewan dikorbankan, usus dikeluarkan secara hati-hati. Diukur
panjang usus yang dilalui marker norit mulai dari pylorus sampai ujung akhir berwarna hitam dan panjang seluruh usus dari pilorus sampai rektum dari
masing-masing hewan coba. Kemudian dari masing-masing-masing-masing mencit dihitung persen lintas yang dilalui marker norit terhadap panjang usus seluruhnya (Chitme, dkk., 2004). Untuk persentase lintas norit:
= X 100%
3.10 Pengumpulan Data
Nilai rasio kemudian dirata-ratakan untuk masing-masing kelompok dan nilai dari masing-masing kelompok tersebut dibandingkan dengan kelompok lainnya.
Efek antidiare dinyatakan positif jika nilai rasio jarak usus yang ditempuh oleh suatu marker dalam waktu tertentu terhadap panjang usus keseluruhan pada
3.11 Analisis Data
Data hasil pengamatan persen lintas marker norit dianalisis secara statistic dengan metode ANAVA (analisis variansi) pada tingkat kepercayaan 95%
BAB IV
HASIL DAN PEMBAHASAN
4.1 Pemeriksaan Bahan Tumbuhan
4.1.1 Identifikasi bahan tumbuhan
Hasil identifikasi tumbuhan yang dilakukan oleh Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor, Indonesia, menunjukkan bahwa tumbuhan yang digunakan adalah
asam jawa (Tamarindus indica L.) suku Leguminosae.
4.1.2 Hasil karakterisasi simplisia dan ekstrak
Hasil pemeriksaan makroskopik simplisia biji asam jawa yaitu berbentuk tidak
teratur dengan panjang sekitar 1,6 cm, memiliki ketebalan ± 0,3 cm, keras dan warna coklat kemerahan atau hitam mengkilap yang dapat dilihat pada Lampiran 2. Hasil
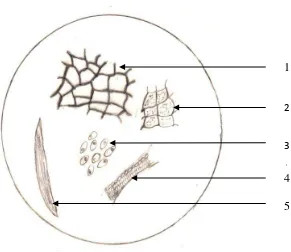
pemeriksaan mikroskopik serbuk simplisia biji asam jawa terlihat adanya parenkim, pembuluh kayu dan pati yang dapat dilihat pada Lampiran 3
Menurut Kemenkes RI (2011), suatu simplisia dan ekstrak yang akan
digunakan sebagai bahan baku obat harus memenuhi persyaratan mutu yang tercantum dalam monografi terbitan resmi Kementerian Kesehatan RI (Farmakope