EFEK ANTIBAKTERI EKSTRAK LERAK DALAM
PELARUT ETANOL TERHADAP
Enterococcus faecalis
(PENELITIAN
IN VITRO)
SKRIPSI
Diajukan untuk memenuhi tugas dan melengkapi syarat guna memperoleh gelar Sarjana Kedokteran Gigi
Oleh :
RISYA DINI MARSA NIM : 060600106
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA
Fakultas Kedokteran Gigi
Departemen Ilmu Konservasi Gigi
Tahun 2010
Risya Dini Marsa
Efek Antibakteri Ekstrak Lerak dalam Pelarut Etanolterhadap Enterococcus
faecalis (Penelitian In vitro)
x + 49 halaman
E.faecalis merupakan bakteri yang sulit dieleminasi dan resisten terhadap antimikrobial yang umum digunakan sehingga sering dijumpai pada perawatan endodontik yang gagal. Chemomechanical cleansing bertujuan untuk membunuh bakteri, membersihkan dan melebarkan saluran akar. Irigan yang umum digunakan mempunyai kadar toksisitas tinggi sehingga dicari bahan alami bersifat biokompatibel. Lerak dipilih karena terbukti memiliki efek antibakteri dan antifungal.
Tujuan penelitian untuk mengetahui efek antibakteri ekstrak lerak dalam pelarut etanol terhadap E.faecalis dengan melihat nilai Minimum Inhibitory Concentration (MIC) dan Minimum Bactericidal Concentration (MBC).
inkubator CO2. Amati kekeruhan, bandingkan dengan kontrol untuk menentukan
MIC.
Setelah penentuan MIC, tiap kelompok divorteks, diambil 50 µl, diteteskan ke media padat, direplikasi 6 petri, diamkan 15-20 menit lalu diinkubasi pada 37°C, 24 jam menggunakan inkubator CO2. Lanjutkan dengan perhitungan koloni bakteri dengan metode Drop Plate Mills Mesra.
Hasil penelitian menunjukkan bahwa ekstrak lerak dalam pelarut etanol mempunyai efek antibakteri terhadap E.faecalis dengan nilai MBC 25 %.
LEMBAR PENGESAHAN
SKRIPSI INI TELAH DISETUJUI UNTUK DISEMINARKAN PADA TANGGAL 12 MARET 2010
OLEH :
Pembimbing
Nevi Yanti, drg., M.Kes NIP : 19631117 199203 2 004
Mengetahui
Ketua Departemen Ilmu konservasi Gigi Fakultas Kedokteran Gigi
Universitas Sumatera Utara
PERNYATAAN PERSETUJUAN
Skripsi berjudul
EFEK ANTIBAKTERI EKSTRAK LERAK DALAM PELARUT ETANOL TERHADAP Enterococcus faecalis (PENELITIAN IN VITRO)
Yang dipersiapkan dan disusun oleh : RISYA DINI MARSA
NIM : 060600106
Telah dipertahankan didepan tim penguji pada tanggal 12 Maret 2010
dan dinyatakan telah memenuhi syarat untuk diterima Susunan Tim Penguji Skripsi
Ketua Penguji
Nevi Yanti, drg., M.Kes 19631117 199203 2 004
Anggota tim penguji lain
Prof.Trimurni Abidin,drg.,M.Kes,Sp.KG Prof.Dr.Rasinta Tarigan,drg.,Sp.KG NIP : 19500828 197902 2 001 NIP : 19410830 196509 1 001
Medan, 12 Maret 2010 Fakultas Kedokteran Gigi Departemen Ilmu Konservasi Gigi
Ketua,
KATA PENGANTAR
Puji syukur kepada Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini sebagai salah satu syarat untuk mendapatkan gelar Sarjana Kedokteran Gigi pada Fakultas Kedokteran Gigi Universitas Sumatera Utara.
Pada kesempatan ini, penulis ingin menyampaikan terima kasih yang sebesar-besarnya kepada ayahanda dan ibunda tercinta, H. Bambang Risbagio, SE dan Hj. Yati Roesnawi, drg yang telah begitu banyak memberikan pengorbanan untuk membesarkan, mendidik, memberikan kasih sayang, cinta, bimbingan dan semangat yang tidak akan terbalaskan. Tidak lupa penulis ucapkan terima kasih untuk kakak dan abangku yaitu Ninin, Ninoy dan Kiki yang telah memberi banyak dukungan.
Dalam penelitian dan penulisan skripsi ini, penulis mendapatkan banyak bantuan dan bimbingan dari berbagai pihak. Untuk itu, dengan segala kerendahan hati dan penghargaan yang tulus, penulis menyampaikan rasa terima kasih kepada :
1. Prof. H. Ismet Danial Nasution, drg., Ph.D, Sp.Pros(K) selaku Dekan Fakultas Kedokteran Gigi Universitas Sumatera Utara.
2. Prof. Trimurni Abidin, drg., M.Kes., Sp.KG(K) selaku Ketua Departemen Ilmu Konservasi Gigi Fakultas Kedokteran Gigi Universitas Sumatera Utara yang telah memberikan saran dan masukan dalam penyelesaian skripsi ini. 3. Nevi Yanti, drg., M.Kes selaku dosen pembimbing skripsi yang telah banyak
4. Lasminda Syafiar, drg., M.Kes selaku dosen pembimbing akademik di Fakultas Kedokteran Gigi Universitas Sumatera Utara.
5. Seluruh staf pengajar dan tenaga administrasi FKG USU terutama Departemen Ilmu Konservasi Gigi yang telah memberikan bantuan, saran dan bimbingan kepada penulis.
6. Drs. Awaluddin Saragih, M.Si., Apt, kak Puji dan seluruh staf laboratorium Farmasi Universitas Sumatera Utara yang turut membantu mengerjakan penelitian ini.
7. Wahyu Hidayatiningsih, S.Si., M.Kes selaku peneliti di Laboratorium Pusat Penyakit Tropis Surabaya yang telah meluangkan waktunya, membimbing, dan membantu pelaksanaan penelitian ini.
8. Prof. Dr. Dwi Suryanto, drs., B.Sc., M.Sc selaku Ketua Departemen Biologi Fakultas MIPA USU atas pemikirannya dalam pelaksanaan skripsi ini.
9. Teman-teman terbaikku, Nanda, Tika, Luki, Noni, Uul, Esti, Wina, Mita, Lita dan Dita atas dukungan, semangat, doa, harapan dan kebersamaan kita selama saya mendapat pendidikan di FKG USU ini.
10. Ahmad Affandi yang selalu bisa memberikan semangat, dukungan dan bantuan yang sangat banyak, kapan dan di mana saja.
11. Tari, Tiwi, Lusi, Ratih dan Yanda atas bantuan, dukungan, saran dan kebersamaan selama penelitian ini berlangsung.
13. Kak Lia dan Kak Roza yang selalu meluangkan waktunya dan memberikan masukan, motivasi dan bimbingan yang sangat berguna selama saya mengerjakan skripsi ini.
14. Semua pihak yang telah banyak membantu penulisan skripsi ini yang tidak dapat saya sebutkan satu persatu.
Penulis mengucapkan banyak terima kasih kepada semua pihak yang telah turut membantu dan memohon maaf apabila ada kesalahan selama melakukan penelitian dan penyusunan skripsi ini.
Penulis menyadari bahwa skripsi ini jauh dari sempurna, untuk itu diharapkan saran dan kritik yang membangun untuk kesempurnaan skripsi ini. Semoga hasil karya atau skripsi ini dapat memberikan sumbangan pikiran yang berguna bagi fakultas, pengembangan ilmu dan masyarakat.
Medan, 12 Februari 2010
Penulis,
Risya Dini Marsa
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN JUDUL... ii
HALAMAN PERSETUJUAN... iii
KATA PENGANTAR....……….. iv
DAFTAR ISI..………... vii
DAFTAR TABEL………... ix
DAFTAR GAMBAR……….... x
DAFTAR LAMPIRAN...……… xii
BAB 1 PENDAHULUAN 1.1 Latar Belakang Masalah……..……….….. 1
1.2 Rumusan Masalah………... 4
1.3 Tujuan Penelitian……….... 4
1.4 Manfaat Penelitian……….…. 5
BAB 2 TINJAUAN PUSTAKA 2.1 Enterococcus faecalis sebagai salah satu bakteri yang terdapat pada infeksi saluran akar... 6
2.2. Buah Lerak (Sapindus rarak DC)... 13
BAB 3 KERANGKA KONSEPTUAL DAN HIPOTESA PENELITIAN 3.1 Kerangka Konsep……….……...………. 16
3.2 Hipotesa Penelitian………....……….……….. 17
4.2 Populasi, sampel dan besar sampel……….….. 18
4.3 Variabel Penelitian ………..………...……... 20
4.4 Definisi Operasional……….………... 22
4.5 Bahan dan Alat Penelitian... ………...………... 23
4.6 Tempat dan Waktu Penelitian... 24
4.7 Prosedur Penelitian... 24
4.8 Analisa Data... 30
BAB 5 HASIL PENELITIAN 5.1 Ekstrak kental lerak... 31
5.2 Uji efektifitas antibakteri………... 31
BAB 6 PEMBAHASAN... 34
BAB 7 KESIMPULAN DAN SARAN 7.1 Kesimpulan... 42
7.2 Saran... 42
DAFTAR PUSTAKA... 43
DAFTAR TABEL
Tabel Halaman
1. Faktor virulen E.Faecalis dan fungsinya... 11 2. Hasil perhitungan jumlah bakteri untuk bahan coba ekstrak
DAFTAR GAMBAR
Gambar Halaman
1. Koloni Enterococcus faecalis dengan scanning electron microscope... 7
2. Scanning electron microscopy (a,b) Saluran akar tertutup oleh biofilm E.faecalis (c,d) agregasi sel bakteri ke tubulus dentinal... 8
3. Sebuah model penyakit endodontik terkait dengan faktor-faktor virulensi E. Faecalis... 9
4. Buah lerak yang berasal dari Desa Maga, Kecamatan Panyabungan Tapanuli Selatan... 13
5. Penimbangan buah lerak... 25
6. Pemotongan daging buah lerak... 26
7. Lemari pengering... 26
8. Potongan lerak di lemari pengering... 26
9. Potongan lerak yang sudah kering... 26
10. Potongan lerak diblender... 26
11. Simplisia lerak...………... 26
12. Simplisia di dalam perkolator... 27
13. Vaccum rotavapor... 27
14. Media Mueller Hinton Agar (Difco, USA)... 28
15. Ekstrak kental lerak... 31
16. Pertumbuhan bakteri pada media perbenihan pada ekstral lerak dalam pelarut etanol... 33
17. Tidak ada pertumbuhan bakteri pada media perbenihan pada ekstrak lerak dalam pelarut etanol 100 %, 50 % dan 25 %……….…… 33
DAFTAR LAMPIRAN
Lampiran Halaman
1. Alur ekstraksi tanaman Sapindus rarak DC... 46 2. Penyiapan suspensi bakteri
3.1 Pembuatan media pertumbuhan ... 47 3.2 Pembuatan suspensi bakteri ... 47 3. Alur pengujian efek antibakteri ekstrak lerak dalam pelarut etanol ... 48 4. Tabel hasil uji antibakteri ekstrak lerak dalam pelarut etanolterhadap
Fakultas Kedokteran Gigi
Departemen Ilmu Konservasi Gigi
Tahun 2010
Risya Dini Marsa
Efek Antibakteri Ekstrak Lerak dalam Pelarut Etanolterhadap Enterococcus
faecalis (Penelitian In vitro)
x + 49 halaman
E.faecalis merupakan bakteri yang sulit dieleminasi dan resisten terhadap antimikrobial yang umum digunakan sehingga sering dijumpai pada perawatan endodontik yang gagal. Chemomechanical cleansing bertujuan untuk membunuh bakteri, membersihkan dan melebarkan saluran akar. Irigan yang umum digunakan mempunyai kadar toksisitas tinggi sehingga dicari bahan alami bersifat biokompatibel. Lerak dipilih karena terbukti memiliki efek antibakteri dan antifungal.
Tujuan penelitian untuk mengetahui efek antibakteri ekstrak lerak dalam pelarut etanol terhadap E.faecalis dengan melihat nilai Minimum Inhibitory Concentration (MIC) dan Minimum Bactericidal Concentration (MBC).
inkubator CO2. Amati kekeruhan, bandingkan dengan kontrol untuk menentukan
MIC.
Setelah penentuan MIC, tiap kelompok divorteks, diambil 50 µl, diteteskan ke media padat, direplikasi 6 petri, diamkan 15-20 menit lalu diinkubasi pada 37°C, 24 jam menggunakan inkubator CO2. Lanjutkan dengan perhitungan koloni bakteri dengan metode Drop Plate Mills Mesra.
Hasil penelitian menunjukkan bahwa ekstrak lerak dalam pelarut etanol mempunyai efek antibakteri terhadap E.faecalis dengan nilai MBC 25 %.
BAB 1
PENDAHULUAN
1.1Latar Belakang Masalah
Masuknya bakteri ke pulpa sering disebabkan oleh proses lanjutan dari karies. Infeksi yang berlangsung terlalu lama memungkinkan bakteri berpenetrasi ke kamar pulpa dan saluran akar melalui tubulus dentin yang terbuka karena proses karies tersebut.1 Interaksi dan produksi toksin oleh bakteri pada saluran akar dapat menyebabkan terjadinya infeksi endodontik.
Sundqvist menemukan sejumlah bakteri anaerob seperti Enterococcus faecalis (E.faecalis), Streptococcus anginosus, Bacteroides gracilis, dan Fusobacterium nucleatum pada perawatan saluran akar yang gagal.2 Penelitian menunjukkan bahwa dari 100 pengisian saluran akar yang gagal disertai periodontitis apikalis, terdapat bakteri fakultatif sebanyak 69 % dan 50 % diantaranya merupakan enterococci. Walaupun Enterococcus biasanya ditemukan pada saluran akar yang tidak dirawat dalam jumlah sedikit, bakteri ini sering ditemukan pada perawatan saluran akar yang gagal dan dapat menyebabkan infeksi saluran akar yang persisten.2 E.faecalis
bertanggung jawab terhadap 80-90 % infeksi saluran akar oleh enterococci dan biasanya merupakan satu-satunya spesies Enterococcus yang diisolasi dari saluran akar yang telah diisi.19
Menurut taksonominya, E.faecalis termasuk Kingdom Bacteria, Filum
kolonisasi pada host, bersaing dengan bakteri lain, resisten terhadap mekanisme pertahanan host dan menghasilkan perubahan patogen baik secara langsung maupun tidak langsung.17 Faktor-faktor virulen yang berperan adalah komponen agregation substance (AS), surface adhesins, sex pheromones, lipoteichoic acid (LTA),
extraceluller superoxide production (ESP), gelatinase lytic enzyme, hyalurodinase, dan cytolysin toxin. 18E.faecalis terbukti dapat bertahan hidup di dalam saluran akar sebagai organisme tunggal dan resisten terhadap bahan-bahan antimikrobial yang umum digunakan sehingga sulit dieliminasi dari saluran akar secara sempurna. 17
Persistensi bakteri memegang peranan penting terhadap timbulnya kegagalan perawatan saluran akar. Salah satu tindakan pencegahan yang dapat dilakukan adalah dengan proses chemomecanical cleansing. Ini merupakan kombinasi dari tindakan instrumentasi mekanis dan pengaliran bahan kimia yang bertujuan untuk membunuh bakteri, pembersihan dan pembentukan saluran akar. Sifat irigan yang ideal yaitu mampu melarutkan jaringan atau debris khususnya pada daerah yang tidak terjangkau instrumen, toksisitas rendah, tegangan permukaan rendah, pelumas alat endodontik, dapat membuang smear layer, membunuh mikroba, dan ekonomis.2
Kecenderungan masyarakat kembali memakai bahan alami dikenal sebagai
New Green Wave, gerakan ini berupaya menggunakan kembali obat-obatan
tradisional yang ramuannya dari bahan alami yang didapat dari alam (biofarmaka).5 Hal ini juga sesuai dengan fokus area rencana pembangunan jangka menengah (RPJM) 2004-2009 mengenai teknologi kesehatan dan obat-obatan yang program utamanya berupa penerapan teknologi produksi yang ramah lingkungan, meningkatkan pengelolaan kelestarian pemanfaatan sumber daya alam dan iklim global,karena limbah dari obat-obatan berbahan dasar alami akan lebih mudah diurai daripada limbah bahan-bahan sintetis yang dapat merusak jaringan hidup dan membutuhkan waktu yang sangat lama agar terurai secara sempurna.6
Buah lerak (Sapindus rarak DC) menjadi salah satu alternatif bahan alami yang dapat dikembangkan sebagai bahan irigasi saluran akar. Secara tradisional buah ini digunakan untuk mencuci kain batik, sebagai sabun wajah untuk mengurangi jerawat, obat eksim dan kudis.7,8 Penelitian membuktikan bahwa ekstrak lerak 0,01 % mempunyai efek antibakteri terhadap Streptococcus mutans dan efek antifungal terhadap Candida albicans lebih baik daripada NaOCl 5 %. 9,10 Sedangkan terhadap
Fusobacterium nucleatum, ekstrak lerak mempunyai efek antibakteri dengan nilai
Minimum Inhibitory Concentration (MIC) dan nilai Minimum Bactericidal
Concentration (MBC) 0,25 %, serta saponin buah lerak 0,01 %.11
Saponin merupakan kandungan utama dari buah lerak yang sifatnya seperti deterjen. Penelitian menunjukkan bahwa pada 100 gram daging buah lerak terdapat 20 gram (20 %) saponin yang memiliki efek antibakteri terhadap S.pyogenus pada
terdapat ± 10 gram (17,5 %) saponin dari 175 gram daging buah lerak, yang pada konsentrasi 0,008 % dapat membersihkan dinding saluran akar lebih baik dari NaOCl 5 % yang umum digunakan di praktek.15
Dari uraian di atas, dapat dilihat bahwa walaupun sudah ada penelitian untuk mengetahui efek antibakteri ekstrak lerak terhadap S.mutans dan F.nucleatum, serta efek antifungal terhadap C.albicans, namun belum ada penelitian efek antibakteri ekstrak lerak terhadap E.faecalis sebagai bakteri yang sulit dieleminasi dari saluran akar dan resisten terhadap antimikrobial yang umum digunakan. Oleh karena itu, perlu dilakukan pengujian efek antibakteri ekstrak lerak terhadap E.faecalis dengan menentukan nilai Minimum Inhibitory Concentration (MIC) dan Minimum Bactericidal Concentration (MBC).
1.2 Rumusan Masalah
Berdasarkan uraian di atas, maka timbul permasalahan sebagai berikut : 1. Apakah ada efek antibakteri ekstrak lerak dalam pelarut etanol terhadap E.
faecalis?
2. Berapa besar konsentrasi minimal ekstrak lerak dalam pelarut etanol yang dapat menghambat pertumbuhan (MIC) dan membunuh (MBC)E.faecalis?
1.3Tujuan Penelitian
2. Untuk mengetahui besar konsentrasi minimal ekstrak lerak dalam pelarut etanol yang dapat menghambat pertumbuhan (MIC) dan membunuh (MBC) E.faecalis.
1.4 Manfaat Penelitian
1. Sebagai dasar untuk penelitian lebih lanjut pengembangan ekstrak lerak sebagai bahan irigasi saluran akar.
2. Meningkatkan pelayanan kesehatan gigi masyarakat dengan menggunakan bahan alami yang mudah didapat dengan harga terjangkau.
3. Meningkatkan pengembangan material kedokteran gigi yang berasal dari alam sehingga limbahnya lebih mudah terurai dan bersifat kompatibel tinggi dengan cara kerja yang berbeda dengan bahan terdahulu.
BAB 2
TINJAUAN PUSTAKA
Enterococcus faecalis merupakan bakteri yang resisten terhadap bahan antimikrobial yang umum digunakan dan sering diisolasi dari perawatan saluran akar yang gagal. Ekstrak lerak diharapkan dapat dikembangkan menjadi bahan irigasi saluran akar yang dapat membunuh mikroba dan bersifat biokompatibel terhadap jaringan. Pada bab ini akan diuraikan tentang bakteri E.faecalis dan buah lerak tersebut.
2.1 Enterococcus faecalis sebagai salah satu bakteri yang terdapat pada
infeksi saluran akar
Nama ”Enterocoque” pertama kali digunakan oleh Thiercelin pada surat kabar di Prancis pada tahun 1899 untuk mengidentifikasi organisme pada saluran intestinal. Pada tahun 1930, Lancefield mengelompokkan Enterococci sebagai
E.faecalis diklasifikasikan dalam Kingdom Bacteria, Filum Firmicutes, Famili Enterococcaceae, Genus Enterococcus, Spesies Enterococcus faecalis.32
Habitat bakteri ini adalah di saluran pencernaan, saluran kemih dan juga dapat berkoloni di rongga mulut manusia. E.faecalis merupakan bakteri yang tidak membentuk spora, fakultatif anaerob, kokus gram positif dan tidak menghasilkan reaksi katalase dengan hidrogen peroksida. Bakteri ini berbentuk ovoid dengan diameter 0,5 – 1 µm dan terdiri dari rantai pendek, berpasangan atau bahkan tunggal. Pada blood agar, permukaan koloni berbentuk sirkular, halus dan menyeluruh (Gambar 1).17,21
Gambar 1. Koloni Enterococcus faecalis dengan scanning electron microscope. 20
Dinding sel bakteri ini terdiri dari peptidoglikan 40 %, sisanya merupakan
Virulensi bakteri ini disebabkan kemampuannya dalam pembentukan kolonisasi pada host, dapat bersaing dengan bakteri lain, resisten terhadap mekanisme pertahanan host, menghasilkan perubahan patogen baik secara langsung melalui produksi toksin atau secara tidak langsung melalui rangsangan terhadap mediator inflamasi.17 Faktor-faktor virulen yang berperan adalah komponen agregation substance (AS), surface adhesins, sex pheromones, lipoteichoic acid (LTA),
extraceluller superoxide production (ESP), gelatinase lytic enzyme, hyalurodinase, dan cytolysin toxin.18
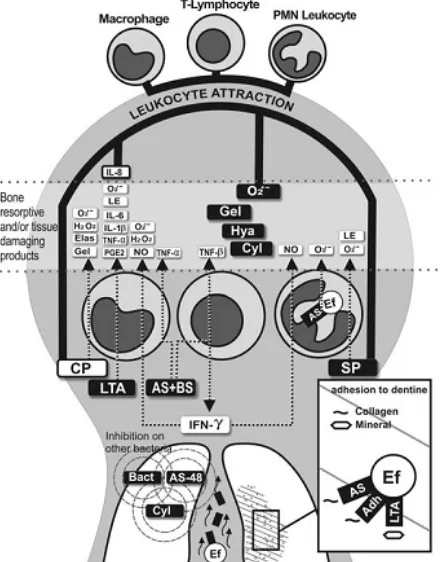
Gambar 2. Scanning electron microscopy (a,b) Saluran akar tertutup oleh biofilmE.faecalis (c,d) agregasi sel bakteri ke tubulus dentin. 33
E.faecalis dapat berkolonisasi di saluran akar dan bertahan tanpa bantuan dari bakteri lain. Gambar 2 menunjukkan bakteri mengkontaminasi saluran akar dan membentuk koloni di permukaan dentin dengan bantuan LTA, sedangkan AS dan
surface adhesin lainnya berperan pada perlekatan di kolagen. Cytolysin, AS-48 dan
jumlah bakteri lain pada infeksi endodontik yang persisten sehingga E.faecalis
menjadi mikroorganisme dominan pada saluran akar.18
Gambar 3. Sebuah model penyakit endodontik terkait dengan faktor-faktor virulensi E. faecalis. Faktor-faktor virulensi bakteri dalam tubulus dentin dan saluran akar yang dilepas menuju daerah periradikular sehingga merangsang leukosit untuk menghasilkan mediator inflamasi atau enzim litik. Beberapa bakteri dapat berpindah ke lesi periradikular. Faktor-faktor virulensi yang merugikan dan produk leukosit ditampilkan pada zona antara garis potong. Pada gambar yang diperbesar, perlekatan bakteri ke berbagai elemen dari dentin digambarkan. Produk bakteri melawan bakteri lain juga dimasukkan. Perhatikan bahwa nama dalam kotak hitam adalah produk dari bakteri. Singkatan: Adh (surface adhesions); AS (agregation substance); Bact (bacteriocins); BS (binding substance); CP (colagen peptides); Cyl (cytolysin); Ef (Enterococcus Faecalis); Elas (elastase); Gel (gelatinase); Hya (hyaluronidase); H2O2 (hidrogen peroksida); IFN- (gamma interferon); IL( interleukin); LE (lysosomal enzyme); LTA (lipoteichoic acid); NO (nitrat oxide); O2.- (superoxide anion); PGE2 (prostaglandin E2); SP (sex pheromones); dan TNF (tumor necrosis factor).18
secara langsung melalui produksi toksin atau secara tidak langsung dengan cara menginduksi proses inflamasi.17 Sex pheromones, LTA dan peptide corresponding inhibitor memodulasi proses inflamasi lokal dengan cara menstimulasi leukosit untuk melepas beberapa mediator yang ikut berperan dalam kerusakan periradikular. LTA menstimulasi leukosit untuk melepas beberapa mediator inflamasi berupa TNF- , interleukin 1 beta (IL-1β),interleukin 6 (IL-6), interleukin 8 (IL-8) dan superoxide anion yang dikultur dari monosit dan leukosit manusia, sedangkan pelepasan prostaglandin E2 (PGE2) dan enzim lisosomal pada makrofag peritoneal tikus. Faktor-faktor ini ditemukan di sampel periapikaldan diketahui dapat merusak serta menarik leukosit. Hal ini menyebabkan apoptosis pada sel-sel (osteoblas, osteoklas, jaringan ikat ligamen periodontal, makrofag dan neutrofil) sehingga berakibat terjadinya lesi periradikular.18
Faktor virulensi yang menyebabkan perubahan patogen secara langsung adalah gelatinase, hyalurodinase, cytolysin dan extracelullar superoxide anion. Gelatinase berkontribusi terhadap resorpsi tulang dan degradasi dentin matriks organik. Hal ini berperan penting terhadap timbulnya inflamasi periapikal.
Hyaluronidase membantu degradasi hyaluronan yang berada di dentin untuk menghasikan energi untuk organisme, sedangkan extracellular superoxide anion dan
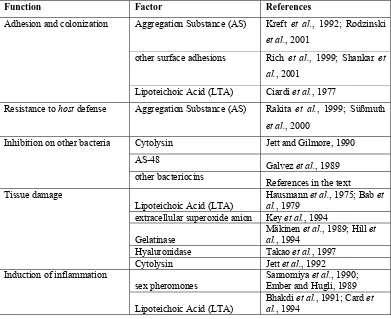
cytolysin berperan aktif terhadap kerusakan jaringan (Tabel 1).18
TABEL.1 FAKTOR VIRULEN E.faecalis DAN FUNGSINYA.18
Function Factor References
Adhesion and colonization Aggregation Substance (AS) Kreft et al., 1992; Rodzinski
et al., 2001
other surface adhesions Rich et al., 1999; Shankar et al., 2001
Lipoteichoic Acid (LTA) Ciardi et al., 1977
Resistance to host defense Aggregation Substance (AS) Rakita et al., 1999; Süßmuth
et al., 2000
Inhibition on other bacteria Cytolysin Jett and Gilmore, 1990
AS-48
Galvez et al., 1989 other bacteriocins
References in the text Tissue damage
Lipoteichoic Acid (LTA)
Hausmann et al., 1975; Bab et al., 1979
extracellular superoxide anion Key et al., 1994
Gelatinase
Mäkinen et al., 1989; Hill et al., 1994
Hyaluronidase Takao et al., 1997 Cytolysin Jett et al., 1992 Induction of inflammation
sex pheromones
Sannomiya et al., 1990; Ember and Hugli, 1989
Lipoteichoic Acid (LTA)
Bhakdi et al., 1991; Card et al., 1994
Harus diperhatikan bahwa saluran akar dan tubulus dentin sulit dicapai oleh unsur mekanisme pertahanan host. Oleh karena itu, prosedur perawatan lebih baik dilakukan secara lokal daripada sistemik.17 E.faecalis dapat bertahan pada pH 4-11 dan pada suhu 5°C-50°C. Hal ini diperkirakan mendapat pengaruh dari impermeabilitas membran terhadap asam dan alkali. 19
ditransfer kapan saja.4 Hal ini disebut dengan resistensi faktor R atau plasmid (resistensi silang).18
Saluran akar yang terinfeksi merupakan salah satu kondisi di mana nutrisi kurang memadai, ada toksin dari bakteri lain dan invasi medikamen endodontik. Kondisi yang keras ini dapat menyebabkan perubahan fisiologi yang spesifik sebagai respon terhadap lingkungan tersebut dan bertindak sebagai mekanisme pertahanan. Pada kondisi ini bakteri kehilangan kemampuan untuk tumbuh dan berkembang tapi tetap hidup dan bersifat patogen. Kondisi ini dinamakan dengan fase Viable but Nonculturable (VBNC). Biasanya hal ini hanya ditemukan pada bakteri gram negatif saja, namun belakangan diketahui bahwa E.faecalis sebagai bakteri gram positif juga memiliki kemampuan ini.31
Pada kondisi ini, E.faecalis dapat memanjang, berbentuk cocobacillary
2.2. Buah Lerak (Sapindus rarak DC)
Menurut taksonominya, Sapindus rarak termasuk ke dalam Divisi
Spermatophyta, Sub divisi Angiospermae, Kelas Dycotyledonae, Bangsa Sapindales, Suku Sapindaceae, Marga Sapindus, Jenis Sapindus rarak DC. Tanaman ini lebih dikenal dengan nama lerak, namun di daerah lain lerak memiliki nama yang berbeda-beda. Masyarakat Sunda menyebutnya dengan nama Rerek, di Jawa disebut Werak/Lerak, di Jambi disebut dengan Kalikea, penduduk Minang menyebutnya Kanikia, di Sumatera Selatan disebut dengan Lamuran dan di Tapanuli Selatan dikenal dengan nama buah sabun.7,15
Tumbuhan ini berbentuk pohon yang tinggi dan besar. Tingginya mencapai ± 42 m. Daun bentuknya bundar telur sampai lanset. Bunganya majemuk, terdapat di ujung batang berwarna putih kekuningan. Bentuk buah bundar seperti kelereng, kalau sudah tua berwarna coklat kehitaman dengan permukaan buah licin dan mengkilat (Gambar 4).
Buah lerak sering dipergunakan untuk mencerahkan warna yang diperoleh dari soga alam/pewarna alam, mencuci kain batik, emas dan sebagai sabun wajah untuk mengurangi jerawat.7 Lerak sangat baik untuk membasmi cacing tanah. Di Jakarta buah ini sudah diolah menjadi insektisida. Daging buahnya mengandung zat saponin, sedangkan bijinya mengandung minyak. Penelitan menunjukkan bahwa lerak mengandung senyawa saponin, alkaloid, alteroid dan triterpen masing masing berurutan mengandung bahan aktif sebesar 12 %, 1 %, 0,036 %, dan 0,029 %.23
Ekstrak lerak memiliki kandungan berupa saponin dan flavonoida didapat dari kulit buah, biji, kulit batang, dan daun, sedangkan alkaloida dan polifenol terdapat pada kulit buahnya. Senyawa saponin dapat bekerja sebagai antimikroba sebagai surfaktan atau deterjen yang diduga akan menyerang lapisan batas sel bakteri melalui ikatan gugus polar dan non polar. Flavonoid diduga dapat merusak membran sel karena sifatnya yang lipofilik dan kemampuannya membentuk kompleks dengan protein ekstraseluler. Seyawa Fenol menghambat enzim penting mikroorganisme, sedangkan Alkaloid sudah digunakan berabad-abad dalam bidang medis karena dapat melawan sel asing melalui ikatan dengan DNA sel sehingga mengganggu fungsi sel.11
Saponin merupakan kandungan utama dari buah lerak yang sifatnya seperti deterjen. Penelitian menunjukan bahwa pada 100 gram daging buah lerak terdapat 20 gram (20 %) saponin yang memiliki efek antibakteri terhadap S.pyogenus pada MIC
membuat sampo.25 Berbagai khasiat farmakologik dari saponin adalah antiinflamasi, antimikroba, antijamur, antivirus, ekspektoran, antiulser, perbaikan sintesa protein, stimulasi dan depresi susunan saraf pusat dan molusida serta sebagai ekspektoran.22
BAB 3
KERANGKA KONSEPTUAL DAN HIPOTESIS PENELITIAN
3.1 Kerangka Konsep
? ?
?
Irigasi Saluran Akar
Bakteri E. Faecalis,
Polisakarida
Perawatan Saluran Akar Infeksi Saluran Akar
Ekstrak lerak dalam pelarut etanol 100%, 50%, 25% dan 12,5%
Saponin Alkaloid Polifenol Flavonoid
Bekerja sebagai
Gangguan semipermeabilitas membran sel
Diagram di atas menunjukkan mekanisme ekstrak lerak dalam pelarut etanol dalam membunuh bakteri. Ekstrak lerak memiliki kandungan berupa saponin dan flavonoida didapat dari kulit buah, biji, kulit batang, dan daun Sapindus rarak, sedangkan alkaloida dan polifenol terdapat pada kulit buahnya. Senyawa saponin dapat bekerja sebagai antimikroba dengan cara merusak membran sel. Saponin yang berperan sebagai surfaktan (bahan aktif permukaan) akan merusak lapisan batas sel bakteri melalui ikatan gugus polar saponin dengan polisakarida dan peptidoglikan serta gugus non polar saponin dengan LTA sehingga menyebabkan terjadinya gangguan permeabilitas membran sel, fungsi sel, sel lisis dan kemudian mati.
Mekanisme kerja senyawa flavonoid diduga dengan merusak membran sel karena sifatnya yang lipofilik dan kemampuannya membentuk kompleks dengan protein ekstraseluler. Seyawa fenol bersifat toksik terhadap mikroorganisme, dan mekanisme yang dianggap bertanggungjawab terhadap toksisitas fenol meliputi inhibisi enzim penting dari mikroorganisme yang mengganggu fungsi sel dan perusakan senyawa protein menganggu semipermeabilitas membran sel.Mekanisme kerja antimikroba dari alkaloid dapat berikatan dengan DNA sel sehingga mengganggu fungsi sel diikuti kematian sel.11
3.2Hipotesis Penelitian
Dari kerangka konsep di atas dapat ditarik hipotesa bahwa:
Ada efek antibakteri dari ekstrak lerak dalam pelarut etanol terhadap
BAB 4
METODE PENELITIAN
4.1 Rancangan Penelitian : Posttest Only Control Group Design
Jenis Penelitian : Eksperimental Laboratorium
4.2 Populasi, sampel dan besar sampel
4.2.1 Populasi : Bakteri E.faecalis
4.2.2 Sampel : Koloni E.faecalis ATCC 29212 yang telah diisolasi dan dibiakkan dengan media Mueller Hinton Agar (MHA).
4.2.3 Besar sampel
Penentuan besar sampel berdasarkan penelitian sebelumnya, yaitu: sesuai dengan SOP (Standard Operational Prosedure) yang ada di Laboratorium Pusat Penyakit Tropis, Universitas Airlangga. Adapun penentuan besar sampel dilakukan sebagai berikut:
a. Penentuan nilai MIC
Kelompok 1 : ekstrak lerak100% 6 sampel Kelompok 2 : ekstrak lerak50% 6 sampel Kelompok 3 : ekstrak lerak 25% 6 sampel Kelompok 4 : ekstrak lerak 12,5% 6 sampel Kelompok 5 : kontrol Mc Farland 1 sampel
Kelompok 6 : kontrol negatif (ekstrak lerak tanpa diberi suspensi
Dari masing-masing konsentrasi dilakukan dilusi (pengenceran) untuk memastikan konsentrasi minimal yang dapat menghambat pertumbuhan bakteri. Pada penentuan nilai MIC,jumlah keseluruhan sampel adalah 26 sampel.
b. Penentuan nilai MBC
Kelompok yang dilanjutkan perhitungan jumlah koloni bakteri dengan metode
Drop Plate Mills Mesra, adalah:
Kelompok 1 : ekstrak lerak100% 6 sampel Kelompok 2 : ekstrak lerak50% 6 sampel Kelompok 3 : ekstrak lerak 25% 6 sampel Kelompok 4 : ekstrak lerak 12,5% 6 sampel Kelompok 5 : kontrol Mc Farland 1 sampel
Kelompok 6 : kontrol negatif (ekstrak lerak tanpa diberi suspensi
E.faecalis) →1 sampel
4.3 Variabel Penelitian
4.3.1 Variabel bebas
Ekstrak lerak dalam pelarut etanol 100%, 50%, 25%, 12,5%.
4.3.2 Variabel tergantung : pertumbuhan bakteri E.faecalis pada media
MHA dengan pengukuran nilai MIC dan MBC. 4.3.3 Variabel terkendali
a. Jenis dan geografis asal tumbuhan lerak (Sapindus rarak DC, Desa Maga, Kec. Panyabungan Tapanuli Selatan)
Variabel bebas
Ekstrak lerak dalam pelarut etanol pada konsentrasi 100%, 50%, 25%, 12,5%
Variable tergantung Pertumbuhan bakteri
E.faecalis pada media
MHA dengan
pengukuran nilai MIC
dan MBC Variabel terkendali
Jenis dan geografis asal lerak(Sapindus rarak DC, Desa Maga, Kec.Panyabungan Tapanuli Selatan)
Media pertumbuhan (Mueller Hinton Agar)
Suhu inkubasi (370 C) Stem cell E.faecalis
Waktu pembiakan E.faecalis (24 jam) Sterilisasi alat, bahan coba dan media Teknik pengisolasian dan pengkulturan Suhu (500 C) penguapan dengan rotavapor Waktu penguapan rotavapor
Jenis etanol yang digunakan
Jumlah bahan coba yang diteteskan ke media
Waktu pengamatan (24 jam) Keterampilan operator
Variabel tidak terkendali Perlakuan terhadap Lerak
selama tumbuh.
Lingkungan (kondisi tanah dan iklim) tempat tumbuh
Sapindus rarak.
Lamanya penyimpanan buah lerak setelah dipetik dari pohon sampai ekstraksi buah lerak.
Waktu dan suhu saat
pengiriman dari bahan coba. Suhu dan lama penyimpanan
b. Media pertumbuhan (Mueller Hinton Agar) c. Suhu inkubasi (370 C)
d. Stem cell E.faecalis (ATCC 29212) e. Waktu pembiakan E.faecalis (24 jam) f. Sterilisasi alat, bahan coba dan media g. Teknik pengisolasian dan pengkulturan
h. Suhu (500 C) penguapan dengan vaccum rotavapor i. Waktu penguapan vaccum rotavapor
j. Jenis etanol yang digunakan (etanol pro teknis yang didestilasi) k. Jumlah bahan percobaan yang diteteskan ke media padat l. Waktu pengamatan (24 jam)
m. Keterampilan operator
4.3.4 Variabel tidak terkendali
a. Perlakuan terhadap lerak selama tumbuh.
b. Lingkungan (kondisi tanah dan iklim) tempat tumbuh Sapindus rarak.
c. Lamanya penyimpanan buah lerak setelah dipetik dari pohon sampai ekstraksi lerak.
d. Waktu, suhu dan pengiriman dari bahan coba.
4.4 Definisi Operasional
a. Tumbuhan lerak adalah tumbuhan Sapindus rarak DC yang tumbuh di Desa Maga, Kecamatan Panyabungan Tapanuli Selatan.
b. Larutan ekstrak lerak adalah pengenceran hasil ekstraksi buah lerak yang dilarutkan dalam Mueller Hinton Broth sesuai dengan konsentrasi 100 %, 50 %, 25 % dan 12,5 %. Ekstraksi buah lerak dilakukan dengan melarutkan buah lerak dalam pelarut etanol dan dimasukkan ke dalam rotavapor sehingga diperoleh ekstrak kental.
c. Koloni E. faecalis adalah bakteri E. faecalis yang berasal dari stem cell E. faecalis ATCC 29212 dan kemudian dikultur pada media MHA dalam suasana anaerob di Laboratorium Pusat Penyakit Tropis UNAIR
d. MIC (Minimum Inhibitory Concentration) adalah konsentrasi minimal bahan coba yang mampu menghambat pertumbuhan bakteri setelah diinkubasi 24 jam dan tidak menunjukkan adanya pertumbuhan bakteri secara makroskopik yang dapat dilihat dari hasil biakan pada tabung yang mulai tampak jernih dengan menggunakan metode dilusi.34
e. MBC (Minimum Bactericidal Concentration) adalah konsentrasi minimal bahan coba yang dapat membunuh 99,9 % atau 100 % bakteri setelah dilakukan uji dilusi selama 24 jam, dengan cara menghitung jumlah koloni bakteri pada media agar padat menggunakan metode Drop Plate Mills Mesra.
Jadi jumlah kuman pada sampel cair tersebut adalah :
7 x 1 (faktor pengenceran) x 20 (faktor pengali) = 140 CFU / ml
f. Kontrol Mc Farland berisi bakteri yang disuspensikan dengan menggunakan larutan NaCl 0,9 % sampai diperoleh kekeruhan sesuai standard 0,5 Mc Farland atau sebanding dengan jumlah bakteri 1x108 CFU/ml.
4.5 Bahan dan Alat Penelitian
4.5.1 Bahan Penelitian
Bahan penelitian yang dipakai adalah :
1. Buah lerak 940 gram (Desa Maga, Kec. Panyabungan Tapanuli Selatan,
Indonesia)
2. Media Mueller Hinton (Difco, USA)
3. Stem cell E.faecalis ATCC 29212(MediMark®Europe, France) 4. Etanol 96% (Kimia Farma, Indonesia) 4 liter
5. NaCl 0,9% (Kimia Farma, Indonesia) 1 liter 6. Alkohol 70% (Kimia Farma, Indonesia) 1 liter 7. Aquadest (Kimia Farma, Indonesia) 1 liter 4.5.2 Alat Penelitian
1. Electronic balance (Ohyo JP2 6000, Japan dan Denver Instrument Company, USA)
2. Timbangan (Home Line, China)
3. Alat destilasi pelarut (Electrothermal, England)
5. Kertas saring (Whatman no.42, England) 6. Autoklaf (Tomy, Japan)
7. Vaccum rotavapor (Antriebs ATB, England) 8. Erlenmeyer (Pyrex, USA)
9. Vortex/whirli mixer (Iwaki model TM-100, Japan) 10. Inkubator CO2 (Sanyo, Japan)
11. Pipet mikro (Gilson, France) 12. Piring petri (Pyrex, Japan)
4.6. Tempat dan Waktu Penelitian
4.6.1 Tempat Penelitian
1. Laboratorium Farmasi USU
2. Laboratorium Lembaga Pusat Penyakit Tropis UNAIR 4.6.2 Waktu penelitian
Waktu penelitian adalah 6 bulan
4.7 Prosedur Penelitian
4.7.1 Ekstraksi buah lerak
dalam wadah plastik tertutup. Tambahkan etanol destilasi sebanyak 800 ml untuk maserasi (Gambar 12) lalu disimpan dalam wadah tertutup dan didiamkan selama 3 jam. Massa dipindahkan sedikit demi sedikit ke dalam perkolator dengan hati-hati sambil sesekali ditekan, kemudian tuangkan etanol destilasi sebanyak 200 ml dan disaring dengan selapis kertas saring. Biarkan sampai cairan mulai menetes, perkolator ditutup dan dibiarkan selama 24 jam. Cairan dibiarkan menetes dengan kecepatan ± 20 tetes/menit, etanol destilasi ditambahkan berulang-ulang secukupnya hingga selalu terdapat selapis cairan penyari diatas simplisia (Depkes RI,2000). Perkolat diuapkan dengan alat vacuum rotavapor pada suhu tidak lebih 50°C hingga diperoleh ekstrak kental dengan konsistensi seperti madu (Gambar 13). Ekstrak lerak dimasukkan ke dalam botol kaca lalu disimpan di tempat yang sejuk. (Lampiran 1)
Gambar 6. Pemotongan daging buah lerak. Gambar 7. Lemari pengering.
Gambar 8. Potongan lerak di lemari pengering. Gambar 9. Potongan lerak yang sudah kering.
Gambar 12. Simplisia di dalam perkolator. Gambar 13. Vaccumrotavapor.
4.7.2 Pembuatan Suspensi Bahan Uji
Ekstrak lerak dalam pelarut etanol ditimbang menggunakan electronic balance dan massanya disesuaikan dengan konsentrasi yang diinginkan dengan cara dilarutkan dengan media Mueller Hinton Broth.
Ekstrak lerak dalam pelarut etanol dimulai dari konsentrasi 100 % karena belum diketahui konsentrasi ekstrak yang mampu menghambat pertumbuhan
E.faecalis, jadi pengujian dimulai pada konsentrasi terbesar. Kemudian dilakukan pengenceran berganda, diperoleh konsentrasi 50 %, 25 % dan 12,5 %. Masing-masing konsentrasi dimasukkan ke dalam tabung dan diberi label.
4.7.3 Pembuatan media bakteri
suhu 1210 C, lalu simpan dalam lemari pendingin. Jika akan digunakan, media dipanaskan kembali hingga mendidih lalu dituang ke dalam petri.
Gambar 14. Media Mueller Hinton Agar (Difco, USA)
4.7.4 Pembiakan spesimen
E.faecalis yang digunakan adalah spesimen stem sel E.faecalis ATCC 29212 yang dibiakkan secara murni pada media MHA dalam suasana anaerob hingga didapatkan pertumbuhan yang sehat, yang berarti bahwa bakeri tumbuh subur. Ambil beberapa koloni bakteri lalu diencerkan dengan larutan NaCl 0,9 % hingga konsentrasi 108 CFU/ml (CFU: Colony Forming Unit) atau setara dengan 0,5 Mc Farland Standard.
4.7.5 Penentuan MIC bahan coba
tersebut kemudian divorteks, lalu diinkubasi pada suhu 370C selama 24 jam pada inkubator CO2. Kemudian amati kekeruhan yang terjadi dengan membandingkan tabung-tabung tersebut dengan kontrol untuk menentukan nilai MIC. Tabung dengan kekeruhan yang mulai tampak jernih untuk setiap kelompok perlakuan merupakan
MIC yaitu konsentrasi minimal bahan coba yang mampu menghambat pertumbuhan
E.faecalis dalam media perbenihan setelah diinkubasi 24 jam dan tidak tumbuh koloni bakteri dalam media tersebut.
4.7.6 Penentuan MBC bahan coba
Dari semua konsentrasi bahan coba yang diuji ternyata pada larutan ekstrak lerak tidak dapat terlihat larutan yang mulai tampak jernih dan tidak representatif untuk diukur sehingga semua kelompok larutan dilanjutkan dengan penghitungan jumlah koloni bakteri. Dari hasil prosedur penentuan nilai MIC diperoleh 4 kelompok yang dilanjutkan dengan penghitungan jumlah koloni menggunakan metode Drop Plate Mills Mesra, yaitu ekstrak lerak dalam pelarut etanol 100%, 50%, 25% dan 12,5%. Dengan metode ini dapat dihitung jumlah bakteri hidup yang telah disuspensikan dalam bahan coba, sehingga dapat ditentukan penyebab kekeruhan dalam media uji, apakah karena bahan coba, pertumbuhan kuman yg cepat, atau karena tumpukan sel bakteri mati.
satu sel bakteri hidup bila dibiakkan pada media padat akan tumbuh menjadi satu koloni bakteri. Apabila bentuk koloni melebar dianggap berasal dari satu koloni, bila bentuknya dua koloni bersinggungan dianggap sebagai dua koloni.
Setelah dihitung jumlah koloni bakteri pada masing-masing tetesan, dibuat rata-ratanya dan dikalikan dengan faktor pengenceran dan faktor pengali. Oleh karena pada penelitian konsentrasi yang dilakukan perhitungan jumlah koloni bakteri merupakan konsentrasi awal (sebelum dilakukan dilusi) maka faktor pengenceran x1, selain itu karena pada penetesan suspensi bahan coba dan bakteri pada media padat sebanyak 50 µl, maka hasil perhitungan harus dikali dengan faktor pengali 20 untuk mendapatkan hasil sesuai satuan standar (CFU/ml).
4.8 Analisa Data
BAB 5
HASIL PENELITIAN
5.1 Ekstrak kental Lerak
Daging buah lerak yang telah dikeringkan dan dihaluskan (520 gram) diekstraksi, diperoleh ekstrak kental berwarna coklat kehitaman (Gambar 15), disimpan dalam wadah kaca tertutup dan diletakkan di tempat yang sejuk.
Gambar 15. Ekstrak kental lerak
5.2Uji Efektifitas Antibakteri
Tabel 2. HASIL PERHITUNGAN JUMLAH BAKTERI UNTUK BAHAN COBA EKSTRAK LERAK DALAM PELARUT ETANOL TERHADAP E. Faecalis
Bahan
Keterangan : 0 CFU/ml = Steril, tidak dijumpai pertumbuhan bakteri. CFU/ml = Colony Forming Unit per ml
* = sudah dikali dengan 20 (faktor pengali)
Tabel 2 menunjukkan bahwa pengujian efek antibakteri terhadap E.faecalis
pada bahan coba ekstrak lerak dalam pelarut etanol 25 % adalah steril (0), yang berarti bahwa setelah penanaman pada media MHA dan diinkubasi selama 24 jam tidak terlihat adanya pertumbuhan bakteri, atau semua bakteri mati. Hal ini terlihat dari zona yang bening pada petri. Pada pengujian efek antibakteri ekstrak lerak dalam pelarut etanol pada konsentrasi 12,5 % memperlihatkan pertumbuhan koloni dengan jumlah yang berbeda pada tiap replikasi (Gambar 16), dengan rata-rata (312.109 ± 36,23.109) CFU/ml yang artinya pertumbuhan bakteri masih subur.
b b a b
a
a
(i) (ii) (iii)
a a a
b b b
(iv) (v) (vi)
Gambar 16. Pertumbuhan bakteri pada media perbenihan pada ekstrak lerak dalam pelarut etanol 12,5 % (i) replikasi ke 1, (ii) replikasi ke 2, (iii) replikasi ke 3, (iv) replikasi ke 4, (v) replikasi ke 5, (vi) replikasi ke 6. Keterangan : (a) Media MHA. (b) Koloni bakteri E.faecalis.
BAB 6
PEMBAHASAN
Penelitian ini dimulai dengan pembuatan ekstrak lerak. Daging buah lerak dipotong kecil-kecil dengan lebar ± 3 mm, dimasukkan ke dalam lemari pengering selama ± 7 hari hingga konsistensinya rapuh ketika digenggam, dihaluskan dengan blender, kemudian dilakukan maserasi dengan menggunakan pelarut etanol dan dimasukkan ke dalam perkolator. Setelah didapat ekstrak cair, masukkan ke dalam
vaccum rotavapor untuk memisahkan ekstrak dan pelarut sehingga diperoleh ekstrak kental.
Buah lerak dimasukkan ke dalam lemari pengering untuk mencegah proses pembusukkan. Proses ini tidak mempengaruhi efek antibakteri karena saponin, flavonoid, alkaloid dan fenol merupakan senyawa yang tahan terhadap pemanasan, sedangkan etanol dipilih sebagai pelarut karena tidak bersifat toksik dan merupakan pelarut yang telah memenuhi syarat kefarmasian atau “pharmaceutical grade”.24 Ekstrak lerak dalam pelarut etanol dilarutkan dalam media Mueller Hinton Broth
karena media ini memiliki pH netral yaitu 7,327 sehingga efek antibakteri yang dihasilkan pada pengujian efek antibakteri murni berasal dari ekstrak lerak itu sendiri, bukan karena penambahan pelarut yang bersifat asam yang akan meningkatkan efek antibakterinya.
Pada tahap awal, pengujian efek antibakteri dari suatu bahan dilakukan secara
zona inhibisi antibakteri tergantung daripada kelarutan dan difusi bahan coba pada media, sehingga kemungkinan kurang efektif dalam menginhibisi mikroorganisme. Dalam penelitian ini dilakukan pengujian efek antibakteri dari ekstrak lerak dalam pelarut etanol terhadap E.faecalis dengan metode dilusi. Dengan metode ini bahan coba dapat berkontak langsung dengan mikroorganisme,26 sehingga hasil yang diperoleh lebih akurat dan dapat diketahui nilai MIC dan MBC dari bahan coba seperti yang direkomendasikan oleh National Committee for Clinical Laboratory Standards (NCCLS, USA)dan sesuai dengan penelitian sebelumnya oleh Sanny pada tahun 2008 yang meneliti efek antibakteri berbagai sediaan dari buah Lerak terhadap
F. nucleatum (penelitian in vitro) dengan metode dilusi.11
Penelitian dilakukan dengan metode dilusi dengan cara pengenceran ganda sehingga didapat konsentrasi bahan coba yang besarnya setengah dari konsentrasi awal yaitu 100 %, 50 %, 25 % dan 12,5 %. Pada masing-masing konsentrasi dilakukan replikasi sebanyak 6 kali untuk hasil yang lebih akurat dan mengetahui berapa rata-rata jumlah bakteri yang tumbuh pada ekstrak lerak dalam berbagai konsentrasi karena pada konsentrasi yang sama belum tentu jumlah bakteri yang tumbuh juga sama.
MIC dilihat dari konsentrasi minimal bahan coba yang mampu menghambat pertumbuhan bakteri setelah diinkubasi 24 jam dan tidak menunjukkan adanya pertumbuhan bakteri secara makroskopik yang dapat dilihat dari hasil biakan pada tabung yang mulai tampak jernih dengan menggunakan metode dilusi, sedangkan
Pada penelitian untuk mengetahui nilai MIC menunjukkan bahwa dari semua konsentrasi bahan coba yang diuji ternyata tidak dapat terlihat larutan yang mulai tampak jernih. Hal ini bisa disebabkan oleh bahan coba, pertumbuhan kuman yang cepat, atau karena tumpukan sel bakteri mati. Dalam hal ini, tidak adanya perubahan kekeruhan diduga akibat bahan coba itu sendiri berwarna coklat, sehingga ketika diuji semua konsentrasi berwarna coklat keruh dan tidak jernih sehingga dianggap tidak representatif untuk dicari nilai MIC. Oleh karena itu perlu dilakukan penelitian lebih lanjut untuk mengetahui nilai MIC dengan menggunakan metode yang lain.
Pada penelitian untuk mengetahui MBC, setelah ditanam di MHA dan diinkubasi selama 24 jam, pada konsentrasi 100 % tidak terlihat adanya pertumbuhan bakteri (steril), begitu juga pada konsentrasi 50 % dan 25 %. Pada konsentrasi 12,5 % sudah terlihat pertumbuhan bakteri pada media perbenihan. Oleh karena itu, dapat diketahui bahwa nilai MBC adalah 25 %. Akan tetapi, rentang konsentrasi di mana bakteri mati seluruhnya dan konsentrasi di mana bakteri sudah mulai tumbuh masih terlalu besar sehingga diduga masih ada konsentrasi lebih kecil yang dapat membunuh seluruh E.faecalis diantara konsentrasi 12,5 % - 25 %. Untuk itu, perlu dilakukan penelitian lebih lanjut untuk mengetahui nilai MBC yang lebih terperinci dengan menggunakan metode yang lain.
Walaupun nilai MIC tidak diketahui, hasil penelitian menunjukkan bahwa bahan coba ekstrak lerak dalam pelarut etanol memiliki efek antibakteri terhadap
antibakteri terhadap Streptococcus mutans dan efek antifungal terhadap Candida albicans lebih baik daripada NaOCl 5 % 9,10 Sedangkan terhadap Fusobacterium nucleatum, ekstrak lerak mempunyai efek antibakteri dengan MIC dan MBC 0,25 % dan 0,01 % untuk saponin buah lerak.11 Nilai MIC dan MBC yang diperoleh peneliti berbeda dengan konsentrasi tiga peneliti sebelumnya, hal ini terjadi kemungkinan karena tujuan, metode, bakteri, atau bahan yang digunakan berbeda.
Tujuan dan metode yang digunakan peneliti untuk pengujian efek antibakteri ekstrak lerak terhadap E.faecalis dan F.nucleatum sama, yaitu untuk mencari nilai
MIC dan MBC. Metode yang digunakan adalah metode dilusi. Dua peneliti sebelumnya bertujuan mencari konsentrasi LD50 dan metode yang digunakan adalah agar diffusion test. Hal ini diduga menyebabkan perbedaan hasil.
Pelarut yang digunakan untuk maserasi simplisia lerak berbeda. Peneliti menggunakan etanol sedangkan tiga peneliti sebelumnya menggunakan metanol.Asal buah lerak yang berbeda dapat menyebabkan hasil yang berbeda karena ada kemungkinan kadar senyawa aktif yang terkandung dalam buah lerak tidak sama karena geografis asal buah lerak yang berbeda. Uji efek antibakteri terhadap
Bakteri yang diuji peneliti adalah E.faecalis, sedangkan tiga peneliti sebelumnya menguji bakteri F.nucleatum, S.mutans dan C.albicans. Morfologi bakteri yang berbeda menyebabkan struktur membran sel bakteri juga berbeda sehingga diduga menyebabkan perbedaan aktifitas dan besar konsentrasi bahan coba dalam membunuh sel bakteri tersebut. Perbedaan morfologi bakteri tersebut dapat dilihat pada tabel berikut.
TABEL. 3 PERBEDAAN MORFOLOGI BAKTERI.9-11,35-37
Nama bakteri E.faecalis S.mutans F.nucleatum C.albicans
Membran sel - Peptidoglikan (40%)
Pada dasarnya, dinding sel bakteri ini terdiri dari peptidoglikan sebanyak 40 %, sisanya merupakan teichoic acid dan polisakarida (Gambar 17).30 Keseimbangan antara enzim polimerisasi dan hidrolitik menghasilkan sintesis peptidoglikan.31
Gambar 18. Struktur membran sel bakteri gram positif. 28
Efek antibakteri yang ditimbulkan ekstrak lerak diduga karena ekstrak lerak punya banyak senyawa aktif. Ekstrak lerak memiliki kandungan berupa saponin, flavonoida, alkaloida dan polifenol yang bersifat antibakteri. Kematian bakteri
E.faecalis mungkin disebabkan saponin yang berperan sebagai surfaktan / sabun atau deterjen (bahan aktif permukaan) akan menyerang lapisan batas sel bakteri melalui ikatan gugus polar saponin dengan polisakarida dan peptidoglikan serta gugus non polar saponin dengan LTA sehingga menyebabkan terjadinya gangguan permeabilitas sel, fungsi sel, sel lisis dan kemudian mati.
protein ekstraseluler. Seyawa fenol bersifat toksik terhadap mikroorganisme karena dapat menginhibisi enzim penting mikroorganisme sehingga mengganggu fungsi sel serta perusakan senyawa protein yang dapat menganggu semipermeabilitas membran sel.Alkaloid bersifat toksik sehingga dapat melawan sel yang berasal dari organisme asing. Mekanisme kerja antimikroba dari alkaloid dapat berikatan dengan DNA sel sehingga mengganggu fungsi sel diikuti kematian sel.11 Uji coba efek antibakteri terhadap E.faecalis menggunakan keseluruhan ekstrak lerak dalam pelarut etanol tanpa memisah-misah senyawa yang terkandung di dalamnya sehingga tidak diketahui zat aktif mana yang memiliki efek antibakteri paling besar pada lerak.
E.faecalis merupakan bakteri yang bisa bertahan pada kondisi di bawah tekanan. Saluran akar yang terinfeksi merupakan suatu kondisi di mana nutrisi kurang memadai, adanya toksin dari bakteri lain dan invasi dari medikamen endodontik. Hal ini menyebabkan perubahan fisiologi yang spesifik sebagai suatu respon yang bertindak sebagai mekanisme pertahanan dari tekanan lingkungan. Pada fase ini
BAB 7
KESIMPULAN DAN SARAN
7.1 Kesimpulan
Dari penelitian eksperimental yang sudah dilakukan, maka dapat ditarik kesimpulan bahwa ekstrak lerak dalam pelarut etanol memiliki efek antibakteri terhadap E.faecalis dengan nilai MBC 25%.
7.2 Saran
1. Perlu penelitian lebih lanjut untuk mengetahui kandungan zat aktif mana yang memiliki efek antibakteri paling besar pada lerak.
2. Perlu penelitian lebih lanjut untuk mengetahui MIC dari ekstrak lerak dalam pelarut etanol dengan menggunakan metode yang lain.
3. Perlu penelitian lebih lanjut untuk mengetahui MBC dari ekstrak lerak dalam pelarut etanol antara konsentrasi 12,5 % sampai 25 % dengan menggunakan metode yang lain.
4. Perlu dilakukan penelitian lebih lanjut mengenai keefektifan ekstrak lerak sebagai alternatif bahan irigasi saluran akar secara in vivo sebagai lanjutan penelitian ini sehingga bahan ini dapat digunakan secara klinis.
5. Perlu dilakukan penelitian lebih lanjut tentang efek antibakteri dari ekstrak lerak dalam pelarut etanolterhadap bakteri patogen endodontic lain.
DAFTAR PUSTAKA
1. Walton RE, Torabinejad M. Prinsip dan Praktek ilmu endodonsi. Alih bahasa: Narlan S, Winiati S, Bambang N. ed ke-3.Jakarta: EGC, 2008: 41-278
2. Bodrumlu E, Semiz M. Antibacterial activity of a new endodontic sealer against Enterococcus faecalis. J Can Dent Assoc 2006; 72(7): 637a-c
3. Nevi Yanti. Biokompatibilitas larutan irigasi saluran akar. Maj Kedokteran Gigi (Dent.J). 2000: 5(1).
4. Murray BE. Diversity among the multidrug-resitant enterococci. Emerging Infection Disease 1998; 4(1): 46-65
5. Ristek.Pendayagunaan Produk Bahan Alami dalam Mengatasi kanker <http://www.ristek.go.id/index.php?mod=News&conf=4089>(8 Oktober 2009) 6. Kebijakan Strategis Pembangunan Ilmu Pengetahuan dan Teknologi Nasional
(Jakstra Ipteknas) 2000–2004. (8 Oktober 2009)
7. Heyne K. Tumbuhan berguna Indonesia. Alih bahasa : Badan Litbang Kehutanan Jakarta. Jilid III. Jakarta: Koperasi Karyawan Departemen Kehutanan, 1987: 1250-1.
8. Laba U, Balittri. Lerak (Sapindus rarak DC) Tanaman industri pengganti sabun. Warta Penelitian dan Pengembangan Tanaman Industri, 2009:15(2);7-8. 9. Nevi Yanti, Fadhlina I. Efek antibakteri berbagai sedian buah lerak terhadap
Streptococcus mutans. Maj Kedokteran Gigi (Dent.J). 2009: 14(1): 53-8.
10. Juni F. Efek antibakteri berbagai sedian buah lerak terhadap Candida albicans. Skripsi. Medan: FKG USU, 2006 : 41.
11. Nevi Yanti, Sanny. The antimicrobial effect of Lerak properties as intracanal irrigants on Fusobacterium nucleatum : Faculty of Dentistry Trisakti University, Proceedings of the 9th Scientific Forum, 2008: 84.
13. Wydiavei. Pengaruh bahan irigasi ektrak buah lerak terhadap kekuatan tarik sistim resin komposit dengan dentin. Skripsi. Medan : FKG USU, 2009 : 50. 14. Dyatmiko W, Soeharto S, Moegijanto L, dkk. Aktivitas biologic zat kandungan
buah Sapindus rarak DC sebagai anti mikroba dan mulloscuide. Surabaya: Lembaga Penelitian UNAIR, 1983: 1-18.
15. Nevi Yanti. Sitotoksisitas larutan saponin dari buah Sapindus rarak DC. Maj Kedokteran Gigi (Dent.J). 1999: 32(2).45-8.
16. Dilsah, Ozant, Atac, et al. Detection of Enterococcus faecalis in Necrotic Teeth Root Canals by Culture and PCR Methods. J Europ Dent 2007; 70 : 216-20. 17. Kundabala M, Suchitra U. Enterococcus Faecalis: An Endodontic Pathogen. J
Endod 2002; 11-3
18. Kayaoglu G, Ørstavik D. Virulence factors of Enterococcus Faecalis :Relationship of endodontic disease. Crit Rev Oral Biol Med 2004; 15(5) : 308-20.
19. Fisher K, Phillips C. The ecology, epidemiology and virulence of Enterococcus. Microbiology 2009; 155: 1749–57.
20. Delisle G, Tomalty L. Enterococcus faecalis in a Blood Culture. American Society for Microbiology 2002.
21. Rollins DM, Joseph SW. BSCI 424 - Pathogenic Microbiology – Enterococcus Summary. (23 Agt 2009)
22. Dyatmiko W. Molusida alami untuk pemberantasan penyakit Schistosomiasis di daerah Danau Lindu Sulawesi Tengah. Surabaya: Lembaga Penelitian UNAIR, 1983: 1-18.
23. Nunik SA. Penggunaan buah lerak Sapindus rarak De Candole sebagai insektisida. <http://www.digilib.litbang.depkes.co.id/php?id=jkpkbppk-gdl-res-1998-nunik-1127-lerak> (12 Agustus 2009)
24. Departemen Kesehatan RI. Direktorat Jenderal Pengawasan Obat dan Makanan. Parameter standar umum ekstrak tumbuhan obat. Jakarta: Departemen Kesehatan, 2000: 1-12.
26. Estrela C, Barbin EL, et al. Mechanism of action of sodium hypoclorite. J Braz Dent 2002; 13(2): 113-7
27. Hardy Diagnostic. Mueller Hinton Media. <https://www.hardydiagnostics .com/catalog2/ hugo/MuellerHintonMed.htm> (31 Januari 2010).
28. Decker JM. Infection disease. University of Arizona. <http://www.rkm.com. au/CELL/Bacteria/bacterialimages/Gram-positive-wall-500.jpg> (31 Januari 2010).
29. Jawetz, Melnick, Adelberg. Struktur sel. Alih bahasa: Bagian Mikrobiologi FK UNAIR. Mikrobiologi kedokteran. Ed ke-1. Jakarta: Salemba Medika, 2005: 11-38.
30. Luis M, Marie T, Pezzlo, et al. Color Atlas of Medical Bacteriology. Washington DC: American Society for Microbiology Press, 2004.
31. Signoretto C, Tafi MC, Canepari P, et al. Cell wall chemical composition of Enterococcus faecalis in the viable but nonculturable state. Applied and Enviromental Microbiology 2000; 66(5):1953-9
32. Enterococcus faecalis (Streptococcus faecalis) complete proteome. Swiss Institute of Bioinformatic. <http://www.expasy.ch/sprot/hamap/ENTFA.html> (17 Februari 2010)
33. Estrela C, Sydney GB, et al. A model system to study antimicrobial strategies in endodontic biofilms. J. Appl. Oral Sci 2009; 17(2)
34. Bonang G, Koeswardono ES. Mikrobiologi Kedokteran untuk Laboratorium dan Klinik. Jakarta: 1982: 122
35. Hancock LE, Gilmore MS. The capsular polysaccharide of Enterococcus faecalis and its relationship to other polysaccharide in the cell wall. PNAS 2002; 99(3):1574-9
36. Biswas SK, Chaffin WL. Anaerobic Growth of Candida albicans does not support biofilm formation under similar condition used for aerobic biofilm. Current Microbiologi Journal 2005; 51(2): 100-4
LAMPIRAN 1
Alur ekstraksi buah lerak (Sapindus rarak DC)
Buah lerak 940 gram dicuci, keluarkan bijinya, daging buah dipotong kecil (±3mm).
Potongan daging buah dimasukkan ke dalam lemari pengering hingga rapuh.
Lerak kering seberat 600 gram diblender dan diayak.
520 gram simplisia dimaserasi dengan pelarut etanol destilasi (3jam).
Pindahkan simplisia ke dalam perkolator dan tambahkan etanol destilasi.
Diamkan selama 24 jam, kemudian biarkan menetes.
Disaring dengan kertas Whatman.
Ekstrak cair.
Diuapkan sampai kental dengan vaccum rotavapor selama 5 jam.
Ektrak kental berwarna cokelat kehitaman.
Disimpan dalam botol kaca tertutup, simpan di tempat sejuk.
LAMPIRAN 2
Penyiapan Suspensi Bakteri
Pembuatan Media Pertumbuhan
Mueller Hinton Agar 12 gram + akuades 240 ml
Dipanaskan hingga mendidih
Disterilkan dengan autoklaf selama 15 menit
Disimpan dalam lemari pendingin
Saat akan digunakan, dipanaskan kembali hingga mendidih
Dituangkan ke dalam petri (20ml/petri)
Pembuatan Suspensi Bakteri
Bakteri E.faecalis yang telah dibiakkan secara murni pada Mueller Hinton Agar
Ambil beberapa koloni bakteri lalu diencerkan dengan larutan NaCl 0,9%
LAMPIRAN 3
Alur pengujian efek antibakteri ekstrak lerak dalam pelarut etanol Ekstrak lerak dalam pelarut etanol 100%, 50%, 25%, 12,5% (masing-masing konsentrasi = 1 ml) + Suspensi bakteri (1 ml)
Diinkubasi dalam inkubator CO2 dengan suhu 370 C selama 24 jam
Bandingkan kekeruhan dengan kontrol Mc Farland
Semua konsentrasi ekstrak lerak dalam pelarut etanol
Masing-masing kelompok konsentrasi di atas divorteks
Ambil 50µl dan teteskan pada media padat (Mueller Hinton Agar)
Masing-masing direplikasi sebanyak 6 kali
Dimasukkan ke dalam inkubator CO2 dengan suhu 370 C selama 24 jam
Hitung jumlah koloni bakteri pada tiap petri
Hasil
LAMPIRAN 4
Tabel hasil uji antibakteri ekstrak lerak dalam pelarut etanol terhadap
E.faecalis
Keterangan : 0 CFU/ml = Steril, tidak dijumpai pertumbuhan bakteri. CFU/ml = Colony Forming Unit per ml