TOLERANSI LARVA DAN NYAMUK DEWASA
Aedes
aegypti
TERHADAP TEMEFOS DAN MALATION DI
WILAYAH ENDEMIK KELURAHAN DUREN SAWIT
JAKARTA TIMUR
MARISA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Pernyataan mengenai tesis dan sumber informasi
Dengan ini saya menyatakan bahwa tesis berjudul:
Toleransi Larva dan Nyamuk Dewasa Aedes aegypti Terhadap Temefos dan Malation di Wilayah Endemik Kelurahan Duren Sawit
Jakarta Timur
Adalah benar-benar karya sendiri dan belum pernah dipublikasikan dalam bentuk apapun. Semua informasi yang berasal dari karya ilmiah yang diterbitkan maupun yang
tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Oktober 2007
Marisa
ABSTRAK
MARISA. Toleransi Larva dan Nyamuk Dewasa Aedes aegypti Terhadap Temefos dan Malation di Wilayah Endemik Kelurahan Duren Sawit Jakarta Timur, dibimbing oleh Dr. drh. F.X. Koesharto, M.Sc dan Dr. drh. Dwi Jayanti Gunandini, M.Si.
Menurut data Dinas Kesehatan DKI Jakarta, pada tahun 2006 dan 2007 wilayah Jakarta Timur tercatat sebagai daerah yang mengalami kasus demam berdarah terbesar di Jakarta dan pada wilayah tersebut Kecamatan Duren Sawit adalah yang paling banyak ditemui kasus demam berdarah. Selanjutnya dari wilayah kecamatan Duren Sawit, kelurahan Kelender dan kelurahan Duren Sawit merupakan wilayah dengan kasus DBD yang tinggi. Peningkatan kasus DBD ini patut diduga pula oleh toleransi insektisida yang digunakan dalam pengendalian vektor nyamuk Aedes aegypti. Insektisida yang digunakan untuk mengendalikan nyamuk Aedes aegypti di Indonesia dan banyak negara lain adalah temefos untuk fase larva dan malation untuk nyamuk dewasa. Penelitian ini bertujuan untuk mengetahui status toleransi nyamuk Aedes aegypti terhadap insektisida yang digunakan dalam program pengendalian larva dan nyamuk dewasa di daerah kelurahan Duren Sawit yang merupakan daerah endemik Jakarta Timur.
Penelitian ini diawali dengan identifikasi daerah kajian yang dilanjutkan dengan uji toleransi. Penentuan status toleransi nyamuk Aedes aegypti dilakukan dengan uji bio assay dan biokimia. Uji bio assay mengikuti standar WHO sedangkan prosedur biokimia menggunakan uji elisa.
ABSTRACT
MARISA. The Tolerance of Larvae and Adult Mosquitoes of Aedes aegypti to Themephos and Malathion in the Endemic Area of Duren Sawit, East Jakarta. Under the Supervision of Dr. drh. F.X. Koesharto, M.Sc and Dr. drh. Dwi Jayanti Gunandini, M.Si.
According to the data of Health Services in the Capital City of Jakarta, in the period of 2006 and 2007, the Eastern part of Jakarta has been recorded as an area with the highest number of dengue fever cases in Jakarta, i.e. the District of Duren Sawit, which involves two of its sub-districts (Kelender and Duren Sawit). The increased cases of dengue fever are predicted as a result of the tolerance of the insecticides applied to the control of Aedes aegypti. The insecticides commonly used In Indonesia and many other countries are themephos for larvae and malathion for adult mosquitoes. The objective of this research was to determine the tolerance level of Aedes aegypti against the insecticide used in the control of larvae and adult mosquitoes in the Sub-district of Duren Sawit, an endemic area in East Jakarta.
The study was initiated by identifying the research areas followed by a test of tolerance. The degree of Aedes aegypti’stolerance was measured through a bio essay test (WHO standard) and biochemical test (Elisa test).
The research results show that the dosage of themefos at 0,00004 to 0,025 ppm for larvae and malathion at 0,8% and 5% for adult mosquitoes applied in the control of
@ Hak cipta milik Institut Pertanian Bogor, tahun 2007
Hak Cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis
dari Institut Pertanian Bogor sebagian atau seluruhnya
dalam bentuk apapun, baik cetak, fotocopy, microfilm dan
TOLERANSI LARVA DAN NYAMUK DEWASA
Aedes aegypti TERHADAP TEMEFOS DAN
MALATION DI WILAYAH ENDEMIK
KELURAHAN DUREN SAWIT JAKARTA TIMUR
MARISA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Thesis : Toleransi Larva dan Nyamuk Dewasa Aedes aegypti
Terhadap Temefos dan Malation Di Wilayah Endemik Kelurahan Duren Sawit Jakarta Timur
Nama : Marisa
Nomor Pokok : B.052040031
Program Studi : Entomologi Kesehatan
Disetujui
Komisi Pembimbing
Dr. drh. F.X. Koesharto, M.Sc Dr. drh. Dwi Jayanti Gunandini, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Entomologi Kesehatan
Dr. drh. Upik Kesumawati, M.S Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas terselesaikannya tesis ini yang merupakan salah satu syarat untuk menyelesaikan pendidikan di Sekolah Pascasarjana Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terimakasih kepada Bapak Dr.drh.F.X.Koesharto, M.Sc selaku ketua komisi pembimbing dan Ibu Dr.drh. Dwi Jayanti Gunandini, M.Si sebagai anggota komisi pembimbing yang mana selama penulis merencanakan, melaksanakan dan menyusun tesis banyak dibantu sehingga tesis ini dapat terselesaikan, serta Ibu Dr.drh. Susi Soviana, M.Si atas kesediaannya menguji dalam sidang tesis penulis.
Terimakasih kepada Bapak Prof.Dr.drh. Singgih H Sigit, M.Sc, Ibu Dr. drh. Upik Kesumawati, M.S, Bapak Dr.drh. Ahmad Arif Amin atas ilmu pengetahuan yang penulis peroleh selama mengikuti pendidikan.Seluruh pegawaidi Program studi Entomologi Kesehatan IPB (Bapak Heri, Ibu Juju, Bapak Yunus, Bapak Taufik dan Bapak Nanang) atas kekeluargaannya dan dan bimbingan praktikum selama ini. Temanku Bonita Ayu Novelani atas bantuan dan persahabatannya.
Terimakasih penulis sampaikan kepada Dirjen Pemberantasan Penyakit Menular dan Penyehatan Lingkungan Pemukiman, Balai Besar Teknik Kesehatan Lingkungan dan Pemberantasan Penyakit Menular, Provicial Health Project II Departemen Kesehatan RI yang memberikan izin dan biayaselama mengikuti pendidikan pada program studi Entomologi Kesehatan Institut Pertanian Bogor .
Terimakasih dan penghargaan yang tidak terhingga kepada suami dan anakku tercinta, atas dukungannya selama ini serta kedua orang tuaku Bapak Tjarsiman Sambas dan Ibu Hartati Aminah yang tiada henti-hentinya berdoa dan memberikan dorongan.
Akhirnya penulis menyadari bahwa karya tulis ini masih terdapat kekurangannya, untuk itu mohon kritik dan saran.
Bogor, September 2007
Penulis dilahirkan di Palembang pada tangal 1 Maret 1968 dari ayah Bapak Tjarsiman Sambas dan Ibu Hartati Aminah. Penulis merupkan putri kedua dari tujuh bersaudara.
DAFTAR TABEL
1. Empat kriteria toksisitas malation berdasarkan nilai LD50 ... 18
2. Data toksisitas temefos ………. 19
3. Persentase kematian larva nyamuk Aedes aegypti pada uji toleransi terhadaptemefos ……….... 33
4. Analisis probit larva nyamuk Aedes aegypti terhadap pemakaian
temefos 0,00004 sampai dengan 0,025 ppm ... 35
5. Persentase kematian nyamuk Aedes aegypti pada konsentrasi malation 0,8% ... 39
6. Analisis probit uji pendahuluan pemakaian malation 0,8% terhadap
nyamuk Aedes aegypti ………... 40
7. Persentase kematian nyamuk Aedes aegypti pada konsentrasi malation 5% ... 41
8. Hasil perhitungan probit uji pendahuluan pemakaian malation 5%
terhadap nyamuk Aedes aegypti ………... 43
9. Nilai α-esterase larva Aedes aegypti ... 44
10. Nilai β-esterase larva Aedes aegypti ... 44
11. Hasil survei tentang sikap masyarakat terhadap penanggulangan
DAFTAR GAMBAR
1. Nyamuk Aedes aegypti ... 5
2. Infeksi virus dengue melalui vektor nyamuk Aedes aegypti ... 7
3. Reseptor neurotransmiter dan saluran ion ... 13
4. Transmisi impuls pada celah sinaps... 14
5. Reaksi enzim asetilkolinesterase ... 16
6. Rumus bangun malation ... 17
7. Rumus bangun malaoxon ... 17
8. Rumus bangun temefos ………. 18
9. Tiga jenis perubahan materi genetik yang menyebabkan resistensi …. 20 10. Lokasi Kecamatan Duren Sawit di Jakarta Timur ... 23
11. Lokasi penelitian di wilayah Kelurahan Duren Sawit, Kecamatan Duren Sawit Jakarta Timur ... 24
12. Daerah padat dan kumuh ... 25
13. Daerah terbuka ... 26
14. Pemeliharaan larva nyamuk Aedes aegypti ... 27
15. Kandang pemeliharaan nyamuk Aedes aegypti dewasa ... 28
16. Marmut umpan sebagai sumber darah untuk nyamuk Aedes aegypti dewasa ... 28
17. Peralatan pengujian resistensi nyamuk Aedes aegpti terhadap malation ... 30
18. Hubungan kematian larva Aedes aegypti terhadap konsentrasi temefos ... 35
19. Hubungan antara waktu kontak dengan kematian nyamuk Aedes aegypti pada penggunaan malation 0,8% ... 40
DAFTAR LAMPIRAN
1. Jumlah kematian larva nyamuk Aedes aegypti pada pemakaian temefos 0,00004 sampai dengan 0,025 ppm. ... 52
2. Jumlah kematian nyamuk Aedes aegypti pada uji pendahuluan
konsentrasi malation 0,8% ... 53
3. Jumlah kematian nyamuk Aedes aegypti pada konsentrasi malation
0,8% ... 54
4. Jumlah kematian nyamuk Aedes aegypti pada konsentrasi malation 5% . 55
5. Nilai α -esterase larva Aedes aegypti ... 56
PENDAHULUAN
Dengue fever dan dengue hemorrhagic fever masih merupakan problem kesehatan utama di banyak negara sub tropis dan tropis. Tahun 1920 kasus pertama
ditemui di Malaysia dan tahun 1962 dilaporkan di Penang. Tahun 1994 laju infeksi
dengue menjadi 22,4 kasus per 100.000 populasi dan menjadi 29,5 kasus pada tahun
1998 (Nasir et al, 2001). Sebanyak 1.672.883 kasus dangue di Brazil telah dilaporkan sepanjang tahun 1981 sampai dengan 1998 (Madeira et al, 2002) dan sepanjang tahun 2002 terdapat 672.371 kasus dengue klasik dan 2.090 kasus dengue hemorrhagic (de Carvalho et all. 2004)
Penyakit Demam Berdarah Dengue (DBD) di Indonesia dilaporkan untuk
pertama kalinya di Surabaya dan Jakarta pada tahun 1968, akan tetapi konfirmasi
virologis baru didapat pada tahun 1972 (Kho et al., 1969 , Pratana et al., 1970, Wahono, 2004). Sejak itu penyakit tersebut menyebar ke berbagai daerah, sehingga
terakhir sampai tahun 1980 seluruh propinsi di Indonesia sudah ditemui kasus demam
berdarah dengue. Sejak pertama kali ditemukan, jumlah kasus menunjukkan
kecenderungan meningkat baik dalam jumlah maupun luas wilayah yang terjangkit
dan secara sporadis selalu terjadi kasus luar biasa (KLB) setiap tahun.
Tahun 2004 kasus DBD tertinggi terdapat di Propinsi DKI Jakarta (Wahono,
2004). Kasus tersebut cenderung mengalami peningkatan yang cukup besar. Tercatat
pada bulan Januari sampai dengan April 2006 terdapat kasus berturut-turut sebesar
2536, 2481, 2923 dan 3038 kasus (Sudin Kesehatan Masyarakat DKI, 2007). Pada
bulan yang sama tahun 2007 jumlah kasus berturut-turut sebesar 2459, 3553, 4409
dan 4740 kasus (Sudin Kesehatan Masyarakat DKI, 2007).
Menurut data Dinas Kesehatan DKI Jakarta, pada tahun 2005 wilayah Jakarta
Timur tercatat sebagai daerah yang mengalami kasus demam berdarah terbesar di
Jakarta (Sudin Kesehatan Masyarakat DKI, 2005). Pada wilayah tersebut kecamatan
yang terbanyak ditemui kasus demam berdarah adalah kecamatan Duren Sawit dan
Cakung. Tahun 2006 dan 2007 kedua kecamatan tersebut masih menjadi wilayah
kecamatan Duren sawit, kelurahan Kelender dan kelurahan Duren Sawit merupakan
wilayah dengan kasus DBD yang tinggi. Luas wilayah Kelurahan Duren Sawit 4,56
km2 atau menempati 20,09% dari total wilayah Kecamatan Duren Sawit Jakarta
Timur dengan kepadatan mencapai 10.445 jiwa per km2.
Peningkatan kasus demam berdarah tersebut antara lain dimungkinkan oleh
perubahan cuaca global dan infrastruktur wilayah yang buruk. Disisi lain patut diduga
pula toleransi insektisida yang digunakan dalam pemberantasan vektor nyamuk Aedes aegypti turut memberikan kontribusi terhadap peningkatan kasus demam berdarah di Jakarta Timur. Insektisida yang digunakan untuk mengendalikan nyamuk Aedes aegypti di Indonesia dan banyak negara adalah temefos untuk fase larva dan malation untuk nyamuk dewasa.
Insektisida temefos di Indonesia digunakan untuk pengendalian larva nyamuk
Aedes aegypti sejak tahun 1980 sedangkan insektisida malation digunakan dalam pengendalian nyamuk dewasa Aedes aegypti sejak tahun 1969 (Hoedojo, 1993). Penggunaan insektisida ini sudah demikian lama sehingga perlu dilakukan
pengamatan terhadap kemungkinan adanya perubahan kerentanan larva dan nyamuk
dewasa Aedes aegypti terhadap insektisida temefos dan malation. (WHO, 1976). Penelitian ini bertujuan untuk mengetahui status kerentanan Aedes aegypti terhadap insektisida (temefos dan malation) yang digunakan dalam program oleh
dinas kesehatan untuk pengendalian larva dan nyamuk dewasa di daerah Kelurahan
Duren Sawit Kecamatan Duren Sawit yang merupakan wilayah endemik Jakarta
Timur. Penelitian ini diawali dengan identifikasi daerah kajian yang dilanjutkan
dengan uji toleransi. Daerah kajian meliputi wilayah kelurahan/desa endemis
berdasarkan petunjuk Dinas Kesehatan Jakarta Timur. Penentuan status toleransi
Aedes aegypti dilakukan dengan uji bio assay dan biokimia. Uji bio assay mengikuti standar WHO sedangkan prosedur biokimia menggunakan uji Elisa. Dari hasil
penelitian diharapkan dapat diperoleh status toleransi nyamuk Aedes aegypti terhadap temefos dan malation di wilayah di Kelurahan Duren Sawit, sehingga pengendalian
TINJAUAN PUSTAKA
Penyakit Demam Berdarah Dengue
Penyakit Demam Berdarah atau Dengue Hemorrhagic Fever (DHF) ialah penyakit yang disebabkan oleh virus dengue yang ditularkan melalui gigitan nyamuk
Aedes aegypti dan Aedes albopictus. Kedua jenis nyamuk ini terdapat hampir di seluruh pelosok Indonesia, kecuali di tempat-tempat dengan ketinggian lebih dari
1000 meter di atas permukaan air laut. Penyakit DBD sering salah didiagnosis dengan
penyakit lain seperti flu atau tipus. Hal ini disebabkan karena infeksi virus dengue
yang menyebabkan DBD bisa bersifat asimtomatik atau tidak jelas gejalanya. Data di
bagian anak RSCM menunjukkan pasien DBD sering menunjukkan gejala batuk,
pilek, muntah, mual, maupun diare (WHO dan Depkes 2003). Gejala pada penyakit
demam berdarah diawali dengan :
a. demam tinggi yang mendadak 2 sampai dengan 7 hari (38 °C- 40 °C).
b. manifestasi pendarahan, dengan bentuk : uji tourniquet positif puspura,
pendarahan, konjungtiva, epitaksis, melena, dan sebagainya
c. Hepatomegali (pembesaran hati).
d. Syok, tekanan nadi menurun menjadi 20 mmHg atau kurang, tekanan sistolik
sampai 80 mmHg atau lebih rendah.
e. Trombositopeni, pada hari ke 3 - 7 ditemukan penurunan trombosit sampai
100.000 /mm³.
f. Hemokonsentrasi, meningkatnya nilai Hematokrit.
g. Gejala-gejala klinik lainnya yang dapat menyertai: anoreksia, lemah, mual,
muntah, sakit perut, diare kejang dan sakit kepala.
h. Pendarahan pada hidung dan gusi.
Rasa sakit pada otot dan persendian, timbul bintik-bintik merah pada kulit
akibat pecahnya pembuluh darah. Masa inkubasi terjadi selama 4-6 hari. Masalah bisa
bertambah karena virus tersebut dapat masuk bersamaan dengan infeksi penyakit lain
seperti flu atau tipus. Oleh karena itu diperlukan kejelian pemahaman tentang
klinis. Dengan pemeriksaan klinis yang baik dan lengkap, diagnosis DBD serta
pemeriksaan penunjang (laboratorium) dapat membantu terutama bila gejala klinis
kurang memadai.
Penyakit DBD disebabkan oleh virus dengue yang termasuk famili genus
Flavirus grup B arthropod borne viruses (arboviruses) dengan tipe DEN 1, DEN 2, DEN 3 dan DEN 4 (Jawetz, 1982; Kettle et al, 1984). Selama ini penyakit DBD secara klinik mempunyai tingkatan manifestasi yang berbeda, tergantung dari serotipe
virus dengue. Penyakit DBD menyebar di negara-negara Tropis dan Subtropis.
Penyakit DBD di Indonesia pertama kali ditemukan pada tahun 1968 di Surabaya dan
sekarang menyebar keseluruh propinsi di Indonesia.
Kejadian penyakit DBD semakin tahun semakin meningkat dengan
manifestasi klinis yang berbeda mulai dari yang ringan sampai berat. Manifestasi
klinis berat yang merupakan keadaan darurat dikenal dengan Dengue Hemorrhagic Fever (DHF) dan Dengue Shock Syndrome (DSS) (WHO, 1986). Manifestasi klinis infeksi virus Dengue termasuk didalamnya Demam Berdarah Dengue sangat
bervariasi, mulai dari asimtomatik, demam ringan yang tidak spesifik, Demam
Dengue, Demam Berdarah Dengue, hingga yang paling berat yaitu Dengue Shock Syndrome (DSS). Sampai saat ini mekanisme respons imun pada infeksi oleh virus Dengue masih belum jelas karena banyak faktor yang mempengaruhi kejadian
penyakit Demam Berdarah Dengue. Faktor-faktor tersebut diantaranya: inang (host), lingkungan (environment) dan faktor virusnya sendiri. Faktor host adalah kerentanan (susceptibility) dan respon imun. Faktor lingkungan (environment) adalah kondisi geografi (ketinggian dari permukaan laut, curah hujan, angin, kelembaban, musim);
kondisi demografi (kepadatan, mobilitas, perilaku, adat istiadat, sosial ekonomi
penduduk).
Biologi Nyamuk Aedes aegypti
Nyamuk Aedes aegypti merupakan vektor penyakit demam berdarah. Nyamuk tersebut berwarna belang hitam putih, tersebar di daerah tropis tetapi berasal dari
ujung abdomen meruncing dan mempunyai sersi yang menonjol, lalu dibagian lateral
dada terdapat rambut postspiracular dan tidak mempunyai rambut spiracular (Mattingly, 1969). Aedes yang berperan sebagai vektor penyakit semuanya tergolong subgenus Stegomyia, dengan ciri-ciri tubuh berorak belang hitam putih pada toraks, abdomen dan tungkai. Corak ini merupakan sisik yang menempel di luar tubuh
nyamuk. Corak putih pada dorsal dada Aedes aegypti berbentuk seperti siku yang berhadapan (lyre-shape), sedangkan Aedes albopictus berbentuk lurus ditengah-tengah punggung (median stripe).
Aedes aegypti merupakan ordo Diptera dan termasuk famili Culicidae. Aedes aegypti dewasa berukuran kecil dengan warna dasar hitam. Probosis bersisik hitam, palpi pendek dengan ujung hitam bersisik putih perak. Oksiput bersisik lebar,
berwarna putih terletak memanjang. Femur bersisik putih pada permukaan posterior
dan setengah basal, anterior dan tengah bersisik memanjang. Tibia semuanya
berwarna hitam dan pada tibia belakang berlingkar putih pada segmen basal ke satu
sampai ke empat dan segmen ke lima berwarna putih. Sayap berukuran 2,5 – 3,0 mm,
bersisik hitam (Christophers, 1960).
Gambar 1. Nyamuk Aedes aegypti
kadang-kadang di luar rumah dan di tempat yang agak gelap. Pada malam hari
nyamuk beristirahat dalam rumah pada benda-benda yang digantung, seperti pakaian,
pada dinding rumah dan sebagainya. Nyamuk ini mempunyai kebiasaan menggigit
berulang (multiple bitters), yaitu menggigit beberapa orang secara bergantian dan dalam waktu singkat. Hal ini disebabkan karena nyamuk Aedes aegypti sangat sensitif dan mudah terganggu. Keadaan ini sangat membantu Aedes aegypti dalam memindahkan virus dengue ke bebarapa orang sekaligus.
Telur Aedes aegypti berwarna hitam seperti sarang tawon, diletakkan satu demi satu di permukaan atau sedikit di bawah permukaan air dalam jarak 2,5 cm dari
dinding tempat perindukan. Telur tahan sampai berbulan-bulan pada suhu –2oC
sampai 42oC. Dalam keadaan tanpa air (kering) telur mampu bertahan sampai dengan
6 bulan. Namun bila kelembaban terlampau rendah, maka telur akan menetas dalam
4 hari. Dalam keadaan optimal telur akan menetas menjadi larva setelah dua hari
terendam air. Larva nyamuk akan tubuh menjadi pupa nyamuk setelah 6 – 8 hari.
Kepala larva berkembang baik dengan sepasang antena dan mata majemuk
serta sikat mulut yang menonjol. Abdomen larva terdiri atas 9 ruas yang jelas dan
ruas terakhir dilengkapi dengan tabung udara (sifon) berbentuk silinder. Tahap larva
adalah tahap makan. Perbedaan antara kedua jenis larva nyamuk Aedes hanya dapat dilihat dibawah mikroskop dengan melihat bentuk pekten sifon dan comb pada ruas
terakhir abdomen (Christophers, 1960).
Pupa nyamuk berbentuk seperti koma, kepala dan dada bersatu dilengkapi
dengan terompet pernafasan. Tahap pupa adalah tahap tidak makan. Pupa nyamuk
masih dapat aktif bergerak di dalam air dan setelah 1-2 hari akan memunculkan
nyamuk Aedes aegypti baru. Secara ringkas maka perkembangan telur sampai dengan nyamuk dewasa berlangsung sekurang-kurangnya 9 hari. Nyamuk setelah
muncul dari pupa akan mencari pasangan kemudian mengadakan perkawinan.
Setelah perkawinan inilah nyamuk siap mencari darah untuk perkembangan telurnya.
Nyamuk betina dewasa yang mulai menghisap darah manusia kemudian 3 hari
sesudahnya sanggup bertelur sampai dengan 100 butir dengan ukuran 0,7 mm per
selanjutnya kembali bertelur. Walaupun nyamuk betina berumur kira-kira 10 hari,
waktu tersebut cukup untuk untuk berkembang biak dan selanjutnya menyebarkan
virus ke manusia. Pada saat nyamuk menghisap darah manusia yang kebetulan
menderita demam dengue, virus dengue turut masuk ke dalam tubuh nyamuk. Virus
yang dihisap masuk ke dalam saluran pencernaan kemudian sampai di hemosul dan
kelenjar ludah. Virus memerlukan waktu 8 – 11 hari untuk dapat berkembang biak
baik secara propagatif agar dapat menjadi infektif (masa tunas ekstrinsik). Kemudian
nyamuk akan tetap infektif selama hidupnya. Nyamuk betina dapat terbang sejauh 2
kilometer, tetapi kemampuan normalnya adalah kira-kira 50 meter (Horsfall, 1955;
Dit Jen. PPM &PLP, 1990). Virus dengue dapat ditularkan secara transovarial dari
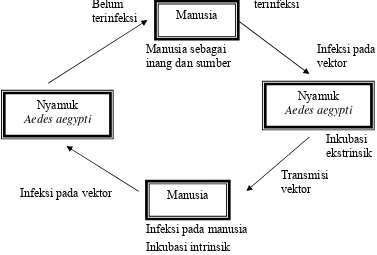
nyamuk betina Aedes aegypti melalui telur hingga keturunannya (Rosen et al, 1983). Infeksi virus dengue melalui vektor nyamuk Aedes aegypti ditunjukkan pada Gambar 2.
Berdasarkan Gambar 2, maka komponen pada siklus transmisi adalah :
- Inang vertebrata mengembangkan tingkat infeksi yang merupakan infeksi
kepada vektor
- Inang antropoda atau vektor mampu melakukan transmisi
- Satu atau lebih inang vertebrata terinfeksi setelah digigit vektor
Untuk dapat memberantas nyamuk Aedes aegypti secara efektif terdapat 3 perilaku nyamuk yang perlu diketahui, yaitu: perilaku mencari darah, istirahat dan
berkembang biak. Perilaku mencari darah dilakukan pada saat setelah kawin dimana
nyamuk betina memerlukan darah untuk bertelur. Nyamuk betina menghisap darah
manusia setiap 2 – 3 hari sekali dan pada pagi hari sampai dengan sore, lebih disukai
pada jam 08.00 – 12.00 dan 15.00 – 17.00. Untuk memperoleh darah yang cukup
nyamuk betina lebih sering menggigit lebih dari 1 orang. Perilaku istirahat nyamuk
Aedes aegypti adalah setelah kenyang menghisap darah, nyamuk betina perlu beristirahat 2 – 3 hari untuk mematangkan telurnya. Tempat istirahat yang paling
disukai adalah tempat-tempat yang lembab, dan kurang terang seperti kamar mandi,
WC, dapur; di dalam rumah seperti baju yang digantung, kelambu dan tirai, di luar
rumah seperti pada tanaman hias di halaman rumah.
Keberadaan Aedes aegypti yang mula-mula ditemukan di Ujung Pandang pada tahun 1860 oleh Walker (Christophers, 1960) kemudian menyebar luas dan
ditemukan di Jawa, Bali, Sumatera, Kalimantan, Maluku, Nusa Tenggara dan Irian
Jaya. Penyebaran Aedes aegypti yang kosmopolit dan menjangkau daerah yang sangat luas erat kaitannya dengan perkembangan sistem transportasi. Penyebaran spesies
nyamuk ini di Indonesia bermula dari kota-kota pelabuhan ke kota-kota di pedalaman
termasuk ke desa-desa, diakibatkan oleh transportasi yang mengangkut tempat-tempat
penampungan air hujan seperti drum, kaleng, ban bekas, dan benda-benda lainnya
yang mengandung larva Aedes aegypti. Penyebaran populasi Aedes aegypti juga erat kaitannya dengan perkembangan pemukiman penduduk akibat didirikannya
rumah-rumah baru yang dilengkapi dengan sarana pengadaan air untuk keperluan
Perilaku berkembang biak nyamuk Aedes aegypti adalah bertelur dan berkembang biak di tempat penampungan air yang bersih, yaitu: tempat penampung
air untuk keperluan sehari-hari sepeti bak mandi, tempayan, drum air, bak menara air
yang tidak tertutup; wadah yang berisi air bersih atau air hujan seperti: tempat minum
burung, vas bunga, ban bekas, potongan bambu yang dapat menampung air, talang
rumah, ketiak daun-daun tebal, lubang pohon, kaleng, botol dan barang bekas
lainnya.
Pengendalian Nyamuk Demam Berdarah
Lingkungan pemukiman manusia yang umumnya berupa suatu kompleks
bangunan tempat tinggal berikut berbagai fasilitas yang berhubungan dengan
berbagai hajat hidupnya, termasuk juga jalan, selokan, berikut tanaman pekarangan
dan hewan-hewan peliharaan merupakan suatu ekosistem tersendiri yang unik.
Lingkungan tersebut dibangun dan diciptakan terutama untuk kepentingan
kenyamanan hidup manusia, tetapi pada kenyataannya banyak mahluk hidup lainnya
ikut memanfaatkan kondisi itu sebagai habitat, tempat istirahat dan tempat mencari
makan.
Permasalahan hama pemukiman termasuk nyamuk Aedes aegypti timbul sebagai resultante dari faktor-faktor (Rabb, 1972):
1. Tingkat bahaya, kerugian atau gangguan yang mungkin ditimbulkan oleh
hama tersebut.
2. Tingkat populasi hama di lingkungan pemukiman.
3. Tingkat toleransi pemukim terhadap keberadaan hama lingkungannya
Di dalam ekosistem, populasi suatu jenis hama untuk jangka panjang ada
pada tingkat keseimbangan, sesuai dengan komponen-komponen biotik maupun
abiotik yang membentuk ekosistem. Namun untuk jangka waktu pendek, sebenarnya
tingkat populasi tersebut berfluktuasi tergantung pada faktor-faktor lingkungan yang
mengendalikannya. Faktor-faktor tersebut dapat dikelompokan menjadi dua macam
(1) faktor yang terpengaruh oleh kepadatan populasi serangga atau density
dependent factors,
(2) faktor yang tidak terpengaruh oleh kepadatan populasi hama atau density
independent factors.
Faktor-faktor pengendali yang terpengaruh oleh kepadatan adalah terutama
makanan dan musuh-musuh di alam (predator, parasit, patogen). Faktor-faktor
pengendali yang tidak terpengaruh oleh kepadatan adalah komponen-komponen
cuaca terutama suhu, kelembaban serta berbagai faktor fisik habitat tersebut. Dalam
konsep pengendalian hama perlu terlebih dahulu ditanamkan paham bahwa suatu
populasi hama tidak mungkin dapat diberantas habis, kecuali dalam suatu lokasi yang
amat terbatas dan benar-benar terisolasi dari populasi lainnya. Selama lapangan atau
areal merupakan lingkungan yang mempunyai hubungan bebas secara fisik, biologis
serta sosial ekonomis dengan lingkungan sekitarnya, maka harus dilakukan
pendekatan pengendalian populasi. Pendekatan ini hanya menekan populasi hama
sampai ketingkat yang tidak membahayakan, tidak merugikan atau tidak merupakan
gangguan pada manusia.
Menurut Metcalf (1982), dengan mempelajari sifat-sifat nyamuk, biologi dan
perilakunya di alam yang sedemikian kompleks, strategi pengendalian nyamuk Aedes
aegypti dapat dirancang. Secara umum pengendalian nyamuk dapat dilakukan dengan dua cara yaitu pengendalian non kimiawi dan kimiawi. Pengendalian non
kimiawi pada dasarnya adalah berbagai upaya untuk membuat keadaan lingkungan
menjadi tidak sesuai lagi bagi perkembangan nyamuk Aedes aegypti. Pengendalian ini salah satunya adalah dengan modifikasi lingkungan secara permanen agar tempat
perindukan nyamuk tidak tersedia. Kegiatan ini di Indonesia dikenal sebagai
Pengendalian Sarang Nyamuk 3M yang berarti menutup, menguras dan menimbun
berbagai tempat yang menjadi sarang nyamuk.
Pengendalian nyamuk secara kimiawi dilakukan menggunakan insektisida.
Insektisida dan cara-cara aplikasinya yang banyak digunakan di Indonesia adalah
larvasida, berbagai repelan dan insektisida yang digunakan dalam bentuk semprot dan
Menurut Rabb (1972), penggunaan insektisida dilakukan hanya bila
diperlukan saja dengan mempertimbangkan efek samping insektisida. Bagi ekosistem
permukiman yang utama harus dipertimbangkan adalah: (1) kemungkinan keracunan
langsung pada para pemukim maupun makhluk bukan sasaran lainnya,
(2) kemungkinan pencemaran berbagai medium berkaitan dengan kepentingan
aktivitas makhluk hidup lainnya, (3) kemungkinan timbul resistensi pada populasi
hama serangga sasaran setelah beberapa generasi. Dalam hal alternatif pestisida yang
dipilih, maka masih ada satu persoalan lagi yang krusial yaitu bagaimana cara
aplikasinya. Cara aplikasi yang akan dipilih harus efektif, efesien, murah, mudah,
diterima dikalangan masyarakat dan tidak merusak lingkungan.
Toksikologi Insektisida
Interaksi kimiawi toksik dengan sistem biologi berhubungan dengan dosis.
Toksisitas pada suatu organisme selalu dinyatakan dalam istilah LD50 (lethal dose)
yang berarti jumlah racun per unit berat organisme yang dibutuhkan untuk
membunuh 50% populasi percobaan. Satuan dari LD50 dinyatakan dalam mg
insektisida per Kg berat organisme. Pada kondisi bahan kimia/insektisida digunakan
untuk serangga, maka LD50 dinyatakan dalam mikrogram insektisida per serangga
(μ g/serangga).
Konsentrasi bahan kimia yang digunakan secara eksternal yang dapat
membunuh 50% hewan dinamakan LC50 (lethal concentration). Nilai ini digunakan
ketika dosis yang pasti pada serangga tidak dapat ditentukan. Istilah LT50 (lethal
time) merepresentasikan waktu yang dibutuhkan sehingga menyebabkan kematian 50% hewan percobaan pada dosis atau konsentrasi tertentu (Perry et al, 1998). Metode ini digunakan ketika jumlah hewan percobaan terbatas dan sering digunakan
pada pengujian lapangan dimana sulit mengumpulkan jumlah serangga yang cukup
untuk suatu pengujian. Pada kasus tertentu digunakan nilai KD50 (knockdown dose)
dan KT50 ( knockdown time).
Terdapat beberapa cara untuk melakukan pengujian pada serangga dan
dilarutkan dalam pelarut yang relatif tidak toksik seperti aseton dan larutan yang
dihasilkan diteteskan pada permukaan tubuh serangga (Perry et al, 1998).
Ketika pengetahuan tentang jumlah pasti insektisida dalam tubuh serangga
diperlukan, maka metode injeksi dapat digunakan. Metode ini mengunakan jarum
suntik yang sangat halus terbuat baja tahan karat 20 – 30 gauge (diameter 0,41 atau 0,3mm). Dibutuhkan gelas kecil untuk wadah insektisida yang akan disuntikkan
dengan ukuran diameter 0,1 – 0.16 mm. Insektisida umumnya dilarutkan dalam
propilen glikol atau minyak kacang tanah dan injeksi dilakukan intraperitoneal (ke dalam lubang tubuh). Metode pencelupan digunakan ketika aplikasi topical dipandang tidak praktis untuk dilaksanakan. Sebagai contoh pekerjaan pengujian
menggunakan serangga-serangga seperti larva, telur, laba-laba merah dan sebagainya.
Pengujian menggunakan metode kontak atau residu dengan cara insektisida
dilarutkan dalam pelarut yang mudah menguap (volatile) kemudian dimasukkan pada kontainer gelas. Pelarut yang mengandung insektisida tersebut akan menguap dan
ditampung dalam kontainer yang diputar-putarkan sehingga menghasilkan lapisan
residu pada dinding gelas. Alternatif lain insektisida ditempatkan pada kertas saring,
panel kayu atau jenis material bangunan lainnya dan dibiarkan mengering sebelum
dipajankan pada serangga percobaan. Deposit residu insektisida tersebut dinyatakan
sebagai miligram ramuan aktif per meter persegi ( mg atau g AI/m2).
Insektisida Organofosfat
Menurut Foley (2005), fungsi sistem syaraf adalah memediasi komunikasi
antara sel syaraf dengan sel-sel lain dalam suatu organisme. Komunikasi diawali
dengan melepaskan senyawa kimia yang dinamakan neurotransmiter dari pre sinap
ke sel-sel syaraf. Neurotransmiter berdifusi sepanjang sinap diantara sel-sel syaraf
dan sel-sel pengontak (postsynaptic) dan berikatan pada protein reseptor di dalam membran sel. Ikatan tersebut menstimulasi perubahan saluran ion dalam membran
yang difasilitasi oleh ion-ion spesifik (Na+, K+, Ca2+ atau Cl-) yang mengalir
disepanjang membran bagian bawah dari gradien konsentrasinya masuk atau keluar
perubahan muatan ion di bagian dalam sel. Pada keadaan absennya neurotransmitor
muatan di luar sel menjadi negatif. Pemicuan neurotransmiter oleh sel terjadi melalui
aliran ion Na+ dan dilipatgandakan melalui pembukaan tegangan listrik sensitif pada
saluran Na+ disepanjang akson sel-sel syaraf. Aliran ini membukakan tegangan listrik
sensitif saluran Ca2+ pada ujung sel syaraf. Aliran Ca2+ selanjutnya menstimulasi
perbedaan neurotransmiter berikutnya yang menghasilkan kontraksi otot. Inhibisi
neurotransmiter pada sel disebabkan oleh aliran ion K+ atau ion Cl- yang
menghasilkan suatu sel lebih resisten dalam mendepolarisasikan aliran Ca2+.
Asetillkolin adalah suatu neurotransmiter yang menstimulasi pembukaan
saluran Na+ and K+. Asetillkolin memberikan sinyal pada sinap yang diakhiri
melalui suatu enzim asetilkolinesterase (AChE) yang berfungsi mengkatalisis reaksi
hidrolisis asetilkolin menjadi kolin tidak aktif dan asetat seperti ditunjukkan pada
reaksi berikut:
AChE
(CH3)NCH2CH2OCOCH3 (CH3)3NCH2CH2OH + CH3CO2H
Asetilkolin kolin asam asetat
Enzim AChE merupakan kelompok serin esterase yang mengandung sisi
aktif serin (Ser), histidin (His) dan residu asam amino glutamat (Glu) yang
bersama-sama mengkatalisis reaksi hidrolisis asetilkolin. Ikatan H antara gugus Glu
karboksilat dan N-1 pada histidin meningkatkan kemampuan N-3 His untuk bertindak
sebagai basa yang menghilangkan H dari gugus hidroksil Ser. Hal ini yang
menyebabkan oksigen pada Ser merupakan nukleofilik dan mampu menyerang gugus
karbonil dari asetilkolin.
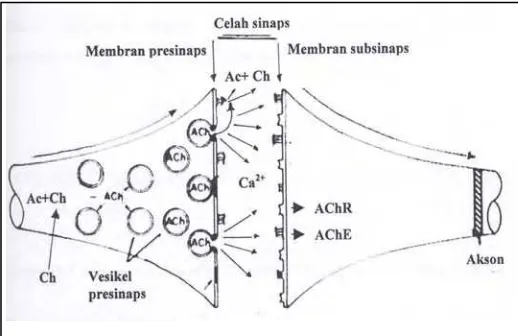
Reseptor neurotransmiter dan transmisi impul pada celah sinap ditunjukkan
Gambar 3. Reseptor neurotransmiter dan saluran ion (Foley, 2005)
Gambar 4. Transmisi impuls pada celah sinaps (Shankland dan Frazier, 1985 dalam Gunandini 2002)
Organofosfat bekerja dengan cara menghambat enzim AChE, sehingga
enzim ini tidak dapat menghidrolisis ACh. Senyawa organofosfat secara luas telah
digunakan menggantikan insektisida organoklorin. Senyawaan ini merupakan ester
atau derifat amida dari asam fosfat dan merupakan zat toksik untuk serangga maupun
vertebrata melalui inhibisi enzim kolinesterase.
ENZIM –OH + Z-P-(O)(OR)2 Æ ENZIM-O-P(O) (OR)2 + ZH
Senyawaan organofosfat diproduksi pada suhu tinggi (150 – 200oC) sehingga pada
umumnya mengandung isomer atau produk samping yang menyebabkan bau tidak
enak (Perry et al, 1998).
Gejala peracunan pada serangga mengikuti pola umum dari peracunan syaraf,
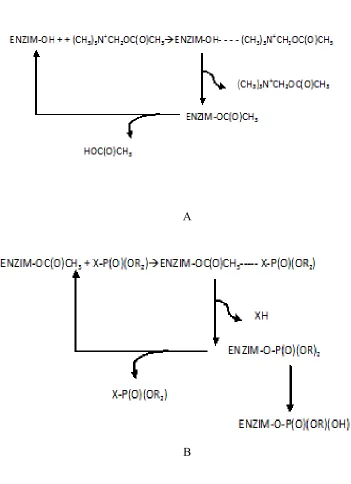
misalnya keresahan, hyperexiability, gemetaran, kejang, lumpuh dan mati. Untuk mengetahui mekanisme aksi toksik senyawaan organofosfat adalah interaksi enzim
asetilkoline dengan asetilkolinesterase (AChE). Pertama-tama AChE menghasilkan
kompleks E-OH –ACh (Asetilkolin – Enzim) yang merupakan intermediasi antara
enzim dengan substrat kompleks tersebut bersifat reversibel yang membentuk
asetilase AChE. Selanjutnya asetyl AChE dihidrolisis kembali menghasilkan AChE
(Perry et al, 1998). Reaksi tersebut sangat cepat sehingga tidak terjadi akumulasi asetilkolin sepanjang sinap atau pada sambungan neuromuscular. Bagian kolin kemudian dihilangkan dan asam asetat berkombinasi lagi (dengan pertolongan enzim
lain) membentuk asetilkoline dan siklus berulang.
Insektisida organofosfat yang diaplikasikan pada serangga bereaksi dengan
AChE pada kondisi yang sama. Tahap pertama enzim membentuk kompleks
reversibel dengan senyawa organofosfat, kemudian kompleks tersebut putus
menghasilkan organofosfat dan enzim yang terinhibisi (enzim fosforilate). Inhibisi
tersebut menghasilkan fosforilat yang eksistensinya cukup sama dengan tahapan
terakhir. Selanjutnya terjadi hidrolisis dan AChE dibebaskan dengan sebuah residu
fosfat (sebagai dimetil asam fosfat). Tahapan hidrolisis tersebut sangat lambat
dibandingkan dengan kondisi normal substrat asetilkolin sehingga enzim tidak dapat
berfungsi secara efektif dengan peningkatan asetilkolin yang masuk ke sinap sebagai
A
B
Gambar 5. Reaksi enzim asetilkolinesterase A: Dalam keadaan normal
Insektisida Malation
Malation termasuk ke dalam golongan insektisida organofosfat, untuk pertama
kalinya organofosfat dibuat di Jerman pada tahun 1934 oleh Schrader. Penggunaan
malation di Amerika Serkat sejak tahun 1950 Insektisida ini termasuk jenis yang
aman terhadap mamalia dengan nilai LD50 oral akut 900 - 5800 mg/kg berat badan
mempunyai tekanan uap 1,25 x 10-4 mm Hg pada suhu 20oC. Malation berwujud cair,
tidak berwarna dengan titik didih 156 - 157oC, insektisida ini larut dalam hampir
semua pelarut organik dan sedikit larut dalam air. Malation memiliki gugus karboksil
yang menyebabkan insektisida ini mudah terhidrolisis dalam tubuh mamalia
(Matsumura, 1989).
Malation merupakan insektisida organofosfat yang telah digunakan sejak
tahun 1950 di Amerika Serikat. Pemakaian malation sebagai insektisida di Amerika
Serikat mencapai 30 juta pound per tahun. Malation mulai digunakan di Indonesia
sejak tahun 1972 menggunakan metode pengasapan (fogging) (Suroso, 1992 dan Hoedojo. 1993).
Malation [O,O-dimethyl dithiophosphate of diethyl mercaptosuccinate]
adalah insektisida yang digunakan untuk berbagai tanaman sayuran, buah dan
lain-lain. Rumus empirik melathion adalah C10H19O6PS2 dengan berat molekul 330,4
(Cox, 2003). Rumus bangun malation ditunjukkan pada Gambar 6
Malation membunuh serangga sebab di dalam tubuh serangga malation
diubah menjadi malaoxon yang menghambat enzim asetilkolinesterase.
Gambar 7. Rumus bangun malaoxon
Pada tahun 2000 malation diduga sebagai bahan karsinogenik tetapi tidak
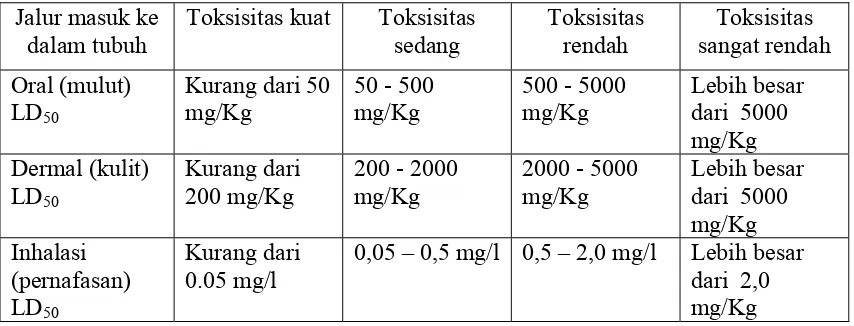
cukup berdampak karsinogenik terhadap manusia (Cox, 2003). Toksisitas malation
dibagi menjadi 4 jenis sesuai dengan dosisnya dan ditunjukkan pada Tabel. 1.
Tabel 1. Empat kriteria toksisitas malation berdasarkan nilai LD50
Jalur masuk ke
Temefos dikenal dengan nama dagang abate dan merupakan satu-satunya
penggunaannya biasa disebut dengan abatisasi. Temefos mempunyai rumus molekul
C16H20O6P2S3 dan rumus bangun ditunjukkan pada Gambar 8.
Gambar 8. Rumus bangun temefos
Temefos merupakan golongan insektisida organofosfat dengan nama dagang
abate dan nama kimia phosphorothioic acid, O,O'-(thiodi-4,1-phenylene) bis
(O,O'-dimethyl) phosphorothioate atau Phosphoric acid, O,O'-(thiodi,1,4-phenylene)
O,O,O',O'-tetramethyl ester. Rumus kimia insektisida ini adalah C16H20O6P2S3 dan
mempunyai berat molekul 446,46 dan kelarutannya pada suhu 26oC sebesar 30 g/l.
Menurut US EPA (1999), temefos mempunyai toksisitas rendah sampai dengan
moderat akut dibandingkan dengan insektisida organofosfat lainnya. Temefos
bersifat toksisitas moderat akut jika melalui jalur dermal atau oral dan bersifat
toksisitas rendah jika melalui jalur inhalasi. Data toksisitas temefos ditunjukkan pada
Tabel 2.
Tabel 2. Data toksisitas temefos
Jenis Studi Hasil Katagori
Toksisitas Akut oral (Tikus) LD50= 444 mg/kg II
Akut dermal (Kelinci) LD50 = 1850 mg/kg (Jantan)
LD50 = 970 mg/kg (Betina)
II II
Akut inhalasi LC50 > 1,3 mg/L III
Iritasi primer pada mata Corneal opacity 72 jam III
Iritasi primer pda kulit 1,4 IV
Masalah Resistensi
Cekaman didefinisikan secara luas sebagai suatu perubahan lingkungan yang
mempengaruhi kesehatan organisme. Cekaman dapat disebabkan karena faktor fisik,
biotik dan senyawa kimia beracun. Resistensi telah didefinisikan sebagai
perkembangan kemampuan suatu strain organisme untuk bertoleransi terhadap dosis
zat beracun yang dapat menyebabkan kematian pada kebanyakan individu dalam
spesies yang sama pada kondisi normal (Scott, 1995).
Resistensi dan toleransi sering digunakan secara bergantian dalam berbagai
pustaka untuk mendefinisikan satu dengan lainnya, walaupun toleransi digunakan
juga untuk menjelaskan pergeseran kerentanan yang terjadi dalam generasi tunggal
setelah terpajan. Dua istilah lain yang sering digunakan adalah resistensi silang
(cross-resistance) dan resistensi ganda (multiple resistance). Resistensi silang adalah resistensi terhadap dua atau lebih insektisida yang mempunyai fungsi kerja yang
sama. Sebagai contoh resistensi silang dapat terjadi pada serangga terhadap
organofosfat dan karbamat karena kedua insektisida tersebut mempunyai target kerja
yang sama. Resistensi ganda mengacu pada resisten terhadap dua atau lebih golongan
pestisida dengan mekanisme kerja yang berbeda. Sebagai contoh adalah resistensi
serangga terhadap organofosfat dan piretroid.
Untuk menjelaskan bagaimana generasi induk dapat menghasilkan keturunan
yang resisten terhadap insektisida dapat dijelaskan sebagai berikut, pajanan
insektisida yang terus menerus akan membuat cekaman terhadap materi genetik
(misalnya DNA) sehingga menjadi berubah. Terdapat 3 jenis perubahan materi
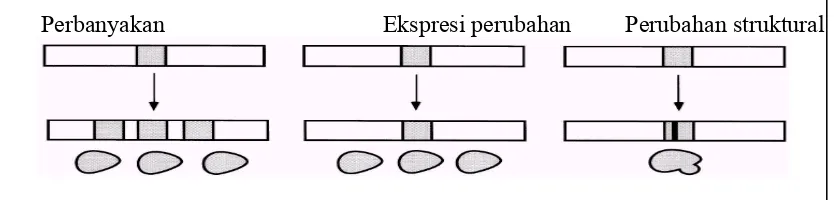
genetik yang ditunjukkan pada Gambar 6 (Scott, 1995).
Perbanyakan Ekspresi perubahan Perubahan struktural
Perubahan yang pertama adalah suatu gen mengalami perbanyakan
(amplifikasi) sehingga menghasilkan lebih dari satu salinan gen. Jika suatu serangga
mempunyai 10 salinan gen detoksifikasi, maka akan menghasilkan produk
detoksifikasi 10 kali lebih besar dibandingkan serangga yang mempunyai satu buah
gen. Ekspresi gen juga menghasilkan perubahan resistensi. Pada kasus kedua ini
hanya ada satu salinan gen yang bermutasi tetapi produk mutasinya menghasilkan gen
pengatur yang lebih atau kurang dibandingkan gen induk. Sebagai contoh dalam
serangga rasio gen terhadap gen produk adalah 1:1, tetapi pada serangga yang resisten
rasio tersebut berubah. Gen dapat mengatur lebih untuk menghasilkan lebih banyak
produk sehingga rasio gen terhadap gen produk adalah 1:10 atau gen mengatur
kurang sehingga membuat rasionya menjadi lebih sedikit (misalnya 1: 0,1).
Perubahan gen yang ketiga yang menyebabkan serangga resisten adalah perubahan
struktural suatu gen yang menghasilkan perubahan-perubahan produk. Sebagai
contoh nukleotida dalam daerah gen pengkode disubstitusi dengan nukleotida yang
berbeda sehingga asam amino yang berbeda akan dikodekan pada posisi tertentu.
Perubahan ini menyebabkan gen produk mempunyai tiga dimensi struktur yang
berbeda dan dapat menghasilkan sifat resisten dalam berbagai cara. Hal ini mungkin
dapat menyebabkan penurunan atau peningkatan kemampuan serangga dalam
memetabolisme insektisida.
Resisten metabolik senyawa organofosfat pada serangga umumnya
disebabkan oleh perbedaan secara kualitatif dan kuantitatif pada karboksilesterase. Perbedaan kuantitatif merupakan penyebab utama resistensi pada Culex quinquefasciatus dan C. tritaeniorhynchus. Kenaikan tingkatan enzim disebabkan oleh amplifikasi gen pada kedua spesies ini. Perubahan secara kualitatif, misalnya
mutasi dapat menyebabkan perbedaan esterase pada serangga tertentu. Mutasi enzim
ini mampu memetabolit insektisida lebih cepat dari pada enzim asalnya. Karunaratne
dan Hemingway (2001) dalam percobaan di Srilangka melaporkan bahwa resistensi
tingkat tinggi terhadap malation terjadi pada Culex quinquefasciatus dimana 78% dapat selamat dari dosis malation yang dianjurkan oleh WHO. Tingkatan resistensi
gelidus, Aedes aegypti dan Aedes albopictus terbukti tidak resisten pada dosis malation yang dianjurkan oleh WHO.
Mekanisme resitensi insektisida mempunyai suatu dasar biokimia (Brogdon
dan McAllister, 1998). Terdapat dua bentuk biokimia sebagai sisi target resistensi
terhadap insektisida yang terjadi ketika insektisida tidak lagi berikatan dengan target
dan terjadi detoksifikasi oleh enzim-enzim seperti esterase, oksidase atau glutathion S-transferase (GST) yang mencegah insektisida mencapai target tersebut. Mekanisme perubahan sisi target asam-asam amino yang merupakan pengikat
insektisida pada sisi-sisi aktifnya menyebabkan insektisida tersebut kurang atau
menjadi tidak efektif.
Penggunaan insektisida sejenis secara terus menerus akan menimbulkan
dampak yang merugikan yaitu munculnya galur serangga yang resisten. Resistensi
Aedes aegypti terhadap berbagai insektisida dapat menimbulkan masalah pada program pengendalian vektor dengue dan yellow fever. Studi awal pada dugaan resistensi Aedes aegypti terhadap insektisida telah dilakukan di Puerto Rico, Brazil dan negara-negara Amerika lainnya. Berdasarkan hasil penelitian telah ditemukan
bukti resistensi Aedes aegypti terhadap insektisida organofosfat (Lima et al, 2003). Untuk menghindari resistensi, pemerintah Srilangka menggunakan malation sebagai
insektisida utama untuk mengendalikan malaria menggantikan DDT dan selanjutnya
insektisida piretroid digunakan antara tahun 1995 dan 1997. Penggunaan malation
yang sangat ekstensif ini telah berkontribusi pada resistensi nyamuk vektor malaria
terhadap insektisida organofosfat (Karunaratne dan Hemingway, 2001).
Percobaan resistensi nyamuk Aedes aegypti terhadap insektisida dilakukan di India menggunakan DDT, dieldrin, fenitrotion, propoksur, malation, deltametrin,
pemetrin dan lambdacihalotrin. Hasil percobaan menunjukkan bahwa nyamuk Aedes aegypty telah resisten terhadap DDT dan dieldrin, toleran terhadap fenitrotion dan proporsur dan tidak resisten terhadap malation, deltametrin, permetrin dan
Mekanisme Detoksifikasi
Menurut Brogdon dan Mc Allister (1998), enzim yang bertanggungjawab
terhadap detoksifikasi xenobiotic pada mahluk hidup diturunkan melalui sejumlah besar multigen seperti enzim esterase, oksidase dan GST. Kemungkinan seluruh
mekanisme resistensi pada serangga merupakan tingkatan-tingkatan atau aktivitas
detoksifikasi enzim esterase yang menghidrolisis ester-ester sejumlah besar
insektisida. Enzim estarase tersebut termasuk 6 jenis protein termasuk jenis lipatan
enzim α/β hidrolase. Pada Diptera, hal ini terjadi sebagai kelompok gen pada kromosom yang sama. Kelompok gen dimodifikasi melalui perubahan suatu asam
amino tunggal dan mengubahnya secara khusus suatu ester menjadi hidrolisis
insektisida atau melalui penggandaan gen yang memperbesar resistensi insektisida.
Oksidase sitokrom P450 memetabolisme insektisida melalui mekanisme: (a) hidroksilasi O-,S-, dan N-alkil,
(b) hidroksilasi dan epoksidasi alifatik,
(c) hidroksilasi armatik,
(d) oksidasi ester
BAHAN DAN METODE
Lokasi Pengambilan Sampel
Nyamuk untuk bahan uji dalam penelitian ini berasal dari telur Aedes aegypti yang diperoleh dari wilayah Jakarta Timur yang memiliki kasus demam berdarah tertinggi.
Survey pendahuluan untuk menentukan lokasi penelitian dipandu oleh petugas Dinas
Kesehatan Jakarta Timur berdasarkan data kasus kejadian tertinggi di wilayah tersebut.
Peta lokasi penelitian tersaji pada Gambar 10 dan 11.
25
Gambar 11. Lokasi penelitian di wilayah Kelurahan Duren Sawit, Kecamatan Duren Sawit Jakarta Timur
Setelah ditentukan wilayah studi oleh petugas Dinas Kesehatan Jakarta Timur maka
dari lokasi tersebut dipilih beberapa sub lokasi secara random untuk pengambilan telur
nyamuk Aedes aegypti. Pengambilan telur dilakukan dengan menggunakan ovitrap selama satu minggu. Pada penelitian ini dilakukan dua kali pengambilan. Pemasangan
ovitrap dilakukan pada wilayah rukun warga (RW) yang paling endemik, yaitu di Rawa Domba Kelurahan Duren Sawit, Kecamatan Duren Sawit Jakarta Timur. Pemasangan
ovitrap dilakukan pada RW 7 yang terdiri dari 4 RT, yaitu RT 4, RT 5, RT 6 dan RT 9. Lokasi pengambilan telur nyamuk dilakukan pada daerah padat dan kumuh serta daerah
terbuka seperti terlihat pada Gambar 12 dan 13.
RT 4
RT 5 RT 6
26
Gambar 12. Daerah padat dan kumuh
a : Tipe rumah tinggal dengan intensitas cahaya kurang (gelap) b: Tipe rumah tinggal dengan talang air yang tidak terawat c: Tipe rumah tinggal tanpa saluran pembuangan air
d: Tipe rumah tinggal berfungsi sebagai penampung barang bekas
a b
27
A B
Gambar 13. Daerah terbuka
a: Lahan terbuka yang berfungsi sebagai tempat pembuangan sampah b: Lahan terbuka yang mempunyai genangan air
Jumlah ovitrap yang dipasang untuk masing-masing RT sebanyak 20 buah. Pemasangan ovitrap dibantu oleh petugas puskesmas, jumantik dan kader. Sebelum pelaksanaan dilakukan pelatihan untuk tenaga yang akan terlibat sesuai kegiatannya.
Pengambilan kertas saring di dalam ovitrap dibantu oleh jumantik dan kader dibawah supervisi ketua PKK dan ketua kader jumantik. Setelah masa pemasangan ovitrap selesai maka semua ovitrap dikumpulkan kembali supaya tidak menjadi tempat nyamuk bertelur.
Pemeliharaan Nyamuk Aedes aegypti di Laboratorium
Telur yang didapat dari setiap lokasi ditetaskan di dalam nampan yang berbeda
untuk setiap lokasi, nampan-nampan tersebut diisi air bersih sebagai media larva. Setelah
menjadi larva, dilakukan pemberian pakan berupa hati ayam rebus. Besarnya kebutuhan
pakan larva tergantung pada jumlah dan instar larva. Setelah larva menjadi pupa, maka
pupa-pupa tersebut dipindahkan ke wadah yang diisi air bersih untuk ditetaskan dalam
28
menetas dan akan kawin diberi pakan darah marmut agar telur yang dihasilkan menjadi
fertil. Untuk mendapatkan telur, dibuat perangkap telur sederhana berupa kertas saring
yang diletakkan dalam mangkuk plastik berisi air secukupnya untuk melembabkan media
tersebut. Telur-telur hasil pemeliharaan dan pembiakan di laboratorium dikumpulkan
sampai jumlahnya dapat menghasilkan larva nyamuk F2 untuk diuji toleransinya.
Pemeliharaan nyamuk yang berasal dari pengambilan telur di lapangan (wilayah
pengamatan) dilakukan di Bagian Parasitologi dan Entomologi Kesehatan Fakultas
Kedokteran Hewan IPB
a b
29
Gambar 15. Kandang pemeliharaan nyamuk Aedes aegypti dewasa
30
Uji Toleransi
Uji Toleransi Larva Nyamuk Aedes aegypti Terhadap Temefos
Uji toleransi yang digunakan sesuai standar WHO dan mengacu pada penelitian
yang dilakukan oleh Polson (Polson et al, 2001). Sebanyak 50 larva ditempatkan pada wadah plastik yang berisi 500 ml air tanah. Larva-larva dikontakkan dengan temefos
berkonsentrasi 0,00004; 0,0002; 0,0001; 0,01 dan 0,025 ppm. Pengujian dilakukan
masing-masing dengan tiga kali pengulangan dan kontrol menggunakan nyamuk yang
berasal dari Bagian Parasitologi dan Entomologi Kesehatan Fakultas Kedokteran Hewan
IPB sebagai pembanding. Mortalitas dihitung setelah larva nyamuk berkontak dengan
temefos selama 24 jam. Kriteria toleransi larva terhadap temefos ditentukan sebagai
berikut:
• kematian sebesar 99 — 100% (peka)
• kematian sebesar 80 — 98% (diperlukan verifikasi/toleran)
• kematian sebesar <80% (resisten)
Uji Toleransi Nyamuk Dewasa Aedes aegypti Terhadap Malation
Uji toleransi yang digunakan sesuai standar WHO (1981) untuk insektisida
malation (organofosfat). Percobaan ini dilakukan berdasarkan kontak nyamuk dewasa
dengan insektisida yang terimpregnasi (impregnated) dalam kertas saring. Kertas saring yang digunakan mempunyai konsentrasi 0,8% dan 5% (v/v). Nyamuk yang digunakan
adalah nyamuk betina dewasa. Sebagai pembanding atau kontrol digunakan nyamuk
Aedes aegypti yang berasal dari insektarium Bagian Parasitologi dan Entomologi Kesehatan Fakultas Kedokteran Hewan IPB. Empat pasang tabung disiapkan dan pada
setiap tabung uji (yang diberi tanda merah) dipasang kertas berinsektisida memutari
dinding tabung (Gambar 17). Selanjutnya ke dalam tabung uji dimasukkan nyamuk
betina sebanyak 25 ekor dengan kondisi abdomen kenyang air gula. Uji toleransi nyamuk
Aedes aegypti dilakukan dengan dua standar:
1. Standar WHO, nyamuk yang dikontakkan dengan insektisida malation 0,8%
31
waktu untuk melakukan percobaan, dilakukan percobaan dengan cara yang sama
tetapi waktu kontak 45 sampai dengan 90 menit.
2. Standar Indonesia: nyamuk dikontakkan dengan insektisida malation 5% selama 2,
5, 10, 15 dan 30 menit.
a b
Gambar 17. Peralatan pengujian resistensi nyamuk Aedes aegpti terhadap malation.
a. Tabung pengujian resistensi nyamuk dewasa terhadap malation b. Pengujian resistensi nyamuk dewasa terhadap malation
Sebagai kontrol digunakan 2 tabung yang diberi tanda hijau dan dilengkapi kertas
tanpa insektisida. Setelah nyamuk diuji kontak, kemudian dipindahkan kedalam tabung
penyimpanan (holding) yang diberi tanda hijau. Kematian nyamuk dihitung/diamati setelah 24 jam penyimpanan. Selama penyimpanan kelembaban dijaga dengan cara pada
ujung tabung penyimpanan diletakkan kapas basah. Percobaan yang sama dilakukan
pada nyamuk pembanding. Data seluruh uji toleransi baik larva maupun nyamuk
dewasa digunakan untuk menghitung konsentrasi kematian (LC) untuk larva dan waktu
kematian (LT) untuk dewasa menggunakan piranti lunak POLO. Perbandingan nilai LC
nyamuk yang diamati dengan nyamuk laboratorium merupakan nilai rasio resistensi
32
Untuk membuktikan secara komprehensif status toleransi nyamuk Aedes aegypti
terhadap temefos dilakukan perhitungan probit untuk menentukan LC50, LC95 dan rasio
resistensi (RR). Setelah LC50, LC95 diperoleh dari perhitungan probit, maka nilai rasio
toleransi (RR) dapat dihitung menggunakan persamaan di bawah ini (Rawlins, 1998.,
Ponlawat et al, 2005):
Uji Peningkatan Enzim Esterase Non Spesifik (Lee, 1990 dalam Widiarti, et al 2002)
Larutan yang disediakan untuk pengujian peningkatan enzim esterase adalah:
1. Larutan α-naftil asetat (α-NA), dibuat dengan cara melarutkan 0,0559 g α-NA
ke dalam 10 ml aseton sehingga diperoleh α-NA 30 mM (larutan stock)
2. Larutan β-naftil asetat (β-BA) dibuat dengan cara melarutkan 0,0559 g α-NB
ke dalam 10 ml aseton sehingga diperoleh α-NA 30 mM (larutan stock)
3. Larutan A (NaH2PO4 0,2M) dibuat dengan cara melarutkan 6 g Na2H2PO4 ke
dalam 200ml H2O.
4. Larutan B (Na2HPO4 0,2M) dibuat dengan cara melarutkan 6 g Na2HPO4 ke
dalam 200ml H2O.
5. Larutan fosfat buffer (PBS) 0,1 M; pH 7, dibuat dengan cara mencampur 35
ml larutan A + 90 ml larutan B + 125 ml H2O.
6. Larutan fosfat buffer (PBS) 0,2 M; pH 7,2 dibuat dengan cara mencampur 5
ml larutan A + 90 ml larutan B + 125 ml H2O.
7. Larutan SDS 5% dibuat dengan cara melarutkan 2,5 g SDS ke dalam 50 ml
PBS 0,1M pH 7.
8. Larutan α-NA 0,3 mM dibuat dengan cara mencampur 120 μl larutan α-NA
30 mM ke dalam 11,88 ml PBS 0,002M; pH 7,2.
9. Larutan β-NA 0,3 mM dibuat dengan cara mencampur 120 μl larutan β-NA
30 mM ke dalam 11,88 ml PBS 0,002M; pH 7,2.
10. Larutan fast blue, dibuat dengan cara melarutkan 50 mg Fast Blue B salt + 5
33
Cara pengujian sebagai berikut, seekor larva nyamuk Aedes aegypti instar 4 digerus dengan dengan 150 μl deionized water di dalam tabung Eppendorf menggunakan grinder bertenaga baterai sampai hancur. Untuk setiap piringan dengan jumlah lubang 96 buah dibutuhkan 47 larva, satu larva digunakan untuk dua sumur, masing-masing untuk
pengujian dengan α-NA dan β-NA. Sebagai standar digunakan air untuk diisikan pada
dua buah sumur pertama (A1 dan B1). Setelah itu ekstrak dari setiap satu tabung minitub eppendorf diambil 2 X 20 μl larutan yang mengandung gerusan larva nyamuk (homogenat), satu sumur diisi 20 μl homogenat. Untuk baris pertama, ketiga, kelima dan
ketujuh (A, C, E dan G) direaksikan dengan 200 μl larutan α-NA, sedangkan untuk
barisan kedua, keempat, keenam dan kedelapan (B, D, F dan H) direaksikan dengan 200 μl larutan β-NA, setelah itu didiamkan selama satu menit, kemudian ditambahkan 50 μl larutan fast blue. Reaksi dibiarkan berlangsung selama 15 menit. Untuk menghentikan reaksi ditambahkan 50 μl larutan asam asetat ke dalam setiap mikroplate. Pembacaan
hasil reaksi dilakukan mengunakan Elisa reader pada panjang gelombang 450 nm.
Tanggapan masyarakat terhadap penyakit DBD dan pengendaliannya
Tanggapan masyarakat terhadap penyakit DBD dan pengendaliannya dilakukan dengan
membagikan angket berupa kuesioner yang disampaikan kepada 80 kepala keluarga.
Angket tersebut berupa isian data mengenai:
(1) Karakteristik responden: umur, pekerjaan dan penghasilan perbulan
(2) Pengetahuan terhadap perilaku nyamuk Aedes aegypti
34
HASIL DAN PEMBAHASAN
Status toleransi larva Aedes aegyptiterhadap temefos
Penentuan staus toleransi Aedes aegypti terhadap temefos di Kelurahan Duren
Sawit, Kecamatan Duren Sawit Jakarta Timur, dilakukan berdasarkan kriteria WHO
(WHO 1981) bahwa suatu populasi dianggap resisten bila pada saat dilakukan pengujian
bioassay, kematian nyamuk kurang dari 80% dengan konsentrasi temefos 0,02 ppm.
Hasil pengujian bioassay ditunjukkan pada Tabel 3.
Tabel 3 Persentase kematian larva nyamuk Aedes aegypti pada uji toleransi terhadap temefos
Lokasi
35
Merujuk Tabel 3, pemakaian temefos pada konsentrasi 0,00004 ppm
menunjukkan jumlah kematian larva nyamuk Aedes aegypti pada seluruh daerah
pengamatan berkisar antara 23,33 sampai dengan 60,67%. Pada konsentrasi tersebut
larva nyamuk Aedes aegypti yang berasal dari Bagian Parasitologi dan Entomologi
Kesehatan Fakultas Kedokteran Hewan IPB yang digunakan sebagai pembanding
mengalami kematian sebesar 88%. Pada konsentrasi temefos 0,0002 ppm jumlah larva
nyamuk yang mati berada pada kisaran 55,33 sampai dengan 92%. Disisi lain kematian
larva nyamuk Aedes aegypti yang berasal dari laboratorium entomologi FKH IPB
95,33%.
Pada konsentrasi temefos 0,001% menunjukkan respon kematian yang signifikan
pada kisaran 78 sampai dengan 100% untuk larva nyamuk dari seluruh daerah
pengamatan. Pemakaian konsentrasi temefos 0,01% atau setengah dari konsentrasi yang
dianjurkan oleh WHO menunjukkan seluruh larva nyamuk mengalami kematian
sebanyak 100%, demikian juga pada konsentrasi temefos 0,025%. Berdasarkan hasil
percobaan menunjukkan bahwa larva nyamuk Aedes aegypti pada semua lokasi pengamatan belum berada pada status resisten. Hal ini merujuk pada WHO, yang
menyatakan bahwa suatu populasi dinyatakan resisten jika persen kematian larva
nyamuk kurang dari 80% setelah mengalami pajanan temefos 0,02 ppm selama 24 jam
(WHO, 1981).
Dari pengolahan data menggunakan perhitungan probit diperoleh hubungan antara
respon kematian larva nyamuk Aedes aegypti terhadap pengaruh peningkatan konsentrasi temefos (mortalitas dalam probit), hal ini ditunjukkan pada Gambar 18. Dari gambar
tersebut dapat dilihat adanya hubungan antara respon kematian larva Aedes aegypti
terhadap pengaruh peningkatan konsentrasi temefos yang digunakan. Hal ini ditunjukkan
oleh koefisien korelasi antara log konsentrasi dengan mortalitas dalam probit pada semua
daerah pengamatan. Hasil perhitungan koefisien korelasi tersebut untuk wilayah RT 4,
36
Gambar 18. Hubungan kematian larva Aedes aegypti terhadap konsentrasi temefos
Nilai koefisien korelasi tersebut diatas 0,5 atau 50% yang berarti terdapat
hubungan antara kematian larva Aedes aegypti dengan konsentrasi temefos pada kisaran
0,00004 sampai dengan 0,025 ppm. Nilai koefisien korelasi disetiap daerah pengamatan
yang berkisar antara 0,805 sampai dengan 0,913 menunjukkan adanya homogenitas
respon larva nyamuk terhadap konsentrasi temefos.
Perhitungan probit yang digunakan untuk menyatakan status toleransi larva
nyamuk Aedes aegypti terhadap larvasida temefos di kelurahan Duren Sawit, Kecamatan
Duren Sawit Jakarta Timur ditunjukkan pada Tabel 4.
37
Mengacu pada Tabel 4, nilai RR50 larva Aedes aegypti yang berasal dari RT 4,
RT 5, RT 6 dan RT 9 berturut-turut 6, 17, 6 dan 2 kali dibandingkan dengan larva
nyamuk pembanding. Disisi lain nilai RR95 larva yang berasal dari RT 4, RT 5, RT 6 dan
RT 9 berturut-turut 2,15; 29,38; 9,23 dan 3,85 kali dibandingkan dengan larva nyamuk
pembanding. Berdasarkan nilai rasio resistensi (RR) maka terbukti pemakaian temefos
untuk menangani kasus demam berdarah di Kelurahan Duren sawit, Kecamatan Duren
Sawit Jakarta Timur belum berada pada status resisten. Hal ini mengacu pada Brown
(1989) yang menyatakan bahwa nyamuk berada pada tahap resisten jika nilai rasio
resistensi meningkat lebih dari 10 kali dan nilai LC50 melebihi 0,25 ppm. Walaupun
sebagian besar wilayah Kelurahan Duren Sawit Jakarta Timur belum berada pada status
resisten tetapi perlu diwaspadai kemungkinan peningkatan status toleran terhadap
temefos. Dari Hasil penelitian Gunandini (2002) pada 20 generasi terlihat bahwa
besarnya LC50 temefos semakin meningkat dengan semakin bertambahnya generasi yaitu
pada konsentrasi 0,025 ppm (Fo), 0,032 ppm (F5) 0,042 ppm (F10), 0,062 (F15) dan
0,071 ppm (F20).
Toleransi terhadap temefos pada Aedes aegypti telah dilaporkan di Bangkok. Pada tahun 1966, larva Aedes aegypti yang berasal dari 14 daerah di kota Bangkok menunjukkan toleran terhadap temefos. Tahun 1986 sampai dengan 1993 nyamuk Aedes aegypti terindikasi resisten terhadap temefos (Ponlawat, et.al 2005). Paeporn et al (2005) melaporkan terdapat satu kasus toleran terhadap temefos dari 4 wilayah
pengamatan di Thailand. Tingkat resistensi yang tinggi terdeteksi di wilayah Surat Thani
yang ditunjukkan oleh nilai rasio resistensi (RR95) sebesar 130 kali terhadap strain
pembanding. Uji toleransi terhadap temefos di Rajahmundry town India, memberikan
hasil pada konsentrasi malation 0,125 dan 0,625 ppm menyebabkan kematian larva
nyamuk Aedes aegypti sebesar 100% (Mukhopadhyay et al, 2006).
Laporan internal Environmental Surveillance Directory Brazil menunjukkan sebanyak 33,833 ton temefos telah digunakan sepanjang tahun 1997-2001. Terkait
dengan hal tersebut, penelitian uji kepekaan nyamuk Aedes aegypti terhadap temefos di
Brazil menunjukkan indikasi resisten. Dua dari tujuh wilayah yang diamati yaitu
Ceilandia dan Gama masih menunjukkan status peka terhadap temefos. Tiga wilayah
38
dan dua wilayah Guara dan N. Bandeirante terindikasi resisten. Dua wilayah yang
diindikasikan resisten tersebut berdasarkan hasil percobaan bioassay menunjukkan
sebanyak 54,1% sampai dengan 61,9% larva nyamuk Aedes aegypti yang mati pada
konsentrasi temefos 0,012 ppm (de Carvalho et al, 2004).
Berdasarkan data pembanding kasus resistensi di kedua negara tersebut diatas,
timbul pertanyaan mengapa disebagian besar wilayah pengamatan belum terdapat kasus
resistensi temefos. Dari 4 wilayah pengamatan, hanya 1 wilayah yang terindikasi toleran
yaitu di RT 5. Di wilayah ini bertahun-tahun terjadi kasus demam berdarah yang cukup
tinggi dan mendapat perhatian yang cukup besar dari setiap stake holder termasuk upaya
pemberantasan vektor nyamuk Aedes aegypti. Disisi lain pemakaian temefos di Indonesia juga telah digunakan selama bertahun-tahun dan secara masal pernah
digunakan pada tahun 1986 sampai dengan 1989 di berbagai kota endemis (Hoedojo,
1993).
Menurut petunjuk Departemen Kesehatan RI konsentrasi temefos yang dianjurkan
adalah 1% atau jauh lebih tinggi dari konsentrasi yang dianjurkan oleh WHO yaitu 0,02%
(Suroso et al, 2003). Belum terindikasinya resistensi temefos di wilayah pengamatan ini kemungkinan karena upaya pengendalian nyamuk Aedes aegypti sebagian besar hanya dilakukan melalui pemutusan rantai penularan manusia-nyamuk-manusia, yaitu dengan
membasmi habitat nyamuk dan jarang dilakukan menggunakan metoda kimiawi. Usaha
ini lebih banyak dilakukan dengan program pemberantasan sarang nyamuk (PSN) dengan
menguras dan menutup tempat penampungan air serta mengubur wadah-wadah yang
dapat digunakan untuk berkembangbiak nyamuk dibandingkan dengan pemakaian
temefos. Hal ini dapat dijelaskan dari hasil kuesioner dengan responden sebanyak 50
kepala keluarga (30 kepala keluarga tidak mengembalikan kuesioner) di wilayah
penelitian ini. Berdasarkan hasil kuesioner, sebanyak 48,15% tidak mengetahui penyakit
demam berdarah sedangkan 46,15% dari responden mengetahui penyakit demam
berdarah tetapi tidak mengetahui cara pemberantasan jentik nyamuk Aedes aegypti menggunakan temefos.
Seperti halnya diberbagai wilayah di Indonesia, pemberantasan sarang nyamuk
dilakukan dan dikoordinasi oleh juru pemantau jentik (jumantik) dibawah pengawasan