46
45
Tim Mikrobiologi FK Brawijaya. (2003). Bakteriologi Medik. Cetakan Pertama. Malang: Bayu Media Publishing.
Tisnadjaja D. (2006). Bebas Kolesterol dan Demam Berdarah. Cibinong: Niaga Swadaya. Halaman 3.
Trease, E. (1983). Pharmacognosy. Edisi kedua belas. London: Aldon Press. Halaman 135-136.
Venn, R.F. (2008). Principles and Practices of Bioanalysis. Edisi kedua. Boca Raton: Taylor and Francis Group. Halaman 23-25.
Volk, W.A. dan Wheeler, M.F. (1993). Mikrobiologi Dasar. Jilid I. Alih Bahasa: Markam. Jakarta: Erlangga. Halaman 33-40; 218-219.
World Health Organization. (1992). Quality Control Methods For Medicinal Plant Material. Switherland: WHO. Halaman 19-25.
47
Tumbuhan laja gowah
Simplisia rimpang laja gowah
48
Rimpang laja gowah segar
49
Serbuk simplisia
50 Keterangan :
1. Minyak atsiri
2. Berkas pembuluh (xylem) 3. Pati (bentuk: mirip kunci) 4. Parenkim
5. Epidermis
Lampiran 5. Bagan kerja penelitian
1
4 2
3
51
dicuci dari pengotor sampai bersih ditiriskan
dipotong-potong 1-2 cm ditimbang berat basahnya dikeringkan
ditimbang berat keringnya
dihaluskan dengan blender disimpan
Lampiran 6. Bagan pembuatan ekstrak etanol rimpang laja gowah (Alpinia
imalaccensis (Burm.f.) Roscoe) Rimpang laja gowah
Simplisia
Karakterisasi Skrining fitokimia Pembuatan ekstrak
•Makroskopik •Mikroskopik
•Penetapan Kadar Air •Penetapan Kadar Sari
yang Larut Air •Penetapan Kadar Sari
yang Larut Etanol •Penetapan Kadar Abu
Total
•Penetapan Kadar Abu yang Tidak Larut Asam
Senyawa
Fraksi Fraksi Ekstrak
52
dimasukkan ke dalam bejana tertutup
direndam dalam cairan penyari etanol selama 3 jam
dimasukkan massa ke dalam perkolator
ditutup mulut perkolator, dibiarkan selama 24 jam
dibuka kran perkolator, dibiarkan cairan perkolat menetes dengan kecepatan 1 tetes per detik. ditampung ke dalam botol bening dihentikan perkolator apabila 500 mg cairan perkolat terakhir diuapkan di atas penangas air tidak meninggalkan sisa
dipekatkan dengan rotary evaporator
dikeringkan dengan freeze dryer
Lampiran 7. Bagan pembuatan fraksi n-heksana dan fraksi etil asetat rimpang ilaja gowah
Perkolat
53
ditambahkan etanol dan 20 ml iakuades
dihomogenkan
dimasukkan dalam corong pisah diekstraksi dengan 50 ml n- iheksana
dikocok dan didiamkan sampai iterbentuk dua lapisan dan idipisahkan
diekstraksi dengan 50 ml dikumpulkan
etil asetat dipekatkan dengan
rotary evaporator dikocok dan didiamkan
sampai terbentuk dua lapisan dan dipisahkan
dikumpulkan
dipekatkan dengan rotary evaporator
Lampiran 8. Bagan pengujian aktivitas antibakteri
Ekstrak etanol rimpang laja gowah (10 g)
Fraksi n-heksana Fraksi air
Fraksi n-heksana pekat
Fraksi etil asetat Fraksi air
Fraksi etil asetat pekat
54
← diambil dengan jarum ose steril
← ditanam pada media mueller hinton agar miring
← diinkubasi pada suhu 37oC selama 24 jam
← disuspensikan dalam 10 ml media nutrient broth steril
←idiukur kekeruhan suspensi bakteri menggunakan spektrofotometer pada panjang gelombang 580 nm sampai diperoleh nilai transmitan 25%
←idimasukkan 0,1 ml inokulum ke dalam cawan petri
← ditambahkan 15 ml media mueller hinton agar ke dalam cawan petri
← dihomogenkan dan dibiarkan hingga memadat
←idiletakkan pencadang kertas yang telah direndam ke dalam larutan uji ekstrak /fraksi dengan berbagai konsentrasi dan pelarut DMSO sebagai blanko
← diinkubasi pada suhu 37oC selama 18-24 jam
←idiukur diameter daerah hambatan di sekitar pencadang kertas dengan menggunakan jangka sorong
Lampiran 9. Perhitungan penetapan kadar air simplisia rimpang laja gowah Stok kultur bakteri
Inokulum bakteri
Media Padat
Hasil
Kadar air
=
volume II−volume I55 a. Berat sampel = 5,036 g
Volume I = 3,2 ml Volume II = 3,8 ml
Kadar air =3,7−3,2
5,046 x 100% = 9,9088%
b. Berat sampel = 5,014 g Volume I = 3,8 ml Volume II = 4,2 ml Kadar air = 4,2−3,8
5,014 x 100% = 7,9777%
c. Berat sampel = 5,045 g Volume I = 0,6 ml Volume II = 1,0 ml
Kadar air = 1,0−0,6
5,045 x 100% = 7,9286%
Kadar air rata-rata = (9,9088+7,9777+7,9286)% 3
= 8,60%
Lampiran 9. Perhitungan penetapan kadar sari larut dalam air simplisia rimpang laja gowah
Kadarsari = Beratsari Berat sampelx
100
56 a. Berat sampel = 5,0247 g
Berat sari = 0,2992 g
Kadar sari =0,2992 5,0247 x
Kadar sari =0,2981 5,0478 x
Kadar sari =0,2979 5,0032 x
100
20 × 100%
= 29,7709%
Kadar sari larut dalam air rata−rata =(29,7729 + 29,5277 + 29,7709)% 3
= 29,69%
Lampiran 9. Perhitungan penetapan kadar sari larut dalam etanol rimpang laja gowah
Kadar sari = Berat sari Berat sampel x
100
57 a. Berat sampel = 5,0013 g
Berat sari = 0,1888 g
Kadar sari =0,1888 5,0013 x
100
20 × 100%
Kadar sari =18,8751% b. Berat sampel = 5,0123 g
Berat sari = 0,1806 g
Kadar sari =0,1806 5,0123 x
100
20 × 100%
Kadar sari = 18,0157% c. Berat sampel = 5,0034 g
Berat sari = 0,1820 g
Kadar sari = 0,1820 5,0034 x
100
20 × 100%
Kadar sari = 18,1876%
Kadar sari larut dalam etanol rata−rata
=(18,8751 + 18,0157 + 18,1876)% 3
58
Lampiran 9. Perhitungan penetapan kadar abu total simplisia rimpang laja gowah
a. Berat sampel = 2,0160 g Berat abu = 0,0990 g
Kadar abu total =0,0990
2,0160× 100%
= 4,91 % b. Berat sampel = 2,0850 g
Berat abu = 0,1040 g
Kadar abu total =0,1040
2,0850× 100%
= 4,98% c. Berat sampel = 2,0900 g
Berat abu = 0,1050 g
Kadar abu total =0,1050
2,0900× 100%
= 5,02%
Kadar abu total rata−rata = (4,91 + 4,98 + 5,02)% 3
= 4,97%
Kadar abu total = Berat abu
59
Lampiran 9. Perhitungan penetapan kadar abu tidak larut dalam asam simplisia rimpang laja gowah
Sampel I Berat sampel = 2,0160 g Berat abu = 0,0090 g
Kadar abu =0,0090
2,0160× 100%
= 0,44 % Sampel II Berat sampel = 2,0850 g
Berat abu = 0,0080 g
Kadar abu =0,0080
2,0850× 100%
= 0,38% Sampel III Berat sampel = 2,0900 g
Berat abu = 0,0060 g
Kadar abu =0,0060
2,0900× 100%
= 0,28 %
Kadar abu yang tidak larut dalam asam rata−rata
=(0,44% + 0,38% + 0,28)% 3
= 0,36%
Kadar abu yang tidaklarutdalamasam
=
Berat abu60
Lampiran 10. Data hasil uji aktivitas antibakteri ekstrak etanol, fraksi n-heksana, aadan fraksi etil asetat rimpang laja gowah terhadap bakteri aaStaphylococcus aureus
Diameter Daerah Hambatan (mm)
Ekstrak etanol Fraksi n-heksana Fraksi etil asetat D1 D2 D3 D* D1 D2 D3 D* D1 D2 D3 D*
D1 = Diameter daerah hambatan pertumbuhan bakteri pada perlakuan pertama D2 = Diameter daerah hambatan pertumbuhan bakteri pada perlakuan kedua D3 = Diameter daerah hambatan pertumbuhan bakteri pada perlakuan ketiga D* = Diameter rata- rata daerah hambatan pertumbuhan bakteri
61
Lampiran 11. Data hasil uji aktivitas antibakteri ekstrak etanol, fraksi n-heksana, adan fraksi etil asetat rimpang laja gowah terhadap bakteri aEscherichia coli
N
o. Konsent rasi (mg/ml)
Diameter Daerah Hambatan (mm)
Ekstrak etanol Fraksi n-heksana Fraksi etil asetat D1 D2 D3 D* D1 D2 D3 D* D1 D2 D3 D*
D1 = Diameter daerah hambatan pertumbuhan bakteri pada perlakuan pertama D2 = Diameter daerah hambatan pertumbuhan bakteri pada perlakuan kedua D3 = Diameter daerah hambatan pertumbuhan bakteri pada perlakuan ketiga D* = Diameter rata- rata daerah hambatan pertumbuhan bakteri
62
Lampiran 12. Gambar pengujian aktivitas antibakteri ekstrak etanol rimpang laja gowah terhadap bakteri Staphylococcus aureus
Keterangan:
A = Konsentrasi 100 mg/ml B = Konsentrasi 200 mg/ml C = Konsentrasi 300 mg/ml D = Konsentrasi 400 mg/ml E = Konsentrasi 500 mg/ml
C
B A
D
63
Lampiran 12. Gambar hasil uji aktivitas antibakteri ekstrak etanol rimpang laja gowah terhadap bakteri Escherichia coli
Keterangan:
A = Konsentrasi 100 mg/ml B = Konsentrasi 200 mg/ml C = Konsentrasi 300 mg/ml D = Konsentrasi 400 mg/ml E = Konsentrasi 500 mg/ml F = Blanko (DMSO)
B C
A
E
F
64
Lampiran 13. Gambar pengujian aktivitas antibakteri fraksi etil asetat rimpang laja gowah terhadap bakteri Staphylococcus aureus
Keterangan:
A = Konsentrasi 100 mg/ml B = Konsentrasi 200 mg/ml C = Konsentrasi 300 mg/ml D = Konsentrasi 400 mg/ml E = Konsentrasi 500 mg/ml
B
C
A
E
65
Lampiran 13. Gambar hasil uji aktivitas antibakteri fraksi etil asetat rimpang laja gowah terhadap bakteri Escherichia coli
Keterangan:
A = Konsentrasi 100 mg/ml B = Konsentrasi 200 mg/ml C = Konsentrasi 300 mg/ml D = Konsentrasi 400 mg/ml E = Konsentrasi 500 mg/ml F= Blanko (DMSO)
B C
A
D
66
Lampiran 14. Gambar pengujian aktivitas antibakteri fraksi n-heksana rimpang laja gowah terhadap bakteri Staphylococcus aureus
Keterangan:
A = Konsentrasi 100 mg/ml B = Konsentrasi 200 mg/ml C = Konsentrasi 300 mg/ml D = Konsentrasi 400 mg/ml E = Konsentrasi 500 mg/ml F= Blanko (DMSO)
B A
C
D
E
67
Lampiran 14. Gambar pengujian aktivitas antibakteri fraksi n-heksana rimpang laja gowah terhadap bakteri Escherichia coli
Keterangan:
A = Konsentrasi 100 mg/ml B = Konsentrasi 200 mg/ml C = Konsentrasi 300 mg/ml D = Konsentrasi 400 mg/ml E = Konsentrasi 500 mg/ml F= Blanko (DMSO)
D
E F
A
42
c. Hasil uji aktivitas antibakteri rimpang laja gowah menunjukkan aktivitas antibakteri terkuat pada fraksi etil asetat, kemudian ekstrak etanol dan fraksi n-heksana.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk melakukan pengujian aktivitas antijamur ekstrak rimpang laja gowah (Alpinia malaccensis (Burm.f.) Roscoe) terhadap jamur.
DAFTAR PUSTAKA
Adams, M.R dan Moss, M.O. (1995). Food Microbiology. Cambridge: The Royal Society of Chemistry. Halaman 181-182; 203-205.
Anonim. (2010). Laja Gowah(Alpinia malaccensis (Burm.f.)Roxb.). www.abuanjeli.wordpress.com/2010/08/31/a037/, diakses pada 24 Januari 2015.
Aqel, Hazem, Al-Charchafchi, F., Ghazzawi, D. (2012). Biochemical, antibacterial and antifungal activity of extracts from Achillea fragrantissima and evaluation of volatile oil composition. Pelagia Research Library. 3(3): 349-356.
Chanda, S. dan Kaneria M. (2010). Antioxidative and antibacterial effects of seed and fruit rind of nutraceutical plants belonging to the Fabaceae family. Food and Function. 2010a;1: 308-315.
Depkes RI. (1986). Sediaan Galenik. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 19.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Halaman 333-337.
Depkes RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan Pertama. Jakarta. Departemen Kesehatan RI. Halaman 1, 9-10.
Dey, P.M. (2012). Methods in Plant Biochemistry. Volume I. USA: Academic Press. Halaman 81-82.
43
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta : Departemen Kesehatan Republik Indonesia. Halaman 32, 896.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Halaman 891- 898, 1035.
Dwidjoseputro. (1978). Dasar-Dasar Mikrobiologi. Jakarta : Penerbit Djambatan. Halaman 15-17.
Harborne, J. B. (1987). Metode Fitokimia. Edisi kedua. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Bandung: Penerbit ITB. Halaman 6, 49, 240.
Hayek, S. A., Gyawali, R., dan Ibrahim, S. A. (2013). Antimicrobial Natural Products. Dalam: Vilas, A. M. (ed). Microbial Pathogens and Strategies for Combating them: Science, Technology and Education. Formatex. Halaman 911, 915-916.
Hernani dan Endjo, D. (2004). Gulma Berkhasiat Obat. Jakarta: Penebar Swadaya. Halaman 2-3.
Hill, G dan Holman, J. (2000). Chemistry in Context. Edisi kelima. London: Nelson Tholnes Ltd. Halaman 32, 502, 534.
Holt, G.J., Kneg, N.R., Sneath, A.H., Starley, T.J, Witirams, T.S. (1988). 9th edition. Bergey’s Manual Od Determinative Bacteriology. London: Williams & Wilkins Company. Halaman 187.
Jawetz, E., Melnick, J.L., dan Adelberg, E.A. (1996). Mikrobiologi untuk Profesi Kesehatan. Jakarta: Penerbit Buku Kedokteran. Halaman 369.
Killeen, G., Madigan, C., Connolly, C., Walsh, G., Clark, C., Hynes, M., Timmins, B., James, P., Headon, D., Power, R. (1998). J. Agric. Food Chem. 46: 3178
Lay, B.W dan Sugiyo Hastowo. (1994). Analisis Mikroba di Laboratorium. Jakarta : PT. Raja Grafindo Persada. Halaman 34, 72-73.
Marliana, E dan Saleh, C. (2011). Uji Fitokimia dan Aktivitas Antibakteri Ekstrak Kasar Etanol, Fraksi n-Heksana, Etilasetat dan Metanol dari Buah Labu Air (Lagenari siceraria (Molina) Standl. Jurnal Kimia Mulawarman. 8(2): 63-69.
Mursito. (2001). Ramuan Tradisional untuk Kesehatan Anak. Jakarta: Penebar Swadaya. Halaman 2.
44
Odugbemi, T. (2008). A Textbook of Medicinal Plants from Nigeria. Nigeria: University of Lagos Press. Halaman 219-220.
Oxoid. (1982). The Oxoid Manual of Culture Media, Ingredients and Other Laboratory Services. Fifth Edition. Hampshire: Oxoid Limited. Halaman 212, 224.
Pelczar, M. J dan E. C. S. Chan. (1986). Dasar- Dasar Mikrobiologi. Terjemahan: R. S.Hadioetomo, T. Imas, S. S. Tjitrosomo, dan S. L. Angka. Jakarta: Penerbit UI Press. Halaman 132-133.
Prasetyo, D.P dan Sasongko, H. (2014). Aktivitas Antibakteri Ekstrak Etanol 70% Daun Kersen (Muntingia calabura L.) terhadap Bakteri Bacillus subtilis dan Shigella dysenteriae Sebagai Materi Pembelajaran Biologi SMA Kelas Xuntuk Mencapai Kd 3.4 pada Kurikulum 2013. JUPEMASI-PBIO. 1(1): 98-102.
Pratiwi, S. T. (2008). Mikrobiologi Farmasi. Jakarta: Erlangga. Halaman 22, 24-31, 106-108, 174.
Rachmawati, R., Nuria, M.C dan Sumantri. (2011). Uji Aktivitas Antibakteri Fraksi Kloroform Ekstrak Etanol Pegagan (Centella asiatica (L) Urb) Serta Identifikasi Senyawa Aktifnya. Jurnal. Semarang: Fakultas Farmasi Universitas Wahid Hasyim.
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Edisi keenam. Bandung: ITB. Halaman 191-193.
Roslizawaty,R., N.Y., Fakhrurrazi., dan Herrialfian. Aktivitas Antibakterial Ekstrak Etanol dan Rebusan Sarang Semut (Myrmecodia sp.) terhadap Bakteri Escherichia coli. Jurnal Medika Veterinaria. 7(2): 91-94.
Siregar, A.F., Sabdono, A., dan Pringgenies, D. (2012). Potensi Antibakteri Ekstrak Rumput Laut terhadap Bakteri Penyakit Kulit Pseudomonas aeruginosa, Staphylococcus epidermidis dan Micrococcusluteus.Journal Of Marine Research. 1(2): 152-160.
Soebagio. (2005). Kimia Analitik II. Malang: Universitas Negeri Malang (UM-PRESS).
Stefanovic, O., Radojevic, I., Vasic, S., dan Comic, L. (2012). Antibacterial Activity of Naturally Occurring Compounds from Selected Plants. Dalam: Bobbarala, V. (ed). Antimicrobial Agents. Kroasia: InTech. Halaman 2-3. Supardi, I dan Sukamto. (1999). Mikrobiologi dalam Pengolahan dan Keamanan
45
Tim Mikrobiologi FK Brawijaya. (2003). Bakteriologi Medik. Cetakan Pertama. Malang: Bayu Media Publishing.
Tisnadjaja D. (2006). Bebas Kolesterol dan Demam Berdarah. Cibinong: Niaga Swadaya. Halaman 3.
Trease, E. (1983). Pharmacognosy. Edisi kedua belas. London: Aldon Press. Halaman 135-136.
Venn, R.F. (2008). Principles and Practices of Bioanalysis. Edisi kedua. Boca Raton: Taylor and Francis Group. Halaman 23-25.
Volk, W.A. dan Wheeler, M.F. (1993). Mikrobiologi Dasar. Jilid I. Alih Bahasa: Markam. Jakarta: Erlangga. Halaman 33-40; 218-219.
World Health Organization. (1992). Quality Control Methods For Medicinal Plant Material. Switherland: WHO. Halaman 19-25.
19 BAB III
METODE PENELITIAN
Penelitian ini dilakukan dengan menggunakan metode eksperimental parametrik. Uji aktivitas antibakteri dilakukan dengan metode difusi agar menggunakan pencadang kertas. Parameter yang diukur adalah besarnya zona hambat di sekitar pencadang kertas. Tahapan-tahapan penelitian meliputi pengumpulan dan pengolahan sampel, skrining fitokimia, pemeriksaan karakterisasi simplisia, pembuatan ekstrak etanol rimpang laja gowah dengan cara perkolasi kemudian difraksinasi berturut-turut dengan pelarut n-heksana dan etil asetat. Pengujian aktivitas antibakteri dilakukan terhadap bakteri Staphylococcus aureus dan Escherichia coli. Penelitian ini dilakukan di Laboratorium Farmakognosi dan Laboratorium Mikrobiologi Fakultas Farmasi USU Medan pada bulan Oktober 2014-Februari 2015.
3.1 Alat-alat
20 3.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah rimpang laja gowah (Alpinia malaccensis (Burm.f.) Roscoe), air suling, mueller hinton agar, nutrient broth dan bahan-bahan yang berkualitas proanalisa (E. Merck): etanol, dimetilsulfoksida (DMSO), n-heksana, etil asetat, raksa (II) klorida, natrium hidroksida, iodium, bismuth (III) nitrat, kalium iodida, besi (III) klorida, α-naftol, asam nitrat pekat, asam klorida pekat, asam sulfat pekat, timbal (II) asetat, asam asetat anhidrat, isopropanol, kloroform, metanol,natrium klorida, benzena, serbuk magnesium, toluena dan amil alkohol. Bakteri yang digunakan adalah bakteri Staphylococcus aureus ATCC 25923dan Escherichia coli ATCC 25922.
3.3 Pembuatan Larutan Pereaksi dan Media 3.3.1 Pembuatan larutan pereaksi
3.3.1.1 Pereaksi Mayer
Sebanyak 2,266 g raksa (II) klorida dilarutkan dalam air suling hingga 100 ml. Pada wadah lain, 50 g kalium iodida dilarutkan dalam 100 ml air suling, kemudian 60 ml larutan I dicampurkan dengan 10 ml larutan II dan ditambahkan air suling hingga 100 ml (Depkes RI, 1989).
3.3.1.2 Pereaksi natrium hidroksida 2 N
Sebanyak 8,002 g Natrium hidroksida ditimbang, kemudian dilarutkan dalam air suling hingga 100 ml (Ditjen POM, 1979).
21
Sebanyak 4 g Kalium Iodida ditimbang kemudian dilarutkan dalam air suling secukupnya sampai KI larut dengan sempurna, lalu ditambahkan 2 g iodium sedikit demi sedikit. Setelah semuanya larut, dicukupkan dengan air suling hingga volume 100 ml (Depkes RI, 1989).
3.3.1.4 Pereaksi Dragendorff
Sebanyak 8,0 g bismuth (II) nitrat dilarutkan dalam 20 ml asam nitrat dan dilarutkan 27,2 g kalium iodida dalam 50 ml air suling, lalu dicampurkan kedua larutan dan dicukupkan dengan air suling hingga 100 ml (Depkes RI, 1989). 3.3.1.5 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air suling hingga 100 ml, lalu disaring (Ditjen POM, 1979).
3.3.1.6 Pereaksi asam klorida 2 N
Asam klorida pekat sebanyak 16,6 ml ditambahkan air suling sampai 100 ml (Ditjen POM, 1979).
3.3.1.7 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida hingga 100 ml (Depkes RI, 1989).
3.3.1.8 Pereaksi Liebermann-Burchard
Sebanyak 10 tetes asam asetat anhidrat dicampur dengan 1 tetes asam sulfat pekat. Larutan selalu dibuat baru (Depkes RI, 1989).
3.3.1.9 Pereaksi Molisch
22 3.3.1.10 Pereaksi kloralhidrat
Sebanyak 50 g kloralhidrat dilarutkan dalam 20 ml air (Depkes RI, 1995).
3.3.2 Pembuatan media
3.3.2.1 Media mueller hinton agar
Komposisi : Meat infusion 6,0 g/L Casein Hydrolysate 17,5 g/L
Starch 1,5 g/L
Agar No. 1 10 g/L
Cara pembuatan:
Sebanyak 35,0 g mueller hinton agar(MHA) disuspensikan ke dalam air suling sebanyak 1000 ml, lalu dipanaskan sampai bahan larut sempurna dan disterilkan di dalam autoklaf pada suhu 121oC selama 15 menit (Oxoid, 1982). 3.3.2.2 Media nutrient broth
Komposisi : Lab-Lemco Powder 1 g/L Yeast Extract 2 g/L
Peptone 5 g/L
Sodium Chloride 5 g/L Cara pembuatan:
Sebanyak 13 g media nutrient broth (NB) dilarutkan dengan air suling 1000 ml, lalu dipanaskan sampai larut sempurna, kemudian media dimasukkan dalam erlenmeyer steril yang bertutup dan disterilkan dalam autoklaf pada suhu 121oC selama 15 menit (Oxoid, 1982).
23
Sebanyak 3 ml media MHA cair dimasukkan ke dalam tabung reaksi, lalu diletakkan pada sudut kemiringan 30-45o dan dibiarkan memadat, kemudian disimpan di lemari pendingin (Lay, 1994).
3.4 Sterilisasi Alat dan Bahan
Alat dan bahan yang digunakan dalam uji aktivitas antibakteri ini disterilkan lebih dahulu sebelum dipakai. Media pertumbuhan disterilkan di autoklaf pada suhu 121oC selama 15 menit dan alat-alat gelas disterilkan di oven pada suhu 160 – 170oC selama 1 – 2 jam. Jarum ose dan pinset disterilkan dengan cara dibakar dengan nyala bunsen (Lay, 1994).
3.5 Pengumpulan dan Pengolahan Bahan Tumbuhan 3.5.1 Pengumpulan bahan tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa membandingkan tumbuhan yang sama dengan daerah lain. Bahan tumbuhan yang digunakan adalah rimpang laja gowah (Alpinia malaccensis (Burm.f.) Roscoe), diambil dari Namo Rambe, Kelurahan Tangkahan, Kabupaten Deli Serdang, Provinsi Sumatera Utara.
3.5.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense Bidang Botani Pusat Penelitian dan Pengembangan Biologi LIPI Bogor.
3.5.3 Pembuatan simplisia
24
kering apabila sudah rapuh (dapat dipatahkan). Simplisia rimpang laja gowah yang telah kering diserbuk menggunakan blender, kemudian disimpan dalam wadah plastik yang tertutup rapat. Gambar simplisia dapat dilihat pada Lampiran 3, halaman 47 – 48.
3.6 Karakterisasi Simplisia 3.6.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan terhadap serbuk simplisia rimpang laja gowah (Alpinia malaccensis (Burm.f.) Roscoe) dengan mengamati bentuk, bau, rasa dan warna.
3.6.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia rimpang laja gowah (Alpinia malaccensis (Burm.f.) Roscoe). Serbuk simplisia ditaburkan di atas kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati di bawah mikroskop. Selain itu, pemeriksaan mikroskopik juga dilakukan dengan menggunakan aquades (hasil dapat dilihat pada Lampiran 4, halaman 49).
3.6.3 Penetapan kadar air a. Penjenuhan toluen
25
Labu berisi toluen tersebut dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, lalu dipanaskan hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan toluen diatur 2 tetes per detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes per detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,1 ml. Selisih kedua volume air yang dibaca sesuai dengan kadar air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1998).
3.6.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam aquadest sampai 1000 ml) dengan menggunakan botol bersumbat sambil sekali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 – 24 jam dan disaring. Sebanyak 20 ml filtrat pertama diuapkan hingga kering dalam cawan yang berdasar rata yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 105oC sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.6.5 Penetapan kadar sari larut dalam etanol
26
berdasar rata yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 105oC sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.6.6 Penetapan kadar abu total
Sebanyak 2,5 g serbuk simplisia yang telah digerus dan ditimbang seksama, lalu dimasukkan ke dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Kurs porselin bersama isinya dipijarkan perlahan hingga arang habis, lalu dinginkan dan ditimbang sampai diperoleh bobot yang tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.6.7 Penetapan kadar abu yang tidak larut asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dengan 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut asam dikumpulkan, disaring dengan kertas saring, lalu cuci dengan air panas, kemudian residu dan kertas saring dipijarkan sampai diperoleh bobot yang tetap, lalu dinginkan dan ditimbang beratnya. Kadar abu yang tidak larut asam dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.7 Skrining Fitokimia
Skrining Fitokimia dari serbuk simplisia, ekstrak etanol, n-heksana dan etil asetat meliputi pemeriksaan golongan senyawa alkaloida, flavonoida, saponin, tanin, glikosida, glikosida antrakinon dan steroida/triterpenoida.
27
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanasakan di atas penangas air selama 2 menit, lalu didinginkan dan disaring. Filtrat dipakai untuk percobaan sebagai berikut:
a. Filtrat sebayak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer, akan terbentuk endapan menggumpal bewarna putih atau kuning.
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Bouchardat, akan terbentuk endapan berwarna coklat sampai hitam.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Dragendorff, akan terbentuk endapan merah atau jingga.
Alkaloida positif jika terjadi endapan atau kekeruham paling sedikit dua dari tiga percobaan (Depkes RI, 1995).
3.7.2 Pemeriksaan flavonoida
Sebanyak 0,5 g serbuk simplisia ditambahkan 20 ml air panas, lalu dididihkan selama 10 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium, 1 ml asam klorida pekat dan 2 ml amil alkohol, kemudian dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol (Depkes RI, 1995). 3.7.3 Pemeriksaan saponin
28 3.7.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna hijau, biru atau kehitaman menunjukkan adanya tanin (Harborne, 1987).
3.7.5 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia disari dengan 30 ml campuran etanol 95% dengan air suling (7:3) dan 10 ml asam sulfat 2 N, lalu direfluks selama 1 jam, kemudian didinginkan dan disaring. Pada 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0.4 M, lalu dikocok dan didiamkan 5 menit, kemudian disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Kumpulan sari air diuapkan dengan temperatur tidak lebih dari 50oC. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa dipakai untuk percobaan berikut:
a. Larutan sisa dimasukkan ke dalam tabung reaksi selanjutnya diuapkan di atas penangas air, pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi molish, kemudian ditambahkan hati-hati 2 ml asam sulfat pekat melalui dinding tabung sehingga terbentuk cincin ungu pada batas kedua cairan yang menunjukkan adanya glikosida.
29 3.7.6 Pemeriksaan glikosida antrakinon
Sebanyak 0,2 g serbuk simplisia ditambah 5 ml asam sulfat 2 N, kemudian dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzena, lalu dikocok dan didiamkan. Lapisan benzena dipisahkan dan disaring. Lapisan benzena dikocok dengan 2 ml NaOH 2 N, kemudian didiamkan. Lapisan air berwarna merah dan lapisan benzena tidak berwarna menunjukkan adanya glikosida antrakinon (Depkes RI, 1989).
3.7.7 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam, lalu disaring, kemudian filtrat diuapkan dalam cawan penguap dan pada sisanya ditambahkan 10 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi Liebermann – Burchard). Apabila terbentuk warna ungu atau merah yang berubah menjadi biru hijau menunjukkan adanya steroida/triterpenoida (Harborne, 1987).
3.8 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan secara perkolasi menggunakan cairan penyari etanol.
Cara kerja :
30
dengan kecepatan 1 tetes per detik dan ditampung ke dalam botol berwarna bening. Perkolasi dihentikan apabila 500 mg cairan perkolat terakhir diuapkan diatas penangas air tidak meninggalkan sisa. Perkolat dipekatkan dengan bantuan alat penguap rotary evaporator pada suhu tidak lebih dari 40oC sampai diperoleh ekstrak kental kemudian dikeringkan dengan freeze dryer. Bagan pembuatan ekstrak etanol secara perkolasi dapat dilihat di Lampiran 6, halaman 51.
3.9 Pembuatan Fraksi n-Heksana dan Etil Asetat
Pembuatan fraksi-fraksi dilakukan secara ekstraksi cair-cair (ECC) menggunakan pelarut n-heksana dan etil asetat. Sebanyak 10 g ekstrak etanol ditambahkan etanol dan 20 ml air suling, lalu dimasukkan kadalam corong pisah, kemudian ditambahkan 50 ml n-heksana, lalu dikocok dan didiamkan sampai terdapat 2 lapisan yang terpisah. Lapisan n-heksana (lapisan atas) diambil dengan cara dekantasi dan fraksinasi dilakukan sampai warna lapisan n-heksana jernih, kemudian ditambahkan 50 ml etil asetat pada lapisan air, lalu dikocok dan didiamkan sampai terdapat 2 lapisan yang terpisah. Lapisan etil asetat (lapisan atas) diambil dengan cara dekantasi dan fraksinasi dilakukan sampai warna lapisan etil asetat jernih, fraksi air (fraksi sisa) diambil dan semua fraksi yang diperoleh diuapkan sampai diperoleh ekstrak kental. Masing-masing fraksi yang diperoleh dilakukan uji aktivitas antibakteri. Bagan fraksinasi dapat dilihat di Lampiran 7, halaman 52.
31
Ekstrak etanol rimpang laja gowah(Alpinia malaccensis (Burm.f.) Roscoe) ditimbang 1 g kemudian dilarutkan dengan pelarut DMSO hingga 2 ml hingga diperoleh konsentrasi ekstrak 500 mg/ml, kemudian larutan tersebut diencerkan kembali dengan pelarut DMSO sehingga didapat konsentrasi 400 mg/ml; 300 mg/ml, 200 mg/ml; 100 mg/ml. Prosedur yang sama dilakukan dengan fraksi n -heksana dan etil asetat.
3.11 Pembiakan Bakteri
3.11.1 Pembuatan stok kultur bakteri
Satu koloni bakteridiambil dengan menggunakan jarum ose steril, lalu ditanamkan pada media MHAmiring dengan cara menggores, setelah itu diinkubasi dalam inkubator pada suhu 36 ± 1o
C selama 18 – 24 jam. 3.11.2 Penyiapan inokulum bakteri
Kultur bakteri yang telah tumbuh diambil dari stok kultur dengan jarum ose steril lalu disuspensikan dalam tabung yang berisi 10 ml larutan Nutrient Broth, kemudian diukur kekeruhan larutan dengan menggunakan alat spektrofotometer visible pada panjang gelombang 580 nm sampai diperoleh transmitan 25% (Ditjen POM, 1995).
3.12 Uji Aktivitas Antibakteri
32
antibakteri dengan metode difusi cakram kertas dilakukan dengan meletakkan cakram kertas yang telah direndam dalam beberapa konsentrasi larutan uji ekstrak etanol di atas media padat yang telah diinokulasi bakteri, kemudian dibiarkan selama 15 menit, kemudian diinkubasi dalam inkubator pada suhu 36 ± 1o
33 BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian dan Pengembangan LIPI Bogor adalah Alpinia malaccensis (Burm.f.) Roscoe, suku Zingiberaceae (Hasil dapat dilihat pada Lampiran 1, halaman 45).
4.2 Hasil Pemeriksaan Karakterisasi
Hasil pemeriksaan makroskopik simplisia rimpang laja gowah yaitu panjang rimpang 5-20 cm, lebar 4-6 cm, kadang-kadang bercabang, berkas patahan berserat pendek, warna kulit rimpang coklat sedangkan warna daging rimpang coklat keunguan, berbau khas, dan rasa agak tajam. Hasil pemeriksaan mikroskopik serbuk simplisia memperlihatkan adanya epidermis dan jaringan korteks, parenkim, butir pati, minyak atsiri dan berkas pembuluh. Hasil pemeriksaan dapat dilihat pada Lampiran 4, halaman 49.
Hasil pemeriksaan karakterisasi serbuk simplisia rimpang laja gowah dapat dilihat pada Tabel 4.1 (Data selengkapnya dapat dilihat pada Lampiran 10 dan 11, halaman 59 dan 60).
34
No. Parameter Hasil (%)
1. Kadar Air 8,60
2. Kadar Sari Larut Air 29,69
3. Kadar Sari Larut Etanol 18,35
4. Kadar Abu Total 4,97
5. Kadar Abu Tidak Larut Asam 0,36
Penetapan kadar air pada simplisia dilakukan untuk mengetahui jumlah air yang terkandung dalam simplisia yang digunakan. Kadar air simplisia ditetapkan untuk menjaga kualitas simplisia karena kadar air berkaitan dengan kemungkinan pertumbuhan jamur/kapang. Hasil penetapan kadar air diperoleh lebih kecil dari 10% yaitu 8,60%. Kadar air yang melebihi 10% dapat menjadi media yang baik untuk pertumbuhan mikroba, keberadaan jamur atau serangga, serta mendorong kerusakan mutu simplisia (Trease, 1983; WHO, 1992).
Penetapan kadar sari dilakukan menggunakan dua pelarut, yaitu air dan etanol. Penetapan kadar sari larut air adalah untuk mengetahui kadar senyawa kimia bersifat polar yang terkandung di dalam simplisia, sedangkan kadar sari larut dalam etanol dilakukan untuk mengetahui kadar senyawa larut dalam etanol, baik senyawa polar maupun non polar.
35
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral internal (abu fisiologis) yang berasal dari jaringan tanaman itu sendiri yang terdapat di dalam sampel (Ditjen POM, 2000; WHO, 1992). Kadar abu tidak larut asam untuk menunjukkan jumlah silikat, khususnya pasir yang ada pada simplisia dengan cara melarutkan abu total dalam asam klorida (WHO, 1992). Penetapan kadar abu pada simplisia rimpang laja gowah menunjukkan kadar abu total sebesar 4,97% dan kadar abu tidak larut dalam asam sebesar 0,36%.
Monografi simplisia rimpang laja gowah tidak terdaftar di buku Materia Medika Indonesia (MMI), sehingga perlu dilakukan pembakuan secara nasional mengenai parameter karakterisasi simplisia rimpang laja gowah. Hasil perhitungan karakterisasi simplisia rimpang laja gowah meliputi penetapan kadar air, kadar sari larut air, kadar sari larut etanol, kadar abu dan kadar abu tidak larut asam dapat dilihat pada Lampiran 9, halaman 54-58.
4.3. Hasil Ekstraksi dan Fraksinasi
Hasil ekstraksi 350 g simplisia rimpang laja gowah dengan cara perkolasi menggunakan pelarut etanol 96% diperoleh ekstrak etanol rimpang laja gowah sebanyak 38,20 g, kemudian dilakukan ekstraksi cair-cair menggunakan pelarut n -heksana dan air, dari 20 g ekstrak diperoleh fraksi n-heksana 2,12 g, selanjutnya fraksi air di fraksinasi dengan etil asetat sehingga diperoleh fraksi etil asetat 3,41 g. Ekstrak etanol, fraksi n-heksana dan etil asetat yang diperoleh dilakukan skrining fitokimia dan kemudian diuji aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Escherichia coli.
36
Penentuan golongan senyawa kimia simplisia, ekstrak etanol, fraksi n -heksana dan fraksi etil asetat dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang terdapat di dalamnya. Adapun pemeriksaan yang dilakukan adalah pemeriksaan golongan senyawa alkaloid, glikosida, steroid/triterpenoid, flavonoid, tanin dan saponin. Hasil skrining fitokimia serbuk simplisia, ekstrak etanol, fraksi n-heksana dan etil asetat rimpang laja gowah dapat dilihat pada Tabel 4.2.
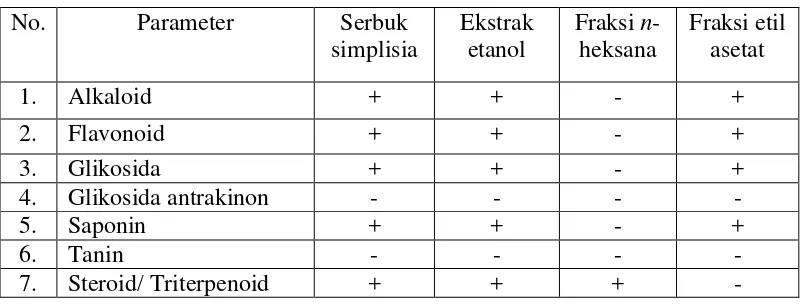
Tabel 4.2 Hasil skrining fitokimia Serbuk simplisia, ekstrak dan fraksi rimpang laja gowah
(+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
Hasil skrining serbuk simplisia dan ekstrak etanol menunjukkan hasil postitif pada senyawa polar, semipolar dan non polar yaitu alkaloid, flavonoid, glikosida, saponin dan steroid/triterpenoid. Fraksi n-heksana hanya mengandung senyawa nonpolar yaitu steroid/triterpenoid dan fraksi etil asetat mengandung senyawa polar dan semipolar seperti alkaloid, flavonoid, glikosida dan saponin.
37
Hasil uji aktivitas antibakteri EERLG, FHRLG dan FERLG dapat menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli. Aktivitas suatu zat antimikroba dalam menghambat pertumbuhan atau membunuh mikroorganisme tergantung pada konsentrasi dan jenis bahan antimikroba tersebut (Tim Mikrobiologi FK Brawijaya, 2003).
Tabel 4.3 Data hasil pengukuran diameter rata-rata daerah hambatan pertumbuhan bakteri Staphylococcus aureus
No. Konsentrasi (mg/ml)
Diameter Daerah Hambatan (mm)* Ekstrak
Tabel 4.4 Hasil pengukuran diameter rata-rata daerah hambatan pertumbuhan bakteri Escherichia coli
No. Konsentrasi (mg/ml)
Diameter Daerah Hambatan (mm)* Ekstrak etanol Fraksi
n-heksana
38
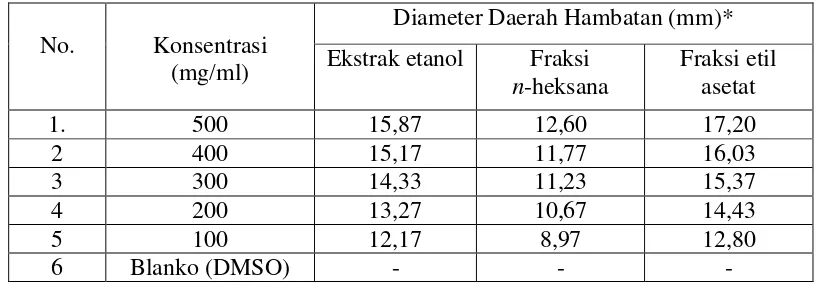
Menurut Ditjen POM (1995), persyaratan batas daerah hambatan yang efektif lebih kurang 14-16 mm. Hasil pengukuran dapat dilhat pada Lampiran 10 dan 11, halaman 59 dan 60.
Hasil pengukuran diameter daerah hambatan memperlihatkan bahwa FERLG memberikan aktivitas antibakteri yang efektif dalam menghambat pertumbuhan Staphylococcus aureus pada konsentrasi 200 mg/ml dengan diameter daerah hambat 14,50 mmsedangkan padaEscherichia coli memberikan aktivitas antibakteri yang efektif pada konsentrasi 200 mg/ml dengan diameter daerah hambat 14,43 mm.
Hasil uji aktivitas antibakteri EERLG yang efektif terhadap bakteri Staphylococcus aureus pada konsentrasi 300 mg/ml memberikan diameter daerah hambat 14,57 mm,sedangkan terhadapbakteri Escherichia coli memberikan aktivitas antibakteri pada konsentrasi 300 mg/ml dengan diameter daerah hambat 14,33 mm.
Hasil pengukuran diameter daerah hambatan FHRLG menunjukkan aktivitas antibakteri yang terlemah dan tidak efektif dalam menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli.
39
Flavonoid merupakan kelompok senyawa fenol yang mempunyai kecenderungan untuk mengikat protein, sehingga menganggu proses metabolisme bakteri, selain itu flavonoid juga berfungsi sebagai antibakteri dengan cara membentuk senyawa kompleks terhadap protein ekstraseluler yang mengganggu integritas membran sel bakteri. Polifenol pada kadar tinggi dapat menyebabkan koagulasi protein dan menyebabkan sel membran mengalami lisis (Prasetyo et al., 2014).
Saponin digunakan sebagai antimikroba pada beberapa tahun terakhir. Mekanisme kerja saponin sebagai antibakteri adalah menurunkan tegangan permukaan sehingga mengakibatkan naiknya permeabilitas atau kebocoran sel dan mengakibatkan senyawa intraseluler akan keluar (Robinson, 1991).Menurut Killeen et. al., (1998), mekanisme saponin sebagai antibakteri lebih karena adanya efek membranolitik daripada mengubah tegangan permukaan media ekstraseluler. Mekanisme terpenoid sebagai antibakteri adalah bereaksi dengan porin (protein transmembran) pada membran luar dinding sel bakteri, membentuk ikatan polimer yang kuat sehingga mengakibatkan rusaknya porin (Cowan, 1999). Alkaloid memiliki kemampuan sebagai antibakteri. Mekanisme kerja antibakteri senyawa alkaloid dihubungkan dengan kemampuan untuk menyisip pada DNA, penghambatan enzim (esterase, DNA-polimerase, RNA-polimerase) dan penghambatan respirasi sel (Stefanovic, dkk., 2012).
40
yang dihasilkan lebih kecil daripada fraksi etil asetat. Menurut Marliana (2011), hal ini mungkin disebabkan karena adanya kerja yang tidak sinergis antara senyawa metabolit sekunder dalam ekstrak etanol dalam peranannya sebagai antibakteri.
Uji aktivitas antibakteri FHRLG menunjukkan aktivitas antibakteri yang terlemah bila dibandingkan dengan ekstrak etanol dan fraksi etil asetat. Hal ini disebabkan fraksi n-heksana memiliki senyawa metabolit sekunder yang lebih sedikit dibandingkan dengan fraksi etil asetat dan ekstrak etanol. Fraksi n-heksana hanya mengandung senyawa triterpen/steroid yang berperan sebagai antibakteri.
41 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil penelitian yang dilakukan terhadap rimpang laja gowah (Alpinia malaccensis (Burm.f.) Roscoe) diperoleh kesimpulan:
a. Hasil karakterisasi simplisia yaitu bentuk memanjang kadang bercabang, bekas patahan berserat, warna kulit coklat, warna daging coklat keunguan, bau khas dan rasa agak tajam, pemeriksaan mikroskopik menunjukkan adanya minyak atsiri, epidermis, berkas pembuluh dan pati, serta diperoleh kadar air 8,60%, kadar sari larut air 29,69%, kadar sari larut etanol 18,35%, kadar abu total 4,97% dan kadar abu tidak larut dalam asam 0,36%.
4 BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Sistematika tumbuhan
Tumbuhan laja gowah (Burm.f.) Roscoe)
diklasifikasikan sebagai berikut:
Kingdom
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Monocotyledonae Bangsa : Zingiberales Suku : Zingiberaceae
Marga
Jenis (Burm.f.) Roscoe(Anonim, 2010).
2.1.2 Sinonim tumbuhan
Sinonim: Alpinia malaccensis (Burm.f.) Roxb; Galanga malaccensis Rumph; Catimbium malaccensis L. (Anonim, 2010).
2.1.3 Nama daerah
5 2.1.4 Morfologi tumbuhan
Tumbuhan laja gowah merupakan herba tahunan, berdiri tegak, tinggi 1-4 m dan tumbuh dalam rumpun yang rapat. Batangnya merupakan batang semu, terdiri kumpulan pelepah daun yang menyatu. Daun laja gowah merupakan daun tunggal berwarna hijau, berbentuk lanset, panjang 40-80 cm dan lebar 9-12 cm, tepi daun rata, pangkal tumpul, ujungnya runcing dan pertulangan menyirip. Permukaan daun bagian atas licin, tetapi permukaan bawahnya berbulu. Tangkai daun pendek, berpelepah panjang, beralur dan berwarna hijau muda. Bunga majemuk berwarna putih, tersusun dalam tandan yang muncul dari ujung batang (Anonim, 2010).
2.1.5 Kandungan kimia
Tumbuhan laja gowahmengandung minyak atsiri, saponin dan flavonoid(Anonim, 2010).
2.1.6 Manfaat tumbuhan laja gowah
Rimpang laja gowah digunakan oleh masyarakat Ambon sebagai obat bisul dan luka, untuk memelihara tenggorokan, mengobati sakit perut dan untuk obat kuat. Laja gowah juga sering dimanfaatkan sebagai sabun dan anti emetikum (mencegah muntah), kulit buahnya dapat digunakan untukmewangikan rambut dan cucian (Anonim, 2010).
2.2 Ekstraksi
6
senyawa aktif dari simplisia menggunakan pelarut yang sesuai. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain. Pemilihan pelarut dan cara ekstraksi yang tepat akan lebih mudah apabila senyawa aktif yang dikandung simplisia diketahu.Pelarut yang digunakan yaitu air, etanol dan campuran air - etanol (Depkes RI, 2000).
Menurut Departemen Kesehatan RI (2000), beberapa metode ekstraksi dengan menggunakan pelarut yaitu:
a. Cara dingin
- Maserasiadalah proses penyarian simplisia dengan cara perendaman menggunakan pelarut dengan sesekali pengadukan pada suhu kamar. Maserasi yang dilakukan dengan pengadukan secara terus menerus disebut dengan maserasi kinetik, sedangkan yang dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi.
- Perkolasiadalah proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus menerus sampai diperoleh perkolat.
b. Cara panas
7
- Digestiadalah proses penyarian dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50oC.
- Sokletasiadalah proses penyarian dengan menggunakan pelarut yang selalu baru, dilakukan menggunakan alat soklet sehingga terjadi ekstraksi kontinu dengan pelarut relatif konstan dengan adanya pendingin balik.
- Infudansiadalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 15 menit.
- Dekoktasiadalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 30 menit.
2.3 Fraksinasi
Fraksinasi adalah suatu metode pemisahan senyawa organik berdasarkan kelarutan senyawa-senyawa tersebut dalam dua pelarut yang tidak saling bercampur, biasanya antara pelarut air dan pelarut organik (Soebagio, 2005).
Teknik pemisahan ekstraksi cair-cair ini biasanya dilakukan dengan menggunakan corong pisah (separatory funnel). Kedua pelarut yang saling tidak bercampur tersebut dimasukkan ke dalam corong pisah, kemudian digojok dan didiamkan. Solut atau senyawa organik akan terdistribusi ke dalam fasenya masing-masing bergantung pada kelarutannya terhadap fase tersebut dan kemudian akan terbentuk dua lapisan, yaitu lapisan atas dan lapisan bawah yang dapat dipisahkan dengan membuka kunci pipa corong pisah (Odugbemi, 2008).
8
Pemilihan pelarut pada ekstraksi umumnya bergantung pada sifat analitnya dimana pelarut dan analit harus memiliki sifat yang sama, contohnya analit yang sifat lipofilitasnya tinggi akan terekstraksi pada pelarut yang relatif nonpolar seperti n-heksana sedangkan analit yang semipolar terlarut pada pelarut yang semipolar seperti etilasetat atau diklorometana (Venn, 2008).
Aglikon umumnya terekstraksi pada fraksi nonpolar seperti terpenoid dan steroid sedangkan flavonoid, glikosida, saponin dan gula ester ditemukan pada fraksi yang lebih polar dan fraksi air. Petroleum eter dan n-heksana juga dapat digunakan untuk menghilangkan lipid, wax dan senyawa lemak (Dey, 2012).
Pelarut yang dapat digunakan untuk ekstraksi ada banyak, namun beberapatidak dapat digunakan karena tidak memenuhi syarat. Pertama, pelarut harus tidak bercampur dengan air, mempunyai titik didih yang rendah (jika digunakan untuk evaporasi) dan sebaiknya memiliki densitas yang lebih rendah daripada air (untuk membentuk lapisan atas sehingga pemisahan lebih mudah dilakukan). Kedua, pelarut harus aman dan tidak merusak lingkungan jika digunakan. Banyak pelarut yang tidak aman digunakan karena berbagai alasan seperti dietil eter (mudah terbakar), toluen (memiliki titik didih yang tinggi), benzen (keamanan) dan pelarut klorida seperti diklorometana (berbahaya bagi lingkungan). Praktisnya, hanya ada beberapa pelarut saja yang biasa digunakan untuk ekstraksi seperti n-heksana, metil tertier butil eter (MTBE) dan etilasetat (Venn, 2008).
9
bersifat nonpolar. Berbeda dengan etanol, etilasetat (CH3COOCH2CH3) tidak memiliki gugus –OH sehingga menyebabkan etilasetat bersifat kurang polar karena tidak dapat membentuk ikatan hidrogen. n-Heksana (C6H14) merupakan golongan alkana dan termasuk ke dalam pelarut nonpolar. Adanya ikatan antara C-H menyebabkan n-heksana bersifat nonpolar. Karbon dan hidrogen memiliki elektronegativitas yang sangat dekat, sehingga pasangan elektron pada ikatan kovalen antara karbon dan hidrogen saling berbagi sehingga menyebabkan polaritas antara ikatan C-H sedikit. Pasangan elektron antara ikatan C-C pada n -heksana juga saling berbagi sehingga ikatan ini juga nonpolar (Hill, 2000).
2.4 Bakteri
2.4.1 Uraian umum
Nama bakteri berasal dari kata “bakterion” dari bahasa Yunani yang berarti tongkat atau batang. Nama tersebut belakangan dipakai untuk menyebut sekelompok mikroorganisme yang bersel satu, berbiak dengan pembelahan diri, serta demikian kecilnya sehingga hanya tampak dengan mikroskop (Dwidjoseputro, 1978).
Pertumbuhan dan perkembangan bakteri dipengaruhi oleh: a. Zat makanan (nutrisi)
Sumber zat makanan bagi bakteri diperoleh dari senyawa karbon, nitrogen, sulfur, fosfor, unsur logam (natrium, kalsium, magnesium, mangan, besi, tembaga dan kobalt), vitamin dan air untuk fungsi metabolik dan pertumbuhannya.
10
Bakteri umumnya tumbuh optimum padapH antara 6,5-7,5. Namun, beberapa spesies dapat tumbuh dalam keadaan sangat asam atau basa.
c. Temperatur
Proses pertumbuhan bakteri tergantung pada reaksi kimiawi dan laju reaksi kimia yang dipengaruhi oleh temperatur. Berdasarkan hal tersebut, maka bakteri dapat diklasifikasikan sebagai berikut:
- Bakteri psikofil, yaitu bakteri yang dapat hidup pada temperatur 0-30oC, dengan temperatur optimum adalah 10-20oC.Contoh: Pseudomonas.
- Bakteri mesofil, yaitu bakteri yang dapat hidup pada temperatur 5-60oC, temperatur optimum adalah 25-40oC. Contoh: Staphylococcus.
- Bakteri termofil, yaitu bakteri yang dapat hidup pada temperatur optimum adalah 55-65oC. Contoh: Thermus aquaticus.
d. Oksigen
Berdasarkan keterbutuhan bakteri terhadap oksigen dalam pertumbuhannya, bakteri dibedakan sebagai berikut:
- Aerobik, yaitu bakteri yang membutuhkan oksigen dalam pertumbuhannya. Contoh: Pseudomonas aeruginosa.
- Anaerobik, yaitu bakteri yang dapat tumbuh tanpa oksigen. Contoh: Prevotella melaninigenica.
- Anaerobik fakultatif, yaitu bakteri yang dapat tumbuh dengan oksigen ataupun tanpa oksigen. Contoh: Escherichia coli.
- Mikroaerofilik, yaitu bakteri yang dapat tumbuh baik dengan adanya sedikit oksigen. Contoh: Borrelia burgdorferi.
11
Medium yang baik bagi pertumbuhan bakteri adalah medium isotonis terhadap isi sel bakteri.
f. Kelembapan
Secara umum bakteri tumbuh dan berkembang biak dengan baik pada lingkungan yang lembap. Kebutuhan akan air tergantung dari jenis bakterinya (Pelczar,et al.,1988).
2.4.2 Staphylococcus aureus
Staphylococcus aureus termasuk dalam suku Micrococcaceae. Staphylococcus aureus berasal dari kata “Staphele” yang berarti kumpulan dari anggur, dan kata “aureus” dalam bahasa Latin yang berarti emas. Staphylococcus aureus adalah bakteri gram positif, berbentuk bulat (kokus) dengan diameter
sekitar 1 μm, tidak membentuk spora dan termasuk anaerob fakultatif.
Staphylococcus aureus adalah bakteri mesofil dengan suhu pertumbuhan yaitu antara 7-48oC dengan suhu optimum 37oC dan tumbuh secara optimum pada pH 6-7 (Adams dan Moss, 1995).
Adapun sistematika dari bakteri Staphylococcus aureus yaitu: Divisi : Schizophyta
Kelas : Schizomycetes Ordo : Eubacteriales Suku : Micrococcaceae Genus : Staphylococcus
Spesies : Staphylococcus aureus(Holt, et al., 1988).
12
tenggorokan dan dapat pula dikeluarkan pada waktu batuk atau bersin. Bakteri ini dapat menyebabkan berbagai macam infeksi seperti intoksikasi, jerawat, bisul, meningitis, osteomielitis, pneumonia dan mastitis pada manusia dan hewan (Supardi dan Sukamto, 1999).
Keracunan makanan oleh Staphylococcus aureus dapat menimbulkan berbagai gejala setelah 2-4 jam. Gejala-gejala tersebut yaitu meliputi muntah, diare, mual, kejang dan timbul perasaan letih (Adams dan Moss, 1995).
2.4.3 Escherichia coli
Bakteri Escherichia coli umumnya merupakan flora normal saluran pencernaan tubuh manusia dan hewan. Escherichia coli merupakan bakteri gram negatif berbentuk batang, tidak berkapsul, umumnya mempunyai fimbria dan bersifat motile. Sel Escherichia coli mempunyai ukuran panjang 2,0-6,0 μm dan lebar 1,1-1,5 μm, tersusun tunggal, berpasangan, dengan flagella peritikus (Supardi dan Sukamto, 1999).
Adapun sistematika dari bakteri Escherichia coli adalah sebagai berikut: Divisi : Schizophyta
Kelas : Schizomycetes Ordo :Eubacteriales Suku : Enterobacteriaceae Genus : Escherichia
Spesies : Escherichia coli(Holt, et al., 1988).
13
pasteurisasi makanan atau selama pemasakan makanan (Supardi dan Sukamto, 1999).
Strain Escherichia coli yang memproduksi enterotoksin melepaskan toksin yang menyebabkan sekresi elektrolit dan cairan ke saluran pencernaan yang berlebihan. Hal ini dapat menyebabkan gejala diare yang bervariasi yaitu dari ringan sampai berat (Supardi dan Sukamto, 1999).
2.5Morfologi Bakteri
Berdasarkan morfologinya bakteri dapat dibedakan atas tiga bagian yaitu: a. Bentuk basil
Basil adalah bakteri yang mempunyai bentuk batang atau silinder, membelah dalam satu bidang, berpasangan ataupun bentuk rantai pendek atau panjang.
Bakteri bentuk basil dapat dibedakan atas:
- Monobasil yaitu basil yang terlepas satu sama lain dengan kedua ujung tumpul.
- Diplobasil yaitu basil yang bergandeng dua dan kedua ujungnya tumpul.
- Streptobasil yaitu basil yang bergandengan panjang dengan kedua ujung tajam.
Contoh bakteri dengan bentuk basil adalahEschericia coli, Bacillus anthracis, Salmonella typhimurium dan Shigella dysentriae.
b. Bentuk kokus
14
Bakteri bentuk kokus dapat dibedakan atas: - Diplokokus yaitu kokus yang bergandeng dua. - Tetrakokus yaitu kokus yang mengelompok empat.
- Stafilokokus yaitu kokus yang mengelompok dan membentuk anggur. - Streptokokus yaitu kokus yang bergandengan panjang menyerupai rantai. - Sarsina yaitu kokus yang mengelompok seperti kubus.
Contoh bakteri dengan bentuk kokus adalahStaphylococcus aureus, Sarcina luten, Diplococcus pneumonia dan Streptococcus lactis.
c. Bentuk spiral
Bakteri bentuk spiral dapat dibedakan atas: - Spiral yaitu menyerupai spiral atau lilitan.
- Vibrio yaitu bentuk batang yang melengkung berupa koma.
- Spirochaeta yaitu menyerupai bentuk spiral, bedanya dengan spiral dalam kemampuannya melenturkan dan melengkukkan tubuhnya sambil bergerak.
Contoh bakteri dengan bentuk spiral adalahVibrio cholera dan Spirochaeta palida (Volk dan Wheeler, 1989).
2.6 Fase Pertumbuhan Mikroorganisme
Ada empat macam fase pertumbuhan mikroorganisme, yaitu: a. Fase lag
15
mikroorganisme diambil dari kultur yang sama sekali berlainan, maka yang sering terjadi adalah mikroorganisme tersebut tidak mampu tumbuh dalam kultur.
b. Fase log (fase esksponensial)
Fase ini merupakan fase dimana mikroorganisme tumbuh dan membelah pada kecepatan maksimum, tergantung pada genetika mikroorganisme, sifat media, dan kondisi pertumbuhan. Sel baru terbentuk dengan laju konstan dan massa yang bertambah secara eksponensial. Hal yang dapat menghambat laju pertumbuhan adalah bila satu atau lebih nutrisi dalam kultur habis, sehingga hasil metabolisme yang bersifat racun akan tertimbun dan menghambat pertumbuhan. c. Fase stationer
Fase ini merupakan fase dimana pertumbuhan mikroorganisme terhenti dan terjadi keseimbangan antara jumlah sel yang membelah dengan jumlah sel yang mati. Terdapat kehilangan sel yang lambat karena kematian diimbangi oleh pembentukan sel-sel baru melalui pertumbuhan dan pembelahan dengan nutrisi yang dilepaskan oleh sel-sel yang mati karena mengalami lisis.
d. Fase kematian
Fase ini merupakan fase dimana jumlah sel yang mati meningkat. Faktor penyebabnya adalah ketidaktersediaan nutrisi dan akumulasi produk buangan yang toksik (Pratiwi, 2008).
2.7 Pengukuran Aktivitas Antibakteri
Penentuan kepekaan bakteri patogen terhadap agen antibakteri tertentu dapat dilakukan dengan salah satu dari dua metode pokok, yaitu:
16
Metode ini digunakan untuk mengukur kadar hambat minimum (KHM) dan kadar bunuh minimum (KBM). Cara yang dilakukan yaitu dengan membuat seri pengenceran agen antimikroba pada media yang telah ditambahkan dengan mikroba uji. Larutan uji agen antimikroba pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan mikroba uji ditetapkan sebagai KHM. Larutan yang ditetapkan sebagai KHM tersebut selanjutnya dikultur ulang pada media tanpa penambahan mikroba uji ataupun agen antimikroba dan diinkubasi selama 18–24 jam. Media yang tetap terlihat jernih setelah diinkubasi ditetapkan sebagai KBM (Pratiwi, 2008).
b. Metode difusi agar
Metode yang paling sering digunakan yaitu metode difusi agar. Obat dengan jumlah tertentu ditempatkan pada permukaan media padat yang sebelumnya telah diinokulasi bakteri uji pada permukaannya dan kemudian diinkubasi. Diameter zona hambatan sekitar pencadang digunakan untuk mengukur kekuatan hambatan obat terhadap organisme uji. Metode ini dipengaruhi oleh beberapa faktor fisika dan kimia, misalnya sifat medium, kemampuan difusi,ukuran molekular dan stabilitas obat (Jawetz,et al., 2001).
2.8 Tumbuhan sebagai Sumber Senyawa Antibakteri
17
sebagai antibakteri (Tisnadjaja, 2006). Aktivitas antibakteri dari tumbuhan dapat dipengaruhi oleh tempat tumbuh, waktu panen, umur tumbuhan, metode ekstraksi,
struktur dan gugus fungsi komponen aktif serta konsentrasinya (Hayek, dkk., 2013).
Metabolit sekunder berkhasiat sebagai antibakteri diklasifikasikan menjadi tiga kelompok yaitu fenol, terpen dan alkaloid. Senyawa fenol dan polifenol merupakan kelompok metabolit sekunder terbesar, mempunyai gugus hidroksil yang melekat pada gugus fenol aromatik. Fenol, kuinon, flavon, flavonoid, flavonol, tanin dan kumarin termasuk dalam kelompok ini. Letak dan jumlah gugus hidroksil pada gugus fenol diperkirakan berhubungan dengan toksisitas terhadap mikroorganisme (Stefanovic, dkk., 2012). Mekanisme kerja senyawa fenol belum jelas tetapi kemampuan senyawa ini merubah permeabilitas sel bakteri, sehingga menyebabkan kehilangan makromolekul dari dalam sel, dapat membantu menjelaskan aktivitas antibakterinya. Penjelasan lain bahwa senyawa ini mengganggu fungsi membran dan mempengaruhi protein membran, menyebabkan perubahan struktur dan fungsi. Kombinasi senyawa fenol dapat memberikan efek sinergis dan dapat menambah reaksi antibakteri lebih baik dibandingkan dengan senyawa tunggal. Senyawa fenol pada konsentrasi rendah mempengaruhi aktivitas enzim, sedangkan pada konsentrasi tinggi menyebabkan denaturasi protein (Hayek, dkk., 2013).
Terpen merupakan senyawa organik yang tersebar luas dan sangat bervariasi. Mekanisme kerja antibakteri senyawa terpen belum dipahami sepenuhnya tetapi diduga mengganggu pembentukan membran oleh senyawa lipofilik (Stefanovic, dkk., 2012).
18
1 BAB I PENDAHULUAN
I.1 Latar Belakang
Indonesia merupakan salah satu negara penghasil tanaman obat yang potensial dengan keanekaragaman hayati yang dimilikinya. Keanekaragaman hayati Indonesia menempati urutan ketiga terbesar di dunia setelah Brazil dan Zaire (Hernani, 2004).
Penggunaan obat tradisional semakin disukai dari pada obat kimia, hal ini disebabkan oleh karena mahalnya obat-obatan kimia, serta efek samping yang relatif tinggi membuat masyarakat beralih ke pengobatan herbal dan back to nature. Penggunaan tumbuhan di masyarakat terutama untuk mencegah penyakit, menjaga kesegaran tubuh maupun mengobati penyakit (Mursito, 2001).
Tanaman obat yang dapat dimanfaatkan untuk pengobatan adalah laja gowah. Rimpang laja gowah telah digunakan di Ambon untuk memelihara tenggorokan agar suara tetap bagus, mengobati sakit perut, bisul dan luka serta obat kuat (Anonim,2015). Tanaman laja gowah (Alpinia malaccensis (Burm.f.) Roscoe) untuk mengobati sakit perut oleh masyarakat Namo Rambe, Kabupaten Deli Serdang, Provinsi Sumatera Utara dilakukan dengan cara ± 10 gram rimpang segar Alpinia malaccensis dicuci, lalu diparut, kemudian ditambahkan air matang ½ gelas dan disaring. Hasil saringan diminum sekaligus (Anonim, 2015).
2
Berdasarkan uraian di atas, maka perlu dilakukan uji aktivitas antibakteri ekstrak rimpang laja gowah yang diekstraksi secara perkolasi dengan menggunakan pelarut etanol 96% terhadap bakteri Staphylococcus aureus dan Escherichia coli. Penelitian ini meliputi pengumpulan dan pengolahan sampel, skrining fitokimia, pemeriksaan karakteristik simplisia, pembuatan ekstrak etanol rimpang laja gowah dengan cara perkolasi kemudian difraksinasi berturut-turut dengan pelarut n-heksana dan etil asetat, serta uji aktivitas antibakteri dari ekstrak etanol, fraksi n-heksana dan etil asetat terhadap bakteri Staphylococcus aureus dan Escherichia coli.
I.2 Perumusan Masalah
Berdasarkan uraian di atas, maka permasalahan dalam penelitian ini adalah:
a. Apakah simplisia rimpang laja gowah memenuhi persyaratan mutu simplisia. b. Apa saja golongan senyawa metabolit sekunder yang terdapat pada serbuk
simplisia, ekstrak etanol dan fraksi n-heksana serta etil asetat rimpang laja gowah.
c. Apakah ekstrak etanol, fraksi n-heksana dan etil asetat rimpang laja gowah mempunyai aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Escherichia coli.
1.3 Hipotesis
3
a. Simplisia rimpang laja gowah memenuhi persyaratan mutu simplisia.
b. Serbuk simplisia, ekstrak etanol dan fraksi n-heksana serta etil asetatrimpang laja gowahmengandung senyawa alkaloid, flavonoid, glikosida, saponin dan steroida/triterpenoida.
c. Ekstrak etanol, fraksi n-heksana dan etil asetat rimpang laja gowah mempunyai aktivitas antibakteri terhadap Staphylococcus aureus dan Escherichia coli.
1.4 Tujuan Penelitian
Penelitian ini bertujuan untuk:
a. Mengetahui simplisia rimpang laja gowah yang digunakan memenuhi persyaratan mutu simplisia.
b. Mengetahui golongan senyawa kimia apa saja yang terdapat pada simplisia, ekstrak etanol dan fraksi n-heksana serta etil asetat rimpang laja gowah.
c. Mengetahui aktivitas antibakteri ekstrak etanol, fraksi n-heksana dan etil asetat rimpang laja gowah terhadap bakteri Staphylococcus aureus dan Escherichia coli.
1.5 Manfaat Penelitian
vi
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAN FRAKSI n-HEKSANA SERTA ETIL ASETAT
RIMPANG LAJA GOWAH (Alpinia malaccensis (Burm.f.) Roscoe) TERHADAP Staphylococcus aureus DAN Escherichia coli
ABSTRAK
Indonesia merupakan Negara yang kaya akan sumber tanaman obat yang secara turun temurun telah digunakan sebagai ramuan obat tradisional. Laja gowah merupakan salah satu tanaman obat yang dapat dimanfaatkan untuk mengobati sakit perut, infeksi kulit dan infeksi tenggorokan. Tujuan dari penelitian ini adalah untuk mengetahui karakteristik simplisia, golongan senyawa dan aktivitas antibakteri ekstrak etanol, fraksi n-heksana, dan fraksi etilasetat rimpang laja gowah terhadap Staphylococcus aureus dan Escherichia coli.
Serbuk simplisia dikarakterisasi dan diskrining fitokimia kemudian diekstraksi secara perkolasi menggunakan pelarut etanol 96%, kemudian ekstrak etanol difraksinasi dengan cara ekstraksi cair-cair menggunakan pelarut n-heksana dan dilanjutkan dengan pelarut etil asetat. Selanjutnya dilakukan uji aktivitas antibakteri ekstrak rimpang laja gowah terhadap Staphylococcus aureus dan Escherichia coli secara in vitro dengan metode difusi agar menggunakan cakram kertas.
Hasil karakterisasi simplisia diperoleh kadar air 8,60%, kadar sari larut air 29,69%, kadar sari larut etanol 18,35%, kadar abu total 4,97% dan kadar abu tidak larut dalam asam 0,36%. Skrining fitokimia simplisia dan ekstrak etanol menunjukkan adanya golongan senyawa alkaloid, flavonoid, glikosida, steroid/triterpenoid dan saponin, fraksi n-heksana menunjukkan adanya steroid/triterpenoid dan pada fraksi etil asetat menunjukkan adanya alkaloid, flavonoid, glikosida dan saponin. Hasil uji aktivitas antibakteri menunjukkan bahwa fraksi etil asetat memiliki efektivitas terbesar sebagai antibakteri yaitu konsentrasi 200 mg/ml terhadapStaphylococcus aureus dan Escherichia colidengan diameter daerah hambat 14,50 mmdan 14,43 mm. Ekstrak etanol memberikan aktivitas antibakteri yang efektif pada konsentrasi 300 mg/ml terhadapStaphylococcus aureus dan Escherichia colidengan diameter daerah hambat 14,57 mmdan 14,33 mm. Fraksi n-heksana ekstrak etanol rimpang laja gowah tidak memiliki efektivitas sebagai antimikroba terhadap Staphylococcus aureus dan Escherichia coli.
vii
ANTIBACTERIAL ACTIVITY TEST OF ETHANOL EXTRACT AND
n-HEXANE AND ETHYL ACETATE FRACTION OF
LAJA GOWAH RHIZOME (Alpinia malaccensis (Burm.f.) Roscoe) AGAINST Staphylococcus aureus AND Escherichia coli
ABSTRACT
Indonesia is a country which has the rich source of medicinal plants that have historically been used as a traditional medicine. Laja gowah is one of the herbs that can be used to treat GI problem, skin and throat infections. The aim of this research is simplex characteristic, phytochemical screening and antibacterial activity of ethanol extract, n-hexane fraction, and ethyl acetate fraction of laja gowah rhizome against Staphylococcus aureus and Escherichia coli.
Simplex was characterized, phytochemical screening and extracted by percolation using ethanol 96% as solvent and then fractionated by liquid-liquid extraction method using n-hexane then fractionated using ethyl acetate as solvent and the antibacterial activity tests against Staphylococcus aureus and Escherichia coli carried out by using agar diffusion method.
The characteristic of simplex were 8.60% for water content, 29.69% for water soluble extract, 18.35% for ethanol soluble extract, 4.97% for total ash, and 0.36% for acid insoluble ash. The pytochemical screening of simplex and ethanol extract were showed the presence of alkaloids, flavonoids, glycosides, steroids/triterpenes and saponins. n-hexane fraction showed the presence of steroids/triterpenes and ethyl acetate fraction showed the presence of alkaloids, flavonoids, glycosides and saponins. Antibacterial activity showed ethyl acetate fraction most effectively as antibacterial is at concentration 200 mg/ml againstStaphylococcus aureus and Escherichia coli with inhibition zone diameter 14.50 mmand 14.43 mm. Ethanol extract showed effective antibacterial activity at concentration 300 mg/ml against Staphylococcus aureus dan Escherichia coli with inhibiton zone 14.57 mm and 14.33. n-hexane fraction of the ethanol extract of the rhizome laja gowah does not have effectiveness as antimicrobial against Staphylococcus aureus dan Escherichia coli.