INDUKSI EMBRIOGENESIS SOMATIK ORGAN BUNGA
KAKAO (
Theobroma cacao
L.) SECARA
IN VITRO
RARA PUSPITA DEWI LIMA WATI
A24070031
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
ABSTRACT
RARA PUSPITA DEWI LIMA WATI. (Embryogenesis Somatic Induction of
Flower Organ Cocoa (
Theobroma cacao
L.) by
In Vitro
).
RINGKASAN
RARA PUSPITA DEWI LIMA WATI. Induksi Embriogenesis
Somatik Organ Bunga Kakao (
Theobroma cacao
L.) Secara
In
Vitro
.
(Dibimbing oleh DINY DINARTI dan SUDARSONO).
Percobaan ini dilakukan untuk mengevaluasi efektivitas auksin picloram
dan 2,4-D untuk menginduksi embrio somatik dari eksplan organ bunga kakao
(Theobroma cacao L.) Uper Amazon Hybrid (UAH) secara in vitro yang
dilaksanakan di Laboratorium Bioteknologi Tanaman, Departemen Agronomi dan
Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor dari bulan April sampai
Oktober 2011.
Penelitian ini terdiri dari dua percobaan. Percobaan pertama bertujuan
untuk mendapatkan media terbaik yang akan dilanjutkan pada tahap berikutnya.
Percobaan kedua merupakan ulangan dari percobaan pertama untuk mendapatkan
media terbaik dengan mengunakan media kombinasi seperti tahap kedua pada
percobaan pertama. Kedua percobaan menggunakan bagian bunga petal dan
staminoidia.
Pada percobaan pertama tahap pertama, media kombinasi yang digunakan
adalah 2,4-D 2 mg/l + adenine 0.1 mg/l; 2,4-D 2 mg/l + adenine 0.25 mg/l;
picloram 1.1 mg/l + adenine 0.1 mg/l; picloram 1.1 mg/l + adenine 0.25 mg/l;
picloram 2.2 mg/l + adenine 0.1 mg/l; picloram 2.2 mg/l + adenine 0.25 mg/l;
picloram 3.3 mg/l + adenine 0.1 mg/l, dan picloram 3.3 mg/l + adenine 0.25 mg/l
dengan media dasar MS. Sedangkan pada percobaan pertama tahap kedua terdiri
dari media terbaik pada tahap pertama (MS + 2,4-D 2 mg/l + adenine 0.25 mg/l
dan MS + picloram 1.1 mg/l + adenine 0.25 mg/l) dan media kombinasi baru (MS
+ 2,4-D 2 mg/l + kinetin 0.25 mg/l dan MS + picloram 1.1 mg/l + kinetin 0.25
mg/l).
Hasil pada percobaan petama tahap pertama, media MS + picloram 1.1
mg/l + adenin 0.25 mg/l dan MS + 2,4-D 2 mg/l + adenin 0.25 mg/l merupakan
media terbaik yang dipilih. Media tersebut menghasilkan persentase kalus yang
berpotensi embriogenik terbesar secara keseluruhan, yaitu masing-masing sebesar
merupakan media yang masih menghasilkan kalus berpotensi embriogenik. Pada
percobaan pertama tidak satupun kalus menghasilkan embrio somatik.
Percobaan kedua terdiri dari 3 sub percobaan. Pada sub percobaan 2.1,
media yang digunakan dibuat dalam botol kecil (volume 100 ml) dengan
komposisi media MS dan penambahan media zat pengatur tumbuh sama seperti
media percobaan pertama tahap kedua. Bahan pemadat yang digunakan adalah
agar-agar 6 g/l dan 30 g/l sukrosa dengan merk dagang “gulaku”. Sub percobaan
2.2 sama seperti percobaan 2.1 tetapi botol yang digunakan adalah botol besar
(volume 200 ml) dengan bahan pemadat phytagel 2 g/l dan sukrosa p.a. sebanyak
30 g/l. Pada percobaan 2.3 botol yang digunakan adalah botol kecil (volume 100
ml) dengan bahan pemadat phytagel 2 g/l dan sukrosa p.a 30 g/l.
Hasil percobaan kedua menunjukan bahwa embrio dapat diinduksi pada
sub percobaan 2.2 dengan persentase eksplan terinisiasi embrio somatik adalah
1.1% atau 4.8% dari jumlah kalus berpotensi embriogenik pada bagian
staminoidia. Jumlah embrio somatik yang terinisiasi sebanyak 4 embrio somatik
pada eksplan yang sama. Embrio somatik terinisiasi pada media kombinasi
picloram 1.1 mg/l + kinetin 0.25 mg/l selama 8 minggu setelah perlakuan (MSP).
Pada sub percobaan 2.1 dan 2.3 tidak dihasilkan embrio somatik. Namun
persentase kalus berpotensi embriogenik terbesar pada sub percobaan 2.1
mencapai 100% pada staminoidia dan 95% pada petal pada media kombinasi MS
+ 2,4-D 2 mg/l + kinetin 0.25 mg/l. Pada sub percobaan 2.3 media ini juga
menghasilkan kalus potensi embriogenik terbesar sebesar 75% baik pada petal
maupun staminoidia.
Kesimpulan dari penelitian ini adalah embrio kakao Uper Amazon Hybrid
(UAH) terinduksi pada organ bunga staminoidia. Embrio somatik terinduksi pada
media kombinasi MS + picloram 1.1 mg/l dan kinetin 0.25 mg/l selama 8 minggu
dengan selang waktu subkultur 4 minggu sekali. Botol yang digunakan
merupakan botol kultur volume 200 ml dengan menggunakan bahan pemadat
INDUKSI EMBRIOGENESIS SOMATIK ORGAN BUNGA
KAKAO (
Theobroma cacao
L.) SECARA
IN VITRO
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
Oleh
RARA PUSPITA DEWI LIMA WATI A24070031
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul :
INDUKSI EMBRIOGENESIS SOMATIK ORGAN
BUNGA KAKAO (
Theobroma cacao
L.) SECARA
IN
VITRO
Nama :
RARA PUSPITA DEWI LIMA WATI
NIM
: A24070031
Menyetujui,
Pembimbing I Pembimbing II
Ir. Diny Dinarti, MSi. Prof. Dr. Ir. Sudarsono, MSc. NIP. 19660408 199203 2 003 NIP. 19610613 198503 1 001
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
RIWAYAT HIDUP
Penulis dilahirkan di Banjarmasin, Kalimantan Selatan pada tanggal 18
Juni 1989. Penulis merupakan anak terakhir dari Bapak Gutomo dan Ibu Boky
Halimah.
Tahun 2001 penulis menyelesaikan sekolah dasar dari SDN Telaga Biru 7
Banjarmasin. Pada tahun 2004 penulis menyelesaikan studi sekolah menengah
pertama di SMPN 1 Banjarmasin. Setelah menyelesaikan sekolah menengah
pertamanya Penulis melanjutkan studi di SMA Negeri 1 Banjarmasin hingga
tahun 2007 dan pada tahun tersebut penulis diterima di sekolah perguruan tinggi
Institut Pertanian Bogor dengan jalur USMI.
Selama di IPB, penulis ikut berpartisipasi pada beberapa organisasi,
Program Kreativitas Mahasiswa (PKM), dan kepanitiaan. Organisasi yang diikuti
antara lain FORCES (Forum for Scientific Studies) pada tahun 2008 sebagai
anggota dan Himpunan Mahasiswa Agronomi tahun 2009 sebagai Bendahara II,
serta sebagai anggota Ikatan Mahasiswa Kalimantan Selatan. Penulis pernah
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT yang telah memberikan
kekuatan, rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan
penelitian yang berjudul “Induksi Embriogenesis Somatik Organ Bunga Kakao (Theobroma Cacao L.) Secara In Vitro”
Pada kesempatan kali ini penulis mengucapkan terima kasih kepada :
1. Ir. Diny Dinarti, MSi. dan Prof. Dr. Ir. Sudarsono, MSc selaku
pembimbing skripsi yang telah memberikan masukan dan saran untuk
pelaksanaan penelitian.
2. Dr. Ir Trikoesoemaningtyas, MSc. selaku pembimbing akademik yang
telah membimbing penulis selama menjalani studi.
3. Dr. Sintho W. Ardie, SP, MSi selaku penguji yang telah memberikan
masukan dan saran untuk penulisan skipsi.
4. Ayah dan Ibu beserta seluruh keluarga besar yang selalu mendukung
dalam segala aktivitas penulis.
5. Abang Ricki Susilo yang telah memberikan semangat dan dukungan serta
bantuan selama penulis menjalani penelitian hingga penyelesaian skipsi.
6. Teman-teman “AGH 44”, Andra, Meyga, Galuh, Lilis, Meli, Feni,
Neneng, Mba Fitri Yulianti dan teman-teman laboratorium yang telah
memberikan motivasi dan masukan.
7. Semua pihak yang telah membantu dalam penyelesaian usulan penelitian
ini.
Semoga penelitian ini dapat bermanfaat sebagai pedoman civitas
akademika dalam kemajuan ilmu pengetahuan.
Bogor, Januari 2012
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... ii
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Hipotesis ... 2
TINJAUAN PUSTAKA ... 3
Kultur Jaringan Tanaman ... 3
Eksplan ... 3
Media Kultur ... 4
Zat Pengatur Tumbuh ... 4
Embrio Somatik ... 6
Embrio Somatik Kakao ... 7
BAHAN DAN METODE ... 8
Tempat dan Waktu ... 8
Bahan dan Alat ... 8
Metode Penelitian ... 8
Pelaksanaan Percobaan ... 11
Pengamatan ... 12
HASIL DAN PEMBAHASAN ... 14
Percobaan 1 ... 14
Tahap 1 ... 14
Waktu Pembentukan Kalus ... 14
Persentase Eksplan Berkalus ... 15
Kalus yang Berpotensi Menjadi Kalus Embriogenik ... 17
Tahap 2 ... 18
Kalus Berpotensi Embriogenik ... 18
Percobaan 2 ... 20
Persentase Eksplan Berkalus ... 20
Warna Kalus ... 22
Persentase Kalus Berpotensi Embriogenik... 24
Embrio Somatik ... 26
KESIMPULAN DAN SARAN ... 29
Kesimpulan ... 29
Saran ... 29
DAFTAR PUSTAKA ... 30
DAFTAR TABEL
Nomor Halaman
1. Pengaruh Berbagai Kombinasi Media Terhadap Waktu Inisiasi
Kalus... 14
2. Persentase Eksplan Berkalus Berbagai Komposisi Media pada
Bagian Bunga Petal dan Staminoidia pada 4 MSP ... 16
3. Pengaruh Komposisi Media Terhadap Persentase Eksplan yang
Berpotensi Menjadi Kalus Embriogenik pada 8 MSP ... 18
4. Media Kombinasi yang Menghasilkan Kalus Berpotensi
Embriogenik pada Bagian Bunga Staminoidia pada 16 MSP. ... 19
5. Persentase Eksplan Berkalus Percobaan Kedua pada 4 MSP dan
8 MSP ... 21
6. Persentase Embrio Somatik Kakao pada Bagian Bunga Staminoidia pada Sub Percobaan 2.2 saat 8 Minggu Setelah
DAFTAR GAMBAR
Nomor Halaman
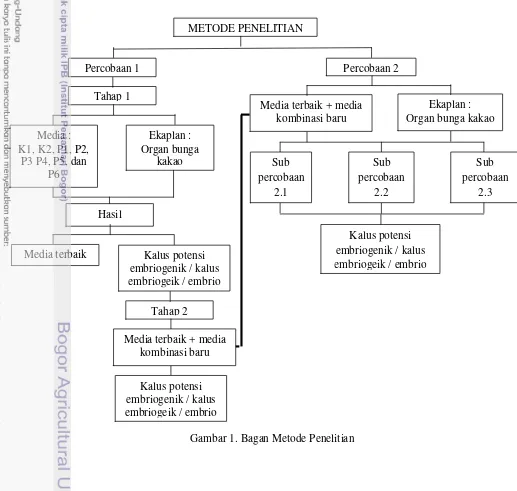
1. Bagan Metode Penelitian ... 10
2. Pembentukan Kalus Kakao ... 16
3. Kalus yang Tidak Berpeluang Embriogenik dan yang
Berpeluang Embriogenik pada 8 Minggu Setelah Perlakuan ... 17
4. Tipe Kalus Kakao Pada 16 MSP. Kalus Berpotensi
Embriogenik dan Kalus Tidak Berpotensi Embriogenik ... 19
5. Warna Kalus. Warna Kalus Putih Kekuningan dan Kalus
Browning pada 8 MSP ... 23
6. Kalus Embriogenik pada Staminoidia saat 8 MSP dengan
Perbesaran 40x. ... 25
7. Perkembangan Pembentukan Embrio Somatik pada
Staminoidia. ... 27
8. Embrio yang terinisiasi dalam satu eksplan. Tanpa perbesaran
DAFTAR LAMPIRAN
Nomor Halaman
1. Komposisi Media Murashige dan Skoog ... 33
2. Data Tahapan Perubahan Kalus yang Berpotensi Embriogenik
Setelah Dipindah pada Tahap Kedua pada Staminoidia. ... 34
3. Data Tahapan Perubahan Kalus yang Berpotensi Embriogenik
Setelah Dipindah pada Tahap Kedua pada Petal ... 35
4. Data Persentase Warna Kalus Putih Kekuningan pada Tiga Sub
Percobaan saat 4 dan 8 MSP ... 36
5. Data Persentase Warna Kalus Browning pada Tiga Sub
PENDAHULUAN
Latar Belakang
Kakao (Theobroma cacao L.) termasuk family Sterculiaceae. Tanaman ini
berasal dari hutan-hutan di daerah Amerika Selatan, yang kemudian tanaman ini
diusahakan penanamannya oleh orang-orang Indian Aztec (Puslitkoka, 2004). Biji
kakao merupakan produk yang diolah menjadi berbagai produk makanan dan
minuman. Produk olahannya banyak digemari, sehingga permintaan akan kakao
terus meningkat tiap tahunnya.
Luas perkebunan kakao di Indonesia pada tahun 2008 sebesar 1 425 216
ha, sebagian besar dimiliki oleh rakyat yaitu sebesar 92.6%. Perkebunan kakao
yang diusahakan pemerintah dan swasta sebesar 3.9% dan 3.5% (Ditjenbun,
2012). Luas areal perkebunan kakao tiap tahun mengalami peningkatan namun
tidak sejalan dengan produktivitasnya.
Produktivitas kakao di Indonesia beberapa tahun terakhir mengalami
penurunan. Pada tahun 2005 produktivitas kakao mencapai 921 kg/ha, dan terus
mengalami penurunan pada tahun berikutnya hingga pada tahun 2009 mencapai
822.43 kg/ha (Deptan, 2011). Ada banyak hal yang menjadi faktor penurunan
produktivitas kakao, salah satunya adalah umur tanaman kakao yang sudah terlalu
tua.
Pada tahun 2008, perkebunan kakao yang rusak berat dan sedang
mencapai 70 ribu hingga 235 ribu ha, bahkan masih terdapat 145 ribu ha
perkebunan kakao yang kurang terpelihara. Sehingga pada tahun tersebut
pemerintah melakukan peremajaan, rehabilitasi dan intensifikasi (Forum
Kemitraan Kakao, 2008). Program ini tentunya memerlukan ketersediaan bibit
kakao dalam jumlah yang besar.
Perbanyakan tanaman secara in vitro menjadi salah satu teknik yang dapat
diandalkan dalam memenuhi kebutuhan bibit kakao secara cepat dan dalam
jumlah yang banyak. Teknologi perbanyakan bibit kakao secara in vitro melalui
embriogenesis somatik telah tersedia, tetapi prosedur perbanyakannya dilindungi
oleh paten sehingga tidak dapat digunakan secara bebas. Untuk itu perlu
2
yang ada di Indonesia. Evaluasi komposisi media dan zat pengatur tumbuh yang
tepat untuk induksi embrio somatik kakao Indonesia perlu dilakukan.
Perbanyakan tanaman dengan cara embriogenesis somatik banyak
mendapat perhatian. Cara ini memberikan jumlah propagula yang dihasilkan tidak
terbatas dan dapat diperoleh dalam waktu yang lebih singkat. Selain itu, embrio
somatik dianggap merupakan bahan tanaman yang ideal untuk disimpan karena
bila diregenerasikan dapat membentuk bibit somatik (Purnamaningsih, 2002).
Winarsih et al. (2003) menyatakan pada media induksi dan multiplikasi
yaitu MS yang diperkaya dengan 2,4-D 2 mg/l dan adenin 0,1 mg/l merupakan
media yang menghasilkan jumlah embrio somatik paling besar pada kakao klon
Sca 6. Pada penelitian Avivi et al. (2010) media inisiasi 2,4-D 2 mg/l dan adenin
0,25 mg/l menghasilkan persentase embrio somatik 52.5% pada klon yang sama.
Picloram merupakan salah satu auksin sintetik seperti 2,4-D. Picloram
dalam konsentrasi rendah mampu menstimulasi sintesis RNA, DNA, dan protein
untuk mengatur pembelahan sel dan pertumbuhan yang tidak terkontrol (Tu et al.,
2001). Bakti (2005) menyatakan bahwa picloram pada 10 dan 20 mg/l mampu
menginduksi secara cepat kalus embriogenik pada tanaman jahe. Purba (2009)
mendapatkan konsentrasi picloram 0.5 µ M hingga 1.0 µM dapat membentuk
embrio sebesar 20% dan 6.25% pada tanaman manggis.
Tujuan
Tujuan dari penelitian ini adalah untuk mengevaluasi pengaruh auksin
picloram dan 2,4-D dalam menginduksi embriogenesis somatik dari eksplan organ
bunga kakao (Theobroma cacao L.) klon Upper Amazon Hybrid (UAH) secara in
vitro.
Hipotesis
Hipotesis dari penelitian ini adalah kombinasi picloram atau 2,4-D dengan
adenin pada konsentrasi tertentu dapat menginduksi embrio somatik dari eksplan
TINJAUAN PUSTAKA
Kultur Jaringan Tanaman
Kultur in vitro merupakan suatu budidaya dalam botol. Salah satu kegiatan
dalam kultur in vitro adalah kultur jaringan yaitu budidaya in vitro yang
menggunakan jaringan sebagai bahan tanamnya (Santoso dan Nursandi, 2003).
Menurut Zulkarnain (2009) kultur jaringan tanaman adalah suatu upaya
mengisolasi bagian-bagian tanaman, kemudian dikulturkan pada nutrient buatan
yang steril dibawah kondisi lingkungan yang terkendali, sehingga bagian-bagian
tersebut dapat beregenerasi menjadi tanaman lengkap.
Perbanyakan tanaman secara in vitro memberikan keefektifan dalam
perbanyakan perkecambahan dan prosedur reproduksi dalam melindungi tanaman
yang punah dan ketika terjadi hambatan secara genetik (Hartmann dan Kester,
1997). Zulkarnain (2009) menambahkan bahwa manfaat utama dari aplikasi kultur
jaringan tanaman adalah perbanyakan klon atau perbanyakan massal dari tanaman
yang sifat genetiknya identik satu sama lain. Di samping itu, teknik kultur
jaringan bermanfaat dalam beberapa hal khusus seperti perbanyakan klon secara
cepat, keseragaman genetik, kondisi aseptik, seleksi tanaman, stok tanaman
mikro, lingkungan terkendali, pelestarian plasma nutfah, produksi tanaman
sepanjang tahun, dan memperbanyak tanaman yang sulit diperbanyak secara
vegetatif.
Eksplan
Eksplan merupakan bagian tanaman (propagul) yang digunakan untuk
menginisiasi pembiakan tanaman secara mikro atau proses kultur jaringan
(Hartmann dan Kester, 1997). Seleksi bahan eksplan yang cocok merupakan
faktor penting yang menentukan keberhasilan program kultur jaringan. Sistem
kultur jaringan yang baru dengan spesies dan kultivar yang baru, seringkali
menghendaki analisis yang sistematis terhadap potensi eksplan dari setiap tipe
jaringan. Tiga aspek yang perlu diperhatikan dalam seleksi bahan eksplan yaitu
4
Beberapa jenis eksplan yang digunakan dalam kultur jaringan antara lain
potongan daun, lapisan epidermis, tunas apikal yang terfragmentasi, kotiledon dan
hipokotil, pucuk, bunga muda, umbi dan bagian lainnya (Hartmann dan Kester,
1997). Bagian bunga pada kakao dapat digunakan sebagai eksplan (Figuera dan
Alemanno, 2005). Bagian ini memproduksi fenol dan lendir yang relatif sedikit.
Mahkota bunga (petal) memberikan respon jumlah embrio yang paling besar
diikuti oleh staminoidia dan antera (Winarsih et al., 2003; Avivi et al., 2010).
Media Kultur
Media kultur merupakan salah satu komponen penting dalam penanaman
sel dan metode kultur jaringan. Aplikasi yang sukses dalam prosedur kultur
jaringan tanaman bergantung pada media kultur dengan komposisi yang tepat
(Evans et al., 2003). Medium hara untuk kultur jaringan tanaman mengandung
lima kelompok senyawa yaitu garam organik, sumber karbon, vitamin, pengatur
tumbuh, dan pelengkap organik (Gamborg, 1991). Wetherell (2000) juga
menyatakan bahwa media kultur yang memenuhi syarat adalah media yang
mengandung nutrien makro mikro dalam kadar dan perbandingan tertentu, serta
sumber energi (umumnya menggunakan sukrosa), serta mengandung satu atau dua
macam vitamin dan zat pengatur tumbuh.
Salah satu media yang sering digunakan dalam kultur jaringan adalah
media Murashige dan Skoog yang dikemukakan oleh Toshio Murashige pada
tahun 1962(Zulkarnain, 2009). Media Murashige dan Skoog yang dikenal dengan
nama MS mengandung 40 mM nitrogen dalam bentuk NO3 dan 29 mM dalam bentuk NH4+. Kandungan N ini, lima kali lebih tinggi dari N total yang terdapat pada media Miller, 15 kali lebih tinggi dari media tembakau Hildebrant, dan 19
kali lebih tinggi dari media white (Gunawan, 1988).
Zat Pengatur Tumbuh
Konsep zat pengatur tumbuh (ZPT) diawali dengan konsep hormon.
Hormon tanaman adalah senyawa-senyawa organik tanaman yang dalam
konsentrasi yang rendah (< 1 mM) mempengaruhi proses-proses fisiologi (Wiendi
pertumbuhan serta perkembangan sel, jaringan, dan organ tanaman menuju arah
diferensiasi tertentu. Senyawa-senyawa lain yang memiliki karateristik yang sama
dengan hormon, tetapi diproduksi secara eksogen, dikenal sebagai zat pengatur
tumbuh (Zulkarnain, 2009).
Zat pengatur tumbuh diperlukan sebagai komponen media bagi
pertum-buhan dan diferensiasi. Tanpa penambahan zat pengatur tumbuh dalam medium,
pertumbuhan sangat terhambat bahkan mungkin tidak tumbuh sama sekali.
Pembentukan organ-organ tanaman ditentukan oleh penggunaan zat pengatur
tumbuh yang tepat (Hendaryanto dan Wijayani, 1994).
Pada saat ini dikenal enam kelompok ZPT yaitu auksin, giberelin,
sitokinin, asam absisik (ABA), etilen, dan retardan (Wiendi et al., 1992). Untuk
inisiasi kalus umumnya digunakan auksin 2,4-D saja atau dikombinasikan dengan
sitokinin. Zat pengatur tumbuh 2,4-D efektif dalam menginduksi kalus, hal ini
telah dibuktikan dalam penelitian Sari et al. (2005) bahwa penggunaan 2,4-D
secara tunggal pada konsentrasi rendah mampu menginduksi kalus gambir.
Winarsih et al. (2003) juga menyebutkan bahwa persentase eksplan menghasilkan
embrio kakao akan lebih tinggi jika menggunakan auksin (2,4-D 2 mg/l) yang
lebih tinggi konsentrasinya dan konsentrasi sitokinin rendah (adenin 0,1 mg/l)
dibandingkan menggunakan konsentrasi auksin (2,4-D) rendah.
Picloram merupakan auksin sintetik. Zat ini dapat menyebabkan kematian
pada tanaman apabila digunakan dengan dosis yang tinggi. Namun, dalam
konsentrasi rendah picloram dapat menstimulasi sintesis RNA, DNA, dan protein
untuk mengatur pembelahan sel dan pertumbuhan yang tidak terkontrol (Tu et al.,
2001). Penelitian Sudarmonowati dan Henshaw (1996) melaporkan bahwa
picloram pada konsetrasi 3.0 mg/l menghasilkan total embrio somatik terbesar
yaitu sebanyak 70% pada daun muda ubi kayu CMC 76. Pada penelitian Priadi
danSudarmonowati(2006), penambahan picloram 6 mg/l pada media MS dan GD
selama 2 minggu mampu menginduksi kalus eksplan daun pucuk ubi kayu
menjadi kalus embrogenik. Belarmino dan Gonzales (2008) juga menambahkan
bahwa penggunaan media MS dengan penambahan 1.0 mg/l picloram efektif
6
Embrio Somatik
Kohlenbach mengklasifikasikan embrio ke dalam dua kategori. Embrio ini
dapat tumbuh normal secara in vivo atau di bawah kontrol lingkungan in vitro.
Kedua kategori tersebut adalah embrio zigotik dan non-embryo zigotik. Embrio
zigotik terbentuk dari sebuah zigot yang dihasilkan dari peleburan telur,
sedangkan non-embrio zigotik terbentuk dari sel selain zigot misalnya embrio
somatik yang terbentuk dari sel somatik baik in vivo atau in vitro (Vajrabhaya,
1988). Embrio somatik merupakan suatu istilah yang digunakan untuk
menyatakan perkembangan embrio lengkap dari sel vegetatif yang dihasilkan dari
berbagai sumber eksplan yang ditumbuhkan pada sistem kultur jaringan
(Hartmann dan Kester, 1997). Menurut Ammirato (1983), embrio somatik
merupakan proses perkembangan embrio dari sel tanpa melewati fusi gamet.
Wiendi et al. (1992) menambahkan, embrio terbentuk dari sel meristematik yang
pro-embrional ini dikenal dengan bermacam-macam nama seperti kalus
embrionik, nodul, dan lain-lain.
Pembentukan embrio somatik dapat terjadi secara langsung dan secara
tidak langsung. Menurut Wiendi et al. (1992) embriogenesis langsung dari
jaringan somatik secara in vitro umumnya terjadi pada eksplan yang masih muda
(juvenil). Embrio somatik yang dihasilkan dari kecambah kadang-kadang
terbentuk dari sel-sel epidermal, namun ada juga dari jaringan petiol, atau sel-sel
kortikal. Embrio somatik tidak langsung diperoleh dari kalus atau kultur suspensi.
Kalus yang diperoleh dari inisiasi awal akan memiliki kemampuan untuk
beregenerasi membentuk embrio somatik yang tinggi dibandingkan dengan kalus
hasil subkultur.
Embrio somatik dapat tumbuh secara langsung dari hipokotil maupun
daun kotil embrio zigotik eksplan. Embrio somatik yang tumbuh dari hipokotil
bentuknya normal sedangkan yang tumbuh dari daun kotil sering tidak normal
(Winarsih et al., 2002). Zulkarnain (2009) juga menambahkan bahwa embrio
somatik dapat muncul langsung dari permukaan eksplan (pada eksplan kotiledon
Cucumis sativus dan tunas Foeniculum vulgare) atau setelah fase penggandaan
Embrio somatik yang terbentuk dari kalus umumnya diawali dengan
adanya proembrio yang tumbuh dari pemukaan eksplan dengan suspensor yang
terhubung pada kalus dan biasanya terjadi dalam bentuk gerombol. Struktur ini
kemudian berkembang menjadi bentuk globular, hati, torpedo, dan kotiledon
(Winarsih et al., 2002). Zulkarnain (2009) menambahkan bahwa perkembangan
embrio somatik sama seperti embrio zigotik yang berkembang melewati
tahapan-tahapan yang sama. Tahapan-tahapan-tahapan tersebut adalah oktan, globular, awal hati,
hati, torpedo, dan embrio dewasa.
Salah satu keuntungan dari embrogenesis somatik adalah embrio yang
dihasilkan bersifat bipolar, yaitu memiliki ujung-ujung akar dan pucuk yang
diperlukan bagi pertumbuhan tanaman lengkap. Berbeda pada pembentukan tunas
adventif yang unipolar, perkembangan pucuk dan akar sering terjadi secara
terpisah dan sangat tergantung pada perubahan media (Purnamaningsih, 2002;
Zulkarnain, 2009).
Embrio Somatik Kakao
Pada tanaman kakao embrio somatik dapat terbentuk pada organ bunga
maupun embrio zigotik kakao. Pembentukan embrio sangat besar dipengaruhi
oleh zat pengatur tumbuh (Winarsih et al., 2002; 2003). Menurut Winarsih et al.
(2003) konsentrasi zat pengatur tumbuh 2,4-D dan adenin pada media inisiasi
sangat berpengaruh terhadap persentase eksplan menghasilkan embrio dan jumlah
per eksplan yang dihasilkan. Perlakuan 2,4-D konsentrasi tinggi (2 mg/l) dan
adenin konsentrasi rendah (0.10 mg/l) ternyata menghasilkan embrio dan jumlah
embrio per eksplan lebih tinggi pada eksplan organ bunga kakao.
Embrio somatik primer dapat terbentuk setelah minggu ke 9 sejak eksplan
di induksi. Perbedaan organ bunga kakao yang digunakan sebagai eksplan
menunjukan perbedaan presentase eksplan menghasilkan embrio (Avivi et al.,
2010). Eksplan yang menghasilkan embrio paling baik terutama dijumpai pada
organ petala diikuti oleh staminoid dan kemudian antera (Winarsih et al., 2003;
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Bioteknologi Tanaman,
Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian
Bogor. Penelitian ini dimulai pada bulan April sampai dengan Oktober 2011.
Bahan dan Alat
Eksplan yang digunakan dalam penelitian ini adalah organ bunga kakao
klon Uper Amazon Hybrid (UAH) yang masih kuncup. Bahan lain yang
digunakan yaitu media MS (Murashige and Skoog), phytagel dan agar-agar
sebagai bahan pemadat, sukrosa, zat pengatur tumbuh (2,4-D, picloram, kinetin,
adenin) dan bahan sterilan seperti agrimycin, dhitane, sodium hypoklorit 5%,
alkohol, spritus dan aquades steril.
Peralatan untuk pembuatan media yaitu gelas ukur, gelas piala, pipet
volumetrik, magnetik stirer, spatula, kompor, botol kultur, timbangan analitik, pH
meter, autoclave, dan oven. Peralatan untuk menanam antara lain Laminar Air
Flow Cabinet, Petridis, lampu Bunsen, pinset, hand sprayer, pisau, dan gunting.
Metode Penelitian
Penelitian ini terdiri dari dua percobaan, yaitu : percobaan pertama di
lakukan untuk mendapatkan media terbaik yang akan dilanjutkan pada tahap
berikutnya. Percobaan kedua merupakan pengulangan dari percobaan pertama
untuk mendapatkan media terbaik dengan menggunakan media hasil percobaan
pertama.
Percobaan 1
Percobaan pertama dilakukan dengan dua tahap. Pada tahap pertama
bagian bunga yang digunakan adalah bagian staminoid dan petal dengan 8
kombinasi media dengan media dasar MS yang terdiri dari :
K2=2,4-D 2 mg/l + adenine 0.25 mg/l
P1= picloram 1.1 mg/l + adenine 0.1 mg/l
P2= picloram 1.1 mg/l + adenine 0.25 mg/l
P3= picloram 2.2 mg/l + adenine 0.1 mg/l
P4= picloram 2.2 mg/l + adenine 0.25 mg/l
P5= picloram 3.3 mg/l + adenine 0.1 mg/l
P6= picloram 3.3 mg/l + adenine 0.25 mg/l
Media terbaik ditambah dengan media kombinasi baru (MS + 2,4-D 2 mg/l +
kinetin 0.25 mg/l dan MS + picloram 1.1 mg/l + kinetin 0.25 mg/l) yang
digunakan sebagai media lanjutan tahap kedua pada percobaan pertama dengan
bahan tanam berupa kalus terbaik hasil percobaan pada tahap pertama.
Percobaan 2
Percobaan kedua terdiri dari tiga sub percobaan. Pada percobaan kedua
bahan tanam yang digunakan adalah bagian bunga kakao berupa staminoid dan
petal. Media yang digunakan adalah media terbaik pada percobaan pertama tahap
pertama ditambah dengan media kombinasi baru. Masing–masing perlakuan
terdiri dari 100 eksplan staminoidia dan 100 eksplan petal dengan jumlah eksplan
per botol 5 eksplan. Setiap sub percobaan terdiri dari 160 botol kultur.
Sub Percobaan 2.1
Pada sub percobaan 2.1 media tanam menggunakan botol kultur kecil
(volume 100 ml), serta bahan pemadat agar-agar sebanyak 6 g/l dan sukrosa
dengan merk dagang “Gulaku” 30 g/l. Percobaan ini memiliki 8 satuan percobaan
dengan 4 media kombinasi dan 2 bagian bunga. Tiap satuan percobaan terdiri dari
20 botol kultur dengan 5 eksplan per botol. Sehingga penelitian ini terdiri dari 800
satuan pengamatan.
Sub Percobaan 2.2
Pada sub percobaan 2.2 media tanam menggunakan botol kultur besar
(volume 200 ml), serta bahan pemadat phytagel 2 g/l dan sukrosa p.a 30 g/l.
Percobaan ini memiliki 8 satuan percobaan dengan 4 media kombinasi dan 2
bagian bunga. Tiap satuan percobaan terdiri dari 20 botol kultur dengan 5 eksplan
10
Sub Percobaan 2.3
Pada sub percobaan 2.3 media tanam menggunakan botol kultur kecil
(volume 100 ml), serta bahan pemadat phytagel 2 g/l dan sukrosa p.a 30 gr/l.
Percobaan ini memiliki 8 satuan percobaan dengan 4 media kombinasi dan 2
bagian bunga. Tiap satuan percobaan terdiri dari 20 botol kultur dengan 5 eksplan
per botol. Sehingga penelitian ini terdiri dari 800 satuan pengamatan.
Gambar 1. Bagan Metode Penelitian Tahap 2
Kalus potensi embriogenik / kalus embriogeik / embrio Percobaan 1
Tahap 1
Media : K1, K2, P1, P2,
P3 P4, P5, dan P6
Ekaplan : Organ bunga
kakao
Hasil
Media terbaik Kalus potensi embriogenik / kalus embriogeik / embrio
Media terbaik + media kombinasi baru
METODE PENELITIAN
Percobaan 2
Media terbaik + media kombinasi baru
Ekaplan : Organ bunga kakao
Pelaksanaan Percobaan
Sterilisasi Alat
Peralatan yang digunakan, meliputi alat tanam, cawan petri dan botol
kultur, disterilkan untuk mencegah kontaminasi. Peralatan dicuci bersih terlebih
dahulu, lalu disterilkan dengan menggunakan autoklaf pada temperature 121°C
bertekanan 17.5 psi selama 30 menit.
Pembuatan Media
Larutan stok dibuat sesuai dengan komposisi masing-masing media.
Larutan stok MS dibuat untuk memudahkan pembuatan media. Larutan stok zat
pengatur tumbuh 2,4-D, picloram (golongan auksin), kinetin dan adenin
(golongan sitokinin) dibuat dengan konsentrasi masing-masing 1000 ppm untuk
auksin, serta 100 ppm untuk sitokinin. Selanjutnya ditambahkan aquades sesuai
volume yang diinginkan dan disimpan dalam lemari es.
Media dibuat dari larutan stok yang ditambah gula 30 g/l media, kemudian
ditambah aquades hingga volume mencapai 1 liter. Kemasaman media diatur
dengan mengguanakan NaOH atau HCl hingga berkisar antara 5.5-5.8. Larutan
media kemudian ditambah agar-agar 6 g/l atau 2 g/l untuk phytagel, dipanaskan
sambil diaduk-aduk, lalu tuangkan ke botol kultur. Botol kemudian ditutup
dengan menggunakan plastik dan diikat dengan karet gelang. Botol-botol yang
berisi media perlakuan disterilkan dengan menggunakan autoklaf pada suhu
121°C dan tekanan 17.5 psi selama 30 menit.
Sterilisasi Eksplan dan Penanaman
Kuncup bunga dicuci dengan tween lalu dibilas dengan air mengalir.
Setelah itu bunga direndam dalam larutan fungisida selama 30 menit dan dibilas
sebanyak tiga kali. Tahap selanjutnya direndam dengan Sodium hypochloride 5%
selama 5 menit sambil sesekali dikocok, kemudian dibilas tiga kali dengan
aquadestilata steril. Setelah itu bunga dipisahkan sesuai bagian-bagiannya yaitu
mahkota (petala), dan staminoid. Bagian bunga yang dipisahkan, ditanam pada
12
Penginduksian kalus
Eksplan yang steril ditumbuhkan ke dalam media MS dengan penambahan
ZPT sesuai perlakuan yang ditambah dengan sukrosa 30 g/l dan phytagel 2 g/l
atau agar-agar 6 g/l, sebanyak lima potong per botol. Kultur disimpan dalam
ruang gelap dengan suhu 26-28°C.
Pemeliharaan Kultur
Pemeliharaan dilakukan dengan mempertahankan suhu ruang kultur. Botol
kultur yang terkontaminasi dipindahkan dari ruang kultur untuk mencegah
penyebaran kontaminasi ke seluruh botol.
Pengamatan
Pengamatan pada percobaan pertama antara lain :
1. Pengamatan waktu berkalus, yaitu waktu terbentuknya kalus setelah
perlakuan yang dihitung berdasarkan hari setelah perlakuan.
2. Persentase eksplan berkalus merupakan perbandingan eksplan berkalus
pada tiap jumlah eksplan steril.
Per sentase eksplan ber kalus = ∑or gan bunga ber kalus
∑or gan bunga yang ster il × 100%
3. Persentase kalus berpotensi embriogenik,
Per sentase kalus potensi embriogenik
= ∑kal us potensi embr iogenik
∑or gan bunga steri l ber kalus × 100%
Pada percobaan kedua, pengamatan yang dilakukan antara lain :
1. Persentase eksplan berkalus,
Per sentase eksplan ber kalus = ∑or gan bunga ber kalus
∑or gan bunga yang ster il × 100%
2. Persentase warna kalus, yaitu persentase warna tampilan kalus dengan
kriteria warna kalus putih kekuningan dan browning.
Per sentase war na kalus putih kekuningan atau
= ∑war na kalus puti h kekuni ngan atau
3. Persentase kalus potensi embriogenik,
Per sentase kal us potensi embr iogenik
= ∑kalus potensi embr iogenik
∑or gan bunga ster il berkal us × 100%
4. Persentase embrio,
Per sentase embr io = ∑embri o
HASIL DAN PEMBAHASAN
Percobaan 1 Tahap 1
Waktu Pembentukan Kalus
Eksplan menunjukan pembengkakan pada 5 hari setelah tanam pada media
prekondisi yaitu yang terdiri dari MS tanpa penambahan ZPT. Eksplan yang steril
disubkultur pada media perlakuan dan diamati selama kurang lebih 8 MSP.
Tabel 1.Pengaruh Berbagai Kombinasi Media Terhadap Waktu Inisiasi Kalus
Data pada Tabel 1 menunjukkan bahwa staminoidia berkalus antara 16
hingga 23 hari setelah perlakuan (HSP). Petal berkalus lebih cepat yaitu antara 11
hingga 22 hari. Menurut Avivi et al. (2010) eksplan klon kakao ICCRI 01, ICCRI
04, KW 514 dan RCC 72 sudah dapat berkalus pada hari ke-12 dengan kisaran
persentase 12.7-100%. Bahkan pada eksplan petala, staminoidia dan beberapa
antera sudah terbentuk pada hari ke-6.
Waktu pembentukan kalus lebih bervariatif dan lebih lama dari penelitian
sebelumnya. Hal ini dapat disebabkan adanya perbedaan genotipe. Respon Kombinasi Media Waktu inisiasi kalus (HSP)
Staminoidia Petal
2,4-D 2 mg/l + adenine 0.1 mg/l 23 ± 3 16 ± 8
2,4-D 2 mg/l + adenine 0.25 mg/l 19 ± 3 11 ± 2
Picloram 1.1 mg/l + adenine 0.1 mg/l 20 ± 3 16 ± 3
Picloram 1.1 mg/l + adenine 0.25 mg/l 18 ± 3 17 ± 7
picloram 2.2 mg/l + adenine 0.1 mg/l 19 ± 3 21 ± 6
Picloram 2.2 mg/l + adenine 0.25 mg/l 20 ± 3 15 ± 8
Picloram 3.3 mg/l + adenine 0.1 mg/l 19 ± 4 14 ± 3
Picloram 3.3 mg/l + adenine 0.25 mg/l 16 ± 2 22 ± 6
masing-masing genotipe dapat berbeda meskipun dalam perlakuan yang sama
(Wiendi et al., 1992; Winarsih et al., 2003; Avivi et al., 2010).
Selain genotipe, cara sterilisasi tanaman diduga dapat meghambat
pembentukan kalus. Bahan sterilan yang digunakan untuk sterislisasi tanaman
umumnya bersifat toxic sehingga dapat mematikan sel tanaman (Gunawan, 1988).
Pada penelitian Winarsih et al. (2003), Maximova (2005), dan Avivi et al. (2010)
cara sterilisasi cukup sederhana hanya menggunakan sodium hypoclorit (clorox)
5-6%. Namun pada penelitian ini cara sterilisasi lebih kuat dengan menggunakan
bakterisida dan fungisida. Hal ini dilakukan karena kondisi tanaman sumber
eksplan kurang terawat sehingga memerlukan cara sterilisasi yang berbeda.
Media kombinasi picloram 3.3 mg/l dan adenin 0.25 mg/l merupakan
media yang menginisiasi kalus lebih cepat pada staminoidia. Pada petal, media
yang menginisiasi kalus paling cepat terdapat pada media MS + 2,4-D 2 mg/l dan
adenin 0.25 mg/l yaitu sekitar 11 hari. Hal ini menunjukan bahwa jenis eksplan
berpengaruh terhadap kemampuan eksplan berkalus. Menurut Wiendi et al. (1992)
bagian tanaman yang digunakan sebagai eksplan merupakan salah satu faktor
utama pertumbuhan dan morfogenesis tanaman dalam kultur in vitro.
Persentase Eksplan Berkalus
Kalus tumbuh pada bagian pangkal staminodia yang dipotong, sedangkan
pada petal dimulai dari eksplan menggulung dan mengeluarkan kalus pada bagian
pinggir petal (Gambar 2). Winarsih et al. (2003) juga menyatakan bahwa kalus
pada staminoidia mulai tumbuh pada bagian pangkal eksplan, sedangkan pada
bagian petal pertumbuhan kalus dimulai pada bagian yang membentuk cakram.
Pada Tabel 2 dapat diketahui bahwa persentase eksplan terbesar pada
bagian petal terdapat pada media MS ditambah 2,4-D 2 mg/l dan adenin 0.25 mg/l
yaitu sebesar 73.91%. Pada staminoidia media kombinasi yang memberikan
persentase kalus terbesar terdapat pada media MS + picloram 1.1 mg/l dan
adenine 0.25 mg/l yaitu sebesar 50%.
Bagian petal pada media MS dengan penambahan 2,4-D 2 mg/l dan adenin
0.25 mg/l memberikan persentase paling besar. Hal ini sesuai pada penelitian
16
adenin 0.25 mg/l merupakan media inisiasi terbaik yang diperoleh dari mahkota
bunga hingga 100% pada beberapa klon kakao.
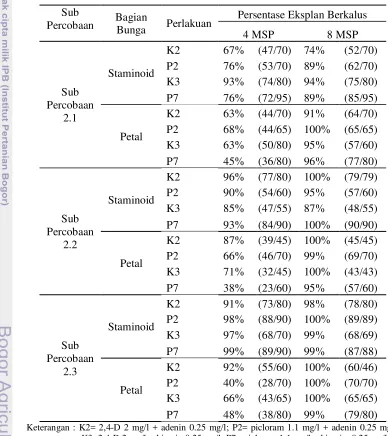
Tabel 2. Persentase Eksplan Berkalus Berbagai Komposisi Media pada Bagian Bunga Petal dan Staminoidia pada 4 MSP
Keterangan : ( ) menunjukan jumlah kalus per jumlah eksplan yang steril
Gambar 2. Pembentukan Kalus Kakao A. Eksplan Bunga Kuncup, B. Bagian Bunga Staminoidia (panah putih) dan Petal (panah merah), C. Staminoidia, D. Kalus Staminoidia 4 Minggu Setelah Perlakuan (MSP), E. Kalus Staminoidia 8 MSP, F. Petal, G, Kalus Petal 4 MSP, H. Kalus Petal 8 MSP.
Hal ini menunjukan bahwa kombinasi auksin dan sitokinin memberikan
respon yang berbeda-beda pada tiap bagian bunga. Menurut Winarsih et al. (2003)
respon setiap jenis organ bunga terhadap media bervariasi. Pada penelitiannya
staminoidia memberikan respon yang paling besar diikuti oleh mahkota bunga dan
antera. Adanya perbedaan respon antar organ bunga diduga karena perbedaan
kandungan hormon pada masing-masing organ dan fase fisiologis pada saat
pengambilan bunga.
Perlakuan Petal (%) Staminoid (%) 2,4-D 2 mg/l + adenine 0.1 mg/l, 68.25 (43/63) 40.74 (22/54) 2,4-D 2 mg/l + adenine 0.25 mg/l, 73.91 (51/69) 48.00 (24/50) Picloram 1.1 mg/l + adenine 0.1 mg/l 55.17 (32/58) 39.13 (27/69) Picloram 1.1 mg/l + adenine 0.25 mg/l 40.38 (21/52) 50.00 (25/50) picloram 2.2 mg/l + adenine 0.1 mg/l 34.62 (18/52) 26.98 (17/63) Picloram 2.2 mg/l + adenine 0.25 mg/l 43.84 (32/73) 44.78 (30/67) Picloram 3.3 mg/l + adenine 0.1 mg/l 45.76 (27/59) 48.00 (24/50) Picloram 3.3 mg/l + adenine 0.25 mg/l 33.96 (18/53) 45.76 (27/59)
A
C D
B
E
Picloram dengan konsentrasi 1.1 mg/l setara dengan 4.6 µM, sedangkan
2 mg/l 2,4-D setara dengan 9.05 µM. Hal ini menunjukan bahwa picloram lebih
efektif dalam menginduksi kalus dibandingkan 2,4-D. Cukup dengan
menggunakan setengah konsentrasi 2,4-D, picloram mampu menginduksi kalus
hingga 50%. Sedangkan 2,4-D pada konsentrasi yang sama hanya menginduksi
sekitar ±35% pada bagian petal.
Kalus yang Berpotensi Menjadi Kalus Embriogenik
Embrio somatik dapat terbentuk melalui dua jalur yaitu langsung dan tidak
langsung. Keberhasilan akan tercapai apabila kalus atau sel yang digunakan
bersifat embriogenik (Purnamaningsih, 2002). Pengamatan kalus yang berpeluang
embriogenik dilakukan pada 8 minggu setelah perlakuan (MSP).
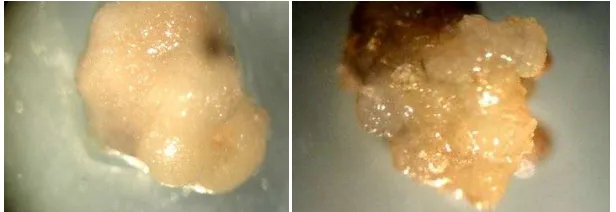
Gambar 3. Kalus yang tidak berpeluang embriogenik (kiri) dan yang berpeluang embriogenik pada 8 minggu setelah perlakuan (kanan) dengan mikroskop perbesaran 20x.
Pada Gambar 3 menunjukan bahwa kalus yang berpeluang embriogenik
memiliki struktur yang bernodul dan remah ketika disentuh. Pada kalus yang tidak
berpeluang embriogenik maka kalus bersifat lembek dan mengeluarkan cairan
ketika disentuh.
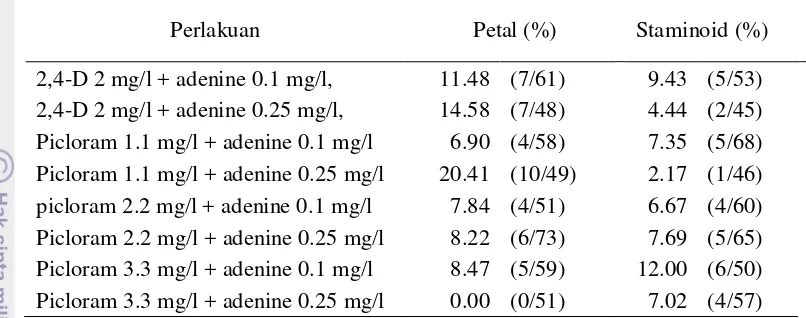
Persentase kalus yang berpeluang menjadi kalus embriogenik (Tabel 3)
terbesar terdapat pada media MS + picloram 1.1 mg/l dan adenin 0.25 mg/l yaitu
sebesar 20.41% pada bagian petal. Pada staminoidia persentase terbesar terdapat
18
Tabel 3. Pengaruh Komposisi Media Terhadap Persentase Eksplan Yang Berpotensi Menjadi Kalus Embriogenik pada 8 MSP
Perlakuan Petal (%) Staminoid (%)
2,4-D 2 mg/l + adenine 0.1 mg/l, 11.48 (7/61) 9.43 (5/53) 2,4-D 2 mg/l + adenine 0.25 mg/l, 14.58 (7/48) 4.44 (2/45) Picloram 1.1 mg/l + adenine 0.1 mg/l 6.90 (4/58) 7.35 (5/68) Picloram 1.1 mg/l + adenine 0.25 mg/l 20.41 (10/49) 2.17 (1/46) picloram 2.2 mg/l + adenine 0.1 mg/l 7.84 (4/51) 6.67 (4/60) Picloram 2.2 mg/l + adenine 0.25 mg/l 8.22 (6/73) 7.69 (5/65) Picloram 3.3 mg/l + adenine 0.1 mg/l 8.47 (5/59) 12.00 (6/50) Picloram 3.3 mg/l + adenine 0.25 mg/l 0.00 (0/51) 7.02 (4/57)
Keterangan : ( ) menunjukan jumlah kalus potensi embriogenik per jumlah eksplan berkalus.
Media MS + picloram 1.1 mg/l + adenin 0.25 mg/l dan media MS + 2,4-D
2 mg/l + adenin 0.25 mg/l merupakan media yang memiliki persentase kalus
berpotensi embriogenik terbesar yaitu 20.41% dan 14.58% pada eksplan petal.
Media tersebut merupakan media terpilih yang akan dilanjutkan pada tahap kedua
dengan bagian bunga utama petal. Menurut Winarsih et al. (2003) dan Avivi et al.
(2010) bagian bunga petal memberikan respon terbaik yang menghasilkan embrio
terbanyak yang dilanjutkan oleh bagian staminoidia dan antera pada tanaman
kakao. Namun, Figueira dan Alemanno (2004) menyatakan bahwa bagian
staminoidia merupakan eksplan yang lebih responsif. Sehingga pada tahapan
berikutnya bagian staminoidia tetap digunakan.
Tahap 2
Percobaan pertama pada tahap kedua bertujuan mendapatkan media
terbaik sebagai media SCG (secondary callus growth), sehingga kalus yang
berpotensi sebagai kalus embriogenik dipindah pada media terbaik yang dipilih.
Kalus Berpotensi Embriogenik
Kalus embriogenik ditandai dengan adanya struktur kalus yang berwarna
kekuningan dan remah (mudah dipisahkan) (Roostika et al., 2009). Kalus tersebut
diharapakan dapat berkembang membentuk nodul-nodul yang merupakan tahap
memiliki struktur yang remah dan bernodul, sedangkan pada kalus yang tidak
berpotensi embriogenik kalus bersifat lembek dan mengeluarkan cairan ketika
[image:31.612.147.484.140.266.2]disentuh.
Gambar 4. Tipe Kalus Kakao Pada 16 MSP. Kalus berpotensi embriogenik (kiri) dan kalus tidak berpotensi embriogenik (kanan)
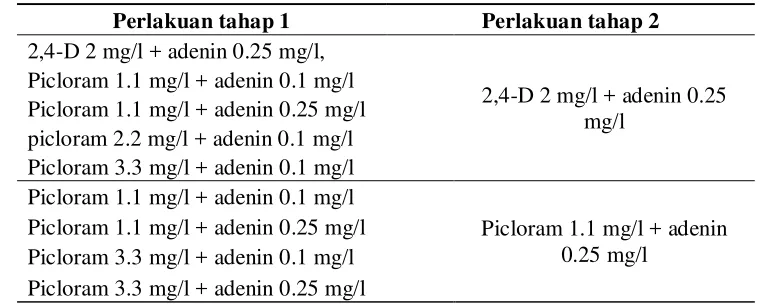
Tabel 4. Media Kombinasi yang Menghasilkan Kalus Berpotensi Embriogenik pada Bagian Bunga Staminoidia pada 16 MSP.
Perlakuan tahap 1 Perlakuan tahap 2 2,4-D 2 mg/l + adenin 0.25 mg/l,
2,4-D 2 mg/l + adenin 0.25 mg/l
Picloram 1.1 mg/l + adenin 0.1 mg/l Picloram 1.1 mg/l + adenin 0.25 mg/l picloram 2.2 mg/l + adenin 0.1 mg/l Picloram 3.3 mg/l + adenin 0.1 mg/l Picloram 1.1 mg/l + adenin 0.1 mg/l
Picloram 1.1 mg/l + adenin 0.25 mg/l
Picloram 1.1 mg/l + adenin 0.25 mg/l Picloram 3.3 mg/l + adenin 0.1 mg/l Picloram 3.3 mg/l + adenin 0.25 mg/l
Pada percobaan tahap kedua, tidak semua media kombinasi pada tahap
pertama dapat membentuk kalus berpotensi embriogenik, setelah disubkultur ke
media tahap kedua dalam kurun waktu 8 MSP. Hanya pada media MS + 2,4-D 2
mg/l + adenin 0.25 mg/l dan MS + picloram 1.1 mg/l + adenin 0.25 mg/l yang
dapat masih membentuk kalus berpotensi embriogenik. Tahapan media yang
dapat menghasikan kalus yang berpotensi embriogenik dapat dilihat pada Tabel 4.
Kalus berpotensi embriogenik pada tahap kedua tidak menunjukan adanya
pertumbuhan embrio.
Pada media kombinasi lain, kalus tidak berkembang dan menghitam atau
[image:31.612.123.503.345.497.2]20
penggunaan media MS + picloram 1.1 mg/l + kinetin 0.25 mg/l dan media MS +
2,4-D 2 mg/l + kinetin 0.25 mg/l kurang tepat pada tahap kedua (Lampiran 2).
Kemungkinan hal ini disebabkan karena ketidaksesuaian jenis zat pengatur
tumbuh dan lama selang waktu subkultur.
Menurut Fahkrina (2010), lama kalus disubkultur juga merupakan salah
satu faktor penentu terbentuknya kalus embriogenik. Pada padi varietas IR 64
hanya dapat bertahan selama 25-30 hari, sedangkan Situ Bagendit mampu
bertahan 30-40 hari. Jika lebih, maka kalus akan berkurang atau hilang daya
regenerasinya. Pada penelitian ini kakao yang di subkultur setiap 28 hari atau 4
minggu sekali sebaiknya dilakukan setiap 2 atau 3 minggu sekali seperti yang
dilakukan pada penelitian Winarsih et al. (2003) dan Avivi et al. (2010).
Percobaan 2
Pada percobaan kedua media yang digunakan sama dengan media tahap
lanjutan pada percobaan pertama tahap kedua yaitu 2,4-D 2 mg/l + adenin 0.25
mg/l; picloram 1.1 mg/l + adenin 0.25 mg/l; 2,4-D 2 mg/l + kinetin 0.25 mg/l; dan
picloram 1.1 mg/l + kinetin 0.25 mg/l dengan media dasar MS. Eksplan yang
digunakan adalah bagian bunga petal dan staminoidia pada tanaman kakao.
Persentase Eksplan Berkalus
Eksplan menunjukan pembengkakan pada 5 hari setelah tanam pada media
prekondisi MS tanpa penambahan ZPT. Eksplan yang steril disubkultur pada
media perlakuan. Eksplan mulai berkalus pada minggu ke-2 hingga ke-3 setelah
perlakuan.
Pada Tabel 5 menunjukan bahwa sub percobaan 2.1 memiliki persentase
eksplan berkalus terdapat pada kisaran 45 - 100% pada berbagai media kombinasi
dan bagian bunga. Persentase kalus terbesar terdapat pada bagian petal yaitu
sebesar 68% pada 4 MSP dan meningkat 100% pada 8 MSP yang diinduksi
dengan media MS + picloram 1.1 mg/l + adenin 0.25 mg/l. Pada bagian
staminoidia, persentase kalus terbesar terdapat pada media MS + 2,4-D 2 mg/l +
Persentase eksplan berkalus pada sub percobaan 2.2 sebesar 38-100%.
Persentase mencapai 100% pada 8 MSP terdapat pada media MS + 2,4-D 2 mg/l +
adenin 0.25 mg/l dan media MS + 2,4-D 2 mg/l + kinetin 0.25 mg/l pada bagian
staminoidia. Pada eksplan petal media yang menginisiasi kalus 100% terdapat
pada media MS + 2,4-D 2 mg/l + adenin 0.25 mg/l dan MS + 2,4-D 2 mg/l +
[image:33.612.106.494.221.657.2]kinetin 0.25 mg/l.
Tabel 5. Persentase Eksplan Berkalus Percobaan Kedua pada 4 MSP dan 8 MSP
Sub
Percobaan Bagian Bunga Perlakuan
Persentase Eksplan Berkalus
4 MSP 8 MSP
Sub Percobaan
2.1
Staminoid
K2 67% (47/70) 74% (52/70) P2 76% (53/70) 89% (62/70) K3 93% (74/80) 94% (75/80) P7 76% (72/95) 89% (85/95)
Petal
K2 63% (44/70) 91% (64/70) P2 68% (44/65) 100% (65/65) K3 63% (50/80) 95% (57/60) P7 45% (36/80) 96% (77/80)
Sub Percobaan
2.2
Staminoid
K2 96% (77/80) 100% (79/79) P2 90% (54/60) 95% (57/60) K3 85% (47/55) 87% (48/55)
P7 93% (84/90) 100% (90/90)
Petal
K2 87% (39/45) 100% (45/45) P2 66% (46/70) 99% (69/70) K3 71% (32/45) 100% (43/43) P7 38% (23/60) 95% (57/60)
Sub Percobaan
2.3
Staminoid
K2 91% (73/80) 98% (78/80) P2 98% (88/90) 100% (89/89) K3 97% (68/70) 99% (68/69) P7 99% (89/90) 99% (87/88)
Petal
K2 92% (55/60) 100% (60/46) P2 40% (28/70) 100% (70/70) K3 66% (43/65) 100% (65/65) P7 48% (38/80) 99% (79/80)
22
Pada sub percobaan 2.3, media MS + picloram 1.1 mg/l + adenin 0.25
mg/l pada percobaan ini dapat menghasilkan persentase berkalus 100% saat 8
MSP pada bagian staminoidia. Sedangkan pada bagian petal hampir seluruh media
menghasilkan kalus sebesar 100% pada 8 MSP.
Hal ini menunjukan bahwa hampir seluruh media kombinasi dapat
menginisiasi kalus dengan baik pada berbagai eksplan bunga, meskipun bahan
pemadat, jenis botol, dan sukrosa yang digunakan berbeda. Perbedaan respon
dapat disebabkan oleh perbedaan hormon pada masing-masing organ dan fase
fisiologis pada saat pengambilan eksplan (Winarsih et al., 2002).
Adanya perbedaan persentase ekplan berkalus pada percobaan pertama
dengan percobaan kedua diduga karena adanya perbedaan selang waktu subkultur.
Pada percobaan pertama, eksplan disubkultur setiap 2 minggu sekali saat awal
inisiasi kalus, sehingga banyak eksplan yang tidak tumbuh. Menurut Wiendi et al.
(1992) penurunan daya regenerasi dapat perjadi karena subkultur yang berulang.
Hal ini dapat terjadi karena adanya perubahan epigenetik dari sel yang
dikulturkan. Sehingga sel-sel yang tidak kompeten bisa kehilangan daya
totipotensinya. Pada dua percobaan tersebut dapat diperoleh bahwa saat inisiasi
kalus sebaiknya lama waktu subkultur 4 minggu sekali. Setelah kalusnya cukup
besar, intensitas subkulturnya ditingkatkan menjadi 2 minggu sekali.
Respon pertumbuhan kalus dapat juga disebabkan karena pengaruh zat
pengatur tumbuh yang diberikan media. Menurut Wiendi et al. (1992) auksin
(2,4-D dan picloram) merupakan zat pengatur tumbuh utama yang mempengaruhi
pertumbuhan kalus. Pada tanaman dikotil kisaran auksin yang diberikan berkisar
pada konsentrasi 4.0-14.0 M.
Warna Kalus
Kalus memiliki warna putih kekuningan saat pertama kali tumbuh. Secara
berangsur-angsur kalus yang berwarna putih kekuningan berubah menjadi
kecoklatan (browning) kemudian menghitam dan tidak berkembang. Pada 4
hingga 8 MSP persentase kalus yang browning semakin meningkat. Pada Gambar
5 menunjukan terdapat perbedaan warna kalus yang terjadi saat kalus tumbuh
Gambar 5. Warna Kalus. Warna Kalus Putih Kekuningan (kiri) dan Kalus Browning (kanan) pada 8 MSP
Kalus yang diharapkan adalah kalus yang berwarna putih kekuningan.
Menurut Handayani (2008) pada tanaman kedelai, embrio somatik muncul pada
media yang mengandung 2,4-D cenderung mempunyai struktur friabel/remah,
berwarna kuning-hijau transparan. Pada penelitian ini diperoleh bahwa persentase
kalus berwarna putih kekuningan (Lampiran 4) terbesar pada sub percobaan 2.1,
terdapat pada media MS + 2,4-D 2 mg/l dan kinetin 0.25 mg/l pada bagian bunga
petal dan staminoidia. Persentase kalus putih kekuningan terbesar terdapat pada
staminoidia sebesar 72% pada 4 MSP dan menurun menjadi 27% pada 8 MSP.
Respon bagian petal pada media yang sama menghasilkan persentase tertinggi
sebesar 98% pada 4 MSP dan menurun hingga 61% pada 8 MSP.
Pada sub percobaan 2.2 media MS + 2,4-D 2 mg/l dan kinetin 0.25 mg/l
tersebut menghasilkan persentase kalus berwarna putih kuning hingga 100% baik
pada bagian staminoidia maupun petal pada 4 MSP dan 8 MSP. Pada sub
percobaan 2.3 media tersebut memiliki persentase kalus berwarna putih kuning
serbesar 90% pada staminoidia dan 100% pada petal saat 8 MSP.
Warna kalus selain putih kekuningan juga terdapat warna kalus kecoklatan
atau browning (Lampiran 5). Pada sub percobaan 2.1 persentase kalus browning
2-77% pada 4 MSP dan 39-92% pada 8 MSP. Pada petal persentase kalus
browning terbesar terdapat pada media MS + picloram 1.1 mg/l + kinetin 0.25
mg/l yaitu sebesar 92%. Pada staminoidia sebesar 88% pada media MS + 2,4-D 2
mg/l + adenin 0.25 mg/l.
Pada sub percobaan 2.2 browning yang dihasilkan terdapat pada kisaran
24
+ adenin 0.25 mg/l merupakan media yang menghasilkan warna browning
terbesar sebesar 91% pada staminoidia dan 94% pada media MS + picloram
1.1 mg/l + adenin 0.25 mg/l bagian petal. Begitu pula pada sub percobaan 2.3
media tersebut menyebabkan browning sebesar 99% pada bagian petal. Pada
staminoidia sebesar 79% pada media kombinasi MS + picloram 1.1 mg/l + kinetin
0.25 mg/l. Persentase kalus browning yang dihasilkan pada media ini sekitar
13-71% pada 4 MSP dan 0-99% pada 8 MSP.
Handayani (2008) juga memaparkan tingginya konsentrasi 2,4-D (90.05
µM) pada kedelai menyebabkan terjadinya perubahan kalus menjadi coklat. Pada
percobaan ini, sub percobaan 2.2 menghasilkan persentase kalus browning paling
kecil yaitu 0% pada 4 MSP maupun 8 MSP dengan menggunakan media MS
ditambah dengan 2,4-D 2 mg/l (9.05 µM) dan kinetin 0.25 mg/l.
Wiendi et al. (1992) memaparkan bahwa auksin jenis 2,4-D dan picloram
merupakan herbisida untuk gulma berdaun lebar. Pemakaian auksin tersebut pada
tanaman dikotil harus dalam konsentrasi lebih rendah pada monokotil. Konsentrasi auksin pada tanaman dikotil antara 4.0-14.0 M. Pada penelitian ini
2,4-D 9.05 µ M ternyata menginduksi persentase browning lebih kecil 0-91%
dibandingkan picloram 4.56 µM pada kisaran 38-99% pada 8 MSP. Hal ini
menunjukan terdapat perbedaan respon browning pada jenis auksin yang berbeda.
Wiendi et al. (1992) juga mengatakan bahwa selain konsentrasi ZPT, jenis ZPT
yang digunakan juga memberikan respon yang berbeda pada tanaman.
Wiendi et al. (1992) menyatakan browning dapat dicegah dengan
meningkatkan intensitas subkultur baik pada media yang sama atau media pada
konsentrasi auksin yang lebih rendah. Tingginya persentase browning
menunjukan bahwa waktu subkultur sebaiknya dilakukan lebih sering yaitu dari
4 minggu sekali menjadi 2 minggu sekali.
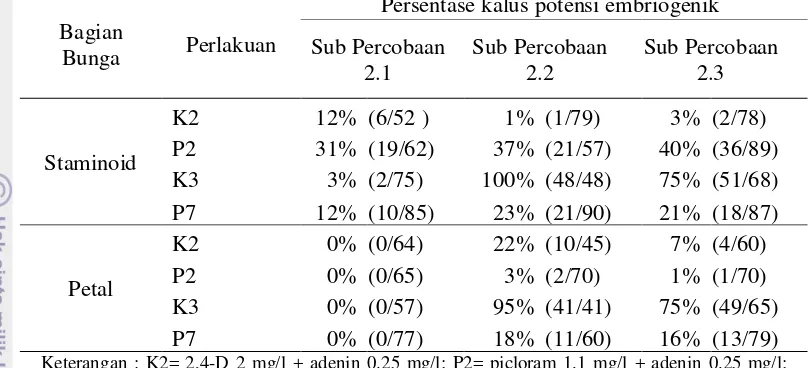
Persentase Kalus Berpotensi Embriogenik
Embrio somatik akan diperoleh jika kalus atau sel yang digunakan bersifat
embriogenik. Kalus embriogenik dicirikan oleh sel yang berukuran kecil,
sitoplasma padat, inti besar, vakuola kecil-kecil dan mengandung butir pati
berpotensi embriogenik yang diperoleh pada bagian staminoidia. Kalus memiliki
warna putih kekuningan, remah dan bernodul. Pada penelitian Winarsih et al.
(2002) kalus yang embriogenik pada tanaman kakao adalah yang berwarna putih
kekuningan, halus, berbentuk nodul dan mengkilat.
Gambar 6. Kalus Embriogenik pada Staminoidia saat 8 MSP dengan Perbesaran 40x.
Data pada Tabel 6, menunjukan bahwa persentase kalus berpotensi
embriogenik pada sub percobaan 2.1 antara 0-31%. Persentase kalus terbesar
diperoleh dari staminoidia pada media MS + picloram 1.1 mg/l + adenin 0.25 mg/l
yaitu sebesar 31%. Pada bagian petal tidak terdapat kalus yang berpotensi
embriogenik.
Persentase kalus berpotensi embriogenik paling tinggi terdapat pada sub
percobaan 2.2 1-100%, pada percobaan 2.3 antara 1-75%. Media kombinasi yang
menghasilkan kalus potensi embriogenik paling besar terdapat pada media MS +
2,4-D 2 mg/l + kinetin 0.25 mg/l. Pada sub percobaan 2.2 media tersebut mampu
menginisiasi kalus potensi embriogenik hingga 100% pada staminoidia dan 95%
pada petal. Pada sub percobaan 2.3 media ini menghasilkan kalus potensi
26
Tabel 6. Persentase Kalus Potensi Embriogenik pada Tiga Sub Percobaan
Bagian
Bunga Perlakuan
Persentase kalus potensi embriogenik
Sub Percobaan 2.1
Sub Percobaan 2.2
Sub Percobaan 2.3
Staminoid
K2 12% (6/52 ) 1% (1/79) 3% (2/78) P2 31% (19/62) 37% (21/57) 40% (36/89) K3 3% (2/75) 100% (48/48) 75% (51/68)
P7 12% (10/85) 23% (21/90) 21% (18/87)
Petal
K2 0% (0/64) 22% (10/45) 7% (4/60) P2 0% (0/65) 3% (2/70) 1% (1/70) K3 0% (0/57) 95% (41/41) 75% (49/65) P7 0% (0/77) 18% (11/60) 16% (13/79)
Keterangan : K2= 2,4-D 2 mg/l + adenin 0.25 mg/l; P2= picloram 1.1 mg/l + adenin 0.25 mg/l; K3=2,4-D 2 mg/l + kinetin 0.25 mg/l; P7= picloram 1.1 mg/l + kinetin 0.25 mg/l. ( ) menunjukan jumlah kalus potensi embriogenik per jumlah eksplan berkalus.
Hal ini menunjukan bahwa pada bahan pemadat seperti phytagel dan
sukrosa p.a. mampu menghasilkan persentase kalus berpotensi embriogenik paling
besar. Selain itu penggunaan botol kultur yang besar memberikan pengaruh yang
lebih baik. Menurut Wiendi et al. (1992), volume botol kultur kadang-kadang
dapat mempengaruhi pertumbuhan dan morfogenesis pada jaringan di dalamnya.
Hal ini mungkin disebabkan karena CO2, etilen dan gas-gas lainnya di udara yang terdapat dalam botol.
Embrio Somatik
Embriogenesis somatik merupakan suatu proses dimana sel somatik (baik
haploid maupun diploid) berkembang membentuk tumbuhan baru melalui tahap
perkembangan embrio yang spesifik tanpa melalui fusi gamet (Purnamaningsih,
2002). Menurut Maximova et al. (2005) embrio somatik pada kakao muncul pada
tipe kalus yang terdiri dari sel yang bulat, berwarna kecoklatan dan friable. Pada
penelitian ini embrio terbentuk pada 8 minggu setelah perlakuan (MSP). Tahapan
embrio somatik pada penelitian ini terbantuk dan teramati dari fase globular
Gambar 7. Perkembangan Pembentukan Embrio Somatik pada Staminoidia. A. Bunga Kakao, B. Bagian Bunga Staminoidia, C. Kalus Berpotensi Embriogenik, D. Embrio pada Fase Globular, E. Embrio pada Fase Heart (Hati), F. Embrio pada Fase Kotiledon.
Data pada Tabel 6, menunjukan bahwa embrio berhasil diinduksi pada
media MS ditambah picloram 1.1 mg/l dan kinetin 0.25 mg/l selama 8 MSP
dengan selang subkultur 4 minggu sekali. Persentase embrio adalah 1.1% (dari 90
eksplan yang ditanam, dihasilkan 1 eksplan yang terinisiasi embrio). Persentase
terbentuknya embrio terhadap kalus potensi embriogenik sebesar 4.8% (dari 21
kalus berpotensi embriogenik, dihasilkan 1 kalus yang terinisiasi embrio). Jumlah
embrio yang terinisiasi pada penelitian ini sebanyak 4 embrio dalam 1 eksplan
(Gambar 8). Embrio muncul pada sub percobaan 2.2 yaitu media dibuat dengan
menggunakan botol besar dengan bahan pemadat phytagel 2 g/l, serta
menggunakan sukrosa p.a. 30 g/l. Pada penelitian ini kalus embriogenik yang
terbentuk hanya 1 dari 21 kalus potensi embriogenik yang berkembang
[image:39.612.127.485.78.275.2]membentuk embrio.
Gambar 8. Embrio yang Terinisiasi dalam Satu Eksplan. Tanpa Perbesaran Mikroskop (kiri) dan dengan Mikroskop Perbesaran 40x (kanan)
A B C
[image:39.612.148.469.563.677.2]28
Tabel 6. Persentase Embrio Somatik Kakao pada Bagian Bunga Staminoidia pada Sub Percobaan 2.2 saat 8 Minggu Setelah Perlakuan (MSP)
Perlakuan
Persentase ekplan terinisiasi embrio
(%)
Persentase kalus potensi embriogenik
yang terinisiasi embrio (%) 2,4-D 2 mg/l + adenin 0.25 mg/l, 0.0 (0/79)* 0.0 (0/1 )** Picloram 1.1 mg/l + adenin 0.25 mg/l 0.0 (0/57)* 0.0 (0/21)** 2,4-D 2 mg/l + kinetin 0.25 mg/l, 0.0 (0/48)* 0.0 (0/48)** Picloram 1.1 mg/l + kinetin 0.25 mg/l 1.1 (1/90)* 4.8 (1/21)**
Keteramgan : ()* menunjukan jumlah eksplan terinisiasi embrio per jumlah eksplan yang steril.
()** menunjukan jumlah kalus potensi embriogenik yang terinisiasi embrio per total
jumlah kalus berpotensi embriogenik.
Kecilnya persentase embrio somatik menunjukan bahwa peluang
mendapatkan embrio pada tanaman kakao sangat rendah, terdapat banyak faktor
yang mempengaruhi pembentukan embrio somatik. Menurut Purnamaningsih
(2002), beberapa faktor yang mempengaruhi pembentukan embrio somatik adalah
jenis eksplan, sumber nitrogen dan gula, serta zat pengatur tumbuh.
Pada penelitian ini embrio somatik hanya tumbuh pada bagian bunga
staminoidia. Berbeda pada penelitian Winarsih et al. (2003) dan Avivi et al.
(2010) bagian petal menghasilkan embrio lebih banyak dibandingkan dengan
staminoidia dan antera. Hal ini diduga dapat terjadi karena adanya pengaruh
genotipe. Pada kakao UAH embrio dapat terinisiasi pada media MS + picloram
1.1 mg/l dan kinetin 0.25 mg/l.
A
B
C
KESIMPULAN DAN SARAN
Kesimpulan
Bagian bunga kakao Uper Amazon Hybrid (UAH) yang mengasilkan
embrio adalah bagian bunga staminoidia. Embrio terinisiasi pada 8 minggu setelah
perlakuan, dengan besar persentase embrio somatik 1.1% (dari 90 eksplan yang
ditanam, dihasilkan 1 eksplan yang terinisiasi embrio somatik) atau 4.8% (dari 21
kalus berpotensi embriogenik, dihasilkan 1 kalus yang terinisiasi embrio somatik).
Jumlah embrio somatik yang dihasilkan sebanyak 4 embrio somatik dari satu
ekplan yang terinisiasi. Media yang digunakan dalam menginduksi embrio
somatik kakao adalah media MS dengan kombinasi picloram 1.1 mg/l dan kinetin
0.25 mg/l dengan menggunakan bahan pemadat phytagel 2 g/l dan sukrosa p.a 30
g/l.
Saran
Pada penelitian berikutnya sebaiknya pengamatan dilakukan setiap 2
minggu sekali. Subkultur saat inisiasi awal dilakukan pada minggu ke-4 dan
setelah kalus cukup besar dilakukan setiap 2 minggu sekali. Semakin kecil ukuran
botol yang digunakan maka intensitas subkultur ditingkatkan. Jika memungkinkan
pengamatan struktur sel dilakukan secara mikroskopis pada setiap eksplan. Selain
itu, jumlah eksplan yang digunakan sebaiknya lebih banyak yaitu lebih dari 100
eksplan per perlakuan sebagai cadangan jika terjadi kontaminasi. Setelah embrio
terinisiasi, isolasi bagian embrio dan pisahkan dari kalus yang lain sehingga
DAFTAR PUSTAKA
Ammirato, P.V. 1983. Embryogenesis. p. 83-113. In : D.A. Evans, W.R. Sharp, P.V. Amiranto, and Y. Yamada. (Eds.). Handbook of Plant Cell Culture. Vol. 1. Macmillan Publlishing Company. New York.
Avivi, S., A. Prowoto, dan R. F. Octami. 2010. Regenerasi embriogenesis somatik pada beberapa klon. J. Agron. Indonesia 38(2):138-143.
Bakti, C. 2005. Embriogenesis Sonmatik Jahe (Zingiber officinale Rosc.) pada Berbagai Zat Pengatur Tumbuh. Thesis. Sekolah Pasca Sarjana, Institut Pertanian Bogor. 47 hal.
Belarmino, M. M. and J. R. Gonzales. 2008. Somatic embryogenesis and plant regeneration in purple food yam (Dioscorea alata L.). Annals of Tropical Researce. Phillippines. 30(2):22-33.
Departemen Pertanian. 2011. Basis Data Statistik Indonesia. http//deptan.go.id. [13 Desember 2011].
Direktorat Jendral Perkebunan. 2012. Luas Area dan Jumlah Produksi Kakao Indonesia. http://ditjenbun.deptan.go.id/. [17 Januari 2012].
Evans, D. E., J.O.D. Coleman, and A. Kearns. 2003. Plant Cell Culture. Bios Scientific Publisher. London. 194 p.
Fakhrina, Z. 2010. Induksi Embrio Somatik pada Padi Varietas IR64 dan Situ Bagendit. Skipsi. Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Bogor. 11 hal.
Figuera, A., and L. Alemanno. 2004. Theobroma Cacao, p 639-668. In : Litz R. E. Biotechnology of Fruit and Nut Crops. CABI. USA. Biotechnology in Agricultur Series No. 29. 707 p.
Forum Kemitraan Kakao Berkelanjutan. 2008. Program Gerakan Percepatan Revitalisasi Kakaonasional (GERNAS). www.aciar.gov.au. [13 Desember 2011].
Gamborg, O.L. 1991. Kalus dan Kultur Sel, hal 1-13. Dalam : L. R. Wetter dan F. Constabel (Eds.). Metode Kultur jaringan Tanaman (diterjemahkan dari : Plant Tissue Culture Methods, penarjemah : M. B. Widianto). Penerbit ITB. Bandung. 191 hal.
Handayani, T. 2008. Potensi Embriogenesis Beberapa Genotipe Kedelai Toleran dan Peka Naungan. Skipsi. Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Bogor. 69 hal.
Hartmann, H.T. and D. E. Kester. 1997. Plant Propagation Principles and Practice, 6th edition. Prentice Hall, inc. New Jersey. 727 p
Hendaryanto D.P.S. dan A. Wijayani. 1994. Teknik Kultur Jaringan, Pengenalan dan Petunjuk Perbanyakan Tanaman Secara Vegetatif-Modern. Kanisius. Yogyakarta.
Maximova S. N., A. Young, S. Pishak, C. Miller, A. Traore, and M.J. Guiltinan. 2005. Integrted sistem for propagation of Theobroma cacao L., p. 209-227. In S. M. Jain and P. K. Gupta (Eds.). Protocol for Somatic Embryogenesis in Woody Plants. Springer. Netherlands.
Priadi, D. dan E. Sudarmonowati. 2006. Pengaruh komposisi media dan ukuran eksplan terhadap pembentukan kalus embriogenik beberapa genotipe lokal ubi kayu (Manihot esculenta Crantz). Biodiversitas 7(3):269-272.
Purba, H.I. 2009. Pengaruh Jenis Media Dan Konsentrasi Picloram Terhadap Induksi Embrio Somatik Manggis (Garcinia mangostana L.). Skripsi. Program Studi Hortikultura, Institut Pertanian Bogor. 39 hal.
Purnamaningsih, R. 2002. Regenerasi tanaman melalui embriogenesis somatik dan beberapa gen yang mengendalikannya. Buletin AgroBio 5(2):51-58).
Puslitkoka. 2004. Panduan Lengkap Budidaya Kakao. PT Agromedia Pustaka. Jakarta. 328 hal.
Roostika, I., V.N. Arief, dan N. Sunarlim. 2009. Regenerasi kultur lengkeng dataran rendah cv. Diamond river melalui embriogenesis somatik. J. Hort. vol 19(1):14-22.
Santoso, U. dan F. Nursandi. 2003. Kultur Jaringan Tanaman. UMM Press. Malang. 191 hal.
Sari D.Y.I, Halimi E.S dan Hayati R. 2005. Pembentukan kalus dan katekin tanaman gambir (Uncari gambir Roxb.) secara in vitro dari eksplan daun melaui pemberian 2,4-D dan kinetin. Tanaman tropika 8(1): 22-29.
Sudarmonowati, E. dan Henshaw G.G. 1996. The use of picloram and dicamba to introduce somatic embryogenesis in cassava. Annales Bogoriensis Vol. 4 No. 1.
32
Vanjrabhaya, M. 1988. Embryogenesis. Proceeding of The