ASAL TAMAN NASIONAL KEPULAUAN WAKATOBI
DAN IMPLIKASI PENGELOLAANNYA
ENDAR MARRASKURANTO
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Kajian Bioprospeksi Spons Laut Asal Taman Nasional Kepulauan Wakatobi dan Implikasi Pengelolaannya adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2010
direction of YUSLI WARDIATNO, ZAIRION, and SINGGIH WIBOWO.
Most of eastern region of Indonesian waters are located in biodiversity center of coral triangle ecoregion and Wakatobi Archipelago Marine Park is one of them. Marine sponge is one of prominent benthic marine organism in coral reef. It is one of the prolific sources of pharmacological bioactive substances that are useful for drug development. About 30% of potentially natural products for drug lead had been isolated from marine sponges. Their bioactive substance has varied potential such as anticancer, antivirus, antimicrobe, anti-inflamation, and antimalaria. Based on preliminary cytotoxic assay on sponge crude extracts in 2008, marine sponge extracts (code W-19-08 and W-36-08) were among marine sponges collected from Wakatobi Archipelago National Park that had the potential of its cytotoxic activity. The purpose of this research were to examine sponge crude extract Lethal Concentration (LC50) and to describe human breast cancer cell line T47D morphology after treating with crude extract. The in vitro
cytotoxicity assay was conducted using MTT method. In vitro cytotoxicity assay showed that marine sponge extracts W-19-08 and W-36-08 bioactivity were considered to medium with the LC50 value of 156.14 and 97.04 ppm, respectively. The cell line T47D morphology showed that these extracts were considered of having cytostatic properties.
YUSLI WARDIATNO, ZAIRION, dan SINGGIH WIBOWO.
Salah satu proses penemuan dan pengembangan obat yang bersumber dari produk alami laut adalah bioprospeksi. Kajian bioprospeksi mengungkapkan potensi farmakologi yang dimiliki produk alami laut yang dihasilkan avertebrata laut. Spons laut yang diklasifikasikan ke dalam Filum Porifera dan bersama karang batu serta karang lunak termasuk hewan bentos yang menonjol di terumbu karang. Potensi farmakologi metabolit sekunder yang dihasilkan spons beragam mulai dari sitotoksik, antikanker, antivirus, antiinflamasi, antimikroba, dan lain-lain. Penelitian potensi farmakologi dari spons laut terus dilakukan sejak hampir tiga dekade sebelumnya penelitian potensi farmakologi spons laut asal Indonesia pertama kali dilakukan.
Pada tahun 2008, dua sampel spons asal Taman Nasional Kepulauan Wakatobi diketahui memiliki potensi sitotoksik terhadap sel lestari kanker payudara T47D. Kedua sampel dengan kode W-19-08 dan W-36-08 diperoleh dari perairan Pulau Wangi-wangi dan Pulau Hoga. Persentase kematian sel uji akibat perlakuan dengan ekstrak kasar kedua sampel menunjukkan potensi sitotoksik yang tinggi dimiliki kedua sampel. Sejak saat itu, kedua sampel dalam bentuk biota utuh tersimpan di dalam pendingin beku -20oC selama 16 bulan.
Taman Nasional Kepulauan Wakatobi merupakan salah satu taman nasional yang memiliki keanekaragaman hayati laut yang tinggi karena posisi geografisnya yang terletak berdekatan dengan pusat segitiga terumbu karang. Perairan Taman Nasional Kepulauan Wakatobi (TNK Wakatobi) terletak di pertemuan Laut Banda dan Laut Flores. Di sebelah utara dibatasi dengan Pulau Buton dan Laut Banda. Di sebelah selatan dibatasi oleh Laut Flores, di sebelah timur dibatasi oleh Laut Banda, dan sebelah barat dibatasi Pulau Buton dan Laut Flores.
Tujuan dari penelitian ini adalah: (1) Menjajaki potensi sumberdaya spons yang diperoleh di Taman Nasional Wakatobi dibandingkan dengan potensi sumberdaya spons di perairan kawasan Indonesia Timur yang lain; (2) Menghitung konsentrasi ekstrak kasar yang mengakibatkan kematian 50% sel lestari kanker payudara T47D (Lethal Concentration/LC50) dan menerangkan respon sel uji tersebut terhadap ekstrak kasar sampel spons W-19-08 dan W-36-08; (3) Menerangkan respon sel lestari kanker payudara T47D terhadap ekstrak kasar sampel spons W-19-08 dan W-36-08 berdasarkan perubahan morfologi sel uji sebelum dan sesudah perlakuan dengan ekstrak kasar spons.
absorbansi sumuran sel uji ditambah ekstrak spons, dan absorbansi sumuran kontrol media. Lethal Concentration (LC50) ekstrak kasar spons dihitung dengan analisis probit. Persentase kematian sel uji dikonversi menjadi angka probit berdasarkan tabel probit (Lampiran 1). Plot log konsentrasi versus angka probit masing-masing sebagai sumbu x dan sumbu y digunakan untuk mencari nilai LC50 dari persamaan regresi yang diperoleh. Pengamatan perubahan morfologi sel uji dilakukan di bawah mikroskop inverted dengan pembesaran 100x.
Hasil perhitungan Lethal concentration (LC50) ekstrak kasar diperoleh spons W-19-08 memiliki LC50 sebesar 156,14 ppm dan spons W-36-08 sebesar 97,04 ppm. Hasil ini menunjukkan bahwa ekstrak kedua spons memiliki bioaktivitas dengan kategori menengah. Pengamatan mikroskopis sel uji T47D menunjukkan telah terjadi perubahan morfologi sel uji akibat perlakuan dengan ekstrak kedua sampel spons dan berdasarkan hasil bioaktivitasnya, ekstrak kedua sampel spons dikategorikan bersifat sitostatik.
Keanekaragaman spons laut di kawasan timur perairan Indonesia sangat tinggi. Data sekunder menunjukkan terdapat 100 spesies spons teridentifikasi di dua lokasi terumbu di Sampela dan Pulau Hoga perairan Kepulauan Wakatobi. Fakta ini menunjukkan bahwa potensi sumberdaya spons yang terdapat di perairan Kepulauan Wakatobi sangat tinggi.
Tingginya potensi sumberdaya spons di perairan Kepulauan Wakatobi dan kandungan metabolit sekundernya yang memiliki nilai ekonomis tinggi sebagai bahan baku obat, pengelolaan sumberdaya spons yang tepat sangat diperlukan agar ketersediaan sumberdayanya tidak punah dan pemanfaatannya tetap dapat meningkatkan perlindungan dan konservasi keanekaragaman hayati. Oleh karena itu, kemajuan yang telah dicapai bidang bioteknologi laut sangat perlu dikembangkan di Indonesia melalui kolaborasi dengan ilmuwan-ilmuwan terkait di luar negeri.
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah;
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
ASAL TAMAN NASIONAL KEPULAUAN WAKATOBI
DAN IMPLIKASI PENGELOLAANNYA
ENDAR MARRASKURANTO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Pengelolaan Sumberdaya Pesisir dan Lautan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
segala karunia dan rahmat-Nya sehingga Penulis dapat menyelesaikan tesis dengan judul “Kajian Bioprospeksi Spons Laut Asal Taman Nasional Kepulauan Wakatobi dan Implikasi Pengelolaannya”.
Penelitian dan proses penulisan tesis ini dapat berlangsung dengan baik atas prakarsa berbagai pihak, untuk itu penulis ingin mengucapkan terima kasih yang tak terhingga kepada:
1. Dr. Ir. Yusli Wardiatno, M.Sc., Ir. Zairion, M.Sc, dan Dr. Ir. Singgih Wibowo, MS selaku komisi pembimbing yang telah membantu dan memberikan perhatian, arahan, tenaga, waktu, dan saran dalam penyusunan tesis ini.
2. Dr. Ir. Etty Riani, M.Sc selaku Dosen Penguji Luar Komisi yang telah memberikan masukan dan saran demi kesempurnaan tesis ini.
3. Prof. Dr. Ir. Mennofatria Boer, DEA sebagai Ketua Program Studi Pengelolaan Pesisir dan Lautan beserta staf pengajar yang telah memberikan pengetahuan dan pengalaman terkait pengelolaan pesisir dan lautan.
4. Staf sekretariat SPL (Pak Zainal, Mbak Ola, Dindin dan Aji) yang banyak membantu selama masa perkuliahan di SPL-IPB.
5. Dr. Ir. Yusli Wardiatno, M.Sc selaku Ketua Departemen MSP dan penanggung jawab Program SPL Sandwich COREMAP II-ADB.
6. COREMAP II – ADB, Kementerian Kelautan dan Perikanan atas kesempatan
pendidikan dan beasiswa yang diberikan.
7. Prof. Dr. H. Hari Eko Irianto selaku Kepala Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan (BBRP2B-KP) serta Dr. Ekowati Chasanah, M.Sc selaku Kepala Kelompok Peneliti Bioteknologi atas ijinnya untuk mengikuti program beasiswa ini.
8. Bapak H. Sutarno, Ibu Hj. Sri Supeni, SH dan adik yang telah memberikan doa dan bantuan moril.
9. Istriku tercinta dr. Santi Sinarwati, anak-anakku tersayang Daffa dan Radhit yang selalu memberikan motivasi, semangat, dan doa dalam mengikuti pendidikan ini.
10. Rekan-rekan SPL-Sandwich COREMAP II-ADB atas kebersamaannya
selama mengikuti masa studi.
11. Rekan-rekan peneliti dan teknisi di laboratorium Instrumen dan Bioteknologi BBRP2B-KP Jakarta atas kerjasama dan dukungan yang diberikan selama penelitian.
Penulis juga ingin mengucapkan terima kasih kepada Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan atas pembiayaan penelitian dalam rangka penyusunan tesis ini melalui APBN TA 2009.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari sempurna. Oleh karena itu, masukan berupa kritik dan saran yang sifatnya membangun sangat diharapkan untuk kesempurnaan tulisan ini. Semoga karya ilmiah ini dapat memberikan manfaat.
Bogor, Oktober 2010
xxi
xxiii
Halaman
1 Posisi geografis, jumlah, kode, dan prediksi taksonomi spons
yang dikoleksi di stasiun 1 dan stasiun 4 ... 27
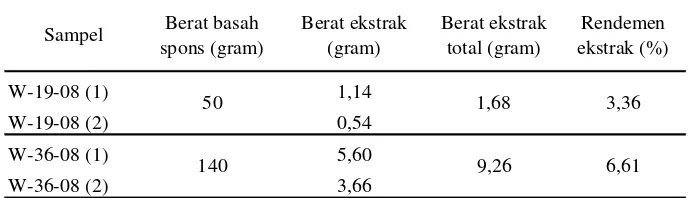
2 Nilai berat sampel basah (gram) dan rendemen ekstrak kasar (%)
sampel spons W-19-08 dan W-36-08 ... 30
3 Nilai LC50 ekstrak kasar sponge W-19-08 dan W-36-08
xxv
Halaman
1 Gambaran umum tahap bioprospeksi yang ideal ... 8
2 Lokasi penelitian di Kepulauan Wakatobi ... 20
3 Jumlah sampel spons dikoleksi di stasiun 1 (barat Pulau Wangi-
wangi) dan stasiun 4 (selatan Pulau Hoga) ... 25
4 Spons W-19-08 di dalam air (A) dan di atas permukaan air (B) ... 28
5 Spons W-36-08 di dalam air (A) dan di atas permukaan air (B) ... 28
6 Persentase kematian sel lestari tumor T47D setelah perlakuan dengan ekstrak kasar spons W-19-08 dan W-36-08 (Keterangan:
(---) batas persentase kematian 50%) ... 31
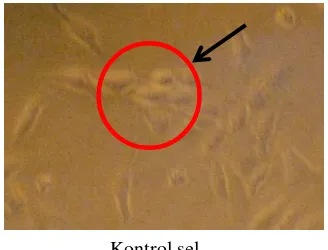
7 Sel uji T47D tanpa perlakuan ekstrak kasar (sel normal T47D
ditunjukkan dalam lingkaran merah) ... 34
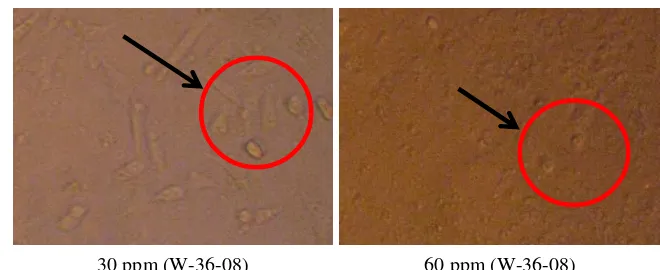
8 Sel uji T47D setelah perlakuan ekstrak kasar W-19-08 pada konsentrasi 30 ppm dan 60 ppm (morfologi sel uji T47D yang
berubah ditunjukkan dalam lingkaran merah) ... 35
9 Sel uji T47D setelah perlakuan ekstrak kasar W-36-08 pada konsentrasi 30 ppm dan 60 ppm (morfologi sel uji T47D yang
berubah ditunjukkan dalam lingkaran merah) ... 35
10 Pembentukan kompleks formazan sel uji T47D dengan pereaksi MTT pada perlakuan ekstrak W-19-08 konsentrasi 30 ppm
(ditunjukkan dalam lingkaran merah) ... 36
11 Pembentukan kompleks formazan sel uji T47D dengan pereaksi MTT pada perlakuan ekstrak W-36-08 konsentrasi 30 ppm
xxvii
Halaman
1 Spesies-spesies spons dan metabolit sekunder yang dihasilkan ... 49
2 Spesies-spesies spons dan metabolit sekundernya yang memasuki
tahap uji pra-klinis dan klinis ... 51
3 Tabel probit ... 52
4 Contoh perhitungan rendemen ekstrak kasar spons W-19-08
dan W-36-08 ... 53
5 Contoh perhitungan persentase kematian dan penentuan LC50 ... 54
1. PENDAHULUAN
1.1Latar Belakang
Sebagian besar perairan kawasan timur Indonesia terletak di pusat
keanekaragaman hayati ekosistem segitiga terumbu karang atau coral triangle. Batas coral triangle meliputi enam negara antara lain Filipina, Malaysia, Indonesia, Timor Leste, Papua Nugini, dan Kepulauan Solomon. Hal ini
menjadikan Indonesia sebagai salah satu negara dengan kekayaan
keanekaragaman hayati laut tertinggi di dunia dan juga didukung kenyataan
bahwa laut Indonesia memiliki hamparan terumbu karang terluas di dunia, yaitu
51.020 km2 atau sekitar 17,95% dari luas seluruh terumbu karang di dunia dan
kedudukannya merupakan pusat segitiga terumbu karang dunia (coral triangle). Salah satu wilayah di kawasan Indonesia Timur yang termasuk ke dalam segitiga
terumbu karang adalah perairan Taman Nasional Kepulauan Wakatobi.
Terumbu karang mempunyai fungsi yang sangat penting dalam mendukung
keberadaan biota yang berasosiasi, baik ikan maupun biota lainnya. Ekosistem
terumbu karang secara ekologis mempunyai fungsi sebagai tempat untuk mencari
makan (feeding ground), daerah asuhan (nursery ground) dan daerah pemijahan (spawning ground) bagi ikan dan organisme pendukung yang ada di ekosistem tersebut. Terumbu karang yang sehat tidak hanya menyediakan manfaat bagi ikan
dan biota laut lainnya yang berasosiasi dengannya tetapi terumbu karang juga
menyediakan barang dan jasa yang bermanfaat bagi kesejahteraan manusia, antara
lain perikanan, pariwisata, nilai-nilai keindahan dan budaya. Terumbu karang juga
merupakan sumber makanan dan bahan baku substansi bioaktif yang berguna
dalam farmasi dan kedokteran (Dahuri 2003). Diperkirakan lebih dari 35.000
spesies biota laut memiliki potensi sebagai penghasil bahan obat-obatan,
sementara yang dimanfaatkan baru sekitar 5.000 spesies (Dahuri 2000).
Secara ekologis, substansi bioaktif adalah metabolit sekunder yang
dikeluarkan oleh biota laut dan berfungsi meningkatkan kemampuan bertahan
hidup suatu organisme dan dapat pula berfungsi sebagai senjata kimia untuk
merupakan produk alami laut yang memiliki aktivitas biologis dan berpotensi
untuk dapat diaplikasikan dalam bidang farmasi dan kedokteran terutama sebagai
obat, bahan baku obat (drug leads), dan kosmetika.
Beberapa biota laut yang menghasilkan metabolit sekunder sebagian besar
didominasi oleh avertebrata laut antara lain spons, karang lunak, bryozoa,
tunikata, dan lain-lain (Hunt & Vincent 2006). Munro et al. (1999) mengungkapkan filum Porifera merupakan filum yang paling banyak diteliti
potensi metabolit sekundernya, kemudian diikuti Cnidaria, Moluska, Chordata
(subfilum Urochordata) dan Ekinodermata. Spons laut merupakan hewan yang
paling dominan dalam filum Porifera, bersama karang batu dan karang lunak,
spons laut termasuk bentos yang menonjol di terumbu karang.
Metabolit sekunder yang dihasilkan oleh spons laut memiliki golongan
senyawa kimia antara lain alkaloid, terpenoid, fenol, peptida, poliketida dan
lain-lain (Thakur & Müller 2004). Potensi biologis yang dimilikinya pun sangat
beragam antara lain bersifat sitotoksik, antitumor/antikanker, antivirus, antimikroba, antiinflamasi, antimalaria, dan lain-lain (Guyot 2000). Penelitian
potensi metabolit sekunder yang dimiliki spons asal perairan di Indonesia sudah
dimulai sejak hampir tiga dekade yang lalu saat Corley et al. (1988) mengisolasi laulimalida dan isolaulimalida dari spons Hyatella sp. yang memiliki sifat sitotoksik. Senyawa antioksidan berhasil diidentifikasi dari spons Callyspongia
sp. asal Kepulauan Seribu (Hanani et al. 2005). Handayani et al. (2006) melaporkan spons laut Axinella carteri Dendy asal Pulau Babi, Sumatera Barat memiliki potensi sebagai larvasida. Gabungan tujuh senyawa toksik berhasil
diidentifikasi dari ekstrak spons laut yang berasal dari perairan Gili Sulat,
Lombok (Swantara et al. 2007). Setyowati et al. (2007) telah berhasil mengisolasi senyawa bersifat sitotoksik terhadap sel lestari tumor myeloma dari ekstrak spons
Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan
Perikanan (BBRP2B-KP) melaksanakan Riset Isolasi dan Uji Farmakologi
Senyawa Bioaktif dari Biota Laut pada tahun 2008. Salah satu judul sub kegiatan
risetnya yaitu Uji Hayati (in vitro) Bioaktivitas Bahan Aktif dari Makroinvertebrata Laut dan Isolasi Simbionnya dengan penekanan pada
Karakterisasi Kimia dan Bioaktivitas Senyawa Bioaktif dari Makroinvertebrata
Laut. Salah satu lokasi dalam kegiatan ini adalah Taman Nasional Kepulauan
Wakatobi dan dilaksanakan pada bulan April 2008 dan mengambil lokasi di 4
(empat) pulau, yaitu pulau Wangi-wangi, pulau Kapota, pulau Kaledupa, dan
pulau Hoga. Kegiatan tersebut berhasil mengumpulkan 73 sampel avertebrata laut
yang tersebar di keempat stasiun (BRKP 2009).
Hasil Monitoring Kesehatan Terumbu Karang Kabupaten Wakatobi tahun
2007 mengungkapkan bahwa persentase tutupan rata-rata karang hidup di perairan
Pulau Wangi-wangi dan Pulau Kaledupa masing-masing sebesar 55,42% dan
44,63%, sehingga kondisi terumbu karang di perairan tersebut masing-masing
termasuk kedalam kategori baik dan sedang (CRITC COREMAP II-LIPI 2007).
Berdasarkan uraian di atas, kajian ini masih memiliki peluang yang terbuka
lebar mengingat tingginya keanekaragaman hayati laut yang dimiliki Taman
Nasional Kepulauan Wakatobi, keanekaragaman kandungan metabolit sekunder
dari spons laut dan potensi terumbu karang di wilayah segitiga terumbu karang
dunia (coral triangle).
1.2 Perumusan Masalah
Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan
Perikanan (BBRP2B-KP) melaksanakan Riset Isolasi dan Uji Farmakologi
Senyawa Bioaktif dari Biota Laut pada tahun 2008. Tim peneliti bioteknologi
melakukan sampling sebanyak 73 sampel avertebrata laut di 4 (empat) stasiun di
dalam kawasan Taman Nasional Kepulauan Wakatobi. Keempat stasiun tersebut
antara lain pesisir Pulau Kapota, Tanjung Sombano Kaledupa, pesisir Pulau Hoga,
menunjukkan terdapat 20 sampel karang lunak, satu sampel ascidian, 51 sampel
spons, dan satu biota tak teridentifikasi (BRKP 2009).
Tahap awal kajian bioprospeksi bertujuan memperoleh sejumlah kecil
sampel yang memiliki aktivitas biologis dan disebut sebagai hit. Sejumlah 51 sampel ekstrak kasar spons diuji aktivitas biologis sitotoksik dan hasilnya
menunjukkan 2 sampel spons kode W-19-08 dan W-36-08, yang masing-masing
diperoleh dari Pulau Wangi-wangi (stasiun 1) dan Pulau Hoga (stasiun 4),
memiliki aktivitas yang toksik terhadap 2 sel lestari tumor leher rahim (HeLa) dan
payudara (T47D) dengan persentase kematian sel uji masing-masing ekstrak kasar
spons 87,52% dan 100% serta 58,45% dan 100% pada konsentrasi ekstrak 30 ppm
(BRKP 2009).
Kedua sampel spons disimpan dalam keadaan utuh (spesimen biota laut) di
dalam pendingin beku -20oC selama 16 bulan. Upaya untuk menelusuri kembali
aktivitas biologis kedua sampel dilakukan untuk mengetahui apakah terdapat
perbedaan setelah masa penyimpanan.
1.3 Tujuan dan Manfaat Penelitian
Penelitian difokuskan pada dua sampel spons W-19-08 dan W-36-08 yang
masing-masing diperoleh di Pulau Wangi-wangi dan Pulau Hoga dan memiliki
tujuan:
1. Menjajaki potensi sumberdaya spons yang diperoleh di Taman Nasional
Wakatobi dibandingkan dengan potensi sumberdaya spons di perairan
kawasan Indonesia Timur yang lain.
2. Menghitung konsentrasi ekstrak kasar yang mengakibatkan kematian 50% sel
lestari kanker payudara T47D (Lethal Concentration/LC50) dan menerangkan respon sel uji tersebut terhadap ekstrak kasar sampel spons 19-08 dan
W-36-08.
3. Menerangkan respon sel lestari kanker payudara T47D terhadap ekstrak kasar
sampel spons W-19-08 dan W-36-08 berdasarkan perubahan morfologi sel uji
Selain dapat bermanfaat sebagai pengetahuan dan pendukung bagi para
pengelola pesisir dan lautan pentingnya sumberdaya spons yang terdapat di
terumbu karang, penelitian ini diharapkan juga dapat menghasilkan dan
menambah informasi mengenai:
1. Aktivitas ekstrak spons yang telah melalui masa simpan selama 1 tahun;
2. TINJAUAN PUSTAKA
2.1 Bioprospeksi
Bioprospeksi didefinisikan sebagai pengambilan biota laut yang akan
digunakan untuk proses penemuan, pengembangan dan jika memungkinkan,
penyediaan bahan obat secara komersial (Hunt & Vincent 2006). Kajian
bioprospeksi merupakan bagian dari penelitian penemuan dan pengembangan obat
dari bahan alami laut dan bioprospeksi merupakan tahap awal dalam proses
penemuan tersebut (Dewi et al. 2008).
Bioprospeksi melibatkan pengambilan ribuan biota laut telah dikoleksi dari
habitatnya untuk memenuhi harapan dapat menemukan substansi bioaktif baru
dan mengembangkannya menjadi obat. Pengambilan awal biasanya bersifat luas
dan spekulatif untuk memaksimalkan kemungkinan ditemukannya substansi
bioaktif atau metabolit sekunder. Proses selanjutnya melibatkan proses ekstraksi
dan maserasi untuk memperoleh ekstrak. Kemudian ekstrak yang diperoleh dari
sekian banyak sampel bahkan ribuan diuji aktivitas biologisnya terhadap berbagai
target penyakit menular atau kanker melalui uji in vitro untuk memperoleh sejumlah kecil sampel yang memiliki aktivitas biologis dan disebut sebagai hit. Untuk mengembangkan hit menjadi kandidat untuk uji pra-klinis atau disebut sebagai lead, ekstrak dianalisis lebih lanjut melalui proses fraksinasi, isolasi, dan kromatografi untuk penentuan struktur senyawa aktif. Proses ini dapat saja
membutuhkan sekitar 50.000 – 100.000 senyawa aktif untuk memperoleh satu
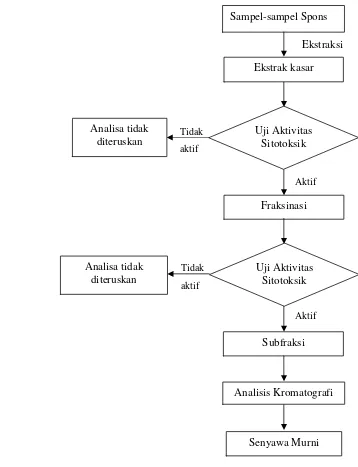
lead (Hunt & Vincent 2006). Kunci utama bioprospeksi adalah menyediakan ribuan senyawa yang memiliki keunikan struktur kimia dan bioaktivitas (Kursar et al. 2007 in Dewi et al. 2008). Secara umum, proses ini dapat terlihat pada Gambar 1.
Hingga saat ini, sebagian besar sumber substansi bioaktif adalah metabolit
sekunder yang berasal dari avertebrata laut yang bertubuh lunak dan menempel
pada substrat (sessile), seperti Porifera (spons), Cnidaria (ubur-ubur, karang batu, karang lunak, anemone laut), dan Urochordata (ascidian). Hal ini disebabkan
menggunakan tangan pada saat penyelaman dari habitat dengan keanekaragaman
yang tinggi, dangkal dan perairan yang hangat seperti terumbu karang (Hunt &
Vincent 2006).
Gambar 1 Gambaran umum tahap bioprospeksi yang ideal.
Proses di atas disebut juga sebagai bioassay-guided fractionation atau fraksinasi dipandu uji bioaktivitas menggunakan sel lestari kanker atau pun biota
lain seperti Artemia salina (brine shrimp lethality test atau BSLT). Proses utama
Aktif
Tidak
aktif Tidak
aktif
Senyawa Murni Sampel-sampel Spons
Analisis Kromatografi Subfraksi Fraksinasi Ekstrak kasar
Uji Aktivitas Sitotoksik Analisa tidak
diteruskan
Uji Aktivitas Sitotoksik Analisa tidak
diteruskan
Ekstraksi
yang terlibat dalam proses ini adalah ekstraksi, fraksinasi dan kromatografi.
Ekstraksi dilakukan dengan melakukan perendaman atau maserasi sampel biota
laut di dalam larutan kimia seperti alkohol untuk memperoleh ekstrak kasar.
Ekstraksi didefinisikan sebagai suatu metode pemisahan atau pengambilan secara
selektif zat terlarut dari campuran yang didasarkan pada distribusi zat terlarut
dengan perbandingan tertentu antara dua pelarut yang tidak saling bercampur.
Faktor-faktor yang berpengaruh terhadap proses ekstraksi adalah lama ekstraksi,
suhu, dan jenis pelarut yang digunakan (Triyulianti 2009). Metode ekstraksi yang
digunakan pada penelitian ini adalah metode fase organik karena dalam prosesnya
digunakan pelarut organik yaitu berupa alkohol teknis (96%) atau etanol.
Fraksinasi adalah suatu teknik untuk memisahkan komponen organik dan
ionik (larut dalam air) dalam suatu senyawa campuran menjadi dua fraksi berbeda
(Parenrengi 1999 in Triyulianti 2009). Fraksinasi merupakan kegiatan awal pemurnian dalam tahapan isolasi dan melibatkan uji bioaktivitas untuk
menentukan apakah ekstrak memiliki aktivitas atau tidak.
Kromatografi adalah teknik analisis kimia bagi pemisahan komponen
senyawa yang masih bercampur. Kromatografi analitik digunakan untuk
menentukan identitas dan konsentrasi molekul pada suatu senyawa campuran,
dimana pemisahan kromatografi dapat memurnikan sejumlah besar sampel
molekul. Teknik kromatografi untuk pemisahan suatu campuran dipengaruhi oleh
sifat kelarutan dari komponen yang bersangkutan didalam eluennya, sifat interaksi
komponen dengan bahan yang terdapat dalam fase diam dan interaksi pelarut
dengan fase gerak (Harborne 1987; Gritter et al. 1991).
Tahap pengembangan, senyawa aktif lead memasuki standar uji pra-klinis dan klinis. Untuk menyiapkan uji ini, biasanya akan dibutuhkan bahan baku
tambahan yaitu sampel biota laut. Proses pengambilan kembali (re-collection) sampel spesies yang merupakan kandidat atau lead (Hunt & Vincent 2006). Pada tahap kedua ini kuantitas sampel (per spesies) yang diambil akan lebih banyak
daripada kuantitas sampel pada tahap pertama. Hal ini disebabkan:
1. sangat rendahnya konsentrasi alami senyawa aktif yang terkandung sehingga
untuk menjamin jumlah ekstrak pada proses pengembangan obat lanjutan (uji
klinis) (Mendola 2003);
2. kompleksnya struktur kimia metabolit sekunder sehingga mempersulit
industri farmasi dalam usahanya melakukan sintesis dan berpotensial tidak
ekonomis (Faulkner 2000).
Memasuki uji pra-klinis, senyawa aktif lead akan diuji melalui uji in vivo
dengan menggunakan hewan dalam serangkaian tesnya. Sedangkan dalam uji
klinis, senyawa aktif lead langsung diuji coba pada manusia. Biasanya satu dari 50 lead akan menghasilkan obat yang dapat dipasarkan (Hunt & Vincent 2006).
Kedua proses baik penemuan maupun pengembangan membutuhkan waktu
15 tahun, diantaranya fase penelitian dan klinis membutuhkan waktu hingga 13
tahun ditambah fase akhir yang sifatnya administratif selama dua sampai tiga
tahun (UNU-IAS Report 2005 in Dewi et al. 2008). Proses pengembangan obat baru sangat mahal dan membutuhkan dana sebesar 900 juta US dollar atau
melebihi 1 miliar US dollar untuk menghasilkan suatu produk mulai dari konsep
hingga ke pasar (Hunt & Vincent 2006; Lindberg 2006 in Dewi et al. 2008).
3.2 Biologi Spons
Menurut Pechenik (2005), spons diklasifikasikan ke dalam kingdom
Animalia atau hewan, subkingdom Metazoa, dan filum Porifera. Spons
dimasukkan ke dalam filum Porifera dikarenakan seluruh tubuhnya yang berpori
dimana dalam bahasa Latin “Porifera” berarti memiliki pori. Spons memiliki 3 pembagian dasar struktur tubuh, yaitu asconoid, syconoid dan leuconoid.
Sebagian besar spesies spons memiliki struktur tubuh leuconoid. Berdasarkan
komposisi kimia dan morfologinya filum Porifera terbagi atas tiga kelas, yaitu:
Calcarea, Demospongiae, dan Hexactinellida. Namun saat ini telah diketahui kelas
ke-4 dari filum ini, yaitu: Sclerospongia terdiri atas 16 spesies yang memiliki
struktur leuconoid dan hanya terdapat di bagian gua-gua dan celah-celah terumbu
karang yang gelap (Pechenik 2005).
Kelas Demospongiae adalah kelompok spons yang paling dominan di antara
organismenya sangat banyak. Umumnya berbentuk masif dan berwarna cerah
dengan sistem saluran yang rumit, dihubungkan dengan kamar-kamar yang
mengandung cambuk kecil yang berbentuk bundar. Spikulanya ada yang terdiri
dari silikat dan ada beberapa spikulanya hanya terdiri dari serat spongin, serat
kolagen atau tanpa spikula yaitu terdapat dalam famili Dictyoceratida,
Dendroceratida, dan Verongida.
Spons pada umumnya berwarna putih atau abu-abu, dan ada pula yang
berwarna kuning, jingga, merah, atau hijau. Spons yang berwarna hijau biasanya
disebabkan oleh adanya alga simbiotik yang disebut sebagai zoochlorellae yang terdapat didalamnya (Romimohtarto & Juwana 1999). Warna spons tersebut
sebagian dipengaruhi oleh fotosintesis mikrosimbionnya. Mikrosimbion spons
pada umumnya adalah cyanophyta (sianobakteria dan eukariot alga seperti
dinoflagellata atau zooxanthellae). Beberapa spons memiliki warna yang berbeda walaupun termasuk dalam jenis yang sama. Beberapa spons juga memiliki warna
dalam tubuh yang berbeda dengan pigmentasi luar tubuhnya. Spons yang hidup di
lingkungan yang gelap akan berbeda warnanya dengan spons sejenis yang hidup
pada lingkungan yang cerah (Wilkinson 1980).
Walaupun terlihat tidak memiliki pertahanan, spesies-spesies ini jarang
dimakan oleh beberapa jenis ikan dan kepiting. Kenyataan inilah yang dijadikan
acuan bahwa spesies-spesies tersebut memiliki semacam mekanisme pertahanan
diri (Castro & Huber 2007). Sebagian besar spons laut yang bersifat sessile
mengandung sistem imun yang primitif dan menghasilkan senyawa kimia yang
bersifat toksik sebagai bentuk pertahanan dirinya. Beberapa senyawa ini memiliki
aktivitas farmakologi karena interaksi mereka dengan reseptor dan enzim yang
spesifik (Amador et al. 2003).
Spons termasuk hewan filter feeder yang menyaring air yang memasuki tubuhnya melalui pori-pori kecil yang disebut sebagai ostia sebagai tempat masuknya air laut untuk bersirkulasi melalui sejumlah saluran atau kanal dimana
partikel-partikel plankton dan organik akan dimakan dan disaring keluar kembali.
Pori-pori tersebut dan sistem kanal tersebut berfungsi untuk menyaring air setiap
yang terdapat pada bagian dalam mesohyl, sejajar dengan spongocoel. Sel ini memiliki struktur yang menyerupai protozoa choanoflagelata. Choanocyte
berbentuk bulat, dengan satu ujungnya terhubung ke mesohyl. Partikel-partikel
plankton dan organik tersebut di pompa masuk menuju ruang makan yang lebih
besar yang disebut sebagai spongocoel. Sel choanocyte berperan dalam
pergerakan air dalam tubuh spons dan untuk menyediakan makanan (Rupert &
Barnes 1994). Pada bagian atas tubuhnya terdapat kanal yang berfungsi sebagai
tempat keluarnya air yang disebut osculum dengan jumlah yang lebih sedikit daripada ostia.
Proses interaksi antara spons dan mikroba simbionnya belum sepenuhnya
diketahui. Beberapa teori mengemukakan bahwa proses rekrutmen mikroba
simbion dilakukan spons pada saat proses filter feeder. Dikatakan bahwa spons mengandung komunitas mikroba yang beragam dan kompleks, yang secara
genetik berbeda dengan mikroba yang ditemukan di plankton dan sedimen laut
(Fieseler et al. 2004 in Sjögren 2006).Spons juga bersimbiosis dengan beberapa mikroorganisme, seperti bakteri. Menurut Friedrich et al. (2001) in Thakur & Müller (2004), diperkirakan sekitar 40% biomassa beberapa spons disusun oleh
komunitas bakteri. Bakteri-bakteri tersebut merupakan simbion dalam tubuh
spons. Beberapa penelitian menunjukkan bahwa simbion-simbion tersebut
memiliki peranan dalam produksi senyawa bioaktif yang berfungsi dalam adaptasi
ekologi spons (Proksch et al. 2003; Thakur & Müller 2004; Ismet 2007).
Beberapa penelitian menunjukkan bahwa selain mikroba episimbion yang
melekat pada bagian permukaan spons selama masa pertumbuhan, beberapa
bakteri dan fungi diturunkan secara genetis dalam tubuh spons (Ismet 2007).
Telah diketahui bahwa mikroba simbion spons memiliki peran menjaga kestabilan
pertumbuhan dan kesehatan spons. Simbion-simbion tersebut memiliki peran
penting dalam penyediaan energi dan nutrisi (Ismet 2007), beberapa spons hidup
secara simbiosis dengan sianobakteria, yang berfungsi sebagai penyuplai nutrien
melalui proses fotosintesis (Hoffmann et al. 2005 in Sjögren 2006), menghambat mikroba patogen, serta sebagai pelindung terhadap radiasi sinar UV dan penghasil
berasosiasi dengan spons inilah yang menjadi penghasil senyawa metabolit
sekunder yang mempunyai aktivitas biologis (Proksch 2003).
Secara ekologis, spons yang mengalami tekanan evolusi yang intensif dari
kompetitor, yang mengancam dengan mengungguli pertumbuhannya, meracuni,
menginfeksi atau memangsa telah mempersenjatai dengan senjata kimia yang
potensial. Kajian pada kimia ekologi spons berhasil mengungkap bahwa metabolit
sekunder yang dikandung spons tidak hanya berperan pada beragam peran
metabolisme tetapi juga dalam menghadapi lingkungan hidupnya (Thakur &
Müller 2004).
Spons bereproduksi secara aseksual dan seksual. Secara aseksual, spons
bereproduksi melalui proses fragmentasi atau dengan menghasilkan gemmules
atau budding. Secara seksual, spons bereproduksi dengan menghasilkan sel telur dan sel sperma. Sebagian besar spesies spons bersifat hermafrodit dimana satu
individu menghasilkan 2 jenis gamet (sel telur dan sel sperma) sekaligus.
Proses pembuahan dan perkembangan awal embrio biasanya terjadi secara
internal. Sebagian besar spons menahan embrionya yang sedang berkembang
secara internal selama beberapa waktu, kemudian melepaskannya keluar melalui
oscula sebagai larva yang berenang. Sedangkan sebagian kecil spons bersifat
oviparous dimana sel telur yang baru dibuahi dilepaskan ke kolom air laut dan embrio akan berkembang secara eksternal.
Larva spons biasanya tidak mampu untuk mencari makan dan berenang
selama kurang dari 24 jam sebelum mengalami metamorfosis. Sebelum
kehilangan kemampuannya untuk berenang, larva menempel pada suatu substrat.
Selama proses metamorfosis lanjutan, sel-sel dari berbagai bagian embrio
mengalami perpindahan dan perubahan menjadi spons dewasa secara
besar-besaran (Pechenik 2005).
3.3 Produk Alami Laut dari Spons
Pengertian produk alami laut merupakan salah satu cabang ilmu kimia yang
membahas tentang senyawa-senyawa kimia yang terdapat dalam bahan alam laut
jumpai seperti karbohidrat, lipid, vitamin dan asam nukleat termasuk bahan alam,
namun ahli kimia memberikan arti yang lebih sempit tentang istilah bahan alam
yakni senyawa kimia yang berkaitan dengan metabolit sekunder saja seperti
alkaloid, terpenoid, golongan fenol, feromon dan sebagainya. Produk alami laut
dikelompokkan atas: (1) sumber biokimia yang mudah diperoleh dalam jumlah
yang besar dan barangkali dapat diubah menjadi bahan-bahan yang lebih
berharga; (2) substansi bioaktif yang termasuk (a) senyawa antimikroba, (b)
senyawa aktif secara fisiologis (sinyal kimia), (c) senyawa aktif secara
farmakologi dan (d) senyawa sitotoksik dan antitumor; dan (3) racun laut (Ismet
2007).
Metabolit terbagi atas dua tipe yaitu primer dan sekunder. Metabolit primer
memiliki peranan penting dalam pertumbuhan dan kehidupan bagi semua
makhluk hidup dan terbentuk melalui serangkaian reaksi metabolit yang terbatas.
Metabolit primer berperan sebagai bahan penyusun dalam pembuatan
makromolekul seperti protein, asam nukleat, karbohidrat dan lipid. Sedangkan
metabolit sekunder tidak memiliki peran penting dalam kehidupan makhluk hidup
dan terbentuk dari metabolit primer (Gudbjarnason 1999). Definisi metabolit
sekunder yang berlaku secara luas yaitu senyawa yang terbentuk di dalam tubuh
makhluk hidup tetapi tidak ikut berperan dalam proses metabolisme yang
diperlukan dalam kehidupan dan perkembangan makhluk hidup (Hedner 2007).
Kebanyakan metabolit sekunder berfungsi meningkatkan kemampuan bertahan
hidup suatu organisme dan dapat berfungsi, contohnya, sebagai senjata kimia
untuk melawan bakteri, jamur, serangga dan hewan yang besar. Fungsi metabolit
sekunder inilah yang dikatakan memiliki aktivitas biologis atau disebut juga
sebagai substansi bioaktif. Sebagian besar produk alami yang menjadi perhatian
industri farmasi adalah metabolit sekunder tetapi ada pula yang tertarik pada
produk metabolit primer seperti beragam lipid laut, enzim dan heteropolisakarida
yang kompleks (Gudbjarnason 1999).
Karakteristik senyawa metabolit sekunder adalah (Ismet 2007):
a. Masing-masing senyawa metabolit sekunder dihasilkan oleh beberapa
b. Metabolit sekunder bukanlah merupakan senyawa yang esensial bagi
pertumbuhan dan reproduksi;
c. Pembentukan senyawa metabolit sekunder sangat dipengaruhi oleh kondisi
lingkungan organisme;
d. Beberapa senyawa metabolit sekunder yang dihasilkan organisme merupakan
kelompok senyawa yang berkerabat (memiliki kesamaan struktur);
e. Beberapa organisme membentuk berbagai substansi yang berbeda sebagai
metabolit sekundernya;
f. Regulasi biosintesis metabolit sekunder sangat berbeda dengan metabolit
primer;
g. Produksi metabolit sekunder seringkali dapat terjadi secara berlebihan jika
terkait dengan produksi metabolit primer;
h. Produk metabolit sekunder dapat berasal dari hasil samping produk metabolit
primer, atau disebut juga berasal dari beberapa produk intermedia yang
terakumulasi selama metabolisme primer.
Spons merupakan salah satu avertebrata laut yang memiliki kekayaan
kandungan metabolit sekunder yang bersifat bioaktif. Dalam tinjauannya, Lee et al. (2001) menyajikan 89 spesies spons yang menghasilkan metabolit sekunder yang beragam. Spesies yang sama menghasilkan beberapa metabolit sekunder dan
aktivitas biologis yang berbeda. Metabolit sekunder yang dihasilkan oleh spons
laut memiliki golongan senyawa kimia antara lain alkaloid, terpenoid, fenol,
peptida, poliketida dan lain-lain (Thakur & Müller 2004). Potensi biologis yang
dimilikinya pun sangat beragam antara lain inhibitor enzim, inhibitor pembelahan
sel, anti-virus, antifungi, antiparasit, insektisida, antimikroba, anti-inflamasi,
antitumor, sitotoksik atau kardiovaskular. Spons yang kandungan metabolit
sekundernya memiliki aktivitas biologis sitotoksik berjumlah 27 spesies,
diantaranya berasal dari genus yang sama yaitu Haliclona, Jaspis, Petrosia,
Spongia, dan Verongia. Selengkapnya dapat dilihat pada Lampiran 1.
Hingga tahun 2004 tercatat 16 senyawa metabolit sekunder yang bersumber
dari spons layak memasuki tahap uji pra-klinis dan klinis. Senyawa-senyawa
metabolit sekunder yang diisolasi dari beberapa spons. Tahap uji yang dilakukan
bervariasi dari uji sebagai obat anti asma, anti osteoarthritis, antikanker,
anti-inflamasi, anti malaria, anti TB (tuberculosis), dan lain-lain. Bahkan beberapa metabolit sekunder telah memperoleh ijin untuk dijadikan bahan pengembangan
obat oleh beberapa perusahaan farmasi. Salah satu metabolit sekunder, yaitu
Manzamin A, diperoleh dari spons Haliclona sp. yang diperoleh di perairan Indonesia. Selengkapnya daftar tersebut dapat dilihat pada Lampiran 2. Metabolit
sekunder yang paling menonjol diisolasi dari spons adalah halichondrin B.
Halichondrin B adalah senyawa polieter dan merupakan salah satu senyawa
metabolit sekunder paling aktif diantara senyawa halichondrin B yang lain.
Senyawa halichondrin B yang lain adalah isohomohalichondrin B dan
homohalichondrin B. Isolasi halichondrin B pertama kali dilaporkan di Jepang
pada tahun 1986 dari spons Halichondria okadai. Metabolit ini juga pernah diisolasi dari beberapa spons yang hidup di wilayah Samudera Pasifik dan
Samudera Hindia, spesies spons tersebut antara lain Axinella sp. di Pasifik Barat,
Phakellia carteri di Samudera Hindia bagian timur dan Lissodendoryx sp. di lautan dalam lepas Pantai Timur di South Island, Selandia Baru (Newman & Cragg 2004).
Beberapa peneliti Indonesia juga telah melakukan isolasi dan identifikasi
struktur senyawa metabolit sekunder dari spons di perairan Indonesia. Senyawa
antioksidan berhasil diidentifikasi dari spons Callyspongia sp. asal Kepulauan Seribu (Hanani et al. 2005). Handayani et al. (2006) melaporkan spons laut
Axinella carteri Dendy asal Pulau Babi, Sumatera Barat memiliki potensi sebagai larvasida. Gabungan 7 (tujuh) senyawa toksik berhasil diidentifikasi dari ekstrak
spons laut yang berasal dari perairan Gili Sulat, Lombok (Swantara et al. 2007). Setyowati et al. (2007) telah berhasil mengisolasi senyawa bersifat sitotoksik terhadap sel lestari tumor myeloma dari ekstrak spons Kaliapsis sp. asal Pulau
Menjangan, Bali Barat. Senyawa antibakteri pun telah berhasil diisolasi dan
toksisitas ekstrak metanol spons Geodia sp. asal Pantai Wediombo, Yogyakarta (Isnansetyo et al. 2009).
2.4 Taman Nasional Kepulauan Wakatobi
Berdasarkan UU No. 5 tahun 1990 tentang Konservasi Sumber Daya Alam
Hayati dan Ekosistemnya, Taman Nasional didefinisikan sebagai kawasan
pelestarian alam yang mempunyai ekosistem asli, dikelola dengan sistem zonasi
yang dimanfaatkan untuk tujuan penelitian, ilmu pengetahuan, pendidikan,
menunjang budidaya, pariwisata dan rekreasi. Kawasan Kepulauan Wakatobi dan
perairan disekitarnya seluas ± 1.390.000 Ha ditunjuk sebagai Taman Nasional
berdasarkan SK Menhut No. 393/Kpts-VI/1996, tanggal 30 Juli 1996 dan telah
ditetapkan berdasarkan SK Menhut No. 7651/Kpts-II/2002, tanggal 19 Agustus
2002, terdiri dari 4 (empat) pulau besar (P. Wangi-Wangi, P. Kaledupa, P. Tomia
dan P. Binongko) yang terbagi menjadi 5 (lima) kecamatan dalam wilayah
administratif Kabupaten Wakatobi, Provinsi Sulawesi Tenggara. Luas
masing-masing pulau tersebut adalah Pulau Wangi-wangi (156,5 km2), Pulau Kaledupa
(64,8 km2), Pulau Tomia (52,4 km2), dan Pulau Binongko (98,7 km2) (Dirjen
PHKA Dephut2007).
Sampel yang digunakan dalam penelitian ini berasal dari lokasi
pengambilan di perairan Pulau Wangi-wangi dan Pulau Hoga. Berdasarkan
Permenhut Nomor: P.56/Menhut-II/2006 tanggal 29 Agustus 2006 tentang
Pedoman Zonasi Taman Nasional, kedua lokasi pengambilan sampel termasuk
kedalam zona pemanfaatan (Dirjen PHKA Dephut2007).
Gambaran umum pulau-pulau tempat diambilnya dua sampel spons yang
digunakan dalam penelitian ini dideskripsikan sebagai berikut (CRITC
COREMAP II-LIPI 2007; Rudianto & Santoso 2008):
1. P. Wangi-wangi, bagian selatan bertopografi datar hingga curam. Pulau ini memiliki luas 156,5 km2, berbentuk memanjang kearah barat laut dengan lebar
sekitar 14,36 km dan panjang 16,09 km. pada rataan pulau ini sendiri terdiri
dari beberapa pulau antara lain Pulau Kapota, Pulau Oroho, dan Pulau
dengan panjang sekitar 250 m – 1,5 km. Pulau Wangi-wangi mempunyai
profil yang hampir sama dengan pulau-pulau di sekitarnya yaitu rataan
terumbu umumnya sebagian besar landai dengan rataan terumbu lebar dengan
dasar perairan karang mati dan pasir lumpuran. Kedalaman perairannya
berkisar 5 – 1.884 m. Lereng terumbu mempunyai kemiringan antara 60-70o
dengan pertumbuhan karang hidup yang tidak begitu rapat sampai kedalaman
40 meter. Kecepatan arus perairan P. Wangi-Wangi 0,09 – 0,6 m/detik. Musim
timur gelombang sangat kuat dipengaruhi angin Laut Banda, sedang musim
barat tidak terlalu besar karena terhalang P. Buton.
2. P. Hoga, pulau ini merupakan salah satu pulau yang termasuk kedalam gugusan pulau dalam rataan terumbu Pulau Kaledupa dan berada di sebelah
timur Pulau Kaledupa. Perairan Pulau Hoga bagian selatan telah ditetapkan
sebagai daerah perlindungan (no fishing zone) oleh masyarakat. Secara geografis, Pulau Hoga memiliki kemiripan dengan Pulau Wangi-wangi,
perairan bagian timurnya dipengaruhi langsung oleh Laut Banda dan sebelah
3. METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian meliputi kegiatan penapisan substansi bioaktif dari beberapa
spons laut. Kegiatan ekplorasi penapisan substansi bioaktif terdiri atas kegiatan
pengambilan sampel spons, lalu ekstraksi, dan maserasi. Kegiatan pengambilan
sampel spons telah dilakukan pada tanggal 25-26 April 2008 oleh tim peneliti dari
Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan di
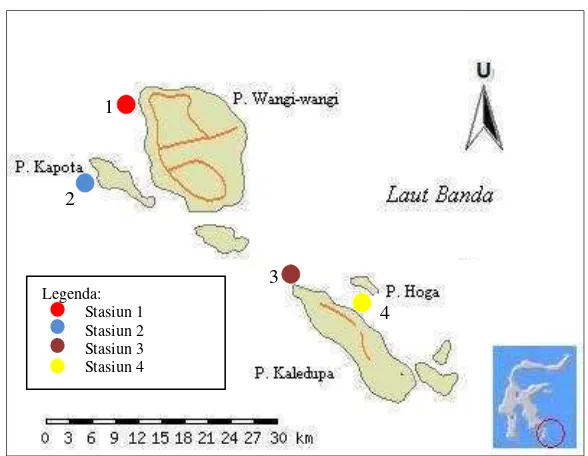
perairan Taman Nasional Wakatobi, Sulawesi Tenggara (Gambar 2). Analisa
laboratorium dilaksanakan di Laboratorium Balai Besar Riset Pengolahan Produk
dan Bioteknologi Kelautan dan Perikanan. Penelitian ini dilaksanakan dari awal
bulan Agustus 2009 hingga akhir bulan Juni 2010.
Pengambilan sampel spons dilakukan di 4 (empat) stasiun berbeda perairan
Taman Nasional Laut Kepulauan Wakatobi pada bulan April 2008. Namun
sampel yang digunakan dalam penelitian ini adalah sampel-sampel yang berasal
dari Pulau Wangi-wangi (stasiun 1) dan Pulau Hoga (stasiun 4). Hasil Studi
Baseline Ekologi Wakatobi dengan metode Line Intercept Transect (LIT) oleh CRITC COREMAP-LIPI (2006) menunjukkan tutupan rata-rata spons sebesar
3,71% dan 3,48% masing-masing di pulau Wangi-wangi dan Kaledupa.
Pengambilan sampel dilakukan dengan melakukan penyelaman pada
kedalaman antara 3-10 m di tiap stasiun tersebut. Berat spons yang diambil adalah
antara 50 – 550 gram bergantung pada kelimpahan spons di habitatnya. Spons
didokumentasikan di habitatnya dan di atas permukaan air serta dilakukan
pengamatan makroskopis setiap spons dengan menggunakan literatur yang ada
(Colin & Arneson 1995).
Sampel tersebut kemudian langsung dibersihkan, dipotong kecil dan
dipreservasi dengan menggunakan pelarut alkohol teknis dalam wadah plastik
tahan pelarut organik dan disimpan di dalam kotak pendingin. Selanjutnya sampel
dibawa ke laboratorium instrumen Balai Besar Riset Pengolahan Produk dan
Gambar 2 Lokasi penelitian di Kepulauan Wakatobi. (Sumber: http://pssdal.bakosurtanal.go.id/)
3.2 Bahan dan Alat 3.2.1 Ekstraksi
Ekstraksi adalah suatu teknik untuk memisahkan dan mengisolasi suatu
senyawa dari suatu larutan campuran atau padatan. Ekstraksi padatan dapat
dilakukan untuk mengambil produk alami dari jaringan makhluk hidup, dengan
perendaman jaringan di dalam suatu pelarut yang memiliki kesamaan tingkat
polaritas dengan senyawa yang diinginkan. Bahan dan alat yang digunakan untuk
ekstraksi adalah sampel spons W-19-08 dan W-36-08 yang tersimpan di dalam
pendingin beku -20oC selama 16 bulan, pelarut alkohol teknis (96%), erlenmeyer,
corong Buchner, rotary evaporator, freeze dryer, kertas saring Whatman no 41, timbangan digital OHAUS Adventurer (0,0001 g), dan tabung sampel.
3.2.2 Uji Sitotoksik in vitro
Uji sitotoksik bertujuan untuk mengetahui potensi bioaktif yang terkandung
dalam ekstrak spons W-19-08 dan W-36-08 dengan menggunakan metode MTT
yang merupakan kependekan dari pereaksi (3-[4,5-dimetilthiazol-2yl]-2,5-difenil
tetrazolium bromida) sesuai Zachary (2003). Bahan dan alat yang digunakan
1
Legenda: Stasiun 1 Stasiun 2 Stasiun 3 Stasiun 4
1
2
3
dalam uji ini antara lain microplate 96-well, mikropipet, inkubator CO2, vial,
biosafety cabinet Level 2 FASTER, tabung reaksi, erlenmeyer, t-flask 25 cm3, mikroskop inverted OLYMPUS, dan mikroplate spektrofotometr reader DYNEX.
3.3 Prosedur Penelitian
3.3.1 Pengambilan Sampel
Tahapan pengambilan sampel:
1. Sampel dengan berat 50 - 550 gram diambil dengan melakukan penyelaman
pada kedalaman 3 – 10 m.
2. Beberapa bagian jaringan spons tersebut diambil atau dipotong dengan
menggunakan scalpel dan pinset, lalu dimasukkan kedalam plastik, kemudian dibawa ke permukaan air secara perlahan.
3. Sampel tersebut kemudian langsung dibersihkan, dipotong kecil dan
dimaserasi dengan menggunakan pelarut alkohol teknis dalam wadah plastik
tahan pelarut organik dan disimpan di dalam kotak pendingin.
4. Spons didokumentasikan di habitatnya dan di atas permukaan air.
Identifikasi awal sampel dilakukan dengan membandingkan foto tiap
spesies dengan pustaka yang telah ada (Colin & Arneson 1995).
3.3.2 Ekstraksi Spons
Ekstraksi dilakukan dengan metode maserasi (modifikasi Satari 1994,1995
in Triyulianti 2009) dengan sedikit modifikasi dengan tahapan sebagai berikut: 1. Spons yang telah disimpan dalam freezer ditimbang sebanyak 200 gram untuk
kemudian dipotong menjadi beberapa bagian kecil dan ditempatkan pada
erlenmeyer 250 ml.
2. Ke dalam erlenmeyer tersebut ditambahkan larutan etanol teknis hingga
sampel terendam sepenuhnya dalam larutan lalu diaduk hingga etanol meresap
ke dalam sampel.
3. Erlenmeyer ditutup dengan plastik dan simpan selama 24 jam pada suhu
4. Setelah 24 jam, larutan disaring dengan menggunakan kertas saring untuk
memisahkan suspensi padat dengan cairannya.
5. Cairannya ditampung di dalam labu takar 50 ml (ekstrak) kemudian filtrat
hasil ekstraksi dievaporasi dengan menggunakan rotary evaporator
selanjutnya dikeringkan dengan cara pengeringan beku menggunakan alat
freeze dryer.
6. Ekstrak kasar dipindahkan ke dalam botol-botol kecil dan tutup rapat,
kemudian ditimbang untuk mengetahui rendemennya.
7. Selanjutnya ekstrak disimpan di dalam lemari pendingin untuk dilakukan uji
bioaktivitasnya.
Ekstrak kasar spons ditimbang untuk mengetahui rendemen yang didapatkan
dengan rumus:
Uji sitotoksisitas dilakukan dengan metode MTT
(3-[4,5-dimetilthiazol-2yl]-2,5-difenil tetrazolium bromida) menurut Zachary (2003). Sel T47D dikultur
dalam media DMEM lengkap yang mengandung Fetal Bovine Serum (FBS) 10%
dan penisilin streptomisin 2%.
Masing-masing ekstrak spons selanjutnya diuji pada konsentrasi 30 ppm
sebanyak 3 ulangan. Dibuat pula 4 macam kontrol, yaitu : kontrol sel (100 L sel
+ 100 L media), kontrol media (200 L media), kontrol sampel (100 L ekstrak
spons + 100 L media) dan kontrol DMSO (100 L sel + 100 L konsentrasi
dan diinkubasikan kembali selama 4 jam dalam inkubator CO2. Reaksi MTT
dihentikan dengan penambahan 100 L larutan sodium dodesil sulfat (SDS) 10%,
selanjutnya mikroplat kembali diinkubasikan selama 12 jam dalam ruang gelap
pada suhu kamar. Setelah inkubasi tersebut, absorbansi tiap sumuran diukur
dengan DYNEX spektrofotometer microplate reader pada panjang gelombang 570 nm.
Penentuan persentase kematian sel dihitung berdasarkan rumus:
Kematian (%) = x 100%
Keterangan: A = Absorbansi sumuran kontrol sel (tanpa perlakuan ekstrak) B = Absorbansi sumuran kontrol media
C = Absorbansi sumuran yang diberi ekstrak uji
3.4 Analisa Data
Dalam penelitian ini digunakan dua analisis, yaitu:
1. Penentuan nilai Lethal Concentration 50 (LC50) 24 jam dihitung dengan
menggunakan analisis probit dan persamaan regresi melalui uji probit
menurut Fisher dan Yates in Triyulianti (2009). Persentase kematian sel uji dikonversi menjadi angka probit berdasarkan tabel probit (Lampiran 3). Plot
log konsentrasi versus angka probit masing-masing sebagai sumbu x dan
sumbu y digunakan untuk mencari nilai LC50 dari persamaan regresi yang
diperoleh.
2. Analisis deskriptif digunakan untuk mendeskripsikan potensi bioaktif ekstrak
kasar terhadap sel lestari tumor T47D berdasarkan hasil LC50 dan
mendeskripsikan morfologi sel lestari tumor T47D sebelum dan sesudah
4. HASIL DAN PEMBAHASAN
4.1 Kelimpahan Spons di Lokasi Sampling
Perairan Taman Nasional Kepulauan Wakatobi (TNK Wakatobi) terletak di
pertemuan Laut Banda dan Laut Flores. Di sebelah utara dibatasi dengan Pulau
Buton dan Laut Banda. Di sebelah selatan dibatasi oleh Laut Flores, di sebelah
timur dibatasi oleh Laut Banda, dan sebelah barat dibatasi Pulau Buton dan Laut
Flores. Hal ini menunjukkan bahwa perairan ini berdekatan dengan pusat
keanekaragaman hayati “coral triangle ecoregion”.
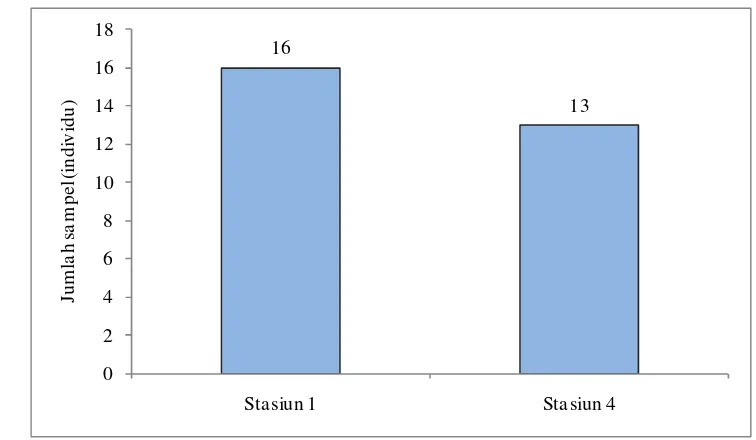
Sampel spons yang berhasil dikoleksi dari kedua lokasi (stasiun 1 dan
stasiun 4) di perairan Taman Nasional Kepulauan Wakatobi berjumlah 29 sampel.
Jumlah terbanyak, yaitu 16 buah, diperoleh di stasiun 1 desa Waha barat Pulau
Secara kualitatif, hasil identifikasi menunjukkan jumlah jenis spons yang
diperoleh di stasiun 1 adalah 16 jenis dan di stasiun 4 adalah 13 jenis. Dari hasil
pengamatan makroskopis, jenis spons yang dapat diidentifikasi awal di stasiun 1
berjumlah enam jenis antara lain Higginsia sp., Ircinia sp., Euplacella sp., Aaptos
sp., Cymbastella sp., dan Hyrtios sp. Sedangkan jenis spons di stasiun 4 yang dapat diidentifikasi berjumlah lima jenis antara lain Kallypilidon sp., Ianthella sp.,
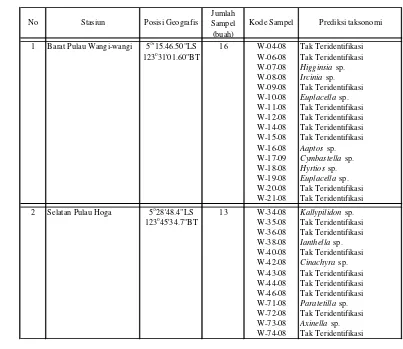
Cinachyra sp., Paratetilla sp., dan Axinella sp. Tabel 1 memperlihatkan hasil identifikasi awal jenis-jenis spons yang dikoleksi di stasiun 1 dan 4.
Jumlah sampel spons yang berhasil diperoleh di kedua stasiun terbilang
cukup banyak hal ini menunjukkan bahwa keanekaragaman spons di perairan ini
cukup tinggi secara kualitatif. Penelitian yang dilakukan oleh Bell & Smith (2004)
di dua lokasi terumbu di Sampela dan Pulau Hoga perairan Wakatobi
mengidentifikasi 100 spesies spons (58 spesies di Sampela dan 73 spesies di
Hoga) dengan 41% diantaranya spesies yang sama terbagi atas 38 famili di kedua
lokasi tersebut pada kedalaman hingga 15 m dengan total area sampling 52,5 m2.
Bell & Smith (2004) mengidentifikasi famili spons yang diperoleh di
Sampela dan Pulau Hoga dan famili spons terbanyak di kedua lokasi tersebut
adalah Famili Microcionidae dengan jumlah 10 spesies. Sedangkan ada lima
famili spons yang masing-masing hanya ditemukan satu spesies antara lain
Ciocalyptidae, Clionaidae, Geodiidae, Palcospongidae, dan Tetillidae.
Sampel yang digunakan dalam penelitian ini memiliki kode W-19-08 dan
W-36-08. Sampel W-19-08 diambil dari perairan sebelah barat Pulau
Wangi-wangi sedangkan sampel W-36-08 diambil dari perairan di sebelah selatan Pulau
Hoga. Berdasarkan hasil pemotretan di bawah air, sampel W-19-08 merupakan
spons bercabang warna biru, bagian cabangnya tampak melilit pada biota lain,
substrat dasarnya menempel pada terumbu, teksturnya kenyal, dan ostia merata di
setiap bagian cabang. Sedangkan hasil pemotretan di atas permukaan air, warna
biru spons W-19-08 memudar yang mungkin terjadi akibat kontak dengan udara.
Berdasarkan identifikasi awal (Colin & Arneson 1995; de Voogd 2004), spons
Hasil pemotretan di bawah air sampel W-36-08, spons ini berbentuk masif,
berwarna kuning-jingga, permukaan tubuh berpori, dan substrat dasar menempel
pada terumbu. Sedangkan hasil pemotretan di atas permukaan air, spons W-36-08
memiliki tekstur tubuh yang keras dan agak sulit dipotong, dan warna tubuh
bagian luar kuning-jingga dengan tubuh bagian dalam berwarna sama tetapi lebih
muda. Gambar 4 memperlihatkan sampel W-19-08 di habitat dan di atas
permukaan air sedangkan dan Gambar 5 memperlihatkan sampel W-36-08 di
habitat dan di atas permukaan air.
Tabel 1 Posisi geografis, jumlah, kode, dan prediksi taksonomi spons yang dikoleksi di stasiun 1 dan stasiun 4.
1 Barat Pulau Wangi-wangi 5o'15.46.50"LS 16 W-04-08 Tak Teridentifikasi 123o31'01.60"BT W-06-08 Tak Teridentifikasi
2 Selatan Pulau Hoga 5o28'48.4"LS 13 W-34-08 Kallypilidon sp. 123o45'34.7"BT W-35-08 Tak Teridentifikasi
Penelitian Rachmat (2007) menunjukkan bahwa perairan kawasan timur
berhasil mengumpulkan 441 jenis spons yang tersebar di 8 (delapan) wilayah
perairan Indonesia Timur antara lain Nusa Tenggara Timur, Nusa Tenggara Barat,
Sulawesi Utara, Sulawesi Tengah, Sulawesi Barat, Sulawesi Selatan, Biak dan
Ternate. Jumlah jenis spons terbanyak diperoleh dari empat wilayah perairan
Sulawesi yaitu 240 jenis.
Gambar 4 Spons W-19-08 di dalam air (A) dan di atas permukaan air (B).
Gambar 5 Spons W-36-08 di dalam air (A) dan di atas permukaan air (B).
Penelitian Suharyanto (2007) yang dilakukan di dua lokasi di perairan Pulau
Barranglompo, Sulawesi Selatan dengan kondisi terumbu karang berbeda berhasil
mengidentifikasi delapan jenis spons antara lain Auletta sp., Callyspongia pseudoreticulatta, Clatria basilana, Clatria reinwardti, Jaspis stellifera, Plakortis nigra, Spirastella vagabunda, dan Xestosponga exiqua di daerah terumbu karang dengan kondisi masih baik dan tujuh jenis spons antara lain Auletta sp.,
Callyspongia sp., Clatria basilana, Jaspis stellifera, Plakortis nigra, Theonella A.W-19-08 di dalam air B. W-19-08 di atas permukaan air
cylindrica, dan Xestosponga exiqua di daerah terumbu karang dengan kondisi terumbu karang kurang baik. Hal ini juga menunjukkan bahwa perairan Sulawesi
memiliki kelimpahan jenis spons yang tinggi.
Sementara itu, jumlah jenis spons yang diperoleh di perairan TNK Wakatobi
adalah 29 jenis, sehingga dapat dikatakan bahwa distribusi dan kelimpahan spons
di wilayah perairan Sulawesi dikategorikan tinggi jika jumlah jenis spons yang
diperoleh di TNK Wakatobi, hasil penelitian Rachmat (2007), dan Suharyanto
(2007) digabungkan.
Kelimpahan jenis spons yang tinggi di perairan Sulawesi diduga
dipengaruhi oleh kondisi perairan Sulawesi yang dilalui Arus Lintas Indonesia
(Arlindo). Arus ini menghubungkan Samudera Pasifik di timur laut Indonesia
dengan Samudera Hindia di selatan Indonesia. Air laut yang mengalir dari
Samudera Pasifik membawa air yang lebih hangat dan salinitas lebih rendah
melalui kepulauan Indonesia dan menuju Samudera Hindia. Arus ini merupakan
satu-satunya arus di daerah tropis yang terlibat dalam pencampuran massa air
antar dua samudera (Lee et al. 2002).
4.2 Ekstraksi dan Uji Bioaktivitas Ekstrak Kasar Spons
Ekstraksi merupakan tahap awal penapisan komponen bioaktif dari sampel
spons (W-19-08 dan W-36-08). Ekstraksi secara harfiah artinya adalah suatu
proses penarikan komponen yang diinginkan dari suatu bahan dengan cara
pemisahan satu atau lebih komponen dari suatu bahan yang menjadi sumber
komponennya. Proses penarikan komponen bioaktif dari spons diawali dengan
proses penghancuran bahan, penimbangan, perendaman dengan pelarut
(maserasi), penyaringan dan tahap pemisahan. Sampel spons (W-19-08 dan
W-36-08) diambil dari dalam pendingin beku dan dibiarkan sesaat di udara terbuka agar
esnya mencair.
Sampel spons dimaserasi dalam alkohol teknis (96%) di dalam erlenmeyer
dalam suhu kamar dan dilakukan hingga warna pelarutnya bening. Proses ini
diharapkan semua senyawa kimia yang terkandung di dalam jaringan spons
yang terlarut merupakan senyawa kimia yang memiliki kesamaan polaritas dengan
pelarut.
Setelah tahap maserasi dan penyaringan (filtration) diperoleh ekstrak kasar dari sampel spons dengan berat setelah di evaporasi serta rendemen yang
diperoleh adalah seperti yang terlihat pada Tabel 2. Rendemen merupakan nilai
persentase perbandingan antara berat ekstrak kering spons dengan berat basah
sampel spons. Contoh perhitungan rendemen ekstrak kasar W-19-08 dan W-36-08
dapat dilihat pada Lampiran 4.
Ekstrak W-19-08 yang diperoleh dari hasil evaporasi berupa ekstrak
berwarna coklat muda sedangkan ekstrak W-36-08 berupa ekstrak kenyal
berwarna kuning-jingga. Kedua ekstrak ini dikeringkan terlebih dahulu
menggunakan freeze dryer hingga diperoleh ekstrak kering atau disebut sebagai ekstrak kasar.
Tabel 2 Nilai berat sampel basah (gram) dan rendemen ekstrak kasar (%) sampel spons W-19-08 dan W-36-08.
Terlihat dari Tabel 2, berat ekstrak kasar spons W-19-08 adalah 1,68 gram
dan ekstrak kasar spons W-36-08 adalah 9,26 gram. Berat ekstrak dari spons
selanjutnya digunakan untuk menghitung nilai rendemen hasil ekstraksi dan
maserasi dalam alkohol teknis. Nilai rendemen ekstrak spons W-19-08 dan
W-36-08 masing-masing diperoleh 3,36% dan 6,61%.
Untuk selanjutnya pada ekstrak kasar dari spons dilakukan uji sitotoksik in vitro terhadap sel lestari kanker payudara T47D yang terlebih dahulu ditumbuhkan pada medianya. Uji ini dilakukan untuk menguji potensi senyawa
atau mematikan sel uji T47D. Uji sitotoksik ekstrak kasar dari spons dilakukan
dengan menggunakan metode MTT. Prinsipnya adalah sel uji T47D yang telah
diberi ekstrak spons pada konsentrasi tertentu diberi pereaksi MTT, diamati
perubahan warna yang terjadi, dan dilakukan pengukuran absorbansi intensitas
warna yang terbentuk sebagai representasi kehidupan sel uji T47D. Kemampuan
ekstrak kasar dari spons pada konsentrasi tertentu dalam menghambat
pertumbuhan atau mematikan sel uji T47D memperlihatkan bahwa senyawa
tersebut memiliki sifat sebagai senyawa antikanker. Hasil uji sitotoksisitas ekstrak
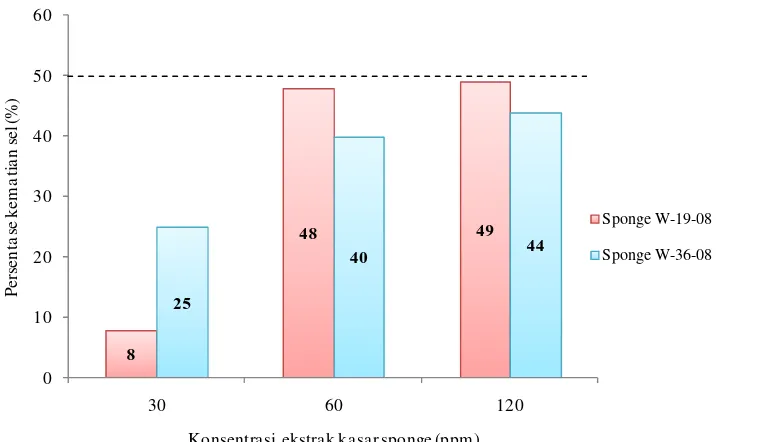
kasar spons W-19-08 dan W-36-08 terlihat pada Gambar 6.
8
Konsentra si ekstra k ka sa r sponge (ppm)
Sponge W-19-08
Sponge W-36-08
Gambar 6 Persentase kematian sel lestari tumor T47D setelah perlakuan dengan ekstrak kasar spons W-19-08 dan W-36-08 (Keterangan: (---) batas persentase kematian 50%).
Persentase kematian sel lestari tumor yang diberi perlakuan ekstrak kasar
dihitung dengan rumus (2) berdasarkan hasil pengukuran dengan spektrofotometer
dan contoh perhitungan persentase kematian dapat dilihat di Lampiran 5. Gambar
6 menunjukkan bahwa semakin tinggi konsentrasi ekstrak kasar maka semakin
tinggi persentase kematian sel tumor. Pada konsentrasi 30 ppm, persentase
diakibatkan perlakuan ekstrak W-36-08 namun persentase keduanya masih
dibawah 50% sehingga kedua ekstrak dapat dikatakan memiliki aktivitas yang
rendah. Menurut Andersen (1991) in Sismindari et al. (2002), suatu ekstrak dianggap aktif apabila mampu menyebabkan mortalitas 50% populasi sel tumor
pada konsentrasi di bawah 30 ppm (LC50 < 30 ppm). Bahkan pada konsentrasi 120
ppm pun, persentase kematian sel uji tetap tidak melebihi 50%. Persentase
kematian yang rendah tersebut diduga disebabkan karena senyawa yang
terkandung di dalam ekstrak kasar masih merupakan campuran senyawa kimia.
Senyawa-senyawa tersebut dapat bersifat antagonis atau saling meniadakan
sehingga ekstrak ini memiliki persentase kematian yang rendah.
Jika dibandingkan dengan hasil uji sitotoksik pada tahun 2008, hasil uji
sitotoksik diatas menunjukkan penurunan aktivitas biologis ekstrak kasar kedua
spons yang diperoleh dari hasil ekstraksi sampel spons yang telah melalui masa
penyimpanan. Sebenarnya kedua hasil tersebut tidak dapat dibandingkan karena
beberapa dugaan berikut ini:
1. uji sitotoksik in vitro dilakukan oleh orang berbeda dan prosedur kerja yang baru sehingga kondisi pada saat uji sudah berbeda dan prosedur kerja
yang baru perlu diverifikasi;
2. generasi sel uji T47D pada uji tahun 2008 berbeda dengan generasi pada
saat uji tahun 2010. Generasi sel uji pada tahun 2008 merupakan hasil
pembiakan yang lama dan diduga sudah resisten terhadap ekstrak uji;
3. masa penyimpanan dalam pelarut dalam waktu yang lama dapat
menyebabkan senyawa yang terkandung di dalam spons mengalami
perubahan struktur secara kimiawi karena dapat terjadi reaksi alkilasi atau
esterifikasi (Ebada et al.2008);
4. metabolit sekunder yang terkandung dalam spons dihasilkan oleh
simbionnya. Sejumlah publikasi mengungkapkan beberapa jenis
mikroorganisme yang bersimbiosis dengan spons ternyata juga
menghasilkan metabolit sekunder yang sama dengan metabolit sekunder