STRUKTUR EKTOMIKORIZANYA
DINI TASURUNI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul “Analisis Morfologi dan Sekuens ITS rDNA Jamur Edibel Ektomikoriza Pelawan dan Struktur Ektomikorizanya” merupakan gagasan dan karya saya bersama dengan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Juli 2012
Dini Tasuruni
DINI TASURUNI. Morphological and ITS rDNA Sequences Analysis of Pelawan Ectomycorrhizal Edible Mushroom and its Ectomycorrhizal Structure. Supervised by NAMPIAH SUKARNO and UTUT WIDYASTUTI.
Ectomycorrhizae is the symbiosis of fungi and specific plant which is characterised by miselium mantled on root, the presence of Hartig net, and extracellular hyphae. Some ectomycorrhizal fungi are edible mushroom, and one of edible ectomyorrhizal fungi in Indonesia is pelawan mushroom. Morphological and molecular analysis of pelawan mushroom has been done. The spore shape is ovoid to ellipsoid with completely reticulate ornamentation. The characteristic of macroscopic and microscopic feature, especially spore shape and ornamentation, drew the description to genus Heimioporus which close to H. retisporus but different in its spore morphology and some cystidial features. The DNA isolated using CTAB method and PCR amplified with ITS1 and ITS 4 primers showed about 700 bp long. Molecular analysis based on ITS ribosomal DNA showed this mushroom was closely related to Strobilomyces retisporus, a basidionym of H. retisporus with similarity under 90%. However, the lack of similar ITS sequences of the same genus made it hard to decide the species judgment based on molecular approach. The ectomycorrhizal structure of root symbiont was also examined. The root has crème colour with monopodially branch type and white extra radical septated hyphae without clamp connection. The section of the root revealed the mantle with plectenchymatous and pseudoparenchymatous hyphae and para-epidermal Hartig net. This research revealed a new information about ectomycorrhizal symbiosis between
Heimioporus sp. and Tristaniopsis merguensis.
Edibel Ektomikoriza Pelawan dan Struktur Ektomikorizanya. Dibimbing oleh NAMPIAH SUKARNO dan UTUT WIDYASTUTI.
Ektomikoriza merupakan hubungan simbiosis antara cendawan dan tumbuhan yang ditandai dengan akar yang diselimuti mantel hifa, adanya jala Hartig, dan miselium ekstra seluler. Beberapa ektomikoriza adalah jamur yang dapat dimakan, salah satu jamur edibel di Indonesia yang mempunyai nilai ekonomis tinggi adalah jamur pelawan. Penelitian ini dilakukan dengan tujuan untuk menganalisis karakter morfologi dan sekuens ITS rDNA tubuh buah jamur pelawan serta struktur simbiosis ektomikorizanya. Analisis karakter morfologi tubuh buah dilakukan secara makroskopik dan mikroskopik. Berdasarkan karakter morfologi terutama bentuk dan ornamen sporanya, jamur pelawan merupakan anggota genus Heimioporus yang mirip dengan H. retisporus tetapi berbeda morfologi spora dan bentuk beberapa komponen pelisnya. Sekuens ITS rDNA yang diisolasi dengan metode CTAB dan diamplifikasi PCR menggunakan primer ITS1 dan ITS4 menunjukkan hasil sekitar 700 bp. Hasil analisis sekuens
ITS rDNA jamur pelawan menunjukkan kekerabatan terdekat dengan
H. retisporus dengan homologi di bawah 90%. Rendahnya jumlah sekuens dari genus yang sama yang terdapat di Bank Gen menyebabkan identifikasi spesies jamur pelawan belum dapat ditentukan. Akar ektomikoriza simbion berwarna krem kekuningan dengan tipe percabangan monopodial. Miselium yang menyelimuti akar berwarna putih, bersekat, tanpa jembatan apit. Mantel tersusun atas hifa plektenkim dan pseudoparenkim. Jala Hartig bersifat para-epidermal. Penelitian ini mengungkap informasi baru mengenai hubungan simbiosis ektomikoriza antara Heimioporus sp. dengan Tristaniopsis merguensis.
©Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
STRUKTUR EKTOMIKORIZANYA
DINI TASURUNI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
:
NIM : G351090011
Disetujui
Komisi Pembimbing
Dr. Ir. Nampiah Sukarno Dr. Ir. Utut Widyastuti, M.Si.
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Mikrobiologi
Dr. Ir. Gayuh Rahayu Prof. Dr. Ir. Dahrul Syah, M.Sc.Agr.
dan karunia-Nya, sehingga karya ilmiah ini dapat diselesaikan. Penelitian yang berjudul “Analisis Morfologi dan Sekuens ITS rDNA Jamur Edibel Ektomikoriza Pelawan dan Struktur Ektomikorizanya” ini didanai oleh Dana Hibah Fundamental IPB atas nama Dr. Ir. Nampiah Sukarno.
Terima kasih penulis ucapkan kepada Dr. Ir. Nampiah Sukarno dan Dr. Ir. Utut Widyastuti, M.Si. selaku pembimbing atas kesabarannya dalam memberikan saran, bimbingan, dukungan serta kesempatan dalam pelaksanaan penelitian dan penyempurnaan penyusunan karya ilmiah ini. Terima kasih penulis ucapkan kepada Dr. Atik Retnowati atas kesediaannya sebagai penguji luar komisi dengan memberikan saran dan bimbingan dalam penyempurnaan penulisan tesis ini. Terima kasih juga penulis sampaikan kepada Dr. Ir. Iman Rusmana, M.Si atas kesediaannya sebagai penyelenggara dari Mayor mikrobiologi Pascasarjana IPB.
Terima kasih yang sebesar-besarnya penulis sampaikan kepada Kementerian Agama Republik Indonesia yang telah memberikan beasiswa bagi penulis untuk menempuh program Pascasarjana (S2) bagi guru madrasah utusan daerah, Institut Pertanian Bogor yang telah memberi kesempatan belajar dan menambah wawasan, para staf dosen, pegawai TU, laboran Departemen Biologi, Mikologi dan Biorin, teman-teman yang bekerja di Laboratorium Mikologi dan Biorin atas kesabarannya membantu penulis dalam pelaksanaan penelitian di laboratorium. Penulis juga berterima kasih kepada Pemerintah Daerah Bangka Tengah yang telah memberikan fasilitas dan bantuan yang sangat besar bagi penelitian ini. Mbak Pepy, Dr. Iman Hidayat, Echa, Eka, Erwin, Oktan, Nicho, dan juga kepada teman-teman Mikrobiologi serta teman-teman di IPB yang senantiasa siap membantu dan memberi semangat untuk senantiasa berjuang menjadi lebih baik, yang tidak dapat saya sebutkan satu per satu, penulis mengucapkan banyak terimakasih atas bantuan dan kebersamaannya.
Ucapan terima kasih akhirnya disampaikan kepada suami H. Abas Nurgaha dan ananda Kamila Rahmani Wafda atas dukungan, kekuatan, kesabaran, pengorbanan, dan ketulusannya dalam memberi motivasi dan semangat. Kepada Ibu (almh.) dan Bapak yang senantiasa memberi inspirasi, semangat, dukungan dan do’a untuk penulis dalam menyelesaikan tugas belajar di Pascasarjana IPB. Semoga Alloh mengampuni kekhilafan mereka dan selalu melimpahkan kasih sayang-Nya, amin. Kepada keluarga besar H. Anwar Rahmatillah dan Suhendar D. Abdullah, terima kasih atas dukungan, doa dan kasih sayangnya selama ini. Kepada seluruh keluarga besar MA Cilendek dan Pondok pesantren Raudlatul Muta’allimin Cilendek atas doa dan dukungannya. Semoga Allah senantiasa membalas kebaikan semuanya dengan pahala yang berlipat ganda, amin.
Semoga hasil penelitian ini bermanfaat, terutama dapat memberikan informasi untuk kepentingan dan perkembangan ilmu pengetahuan dan kesejahteraan manusia terutama masyarakat Indonesia.
Bogor, Juli 2012
Penulis dilahirkan di Tasikmalaya Propinsi Jawa Barat pada tanggal 19 Maret 1977 sebagai anak kelima dari delapan bersaudara dari pasangan Bapak H. Anwar Rahmatillah dan Ibu Siti Aisyah Nurjanah (almh.). Pada tahun 1996 penulis lulus dari SMA Negeri 1 Tasikmalaya dan kemudian melanjutkan studi di Jurusan Biologi FMIPA UNPAD dan lulus pada tahun 2003.
xvii
C. Keragaman Cendawan Ektomikoriza ... 5
D. Heimioporus ... 7
Identifikasi Jamur Ektomikoriza ... 9
A. Metode Identifikasi Jamur Ektomikoriza ... 9
B. Daerah ITS rDNA ... 11
1. Karakterisasi Morfologi Tubuh Buah ... 15
1.1. Metode Pengumpulan Bahan ... 15
1.2. Karakterisasi Makroskopik ... 15
1.3. Karakterisasi Mikroskopik ... 16
1.4. Preparasi Parafin dan SEM ... 16
2. Analisis Sekuens ITS rDNA ... 17
2.1. Ekstraksi dan Kuantifikasi DNA ... 17
2.2. Amplifikasi DNA dengan PCR ... 17
2.3. Sekuensing DNA ... 18
2.4. Analisis BLAST ... 18
2.5. Analisis Filogenetik ... 18
3. Karakterisasi Struktur Simbiosis Ektomikoriza Pelawan ... 18
HASIL DAN PEMBAHASAN 1. Karakteristik Morfologi Jamur Pelawan ... 19
A.Deskripsi Morfologi Jamur Pelawan ... 19
B.Identifikasi Jamur Pelawan ... 20
2. Analisis Sekuens ITS rDNA Jamur Ektomikoriza Pelawan ... 26
A.Ekstraksi DNA, PCR dan Sekuensing... 26
B.Analisis BLAST Sekuens ITS rDNA ... 27
C.Analisis Filogenetik Sekuens ITS rDNA ... 28
xviii
Saran ... 35
DAFTAR PUSTAKA ... 37
xix bulan Maret, gambar bawah dikoleksi pada bulan Oktober. Merah marun tua (A, C), merah kecokelatan (A, B), merah muda kusam (D), cokelat
kekuningan (E).. ... 20
4 Warna tudung tubuh buah jamur pelawan. Gambar atas dikoleksi pada bulan Maret, gambar bawah dikoleksi pada bulan Oktober. Merah marun tua (A, C), merah kecokelatan (A, B), merah muda kusam (D), cokelat
kekuningan (E).. ... 21
5 Spora Heimioporus sp. dilihat di bawah mikroskop SEM. A. Permukaan spora dengan lubang-lubang yang cukup lebar, B. Permukaan spora dengan lubang-lubang melebar dan memanjang ... 22
6 Produk PCR daerah ITS rDNA jamur pelawan . DNA ITS rDNA tubuh buah pori kuning (A) dan pori merah (B).. ... 26
7 Hasil penyejajaran sekuens ITS rDNA jamur pelawan dengan program
Clustal W bioedit. JPPK (atas) dan JPPM (bawah). ... 27
8 Pohon filogenetik daerah ITS1-ITS2 rDNA jamur pelawan dan spesies- spesies yang telah diketahui dengan outgroup S. bovista. Pohon filogeni dikonstruksi dengan metode MP dengan nilai bootstrap 1000. Jamur pelawan adalah Heimioporus sp. JPPK dan Heimioporus sp. JPPM
(kotak). ... 29
9 Pohon filogenetik daerah ITS rDNA jamur pelawan dan spesies-spesies yang telah diketahui dengan outgroup S. bovista. Pohon filogeni dikonstruksi dengan metode NJ dengan nilai bootstrap 1000. Jamur pelawan adalah Heimioporus sp. JPPK dan Heimioporus sp. JPPM
(kotak). ... 30
10 Analisis filogenetik sekuens jamur pelawan dengan sekuens genus
xx
12 Penampang memanjang akar ektomikoriza pelawan. Mantel (M), jala Hartig (tanda panah), sel epidermis yang mengalami pemanjangan
xxi
Halaman 1 Tabel perbandingan morfologi makroskopik tubuh buah pelawan berpori kuning (JPPK) dan berpori merah (JPPM) …... 43
2 Tabel perbandingan morfologi mikroskopik tubuh buah pelawan berpori kuning (JPPK) dan berpori merah (JPPM).…... 43
3 Gambar tubuh buah jamur pelawan ………... 44
4 Gambar spora jamur pelawan pada media air dan KOH …... 45
5 Gambar spora pelawan pada media Melzer’s.………... 45
6 Gambar karakter mikroskopis jamur pelawan ………... 46
7 Gambar sekuens ITS rDNA Heimioporus sp. JPPK …………. ... .. … 48
8 Gambar sekuens ITS rDNA Heimioporus sp. JPPM ... …… 48
9 Hasil BLAST NCBI sekuens ITS rDNA jamur pelawan ………... 49
10 Tabel hasil BLAST sekuens ITS rDNA jamur pelawan JPPK
menggunakan Mycobank ………….…...…... 50
11 Tabel hasil BLAST sekuens ITS rDNA jamur pelawan JPPM
PENDAHULUAN
Latar Belakang
Mikoriza ialah simbiosis mutualisme yang terbentuk antara cendawan
dengan akar tumbuhan (Smith & Read 1997). Umumnya mikoriza berperan
penting dalam memacu pertumbuhan tumbuhan inang dan pengambilan unsur
hara mineral dan air dari tanah bagian rizosfer (Van Hees et al. 2004; Wilson
et al. 2007). Di sisi lain, tumbuhan berperan menyediakan sumber karbon hasil fotosintesis bagi cendawan. Manfaat lain dari cendawan mikoriza diantaranya
ialah melindungi tumbuhan dari serangan hama dan penyakit, menghasilkan
fitohormon, membantu melancarka proses asimilasi karbon oleh tumbuhan,
membantu perbaikan struktur dan kesuburan tanah, dan lain-lain. Bagi ekosistem,
mikoriza berperan dalam siklus nutrisi seperti siklus karbon, mendukung
peningkatan populasi mikroba tanah yang bermanfaat dan mengeluarkan eksudat
akar di daerah rizosfer dan hifosfer, hifa dan tubuh buahnya sebagai habitat dan
sumber makanan bagi hewan avertebrata tanah. Selain sebagai pupuk hayati,
tubuh buah jamur ektomikoriza juga banyak yang digunakan sebagai sumber
pangan, obat, pewarna, dan etnobotani dengan nilai ekonomis yang sangat penting
(Brundrett et al. 1996).
Berdasarkan struktur kolonisasinya, mikoriza secara umum dibagi menjadi
7 kelompok, diantaranya ialah ektomikoriza (Smith & Read 1997). Ciri utama
ektomikoriza yaitu terbentuknya mantel yang menyelimuti akar, kolonisasi hifa
terjadi di ruang antar sel-sel akar, mempunyai hifa eksternal yang mengeksplorasi
tanah dan umumnya membentuk tubuh buah makroskopik di dalam atau
permukaantanah.Ektomikoriza di daerah tropis belum banyak dipelajari, baik
peranan maupun jenisnya.Karakterisasi dan identifikasi ektomikoriza dapat
dilakukan terhadap tubuh buah cendawan dan morfotipe ektomikoriza pada akar
tumbuhan inangnya (Brundrett et al. 1996). Struktur ektomikoriza berkembang sebagai hasil perkembangan dan adaptasi antara cendawan mikoriza dan
tumbuhan inangnya.Struktur tersebut bersifat khas dan dapat digunakan untuk
mengidentifikasi cendawan yang terlibat jika tubuh buahnya tidak ditemukan
Jamur ektomikoriza pelawan merupakan ektomikoriza edibel yang tumbuh
di sekitar pohon pelawan (Tristaniopsis merguensis) di Bangka Tengah. Jamur tersebut mempunyai nilai ekonomis tinggi, dengan harga per kilogram kering
dapat mencapai Rp. 1.800.000,00. Tingginya nilai ekonomis jamur pelawan
menyebabkan makin tingginya minat masyarakat untuk memburu jamur tersebut.
Oleh karena itu, identifikasi dan karakterisasi morfologi jamur tersebut sangat
diperlukan agar tidak terjadi kesalahan identifikasi dengan jamur lain yang
mungkin berbahaya yang tumbuh berdampingan di hutan pelawan.
Identifikasi jamur dapat dilakukan dengan menggunakan pendekatan
morfologi dan molekular. Akan tetapi karakter morfologi mempunyai kelemahan
yaitu hanya memperlihatkan sifat pewarisan dominan dan resesif, tingkat
polimorfismenya sedikit dan sangat dipengaruhi oleh lingkungan. Akibatnya
individu yang mempunyai genotipe yang sama dapat menunjukkan fenotipe yang
berbeda, dan yang memiliki genotipe yang sama dapat menunjukkan fenotipe
yang sama jika lingkungannya berbeda. Kemiripan pada fenotipe belum tentu
menunjukkan kemiripan pada tingkat DNA (Tanskley 1983). Sementara itu,
metode molekuler dianggap bersifat lebih stabil dan lebih akurat, meski
kadang-kadang lebih mahal dan rumit. Metode morfologi dan molekular menyediakan
pendekatan yang saling melengkapi untuk menganalisis struktur komunitas
ektomikoriza. Dalam penelitian ini dilakukan identifikasi secara morfologi dan
molekuler.
Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan sebagai berikut:
1. Mengidentifikasi jamur pelawan menggunakan analisis karakter
morfologi tubuh buah
2. Melakukan analisis sekuens ITS rDNA tubuh buah jamur pelawan untuk
mengetahui kekerabatan terdekatnya
3. Melakukan karakterisasi struktur simbiosis ektomikoriza jamur pelawan
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi awal untuk
konservasi dan pemanfaatan jamur pelawan sebagai jamur edibel dan sebagai
TINJAUAN PUSTAKA
Ektomikoriza
Mikoriza didefinisikan sebagai simbiosis mutualisme antara cendawan dan
akar tumbuhan, yang khususnya berperan dalam penyerapan dan transfer nutrisi
(Brundrett 2004). Menurut Smith & Read (1997), mikoriza dibagi ke dalam tujuh
kelompok berdasarkan tipe penetrasi hifa, perkembangan sel akar, dan spesies
tumbuhan inangnya. Ketujuh kelompok tersebut ialah mikoriza arbuskula,
mikoriza monotropoid, mikoriza arbutoid, mikoriza erikoid, mikoriza anggrek,
ektendomikoriza dan ektomikoriza. Ektomikoriza merupakan tipe mikoriza yang
dapat dibedakan dari kelompok lain karena tidak adanya penetrasi intraseluler
oleh cendawan. Menurut Smith & Read (1997) umumnya ektomikoriza
mempunyai 3 ciri struktur utama. Pertama, akarnya diselubungi oleh mantel atau
jaringan hifa. Kedua, terdapat jaring-jaring pertumbuhan hifa yang tumbuh di
dalam ruang antara sel-sel epidermis dan korteks yang disebut jala Hartig. Ketiga,
terdapat sistem hifa yang tumbuh di daerah rizosfer yang membentuk hubungan
esensial dengan tanah maupun dengan tubuh buah dari cendawan yang
membentuk ektomikoriza. Umumnya akar berektomikoriza dapat dibedakan dari
akar yang tidak bersimbiosis secara kasat mata karena memiliki bentuk yang khas
yaitu lebih pendek, menebal, dan memiliki warna yang berbeda karena
diselubungi hifa atau mantel (Brundrett et al. 1996). A.Manfaat Ektomikoriza
Manfaat mikoriza bagi tumbuhan diantaranya ialah meningkatkan
penyerapan unsur hara makro dan mikro terutama fosfat dan nitrogen dari tanah
saat laju mineralisasi tidak memenuhi kebutuhan tanaman (Smith & Read 1997)
dan menyerap lebih banyak air sehingga tumbuhan tahan terhadap kekeringan.
Selain itu, mikoriza dapat meningkatkan daya tahan tumbuhan terhadap serangan
patogen akar, toksisitas logam berat (Rizzo et al. 1992), serta tingkat salinitas. Cendawan mikoriza juga dapat memacu pertumbuhan tanaman karena
menghasilkan zat-zat pemacu pertumbuhan seperti auksin, giberellin, dan
sitokinin (Smith & Read 1997). Sebaliknya, cendawan mendapat manfaat dengan
inang. Banyak tumbuhankehutanan sangat bergantung pada cendawan
ektomikoriza dan di area tanah yang miskin hara, tumbuhan bahkan tidak dapat
hidup tanpa bersimbiosis. Akibatnya dalam manajemen hutan, cendawan
ektomikoriza merupakan komponen penting.
B.Keragaman Tumbuhan Inang
Hampir semua tumbuhan yang membentuk ektomikoriza berupa pohon
tahunan. Meski hanya sekitar 2% tumbuhan Angiosperma yang merupakan
ektomikoriza (Brundrett 2009), namun peran pentingnya sangat besar karena
tumbuhan-tumbuhan tersebut menempati sebagian besar permukaan daratan dan
mempunyai nilai ekonomi tinggi. Sebagai contoh ialah Pinaceae yang tumbuh mendominasi hutan boreal dari hemispera utara, Fagaceae yang mendominasi hutan iklim sedang di belahan bumi utara, dan Myrtaceae di hutan iklim sedang dan subtropis di wilayah hemispera selatan. Myrtaceae meliputi 10 genus dan terdiri dari sekitar 1800 spesies, diantaranya ialah Eucalyptus, Melaleuca, dan
Tristaniopsis (Brundret 2008). Di hutan tropis Asia Tenggara, hutan
Dipterocarpaceae umumnya hanya membentuk ektomikoriza (Taylor & Alexander 2005), misalnya tengkawang (Lee et al. 2008). Selain itu leguminosae tertentu seperti Caesalpiniaceae yaitu Azfelia, Intsia, dan Eperua, tumbuhan Mimosoideae seperti Acasia juga pernah dilaporkan membentuk ektomikoriza
(Read dan Smith 1997). Tumbuhan Angiospermae yang berbentuk semak dan
sebagian kecil herba juga sering ditemukan membentuk ektomikoriza, seperti
semak Dryas (Rosaceae), Helianthemum (Cistaceae), Polygonum viviparum, dan
Kobresia miyosuroides.
Berdasarkan ketergantungan terhadap simbiosis mikoriza, tumbuhan dibagi
ke dalam 3 kelompok, yaitu mikoriza obligat, mikoriza fakultatif, dan non
mikoriza (Brundrett et al. 1996). Tumbuhan mikoriza obligat ialah tumbuhan yang tidak akan bertahan hidup sampai kematangan reproduktiftanpa berasosisasi
dengan cendawan mikoriza. Tumbuhan mikoriza fakultatif ialah tumbuhan yang
secara alami mendapat keuntungan darisimbiosis mikoriza hanya jika tanah atau
habitatnya kurang subur. Tumbuhan non mikoriza yang sering juga disebut
konsisten resisten terhadap kolonisasi cendawan mikoriza, setidaknya pada saat
muda dan sehat.
Tumbuhan pelawan mempunyai nama ilmiah Tristaniopsis merguensis
(Griff.) Peter G. Wilson & J.T. Waterhouse (http://data.gbif.org 2010).
Tumbuhan tersebut merupakan bagian dari divisi Magnoliophyta, kelas
Magnoliopsida, ordo Myrtales, famili Myrtaceae, dan genus Tritaniopsis. Spesies
tersebut mempunyai beberapa sinonim yaitu Tristania merguensis, T. backhuizenni Back, T maingayi, dan T. subauriculata. Di beberapa daerah
T. merguensis memiliki nama yang berbeda-beda yaitu pelawan tudak (Belitung), pelawan bukit (Malaysia), nyakamaung (Myanmar), dan kha nang (Thailand)
(Sosef & Prawirohatmodjo 1998). Di Indonesia, T. merguensis tumbuh di Jawa Barat, Kalimantan, dan Kepulauan Bangka Belitung (Sosef & Prawirohatmodjo
1998). Selain di Indonesia, T. merguensis juga terdapat di Malaysia, Myanmar dan Thailand bagian selatan. Tumbuhan Myrtaceae telah dilaporkan sebagai salah satu simbion ektomikoriza (Lapeyrie & Chilvers 1985, Jones et al. 1998). Simbiosis tersebut diperkirakan sangat berperan dalam kelangsungan dan
kelestarian tumbuhan pelawan di hutan yang miskin hara.
Tristaniopsis merguensis banyak dimanfaatkan masyarakat Bangka Belitung sebagai kayu bakar, kayu tajar bagi tanaman pertanian, kayu bahan bangunan,
dan bahan pembuatan kapal. Di samping itu, nektar bunga pelawan diduga
menjadi makanan lebah penghasil madu pahit yang disebut madu pelawan (Yarli
2011). Menurut Hidayanti (2010), tumbuhan tersebut juga merupakan tumbuhan
inang dari jamur edibel ektomikoriza pelawan.
C.Keragaman Cendawan Ektomikoriza
Cendawan pembentuk ektomikoriza berjumlah sangat besar dan merupakan
kelompok cendawan yang paling penting secara ekonomi. Mayoritas cendawan
ektomikoriza merupakan Basidiomisetes dan Askomiseteses, meski sejumlah
kecil Zigomisetes juga dilaporkan membentuk ektomikoriza. Menurut Molina
et al. (1992) terdapat sekitar 5000 sampai 6000 spesies cendawan yang membentuk ektomikoriza atau ektendomikoriza. Cendawan tersebut kebanyakan
bersifat epigeal dan hanya sekitar seperempat bagian yang bersifat hipogeal.
Boletaceae, Corticiaceae, Cortinariaceae, Hydnaceae, Hygroporaceae, Russulaceae, Sclerodermataceae, Telephoraceae, dan Tricholomataceae.
Cendawan hipogeal merupakan gabungan dari Basidiomisetes, Askomiseteses,
dan Zigomisetes.
Menurut beberapa taksonom, famili Boletaceae terdiri dari beberapa genus. Corner (1972) membagi Boletaceae di Malaysia menjadi empat genus yaitu
Boletus, Gyroporus, Heimiella, dan Strobilomyces sementara Austroboletus,
Boletellus, Ixocomus, Leccinum, Pulveroboletus, Tylopilus, dan Xerocomus
tersebar dalam sub genus yang terpisah. Pegler & Young (1981) melaporkan
klasifikasi baru cendawan kelompok Bolet berdasarkan morfologi spora yaitu
menjadi 6 familiyang terdiri dari 35 genus. Lebih lanjut Singer (1981, 1986)
menyatukan Bolet ke dalam satu famili dengan 25 genus berdasarkan pada alasan
bahwa semua karakter pada Bolet dianggap sama, meski pada prakteknya Beliau
lebih menekankan pada morfologi basidioma dibandingkan spora. Halling et al. (2007) membagi Bolet kedalam 31 genus yang terbagi dalam 4 famili yaitu
Boletaceae, Boletinellaceae, Gyroporaceae, dan Suillaceae. Genus tersebut ialah
Afroboletus, Aureoboletus, Austroboletus, Boletellus, Boletochaete, Boletinellus, Boletus (termasuk Xerocomus), Bothia, Chalciporus, Fistulinella (termasuk
Mucilopilus), Gyrodon, Gyroporus, Heimioporus, Leccinellum, Leccinum, Paragyrodon, Phlebopus, Phylloboletellus, Phylloporus, Porphyrellus, Pseudoboletus, Pulveroboletus, Retiboletus, Rubinoboletus, Sinoboletus,
Strobilomyces, Suillus, Tuboseta (termasuk Setogyroporus), Tylopilus, Veloporphyrellus, dan Xanthoconium.
Menurut Corner (1972), secara makroskopik terdapat kemiripan yang sangat
tinggi antara Boletaceae dan Xerocomaceae. Meski demikian, terdapat perbedaan utama yang membedakan kedua famili tersebut, diantaranya ialah
bentuk dan pelekatan himenofora, yaitu pada Boletaceae selalu tubulat, adnatus -bebas, umumnya sinuato-adnat, tidak pernah decurrent. Sementara
Boletaceae ialah adanya kandungan gelatin yang sangat tinggi pada trama tabungnya, sedangkan pada Xerocomaceae kandungan gelatinnya lebih rendah (Corner 1972). Menurut Pegler (1986), spora Boletaceae dapat memiliki permukaan yang halus atau berornamen. Spora yang halus digolongkan ke dalam
genus Pulveroboletus, Leccinum atau Boletus, sedangkan spora yang berornamen retikulat hanya dimiliki oleh genus Heimioporus [Horak]. Menurut Brundrett et al. (1996), spora retikulat dimiliki oleh dua genus, yaitu Strobilomyces dan
Heimioporus. Jika keseluruhan spora berornamen, maka genusnya ialah
Heimioporus, sedangkan jika memiliki pola adaxial yang tidak berjala, maka genusnya ialah Strobilomyces.
Cendawan pembentuk mikoriza umumnya mempunyai kisaran inang yang
luas. Artinya cendawan tersebut dapat membentuk mikoriza dengan banyak
spesies tumbuhan. Meski demikian ada juga cendawan yang mempunyai kisaran
inang yang sempit atau bersifat spesifik. Sebagian kecil cendawan bersifat
spesifik genus, sebagian lagi bersifat spesifik famili, dan sebagian lain ada yang
bersifat terbatas pada Gimnospermaee saja (Smith & Read 1997). Contoh
cendawan dengan kisaran inang yang luas diantaranya ialah Amanita muscaria, Cenococcum geophyllum, Hebeloma crustuliniforme, Laccaria laccata, Pisolithus tinctorius, dan Telephora terrestris, yang tersebar luas di dunia pada kisaran
tumbuhan yang sangat luas. Sementara itu, sistem akar individu tumbuhan dapat
dikolonisasi oleh beberapa spesies cendawan, misalnya pada tumbuhan
Eucalyptus, Pseudotsuga, dan Pinus.
D. Heimioporus
Menurut Corner (1972), Heimella [Boedijn] atau Heimioporus [Horak] merupakan spesies dari famili Boletaceae yang memiliki spora retikulat atau berjala, sama dengan Strobilomyces. Perbedaannya terletak pada sporanya yang berwarna cokelat zaitun yang tidak segelap warna spora Strobilomyces, dengan eksospora yang tidak berwarna dan endospora berjala yang berwarna, serta tidak
mempunyai pola adaksial. Spora yang berjala inilah yang membedakannya dengan spora Boletus yang umumnya halus. Dibandingkan dengan
udara, tudung yang bersifat rata tomentosus atau mengkilat (tidak pecah-pecah), dan struktur trama tabung yang bersifat boletoid sejati. Hampir pada semua
anggota spesiesnya mempunyai tangkai yang panjang (Corner 1972). Menurut
Singer (1986) Heimiosporus retisporus termasuk ke dalam genus Boletellus section Retisporus, meski sporanya berjala dan trama tabungnya sangat boletoid berbeda dengan karakter Boletellus.
Gambar 1 Spora beberapa spesiesHeimioporus. H. betula (A), H. fruticicola (B),
H. ivory (C), H. japonicus (D), H. retisporus (E), H. rubropunctus (F) (www.mycobank.com)
Salah satu ciri utama yang membedakan antara spesies Heimioporus dari genus lainnya ialah bentuk dan ornamentasi sporanya. Mungkin inilah yang
menyebabkan genus tersebut bertambah jumlahnya karena mengakomodir
beberapa jamur yang semula digolongkan ke dalam Boletus, Boletellus, Austroboletus, Porphyrellus, dan Strobilomyces. Saat ini di Mycobank terdapat 18 spesies Heimioporus yang terdaftar dengan tiga macam tipe perhiasan spora yaitu punctat, punctat retikulat, dan alveolat retikulat (Gambar 2). Meski
demikian menurut Halling & Fechner (2011), spesies yang sudah diakui hanya 10
spesies.
Heimioporus merupakan jamur pembentuk ektomikoriza yang diantaranya bersimbiosis dengan tumbuhan Fagaceae, Dipterocarpaceae dan Myrtaceae
Halling et al. (2007). Sebagai contoh H. fruticicola ditemukan bersimbiosis dengan Allocasuarina littoralis, Eucalyptus camaldulensis, Eucalyptus sp.,
Acacia sp. dan Hibbertia riparia. Heimioporus japonicus juga dilaporkan membentuk simbiosis dengan tumbuhan pinus dan ek di Jepang, serta dengan
Fechner 2011). Selain kedua negara tersebut, genus ini tersebar di berbagai
belahan dunia, yaitu di daerah timur Amerika Utara, Asia Timur, Asia Tenggara,
Mexico, dan Belize Costa Rica. Di Asia, jamur ini juga dilaporkan ditemukan di
Cina, Malaysia (Corner 1972), Myanmar, Singapura, dan Thailand (Chantorn
et al.2007). Boedijn (1951) telah mendeskripsikan spesies lainnya yaitu
H. retisporus dari Jawa.
Jamur pelawan adalah sejenis jamur epigeal yang ditemukan di hutan
Pelawan, Bangka Tengah. Jamur tersebut muncul setahun sekali sekitar bulan
Oktober. Kemunculan jamur pelawan biasanya diawali dengan banyaknya petir
pada akhir musim panas yang diikuti oleh hujan lebat selama berhari-hari.
Penduduk Bangka Tengah banyak memburu jamur ini karena memiliki nilai
ekonomi yang tinggi. Selain memiliki nilai ekonomi penting, jamur pelawan
mempunyai nilai ekologis yang signifikan karena menentukan keberhasilan
pertumbuhan pohon pelawan (T. merguensis) di alam (Hidayanti 2010). Sintesis ulang simbiosis ektomikoriza antara jamur pelawan dan pohon pelawan telah
berhasil dilakukan menggunakan inokulan alami. Identifikasi morfologis tubuh
buah dan spora jamur pelawan telah dilakukan oleh Hidayanti (2010), dan
hasilnya menunjukkan bahwa jamur tersebut termasuk ke dalam genus Boletus. Ciri jamur tersebut ialah tudung dan tangkainya berwarna merah, bagian bawah
tudung berpori yang berwarna kuning, dengan spora yang berbentuk fusiformis.
Identifikasi Jamur Ektomikoriza
A. Metode Identifikasi Jamur Ektomikoriza
Identifikasi dapat dilakukan secara morfologi, biokimia, dan molekuler.
Secara morfologi, identifikasi dilakukan dengan memperhatikan ciri-ciri tubuh
buah, secara biokimia berdasarkan kemampuan metabolisme atau enzimatik, dan
secara molekular berdasarkan susunan bahan penyusun genetika suatu makhluk
hidup. Karakter yang diamati secara morfologi diantaranya ialah ukuran, bentuk,
warna, dan tekstur permukaan tudung, tangkai, pori atau himenium, daging, spora,
trama, sistidium, serta basidium (Brundrett et al. 1996, Largent et al. 1978). Secara biokimia karakter yang diamati diantaranya ialah perubahan warna pada
Melzer’s, atau terbentuknya zat pati atau gelatin pada saat direndam dengan larutan FAA, dan sebagainya. Secara molekular umumnya ciri yang diamati ialah
urutan sekuen basa pada DNA secara terperinci maupun dalam bentuk mini satelit
dan mikrosatelit (Grubisha et al. 2005).
Karakter morfologi mempunyai kelemahan yaitu hanya memperlihatkan
sifat pewarisan dominan dan resesif, tingkat polimorfismenya sedikit dan sangat
dipengaruhi oleh lingkungan. Akibatnya individu yang mempunyai genotipe
yang sama dapat menunjukkan fenotipe yang berbeda, dan yang memiliki
genotipe yang sama dapat menunjukkan fenotipe yang sama jika lingkungannya
berbeda. Kemiripan pada fenotipe belum tentu menunjukkan kemiripan pada
tingkat DNA (Tanskley 1983). Metode morfologi dan molekular menyediakan
pendekatan yang saling melengkapi untuk menganalisis struktur komunitas
ektomikoriza. Idealnya kedua metode tersebut diaplikasikan secara bersamaan
untuk menyediakan potensi verifikasi hasil yang lebih memuaskan. Sekitar 93%
mikoriza teridentifikasi sama dengan kedua metode tersebut (Sakakibara et al.
2002).
Secara molekuler, umumnya identifikasi cendawan ektomikoriza dilakukan
berdasarkan dua metode utama, yaitu metode sekuensing (Landeweert et al. 2003) dan penggunaan enzim restriksi. Metode restriksi biasanya digunakan untuk
analisis komunitas, sedangkan sekuensing dilakukan untuk analisis individu.
Sekuensing dilakukan untuk merunut susunan basa nukleotida dari suatu gen
secara terperinci. Sementara itu, enzim restriksi digunakan untuk membedakan
potongan-potongan DNA berdasarkan situs restriksi yang terdapat pada DNA
cendawan. Perbedaan situs restriksi yang terdapat pada urutan DNA
menyebabkan hasil potongan yang unik untuk spesies-spesies yang berbeda.
Metode restriksi yang banyak digunakan untuk ektomikoriza ialah restriction fragment length polymorpism (RFLP) (Gardes et al. 1991). Beberapa metode lain telah dilakukan yaitu LH-PCR (Ranjard et al. 2001), T-RFLP (Burke et al.
2006), dan DGGE (Landeweert et al. 2005). Metode-metode tersebut merupakan metode yang cukup akurat untuk membandingkan potongan-potongan yang
mengandung sekuens nukleotida spesifik. Pada RFLP, DNA dipotong dengan
RFLP mempunyai kelemahan yaitu tidak dapat membedakan dua fragmen yang
berukuran sama tetapi mempunyai susunan nukleotida yang berbeda. Dengan
demikian metode sekuensing DNA dianggap lebih dapat diandalkan.
Perkembangan PCR berbasis DNA dan primer spesifik takson (Mullis &
Faloona 1987, Micklos et al. 2003) telah mempermudah studi taksonomi cendawan. DNA ribosom (rDNA) merupakan daerah penyandi RNA dan daerah
sekitarnya. Daerah tersebut, terutama internal transcribed spacer (ITS) merupakan salah satu daerah yang paling umum digunakan untuk penanda
molekular cendawan (Bruns & Gardes1993, Sanchez-Ballesteros et al. 2000). Daerah ITS bersifat konservatif, memiliki variabilitas yang sangat tinggi yang
spesifik takson, dan mempunyai jumlah ulangan yang tinggi. Konfirmasi
simbiosis mikoriza B. edulis dengan membandingkan sekuens ITS rDNA dari mikoriza dan tubuh buahnya telah dilakukan oleh Agueda et al. (2006).
B. Daerah ITS rDNA
DNA ribosom (rDNA) merupakan DNA inti yang menyandikan DNA
ribosom. Ribosom merupakan makromolekul intra sel yang menghasilkan protein
atau rantai-rantai polipeptida. Ribosom sendiri terdiri dari protein dan rRNA.
DNA ribosom dan pemisahnya terdapat dalam suatu kluster gen (biasanya 8-12
kb) yang berulang beberapa kali. Pada sel tanaman tingkat tinggi, setiap genom
inti haploid mengandung 1.000 sampai 10.000 salinan rDNA yang tersusun secara
tandem pada satu atau beberapa lokasi kromosom (Micklos et al. 2003).
Gambar 2 Sekuen DNA ribosom
Unit dasar DNA ribosom terdiri dari gen-gen untuk sub unit ribosom kecil
dipisahkan oleh dua daerah ITS (internally transcribed spacer), yang panjangnya beberapa ratus pasang basa. Daerah ITS1 terletak antara daerah 18S dengan
5.8S, dan ITS2 berada di antara 5.8S dengan 28S. Daerah yang memisahkan unit
transkripsi dari rDNA berulang bersifat non transkrip dan disebut IGS (intergenic
spacer). Pada banyak spesies cendawan, terdapat pula sub unit 5S (Hillis &
Dixon 1991). Beberapa situs restriksi terkonservasi di dalam rDNA cendawan,
sehingga dapat memudahkan dalam proses pengklonanan (Binder & Hibbett
2006).
Gen-gen sub unit mempunyai domain yang terkonservasi maupun variabel,
yang dapat digunakan untuk perbandingan genus. Daerah pemisah yang dianggap
lebih beragam dapat digunakan sebagai pembanding spesies, bahkan pada
beberapa kasus sebagai pembanding bentuk patogenik spesifik. Daerah ITS lebih
beragam dibandingkan daerah penyandi, sehingga bermanfaat untuk
membandingkan hubungan antar spesies dan genus yang berkerabat dekat.
Banyaknya jumlah ulangan kebanyakan sekuens rDNA per genom, dan pola
evolusi bersamaan yang terjadi antara unit yang berulang menjadikan kluster
tersebut sebagai penanda molekular yang baik yang memberi kemudahan dalam
analisis rDNA dengan metodologi sekuensing RNA secara langsung, sekuensing
DNA (baik dengan kloning maupun amplifikasi), maupun dengan restriksi (Hillis
& Dixon 1991).
Morfotipe Akar Ektomikoriza
Ektomikoriza terbentuk ketika akar inang dan cendawan yang sesuai
tumbuh dalam hubungan yang erat dan kondisi lingkungan yang mendukung.
Urutan terbentuknya simbiosis ektomikoriza secara singkat diawali oleh
terjadinya kontak, pengenalan dan pelekatan hifa pada sel epidermis dekat ujung
akar lateral muda yang sedang aktif tumbuh. Selanjutnya, miselia berproliferasi
pada permukaan akar dan berdiferensiasi membentuk mantel. Hifa selanjutnya
menembus antara sel-sel epidermis (dalam kebanyakan Angiospermae) atau ke
ruang antar sel-sel korteks (dalam Gymnospermae) untuk membentuk jala Hartig
dapat berupa produksi polifenol di dalam sel maupun deposisi metabolit sekunder
di dalam dinding sel.
Sebagai akibat waktu yang diperlukan untuk pembentukan simbiosis
mikoriza, daerah mikoriza aktif terbentuk beberapa mili meter di belakang ujung
akar. Akan tetapi hifa jala Hartig mengalami pematangan pada daerah yang lebih
tua, yang lebih jauh dari ujung akar (Massicotte et al. 1987). Akibatnya, aktivitas jala Hartig tergantung pada usia akar dan pertumbuhannya. Dalam akar yang
lebih tua, mantel biasanya masih ada setelah simbiosis menjadi tidak aktif yang
mungkin berfungsi sebagai struktur penyimpan dan propagul.
Struktur anatomi selubung akar dan miselia yang menyelimutinya bersifat
stabil setidaknya sampai tingkat genus cendawan dan semakin banyak digunakan
untuk mempermudah karakterisasi dari ektomikoriza yang terbentuk (Agerer
1991). Bahkan, perbedaan struktur mantel dapat digunakan untuk
mengidentifikasi simbion cendawan yang terlibat jika tubuh buahnya tidak
dijumpai. Selain itu teknik sidik jari molekular untuk cendawan yang
bersimbiosis dengan ujung akar mikoriza juga memegang peranan penting dan
semakin besar dalam menentukan komposisi spesies cendawan di dalam populasi
alami (Bruns &Gardes 1993). Umumnya simbiosis ektomikoriza diketahui
berdasarkan pengamatan tubuh buah dan tumbuhan inang di lapang, dan hanya
sebagian kecil status mikorizanya yang telah diketahui. Oleh karenanya
pengamatan dengan menelusuri hubungan dari tubuh buah ke akar tumbuhan, dan
sintesis ulang mikoriza pada kondisi aksenik yang diikuti dengan sidik jari
molekular sangat disarankan.
Selain dari tubuh buahnya, cendawan ektomikoriza dapat dibedakan satu
dari mikoriza lainnya berdasarkan beberapa ciri utama struktur simbiosisnya yaitu
adanya jala Hartig, mantel, dan miselium ekstraradikal (miselium perpanjangan
akar). Jala Hartig sebagai struktur transfer nutrisi antara cendawan dan tumbuhan
inangnya, memiliki konformasi yang sama pada semua ektomikoriza, kecuali
bahwa pemanjangan penetrasi akar besifat lebih superfisial pada kebanyakan
Angiospermae dibandingkan dengan Gimnospermae. Sebaliknya, mantel hifa
mempunyai struktur diagnostik dari spesies cendawan yang membentuknya.
mengidentifikasi cendawan sampai tingkat genus dan spesies ketika tubuh
buahnya tidak dijumpai (Agerer 1991). Di samping itu, teknik sidik jari
molekular juga digunakan untuk mempertanyakan identitas tipe-tipe mikoriza dan
memungkinkan pertimbangan perubahan komposisi spesies cendawan dalam
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan dari bulan Oktober 2010 sampai dengan Oktober 2011
di laboratorium Mikologi dan Mikroteknik Tumbuhan Biologi FMIPA serta
Biorin PPSHB IPB.
Bahan Penelitian
Bahan yang digunakan dalam penelitian iniialah tubuh buah jamur pelawan
yang dikoleksi dari Air Pasir Bangka Tengah pada bulan Maret, dan September
2011.
Metode Penelitian
1. Karakterisasi Morfologi 1.1.Metode Pengumpulan Bahan
Berdasarkan Largent (1973) pengambilan sampel jamur dilakukan dengan
cara mencabut keseluruhan bagia-bagian badan buah (tudung buah, pori, dan
tangkai) dengan menggunakan sekop kecil. Spesimen jamur pelawan diambil lalu
dibungkus menggunakan kertas tisyu kemudian dibungkus dengan keras merang,
dan dimasukkan ke dalam kotak berisi es kering. Cara lain yaitu tubuh buah
dimasukkan ke dalam kotak koleksi yang terbuat dari plastik dan menutupnya
rapat-rapat agar tidak terjadi penguapan. Foto dilakukan untuk merekam karakter
segar di lapang dan setelah sampai di laboratorium. Sampel segar diambil untuk
isolasi DNA, sedangkan sisanya dikeringkan dan disimpan pada kertas merang
dan dimasukkan ke dalam lemari es. Sebagian lagi dikeringkan dengan oven pada
suhu 80°C. Akar simbion yang diamati ialah yang melekat pada dasar tangkainya.
1.2.Karakterisasi Makroskopik
Identifikasi morfologi dilakukan pada tubuh buah segar dan spora, dan akar
ektomikoriza pelawan menggunakan metode Brundrett et al. (1996) dan Largent
et al. (1978). Ciri-ciri makroskopik yang diamati diantaranya ialahkarakter tudung (bentuk, ukuran, warna, dan tekstur dari tudung), karakter pori (cara pori
menempel pada tangkai, bentuk, ukuran, dan warna pori), dan karakter tangkai
ada tidaknya rhizomorf), sisa tudung, tudung universal, dan warna miselium bila
ada. Karakter tersebut diamati secara langsung di lapang dan melalui hasil foto.
1.3.Karakterisasi Mikroskopik
Karakter mikroskopis yang diamati diantaranya ialah bentuk, ukuran, warna,
dinding sel, dan ornamentasi spora, basidia, basidiola, pleurocystidia, cheilocystidia, trama himenofor, pileipellis, serta ada tidaknya clamp connection
menggunakan mikroskop cahaya. Pengamatan dilakukan menggunakan spesimen
kering yang direvitalisasi menggunakan alkohol absolute dan air, kemudian
diwarnai menggunakan reagen KOH 5%, larutan Melzers, dan biru trifan.
Sebagian sampel dikeringkan dan diamati setelah preparasi paraffin. Struktur
pori dan permukaan akar diamati menggunakan mikroskop stereo. Spora diamati
juga menggunakan SEM.
1.4.Preparasi Parafin
Sampel akar segar dan jaringan tubuh buah dipreparasi parafin untuk
dipotong menggunakan mikrotom dengan menggunakan metode Johansen (1940)
yang dimodifikasi. Sampel difiksasi sedikitnya selama 12 jam dengan FAA
(formaldehid:asam asetat:alkohol5:5:90), kemudian dicuci dua kali menggunakan
alkohol 70% dengan selang waktu 30 menit. Selanjutnya sampel direndam 4x
dengan alkohol 50% yang diganti setiap 1 jam.Sampel kemudian direndam dalam
larutan Johansen.Larutan Johansen I digunakan 2 jam, Johansen II semalam, dan
Johansen III-V masing-masing 2 jam. Johansen VI digunakan semalam, lalu
diulang 3x masing-masing selama 2 jam. Johansen VII dibiarkan di suhu ruang
selama 4 jam, kemudian diinkubasi pada suhu 58°C semalaman. Penanaman
parafin dilakukan bertahap pertama selama 5 jam, lalu parafin diganti selama 6
jam, kemudian selama semalam. Parafin terakhir ditanamkan selama 3 jam, baru
dilakukan pengotakan. Setelah membeku sempurna kotak parafin dimasukkan ke
dalam larutan Gifford (asam asetat: alkohol: gliserin 10:90:5) untuk pelunakan.
2. Analisis Sekuens ITS rDNA Jamur Pelawan
DNA genom total diekstraksi berdasarkan metode CTAB (Sambrook et al.
1989) dan yang dimodifikasi menggunakan buffer Raeder & Broda (1985).
Sekitar 200 mg tubuh buah yang telah disterilisasi permukaan digerus dengan
menggunakan nitrogen cair. Tepung hasil gerusan dimasukkan ke dalam tabung
mikro yang berisi 600 l buffer CTAB (CTAB, 2% PVP, 100 mM Tris-HCl pH 8,
25 mM EDTA, 2 M NaCl dan 200 mM β-merkapto etanol/BME) yang telah
dipanaskan, kemudian disimpan pada suhu 65° C selama 30-60 menit. Setelah
didinginkan, larutan ditambah dengan volume yang sama dari fenol: kloroform:
isoamil alkohol (25:24:1, v/v), kemudian disentrifugasi selama 5 menit pada
kecepatan 10.000 rpm. Larutan ditambah kloroform: isoamil alkohol (24:1, v/v)
lalu disentrifugasi 10 menit. Supernatan dipindahkan ke dalam tabung baru,
ditambah 0.6 volume isopropanol dan dibolak-baik lalu diendapkan selama 30-60
menit di freezer. Endapan diperoleh dengan sentrifugasi 10.000 rpm selama 15
menit, pelet dicuci dengan 70% etanol dan disentrifugasi 5 menit. Pelet yang
didapat dikeringkan kemudian diresuspensi dengan 20- 50 l air steril. Setelah
DNA larut ditambahkan 0,1 volume RNAse (10 l/U) dan diinkubasi selama 30
menit pada suhu 37°C.Selanjutnya, enzim diinaktivasi dengan memanaskan
tabung pada suhu 70°C selama sekitar 10 menit.
Kualitas dan jumlah konsentrasi DNA ditentukan dengan spektrofotometri
pada nilai absorbansi 260 dan 280 nm dengan empat ulangan. Keutuhan DNA
dilihat dengan eletroforesis pada 100V, selama 30 menit pada media agarosa 1%
dengan buffer TAE 1x. Marker 1Kb digunakan sebagai penanda DNA genom,
sedangkan marker digunakan untuk standar hasil PCR.
2.2.Amplifikasi DNA dengan PCR
Amplifikasi DNA daerah ITS rDNA dilakukan menggunakan primer ITS1
Komposisi PCR berjumlah 50 l yang terdiri dari 5 l 10 x buffer PCR, 5 l campuran 10 M dNTP (masing-masing 10 l), 1.25 l 10 M setiap primer, 1 g DNA cetakan, dan 0.25 l Taq DNA polymerase (5U/ l). Reaksi PCR ialah pra denaturasi pada 95°C selama 5 menit, denaturasi 95°C selama 1 menit, annealing
52°C selama 1 menit, elongasi 72°C selama 2 menit, pasca PCR 72°C selama 10
menit, dan pendinginan 15°C selama 10 menit.
2.3.Sekuensing DNA
Sekuensing dilakukan dengan bantuan PT. Genetika Science Indonesia,
Jakarta.DNA murni disekuen menggunakan metode Sanger dengan alat ABI
3730XL (Sambrook et al. 1989).
2.4.Analisis BLAST Sekuens ITS rDNA
Hasil sekuensing dianalisis dan ditentukan homologinya dengan
spesies-spesies yang telah ada di Bank Genmenggunakan program Clustal W Bioedit dan
BLAST (Altscchul et al. 1997) dengan bantuan situs NCBI (http://www.ncbi.nlm.nih.gov.) dan Mycobank (www.mycobank.com).
2.5.Analisis Filogenetik
Analisis filogenetik dilakukan dengan membandingkan hasil sekuensing
daerah ITS rDNA jamur pelawan dengan sekuens-sekuens hasil BLAST-nya yang
telah ada di Bank Gen. Sekuens diekstrak menggunakan program Clustal W
bioedit sedangkanpohon filogeni dikonstruksi dengan MEGA 4 (Tamura et al.
2007). Analisis filogenetik dilakukan dengan menggunakan daerah ITS DNA
ribosom untuk menentukan spesies yang memiliki kekerabatan terdekat dari jamur
pelawan.
3. Karakterisasi Struktur Ektomikoriza simbion
Akar yang melekat pada tubuh buah dikarakterisasi dengan diamati di
bawah mikroskop stereo dan mikroskop cahaya. Tipe percabangan akar diamati
di bawah mikroskop stereo, sedangkan struktur mantel dan jala Hartig diamati di
bawah mikroskop cahaya dengan penyayatan secara memanjang dan radial.
Pewarnaan akar dilakukan dengan pewarna biru trifan merujuk pada metode
Brundrett et al. (1996). Tipe percabangan dan struktur mantel diamati berdasarkan metode Agerer (1991). Sayatan akar dipreparasi dengan metode
HASIL DAN PEMBAHASAN
1. Karakteristik Morfologi Jamur Pelawan A.Deskripsi morfologi jamur Pelawan
Heimioporus sp.
Tudung berdiameter 1.51-14.2 cm, cembung, agak berbentuk payung
sampai mendatar, halus atau retak, kering, agak mengkilat saat basah, merah
marun tua, merah kecokelatan, sebagian kuning kecokelatan, sering dengan
bagian tepian berwarna kuning. Daging tudung tebalnya 1.2-8.4 mm, krem,
kuning muda pucat,atau putih kemerahan, tidak berubah kebiruan saat terpapar
udara atau agak biru. Pori hampir bebas sampai bebas, diameter 0.25-1.8 mm,
bersiku atau agak bulat, merah tua, kuning muda pucat sampai kuning kehijauan;
tinggi tabung pada bagian pusat 0.41-0.73 cm dan bagian tengah 0.67-1.65 cm,
kuning muda, kuning kemerahan sampai kuning kehijauan, tepian rata. Tangkai
berdiameter atas 0.32-1.3 cm, tengah 0.48-1.5 cm dan bawah 0.58-1.6 cm,
panjang 4.54 sampai 12.7 cm, letak di pusat, permukaan berlajur seiring panjang
atau berjala dangkal sampai agak dalam, merah marun tua, merah kecokelatan,
atau merah muda, puncak kuning tepat di bawah tudung, dasar ada yang kuning
atau hijau kecokelatan, daging tangkai kuning, krem atau kemerahan, tidak
berubah saat terpapar udara atau sedikit membiru, padat atau berongga, kering,
clavatus, dinding tipis, bening, 2, 3-4 spora, sterigmata 3.5-10 m. Basidiola 15.3-26.78 x 7.65-20 m, clavatus, dinding tipis, bening. Cheilocystidia 39.78-58.65 x 5.1-20 m, berbentuk seperti botol, dinding tipis, bening. Pleurocystidia 25.58-35.47 x 12.01-12.85. Pileipelis berupa jaringan palisade dengan pileocystidia
sampai 45.9 x 10.2 sampai 16.5 m, hifa tidak bersekat lebar 5.1-10.2 m, sangat
panjang, dinding tipis, bening. Terdapat hifa oleiforus. Trama tabung bilateral
tipe boletoid. Clamp connection tidak ada.
Habit dan habitus. Soliter, dua-dua atau berkelompok di atas tanah, di atas
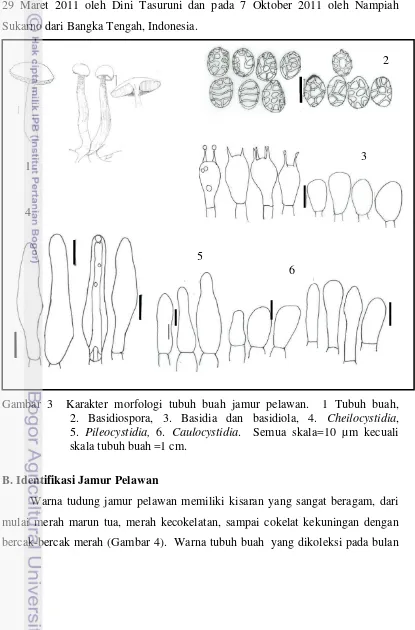
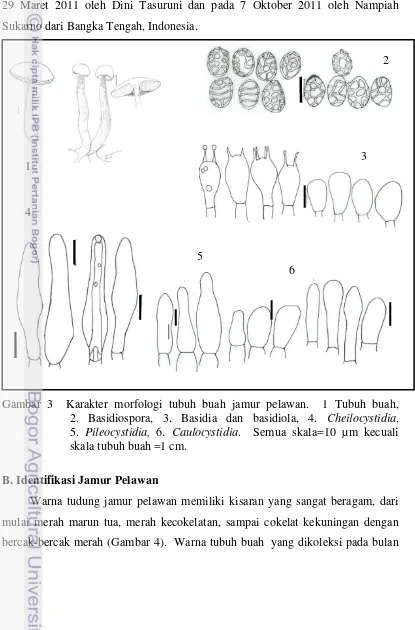
serasah sekitar tumbuhan T. Merguensis. Spesimen yang diamati diambil pada 29 Maret 2011 oleh Dini Tasuruni dan pada 7 Oktober 2011 oleh Nampiah
Sukarno dari Bangka Tengah, Indonesia.
Gambar 3 Karakter morfologi tubuh buah jamur pelawan. 1 Tubuh buah, 2. Basidiospora, 3. Basidia dan basidiola, 4. Cheilocystidia, 5. Pileocystidia, 6. Caulocystidia. Semua skala=10 µm kecuali skala tubuh buah =1 cm.
B.Identifikasi Jamur Pelawan
Warna tudung jamur pelawan memiliki kisaran yang sangat beragam, dari
mulai merah marun tua, merah kecokelatan, sampai cokelat kekuningan dengan
bercak-bercak merah (Gambar 4). Warna tubuh buah yang dikoleksi pada bulan 1
2
3
4
5
Maret umumnya lebih seragam dibandingkan dengan yang dikoleksi pada bulan
Oktober. Pada bulan Oktober terdapat gradasi warna bahkan dalam satu tubuh
buah. Hanya tubuh buah yang sangat kecil ( diameter tudung 1.33-1.57 cm yang
memiliki warna sangat merah (Gambar 4C). Hal tersebut kemungkinan
disebabkan oleh kelembaban yang tinggi dan curah hujan yang berbeda. Bentuk,
warna dan ukuran tubuh buah jamur dapat mengalami variasi yang disebabkan
oleh faktor lingkungan misalnya intensitas cahaya, paparan terhadap cahaya,
komposisi serasah (Way et al. 1995) sehingga warna tubuh buah pada musim hujan umumnya lebih terang.
Gambar 4 Warna tudung tubuh buah jamur pelawan. Gambar atas dikoleksi pada bulan Maret 2011, gambar bawah dikoleksi pada bulan Oktober 2011. Merah marun tua (A, C), merah kecokelatan (A,B), merah muda kusam (D), kuning kecokelatan (E).
Jamur pelawan mempunyai variasi morfologi yang cukup mencolok
(Gambar 4, lampiran 1-3). Meski demikian, terdapat beberapa ciri umum yang
dimiliki oleh jamur tersebut. Ciri-ciri tersebut ialah tudung cembung sampai
mendatar atau agak berbentuk payung, berwarna merah tua-merah kecokelatan,
halus atau pecah-retak, berpori dengan bentuk bersiku atau agak bulat, merah atau
kuning muda pucat sampai kuning kehijauan, tangkainya merah yang sama
dengan tudung atau lebih tua, berjala merah tua, jejak spora kuning zaitun
A B
D E
kecokelatan, spora berbentuk agak seperti telur sampai lonjong dan berornamen
berwarna kuning madu. Merujuk pada kunci identifikasi Pegler (1986) dan Singer
(1986) jamur pelawan termasuk ke dalam ordo Boletales, famili Boletaceae.
Gambar 5 Spora Heimioporus sp. dilihat di bawah mikroskop SEM. A. Permukaan spora dengan lubang-lubang yang cukup lebar B. Permukaan spora dengan lubang-lubang melebar dan memanjang
Bentuk dan ornamentasi spora jamur pelawan (Gambar 5) menyerupai
bentuk spora Heimioporus retisporus dan spesies Heimioporus lainnya yang dilaporkan oleh Watling & Hollands (1990). Brundret et al. (1996), Corner
A
(1972) dan Pegler (1986) menyatakan bahwa Boletaceae dengan spora retikulat sempurna tanpa adanya pola bagian dasar (adaxial patch) digolongkan ke dalam genus Heimioporus. Bentuk spora retikulat ini pula yang membedakan
Heimioporus dari Boletus, Boletellus dan Austroboletus. Permukaan spora
Boletus halus, Boletellus bergerigi, dan Austroboletus berbintik-bintik (Halling & Mueller 2005).
Berdasarkan morfologi sporanya, jamur pelawan merupakan bagian dari
genus Heimioporus. Genus ini ditandai dengan ornamentasi spora yang unik, yaitu dinding basidiosporanya berlubang-lubang atau berornamen
alveolat-retikulat sampai alveolat-retikulat atau dengan lubang-lubang seperti gua, tidak pernah
padat (Halling & Fechner 2011). Ornamentasi spora jamur pelawan yaitu
alveolat-retikulat atau berlubang-lubang yang besar dan lebar (Gambar 5).
Berdasarkan Horak (2005), jamur pelawan termasuk ke dalam genus Heimioporus
subgen. heimioporus. Bentuk spora ini berbeda dengan spesies Heimioporus
subgen punctisporus seperti H. alveolatus, H. betula dan H. punctisporus yang berlubang-lubang kecil atau punctatus (Gambar 1A) dan H. fruticicola yang bergerigi seperti otak atau kawah (Gambar 1B). Sebaliknya, cukup banyak
spesies dari genus Heimioporus yang mempunyai ornamentasi yang sama dengan jamur pelawan yaitu H. anguformis, H. ivoryi, H. japonicus, H. kinabaluensis, H. mandarinus, H. nigricans, H. retisporus, H. ridleyi, H. rubropunctus, H. subretisporus, dan H. xerampelina (Horak 2005).
Bila dibandingkan dengan Heimioporus lainnya, jamur pelawan mempunyai beberapa kesamaan dan perbedaan. Bentuk, ukuran, dan warna tudung jamur
pelawan hampir sama dengan beberapa spesies Heimioporus lainnya. Warna tudung dan tangkai jamur pelawan mirip dengan H. ivoryi (Ortiz-Santana et al.
2008), H. japonicus (Chantorn et al. 2007, Halling & Fechner 2011),
H. mandarinus (Horak 2011) dan H. retisporus (Corner 1972, Horak 2011, Seehanan & Pecharat 2008, Thongklam 2008). Akan tetapi jamur pelawan
berbeda dengan H. ivoryi karena ukuran sporanya lebih kecil, tangkainya berjala merah tua dengan puncak yang berwana kuning hanya tepat di bawah tudung, dan
warna tubuh buah tidak segera menghitam setelah terbuka. Jamur pelawan
Heimioporus anguiformis, H. kinabaluensis dan H. mandarinus (Corner 1972, Horak 2011) yang tangkainya umumnya panjang (lebih dari 17 cm), spora lebih
besar, dan tidak mempunyai hifa oleiferus. Berbeda dengan jamur pelawan,
H. japonicus (Halling & Fechner 2011) bentuk sporanya lebih panjang (lonjong-fusoid) dengan tangkai yang berjala atau beralur dan berbintik merah serta
permukaan tudung yang berbeda, sedangkan H. subretisporus mempunyai tangkai yang lebih panjang (12-17 cm) dan tidak berjala. Dengan merujuk pada kunci
identifikasi Halling pada sistus NYBG (www.nybg.org), jamur pelawan termasuk
spesies H. retisporus karena tudungnya berwarna merah dan kering, berada di Asia, dan sporanya retikulat-alveolat serta berukuran kecil.
Heimioporus retisporus pertama kali dideskripsikan oleh Patouillard dan Baker (1918) sebagai Boletus retisporus. Selain itu Boedijn (1951), Corner (1972), Seehanan & Petcharat (2008) dan Thongklam (2008) juga telah meneliti
H. retisporus dari Asia. Dari semua publikasi yang ada didapati beberapa variasi dari spesies tersebut. Dibandingkan dengan H. retisporus, jamur pelawan mempunyai beberapa kesamaan dan perbedaan. Warna dan bentuk tudung jamur
pelawan sama dengan hampir semua H. retisporus kecuali yang dideskripsi oleh Boedijn (1951) karena tidak mempunyai puncak yang menonjol atau umbo. Selain itu ukuran spora jamur pelawan sama atau mendekati H. retisporus Horak
(2011), Patouillard & Baker (1918), dan Seehanan & Petcharat (2008) tetapi
berbeda dengan H. retisporus Boedijn (1951) dan Thongklam (2008) yang berukuran jauh lebih besar. Perbedaan ukuran ini juga terjadi pada H. japonicus
dari Malaysia yaitu 9,5 -15 X 8-10 m (Corner 1λ72), dari Thailand yaitu λ-13 X 6-8 m (Chantorn et al. 2007) dan dari Australia yaitu 10-14,7 x 6,3-8,4 m (Halling & Fechner 2011). Ciri dan ukuran mikroskopis jamur pelawan
mendekati H. retisporus Malaysia (Corner 1972, Horak 2011) tetapi bentuk komponen pelis dan caulocystidianya berbeda. Jamur pelawan juga mirip dengan
H. retisporus Thailand (Seehanan & Petcharat) tetapi deskripsinya kurang lengkap sehingga perbandingan ciri mikroskopiknya tidak dapat dilakukan. Heimioporus retisporus Patouilard & Baker (1918) juga sangat mirip jamur pelawan tapi warna sporanya berbeda yaitu cokelat. Karena perbedaan tersebut maka kemungkinan
Foto SEM spora jamur pelawan menunjukkan lubang-lubang yang besar dan
lebar dengan banyak sisi atau memanjang (Gambar 5). Jika dibandingkan dengan
artikel Watling & Hollands (1990) dan koleksi gambar dari Mycobank (Gambar
2) (http://www.nybg.org/bsci/res/hall/boletes/Heimioporus spores.html/) foto SEM spora jamur pelawan mirip dengan spora H. retisporus, H. mandarinus dan
H. rubropunctus (Gambar 1D-F), tetapi tidak benar-benar sama. Perbedaannya terletak pada jala-jala yang lebih tebal pada H. retisporus dan lubang-lubang yang lebih dalam dan membulat pada H. mandarinus dan H. rubropunctus. Dengan demikian jika berdasarkan foto SEM, spesies jamur pelawan berbeda dengan jenis
yang telah ada, padahal data tersebut merupakan data yang sangat akurat dan
informatif. Selain itu, karena bentuk mikroskopik jamur pelawan juga berbeda
dengan spesies H. retisporus yang lain, maka kemungkinan jamur pelawan merupakan spesies yang berbeda.
Dari kedua variasi tubuh buah jamur pelawan yang dikarakterisasi tampak
keduanya merupakan spesies yang sama. Hal ini dapat dilihat dari perbandingan
mikroskopik yang hampir sama, terutama bentuk dan ukuran spora (Lampiran 1
dan 2). Warna pori yang merah kemungkinan merupakan warna pori jamur
tersebut pada saat muda. Setelah pori terpapar udara dan kelembaban di sekitar
serta seiring dengan perkembangan tubuh buah, kemungkinan pori berubah warna
menjadi kuning. Keadaan lingkungan yang berbeda menyebabkan perbedaan
kisaran warna merah-kuning tersebut. Hal tersebut juga terbukti dari tidak
terdapatnya tubuh buah besar dengan warna pori yang semerah tubuh buah pada
saat masih sangat kecil. Selain itu, tudung buah dengan pori yang semula
berwarna merah, setelah perlakuan lembab satu malam warnanya berubah menjadi
kuning kecokelatan. Dapat disimpulkan bahwa keragaman morfologi yang terjadi
semata-mata disebabkan oleh kondisi lingkungan yang berbeda pada saat tubuh
buah tersebut tumbuh dan berkembang.
Tubuh buah jamur pelawan umumnya tidak bereaksi dengan udara sehingga
tidak berubah warna segera menjadi biru saat dibuka atau terpapar udara atau
bersifat non cyanescent. Demikian juga saat tubuh buah dibelah dengan pisau atau dipegang dengan tangan, bagian yang tersentuh tidak berubah atau
aman dikonsumsi dan tidak beracun. Sifat ini sama dengan spesies Heimioporus
lainnya yang besifat edibel (Thongklam 2008). Meski demikian, satu spesies
heimioporus yang bersifat halusinogen yaitu H. anguiformis, juga bersifat non
cyanescent (Corner 1972).
2. Analisis Sekuens ITS rDNA Tubuh Buah jamur Ektomikoriza Pelawan A.Ekstraksi DNA, PCR dan Sekuensing
DNA genom diisolasi dari tubuh buah jamur pelawan yang mempunyai pori
berwarna kuning dan merah. DNA diisolasi dengan metode CTAB maupun
metode Raeder & Broda (1985). Hasil spektrofotometri DNA mempunyai
kemurnian sekitar 1.73 sampai 2.0 yang menunjukkan hasil yang cukup murni,
tidak terkontaminasi oleh protein. DNA selanjutnya diamplifikasi PCR
menggunakan primer ITS1 dan ITS4.
Gambar 6 Produk PCR daerah ITS rDNA jamur pelawan. DNA ITS rDNA tubuh buah berpori kuning (A) dan berpori merah (B).
Produk PCR daerah ITS DNA tubuh buah jamur pelawan yang
diamplifikasi menggunakan primer ITS1 dan ITS4 mempunyai ukuran sekitar
700 nukleotida (Gambar 6). Menurut Nilsson et al. (2008) nilai rataan ukuran ITS 1, 5.8S, dan ITS 2 berturut-turut ialah 183, 158, dan 173 pasang basa.
Berdasarkan ukuran basa yang diperoleh menunjukkan bahwa daerah yang
teramplifikasi meliputi sebagian daerah 18S, daerah yang utuh dari ITS1, 5.8S dan
ITS2, serta sebagian daerah 28S DNA ribosom. Hal ini sesuai dengan peran
primer ITS 1 yang mengamplifikasi daerah DNA ribosom dari ujung 18S ke arah
kanan menuju daerah 28S, sedangkan primer ITS4 mengamplifikasi DNA dari
disebabkan hasil sekuens JPPM hanya satu arah yang dapat terbaca dengan baik.
Dari kedua sekuens tersebut hanya ditemukan 3 basa yang berbeda, yaitu pada
ujung kanan (Gambar 7). Perbedaan 3 basa nitrogen dari sekitar 600 pasang basa
dalam daerah ITS rDNA masih dapat ditoleransi karena keragaman daerah
tersebut sangat tinggi, termasuk di dalam satu spesies sehingga dapat digunakan
juga sebagai penanda variabilitas intra spesies. Pada Basidiomisetes, rataan
keragaman daerah ITS rDNA intraspesies adalah 3.33% (Nilsson et al. 2008). Dengan demikian kedua tubuh buah jamur pelawan merupakan spesies yang
sama.
Gambar 7 Hasil penyejajaran sekuens ITS rDNA jamur pelawan dengan program Clustal W bioedit JPPK (atas) dan JPPM (bawah).
B.Analisis BLAST
Analisis BLAST sekuens ITS rDNA jamur pelawan dilakukan untuk seluruh
DNA yang teramplifikasi dengan primer ITS1 dan ITS4 di NCBI dan Mycobank.
Rendahnya perbedaan antara sekuens DNA kedua tubuh buah (Gambar 7)
menyebabkan hasil BLAST antara kedua sekuens tersebut sama. Hasilnya
menunjukkan bahwa jamur pelawan memiliki kesamaan tertinggi dengan
Strobilomyces retisporus sebesar 89% dengan nilai penutupan 90% (NCBI, Lampiran 9) dan kesamaan 86.7% dengan penutupan 72.6% (Mycobank,
lampiran 10 dan 11). Menurut Corner (1972), Horak (2005, 2011), dan data
Mycobank, S. retisporus merupakan sinonim dari H. retisporus. Dengan demikian secara molekuler jamur pelawan mempunyai kemiripan yang cukup
tinggi dengan H. retisporus. Rataan keragaman intraspesies dalam filum Basidiomycota ialah di bawah 4% (Nilsson et al. 2008). Karena nilai homologinya masih di bawah 96%, maka jamur pelawan berkerabat dekat dengan
H. retisporus tetapi berbeda spesies.
Nilai homologi yang rendah dengan spesies-spesies yang terdapat di Bank