ANALISIS KERAGAMAN BEBERAPA GENOTIPE DURIAN
(
Durio zibethinus
Murr.)
MENGGUNAKAN PENANDA
MORFOLOGI DAN MOLEKULER (ISSR)
KARLINA SYAHRUDDIN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASINYA
Dengan ini saya menyatakan bahwa tesis yang berjudul Analisis Keragaman Beberapa Genotipe Durian (Durio zibethinus Murr.) menggunakan Penanda Morfologi dan Molekuler (ISSR) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Juli 2012
ABSTRACT
KARLINA SYAHRUDDIN. Variability Analysis of Several Genotipes of Durian (Duriozibethinus Murr.) using Morphological and Molecular (ISSR) Markers. Under guidance by SOBIR and NURUL KHUMAIDA.
Indonesia is one of the durian diversity center. Evaluation and characterization activities should be conducted to identify the genotipes in order to differentiate the individual plant in the spesies. Genetic variation of 21 collected genotipes of Indonesia Agency for Agricultural Research and Development (IAARD) Cipaku orchard, Bogor was evaluated using morphological and Inter Simple Sequence Repeat (ISSR) markers. Variability analysis based on 22 morphological characters gained 64 (100%) polymorphism. Molecular analysis using ten primers of ISSR amplified 48 locus. The 39 locus (81.25%) were polymorphic and the 9 locus (18.75%) were monomorphic, respectively. Both of the markers have different clustering, therefore they should be analysed using Joint Analysis. The result of the study showed genetic variability among 21 genotipes was grouped into 2 clusters on 0.51 similarity coefficient. The first group (A) consisted of the genotipe from Indonesia and the second group (B) consisted of Kanjau genotipe from Thailand with matrix correlation value was 0.83. Kanjau genotipe was suggested as a candidate in durian breeding programme, in order to increase Indonesian durian value in the future.
RINGKASAN
KARLINA SYAHRUDDIN. Analisis Keragaman Beberapa Genotipe Durian (Durio zibethinus Murr.) menggunakan Penanda Morfologi dan Molekuler (ISSR). Dibimbing oleh SOBIR dan NURUL KHUMAIDA.
Indonesia merupakan pusat keragaman tanaman durian dengan sejumlah besar sumber daya genetik yang belum banyak dimanfaatkan. Salah satu pemanfaatan tanaman durian adalah dengan program pemuliaan dalam rangka perbaikan genetik tanaman durian yang sangat bergantung pada sumber keragaman genetik durian itu sendiri. Oleh karena itu koleksi plasma nutfah durian Balai Pengkajian Teknologi Pertanian (BPTP), Kebun Percobaan Cipaku, perlu dievaluasi keragaman genetiknya untuk kegiatan manipulasi genetik ke arah perakitan kultivar unggul yang diinginkan. Kendala yang diperoleh dengan hanya mengandalkan keragaman morfologi adalah terbatasnya karakter yang diamati dan sangat bergantung pada lingkungan, oleh karena itu diperlukan alat bantu yang lain yaitu dengan metode molekuler. Metode analisis molekuler yang banyak digunakan saat ini adalah yang berbasis PCR. Salah satu penanda yang dapat digunakan dengan metode tersebut yaitu penanda ISSR. Diharapkan dengan kombinasi kedua penanda tersebut akan menghasilkan data yang lebih akurat dalam mencari besar nilai keragaman dan pola hubungan genetik diantara 21 genotipe durian.
Karakter morfologi yang dapat diamati pada 21 genotipe yang diuji adalah sebanyak 22 karakter. Berdasarkan karakter tersebut diperoleh 64 sub karakter polimorfik (100%). Hasil analisis pengelompokan diperoleh koefisien kemiripan genetik sebesar 0.34 hingga 0.83 dengan besar nilai keragaman berkisar 7 hingga 66%. Hasil penelitian ini mengelompokkan 21 genotipe durian dalam 2 kelompok pada koefisien kemiripan 0.34 yaitu kelompok A meliputi Lokal cipaku, Layung, Tambleg, Kendil, Hepe, Sikoclak, Manalagi, Pangkalan, Pingku, Pasirjati, Perwira, Mentega, Bulan, Tanjung mabah, Kuning garing, Hejo, Aseupan, Semeng, Sunan dan kelompok B meliputi Kim dan Kanjau. Pengelompokan terpisah berdasarkan perbedaan karakter bentuk ujung daun, keadaan pinggir daun, keadaan permukaan daun dan warna daun.
Hasil amplifikasi DNA 21 genotipe durian dengan menggunakan 10 primer menghasilkan 659 pita DNA, dengan 48 lokus yang terdiri dari pola pita polimorfik sebanyak 39 lokus dengan 470 pita atau sebesar 81.25 % dan pita monomorfik sebanyak 9 lokus dengan 189 pita atau sebesar 18.75 %. Koefisien kemiripan genetik 21 genotipe dari sepuluh primer ISSR berkisar antara 0.68-0.92, yang berarti keragaman genetik berkisar 8 sampai 32 %. Berdasarkan hasil analisis pengelompokan diperoleh 2 kelompok pada koefisien kemiripan 0.68, yaitu kelompok genotipe Indonesia dan genotipe Kanjau (Thailand).
kelompok A meliputi genotipe durian dari Indonesia meliputi Lokal cipaku, Layung, Tambleg, Kendil, Hepe, Sikoclak, Manalagi, Pangkalan, Pingku, Pasirjati, Perwira, Mentega, Bulan, Tanjung mabah, Kuning garing, Hejo, Aseupan, Semeng, Sunan, Kim dan kelompok B meliputi dan Kanjau dari Thailand. Durian genotipe Kanjau merupakan genotipe potensial untuk dijadikan tetua persilangan untuk menghasilkan durian dengan karakter yang sesuai dengan kebutuhan pasar.
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
ANALISIS KERAGAMAN BEBERAPA GENOTIPE DURIAN
(
Durio zibethinus
Murr.)
MENGGUNAKAN PENANDA
MORFOLOGI DAN MOLEKULER (ISSR)
KARLINA SYAHRUDDIN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Analisis Keragaman Beberapa Genotipe Durian (Durio zibethinus Murr.) Menggunakan Penanda Morfologi dan Molekuler (ISSR).
Nama : Karlina Syahruddin
NIM : A.253090151
Disetujui
Komisi Pembimbing
Dr. Ir. Sobir, MSi Dr. Ir. Nurul Khumaida, MSi
Ketua Anggota
Diketahui
Ketua Mayor Dekan Sekolah Pascasarjana
Pemuliaan dan Bioteknologi Tanaman
Dr. Ir .Trikoesoemaningtyas, MSc Dr. Ir. Dahrul Syah, MSc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian
adalah Analisis Keragaman Beberapa Genotipe Durian (Durio zibethinus
Murr.) menggunakan Penanda Morfologi dan Molekuler (ISSR). Penelitian
dilaksanakan sejak bulan Agustus 2011 sampai dengan Januari 2011.
Ucapan terimakasih dan penghargaan yang setinggi-tingginya
penulis sampaikan kepada :
1. Dr. Ir. Sobir, MSi dan Dr. Ir. Nurul Khumaida, MSi selaku komisi
pembimbing yang telah memberikan arahan dan bimbingan sejak
perencanaan, pelaksanaan sampai penyelesaian penyusunan tesis.
2. Dr. Ir. Trikoesoemaningtyas, MSc selaku ketua Mayor Pemuliaan dan
Bioteknologi Tanaman SPs IPB dan Dr. Ir. Darda Efendi, MSi selaku
Sekretaris Mayor Pemuliaan dan Bioteknologi Tanaman SPs IPB.
3. Pusat Kajian Hortikultura Tropika IPB, yang telah memberikan izin
kepada penulis untuk melakukan penelitian di Laboratorium Molekuler.
4. Balai Pengkajian dan Pengembangan Teknologi Pertanian Bogor, Kebun
Percobaan Cipaku, yang telah memberikan izin kepada penulis untuk
melakukan penelitian morfologi.
5. Dr. Desta Wirnas, SP MSi selaku penguji luar komisi pembimbing.
6. Prof. Dr. Ir. Sudarsono, MSc yang meluangkan waktu untuk berdiskusi.
7. Bapak dan Ibu, kakak (Rika Fitriani, Silvana, Soraya, Fatah,
Jamaluddin), Adik (Sadly, Dian, Rian, Sofyan, Bella dan Devi) serta
seluruh keluarga besar atas restu dan doanya.
8. Erni seminar SP MSi, Dr. Wierny, Dr. Sumadi yang telah mendukung
penulis untuk melanjutkan studi.
9. Sulassih SP MSi, Rahmah Badaruddin, Dede safitri setiawan, Siti
Halimah, Amin Nur, Yusra, Nur Arifin, Vina, Vitri, Erwin, Ernila, Ina
Rahmawati, Sofie, Kristiana, Sulaiman, Cory, Sri Imriani Pulungan, Ira
Bahari, Ipit, Devina, Dina, Putri, Reni, Deden, Selvy, Ade Andry atas
10.Dosen-dosen mayor Pemuliaan dan Bioteknologi Tanaman atas ilmu dan
dukungannya.
11.Teman-teman di Faperta IPB atas doa dan dukungannya.
12.Teman-teman Mayor AGH, PBT 2008, 2009 dan 2010 atas
kebersamaannya.
13.Teman-teman Pondok Rizky atas doa dan kebersamaannya.
14.Adeel Abdulkarim Fadhl Altuhish atas dorongan dan motivasinya
selama penulis menyelesaikan penulisan tesis.
15.Teman-teman yang tidak bisa penulis sebutkan namanya satu-satu.
Terimakasih atas dukungan dan cintanya.
Semoga karya ilmiah ini dapat bermanfaat bagi pengembangan ilmu
pengetahuan dan ilmu pertanian masa depan.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Makassar, 7 November 1983 dari pasangan
Alm. Bapak Syahruddin dan Ibu Nurmiaty Norma. Penulis adalah anak ke
empat dari sepuluh bersaudara. Tahun 2002 penulis lulus dari SMA Negeri
1 Makassar dan pada tahun yang sama penulis melanjutkan studi pada
program sarjana Agronomi, Teknologi Benih Fakultas Pertanian UNPAD.
Penulis berkesempatan melanjutkan pendidikan Program Magister Sains
pada Mayor Pemuliaan dan Bioteknologi Tanaman, Sekolah Pascasarjana
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
Kerangka Pemikiran ... 4
TINJAUAN PUSTAKA Sejarah penyebaran, taksonomi dan botani tanaman durian ... 7
Analisis keragaman genetik tanaman durian ... 9
Penanda Morfologi ... 10
Penanda Molekuler InterSimple Sequence Repeats (ISSR) ... 11
METODOLOGI Waktu dan Tempat ... 13
Bahan dan Alat ... 13
Metode ... 14
Analisis Data ... 20
HASIL DAN PEMBAHASAN Keragaman Karakter Morfologi ... 23
Analisis Penanda Morfologi ... 23
Analisis Penanda Molekuler ... 37
Analisis Gabungan Penanda Morfologi dan Molekuler (ISSR)... 47
SIMPULAN DAN SARAN Simpulan ... 51
Saran ... 51
DAFTAR PUSTAKA ... 53
DAFTAR TABEL
Halaman
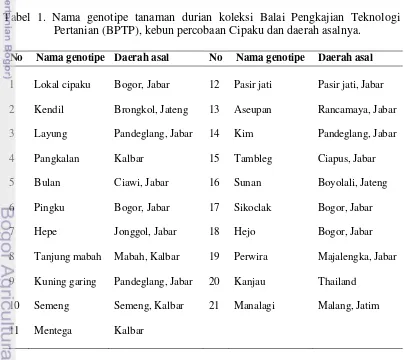
1. Nama genotipe tanaman durian koleksi Balai Pengkajian Teknologi Pertanian (BPTP), kebun percobaan Cipaku dan daerah asalnya ... 13
2. Karakter pengamatan morfologi vegetatif sifat kualitatif pada 21
genotipe tanaman durian di BPTP kebun percobaan Cipaku ... 15
3. Karakter pengamatan morfologi vegetatif sifat kuantitatif pada 21
genotipe tanaman durian di BPTP kebun percobaan Cipaku ... 16
4. Nama dan susunan basa primer ISSR koleksi PKHT-IPB ... 19
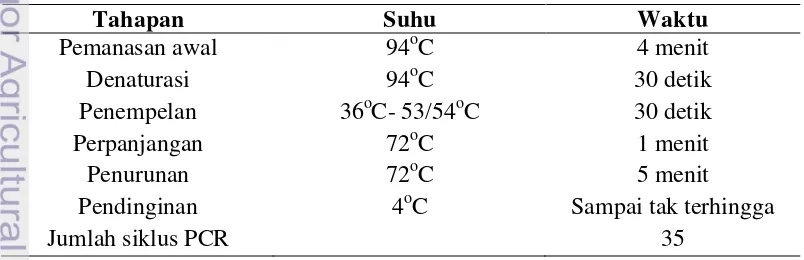
5. Suhu dan waktu yang digunakan pada proses Polymerase Chain
Reaction ... 19
6. Keragaan primer dan lokus pada penanda molekuler ... 20
7. Karakter morfologi vegetatif sifat kualitatif dan proporsi subkarakternya yang ditunjukkan pada 21 genotipe tanaman durian koleksi BPTP kebun percobaan Cipaku ... 24
8. Proporsi karakter daun yang muncul pada 21 genotipe tanaman durian yang diamati di BPTP kebun percobaan Cipaku ... 27
9. Karakter morfologi vegetatif sifat kuantitatif dan proporsi subkarakter yang ditunjukkan pada 21 genotipe tanaman durian koleksi BPTP kebun percobaan Cipaku ... 31
10.Rekapitulasi karakter polimorfik penanda morfologi pada 21 genotipe tanaman durian ... 34
11.Hasil amplifikasi sepuluh primer ISSR pada 21 genotipe tanaman
DAFTAR GAMBAR
Halaman
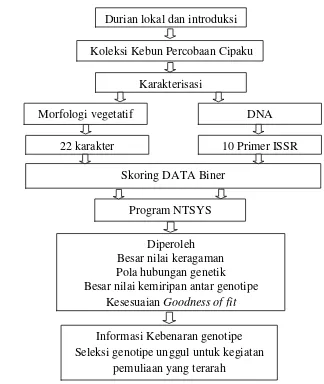
1. Bagan alur penelitian analisis keragaman durian koleksi Balai Pengkajian Teknologi Pertanian, kebun Percobaan Cipaku
berdasarkan penanda morfologi dan molekuler (ISSR). ... 5
2. Wilayah amplifikasi Inter Simple Sequence Repeats (ISSR) ... 12
3. Skematik pengukuran karakter kuantitatif daun durian ... 16
4. Keragaan pinggir daun pada tanaman durian ... 26
5. Keragaan bentuk daun durian genotipe Kanjau ... 29
6. Dendogram koefisien kemiripan 21 genotipe tanaman durian berdasarkan karakter morfologi vegetatif sifat kualitatif. ... 32
7. Dendogram koefisien kemiripan 21 genotipe tanaman durian berdasarkan karakter morfologi vegetative sifat kuantitatif ... 33
8. Dendogram koefisien kemiripan 21 genotipe tanaman durian berdasarkan karakter morfologi vegetatif ... 35
9. Karakter daun pada genotipe durian Kim (A) dan Kanjau (B). ... 36
10.Profil pita DNA yang dibentuk pada primer PKBT 4. ... 41
11.Profil pita DNA yang dibentuk pada primer PKBT 10 ... 40
12.Profil pita DNA yang dibentuk pada primer PKBT 9 ... 40
13.Profil pita DNA yang dibentuk pada primer PKBT 12 ... 41
14.Perbedaan pola pita DNA genotipe kanjau dan genotipe Indonesia ... 43
15.Dendogram 21 genotipe tanaman durian berdasarkan profil pita DNA ... 46
DAFTAR LAMPIRAN
Halaman
1. Koefisien kemiripan pada 21 genotipe tanaman durian berdasarkan
penanda morfologi vegetatif sifat kualitatif ... 57
2. Koefisien kemiripan pada 21 genotipe tanaman durian berdasarkan penanda morfologi vegetatif sifat kuantitatif ... 58
3. Koefisien kemiripan pada 21 genotipe tanaman durian berdasarkan penanda morfologi vegetatif ... 59
4. Koefisien kemiripan pada 21 genotipe tanaman durian berdasarkan penanda molekuler (ISSR) ... 60
5. Koefisien kemiripan pada 21 genotipe tanaman durian berdasarkan penanda gabungan ... 61
6. Deskripsi morfologi vegetatif durian Lokal cipaku ... 62
7. Deskripsi morfologi vegetatif durian Kendil ... 63
8. Deskripsi morfologi vegetatif durian Layung ... 64
9. Deskripsi morfologi vegetatif durian Pangkalan ... 65
10.Deskripsi morfologi vegetatif durian Bulan... 66
11.Deskripsi morfologi vegetatif durian Pingku ... 67
12.Deskripsi morfologi vegetatif durian Hepe ... 68
13.Deskripsi morfologi vegetatif durian Tanjung mabah ... 69
14.Deskripsi morfologi vegetatif durian Kuning garing ... 70
15.Deskripsi morfologi vegetatif durian Semeng ... 71
16.Deskripsi morfologi vegetatif durian Mentega ... 72
17.Deskripsi morfologi vegetatif durian Pasirjati ... 73
18.Deskripsi morfologi vegetatif durian Aseupan ... 74
19.Deskripsi morfologi vegetatif durian Kim ... 75
21.Deskripsi morfologi vegetatif durian Sunan ... 77
22.Deskripsi morfologi vegetatif durian Sikoclak ... 78
23.Deskripsi morfologi vegetatif durian Hejo ... 79
24.Deskripsi morfologi vegetatif durian Perwira ... 80
25.Deskripsi morfologi vegetatif durian Kanjau... 81
PENDAHULUAN
Latar Belakang
Indonesia merupakan salah satu negara dengan kekayaan hayati yang
tinggi di dunia. Salah satu kekayaan hayati tersebut adalah tanaman durian.
Indonesia merupakan pusat keragaman tanaman durian, dimana 19 spesies
ditemukan di Kalimantan, 14 spesies diantaranya adalah endemik Kalimantan dan
7 spesies ditemukan di Sumatra (Subhadrabandhu S & Ketsa 2001). Enam spesies
dari 26 spesies Durio tersebut, merupakan spesies yang dapat dikonsumsi, namun
hanya Durio zibethinus Murr. yang banyak dikembangkan karena memiliki aroma
dan rasa yang khas. D. zibethinus ini kemudian tersebar ke seluruh wilayah
Indonesia dan berkembang menjadi genotipe-genotipe spesifik wilayah.
Program pemuliaan tanaman dalam rangka menghasilkan varietas unggul
untuk memenuhi kebutuhan pasar bergantung pada besarnya keragaman genetik yang
tersedia. Program multivarietas yang dicanangkan oleh pemerintah merupakan suatu
kegiatan eksplorasi dengan mencari plasma nutfah dari wilayah dimana terdapat
keragaman genetik yang tinggi yaitu tempat asal berkembangnya spesies tanaman
tertentu (center of origin) atau dari wilayah di mana tanaman tersebut dibudidayakan
secara intensif (center of diversity). Upaya pengkayaan plasma nutfah kemudian
dengan melakukan kegiatan koleksi, domestikasi dan introduksi (Baihaki et al. 1999).
Kegiatan koleksi bertujuan untuk mengumpulkan plasma nutfah dengan
memanfaatkan variasi yang ada di alam. Koleksi plasma nutfah juga bertujuan untuk
mempelajari tingkat keragaman yang ada dengan kegiatan karakterisasi serta untuk
tujuan konservasi atau penyelamatan keragaman genetik (Syukur et al. 2009).
Menurut Seetharam & Prasad (1989), fungsi plasma nutfah tergantung pada
dua faktor : (1) evaluasi dan karakterisasi dan (2) identifikasi sumber gen yang
berguna. Oleh karena itu, koleksi plasma nutfah yang ada perlu dievaluasi keragaman
genetiknya untuk kegiatan pemuliaan yaitu mengidentifkasi karakter-karakter unggul
yang dimiliki tanaman.
Identifikasi keragaman dari tanaman durian yang dikoleksi penting untuk
dilaksanakan mengingat tanaman-tanaman tersebut membutuhkan identifikasi
yang tepat agar dapat membedakan individu dalam spesies. Data hasil identifikasi
informasi mengenai keragaman jenis atau sumber plasma nutfah akan
menjadikan program pemuliaan lebih terarah sehingga dapat menghasilkan
genotipe unggul yang diinginkan.
Pendekatan untuk mempelajari keragaman genetik pada tanaman dapat
dilakukan melalui penggunaan penanda (marker) tertentu seperti penanda
morfologi, kimiawi dan molekuler (DNA). Menurut Asiedu et al. (1989) penanda
adalah karakter yang dapat diturunkan dan berasosiasi dengan genotipe tertentu.
Penanda morfologi dikembangkan dari karakteristik tanaman yang dapat
dibedakan satu sama lain dan terlihat secara langsung seperti bentuk pohon,
batang, daun, bunga dan buah. Pengembangan metode karakterisasi tanaman
durian ini telah diatur oleh International Plant Genetic Resources Institute
(IPGRI) (Bioversity International 2007).
Penggunaan penanda morfologi terkadang sulit dilakukan untuk
beberapa tanaman yang memiliki kekerabatan dekat sehingga sangat sedikit
penanda yang bisa didapatkan dari sifat morfologi. Penanda morfologi juga
bersifat kompleks karena merupakan hasil interaksi antara genotipe dan
lingkungan. Hal ini menyebabkan kesulitan dalam membedakan antara
karakter yang dibawa secara genetik atau hasil adaptasi terhadap lingkungan.
Di samping itu, pengamatan karakter bunga dan buah sering terkendala oleh
musim dan lingkungan. Kendala tersebut dapat diatasi dengan penggunaan
penanda molekuler yang berbasis DNA.
Penanda molekuler telah digunakan untuk menunjukkan bahwa gen-gen
dapat berkontribusi pada proses spesiasi organisme (Karp et al. 1997). Teknik
penanda molekuler telah banyak tersedia saat ini. Pendekatan berbasis Polymerase
Chain Reaction (PCR) banyak digunakan karena sederhana dan hanya
membutuhkan sedikit sampel DNA. Inter Simple Sequence Repeat (ISSR) adalah
salah satu penanda yang banyak digunakan saat ini. Penanda ISSR merupakan
penanda multilokus acak yang dihasilkan oleh amplifikasi PCR dengan primer
mikrosatelit (Zietkiewicz et al. 1994). Penanda ISSR dapat bersifat dominan dan
untuk beberapa kasus dapat bersifat kodominan (Reddy et all. 2001). ISSR
menguntungkan karena tidak memerlukan informasi genomik tanaman yang akan
3
rendah. Selain itu, ISSR relatif lebih mudah dan sama ekonomisnya dengan RAPD
(Bradford 2008). Penanda ISSR juga berguna dalam mempelajari hubungan
interspesifik dan intraspesifik pada tanaman berkerabat.
Karekterisasi merupakan tahap awal dan sangat penting dalam menunjang
keberhasilan program pemuliaan selanjutnya. Karakterisasi berdasarkan morfologi
dan DNA bertujuan menemukan karakter-karakter spesifik dan unggul dari
tanaman serta dapat berfungsi sebagai DNA fingerprinting. Penelitian ini penting
dilaksanakan karena masih terbatasnya informasi mengenai keragaman genetik
tanaman durian, terutama tanaman durian yang telah dikoleksi oleh BPTP di
kebun percobaan Cipaku.
Tujuan
Secara umum penelitian ini bertujuan untuk mendapatkan informasi tentang
keragaman genetik tanaman durian koleksi Balai Pengkajian Teknologi Pertanian
(BPTP) di kebun percobaan Cipaku Jawa Barat, Departemen Pertanian.
Secara khusus penelitian ini bertujuan untuk :
1. Mengidentifikasi keragaman 21 genotipe tanaman durian berdasarkan
penanda morfologi stadia vegetatif.
2. Mengidentifikasi keragaman 21 genotipe tanaman durian berdasarkan
penanda ISSR.
3. Mengidentifikasi keragaman 21 genotipe tanaman durian berdasarkan data
Kerangka Pemikiran
Indonesia memiliki sejumlah besar sumber daya genetik tanaman
durian, namun belum banyak dimanfaatkan. Salah satu pemanfaatan sumber
daya genetik tanaman durian adalah dengan program pemuliaan dalam rangka
perbaikan genetik tanaman durian yang sangat bergantung pada besarnya
sumber keragaman genetik durian itu sendiri. Oleh karena itu koleksi plasma
nutfah durian yang ada di Cipaku, perlu dievaluasi keragaman genetik nya
untuk kegiatan manipulasi genetik ke arah perakitan kultivar unggul yang
diinginkan. Kendala yang diperoleh dengan hanya mengandalkan keragaman
morfologi adalah terbatasnya karakter yang diamati dan sangat bergantung
pada lingkungan, oleh karena itu diperlukan alat bantu yang lain yaitu dengan
molekuler. Metode analisis molekuler yang banyak digunakan saat ini adalah
yang berbasis PCR. Salah satu penanda yang dapat digunakan dengan metode
tersebut yaitu penanda ISSR, yang merupakan penanda multilokus acak.
Kombinasi kedua penanda morfologi dan molekuler akan menghasilkan data
yang lebih akurat dalam mencari besar nilai keragaman dan pola hubungan
genetik di antara 21 genotipe durian. Berdasarkan latar belakang di atas,
maka disusun serangkaian percobaan identifikasi morfologi dan analisis
molekuler durian koleksi kebun Cipaku, Bogor. Hasil penelitian ditujukan
untuk mendapatkan karakter spesifik atau pembeda morfologi dan molekuler
pada durian lokal dan introduksi. Informasi mengenai tingkat keragaman
plasma nutfah durian di Cipaku dapat digunakan dalam pelestarian plasma
nutfah yang akan membantu program pemuliaan tanaman dan pengembangan
durian di wilayah Cipaku pada khususnya dan Indonesia pada umumnya.
5
Durian lokal dan introduksi
Koleksi Kebun Percobaan Cipaku
Karakterisasi
Morfologi vegetatif DNA
Program NTSYS
10 Primer ISSR
Skoring DATA Biner
Diperoleh Besar nilai keragaman Pola hubungan genetik Besar nilai kemiripan antar genotipe
Kesesuaian Goodness of fit 22 karakter
Informasi Kebenaran genotipe Seleksi genotipe unggul untuk kegiatan
pemuliaan yang terarah
TINJAUAN PUSTAKA
Sejarah Penyebaran, Taksonomi dan Botani Tanaman Durian
a. Asal-usul dan taxonomi durian
Nama durian (Durio Spp) diadopsi dari asal katanya “duri” (bahasa
Melayu). Genus durian diperkirakan berasal dari Asia Tenggara. Tanaman durian
tumbuh liar dan terpencar-pencar di hutan “Malesia” yang sekarang meliputi
daerah Malaysia, Sumatra, dan Kalimantan. Saat ini penanaman durian telah
menyebar ke daerah yang meliputi wilayah Sri Lanka dan India Selatan hingga
New Guinea (Prosea 1992).
Durian termasuk ke dalam ordo Malvaceae, famili Bombacaceae dan
genus Durio. Genus ini terdiri atas sekitar 28 spesies. Di Indonesia 19 spesies
ditemukan di Kalimantan dengan 14 spesies merupakan indigenous Kalimantan
dan 7 spesies ditemukan di Sumatra, namun tidak satupun merupakan indigenous
Sumatra. Kalimantan dikenal sebagai pusat asal-usul dari spesies Durio dengan
ditemukannya tetua (ancestor) dari Durio spesies yaitu D. Wyath smithii.
Sunaryono (1990) menyatakan bahwa pusat keragaman genetik durian berada di
Kalimantan Timur dan Kalimantan Tengah.Spesies durian yang dapat dikonsumsi
hanya D. zibethinus (Durian), D. dulcis (Lahong), D. graveolens (Tabelak), D.
grandiflorus (durian Monyet/Munjit), D. kutejensis (Lai) dan D. testudinarium
(durian Kura).
Spesies D. zibethinus merupakan spesies yang memiliki nilai ekonomi
penting dan banyak ditanam secara komersial. Spesies ini juga dikenal dengan
nama D. accunatissima. Beberapa klon-klon durian spesies D. zibethinus telah
banyak dikebunkan dan memiliki variasi bentuk morfologi pohon, daun, bunga
dan buah (Subhadrabandhu S & Ketsa 2001). Tanaman D. zibethinus bersifat
heterogenous, sehingga menunjukkan karakteristik sifat yang luas dalam bentuk
pohon, bentuk buah, kualitas aril, warna buah menyebar dari warna hijau hingga
kuning-krem, warna aril yang menyebar dari warna putih atau krem hingga
kuning emas, biji yang kecil hingga besar, biji yang kisut hingga bulat, perbedaan
waktu pembungaan dan pembentukan buah serta perbedaan dalam kemampuan
b. Morfologi tanaman durian
Durian tumbuh secara soliter sebagai tanaman tahunan. Durian sebagai
tanaman hutan hujan tropis, dapat tumbuh baik pada dataran rendah hingga
ketinggian 800 meter dpl dengan tinggi tanaman sekitar 30-40 meter dan
diameter batang 2-2.5 meter, tetapi untuk durian hasil grafting tumbuh tidak
lebih dari 12 meter (Brown 1997). Tanaman durian tumbuh optimal pada
daerah dengan curah hujan 1500 mm/tahun.
Tanaman durian memiliki arsitektur pohon Roux dengan bentuk batang
orthotropic monopodial dan cabang lateral plagiotropik. Kulit batang durian
berwarna coklat merah tua, dan mengelupas secara tidak teratur.
Daun durian tumbuh berselang-seling dan pertumbuhannya secara tunggal,
berbentuk jorong sampai lanset, berpangkal daun runcing atau tumpul, sementara
ujung daun melancip. Struktur daun agak tebal dengan permukaan daun atas
berwarna hijau mengkilap sedangkan bagian bawah berwarna coklat tembaga,
kuning keemasan hingga keperakan. Daun durian ditutupi bulu (trichoma) pada
bagian permukaan bawah daun (Widodo 1997).
Pohon durian mulai berbunga pada umur 6-7 tahun untuk tanaman asal
biji. Bakal bunga tumbuh pada titik-titik mata tertentu yang dari tahun ke tahun
akan keluar pada tempat titik yang sama. Bentuk bunga durian indah, beraroma
wangi yang muncul pada bagian batang dan cabang yang kokoh (cauliflorus).
Keluarnya bunga lebih banyak dibagian dekat pangkal dahan atau tengah-tengah
dahan dibandingkan dibagian ujungnya (Brown 1997). Lama pembentukan bunga
dari mulai muncul bakal bunga hingga mekar adalah berkisar antara 40-60 hari
bergantung pada intensitas hujan yang terjadi.
Bunga durian tersusun dalam tangkai dan bergerombol. Setiap kuntum
bunga bermahkota lima helai yang terlepas satu sama lain dan memiliki benang
sari yang menyatu. Bunga durian adalah bunga sempurna, namun untuk
memben-tuk buah, tanaman durian melakukan penyerbukan silang yang dibantu oleh angin
dan serangga dan hanya pada beberapa kultivar saja yang bisa menyerbuk sendiri
seperti Monthong dan Chanee. Bunga akan mekar mulai pada pukul 1600 sore dan
menyerbuk pada malam hari. Dengan tipe penyerbukan seperti ini menyebabkan
9
Bentuk buah durian bervariasi dari bulat hinga lonjong. Warna kulit buah
bermacam-macam dari hijau hingga kecoklatan. Tangkai buah berbentuk bulat
panjang dan terletak dipangkal buah dengan panjang berkisar 15 cm (Wiryanta
2002). Duri durian pun beragam dari mulai panjang meruncing berbentuk piramid
hingga tidak berduri. Setiap buah umumnya terdiri dari lima juring yang bersekat
kuat hingga tidak bersekat.
Warna daging buah bervariasi dari warna putih, kuning muda hingga
jingga (Verheij & Coronel 1991). Ketebalan, rasa dan tekstur daging buah sangat
bergantung pada jenis dan varietas durian. Jumlah biji durian dalam satu juring
bergantung juga pada jenis dan verietas durian. Bentuk dan ukuran biji bervariasi
dengan permukaan halus hingga mengkerut dan warna kulit biji coklat.
Analisis Keragaman Genetik Tanaman Durian
Durian memiliki jumlah kromosom sebanyak 2n=2x=56. Durian merupakan
tanaman dengan sistem penyerbukan silang (cross pollination). Oleh karena itu
progeny durian sangat heterozygous sehingga menghasilkan banyak rekombinasi baru
dan menghasilkan sifat yang beranekaragam (Brown 1997). Kebanyakan
perbanyakan tanaman durian di Indonesia dengan biji dari buah tanaman yang
tumbuh liar di hutan-hutan atau juga yang dilakukan oleh petani dengan cara
generatif atau dengan biji yang disemaikan (Sastrapradja 1979), sehingga banyak
tanaman durian Indonesia yang tidak teridentifikasi dan hanya beberapa diantaranya
yang baru dikarakterisasi secara sederhana dan dilepas menjadi varietas dan masih
terus dalam pengkajian lanjut.
Studi variasi genetik pada tumbuhan telah dilakukan selama beberapa
dekade berdasarkan karakter morfologi dan fisiologi. Karakter ini biasanya
produk dari ekspresi gen dan dipengaruhi oleh faktor lingkungan. Kondisi ini
sering membuat sulit untuk melakukan analisa dan menghasilkan kesimpulan
yang kurang jelas. Analisis berbasis DNA memberikan solusi untuk masalah ini,
karena tidak mengandalkan pada produk yang diekspresikan dari genom dan
independen dari pengaruh lingkungan atau tahap perkembangan. Oleh sebab itu
informasi tambahan secara genetik sangat diperlukan guna mendapatkan hasil
Marka molekuler adalah upaya yang dilakukan dalam membedakan
karakteristik tanaman pada tingkat DNA. Penggunaan penanda molekuler
utamanya dilakukan untuk meminitor variasi pada susunan DNA didalam satu
spesies dan pada sejumlah spesies. Teknologi pada tingkat genetik ini menjadi
penting terkait dengan potensi utamanaya bagi pengembangan program
pemuliaan, yaitu efektivitas pengorganisasian plasma nutfah, pengujian
kemurnian genotipe atau klon dan perlindungan hak kekayaaan intelektual. Para
pemulia bisa melindungi genotipe temuannya tidak hanya teridentifikasi secara
morfologi namun juga secara genetika (Karp et al.1997).
Analisis penanda molekuler menjadi penting karena karakter tanaman
pada dasarnya hasil interaksi antara faktor genetik dengan lingkungannya,
sehingga tanaman yang pada dasarnya masih satu jenis menjadi berbeda secara
fisik karena perbedaan perlakuan atau lingkungan. Salah satu cara
mengidentifikasi persamaan atau perbedaan jenis dibalik keragaman karakteristik
fisik adalah melihat variasi pada tingkat gen (Henry 1997).
Penanda Morfologi
Karakter morfologi tanaman adalah salah satu penanda yang sering
digunakan dalam mengidentifikasi keragaman tanaman. Penampilan morfologi
merupakan hasil dari interaksi antara genotipe dan lingkungan. Pemunculan
suatu fenotipe merupakan hasil ekspresi banyak gen melalui rangkaian proses
pengaturan yang kompleks, itu sebabnya keragaman dapat terjadi karena adanya
perbedaan lingkungan adaptasi (Allard 1960). Deskripsi durian unggul
menggambarkan karakter-karakter buah durian yang beragam. Tiap genotipe
memiliki deskripsi morfologi buah yang berbeda-beda (Dirjen Hort. 2008).
Penggunaan marka morfologi (berdasarkan pengamatan visual) dalam
tataran aplikasi lapangan mempermudah dalam mengidentifikasi suatu
genotipe tanaman, namun kadang sulit dilakukan untuk beberapa tanaman
yang memiliki kekerabatan dekat karena perbedaan karakter pada spesies yang
berkerabat dekat sangat sedikit, dan sangat dipengaruhi oleh lingkungan
sehingga mungkin akan menghasilkan informasi yang bias. Menurut
11
dan kuantitatif. Sifat kualitatif dapat dibedakan secara tegas karena
dikendalikan oleh gen sederhana. Sedangkan sifat kuantitatif tidak dapat
dibedakan secara sederhana karena dikendalikan oleh banyak gen dan memiliki
distribusi kontinu. Kedua sifat tersebut saling mendukung dalam proses adaptasi
dan spesiasi suatu tanaman pada lingkungan tertentu.
Penanda Molekuler Inter Simple Sequence Repeats (ISSR)
Perkembangan teknik-teknik molekuler berdasarkan DNA merupakan salah
satu alat untuk menganalisis genom tanaman. Teknik ini berkembang karena dapat
mengurangi keterbatasan sifat dari penanda morfologi yaitu rendahnya
polimorfisme, adanya pengaruh deleterious, pleiotropi dan epistasis (Weising et al.
2005). Sejak pertengahan 1980-an, identifikasi genom dan seleksi telah
berkembang pesat dengan bantuan teknologi PCR. Sejumlah besar protokol
penanda yang cepat dan membutuhkan hanya sedikit sampel DNA telah
dikembangkan. Tiga penanda berbasis PCR yang luas penggunaannya adalah
RAPD , SSR atau mikrosatelit, dan AFLP.
Setiap teknik penanda molekuler memiliki kekurangan dan kelebihan.
Penanda RAPD sangat cepat dan mudah dikembangkan karena sekuens primernya
bersifat acak, tetapi kurang reprodusibel (Virk et al. 1995). AFLP memiliki
reprodusibilitas yang sedang tetapi membutuhkan biaya operasional yang tinggi
(Karp et al. 1997). Mikrosatelit bersifat spesifik dan sangat polimorfik, namun
membutuhkan pengetahuan awal tentang sekuens genomik tanaman untuk
mendisain primer spesifiknya, sedangkan informasi sekuens genomik tanaman
terbatas hanya pada spesies yang bernilai ekonomi saja.
Pemilihan teknik penanda molekular bergantung pada reprodusibilitas dan
kesederhanaannya. Penanda terbaik untuk pemetaan genom, Marker Assisted
Selection (MAS), studi filogenik, dan konservasi tanaman harus menggunakan
biaya yang rendah dan tenaga kerja yang sedikit serta reliabilitasnya tinggi. Salah
satu penanda molekuler yang banyak digunakan sejak tahun 1994 (Zietkiewicz et
al. 1994) adalah ISSR, yang merupakan bagian mikrosatelite yang tidak mengkode
Daerah mikrosatelit merupakan segmen DNA yang berulang yang dimiliki
oleh semua organism baik eukariot maupun prokariot. DNA repetitif paling
banyak ditemukan pada genom organisme eukariotik. Sekuens DNA berulang ini
merupakan sumber variasi di DNA kloroplas, mitokondria dan inti. Daerah ini
terdiri dari pengulangan daerah secara berpasangan dari beberapa nukleotida,
umumnya 2-6 nukleotida dengan perulangan mencapai ukuran sampai dengan 106
bp yang terdistribusi disepanjang genom dan terdapat pada genom eukariot
(Wolfe & Liston 1998). ISSR merupakan daerah di dalam DNA yang panjangnya
sangat bervariasi dalam suatu spesies yang sama (Salimath et al. 1995).
Karakteristik mikrosatelit sama di dalam genom seluruh organism, memiliki level
variasi alelik yang tinggi, bersifat kodominan, dan potensial untuk analisis yang
dapat diautomasi menjadikan daerah ini sebagai penanda molekuler yang unggul
(Trojanwska & Balibok 2004).
ISSR merupakan penanda semi acak yang diamplifikasi oleh PCR dengan
adanya satu primer yang komplementer terhadap suatu target mikrosatelit (Gambar
2). Penanda ini dikembangkan dari daerah di antara lokus mikrosatelit atau yang
disebut juga Single Sequence Repeat (SSR). Amplikasi daerah tersebut tidak
membutuhkan informasi sekuens genom dan menghasilkan pola multilokus dan
sangat polimorfik (Nagaoka & Ogihara 1997). Setiap pita mewakili sekuens DNA
yang dibatasi oleh dua mikrosatelit yang berbeda. Seperti halnya RAPD, penanda
ISSR cepat dan mudah dilakukan, namun memiliki reprodusibilitas seperti penanda
SSR karena primernya yang lebih panjang.
METODOLOGI
Waktu dan Tempat
Penelitian ini dilakukan mulai bulan September 2011 sampai Januari 2012
bertempat di Balai Pengkajian Teknologi Pertanian (BPTP), kebun koleksi
Cipaku Bogor dan Laboratorium Molekuler Pusat Kajian Hortikultura Tropika
(PKHT), Institut Pertanian Bogor (IPB).
Bahan dan Alat
Dalam penelitian ini digunakan 21 genotipe tanaman durian dari berbagai
daerah yang menjadi koleksi Balai Pengkajian Teknologi Pertanian (BPTP) Jawa
Barat di kebun Cipaku, Bogor (Tabel 1). Genotipe yang digunakan terdiri dari
varietas nasional (yang sudah dilepas) dan genotipe unggul daerah yang belum
dilepas.
Tabel 1. Nama genotipe tanaman durian koleksi Balai Pengkajian Teknologi Pertanian (BPTP), kebun percobaan Cipaku dan daerah asalnya.
No Nama genotipe Daerah asal No Nama genotipe Daerah asal
1 Lokal cipaku Bogor, Jabar 12 Pasir jati Pasir jati, Jabar
2 Kendil Brongkol, Jateng 13 Aseupan Rancamaya, Jabar
3 Layung Pandeglang, Jabar 14 Kim Pandeglang, Jabar
4 Pangkalan Kalbar 15 Tambleg Ciapus, Jabar
5 Bulan Ciawi, Jabar 16 Sunan Boyolali, Jateng
6 Pingku Bogor, Jabar 17 Sikoclak Bogor, Jabar
7 Hepe Jonggol, Jabar 18 Hejo Bogor, Jabar
8 Tanjung mabah Mabah, Kalbar 19 Perwira Majalengka, Jabar
9 Kuning garing Pandeglang, Jabar 20 Kanjau Thailand
10 Semeng Semeng, Kalbar 21 Manalagi Malang, Jatim
Bahan yang digunakan dalam pengamatan molekuler antara lain: pasir kuarsa,
merkaptoetanol, PVPP (polyvinylpolypyrrolidone), CTAB, aquades steril, CIAA
(Chloroform isoamylalcohol) (CIAA 24:1), alkohol absolute 70%, isopropanol,
agarose, air bebas ion, buffer TAE 1x, loading dye, PCR mix, Primer ISSR (10 primer),
ethidium bromide, tube 1.5 ml, tube 0.2µl, tip putih, tip kuning, tip biru dan kb ladder.
Alat-alat yang digunakan adalah mortal, micropipette, vortex, shaker,
freezer, centrifuge, waterbath, mesin PCR (Applied Biosystem 2720 thermal
cycler), bak elektroforesis, UV transluminator dan kamera digital.
Metode
a. Pengamatan Morfologi
Percobaan ini terdiri atas dua tahapan, Tahap pertama pemilihan tanaman
untuk analisis morfologi tanaman. Tanaman durian yang dipilih adalah tanaman
durian yang ditanam pada tahun 1996 - 2001. Dari beberapa tanaman durian yang
mewakili kultivar durian tertentu tersebut kemudian dipilih yang memiliki vigor
tinggi. Tahap kedua, tanaman durian terpilih kemudian diamati berdasarkan
karakter morfologi yang digambarkan dalam deskriptor. Pengamatan dilakukan
pada bulan September sampai dengan Desember 2011.
Contoh daun untuk analisis keragaman morfologi diambil secara acak
dalam 1 pohon induk durian pada cabang 1, 2 dan 3. Cabang terpilih adalah
cabang yang tidak ternaungi dan tidak terdapat serangan hama dan penyakit. Daun
contoh kemudian dipilih dalam satu ranting terpilih dimulai dari daun ke-tiga dan
diskor berdasarkan panduan descriptors for durian (Bioversity Internasional 2007).
Karakter yang diamati sebanyak 22 karaker meliputi karakter kualitatif sebanyak
14 karakter (karakter pohon, batang, dan daun) (Tabel 2) dan karakter kuantitatif
meliputi 8 karakter pengukuran (Tabel 3). Karakter pengamatan karakter daun
dari setiap genotipe kemudian ditabulasi. Hasil tabulasi yang memiliki nilai
15
Tabel 2. Karakter pengamatan morfologi vegetatif sifat kualitatif pada 21 genotipe tanaman durian di BPTP kebun percobaan Cipaku.
No Penanda Morfologi Kualitatif Kategori Deskripsi
1. Bentuk tajuk 1. Piramidal
2. Oblong
2. Habitus pertumbuhan batang 1. Lurus
2. Melilit
6. Bentuk daun (BD) 1. Obovate-lanceolate
2. Oval-oblong
13. Keadaan pinggir daun 1. Lengkung keluar
2. Keatas (V)
3. Datar
4. Lengkung kedalam (U)
14. Keadaan permukaan daun 1. Rata
2. Bergelombang
Tabel 3. Karakter pengamatan morfologi vegetatif sifat kuantitatif pada 21 genotipe tanaman durian di BPTP kebun percobaan Cipaku.
No Penanda Morfologi Kuantitatif Kategori Deskripsi
1. Panjang daun (cm) 1. 14.06 ≤ PD < 14.85
Gambar 3. Skematik pengukuran karakter kuantitatif daun durian (RIRDC 2009).
17
b. Pengamatan Molekuler
Tahapan pengerjaan molekuler meliputi dua kegiatan utama yaitu isolasi
DNA dan analisis ISSR. Persiapan template DNA dilakukan dengan
mengekstraksi DNA dari daun tanaman durian dilakukan pada bulan September -
November 2011. Analisis ISSR dilakukan selama bulan November 2011 - Januari
2012 dengan mengamplifikasi template DNA melalui mesin PCR. Seluruh
kegiatan tersebut, termasuk kegiatan elektroforesis, visualisasi dan dokumentasi
dilaksanakan di laboratorium PKHT.
Isolasi DNA
Prosedur isolasi DNA durian mengikuti metode CTAB (Lian et al. 2006)
yang meliputi 4 tahapan utama yakni pengambilan sampel daun dan ekstraksi,
pemurnian, presipitasi pelet DNA, dan uji kualitas DNA.
a. Pengambilan sampel daun dan ekstraksi
Daun durian diketahui banyak mengandung fenolik, sehingga waktu
pengambilan dan pemilihan daun untuk analisis DNA harus diperhatikan. Untuk
menghindari DNA berwarna kekuningan, daun yang diambil dan waktu
pengambilan daun menjadi sangat penting. Daun yang diambil sebaiknya bukan
daun yang muda karena akan menghasilkan banyak lendir saat dilakukan isolasi
DNA, oleh karena itu daun tua lebih baik. Namun kendala yang sering muncul
pada daun tua banyak terjadi fenolik untuk itu waktu pengambilan daun dilakukan
diwaktu pagi hari sebelum matahari bersinar terik dan saat pengangkutan, daun
diusahakan tidak terpapar panas sehingga daun tidak mengalami pencoklatan.
Sampel daun yang belum digunakan kemudian disimpan di dalam deep freezer
agar tidak rusak.
Sampel daun dari masing-masing bahan tanaman digerus menggunakan
mortar dengan penambahan buffer ekstraksi (CTAB 10%; EDTA 0.5 M (pH
8.0); Tris-HCl 1 M (pH 8.0); NaCl 5 M; β-mercaptoetanol 1%), PVPP dan pasir kuarsa. Hasil gerusan dimasukkan dalam tabung steril ukuran 1.5 ml, Kemudian
ditutup rapat, diinkubasi dalam waterbath pada suhu 65oC selama 30 menit.
larutan chloroform : isoamyl-alcohol. Larutan chloroform : isoamyl-alcohol
digunakan untuk presipitasi protein yang telah didenaturasi. Tujuannya agar
protein terpisah dari larutan buffer yang mengandung DNA.
b. Pemurnian
Buffer pemurnian 1x volume berupa campuran chloroform : isoamylalcohol
(CIAA) dengan perbandingan 24:1 v/v ditambahkan ke dalam sampel setelah tube
diangkat dari waterbath dan suhunya telah turun, lalu divortex perlahan-lahan
(sekitar 6-8 rpm) selama 1 menit. Sampel kemudian disentrifugasi dengan
kecepatan 10 000 rpm selama 10 menit dengan tujuan memisahkan bagian DNA
dan bahan-bahan lainnya. Pemisahan fraksi di dalam campuran dilakukan dengan
mengambil supernatant dan memindahkannya ke dalam tube steril baru. Proses
pemurnian kemudian kembali dilakukan dengan penambahan CIAA 1x volume,
di vortex selama 1 menit dan disentrifugasi pada 10 000 rpm selama 10 menit.
c. Presipitasi
Supernatant dari hasil pemurnian dipindahkan ke tube steril baru ukuran 1.5
ml, ditambahkan isopropanol (dingin) 1x volume, kemudian dikocok perlahan dan
diinkubasi dalam 4oC selama 30 menit sehingga terbentuk gumpalan yang
berbentuk seperti lendir. Larutan DNA tersebut disentrifugasi kembali dan larutan
dibuang hingga pelet DNA tertinggal diujung tube. Pelet kemudian dicuci dengan
100 µl ethanol 70% dan disentrifugasi kembali, kemudian dikering anginkan selama
6 jam sampai pelet kering. Selanjutnya pelet dilarutkan dalam 100 µl TE (1 M
Tris-HCl (pH 8,0); 0,5 M EDTA (pH 8,0); air bebas ion).
d. Uji kualitas DNA
Kualitas DNA total diuji dengan menggunakan gel agarose 0.8% dan
dielektroforesis dalam larutan buffer TAE 1x yang dialirkan arus listrik dari muatan
negatif menuju muatan positif selama 47 menit pada tegangan 50 volt. Konsentrasi
5 µl DNA total kemudian dibandingkan dengan 1 µl lamda DNA (Promega) yang
dielektroforesis bersama dengan konsentrasi 254 µg/ml, sehingga untuk setiap 1 µl
19
perendaman gel agarose dalam larutan EtBr 1% selama 15 menit, kemudian
didokumentasikan menggunakan kamera digital canon power shoot A480 di bawah
penyinaran UV transulliminator.
Polymerase Chain Reaction (PCR)
Amplifikasi dilakukan dengan alat PCR merk Applied Biosystem 2720
thermal cycler. Primer yang digunakan adalah primer Inter Simple Sequence
Repeat (ISSR) koleksi Laboratorium Pusat Kajian Hortikultura Tropika IPB
sebanyak 10 primer (Tabel 4) yang telah dioptimalisasi.
Komposisi PCR yang digunakan dalam proses PCR meliputi DNA template,
primer ISSR, PCR mixgo tag green master Promega dan nuclease free water.
Kom-posisi PCR meliputi : DNA 10 ng/µl, primer 10 pmol/µl, PCR mix 12.5 μl, kemudian
ditambahkan air bebas ion hingga mencapai volume 25 μl. Tahapan PCR meliputi pre
heat, denaturation, annealing, extension, dan pendinginan (Tabel 5).
Tabel 4. Nama dan susunan basa primer ISSR koleksi PKHT-IPB.
No. Nama Primer Sekuens Suhu Annealing (oC)
Tabel 5. Suhu dan waktu yang digunakan pada proses Polymerase Chain Reaction.
Tahapan Suhu Waktu
Pendinginan 4oC Sampai tak terhingga
Pengamatan penanda molekuler
Peubah atau parameter yang diamati pada penanda molekuler adalah jenis
primer, sedangkan lokus yang diamati adalah pita. Terbentuknya lokus untuk
setiap primer berbeda-beda dalam ukuran basepair (bp). Pengamatan parameter
primer dan lokus pada penanda molekuler ditampilkan pada Tabel 6.
Tabel 6. Keragaan primer dan lokus pada penanda molekuler.
No Nama Primer Lokus/pita (bp)
1 PKBT 2 250, 375, 500, 625, 750, 875, 1000
2 PKBT 3 250, 375, 500, 750, 1000, 1250
3 PKBT 4 562, 625, 1000
4 PKBT 5 250, 334, 418, 500
5 PKBT 6 250, 375, 500, 750
6 PKBT 7 250, 375, 500, 625, 1000
7 PKBT 8 250, 313, 376, 439, 500, 750, 1000
8 PKBT 9 250, 375, 500, 750
9 PKBT 10 500, 625, 750, 875
10 PKBT 12 500, 750, 875, 2000
Analisis Data
Data hasil pengamatan morfologi dan ISSR diolah menggunakan program
NTSYSpc (Numerical Taxonomy and Multivariate Analyses System) versi 2.02
(Rohlf 1998). Data hasil pengamatan karakter morfologi diskoring berdasarkan panduan deskriptor Durian, “Descriptors for durian” (Bioversity Internasional 2007), sedangkan untuk menentukan keragaman genetik, produk PCR-ISSR berupa
profil pita DNA diterjemahkan dalam data biner dengan skor nol (0) jika tidak ada
pita, dan satu (1) jika ada pita pada tingkat migrasi yang sama.
a. Analisis similaritas (kekerabatan)
.Koefisien kesamaan genetik antar genotipe durian berdasarkan penanda
morfologi, ISSR dan data gabungan keduanya diolah menggunakan prosedur
SIMQUAL (Similarity for Qualitative Data) pada program NTSYSpc versi 2.02
dan dihitung berdasarkan koefisien DICE dari Nei dan Lei (1979) dengan
21
S = 2 nab
(na + nb )
Keterangan :
S (DICE coefficient) adalah nilai kesamaan genetik antara individu.
a dan b adalah dua individu yang dibandingkan.
nab adalah jumlah pita yang sama posisinya pada individu a dan b.
na dan nb adalah jumlah pita pada masing-masing individu a dan b.
b. Analisis pengelompokan
Analisis Gerombol (Clustering) seluruh data, baik data morfologi, ISSR
maupun data gabungan masing-masing menggunakan Sequential, Agglomerative,
Hierarchical, and Nested (SAHN)-UPGMA (Unweighted pair-group method,
arithmetic average) pada program NTSYSpc versi 2.02. Hasil analisis disajikan
dalam bentuk dendrogram.
c. Analisis komparasi antara dua penanda
Untuk mengetahui tingkat keselarasan koefisien kesamaan antara penanda
morfologi dengan profil DNA, kedua data dibandingkan dan dianalisis tingkat
keselarasannya dengan menggunakan MXCOMP NTSYS-pc versi 2.02. tingkat
keselarasan pengelompokan ditentukan berdasarkan kriteria goodness of fit,
berdasarkan nilai korelasi menurut Rohlf (1993) yakni tingkat kesamaan nilai
HASIL DAN PEMBAHASAN
Keragaman Karakter Morfologi
Hasil identifikasi dan analisis morfologi pada 21 genotipe tanaman durian
koleksi Balai Pengkajian Teknologi Pertanian (BPTP) di kebun percobaan Cipaku
menunjukkan adanya keragaman sifat-sifat morfologi. Karakter-karakter tersebut
dikelompokkan berdasarkan pengamatan langsung dan pengukuran. Proporsi
karakter hasil identifikasi morfologi vegetatif kualitatif disajikan pada Tabel 7,
Proporsi karakter daun yang muncul disajikan pada Tabel 8, sedangkan proporsi
karakter hasil identifikasi pengukuran morfologi (karakter kuantitatif) disajikan
pada Tabel 9 dan rekapitulasi karakter polimorfik penanda morfologi vegetatif
ditampilkan pada Tabel 10. Deskripsi lengkap morfologi 21 genotipe tanaman
durian yang diamati ditampilkan pada lampiran 6-26.
Analisis Penanda Morfologi
Keragaman morfologi pada tanaman durian dapat diamati pada tingkat
spesies yang sama. Parameter atau variabel peubah yang diamati pada penanda
morfologi sebanyak 22 karakter (Tabel 7 & Tabel 9). Variabel morfologi yang
diamati diasumsikan setara dengan jenis primer pada penanda molekuler,
sedangkan kategori dari subkarakter setara dengan lokus pita pada penanda
molekuler (kedua penanda dalam data biner).
Karakter morfologi vegetatif sifat kualitatif
Sifat yang nampak pada tanaman dapat dibedakan atas sifat kualitatif dan
sifat kuantitatif. Sifat kualitatif dapat dibedakan secara tegas atau deskret, karena
dikendalikan oleh gen sederhana. Sifat kualitatif adalah sifat yang secara kualitatif
berbeda sehingga mudah dikelompokkan dan biasanya dinyatakan dalam kategori.
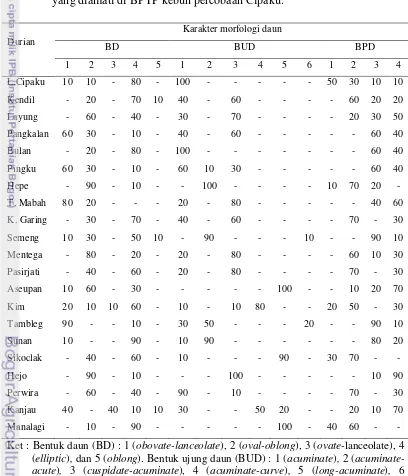
Tabel 7 memperlihatkan bahwa karakter morfologi vegetatif sifat kualitatif
pada 21 genotipe yang diamati menunjukkan keragaman tinggi (proporsi
munculnya subkarakter ≤ 70%) yang terlihat pada karakter pola percabangan,
tekstur kulit batang, warna daun, bentuk daun (BD), bentuk ujung daun (BUD),
menunjukkan keragaman yang rendah terlihat pada kerebahan daun, tekstur daun,
habitus pertumbuhan batang, bentuk tajuk dan keragaan permukaan daun,
peruratan daun atas, peruratan daun bawah.
Tabel 7. Karakter morfologi vegetatif sifat kualitatif dan proporsi subkarakternya yang ditunjukkan pada 21 genotipe tanaman durian koleksi BPTP kebun
13. Keragaan pinggir daun 1. Lengkung keluar 14.29
2. Ke atas 57.14
3. Agak mendatar 14.29
4. Lengkung kedalam 14.29
14. Keragaan permukaan daun 1. Rata 85.71
2. Bergelombang 14.29
25
Lingkar batang 21 genotipe tanaman durian yang diamati mempunyai
ukuran yang bervariasi antara 24.5-131 cm. Genotipe durian yang memiliki lingkar
batang terbesar adalah durian Pasirjati (131 cm) dan lingkar batang yang terkecil
dimiliki oleh hejo dan kuning garing masing-masing 24.5 cm dan 26.5 cm
(Lampiran 4-25). Umur tanaman durian yang tertua adalah yang ditanam tahun
1996 yaitu genotipe durian bulan, aseupan, dan perwira, sedangkan umur tanaman
durian yang termuda ditanam tahun 2001 yaitu genotipe Lokalcipaku.
Bentuk kanopi durian yang diamati dapat dibedakan menjadi dua kategori
yaitu, 1) kategori Oblong dengan ciri pada ujung kanopi, ujung batang utama
bercabang atau tinggi cabang dibawah batang utama hampir mendekati tinggi
batang utama sehingga terlihat rompang dan membulat di ujung kanopi. Pola
percabangan yang dibentuk horizontal dan wide. Subkarakter tajuk oblong ini
ditunjukkan pada durian Manalagi dan Lokal cipaku; 2) kategori pyramidal
ditunjukkan dengan ciri batang utama tumbuh tinggi melebihi cabang dibawahnya
dengan pola percabangan dari erect, wide dan horizontal. Subkarakter tajuk
pyramidal ini ditunjukkan pada durian Sikoclak, Pasirjati, Sunan, Mentega, Kim,
Perwira, Bulan, Kendil, Tambleg, Semeng, Hejo, Pangkalan, Pingku, Hepe,
Layung, Aseupan, Tanjung mabah, Kuning garing, dan Kanjau.
Genotipe yang memiliki tajuk yang rimbun dimiliki oleh Sunan, Pasirjati,
Kim, Tambleg, Kanjau, Perwira, Kendil, Lokal cipaku, Hepe dan Bulan. Pada
durian dengan tajuk rimbun memiliki jumlah cabang primer berjumlah 16-30
cabang. Genotipe dengan tajuk yang tidak rimbun ditunjukkan oleh genotipe
Semeng, Sikoclak, Manalagi, Mentega, Pangkalan dan Hejo. Jumlah cabang
primer pada genotipe durian yang tidak rimbun berkisar 9-14 cabang. Genotipe
yang memiliki percabangan rendah (< 1 m) adalah Semeng, Tambleg, Kim,
Sikoclak dan Pangkalan.
Karakter kualitatif warna daun salah satu parameter pembeda yang jelas
terlihat pada daun durian. Ke-21 genotipe durian memiliki pola penyebaran warna
daun yang dikategorikan dalam 3 kelompok berdasarkan intensitas warna hijau yang
terlihat dilapang. Pengkategorian warna daun yaitu, 1) hijau muda dengan kriteria
warna daun terlihat lebih muda dipohon, dan daun menunjukkan ciri semburat warna
dan Mentega; 2) hijau merupakan keragaman warna yang paling luas pada daun
genotipe durian koleksi cipaku karena menyebar dari warna hijau agak gelap hingga
mendekati hijau tua. Kriteria warna ini ditunjukkan oleh Hepe, Sikoclak, Manalagi,
Pasirjati, Perwira, Hejo, Bulan, Kendil, Pangkalan, Kuninggaring, Tanjung mabah,
Pingku, Aseupan, dan Lokalcipaku; 3) hijau tua, kriteria warna hijau tua ditunjukkan
dengan warna yang lebih gelap dilapang (at a glance) subkarakter ini ditunjukkan
oleh genotipe Kanjau, Tambleg, Kim dan Layung.
Penanda morfologi keragaan pinggir daun durian dapat dibedakan dengan
melihat daun dari sisi tangkai daun dengan daun menghadap ke atas. Kategori
keragaan pinggir daun melengkung keluar ditandai dengan pinggir daun yang
menggulung ke arah luar dengan posisi daging daun yang mencembung keatas.
Subkarakter ini dimiliki oleh genotipe Kanjau, Hepe dan Kim. Subkarakter
keragaan pinggir daun menghadap ke atas membentuk huruf V, merupakan
subkarakter yang paling dominan dan diwakili oleh genotipe Layung, Bulan,
Pingku, Tanjung mabah, Kuning garing, Mentega, Pasirjati, Aseupan, Sikoclak,
Hejo, Perwira dan Manalagi. Subkarakter keragaan pinggir daun lurus ditandai
dengan daun membentuk huruf V yang melebar. Subkarakter ini ditunjukkan pada
Tambleg, Pangkalan dan Lokal cipaku. Subkarakter pinggir daun melengkung ke
dalam ditandai dengan daun membentuk cekungan, sehingga daun seolah-olah
menggulung. Subkarakter ini diwakili oleh Sunan, Semeng dan Kendil (Gambar 4).
Gambar 4. Keragaan pinggir daun pada tanaman durian. a) melengkung ke dalam (cekung); b) melengkung keluar, c) ke atas (bentuk V) dan d) agak datar.
Durian memiliki keragaman bentuk daun yang luas. Telah diketahui
bahwa karakter bentuk daun, bentuk ujung daun, dan bentuk pangkal daun
merupakan karakter yang kuat diwariskan atau dengan kata lain memiliki
heritabilitas yang tinggi pada tanaman durian (Hiranpradit et al 1992). Hasil
27
penelitian Suketi (1994) dan Novayadi (2004) menunjukkan bahwa ketiga
karakter daun tersebut menunjukkan keragaman dalam satu pohon induk durian.
Pada ketiga karakter morfologi daun, pengskoran karakter daun dalam satu pohon
induk dijadikan dasar untuk mengetahui bentuk daun yang dominan. Karakter
daun yang dominan kemudian akan digunakan sebagai dasar dalam menentukan
karakter yang mewakili untuk setiap genotipe tanaman durian yang diamati.
Tabel 8. Proporsi karakter daun yang muncul pada 21 genotipe tanaman durian yang diamati di BPTP kebun percobaan Cipaku.
Durian
Penanda morfologi bentuk ujung daun (BUD) dikelompokkan dalam 5
kategori. Berdasarkan Tabel 8 diketahui bahwa BUD acuminate dan
cuspidate-acuminate merupakan BUD yang dominan muncul pada semua genotipe yang
dievaluasi. Berdasarkan kriteria pengelompokan BUD tersebut, genotipe durian
yang memiliki BUD acuminate-curve ditunjukkan oleh genotipe Kim dan Kanjau.
Genotipe durian yang memiliki BUD long-acuminate ditunjukkan oleh genotipe
Aseupan, Sikoclak dan Manalagi, sedangkan bentuk ujung daun
cuspidate-acuminate ditunjukkan pada genotipe Pangkalan dan Hejo. Genotipe denganBUD
acuminate-acute ditunjukkan pada genotipe Hepe, Semeng, Tambleg dan Sunan.
Subkararakter BUD acuminate ditunjukkan oleh Lokal cipaku, Kendil, Layung,
Bulan, Pingku, Tanjung mabah, Kuning garing, Mentega, Pasirjati dan Perwira.
Karakter bentuk pangkal daun (BPD) menyebar dalam 4 kategori
subkarakter. Tampak bahwa kategori 2 (obtuse), 3 (acute), 4 (cuneate-acute)
merupakan subkarakter yang dominan muncul pada karakter BPD. Berdasarkan
intensitas munculnya BPD, maka subkarakter BPD obtuse ditunjukkan pada
genotipe Kendil, Hepe, Mentega, Pasirjati, Kim, Sikoclak dan Manalagi.
Subkarakter BPD acute ditunjukkan pada genotipe Bulan, Pingku, Semeng,
Tambleg dan Sunan, sedangkan BPD kategori 4 (cuneate-acute) dimiliki oleh
genotipe Layung, Tanjung mabah, Aseupan, Hejo dan Kanjau.
Penanda morfologi bentuk daun (BD) dibagi dalam 5 kategori. Dari Tabel
8 terlihat bahwa genotipe yang memiliki keragaman daun yang tinggi terdapat
pada genotipe Semeng, Kim dan Kanjau. Genotipe Semeng memiliki BD yang
menyebar dalam 4 kategori bentuk daun yaitu kategori 1 (obovate-lanceolate),
2 (oval-oblong), 4 (elliptic) dan 5 (oblong). BD daun genotipe Kim menyebar
dalam 4 kategori bentuk daun yaitu kategori 1 (obovate-lanceolate), 2 (
oval-oblong), 3 (Ovate-lanceolate) dan 4 (elliptic). Pada genotipe Kanjau juga
menyebar dalam 4 kategori yang berbeda yaitu 1 (obovate-lanceolate), 2 (
oval-oblong), 3 (Ovate-lanceolate) dan 5 (oblong). Genotipe yang memiliki keragaman
bentuk daun yang rendah adalah pada genotipe Layung, Bulan, Hepe, Tanjung
mabah, Kuning garing, Mentega, Pasirjati, Tambleg, Sunan, Sikoclak dan
29
Berdasarkan intensitas kemunculan karakter bentuk daun maka keragaman
bentuk daun yang diamati dapat dibedakan menjadi 3 kategori, yaitu 1)
Oval-oblong ditunjukkanoleh genotipe durian Layung, Hepe, Mentega, Aseupan, Hejo,
dan Perwira, 2) Elliptic merupakan bentuk daun yang paling dominan muncul dan
ditunjukkan oleh durian Lokal cipaku, Kendil, Bulan, Kuning garing, Semeng,
Pasir Jati, Kim, Sunan, Sikoclak dan Manalagi serta 3) Obovate-lanceolate dimiliki
oleh durian Pangkalan, Pingku, Tanjung mabah, Tambleg dan Kanjau.
Hasil penelitian Hiranpradit et.al (1992) menyatakan bahwa grup durian
Kanyao (Kanjau) memiliki bentuk daun obovate-lanceolate, namun dari hasil
tersebut tidak didapatkan bentuk daun yang lain. Karakter BUD dan BPD pada daun
durian Kanjau juga terjadi variasi (Gambar 5). Hasil penelitian Suketi (1994) dan
Novayadi (2004) juga menemukan adanya keragaan yang terjadi pada genotipe
durian yang diteliti seperti yang ditunjukkan oleh seluruh genotipe durian Indonesia
dalam penelitian ini. Adanya keragaan pada bentuk daun menunjukkan bahwa
lingkungan dapat mempengaruhi kondisi keragaman dari bentuk daun pada
tanaman durian. Bentuk daun pada tanaman salah satunya dipengaruhi oleh
lingkungan. Bentuk daun dikontrol oleh sistem yang kompleks karena bentuk daun
merupakan faktor penting dalam optimasi pertumbuhan tanaman (Tsukaya 2005).
Gambar 5. Keragaan bentuk daun durian genotipe Kanjau.
Berdasarkan data yang ditunjukkan pada Tabel 8 dapat disimpulkan bahwa
bentuk daun (BD) yang dominan muncul pada durian adalah kategori 1 (
obovate-lanceolate), 2 (oval-oblong), 4(elliptic), dan 5(oblong).Pada karakterbentuk ujung
daun (BUD), subkarakter yang dominan adalah kategori 1 (acuminate), 2
(acuminate-acute) dan 3 (cuspidate). Pada karakter bentuk pangkal daun (BPD),
subkarakter yang dominan muncul adalah kategori 2 (obtuse), 3 (acute) dan 4
Variasi alami yang terjadi dalam klonal tanaman durian cukup besar
(Brown 1997; Suketi 1994). Menurut Jaenisch & Bird (2003), sel-sel dari
organisme multiseluler secara genetik homogen tetapi secara struktural dan
fungsional heterogen yang disebabkan oleh ekspresi gen yang berbeda, sehingga
menimbulkan berbagai variasi. Variasi dalam ekspresi gen muncul selama
perkembangan dan terpelihara melalui pembelahan mitosis. Perubahan stabil dari peristiwa ini disebut sebagai „epigenetik‟. Epigenetik merupakan variasi yang terbentuk dan dapat diwariskan dalam waktu yang singkat tetapi tidak melibatkan
mutasi pada DNA yang disebabkan oleh adanya metilasi DNA dan modifikasi
pada histone (Henderson & Steven 2007). Variasi terjadi pada tanaman salah
satunya disebabkan oleh adanya pengaruh rootstock pada scion yang menginduksi
perubahan fenotipik (Zhang et al. 2008). Variasi ini banyak terjadi pada
tanaman yang bersifat heterozigot seperti durian yang perbanyakannya dilakukan
secara vegetatif.
Karakter morfologi vegetatif sifat kuantitatif
Banyak sifat penting pada tanaman yang berkaitan dengan hasil seperti
produksi, kadar protein dan kualitas dikendalikan oleh sifat kuantitatif. Sifat
kuantitatif adalah sifat yang dikendalikan oleh banyak gen yang masing-masing
mempunyai pengaruh kecil pada sifat itu dan memiliki efek yang sama
(Poespodarsono 1988). Oleh karena itu sifat kuantitatif lebih banyak dipengaruhi
oleh lingkungan. Sifat kuantitatif tidak dapat dibedakan secara tegas karena
dikendalikan banyak gen sehingga kalau dibuat distribusinya akan menunjukkan
distribusi kontinu. Oleh karena itu pengelompokan dilakukan berdasarkan interval
tertentu.
Pengukuran sifat kuantitatif dalam penelitian ini dibagi dalam 3 kategori
(subkarakter) dengan pembagian berdasarkan 3 interval kuartil. Sifat kuantitatif
yang diukur meliputi 8 karakter (Tabel 9). Karakter morfologi vegatatif sifat
kuantitatif seluruh pengamatan memiliki interval subkarakter yang disesuaikan
dengan distribusi data pada ke-21 genotipe durian, sehingga menunjukkan pola
31
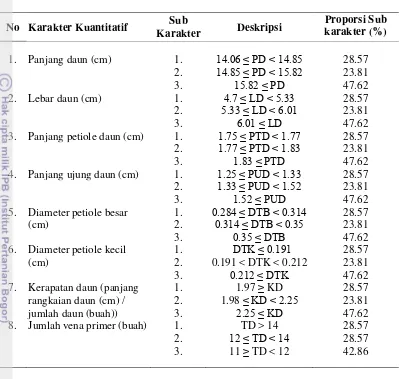
Tabel 9. Karakter morfologi vegetatif sifat kuantitatif dan proporsi subkarakter yang ditunjukkan pada 21 genotipe tanaman durian koleksi BPTP kebun percobaan Cipaku.
Analisis keragaman berdasarkan karakter morfologi sifat kualitatif dan kuantitatif
Berdasarkan keragaman bentuk morfologi sifat kualitatif diperoleh
dendogram yang ditunjukkan pada Gambar 6. Nilai koefisien kemiripan yang
diperoleh adalah sebesar 0.40 – 0.93 dengan nilai keragaman berkisar 7 – 60%.
Keragaman terendah ditunjukkan oleh pasangan genotipe Kuning garing -
Pasirjati dan Semeng – Sunan dengan nilai keragaman 7%, sedangkan genotipe
yang memiliki keragaman tertinggi ditunjukkan oleh genotipe Semeng dan Sunan