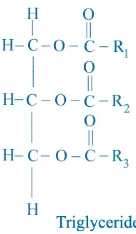GLISEROLISIS ENZIMATIS MINYAK INTI SAWIT
MENGGUNAKAN KATALIS ENZIM LIPASE DARI
Candida rugosa SERTA VARIASI PELARUT
ETANOL, 1-PROPANOL, 2-PROPANOL,
N-HEPTANA DAN ISOOKTANA
SKRIPSI
ATIKA RABIAH
090802018
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
GLISEROLISIS ENZIMATIS MINYAK INTI SAWIT MENGGUNAKAN KATALIS ENZIM LIPASE DARI Candida rugosa SERTA VARIASI
PELARUT ETANOL, 1-PROPANOL, 2-PROPANOL, N-HEPTANA DAN ISOOKTANA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ATIKA RABIAH 090802018
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERNYATAAN
GLISEROLISIS ENZIMATIS MINYAK INTI SAWIT MENGGUNAKAN KATALIS ENZIM LIPASE DARI Candida rugosa SERTA VARIASI
PELARUT ETANOL, 1-PROPANOL, 2-PROPANOL, N-HEPTANA DAN ISOOKTANA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Oktober 2013
PERSETUJUAN
Judul :GLISEROLISIS ENZIMATIS MINYAK INTI
aSAWIT MENGGUNAKAN KATALIS ENZIM
aLIPASE aDARI Candida rugosa SERTA VARIASI
aPELARUT ETANOL, 1-PROPANOL,2-PROPANOL,
jjN- HEPTANA, DAN ISOOKTANA Kategori : SKRIPSI
Nama : ATIKA RABIAH Nomor Induk Mahasiswa : 090802018
Program Studi : SARJANA (S1) KIMIA Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, Oktober 2013
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Ir. Donald Siahaan Drs. Firman Sebayang, MS Ka. Kelti PPKS NIP. 195607261985031001
Diketahui / Disetujui oleh
Ketua Departemen Kimia FMIPA USU
PENGHARGAAN
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini yang berjudul “GLISEROLISIS ENZIMATIS MINYAK INTI SAWIT MENGGUNAKAN KATALIS ENZIM LIPASE DARI Candida rugosa SERTA VARIASI PELARUT ETANOL, 1-PROPANOL, 2-PROPANOL, N-HEPTANA, DAN ISOOKTANA”.Dalam kesempatan ini penulis ingin mengucapkan terima kasih kepada Ibunda Siti Hawa Wahab dan Ayahanda Surya Indra Jaya. Skripsi ini penulis dedikasikan untuk kedua orang tua yang dengan penuh cinta kasih telah membesarkan dan mendidik penulis dan senantiasa memberikan dukungan materil maupun moril serta doa kepada penulis. Akhirnya penulis dapat menyelesaikan pendidikan hingga gelar sarjana sesuai harapan mereka.
Bapak Drs. Firman Sebayang, MS selaku Dosen Pembimbing I dan Bapak Dr. Ir. Donald Siahaan selaku Dosem Pembimbing II yang telah banyak meluangkan waktu untuk memberikan pengarahan, pemikiran serta saran sehingga penulis dapat menyelesaikan penelitian dan skripsi ini. Ibu Rumondang Bulan MS selaku Ketua Departemen Kimia dan Bapak Drs. Albert Pasaribu, M.Sc selaku Sekretaris Jurusan FMIPA USU yang turut memberikan pengarahan serta mengesahkan skripsi ini. Bapak dan Ibu Staf Dosen jurusan Kimia FMIPA USU khususnya Bapak dan Ibu Dosen Biokimia FMIPA USU Bapak Drs. Firman Sebayang, MS, Ibu Dr. Rumondang Bulan, M.Si, Ibu Dr. Yuniarti Yusak, MS, dan Ibu Dra. Emma Zaidar M.Si serta Bapak Alm. Drs. Syamsul Bahri Lubis, M.Si selaku Dosen Wali yang semasa hidupnya senantiasa membimbing penulis dalam perkuliahan serta kepada seluruh dosen Kimia S1 FMIPA USU yang tidak dapat disebutkan satu persatu.
Untuk “Ibu Kedua” penulis Hj. Nismawati Wahab dan Hj. Yusriah Wahab yang selalu membantu penulis ketika penulis berada di masa-masa sulit baik dari segi materil maupun moril.
Rizky Agung Pramisto terima kasih untuk bantuan, dukungan serta doa yang tulus untuk penulis. Terima kasih selalu setia mendukung penulis ketika penulis dalam suka dan duka.
mengharapkan kritik dan saran yang membangun dari Bapak dan Ibu dosen serta pembaca sekalian.
Medan,Oktober 2013
ABSTRAK
Gliserolisis minyak inti sawit menggunakan variasi pelarut etanol,1-propanol, 2-propanol, isooktana, dan n-heptana menghasilkan campuran senyawa monogliserida, digliserida, dan trigliserida.
ENZYMATIC GLYCEROLYSIS OF PALM KERNEL OIL USING LIPASE ENZYME CATALIST FROM Candida rugosa AND VARIATY OF
SOLVENTS OF ETHANOL, 1-PROPANOL, 2-PROPANOL, N-HEPTANE, AND ISOOCTANE
ABSTRACT
Glycerolysis of palm kernel oil using variety of solvents ethanol, 1-propanol, 2-propanol, isooctane, and n-heptane can yield a mixture of monoglycerides, diglycerides, and triglycerides.
DAFTAR ISI
BAB 2 TINJAUAN PUSTAKA 2.1.Minyak inti sawit 6 2.8.1.Enzim lipase 18 2.8.2.Spesifitas dan klasifikasi enzim lipase 18
2.9.Kromatografi lapis tipis (KLT) 20
BAB 3 BAHAN ALAT DAN PROSEDUR PENELITIAN
3.1.Bahan-bahan 23
3.2.Alat-alat 24
3.3.Prosedur penelitian 25
3.2.1.Penentuan kadar air pada minyak inti sawit 25 3.2.2.Penentuan kadar asam lemak bebas minyak inti sawit 25 3.2.3.Gliserolisis minyak inti sawit 26 3.2.4.Analisa gliserida dengan kromatografi lapis tipis 26 3.2.5.Analisa gliserida dengan kromatografi gas 27
3.3.Skema penelitian 28
BAB 4 HASIL DAN PEMBAHASAN
4.1.Hasil penelitian 29
4.2.Pembahasan 32
BAB 5 KESIMPULAN DAN SARAN
5.1.Kesimpulan 35
5.2.Saran 36
DAFTAR PUSTAKA 37
LAMPIRAN
DAFTAR TABEL
Halaman Tabel 2.1. Komposisi minyak kelapa sawit dan minyak inti sawit 7 Tabel 2.2. Yield monogliserida dengan perbandingan jenis pelarut 15 Tabel 4.1. Persentase monogliserida, digliserida, dan trigliserida melalui analisa 29
kromatografi lapis tipis (KLT)
DAFTAR GAMBAR
Halaman Gambar 2.1. Tanaman kelapa sawit 6 Gambar 2.2. Tandan buah kelapa sawit 7 Gambar 2.3. Reaksi gliserolisis 12 Gambar 2.4. Struktur trigliserida 13 Gambar 2.5. Struktur gliserol 13 Gambar 2.6. Pembentukan gliserol melalui reaksi transesterifikasi 14 Gambar 2.7. Struktur enzim lipase 18 Gambar 2.8. Kromatografi lapis tipis 21
DAFTAR GRAFIK
DAFTAR LAMPIRAN
Lampiran 1. Penimbangan bahan baku
Lampiran 2. Gliserolat dari lima variasi pelarut
Lampiran 3. Hasil KLT gliserolat dengan variasi pelarut Lampiran 4. Kromatogram dari hasil gliserolisis enzimatis
ABSTRAK
Gliserolisis minyak inti sawit menggunakan variasi pelarut etanol,1-propanol, 2-propanol, isooktana, dan n-heptana menghasilkan campuran senyawa monogliserida, digliserida, dan trigliserida.
ENZYMATIC GLYCEROLYSIS OF PALM KERNEL OIL USING LIPASE ENZYME CATALIST FROM Candida rugosa AND VARIATY OF
SOLVENTS OF ETHANOL, 1-PROPANOL, 2-PROPANOL, N-HEPTANE, AND ISOOCTANE
ABSTRACT
Glycerolysis of palm kernel oil using variety of solvents ethanol, 1-propanol, 2-propanol, isooctane, and n-heptane can yield a mixture of monoglycerides, diglycerides, and triglycerides.
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Dewasa ini laju perkembangan pemasaran minyak sawit cukup menanjak. Di antara jajaran minyak nabati utama di dunia, antara lain minyak kedelai, bunga matahari, lobak, zaitun, dan kelapa hibrida munculnya minyak sawit dalam pemasaran dengan cepat dan pesat mampu mengisi dan bersaing dengan minyak nabati yang lain. Bahkan, keberadaannya mampu mendesak mendesak pemasaran minyak kedelai. Dengan melihat kemampuannya dalam merebut pasar dunia dengan cepat, tentunya ada hal-hal khusus yang menjadi keunggulan minyak sawit dibandingkan minyak nabati yang lain. Dapat dicatat bahwa ada keunggulan penting yang dipunyai minyak sawit(Satyawibawa, 1993).
Mono- dan digliserida termasuk salah satu produk diversifikasi minyak yang bernilai ekonomi relatif tinggi dan mempunyai prospek pasar yang yang cukup cerah pada era pasar global. Hal tersebut disebabkan karena mono dan digliserida dibutuhkan baik dalam industri pangan dan farmasi, industri kosmetika serta produk pencuci atau pembersih, sebagai surfaktan atau bahan emulsifier (Hassanuddin, 2001).
Produksi monogliserida dapat dilakukan dengan hidrolisis, esterifikasi gliserol dengan asam lemak, dan gliserolisis. Gliserolisis menggunakan katalis logam alkali seperti MgO dan Ca(OH)2 membutuhkan suhu reaksi yang tinggi yaitu 220-250˚C.
lipase) banyak sekali dilakukan karena dalam prosesnya energi yang diperlukan untuk reaksi lebih sedikit, lebih ramah lingkungan, dan dapat menghasilkan produk dengan warna yang lebih terang (Noureddini, 2004).
Sihotang dan Ginting (2006) telah melakukan penelitian mengenai Gliserolisis Minyak Inti Sawit Secara Kimia Menggunakan Katalis Natrium Metoksida. Pada penelitian tersebut dihasilkan campuran mono- dan digliserida tertinggi yakni 37,26% dengan perbandingan minyak inti kelapa sawit dan gliserol 1:3. Sedangkan Sri Kuncorowati (2012) melakukan Optimasi Sintesa Campuran Monogliserida dari Minyak IntiKelapa Sawit Menggunakan Katalis Natrium Hidroksida dan Pelarut
Ter-butanol, pada suhu 82-90˚C dengan perbandingan RBDPKO : gliserol (Refining Bleached Deodorizing Palm Kernel Oil) yakni 1 : 15. Kuncorowati menganalisa gliserolat yang diperoleh secara Kromatografi Lapis Tipis (KLT) dan Kromatografi Gas (KG) dihasilkan mono- dan digliserida sebesar 53,36% dan 12,34%. Penelitian Elisabeth dkk yang berjudul Upaya peningkatan Produksi Mono- dan Digliseridadari Minyak Sawit Mentah dengan Proses Gliserolisis Enzimatik, digunakan campuran enzim lipase yakni Lipozyme IM dan Novozym-435, rasio molar antara minyak sawit mentah dan gliserol adalah 1 : 3, kadar air dalam reaksi ditetapkan sebesar 12% dengan kecepatan pengadukan 300 rpm serta waktu reaksi adalah 24 jam diperoleh kandungan mono- dan digliserida sebesar 44,4% dan 6,1%. Gliserolisis enzimatik ini membutuhkan suhu reaksi hanya 50˚ C, sangat berbeda dengan gliserolisis menggunakan katalis kimia. Penelitian lainnya yang juga menggunakan biokatalis enzim lipase adalah Patricia Bogalhos Lucente Fregolente (2008) yakni gliserolisis minyak kacang kedelai menggunakan biokatalis enzim lipase dari jenis Candida antartica B (Lipase immobilisasi CA-IM).
(Palm Kernel Oil) menggunakan biokatalis enzim lipase dari Candida rugosa.
Peneliti memilih lipase dari Candida rugosa untuk melihat efisiensi penggunaan lipase tersebut dalam proses gliserolisis dibandingkan lipase jenis lain yang umum digunakan. Kemampuan katalitik lipase dari Candida rugosa immobil adalah 800 U/mg (Fregolente et al, 2008) dan dapat digunakan sebagai biokatalis yang serbaguna yang mampu mengkatalisis hidrolisis, esterifikasi, dan transesterifikasi dari trigliserida dan ester-ester hidrofobik lainnya (Pandey et al, 1999).
1.2. Perumusan Masalah
1. Apakah jenis pelarut yang terbaik untuk digunakan dalam gliserolisis sehingga menghasilkan jumlah campuran mono- dan digliserida tertinggi?
2. Apakah lipase dari Candida rugosa dapat digunakan sebagai biokatalis dalam reaksi gliserolisis minyak inti sawit?
1.3. Pembatasan Masalah
1. Biokatalis lipase yang digunakan berasal dari Candida rugosa dan bersifat
free-enzyme berbentuk powder
5. Kecepatan pengadukan yang digunakan konstan yaitu 350 rpm 6. Waktu reaksi yang digunakan konstan yaitu 24 jam
7. Mono- dan digliserida yang dihasilkan dianalisa secara Kromatografi Lapis Tipis (KLT) dan Kromatografi Gas (KG)
1.4. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk :
1. Untuk mengetahui jenis pelarut terbaik yang dapat digunakan dalam gliserolisis
2. Untuk mengetahui apakah biokatalis lipase dari Candida rugosa yang bersifat free dapat digunakan untuk gliserolisis minyak inti sawit
3.
1.5. Manfaat Penelitian
Dari hasil penelitian diharapkan :
1. Dapat memberikan informasi ilmiah mengenai penggunaan biokatalis lipase sebagai pengganti katalis kimia yang bersifat lebih ramah lingkungan
2. Dapat memberikan informasi mengenai alternatif biokatalis lipase dari jenis lain seperti Candida rugosa yang dipakai dalam penelitian ini
3. Untuk memberikan informasi mengenai kadar mono- dan digliserida yang dihasilkan melalui gliserolisis enzimatis
4. Dapat memberikan informasi secara luas mengenai penggunaan minyak inti sawit dalam industri makanan, farmasi, dan surfaktan
Penelitian ini dilakukan di Pusat Penelitian Kelapa Sawit (PPKS) Jl. Brigjen Katamso No. 51 Medan Sumatera Utara
1.7. Metodologi Penelitian
Metodologi penelitian dilakukan dengan beberapa tahap yaitu : 1. Penyediaan minyak inti sawit
• Bahan baku dalam penelitian ini adalah minyak inti sawit yang diperoleh dari PT. SMART Medan
2. Analisa pendahuluan untuk minyak inti sawit
• Analisa kadar air dari minyak inti sawit menggunakan metode oven udara
• Analisa kadar asam lemak bebas (%ALB) dari minyak inti sawit dianalisa melalui metode titrimetri menggunakan metode titrasi netralisasi di mana titran yang digunakan adalah KOH
3. Penghilangan kadar air
• Kadar air yang baik untuk gliserolisis enzimatis adalah 12%
• Penghilangan kadar air dari minyak inti kelapa sawit dan gliserol dapat dilakukan dengan mengalirkannya dengan gas Nitrogen (gassing)
• Bahan yang telah bebas air disimpan dalam erlenmeyer yang tertutup 5. Proses gliserolisis minyak inti sawit
• Gliserolisis dilakukan dengan penambahan gliserol terhadap minyak inti sawit kemudian dilakukan penambahan biokatalis lipase sebanyak 5% dari campuran minyak inti sawit dan gliserol (w/w)
6. Proses gliserolisis
• Campuran reaksi diinkubasi pada suhu reaksi 37˚ C
• Kecepatan pengadukan yang digunakan adalah 350 rpm
• Waktu reaksi yang digunakan adalah 24 jam
7. Analisa mono- dan digliserida
• Gliserolat dianalisa secara kuantitatif menggunakan Kromatografi Lapis Tipis (KLT) dan Kromatografi Gas (KG) untuk mengetahui kadar campuran mono- dan digliserida yang dihasilkan
Adapun variabel-variabel dalam penelitian ini adalah :
1. Variabel bebas adalah variabel yang mempunyai pengaruh terhadap kadar mono- dan digliserida yang dihasilkan, yaitu :
• Jenis pelarut yang digunakan
2. Variabel terikat adalah variabel yang terukur terhadap perubahan perlakuan. Dalam penelitian ini yang menjadi variabel terikat, yaitu :
• Kadar mono- dan digliserida
3. Variabel tetap adalah variabel yang tidak menyebabkan perubahan pada variabel terikat. Dalam penelitian ini variabel tetap yaitu :
• Perbandingan minyak inti kelapa sawit dengan gliserol 1 : 3
• Suhu reaksi yang digunakan yaitu 37˚C
• Kecepatan pengadukan yang digunakan yaitu 350 rpm
BAB 2
TINJAUAN PUSTAKA
2.1. Minyak Inti Sawit
Kelapa sawit didasarkan atas bukti-bukti fosil, sejarah, dan linguistik yang ada, diyakini berasal dari Afrika Barat. Di tempat asalnya ini, kelapa sawit (yang pada saat yang lalu dibiarkan tumbuh liar di hutan-hutan) sejak awal telah dikenal sebagai tanaman pangan yang penting. Oleh penduduk setempat kelapa sawit telah diproses secara amat sederhana menjadi minyak dan tuak sawit.
Gambar 2.1. Tanaman Kelapa Sawit
sawit dan minyak inti sawit yang bermunculan kemudian, adalah dua produk yang dibutuhkan untuk bahan mentah/baku tersebut (Satyawibawa, 1993).
Minyak inti sawit (Palm Kernel Oil) adalah minyak yang diperoleh secara ekstraksi pelarut dari inti kelapa sawit (Trisakti, 1996). Asam laurat merupakan komposisi asam lemak paling besar di dalam minyak inti sawit, oleh karena itu minyak inti sawit dapat digolongkan ke dalam minyak asam laurat. Minyak inti sawit yang baik berkadar asam lemak bebas yang rendah dan berwarna kuning terang serta mudah dipucatkan (Ketaren, 1986).
Gambar 2.2 Tandan Buah Kelapa Sawit
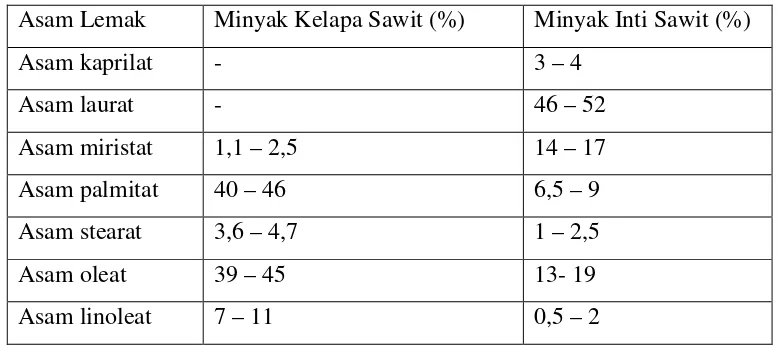
Kandungan asam lemak dalam kedua jenis minyak tersebut secara dapat dilihat pada Tabel 1 :
Asam Lemak Minyak Kelapa Sawit (%) Minyak Inti Sawit (%) Asam kaprilat - 3 – 4
Minyak inti sawit memiliki kemiripan sifat dan komposisi asam lemak dengan minyak kelapa, sehingga dalam penggunaannya dapat bersifat sebagai bahan subtitusi. PKO dan minyak kelapa sering digunakan oleh industri oleokimia sebagai bahan baku untuk menghasilkan produk surfaktan dan emulsifier. Kandungan asam laurat yang cukup tinggi pada minyak sawit menjadi salah satu kelebihan karena karena asam lemak ini memiliki khasiat bagi kesehatan tubuh.
2.2. Monogliserida dan Digliserida
Monogliserida adalah monoester asam lemak dari gliserol. Monogliserida merupakan lemak yang terdiri dari suatu kepala lipofilik dan ekor hidrofilik, yang memberikan sifat detergen. Sifat inilah yang dapat mengurangi tegangan antar muka dari sistem minyak-air, sehingga monogliserida dapat digunakan sebagai zat pengemulsi dan penstabil dalam industri makanan (Birkhahn et al, 1997).
Monogliserida dan digliserida adalah emulsifier anionik w/o yang umum digunakan dalam makanan, kosmetik dan farmasi (kristensen et al, 2005). Sifat dari bahan pengemulsi ini adalah mudah larut dengan bentuk yang bervariasi yakni cair, plastis, maupun padat, bergantung pada proses dan bahan baku yang digunakan. Selain itu mono- dan digliserida digunakan sebagai bahan intermediet dalam industri kimia seperti detergen dan alkalin resin (Pantzaris, 1995). Seringkali campuran monogliserida dan digliserida digunakan dalam aplikasi-aplikasi tersebut, dikarenakan keduanya lebih ekonomis dan memberikan performa yang sesuai (Fregolente, 2008). Penggunaannya dalam bahan-bahan yang dipanggang, industri permen, es krim, margarin, selai kacang, whipped cream, suatu emulsifier dengan konsentrasi monogliserida yang tinggi yang disebut monogliserida terdistilasi sangat penting peranannya. Monogliserida terdiri dari beberapa jenis, salah satunya adalah gliserol monolaurat atau monolaurin adalah senyawa multifungsi yang memiliki sifat antimikroba . Keistimewaan dari monolaurin adalah dapat menghambat sel vegetatif
Bacillus cereus (Cotton et al, 1997). Monolaurin dapat menghambat aktivitas Listeria monocytogenes, B. stearothermophilus dan B. cublitis (Kabara, 1983).
biasa digunakan dalam makanan. Digliserida menunjukkan pengaruh yang menguntungkan secara luas mengenai kemampuannya untuk mengurangi berat badan (Meng, 2006).
Dewasa ini, monogliserida diproduksi dengan sintesis kimia menggunakan gliserol, lemak, dan suatu katalis alkali yang dicampur dan dipanaskan pada suhu hampir 250˚C. Ca(OH)2 digunakan sebagai katalis dalam produksi monogliserida untuk
industri makanan (Sonntag, 1982). Produksi ini menghasilkan yield 40-60% monogliserida; sisanya adalah campuran digliserida dan trigliserida (Krog, 1990). Karena digliserida tidak cukup baik digunakan sebagai emulsifier (Henry, 1995) destilasi vakum harus digunakan untuk memperoleh jumlah monogliserida yang tinggi, biasanya 95% (Krog, 1990). Namun proses tersebut membutuhkan penggunaan energi yang sangat tinggi untuk sintesis kimia dan dan destilasi untuk memperoleh produk. Temperatur yang tinggi juga mengubah warna dan rasa dari produk. Oleh karena itu penggunaan sintesis enzimatis menggunakan lipase lebih diminati, yang membutuhkan temperatur yang rendah dan menghasilkan produk yang lebih baik (Berger, 1992).
2.3. Modifikasi Lemak dan Minyak yang Dikatalisis Enzim Lipase
Dalam aplikasi enzim lipase untuk modifikasi lemak dan minyak enzim lipase yang bersifat tidak spesifik menghasilkan posisi sebaran yang sama yang dinilai kurang efisien dari segi biaya dan peralatan untuk aplikasi ini. Spesifitas posisi 1 dan 3 dari trigliserida disebabkan oleh ketidakmampuan dari enzim lipase untuk berikatan pada posisi 2 dikarenakan halangan sterik mencengah jalan masuk dari asam lemak pada posisi sn-2 terhadap sisi aktif enzim. Posisi dan spesifitas asam lemak dari enzim lipase yang berbeda telah digunakan reaksi yang dikatalisis enzim lipase yakni meliputi transesterifikasi, asidolisis, gliserolisis, dan esterifikasi untuk mengembangkan kualitas lemak dan minyak.
• Transesterifikasi
Transesterifikasi yang dikatalisis oleh enzim lipase didefinisikan sebagai pergantian dari gugus asil antara dua ester yang adalah trigliserida, walaupun juga dapat berbentuk etil ester atau metil ester.
• Asidolisis
Asidolisis didefinisikan sebagai transfer suatu gugus asil antara asam dan ester, dan biasanya menggabungkan asam lemak menjadi trigliserida
• Gliserolisis
Gliserolisis adalah suatu reaksi antara trigliserida dan gliserol, sedangkan esterifikasi adalah reaksi antara gliserol dan asam lemak bebas
2.4. Gliserolisis
dengan waktu yang relatif singkat perlu adanya bantuan katalis. Reaksi dapat dijalankan dengan adanya katalis asam maupun basa. Reaksi dengan katalis basa biasanya lebih cepat (Kimmel, 2004).
Proses gliserolisis kimiawi dengan menggunakan metode batch atau proses kontinu. Temperatur tinggi (berkisar antara 220-250˚C) dan katalis alkali anorganik digunakan untuk mempercepat reaksi. Prosedur proses kontinu menghasilkan monogliserida dengan kualitas lebih baik daripada dengan menggunakan metode batch karena proses kontinu menggunakan pemanasan dan waktu reaksi yang singkat. Keterbatasan dalam proses kimia meliputi bentuk warna produk yang gelap dan rasa seperti terbakar. Yield
monogliserida yang dihasilkan melalui gliserolisi kimiawi adalah 40-60% dan membutuhkan proses destilasi molekuler yang mahal. Proses gliserolisis kimiawi tidak relevan terhadap aplikasi untuk biologi dan nutrisi (Yamane, 1999).
Selain menggunakan katalis kimia, reaksi gliserolisis bisa juga dilakukan dengan katalis enzim. Enzim yang sering dipakai adalah enzim lipase. Temperatur yang digunakan reaksi gliserolisis dengan katalis enzim sekitar 30˚C. Hal ini disebabkan katalis enzim tidak bisa bekerja atau akan mati pada suhu yang tinggi. Oleh karena temperatur yang digunakan rendah, reaksi gliserolisis dengan katalis enzim sebagai katalis adalah mahalnya harga enzim (Kaewthong et al, 2005).
Gliserolisis secara kimia menghasilkan yield 25-35% (McNeill, 1991). Yield
tabung kristalisasi yang didinginkan, dan campuran reaksi mengalir di antara kedua tabung. Pada akhir reaksi di dapat yield mencapai 95-98% (Berger et al, 1992).
Monogiserida yang dihasikan melalui gliserolisis secara bioteknoogi yang telah dilakukan adalah pemanfaatan lipase terjebak lipase immobil pada pembentukan monogliserida dari minyak zaitun. Pada reaksi enzimatis ini, pembentukan monogliserida dilakukan dengan menggunakan fase padat penjebak mikroba agar dapat dipisahkan kembali dari campurannya dengan hasil reaksi untuk digunakan kembali sehingga menurunkan biaya produksi. Bahan penopang padat yang berfungsi sebagai adsorben yang berpori adalah CaCO3, CaSO4.2H2O, Ca2P2O7, dan celite.
Mikroba yang digunakan adalah Pseudomonas sp KWI-56 lipase (PSL),
Chromobacterium Viscosum lipase (CPL) dan Pseudomonas pseudoalkali lipase
(PPL). Reaksi gliserolisis minyak zaitun secara enzimatis di atas dapat menghasilkan 90% monogliserida dengan lama reaksi 72 jam (Rosu dkk, 1997).
Gambar 2.3. Reaksi Gliserolisis
2.5. Trigliserida
Trigliserida merupakan ester antara gliserol dengan asam lemak. Trigliserida ini secara alami terdapat hewan dan minyak nabati. Lemak hewan sebenarnya bukan terminologi yang tepat karena ada juga trigliserida dari hewan yang dikategorikan sebagai minyak misalnya minyak ratif yang berasal dari jenis burung unta dan kaswari, di samping itu trigliserida yang berasal dari ikan juga adalah kategori minyak seperti minyak ikan.
Trigliserida antara gliserol dengan asam lemak biasanya berkisar dari C4-C24 baik yang jenuh maupun yang tidak jenuh. Asam lemak jenuh diantaranya butirat (C4), kaprilat (C8), kaprat (C10), laurat (C12), palmitat (C16), stearat (C180) dan arakhidat (C20); sedangkan asam lemak tak jenuh di antara oleat (C18:1), linoleat (C18:2), linolenat (C18:3) dan sebagainya (Meyer, 1973).
Gambar 2.4. Struktur Trigliserida
Trigliserida yang tersusun dari asam lemak tidak jenuh akan berrwujud cair dan mempunyai titik cair yang rendah, umumnya trigliserida ini terdapat pada minyak nabati. Trigliserida yang tersusun dari asam lemak jenuh akan berwujud padat dan mempunyai titik didih cair yang lebih tinggi, umumnya trigliserida ini terdapat pada minyak hewani. Gliserida dalam minyak dan lemak bukan merupakan gliserida sederhana (tiga gugus hidroksinya berikatan dengan tiga asam dari jenis yang sama pada gliserol, tetapi merupakan gliserida campuran (Christie, 1982).
2.6. Gliserol
terdekomposisi). Dapat bercampur sempurna dengan air dan alkohol, sedikit larut dalam eter, tidak larut dalam koroform (Austin, 1985).
Gliserol mengandung tiga gugus hidroksi yang terdiri dari dua gugus alkohol primer dan satu gugus akohol sekunder. Atom karbon yang terdapat dalam giserol dapat
ditunjukan sebagai atam karbon α, β, dan γ.
CH2OH.CHOH.CH2OH
α β γ
Gambar 2.5. Struktur Gliserol
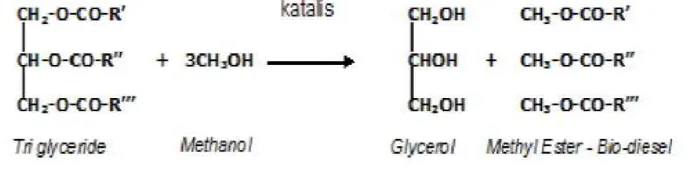
Gliserol juga merupakan produk sampingan dari produksi biodiesel melalui transesterifikasi, membentuk gliserol mentah yang berwarna gelap dan kental seperti sirup. Reaksi pembentukan gliserol melalui transesterifikasi sebagai berikut .
Gambar 2.6. Pembentukan Gliserol Melalui Reaksi Transesterifikasi
2.7. Pelarut
propanol (ter-butanol), 2-metil 2-butanol (ter-pentanol), atau campuran beberapa pelarut akan berguna untuk reaksi interesterifikasi. Tabel II menunjukkan kandungan monogliserida setelah reaksi gliserolisis dalam berbagai pelarut :
Pelarut Kandungan Monogliserida
Tidak menggunakan pelarut 0.0 ± 0.00
Kloroform 0.0 ± 0.00
n-Heptan 1.1 ± 0.02
n-Heksan 1.4 ± 0.03
Iso-oktan 1.5 ± 0.17
Asetonitril 2.0 ± 0.07
Toluen 2.9 ± 0.20
2-Butanon 5.4 ± 0.10
Aseton 11.5 ± 0.73
Isopropanol 18.0 ± 0.31
Etanol 21.0 ± 0.18
3-Pentanon 29.4 ± 0.26
Tert-pentanol 64.9 ± 1.12 Tert-Butanol 83.6 ± 0.14
Sumber : Dramstrup et al (2005)
Pelarut tunggal yang dapat mengikat minyak dan gliserol dalam sistem homogen sebenarnya sangat sulit didapatkan, terutama mengenai dampak pelarut tersebut bagi aplikasi makanan. Pelarut hidrokarbon umumnya tidak mungkin digunakan untuk tujuan ini, di samping bersifat toksin pelarut hidrokarbon juga jarang dipakai dalam proses ini, dan efeknya terhadap aktivitas katalitik enzim.
Sementara itu, beberapa alkohol yang memiliki lebih dari lima atom karbon dapat digunakan karena terdiri dari gugus –OH yang bersifat polar dan rantai karbon yang bersifat nonpolar. Pelarut tersebut memberikan kemungkinan untuk dapat mengikat minyak dan gliserol dalam satu sistem. Alkohol sebenarnya bersifat kompetitif terhadap gliserol, khususnya alkohol primer. Penggunaan alkohol tersier walau bagaimanapun adalah pertimbangan utama karena struktur alkohol tersier memiliki
hydrant sterik yang kuat untuk aktivitas enzim. Asumsi ini juga telah dikemukakan oleh studi terdahulu dengan penggunaan alkohol tert-butanol (Rendon et al, 2001).
2.8. Enzim
Enzim merupakan suatu protein yaitu suatu senyawa yang tersusun dari rangkaian asam amino yang terikat satu sama lain dengan ikatan peptida. Karena merupakan suatau protein, maka sifat yang dimiliki oleh suatu protein tentunya dimiliki oleh enzim juga. Enzim dapat didenaturasi dan dipresipitasi dengan garam, pelarut, dan reagen lain. Enzim merupakan senyawa protein yang dapat mengkatalisis seluruh reaksi kimia dalam sistem biologis. Semua enzim murni yang telah diamati sampai saat ini adalah protein. Aktivitas katalitiknya bergantung kepada integritas strukturnya sebagai protein. Enzim dapat mempercepat reaksi biologis, dari reaksi yang sederhana, sampai ke reaksi yang sangat rumit. Enzim bekerja dengan cara menempel pada permukaan molekul zat-zat yang bereaksi sehingga mempercepat proses reaksi. Percepatan reaksi terjadi karena enzim menurunkan energi pengaktifan yang dengan sendirinya akan mempermudah terjadinya reaksi. Enzim mengikat molekul substrat membentuk kompleks enzim substrat yang bersifat sementara dan lalu terurai membentuk enzim bebas dan produknya (Lehninger, 1995).
E + S ES E + P
E = enzim S = substrat P= Produk
Enzim mempunyai kekhususan aktivitas, yaitu peranannya sebagai katalis hanya terhadap satu reaksi atau beberapa reaksi yang sejenis saja. Jadi dapat melibatkan beberapa jenis substrat (Winarno, 1986). Sifat spesifik (spesifisitas enzim) didefinisikan sebagai kemampuan suatu enzim untuk mendiskriminasikan substratnya berdasarkan perbedaan afinitas substrat-substrat untuk mencapai sisi aktif enzim (August, 2000). Sifat spesifinitas ini dapat dimanfaatkan untuk tujuan reaksi atau jenis produk yang diharapkan. Sifat ini sangat menguntungkan karena tidak akan dijumpai reaksi-reaksi samping, sehingga lebih ramah lingkungan. Berdasarkan biosintesisnya, enzim dibedakan menjadi enzim konstitutif dan enzim induktif. Enzim konstitutif adalah enzim yang selalu tersedia di dalam sel mikroba dalam jumlah yang relatif konstan, sedangkan enzim induktif adalah enzim yang ada dalam jumlah sel yang tidak tetap, tergantung pada adanya induser. Enzim induktif ini jumlahnya akan bertambah sampai beberapa ribu kali bahkan lebih apabila dalam medium mengandung substrat yang menginduksi terutama bila substrat penginduksi merupakan satu-satunya sumber karbon (Lidya dan Djenar, 2000).
Berdasarkan tempat bekerjanya, enzim dapat dibedakan dalam 2 golongan, yaitu endoenzim dan eksoenzim. Endoenzim disebut juga enzim intraseluler, dihasilkan di dalam sel yaitu pada bagian membran sitoplasma dan melakukan metabolisme di dalam sel. Eksoenzim (enzim ekstraseluler) merupakan enzim yang dihasilkan sel kemudian dikeluarkan melalui dinding sel sehingga terdapat bebas dalam media yang mengelilingi sel dan bereaksi memecah bahan organik tanpa tergantung pada sel yang melepaskannya (Soedigdo, 1988).
1. Kemampuan katalitik
2. Spesifitas
Enzim bersifat sangat spesifik, baik jenis reaksi maupun substratnya 3. Kemampuan untuk diatur (regulasi)
Enzim tidak ikut bereaksi dengan substrata tau produknya . Aktifitas dapat dikontrol sesuai dengan kebutuhan organismeitu sendiri. Beberapa enzim disintesis dalam bentuk tidak aktif, dan akan diaktifkan dalam kondisi dan waktu yang sesuai, precursor yang tidak aktif disebut zymogen.
Interaksi enzim-substrat merupakan interaksi yang lemah, khususnya ketika atom terlibat lebih dari satu amstrong dari yang lainnya. Sehingga kesuksesan pengikatan enzim dengan substrat memerlukan kedua molekul untuk berdekatan dengan permukaan yang bersentuhan lebar. Hal ini memerlukan konfigurasi yang saling berkomplemen antara substrat dengan enzim, dan hal ini menjelaskan spesifitas kebanyakan enzim yang diberikan dalam mengkatalisis hanya satu macam reaksi kimia (Saryono, 2011).
2.8.1. Enzim Lipase
Lipase merupakan salah satu enzim yang telah diaplikasikan pada proses proses industri baik industri pangan maupun non pangan. Lipase dikenal sebagai lipolytic enzyme dan didefinisikan sebagai long chain fatty acid ester hydrolase atau sebagai
esterifikasi dan transesterifikasi (Pandey, 1999). Lipase memisahkan lemak (glycerol esters) di- atau monogliserida asam lemak. (Crueger et al, 1984).
Gambar 2.7. Struktur Enzim Lipase
2.8.2. Spesifisitas dan Klasifikasi Enzim Lipase
Spesifitas enzim didefinisikan sebagai ekspresi kemampuan suatu enzim untuk membedakan substrat-substratnya berdasarkan pada perbedaan afinitas substrat dalam berasosiasi dengan sisi aktif enzim untuk membentuk komplek enzim substrat dan akhirnya menghasilkan produk. Sifat spesifisitas dari enzim tersebut sangat bermanfaat untuk menghasilkan produk yang diinginkan serta dapat digunakan secara optimal untuk tujuan reaksi.
Spesifisitas lipase terhadap substrat dapat dikelompokkan menjadi spesifisitas jenis lipid, spesifisitas posisi, spesifisitas asam lemak, spesifisitas alkohol, dan spesifisitas gabungan (Saktiwansyah, 2001).
1. Spesifisitas Jenis Lipid
pankreatik yang memiliki tingkat hidrolitik tinggi terhadap triasilgliserol dibandingkan dengan diasilgliserol dan monoasilgliserol. Lipase P. cyclopium
memiliki tingkat hidrolitik yang lebih tinggi terhadap diolein dan monoolein daripada terhadap triolein. Lipase Aspergillus oryzae mampu menghidrolisis monoasilgliserol dan diasilgliserol, tetapi tidak pada triasilgliserol.
2. Spesifisitas Posisi
Spesifisitas posisi merupakan kemampuan lipase untuk membedakan substrat berdasarkan posisi ikatan ester pada triasilgliserol. Perbedaan spesifisitas posisi lipase didasarkan atas kemampuan lipase untuk menghidrolisis ikatan ester pada triasilgliserol pada posisi primer (sn-1 dan atau sn-3) atau posisi sekunder (sn-2). Lipase mikroorganisme yang memiliki spesifikasi posisi pada sn-1(3) adalah lipase
Mucor javanicus, R. javanicus, R. delemar, Penicillium sp., Aspergillus niger dan R. miehei.
3. Spesifisitas Asam Lemak
Spesifisitas asam lemak merupakan kemampuan lipase untuk membedakan substrat berdasarkan panjang rantai dan derajat kejenuhan dari asam lemak.
4. Spesifisitas Alkohol
Spesifisitas alkohol merupakan spesifisitas yang berhubungan dengan reaksi sintesis ester, dimana dalam aktifitas esterifikasinya setiap jenis lipase memiliki perbedaan terhadap jenis alkohol selain terhadap jenis asam lemaknya. Lipase yang berasal dari
A. niger, R. delemar, G. candidum dan P. cyclopium mampu mensintesis berbagai jenis ester dari asam oleat dengan alkohol primer, namun hanya lipase G. candidum
yang mampu mensintesis ester asam oleat dengan alkohol sekunder 5. Spesifisitas gabungan
lemak berantai sedang pada posisi sn-1. Lipase lingual pada tikus dapat menghidrolisis triasilgliserol dengan asam lemak berantai sedang pada posisi sn-3. Berdasarkan kemampuannya dalam mensintesis ikatan ester, lipase diklasifikasikan ke dalam 3 golongan menurut kekhasannya (Deman, 1997), yaitu:
1. Golongan pertama adalah lipase yang tidak khas. Enzim ini tidak menunjukkan kekhasan dari segi posisi ikatan ester dalam molekul gliserol atau sifat asam lemak. Contoh enzim golongan ini ialah lipase dari Candida cylindracae, Corynebacterium acnes, dan Staphylococcus aureus.
2. Golongan kedua mencakup lipase yang mempunyai kekhasan posisi untuk posisi-1 dan -3 gliserida. Hal ini umum untuk lipase mikroba dan merupakan akibat dari ketidakmampuan ikatan ester posisi-2 untuk memasuki pusat aktif enzim (active center) karena hambatan ruang. Lipase ini diperoleh dari Aspergillus niger, Mucor javanicus, dan Rhizopus arrhizus.
3. Golongan lipase ketiga menunjukkan kekhasan untuk asam lemak tertentu. Contohnya lipase dari Geothricum candidum, yang mempunyai kekhasan menonjol untuk asam lemak rantai panjang yang mengandung ikatan rangkap dua cis pada posisi ke 2.
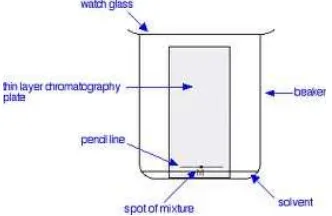
2.9. Kromatografi Lapis Tipis (KLT)
Pemisahan KLT dikembangkan oleh Ismailoff dan Schraiber pada tahun 1938. Tekniknya menggunakan penyokong fase diam berupa lapisan tipis seprti lempeng kaca, aluminium atau pelat inert.
campuran sepanjang fase diam pada pelat sehingga terbentuk kromatogram. Pemisahan yang terjadi berdasarkan adsorpsi dan partisi. Kelebihan KLT dibandingkan kromatografi jenis lain adalah :
1. Waktu pemisahan lebih cepat
2. Sensitif, artinya meskipun jumlah cuplikan sedikit masih dapat dideteksi 3. Daya resolusi tinggi, sehingga pemisahan lebih sempurna
Penentuan harga Rf pada KLT sama dengan pada kromatografi kertas. Harga Rf dapat digunakan untuk identifikasi kualitatif. Untuk tujuan penentuan kadar, bercak komponen dapat dikerok lalu dilarutkan dalam pelarut yang sesuai untuk dianalisa dengan metode lain yang tepat.
Gambar 2.8. Kromatografi Lapis Tipis
Aplikasi KLT sangat luas, termasuk dalam bidang organik dan anorganik. Kebanyakan senyawa yang dapat dipisahkan bersifat hidrofob seperti lipida-lipida dan hidrokarbon di mana sukar bila dikerjakan dengan kromatografi kertas. KLT juga penting untuk pemeriksaan identitas dan kemurnian senyawa obat, kosmetika, tinta, formulasi pewarna dan bahan pewarna (Yazid, 2005).
Kromatografi gas adalah proses pemisahan campuran menjadi komponen-komponennya dengan menggunakan gas sebagai fase bergerak yang melewati suatu lapisan serapan (sorben) yang diam. Fase diam yang berupa zat padat yang dikenal dengan kromatografi gas-padat (GSC) dan zat cair sebagai kromatografi gas-cair (GLC). Keduanya hampir sama kecuali dibedakan dalam hal cara kerjanya. Pada GSC pemisahan berdasarkan adsorpsi sedangkan GLC berdasarkan partisi. Dalam pembicaraan kromatografi gas biasanya yang dimaksud adalag GLC.
Kromatografi gas digunakan untuk analisa kualitatif dan kuantitatif terhadap cupikan yang komponen-komponennya dapat menguap pada suhu percobaan. Keuntungan kromatografi gas adalah waktu analisa yang singkat dan ketajaman pemisahan yang tinggi.
Gambar 2.9. Kromatografi Gas
Untuk tujuan identifikasi dan penetapan kadar dibuat kromatogram komponen zat uji dan larutan baku (standar) lalu keduanya dibandingkan. Salah satu cara pada analisa kualitatif adalah dengan membandingkanwaktu retensi antara kromatogram komponen zat uji dengan larutan baku pembanding. Waktu retensi yang dihasilkan oleh masing-masing senyawa diukur mulai saat disuntikkan atau dimasukkan ke dalam alat sampai terjadinya respon detektor. Waktu retensi karakyteristik untuk tiap komponen dan sebanding dengan jumlah komponen yang dikandung. Bila waktu retensi zat uji dan baku pembanding sama berarti kedua senyawa identik. Pada analisa kuantitatif saah satu caranya dapat dilakukan dengan membandingkan luas area puncak komponen zat uji dengan luas area baku pembanding (Yazid, 2005).
BAB 3
METODE PENELITIAN
3.1. Bahan-Bahan
- Minyak inti sawit PT. SMART
- Gliserol p.a E’merck
- Kloroform p.a E’merck
- Silika Gel 60 G p.a E’merck
- N-heksan p.a E’merck
Gambar 2.9. Kromatografi Gas
Untuk tujuan identifikasi dan penetapan kadar dibuat kromatogram komponen zat uji dan larutan baku (standar) lalu keduanya dibandingkan. Salah satu cara pada analisa kualitatif adalah dengan membandingkanwaktu retensi antara kromatogram komponen zat uji dengan larutan baku pembanding. Waktu retensi yang dihasilkan oleh masing-masing senyawa diukur mulai saat disuntikkan atau dimasukkan ke dalam alat sampai terjadinya respon detektor. Waktu retensi karakyteristik untuk tiap komponen dan sebanding dengan jumlah komponen yang dikandung. Bila waktu retensi zat uji dan baku pembanding sama berarti kedua senyawa identik. Pada analisa kuantitatif saah satu caranya dapat dilakukan dengan membandingkan luas area puncak komponen zat uji dengan luas area baku pembanding (Yazid, 2005).
BAB 3
METODE PENELITIAN
3.1. Bahan-Bahan
- Minyak inti sawit PT. SMART
- Gliserol p.a E’merck
- Kloroform p.a E’merck
- Silika Gel 60 G p.a E’merck
- Asam asetat glacial p.a E’merck
- Etanol p.a E’merck
- 1-propanol p.a E’merck
- 2-propanol p.a E’merck
- isooktana p.a E’merck
- n-heptana p.a E’merck
- Enzim Lipase Candida rugosa p.a E’merck - 2,7 Dichlorfluorescein p.a E’merck - N-Methyl-N-(trimethylsilyl)trifluoroacetamida (MSTFA) p.a E’merck
- Tricaprin p.a E’merck
- Tetrahydrofuran (THF) p.a E’merck - Indikator phenolftalein
-KOH 0,087 N -Aquades
3.2. Alat-Alat
- Neraca analitis Sarotus
- Gelas Erlenmeyer Pyrex
- Gelas beaker Pyrex
- Gelas ukur Pyrex
- Alat kromatografi gas Shimadzu
- Oven Gallenkamp
- Shaker
- Labu leher tiga - Chamber - Pipa kapiler - Desikator - Pipet tetes - Spatula - Mortar
- Alat pengrata bubur silika - Plat kaca
- Kondensor - Buret
3.3. Prosedur Penelitian
3.3.1. Penentuan Kadar Air pada minyak inti sawit (SNI 01-2891-1992)
Pada awal tahap analisis cawan kosong dikeringkan dalam oven selama 15 menit. Didinginkan cawan dalam desikator. Diambil cawan kering dengan penjepit kemudian ditimbang cawan kering yang sudah didinginkan. Ditimbang 1-2 g contoh pada cawan tersebut lalu dikeringkan pada oven suhu 105˚ C selama 3 jam. Dinginkan dalam desikator. Dilakukan penimbangan dan diulangi penimbangan hingga diperoleh bobot tetap/konstan ( ≤0,0005 g).
Kadar air =[(W-(W1-W2))/W1-W2] x 100
dimana: W = berat contoh sebelum dikeringkan (g)
W1 = berat cawan kosong dan contoh kering yang sudah konstan beratnya (g)
W2 = berat cawan kosong
3.3.2. Penentuan Kadar Asam Lemak Bebas (%ALB) pada minyak inti sawit
Untuk pengukuran kadar ALB dilakukan dengan metode titrimetri. 5 gram minyak inti sawit dimasukkan ke dalam erlenmeyer kemudian ditambahkan 10 ml alkohol 96%. Ditutup Erlenmeyer dengan plastik dan diikat dengan karet lalu dipanaskan hingga mendidih. Ditambahkan 3 tetes indikator phenolftalein lalu dititrasi dengan larutan KOH 0,1 N hingga terjadi perubahan warna menjadi merah lembayung. Dicatat volume KOH yang terpakai. Perhitungan % ALB :
BM =Berat molekul asam lemak bebas (asam laurat)
G = berat sampel minyak inti sawit (gram)
3.3.3. Gliserolisis Minyak Inti sawit
Dihilangkan kadar air dari minyak inti sawit dengan cara dioven selama 1 jam dengan suhu 105˚C untuk menghilangkan kadar air. Kemudian dimasukkan 6,75 gr minyak inti sawit yang telah bebas air ke dalam gelas Erlenmeyer lalu ditambahkan 3,24 gr gliserol. Selanjutnya ditambahkan enzim lipase Candida rugosa sebanyak 0,49 gr. Kemudian dimasukkan etanol 20 ml dan ditambahkan aquadest sebanyak 0,4 ml lalu dimasukkan ke dalam oven dengan temperatur 37˚C dengan kecepatan 350 rpm selama 24 jam. Setelah itu dirotarievaporator untuk memisahkan gliserolat dengan pelarut. Dengan menggunakan perlakuan yang sama dilakukan gliserolisis menggunakan pelarut 1-propanol, 2-propanol, n-heptana dan isooktana.
3.3.4. Analisa Gliserida dengan Kromatografi Lapis Tipis (KLT)
kemudian didiamkan beberapa menit sampai uap dari pelarut hilang. Identifikasi kemudian dilakukan dengan menyemprotkan fluorecense dan dianalisis dibawah lampu UV dengan panjang gelombang 366 nm. Spot-spot yang terbentuk kemudian diberi tanda dengan menggunakan pensil untuk memperjelas area fraksi-fraksi yang telah terpisah.
Pengukuran kadar MG dilakukan secara semi kuantitatif dengan membandingkan luas area fraksi MG dengan total fraksi yang terbentuk dari pengelusian hasil gliserolisis tersebut. Caranya adalah dengan menggambar ulang spot yang terbentuk tadi di atas kertas kalkir, kemudian kertas-kertas ini digunting sesuai dengan spot tersebut, sehingga masing-masing guntingan ini bisa ditimbang.
Hasil timbangan menunjukkan kadar masing-masing fraksi. Perhitungan kadar masing-masing fraksi itu adalah sebagai berikut:
Kadar MG (%)=Bobot kertas fraksi MG (gr) Bobot total fraksi (gr)
x 100%
Kadar DG (%)=Bobot kertas fraksi DG (gr) Bobot total fraksi
x 100%
Kadar TG (%)=Bobot kertas fraksi TG (gr) Bobot total fraksi
x 100%
3.3.5. Analisa Gliserida dengan Kromatografi Gas
model split injector 200 : 1. Suhu oven diprogram dari 160 sampai 350˚C pada
30˚C/min dan ditahan pada 350˚C selama 25 menit. Nitrogen digunakan sebagai gas pembawa dengan kecepatan alir 200 ml/menit. Waktu proses 30 menit dan sampel diinjeksikan 1µl secara manual.
3.4. Bagan Penelitian
ANALISA PENDAHULUAN
• Analisa kadar air minyak inti sawit
PROSES GLISEROLISIS
ANALISA KROMATOGRAFI LAPIS TIPIS
BAB 4
HASIL DAN PEMBAHASAN
4.1. HasilGliserolisisminyakintisawitmenggunakanbiokatalisenzim lipase dariCandida rugosamenghasilkanmonogliserida, digliserida, dantrigliserida.
Hasilgliserolisisminyakintisawitmenggunakanbiokatalisenzim lipase dariCandida rugosadanvariasilimajenispelarut yang dianalisamelaluiduatahapanalisa,
yaknianalisamenggunakanKromatografi Lapis Tipis danKromatografi Gas. HasilanalisamenggunakanKromatografi Lapis Tipis (KLT) adalahsebagaiberikut :
N o
JenisPelar
ut Perulang an
Beratkertaskalkir (gr) KADAR (%)
Tabel. 4.1.PersentaseMonogliserida, Digliserida, danTrigliseridaMelaluiAnalisaKromatografi Lapis Tipis (KLT)
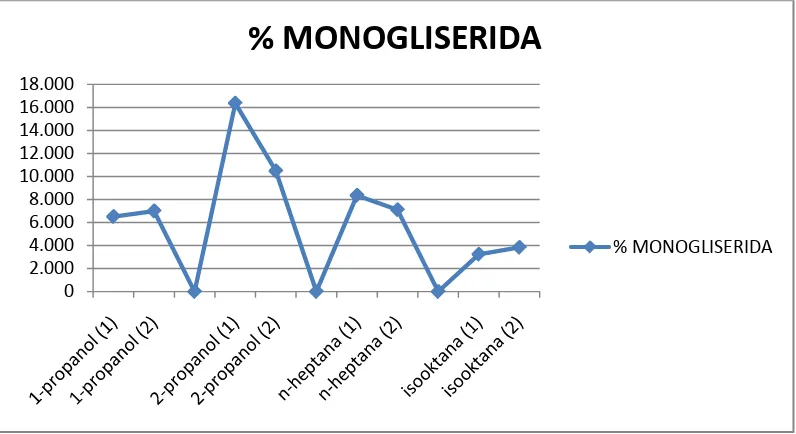
Grafikhasilanalisamenggunakankromatografi lapis tipis adalahsebagaiberikut:
Grafik. 4.1. Persentasemonogliseridamelaluianalisa KLT 0
2.000 4.000 6.000 8.000 10.000 12.000 14.000 16.000 18.000
% MONOGLISERIDA
Grafik. 4. 2. Persentasedigliseridamelaluianalisa KLT
HasilanalisamenggunakanKromatografi Gas adalahsebagaiberikut
No JenisPelarut % Monogliserida % Digliserida % Trigliserida
1 Etanol (1) - - -
2 Etanol (2) - - -
3 1-propanol (1) 2,20 80,27 0 4 1-propanol (2) 0 74,75 60,02
5 2-propanol (1) 2,08 36,27 0 6 2-propanol (2) 7,73 34,98 10,52 7 n-heptana (1) 17,33 28,87 27,23
0 5.000 10.000 15.000 20.000 25.000 30.000 35.000 40.000
% DIGLISERIDA
9 Isooktana (1) 2,35 30,59 4,38
10 Isooktana (2) 8,71 33,34 14,40
Tabel. 4.2. PersentaseMonogliserida, Digliserida, danTrigliseridaMelaluiAnalisaKromatografi Gas
Grafikhasilanalisamenggunakankromatografi gas adalahsebagaiberikut:
Grafik. 4.3. PersentaseMonogliseridamelaluianalisaKromatografi Gas 0
2.000 4.000 6.000 8.000 10.000 12.000 14.000 16.000 18.000 20.000
% Monogliserida
Grafik. 4.4. PersentaseDigliseridamelaluianalisaKromatografi Gas
4.2. Pembahasan
Dari hasilpenelitiangliserolisisminyakintisawitmenggunakanbiokatalisenzim lipase dariCandida rugosadenganvariasijenispelarut, didapatkanbahwapelarut yang menghasilkanpersentasemonogliseridadandigliseridatinggiadalahpelarut 2-propanol dan n-heptana.(Tabel4.1 dan4.2).
Pelarut 2-propanol dapatdigunakansebagaipelarutdalamreaksigliserolisisenzimatiskarena 2-propanol memilikigugus –OH yang bersifat polar mengikatenzim lipase dangliserolsedangkanrantaikarbon yang bersifat nonpolar mengikatminyakintisawit.Hal ini yang menyebabkantumbukanantarapartikel-partikel
Gliserolisismenggunakanpelarut
n-heptanajugamenghasilkanprodukmonogliseridadandigliserida yang cukuptinggi.Namunpenggunaanpelaruthidrokarbondinilaitidakefektifuntukprodukpang
ankarenamenghasilkansenyawaberacun yang berbahaya.
Enzim lipase dari Candida rugosa memiliki tiga sisi aktif enzim yakni serin, histidin
OH
Mekanisme kerja enzim yang terjadi pada reaksi transesterifikasi adalah reaksi “Bi Bi ping-pong” atau reaksi pergantian ganda (double displacement reactions) di mana salah satu sisi aktif enzim berikatan dengan salah satu substrat yakni gliserol kemudian menghasilkan enzim termodifikasi dan produk berupa air. Selanjutnya enzim termodifikasi akan bereaksi dengan substrat kedua yakni minyak inti sawit (trigliserida) yang membentuk produk berupa monogliserida dan digliserida serta enzim yang terbentuk kembali pada akhir reaksi.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Biokatalis enzim lipase dari Candida rugosa yang bersifat free dapat digunakan dalam reaksi gliserolisis untuk menghasilkan monogliserida dan digliserida
2. Pelarut yang sesuai untuk proses gliserolisis menggunakan biokatalis enzim lipase dari Candida rugosa adalah 2-propanol
3. Proses gliserolisis menggunakan pelarut n-heptana dan isooktana menghasilkan persentase monogliserida dan digliserida terendah sehingga tidak cocok digunakan dalam reaksi tersebut
4. Pelarut Hidrokarbon seperti n-heptana dan isooktana tidak dianjurkan sebagai katalis dalam proses gliserolisis untuk tujuan pangan sebab dapat menghasilkan senyawa beracun
5. Pelarut dari golongan alkohol dengan rantai karbon panjang adalah pelarut yang baik digunakan dalam reaksi gliserolisis enzimatis
5.2. Saran
1. Diharapkan untuk penelitian selanjutnya menggunakan biokatalis enzim lipase dari Candida rugosa yang bersifat immobil
2. Diharapkan penelitian selanjutnya dapat memisahkan campuran jenis dari monogliserida dan digliserida serta mengetahui jenis monogliserida dan digliserida yang dihasilkan
DAFTAR PUSTAKA
Atkins, P.W. (1997). Kimia Fisika. Cetakan Keempat. Jakarta : Penerbit Erlangga Austin, G.T. (1985) . Industri Proses Kimia. Edisi Kelima. Jilid 1. Jakarta : Erlangga Berger, M and M.P. Schneider. (1992). Enzymatic Esterification of Glycerol II : Lipase-
Catalyzed of regioisomerically pure 1(2)-rac monoacyl-glycerols. J. Am. Oil Chem. Soc.69(7):961-965
Birkhan RH,Mc Combs C, Clemens R and Hubbs J., (1997). Potential of the
monoglyceride and triglyceride of DL-3-hydroxybutyrate for paranteral nutrition
synthetis and preliminary biological testing in rat, Nutrition. 13(3):213-219 Cotton LN and DL Marshall. (1997). Monolaurin Preparation Method Affects Activity Againts Vegetative Cells of Bacillus Cereus of Food Science and Tech.
30:830-833
Crueger W, Crueger A. (1984). Biotechnology : A Textbook of Industrial Microbiology.
Sunderland : Sinauer Associates
Damstrup, M.L, T. Jensen, F.V. Spars, S.Z. Kiil, A.D. Jensen, dan X.Xu. (2006). Production of Heat-Sensitive Monoacylglycerols by Enzymatic Glycerolysis in tert-Pentanol : Process Optimization by Response Surface
Methodology.JAOCS, 83 (1): 27
Deman, J.M. (1997). Kimia Makanan. Bandung : Penerbit ITB
Dudley SBT., (1957). Production of fatty acid monoglycerides. United States patent US
2789119
Fessenden, R.J.(1994). Kimia Organik. Edisi keempat. Jilid 1. Jakarta : Penerbit Erlangga
Fregolente, P.B. L., Fregolente, L.V., Pinto, G.M., Batistella, B. C., Wolf-Maciel, M.R.,
& Maciel Filho, R. (2008). Applied Biochemistry and Biotechnology, 146, 165 172
Furniss, B.S., Hannaford A.J., Smith, PWG., Tatchell, A.R., 1989.Vogel’s The Textbook
of Practical Organic Chemistry. Edisi Kelima. New York : John Wiley & Sons, Inc
Hasanuddin, A., (2001). Kajian Teknologi Pengolahan Minyak Kelapa Sawit Mentah untuk Emulsifier Mono-Diasilgliserol dan Konsentrat Karotenoid. Makalah Falsafah Sains (PPs702). Institut Pertanian Bogor
Kabara JJ. (1983). Medium-Chain fatty Acids and Esters. Di dalam : Antimicrobials in
Foods. Alfred L. B. dan P.M Davidson (eds). Mercel Dekker Inc., New York and
Basel
Kaewthong, M.,Sirisansaneeyakul, S., Prasertsan, P., & H-Kittikun, A. (2005). Process
Biochemistry, 40, 1525-1530
Ketaren, S. 1986. Pengantar minyak dan Lemak Pangan. Jakarta : UI-Press
Kristensen, J.B., Xu, X., & Mu, H. (2005). Journal of the American Oil Chemists’s Society, 82, 329-334
Krog, N.J. Food Emulsifiers and Their Chemical and Physical Properties, in Food Emulsions, edited by K. Larsson and S.E. Friberg, Marcel Dekker Inc., New York,1990, pp. 127-180
Lehninger, A.L. (1998). Dasar-Dasar Biokimia. Terjemahan, M. Thenawidjaja. Jakarta : Pustaka Sinar Pustaka
McNeill, G.P, S. Shimizu, and T.Yamane, Solid Phase Enzymatic Glycerolysis of Beef
Tallow Resulting in a High Yield of Monoglyceride, J.Am. Oil Chem. Soc. 67:779-783(1990)
Meng, X., Zou, D., Shi Z., Duan, Z., & Mao, Z. (2006). Lipids, 39, 37-41 Noureddini, H, and Medikonduru, V., (1997), Glycerolysis of Soybean Oil,
J.Am.Oil.Chem.Soc.,75,1359
Pandey A, Benjamin S, Soccol CR, Nigam P, Krieger N, Soccol VT,. (1999). The Real
ofMicrobial Lipases in Biotechnology. Biotechnol. Applm. Biochem., 29, 119-131
Pantzaris, T.P. (1995) . Pocketbook of Palm Oil Uses. Third Edition. Malaysia : PORIM
Rendon, X., Lopez-Munguia, A., Castillo, E. Solvent Engineering Applied to Lipase- Catalyzed Glycerolysis of Triolein. J. Am. Oil Chem. Soc. 2001, 78, 1061-1066
Rosu R, Vozaki Y, Iwasaki Y, & Yamane T. (1997) . Repeated use of Immobilizied Lipase for Monoacylglycerol Production by Solid-Phase Glycerolysis of Olive Oil. JAOCS 74(4):445-50
Saryono. (2011). Biokimia Enzim. Edisi Pertama. Yogyakarta : Nuha Medika
Satyawibawa, I. (1993). Kelapa Sawit Usaha Budidaya, Pemanfaatan Hasil, dan Aspek
Pemasaran. Cetakan Ketiga. Jakarta : Penerbit Penebar Swadaya
51-Sonntag NOV. (1982). Glycerolysis of Fats and Methyl Ester-Status. JAOCS 59(10):795A-802A
Trisakti, B. (1996). Esterifikasi Asam Lemak Bebas yang Dikandung Minyak Inti Sawit
dengan Metanol Menggunakan Katalis Berbentuk Padat. Bandung : Program Pasca Sarjana ITB
Winarno, F.G. (1992). Kimia Pangan dan Gizi. Cetakan Keenam. Jakarta : PT Gramedia
Pustaka
Willis, W.M.,Marangoni, A.G.(1999).Biotechnological Strategies for The Modification
of Food Lipids:155-157
Lampiran 1
Penimbangan Bahan Baku
Asam lemak yang terkandung dalam minyak RBDPKO adalah asam laurat C12:0 (51,78%), asam miristat C14:0 (15,54%) dan asam oleat C18:1 (13,99%). Struktur molekul trigliserida dari RBDPKO berdasarkan komponen asam lemak yang paling dominan adalah :
O C C11H23
O
O C C13H27
O
O C C17H34
O
BM TRIGLISERIDA = BM Gliserol + (1,55 x BM Asam Laurat) + (0,47 x BM Asam Miristat) + (0,42 x BM Asam Oleat) – (3 x BM Air)
= 92 + (1,55 x 200) + (0,47 x 228) + (0,42 x 282) – (3 x 18) = 92 + 310 + 107,16 + 118,44 -54
= 573,6
Perhitungan rasio gliserol/RBDPKO 3:1 BM Trigliserida = 573,6
BM Gliserol = 92
BM Total = 573,6 + 276 = 849,6
Berat RBDPKO yang digunakan = BM Trigliserida x 10 gram
BM Total
= 573,6 x 10 gram
849,6
= 6,75 gram
Berat gliserol yang digunakan = BM Gliserol Total x 10 gram
BM Total
= 276 x 10 gram
849,6
= 3,24 gram
Perhitungan jumlah katalis yang digunakan dalam reaksi :
Konsentrasi katalis yang digunakan dalam reaksi 5% pada rasio gliserol/RBDPKO 3:1 Berat minyak dan gliserol = 6,75 gram + 3,24 gram
= 9,97 gram
Berat katalis = 5% x 9,97 gram
Lampiran 2
Lampiran 3
Hasil KLT gliserolat dengan variasi pelarut
Hasil KLT untuk gliserolat dengan pelarut isooktana
Hasil KLT untuk gliserolat dengan pelarut 2-propanol