Lampiran 1. Hasil analisa kadar air dan kadar asam lemak bebas minyak inti sawit
1. Kadar air minyak inti sawit
% air =(cawan kering+minyak inti sawit)–(cawan kering+minyak inti
sawitkering)
Berat minyak inti sawit
= 45,05 – 43,05 x 100%
2
= 2%
Kadar air dalam minyak inti sawit yang digunakan adalah 2%
2. Kadar asam lemak bebas (%ALB) minyak inti sawit
%ALB = V . N . BM x 100%
G . 1000
= 0,8 x 0,1 x 200 x 100%
5 x 1000
= 0,32%
Lampiran 2. Gambar Proses Gliserolisis
a) substrat reaksi gliserolisis b) proses inkubasi gliserolisis
Lampiran 3. Hasil Analisa Kromatografi Lapis Tipis
a) hasil KLT senyawa standart
DAFTAR PUSTAKA
Akoh, C. C., Lee, G. C., Shaw, J. F. 2004. Protein Engineering and Applications of Candida rugosa Lipase Isoforms. Lipids. 39: 513.
Anggoro, D. D. dan Budi, F. S. 2008. Proses Gliserolisis Minyak Kelapa Sawit Menjadi Mono Dan Diacyl Gliserol Dengan Pelarut N-Butanol Dan katalis MgO. Reaktor. 12: 22-28.
Atkins, P.W. 1997. Kimia Fisika. Cetakan Keempat. Penerbit Erlangga. Jakarta
Bezbradica, D., Karalazic, I., Ognjanovic, N., Mijin, D., Siler-Marinkovic, S., Knezevic, Z. 2006. Studies on the specifity of Candida rugosa lipase catalyzed esterification reactions in organic media. J. Serb. Chem. Soc. 71: 31-41.
Corma, A et al. 1997. Catalysts for the Production fine Chemicals-Production of Food Emulsifiers, Monoglycerides, by Glycerolysis of fats Solid base Catalysts. Journal of Catalysia. 173; 315-321 di dalam Pramana, Y. S., Mulyani, S. 2009. Proses Gliserolisis CPO Menjadi Mono Dan Diacyl Gliserol Dengan Pelarut Tert-Butanol Dan Katalis MgO. Universitas Diponegoro.
Cotton, F. A., dan Wilkinson, G. 2007. Kimia Anorganik Dasar. Penerjemah: Suharto, S.
Damstrup, M. L., Jensen. T., Sparso, F. V., Kiil, S. Z., Jensen, A. D., Xu, X. 2005. Solvent Optimization for Efficient Enzymatic Monoacylglycerol Production Based on a Glycerolysis Reaction. J. Am. Oil Chem. Soc.82:559.
Fadiloglu, S. and Soylemez, Z. 1997. Kinetics of lipase catalyzed hydrolysis of olive oil. Food research international. 30:171-175.
Fauzi, Y., Widyastuti, Y. E., Satyawibawa, I., Paeru, R. H., 2012. Kelapa Sawit. Penebar Swadaya. Jakarta.
Ferretti, C. A., Olcese, R. N., Apesteguia, C. R., Cosimo, J. I. D. 2009. Heterogenously catalyzed glycerolysis of fatty acid methyl esters: reaction parameter optimization. Ind. Eng. Chem. Res. 48: 10387-10394.
Fessenden, R. J. 1986. Kimia Organik. Edisi Ketiga. Jilid 2. Alih bahasa: Pudjaatmaka, A. H. Penerbit Erlangga. Jakarta.
Fregolente, L. V., Martins, P. Z., Batistella, C. B., Wolf-Maciel, M. R. 2005. Effect of reaction parameters in the synthesis of monoglycerides from soybean oil. 2nd Mercosur Congress on Chemical Engineering. 4th Mercosur Congress on Process Systems Engineering. 1-7.
Fregolente, P. B. L., Fregolente, L. V., Pinto, G. M. F., Batistella, B. C., Wolf-Maciel, M. R., Filho, R. M. 2008. Monoglycerides and Diglycerides Synthesis in a Solvent-Free System by Lipase-Catalyzed Glycerolysis. Appl Biochem Biotechnol. 146: 165-172.
Fregolente, P. B. L., Pinto, G. M. F., Wolf-Maciel, M. R., Filho, R. M. 2010. Monoglyceride and Diglyceride production through lipase-catalyzed glycerolysis and molecular distillation. Appl Biochem Biotechnol. 160: 1879-1887.
Grochulski, P., Li, Y., Schrag, J. D., Bouthilliert, F., Smith, P., Harrison, D., Rubin, B., Cygler, M. 1993. Insights into interfacial activation from an open structure of Candida rugosa lipase. J. Biol. Chem. 268: 12843-12847.
Hart, H. 2003. Kimia Organik – Suatu Kuliah Singkat. Edisi Kesebelas. Penerbit Erlangga. Jakarta.
Insani, D. N. 2012. Studi esterifikasi antara asam lemak hasil hidrolisis minyak kelapa sawit dengan sukrosa menggunakan lipase Candida rugosa EC 3.1.1.3 terimobilisasi pada matriks silica gel 60. [Skripsi]. Depok: Universitas Indonesia,
Jackson, M. A., King, J. W. 1997. Lipase-Catalyzed Glycerolysis of Soybean Oil in Supercritical Carbon Dioxide. J. Am. Oil Chem. Soc. 74: 103-106.
Ketaren, S. 1986. Minyak dan Lemak Pangan. UI-Press. Jakarta.
Kimmel, T. 2004. Kinetic investigation of the base-catalyzed glycerolysis of fatty acid methyl esters. Berlin: der Technischen Universität Berlin
McNeill, G. P., Yamane, T. 1991. Further improvements in the yield of monoglucerides during enzymatic glycerolysis of fats and oils. J. Am. Oil Chem. Soc. 68: 6-10.
Nandi, S., Gangopadhyay, S., Ghosh, S. 2005. Production of medium chain glycerides from coconut and palm kernel fatty acid distillates by lipase-catalyzed reactions. Enzyme and Microbial Technology. 36: 725-728.
Noureddini, H., Harkey, D. W., Gutsman, M. R. 2004. A Continuous Process for the Glycerolysis of Soybean Oil. Chemical and Biomolecular Engineering Research and Publications.
Poedjiadi, A. 2007. Dasar - Dasar Biokimia. UI-Press. Jakarta.
Pramana, Y. S., Mulyani, S., 2009. Proses Gliserolisis CPO Menjadi Mono Dan Diacyl Gliserol Dengan Pelarut Tert-butanol Dan Katalis MgO. Teknik Kimia, Universitas Diponegoro.
Rosu, R., Yasui, M., Iwasaki, Y., Yamane, T. 1999. Enzymatic Synthesis of Symmetrical 1,3-Diacylglycerols by Direct Esterification of Glycerol in Solvent-Free System. J. Am. Oil Chem. Soc. 76: 839-843.
Sihotang, H. dan Ginting, M. 2006. Pembuatan Monogliserida melalui Gliserolisis Minyak Inti Sawit Menggunakan Katalis Natrium Metoksida. Jurnal Sains Kimia. 10: 51-57.
Sonntag, N. O. V. 1982. Glycerolysis of Fats and Methyl Esters - Status, Review and Critique. J. Am. Oil Chem. Soc. 59: 795A-802A.
Sudarmadji, S. 1992. Analisa Bahan Makanan dan Pertanian. Penerbit Erlangga. Jakarta.
UI-Press. Jakarta.
Villeneuve, P., Muderhwa, J. M., Graille, J., Haas., M. J., 2000, Customizing lipases for biocatalysis: a survey of chemical, physical and molecular biological approaches., J. Mol. Catal B. 9: 113-148.
Winarno, F. G. 1995. Kimia Pangan dan Gizi. Penerbit PT Gramedia Pustaka Utama. Jakarta.
Yang, T., Rebsdorf, M., Engelrud, U., Xu, X. 2005. Enzymatic production of monoacylglycerols containing polyunsaturated fatty acids through an efficient glycerolysis system. J. Agric. Food Chem.
Zaks, A., and Klibanov, A. M. 1985. Enzyme-catalyzed processes in organic solvents. Proc. Natl. Acad. Sci . 82: 3192-3196.
BAB 3
BAHAN DAN METODE PENELITIAN
3.1 Alat-alat
- Neraca analitis Ohauss
- Oven Gallenkamp
- Incubator shaker Vision
- Rotarievaporator Buchi
- Chamber
- Syringe Hamilton
- Desikator
- Erlenmeyer Pyrex
- Beaker glass Pyrex
- Pipet tetes
- Gelas ukur Pyrex
- Spatula
- Botol vial
- Corong pisah Pyrex
- Seperangkat alat Fourier Transform Infrared Spectroscopy Perkin Elmer
- Seperangkat alat Gas Chromatography Shimadzu
- Buret Pyrex
- Statif dan klem
- Cawan porselen
- Vortex
3.2 Bahan-bahan
- Minyak inti sawit PT.SMART
- Gliserol (l) p.a E’merck
- Enzim lipase Candida rugosa(s) p.a E’merck
- Dietil eter(l) p.a E’merck
- KH2PO4(s) p.a E’merck
- K2HPO4(s) p.a E’merck
- Akuades
- N-Methyl-N-(trimethylsilyl)trifluoroacetamida (MSTFA)(l) p.a E’merck
- Trikaprin(l) p.a E’merck
- Tetrahydrofuran (THF) (l) p.a E’merck
- KOH 0,1 N(l)
- Indikator phenolftalein(l)
- Tert-butanol(l) p.a E’merck
- Alkohol 96%(l) p.a E’merck
- Asam oksalat(s) p.a E’merck
- Gas nitrogen
3.3 Prosedur Penelitian
3.3.1 Pembuatan Larutan Pereaksi
3.3.1.1 Indikator Fenolftalein 1%
Sebanyak 1 g indikator fenolftalein ditimbang dan dilarutkan dengan etanol
dalam labu takar 100 mL sampai garis tanda.
3.3.1.2 Pembuatan Larutan KOH 0,1 N a. Pembuatan Larutan KOH 0,1 N
Ditimbang 1,4 g KOH dan dimasukkan kedalam labu takar 250 mL, kemudian
b. Standarisasi Larutan KOH 0,1 N dengan Asam Oksalat
Sebanyak 0,63 g asam oksalat ditimbang dengan teliti (BM=126), kemudian
dilarutkan ke dalam 100 mL aquades dan dipipet sebanyak 10 mL kemudian
ditambahkan 3 tetes indikator fenolftalein kemudian dititrasi dengan larutan KOH
yang akan dstandarisasi hingga warna merah rose. Dilakukan hal yang sama
sebanyak 3 kali.
Perhitungan N larutan KOH = (g asam oksalat x 2)
(0,216 x mL KOH)
3.3.1.3 Pembuatan Buffer Posfat 0,05 M untuk Posfat
Dipakai rumus : atau
Dimana:
[HA] = konsentrasi asam
[A-] = konsentrasi garam
7,0 = 7,2
= 7,2 – 7,0
= 0,2
= 1,5849
=
x 100%
x 100%
x 100%
x 100%
= 61,32%
Gram garam = % Garam x Molaritas x BM
= 38,68% x 0,05M x 174 g/mol
= 0,3868 x 0,05M x 174 g/mol
= 3,3652 g/L
Gram Asam = % Asam x Molaritas x BM
= 61,32% x 0,05M x 136 g/mol
= 0,6132 x 0,05M x 136 g/mol
= 4,1698 g/L
Ditimbang 4,1698 g KH2PO4(s) dan 3,3652 g K2HPO4(s). Dilarutkan
masing-masing kristal dengan sedikit akuades di dalam beaker glass. Dicampurkan larutan
ke dalam labu takar 100 mL. Ditambahkan akuades hingga garis batas lalu
dihomogenkan.
3.3.2. Penentuan Kadar Air PKO (SNI 01-2891-1992)
Cawan kosong dikeringkan dalam oven selama 15 menit. Cawan didinginkan
dalam desikator. Cawan diambil dengan penjepit kemudian cawan kering yang
sudah didinginkan ditimbang. Ditimbang sebanyak 2 g sampel pada cawan
tersebut ditimbang lalu dikeringkan pada oven suhu 105˚C selama 3 jam
kemudian didinginkan dalam desikator. Penimbangan dilakukan dan diulangi
hingga diperoleh bobot tetap/konstan ( ≤0,0005 g).
Kadar air = [(W3-W2) / (W2-W1)] x 100% dimana: W1 = berat cawan kosong (g)
W2 = berat cawan dan contoh kering sebelum dikeringkan (g)
3.3.3. Penentuan Kadar Asam Lemak Bebas (%ALB) pada minyak inti sawit (Ketaren, 1986)
Pengukuran kadar ALB dilakukan dengan metode titrimetri. Sebanyak 5 g minyak
inti sawit dimasukkan ke dalam erlenmeyer kemudian ditambahkan 10 ml alkohol
96%. Gelas Erlenmeyer ditutup dengan plastik dan diikat dengan karet lalu
dipanaskan hingga mendidih. Sebanyak 3 tetes indikator phenolftalein
ditambahkan lalu dititrasi dengan larutan KOH 0,1 N hingga terjadi perubahan
warna menjadi merah lembayung. Volume KOH yang terpakai kemudian dicatat.
Perhitungan % ALB :
% ALB = V. N. BM x 100 %
G.1000
Di mana : V = Volume KOH 0,1N (mL)
N = Normalitas KOH 0,1N (mol/L)
BM =Berat molekul asam laurat (g/mol)
G = berat sampel minyak inti sawit (g)
3.3.4. Gliserolisis minyak inti sawit
Dimasukkan 6,98 gr minyak inti sawit ke dalam gelas Erlenmeyer lalu
ditambahkan 7 mL buffer fosfat pH 7 dan ditambahkan 3,02 gr gliserol.
Kemudian ditambahkan 7 mL tert-butanol. Selanjutnya ditambahkan enzim lipase
Candida rugosa sebanyak 0,1 gr. Diinkubasi di dalam incubator shaker pada suhu 40oC dengan kecepatan 350 rpm selama 4 jam. Hasil gliserolisis dimasukkan
kedalam corong pisah kemudian diekstraksi dengan dietil eter lalu didiamkan
hingga terbentuk 2 lapisan. Diambil lapisan atas yang mengandung gliserolat lalu
diuapkan dengan rotarievaporator sehingga diperoleh gliserolat. Dilakukan
percobaan yang sama dengan waktu reaksi hingga 36 jam dengan variasi waktu 4
Konversi gliserolat dianalisa berdasarkan nilai absorbansi gugus –OH dari monogliserida dan digliserida pada spektroskopi FT-IR. Gliserolat dengan nilai
absorbansi tertinggi dianalisa lebih lanjut dengan kromatografi lapis tipis dan
kromatografi gas untuk mengetahui kadar mono- dan digliserida.
3.3.5 Analisis Gliserolat dengan Kromatografi Gas (AOCS, 1995)
Sampel ditimbang sebanyak 0,05 g kemudian ditambahkan 100 µl MSTFA dan
100 µl trikaprin lalu campuran divortex hingga homogen. Setelah itu ditambahkan
0,1 ml THF dan 1 ml n-heptana lalu didiamkan. Campuran diinjeksikan ke dalam
alat kromatografi gas dilengkapi dengan detektor ionisasi nyala. Kolom yang
digunakan adalah kolom kapiler DB-5HT (5%-phenyl)-methyl polysiloxane (6 m
x 0,32 mm). Suhu detektor dan injektor 350˚C dan digunakan model split injector 200 : 1. Suhu oven diprogram dari 160 sampai 350˚C pada 30˚C/min dan ditahan
pada 350˚C selama 25 menit. Nitrogen digunakan sebagai gas pembawa dengan kecepatan alir 200 ml/menit. Waktu proses 30 menit dan sampel diinjeksikan 1µl
secara manual. Untuk mendapatkan persentase senyawa yang dianalisa, dilakukan
dengan cara menghitung area masing-masing senyawa dari kromatogram yang
Hasil
Cawan porselen Minyak inti sawit
3.4 Bagan Penelitian
3.4.1 Penentuan kadar Air PKO
dikeringkan dalam oven selama 15 menit
didinginkan dalam desikator
ditimbang 2 g minyak inti sawit menggunakan neraca analitis ke dalam cawan porselin
dikeringkan dengan suhu oven 105°C selama 3 jam
didinginkan dalam desikator
ditimbang
diulangi penimbangan hingga diperoleh bobot konstan
Hasil
3.4.2. Analisa kadar asam lemak bebas minyak inti sawit
Minyak inti sawit
ditimbang sebanyak 5 g
dimasukkan ke dalam erlenmeyer
ditambahkan 10 ml alkohol 96%
ditutup dengan plastik dan diikat dengan karet
dipanaskan hingga mendidih
ditambahkan 3 tetes indikator phenolftalein
dititrasi dengan KOH 0,1 N hingga terjadi perubahan warna menjadi merah lembayung
dicatat KOH 0,1 N yang terpakai
6,98 gram Minyak inti sawit
Analisa FT-IR Analisa GC
3.4.3. Gliserolisis minyak inti sawit
dimasukkan ke dalam Erlenmeyer
ditambahkan 7 mL buffer fosfat pH 7
ditambahkan 3,02 gram gliserol
ditambahkan 7 mL tert-butanol
ditambahkan 0,1 gram enzim lipase Candida rugosa
diinkubasi di dalam incubator shaker pada suhu 40°C dengan kecepatan shaker 350 rpm selama 4 jam
dimasukkan ke dalam corong pisah
ditambahkan dietil eter
diekstraksi hingga terbentuk dua lapisan
diuapkan dengan rotarievaporator
Gliserolat
3.4.4 Analisis Gliserolat dengan Kromatografi Gas
ditimbang sebanyak 0,05 g dengan neraca analitis
ditambahkan 100 µl MSTFA
ditambahkan 100 µl trikaprin
dihomogenkan dengan alat vortex
ditambahkan 0,1 ml THF
ditambahkan 1 ml n-heptana
diatur suhu injektor dan detektor 350°C
diatur suhu oven dari 160 sampai 350°C pada 30°C/min
ditahan pada 350°C selama 25 menit
diinjeksikan sampel 1 µl secara manual
dihitung area masing-masing senyawa dari kromatogram
hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
A. Analisa FT-IR Hasil Gliserolisis Minyak Inti Sawit
Gliserolisis minyak inti sawit menggunakan enzim lipase dari Candida rugosa
menghasilkan larutan yang mengandung campuran monogliserida, digliserida, dan
ester. Waktu reaksi optimum gliserolisis dapat diketahui dengan cara gliserolat
terlebih dahulu dianalisa dengan spektroskopi FT-IR untuk mengetahui secara
kualitatif absorbansi gugus –OH dari campuran monogliserida dan digliserida pada gliserolat setiap waktu yang telah ditentukan.
Tabel4.1.Data absorbansi gugus –OH dari campuran monogliserida dan digliserida.
Waktu reaksi (jam) Hasil
4 Ada
8 Ada
12 Ada
16 Ada
20 Ada
24 Ada
28 Tidak Ada
32 Tidak Ada
36 Tidak Ada
Hasil analisa dengan FT-IR menunjukkan bahwa substrat telah banyak
jam dimana nilai absorbansi gugus –OH campuran adalah 0,1313 sehingga memberikan gambaran awal monogliserida dan digliserida paling banyak
terbentuk setelah 4 jam dibandingkan kandungan campuran hasil reaksi pada
waktu reaksi yang lainnya. Walaupun demikian, gliserolat perlu dianalisa lebih
lanjut menggunakan kromatografi gas untuk mengetahui kadar mono- dan
digliserida yang dihasilkan.
.
B. Analisis Kadar Mono- dan Digliserida Hasil Gliserolisis Minyak Inti Sawit
Gliserolat hasil reaksi semuanya masih mengandung campuran senyawa-senyawa
hasil reaksi gliserolisis,oleh karena itu gliserolat perlu dianalisa lebih lanjut
dengan menggunakan kromatografi gas untuk mengetahui persentase dari
senyawa-senyawa yang terkandung dalam gliserolat, khususnya senyawa
monogliserida dan digliserida.
4.2. Pembahasan
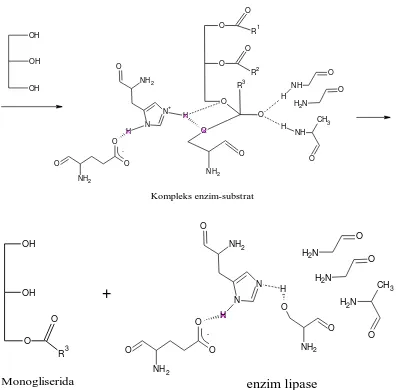
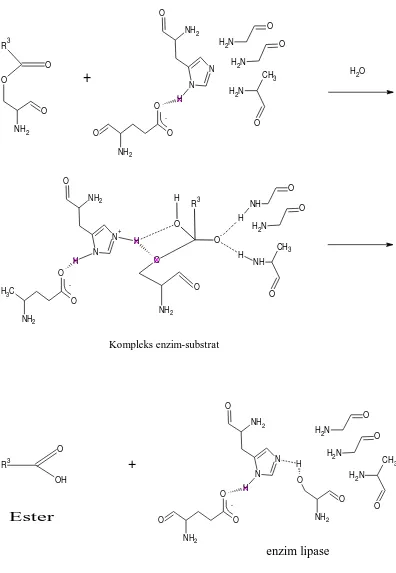
Gliserolisis enzimatis merupakan reaksi dimana dua substrat diubah oleh suatu
enzim menjadi dua produk baru atau reaksi Bi-Bi ping-pong. Sebagai contoh pada
reaksi ini adalah salah satu gugus dari trigliserida dikeluarkan oleh enzim
sehingga trigliserida menjadi produk digliserida dan suatu gugus bebas,
sedangkan enzim mengalami suatu bentuk termodifikasi. Reaksi berikutnya
adalah gugus bebas dan enzim akan bereaksi dengan substrat kedua yaitu gliserol
dimana akan dihasilkan produk monogliserida dan enzim kembali ke bentuk
semula.
Menurut Grochulski (1993), sisi aktif Ser-209 adalah sisi aktif yang
berperan penting dalam reaksi karena memiliki atom O yang terekspos terhadap
model mekanisme reaksi hidrolisis ester dari enzim lipase Candida rugosa.
Berdasarkan informasi tersebut, maka dapat digambarkan bahwa mekanisme
reaksi untuk gliserolisis adalah sebagai berikut:
OH
Gambar 4.1 Mekanisme reaksi gliserolisis enzimatis
Salah satu factor dalam reaksi gliserolisis enzimatis adalah pelarut untuk
membuat minyak dan gliserol bercampur menjadi satu fasa, dengan demikian
enzim dapat bekerja lebih mudah dalam mengubah substrat menjadi produk dan
semakin bagus pelarut yang digunakan, diharapkan enzim dapat lebih cepat dalam
mengubah substrat. Setelah didapatkan perbandingan minimal minyak dengan
pelarut, maka perlu ditentukan juga waktu reaksi dengan harapan produk banyak
dihasilkan dalam waktu singkat. Analisa FT-IR dilakukan hanya sebagai analisa
pada waktu reaksi 4 jam dengan nilai 0,1313 dan muncul pada bilangan
gelombang 3382,69 cm-1.
Pada saat gliserolat dianalisa menggunakan kromatografi gas,terdapat
banyaknya senyawa ester yang terbentuk dari reaksi gliserolisis, sedangkan ester
hanya dapat terbentuk bila terdapat banyak air dalam system reaksi. Minyak dan
gliserol sebelum digunakan untuk reaksi sudah terlebih dahulu dipanaskan pada
suhu 110oC dengan tujuan mengurangi air yang terkandung di dalam sampel dan
mengurangi pembentukan produk selain monogliserida dan digliserida. Pada
reaksi ini, senyawa ester dapat terbentuk karena pada terdapat air dalam jumlah
yang banyak berasal dari larutan buffer, sedangkan tujuan utama digunakan
larutan buffer adalah menjaga pH reaksi sehingga enzim dapat menjaga bentuk
dari sisi aktifnya.
Hal ini menjelaskan fenomena menurunnya nilai absorbansi gugus –OH walaupun muncul pada waktu reaksi jam ke 8 hingga 20, sedangkan tidak
terdeteksi lagi nilai absorbansi gugus –OH pada jam ke 24 hingga 36 walaupun ada beberapa hasil dimana muncul gelombang. Peristiwa ini dapat disebabkan
karena beberapa hal yaitu air dari buffer digunakan oleh enzim untuk
menghasilkan ester, terjadi perubahan pH pada system reaksi yang akan
menyebabkan berubahnya bentuk sisi aktif enzim, pada akhirnya enzim tidak
dapat bekerja lagi atau terdenaturasi karena sisi aktif enzim telah berbeda dan
tidak cocok lagi untuk merubah substrat-substrat.
Ester yang dihasilkan adalah 20,35%, mendekati jumlah digliserida yang
menunjukkan bahwa air bersifat inhibitor kompetitif. Dengan penjelasan
mekanisme reaksi sebelumnya, maka dapat digambarkan reaksi pembentukan
O
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Dengan perbandingan minimal minyak dan pelarut, produk dari reaksi
gliserolisis paling banyak terbentuk setelah reaksi berjalan selama 4 jam .
2. Gliserolisis enzimatis dengan perbandingan minimal minyak dengan
pelarut, dan pada waktu reaksi 4 jam menghasilkan monogliserida
sebanyak 43,58% dan digliserida sebanyak 24,65%.
5.2 Saran
1. Diharapkan pada penelitian selanjutnya tidak digunakan lagi larutan buffer
untuk mengurangi pembentukan ester.
2. Diharapkan pada penelitian selanjutnya digunakan suhu reaksi lebih tinggi
dari 40oC untuk meningkatkan kinerja enzim dan meningkatkan kelarutan
BAB 2
TINJAUAN PUSTAKA
2.1 Minyak Inti Sawit
Pemisahan inti sawit dari tempurungnya dilakukan menggunakan hydrocyclone
separator, dimana inti dan tempurung dipisahkan oleh aliran air yang berputar dalam sebuah tabung sehingga inti sawit akan mengapung dan tempurungnya
tenggelam. Selanjutnya inti sawit dan tempurung dicuci sampai bersih. Inti sawit
harus segera dikeringkan dengan suhu 80oC kemudian diolah lebih lanjut dengan
ekstraksi untuk menghasilkan minyak inti sawit (palm kernel oil, PKO). Berikut
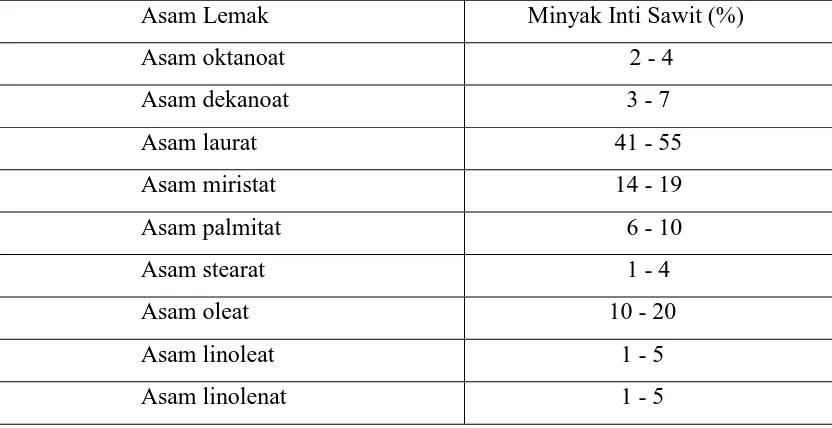
ini adalah komposisi asam lemak dalam minyak inti sawit.
Tabel 2.1 Komposisi Asam Lemak Minyak Inti Sawit.
Asam Lemak Minyak Inti Sawit (%)
Asam oktanoat 2 - 4
Asam dekanoat 3 - 7
Asam laurat 41 - 55
Asam miristat 14 - 19
Asam palmitat 6 - 10
Asam stearat 1 - 4
Asam oleat 10 - 20
Asam linoleat 1 - 5
Asam linolenat 1 - 5
Sumber : Fauzi dkk, 2012
Asam laurat merupakan komposisi asam lemak paling besar di dalam
minyak asam laurat. Minyak inti sawit yang baik berkadar asam lemak bebas yang
rendah dan berwarna kuning terang serta mudah dipucatkan.
Sifat-sifat fisika dan kimia dari minyak inti sawit ialah meliputi warna, bau
dan flavor, kelarutan, titik cair, titik didih, titik pelunakan, splitting point, shot
melting point, bobot jenis, indeks bias, titik kekeruhan, titik asap, titik nyala, titik
api. Warna minyak ditentukan oleh adanya pigmen yang masih tersisa setelah
proses pemucatan, karena asam-asam lemak dan gliserida tidak berwarna. Warna
orange atau kuning disebabkan adanya pigmen karoten yang larut dalam minyak.
Bau dan flavor dalam minyak terdapat secara alami, juga terjadi akibat adanya
asam-asam lemak berantai pendek akibat kerusakan minyak. Sedangkan bau khas
minyak kelapa sawit ditimbulkan oleh persenyawaan beta ionone. Titik cair
minyak sawit berada dalam nilai kisaran suhu, karena minyak kelapa sawit
mengandung beberapa macam asam lemak yang mempunyai titik cair yang
berbeda-beda (Ketaren, 1986).
2.2. Trigliserida
Lemak dan minyak adalah trigliserida atau triasilgliserol, kedua istilah ini berarti
“triester (dari) gliserol.”. Kebanyakan lemak dan minyak yang terdapat dalam
alam merupakan trigliserida campuran, artinya, ketiga bagian asam lemak dari
gliserida itu tidaklah sama (Fessenden, 1986). Lipid (dari kata Yunani lipos,
lemak) merupakan penyusun tumbuhan atau hewan yang dicirikan oleh sifat
kelarutannya. Lipid dapat diekstraksi dari sel dan jaringan dengan pelarut organik.
Sifat kelarutan ini membedakan lipid dari tiga golongan utama lain dari produk
alam lainnyam yaitu karbohidrat, protein, dan asam nukleat yang pada umumnya
tidak larut dalam pelarut organik.
Terdapat dua jenis trigliserida: trigliserida sederhana, yang ketiga asam
tertentu bukanlah trigliserida tunggal, melainkan campuran rumit dari trigliserida.
Beberapa lemak dan minyak terutama menghasilkan satu atau dua asam, dengan
sedikit saja asam lainnya.
2.1 Struktur trigliserida (Hart, 2003).
Minyak dan lemak termasuk salah satu anggota dari golongan lipid, yaitu
merupakan lipid netral. Lipid sendiri dapat diklasifikasikan menjadi 4 kelas, yaitu:
1) lipid netral, 2) fosfatida, 3) spingolipid, dan 4) glikolipid. Semua jenis lipid ini
terdapat di alam. Lemak dan minyak terdiri dari trigliserida campuran, yang
merupakan ester dari gliserol dan asam lemak rantai panjang. Minyak nabati
terdapat dalam buah-buahan, kacang-kacangan, akar tanaman, dan sayur-sayuran.
Dalam jaringan hewan, lemak terdapat di seluruh badan, tetapi jumlah terbanyak
terdapat dalam jaringan adipose dan tulang sumsum. Trigliserida dapat berwujud
padat atau cair, dan hal ini tergantung dari komposisi asam lemak yang
menyusunnya. Sebagian besar minyak nabati berbentuk cair karena mengandung
sejumlah asam lemak tidak jenuh, yaitu asam oleat, linoleat, atau asam linolenat
dengan titik cair yang rendah. Lemak hewan pada umumnya berbentuk padat pada
suhu kamar karena banyak mengandung asam lemak jenuh, misalnya asam
palmitat dan stearat yang mempunyai titik cair lebih tinggi (Ketaren, 1986).
Satu sifat yang khas dan mencirikan golongan lipida (termasuk minyak
dan lemak) adalah daya larutnya dalam pelarut organic atau sebaliknya
ketidak-larutannya dalam pelarut air. Lemak dan minyak ini dalam bidang biologi dikenal
sebagai salah satu bahan penyusun dinding sel dan penyusun bahan-bahan
biomolekul. Dalam bidang gizi, lemak dan minyak merupakan sumber biokalori
Di samping itu lemak dan minyak juga merupakan sumber alamiah
vitamin-vitamin yang terlarut dalam minyak yaitu vitamin A, D, E, dan K.
(Sudarmadji, 1992). Lemak hewani mengandung banyak sterol yang disebut
kolesterol, sedangkan lemak nabati mengandung fitosterol dan lebih banyak
mengandung asam lemak tidak jenuh (Winarno, 1995).
Trigliserida merupakan kelompok lipida yang terdapat paling banyak
dalam jaringan hewan dan tanaman. Trigliserida dalam tubuh manusia bervariasi
jumlahnya tergantung dari tingkat kegemukan seseorang dan dapat mencapai
beberapa kilogram. Jaringan tanaman umumnya mengandung trigliserida sedikit,
kecuali bagian-bagian tanaman tertentu yang menjadi tempat cadangan makanan
misalnya buah dan biji yang dapat mengandung trigliserida cukup tinggi sampai
mencapai puluhan persen (Sudarmadji, 1992).
2.3 Monogliserida dan Digliserida
Penggunaan monogliserida di formulasi bidang farmasi dan makanan terus
meningkat. Di dalam bidang farmasi, monogliserida digunakan sebagai bahan
pengikat pada tablet dan sebagai pelunak untuk obat dengan pelepasan lambat.
Dalam industri makanan, monogliserida bertindak untuk menstabilkan emulsi
didalam saus dan makanan panggang (Jackson and King, 1997) dan juga
memberikan viskositas yang dibutuhkan oleh bahan tersebut (Fregolente et al,
2005).
Selain kegunaan dari monogliserida, penelitian mengenai digliserida
terhadap diet manusia juga telah dilakukan. Penggunaan digliserida sebagai
pengganti trigliserida di dalam makanan dapat mengurangi akumulasi lemak pada
jaringan perut sehingga mencegah berbagai penyakit yang berhubungan dengan
Kedua gliserida tersebut diproduksi dengan reaksi kimiawi atau enzimatis,
secara umum diperoleh dari proses gliserolisis dari trigliserida, hidrolisis dari
trigliserida, atau esterifikasi secara langsung antara gliserol dengan asam lemak
(Fregolente et al, 2010). Dalam skala industri, monogliserida dan digliserida
diproduksi dengan sintesis kimia menggunakan gliserol, lemak, dan suatu katalis
alkali yang dicampur dan dipanaskan pada suhu hampir 250˚C. Ca(OH)2
digunakan sebagai katalis dalam produksi monogliserida (Sonntag, 1982).
Selain itu, digliserida dapat disintesis dengan cara esterifikasi gliserol
dengan asalm lemak oleh enzim lipase terimmobil spesifik-1,3 menggunakan
Lipozyme. (Rosu et al, 1999) Cara lainnya adalah dengan menghidrolisis distilat
asam lemak menggunakan enzim lipase Candida rugosa, diikuti dengan destilasi
uap secara vakum, lalu diesterifikasi dengan Lipozyme (Nandi et al, 2004).
2.4 Gliserol
Gliserol ialah suatu trihidroksi alkohol yang terdiri atas tiga atom karbon. Jadi tiap
atom karbon mempunyai gugus –OH. Satu molekul gliserol dapat mengikat satu,
dua, atau tiga molekul asam lemak dalam bentuk ester, yang disebut
monogliserida, digliserida, atau trigliserida. Gliserol larut baik dalam air dan tidak
larut dalam eter (Poedjiadi, 2007). Gliserol berwujud seperti sirup, tak berwarna,
cairan bertitik didih tinggi yang sangat larut air dengan rasa yang sangat manis.
Kualitas melembutkan dari zat ini sangat berguna yang kemudian digunakan
dalam sabun cukur dan sabun mandi serta obat batuk berwujud tetes dan sirup
(Hart, 2003).
Dalam tanaman, terjadi serangkaian reaksi biokimia; pada reaksi ini
fruktosa difosfat diuraikan oleh enzim aldosa menjadi dihidroksi aseton fosfat,
kemudian direduksi menjadi α-gliserofosfat. Gugus fosfat dihilangkan mealui
CH2OH
CHOH
CH2OH
Gambar 2.2 Gliserol
Stoikiometri reaksi sintesis monogliserida memerlukan perbandingan
molar gliserol terhadap metal ester asam lemak atau fatty acid methyl ester
(FAME) adalah 1:1. Bagaimanapun, dari sudut termodinamika, hasil
monogliserida dapat diraih dengan menaikkan rasio Gliserol:FAME dari rasio
stoikiometris. Gliserol berlebih menggeser kesetimbangan ke kanan dan
menaikkan perubahan metal ester asam lemak. Di lain sisi, efek gliserol
berlebihan pada kinetika reaksi sulit diprediksi karena gliserol lebih padat
daripada fase minyak dan lebih hidrofilik.
Oleh karena itu, gliserol kemungkinan diserap secara kuat di permukaan.
Sebagai tambahan, gliserol harus ditansfer ke fase minyak dimana reaksi terjadi.
Rasio Gliserol/ FAME mempengaruhi kelarutan gliserol (Ferretti et al, 2009)
2.5 Pelarut
Suatu medium pelarut sebenarnya merupakan jawaban yang penting untuk
meningkatkan homogenitas daripada system reaksi. Pelarut tunggal yang dapat
menahan minyak dan gliserol di dalam system homogeny sebenarnya sangat sulit
untuk ditemukan, khususnya berhubungan dengan keamanan pelarut untuk
aplikasi pada makanan. Pelarut hidrokarbon secara umum tidak mungkin
digunakan untuk tujuan ini.
Setelah menyingkirkan pelarut yang berbahaya dan tidak biasa dari daftar,
Pada beberapa pelarut yang tinggal, beberapa alkohol dengan karbon lebih dari
lima dapat dianggap karena mereka mengandung gugus polar –OH dan rantai
karbon yang bersifat nonpolar. Hal ini memberikan kemungkinan untuk menahan
minyak dan gliserol dalam satu system. Alkohol secara alami merupakan lawan
dalam reaksi terhadap gliserol, khususnya alcohol primer. Kegunaan alkohol
tersier merupakan pilihan utama karena struktur tersier akan mempunyai aktivitas
sterik yang kuat terhadap aktivitas enzim. Hal ini sebenarnya dikonfirmasi oleh
penelitian sebelumnya dengan tert-butil alkohol. (Yang et al, 2005)
Ada beberapa keuntungan saat melakukan konversi enzimatik dalam
pelarut organic selain air: kelarutan yang tinggi dari kebanyakan senyawa organik
didalam media non aqueous, kemampuan untuk melakukan reaksi yang mustahil
dalam air karena halangan kinetik atau termodinamik, stabilitas enzim yang lebih
besar, kemudahan pemisahan produk dari pelarut organik dibanding air,
ketidaklarutan enzim dalam pelarut organik sehingga mudah didapatkan kembali
dan digunakan sehingga tidak perlu diimobilisasi. (Zaks and Klibanov, 1985)
2.6 Katalis
Pengetahuan tentang katalis telah dirintis oleh Berzelius pada tahun 1837. Ia
mengusulkan nama katalis untuk zat-zat yang dapat mempercepat reaksi tetapi zat
itu sendiri tidak ikut bereaksi (Poedjiadi, 2007). Faktor lain yang mempengaruhi
laju reaksi ialah katalis. Katalis mempercepat reaksi dengan memberi lintasan
alternatif atau mekanisme alternatif, yaitu yang energi aktivasinya lebih rendah.
Enzim memainkan peran ini dalam reaksi biokimiawi (Hart, 2003).
Katalis adalah suatu zat yang mengakibatkan reaksi lebih cepat mencapai
kesetimbangan. Katalis tidak akan mengubah nilai tetapan kesetimbangan, dan
tidak mengalami perubahan apapun. Peranan katalis adalah menurunkan energi
untuk mencapai komplek teraktifkan yang sama dengan bila tanpa adanya katalis
(Cotton dan Wilkinson, 1989). Katalis dapat menurunkan energi pengaktifan
reaksi (seringkali dengan menyediakan jalan lain, untuk menghindari tahap
penentu laju yang lambat dari reaksi yang tidak dikatalisa), sehingga
menghasilkan laju reaksi yang tinggi. Katalis dapat sangat efektif. (Atkins, 1997).
Dalam kondisi katalis heterogen, reaksi terjadi di permukaan katalis. Oleh
karena itu, peningkatan luas permukaan diharapkan menaikkan konversi reaktan.
Variasi temperatur reaksi akan mempengaruhi khususnya kinetika reaksi, tidak
hanya kecepatan kinetik, akan tetapi juga kelarutan reaktan. Peningkatan
temperatur reaksi diharapkan meningkatkan aktivitas katalis (Ferretti et al, 2009)
2.7 Enzim
Enzim dikenal untuk pertama kalinya sebagai protein oleh Sumner pada tahun
1926 yang telah berhasil mengisolasi urease dari kara pedang. Urease adalah
enzim yang dapat menguraikan urea menjadi CO2 dan NH3. Selanjutnya makin
banyak enzim yang telah dapat diisolasi dan telah dibuktikan bahwa enzim
tersebut ialah suatu protein. Dari hasil penelitian para ahli biokimia ternyata
bahwa banyak enzim mempunyai gugus bukan protein, jadi termasuk golongan
protein majemuk.
Fungsi suatu enzim ialah sebagai katalis untuk proses biokimia yang
terjadi di dalam sel maupun di luar sel. Suatu enzim dapat mempercepat reaksi 108
sampai 1011 kali lebih cepat daripada apabila reaksi tersebut dilakukan tanpa
katalis. Seperti juga katalis lainnya, maka enzim dapat menurunkan energi
aktivasi suatu reaksi kimia. Enzim digolongkan menurut reaksi yang diikutinya,
sedangkan masing-masing enzim diberi nama menurut nama substratnya. Oleh
I. Oksidoreduktase
II. Transferase
III. Hidrolase
IV. Liase
V. Isomerase
VI. Ligase (Poedjiadi, 2007)
2.7.1. Enzim lipase
Ada tiga jenis hidrolase, yaitu yang memecah ikatan ester, memecah glikosida dan
yang memecah ikatan peptida. Beberapa enzim sebagai contoh adalah esterase,
lipase, fosfatase, amylase, amino peptidase, karboksi peptidase, pepsin, tripsin,
kimotripsin (Poedjiadi, 2007). Enzim lipase biasanya terdapat dalam biji-bijian
yang dapat mengandung minyak, misalnya kacang kedele, biji jarak, biji bunga
matahari, biji jagung dan juga terdapat dalam daging hewan dan dalam beberapa
jenis bakteri (Ketaren, 1986).
Lipase ialah enzim yang memecah ikatan ester pada lemak, sehingga
terjadi asam lemak dan gliserol. Enzim ini merupakan katalis pada reaksi
pemecahan molekul lipid secara hidrolisis. Enzim lipase bekerja secara optimum
pada pH 5,5 sampai 7,5. Namun lipase tahan terhadap lingkungan yang bersifat
sangat asam dan dapat juga melangsungkan reaksi hidrolisis terhadap molekul
triasil gliserol atau trigliserida yang mengandung asam lemak pendek atau sedang.
Aktifitas enzim lipase dapat bertambah dengan adanya ion Ca++ dan asam
empedu, dan bekerja secara optimal pada pH 7,0 sampai 8,8. Pemecahan lemak
dengan cara hidrolisis dibantu oleh garam asam empedu yang terdapat dalam
cairan empedu dan berfungsi sebagai emulgator. Dengan adanya garam asam
empedu sebagai emulgator, maka lemak dalam usus dapat dipecah-pecah menjadi
partikel-partikel kecil sebagai emulsi, sehingga luas permukaan lemak bertambah
trigliserida terhidrolisis sempurna menjadi gliserol dan asam lemak, tetapi masih
terdapat digliserida dan monogliserida sebagai hasil reaksi di samping gliserol dan
asam lemak (Poedjiadi, 2007).
2.7.2 Enzim lipase Candida rugosa
Enzim lipase Candida rugosa bekerja optimum pada kisaran pH 6,5-7,5 dengan
pH isoelektriknya sebesar 4,5 (Villenueve et al. ,2000). Sifat katalitiknya
optimum pada rentang suhu 30-350 C (Fadiloglu & Soylemez, 1997). Enzim ini
mempunyai aktivitas 800 U/mg (Fregolente et al, 2008). Struktur lipase Candida
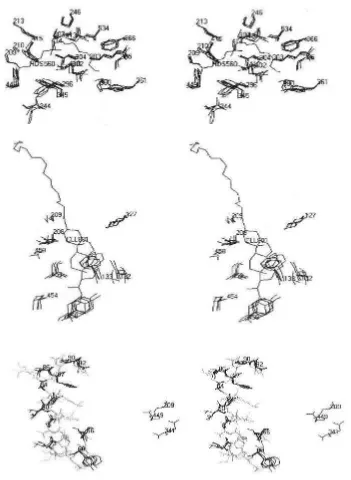
rugosa yang ditentukan pada resolusi 2.06 Å menghasilkan konformasi dengan sisi aktif yang dapat dilewati oleh pelarut. CRL merupakan molekul berbentuk
tunggal dan berasal dari keluarga protein α/β hidrolase. Sisi aktif enzim ini
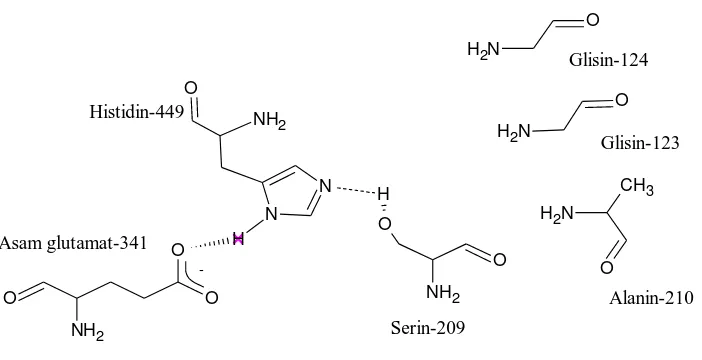
dibentuk oleh Ser-209, His-449, dan Glu-341 (singkatan nama asam amino yang
berperan untuk sisi aktif - urutan asam amino tersebut dalam protein enzim).
Hanya terdapat dua permukaan residu polar di dalam visinitas Ser-209, Glu-208,
dan Ser-450. Mereka mungkin berperan dalam mengikat hidrogen dari gugus
karbonil pada gliserol sebagai substrat.(Grochulski et al, 1993)
O O
Sejumlah air dibutuhkan untuk menjaga enzim di dalam konformasi
aktifnya, tetapi konsentrasi air yang tinggi akan membuat terjadinya hidrolisis
terhadap ester yang terbentuk. Aktivitas tertinggi didapatkan pada sintesa ester
dengan berat molekul rendah. Adanya ikatan rangkap pada molekul asam lemak
meningkatkan aktivitas enzim. (Bezbradica et al, 2005).
Gambar 2.4 Wilayah untuk mengikat substrat dari enzim lipase Candida rugosa
2.8 Gliserolisis
Gliserol dan lemak ditransesterifikasi di dalam reactor yang distirer dengan katalis
basa, secara umum KOH atau Ca(OH)2. Temperatur berkisar 250oC untuk
mencapai kelarutan yang sesuai dari gliserol dalam fase lemak dan reaksi yang
cepat. Nitrogen digunakan sebagai gas inert untuk mencegah terjadinya oksidasi
dan didalam kasus katalis asam adalah pembentukan akrolein. Setelah mencapai
kesetimbangan, katalis dinetralisasi dengan asam fosfat dan dengan cepat
didinginkan untuk mencegah reaksi terbalik. Produk netralisasi diserap dengan
tanah liat. Produk lalu dimurnikan dengan memisahkan gliserol berlebih dan
mencucinya dengan air (Kimmel, 2004).
Kelemahan reaksi gliserolisis dengan menggunakan katalis logam adalah
suhu reaksi yang cukup tinggi yaitu 220-250oC. Hal ini menyebabkan produk
yang dihasilkan berwarna gelap dan bau yang tidak diinginkan (McNeill, 1991).
Sintesis monogliserida secara enzimatik oleh berbagai katalis lipase telah
mengundang banyak perhatian dalam beberapa tahun belakangan karena
memerlukan energy yang lebih rendah dan selektivitas dari katalis.
Kesetimbangan rasio molar untuk reaksi yang ideal antara gliserol dan
trigliserida adalah 2:1 dimana akan terbentuk 3 mol monogliserida. Akan tetapi,
reaksi ini bersifat reversibel dan diyakini mengandung tiga jalur reaksi secara
berkelanjutan. Monogliserida diketahui sebagai produk utama dari reaksi, akan
tetapi digliserida juga akan terbentuk dan beberapa trigliserida yang tidak ikut
bereaksi juga akan ditemukan pada akhir reaksi (Nouredinni et al, 2004).
Gliserolisis berjalan baik pada suhu yang cukup tinggi karena dapat
meningkatkan homogenitas campuran reaksi. Semakin homogeny campuran,
semakin banyak molekul yang bertumbukan dan menghasilkan produk. Pada
reaksi ini gliserol yang polar harus ditingkatkan kelarutannya pada minyak yang
yang cukup tinggi diperlukan untuk meningkatkan kelarutan gliserol dalam
minyak (fase trigliserida). Semakin banyak gliserol yang larut dan bereaksi
dengan CPO, makin besar pula konversi yang diperoleh (Corma et al, 1997).
Menurunnya kelarutan CPO dalam gliserol menyebabkan tumbukan antar molekul
minyak dengan gliserol akan berkurang sehingga konversi reaksi akan menurun.
Kelarutan minyak dalam gliserol sangat rendah pada suhu yang rendah sehingga
untuk meningkatkan kelarutan minyak dalam gliserol dapat dilakukan dengan
menaikkan suhu reaksi atau dengan menggunakan pelarut.
Reaksi gliserolsis merupakan reaksi yang berjalan lambat tanpa adanya
katalis. Katalis sangat berperan penting dalam meningkatkan laju reaksi.
Diperlukan pelarut organic yang dapat meningkatkan kelarutan minyak dalam
gliserol supaya reaksi gliserolsis dapat dilakukan pada suhu yang relative rendah
untuk menghindari terbentuknya warna coklat dan bau tidak sedap akibat
Bab 1
PENDAHULUAN
1.1Latar Belakang
Kelapa sawit merupakan komoditas perkebunan unggulan dan utama Indonesia.
Tanaman yang produk utamanya terdiri dari minyak sawit (Crude Palm Oil) dan
minyak inti sawit (Palm Kernel Oil) ini memiliki nilai ekonomis tinggi dan
menjadikan salah satu penyumbang devisa negara yang terbesar dibandingkan
dengan komoditas perkebunan lainnya. Hingga saat ini kelapa sawit telah
diusahakan dalam bentuk perkebunan dan pabrik pengolahan kelapa sawit hingga
menjadi minyak dan produk turunannya. Minyak sawit dapat dimanfaatkan di
berbagai industry karena memiliki susunan dan kandungan gizi yang cukup
lengkap. Industri yang banyak menggunakan minyak sawit adalah industry
pangan serta industri nonpangan seperti kosmetik dan farmasi. (Fauzi dkk, 2012)
Monoasilgliserol dan Diasilgliserol atau biasa disebut monogliserida dan
digliserida (MG-DG) dibuat dari senyawa gliserida yang banyak terdapat dalam
bahan minyak atau lemak, seperti minyak kelapa sawit dengan gliserol (Anggoro
dan Budi, 2008). Di masa lalu, monogliserida dan digliserida hanya dapat
diproduksi melalui sejumlah proses pada temperatur yang tinggi (220-260oC)
dengan adanya katalis anorganik seperti natrium, kalium, atau kalsium hidroksida
(Sonntag, 1982). Akan tetapi, proses ini memiliki kelemahan karena penggunaan
temperatur yang tinggi sehingga produk yang dihasilkan berwarna gelap dan
terbentuk bau yang tidak diinginkan (McNeill, 1991).
Proses gliserolisis dengan penggunaan biokatalis (enzim lipase) banyak
sekali dilakukan karena dalam prosesnya energi yang diperlukan untuk reaksi
lebih sedikit, lebih ramah lingkungan, dan dapat menghasilkan produk dengan
warna yang lebih terang. Akan tetapi, reaksi enzimatis secara umum berjalan
lambat dan harga enzim yang mahal. (Noureddini, 2004). Hal ini membuat
Sihotang dan Ginting (2006) melakukan penelitian mengenai Pembuatan
Monogliserida Melalui Gliserolisis Minyak Inti Sawit Menggunakan Katalis Natrium Metoksida dimana hasil monogliserida terbesar diperoleh dengan perbandingan mol minyak inti sawit dengan gliserol adalah 1:3. Insani (2012)
melakukan Studi esterifikasi antara asam lemak hasil hidrolisis minyak kelapa
sawit dengan sukrosa menggunakan lipase Candida rugosa EC 3.1.1.3 terimobilisasi pada matriks silica gel 60 dimana suhu reaksi optimum oleh enzim lipase Candida rugosa adalah 37oC. Menurut Ferretti et al (2009), kenaikan
temperature reaksi akan membuat gliserol semakin larut dengan fase minyak dan
aktivitas katalis meningkat, hal ini akan meningkatkan yield MG.
Fregolente et al (2007) melakukan penelitian tentang Monoglycerides and
Diglycerides Synthesis in a Solvent-Free System by Lipase-Catalyzed Glycerolysis dimana gliserolisis dilakukan selama 24 jam tanpa pelarut. Hal ini membuat
enzim lipase Candida rugosa tidak dapat bekerja optimum dalam mengubah
trigliserida. Menurut Damstrup et al (2005), pelarut diperlukan untuk
meningkatkan kelarutan substrat sehingga meningkatkan konversi substrat
menjadi produk dan yang paling baik adalah pelarut tert-butanol. Pada penelitian
tersebut gliserolisis dilakukan selama 4 jam dengan perbandingan pelarut
tert-butanol dan minyak 5:1 dan 30% enzim (w/w), didapatkan hasil MG sebanyak
57,3 %.
Berdasarkan uraian diatas maka penulis tertarik untuk melakukan
penelitian mengenai waktu reaksi optimum enzim lipase Candida rugosa dalam
gliserolisis minyak inti sawit dalam pelarut tert-butanol karena pelarut tersebut
merupakan alcohol tersier, sehingga dapat meningkatkan kelarutan minyak
dengan gliserol dibandingkan dengan pelarut sederhana seperti n-heksana. Selama
ini tidak ada perbandingan pelarut yang baku dalam gliserolisis, oleh karena itu
diadakan percobaan pendahuluan untuk mendapatkan perbandingan minimal
tert-butanol agar minyak bercampur sempurna dengan gliserol yaitu 1:1 (v pelarut/w
minyak). Setelah diketahui perbandingan minimal pelarut, maka perlu dilakukan
penelitian untuk mengetahui waktu konversi terbanyak minyak menjadi
1.2Perumusan masalah
Berapa lama waktu reaksi gliserolisis oleh enzim lipase Candida rugosa
untuk mengkonversi minyak inti sawit dan gliserol secara optimum dan berapa
kadar monogliserida dan digliserida yang dihasilkan pada waktu reaksi tersebut.
1.3Pembatasan masalah
Pada penelitian, permasalahan dibatasi pada:
1. Bahan baku minyak inti sawit diperoleh dari PT. Sinar Mas Agro Resources
and Technology (SMART).
2. Biokatalis lipase berasal dari Candida rugosa yang bersifat free enzyme
dalam bentuk powder.
3. Perbandingan gliserol dan minyak inti sawit adalah 3:1.
4. Pelarut yang digunakan adalah tert-butanol dengan perbandingan pelarut dan
minyak 1:1.
5. Buffer yang digunakan dalam gliserolisis adalah buffer fosfat dengan pH 7.
6. Suhu yang digunakan dalam gliserolisis adalah 40oC.
7. Kecepatan pengadukan yang digunakan adalah 350 rpm.
8. Waktu reaksi pada gliserolisis adalah 4 hingga 36 jam dengan variasi setiap 4
jam.
9. Analisa hasil gliserolisis menggunakan Fourier Transform Infrared Spectroscopy (FT-IR) dan Gas Chromatography (GC).
1.4Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut:
1. Untuk mengetahui waktu reaksi gliserolisis oleh enzim lipase Candida rugosa
untuk mengkonversi minyak inti sawit dan gliserol secara optimum.
2. Untuk mengetahui kadar monogliserida dan digliserida yang dihasilkan enzim
1.5Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menambah informasi mengenai
perbandingan minimal pelarut tert-butanol dengan minyak dalam gliserolisis,
waktu reaksi gliserolisis dimana substrat paling banyak dikonversi menjadi mono-
dan digliserida oleh enzim lipase Candida rugosa, dan persentase hasil mono- dan
digliserida yang dihasilkan oleh enzim lipase Candida rugosa pada waktu reaksi
optimum.
1.6 Lokasi Penelitian
Penelitian ini dilakukan di Pusat Penelitian Kelapa Sawit (PPKS) Jl. Brigjen
Katamso No. 51 Medan, Laboratorium Biokimia Universitas Sumatera Utara, dan
Laboratorium Terpadu USU Medan Sumatera Utara.
1.7 Metodologi Penelitian
Penelitian ini bersifat eksperimen laboratorium yang dilakukan dalam beberapa
tahap:
1. Penyediaan minyak inti sawit
Bahan baku dalam penelitian ini adalah minyak inti sawit yang diperoleh dari
PT.SMART.
2. Analisa pendahuluan minyak inti sawit
Analisa kadar air dari minyak inti sawit menggunakan metode gravimetri
3. Gliserolisis minyak inti sawit
Gliserolisis dilakukan dengan penambahan gliserol terhadap minyak inti sawit lalu ditambahkan tert-butanol dan enzim lipase, diinkubasi dalam
incubator shaker pada suhu 40oC, kecepatan 350 rpm, dan waktu reaksi 4
jam. Setelah waktu reaksi selesai, larutan dimasukkan kedalam corong
pisah, diekstraksi dengan dietil eter, kemudian didiamkan hingga terbentuk
2 lapisan. Diambil lapisan atas karena mengandung gliserolat, lalu
dirotarievaporasi. Dilakukan percobaan yang sama hingga waktu reaksi 36
jam dengan variasi waktu setiap 4 jam.
Gliserolat hasil penguapan dianalisa secara kualitatif menggunakan spektroskopi FT-IR untuk mengetahui banyak tidaknya monogliserida dan
digliserida berdasarkan nilai absorbansi gugus –OH yang terdapat pada
monogliserida dan digliserida untuk mengetahui waktu reaksi optimum.
Setelah diketahui nilai absorbansi gugus -OH , gliserolat dianalisa
menggunakan Kromatografi Gas (KG) untuk mengetahui kadar campuran
mono- dan digliserida yang dihasilkan.
Adapun variable-variabel dalam penelitian ini adalah:
1. Variabel bebas yang mempunyai pengaruh terhadap kadar mono- dan
digliserida meliputi:
Waktu reaksi
2. Variabel terikat yang terukur terhadap perubahan perlakuan dalam gliserolisis
meliputi:
Nilai absorbansi gugus –OH dari monogliserida dan digliserida
3. Variabel tetap yang tidak dapat menyebabkan perubahan terhadap variable
terikat meliputi:
Perbandingan minyak inti kelapa sawit dengan gliserol 1:3
Suhu inkubasi adalah 40oC
Kecepatan pengadukan yang digunakan adalah 350 rpm
PENENTUAN WAKTU REAKSI OPTIMUM GLISEROLISIS MINYAK INTI SAWIT MENGGUNAKAN ENZIM LIPASE Candida rugosa
DALAM PELARUT TERT-BUTANOL
ABSTRAK
Gliserolisis menggunakan pelarut dibutuhkan agar minyak dan gliserol
bercampur, salah satunya adalah tert-butanol. Dengan diketahuinya perbandingan
minimal pelarut dengan minyak maka perlu diketahui juga waktu reaksi yang
diperlukan untuk menghasilkan produk monogliserida dan digliserida terbanyak.
Gliserolisis dilakukan selama 36 jam dengan variasi waktu setiap 4 jam
dengan menggunakan enzim lipase Candida rugosa. Setelah reaksi selesai, larutan
diekstraksi dengan dietil eter hingga terbentuk dua lapisan, dimana lapisan atas
mengandung mono- dan digliserida. Lapisan tersebut dihilangkan terlebih dahulu
pelarutnya lalu dianalisa dengan spektroskopi FT-IR untuk mengetahui
munculnya gugus -OH. Gliserolat lalu dianalisa dengan kromatografi gas.
Hasil analisa kromatografi gas menunjukkan campuran monoglisrida dan
digliserida paling banyak terbentuk pada waktu reaksi 4 jam dengan persentase
monogliserida adalah 47,11% sedangkan persentase digliserida adalah 28,64%.
Kata kunci: gliserolisis, enzim lipase Candida rugosa, monogliserida dan
digliserida
Determination of Optimum Time Reaction for Palm Kernel Oil Glycerolysis Using Candida rugosa Lipase Enzyme in Tert-Butanol
ABSTRACT
Glycerolysis using a solvent is needed to make oil and glycerol blend, one of them
is tert-butanol. With the minimum comparison for solvent and oil is already
known so we must have to know the reaction time needed to produce the most
monoglycerides and diglycerides.
Glycerolysis is performed for 36 hours with every 4 hours using lipase
enzyme of Candida rugosa. After the reaction completed, the mixture is extracted
using diethyl ether until separated to two layers, where the upper layer contains
mono- and diglycerides. We must first evaporate the solvent then analyze with
FT-IR spectroscopy to see the presence from –OH groups. The glycerolate then
will be analyzed by gas chromatography.
The result of gas chromatography analysis shows the mixture of
monoglycerides and diglycerides were most formed after 4 hours of reaction time
with the percentage of monoglycerides is 47,11% while the percentage of
diglycerides is 28,64%
Keywords: glycerolysis, lipase enzyme of Candida rugosa, monoglyceride and
Bahan Seminar Hasil
Departemen Kimia
PENENTUAN WAKTU REAKSI OPTIMUM GLISEROLISIS
MINYAK INTI SAWIT MENGGUNAKAN ENZIM LIPASE
Candida rugosa DALAM PELARUT TERT-BUTANOL
SKRIPSI
JOHANNES VANNESSA CHRISTIANTO 090802045
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENENTUAN WAKTU REAKSI OPTIMUM GLISEROLISIS
MINYAK INTI SAWIT MENGGUNAKAN ENZIM LIPASE
Candida rugosa DALAM PELARUT TERT-BUTANOL
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
JOHANNES VANNESSA CHRISTIANTO 090802045
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENENTUAN WAKTU REAKSI OPTIMUM GLISEROLISIS MINYAK INTI SAWIT MENGGUNAKAN ENZIM LIPASE Candida rugosa DALAM PELARUT TERT-BUTANOL
Kategori : SKRIPSI
Nama : JOHANNES VANNESSA CHRISTIANTO
Nomor Induk Mahasiswa : 090802045
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
(FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Agustus 2014
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Ir. Donald Siahaan Drs. Firman Sebayang, MS
Ka. Kelti PPKS NIP. 195607261985031001
Diketahui / Disetujui oleh,
Departemen Kimia FMIPA USU
Ketua,
Dr. Rumondang Bulan Nst., MS
PERNYATAAN
PENENTUAN WAKTU REAKSI OPTIMUM GLISEROLISIS MINYAK INTI SAWIT MENGGUNAKAN ENZIM LIPASE Candida rugosa
DALAM PELARUT TERT-BUTANOL
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2014
PENGHARGAAN
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa yang telah
memberikan kasih dan karunia-Nya sehingga penulis dapat menyelesaikan studi
dan skripsi ini. Banyak hal yang penulis telah dapatkan selama kuliah dan
penelitian ini sehingga menambah ilmu bagi penulis khususnya dari orang-orang
yang berada di sekitar kita.
Penulis mengucapkan terima kasih yang sebesarnya kepada orang tua
penulis Drs. Hans Henry Hastowo, M.A. dan Nurintan Siregar yang telah
memberikan dukungan moril setiap waktu dalam penyelesaian skripsi ini. Penulis
juga mengucapkan terima kasih kepada Bapak Drs. Firman Sebayang, MS selaku
Dosen Pembimbing I dan Bapak Dr. Ir. Donald Siahaan selaku Dosen
Pembimbing II yang telah banyak meluangkan waktu untuk memberikan
pengarahan, pemikiran serta membagi wawasan terhadap skripsi ini.
Terima kasih juga ditujukan kepada Ibu Dr. Rumondang Bulan Nst, MS
selaku Ketua Departemen dan Bapak Drs. Albert Pasaribu, M.Sc selaku Sekretaris
Departemen yang turut memberikan pengarahan dan mengesahkan skripsi ini.
Ucapan terima kasih kepada teman-teman stambuk 2009, abang dan kakak senior
serta adik-adik dan juga asisten Laboratorium Biokimia MIPA yang terus
memberikan semangat. Penulis menyadari bahwa skripsi ini jauh dari
kesempurnaan, oleh karena itu penulis mengharapkan kritik dan saran yang
membangun dari Bapak dan Ibu Dosen serta pembaca sekalian.
PENENTUAN WAKTU REAKSI OPTIMUM GLISEROLISIS MINYAK INTI SAWIT MENGGUNAKAN ENZIM LIPASE Candida rugosa
DALAM PELARUT TERT-BUTANOL
ABSTRAK
Gliserolisis menggunakan pelarut dibutuhkan agar minyak dan gliserol
bercampur, salah satunya adalah tert-butanol. Dengan diketahuinya perbandingan
minimal pelarut dengan minyak maka perlu diketahui juga waktu reaksi yang
diperlukan untuk menghasilkan produk monogliserida dan digliserida terbanyak.
Gliserolisis dilakukan selama 36 jam dengan variasi waktu setiap 4 jam
dengan menggunakan enzim lipase Candida rugosa. Setelah reaksi selesai, larutan
diekstraksi dengan dietil eter hingga terbentuk dua lapisan, dimana lapisan atas
mengandung mono- dan digliserida. Lapisan tersebut dihilangkan terlebih dahulu
pelarutnya lalu dianalisa dengan spektroskopi FT-IR untuk mengetahui
munculnya gugus -OH. Gliserolat lalu dianalisa dengan kromatografi gas.
Hasil analisa kromatografi gas menunjukkan campuran monoglisrida dan
digliserida paling banyak terbentuk pada waktu reaksi 4 jam dengan persentase
monogliserida adalah 47,11% sedangkan persentase digliserida adalah 28,64%.
Kata kunci: gliserolisis, enzim lipase Candida rugosa, monogliserida dan
digliserida
Determination of Optimum Time Reaction for Palm Kernel Oil Glycerolysis Using Candida rugosa Lipase Enzyme in Tert-Butanol
ABSTRACT
Glycerolysis using a solvent is needed to make oil and glycerol blend, one of them
is tert-butanol. With the minimum comparison for solvent and oil is already
known so we must have to know the reaction time needed to produce the most
monoglycerides and diglycerides.
Glycerolysis is performed for 36 hours with every 4 hours using lipase
enzyme of Candida rugosa. After the reaction completed, the mixture is extracted
using diethyl ether until separated to two layers, where the upper layer contains
mono- and diglycerides. We must first evaporate the solvent then analyze with
FT-IR spectroscopy to see the presence from –OH groups. The glycerolate then
will be analyzed by gas chromatography.
The result of gas chromatography analysis shows the mixture of
monoglycerides and diglycerides were most formed after 4 hours of reaction time
with the percentage of monoglycerides is 47,11% while the percentage of
diglycerides is 28,64%
Keywords: glycerolysis, lipase enzyme of Candida rugosa, monoglyceride and
DAFTAR ISI
BAB 3. Bahan dan Metode Penelitian 3.1. Alat-alat 20
3.2. Bahan-bahan 21
3.3. Prosedur Penelitian 21
3.3.2. Penentuan Kadar Air PKO 23
3.3.3. Penentuan Kadar Asam Lemak Bebas (%ALB) pada PKO 24
3.3.4. Gliserolisis minyak inti sawit 24
3.3.5. Analisa Gliserolat dengan Kromatografi Gas 25
3.4. Bagan penelitian 26
3.4.1. Penentuan Kadar Air PKO 26
3.4.2. Penentuan Kadar Asam Lemak bebas (%ALB) pada PKO 27
3.4.3. Gliserolisis Minyak Inti Sawit 28
3.4.4 Analisis Gliserolat dengan Kromatografi Gas 29
BAB 4. Hasil dan Pembahasan 4.1. Hasil 30
4.2. Pembahasan 32
Bab 5. Kesimpulan dan Saran 5.1. Kesimpulan 37
5.2. Saran 37
DAFTAR PUSTAKA 38
DAFTAR TABEL
Tabel 2.1. Komposisi minyak kelapa sawit dan minyak inti sawit 7 Tabel 4.1. Hasil analisa FT-IR gugus –OH dari campuran monogliserida dan
digliserida. 30
DAFTAR GAMBAR
Gambar 2.1. Struktur Trigliserida 9
Gambar 2.2. Struktur Gliserol 12
Gambar 4.1. Mekanisme reaksi gliserolisis enzimatis 34
DAFTAR LAMPIRAN
Lampiran 1. Hasil analisa kadar air dan kadar asam lemak bebas minyak inti
sawit 41
Lampiran 2. Gambar Proses Gliserolisis 42
Lampiran 3. Hasil Analisa FT-IR 44