POTENSI EKSTRAK RUMPUT KEBAR (
Biophytum
petersianum
Klotzsch) PADA FUNGSI REPRODUKSI TIKUS
JANTAN YANG TERPAPAR ASAP ROKOK
ADRIEN JEMS AKILES UNITLY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi berjudul Potensi Ekstrak Rumput Kebar (Biophytum petersianum Klotzsch) pada Fungsi Reproduksi Tikus Jantan yang Terpapar Asap Rokok adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Adrien Jems Akiles Unitly NRP B161080031
petersianum Klotzsch) pada Fungsi Reproduksi Tikus Jantan yang Terpapar Asap Rokok. Dibimbing oleh NASTITI KUSUMORINI, SRIHADI AGUNGPRIYONO, ARYANI SISMIN SATYANINGTIJAS, dan ARIEF BOEDIONO.
Salah satu penyebab gangguan reproduksi yang mengakibatkan penurunan fungsi reproduksi adalah asap rokok. Di Papua, rumput kebar yang dalam bahasa
lokalnya disebut “banondit” (artinya banyak anak) biasa digunakan oleh penduduk setempat sebagai obat-obatan untuk mengatasi masalah reproduksi. Penelitian ini bertujuan untuk mengetahui potensi ekstrak rumput kebar pada fungsi reproduksi tikus jantan yang terpapar asap rokok. Penelitian ini terdiri atas tiga tahap penelitian.
Tahap pertama adalah pembuatan hewan model penurunan fungsi reproduksi tikus jantan dengan pemaparan asap rokok. Parameter yang diamati adalah analisis mikroskopis paru-paru, gambaran darah, analisis mikroskopis testis, jumlah sel-sel spermatogenik dan kualitas spermatozoa. Hasil pengamatan menunjukkan terdapat peningkatan partikel hitam pada sitoplasma alveoli paru-paru yang diduga adalah tar pada perlakuan 40 hari dan 60 hari, peningkatan nilai PCV, penurunan bobot testis, jumlah sel-sel spermatogenik dan kualitas spermatozoa yang tidak kembali ke kondisi normal setelah pemberhentian pemaparan. Hal ini menguatkan bahwa hewan yang dipapar asap rokok dapat dijadikan sebagai hewan model penurunan fungsi reproduksi jantan.
Tahap kedua bertujuan mempelajari potensi ekstrak rumput kebar pada gambaran darah tikus jantan yang telah terpapar asap rokok. Parameter yang diamati adalah gambaran darah meliputi jumlah butir darah merah/BDM (eritrosit), kadar hemoglobin (Hb), nilai hematokrit (PCV), indeks eritrosit dan jumlah butir darah putih/BDP (leukosit). Hasil penelitian menunjukkan bahwa pemberian ekstrak rumput kebar 0.0945 mg/gr bobot badan/hari dapat menyebabkan penurunan jumlah BDM pada tikus yang terpapar asap rokok.
Tahap ketiga bertujuan mempelajari potensi ekstrak rumput kebar pada testis, hormon testosteron, jumlah sel-sel spermatogenik dan kualitas spermatozoa pada tikus yang terpapar asap rokok. Parameter yang diamati adalah analisis testis, analisis testosteron, jumlah sel-sel spermatogenik dan kualitas spermatozoa. Hasil penelitian menunjukkan bahwa pemberian ekstrak rumput kebar 0.0945 mg/gr bobot badan/hari dapat meningkatkan bobot testis, jumlah sel-sel spermatogenik dan kualitas spermatozoa pada tikus yang terpapar asap rokok.
Dari penelitian ini dapat disimpulkan bahwa pemberian ekstrak rumput kebar dosis 0.0945 mg/gr bobot badan/hari dapat meningkatkan fungsi reproduksi tikus jantan yang terpapar asap rokok.
(Biophytum petersianum Klotzsch) on Reproductive Function in Male Rat that Exposure with Cigarette Smoke. Supervised by NASTITI KUSUMORINI, SRIHADI AGUNGPRIYONO, ARYANI SISMIN SATYANINGTIJAS, and ARIEF BOEDIONO.
One of the causes reproduction disorder that effect of decreasing reproductive function is cigarette smoke. In Papua, kebar„s grass which in local language called "banondit" (meaning many children) are commonly used by locals as a herbal medicine to overcome reproductive problem. This research aims to create an animal model of decreased reproductive function of male rats with cigarette smoke exposure and to determine the potential of extract kebar‟s grass on reproductive function of male rats exposed to cigarette smoke. The research was conducted in three stages.
The first stage was designed to learn the animal model of decreasing reproductive function in male rat exposure with cigarette smoke. The parameters were analysis of microscopic lung, blood profile, analysis of microscopic testes, spermatogenic cells count and spermatozoa quality. The results showed a black particles of cytoplasm alveoli of lung which is predicted as tar in 40d and 60d, increased PCV, decreased testes weight, spermatogenic cells count and spermatozoa quality which did not return to normal conditions after stopping the exposured appropriate time. This confirmed that the animals were exposed to cigarette smoke can be used as an animal model of male reproductive function decline.
The second stage was designed to learn the potential of extract kebar‟s grass on blood profile in male rat exposed with cigarettes smoke. The parameters was blood profile is erythrocyte, hemoglobin, hematokrit, indeks eritrosit and Leukosit. The results showed that extract kebar‟s grass 0.0945 mg/gr body weight/day can increased eritrosit in male rat exposed with cigarettes smoke.
The third stage was designed to learn the potential of extract kebar‟s grass on testes, testosterone levels, spermatogenic cells count and spermatozoa quality in male rat exposed with cigarettes smoke. The parameters were analysis of testes, analysis of testosterone, spermatogenic cells count and spermatozoa quality. The results showed that extract kebar‟s grass 0.0945 mg/gr body weight/day increased testes weight, amount spermatogenic cells and spermatozoa quality in male rat exposed with cigarettes smoke.
From this research could be conclude that giving of extract kebar‟s grass 0.0945 mg/gr body weight/day could increased reproductive function of male rat that exposured by cigarette smoke.
©
Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
JANTAN YANG TERPAPAR ASAP ROKOK
ADRIEN JEMS AKILES UNITLY
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu-ilmu Faal dan Khasiat Obat
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup: Dr. drh. Koekoeh Santoso
Dr. drh. Ligaya ITA Tumbelaka, SP.MP, M.Sc
Penguji pada Ujian Terbuka: Dr. Dra. Ietje Wientarsih, Apt.,M.Sc
Nama : Adrien Jems Akiles Unitly
NRP : B161080031
Disetujui oleh Komisi Pembimbing
Diketahui oleh
Ketua Program Studi/Mayor
Ilmu-ilmu Faal dan Khasiat Obat (IFO)
Prof Dr drh Agik Suprayogi, MSc, AIF
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian : 29 Agustus 2013 Tanggal Lulus : Dr dra Nastiti Kusumorini, AIF
Ketua
drh Srihadi Agungpriyono, Ph.D.PAVet (K) Anggota
Dr drh Aryani S. Satyaningtijas, MSc, AIF Anggota
selalu memberikan Berkat dan AnugerahNya, sehingga penulis dapat menyelesaikan karya ilmiah dengan judul “Potensi Ekstrak Rumput Kebar (Biophytum Petersianum Klotzsch) pada Fungsi Reproduksi Tikus Jantan yang Terpapar Asap Rokok”, yang dilaksanakan sejak Januari 2011 sampai April 2012. Terima kasih penulis ucapkan kepada Dr. dra. Nastiti Kusumorini, AIF, drh. Srihadi Agungpriyono, Ph.D.PAVet (K), Dr. drh. Aryani Sismin Satyaningtijas, M.Sc, AIF dan Prof. drh. Arief Boediono, Ph.D.PAVet (K) selaku komisi pembimbing yang telah bersedia meluangkan waktu untuk membimbing dan mengarahkan dalam pelaksanaan penelitian dan penulisan disertasi. Terima kasih penulis ucapkan kepada Dr. drh. Koekoeh Santoso dan Dr. drh. Ligaya ITA Tumbelaka, SP.MP, M.Sc selaku penguji luar komisi pada ujian sidang tertutup, drh. Agus Setiyono, MS, Ph.D,APVet sebagai pimpinan sidang pada ujian tertutup, Dr. Dra. Ietje Wientarsih, Apt.,M.Sc dan drh. Yulvian Sani, Ph.D selaku penguji luar komisi pada ujian sidang terbuka dan drh. Srihadi Agungpriyono, Ph.D.PAVet (K) sebagai pimpinan sidang pada ujian terbuka.
Ucapan terima kasih disampaikan kepada BPPS Dikti yang telah memberikan biaya untuk studi, Pemda Provinsi Maluku, Yayasan Dana Beasiswa Maluku (YDBM), Yayasan Satyabhakti Widya, dan Yayasan Supersemar yang telah membantu dalam pemberian dana dalam penelitian dan penulisan disertasi. Penulis juga mengucapkan terima kasih kepada Ketua Program Studi Ilmu-ilmu Faal dan Khasiat Obat (IFO) IPB Prof. Dr. drh. Agik Suprayogi, M.Sc, AIF dan seluruh staf pengajar, pegawai dan laboran (Ibu Ida, Ibu Sri, Pak Edi dan Pak Wawan) pada bagian Anatomi, Fisiologi dan Farmakologi FKH-IPB, staf laboran Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian Bogor, staf laboran BALITRO, teman-teman mahasiswa Ilmu-ilmu Faal dan Khasiat Obat (IFO), Sisters Voice (Cerria Inara, Wunuhalono HED Dahoklory, Hearty Salatnaya dan Stylia Johannes), Gita Swara Pascasarjana (GSP) IPB (Alfred O.M Dima, Marleen Pieter, Sarah Nila, Silvia Puspitasari, Yuang Dinni, Sarah Boru Saragih, Adeleyda M.Lumingkewas, Lady D. Tetelepta, Intan Herwindra, Vida, Flandrianto, Fred, Wahid, Daniel, Putra, dll), Keluarga Besar POUKADS, teman-teman PERMAMA, Persekutuan Mahasiswa Oikumene, IMAPPA, PERMASUT, GAMANUSRATIM, mantan pengurus DEMA PASCASARJANA IPB 2010-2011, alumni muda GMNI Sulawesi Utara, serta sahabat penulis Dra Suprihatin, M.Si dan Dr. Safrida, S.Pd, M.Si yang selalu memberikan motivasi dan dukungannya. Ucapan terima kasih yang tak terhingga kepada Papa dan Mama, Kakak Joice serta kedua adik Jane dan Kristo, juga keluarga besar Unitly-Silahooy, Tutupoly dan Oraplean atas dukungan Doa dan kasih sayangnya.
Semoga karya ilmiah ini dapat bermanfaat bagi yang membutuhkannya.
DAFTAR ISI
DAFTAR TABEL --- ii
DAFTAR GAMBAR --- iii
DAFTAR LAMPIRAN --- iii
1 PENDAHULUAN --- 1
Latar Belakang --- 1
Tujuan Penelitian --- 3
Hipotesis --- 3
Manfaat Penelitian --- 3
Kebaruan (Novelty) --- 3
Kerangka Pemikiran --- 3
2 TINJAUAN PUSTAKA --- 6
Taksonomi, Ekologi dan Komposisi Rumput Kebar --- 6
Pengaturan Hormon Reproduksi Jantan --- 8
Spermatogenesis --- 9
Gangguan Reproduksi Jantan --- 10
Pengaruh Asap Rokok Pada Tubuh --- 11
3 PEMBUATAN HEWAN MODEL PENURUNAN FUNGSI REPRODUKSI TIKUS JANTAN DENGAN PEMAPARAN ASAP ROKOK--- 13
Pendahuluan --- 14
Bahan dan Metode --- 15
Hasil dan Pembahasan --- 17
Simpulan --- 27
4 KAJIAN PEMBERIAN EKSTRAK RUMPUT KEBAR TERHADAP GAMBARAN DARAH TIKUS JANTAN YANG TERPAPAR ASAP ROKOK--- 28
Pendahuluan --- 29
Bahan dan Metode --- 30
Hasil dan Pembahasan --- 32
Simpulan --- 36
5 KAJIAN PEMBERIAN EKSTRAK RUMPUT KEBAR PADA FUNGSI REPRODUKSI TIKUS JANTAN YANG TERPAPAR ASAP ROKOK --- 37
Pendahuluan --- 38
Bahan dan Metode --- 38
Hasil dan Pembahasan --- 41
Simpulan --- 47
6 PEMBAHASAN UMUM --- 48
7 SIMPULAN DAN SARAN --- 51
DAFTAR PUSTAKA --- 52
LAMPIRAN --- 56
DAFTAR TABEL
1 Komposisi kimia rumput kebar (Sadsoeitoeboen 2005) --- 7 2 Komposisi asam amino rumput kebar (Sadsoeitoeboen 2005) --- 7 3 Hasil uji kualitatif fitokimia rumput kebar (Azlina 2009) --- 8 4 Rataan bobot basah paru-paru tikus jantan setelah pemaparan asap
rokok dan setelah pemberhentian perlakuan --- 18 5 Rataan jumlah butir darah merah (eritrosit)/RBC (juta/mm3), Kadar
Hemoglobin (Hb) (gr %) dan Hematokrit/PCV (%) setelah pemaparan asap rokok dan setelah pemberhentian perlakuan --- 20 6 Rataan indeks eritrosit setelah pemaparan asap rokok dan setelah
pemberhentian perlakuan --- 21 7 Rataan jumlah butir darah putih (Juta/mm3) setelah pemaparan asap
rokok dan setelah pemberhentian perlakuan --- 22 8 Rataan bobot testis setelah pemaparan asap rokok dan setelah
pemberhentian perlakuan --- 23 9 Rataan jumlah sel-sel spermatogenik (spermatogonium, spermatosit
primer dan spermatid akhir) setelah pemaparan asap rokok dan setelah pemberhentian perlakuan --- 25 10 Rataan kualitas spermatozoa (konsentrasi spermatozoa, viabilitas
spermatozoa dan abnormalitas spermatozoa) setelah pemaparan asap rokok dan setelah pemberhentian perlakuan --- 26 11 Rataan jumlah BDM (juta/mm3), Kadar Hb (gr %) dan Nilai PCV (%)
setelah pemaparan asap rokok, pemberian ekstrak rumput kebar dan setelah pemberhentian pemberian ekstrak rumput kebar --- 32 12 Rataan indeks eritrosit setelah pemaparan asap rokok, pemberian
ekstrak rumput kebar dan setelah pemberhentian pemberian ekstrak rumput kebar --- 35 13 Rataan jumlah BDP (Juta/mm3) setelah pemaparan asap rokok,
pemberian ekstrak rumput kebar dan setelah pemberhentian pemberian ekstrak rumput kebar --- 36 14 Rataan bobot testis, konsentrasi DNA dan RNA testis tikus setelah
pemaparan asap rokok, pemberian ekstrak rumput kebar dan setelah pemberhentian pemberian ekstrak rumput kebar --- 41 15 Rataan kadar hormon testosteron setelah pemaparan asap rokok,
pemberian ekstrak rumput kebar dan setelah pemberhentian pemberian ekstrak rumput kebar --- 43 16 Rataan jumlah sel-sel spermatogenik (spermatogonium, spermatosit
primer dan spermatid akhir) setelah pemaparan asap rokok, pemberian ekstrak rumput kebar dan setelah pemberhentian pemberian ekstrak rumput kebar --- 44 17 Rataan kualitas spermatozoa (konsentrasi spermatozoa, viabilitas
spermatozoa dan abnormalitas spermatozoa) setelah pemaparan asap rokok, pemberian ekstrak rumput kebar dan setelah pemberhentian pemberian ekstrak rumput kebar --- 46 15. Perbandingan luas permukaan tubuh hewan percobaan untuk konversi
DAFTAR GAMBAR
1 Bagan kerangka pemikiran --- 4
2 Tahapan penelitian --- 5
3 Rumput kebar --- 6
4 Rumput kebar dari Papua --- 6
5 Pengaturan hormon reproduksi jantan --- 8
6 Proses spermatogenesis --- 10
7 Bagan alur penelitian --- 17
8 Fotomikrograf paru-paru setelah pemaparan asap rokok menunjukkan peningkatan partikel berwarna coklat tua atau hitam --- 19
9 Fotomikrograf paru-paru menunjukkan peningkatan sel-sel radang pada alveoli paru-paru --- 19
10 Fotomikrograf menunjukkan struktur tubulus seminiferus setelah pemaparan asap rokok --- 24
11 Bagan alur penelitian --- 31
12 Bagan alur penelitian --- 40
13 Smoking chamber --- 56
14 Testis tikus --- 58
DAFTAR LAMPIRAN 1 Tata cara pemaparan asap rokok --- 54
2 Analisis mikroskopis paru-paru --- 54
3 Pengukuran gambaran darah --- 55
4 Analisis mikroskopis testis dan jumlah sel-sel spermatogenik --- 56
5 Kualitas spermatozoa --- 57
6 Perbandingan luas permukaan tubuh hewan percobaan untuk konversi dosis (Laurence dan Bacharah 1964) --- 58
7 Pembuatan ekstrak rumput kebar--- 58
8 Kandungan rumput kebar --- 60
9 Analisis DNA dan RNA testis tikus --- 60
PENDAHULUAN
Latar Belakang
Fungsi reproduksi jantan dipengaruhi oleh testis yang berfungsi menghasilkan spermatozoa dan hormon androgen, yaitu testosteron. Lapisan luar testis adalah tunika albugenia (membran putih tipis) yang merupakan jaringan yang elastis. Pembuluh kapiler darah banyak terdapat di bawah tunika albugenia. Lapisan di bawah tunika albugenia adalah lapisan parenkim yang merupakan lapisan fungsional testis. Di dalam segmen-segmen jaringan parenkim terdapat tubulus seminiferus yang merupakan tempat produksi spermatozoa. Tubulus seminiferus merupakan pembuluh seks primer, mengandung sel-sel germinal (spermatogonia) dan sel Sertoli. Sel-sel tersebut terhubung dengan membran basalis yang membentuk blood testis barrier. Stimulasi oleh follicle stimulating hormone (FSH) menyebabkan sel-sel Sertoli memproduksi androgen binding protein (ABP) dan inhibidin. Di bawah pengaruh FSH, sel Sertoli memicu sel-sel germinal melakukan proses awal spermatogenesis dan menyediakan kebutuhan nutrisi dan perkembangan spermatogonia. Sel-sel Leydig terdapat di dalam jaringan parenkim di antara saluran-saluran tubulus seminiferus. Stimulasi oleh lutenising hormone (LH) menyebabkan sel-sel Leydig memproduksi testosteron yang salah satu fungsinya untuk mengatur proses spermatogenesis. Testosteron diperlukan dalam produksi spermatozoa dan mengembangkan seks sekunder (Bearden et al. 2004). Penurunan fungsi reproduksi dapat terjadi secara genetik dan non genetik seperti terpapar bahan kimia dan penggunaan obat-obatan. Asap rokok mengandung senyawa-senyawa kimia yang bersifat toksik dan akan terbawa oleh darah ke seluruh organ tubuh termasuk organ reproduksi sehingga dapat menurunkan fungsi reproduksi. Beberapa penelitian mengenai efek bahan kimia rokok terhadap sistem reproduksi oleh Rajpurkar et al. (2000) menunjukkan dampak terburuk dari asap rokok adalah rusaknya jaringan pada testis tikus yang akan mengakibatkan gangguan spermatogenesis sehingga terjadi abnormal spermatozoa. Hal ini sejalan dengan Ahmadnia et al. (2007) yang menunjukkan bahwa asap rokok dapat memberikan efek toksik sehingga menurunkan proses spermatogenesis pada tikus. Senyawa toksik asap rokok yang masuk secara inhalasi ke dalam tubuh dapat menyebabkan gangguan pada paru-paru dan akhirnya terjadi iritasi pada hati sehingga hati tidak sanggup melakukan detoksifikasi secara sempurna. Hal ini dapat menyebabkan munculnya metabolit sekunder yang dapat bertindak sebagai radikal bebas yang ikut dalam peredaran darah menuju ke seluruh bagian tubuh termasuk testis.
disertai dengan produksi panas yang kadang disertai cahaya dalam bentuk pendar atau api. Reaksi pembakaran dengan oksigen akan membentuk senyawa CO2,
H2O2, NO, SO, dan CO. Reaksi pirolisa adalah dekomposisi kimia bahan organik
melalui proses pemanasan tanpa atau sedikit oksigen atau reagen lainnya. Material mentah akan mengalami pemecahan struktur kimia menjadi fase gas. Reaksi pirolisa menyebabkan pemecahan struktur kimia rokok menjadi berbagai senyawa kimia (Bindar 2000). Senyawa kimia tersebut bersifat toksik seperti bahan karsinogen, tar, nikotin, nitrosamin, karbon monoksida, senyawa PAH (Polynuclear Aromatic Hydrogen), fenol, karbonil, klorin dioksin, dan furan (Fowles dan Bates 2000). Saat merokok, ada dua aliran asap yang dihasilkan, yakni asap arus utama dan asap arus samping. Asap arus utama dihasilkan dari pembakaran sempurna, hanya 15 % yang dihisap oleh perokok aktif, sedangkan arus samping dihasilkan dari pembakaran tidak sempurna sebanyak 85 % mengandung zat karsinogen yang dapat mencemari lingkungan. Susanna et al. (2003) menyatakan bahwa asap rokok arus samping mengandung nikotin lebih banyak dari pada dalam arus utama. Dengan kata lain bahwa kadar nikotin yang dilepaskan ke lingkungan lebih banyak dari pada nikotin yang dihisap oleh perokok. Perbandingan jumlah nikotin dalam asap arus samping lebih banyak 4 – 6 kali dari pada yang terdapat dalam asap arus utama.
Indonesia merupakan negara kepulauan tropis terbesar di dunia dan memiliki keragaman tumbuhan yang sangat tinggi setelah Brazil. Salah satunya adalah tanaman obat yang jumlahnya mencapai 7500 spesies [Humas Kementan RI 2012]. Hasil Kajian yang telah dilakukan sampai tahun 2000 ditemukan sebanyak 1.845 jenis tumbuhan obat yang tersebar di berbagai bentuk ekologi hutan dan ekosistem alam lainnya. Keanekaragaman hayati tumbuhan obat Indonesia belum banyak dimanfaatkan karena belum diketahui jenis dan manfaatnya, namun sebagian telah dimanfaatkan secara turun temurun sebagai obat tradisional.
Salah satu tumbuhan obat yang memiliki potensi medis untuk reproduksi adalah rumput kebar (Biophytum petersianum Klotzsch) yang belum banyak diketahui di Indonesia, ditemukan di Kecamatan Kebar, Kabupaten Manokwari, Provinsi Papua Barat. Rumput kebar yang termasuk famili Oxalidaceae (belimbing) telah dikenal sejak dulu oleh masyarakat Papua terutama di daerah pegunungan Arfak khususnya Kecamatan Kebar dan merupakan tumbuhan endemik alami daerah ini. Di Papua, rumput kebar yang dalam bahasa lokalnya
disebut “banondit” (artinya banyak anak) biasa digunakan oleh penduduk
amino yang terkandung dalam rumput kebar, diharapkan dapat memperbaiki fungsi reproduksi tikus jantan, sehingga perlu diteliti potensi rumput kebar (Biophytum petersianum Klotzsch) terhadap fungsi reproduksi tikus jantan yang telah terpapar asap rokok.
Tujuan Penelitian
Tujuan umum penelitian ini adalah mengkaji kandungan rumput kebar yang diduga memiliki potensi untuk memperbaiki fungsi reproduksi yang telah menurun. Tujuan khusus penelitian ini adalah untuk :
1. Membuat hewan model penurunan fungsi reproduksi tikus jantan yang diberi pemaparan asap rokok.
2. Mengkaji pemberian ekstrak rumput kebar terhadap perubahan gambaran darah tikus jantan yang terpapar asap rokok.
3. Mengkaji pemberian ekstrak rumput kebar terhadap kualitas testis, kadar testosteron, jumlah sel-sel spermatogenik dan kualitas spermatozoa tikus jantan yang terpapar asap rokok.
Hipotesis
Pemberian ekstrak rumput kebar (Biophytum petersianum Klotzsch) dapat memperbaiki fungsi reproduksi tikus jantan yang terpapar asap rokok.
Manfaat Penelitian
Hasil penelitian ini diharapkan menjadi kontribusi pengetahuan dalam penggunaan ekstrak rumput kebar untuk perbaikan kualitas testis, kadar hormon testosteron, jumlah sel-sel spermatogenik dan kualitas spermatozoa pada fungsi reproduksi yang menurun sehingga dapat diterapkan dalam pengembangan pengobatan pada pasangan yang mengalami gangguan infertilitas khususnya pada pria. Data ini dapat digunakan untuk penerapan dan pengembangan dalam Ilmu Kedokteran, Ilmu Pengetahuan dan Teknologi (IPTEK) dan dalam bidang farmasi.
Kebaruan (Novelty)
Sejauh ini, penggunaan rumput kebar yang diberikan dengan cara direbus dapat memperbaiki bobot testis dan kualitas spermatozoa. Belum pernah dilaporkan tentang pemberian ekstrak rumput kebar dengan parameter yang dilihat adalah analisis mikroskopis testis, hormon testosteron, jumlah sel-sel spermatogenik dan kualitas spermatozoa terhadap tikus jantan yang telah terpapar asap rokok.
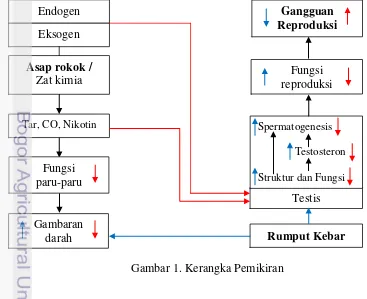
Kerangka Pemikiran
bahan kimia yang berbahaya antara lain nikotin, karbon monoksida, tar, dan khusus rokok kretek mengandung eugenol. Saat terpapar asap rokok, tar yang merupakan zat karsinogen dapat menempel pada alveoli paru-paru sehingga menyebabkan penurunan fungsi paru-paru. Asap rokok dapat menyebabkan penurunan jumlah oksigen yang masuk ke darah melalui paru-paru. Selain itu, CO yang dihasilkan dalam proses merokok akan masuk ke dalam darah dan dapat diikat dengan mudah oleh hemoglobin karena hemoglobin mempunyai afinitas yang lebih tinggi terhadap pengikatan CO dibandingkan oksigen. Ikatan hemoglobin dan CO akan membentuk karbon monoksihemoglobin dan jika dalam jumlah banyak dapat menyebabkan kekentalan darah sehingga gambaran darah dapat menurun. Paparan asap rokok terus menerus juga dapat menyebabkan darah membawa senyawa-senyawa tar mengalir melalui pembuluh darah ke seluruh bagian tubuh termasuk organ reproduksi. Hal ini dapat menyebabkan penurunan kualitas testis sehingga menurunkan produksi hormon testosteron dan menyebabkan gangguan proses spermatogenesis, akibatnya jumlah sel-sel spermatogenik dan kualitas spermatozoa juga menurun. Untuk mengatasi masalah penurunan fungsi reproduksi saat ini, maka banyak dilakukan penelitian-penelitian menggunakan obat-obatan baik kimiawi maupun tradisional.
Rumput kebar (Biophytum petersianum Klotzsch) merupakan obat tradisional yang dipercaya mampu meningkatkan fungsi reproduksi jantan yang menurun akibat terpapar asap rokok. Hal ini dikarenakan rumput kebar mengandung protein, karbohidrat, tanin, flavonoid, antioksidan, fosfor, zat besi, kalsium, vitamin E dan vitamin A yang semua ini berperan dalam fungsi reproduksi jantan. Hal ini menjadi dasar pemikiran penggunaan ekstrak rumput kebar sebagai bahan alami yang dapat memperbaiki fungsi reproduksi yaitu kualitas tesis, hormon testosteron, jumlah sel-sel spermatogenik dan kualitas spermatozoa (Gambar 1)
Gambar 1. Kerangka Pemikiran
Testis
Spermatogenesis
Testosteron
Struktur dan Fungsi
Rumput Kebar Asap rokok /
Zat kimia Endogen
Eksogen
Tar, CO, Nikotin
Fungsi paru-paru
Gambaran darah
Fungsi reproduksi
Berdasarkan kerangka penelitian di atas, dalam rangka pelaksanaannya, penelitian ini dibagi dalam tiga tahap seperti tercantum pada Gambar 2. Masing-masing penelitian dilakukan menggunakan metode yang sesuai dimana hasilnya dibahas pada bagian-bagian dalam disertasi ini.
Gambar 2. Tahapan penelitian
1. Pembuatan hewan model penurunan fungsi reproduksi tikus jantan dengan pemaparan asap rokok.
2. Kajian pemberian ekstrak rumput kebar terhadap gambaran darah tikus jantan yang terpapar asap rokok.
TINJAUAN PUSTAKA
Taksonomi, Ekologi dan Komposisi Rumput Kebar
Tumbuhan rumput kebar yang disebut “banondit” dalam istilah lokal bahasa setempat merupakan tumbuhan perdu yang termasuk dalam kelas Dycotiledoneae, family Oxalidaceae, genus Biophytum, species Biophytum petersianum Klotzsch (Veldkamp 1976) dengan ciri-ciri yaitu gagang bunga (penduncle) berukuran sangat pendek, daun majemuk membulat (obovate) (Gambar 3 dan 4).
Gambar 4. Rumput Kebar dari Papua Barat Sumber: Dokumentasi Syukur Karamang
Rumput kebar tumbuh pada ketinggian 500 – 600 m diatas permukaan laut di padang rumput distrik Kebar yang memiliki luasan hamparan sebesar 743,75 ha
Gambar 3. Rumput Kebar
yang terdiri dari beberapa kampung yaitu Kebaar Timur, Tengah dan Barat. Rumput kebar biasanya tumbuh berasosiasi dan ternaungi oleh Paspalum konyugatum dan Imperata cylindrical (tumbuhan alang-alang) sehingga terlihat adanya perbedaan ukuran tinggi dan rendah akibat terhalangnya cahaya matahari. Imbiri et al. (2003) menyatakan bahwa tanah habitat alami tumbuhan rumput kebar memiliki tekstur tanah pasir dengan permeabilitas sedang sampai tinggi.
Adapun komposisi kimia rumput kebar menurut Sadsoeitoeboen (2005), mengandung senyawa-senyawa antioksidan diantaranya vitamin A dan vitamin E (Tabel 1).
Tabel 1. Komposisi kimia rumput kebar (Sadsoeitoeboen 2005) No Bahan Penyusun Jumlah (%)
1. Bahan kering 89.06
2. Abu 12.76
3. Protein kasar 7.35
4. Serat kasar 35.85
5. Lemak kasar 0.72
6. Beta-N 32.38
7. Calsium (Ca) 1.52
8. Fosfor (P) 0.60
9. NaCl 0.09
10. Vitamin A (IU) 199.30 11. Vitamin E (IU) 13.27
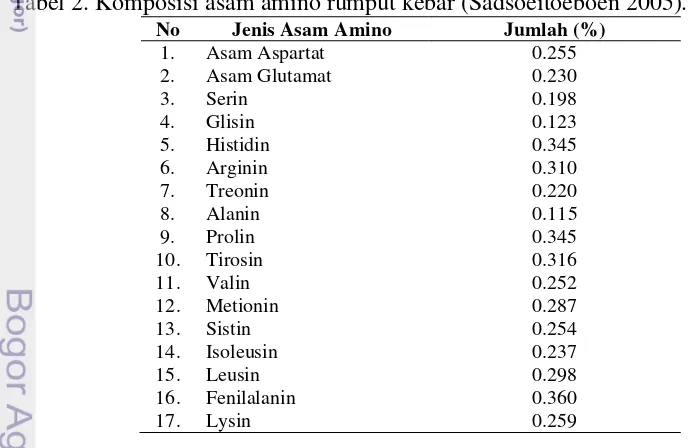
Selain itu pada protein rumput kebar juga mengandung asam-asam amino (Tabel 2) yang sangat dibutuhkan untuk aktivitas reproduksi dan produksi.
Tabel 2. Komposisi asam amino rumput kebar (Sadsoeitoeboen 2005).
No Jenis Asam Amino Jumlah (%)
1. Asam Aspartat 0.255
2. Asam Glutamat 0.230
3. Serin 0.198
4. Glisin 0.123
5. Histidin 0.345
6. Arginin 0.310
7. Treonin 0.220
8. Alanin 0.115
9. Prolin 0.345
10. Tirosin 0.316
11. Valin 0.252
12. Metionin 0.287
13. Sistin 0.254
14. Isoleusin 0.237
15. Leusin 0.298
16. Fenilalanin 0.360
17. Lysin 0.259
Tabel 3. Hasil uji kualitatif fitokimia rumput kebar (Azlina 2009).
No Kandungan Bahan Kualitas Keberadaan Bahan
1. Alkaloid ++++
2. Saponin ++ sampai dengan +++
3. Tanin ++++
4. Fenolik ++
5. Flavonoid ++++
6. Triterfenoid ++++
7. Steroid -
8. Glikosida +++
Keterangan : - : Negatif + : Positif lemah ++ : Positif +++ : Positif kuat ++++ : Positif kuat sekali
Pengaturan Hormon Reproduksi Jantan
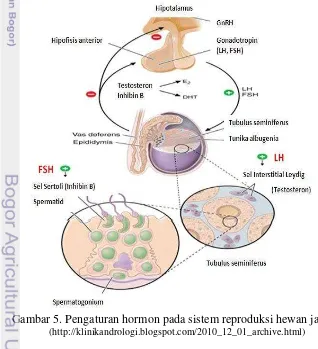
Reproduksi meliputi proses perkembangan sistem reproduksi yang dimulai dari perkembangan sel sampai dengan terbentuknya individu baru. Sistem reproduksi melibatkan suatu substansi yang penting yaitu hormon. Selain pengaturan oleh syaraf, keberadaan hormon sangat diperlukan dalam segala aspek pengaturan tubuh. Oleh karena itu pengaturan sistem reproduksi merupakan kerjasama antara sistem syaraf dan hormon (Gambar 5).
Pada hewan jantan, gonadotrophin releasing hormone (GnRH) disekresikan dari hipothalamus untuk menstimulasi pelepasan lutenising hormone (LH) dan follicle stimulating hormone (FSH) dari hipofisis anterior. LH merangsang sel-sel Leydig untuk memproduksi testosteron. FSH akan menstimulasi sel-sel Sertoli untuk proses pembentukan sel-sel germinal pada spermatogenesis. FSH dan testosteron merangsang sel-sel spermatogenik untuk melakukan meiosis dan berdiferensiasi menjadi spermatozoa (Ganong 2003).
FSH merangsang sel Sertoli untuk mensekresikan ABP (androgen binding protein) dan inhibin. ABP berfungsi mengangkut testosteron ke dalam lumen tubulus seminiferus. Testosteron tidak dapat memasuki lumen tubulus tanpa ABP. Selain menghasilkan inhibin dan ABP, sel Sertoli juga berfungsi sebagai penyedia makanan bagi sel-sel spermatogenik yang sedang tumbuh, memakan (fagositosis) sel-sel germinal yang abnormal dan sebagai pelindung sel-sel germinal yang sedang berkembang. Inhibidin dan testosteron berfungsi sebagai Feed back negatif terhadap GnRH. Testosteron dalam kadar tertentu dapat menghambat pengeluaran FSH dan LH oleh pituitari anterior (Ganong 2003).
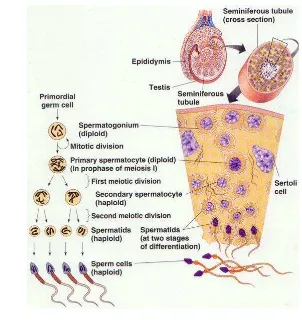
Spermatogenesis
Spermatogenesis adalah proses pertumbuhan dan perubahan dari spermatogonia sampai spermatozoa yang terjadi pada tubulus seminiferus di dalam testis. Spermatogenesis mencakup pematangan sel epitel germinal melalui proses pembelahan dan diferensiasi sel, yang bertujuan untuk membentuk spermatozoa fungsional. Pematangan sel terjadi di tubulus seminiferus yang kemudian disimpan dalam epididimis. Dinding tubulus seminiferus tersusun dari jaringan ikat dan jaringan epitelium germinal (jaringan epitelium benih) yang berfungsi pada saat spermatogenesis. Pintalan-pintalan tubulus seminiferus terdapat di dalam ruang-ruang testis (lobulus testis). Tubulus seminiferus terdiri dari sejumlah besar sel epitel germinal (sel epitel benih) yang disebut spermatogonia (spermatogonium = tunggal). Spermatogonia terletak di dua sampai tiga lapisan luar sel-sel epitel tubulus seminiferus. Spermatogonia terus-menerus membelah untuk memperbanyak diri, sebagian dari spermatogonia berdiferensiasi melalui tahap-tahap perkembangan tertentu untuk membentuk spermatozoa. Pada tubulus seminiferus terdapat sel-sel spermatogonium dan sel Sertoli. Sel Sertoli berfungsi sebagai sumber nutrisi spermatozoa sedangkan sel Leydig yang terdapat di dalam jaringan parenkim di antara tubulus seminiferus berfungsi menghasilkan testosteron. Proses pembentukan spermatozoa dipengaruhi oleh kerja beberapa hormon yang dihasilkan kelenjar hipofisis yaitu: LH merangsang sel Leydig untuk menghasilkan hormon testosteron. Pada masa
pubertas, androgen/testosteron memacu tumbuhnya sifat seks sekunder.
FSH merangsang sel Sertoli untuk menghasilkan ABP (Androgen Binding Protein) yang akan memacu spermatogonium untuk memulai proses spermatogenesis. Proses pematangan (maturasi) spermatosit menjadi spermatozoa disebut spermiogenesis. Spermiogenesis terjadi di dalam epididimis dan pada manusia membutuhkan waktu selama 2 hari (Hafez dan Hafez 2000).
spermatogonia mengalami mitosis menjadi spermatosit primer yang mengandung kromososm diploid (2n) selanjutnya spermatosit primer mengalami meiosis dan menghasilkan spermatosit sekunder yang memiliki kromosom haploid (n). Spermatosit sekunder kemudian mengalami miosis menjadi spermatid yang haploid. Tahapan Spermiogenesis merupakan pembentukan spermatid menjadi spermatozoamatang. Ketika spermatid dibentuk pertama kali, spermatid memiliki bentuk seperti sel-sel epitel. Selanjutnya spermatid mulai memanjang dan akan terlihat bentuk yang terdiri dari kepala dan ekor (Gambar 6).
Gambar 6. Proses spermatogenesis
(http://intanriani.wordpress.com/pembentukan-gamet-jantan-spermatogenesis/)
Apabila proses spermatogenesis telah selesai, maka ABP testosteron (Androgen Binding Protein Testosteron) tidak diperlukan lagi, sel Sertoli akan menghasilkan hormon inhibin untuk memberi umpan balik kepada hipofisis agar menghentikan sekresi FSH dan LH. Spermatozoa akan keluar melalui uretra bersama-sama dengan cairan yang dihasilkan oleh kelenjar vesikula seminalis, kelenjar prostat dan kelenjar cowper yang dikenal sebagai semen. Pada waktu ejakulasi, seorang laki-laki dapat mengeluarkan 300 – 400 juta sel spermatozoa.
Gangguan Reproduksi Jantan
eksogen. Gangguan fungsi reproduksi secara eksogen merupakan gangguan yang terjadi akibat masuknya senyawa-senyawa kimia yang berasal dari obat-obatan, asap kendaraan dan asap rokok. Asap rokok mengandung senyawa-senyawa kimia yang masuk secara inhalasi menyebabkan terjadinya metabolit sekunder yang bertindak sebagai radikal bebas sehingga dapat menurunkan fungsi testis (Ahmadnia et al. 2007). Senyawa kimia asap rokok yang bersifat toksik dapat merusak jaringan testis, menyebabkan gangguan spermatogenesis sehingga terjadi abnormal spermatozoa (Rajpurkar et al. 2000). Gangguan-gangguan spermatozoa yang terjadi yaitu Oligoteratozoospermia merupakan bentuk spermatozoa tidak normal (abnormal) dengan jumlah sel spermatozoa yang dihasilkan hanya sedikit, dysspermia adalah kemampuan gerak (motilitas) spermatozoa yang rendah dan Azoospermia obstruktif merupakan keadaan tidak adanya spermatozoa pada cairan ejakulat karena ada penyumbatan (Tjong dan Rodjani 2012).
Pengaruh Asap Rokok pada Tubuh
Organisasi Kesehatan Dunia (World Health Organization/WHO) tahun 2012 menyatakan bahwa jumlah perokok Indonesia terbanyak ketiga di seluruh dunia setelah Cina dan India, di atas Rusia dan Amerika yaitu sebesar 65 juta perokok atau 28 % per penduduk. Asap rokok mengeluarkan racun karsinogenik yang dapat menyebabkan beraneka macam gangguan kesehatan. Gangguan kesehatan yang dapat ditimbulkan oleh asap rokok berupa penyakit kardiovaskuler, arteriosklerosis, tukak lambung dan usus, kanker, chronic obstructive pulmonary disease (COPD) dan lain-lain (Susanna et al 2003).
Asap rokok mengandung tar. Tar merupakan suatu zat karsinogen yang dapat menempel pada dinding alveolus paru-paru dan dapat mengganggu masuknya oksigen ke seluruh tubuh. Tar juga berpengaruh pada metabolisme di saluran pernafasan dan paru-paru yang pada akhirnya dapat menimbulkan kanker (Droge 2002). Rokok yang mengandung tar, CO, dan nikotin merupakan kumpulan dari ribuan macam bahan kimia, di antaranya nitrogen oksida, sianida, hidrogen, amonia, asetilen, benzaldehida, benzena, metanol, dan lain-lain yang bisa mengganggu kesehatan tubuh. Karbon monoksida menimbulkan desaturasi hemoglobin, menurunkan persediaan oksigen untuk jaringan seluruh tubuh. CO diikat oleh hemoglobin sehingga mengganggu pelepasan oksigen, dan menyebabkan aterosklerosis (pengapuran/penebalan dinding pembuluh darah). Fenomena ini menyebabkan peningkatan viskositas darah, sehingga mempermudah penggumpalan darah. Nikotin, CO, dan bahan-bahan lain dalam asap rokok terbukti merusak endotel (dinding dalam pembuluh darah), dan mempermudah timbulnya penggumpalan darah. Asap rokok dapat menimbulkan aterosklerosis atau terjadi pengerasan pada pembuluh darah (Droge 2002). Masuknya senyawa-senyawa kimia asap rokok yang mengandung toksik ini dapat menyebabkan gangguan darah. Darah sebagai agen tranportasi akan membawa senyawa toksik tersebut sampai ke seluruh sel dan jaringan termasuk jaringan reproduksi sehingga dapat menyebabkan gangguan kesehatan reproduksi.
PEMBUATAN HEWAN MODEL PENURUNAN FUNGSI
REPRODUKSI TIKUS JANTAN DENGAN
PEMAPARAN ASAP ROKOK
Adrien Jems Akiles Unitly1, Nastiti Kusumorini2, Srihadi Agungpriyono2, Aryani Sismin Satyaningtijas2, Arief Boediono2
1
Mahasiswa Program Doktor, Mayor Ilmu-ilmu Faal dan Khasiat Obat (IFO), Sekolah Pascasarjana Institut Pertanian Bogor, 2Mayor Ilmu-ilmu Faal dan
Khasiat Obat (IFO), Sekolah Pascasarjana Institut Pertanian Bogor.
ABSTRAK
Penelitian ini bertujuan untuk membuat hewan model penurunan fungsi reproduksi tikus jantan dengan pemaparan asap rokok. Penelitian ini menggunakan RAL faktorial dengan faktor lama perlakuan dan waktu pengambilan. Pemaparan asap rokok dilakukan dengan menggunakan 10 batang rokok/ekor/hari selama 2,5 jam dalam smoking chamber. Dua puluh empat (24) ekor tikus jantan dibagi menjadi 4 kelompok perlakuan. Kelompok N adalah kelompok yang tidak diberi perlakuan, kelompok 20h adalah kelompok yang dipapar asap rokok selama 20 hari dan diberhentikan pemaparan selama 20 hari, kelompok 40h adalah kelompok yang dipapar asap rokok selama 40 hari dan diberhentikan pemaparan selama 40 hari dan kelompok 60h adalah kelompok yang dipapar asap rokok selama 60 hari dan diberhentikan pemaparan selama 60 hari. Pengambilan data dilakukan sebanyak 2 kali, pertama setelah pemaparan dan kedua setelah pemberhentian pemaparan asap rokok. Parameter yang diamati adalah analisis mikroskopis paru-paru, gambaran darah, analisis mikroskopis testis, jumlah sel-sel spermatogenik dan kualitas spermatozoa. Hasil penelitian menunjukkan peningkatan partikel hitam pada sitoplasma alveoli paru-paru yang diduga adalah tar pada perlakuan 40h dan 60h, peningkatan sel-sel radang pada perlakuan 60h, peningkatan nilai PCV, penurunan kualitas testis, penurunan jumlah sel-sel spermatogenik dan kualitas spermatozoa pada tikus jantan setelah pemaparan yang perubahan tersebut tidak kembali ke kondisi normal setelah pemberhentian pemaparan.
Kata kunci : Asap rokok, spermatogenik, spermatozoa, testis.
ANIMAL MODEL IN DECREASING REPRODUCTIVE
FUNCTION OF MALE RAT EXPOSED WITH
CIGARETTE SMOKE
ABSTRACT
in an smoking chamber. Group N is untreated animals. Group 20d is exposed animals with cigarette smoke for 20 days consectitively and released from the cigarette smoke exposure for 20 days. Group 40d is exposed animals for 40 days and released from the cigarette smoke for 40 days. Group 60d is exposed animals for 60 days similar as above. Data collection was carried out twice : after exposure and after redeasing the cigarette smoke exposure. The parameters of observation included microscopic changes of lungs and testicle, blood profiles, spermatogenic cells count and quality of spermatozoa. The results show an increased number of blackish particulate deposits in the cytoplasm of alveoli at 40d and 60d considered as tar deposit, an increased activity of inflammatory cells, an increased value of PCV, decreasing testical weight, spermatogenic cells count and spermatozoa quality of male rats after exposing which were unable to recover after releasing of cigarette smoke exposure.
Keywords: cigarette smoke, spermatogenic, spermatozoa, testes.
PENDAHULUAN
Asap rokok merupakan aerosol heterogen dari pembakaran tembakau. Setiap batang rokok mengandung berbagai bahan kimia diantaranya adalah akreolin, karbonmonoksida, nikotin, amoniak, asam formiat, hidrogen sianida, nitrogen oksida, sianogen, phenol, aseton, methanol dan tar (Riveles et al. 2005). Kandungan kimia tembakau yang sudah teridentifikasi jumlahnya mencapai 2.500 komponen, sedangkan dalam asap rokok telah teridentifikasi sebanyak 4.800 macam komponen kimia yang dapat membahayakan kesehatan diantaranya tar, nikotin, gas CO, dan NO. Asap rokok mengandung radikal bebas dalam jumlah yang sangat tinggi, diperkirakan dalam satu kali hisapan rokok terdapat 1.014 molekul radikal bebas (Baker 2006). Radikal bebas yang terdapat dalam asap rokok yang paling berbahaya adalah CO yang dapat menyebabkan rusaknya membran sel testis karena fosfolipid dan glikolipid sebagai komponen membran sel testis mengandung asam lemak tidak jenuh yang rentan terhadap pengaruh radikal bebas terutama membran spermatozoa (Handayaningsih 2009). Asap rokok dapat menyebabkan perubahan struktural dalam saluran pernapasan dan penurunan respon imun (Arcavi dan Benewitz 2004). Penelitian mengenai dampak buruk dari asap rokok terhadap sistem reproduksi dilaporkan oleh Rajpurkar et al. (2000) bahwa pemaparan asap rokok selama 15, 30 dan 45 hari menyebabkan kerusakan jaringan testis pada tikus yang mengakibatkan spermatozoa menjadi abnormal. Selain itu, pemaparan asap rokok sebanyak 600 batang/15 ekor/10 minggu dapat menurunkan jumlah sel-sel spermatogenik pada tikus (Ahmadnia et al. 2007). Sejalan dengan hal tersebut di atas pemaparan asap rokok selama 30 hari menyebabkan kerusakan pada tubulus seminiferus (Dewi 2011). Radikal bebas yang terkandung dalam asap rokok dapat menyebabkan kerusakan jaringan testis sehingga menyebabkan gangguan spermatogenesis (Koskinen et al. 2000).
meliputi anatomi, fungsi faal dan genetik. Faktor eksogen dapat berupa bahan kimia dan obat-obatan. Asap rokok merupakan faktor eksogen gangguan spermatogenesis. Pemaparan yang terus menerus dapat menyebabkan masuknya senyawa-senyawa toksik dalam asap rokok ke dalam darah dan akan beredar ke seluruh bagian tubuh termasuk organ reproduksi. Hal ini mengakibatkan terjadi penurunan kualitas testis termasuk penurunan produksi hormon testosteron sehingga menyebabkan gangguan proses spermatogenesis. Pada akhirnya gangguan proses spermatogenesis ini menyebabkan jumlah sel-sel spermatogenik dan kualitas spermatozoa menurun. Semuanya ini dapat disebut sebagai penurunan fungsi reproduksi.
Tujuan
Penelitian ini dilakukan dengan tujuan untuk menetapkan hewan model penurunan fungsi reproduksi tikus jantan menggunakan pemaparan asap rokok dengan parameter analisis mikroskopis paru-paru, gambaran darah, analisis mikroskopis testis, jumlah sel-sel spermatogenik dan kualitas spermatozoa. Data yang diperoleh dari penelitian ini diharapkan dapat memberikan informasi dalam penetapan tikus sebagai hewan model penurunan fungsi reproduksi.
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah tikus putih jantan (Rattus norvegicus) galur Sprague-Dawley dewasa sebanyak 24 ekor, berumur 12 minggu dengan bobot badan 150 gram yang diperoleh dari Animal Facility, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Bahan lain yang digunakan adalah rokok kretek. Alat yang digunakan dalam penelitian ini adalah smoking chamber, mikrotom, seperangkat alat untuk analisis darah seperti: pipet eritrosit, pipet leukosit, kamar hitung Neubauer dan mikroskop.
Metode Penelitian
Persiapan dan Perlakuan
Persiapan. Tikus ditempatkan pada kandang kotak plastik yang ditutupi kawat ram dengan sekam sebagai alas. Pakan berupa pelet (PT. Japfa Comfeed Indonesia) dan air minum diberi ad libitum. Lingkungan kandang dibuat agar tidak lembab, ventilasi yang cukup dengan penerangan selama 14 jam dan gelap selama 10 jam. Masing-masing tikus ditempatkan dalam kandang per kelompok perlakuan. Sebelum perlakuan hewan diadaptasikan pada suasana kandang selama 1 minggu.
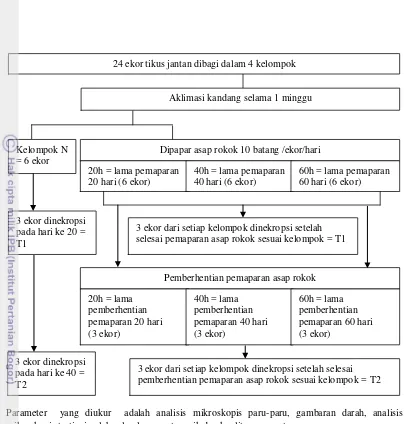
40 hari dan diberhentikan pemaparan selama 40 hari, dan 60h adalah kelompok yang dipapar asap rokok selama 60 hari dan diberhentikan pemaparan selama 60 hari. Pemaparan asap rokok dilaksanakan pada pagi hari dengan tata cara pemaparan seperti yang dituliskan pada Lampiran 1. Selama penelitian data diambil 2 kali yaitu saat setelah pemaparan asap rokok (T1) dan setelah pemberhentian perlakuan pemaparan asap rokok (T2). Pada waktu pengambilan data, 3 ekor tikus jantan pada masing-masing perlakuan dinekropsi untuk diamati analisis mikroskopis paru-paru, gambaran darah, analisis mikroskopis testis, analisis hormon testosteron, jumlah sel-sel spermatogenik dan kualitas spermatozoa (Gambar 6).
Parameter yang Diamati
Analisis Mikroskopis Paru-paru. Setelah tikus dinekropsi, organ paru-paru (pada bagian lobus diaphragmaticus dextra) diambil dan ditimbang untuk mengetahui bobot basah paru-paru, kemudian dibuat preparat histologi dengan pewarnaan histokimia hematoksilin eosin (HE) mengikuti cara Kiernan (1990) (Lampiran 2).
Pengukuran Gambaran Darah. Darah diambil secara intra cardial pada tikus yang sudah dianastesi. Parameter gambaran darah yang diukur adalah jumlah butir darah merah/BDM (eritrosit) dengan metode Counting chamber-burker dan Neubauer, kadar hemoglobin (Hb) dengan metode Cyan-methemoglobin, nilai hematokrit (PCV) dengan metode Microhematokrit, indeks eritrosit dan jumlah butir darah putih/BDP (leukosit) dengan metode Counting chamber-burker dan Neubauer (Lampiran 3).
Analisis Mikroskopis Testis dan Jumlah Sel-sel Spermatogenik.
Setelah tikus dinekropsi, organ testis diambil dan ditimbang untuk mengetahui bobot testis, kemudian dibuat preparat histologi dengan pewarnaan histokimia hematoksilin eosin (HE) mengikuti cara Kiernan (1990). Pengamatan histopatologis pada jaringan testis mencakup jumlah spermatogonium, spermatosit primer dan spermatid akhir (Lampiran 4).
Kualitas Spermatozoa. Kualitas spermatozoa yang diamati meliputi konsentrasi spermatozoa, viabilitas spermatozoa, dan abnormalitas spermatozoa berdasarkan modifikasi dari First (1991) dan Soehadi dan Arsyat (1983) (Lampiran 5).
Rancangan Percobaan dan Analisis Data
Parameter yang diukur adalah analisis mikroskopis paru-paru, gambaran darah, analisis mikroskopis testis, jumlah sel-sel spermatogenik dan kualitas spermatozoa.
Gambar 7. Bagan alur penelitian
HASIL DAN PEMBAHASAN
Analisis Mikroskopis Paru-paru
Rataan bobot basah paru-paru tikus setelah pemaparan asap rokok dan pemberhentian pemaparan disajikan pada Tabel 4. Hasil analisis statistik menunjukkan bahwa terdapat interaksi antara lama pemaparan asap rokok dengan lama pemberhentian pemaparan (P<0.05) terhadap bobot basah paru-paru. Lama pemaparan berpengaruh nyata (P<0.05) terhadap rataan bobot basah paru-paru. Semua kelompok yang dipapar asap rokok memberikan bobot paru-paru yang lebih kecil bila dibandingkan dengan kelompok N. Penurunan bobot basah paru-paru dalam penelitian ini diduga karena terjadinya atropi paru-paru-paru-paru akibat kematian sel yang diakibatkan oleh senyawa toksik asap rokok.
3 ekor dari setiap kelompok dinekropsi setelah selesai pemberhentian pemaparan asap rokok sesuai kelompok = T2 3 ekor dinekropsi
pada hari ke 40 = T2
Aklimasi kandang selama 1 minggu 24 ekor tikus jantan dibagi dalam 4 kelompok
Dipapar asap rokok 10 batang /ekor/hari
20h = lama pemaparan 20 hari (6 ekor)
40h = lama pemaparan 40 hari (6 ekor)
60h = lama pemaparan 60 hari (6 ekor) Kelompok N
= 6 ekor
Pemberhentian pemaparan asap rokok
20h = lama pemberhentian pemaparan 20 hari (3 ekor)
40h = lama pemberhentian pemaparan 40 hari (3 ekor)
60h = lama pemberhentian pemaparan 60 hari (3 ekor)
3 ekor dari setiap kelompok dinekropsi setelah selesai pemaparan asap rokok sesuai kelompok = T1 3 ekor dinekropsi
Tabel 4. Rataan bobot basah paru-paru tikus jantan setelah pemaparan asap rokok dan setelah pemberhentian perlakuan.
Perlakuan Waktu Pengambilan Rataan
T1 T2
N 2.35±0.01b 2.58±0.02a 2.46a
20h 2.09±0.01c 2.09±0.01c 2.10b
40h 1.96±0.02d 2.02±0.01cd 1.99c
60h 1.63±0.06e 1.66±0.10e 1.65d
Rataan 2.01b 2.09a P<0.05
Keterangan: Data yang ditampilkan merupakan nilai rataan ± standar deviasi. Huruf yang berbeda pada baris yang sama atau kolom yang sama menunjukkan beda nyata (p<0.05). T1 = waktu setelah pemaparan, T2 = waktu setelah pemberhentian perlakuan, N = kelompok yang tidak diberi perlakuan, 20h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 20 hari, 40h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 40 hari, dan 60h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 60 hari.
Keadaan ini diduga karena senyawa toksik yang terkandung dalam asap rokok dapat menurunkan fungsi-fungsi sel pada tubuh termasuk sel-sel pada jaringan paru-paru. Pengaruh asap rokok pada saluran pernapasan dapat menimbulkan: a) perubahan histopatologi dan ultrastruktur saluran napas, b) penyempitan saluran napas, c) turunnya tegangan permukaan alveolus, dan d) perubahan pada ultrastruktur pneumosit tipe I, tipe II dan sel clara yang mengarah pada kematian sel (Widodo 2006). Kematian sel inilah yang diduga dapat menyebabkan penurunan bobot basah paru-paru. Lama waktu pemberhentian pemaparan berpengaruh nyata (P<0.05) terhadap rataan bobot basah paru-paru. Namun demikian, lamanya waktu pemberhentian pemaparan terhadap semua kelompok yang dipapar tidak dapat mengembalikan bobot basah paru-paru. Hal ini menunjukkan bahwa pemberhentian pemaparan sesuai dengan waktu pemaparan belum dapat mengembalikan kondisi paru-paru ke keadaan semula.
1
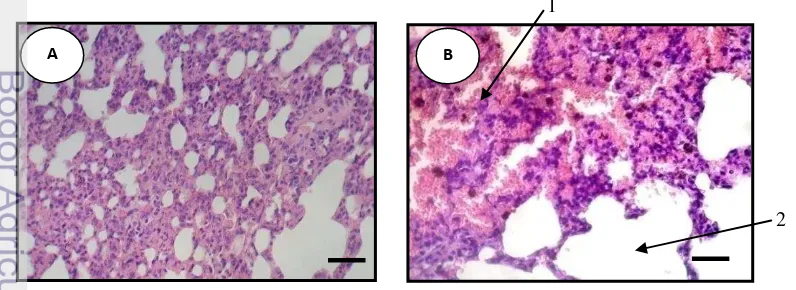
2 Gambar 8. Fotomikrograf paru-paru setelah pemaparan asap rokok menunjukkan peningkatan
partikel berwarna coklat tua atau hitam ( ) pada 40h dan 60h. A (N=kelompok yang tidak diberi perlakuan), B (20h=Pemaparan asap rokok selama 20 hari ), C (40h=Pemaparan asap rokok selama 40 hari) dan D (60h=Pemaparan asap rokok selama 60 hari). Bar = 10 µm. Pewarnaan HE.
Hasil pengamatan juga memperlihatkan peningkatan sel radang dan terjadi pembesaran pada alveoli pada perlakuan 60h (Gambar 9). Pneumonia adalah peradangan pada jaringan alveoli paru-paru. Alveoli bertanggung jawab terhadap pertukaran O2 dan CO2 pada proses pernafasan. Ahmad et al. (2001)menemukan
[image:39.595.138.500.72.315.2]bahwa paparan radikal bebas menyebabkan terjadinya gangguan pada mitokondria paru, jantung, dan otak. Gangguan pernapasan atau perubahan pada epitel saluran napas akibat asap rokok dapat berupa: a) hilangnya silia, b) hipertrofi kelenjar lendir dan peningkatan jumlah sel goblet, c) penurunan lapisan epitel bronkiolus, dan d) penurunan kandungan glutation peroksidase (GSH) jaringan paru. Asap rokok juga dapat menyebabkan terjadinya peningkatan jumlah sel makrofag dan perubahan ketebalan jaringan kolagen pada alveolus, proliferasi sel fibroblast dan peningkatan kandungan malondialdehid pada paru (Guyton 1997).
Gambar 9. Fotomikrograf paru-paru setelah pemaparan asap rokok menunjukan peningkatan sel-sel radang pada alveoli paru-paru (1) dan terjadi pembesaran alveoli (2) pada perlakuan 60h. A (N= kelompok yang tidak diberi perlakuan), B (60h=Pemaparan asap rokok selama 60 hari). Bar = 5 µm. Pewarnaan HE.
D C
A B
[image:39.595.112.510.546.691.2]Gambaran Darah
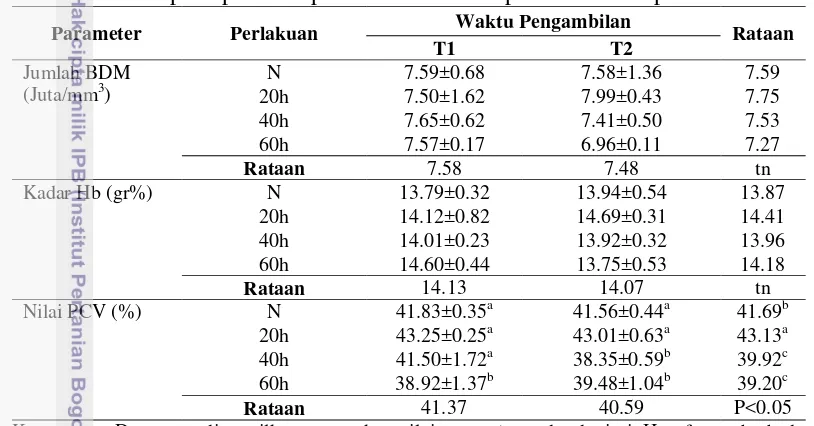
[image:40.595.79.486.230.443.2]Rataan jumlah butir darah merah/BDM (eritrosit), kadar hemoglobin (Hb) dan hematokrit/PCV setelah perlakuan pemaparan asap rokok dan pemberhentian pemaparan disajikan pada Tabel 5. Hasil analisis statistik menunjukkan bahwa jumlah BDM dan kadar Hb tidak dipengaruhi oleh pemaparan asap rokok. Hasil berbeda ditunjukkan oleh nilai PCV, terdapat interaksi antara lama pemaparan dan waktu pengambilan (P<0.05).
Tabel 5. Rataan Jumlah BDM (Juta/mm3), Kadar Hb (gr %) dan Nilai PCV (%) setelah pemaparan asap rokok dan setelah pemberhentian perlakuan.
Parameter Perlakuan Waktu Pengambilan Rataan
T1 T2
Jumlah BDM (Juta/mm3)
N 7.59±0.68 7.58±1.36 7.59
20h 7.50±1.62 7.99±0.43 7.75
40h 7.65±0.62 7.41±0.50 7.53
60h 7.57±0.17 6.96±0.11 7.27
Rataan 7.58 7.48 tn
Kadar Hb (gr%) N 13.79±0.32 13.94±0.54 13.87
20h 14.12±0.82 14.69±0.31 14.41
40h 14.01±0.23 13.92±0.32 13.96
60h 14.60±0.44 13.75±0.53 14.18
Rataan 14.13 14.07 tn
Nilai PCV (%) N 41.83±0.35a 41.56±0.44a 41.69b
20h 43.25±0.25a 43.01±0.63a 43.13a
40h 41.50±1.72a 38.35±0.59b 39.92c
60h 38.92±1.37b 39.48±1.04b 39.20c
Rataan 41.37 40.59 P<0.05
Keterangan: Data yang ditampilkan merupakan nilai rataan ± standar deviasi. Huruf yang berbeda pada baris yang sama atau kolom yang sama menunjukkan beda nyata (p < 0.05). T1 = waktu setelah pemaparan, T2 = waktu setelah pemberhentian perlakuan, N = kelompok yang tidak diberi perlakuan, 20h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 20 hari, 40h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 40 hari, dan 60h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 60 hari.
Perbedaan hanya terjadi pada pemaparan 60 hari bila dibandingkan dengan kelompok N. Hasil penelitian ini menunjukkan bahwa asap rokok diduga dapat menyebabkan permeabilitas pembuluh darah meningkat. Berkurangnya cairan akan membuat persentasi zat padat darah terhadap cairannya naik sehingga nilai PCV juga meningkat. Viskositas dalam darah akan meningkat ketika PCV meningkat yang mengakibatkan aliran darah melalui pembuluh sangat lambat (Guyton 1997). Secara umum, lama pemberhentian tidak mempengaruhi nilai PCV. Namun demikian bila dilihat lebih jauh pemberhentian 40 hari dan 60 hari akan mempengaruhi nilai PCV dibandingkan dengan sesaat setelah pemaparan. Hal ini menunjukkan bahwa setelah pemberhentian pemaparan, tubuh berusaha untuk mempertahankan keadaan homeostatisnya agar semua proses berjalan sempurna.
Indeks eritrosit dipergunakan secara luas dalam mengklasifikasi anemia atau sebagai penunjang dalam membedakan berbagai macam anemia (Riswanto 2009).
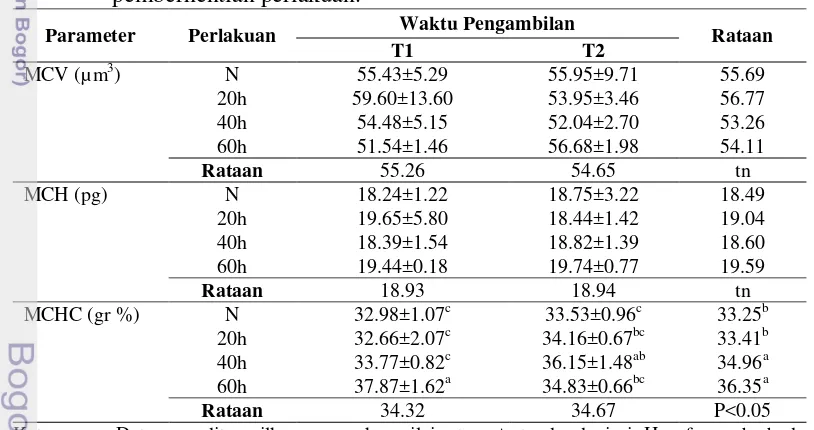
Rataan indeks eritrosit (MCV, MCH dan MCHC) setelah pemaparan asap rokok dan pemberhentian pemaparan disajikan pada Tabel 6. Hasil analisis statistik menunjukkan bahwa indeks eritrosit MCV dan MCH tidak dipengaruhi oleh pemaparan asap rokok. Hasil berbeda ditunjukkan oleh indeks eritrosit MCHC menunjukkan interaksi antara lama pemaparan dan waktu pengambilan (P<0.05). Lama pemaparan berpengaruh nyata (P<0.05) terhadap rataan indeks eritrosit MCHC. Hasil perhitungan menunjukkan bahwa kelompok yang dipapar asap rokok selama 60 hari memiliki nilai MCHC yang lebih tinggi dibandingkan kelompok yang dipapar asap rokok selama 20 hari, 40 hari dan kelompok N. Hal ini menjelaskan bahwa pemaparan asap rokok 60 hari memiliki sifat toksik yang lebih tinggi dan menetap sehingga dapat menurunkan fungsi jaringan. Penurunan fungsi jaringan ini dapat meningkatkan kadar Hb dalam sel-sel darah merah sehingga indeks eritrosit MCHC meningkat. Namun demikian, peningkatan indeks eritrosit MCHC dari nilai normal 32.9 – 33.5 gr% pada tikus menjadi 34.8– 37.8 gr% mengindikasikan bahwa pemaparan asap rokok tidak menyebabkan terjadinya anemia, karena jumlah eritrosit masih dalam batas normal. Menurunnya jumlah eritrosit berakibat pada menurunnya suplai oksigen ke jaringan dan terhambatnya penyaluran bahan organik ke sel yang secara tidak langsung mengganggu metabolisme tubuh (Guyton 1997).
Tabel 6. Rataan indeks eritrosit setelah pemaparan asap rokok dan setelah pemberhentian perlakuan.
Parameter Perlakuan Waktu Pengambilan Rataan
T1 T2
MCV (µ m3) N 55.43±5.29 55.95±9.71 55.69
20h 59.60±13.60 53.95±3.46 56.77
40h 54.48±5.15 52.04±2.70 53.26
60h 51.54±1.46 56.68±1.98 54.11
Rataan 55.26 54.65 tn
MCH (pg) N 18.24±1.22 18.75±3.22 18.49
20h 19.65±5.80 18.44±1.42 19.04
40h 18.39±1.54 18.82±1.39 18.60
60h 19.44±0.18 19.74±0.77 19.59
Rataan 18.93 18.94 tn
MCHC (gr %) N 32.98±1.07c 33.53±0.96c 33.25b
20h 32.66±2.07c 34.16±0.67bc 33.41b
40h 33.77±0.82c 36.15±1.48ab 34.96a
60h 37.87±1.62a 34.83±0.66bc 36.35a
Rataan 34.32 34.67 P<0.05
Keterangan: Data yang ditampilkan merupakan nilai rataan ± standar deviasi. Huruf yang berbeda pada baris yang sama atau kolom yang sama menunjukkan beda nyata (p < 0.05). T1 = waktu setelah pemaparan, T2 = waktu setelah pemberhentian perlakuan, N = kelompok yang tidak diberi perlakuan, 20h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 20 hari, 40h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 40 hari, dan 60h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 60 hari.
[image:41.595.107.514.410.625.2]berbeda nyata. Hal ini menjelaskan bahwa lamanya pemberhentian pemaparan tidak dapat mengembalikan nilai indeks eritrosit dikarenakan sifat toksik asap rokok yang menetap.
Rataan jumlah butir darah putih/BDP (Leukosit) setelah pemaparan asap rokok dan pemberhentian pemaparan disajikan pada Tabel 7. Hasil analisis statistik menunjukkan bahwa tidak terdapat interaksi antara lama pemaparan asap rokok dengan lama pemberhentian pemaparan terhadap jumlah BDP. Lama pemaparan berpengaruh nyata (P<0.05) terhadap jumlah BDP. Semua kelompok yang dipapar asap rokok menunjukkan jumlah BDP yang lebih tinggi dibandingkan kelompok N.
Tabel 7. Rataan Jumlah BDP (Juta/mm3) setelah pemaparan asap rokok dan setelah pemberhentian perlakuan.
Perlakuan Waktu Pengambilan Rataan
T1 T2
N 13.40±0.79c 13.36±0.50c 13.38c
20h 18.45±0.84a 18.47±0.77a 18.46a
40h 15.54±1.25b 15.55±1.32b 15.55b
60h 19.08±0.65a 19.17±0.62a 19.12a
Rataan 16.62 16.64 tn
Keterangan: Data yang ditampilkan merupakan nilai rataan ± standar deviasi. Huruf yang berbeda pada baris yang sama atau kolom yang sama menunjukkan beda nyata (p < 0.05). T1 = waktu setelah pemaparan, T2 = waktu setelah pemberhentian perlakuan, N = kelompok yang tidak diberi perlakuan, 20h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 20 hari, 40h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 40 hari, dan 60h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 60 hari.
Asap rokok yang terhirup akan masuk ke saluran pernafasan sehingga senyawa-senyawa kimia yang bersifat toksik dapat mengganggu metabolisme darah dan dapat menyebabkan peradangan. Banyaknya asap rokok yang masuk ke tubuh tikus pada perlakuan 60h, mengakibatkan peradangan pada paru-paru tikus menyebabkan jumlah BDP meningkat. BDP berfungsi untuk membantu tubuh melawan berbagai penyakit sebagai bagian dari sistem kekebalan tubuh. Masuknya partikel-partikel asing yang bersifat toksik pada asap rokok dapat menyebabkan peningkatan BDP untuk menangkap partikel-partikel tersebut.
Analisis Mikroskopis Testis
[image:43.595.109.501.206.289.2]Rataan bobot testis setelah pemaparan asap rokok dan pemberhentian pemaparan disajikan pada Tabel 8. Hasil analisis statistik menunjukkan bahwa tidak terdapat interaksi antara lama pemaparan asap rokok dengan lama pemberhentian pemaparan terhadap bobot testis.
Tabel 8. Rataan bobot testis tikus setelah pemaparan asap rokok dan setelah pemberhentian perlakuan.
Perlakuan Waktu Pengambilan Rataan
T1 T2
N 2.91±0.01a 2.91±0.03a 2.91a
20h 2.57±0.03ab 2.59±0.01ab 2.58b
40h 2.42±0.01b 2.39±0.01b 2.41b
60h 2.29±0.55b 1.92±0.01c 2.11c
Rataan 2.55 2.46 tn
Keterangan: Data yang ditampilkan merupakan nilai rataan ± standar deviasi. Huruf yang berbeda pada baris yang sama atau kolom yang sama menunjukkan beda nyata (p < 0.05). T1 = waktu setelah pemaparan, T2 = waktu setelah pemberhentian perlakuan, N = kelompok yang tidak diberi perlakuan, 20h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 20 hari, 40h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 40 hari, dan 60h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 60 hari.
Lama pemaparan berpengaruh nyata (P<0.05) terhadap rataan bobot testis. Semua kelompok yang dipapar asap rokok memberikan bobot testis yang lebih kecil bila dibandingkan dengan kelompok N. Hal ini menjelaskan bahwa terjadi penurunan bobot testis pada perlakuan pemaparan asap rokok. Penurunan bobot testis diduga karena adanya karbon monoksida (CO) yang berasal dari asap rokok di dalam darah sehingga tubuh mengalami kekurangan oksigen dan terjadi kematian sel serta lesio pada testis. Pemaparan asap rokok yang mengandung senyawa-senyawa yang bersifat toksik diduga dapat menghambat spermiogenesis yang diikuti oleh atropi testis. Atropi testis adalah pengecilan testis dari ukuran normal, diduga akibat senyawa-senyawa toksik yang masuk melalui darah ke testis sehingga dapat menyebabkan penurunan bobot testis. Ukuran testis merupakan indikator yang digunakan untuk memperkirakan kapasitas produksi spermatozoa hewan jantan (Axner & Forsberg 2002). Lama pemberhentian pemaparan berpengaruh nyata (P<0.05) terhadap rataan bobot testis. Semua kelompok pemberhentian pemaparan asap rokok tidak kembali pada kondisi normal bahkan pemberhentian pemaparan asap rokok selama 60 hari menunjukkan adanya penurunan yang lebih rendah dibandingkan setelah dipapar asap rokok. Fenomena ini menjelaskan pemaparan asap rokok selama 60 hari dapat menurunkan bobot testis dan setelah diberhentikan pemaparan selama 60 hari akan terus terjadi penurunan.
menunjukkan bahwa setelah dilakukan pemberhentian perlakuan, jumlah sel-sel spermatogenik tidak mengalami perubahan yang lebih baik.
Tabel 9. Rataan jumlah sel-sel spermatogenik (spermatogonium, spermatosit primer dan spermatid akhir) setelah pemaparan asap rokok dan setelah pemberhentian perlakuan.
Parameter Perlakuan Waktu Pengambilan Rataan
T1 T2
Spermatogonium N 37.00±1.00a 38.33±0.58a 37.67a
20h 31.66±0.58b 32.33±0.58b 32.00b
40h 22.33±1.53c 20.33±0.58d 21.33c
60h 19.00±1.00de 18.33±0.58e 18.67d
Rataan 27.50 27.33 P<0.05
Spermatosit Primer N 48.00±1.00a 47.33±1.53a 47.67a
20h 48.67±1.15a 47.67±1.15a 48.17b
40h 32.00±1.00b 30.67±1.15b 31.33b
60h 27.67±1.15c 25.00±1.00d 26.33c
Rataan 39.08a 37.67b tn
Spermatid Akhir N 61.33±1.15a 60.33±0.58a 60.83a
20h 37.33±1.15b 37.00±1.00b 37.17b
40h 27.67±1.53c 27.33±0.58c 27.50c
60h 20.33±0.58d 20.67±0.58d 20.50d
Rataan 36.67 36.33 tn
Keterangan: Data yang ditampilkan merupakan nilai rataan ± standar deviasi. Huruf yang berbeda pada baris yang sama atau kolom yang sama menunjukkan beda nyata (p < 0.05). T1 = waktu setelah pemaparan, T2 = waktu setelah pemberhentian perlakuan, N = kelompok yang tidak diberi perlakuan (kontrol), 20h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 20 hari, 40h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 40 hari, dan 60h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 60 hari.
Jumlah sel-sel spermatogenik (spermatogonium, spermatosit primer dan spermatid akhir) menurun seiring dengan lamanya pemaparan asap rokok dan kondisi ini bersifat menetap meskipun pemaparan telah diberhentikan. Hal ini menjelaskan bahwa pemberhentian pemaparan asap rokok tidak mengembalikan jumlah sel-sel spermatogenik pada tahapan spermatogenesis tikus yang pernah terpapar asap rokok. Turunnya jumlah sel-sel spermatogenik pada tahapan spermatogenesis diduga akibat adanya senyawa-senyawa yang bersifat toksik pada asap rokok yang dapat menghambat spermatogenesis.
karsinogen, tar, nikotin, nitrosamin, karbonmonoksida, senyawa PAH (Polynuclear Aromatic Hydrogen), fenol, karbonil, klorin dioksin, dan furan (Fowles dan Bates 2000). Revel et al. (2001) melaporkan bahwa PAH menyebabkan atropi testis, menghambat spermatogenesis, dan merusak morfologi spermatozoa. Radikal bebas dapat menyebabkan gangguan kronik pada tahapan spermatogenesis (Rajpurkar et al. 2000; Rajpurkar et al. 2002; Fitriani et al. 2010).
Kualitas Spermatozoa
Hasil pengamatan terhadap konsentrasi spermatozoa, viabilitas spermatozoa dan abnormalitas spermatozoa disajikan pada Tabel 10. Hasil analisis statistik menunjukkan bahwa terdapat interaksi antara lama pemaparan asap rokok dengan lama pemberhentian pemaparan (P<0.05) terhadap viabilitas spermatozoa, namun tidak terdapat interaksi antara lama pemaparan asap rokok dengan lama pemberhentian pemaparan terhadap konsentrasi spermatozoa dan abnormalitas spermatozoa.
Tabel 10. Rataan kualitas spermatozoa (konsentrasi spermatozoa, viabilitas Spermatozoa dan abnormalitas spermatozoa) setelah pemaparan asap rokok dan setelah pemberhentian perlakuan.
Parameter Perlakuan Waktu Pengambilan Rataan
T1 T2
Konsentrasi Spermatozoa (Juta/ml)
N 243.53±1.95a 246.29±5,82a 244.74a
20h 171.11±13.17b 178.10±0,96b 174.60b
40h 67.35±1.34c 67,68±3,53c 67.42c
60h 46.86±0,18d 49.18±0,02d 47.99d
Rataan 132.06 135.31 tn
Viabilitas Spermatozoa (%)
N 75,91±0,14b 77,61±0,29a 76.76a
20h 39,86±0,01c 39,63±0,09c 39.75b
40h 27,14±0,01e 27,55±0,22d 27.34c
60h 8,46±0,02f 8,07±0,01g 8.27d
Rataan 37.84b 38.21a P<0.05
Abnormalitas Spermatozoa (%)
N 24,74±0,01e 24,79±0,42e 24.76d
20h 49,53±0,46d 49,75±0,23d 49.64c
40h 70,03±0,02c 70,77±0,01c 70.40b
60h 84,96±0,21a 84,61±1,99b 85.29a
Rataan 57.56 57.48 tn
Keterangan: Data yang ditampilkan merupakan nilai rataan ± standar deviasi. Huruf yang berbeda pada baris yang sama atau kolom yang sama menunjukkan beda nyata (p < 0.05). T1 = waktu setelah pemaparan, T2 = waktu setelah pemberhentian perlakuan, N = kelompok yang tidak diberi perlakuan (kontrol), 20h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 20 hari, 40h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 40 hari, dan 60h = kelompok yang dipapar asap rokok 10 batang/ekor/hari selama 60 hari.
[image:46.595.86.482.370.582.2]penurunan kualitas spermatozoa setelah pemaparan asap rokok. Penurunan kualitas spermatozoa sejalan dengan lamanya pemaparan asap rokok.
Pemaparan asap rokok diduga dapat menyebabkan penurunan konsentrasi spermatozoa sebagai akibat dari penurunan sel-sel spermatogenik (spermatogonium, spermatosid primer dan spermatid akhir) di dalam tubulus seminiferus akibat radikal bebas asap rokok dapat menghambat pembentukan ATP mitokondria. Mitokondria merupakan tempat proses perombakan atau katabolisme untuk menghasilkan energi bagi spermatozoa (Anbasari et al. 2005; Fitriani et al. 2010). Menurut Dewi (2011), radikal bebas asap rokok yang terpapar pada tikus dapat menurunkan konsentrasi spermatozoa. Kualitas spermatozoa setelah pemaparan asap rokok yang tidak berbeda dengan kualitas spermatozoa setelah pemberhentian pemaparan menunjukkan bahwa pemaparan asap rokok 20 hari, 40 hari dan 60 hari menyebabkan penurunan fungsi reproduksi.
SIMPULAN
1. Pemaparan asap rokok pada tikus jantan menunjukkan peningkatan partikel hitam yang menempel pada dinding alveolus paru-paru 40h dan 60h, dan peningkatan radang pada alveoli paru-paru pada 60h serta peningkatan nilai PCV.
2. Pemaparan asap rokok selama 20