SKRIPSI
HEMOLISIS ERITROSIT IN VITRO SERTA KAPASITAS ANTIOKSIDAN PEPES IKAN MAS IRADIASI DAN NON IRADIASI
Oleh :
KENCHI TANTRADWITIYA
F24052589
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
HEMOLISIS ERITROSIT IN VITRO SERTA KAPASITAS ANTIOKSIDAN PEPES IKAN MAS IRADIASI DAN NON IRADIASI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh :
KENCHI TANTRADWITIYA F24052589
Dilahirkan pada tanggal 27 Februari 1987 di Semarang
Tanggal lulus :
Menyetujui, Bogor, 2009
Prof. Dr.Ir Fransisca Rungkat-Zakaria Msc. Zubaidah Irawati PhD. Dosen Pembimbing I Dosen pembimbing II
Mengetahui,
Dr. Ir. Dahrul Syah, M.Sc
Kenchi Tantradwitiya. F24052589. Erythrocytes Hemolysis In Vitro and Antioxidant Capacity in Irradiation and Non Irradiation Gold Fish Pepes. Under supervision of Prof. Dr.Ir Fransisca Rungkat-Zakaria Msc. and Zubaidah Irawati PhD.
ABSTRACT
A variety methods of food preservation have been developed to produce products with maximum storage period, such as drying, pasteurisation, sterilisation, and canning. Those methods need high temperature processing, that can cause degradation of food nutritions, for example protein and vitamine. Those methods also can cause organopleptic quality alteration in foods, like colour, taste, and aroma. Irradiation method is alternative of food preservation method that is done by exposing food with controling ionisation radiation certain interval time to attain the definite purpose. This method does not apply high temperature, but, in fact, many people still doubt about the safety of irradiation products may cause negative effect for human health. The aim of this research is definite the safety of irradiation fish pepes by observing free radical activity in irradiated pepes product in vitro by erythrocyte hemolysis and antioxidant capacity.
This research can be devided into four steps; samples preparation consisting ofthe making of irradiation gold fish pepes extract, chemical analysis (DPPH assay), the hemolysis rate of erythrocytes measurement, and statistic testing with ANOVA methode.
The hemolysis rate of erythrocytes in vitro and antioxidant capacity measurments of irradiated gold fish pepes indicated that samples with period of storage more than 12 month (November 11th 2006 pepes and June 14th 2007 pepes) have higher hemolysis rate of erythrocytes and lower antioxidant capacity than samples with storage period less than 12 month (April 5th 2008 pepes and No Label pepes).
The antioxidant capacity of November 11th 2006 Rell Ion pepes is 21.06%, and the hemolysis rate of erythrocytes is 129.14%. The antioxidant capacity of November 14th 2007 Dipa pepes is 20.42%, and the hemolysis rate of erythrocytes is 125.11%. The antioxidant capacity of April 5th 2008 pepes is 31.91%, and the hemolysis rate of erythrocytes is 114.20%. The antioxidant capacity of No Label pepes is 33.83%, and the hemolysis rate of erythrocytes is 114.20%. The antioxidant capacity of control pepes is 15.53%, and the hemolysis rate of erythrocytes is 95.96%. The influence of sample dilution in this research is tended to increase the rate hemolysis of erythroctes.
Based on statistic test ANOVA method, control pepes is not real different with irradiated pepes. In addition, there were no difference at 0.05 invariance of interval..
Kenchi Tantradwitiya. F24052589. Hemolisis Eritrosit In Vitro Serta Kapasitas Antioksidan Pepes Ikan Mas Iradiasi Dan Non Iradiasi. Dibawah bimbingan Prof. Dr. Ir Fransisca Zakaria Rungkat dan Dr. Ir Zubaidah Irawati.
RINGKASAN
Berbagai metode pengawetan pangan telah banyak dikembangkan untuk menghasilkan suatu produk dengan daya simpan yang maksimum, misalnya pengeringan, pasteurisasi, sterilisasi, dan pengalengan. Metode-metode tersebut membutuhkan suhu yang tinggi dalam prosesnya sehingga dapat mengakibatkan destruksi nutrisi-nutrisi penting yang terkandung dalam bahan pangan, seperti protein dan vitamin. Selain itu hal ini juga dapat menyebabkan perubahan kualitas organoleptik pada bahan pangan, seperti timbulnya perubahan warna, rasa, dan aroma.
Teknik iradiasi merupakan alternatif metode pengawetan yang dilakukan dengan mengekspos bahan pangan baik yang dikemas maupun yang tidak terhadap sejumlah radiasi ionisasi yang terkontrol dalam waktu tertentu untuk mencapai tujuan yang diinginkan.. Produk yang dihasilkan dari proses iradiasi ini diharapkan adalah produk yang steril. Akan tetapi masih diragukan keamanan dari produk-produk iradiasi karena dikhawatirkan proses tersebut dapat menimbulkan pengaruh negatif terhadap kesehatan manusia seperti terbentuknya radikal-radikal bebas atau pangan yang menjadi bersifat radioaktif yang dapat mempengaruhi kondisi tubuh manusia
Penelitian ini bertujuan untuk menentukan keamanan produk pepes ikan mas iradiasi dengan melihat masih ada tidaknya aktivitas radikal bebas pada produk pepes ikan mas iradiasi secara in vitro (aktivitas hemolisis eritrosit) serta kapasitas antioksidan pada produk pepes ikan mas iradiasi. Secara garis besar, penelitian ini dapat dibagi mejadi berberapa tahap, yaitu tahap persiapan yang meliputi tahap pembuatan ekstrak sampel pepes ikan mas radiasi dan non iradiasi serta isolasi sel eritrosit, tahap uji analisis kimia uji antioksidan DPPH, tahap pengujian hemolisis eritrosit terhadap penambahan ekstrak pepes ikan mas iradiasi dan non iradiasi serta analisis sidik ragam
Pengujian aktivitas penghambatan hemolisis yang dilakukan secara in vitro
serta pengukuran kapasitas antioksidan pada sampel pepes ikan mas iradiasi menunjukkan bahwa sampel dengan masa simpan lebih besar dari 12 bulan (pepes 11 November 2006 dan pepes 14 Juni 2007) memiliki persentase hemolisis eritrosit yang lebih besar serta kapasitas antioksidan yang lebih rendah apabila dibandingkan terhadap sampel dengan masa simpan kurang dari 12 bulan (sampel pepes No Label dan sampel pepes 5 April 2008).
Pengaruh pengenceran yang dilakukan terhadap masing-masing sampel pepes ikan mas iradiasi dan pepes kontrol cenderung memicu terjadinya proses hemolisis pada sel eritrosit Berdasarkan uji stastistik metode ANOVA, sampel pepes kontrol ternyata tidak berbeda nyata terhadap sampel pepes yang mengalami perlakuan iradiasi. Selain itu juga didapat hubungan bahwa antar sampel pepes yang diiradiasi dengan bervariasi tanggal penyinaran ternyata juga tidak berbeda secara nyata pada selang 0.05
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 27 Februari 1987 di Semarang. Penulis adalah putra dari pasangan Tan Linggo Sapto dan Ibu Hesti Kusumawati dan merupakan anak kedua dari tiga bersaudara.
Penulis menempuh pendidikan sekolah dasar di SD PL Bernardus Semarang pada tahun 1993-1999, pendidikan sekolah menengah pertama di SMP PL Domenico Savio Semarang pada tahun 1999-2002, dan pendidikan sekolah menengah atas di SMA Kolese Loyola Semarang pada tahun 2002-2005. Pada tahun 2005, penulis melanjutkan pendidikan di Institut Pertanian Bogor pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian yang diterima melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru).
Selama kuliah di Departemen Ilmu dan Teknologi Pangan, penulis terlibat dalam Himpunan Mahasiswa Ilmu dan Teknologi Pangan (HIMITEPA), dan Keluarga Mahasiswa Buddhis Institut Pertanian Bogor (KMB-IPB). Penulis terlibat dalam beberapa kepanitian dan berapa kompetisi penulisan Program Kreativitas Mahasiswa. Berbagai pengalaman kerja juga telah diperoleh penulis, baik sebagai asisten praktikum Kimia Dasar dan Biologi Dasar untuk mahasiswa TPB, asisten praktikum Teknologi Pengolahan Pangan.
KATA PENGANTAR
Syukur dan terimakasih saya panjatkan kepada Tuhan Yang Maha Esa karena penulis dapat menyelesaikan skripsi yang berjudul Uji Toksisitas Hemolisis Eritrosit In Vitro Serta Pengukuran Kapasitas Antioksidan Pada Ekstrak Pepes Ikan Mas Iradiasi. Tulisan ini merupakan laporan penelitian yang telah dilakukan penulis di Laboratorium Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor.
Penulisan skripsi ini tidak terlepas dari bantuan banyak pihak. Oleh karena itu, penulis ingin menyampaikan terima kasih yang sebesar-besarnya kepada: 1. Prof. Dr. Ir Fransisca Zakaria Rungkat selaku dosen pembimbing akademik
yang telah memberi bimbingan, bantuan, serta nasehat kepada penulis selama perkuliahan, penelitian, dan penyelesaian tugas akhir.
2. Zubaidah Irawati PhD. selaku dosen pembimbing kedua yang telah membimbing penulis dalam pelaksanaan penelitian dan penulisan.
3. Pihak PATIR BATAN yang telah memberikan kesempatan untuk ikut terlibat dalam proyek penelitian.
4. Ibu Waysima, selaku dosen yang telah membantu kelancaran studi serta memberikan semangat kepada penulis selama menempuh pendidikan di Departemen Ilmu dan Teknologi Pangan
5. Seluruh Staf pengajar di Departemen Ilmu dan Teknologi Pangan IPB yang telah membagi ilmunya kepada penulis, semoga ilmu yang diberikan menjadi ilmu yang bermanfaat.
6. Semua teknisi dan laboran Departemen ITP: Pak Wahid, Pak Gatot, Pak Rojak, Pak Sobirin, Bu Rubiah, Mas Edi, Pak Iyas, terima kasih atas bantuan, saran, dan kerja samanya selama penulis melakukan penelitian.
7. Keluargaku tercinta: Mama, Papa dan Kakak dan Adik Lisa Tanika dan Alexandra Tri Tantya yang selalu memberikan doa, kasih sayang, nasihat, dan motivasi tiada henti
9. Tuti, Sisi, Vero, Stela, Waisak, Suhendri, Glenn, Tere, Cath, Ola, Dion, Adi L, Marcel, Irene, Rheiner, Belinda, Epink, Wiwik, Chaca, Tjan, Melisa, Abi dan semua Warga PERWIRA atas kebersamaanya.
10.Arya, Dewi, Sobur, Harist, Yuni, Galih Ika, dan teman-teman pengguna Lab. Biokimia. Terimakasih atas suka-dukanya.
11.Teman-teman ITP 42, terima kasih atas kebersamaannya selama menjalani kuliah dan praktikum di Departemen ITP.
12.Keluarga besar TPG/ ITP angkatan 40, 41, 42, 43, 44 atas kebersamaannya selama ini. Semoga persahabatan kita tidak akan pernah hilang.
13.Sahabat-sahabatku ”KMB-IPB”. Terima kasih selalu mau berbagi kebersamaan, keceriaan, kesedihan, serta terima kasih untuk tiap doa kesuksesannya.
14.Teman di Kos Pondok Joglo : Olive, Ester, Dimitri, Bi Uket terima kasih atas semangat dan bantuannya
Akhir kata penulis menyadari bahwa skripsi ini masih jauh sempurna dan perlu banyak masukan serta saran. Penulis juga berharap agar skripsi ini dapat bermanfaat bagi seluruh pihak yang membutuhkan dan terhadap pengembangan ilmu dan teknologi khususnya dalam bidang llmu dan teknologi pangan.
Bogor, Mei 2009
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR GAMBAR ... vi
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... ix
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN ... 2
C. MANFAAT PENELITIAN ... 3
II. TINJAUAN PUSTAKA ... 4
A. Ikan Mas ... 4
B. Pepes ... 5
C. Pembuatan Pepes Ikan Mas Iradiasi ... 5
D. Iradiasi ... 6
E. Pangan Iradiasi ... 8
F. Toksikologi Iradiasi ... 9
G. Radikal Bebas... 10
H. Antioksidan ... 12
I. Komponen Bioaktif Rempah-Rempah Pepes Ikan Mas... 14
J. Eritrosit ... 16
K. Hemolisis Eritrosit ... 17
III.METODE PENELITIAN ... 21
A. ALAT DAN BAHAN ... 21
B. METODE ... 21
a.Tahap Persiapan ... 22
1. Ekstraksi Sampel dengan Pelarut Aquades ... 22
2. Isolasi Eritrosit Manusia ... 23
c. Analisis Kapasitas Antioksidan ... 25
d.Analisis Sidik Ragam Nilai Absorbansi Pada Pengujian Hemolisis Eritrosit Pepes Ikan Mas Iradiasi ... 26
IV.HASIL DAN PEMBAHASAN ... 27
A. Ekstraksi ... 27
B. Kapasitas Antioksidan (Metode DPPH)... 28
C. Pengaruh Penambahan Ekstrak Pepes terhadap Hemolisis Eritrosit.. ... 32
a.Respon Hemolisis Eritrosit terhadap Sampel Ekstrak Pepes pada Pengenceran 1x ... 34
b.Respon Hemolisis Eritrosit terhadap Sampel Ekstrak Pepes pada Pengenceran 2x dan 4x... 38
c.Respon Hemolisis Eritrosit Terhadap Ekstrak Sampel Pepes 11 November 2006 dengan Variasi Pengenceran ... 43
d.Respon Hemolisis Eritrosit Terhadap Ekstrak Sampel Pepes 14 Juni 2007 dengan Variasi Pengenceran... 44
e.Respon Hemolisis Eritrosit Terhadap Ekstrak Sampel Pepes 5 April 2008 dengan Variasi Pengenceran ... 46
f.Respon Hemolisis Eritrosit Terhadap Ekstrak Sampel No Label dengan Variasi Pengenceran ... 47
g.Respon Hemolisis Eritrosit Terhadap Ekstrak Sampel Pepes Kontrol dengan Variasi Pengenceran ... 49
h.Pengujian Aktifitas Hemolisis Eritrosit pada Sampel Pepes Ikan Mas dengan Menggunakan Metode Triphan Blue ... 51
D. Analisis Sidik Ragam Nilai Absorbansi Pada Pengujian Hemolisis Eritrosit Pepes Ikan Mas Iradiasi ... 54
V. KESIMPULAN DAN SARAN ... 55
A. KESIMPULAN ... 55
B. SARAN ... 56
DAFTAR PUSTAKA ... 57
SKRIPSI
HEMOLISIS ERITROSIT IN VITRO SERTA KAPASITAS ANTIOKSIDAN PEPES IKAN MAS IRADIASI DAN NON IRADIASI
Oleh :
KENCHI TANTRADWITIYA
F24052589
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
HEMOLISIS ERITROSIT IN VITRO SERTA KAPASITAS ANTIOKSIDAN PEPES IKAN MAS IRADIASI DAN NON IRADIASI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh :
KENCHI TANTRADWITIYA F24052589
Dilahirkan pada tanggal 27 Februari 1987 di Semarang
Tanggal lulus :
Menyetujui, Bogor, 2009
Prof. Dr.Ir Fransisca Rungkat-Zakaria Msc. Zubaidah Irawati PhD. Dosen Pembimbing I Dosen pembimbing II
Mengetahui,
Dr. Ir. Dahrul Syah, M.Sc
Kenchi Tantradwitiya. F24052589. Erythrocytes Hemolysis In Vitro and Antioxidant Capacity in Irradiation and Non Irradiation Gold Fish Pepes. Under supervision of Prof. Dr.Ir Fransisca Rungkat-Zakaria Msc. and Zubaidah Irawati PhD.
ABSTRACT
A variety methods of food preservation have been developed to produce products with maximum storage period, such as drying, pasteurisation, sterilisation, and canning. Those methods need high temperature processing, that can cause degradation of food nutritions, for example protein and vitamine. Those methods also can cause organopleptic quality alteration in foods, like colour, taste, and aroma. Irradiation method is alternative of food preservation method that is done by exposing food with controling ionisation radiation certain interval time to attain the definite purpose. This method does not apply high temperature, but, in fact, many people still doubt about the safety of irradiation products may cause negative effect for human health. The aim of this research is definite the safety of irradiation fish pepes by observing free radical activity in irradiated pepes product in vitro by erythrocyte hemolysis and antioxidant capacity.
This research can be devided into four steps; samples preparation consisting ofthe making of irradiation gold fish pepes extract, chemical analysis (DPPH assay), the hemolysis rate of erythrocytes measurement, and statistic testing with ANOVA methode.
The hemolysis rate of erythrocytes in vitro and antioxidant capacity measurments of irradiated gold fish pepes indicated that samples with period of storage more than 12 month (November 11th 2006 pepes and June 14th 2007 pepes) have higher hemolysis rate of erythrocytes and lower antioxidant capacity than samples with storage period less than 12 month (April 5th 2008 pepes and No Label pepes).
The antioxidant capacity of November 11th 2006 Rell Ion pepes is 21.06%, and the hemolysis rate of erythrocytes is 129.14%. The antioxidant capacity of November 14th 2007 Dipa pepes is 20.42%, and the hemolysis rate of erythrocytes is 125.11%. The antioxidant capacity of April 5th 2008 pepes is 31.91%, and the hemolysis rate of erythrocytes is 114.20%. The antioxidant capacity of No Label pepes is 33.83%, and the hemolysis rate of erythrocytes is 114.20%. The antioxidant capacity of control pepes is 15.53%, and the hemolysis rate of erythrocytes is 95.96%. The influence of sample dilution in this research is tended to increase the rate hemolysis of erythroctes.
Based on statistic test ANOVA method, control pepes is not real different with irradiated pepes. In addition, there were no difference at 0.05 invariance of interval..
Kenchi Tantradwitiya. F24052589. Hemolisis Eritrosit In Vitro Serta Kapasitas Antioksidan Pepes Ikan Mas Iradiasi Dan Non Iradiasi. Dibawah bimbingan Prof. Dr. Ir Fransisca Zakaria Rungkat dan Dr. Ir Zubaidah Irawati.
RINGKASAN
Berbagai metode pengawetan pangan telah banyak dikembangkan untuk menghasilkan suatu produk dengan daya simpan yang maksimum, misalnya pengeringan, pasteurisasi, sterilisasi, dan pengalengan. Metode-metode tersebut membutuhkan suhu yang tinggi dalam prosesnya sehingga dapat mengakibatkan destruksi nutrisi-nutrisi penting yang terkandung dalam bahan pangan, seperti protein dan vitamin. Selain itu hal ini juga dapat menyebabkan perubahan kualitas organoleptik pada bahan pangan, seperti timbulnya perubahan warna, rasa, dan aroma.
Teknik iradiasi merupakan alternatif metode pengawetan yang dilakukan dengan mengekspos bahan pangan baik yang dikemas maupun yang tidak terhadap sejumlah radiasi ionisasi yang terkontrol dalam waktu tertentu untuk mencapai tujuan yang diinginkan.. Produk yang dihasilkan dari proses iradiasi ini diharapkan adalah produk yang steril. Akan tetapi masih diragukan keamanan dari produk-produk iradiasi karena dikhawatirkan proses tersebut dapat menimbulkan pengaruh negatif terhadap kesehatan manusia seperti terbentuknya radikal-radikal bebas atau pangan yang menjadi bersifat radioaktif yang dapat mempengaruhi kondisi tubuh manusia
Penelitian ini bertujuan untuk menentukan keamanan produk pepes ikan mas iradiasi dengan melihat masih ada tidaknya aktivitas radikal bebas pada produk pepes ikan mas iradiasi secara in vitro (aktivitas hemolisis eritrosit) serta kapasitas antioksidan pada produk pepes ikan mas iradiasi. Secara garis besar, penelitian ini dapat dibagi mejadi berberapa tahap, yaitu tahap persiapan yang meliputi tahap pembuatan ekstrak sampel pepes ikan mas radiasi dan non iradiasi serta isolasi sel eritrosit, tahap uji analisis kimia uji antioksidan DPPH, tahap pengujian hemolisis eritrosit terhadap penambahan ekstrak pepes ikan mas iradiasi dan non iradiasi serta analisis sidik ragam
Pengujian aktivitas penghambatan hemolisis yang dilakukan secara in vitro
serta pengukuran kapasitas antioksidan pada sampel pepes ikan mas iradiasi menunjukkan bahwa sampel dengan masa simpan lebih besar dari 12 bulan (pepes 11 November 2006 dan pepes 14 Juni 2007) memiliki persentase hemolisis eritrosit yang lebih besar serta kapasitas antioksidan yang lebih rendah apabila dibandingkan terhadap sampel dengan masa simpan kurang dari 12 bulan (sampel pepes No Label dan sampel pepes 5 April 2008).
Pengaruh pengenceran yang dilakukan terhadap masing-masing sampel pepes ikan mas iradiasi dan pepes kontrol cenderung memicu terjadinya proses hemolisis pada sel eritrosit Berdasarkan uji stastistik metode ANOVA, sampel pepes kontrol ternyata tidak berbeda nyata terhadap sampel pepes yang mengalami perlakuan iradiasi. Selain itu juga didapat hubungan bahwa antar sampel pepes yang diiradiasi dengan bervariasi tanggal penyinaran ternyata juga tidak berbeda secara nyata pada selang 0.05
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 27 Februari 1987 di Semarang. Penulis adalah putra dari pasangan Tan Linggo Sapto dan Ibu Hesti Kusumawati dan merupakan anak kedua dari tiga bersaudara.
Penulis menempuh pendidikan sekolah dasar di SD PL Bernardus Semarang pada tahun 1993-1999, pendidikan sekolah menengah pertama di SMP PL Domenico Savio Semarang pada tahun 1999-2002, dan pendidikan sekolah menengah atas di SMA Kolese Loyola Semarang pada tahun 2002-2005. Pada tahun 2005, penulis melanjutkan pendidikan di Institut Pertanian Bogor pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian yang diterima melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru).
Selama kuliah di Departemen Ilmu dan Teknologi Pangan, penulis terlibat dalam Himpunan Mahasiswa Ilmu dan Teknologi Pangan (HIMITEPA), dan Keluarga Mahasiswa Buddhis Institut Pertanian Bogor (KMB-IPB). Penulis terlibat dalam beberapa kepanitian dan berapa kompetisi penulisan Program Kreativitas Mahasiswa. Berbagai pengalaman kerja juga telah diperoleh penulis, baik sebagai asisten praktikum Kimia Dasar dan Biologi Dasar untuk mahasiswa TPB, asisten praktikum Teknologi Pengolahan Pangan.
KATA PENGANTAR
Syukur dan terimakasih saya panjatkan kepada Tuhan Yang Maha Esa karena penulis dapat menyelesaikan skripsi yang berjudul Uji Toksisitas Hemolisis Eritrosit In Vitro Serta Pengukuran Kapasitas Antioksidan Pada Ekstrak Pepes Ikan Mas Iradiasi. Tulisan ini merupakan laporan penelitian yang telah dilakukan penulis di Laboratorium Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor.
Penulisan skripsi ini tidak terlepas dari bantuan banyak pihak. Oleh karena itu, penulis ingin menyampaikan terima kasih yang sebesar-besarnya kepada: 1. Prof. Dr. Ir Fransisca Zakaria Rungkat selaku dosen pembimbing akademik
yang telah memberi bimbingan, bantuan, serta nasehat kepada penulis selama perkuliahan, penelitian, dan penyelesaian tugas akhir.
2. Zubaidah Irawati PhD. selaku dosen pembimbing kedua yang telah membimbing penulis dalam pelaksanaan penelitian dan penulisan.
3. Pihak PATIR BATAN yang telah memberikan kesempatan untuk ikut terlibat dalam proyek penelitian.
4. Ibu Waysima, selaku dosen yang telah membantu kelancaran studi serta memberikan semangat kepada penulis selama menempuh pendidikan di Departemen Ilmu dan Teknologi Pangan
5. Seluruh Staf pengajar di Departemen Ilmu dan Teknologi Pangan IPB yang telah membagi ilmunya kepada penulis, semoga ilmu yang diberikan menjadi ilmu yang bermanfaat.
6. Semua teknisi dan laboran Departemen ITP: Pak Wahid, Pak Gatot, Pak Rojak, Pak Sobirin, Bu Rubiah, Mas Edi, Pak Iyas, terima kasih atas bantuan, saran, dan kerja samanya selama penulis melakukan penelitian.
7. Keluargaku tercinta: Mama, Papa dan Kakak dan Adik Lisa Tanika dan Alexandra Tri Tantya yang selalu memberikan doa, kasih sayang, nasihat, dan motivasi tiada henti
9. Tuti, Sisi, Vero, Stela, Waisak, Suhendri, Glenn, Tere, Cath, Ola, Dion, Adi L, Marcel, Irene, Rheiner, Belinda, Epink, Wiwik, Chaca, Tjan, Melisa, Abi dan semua Warga PERWIRA atas kebersamaanya.
10.Arya, Dewi, Sobur, Harist, Yuni, Galih Ika, dan teman-teman pengguna Lab. Biokimia. Terimakasih atas suka-dukanya.
11.Teman-teman ITP 42, terima kasih atas kebersamaannya selama menjalani kuliah dan praktikum di Departemen ITP.
12.Keluarga besar TPG/ ITP angkatan 40, 41, 42, 43, 44 atas kebersamaannya selama ini. Semoga persahabatan kita tidak akan pernah hilang.
13.Sahabat-sahabatku ”KMB-IPB”. Terima kasih selalu mau berbagi kebersamaan, keceriaan, kesedihan, serta terima kasih untuk tiap doa kesuksesannya.
14.Teman di Kos Pondok Joglo : Olive, Ester, Dimitri, Bi Uket terima kasih atas semangat dan bantuannya
Akhir kata penulis menyadari bahwa skripsi ini masih jauh sempurna dan perlu banyak masukan serta saran. Penulis juga berharap agar skripsi ini dapat bermanfaat bagi seluruh pihak yang membutuhkan dan terhadap pengembangan ilmu dan teknologi khususnya dalam bidang llmu dan teknologi pangan.
Bogor, Mei 2009
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR GAMBAR ... vi
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... ix
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN ... 2
C. MANFAAT PENELITIAN ... 3
II. TINJAUAN PUSTAKA ... 4
A. Ikan Mas ... 4
B. Pepes ... 5
C. Pembuatan Pepes Ikan Mas Iradiasi ... 5
D. Iradiasi ... 6
E. Pangan Iradiasi ... 8
F. Toksikologi Iradiasi ... 9
G. Radikal Bebas... 10
H. Antioksidan ... 12
I. Komponen Bioaktif Rempah-Rempah Pepes Ikan Mas... 14
J. Eritrosit ... 16
K. Hemolisis Eritrosit ... 17
III.METODE PENELITIAN ... 21
A. ALAT DAN BAHAN ... 21
B. METODE ... 21
a.Tahap Persiapan ... 22
1. Ekstraksi Sampel dengan Pelarut Aquades ... 22
2. Isolasi Eritrosit Manusia ... 23
c. Analisis Kapasitas Antioksidan ... 25
d.Analisis Sidik Ragam Nilai Absorbansi Pada Pengujian Hemolisis Eritrosit Pepes Ikan Mas Iradiasi ... 26
IV.HASIL DAN PEMBAHASAN ... 27
A. Ekstraksi ... 27
B. Kapasitas Antioksidan (Metode DPPH)... 28
C. Pengaruh Penambahan Ekstrak Pepes terhadap Hemolisis Eritrosit.. ... 32
a.Respon Hemolisis Eritrosit terhadap Sampel Ekstrak Pepes pada Pengenceran 1x ... 34
b.Respon Hemolisis Eritrosit terhadap Sampel Ekstrak Pepes pada Pengenceran 2x dan 4x... 38
c.Respon Hemolisis Eritrosit Terhadap Ekstrak Sampel Pepes 11 November 2006 dengan Variasi Pengenceran ... 43
d.Respon Hemolisis Eritrosit Terhadap Ekstrak Sampel Pepes 14 Juni 2007 dengan Variasi Pengenceran... 44
e.Respon Hemolisis Eritrosit Terhadap Ekstrak Sampel Pepes 5 April 2008 dengan Variasi Pengenceran ... 46
f.Respon Hemolisis Eritrosit Terhadap Ekstrak Sampel No Label dengan Variasi Pengenceran ... 47
g.Respon Hemolisis Eritrosit Terhadap Ekstrak Sampel Pepes Kontrol dengan Variasi Pengenceran ... 49
h.Pengujian Aktifitas Hemolisis Eritrosit pada Sampel Pepes Ikan Mas dengan Menggunakan Metode Triphan Blue ... 51
D. Analisis Sidik Ragam Nilai Absorbansi Pada Pengujian Hemolisis Eritrosit Pepes Ikan Mas Iradiasi ... 54
V. KESIMPULAN DAN SARAN ... 55
A. KESIMPULAN ... 55
B. SARAN ... 56
DAFTAR PUSTAKA ... 57
DAFTAR TABEL
DAFTAR GAMBAR
Halaman Gambar 1. Pepes Ikan Mas Iradiasi dalam Kemasan. ... 6 Gambar 2. Eritrosit, Trombosit, dan Leukosit ... 16 Gambar 3. Struktur Hemoglobin ... 17 Gambar 4. Kerusakan Membran Sel Darah Merah yang Menyebabkan
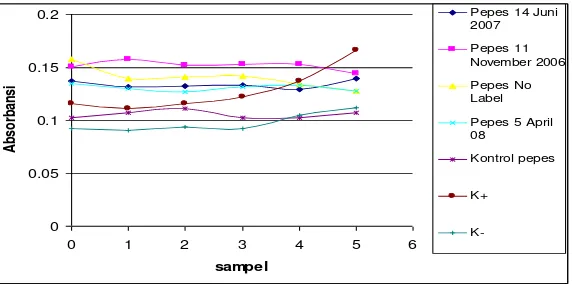
Hemolisis ... 18 Gambar 5. Pemisahan Sel Darah Manusia ... 23 Gambar 6. Kapasitas Antioksidan Sampel per Pengenceran ... 28 Gambar 7. Hubungan Absorbansi dan Waktu Pengamatan pada Sampel
Pengenceran 1x ... 34 Gambar 8. Persentase Hemolisis Eritrosit pada Berbagai Jenis Sampel
Pepes ... 35 Gambar 9. Rata-Rata enam Nilai Absorbansi Hemolisis
pada Pengenceran 1x ... 37 Gambar 10. Rata-Rata Nilai Absorbansi Hemolisis Ulangan I
Pengenceran 1x ... 37 Gambar 11. Rata-Rata Nilai Absorbansi Hemolisis Ulangan II
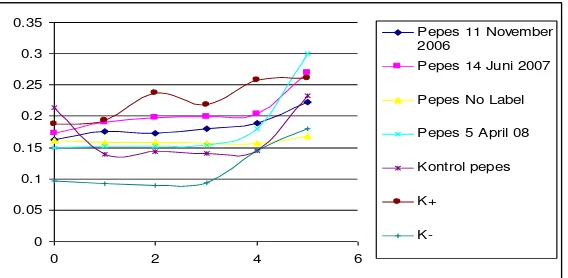
Pengenceran 1x ... 37 Gambar 12. Hubungan Absorbansi dan Waktu Pengamatan pada Sampel
Pengenceran 2x ... 39 Gambar 13. Hubungan Absorbansi dan Waktu Pengamatan pada Sampel
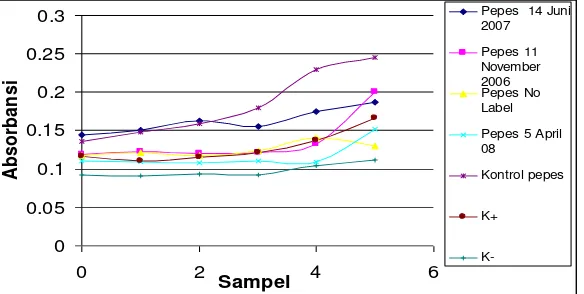
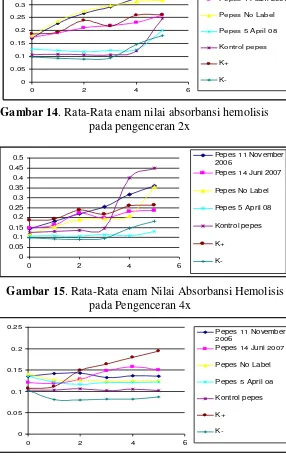
Pengenceran 4x ... 39 Gambar 14. Rata-Rata enam Nilai Absorbansi Hemolisis
pada Pengenceran 2x ... 41 Gambar 15. Rata-Rata enam Nilai Absorbansi Hemolisis
pada Pengenceran 4x ... 41 Gambar 16. Rata-Rata Nilai Absorbansi Hemolisis Ulangan I
Pengenceran 2x ... 41 Gambar 17. Rata-Rata Nilai Absorbansi Hemolisis Ulangan II
Gambar 18. Rata-Rata Nilai Absorbansi Hemolisis Ulangan I
Pengenceran 4x ... 42 Gambar 19. Rata-Rata Nilai Absorbansi Hemolisis Ulangan II
Pengenceran 4x ... 42 Gambar 20. Persentase Hemolisis pada Sampel Pepes 11 November 2006 . 43 Gambar 21. Persentase Hemolisis pada Sampel Pepes 14 Juni 2007 ... 45 Gambar 22. Persentase Hemolisis pada Sampel Pepes 5 April 2008 ... 46 Gambar 23. Persentase Hemolisis pada Sampel Pepes No Label ... 48 Gambar 24. Persentase Hemolisis pada Sampel Pepes Kontrol ... 50 Gambar 25. Jumlah Sel Eritrosit pada Pengamatan Jam ke-5 ... 52 Gambar 26. Jumlah dan Penampakan Sel Eritrosit pada Pengamatan Jam
DAFTAR LAMPIRAN
Halaman Lampiran 1. Perhitungan Kurva Standar Pengukuran Kapasitas Anti
I. PENDAHULUAN
A. LATAR BELAKANG
Perkembangan zaman menuntut keanekaragaman pangan, di mana pangan merupakan kebutuhan mendasar dalam kehidupan manusia. Variasi pangan olahan semakin diminati masyarakat karena mampu mencegah kejenuhan akan jenis pangan yang umumnya dikonsumsi. Sedikit mengubah proses pengolahan pangan akan diperoleh produk dengan jenis lain. Pengolahan pangan sendiri selain bertujuan menghasilkan produk yang lebih bervariasi, juga bertujuan memperpanjang umur simpan dari bahan yang diolah.
Ikan merupakan salah satu bahan pangan alami yang banyak mengandung protein sehingga sering dijadikan sebagai salah satu bahan pangan utama dalam pemenuhan gizi manusia. Daging ini lebih disukai masyarakat kebanyakan karena rasanya yang lebih lezat apabila dibandingkan dengan sumber protein yang berasal dari nabati. Daging ikan juga memiliki asam amino esensial yang lengkap dan seimbang juga berberapa jenis vitamin dan mineral.
Kandungan gizi dalam daging secara umum yang terbesar adalah protein, yaitu sebesar 15-20% dari berat total bahan. Dengan keadaan seperti ini bahan pangan tersebut sangat rentan terhadap pertumbuhan mikroba. Hal ini menyebabkan daging dikategorikan sebagai produk hi-risk. Dengan kata lain diperlukan penanganan khusus dalam pengolahannya, termasuk di dalamnya suhu dan mutu daging tersebut.
juga dapat menyebabkan perubahan kualitas organoleptik pada bahan pangan, seperti timbulnya perubahan warna, rasa, dan aroma.
Teknik iradiasi merupakan alternatif metode pengawetan yang dilakukan dengan mengekspos bahan pangan baik yang dikemas maupun yang tidak terhadap sejumlah radiasi pengion yang terkontrol dalam waktu tertentu untuk mencapai tujuan yang diinginkan. Produk yang dihasilkan dari proses iradiasi ini diharapkan adalah produk yang steril.
Akan tetapi pada kenyataannya, masih banyak masyarakat awam yang meragukan keamanan dari produk-produk iradiasi karena dikhawatirkan proses tersebut dapat menimbulkan pengaruh negatif terhadap kesehatan manusia seperti terbentuknya radikal-radikal bebas yang dapat mempengaruhi kondisi tubuh manusia. Umumnya pengujian aktivitas komponen suatu senyawa dalam bahan pangan dapat memberikan data positif atau negatif berkaitan dengan interaksinya secara in vitro dan in vivo. Hal positif yang dimaksud di sini dapat berarti aktivitasnya dalam memperkuat fungsi-fungsi tubuh, sedangkan hasil negatif sendiri berarti adanya kemungkinan komponen tersebut mengakibatkan kerusakan seperti toksik bagi sel-sel dalam tubuh. Dalam penelitian ini akan dilakukan uji toksisitas secara in vitro hemolisis eritrosit dan uji antioksidan DPPH pada sampel pepes ikan mas yang telah diawetkan menggunakan metode iradiasi.
B. TUJUAN PENELITIAN
Penelitian ini bertujuan untuk menentukan keamanan produk pepes ikan mas iradiasi dengan menguji masih ada tidaknya aktivitas radikal bebas pada produk pepes ikan mas iradiasi secara in vitro, yaitu hemolisis eritrosit serta kapasitas antioksidan pada produk pepes ikan mas iradiasi.
C MANFAAT PENELITIAN
II. TINJAUAN PUSTAKA
A. Ikan Mas
Ikan mas (Cyprinus carpio Linn.) merupakan spesies yang paling banyak dibudidayakan di Indonesia dan ditemukan pada pertengahan abad ke-19 dan baru dikembangkan pada abad ke-20 Ikan mas mempunyai ciri-ciri badan yang memanjang sedikit pipih ke samping (compressed), mulut dapat disembulkan, dan terletak di ujung tengah (terminal), mempunyai dua pasang sungut, sisik yang relatif besar yang tergolong tipe cycloid, mempunyai garis rusuk lengkap dan berada pada pertengahan sirip ekor (Susanto, 1993).
Ikan mas merupakan salah satu bahan pangan yang mempunyai nilai gizi tinggi dan sangat dibutuhkan oleh manusia. Menurut Okada (1990), berdasarkan komposisi kimia protein dan lemak, ikan dibagi menjadi empat golongan, yaitu:
1. Lemak rendah (<5%) dan protein tinggi (>15%) 2. Lemak sedang (5-15%) dan protein tinggi (>15%) 3. Lemak tinggi (>15%) dan protein rendah (<15%) 4. Lemak rendah (<5%) dan protein rendah (<15%)
B. Pepes
Pepes merupakan salah satu makanan daerah atau etnis yang terkenal di berbagai daerah di Indonesia. Pepes ini biasanya dibuat dengan menggunakan bahan dasar ikan mas di Jawa Barat. Sedangkan di wilayah lain, pepes juga dapat dibuat dengan bahan dasar ikan laut seperti ikan makarel. Selain itu, pepes merupakan suatu cara mengolah bahan makanan (biasanya untuk ikan) dengan bantuan daun pisang untuk membungkus ikan beserta bumbunya. Bumbu yang dipadukan dalam pembuatan pepes ini merupakan rempah-rempah seperti tomat, bawang putih, kunyit, jahe, daun sereh, lemon, sereh, dan daun salam (Irawati et al, 2000).
Cara membuatnya secara tradisional adalah bumbu dan rempah dihaluskan dan ditambah daun kemangi, tomat, dan cabai dibalur atau dibalut bersama ikan mas yang sudah dibersihkan. kemudian dibungkus dengan daun pisang. Bungkusan ini lalu dikukus dengan waktu lebih dari satu jam atau dipresto.
C. Pembuatan Pepes Ikan Mas Iradiasi
Menurut Irawati et al (2000), pepes ikan mas iradiasi dibuat melalui tahap-tahap sebagai berikut: pertama, ikan mas dibersihkan dengan cara dikeluarkan isi perutnya, kemudian dicuci dengan menggunakan air yang telah dicampur lemon dan garam selama 15 menit. Ikan kemudian dicuci kembali menggunakan air dan segera diasinkan dengan menggunakan bumbu seperti bawang putih, kunyit, jahe, daun sereh, lemon, daun jeruk, dan daun salam selama 2 jam. Setelah itu, ikan dibungkus menggunakan daun pisang dan diproses panas menggunakan Inoxpran pressure cooker
Gambar 1. Pepes ikan mas iradiasi dalam kemasan
Proses iradiasi dilakukan dengan menggunakan sinar gamma melalui iradiator IRKA di National Nuclear Energy Agency, Pasar Jumat, Jakarta. Cobalt 60 digunakan sebagai sumber radiasi pengion dengan laju dosis rata-rata 5.2 kGy/jam. Radiochromic FW-60 digunakan sebagai kalibrasi dosimeter, sedangkan perspex dosimeters digunakan untuk menentukan dosis yang terserap. Pepes ikan mas diiradiasi dengan dosis minumum 45 kGy di dalam dry ice. Dosis sterilitas ditentukan dengan mengacu pada metode AAMI (Association for the Advancement of Medical Instrumentation) ISO/DIS 11137.2 berdasarkan bioburden. Setelah dosis sterilitas tercapai, pepes ikan mas iradiasi disimpan pada suhu ruang.
Tabel 1. Karakteristik Pepes Ikan Mas Iradiasi
Produk Durasi
(Bulan)
Kadar air (%)
Kadar Protein (%)
Kadar lemak (%)
pH
Pepes 0 57.39 15.25 31.19 6.25
6 57.20 15.35 32.25 5.95
12 56.90 15.16 30.16 5.75
18 56.40 15.15 29.85 5.25
Irawati, et al (2000)
D. Iradiasi
Radiasi pengion dapat berupa suatu partikel bermuatan berenergi seperti elektron, atau foton berenergi tinggi, seperti sinar x atau sinar gamma (Diehl, 1990).
Menurut Maha (1985), iradiasi adalah suatu teknik yang digunakan untuk pemakaian energi radiasi secara sengaja dan terarah. Sedangkan menurut Winarno et al, (1997), iradiasi adalah teknik penggunaan energi untuk penyinaran bahan dengan menggunakan sumber radiasi buatan.
Apabila suatu zat dilalui oleh radiasi pengion, energi yang melewatinya akan diserap dan menghasilkan pasangan ion. Energi yang diserap oleh tumbukan radiasi pengion dengan partikel bahan pangan akan menyebabkan eksitasi dan ionisasi beribu-ribu atom dalam lintasannya yang terjadi dalam waktu kurang dari 0.001 deik.
Dua jenis radiasi pengion yang umum digunakan untuk pengawetan makanan adalah :
a. Sinar gamma
Dipancarkan oleh radio nuklida 60Co dan 137Cs. Keduanya merupakan gelombang elektromagnetik dengan panjang gelobang pendek.
b Berkas Elektron
Dihasilkan oleh mesin pemercepat elektron yang terdiri dari partikel-partikel bermuatan listrik.
Goresline (1964) mengelompokkan dosis iradiasi yang digunakan untuk bahan makanan berdasarkan tujuan pengawetan sebagai berikut: a. Dosis rendah, Radurisation (0.4-10 kGy)
Pemakaian dosis ini bertujuan untuk menghambat pertumbuhan tunas pada berbagai jenis umbi-umbian serta untuk membunuh serangga perusak makanan
b. Dosis sedang, Radicidation (2-8 kGy)
c. Dosis tinggi, Radappertisation (25-45kGy)
Pemakaian dosis tinggi ini bertujuan untuk sterilisasi guna membunuh semua mikroba termasuk virus. Umumnya diaplikasikan pada produk daging agar tetap awet selama jangka penyimpanan pada kondisi normal.
Dosis iradiasi adalah jumlah energi radiasi yang diserap bahan pangan dan merupakan faktor kritis pada iradiasi pangan. Untuk setiap jenis pangan dibutuhkan dosis khusus sehingga diperoleh hasil yang diinginkan (Diehl, 1990)
E. Pangan Iradiasi
Bahan pangan merupakan materi yang mudah rusak (perishable). Dengan sifat yang mudah rusak, maka bahan pangan mempunyai masa simpan yang terbatas. Bermacam-macam teknik pengawetan dan pengolahan bahan pangan dilakukan untuk memperpanjang marketable life komoditas hasil pertanian di antaranya pengeringan, pembekuan, penggunaan bahan kimia dan iradiasi.
Tujuan pengawetan pangan adalah untuk menghambat atau mencegah terjadinya kerusakan pangan, mempertahankan kualitas bahan, menghindarkan terjadinya keracunan dan mempermudah penanganan serta penyimpanan. Bahan pangan yang awet mempunyai nilai yang lebih tinggi karena terjadinya kerusakan dapat diperkecil. Namun demikian, metode pengawetan tidak selalu dapat mempertahankan kualitas asal bahan pangan atau kandungan gizi dari komoditas yang diawetkan.
Metode iradiasi telah disetujui oleh tiga badan dunia yaitu The Joint Expert Committee on Wholesomeness of Irradiation Foods (JECWIF) yang mewakili WHO, IAEA dan FAO tahun 1981 setelah menelaah data-data makanan yang diiradiasi sampai dosis rata-rata 1 Mrad, sehat untuk dikonsumsi. Selanjutnya Codex Allimentarius Comunission dari FAO mengesahkan kesimpulan yang dikeluarkan JECWIF.
Oleh karena itu, perlu diinformasikan mengenai aplikasi iradiasi dalam teknik pengawetan pangan dan pengaruhnya terhadap keamanan dan mutu pangan yang merupakan masalah yang banyak mendapat perhatian dan menimbulkan kesalahpahaman. Penelitian yang dilakukan oleh Al-Bachir (2007) membuktikan bahwa radiasi menggunakan sinar gamma dengan dosis 2, 4, dan 6 kGy dapat digunakan untuk mengontrol Total Plate Count
pada daging unta serta dapat meningkatkan umur simpan dari dua bulan menjadi lebih dari enam bulan. Iradiasi gamma tidak menyebabkan perubahan kualitas karakteristik daging unta.
F. Toksikologi Iradiasi
Iradiasi tidak menyebabkan pangan menjadi bersifat radioaktif, seperti halnya pada alat pendeteksi bagasi atau barang di airport tidak menjadikan bagasi atau barang tersebut bersifat radioaktif. Selain itu, juga tidak menyebabkan perubahan konponen kimia menjadi komponen yang berbahaya. Proses iradiasi ini memang dapat menyebabkan kehilangan sejumlah komponen nutrisi, namun tidak lebih dari metode pengolahan lainnya seperti halnya pemasakan, pengalengan, atau aplikasi pasteurisasi. Agar pangan yang diiradiasi tidak tercampur dengan pangan non iradiasi, maka pangan iradiasi disyaratkan menggunakan label radura agar dapat dibedakan (FDA Consumer Magazine, 2000).
diiradiasi dengan dosis hingga batas 10 kGy tidak memerlukan pemeriksaan toksikologi (Eale, 1998).
Bradley et al (1968) menginkubasi akar Vicia favia dalam larutan sukrosa 2% yang telah diiradiasi dengan dosis 20 kGy. Inkubasi dilakukan selama empat jam pada pH 3-7.5 serta 24 jam pada larutan pH 6.5. Penelitian tersebut menghasilkan peningkatan anafase abnormal hanya pada larutan yang memiliki pH rendah. Peningkatan tersebut disebabkan oleh larutan sukrosa telah diiradiasi pada dosis yang lebih tinggi dari kontrol.
Vijayalaxmi (1980) melakukan iradiasi pada media kultur sel limfosit dengan dosis lebih dari 20 kGy. Media yang diiradiasi tersebut dibagi menjadi dua perlakuan, yaitu penggunaan langsung pada sel limfosit atau penyimpanan media selama 12 bulan.sebelum digunakan. Hasil penelitian tersebut menunjukkan bahwa tidak ada efek mutagenik yang ditemukan pada sel limfosit pada kedua macam media tersebut.
G. Radikal Bebas
Radikal bebas memiliki reaktifitas yang tinggi. Hal ini ditunjukkan oleh sifatnya yang segera menarik atau menyerang elektron disekelilingnya. Senyawa radikal bebas juga dapat mengubah suatu molekul menjadi suati radikal bebas.
Sadikin (2001) berpendapat bahwa serangan radikal bebas terhadap molekul disekelilingnya akan menyebabkan terjadinya reaksi berantai, yang kemudian menghasilkan senyawa radikal baru. Dampak reaktifitas senyawa radikal bebas bermacam-macam, mulai dari kerusakan sel atau jaringan, penyakit autoimun, penyakit degeneratif hingga kanker. Berbagai kemungkinan dapat terjadi sebagai akibat kerja radikal bebas, misal gangguan fungsi sel, kerusakan struktur sel, molekul termodifikasi yang tidak dapat dikenali oleh sistem imun, dan bahkan mutasi.
Senyawa radikal bebas di dalam tubuh dapat merusak asam lemah tak jenuh ganda pada membran sel. Akibatnya, dinding sel menjadi rapuh. Senyawa oksigen reaktif ini juga mampu merusak bagian dalam pembuluh darah sehingga meningkatkan pengendapan kolesterol dan menimbulkan arterosklerosis (Enstenbauer, et al, 1991). Senyawa radikal bebas ini juga berpotensi merusak DNA sehingga mengacaukan sistem info genetika, dan berlanjut pada pembentukan sel kanker (Halliwell and Guteridge, 1991). Jaringan lipid juga akan dirusak oleh senyawa radikal bebas sehingga terbentuk peroksida yang memicu munculnya penyakit degeneratif. Diplock (1991) berpendapat bahwa kerusakan molekul protein oleh senyawa oksigen reaktif akan meninbulkan penyakit katarak.
Supari (1996) berpendapat bahwa pada dasarnya radikal bebas terbentuk melalui dua cara, yaitu secara endogen (sebagai respon normal proses biokimia intrasel maupun ekstrasel) dan secara eksogen (misal dari polusi, makanan, serta injeksi ataupun absorpsi pada kulit). Belleville-Nabet (1996) menunjukkan berberapa reaksi pembentukkan senyawa oksigen reaktif. Teraktifasinya oksigen dapat menyebabkan terbentuknya radikal bebas oksigen, yang disebut anion superoksida (O2.). Secara in vitro
kompleks, antara lain adanya sifat permukaan membran, muatan listrik, sifat pengikatan makromolekul, dan bagian enzim, substrat, maupun katalisator. Senyawa kompleks ini dapat terjadi pada berbagai sel yang masih normal maupun tidak normal atau telah teraktivasi.
H Antioksidan
Koschar dan Russell (1990) mendefinisikan antioksidan sebagai senyawa berberat molekul rendah yang bereaksi dengan oksidan sehingga tidak menimbulkan reaksi yang membahayakan. Antioksidan bersifat dapat menunda, memperlambat, dan mencegah proses oksidasi sehingga antioksidan memiliki peranan yang sangat penting dalam memerangi radikal bebas.
Secara umum, antioksidan dikelompokkan menjadi dua yaitu antioksidan enzimatis dan non-enzimatis. Antioksidan enzimatis misalnya enzim superoksida dismutase (SOD), katalase, dan glutation peroksidase. Antioksidan non-enzimatis masih dibagi menjadi dua kelompok lagi.
a. Antioksidan larut lemak seperti tokoferol, karotenoid, flavonoid, quinon, dan bilirubin.
b. Antioksidan larut air seperti asam askorbat, asam urat, protein pengikat logam, dan protein pengikat heme.
radikal bebas baru, atau mengubah radikal bebas yang telah terbentuk menjadi molekul yang kurang reaktif.
Antioksidan sekunder disebut juga antioksidan eksogenus atau non-enzimatis. Antioksidan kelompok ini juga disebut sistem pertahanan preventif. Dalam sistem pertahanan ini, terbentuknya senyawa oksigen reaktif dihambat dengan cara pengkelatan metal atau dirusak pembentukannya. (Belleville-Nabet, 1996). Antioksidan non-enzimatis dapat berupa komponen non-nutrisi dan komponen nutrisi dari sayuran dan buah-buahan. Kerja dari antioksidan non-enzimatis yaitu dengan cara memotong reaksi berantai dari radikal bebas atau dengan cara menangkapnya. Akibatnya, radikal bebas tidak bereaksi dengan komponen seluler (Lampe, 1999). Menurut Soewoto (2001) dan Lampe (1999), antioksidan sekunder meliputi vitamin E, vitamin C, -karoten, flavonoid, asam urat, bilirubin, dan albumin.
Kelompok antioksidan tersier meliputi sistem enzim DNA-repair dan mentionin sulfoksida reduktase. Enzim-enzim ini berfungsi dalam perbaikan biomolekuler yang rusak akibat reaktivitas radikal bebas.
Antioksidan sintetik atau alami digunakan secara luas dalam nutrisi dan obat untuk memperlambat proses penuaan alami. Antioksidan ini juga berfungsi untuk mencegah atau memperlambat penyakit yang diakibatkan kerusakan sel. Terdapat ratusan jenis antioksidan nutrisional seperti vitamin, koenzim, selenium, mineral, hormon, karotenoid, terpenoid, flavonoid, fenol nonflavonoid, polifenol, dan ester-esternya (asam ellagat, asam sitrat, asam galat, asam salisilat, asam sinamat, dan asam klorogenat). Antioksidan fenolik umumnya merupakan antioksidan primer (Koschar dan Russell, 1990).
Reaksi yang cepat dari radikal DPPH dapat terjadi dengan berberapa polifenol, termasuk tokoferol, tetapi reaksi sekunder yang lambat dapat menyebabkan penurunan yang progresif pada nilai absorbansi. Oleh sebab itu, keadaan tetap (steady state) mungkin tidak tercapai pada berberapa saat lamanya. Berberapa laporan mengatakan bahwa aktifitas pencegahan terjadi setelah 15 menit hingga 30 menit (Gordon, 1992)
I. Komponen Bioaktif Rempah-Rempah Pepes Ikan Mas
Pepes adalah produk olahan daging (unggas atau ikan) dengan menambahkan rempah bumbu pada daging dan dikemas dengan menggunakan daun pisang. Rempah atau bumbu yang digunakan dalam pembuatan pepes ikan mas adalah bawang putih, kunyit, jahe, daun sereh, lemon, lemon grass, dan bay leaves (Irawati et al (2000) . Berikut ini adalah informasi komponen bioaktif yang terdapat pada masing-masing rempah atau bumbu pada pembuatan pepes ikan mas:
1. Bawang Putih
Bawang putih (Allium sativum Linn.) termasuk salah satu rempah-rempah yang telah terbukti dapat menghambat pertumbuhan mikroorganisme. Komponen bawang putih yang telah terbukti dapat menghambat mikroba adalah alisin atau asam diallil tiosulfinat. Daya antimikroba tinggi yang dimiliki bawang putih dikarenakan kandungan alisin yang tinggi dan senyawa sulfida lain yang terjandung dalam minyak atsiri bawang putih (Whitmore dan Naidu, 2000). Daya antimikroba inilah yang membuatnya berpotensi dijadikan sebagai pengawet bahan pangan. Komponen bioaktif lainnya adalah alliin, gurwithrays, scordinin, dan ajoene (Soetomo, 1987).
2. Kunyit
senyawa fenolik lainnya. Fungsi lain dari kurkumin adalah sebagai antioksidan, antiinflamasi, efek pencegah kanker serta menurunkan risiko serangan jantung (anonim, 2006).
3. Jahe
Komponen bioaktif yang terdapat pada jahe meliputi minyak atsiri dan oleoresin. Minyak atsiri jahe merupakan komponen pemberi aroma yang khas, sedangkan oleoresin merupakan pemberi rasa pedas dan pahit. Komponen utama minyak atsiri jahe adalah zingiberen dan
zingiberol. Secara umum oleoresin jahe tersusun oleh komponen-komponen sebagai berikut: gingerol dan zingeron, shagaol, minyak atsiri, dan resin (Koswara, 1995). Jahe juga termasuk jenis rempah yang berpotensi memiliki aktifitas antioksidan dan antikanker yang tinggi (Darwis et al, 1991). Kikuzaki dan Nakatani (2000) juga meyakini dalam jahe terkandung sejumlah senyawa fenolik yang bersifat antioksidan.
4. Lemon
Buah jeruk lemon (Citrus medica Var. Lemon) berbentuk bulat telur dan pada ujungnya terdapat sebuah tonjolan. Buah ini banyak mengandung vitamin C yang dapat berfungsi sebagai antioksidan (Sarwono, 1991).
5. Lengkuas
Lengkuas termasuk dalam famili Zingiberaceae, dan memiliki nama lain Alpinia galanga (L.) Swartz. Hasil penelitian yang dilakukan oleh Rahayu (1999) menunjukkan bahwa minyak atsiri lengkuas mengandung 29 komponen dengan komponen utama 8-pinen, 1,8-sineol, farnasen, isokariofen, dan asetokavikol asetat. Komponen minyak tersebut diketahui bersifat antimikroba. Ekstrak air lengkuas diperkirakan mengandung senyawa fenolik seperti asam fenolat, turunan dehidrosinamat dan flavonoid (Duke, 1994).
6. Cabe Merah
Cabe memiliki rasa pedas, yang disebabkan oleh kandungan
homodihidrocapcaisin terdapat dalam konsentrasi sangat kecil. Selain itu pada cabe merah terdapat karotenoid (capsanthin, capsorubin, carotene, dan lutein), lemak (9-17%), protein (12-15%), vitamin A, vitamin C, dan sejumlah kecil minyak volatil (Lukmana, 1994).
7. Daun Salam
Daun salam (Syzygium polyanthum) mengandung minyak atsiri (nerolidol, farnesol, lonalool, aldehida, pinen), tanin, flavonoid, alkaloid, saponin, dan steroid. Senyawa fenolik, flavonoid, minyak atsiri, terpena, asam organik tertentu, dan alkaloid tanaman mempunya aktivitas antimikroba (Syamsuhidayat, 1991).
J. Eritrosit
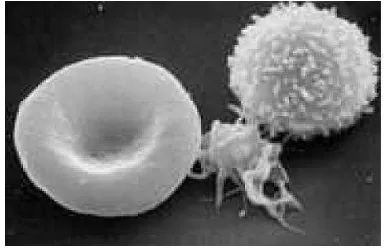
[image:39.595.246.439.533.657.2]Sel darah merah atau eritrosit adalah sel yang paling banyak terdapat pada plasma darah. Sebanyak 5 juta sel darah merah terkandung dalam darah manusia per milliliter, dan sebanyak 25x 1012 sel darah merah bersirkulasi dalam tubuh manusia (Hopson dan Wessells, 1990). Eritrosit ini berisi hemoglobin dan membawa oksigen dari paru-paru ke seluruh tubuh. Sel ini berbentuk lempeng bikonkaf yang meningkatkan area permukaan sel sehingga memudahkan difusi oksigen dan karbon dioksida. Diameter eritrosit kira-kira 8.0 m, dengan ketebalan hingga 2.6 m pada bagian yang paling tebal dan kurang lebih 1.1 m pada bagian tengah (Buhler, 2000).
Pada dasarnya, ketika sel darah merah telah mencapai batas akhir masa hidupnya, sekitar 120 hari, akan terjadi hemolisis secara alami. Proses ini diawali dengan menurunnya volume sel hingga 13%, meningkatnya sensitivitas membran sel karena faktor stress, menurunnya deformabilitas, dan beberapa perubahan pada daya adhesi, dan transport membran (Bartosz, 1990). Eritrosit yang telah dewasa, selain tidak mengandung nukleus, ribosom, dan mitokondria, juga telah kehilangan kemampuan untuk mensintesis protein dan metabolisme aerobik. Selain itu eritrosit yang telah dewasa juga telah kehilangan kemampuannya untuk mensintesis membran yang baru (Weiss et.al, 1977).
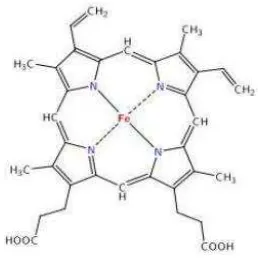
[image:40.595.262.391.462.591.2]Hemoglobin, pigmen merah yang membawa oksigen dalam eritrosit, merupakan suatu protein yang mempunyai berat molekul 64.450 dan terdiri dari empat subunit, di mana masing-masing subunit mengandung satu bagian heme yang berkonjugasi dengan suatu polipeptida. Heme adalah suatu derifat porifirin yang mengandung Fe2+ yang dapat mengikat oksigen. Hemoglobin bertanggungjawab untuk mengikat dan mengangkut oksigen di dalam darah. Sekitar 300 juta hemoglobin terkandung dalam sitoplasma pada setiap sel darah merah (Hopson dan Wessells, 1990)
Gambar 3. Struktur hemoglobin (Dickerson dan Geis, 1983)
radikal bebas larut lemak yang terdapat di membran eritrosit (Qin Yan Zhu
et al, 2002).
K. Hemolisis Eritrosit
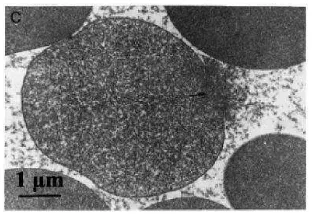
Hemolisis berasal dari bahasa Yunani, “hemo” yang berarti darah dan “lysis” yang berarti pecah atau terbuka. Sehingga dapat diungkapkan bahwa hemolisis adalah pecahnya sel darah merah dan keluarnya hemoglobin ke plasma. Sebuah penelitian yang dilakukan oleh Niki, et al.
[image:41.595.247.403.410.517.2](1988) mengenai hemolisis eritrosit menunjukkan dengan jelas perubahan yang terjadi pada membran sel ketika hemolisis terjadi. Membran sel darah merah yang terdiri dari protein dan lipid akan rusak dan akhirnya pecah sehingga mengeluarkan berbagai senyawa yang ada di dalamya seperti hemoglobin, ion-ion, dan beberapa jenis enzim. Hemoglobin inlah yang akan memberikan warna merah pada larutan sel darah merah yang mengalami hemolisis. Kerusakan sel darah merah pada saat hemolisis dapat dilihat pada Gambar 4.
Gambar 4. Kerusakan membran sel darah merah yang menyebabkan hemolisis (Niki, et al. 1988).
Parameter-parameter yang penting dan dapat digunakan untuk mendeteksi kerusakan akibat toksik pada membran eritrosit antara lain hemolisis, kehilangan ion potasium, autooksidasi membran lipid, perubahan fluiditas eritrosit, perubahan bentuk membran, pengendapan protein membran, dan perubahan rasio volume terhadap luas permukaan membran sel (Luke et al, 1987).
merupakan dasar dan konstituen permanen bagi membran seluler. Membran-membran seluler ini terbentuk dalam lapisan bilayer di mana senyawa makromolekul protein seperti reseptor, pembawa spesifik, dan enzim dimasukkan. Pada sistem biologis, PUFA merupakan komponen esensial dari biomembran, yang bersifat sangat rentan terhadap peroksidasi. Kerusakan oksidatif pada eritrosit dapat dicegah oleh enzim antioksidan seperti superoksida dismutase (SOD), glutation peroksidase, dan katalase.
Eritrosit, seperti sel-sel lainnya, mengerut dalam larutan yang mempunyai tekanan osmotik lebih besar dari tekanan osmotik plasma normal. Dalam larutan yang memiliki tekanan osmotik lebih rendah, eritrosit akan membengkak, berbentuk bulat, dan tidak berbentuk cakram lagi, kemudian mengalami hemolisis. Eritrosit juga dapat mengalami lisis karena pengaruh obat dan infeksi (Ganong, 1990).
Pada dasarnya, ketika sel darah merah telah mencapai batas akhir masa hidupnya, sekitar 120 hari, akan terjadi hemolisis secara alami. Proses ini diawali dengan menurunnya volume sel hingga 13%, meningkatnya sensitivitas membran sel karena faktor stress, menurunnya deformabilitas, dan beberapa perubahan pada daya adesi, dan transpor membran (Bartosz, 1990). Tidak terdapat perubahan morfologi yang signifikan pada sel eritrosit yang telah tua. Namun sel ini umumnya tidak mampu lagi mempertahankan hemoglobin pada keadaan fungsionalnya (Weiss, 1977). Keadaan ini nantinya akan menuju kepada hemolisis sel darah merah. Hemolisis pada sel darah merah dapat dipicu dengan keberadaan senyawa pengoksidasi seperti aldehid, H2O2, maupun aloksan. Kerusakan oksidatif pada eritrosit
berasal dari perkebunan di Indonesia dapat meningkatkan sistem pertahanan tubuh secara enzimatis terhadap serangan radikal bebas.
Tersedianya vitamin E dan senyawa antioksidan lainnya dalam plasma darah dapat mengurangi terjadinya kerusakan oksidatif pada eritrosit. Kekurangan senyawa antioksidan dapat menyebabkan terjadinya proses oksidasi yang tinggi, atau terjadinya beberapa kelainan pada darah seperti β - thalasemia, sickle cell anemia, dan defisiensi glukosa-6-fosfat dehidrogenase yang dapat meningkatkan kecenderungan eritrosit terhadap peroksidasi (Zhu, et al, 2002).
Pengujian aktivitas antihemolisis pada sel darah merah dapat dilakukan dengan penambahan larutan pengoksidasi seperti H2O2,
senyawa-senyawa aldehid seperti formaldehid, asetaldehid, atau glutaraldehid dan juga aloksan (Rose dan Gyorgy, 1950). H2O2 dapat dihasilkan dari proses
perubahan radikal O2- (superoksida) yang dihasilkan dari kerja enzim superoksida dismutase (SOD) yang terdapat pada membran eritrosit. H2O2
yang terbentuk nantinya akan diubah menjadi air oleh enzim katalase dan glutation peroksidase. Hidrogen peroksida sendiri merupakan oksidator yang tidak terlalu berbahaya, akan tetapi kehadiran ion logam transisi seperti besi, yang diubah menjadi bentuk ferric oleh radikal O2-, dapat bereaksi dengan H2O2 menghasilkan radikal hidroksil yang sangat reaktif
(Yoshikawa, et al. 1997).
.Penambahan H2O2 dalam suspensi eritrosit diketahui mampu
mempercepat hemolisis. Peroksidasi lipid yang terukur melalui reaksi
thiobarbituric acid, terjadi selama 60 menit setelah penambahan H2O2.
Hal ini menunjukkan bahwa H2O2 hanya berfungsi sebagai inisiator bagi
reaksi peroksidasi. H2O2 bekerja dengan jalan menginduksi terjadinya
peroksidasi lipid pada membran sel yang akan menyebabkan reaksi berantai peroksidasi pada membran sel dan akhirnya menyebabkan hemolisis (Younkin, et al. 1971).
III. BAHAN DAN METODE
A. ALAT DAN BAHAN
Alat-alat yang digunakan dalam penelitian ini meliputi alat untuk ekstraksi dan persiapan sampel, yaitu mortar, kain saring, kertas saring
Whatman 01, tabung sentrifuse, sentrifuse, alat-alat gelas, tabung eppendorf, syringe, membran steril 0.22 m. Alat-alat yang digunakan untuk isolasi sel eritrosit dan inkubasi sel adalah tabung vacutainer steril, sentrifuse CR412, tabung sentrifuse steril 15 ml disposible, mikropipet 100 l dan 1000 l, mikrotip, hemasitometer (Bright-line), mikroskop (Olympus CH 20), lempeng mikrokultur (96 well), laminar flow hood, inkubator VWR
Scientific (CO2 5%, 37C), dan Spectrophotometer Microplate Reader
(Bio-rad model 550). Alat-alat yang digunakan untuk analisis antioksidan adalah spektrofotometer, kuvet, tabung reaksi, mikropipet, vorteks, pipet volumetrik, sentrifuse CR412, dan tabung sentrifuse steril 15 ml disposible
(Nunc).
Bahan utama yang digunakan adalah pepes ikan mas iradiasi dengan berbagai macam tanggal penyinaran, yaitu pepes 11 November 2006 (A), pepes 14 Juni 2007 (B), pepes 5 April 2008 (C), pepes No Label (D), dan kontrol pepes non iradiasi (KP). Bahan kimia yang dipakai untuk ekstraksi adalah air. Bahan-bahan yang digunakan untuk isolasi sel eritrosit kultur sel adalah darah dari donor yang sehat, aquades, aquabides, biru triphan, dan PBS (Phospat Buffer Saline). Bahan-bahan kimia yang digunakan untuk pengujian sel darah metah adalah PBS (Phospat Buffer Saline), H2O2 0.5.
Bahan kimia yang digunakan untuk analisis antioksidan adalah DPPH
(2,2-diphenyl-1-picrylhydrazil) segar, metanol, asam askorbat, dan larutan buffer asetat (campuran Na-asetat dan asam asetat).
B. METODE
DPPH), tahap pengujian hemolisis eritrosit terhadap penambahan ekstrak pepes ikan mas iradiasi dan analisis sidik ragam nilai absorbansi pada pengujian hemolisis eritrosit pepes ikan mas iradiasi.
a. Tahap Persiapan
1. Ekstraksi Sampel dengan Pelarut Aquades
Ekstraksi sampel pepes ikan mas iradiasi dilakukan dengan menggunakan aquades. Bagian sampel yang diekstrak adalah daging pepes yang telah dibersihkan dari tulang dan rempah penutup pepes. Masing-masing jenis sampel pepes mengalami prosedur pengekstrakan yang sama.
Sebanyak 20 gram daging pepes beku, dithawing, kemudian ditimbang. Kemudian ditambahkan pelarut aquades sebanyak 20 ml (1:1 v/v) dan dilumatkan hingga rata dengan menggunakan mortar. Sampel kemudian disaring dengan menggunakan kain saring sehingga didapatkan ekstrak sampel kasar (mengandung partikel-partikel yang besar) yang kemudian ditempatkan di dalam tabung sentrifuse. Ekstrak sampel kasar disentrifuse dengan kecepatan 3500 rpm selama 30 menit untuk memisahkan fraksi padatan dan fraksi cair. Supernatan yang diperoleh kemudian disaring kembali dengan menggunakan kertas saring Whatman untuk memisahkan kemungkinan partikel atau molekul yang tidak terendapkan saat proses sentrifuse berlangsung. Hasil saringan dari kertas saring kemudian disterlisasi dingin dengan menggunakan membran steril (0.22 m) untuk memisahan kemungkinan adanya mikroba yang mengkontaminasi selama tahap persiapan sampel. Sampai pada tahap ini didapatkan ekstrak sampel pepes ikan mas iradiasi dalam kondisi steril.
2. Isolasi Eritrosit Manusia (Nike, et al. (1988) dan Zhu (2002)
Pengambilan darah dilakukan di Klinik Farfa, Dramaga Bogor oleh seorang dokter. Sumber darah yang digunakan berasal dari darah mahasiswa sehat dari Institut Pertanian Bogor. Darah diambil sebanyak 6 ml dan ditempatkan dalam vacutainer steril yang berisi EDTA 0.1%. Fungsi EDTA 0.1% adalah sebagai antikoagulan darah. Darah tersebut kemudian dipindahkan ke dalam tabung sentrifuse secara aseptis di dalam laminar hood untuk mencegah terjadinya kontaminasi yang dapat berasal dari udara ruangan atau pekerja.
[image:47.595.240.411.418.555.2]Darah disentrifuse dengan kecepatan 1500 rpm selama 10 menit. Akibat dari perlakuan ini adalah terbentuknya tiga lapisan dalam tabung sentrifuse. Lapisan teratas adalah plasma yang berwarna kuning. Lapisan di bawahnya adalah buffycoat yang tersusun atas leukosit dan platelet. Lapisan terakhir, berada pada posisi terbawah adalah eritrosit yang menyusun 45% dari total volume darah. Plasma dan buffycoat kemudian dipisahkan dari eritosit.
Gambar 5. Pemisahan sel darah manusia
Eritrosit yang mengendap di dalam tabung di”aspire” kemudian dicuci dengan menggunakan larutan PBS (phospat buffer saline). Perbandingan eritrosit dan PBS yang digunakan adalah 1 ml eritrosit dicuci dengan 5 ml PBS. Pencucian dilakukan dengan cara sentrifugasi dengan kecepatan 2000 rpm selama 10 menit. Pencucian dilakukan sebanyak tiga kali hingga larutan PBS hampir tidak berwarna dan jernih.
Plasma
Buffycoat
Penghitungan jumlah eritrosit dilakukan dengan metode pewarnaan biru triphan menggunakan hemacytometer. Sebelum dilakukan penghitungan, terlebih dahulu dilakukan pengenceran pada darah untuk memudahkan penghitungan sel eritrosit. Pengenceran dilakukan sebanyak 100 kali, yaitu sebanyak 500 l eritrosit diambil, ditambahkan 49.5 ml PBS sehingga didapat volume darah sebanyak 50ml. Kemudian sebanyak 20 l suspensi eritrosit diambil, ditambahkan biru triphan sebanyak 20 l, diaduk dengan mikropipet, kemudian sel dihitung menggunakan mikroskop pada perbesaran 400x. Jumlah sel eritrosit yang hidup harus di atas 95% dengan konsentrasi sel 2x108 sel/ml agar dapat digunakan untuk uji (Zhu, et al, 2002).
Rumus penghitungan eritrosit menggunakan hemacytometer yaitu: N = A x FP x 104 sel/ml
Dimana :
N = Jumlah sel eritrosit
A = Jumlah sel hidup dalam 16 kotak FP = Faktor pengenceran
b. Pengujian Hemolisis Eritrosit Akibat Penambahan Ekstrak Pepes Ikan Mas Iradiasi (Qin Yan Zhu, 2002)
Supensi sel eritrosit yang hidup di atas 95% dengan konsentrasi sel 2x108 sel/ml disiapkan. Suspensi sel tersebut kemidian ditambahkan ke dalam tabung eppendorf sebanyak 800 l. Kemudian ke dalam masing-masing tabung eppendorf ditambahkan pula ekstrak sampel sebanyak 200 l. Masing-masing jenis ekstrak yang telah disiapkan terdiri dari tiga konsentrasi pengenceran , yaitu pengenceran 1x, pengenceran 2x, dan pengenceran 4x dan masing-masing dilakukan pengulangan sebanyak tiga kali (triplo). Pada pengujian menggunakan eritrosit ini juga terdapat kontrol positif dan kontrol negatif. Kontrol positif terdiri atas 800 l darah dan 200 l H2O2,
Tabung eppendorf yang telah terisi kemudian diinkubasi pada inkubator bersuhu 37C, 5% CO2 hingga waktu pengamatan.
Pengamatan dilakukan pada jam ke-0 sampai pada jam ke-5.
Pada tiap waktu pengamatan, tabung eppendorf diambil dan disentrifuse dengan kecepatan 2000 rpm selama 5 menit untuk mengendapkan sel darah merah. Sebanyak 100 l supernatan diambil dan dimasukkan ke dalam 96-well plate lalu diukur absorbansinya menggunakan spectrophotometer microplate reader pada panjang gelombang 450 nm. Setiap 1 jam dari jam ke-0 hingga jam ke-5, tabung eppendorf tersebut diambil dan diperlakukan seperti perlakuan tersebut diatas. Pada jam ke-5 jumlah sel yang hidup dihitung dengan metode pewarnaan biru trifan.
% Hemolisis = .
Keterangan:
Abs Kontrol (-) : Aborbansi suspensi eritrosit + PBS
Abs Sampel : Absorbansi suspensi eritrosit + hasil ekstraksi sampel pepes
c. Analisis Kapasitas Antioksidan (Kubo et al, 2002)
Analisis kapasitas antioksidan dilakukan dengan menggunakan metode DPPH. Sebanyak 4 ml buffer asetat dicampur dengan 7.50 ml metanol dan 400 l larutan DPPH. Campuran kemudian divorteks. Setelah itu ditambahkan 100 l sampel atau larutan standar. Larutan kemudian divorteks dan didiamkan selama 20 menit di ryang gelap. Aborbasnsi diukur pada panjang gelombang 517 nm. Kontrol negatif yang digunakan adalah metanol, sedangkan kontrol positif yang digunakan adalah asam askorbat dengan konsentrasi 0, 50, 100, 250, 500, dan 1000 ppm Kapasitas antioksidan diperoleh dengan menggunakan perhitungan sebagai berikut:
% 100 . .
.
x atif KontrolNeg Abs
Kapasitas antioksidan (%) =
d. Analisis Sidik Ragam Nilai Absorbansi Pada Pengujian Hemolisis Eritrosit Pepes Ikan Mas Iradiasi
Analisis sidik ragam ini dilakukan dengan Metode Anova. Analisis dilakukan dengan cara memasukkan nilai-nilai aborbansi sampel pepes yang telah didapat ke dalam program SPSS. Melalui program ini, data absorbansi masing-masing akan diolah sehingga nantinya akan diperoleh hubungan antar sampel pada suatu selang kepercayaan.
100 )
( ) (
x Akontrol
Asampel Akontrol
IV. HASIL DAN PEMBAHASAN
A. Ekstraksi
Sampel pepes dalam keadaan beku dithawing pada suhu ruang. Sampel pepes ikan mas non iradiasi memiliki daging dengan tekstur agak keras dan berwarna putih. Sampel pepes ikan mas iradiasi memiliki daging dengan tekstur lebih lunak dan warna lebih gelap karena telah mengalami proses pembekuan pada suhu -79ºC selama iradiasi. Ekstraksi sampel pepes ikan mas iradiasi dan pepes kontrol (non iradiasi) dilakukan dalam keadaan basah, artinya sampel tidak mengalami proses pengeringan terlebih dahulu. Tahap ekstraksi dilakukan dengan menggunakan aquades. Ekstraksi dilakukan pada daging sampel pepes yang telah terlebih dahulu dipisahkan dari balutan rempah yang membungkusnya. Hal ini dilakukan untuk melihat sejauh mana senyawa antioksidan yang terdapat pada rempah-rempah dapat berpenetrasi ke dalam daging sampel dan memberikan pengaruhnya untuk melindungi komponen-komponen daging dari senyawa radikal bebas yang terbentuk. Ekstraksi dilakukan terhadap tiap-tiap jenis sampel dengan perbandingan daging ikan dan aquades adalah 1:1. Tahap Ekstraksi ini dilakukan untuk mendapatkan sari dari daging pepes yang memungkinkan masih mengandung komponen-komponen untuk keperluan analisis.
Hasil ekstrak yang didapat dianggap sebagai ekstrak dengan pengenceran 1x. Kemudian dari ekstrak tersebut dilakukan kembali pengenceran 2x dan 4x. Berikut ini adalah perbandingan volume ekstrak masing-masing sampel pepes dan aquades untuk memperoleh pengenceran yang diinginkan:
Tabel 2. Perbandin