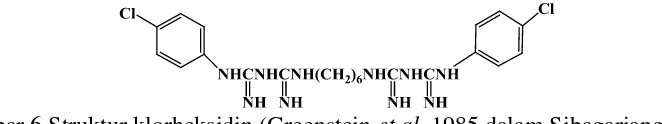MINYAK ATSIRI RIMPANG, BATANG, DAN DAUN TEMU HITAM
(Curcuma aeruginosa Roxb.) SEBAGAI ANTIBAKTERI Streptococcus
mutans DAN PENDEGRADASI BIOFILM PADA GIGI
DEVI YUSNITA S. TAMBUNAN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Minyak Atsiri Rimpang, Batang, dan Daun Temu Hitam (Curcuma aeruginosa Roxb.) sebagai Antibakteri
Streptococcus mutans dan Pendegradasi Biofilm pada Gigi adalah benar karya
saya dengan arahan dari pembimbing dan belum pernah diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Devi Yusnita S. Tambunan
ABSTRAK
DEVI YUSNITA S. TAMBUNAN. Minyak Atsiri Rimpang, Batang, dan Daun Temu Hitam (Curcuma aeruginosa Roxb.) sebagai Antibakteri Streptococcus
mutans dan Pendegradasi Biofilm pada Gigi. Dibimbing oleh IRMANIDA
BATUBARA dan WULAN TRI WAHYUNI.
Rimpang temu hitam banyak digunakan sebagai antibakteri. Penelitian ini membandingkan kemampuan minyak atsiri rimpang, batang, dan daun temu hitam sebagai antibakteri Streptococcus mutans dan pendegradasi biofilm pada gigi menggunakan metode mikrodilusi. Minyak atsiri diisolasi dengan distilasi uap. Potensi antibakteri terbaik adalah minyak rimpang KHM=konsentrasi hambat minimum=15.63 µg/mL dan KBM=konsentrasi bunuh minimum=1000 µg/mL. KHM rimpang sama dengan tetrasiklin. Setelah difraksionasi dengan kolom maupun kromatografi lapis tipis preparatif, KHM dan KBMnya tidak lebih baik. Senyawa 2,2,5-trimetil-2‟(H)-5‟-6‟-dihidropirano[3‟,4‟,g]indan-1-on diduga paling berperan sebagai antibakteri S. mutans. Kemampuan degradasi biofilm minyak atsiri kasar temu hitam kurang kuat. Minyak atsiri batang lebih baik mendegradasi biofilm (IC50=1347 µg/mL) daripada rimpang dan daun. Setelah difraksionasi, beberapa fraksi minyak atsiri rimpang (F1, F2, dan F3) lebih baik kemampuan degradasinya tetapi IC50 lebih tinggi dari klorheksidin.
Kata kunci: antibakteri, minyak atsiri, pendegradasi biofilm, Streptococcus
mutans.
ABSTRACT
DEVI YUSNITA S. TAMBUNAN. Essential Oil of Temu Hitam (Curcuma
aeruginosa Roxb.)„s Rhizomes, Stems, and Leaves as Antibacterial toward
Streptococcus mutans and Biofilm Degradator on Teeth. Supervised by
IRMANIDA BATUBARA and WULAN TRI WAHYUNI.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
MINYAK ATSIRI RIMPANG, BATANG, DAN DAUN TEMU HITAM
(Curcuma aeruginosa Roxb.) SEBAGAI ANTIBAKTERI Streptococcus
mutans DAN PENDEGRADASI BIOFILM PADA GIGI
DEVI YUSNITA S. TAMBUNAN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Minyak Atsiri Rimpang, Batang, dan Daun Temu Hitam (Curcuma
aeruginosa Roxb.) sebagai Antibakteri Streptococcus mutans dan
Pendegradasi Biofilm pada Gigi Nama : Devi Yusnita S Tambunan NIM : G44100011
Disetujui oleh
Dr Irmanida Batubara, MS Pembimbing I
Wulan Tri Wahyuni, SSi, MSi Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PR
AKATA
Saya bersyukur kepada Allah Bapa, karena kasih karuniaNya penulis dapat menyelesaikan tulisan ilmiah berjudul Minyak Atsiri Rimpang, Batang, dan Daun Temu Hitam (Curcuma aeruginosa Roxb.) sebagai Antibakteri Streptococcus
mutans dan Pendegradasi Biofilm pada Gigi. Penelitian ini dilakukan sejak
Desember 2013 hingga Juni 2014.
Penulis mengucapkan terima kasih kepada Dr. Irmanida Batubara MS selaku pembimbing I dan Wulan Tri Wahyuni SSi, MSi selaku pembimbing II atas ilmu, pengalaman, dan arahannya selama penelitian. Penulis juga mengucapkan terima kasih kepada Kementrian Pendidikan dan Kebudayaan Republik Indonesia yang telah membiayai selama kuliah di IPB lewat program Bidikmisi. Penulis mengucapkan terima kasih kepada Bapak L. R Tambunan dan alm. Ibunda J. Sianipar yang menjadi semangat penulis menyelesaikan tulisan ilmiah ini. Penulis juga mengucapkan terima kasih kepada DIKTI untuk bantuan dananya karena penelitian ini merupakan bagian dari Unggulan Strategis Nasional No.77/IT3.11/LT/2014 dengan judul Pakan Unggas Berbahan Fitofarmaka Terstandar Indonesia yang Berkhasiat dalam Menanggulangi Wabah Avian Influenza. Penulis juga mengucapkan terima kasih kepada DIKTI untuk bantuan dana penelitian lewat program Bidikmisi. Ucapan terima kasih juga penulis sampaikan kepada mama B. Sianipar, Bapak J. Pangaribuan, Linda Sianipar, Libur Sianipar, Wira Tambunan, Nola Tambunan, dan Bayu Tambunan atas dukungan doa dan dana selama penulis kuliah dan penelitian. Penulis juga ucapkan terima kasih kepada Imam, Fahmi, Cempaka, Melisa, Vicky, Pak Eman, Pak Dede, Bu Nunung, dan Bu Nunuk untuk masukannya.
Penulis menyadari banyak kekurangan tulisan ilmiah ini. Saran yang membangun, penulis harapkan agar dapat digunakan untuk perbaikan ke depan. Semoga tulisan ini bermanfaat bagi pembaca dan penulis.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan 2
Alat 3
Prosedur 3
Preparasi Sampel 3
Distilasi Minyak Atsiri Temu Hitam 3
Penentuan Eluen Terbaik dengan KLT 3
Fraksionasi dengan Kromatografi Kolom dan KLT Preparatif 3
Uji Antibakteri Minyak Atsiri 3
Uji Kemampuan Degradasi Biofilm 4
Identifikasi senyawa 4
HASIL DAN PEMBAHASAN 5
Kadar Air, Kadar Abu dan Distilat Rimpang, Batang, dan Daun Temu
Hitam 5
Hasil Penentuan Eluen Terbaik, Fraksionasi Minyak Rimpang dengan Kolom, dan Fraksionasi Fraksi 1 Minyak Rimpang dengan KLTP 6
Aktivitas Antibakteri dan Degradator Biofilm Minyak Atsiri dan
Fraksi Temu Hitam 7
Identitas Senyawa Rimpang, Batang, dan Daun Temu Hitam dengan
GC-MS dan NMR 10
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 14
DAFTAR PUSTAKA 14
LAMPIRAN 16
DAFTAR TABEL
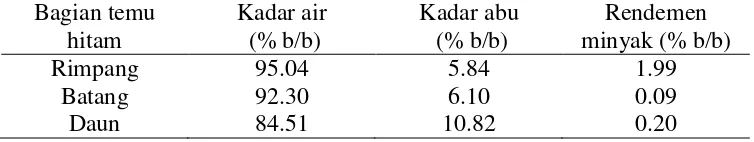
1 Kadar air, kadar abu, dan rendemen minyak atsiri rimpang, batang,
dan daun temu hitam 5
2 Rendemen fraksi minyak rimpang temu hitam hasil fraksionasi 7 3 Aktivitas rimpang, batang dan daun temu hitam sebagai antibakteri S. mutans dan degradasi biofilm pada gigi 9 4 Komponen minyak atsiri temu hitam dan F1 MR hasil analisis
dengan GC-MS 11
5 Geseran kimia sinyal 1H dan 13C NMR F1.2 MR 13
DAFTAR GAMBAR
1 Minyak atsiri batang, rimpang dan daun temu hitam 6
2 Kromatogram penentuan eluen terbaik minyak atsiri rimpang temu hitam dengan berbagai eluen 6
3 Kromatogram fraksi hasil fraksionasi minyak atsiri temu hitam dengan kromatografi kolom 6
4 Bagan pemisahan senyawa pada minyak atsiri temu hitam 7
5 Kromatogram fraksi hasil fraksionasi F1 dengan KLTP 7
6 Struktur klorheksidin 10
7 Struktur senyawa dominan minyak atsiri temu hitam 12
8 Struktur 2,2,5-trimetil-2‟(H)-5‟-6‟-dihidropirano [3‟,4‟,g] indan- 1-on(δ ppm 13C NMR dan 1H NMR) 13
DAFTAR LAMPIRAN
1 Bagan alir penelitian 162 Hasil determinasi tanaman Temu Hitam 17
3 Kadar air rimpang, batang, dan daun Temu Hitam 18
4 Kadar abu rimpang, batang, dan daun Temu Hitam 18
5 Rendemen minyak atsiri Temu Hitam 19
6 Visualisasi degradasi biofilm minyak atsri rimpang, batang, dan daun temu hitam, dan klorheksidin 19
7 Visualisasi degradasi biofilm fraksi minyak atsri rimpang dan fraksi hasil fraksionasi F1 MR dengan KLTP 20
8 Contoh penentuan IC50 (µg/ml) degradator biofilm minyak atsiri batang temu hitam, fraksi minyak astsiri rimpang, dan klorheksidin 20 9 Kromatogram hasil analisis senyawa minyak atsiri GC-MS 22 10 Kromatogram hasil analisis senyawa F1.2 MR menggunakan GC-MS
dan data MS 24
PENDAHULUAN
Gigi yang sehat tidak hanya bermanfaat memperindah penampilan, tetapi juga menjaga kesehatan tubuh. Bakteri gigi dalam jumlah berlebih menyebabkan penyakit gigi maupun penyakit fatal pada tubuh, karena bakteri dapat dialirkan oleh darah ke organ penting dalam tubuh. Tidak rutin membersihkan gigi sehingga terbentuk biofilm yang tebal (plak), dan bakteri berkembang biak melebihi normal merupakan penyebab utama kerusakan gigi (Darmawan 2007). Plak gigi adalah lapisan lunak kumpulan mikroorganisme yang berkembang biak dalam matriks dan melekat kuat pada permukaan gigi yang tidak dibersihkan. Plak gigi merupakan salah satu penyebab terjadinya karies. Karies ialah masalah utama kesehatan gigi dan mulut (Ardani et al. 2010). Bakteri penyebab utama kerusakan gigi akibat terbentuknya biofilm adalah S. mutans. S. mutans mengubah polisakarida ekstraseluler menjadi asam laktat melalui proses homofermentasi sehingga membentuk koloni pada permukaan gigi, bersifat asidogenik, dan sebagai pemicu rusaknya gigi (Sabir 2005). Karies dapat dihambat dengan menghambat pertumbuhan bakteri S. mutans, degradasi biofilm pada gigi, dan menghambat kerja enzim glukosiltransferase (GTF). Enzim GTF digunakan oleh
S. mutans untuk membentuk biofilm pada gigi dengan mengubah glukosa menjadi
glukan (Won et al. 2007).
Pasta gigi dan obat kumur hingga saat ini sudah cukup baik mendegradasi biofilm dan membunuh bakteri pada gigi. Kandungan obat kumur yang berfungsi sebagai antibakteri adalah senyawa fenolik seperti timol, eukaliptol, metil salisilat, dan mentol. Selain itu sering juga digunakan antibakteri kationik kuarterner seperti setilpiridinium klorida (CPC), klorheksidin, dan domifen bromida (Sibagariang 1997 dan Rukayadi dan Hwang 2006). Senyawa klorida, flourida, dan bromida, serta senyawa lain hasil sintesis yang terkandung dalam pasta gigi dan obat kumur jika tertelan melebihi dosis menimbulkan efek samping bagi tubuh.
Hingga saat ini, masyarakat Indonesia telah banyak menggunakan obat herbal. Namun, penggunaannya masih didominasi oleh pengalaman masa lalu dan tidak banyak didukung oleh kajian ilmiah mengenai senyawa pada tanaman tersebut. Oleh sebab itu, penelitian tentang potensi obat herbal perlu ditingkatkan. Obat herbal yang umum digunakan masyarakat Indonesia berasal dari tanaman
curcuma suku Zingiberaceae karena memiliki khasiat dan kegunaan
2
oleh Nugrahaningtyas et al. pada tahun 2005. Ekstrak rimpang C. aeruginosa Roxb memiliki potensi sebagai antibakteri gram positif maupun gram negatif (Philip et al. 2009).
Tumbuhan terdiri dari beberapa bagian seperti, rimpang, batang, dan daun. Bagian-bagian tumbuhan tersebut memiliki fungsi yang berbeda. Hal ini diduga menyebabkan jumlah kandungan setiap bagian tumbuhan tersebut berbeda. Umumnya, bagian temu hitam yang dimanfaatkan masyarakat sebagai obat herbal adalah rimpang sedangkan batang dan daun pemanfaatannya tidak seperti pada rimpang.
Penelitian ini bertujuan mengisolasi minyak atsiri rimpang, batang, dan daun temu hitam, dan mengidentifikasi senyawa yang terdapat di dalamnya, serta menguji aktivitasnya sebagai antibakteri S. mutans dan degradator biofilm pada gigi.
METODE
Penelitian ini dilakukan dengan mengisolasi minyak atsiri temu hitam menggunakan metode distilasi uap. Seluruh minyak atsiri kasar diuji aktivitas antibakterinya terhadap S. mutans dan degradasi biofilmnya dengan metode mikrodilusi, serta diidentifikasi kandungan senyawanya menggunakan GC-MS. Minyak atsiri rimpang difraksionasi dengan kromatografi kolom. Pemilihan eluen terbaik dilakukan menggunakan KLT G60F254. Setiap fraksi kemudian diuji aktivitas antibakterinya terhadap S. mutans dan degradasi biofilmnya. Fraksi 1 minyak atsiri rimpang temu hitam difraksionasi menggunakan KLT Preparatif. Setiap fraksi dikerok dan dilarutkan dengan etil asetat dan kemudian dipekatkan serta diuji aktivitas antibakteri dan degradasi biofilmnya. Senyawa fraksi 1.2 rimpang temu hitam diidentifikasi menggunakan GC-MS dan NMR (Lampiran 1).
Bahan
Bahan yang digunakan adalah rimpang, batang, dan daun temu hitam segar dari kebun Biofarmaka IPB dan telah dideterminasi di Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong-Bogor, akuades,
n-heksana, n-butanol, metanol, dietil eter, asam asetat, diklorometana, etil asetat, aseton, toluena, kloroform, silika gel, metanol, TSB (Tryptic Soy Broth), TSA
3
microtiterplate polystyrene 96 well steril, microplate reader, dan alat gelas
lainnya.
Prosedur
Preparasi Sampel
Rimpang, batang, dan daun temu hitam dicuci bersih dengan air. Kemudian dikeringudarakan dan terhindar dari matahari. Setelah itu, rimpang, batang, dan daun temu hitam diiris hingga halus. Seluruh sampel kemudian dianalisis kadar air dan kadar abunya menggunakan motode AOAC 2006.
Distilasi Minyak Atsiri Temu Hitam (Muchtaridi et al. 2004)
Sebanyak 2 kg rimpang, batang, dan daun temu hitam masing-masing dipotong kecil dan dimasukkan ke distilator uap. Setelah itu sejumlah tertentu akuades (sampel:air = 1:5) ditambahkan ke dalamnya. Distilasi dilakukan pada suhu 100-105°C selama 6 jam. Minyak atsiri yang diperoleh disimpan dalam kulkas untuk dianalisis tahap berikutnya.
Penentuan Eluen Terbaik dengan KLT
Pelat KLT G60F254 ukuran 10×1 cm disiapkan dengan garis start dan finish cm. Minyak atsiri temu hitam teraktif ditotolkan pada pelat KLT dan dikeringkan. Setelah itu, pelat KLT dielusi dalam chamber berisi 10 mL eluen. Eluen telah dijenuhkan selama 30 menit. Eluen tunggal yang digunakan ialah
n-heksana, n-butanol, metanol, dietil eter, asam asetat, diklorometana, etil asetat, aseton, toluena, dan kloroform. Setelah eluen sampai garis finish, pelat dikeluarkan dan dikeringudarakan. Setelah itu, disinari dengan lampu UV (λ=254 dan 366 nm) dan ditentukan jumlah spotnya. Eluen terbaik menghasilkan jumlah spot terbanyak dan terpisah.
Fraksionasi dengan Kromatografi Kolom (Rouessac & Rouessac 2007) dan KLT Preparatif
Kolom yang digunakan adalah silika gel 60 g, diameter 3 cm, dan tinggi 30 cm. Kolom dikemas dengan baik, komponen yang terdapat pada distilat kasar minyak atsiri teraktif (3 g) dipisahkan menggunakan diklorometana. Eluat yang diperoleh ditampung sebanyak setiap 5 mL dalam tabung reaksi. Eluat yang memiliki pola spot yang sama dicampurkan menjadi satu fraksi. Setiap fraksi diuji aktivitas antibakteri dan degradasi biofilmnya. Fraksi teraktif kemudian dipisahkan dengan KLTP dengan diklorometana. Setiap fraksi dikerok dan dilarutkan dalam etil asetat dan diuji aktivitas antibakteri dan degradasi biofilmnya.
Uji Antibakteri Minyak Atsiri (Batubara et al. 2009)
Uji antibakteri pada percobaan ini menggunakan metode mikrodilusi pada
96 well plate dengan medianya ialah TSB. Sebanyak 100 µL sampel (15.63-2000
4
terendah dipilih sebagai KHM (konsentrasi hambat minimum). Sumur yang masih jernih dipipet sebanyak 100 µL ke plate baru dan ditambahkan 100 µL TSB. Kemudian inkubasi selama 24 jam pada suhu 37ºC. Sumur yang jernih dengan konsentrasi terendah ditentukan sebagai KBM (konsentrasi bunuh minimum). DMSO 20% sebagai kontrol negatif dan kontrol positif digunakan tetrasiklin dan obat kumur “X”.
Uji Kemampuan Degradasi Biofilm (O’Toole et al. 1998 dan Ardani et al.
2010)
Metode yang digunakan adalah metode mikrodilusi. Biofilm dibentuk dengan cara 100 µ L saliva dimasukkan ke dalam 96 well plate dan ditambahkan larutan (TSB 100 µl + 3% glukosa) serta 20 µL inokulan bakteri. Selanjutnya diinkubasi selama 24 jam pada suhu 37oC. Setelah biofilm terbentuk, sisa medium dibuang. Setelah itu ditambahkan sebanyak 100 µL sampel (15.625-2000 µg/mL). Klorheksidin sebagai kontrol positif dan DMSO 20% sebagai kontrol negatif. Kemudian diinkubasi selama 24 jam pada suhu 37oC.
Selanjutnya dilakukan pewarnaan biofilm. Biofilm pada dinding sumur dicuci dengan buffer fosfat air steril. Sebanyak 100 µL kristal violet 1% ditambahkan ke dalam sumur dan didiamkan selama 30 menit. Setelah itu dibilas dengan air steril dan kemudian ditambahkan 200 µL etanol 95%. Kemudian diinkubasi selama 45 menit. Sebanyak 100 µL larutan dipindahkan ke microplate
baru. Absorbans larutan pada sumur yang cukup jernih diukur menggunakan
microplate reader (λ=595 nm) dan ditentukan % degradasinya.
% Degradasi
Keterangan:
Asampel = Absorbans (minyak atsiri atau kontrol positif + suspensi bakteri) Ablanko = Absorbans (DMSO 20% + suspensi bakteri)
Identifikasi Senyawa
Identifikasi senyawa dengan GC-MS di Markas Besar Polisi Jakarta Selatan
oleh analis. Minyak atsiri rimpang, batang, dan daun, fraksi 1 hasil fraksionasi kolom minyak atsiri rimpang temu hitam (F1MR), dan fraksi 1.2 minyak atsiri rimpang temu hitam diinjeksikan ke dalam injector GC-MS (GC-MS type Agilent 5873). Kolom yang digunakan HP-5 MS (dimensi 30 m × 0.25 mm x 250 µm). Gas pembawanya adalah He dengan laju alir 20 mL/menit. Suhu injektor yang digunakan adalah 80oC dan suhu detektor 250 oC. Suhu kolom adalah suhu terprogram, suhu awal 80 oC dibiarkan selama 5 menit dan diubah perlahan dengan kenaikan suhu 10oC setiap menitnya hingga dicapai suhu 250oC dan dibuat konstan hingga menit ke-45. Kondisi spektroskopi massa yang digunakan adalah EI 70 eV dengan mode ionisasi EI, arah deteksi 50-1000 m/z. Kemudian puncak yang muncul pada kromatogram ion total diidentifikasi dengan membandingkan spektrum massa dengan library index MS.
Identifikasi Senyawa dengan NMR oleh analis. Senyawa F1.2 MR diidentifikasi
5
HASIL DAN PEMBAHASAN
Kadar Air, Kadar Abu, dan Distilat Rimpang, Batang, dan Daun Temu Hitam
Temu hitam pada penelitian ini dideterminasi di Pusat Penelitian Biologi, LIPI Cibinong-Bogor (Lampiran 2). Kadar air temu hitam digunakan sebagai koreksi perhitungan rendemen minyak atsiri, dan ditentukan berdasarkan bobot basah (Lampiran 3). Kadar air cukup tinggi (Tabel 1) yang menunjukkan masa simpan sampel tidak panjang. Meskipun demikian, distilasi tetap menggunakan sampel segar. Jika digunakan sampel kering, minyak atsiri sampel dapat menguap sebelum didistilasi. Kadar air rimpang temu hitam paling tinggi, kemudian disusul batang dan daun. Kadar abu temu hitam semakin menurun berturut-turut dari daun, batang, ke rimpang (Tabel 1). Kadar abu ini ditentukan berdasarkan bobot kering (Lampiran 4). Rukmana (2004) melaporkan berdasarkan hasil analisis laboratorium Balittro Bogor tahun 1987, bahwa kadar abu rimpang temu hitam asal Bogor (Cimanggu) ialah 4.24%. Perbedaan kadar abu temu hitam dapat disebabkan oleh perbedaan tempat tumbuh, kondisi pertumbuhan, dan musim tanam. Menurut Departemen Kesehatan RI (1987), kadar abu rimpang temu hitam tidak lebih dari 6.10%.
6
Gambar 1 Minyak atsiri batang (a), rimpang (b), dan daun (c) temu hitam
Hasil Fraksionasi Minyak Rimpang Temu Hitam dengan Kolom dan Fraksionasi Fraksi 1 Minyak Rimpang dengan KLTP
Minyak atsiri rimpang merupakan yang teraktif sebagai antibakteri S.
mutans sehingga dipilih untuk difraksionasi dengan kromatografi kolom. Eluen
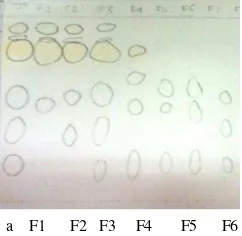
terpilih untuk fraksionasi minyak atsiri rimpang temu hitam ialah diklorometana. Eluen ini menghasilkan noda lebih banyak dan terpisah (Gambar 2).Enam fraksi
(F1 F6 MR) dihasilkan dari kromatografi kolom (Gambar 3). F1 MR yang teraktif sebagai antibakteri S. mutans sehingga difraksionasi lebih lanjut dengan KLTP dan dihasilkan 3 fraksi (F1.1, F1.2, dan F1.3 MR). Rendemen masing-masing fraksi disajikan dalam Tabel 2. Bagan alir pemisahan senyawa minyak atsiri rimpang temu hitam ditunjukkan pada Gambar 4.
Gambar 2 Kromatogram penentuan eluen terbaik minyak atsiri rimpang temu hitam dengan pelarut (a) diklorometana, (b) toluena, (c) kloroform, (d) n-heksana, (e) dietil eter, (f) etil asetat, (g) n-butanol, (h) aseton, (i) asam asetat, dan (j) metanol
Gambar 3 Kromatogram fraksi minyak atsiri temu hitam hasil kromatografi
kolom (F1 F6) dan minyak atsiri rimpang temu hitam (a) dengan diklorometana sebagai eluen
a b c
a b c d e f g h i j
7 Tabel 2 Rendemen fraksi minyak rimpang temu hitam hasil kromatografi kolom
dan KLTP
Sampel Rendemen (%b/b)
Fraksi 1 MR 20.61
Fraksi 2 MR 41.82
Fraksi 3 MR 5.94
Fraksi 4 MR 4.61
Fraksi 5 MR 0.76
Fraksi 6 MR 0.36
Fraksi 1.1 MR 0.66
Fraksi 1.2 MR 41.73
Fraksi 1.3 MR 7.57
Keterangan
MR = minyak atsiri rimpang
Fraksi 1-6 MR = hasil fraksionasi minyak rimpang dengan kolom Fraksi 1.1-1.3 MR = hasil fraksionasi fraksi 1 MR dengan KLTP
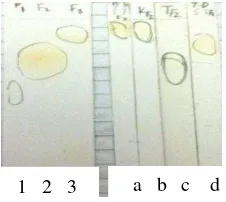
F1.2 MR teraktif sebagai antibakteri S.mutans sehingga diuji lanjut dengan KLT, GC-MS, dan NMR. Elusi F1.2 MR menggunakan KLT dengan variasi beberapa eluen seperti diklorometana, toluena, kloroform, diklorometana-kloroform (3:7), dan diklorometana-toluena (5:5) hanya menghasilkan 1 noda (Gambar 5). Oleh karena itu, diduga terdapat senyawa tunggal pada F1.2 MR.
Gambar 5 Kromatogram (1) Fraksi 1.1 MR, (2) Fraksi 1.2 MR, dan (3) Fraksi 1.3 MR, dan fraksi 1.2 MR temu hitam dengan eluen (a) toluena, (b) kloroform-diklorometana (7:3), (c) toluena-diklorometana (5:5), (d) kloroform
1 2 3 a b c d
Minyak atsiri rimpang temu hitam
Fraksionasi kolom
Fraksi 1 MR Fraksi 2 MR … Fraksi 6 MR
Fraksionasi KLTP
Fraksi 1.1 MR Fraksi 1.2 MR Fraksi 1.3 MR
8
Aktivitas Antibakteri dan Degradator Biofilm Minyak Atsiri dan Fraksi Temu Hitam
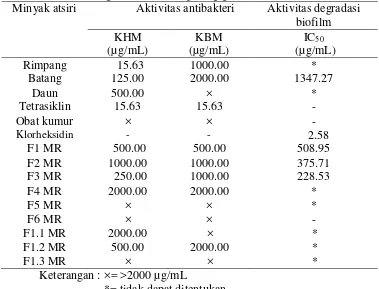
KHM dan KBM minyak atsiri rimpang lebih kecil dari minyak atsiri batang, daun, dan obat kumur (KHM=15.63 µg/mL dan KBM=1000 µg/mL). Namun KHMnya sama dengan tetrasiklin dan KBMnya lebih tinggi dari tetrasiklin (Tabel 3). Hal ini menunjukkan minyak atsiri rimpang temu hitam cukup baik sebagai antibakteri S.mutans.
Setelah minyak atsiri rimpang difraksionasi dengan kolom maupun KLTP tidak lebih baik sebagai antibakteri S. mutans. Minyak atsiri kasar memiliki KHM dan KBM yang lebih kecil dari F1-F6 MR dan F1.1-F1.3 MR. Hal ini diduga disebabkan gabungan senyawa minyak atsiri kasar lebih mampu berdifusi ke dalam dinding sel bakteri jika dibandingkan dengan fraksi yang telah dipisahkan menjadi beberapa bagian. Minyak atsiri kasar tersusun lebih banyak senyawa. Adanya sinergisme antar senyawa minyak atsiri kasar diduga menyebabkan minyak atsiri kasar lebih baik sebagai antibakteri S.mutans daripada fraksinya. Sama halnya seperti yang telah dilaporkan oleh Ardani et al. (2010), saat minyak atsiri cengkeh dan kayu manis dikombinasikan (50:50) dengan konsentrasi masing-masing 0.002% (v/v) menunjukkan peningkatan kemampuannya sebagai antibakteri S.mutans karena adanya sinergisme antar senyawa.
Suatu bahan berpotensi sebagai antibakteri bekerja dengan merusak dinding sel bakteri, menghambat pertumbuhan dinding sel, dan melisiskan membran sel sehingga mempengaruhi permeabilitas membran sitoplasma. Membran sel terbentuk dari protein yang bergabung dengan lapisan bilayer molekul fosfogliserida dengan ujung hidrofobik menghadap ke dalam dan ujung hidrofilik ke luar. Protein tersebut berfungsi sebagai media masuk dan keluar air, ion-ion, dan senyawa. Senyawa minyak atsiri yang bersifat non polar dengan konsentrasi tinggi akan berdifusi dan ditangkap oleh sensor hidrofilik. Hal ini menyebabkan lisisnya membran lipoprotein, sehingga menghambat pertumbuhan dinding sel. Apabila dinding sel pelindung bagi sel rusak, akan menyebabkan matinya sel bakteri (Purwanti 2003). Selain merusak dinding sel, antibakteri dapat juga bekerja melalui penginaktifan enzim tertentu dan penghancuran tempat tumbuh. S.
mutans menghasilkan enzim glukosiltransferase (GTF). GTF dimanfaatkan oleh S.
mutans untuk membentuk lapisan eksopolisakarida (pembentuk biofilm) yang
bermanfaat sebagai tempat berkembang biaknya S.mutans (Sabir 2005, Won et al.
2007). Jika tempat tumbuh S. mutans dirusak pasti pertumbuhannya terhambat. Namun pada penelitian ini tidak dilakukan uji terhadap penginaktifan GTF. Sehingga belum dapat diketahui pasti mekanisme minyak atsiri temu hitam sebagai antibakteri, berperan menghambat pertumbuhan dinding sel dan melisiskan membran sel atau menginaktifkan enzim GTF yang dihasilkan oleh
S.mutans.
9 mampu menghancurkan dan menghilangkan lapisan eksopolisakarida pembentuk biofilm (Ardani et al.2010).
Kemampuan degradasi biofilm minyak atsiri kasar dari paling tinggi hingga paling rendah adalah minyak atsiri batang, daun, dan rimpang. Semakin berkurang warna biru larutan, semakin baik minyak atsiri mendegradasi biofilm (Lampiran 6). Berdasarkan warna larutan pada Lampiran 6 ditentukan nilai IC50 minyak atsiri batang temu hitam sebagai degradator biofilm yaitu 1347.27 µg/mL (Tabel 3). Sementara minyak atsiri daun temu hitam pada konsentrasi 2000 µg/mL hanya dapat mendegradasi biofilm hingga 34.70% dan rimpang temu hitam pada konsentrasi 15.63-2000 µg/mL tidak dapat mendegradasi biofilm dengan baik (warna larutannya tidak berbeda jauh dengan warna DMSO 20%) sehingga tidak dapat ditentukan nilai IC50 minyak atsiri rimpang maupun daun.
Tabel 3 Aktivitas rimpang, batang dan daun temu hitam sebagai antibakteri S.
mutans dan degradator biofilm pada gigi
Minyak atsiri Aktivitas antibakteri Aktivitas degradasi biofilm
10
degradasi biofilm (Lampiran 8) sehingga nilai IC50 masing-masing fraksi tidak dapat ditentukan. Walaupun demikian, F1.2 MR memiliki persen degradasi sebesar 40% pada konsentrasi 2000 µg/mL (Lampiran 7). Minyak atsiri rimpang temu hitam setelah difraksionasi dengan kolom mampu mendegradasi biofilm lebih baik yaitu yang ditunjukkan oleh F1, F2, F3, dan F4 MR.
Klorheksidin banyak dilaporkan sebagai antiplak. Rukayadi dan Hwang (2006) melaporkan klorheksidin mampu menghambat pembentukan biofilm karena mampu membunuh bakteri S. mutans hingga 40% dengan konsentrasi 2.23 mmol/L klorheksidin. Klorheksidin merupakan 4-klorofenil dan 2 bikuanid yang dihubungkan oleh rantai pusat heksametilena C22H30N10Cl2 (Gambar 6) dan digunakan sebagai kontrol positif. Kemampuan degradasi klorheksidin jauh lebih baik daripada minyak atsiri temu hitam dengan IC50 (2.58 µg/mL) (Lampiran 8).
Gambar 6 Struktur klorheksidin (Greenstein et al. 1985 dalam Sibagariang 1997) Pengaplikasian minyak atsiri rimpang temu hitam dalam pasta gigi dan obat kumur sebaiknya menggunakan minyak kasar saja, tidak menggunakan fraksi. Namun masih dibutuhkan uji lebih lanjut mengenai interaksi minyak atsiri dengan bahan pengisi pasta gigi dan obat kumur. Minyak atsiri dan bahan pengisi pasta gigi dan obat kumur bisa saja memiliki interaksi yang tidak baik sehingga mengurangi aktivitas antibakteri minyak atsiri rimpang terhadap S. mutans.
Identitas Senyawa Rimpang, Batang, dan Daun Temu Hitam dengan GC-MS dan NMR
11
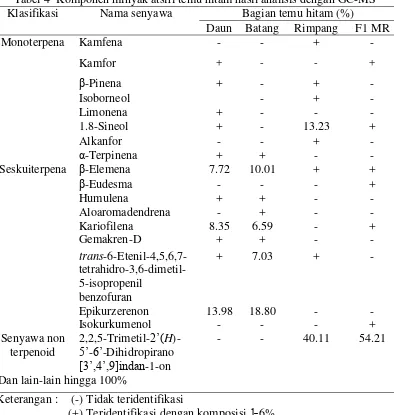
epikurzerenon, β-elemena, trans-benzofuran-6-etenil-4,5,6,7-tetrahidro-3,6-dimetil-5-isopropenil, dan kariofilena. Namun perlu uji lebih lanjut untuk memastikan bahwa senyawa tersebut di atas memiliki aktivitas yang baik sebagai antibakteri S.mutans. β-elemena telah dilaporkan oleh Ardani et al. (2010) memiliki aktivitas sebagai anti bakteri S. mutans. Perbedaan komposisi senyawa minyak atsiri rimpang hasil isolasi pada penelitian ini dengan hasil penelitian sebelumnya (Tabel 4) dapat disebabkan oleh perbedaan tempat tumbuh, waktu penanaman, dan kondisi tumbuh.
F1 MR ialah yang teraktif sebagai antibakteri S. mutans sehingga dianalisis menggunakan GC-MS. Senyawa 2,2,5-trimetil-2‟(H)-5‟-6‟-ihidropirano
[3‟,4‟,g]indan-1-on merupakan senyawa yang dominan dengan komposisi 54.21% (Tabel 4).
Tabel 4 Komponen minyak atsiri temu hitam hasil analisis dengan GC-MS Klasifikasi Nama senyawa Bagian temu hitam (%)
Daun Batang Rimpang F1 MR
Keterangan : (-) Tidak teridentifikasi
12
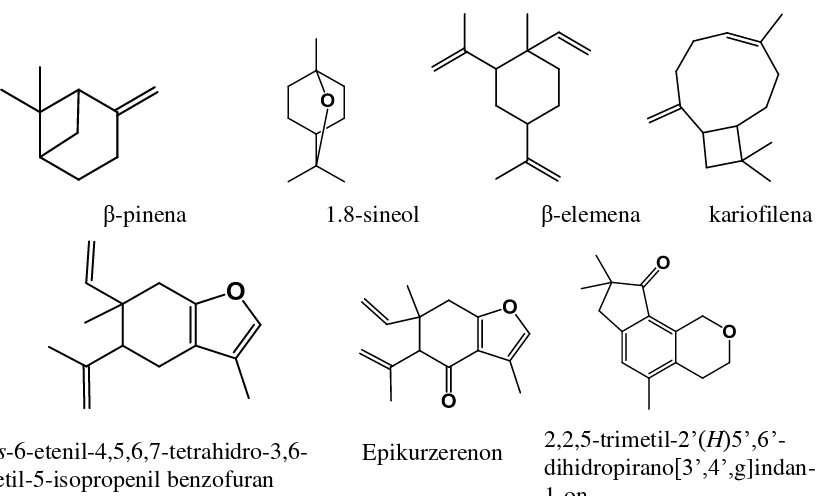
Gambar 7 Struktur senyawa dominan minyak atsiri temu hitam
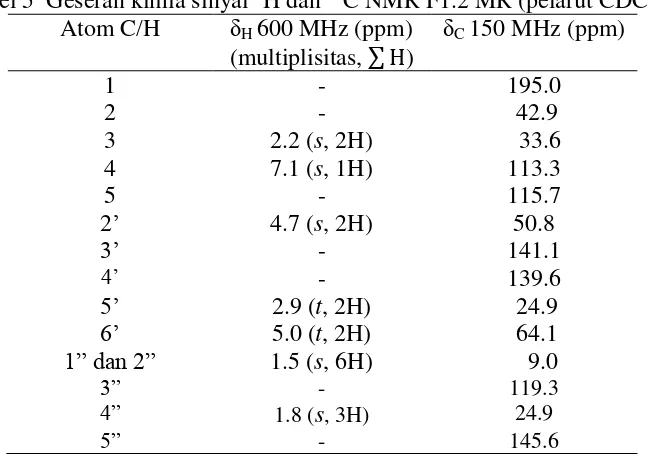
F1.2 MR yang aktif sebagai antibakteri, berdasarkan hasil identifikasi GC-MS, memiliki 1 puncak dominan dengan bobot molekul 230 g/mol (Lampiran 10b). Hasil spektrum 13C NMR (Lampiran 11a) menunjukkan ada 15 karbon. Geseran kimia 195.0 ppm menunjukkan gugus karbonil berupa keton terkonjugasi. Geseran kimia 145.6, 141.1, 139.6, 119.3, 115.7, 113.0 ppm adanya gugus benzena tersubstitusi. Geseran kimia benzena jika tidak tersubstitusi adalah 128.5 ppm (Pavia et al. 2001). Adanya gugus penarik elektron membuat geseran kimia lebih downfield. Geseran kimia 64.1 dan 50.8 ppm menunjukkan adanya gugus C-O (Pavia et al. 2001 dan Supratman 2010). Berdasarkan spektrum 1H NMR terdapat 18 hidrogen pada senyawa tersebut. Geseran kimia 7.1 ppm menunjukkan adanya H yang menempel langsung pada benzena. Geseran kimia 1.5 ppm menunjukkan adanya -CH3. Berdasarkan data tersebut senyawa pada F1.2 MR diduga adalah 2,2,5-trimetil-2‟(H)-5‟,6‟-dihi-dropirano[3‟,4‟-g]indan-1-on (C15H18O2). Geseran kimia atom C dan atom H disajikan di Gambar 8 dan Tabel 5.
Gambar 8 Struktur 2,2,5-trimetil-2‟(H)-5‟-6‟-dihidropirano-[3‟,4‟,g]indan-1-on (δ ppm 13C NMR dan 1H NMR)
β-pinena 1.8-sineol β-elemena kariofilena
trans
-6-etenil-4,5,6,7-tetrahidro-3,6-dimetil-5-isopropenil benzofuran
2,2,5-trimetil-2‟(H)5‟,6‟ -dihidropirano[3‟,4‟, g]indan-1-on
13
Minyak atsiri rimpang, batang, dan daun temu hitam hasil isolasi berwarna cokelat dan berbau khas. Rimpang temu hitam memiliki rendemen paling tinggi (1.99 %). Senyawa dominan minyak rimpang adalah 2,2,5-trimetil-2‟(H)-5‟-6‟
-dihidropirano[3‟,4‟,9]indan-1-on (40.11%) dan 1,8 sineol (13.23%). Senyawa dominan minyak atsiri batang adalah epikurzerenon, β-elemena, trans-benzofuran-6-etenil-4,5,6,7-tetrahidro-3,6-dimetil-5-isopropenil, dan kariofilena. Sementara itu, senyawa dominan minyak atsiri daun adalah epikurzerenon, kariofilena, dan
β-elemena. Minyak atsiri rimpang memiliki potensi antibakteri paling baik dengan KHM dan KBM berturut-turut adalah 15.63 dan 1000 µg/mL. Minyak kasar rimpang lebih kecil nilai KHM dan KBMnya daripada fraksi hasil fraksionsi kolom maupun KLTP. Senyawa dalam minyak atsiri rimpang yang diduga paling berperan sebagai antibakteri S.mutans adalah 2,2,5-trimetil-2‟(H)-5‟-6‟
14
itu, perlu diuji lebih lanjut kelarutan minyak atsiri dalam pasta gigi atau obat kumur.
Saran
Minyak atsiri rimpang, batang, dan daun temu hitam, serta F1, F2, F3, dan F4 MR perlu diuji aktivitasnya terhadap penghambatan kerja enzim glukosiltransferase agar diketahui cara kerja masing-masing minyak atsiri tersebut sebagai antibakteri S. mutans.
DAFTAR PUSTAKA
Agusta A. 2007. Perbandingan Komponen kimia rimpang temu hitam (Curcuma aeruginosa Roxb.) dan temu putih (C. zeodaria ) yang tumbuh di Indonesia dengan Gajutsu (C. zedoaria) asal Jepang. Bogor (ID) : Puslit Biologi-LIPI Anggraeni A.2010. Fraksionasi senyawa minyak atsiri Temulawak sebagai
pelangsing aromaterapi secara in vivo [skripsi]. Bogor : Institut Pertanian Bogor (ID).
[AOAC] Association of Official Analytical Chemist. 2006. Official Methods of
AOAC International. Edisi ke-14. Arlington: Association of Official Analytical
Chemist.
Ardani M, Pratiwi S U T, dan Hertiani T. 2010. Efek campuran minyak atsiri daun cengkeh dan kulit manis sebagai antiplak gigi. Majalah Farmasi Indonesia 21 (3) : 191-201.
Batubara I, Mitsunaga T, Ohasi H. 2009. Screening antiacne potency of Indonesian medicinal plants; antibacterial, lipase inhibition, and antioxidant activities. JWood Sci 55: 230-235.
Darmawan L. 2007. Cara Instan Membuat Gigi Sehat dan Cantik dengan Dental
Cosmetic dan Kiat Merawat Gigi yang Tepat dan Efektif. Jakarta: Gramedia
Pustaka Utama.
[Depkes RI] Departemen Kesehatan Republik Indonesia. 1978. Jilid 2. Jakarta (ID): Depkes RI.
Muchtaridi, A. Subarnas, A. Apriyantono, S. Budijanto. 2004. Analysis of volatile active compounds of essential oils of nutmeg seeds pessesing inhibitory properties on mice locomotor activity. J Nat Acta Math 3(3):20-28.
O‟Toole G dan Kolter R (1998). Initiation of biofilm formation in Pseudomonas
fluorescens WCS365 proceeds via multiple, convergent signaling pathways: a genetic analysis. Molecular Microbiology 28 (3) : 449-461.
Pavia, Lampman, & Kriz. 2001. Introduction Spectroscopy Third Edition. Washington: Thomson Learning Inc.
Philip K, Malek SNA, Sani W, Shin SK, Kumar S, Lai HK, Serm LG, dan Rahman SNSA. 2009. Am. J. Applied Sci. 6 (8) : 1613-1617.
Pramono S, Wahyono D, Farjawati R. 2001.Pengaruh minyak atsiri temu ireng (Curcuma aeruginosa Roxb.) terhadap bobot badan tikus. Warta Tumbuhan
15 Purwanti , Suranto, Setyaningsih R. 2003. Potensi penghambatan minyak atsiri dan ekstrak kasar rimpang lempuyang (Zingiber spp.) terhadap pertumbuhan
Fusarium oxysporum Schlecht f sp. Cubense.Biofarmasi 1 (2): 58-64
Reanmongkol W, Subhadhirasakul S, Khaisombat N, Fuengnawakit P, Jantasila S, dan Khamjun A. 2006. Investigation the antinociceptive, antipyretic and anti-inflammatory activities of Curcuma aeruginosa Roxb. extracts in experimental animals. Songklanakarin J. Sci.Technol 28(5) : 999-1008.
Rouessaac F dan Roussac A. 2007. Chemical Analysis Modern Instrumentation Methods and Techniques. Second Edition. England : John Wiley & Sons Ltd. Rukmana HR. 2004. Temu-temuan Apotik Hidup di Pekarangan. Yogyakarta :
Kansius.
Rukayadi Y dan Hwang J K. 2006. In vitro activity of xanthorrhizol against
Streptococcus mutans biofilms. Letters in Applied Mic. 42 : 400-404.
Sabir A. 2005. Aktivitas flavonoid propolis trigona Sp terhadap bakteri
Streptococcus mutans (in vitro). Majalah Kedokteran Gigi ( Dent. J) 38 (3) :
135-141.
Sibagariang N. 1997. Efek samping penggunaan khlorheksidin 0,2% pada penderita gingivitis. [skripsi]. Medan (ID): Universitas Sumatera Utara.
Supratman U. 2010.Elusidasi Struktur Senyawa Organik; Metode Spektroskopi untuk penentuan struktur senyawa organic. Bandung(ID): Widya Padjajaran. Sutaryo, Broto S.S, Damajanti D, dan Chairul.1996. Telaah komponen kimia
rimpang temu hitam curcuma aeruginosa dan temu giring (Curcuma heyneana
Val, & V.Zijp.). Prosiding Simposium Nasional 1 Tumbuhan Obat dan
Aromatik APINMAP. Jakarta.
16
LAMPIRAN
Lampiarn 1 Bagan alir penelitian
Kadar air dan kadar abu
Distilasi uap
Rendeman minyak atsiri Minyak
rimpang Dikeringkan
Analisis GC-MS Uji aktivitas
Penentuan eluen terbaik dengan KLT Senyawa minyak atsiri rimpang,
batang, daun, dan bunga temu hitam
Eluen terbaik
Minyak rimpang
Fraksi 2
Fraksi 1 Fraksi 3 … Fraksi 6
Fraksionasi dengan kolom
Uji aktivitas Analisis
GC-MS
Fraksi 1
Uji aktivitas
Senyawa fraksi 1.2
Identifikasi GC-MS dan NMR
Fraksi 1.2
Fraksionasi dengan KLTP
Fraksi 1.1 Fraksi 1.2 Fraksi 1.3 Senyawa
fraksi 1
Rimpang segar Batang segar Daun segar
Minyak batang
18
Lampiran 3 Kadar air rimpang, batang, dan daun Temu Hitam
Sampel Ulangan
Lampiran 4 Kadar abu rimpang, batang, dan daun Temu Hitam
19
20
Lampiran 7 Visualisasi degradasi biofilm fraksi minyak atsri rimpang dan fraksi hasil fraksionasi F1 MR dengan KLTP
Lampiran 8 Contoh penentuan IC50 (µg/ml) degradator biofilm minyak atsiri batang temu hitam, fraksi minyak astsiri rimpang, dan klorheksidin Konsentrasi
(µg/ml)
% degradasi batang IC50
(µg/ml)
0 500 1000 1500 2000 2500
22
Lampiran 9 Kromatogram minyak atsiri (a) rimpang, (b) batang, (c) daun, dan (d) F1 MR temu hitam; (1) kamfena, (2) 1,8-sineol; (3) kamfor, (4) (-)-alkanfor, (5) β-elemena, (6) kariofilena, (7) trans-benzofuran-6-etenil-4,5,6,7-tetrahidro-3,6-dimetil-5 isopropenil, (8)
2,2,5-trimetil-2‟(H)-5‟-6‟-dihidropirano[3‟,4‟,9]indan-1-on, (9) epikurzerenon
24
Lampiran 10 Kromatogram (a) F1.2 MR dengan GC-MS dan (b) spektrum MS
Lampiran 11 Spektrum (a) 1H NMR dan (b) 13C NMR senyawa F1.2 MR
50.0 75.0 100.0 125.0 150.0 175.0 200.0 225.0 250.0 275.0 300.0 325.0 350.0 375.0 400.0 425.0 450.0 475.0
0.0 25.0 50.0 75.0 100.0 %
122
94 65 41
230
162 215
145 187 252 298 409 431 484
MR=230 g/mol
a a
b
25
CDCl3
26
RIWAYAT HIDUP
Penulis dilahirkan di Tebing Tinggi pada tanggal 24 Juni 1992 dari pasangan Bapak Liston Repto Tambunan dan Juliana Sianipar. Penulis adalah anak ke-2 dari empat bersaudara. Penulis menyelesaikan pendidikan di sekolah dasar SDN 068475 Medan, Sumatera Utara pada tahun 2004. Pada tahun 2007, penulis menyelesaikan pendidikan di SMPN 45 Medan, Sumatera Utara. Penulis menyelesaikan pendidikan di SMAN 12 Medan, Sumatera Utara pada tahun 2010. Pada tahun 2010, penulis lolos seleksi masuk Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur undangan (USMI).