RESPON FISIOLOGI DAN PERTUMBUHAN BEBERAPA
GENOTIPE SORGUM (
Sorghum bicolor
(L.) Moench)
TERHADAP TOKSISITAS BESI PADA KULTUR HARA
LARA WULANDARI
A24110185
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Respon Fisiologi dan Pertumbuhan Beberapa Genotipe Sorgum (Sorghum bicolor (L.) Moench) terhadap Toksisitas Besi pada Kultur Hara adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2015
ABSTRAK
LARA WULANDARI. Respon Fisiologi dan Pertumbuhan Beberapa Genotipe Sorgum (Sorghum bicolor (L.) Moench) terhadap Toksisitas Fe pada Kultur Hara. Dibimbing oleh DIDY SOPANDIE dan SINTHO WAHYUNING ARDIE.
Pemahaman mengenai mekanisme toleransi sorgum [Sorghum bicolor (L.) Moench] terhadap toksisitas besi sangat diperlukan untuk mendukung program pemuliaan sorgum toleran di lahan masam dimana toksisitas besi banyak dijumpai. Tujuan penelitian ini adalah untuk memperoleh sejumlah materi genetik sorgum yang toleran dan peka terhadap toksisitas besi dan memperoleh konsentrasi besi yang dapat menyeleksi genotipe toleran dan peka. Penelitian ini terdiri atas 2 percobaan. Percobaan pertama bertujuan untuk mempelajari respon tanaman sorgum terhadap toksisitas besi dan percobaan kedua bertujuan untuk mempelajari konsentrasi Fe yang mampu menyeleksi sorgum genotipe toleran dan peka. Penelitian ini dilaksanakan di Kebun Percobaan Cikabayan (240 mdpl) pada bulan April sampai dengan Juni 2015. Percobaan 1 disusun berdasarkan rancangan kelompok lengkap teracak (RKLT) dengan dua faktor dan tiga ulangan. Faktor pertama adalah konsentrasi Fe2+ menggunakan FeSO4.7H2
O-EDTA yang terdiri atas 5 taraf yakni 0, 200, 400, 600 dan 800 ppm. Faktor kedua adalah genotipe sorgum terdiri atas Numbu, Mandau, ZH 30-29-07, 69 dan B-75. Bibit genotipe Numbu, Mandau, ZH 30-29-07, B-69 dan B-75 ditanam secara hidroponik dalam kultur hara selama 21 hari. Hasil percobaan 1 menunjukkan bahwa konsentrasi Fe di atas 200 ppm menyebabkan pertumbuhan semua genotipe terhambat dan mati karena toksisitas Fe. Keragaan tanaman sorgum Numbu pada kondisi tercekam Fe paling besar berdasarkan variabel pertumbuhan yang diamati dibandingkan genotipe lainnya. Percobaan 2 disusun berdasarkan rancangan kelompok lengkap teracak dengan dua faktor dan tiga ulangan. Faktor pertama adalah konsentrasi Fe2+ menggunakan FeSO4.7H2O.EDTA yang terdiri
atas 5 taraf yakni 0, 50,100,150,200 ppm. Faktor kedua adalah genotipe sorgum terdiri atas Numbu, ZH 30-29-07 dan B-69. Hasil percobaan 2 menunjukkan bahwa variabel panjang akar, bobot basah tajuk, bobot basah akar, bobot kering tajuk dan bobot kering akar dapat dijadikan sebagai karakter seleksi sorgum pada kondisi toksisitas Fe. Konsentrasi 200 ppm merupakan konsentrasi yang mampu digunakan untuk seleksi toleransi genotipe sorgum terhadap toksisitas Fe berdasarkan hasil analisis Reduction Concentration 50 (RC50) terhadap variabel
panjang akar, bobot basah tajuk dan akar, bobot kering tajuk dan akar. Genotipe Numbu merupakan genotipe yang memiliki toleransi terhadap toksisitas Fe yang paling baik dibandingkan dua genotipe lainnya, sedangkan genotipe ZH 30-29-07 merupakan genotipe dengan toleransi yang paling rendah berdasarkan variabel pertumbuhan dan skoring gejala bronzing yang diamati.
ABSTRACT
LARA WULANDARI. Physiological and Growth Responses of Some Sorghum (Sorghum bicolor (L.) Moench) Genotypes to Iron Toxicity Stresses in Nutrient Culture. Supervised by DIDY SOPANDIE and SINTHO WAHYUNING ARDIE. Understanding the tolerance mechanism of sorghum [Sorghum bicolor (L.) Moench] to iron toxicity stresses is needed to support the breeding program sorghum tolerant of acid soil where iron toxicity problem mostly occured. The purpose of this study was to identify sorghum genotypes tolerant to iron toxicity stresses and to determine iron concentrations that are able to select the genotype tolerant and sensitive. This research was conducted at Cikabayan Experimental Field (240 masl) from April to June 2015. This research consisted of two experiments. The first experiment was aimed to determine the response of sorghum to iron toxicity and the second experiment was aimed to determine concentration of Fe were able to select sorghum genotypes tolerant and sensitive. The first experiment was arranged in randomized completely block design with two factors and three replications. The first factor was Fe2+ concentration using FeSO4.7H2O.EDTA as iron source, conducted of 5 levels of Fe2+ i.e 0,
50,100,150,200 ppm . The second factor was three of sorghum genotypes namely Numbu, ZH 30-29-07 and B-69. Numbu, ZH 30-29-07, B-69 were grown hydroponically in nutrient culture for 21 days. The first experiment result showed that the Fe concentrations above 200 ppm cause stunted growth of all genotypes and death due to toxicity Fe. Performance of Numbu on stress Fe condition is the biggest based on growth variabel compared to other genotypes. The second experiment was arranged in randomized completely block design with two factors and three replications. The first factor is the concentration of Fe using FeSO4.7H2O.EDTA comprising 5 level ie 0, 50,100,150,200 ppm. The second factor was three of sorghum genotypes namely Numbu, ZH 30-29-07 and B-69. The second experiment results showed that the variable root length, shoot fresh weight, root fresh weight, shoot dry weight and root dry weight can be used as a selection of characters sorghum on condition Fe toxicity. Concentration of 200 ppm Fe is the concentration that could be used for the selection of sorghum genotypes tolerance to the toxicity of Fe based on Reduction Concentration 50
(RC50) analysis to the variable length of the root, crown and root fresh weight,
shoot dry weight and root. Numbu genotypes are tolerant genotype of Fe toxicity of the most well compared to the other two genotypes, while genotype 30-29-07 ZH is a genotype with the lowest tolerance based on growth variables and scoring bronzing symptoms were observed.
RESPON FISIOLOGI DAN PERTUMBUHAN BEBERAPA
GENOTIPE SORGUM (
Sorghum bicolor
(L.) Moench)
TERHADAP TOKSISITAS BESI PADA KULTUR HARA
LARA WULANDARI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis khaturkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul Penelitian yang dilaksanakan sejak bulan April sampai Juni 2015 di Kebun Pecobaan Cikabayan IPB ini ialah Respon Fisiologi dan Pertumbuhan Beberapa Genotipe Sorgum (Sorghum bicolor (L.) Moench) terhadap Toksisitas Fe pada Kultur Hara.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Didy Sopandie dan Ibu Dr Sintho Wahyuning Ardie selaku pembimbing skripsi, Ibu Dr Ir Eny Widajati selaku pembimbing akademik serta Ibu Dr Desta Wirnas selaku pemberi saran dan Ibu Dr Ir Trikoesumaningtyas yang telah memberikan benih sorgum sebagai bahan tanam pada penelitian ini. Penulis juga ucapkan terima kasih kepada Bapak Joko Mulyono laboran Micro Technique Laboratory dan Pak Mamat yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada kedua orang tua atas doa dan kasih sayangnya dan teman-teman yang telah memberikan dukungan baik moril maupun materil serta kepada semua pihak yang telah membantu dalam penyusunan skripsi ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Umum 2
Tujuan Khusus 2
Hipotesis 2
TINJAUAN PUSTAKA 2
Sorgum (Sorghum bicolor (L.) Moench) 2
Tanah Sulfat Masam 3
Toksisitas Besi 4
METODE PENELITIAN 5
Tempat dan Waktu 5
Bahan dan Alat 5
Pelaksanaan 5
Analisis Data 9
HASIL DAN PEMBAHASAN 9
SIMPULAN 24
DAFTAR PUSTAKA 25
RIWAYAT HIDUP 28
Percobaan 1 Penentuan konsentrasi Fe untuk mempelajari respon
sorgum terhadap toksisitas Fe 9
Percobaan 2 Penentuan konsentrasi Fe untuk seleksi sorgum genotipe
DAFTAR TABEL
1 Standar evaluasi nilai skoring gejala bronzing pada daun 8 2 Hasil sidik ragam pengaruh genotipe, konsentrasi Fe dan interaksi
genotipe dan konsentrasi Fe terhadap berbagai variabel
pertumbuhan 13
3 Tinggi tanaman, jumlah daun, diameter batang dan panjang akar
sorgum pada beberapa taraf konsentrasi Fe pada 7 dan 14 HSP 14 4 Bobot basah akar, bobot basah tajuk, bobot kering akar dan bobot
kering tajuk sorgum pada beberapa taraf konsentrasi Fe
6 Bobot basah akar, bobot basah tajuk, bobot kering akar dan bobot
kering tajuk pada beberapa genotipe sorgum 15
7 Hasil analisis reduction concentration 50 pada berbagai variabel
pertumbuhan 17
8 Pengaruh genotipe terhadap bobot basah akar dan tajuk serta bobot
kering akar dan tajuk pada konsentrasi 200 ppm Fe pada 14 HSP 18 9 Persentase dan skala skoring bronzing daun pada berbagai genotipe
sorgum 24
DAFTAR GAMBAR
1 Ilustrasi pengukuran anatomi akar sorgum 7
2 Ilustrasi nilai indeks persentase tingkat keparahan cekaman Fe 8 3 Keragaan sorgum genotipe Numbu, Mandau, ZH 30-29-07, B-69
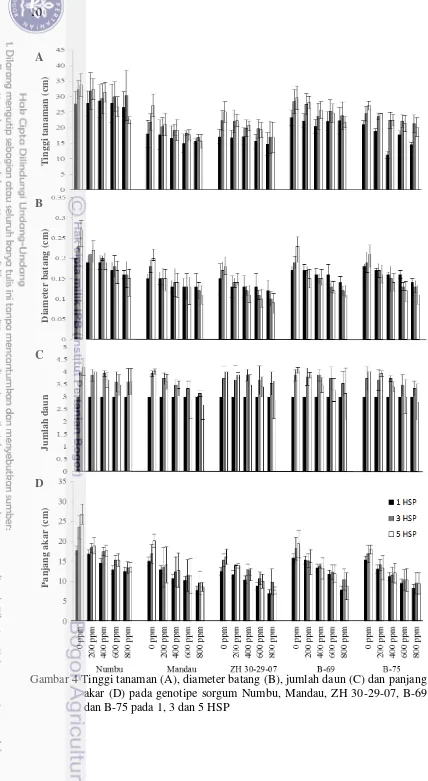
dan B-75 (7 HSP) pada berbagai konsentrasi Fe yang diujikan 9 4 Tinggi tanaman (A), diameter batang (B), jumlah daun (C) dan tajuk serta bobot kering akar dan bobot kering tajuk pada perlakuan berbagai konsentrasi Fe
B-69 pada perlakuan berbagai konsentrasi Fe 21
10 Perbandingan tebal korteks genotipe Numbu, ZH 30-29-07 dan
11 Perbandingan diameter stele genotipe Numbu, ZH 30-29-07 dan B-69 perlakuan berbagai konsentrasi Fe
22 12 Perbandingan jumlah metaxylem genotipe Numbu, ZH 30-29-07
dan B-69 pada perlakuan berbagai konsentrasi Fe 22 13 Gejala toksisitas Fe (bronzing) pada sorgum genotipe Numbu, ZH
PENDAHULUAN
Latar Belakang
Kendala yang dihadapi dalam kegiatan budidaya tanaman di Indonesia diantaranya ialah terbatasnya lahan yang sesuai dan belum dimanfaatkannya lahan tersebut secara optimal. Lahan yang tidak sesuai disebut juga dengan lahan sub optimal atau lahan marginal. Lahan sub optimal atau lahan marginal ialah lahan yang memiliki tingkat kesuburan yang rendah, erositas tinggi, sering mengalami kekeringan atau kebanjiran, atau memiliki tingkat kemasaman tinggi serta keracunan pada kondisi tertentu. Salah satu lahan marginal yang ada di Indonesia ialah lahan pasang surut. Karakteristik lahan pasang surut meliputi beragamnya kondisi fisiko-kimia tanah, kemasaman tanah dan asam organik yang tinggi pada lahan gambut, adanya zat beracun, intrusi air garam, dan rendahnya kesuburan alami tanah (Nazemi et al. 2012). Khusus untuk lahan pasang surut sulfat masam memiliki kendala yang lebih berat dibandingkan lahan pasang surut lainnya karena kemasaman tanah dan air sangat tinggi, kandungan aluminium (Al), besi (Fe) dan hidrogen sulfida (H2S) yang bersifat meracun serta ketersediaan unsur
hara terutama P dan K rendah (Noor dan Khairuddin 2013). Dibandingkan dengan aluminium, budidaya pada lahan sulfat masam lebih besar terkendala toksisitas besi dikarenakan besi merupakan unsur yang mudah tereduksi dan sensitif terhadap perubahan kondisi redoks tanah akibat penggenangan sementara kelarutan aluminium akan menurun (Ussiri dan Johnson 2004).
Toksisitas Fe utamanya disebabkan karena efek toksik atau berlebihnya pengambilan Fe dalam konsentrasi besar pada larutan tanah yang menyebabkan meningkatknya aktivitas polifenol, yang mengarah ke produksi polifenol teroksidasi, penyebab daun bronzing (Dobermann dan Fairhurst 2002). Gejala yang khas pada tanaman yang mengalami toksisitas Fe dimulai dengan bercak berwarna cokelat kemerahan yang meluas ke daun tua secara bertahap yang mengakibatkan daun mati sebelum waktunya (Barker dan Pilbeam 2007).
Sorgum (Sorghum bicolor (L.) Moench) merupakan tanaman yang banyak dibudidayakan di daerah beriklim panas dan kering. Sorgum dapat tumbuh optimal pada daerah yang memiliki suhu 20-30°C dengan kelembaban udara 20% dan curah hujan 400-600 mm (Dicko et al. 2006). Potensi dan keunggulan yang dimiliki sorgum antara lain dapat ditanam pada lahan suboptimal (lahan kering, rawa, lahan masam yang tersedia cukup luas di Indonesia sekitar 38.7 juta hektar dan lahan tergenang) dengan produktivitas yang cukup tinggi apabila telah memiliki perakaran yang kuat (Kemenristek 2012). Sesuai dengan karakteristik tanaman yang tumbuh baik pada agroklimat kering dengan suhu tinggi, curah hujan rendah dan lahan yang relatif terdegradasi, maka pengembangan sorgum diarahkan pada lahan-lahan suboptimal yang tidak berkompetisi dengan tanaman pangan lainnya (Susilowati dan Saliem 2013).
2
tajuk pada kedelai (Noya 2014), peningkatan oksidasi lipid daun pada Eugenia uniflora (De Oliveira-Jucoski et al. 2013), serta perbedaan proporsi dan akumulasi bahan kering pada organ tanaman brokoli (Pena-Olmos et al. 2014)
Adaptasi tanaman sorgum terhadap toksisitas besi belum dipelajari namun secara umum meliputi mekanisme internal (toleran) dan eksternal (penghindaran) (Sopandie 2013). Strategi perbaikan adaptasi tanaman terhadap besi selain dapat dilakukan dengan teknologi budidaya dan pengelolaan tanah dan air, juga dapat dilakukan dengan penggunaan varietas toleran atau cukup toleran dalam mengendalikan keracunan besi sehingga lebih efisien dalam penggunaan input (Noor dan Khairuddin 2013). Berdasarkan hal tersebut penting untuk dilakukan kajian mengenai respon fisiologi dan pertumbuhan tanaman pada beberapa genotipe sorgum terhadap toksisitas besi.
Tujuan Umum
1. Menjelaskan pengaruh konsentrasi Fe terhadap pertumbuhan tanaman sorgum pada kultur hara
2. Menjelaskan pengaruh genotipe terhadap pertumbuhan tanaman sorgum pada kultur hara
3. Menjelaskan pengaruh interaksi antara konsentrasi Fe dan genotipe terhadap pertumbuhan tanaman sorgum pada kultur hara
Tujuan Khusus:
1. Memperoleh sejumlah materi genetik sorgum yang toleran dan peka terhadap toksisitas Fe
Hipotesis
1. Terdapat beberapa konsentrasi Fe yang berpengaruh terhadap pertumbuhan tanaman sorgum pada kultur hara.
2. Terdapat minimal satu genotipe yang berpengaruh terhadap pertumbuhan tanaman sorgum pada kultur hara.
3. antara konsentrasi Fe dan genotipe yang berpengaruh terhadap pertumbuhan tanaman sorgum pada kultur hara
TINJAUAN PUSTAKA
Sorgum (Sorghum bicolor (L.) Moench)
Eropa Selatan, Amerika Utara, Amerika Tengah, dan Asia Selatan. Spesies sorgum yang paling banyak dibudidayakan ialah spesies Sorghum bicolor (L.) Moench. Sorgum termasuk kelas Monocotyledoneae (tumbuhan biji berkeping satu) dengan ordo Poales yang dicirikan melalui bentuk tanaman ternal dengan siklus hidup semusim; famili Poaceae yaitu tumbuhan jenis rumput-rumputan dengan karakteristik batang berbentuk silinder dengan buku-buku yang jelas (Tjitrosoepomo 2000). Sorgum banyak ditanam pada daerah semiarid tropis dan subtropis. Tanaman ini merupakan tanaman hari pendek dan membutuhkan temperatur tinggi untuk dapat tumbuh dan memberi hasil tinggi. Kondisi yang optimum penanaman sorgum ialah daerah yang memiliki suhu 20-30°C dengan kelembaban rendah dan curah hujan 400-600 mm (Dicko et al. 2006).
Perakaran sorgum tidak membentuk akar tunggang, perakaran hanya terdiri atas akar lateral. Sistem perakaran sorgum terdiri atas akar-akar seminal (akar-akar primer) pada dasar buku pertama pangkal batang, (akar-akar sekunder dan (akar-akar koronal (akar pada pangkal batang yang tumbuh ke arah atas) dan akar udara (Tjitrosoepomo 2000).
Batang tanaman sorgum merupakan rangkaian berseri dari ruas (internodes) dan buku (nodes), tidak memiliki kambium. Bagian tengah batang terdapat seludang pembuluh yang diselubungi oleh lapisan keras (sel-sel parenkim). Tinggi tanaman sorgum bergantung pada jumlah dan ukuran ruas batang. Sorgum memiliki tinggi rata-rata 2.6-4 m. Batang dan daun sorgum mirip dengan jagung. Tinggi tanaman sorgum berhubungan erat dengan umur dan jumlah daun, pada tanaman berumur genjah tinggi dan jumlah daun lebih sedikit daripada tanaman berumur dalam (Tjitrosoepomo 2000).
Daun tanaman sorgum berbentuk pita dengan struktur terdiri atas helai daun dan tangkai daun. Posisi daun terdistribusi secara berlawanan sepanjang batang dengan pangkal daun menempel pada ruas batang. Panjang daun sorgum rata-rata 1 m dengan penyimpangan 10-15 cm dan lebar 5-13 cm (House 1985). Jumlah daun bervariasi antara 7-40 helai, bergantung pada varietas (Gardner et al. 1981).
Tanah Sulfat Masam
Tanah sulfat masam adalah tanah yang mengandung pirit (FeS2) ≥ 2% dan
terletak pada kedalaman kurang dari 50 cm dari permukaan tanah (Widjaja-Adhi et al. 1992). Tanah sulfat masam merupakan tanah liat rawa yang seringkali memiliki lapisan gambut tipis < 20 cm; memiliki lapisan pirit yang belum teroksidasi (bahan sulfidik) atau sudah teroksidasi (horison sulfurik) pada kedalaman 0-50 cm (Suriadikarta dan Setyorini 2006) serta memiliki bercak jarosit dan bahan penetral berupa karbonat atau basa-basa tertukar lainnya (Noor 2004).
4
diakibatkan oleh sulfat masam yang memiliki ciri bercak jarosit, terletak langsung di atas lapisan bahan sulfidik dan kandungan sulfat larut air 0.05% atau lebih.
Pirit yang terkandung dalam tanah sulfat masam bersifat stabil jika berada dalam kondisi reduktif, tetapi akan mengalami oksidasi jika tanah sulfat masam di drainase. Menurunnya permukaan air tanah akibat pembuatan saluran drainase primer-sekunder-tersier menyebabkan oksigen masuk ke dalam pori tanah dan akan mengoksidasi pirit membentuk ion hidrogen dan Fe3+ dan asam sulfat yang dapat meningkatkan kemasaman tanah hingga mencapai pH < 3.5 (Ponammperuma 1972).
Toksisitas Besi
Toksisitas besi di Indonesia banyak dijumpai terutama pada lahan pasang surut yang mempunyai beberapa kendala seperti kahat hara, kemasaman yang tinggi, kadar Al, Fe dan H2S yang tinggi (Sarwani 2004). Toksisitas besi
disebabkan karena berlebihnya unsur Fe bervalensi dua dalam tanah yang menyebabkan akar tanaman tidak dapat menyerap dan mentransportasikan hara yang dibutuhkan ke daun melalui transpirasi (Kasno 2009).
Gejala toksisitas besi umumnya mirip dengan gejala toksisitas aluminium pada tajuk tanaman, namun keduanya memiliki gejala yang sangat berbeda pada akar. Skeen (1992) mengamati bahwa ujung akar pada tanaman yang kelebihan unsur besi umumnya lembek sementara ujung akar pada tanaman yang kelebihan unsur aluminium ialah rapuh. Akar dari tanaman yang terkena toksisitas besi berjumlah sedikit, kasar, pendek, dan berwarna cokelat gelap dan ketika terjadi pengurangan cekaman akar tanaman perlahan-lahan akan kembali berwarna putih (Sahrawat 2004). Umumnya keracunan besi ditandai dengan bintik-bintik cokelat mulai dari ujung bawah daun kemudian naik ke daun atas sedangkan daun yang lebih rendah akhirnya berubah abu-abu atau putih (Tadano 1975). Keracunan besi yang meningkat menyebabkan daun berwarna cokelat keungu-unguan yang diikuti mengeringnya daun (Sahrawat 2004). Menurut Fageria et al. (2008), toksisitas besi pada tanaman akan menyebabkan terhambatnya pertumbuhan tinggi tanaman dan pembungaan, diskolorisasi daun dan kehilangan klorofil serta pengurangan jumlah akar.
Gejala toksisitas besi ini akan berbeda pada tanaman tergantung usia tanaman, status hara, dan budidaya. Mulleriyawa (1966) melaporkan bahwa keracunan besi menyebabkan bronzing pada tanaman ketika tingkat tanah kalium rendah dan kelebihan H2S dapat mempengaruhi tanaman untuk bronzing dengan
mengurangi atau menghambat akar untuk berespirasi. Tanaka dan Yoshida (1970) menemukan bahwa dengan konsentrasi besi yang tinggi menyebabkan akar padi akan mengoksidasi besi dan pada ujung akar menumpuk atau kelebihan jumlah zat besi yang akan ditranslokasi ke daun yang lebih rendah. Pemotongan akar meningkatkan penyerapan zat besi dan tingkat toksisitas.
Mekanisme untuk penghindaran terhadap toksisitas besi pada sorgum umumnya belum dipelajari, namun dapat dilakukan pendekatan terhadap tanaman monokotil lainnya. Tanaman monokotil yang toleran terhadap Fe memiliki ciri : sistem detoksifikasi yang lebih efisien yg mereduksi langsung toksisitas besi, dan menurunkan laju pertumbuhan dengan meminimalisasi efek toksisitas tidak langsung pada larutan hara (Snowden dan Wheeler 1993). Resistensi terhadap toksisitas besi memiliki karakter yang kompleks antara genetik dan fisiologi. Beberapa mekanisme toleransi menurut Dufey et al. (2009) diantaranya oksidasi di rizosfer, eksudasi Fe2+ dari akar, menyimpan kelebihan Fe di dalam apoplas dan vakuola serta detoksifikasi Fe yang diinduksi reaktif spesies oksigen (ROS) oleh enzim antioksidan. Tak satu pun dari mekanisme ini secara langsung ditargetkan dalam program pemuliaan (Shabala 2010). Sifat-sifat yang mudah diukur ialah indeks bronzing pada daun, bobot kering tunas dan akar, jumlah mdpl) dan Laboratorium Micro Technique, Institut Pertanian Bogor, Bogor. Penelitian dilaksanakan pada April 2015 hingga Juni 2015.
Bahan dan Alat
Bahan tanaman yang digunakan ialah benih sorgum genotipe Numbu, ZH 30-29-07 dan B-69. Bahan-bahan lainnya ialah aquades, NaOH 1M, HCl 1M, 2.2 bypiridine, styrofoam, arang sekam, dan larutan FeSO4.7H2O.EDTA, Komposisi
larutan hara yang digunakan mengacu pada Ohki (1987) yaitu 0.24 mM NH4NO3,
0.03 mM (NH4)2.SO4, 0.088 mM K2SO4, 0.38 mM KNO3, 1.27 mM
Ca(NO3)2.4H2O, 0.27 mM Mg(NO3)2.4H2O, 0.14 mM NaCl, 6.6 μM H3BO3, 5.1
μM MnSO4.4H2O, 0.61 μM ZnSO4.7H2O, 0.16 μM CuSO4.5H2O, 0.1 μM
Na2Mo7.7H2O, 45 μM FeSO4.7H2O-EDTA.
Alat yang digunakan dalam penelitian ini ialah pot, alat pengaduk kayu, meteran atau penggaris, timbangan analitik, jangka sorong, pH meter portable AD-110, mikroskop, isolasi bening, mesin dan selang aerator.
Pelaksanaan
Penelitian ini terdiri atas 2 perobaan yaitu (1) penentuan konsentrasi Fe untuk mempelajari respon tanaman sorgum terhadap toksisitas besi dan (2) penentuan konsentrasi Fe untuk seleksi sorgum genotipe toleran dan peka. Percobaan 1 dilaksanakan pada April 2015 dan percobaan 2 dilaksanakan pada bulan Mei 2015 hingga Juni 2015. Percobaan 1 disusun berdasarkan rancangan kelompok lengkap teracak (RKLT) dengan dua faktor dan tiga ulangan. Faktor pertama adalah konsentrasi Fe2+ menggunakan FeSO4.7H2O-EDTA yang terdiri
6
sorgum yang terdiri atas Numbu, Mandau, ZH 30-29-07, B-69 dan B-75. Media tanam yang digunakan pada Percobaan 1 adalah larutan hara Ohki (1987). Tiap satu satuan percobaan terdiri atas 1 pot yang berisi 5 bibit sorgum. Saat pelaksanaan di lapang, penanaman sorgum pada kultur hara tidak dilaksanakan serentak 3 ulangan karena daya berkecambah beberapa genotipe sorgum rendah dan banyaknya pengamatan yang dilakukan dikhawatirkan tidak selesai dan memunculkan bias data. Ulangan pertama dan kedua dikerjakan pada minggu pertama pindah tanam sementara ulangan ketiga pada minggu keduanya.
Benih sorgum yang telah disemai menggunakan media arang sekam hingga berumur 7 hari setelah semai (HSS) kemudian dipindahkan pada media kultur dengan memilih bibit yang memiliki panjang akar, tinggi tanaman dan jumlah daun yang seragam. Pindah tanam bibit sorgum dilakukan dengan cara memisahkan bibit dari media tanam dan kulit benih yang masih menempel serta mencuci akar hingga bersih. Pangkal batang bibit sorgum kemudian dibungkus menggunakan busa lunak dan diapungkan pada media kultur yang telah diberi penyangga styrofoam. Media tanam disiapkan dengan mengisi larutan hara sebanyak 2 L pot-1 dan menambahkan NaOH 1 M atau HCl 1 M untuk mencapai pH 4.0. Perlakuan konsentrasi Fe2+ ditambahkan pada larutan hara setelah proses pengapungan dalam larutan hara selama 7 hari. Larutan hara diberi aerasi agar Fe dan hara lainnya tidak mengendap. Air yang hilang akibat transpirasi diganti dengan menambahkan aquades agar jumlah larutan tetap dengan pH tetap dipertahankan sekitar 4.0 selama tanaman dipelihara dengan menggunakan pH meter portable AD-110 .
Pengamatan Percobaan 1 dilakukan pada semua tanaman di setiap satuan percobaan. Variabel pengamatan yang diamati yakni pertumbuhan tanaman. Pengamatan variabel pertumbuhan tanaman terdiri atas tinggi tanaman, jumlah daun, diameter batang dan panjang akar yang dilakukan pada 7 dan 14 hari setelah perlakuan (HSP). Pengamatan tinggi tanaman (cm) dilakukan dengan mengukur tinggi tanaman dari permukaan batang sampai daun terpanjang pada batang utama menggunakan alat bantu meteran atau penggaris. Pengamatan jumlah daun (helai) dilakukan dengan menghitung jumlah daun yang telah membuka sempurna pada batang utama. Panjang akar (cm) diukur dari permukaan batang sampai ujung akar terpanjang dan diameter batang (cm) diukur pada batang utama menggunakan jangka sorong.
Percobaan 2 disusun berdasarkan rancangan kelompok lengkap teracak (RKLT) dengan dua faktor dan tiga ulangan. Faktor pertama adalah konsentrasi Fe2+ menggunakan FeSO4.7H2O-EDTA yang terdiri atas 5 taraf yakni 0, 50, 100,
150 dan 200 ppm. Faktor kedua adalah genotipe sorgum yang terdiri atas Numbu, ZH 30-29-07 dan B-69. Konsentrasi FeSO4.7H2O-EDTA yang digunakan pada
percobaan 2 berdasarkan hasil yang diperoleh pada percobaan 1 dan genotipe yang terpilih ialah didasarkan pada daya kecambah yang tinggi sewaktu penyemaian. Prosedur persiapan dan penanaman bibit sama dengan prosedur pada Percobaan 1.
Pengamatan pada Percobaan 2 dilakukan pada semua tanaman di setiap satuan percobaan. Variabel pengamatan yang diamati terdiri atas pertumbuhan tanaman dan fisiologis serta pengamatan data lingkungan.
bobot basah tajuk dan akar serta bobot kering tajuk dan akar dilakukan pada 14 HSP.
a. Tinggi tanaman (cm), tinggi tanaman diukur dari permukaan batang sampai daun terpanjang pada batang utama menggunakan alat bantu meteran atau penggaris.
b. Jumlah daun (helai), dihitung jumlah daun pada batang utama.
c. Panjang akar (cm), diukur dari permukaan batang sampai ujung akar terpanjang.
d. Diameter batang (cm), diukur pada batang utama menggunakan jangka sorong.
h. Bobot basah tajuk (g). Pengamatan bobot basah tajuk dilakukan dengan menimbang tajuk menggunakan timbangan analitik.
i. Bobot basah akar (g). Pengamatan bobot basah akar dilakukan dengan menimbang akar menggunakan timbangan analitik.
j. Bobot kering tajuk (g). Pengamatan bobot kering tajuk dilakukan dengan menimbang tajuk setelah dikeringkan menggunakan oven selama 72 jam pada suhu 60 °C.
k. Bobot kering akar (g). Pengamatan bobot kering akar dilakukan dengan menimbang akar setelah dikeringkan menggunakan oven selama 72 jam pada suhu 60 °C.
2. Variabel fisiologis kerusakan daun dan akar. Pengamatan anatomi akar dilakukan pada 7 dan 14 HSP, gejala bronzing daun dan pola pewarnaan besi dilakukan pada 14 hari setelah perlakuan (HSP).
a. Pola pewarnaan besi / Distribusi Besi. Dianalisis menggunakan metode
semi kuantitatif 2.2’bipyridine (Engel et al. 2012).
b. Anatomi akar. Akar bibit sorgum sekitar 1 cm dari ujung akar diiris melintang lalu diukur tebal epidermis, tebal korteks, diameter stele dan jumlah metaxylem pada mikroskop jenis DP2-BSW dengan perbesaran 10x.
Gambar 1 Ilustrasi pengukuran anatomi akar sorgum
8
Gambar 2 Ilustrasi nilai indeks persentase tingkat keparahan cekaman Fe (Shimizu et al. 2005)
Tabel 1 Standar evaluasi nilai skoring gejala bronzing pada daun (Shimizu et al. 2005)
3. Pengamatan data lingkungan, meliputi:
a. Pengukuran pH media. Kondisi larutan media dimonitor setiap hari dengan menggunakan pH meter portable AD-110.
b. Suhu rumah kaca (°C), diukur dengan cara mengamati suhu setiap hari pada pukul 08.00, 12.00, dan 16.00 WIB menggunakan termometer. Data suhu kemudian dibuat menjadi data suhu harian. Pengukuran rata-rata suhu harian dihitung menggunakan rumus (Handoko 1993):
Trata-rata harian = (2T08.00+(T12.00)+T16.00)/4
T08.00 = suhu pada pengamatan pukul 08.00; T12.00 = suhu pada pengamatan pukul 12.00; T16.00 = suhu pada pengamatan pukul 16.00.
Analisis Data
Data yang diperoleh dianalisis menggunakan analisis ragam pada α = 1% dan 5%. Jika perlakuan berpengaruh nyata berdasarkan analisis ragam dilanjutkan dengan pengujian beda nilai tengah antar perlakuan dengan Uji Wilayah Berganda Duncan (DMRT) pada taraf 5% menggunakan STAR (Statistical Tool for Agricultural Research). Analisis regresi dilakukan untuk menentukan karakter seleksi yang tepat. Setelah diperoleh karakter seleksi yang ditepat dilakukan penentuan analisis reduction concentration 50 (RC50) menggunakan software
CurveExpert. RC50 dilakukan untuk menentukan konsentrasi Fe yang menurunkan
50% pertumbuhan tanaman sorgum. Persentase Luas Daun
yang Terpengaruh Skala Bronzing Tingkat toleransi
HASIL DAN PEMBAHASAN
Percobaan 1 Penentuan konsentrasi Fe untuk mempelajari respon sorgum terhadap toksisitas Fe
Secara umum suhu rata-rata di dalam rumah kaca pada bulan April 2015 adalah 28.31°C, dengan suhu maksimum pada bulan minggu ke-2 adalah 29.56°C dan suhu minimum pada minggu ke-4 adalah 27.33°C. Menurut Dicko et al. (2006) tanaman sorgum dapat tumbuh baik pada kisaran suhu 20-30 °C dan kelembaban udara yang rendah, oleh karena itu suhu lingkungan pada penelitian ini sesuai dengan syarat tumbuh sorgum.
Hasil percobaan 1 menunjukkan bahwa semua genotipe sorgum mati pada perlakuan konsentrasi Fe diatas 200 ppm (Gambar 3). Adanya Fe yang berlebih diserap oleh tanaman menyebabkan pertumbuhan menjadi terhambat.
Gambar 3 Keragaan sorgum genotipe Numbu, Mandau, ZH 30-29-07, B-69 dan B-75 pada berbagai konsentrasi Fe yang diujikan pada 7 HSP
Pengaruh toksisitas Fe terhadap pertumbuhan tanaman dapat dilihat pada gambar 4 A-D. Rata-rata tinggi tanaman meningkat pada 3 HSP namun pada 5 HSP menurun (Gambar 4A). Tinggi tanaman menurun karena adanya cekaman toksisitas Fe. Tinggi tanaman pada genotipe sorgum yang diberi perlakuan 0 ppm dan 200 ppm Fe, terus meningkat sementara ketika diberi perlakuan 400 ppm, 600 ppm dan 800 ppm Fe pertambahan tinggi tanaman semua genotipe sorgum terhambat. Penelitian Aung (2006), menunjukkan bahwa tinggi tanaman 10 varietas padi yang diberi perlakuan 1500 ppm Fe selama 3 hari menurun dibandingkan hari pertama pengamatan.
10
Panjang akar genotipe Numbu, Mandau, ZH 30-29-07, B-69 dan B-75 pada perlakuan 0 ppm dan 200 ppm meningkat sementara panjang akar yang diberi perlakuan 400 ppm, 600 ppm dan 800 ppm menjadi terhambat (Gambar 4C). Genotipe yang diberi perlakuan 400 ppm, 600 ppm dan 800 ppm awalnya mengalami peningkatan panjang akar pada 0 HSP sampai 3 HSP, dan menurun pada 5 HSP. Penelitian Batty dan Younger (2003), menunjukkan bahwa panjang akar kecambah Phragmites australis yang diberi perlakuan lebih dari 2 mg L-1 mengalami penurunan dibandingkan panjang akar pada awal pengamatan. Penurunan panjang akar yang terjadi selama pengamatan disebabkan akar sorgum yang lembek dan putus akibat berlebihnya Fe yang diserap oleh akar
Toksisitas Fe mempengaruhi jumlah daun masing-masing genotipe sorgum (Gambar 4D). Jumlah daun genotipe Numbu, Mandau, ZH 30-29-07, 69 dan B-75 meningkat pada 3 HSP pada semua konsentrasi Fe yang diujikan, namun jumlah daun kemudian menurun pada 5 HSP pada konsentrasi 400, 600 dan 800 ppm. Pengamatan jumlah daun hanya dilakukan sampai 5 HSP karena pada pengamatan 7 HSP semua genotipe sorgum mati pada konsentrasi 400, 600 dan 800 ppm. Berlebihnya Fe yang diserap oleh tanaman menyebabkan penurunan jumlah daun. Jumlah daun berkurang pada 5 HSP disebabkan daun tua pada tanaman sorgum banyak yang mati akibat toksisitas Fe. Barker dan Pilbeam (2007), menyatakan bahwa gejala toksisitas Fe mudah diamati pada daun yakni dengan munculnya bercak berwarna cokelat kemerahan atau bronzing yang mengakibatkan daun mati sebelum waktunya.
Percobaan 2 Penentuan konsentrasi Fe untuk seleksi sorgum genotipe toleran dan peka
Secara umum suhu rata-rata di dalam rumah kaca pada bulan Mei hingga Juni 2015 adalah 28.73°C, dengan suhu maksimum pada bulan Mei minggu ke-3 adalah 29.71°C dan suhu minimum pada bulan Mei minggu ke-1 adalah 26.53°C. Menurut Dicko et al. (2006) tanaman sorgum dapat tumbuh baik pada kisaran suhu 20-30 °C dan kelembaban udara yang rendah, oleh karena itu suhu lingkungan pada penelitian ini sesuai dengan syarat tumbuh sorgum.
12
A
B
C
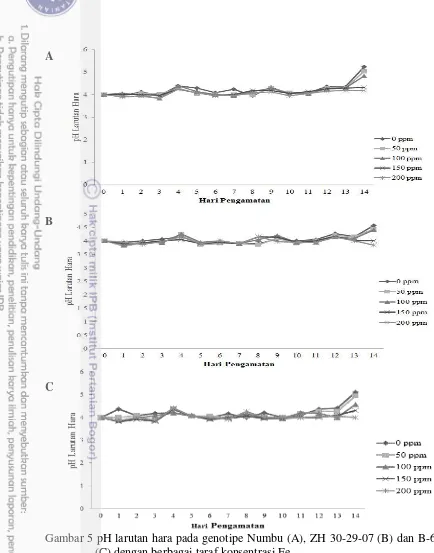
Gambar 5 pH larutan hara pada genotipe Numbu (A), ZH 30-29-07 (B) dan B-69 (C) dengan berbagai taraf konsentrasi Fe
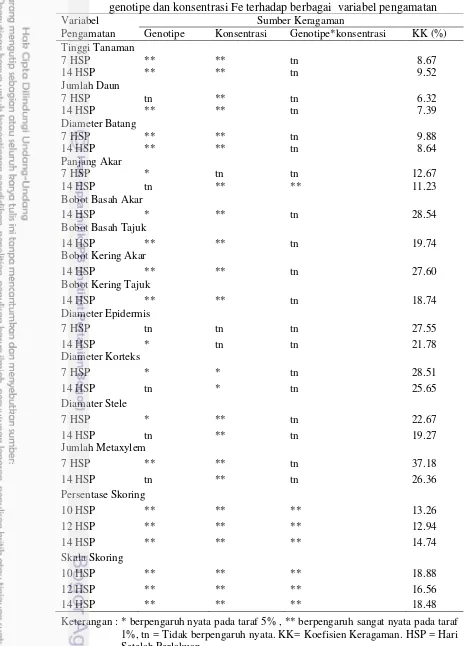
Tabel 2 Hasil sidik ragam pengaruh genotipe, konsentrasi Fe dan interaksi genotipe dan konsentrasi Fe terhadap berbagai variabel pengamatan Variabel
Pengamatan
Sumber Keragaman
Genotipe Konsentrasi Genotipe*konsentrasi KK (%)
Tinggi Tanaman
14
Pengaruh Konsentrasi Fe terhadap Pertumbuhan Sorgum pada Kultur Hara
Toksisitas Fe dengan konsentrasi 100 ppm sudah menunjukkan hambatan pertumbuhan sorgum yang signifikan pada 7 HSP terhadap kontrol, yaitu pada variabel jumlah daun dan diameter batang (Tabel 3). Seluruh variabel pertumbuhan mengalami hambatan pertumbuhan pada konsentrasi Fe lebih dari 100 ppm sejak 7 HSP. Hambatan pertumbuhan semakin terlihat jelas pada 14 HSP dimana konsentrasi rendah yakni 50 ppm sudah menunjukkan perbedaan terhadap kontrol pada variabel panjang akar, diameter batang, dan jumlah daun. Meningkatnya konsentrasi Fe yang diberikan semakin menghambat pertumbuhan tanaman yang diamati. Menurut Ward et al. (2008), tanaman Arabidopsis thaliana yang diberi perlakuan 100 µM Fe-EDTA memiliki panjang akar yang lebih pendek dibandingkan dengan panjang akar yang diberi perlakuan 0 dan 10 µM Fe-EDTA. Penelitian Nenova (2006), menunjukkan bahwa peningkatan konsentrasi Fe menyebabkan terhambatnya pertumbuhan tinggi tanaman Pisum sativum L. cv. Manuela sekitar 25-40%.
Tabel 3 Tinggi tanaman, jumlah daun, diameter batang dan panjang akar pada beberapa taraf konsentrasi Fe pada 7 dan 14 HSP
Konsen-ppm sudah menunjukkan hambatan pertumbuhan yang signifikan terhadap kontrol, yaitu pada variabel bobot kering tajuk. Variabel bobot basah akar, bobot basah tajuk dan bobot kering akar mengalami hambatan pertumbuhan pada konsentrasi lebih dari 50 ppm.
Tabel 4 Bobot basah akar,bobot basah tajuk, bobot kering akar dan bobot kering tajuk pada beberapa taraf konsentrasi Fe
Pengaruh Genotipe terhadap Pertumbuhan Sorgum pada Kultur Hara
Tabel 5 menunjukkan Genotipe Numbu memiliki tinggi tanaman, jumlah daun, diameter batang dan panjang akar yang paling tinggi dibandingkan genotipe lainnya. Genotipe ZH 30-29-07 menunjukkan pertumbuhan paling rendah pada berbagai perlakuan konsentrasi Fe yang diujikan.
Tabel 5 Tinggi tanaman, jumlah daun, diameter batang dan panjang akar pada besar dibandingkan dua genotipe lainnya sementara genotipe ZH 30-29-07 dan B-69 tidak berbeda nyata dan merupakan genotipe yang memiliki bobot basah akar, bobot basah tajuk, bobot kering akar dan bobot kering tajuk yang paling rendah. Berdasarkan data tabel 5 dan 6 diketahui bahwa genotipe Numbu memiliki keragaan tanaman yang paling besar dibandingkan kedua genotipe lainnya.
Tabel 6 Bobot basah akar,bobot basah tajuk, bobot kering akar dan bobot kering tajuk pada beberapa genotipe sorgum
Genotipe Bobot Basah
16
menunjukkan bahwa variabel tinggi tanaman, jumlah daun, diameter batang, panjang akar , bobot basah akar, bobot basah tajuk, bobot kering akar, bobot kering tajuk
pada perlakuan berbagai konsentrasi Fe
Analisis Reduction Concentration 50 (RC50) dilakukan pada
variabel-variabel yang terpilih sebagai karakter seleksi. Reduction concentration 50 adalah
konsentrasi bahan uji yang menyebabkan penurunan nilai peubah sebesar 50% dari kontrol pada konsentrasi radikal (meracun) yang dihitung sebagai mg mL-1 (Razavi et al. 2008). Firdausya (2015) menggunakan nilai RC50 sebagai
konsentrasi untuk seleksi tanaman gandum terhadap cekaman kekeringan.
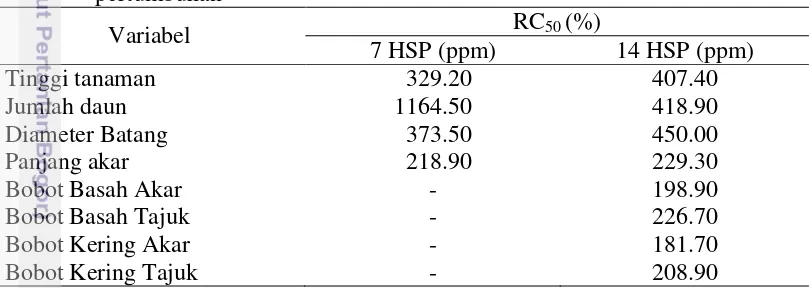
Berdasarkan hasil analisis RC50 konsentrasi Fe yang menyebabkan hambatan
pertumbuhan hingga 50% pada variabel tinggi tanaman, jumlah daun dan diameter batang mencapai lebih dari 300 ppm pada 7 dan 14 HSP (Tabel 7). Konsentrasi Fe sebesar 218.9 ppm menyebabkan hambatan pertumbuhan panjang akar hingga 50% pada 7 HSP. Hambatan pertumbuhan hingga 50% pada variabel bobot basah akar, bobot basah tajuk, bobot kering akar, bobot kering tajuk pada 14 HSP terjadi pada konsentrasi Fe sebesar 200 ppm. Oleh karena itu, seleksi sorgum pada kondisi toksisitas Fe dapat dilakukan pada konsentrasi 200 ppm menggunakan variabel panjang akar, bobot basah akar, bobot basah tajuk, bobot kering akar serta bobot kering tajuk pada 14 HSP. Asch et al. (2005) yang menyatakan bahwa konsentrasi Fe dalam larutan yang menyebabkan keracunan bervariasi sangat luas berkisar antara 10-500 ppm Fe.
Tabel 7 Hasil analisis reduction concentration 50 (RC50) pada berbagai variabel
pertumbuhan
Variabel RC50 (%)
7 HSP (ppm) 14 HSP (ppm)
Tinggi tanaman 329.20 407.40
Jumlah daun 1164.50 418.90
18
Tabel 8 Pengaruh genotipe terhadap bobot basah akar dan tajuk serta bobot kering akar dan tajuk pada konsentrasi 200 ppm Fe pada 14 HSP
Genotipe Panjang dalam substrat dapat menurunkan pengembangan radikula terutama ketika konsentrasi Fe2+ melampaui 50 mg L-1 karena konsentrasi logam yang tinggi meningkatkan peroksidasi lipid, terutama di zona radikula, yang disertai dengan terhambatnya pertumbuhan tanaman. Pengurangan volume radikula dapat menginduksi penurunan drastis kadar relatif air pada tanaman (Dordolot et al. 2005). Hal ini lah yang menyebabkan genotipe sorgum yang peka memiliki bobot kering akar yang rendah. Hasil pengamatan terhadap variabel bobot basah akar dan tajuk serta bobot kering akar dan tajuk menunjukkan bahwa Numbu dan B-69 memiliki tingkat toleransi terhadap toksisitas besi yang lebih tinggi dibandingkan ZH 30-29-07.
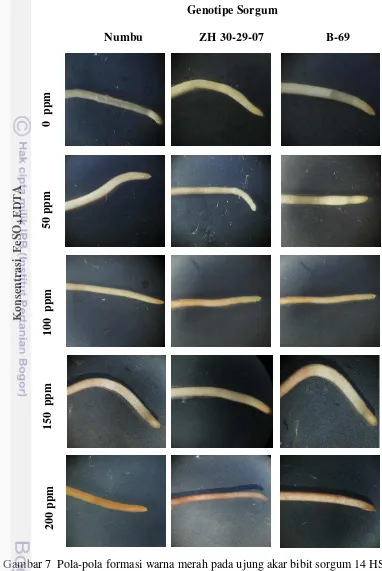
Gambar 7 Pola-pola formasi warna merah pada ujung akar bibit sorgum 14 HSP
Irisan melintang akar pada genotipe ZH 30-29-07, B-69 dan Numbu menunjukkan adanya formasi merah mencapai jaringan epidermis dan endodermis
Numbu
100 p
p
m
150 p
p
m
200 p
p
m
ZH 30-29-07 B-69
0 p
p
m
50 p
p
m
Genotipe Sorgum
Kon
se
n
tr
asi FeSO
4.
E
20
pada konsentrasi 50 ppm Fe (Gambar 8). Hal ini menunjukkan bahwa pada konsentrasi Fe rendah (50 ppm) besi sudah terdeteksi pada jaringan akar.
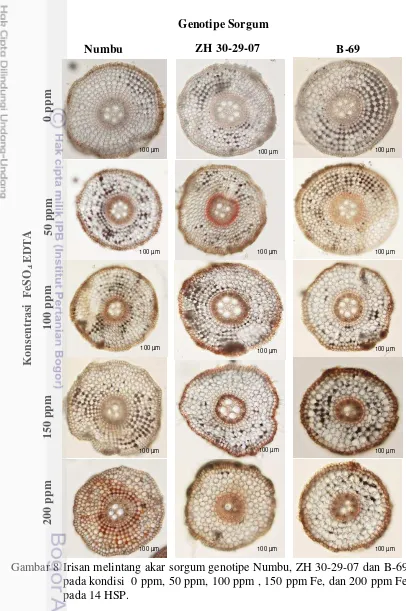
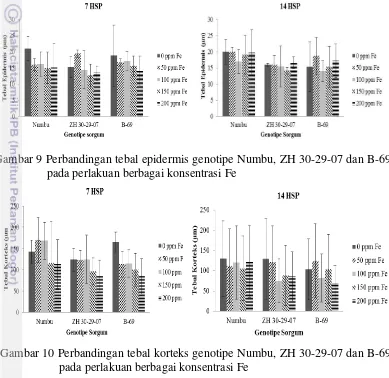
Berdasarkan hasil pengamatan pada variabel pertumbuhan diketahui bahwa Numbu merupakan genotipe yang memiliki toleransi terhadap toksisitas Fe yang lebih baik dibandingkan dua genotipe lainnya. Pengamatan anatomi akar dilakukan untuk mendukung data pada variabel pertumbuhan. Berdasarkan anatomi akar yakni tebal epidermis dan tebal korteks tidak terlalu dipengaruhi secara signifikan oleh meningkatnya konsentrasi Fe2+ baik pada genotipe Numbu, ZH 30-29-07 dan B-69 pada 7 dan 14 HSP (Gambar 9 dan 10), namun berpengaruh secara signifikan pada pengamatan diameter stele dan jumlah metaxylem (Gambar 11 dan 12).
Gambar 9 Perbandingan tebal epidermis genotipe Numbu, ZH 30-29-07 dan B-69 pada perlakuan berbagai konsentrasi Fe
Gambar 10 Perbandingan tebal korteks genotipe Numbu, ZH 30-29-07 dan B-69 pada perlakuan berbagai konsentrasi Fe
22
unsur hara lainnya. Penelitian Gomes et al. (2011) menunjukkan bahwa terjadi peningkatan jumlah metaxylem pada tanaman Brachiaria decumbens yang diberi perlakuan toksisitas logam berat (seng, kadmium, tembaga dan timbal) dibandingkan kontrol. Penelitian Santandrea et al. (1998) menunjukkan bahwa jumlah xylem (metaxylem dan protoxylem) pada tanaman Nicotiana tabacum L. yang diberi perlakuan toksisitas Mn 5000 mmol L-1 lebih tinggi dibandingkan tanaman kontrol (100 mmol L-1 Mn).
Gambar 11 Perbandingan diameter stele genotipe Numbu, ZH 30-29-07 dan B-69 pada perlakuan berbagai konsentrasi Fe
Gambar 12 Perbandingan jumlah metaxylem genotipe Numbu, ZH 30-29-07 dan B-69 pada perlakuan berbagai konsentrasi Fe
Pengamatan gejala toksisitas besi yakni bronzing atau akumulasi polyphenol teroksidasi pada daun di lakukan dengan skoring. Nilai skoring besi menunjukkan seberapa berat tanaman keracunan besi. Penampilan tanaman keracunan besi berhubungan dengan tingginya serapan Fe2+ oleh akar dan ditransportasikan ke daun melalui aliran transpirasi. Gejala bronzing dimulai dari daun tua yang ditandai dengan bercak berwarna cokelat kemerahan (Gambar 13). Bercak berwarna tembaga kemudian meluas keseluruh daun, perkembangan gejala selanjutnya ujung daun menjadi kuning-jingga kemudian kering dari bagian atas (Peng dan Yamauchi 1993).
bronzing pada Numbu berada pada konsentrasi Fe yang lebih tinggi (100 ppm) dibandingkan genotipe ZH 30-29-07 dan B-69 (50 ppm). Hal ini menunjukkan bahwa Numbu cenderung memiliki toleransi yang lebih baik dibandingkan kedua genotipe lainnya. Hasil pengamatan visual ini kemudian di ukur secara kuantitatif melalui skoring untuk menentukan seberapa berat kerusakan yang terjadi pada daun seperti yang terlihat pada Tabel 9.
Gambar 13 Gejala toksisitas Fe (bronzing) pada sorgum genotipe Numbu, ZH 30-29-07 dan B-69 pada 14 HSP
Bronzing ketiga genotipe mulai terlihat pada 7 HSP namun interaksi antara faktor genotipe dan faktor konsentrasi Fe mulai terlihat pada 10 HSP. Berdasarkan acuan Shimizu et al. (2005), pengamatan pada 10 dan 12 HSP belum menunjukkan perbedaan toleransi ketiga genotipe tersebut pada berbagai konsentrasi Fe yang diajukan. Berdasarkan Tabel 9 diketahui bahwa pada pengamatan 14 HSP terdapat konsentrasi Fe yang sudah menunjukkan perbedaan toleransi pada masing-masing genotipe yakni pada konsentrasi 200 ppm dengan persentase bronzing tertinggi yakni pada genotipe ZH 30-29-07 sebesar 38.13% dengan skor 4.33, diikuti oleh genotipe B-69 sebesar 34.49% dengan skor 4.00 dan genotipe Numbu sebesar 20.05% dengan skor 2.75. Menurut Shimizu et al. (2005), persentase dan skala ini menunjukkan bahwa genotipe ZH 30-29-07 dan B-69 moderat terhadap toksisitas Fe (200 ppm Fe) sedangkan Numbu tergolong toleran terhadap toksisitas Fe hingga konsentrasi 200 ppm.
Numbu
ZH 3
0-
29-07
B
-69
0 ppm 50 ppm 100 ppm 150 ppm 200 ppm
Konsentrasi FeSO4.EDTA
Genotip
e S
or
gu
24
Tabel 9 Persentase dan skala skoring bronzing daun pada berbagai genotipe Geno-
Angka rataan yang diikuti oleh huruf yang sama pada kolom sama tidak berbeda nyata pada uji DMRT 5%.
SIMPULAN
Konsentrasi Fe di atas 200 ppm menyebabkan pertumbuhan semua genotipe sorgum terhambat dan mati karena toksisitas Fe. Keragaan tanaman sorgum Numbu pada kondisi tercekam Fe paling besar berdasarkan variabel pertumbuhan yang diamati dibandingkan genotipe lainnya. Panjang akar, bobot basah tajuk, bobot basah akar, bobot kering tajuk dan bobot kering akar dapat dijadikan sebagai karakter seleksi sorgum pada kondisi toksisitas Fe. Konsentrasi 200 ppm merupakan konsentrasi yang mampu digunakan untuk seleksi toleransi genotipe sorgum terhadap toksisitas Fe berdasarkan hasil analisis Reduction Concentration 50 (RC50) terhadap variabel panjang akar, bobot basah tajuk dan
DAFTAR PUSTAKA
Amnal. 2009. Respon fisiologi beberapa varietas padi terhadap cekaman besi [tesis]. Bogor (ID): Institut Pertanian Bogor.
Asch F, Becker M, Kpongor DS. 2005. A quick and efficient screen for tolerance to iron toxicity in lowland rice. J Plant Nutr Soil Sci. 168:764–773.
Aung T. 2006. Physiological mechanisms of iron toxicity tolerance in lowland rice [thesis]. Faculty of Agriculture, Rheinische Friedrich-Wilhelms-Universität zu Bonn.
Barker AV, Pilbeam DJ. 2007. Hand Book of Plant Nutrition. New York (US): CRC Press.
Batty LC, Younger PL. 2003. Effects of external iron concentration upon seedling growth and uptake of Fe and phosphate by the common reed. Phragmites australis (Cav.) Trin ex. Steudel.Ann Bot 92: 801-806,
De Oliveira-Jucoski G, Cambraia J, Riveiro C, Alves-De Oliveira J, Oliveira-De Paula S, Oliva MA. 2013. Impact of iron toxicity on oxidative metabolism in young Eugenia uniflora L. plants. Acta Physiol Plant 35(5):1645-1657. Dicko MH, Gruppen H, Traore AS, van Berkel WJH, Voragen AGJ. 2006.
Sorghum grain as human food in Africa: relevance of content of starch and amylase activities. Afr J Biotechnol. 5(5):384-395.
Dobermann A, Fairhurst T. 2002. Rice: Nutrient Disorders & Nutrient Management. International Rice Research Institute (IRRI). Potash & Phophate Institute/Potash & Phosphate Institute of Canada.
Dordolot S, Lutts S, Bertin P. 2005. Effects of ferrous iron toxicity on the growth and mineral composition of an interspecific rice. J Plant Nutr 28(1): 1-20 Dufey, Hiel MP, Hkizamana P, Draye X, Lutts S, Kone B, Drame KN, Konate
KA, Sie M, Bertin P. 2009. Multi-environment QTL mapping and consistency across environment of resistance mechanisms to ferrous iron toxicity in rice. Second African Rice Congress.
Engel K, Arsch F, Becker M. 2012. In vivo staining of reduced iron by 2.2 bypiridine in rice axposed to iron toxicity. J Plant Nutr Soil Sci. 175:548-552.
Fageria NK, Santos AB, Barbosa FMP, Guimares CM. 2008. Iron toxicity in lowland rice. J Plant Nutr. 31:1678-1697
Firdausya AF. 2015. Penapisan cepat terhadap cekaman kekeringan serta induksi embriogenesis somatik dan organogenesis beberapa genotipe gandum [tesis]. Bogor (ID): Institut Pertanian Bogor
Foy CD, Chaney RL, White MC. 1978. The physiology of metal toxicity in plants. Ann Rev Plant Physiol. 29:511-566
26
Gomes MP, de Sa e TCLLMM, de Oliveira GNM, de Castro MM, Soares MM. 2011. Ecophysiological and anatomical changes due to uptake and accumulation of heavy metal in Brachiaria decumbens. Sci Agric. 68(5): 566-573
Handoko. 1993. Klimatologi Dasar. Jakarta (ID): Pustaka Jaya.
House LR. 1985. A guide to sorghum breeding. India: International Crops Research Institute for Semi-Arid Tropics (ICRISAT).
Kasno A. 2009. Keracunan besi pada sawah bukaan baru dan penanggulangannya. Balai Besar Padi Depatemen Pertanian
Kemenristek. 2012. Potensi tanaman sorgum untuk menopang ketahanan pangan nasional. Diunduh pada:http://ristek.go.id/index.php [8 Oktober 2014]. Mehbaran P, Zadeh AA, Sadeghipour HR. 2008. Iron toxicity in rice (Oryza
sativa L.), under different potassium nutrion. Asian J Plant Sci. 7(3):251-259
Mulleriyawa RP. 1966. Some factors influencing bronzing, a physiological disease of rice in Ceylon [tesis] Phillipines (PH): Univ. Phillipines.
Nazemi D, Hairani A, Nurita. 2012. Optimalisasi pemanfaatan lahan rawa pasang surut melalui pengelolaan lahan dan komoditas. Agrovigor. 5(1):52-57. Nenova V. 2006. Effect of iron supply on growth and photosystem II efficiency of
plea plants. Gen Appl Plant Phsyiology 1:81-90.
Noor M. 2004. Lahan Rawa, Sifat dan Pengelolaan Tanah Bermasalah Sulfat Masam. Jakarta (ID): Raja Grafindo Persada.
Noor A, Khairuddin. 2013. Keracunan besi pada padi: aspek ekologi, fisiologi-agronomi. Seminar Nasional Inovasi Teknologi Pertanian 2013.
Noya AI. 2014. Adaptasi kedelai pada lahan sulfat masam dengan teknologi budidaya jenuh air [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Ohki K. 1987. Aluminium stress on sorghum growth and nutrient relationships. induced by ferrous iron. Plant Soil. 149:227–234.
Ponnamperuma FN. 1972. The chemistry of submerged soils. Adv Agron. 24:29-36.
Razavi SM, Nazemiyeh H, Hajiboland R, Kumaramasamy Y, Delazar A, Nahar L 2008. Coumarins from aerial parts of Prangos uloptera. Brazilian Journal of Pharmacogonosy 18: 1-5.
Sahrawat K.L. 2004. Iron to xicity in wetland rice and the role of other nutrient. J Plant Nutr. 27(8):1471-1504.
Santandrea G, Tani C, Bennici A. 1998. Cytological and ultrastructural response of Nicotiana tabacum L. roots to manganese stress. Plant Biosyst. 132:197-206.
Sarwani M. 2004. Pengelolaan air dan produktivitas lahan rawa pasang surut, pengalaman dari Kalimantan Selatan dan Tengah. Badan Litbang Pertanian.
Banjarbaru. Diunduh pada:
Shabala S. 2010. Physiological and cellular aspect of phitotoxicity tolerance in plants: therole of membrane transporters and implications for crop breeding for waterlogging tolerance. New Phytol.190(2): 289-298.
Shamshuddin J, Syarwani M, Fauziah S, van Ranst I. 2004. A laboratory study on pyrite oxidation in acid sulphate soils. Soil Sci Plant Anal. 35(1):117-129. Shimizu A, Guerta CQ, Gregorio GB, Ikehashi H. 2005. Improved mass screening
of tolerance to iron toxicity in rice by lowering temperature of culture solution. J Plant Nutr. 28(9): 1481-1493.
Skeen JR. 1992. The tolerance limit of seedlings for aluminum and the antagonism of calcium. Soil Sci. 27:69-80.
Snowden RED, Wheeler BD. 1993. Iron toxicity to fen plant speseis. J ecology: 35-46.
Soil Survey Staff. 2010. Keys to soil taxonomy. Washington (US): United States Department of Agriculture Natural Resources Conservation Service.
Sopandie D. 2013. Fisiologi Adaptasi Tanaman terhadap Cekaman Abiotik pada Agroekosistem Tropika. Bogor (ID): IPB press
Sulistyono E, Suwarno, Lubis 1. 2011. Karakterisasi morfologi dan fisiologi untuk mendapatkan marka morfologi dan fisiologi padi sawah tahan kekeringan (-30kPa) dan produktivitas tinggi (>8 t/ha). Agrovigor. 6(2): 92-102
Suriadikarta RA, Setyorini D. 2006. Teknologi pengolahan lahan sulfat masam.Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian.
Susilowati SP, Saliem HP. 2013. Perdagangan sorgum di pasar dunia dan asia serta prospek pengembangannya di Indonesia. Di dalam : Sumarno, Damardjati DS, Syam M, Hermanto, editor. Sorgum Inovasi dan Teknologi Pengembangan; Jakarta (ID): IAARD Press.
Tadano T. 1975. Devices of rice roots to tolerate high iron concentrations in growth media. Jpn Agric Res Q. 9:34-39.
Tanaka A, Yoshida S. 1970. Nutritional disorders of the rice plant in Asia. Int. Rice. Res.Inst. Tech. Bull. 10. Makati Rizal P. I:55.
Tjitrosoepomo G. 2000. Morfologi Tumbuhan. Yogyakarta (ID): Gadjah Mada University Press
Ussiri DAN, Johnson CE. 2004. Sorption of organic carbon fractions by spododsol mineral horizons. Soil Sci Soc Am J. 68:253-262.
Wan JL, Zhai HQ, Wan JM, Ikehashi H. 2003. Detection and analysis of QTLs for ferrous iron toxicity tolerance in rice, Oryza sativa L. Euphytica 131: 201–206.
Ward JT, Lahner B, Yakubova E, Salt DE, Raghothama KG. 2008. The effect of iron on the primary root elongation of Arabidopsis during phospate deficiency. Plant Physiol. 147:1181–1191
Widjaja-Adhi IPG, Nugroho K, Suriadikarta DA, Syarifudin A. 1992. Sumber
Daya Lahan Rawa: Potensi, Keterbatasan dan Pemanfaatan. Jakarta (ID):
28
RIWAYAT HIDUP
Penulis dilahirkan di Lahat pada tanggal 3 Oktober 1993 dari ayah Hidayat dan ibu Sampiana. Penulis adalah putri pertama dari tiga bersaudara. Tahun 2011 penulis lulus dari SMA Negeri 4 Lahat dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Beasiswa Utusan Daerah (BUD) dan diterima di Departemen Agronomi dan Hortikultura, Fakultas Pertanian.