OPTIMASI SINTESIS SURFAKTAN ALKANOLAMIDA
DARI ASAM LAURAT DENGAN DIETANOLAMINA
DAN N-METIL GLUKAMINA
SECARA ENZIMATIK
DISERTASI
Oleh
ZUHRINA MASYITHAH
068103007/KM
PROGRAM DOKTOR ILMU KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
OPTIMASI SINTESIS SURFAKTAN ALKANOLAMIDA
DARI ASAM LAURAT DENGAN DIETANOLAMINA
DAN N-METIL GLUKAMINA
SECARA ENZIMATIK
DISERTASI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Doktor
dalam Program Studi Ilmu Kimia pada Fakultas Matematika dan
Ilmu Pengetahuan Alam Universitas Sumatera Utara
Oleh
ZUHRINA MASYITHAH
068103007/KM
PROGRAM DOKTOR ILMU KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
Judul Disertasi : OPTIMASI SINTESIS SURFAKTAN ALKANOLAMIDA DARI ASAM LAURAT DENGAN DIETANOLAMINA DAN N-METIL GLUKAMINA SECARA ENZIMATIK
Nama Mahasiswa : Zuhrina Masyithah Nomor Pokok : 068103007
Program Studi : Program Doktor Ilmu Kimia
Menyetujui Komisi Pembimbing
(Prof. Dr. Seri Bima Sembiring, M.Sc.) Promotor
(Prof. Dr. Zul Alfian, M.Sc.) (Dr. Ir. Tjahjono Herawan, M.Sc.) Co Promotor Co Promotor
Ketua Program Doktor Ilmu Kimia, Dekan Fakultas MIPA,
(Prof. Basuki Wirjosentono, MS., Ph.D.) (Prof. Dr. Eddy Marlianto, M.Sc.)
PROMOTOR
Prof. Dr. Seri Bima Sembiring, M.Sc.
Guru Besar Kimia Bidang Kimia Anorganik
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
CO-PROMOTOR
Prof. Dr. Zul Alfian, M.Sc.
Guru Besar Kimia Bidang Kimia Analitik
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
CO-PROMOTOR
Dr. Ir. Tjahjono Herawan, M.Sc.
Peneliti Madya Bidang Teknologi Pasca Panen
TIM PENGUJI
Ketua
: Prof. Dr. Seri Bima Sembiring, M.Sc.
Guru Besar Kimia Bidang Kimia Anorganik
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Anggota:
Prof. Dr. Zul Alfian, M.Sc.
Guru Besar Kimia Bidang Kimia Analitik
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Dr. Ir. Tjahjono Herawan, M.Sc.
Peneliti Madya Bidang Teknologi Pasca Panen
Pusat Penelitian Kelapa Sawit
Medan
Prof. Basuki Wirjosentono, M.S., Ph.D.
Guru Besar Kimia Bidang Kimia Fisika Polimer
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Prof. Dr. Ir. Sumono, M.S.
Guru Besar Pertanian Bidang Teknologi Tanah dan Air
Fakultas Pertanian
Universitas Sumatera Utara
Prof. Dr. Yunazar Manjang
HALAMAN PERNYATAAN ORISINALITAS
Disertasi ini adalah hasil karya penulis sendiri, dan semua sumber baik yang dikutip
maupun dirujuk telah penulis nyatakan dengan benar.
Nama : Zuhrina Masyithah
NIM : 068103007
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini:
Nama : Zuhrina Masyithah
NIM : 068103007
Program Studi : Doktor Ilmu Kimia Jenis Karya : Disertasi
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-ekslusif (Non-Exclusive Royalty Free Right) atas disertasi saya yang berjudul:
OPTIMASI SINTESIS SURFAKTAN ALKANOLAMIDA
DARI ASAM LAURAT DENGAN DIETANOLAMINA DAN N-METIL GLUKAMINA SECARA ENZIMATIK
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-ekslusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media/formatkan, mengelola dalam bentuk database, merawat dan mempublikasikan disertasi saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan pemilik hak cipta.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Medan Pada Tanggal : Januari 2010 Yang menyatakan
KATA PENGANTAR
Segala puji bagi Allah SWT yang telah melimpahkan rahmat dan hidayahNya sehingga penulis dapat menyelesaikan penelitian dan penulisan disertasi ini.
Sebagai insan yang senantiasa mengenang budi baik sesama, perkenankanlah saya menyampaikan rasa hormat dan terima kasih serta penghargaan yang setinggi-tingginya kepada yang terhormat:
1. Rektor Universitas Sumatera Utara, Prof. Chairuddin P. Lubis, DTM&H, Sp.A(K), yang telah memberi kesempatan kepada penulis untuk mengikuti program pendidikan Doktor Ilmu Kimia pada Fakultas Matematika dan Ilmu Pengetahuan Alam USU dan berkenan memberikan bantuan pendidikan.
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam USU, Prof. Dr. Eddy Marlianto, M.Sc., atas bantuan dan proses administrasi yang baik di Fakultas MIPA USU.
3. Ketua Program Studi S3 Ilmu Kimia, Prof. Basuki Wirjosentono, MS., Ph.D. dan Sekretaris Program Studi S3 Ilmu Kimia Prof. Dr. Harry Agusnar, M.Sc. M.Phil., yang telah memberikan dorongan dan bantuan kepada penulis.
4. Promotor, Prof. Dr. Seri Bima Sembiring, M.Sc., Co-promotor Prof. Dr. Zul Alfian, M.Sc. dan Co-promotor Dr. Ir. Tjahjono Herawan, M.Sc., yang dengan kesabaran dan tanpa bosan-bosannya telah banyak memberikan bimbingan dan pemikiran, serta memacu saya dalam menyelesaikan disertasi ini. Terima kasih juga disampaikan kepada Prof. Dr. Hemat R. Brahmana, M.Sc. selaku Promotor di awal penelitian ini.
5. Tim Penguji, Prof. Dr. Seri Bima Sembiring, M.Sc., Prof. Dr. Zul Alfian, M.Sc., Dr. Ir. Tjahjono Herawan, M.Sc., Prof. Dr. Basuki Wirjosentono, MS., Ph.D., Prof. Dr. Ir. Sumono, MS. dan Prof. Dr. Yunazar Manjang, diucapkan terima kasih atas kesediaannya mengikhlaskan waktu untuk memberikan penilaian maupun masukan sehingga terselesaikannya disertasi ini.
6. Direktur Pusat Penelitian Kelapa Sawit Medan beserta seluruh staff dan teknisi, atas segala fasilitas dan bantuan yang diberikan sehingga penelitian ini dapat terlaksana.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Direktorat Pembinaan Penelitian dan Pengabdian pada Masyarakat, Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional yang mendanai penelitian disertasi ini melalui program penelitian Hibah Bersaing, Surat Perjanjian No. 002/SP2H/PP/DP2M/III/2008 dan Hibah Strategis Nasional, Surat Perjanjian No. 078/H5.1.R/KEU/2009.
Akhir kata, terima kasih kepada keluarga H. Muhammad Aziz Ibrahim dan keluarga H. Tenteng Ginting, atas bantuan moral maupun materil. Kepada suami penulis Prof. Dr. Ir. Armansyah Ginting, M.Eng. dan anak-anak tercinta Muhammad Fadhil Ginting dan Nurul Izzati Ginting, pengertian, kesabaran dan dorongan yang diberikan sepanjang penyelesaian disertasi ini adalah sesuatu yang amat berarti. Semoga Allah SWT senantiasa melimpahkan rahmatNya.
Medan, Januari 2010
DAFTAR RIWAYAT HIDUP
I. DATA PRIBADI
Nama : Zuhrina Masyithah
NIP : 19710905 199512 2001
Tempat dan Tanggal Lahir : Pematang Siantar, 5 September 1971 Golongan/Jabatan Fungsional : IV b / Lektor Kepala
Perguruan Tinggi : Universitas Sumatera Utara
Alamat : Fakultas Teknik, Jl. Almamater Kampus USU,
Medan 20155
II. RIWAYAT PENDIDIKAN PERGURUAN TINGGI
Tahun Lulus
Pendidikan Nama Sekolah/Perguruan Tinggi Jurusan/ Bidang Studi
1983 SD SD Negeri I Langsa, Aceh Timur -
1986 SMP SMP II Harapan, Medan -
1989 SMA SMA Harapan, Medan Fisika
1995 S-1 Universitas Sumatera Utara, Medan Teknik Kimia
2001 S-2 University Kebangsaan Malaysia,
Malaysia
Teknik Kimia
III. PENGALAMAN JABATAN
Jabatan Institusi Tahun ... s.d. ... Staf Akademik Departemen
Teknik Kimia
Fakultas Teknik USU 1995 – sekarang
Staf Akademik Magister Teknik Kimia
Sekolah Pasca Sarjana USU 2002 – sekarang
Sekretaris Program Magister Teknik Kimia Sekolah Pasca Sarjana USU
2001 – 2005
Kepala Laboratorium Kimia Fisika
Fakultas Teknik USU 2001 – sekarang
IV. PENGALAMAN MENGAJAR (5 tahun terakhir)
Mata Kuliah Jenjang Institusi/Program Analisis Proses Teknik Kimia S-2 USU/ Magister Teknik Kimia Teknik Reaksi Kimia Lanjut S-2 USU/ Magister Teknik Kimia
Rancangan Percobaan S-2 USU/ Magister Teknik Kimia
Mekanika Fluida dan Partikel (OTK 1)
S-1 USU/ Teknik Kimia
Perpindahan Panas (OTK II) S-1 USU/ Teknik Kimia Proses Pemisahan I (OTK III) S-1 USU/ Teknik Kimia Proses Pemisahan II (OTK IV) S-1 USU/ Teknik Kimia
V. PELATIHAN PROFESIONAL
Tahun Pelatihan Penyelenggara
2000 Pelatihan Simulasi Proses Teknik Kimia menggunakan HYSYS
Departemen Teknik Kimia dan Proses UKM, Malaysia. 2000 Pelatihan Computational Fluid Dynamic
menggunakan software Fluent
Departemen Teknik Kimia dan Proses UKM, Malaysia.
VI. KARYA TULIS ILMIAH YANG BERKAITAN DENGAN DISERTASI
No .
Tahun Judul Penerbit/Jurnal
1. 2010 The Optimizations on the Synthesis of Lauroyl-N-methyl glucamide for Cosmetics Supplies
Abstrak sudah dikirim untuk International Oil Palm Conference (IOPC 2010), 1-3 Juni, Jogjakarta.
2. 2009 Studi Metode Permukaan
Sambutan pada Sintesis Surfaktan Alkanolamida Menggunakan Enzim Lipase
Telah diterima untuk diterbitkan pada jurnal nasional
terakreditasi, Jurnal Penelitian Kelapa Sawit.
3. 2009 Pembuatan Alkil -Dietanolamida sebagai Biosurfaktan secara Enzimatik
Peringkat 5 pada Seminar Nasional Masyarakat Kelapa Sawit Indonesia (MAKSI), 24-25 November 2009, Bogor.
4. 2009 Enzymatic Synthesis of Fatty Alkanolamides by Amidification Reaction
International Seminar on Chemistry dan Polymer, USU.
5. 2008 Amidifikasi Enzimatik pada Sintesis lauril-dietanolamida
Jurnal nasional terakreditasi, Jurnal Penelitian Kelapa Sawit, 16(3), 147-162.
6. 2008 Sintesis Alkanolamida dari Fraksi Minyak Inti Sawit Secara
Enzimatik: Optimasi
Menggunakan Rancangan Susunan Terpusat (Central Composite Design)
Seminar Internasional Soehadi Reksowardjojo 2008, Bandung 3-4 November 2008.
7. 2008 Sintesis biosurfaktan dietanolamida menggunakan lipase dari Rhizomucor miehei dan Candida antacrtica
Jurnal nasional terakreditasi, Jurnal Teknologi Proses, 7(2), 84-90.
8. 2007 Perbandingan Korelasi
Pencampuran Balik antara Kolom Aliran Osilasi dengan Kolom Berpengaduk Multi Peringkat
Jurnal nasional tidak
terakreditasi, Jurnal Teknik dan Teknologi, 2(2), 33-40.
9. 2007 Kajian Berbagai Jenis Surfaktan Karbohidrat dan Asam Amino yang Berasal dari Bahan Terbarukan
VII. PENGALAMAN PENELITIAN
Tahun Judul Penelitian Jabatan Sumber Dana
2008-2009
Pembuatan Surfaktan Alkanolamida antara minyak inti sawit yang kaya akan MCT dengan glukosamin
Ketua Hibah Bersaing
Tahun I dan II DIKTI 2009 Optimasi sintesis enzimatik
oleil-dietanolamida dari asam oleat dengan dietanolamina pada bioreaktor multi tahap
Anggota Hibah Strategis DIKTI
2003 Kajian pencampuran balik, gas tertahan dan titik banjir pada kolom berpengaduk multiperingkat
Ketua Penelitian Dosen Muda
2003 Penentuan tingkat pencampuran balik dan konversi reaksi safonifikasi pada reaktor berpengaduk multiperingkat
ABSTRAK
Optimasi sintesis dua jenis surfaktan alkanolamida yaitu lauroil-dietanolamida dan lauroil-N-metil glukamida, yang dapat digunakan sebagai formulasi pada bahan kosmetika dan farmasi diamati pada penelitian ini. Fraksi minyak inti sawit yaitu asam laurat diamidasi dengan dietanolamina menjadi lauroil-dietanolamida dan dengan N-metil glukamina menjadi lauroil-N-N-metil glukamida. Penelitian dilakukan menggunakan dua jenis enzim terimobilisasi yaitu lipase dari Rhizomucor miehei (Lipozym TL IM®) dan lipase dari Candida antarctica (Novozym 435®) serta sejumlah pelarut yaitu n-heksan, tert-butanol, tert-amilalkohol, dan isopropanol. Penelitian meliputi tiga tahap pekerjaan yaitu tahap pendahuluan, tahap optimasi dan tahap pengembangan proses. Pada tahap pendahuluan, variabel reaksi yang diamati adalah waktu reaksi, jenis dan konsentrasi enzim, jenis dan rasio pelarut, rasio molar substrat amina/asam laurat serta temperatur. Pada tahap optimasi, model regresi dan pengaruh interaksi dari konsentrasi Novozym, rasio molar substrat serta temperatur dioptimasikan untuk memperoleh respon konversi asam lemak dan persen yield yang maksimum. Optimasi dirancang mengikuti Rancangan Susunan Terpusat (CCD) dan dilakukan menggunakan Metode Permukaan Sambutan (RSM). Pada tahap pengembangan proses, dilakukan pengamatan penambahan amina bertahap, penerapan kondisi tanpa pelarut, recoveri enzim dan pembesaran skala sintesis pada bioreaktor multi-tahap. Hasil penelitian pendahuluan menunjukkan bahwa pada sintesis lauroil-dietanolamida, enzim Novozym dengan konsentrasi 10% (b/b AL), pelarut n-heksan dengan rasio pelarut 2:1 (v/b AL), rasio molar substrat (DEA/AL) 3:1, suhu 50oC dan waktu reaksi 24 jam memberikan hasil terbaik. Kondisi optimum yang diprediksi untuk sintesis lauroil-dietanolamida adalah rasio molar DEA:AL 3:1; konsentrasi Novozym, 10 % serta temperatur 50-55 oC, dan untuk sintesis lauroil-N-metil glukamida adalah rasio molar MGL:AL 1:1; konsentrasi Novozym, 8 % serta temperatur 50-55 oC. Reaksi pada kondisi optimum akan menghasilkan persen konversi asam laurat 73,05 % dan yield 77,82 % untuk lauroil-dietanolamida serta konversi asam laurat 64,52 % dan yield 97,59 % untuk sintesis lauroil-N-metil glukamida. Penambahan amina terbaik dilakukan secara 2-3 tahapan sedangkan penggunaan enzim hingga empat kali ulangan, masih memberikan hasil yang baik yang ditandai dengan kemampuan konversi asam laurat yang masih tinggi. Pembesaran skala sintesis menggunakan bioreaktor multi-tahap menunjukkan bahwa pada putaran motor 150 rpm (Rea 1618), pengaduk jenis B (paddle lengkung 45o) memberikan nilai persen konversi asam laurat yang lebih besar, manakala putaran motor 250 rpm (Rea 2697), secara keseluruhan pengaduk jenis A dan B memberikan perolehan persen konversi yang hampir sama. Untuk mengetahui terjadinya hasil reaksi amidasi dilakukan uji struktur dengan spektroskopi FT-IR dan 1H-NMR, serta untuk mengetahui nilai persen yield dilakukan analisa dengan HPLC. Selanjutnya dilakukan pengukuran HLB dan analisa sifat fisika lain dengan metode titrasi. Hasil penelitian ini diharapkan dapat menghasilkan surfaktan alkanolamida yang murah dan alami karena diperoleh dari bahan baku yang dapat diperbaharui dan diolah melalui proses yang dapat diterima secara ekologis.
ABSTRACT
The optimizations on the synthesis of two surfactants namely lauroyl-diethanolamide and lauroyl-N-methyl glucamide, which can be used in formulating cosmetics and pharmacy supplies, are studied. The fraction of palm kernel oil namely lauric acid was amidificationed with diethanolamide and N-methyl glucamine to form lauroyl-diethanoamide and lauroil-N-methyl glucamide, respectively. Study was carried out by using two immobilized enzymes namely lipase from Rhizomucor miehei (Lipozyme TL IM®) and lipase from Candida antarctica (Novozyme 435®), and a numbers of solvent namely n-hexane, tert-butanol, tert-amylalcohol and isopropanol. Study consists of three stages of work, i.e. preliminary stage, optimization stage, and development process stage. In the preliminary stage, the reaction variables observed were reaction time, enzyme’s type and concentration, solvent’s type and ratio, molar ratio of substrate (amine/lauric acid), and temperature. In the optimization stage, regression model and the interactions of Novozym concentration, molar ratio of substrate, and temperature were optimized to obtain response of lauric acid conversion and percentage of maximum yield. Optimization was carried out by utilizing the Central Composite Design (CCD) and Response Surface Methodology (RSM). In the development process stage, the frequent addition of amine was observed, the condition without solvent, enzyme recovery and synthesis scale up in multistage bioreactor were implemented. The results of preliminary stage show that in the synthesis of lauroyl-dietanolamide, the Novozym with concentration of 10% (b/b AL), n-hexane with solvent ratio 2:1 (v/b AL), molar substrate ratio (DEA/AL) 3:1, temperature of 50 oC and reaction time of 24 hours, give the best performance. The expected optimum condition in the synthesis of lauroyl-diethanolamide was at molar ratio DEA:AL 3:1; Novozym concentration of 10% at temperature of 50-55 oC, and in the synthesis of lauroyl-N-methyl glucamide was at molar ratio MGL:AL 1:1; Novozym concentration of 8% at temperature of 50-55
o
C. The reactions at the optimum condition produce the percentage of lauric acid convertion of 73.05% and yield of 77.85% for the synthesis of lauroyl-diethanolamide and the convertion of lauric acid of 64.5% and yield of 97.59% for the synthesis of lauroyl-N-methyl glucamide. The best addition of amine was done by 2-3 stages while the enzyme usage was up to 4 times of repetition, and it was indicated by the high conversion performance of lauric acid. The synthesis scale up using multi-stage bioreactor show that at motor rotation of 150 rpm (Rea 1618), stirrer type B (45o
paddle) gives higher percentage of lauryl acid conversion, while at motor rotation of 250 rpm (Rea 2697), in overall stirrer A and B gives similar result of lauryl acid
conversion. For the purpose of verifying of amidification reaction, spectroscopy FT-IR and 1H-NMR were carried out for structure testing while HPLC analysis was done for the magnitude of yield percentage. Moreover, the HLB measurement and the other analyses of physical property were done by titration method. The expectation output of the study in this research is producing the economic and natural alkanolamide surfactant because it is made of renewable raw materials and produced under ecologically acceptable process.
DAFTAR ISI
Halaman
KATA PENGANTAR ……… i
DAFTAR RIWAYAT HIDUP ………... iii
ABSTRAK ………. vi
ABSTRACT ………. vii
DAFTAR ISI ……….. viii
DAFTAR TABEL ……….. x
DAFTAR GAMBAR ………. xii
DAFTAR LAMPIRAN ……….. xvii
DAFTAR SINGKATAN DAN LAMBANG ………. xviii
BAB I PENDAHULUAN ……… 1
1.1 Latar Belakang ……… 1
1.2 Perumusan Masalah ………. 9
1.3 Tujuan Penelitian ………. 9
1.4 Hipotesis Penelitian ………. 10
1.5 Manfaat Penelitian ……….. 10
BAB II TINJAUAN PUSTAKA …..……… 12
2.1 Surfaktan ... 12
2.2 Surfaktan Alkanolamida ... 15
2.2.1 Dietanolamida ... 18
2.2.2 N-metil glukamida ... 19
2.3 Asam Lemak ... 20
2.4 Asam Laurat dari Minyak Inti Sawit ………... 22
2.4.1 Minyak Inti Sawit ………. 24
2.4.2 Asam Laurat ... 24
2.5 Sintesis Alkanolamida secara Enzimatik ... 24
2.6 Lipase ... 29
2.6.1 Lipase dalam Industri Oleokimia ... 32
2.6.2 Fungsi dan Cara Kerja Lipase ... 33
2.7 Reaktor Berpengaduk Multitahap ... 34
2.8 Penentuan Nilai HLB ... 36
2.9 Metode Permukaan Sambutan ... 37
BAB III METODE PENELITIAN ... 40
3.1 Bahan dan Peralatan Penelitian ... 40
3.2 Tahapan Penelitian ……….. 41
3.2.1 Penelitian Pendahuluan ……… 41
3.2.2 Penelitian Optimasi ……….. 45
3.2.3 Penelitian Pengembangan Proses ... 48
BAB IV HASIL DAN PEMBAHASAN ………... 53
4.1 Penelitian Pendahuluan ... 53
4.1.1 Penentuan Jenis Enzim ... 53
4.1.2 Penentuan Waktu Reaksi ... 55
4.1.4 Penentuan Rasio Pelarut ... 59
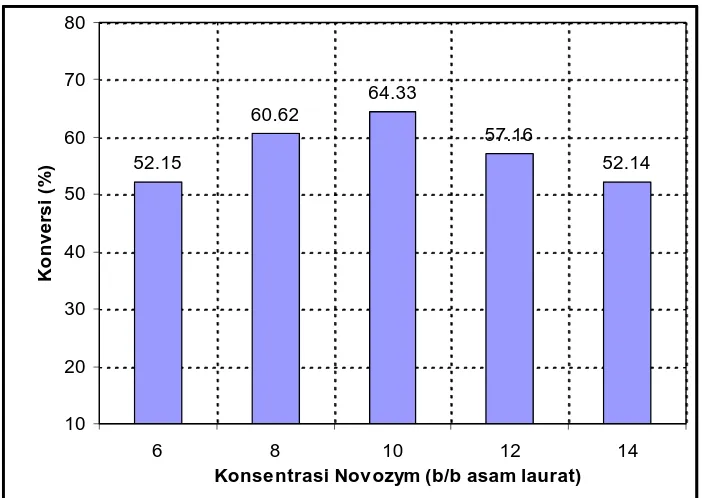
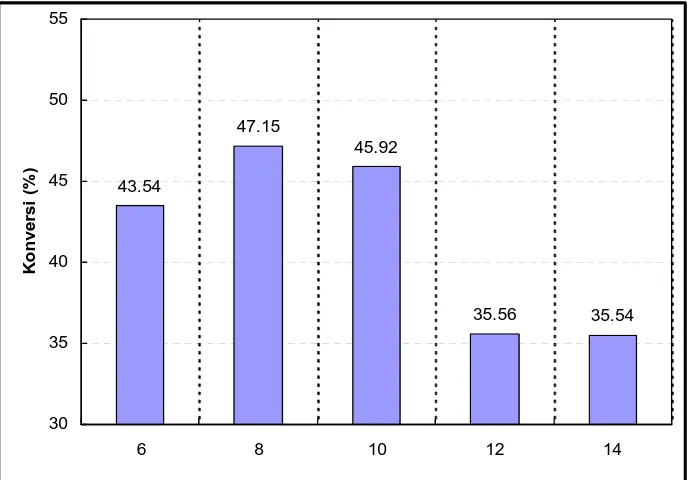
4.1.5 Penentuan Konsentrasi Enzim ... 61
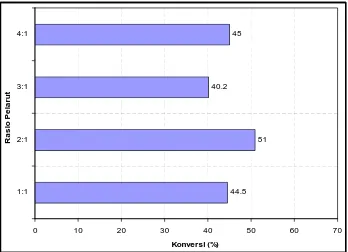
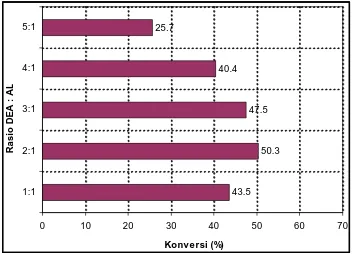
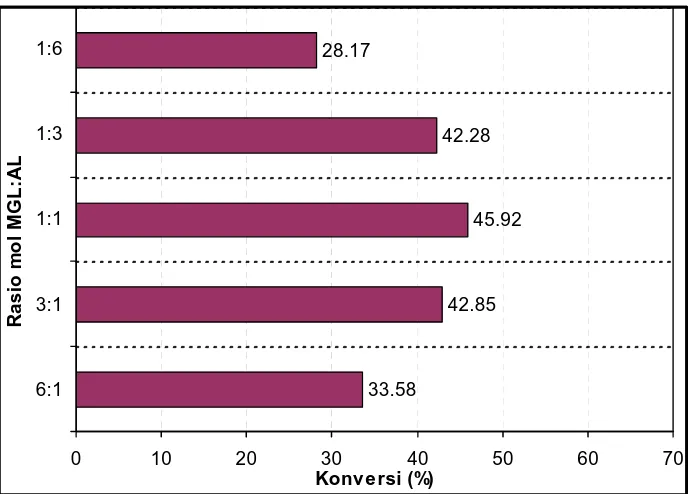
4.1.6 Penentuan Rasio Molar Substrat ... 62
4.1.7 Penentuan Level Temperatur ... 64
4.2 Hasil Optimasi Kondisi Penelitian ... 66
4.2.1 Optimasi Sintesis Lauroil-dietanolamida ... 67
4.2.2 Optimasi Sintesis Lauroil-N-metil glukamida ... 78
4.3 Penelitian Pengembangan Proses ... 89
4.3.1 Penambahan Amina Bertahap ... 90
4.3.2 Sintesis tanpa Pelarut ... 93
4.3.3 Penggunaan Asam Oleat ... 95
4.3.4 Pembesaran Skala Menggunakan Bioreaktor ... 105
4.3.5 Recoveri Enzim ... 108
4.4 Analisis dan Karakterisasi Produk ... 111
4.4.1 Analisis Spektrum FTIR ... 112
4.4.2 Analisis Spektrum 1H-NMR ... 119
4.4.3 Analisis Spektrum HPLC ... 125
4.4.4 Analisis Sifat Fisika Kimia ... 132
BAB V KESIMPULAN DAN SARAN ... 134
5.1 Kesimpulan ... 134
5.2 Saran ... 135
DAFTAR PUSTAKA ... 136
DAFTAR TABEL
Nomor Judul Halaman
1.1 Pengaruh rasio mol bahan baku dan pelarut terhadap
yield berbagai alkanolamida ... 6
2.1 Jenis Aliran dalam Tangki ... 36
2.2 Nilai HLB berdasarkan gugus fungsi ... 37
3.1 Variabel dan level yang dikembangkan untuk sintesis
lauroil-dietanolamida ... 46
3.2 Variabel dan level yang dikembangkan untuk sintesis
lauroil-N-metil glukamida ... 46
3.3 Eksperimen aktual yang dilakukan dan dikembangkan dari
model ... 47
3.4 Rentang perubahan variabel operasi ... 50
4.1 Hasil Optimasi Sintesis Lauroil-dietanolamida ... 67
4.2 Hasil Prediksi Koefisien Regresi untuk Menyusun
Model Permukaan Sambutan Sintesis Lauroil-Dietanolamida ... 68
4.3 Hasil Analisis Variansi Model Permukaan Sambutan
untuk Sintesis Lauroil-Dietanolamida ... 70
4.4 Hasil Optimasi Sintesis Lauroil-N-metil glukamida ... 78
4.5 Hasil Prediksi Koefisien Regresi untuk Menyusun Model Permukaan Sambutan Sintesis Lauroil-N-metil
Glukamina ... 79
4.6 Hasil Analisis Variansi Model Permukaan Sambutan
untuk Sintesis Lauroil-N-metil glukamida ... 80
4.7 Hasil Optimasi Sintesis Oleoil-Dietanolamida ... 95
4.8 Hasil Prediksi Koefisien Regresi untuk Menyusun
Model Permukaan Sambutan Sintesis Oleoil-Dietanolamida .... 96
4.9 Hasil Analisis Variansi Model Permukaan Sambutan
Nomor Judul Halaman
4.10 Hasil Analisis HPLC Bahan Baku Sintesis
Lauroil-Dietanolamida ... 126
4.11 Hasil Analisis HPLC sintesis Lauroil-Dietanolamida ... 126
4.12 Hasil Analisis HPLC Bahan Baku Sintesis Lauroil-N-metil glukamida ... 128
4.13 Hasil Analisis HPLC sintesis Lauroil-N-metil glukamida ... 129
4.14 Hasil Analisis HPLC Bahan Baku dan Produk Sintesis Oleoil-dietanolamida ………... 131
4.15 Karakteristik Produk Lauroil-dietanolamida ... 132
4.16 Karakteristik Produk Lauroil- N-metil glukamida ... 132
DAFTAR GAMBAR
Nomor Judul Halaman
1.1 Reaksi pembentukan lauroil-dietanolamida dari asam laurat dan
dietanolamina ... 3
1.2 Reaksi pembentukan lauroil-N-metil glukamida dari asam laurat dan N-metil glukamina ……… 4
1.3 Skema reaksi amidasi asam oleat dengan N-metil glukamina oleh Maugard, dkk. (1998). (Keterangan: (1) amina, (2) asam oleat, (3a) amida, (4a) ester, (5a) amida-ester) ... 7
1.4 Hasil analisa HPLC secara bertahap pada amidasi N-metil glukamina dengan asam oleat oleh Maugard, dkk. (1998) ……. 7
2.1 Beberapa jenis surfaktan alkanolamida ... 16
2.2 Sintesis alkanolamida dari asam lemak ... 17
2.3 Sintesis alkanolamida dari ester asam lemak ... 17
2.4 N-metil glukamida membentuk pasangan ion dengan adanya asam lemak (Sumber: Maugard, dkk. (1998) ... 25
2.5 Gambar reaktor CSTR seri (Mohd Sobri Takrif, dkk. 1998) ... 34
2.6 Reaktor Berpengaduk Multitahap (Multistage Mechanically Agitated Compartmented , MSAC) ………. 35
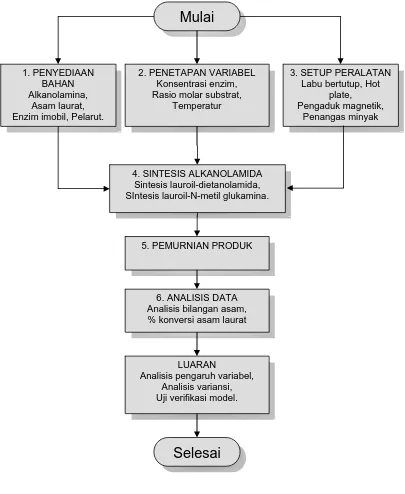
3.1 Bagan Alir Penelitian Pendahuluan ... 42
3.2 Sintesis lauroil-dietanolamida ... 43
3.3 Sintesis lauroil-N-metil glukamina ... 44
3.4 Bagan Alir Penelitian Optimasi ... 45
3.5 Bagan Alir Penelitian Pengembangan Proses ... 48
3.6 Skema reaksi sintesis oleoil-dietanolamida ... 49
3.7 Skema Reaktor Berpengaduk Multi-tahap dan Jenis-jenis Turbin yang Digunakan dalam Sintesis ... 51
Nomor Judul Halaman
4.2 Penentuan Jenis Enzim dan Waktu Reaksi pada Sintesis Lauroil-N-metil glukamida dari AL+MGL (Rasio MGL:AL 2:1, Pelarut n-heksan, Konsentrasi Enzim 10 % (b:b AL), T=30 o
C) ... 55
4.3 Penentuan Jenis Pelarut pada Sintesis Lauroil-dietanolamida dari AL+DEA (Rasio DEA:AL 2:1, onsentrasi Novozym 10 %
(b:b AL), T=30 oC, t = 24 jam) ... 58
4.4 Penentuan Jenis Pelarut pada Sintesis Lauroil- N-metil glukamida dari AL+MGL (Rasio MGL:AL 2:1, onsentrasi
Novozym 10 % (b:b AL), T=30 oC, t = 24 jam) ... 59
4.5 Penentuan Rasio Pelarut n-heksan:AL pada Sintesis Lauroil- dietanolamida dari AL+DEA (Pelarut n-heksan, Konsentrasi
Novozym 10 % (b:b AL), T=30 oC, t = 24 jam) ... 60
4.6 Penentuan Rasio Pelarut tert-amil alkohol:AL pada Sintesis Lauroil-N-metil glukamida dari AL+MGL (Pelarut tert-amil alkohol, Konsentrasi Novozym 10 % (b:b AL), T=30 oC, t = 24
jam) ... 60
4.7 Pengaruh Konsentrasi Novozym pada Sintesis Lauroil-dietanolamida dari AL+DEA Rasio DEA:AL 2:1, Pelarut
n-heksan, T=30 oC, t = 24 jam) ... 61
4.8 Pengaruh Konsentrasi Novozym pada Sintesis Lauroil-
N-metil glukamida dari AL+MGL (Rasio MGL:AL 2:1, Pelarut
tert-amil alkohol, T=30 oC, t = 24 jam) ... 62
4.9 Penentuan Rasio Substrat pada Sintesis Lauroil-dietanolamida dari AL+DEA (Pelarut n-heksan, Konsentrasi Novozym 10 %
(b:b AL), T=30 oC, t = 24 jam) ... 63
4.10 Penentuan Rasio Substrat pada Sintesis Lauroil-N-metil glukamida dari AL+MGL (Pelarut tert-amil alkohol,
Konsentrasi Novozym 10 % (b:b AL), T=30 oC, t = 24 jam) ... 64
4.11 Penentuan Level Temperatur pada Sintesis
Lauroil-dietanolamida dari AL+DEA (Rasio DEA:AL 2:1, Pelarut
n-heksan, Konsentrasi Novozym 10 % (b:b AL), t = 24 jam) ... 65
4.12 Penentuan Level Temperatur pada Sintesis Lauroil- N-metil glukamida dari AL+MGL (Rasio MGL:AL 2:1, Pelarut tert-amil alkohol, Konsentrasi Novozym 10 % (b:b AL), t = 24
Nomor Judul Halaman
4.13 Grafik probabilitas normal residual ... 71
4.14 Plot Residual dengan fitted value pada Sintesis
Lauroil-Dietanolamida ………. 2
4.15 Plot Residual dengan Order Model pada Sintesis
Lauroil-Dietanolamida ... 73
4.16 Respon permukaan dan kontur dari plot konsentrasi enzim
Novozym dan rasio mol dietanolamina:asam laurat ... 74
4.17 Respon permukaan dan kontur dari plot konsentrasi enzim dan
temperatur ... 76
4.18 Respon permukaan dan kontur dari plot temperatur dan rasio
mol substrat ... 77
4.19 Grafik probabilitas normal residual ………. 82
4.20 Plot Residual dengan fitted value pada Sintesis Lauroil-N-metil
glukamida ………... 82
4.21 Plot Residual dengan Order Model pada Sintesis
Lauroil-N-metil glukamida ……….. 83
4.22 Respon permukaan dan kontur dari plot konsentrasi enzim dan
rasio mol ... 84
4.23 Respon permukaan dan kontur dari plot konsentrasi enzim dan
temperatur ... 87
4.24 Respon permukaan dan kontur dari plot temperatur dan rasio
molar substrat ... 88
4.25 Pengaruh Penambahan Amina secara Bertahap Terhadap
Persen Konversi pada Sintesis Lauroil-Dietanolamida ... 91
4.26 Pengaruh Penambahan Amina secara Bertahap Terhadap
Persen Konversi pada Sintesis Lauroil-N-Metil Glukamida ... 92
4.27 Pengamatan Pengaruh Penggunaan Pelarut n-heksan Terhadap
Persen Konversi pada Sintesis Lauroil-Dietanolamida ... 94
4.28 Grafik probabilitas normal residual ... 98
4.29 Plot Residual dengan fitted value pada Sintesis
Nomor Judul Halaman
4.30 Plot Residual dengan Order Model pada Sintesis
Oleoil-Dietanolamida ... 99
4.31 Respon Permukaan dan Kontur dari Plot Konsentrasi Enzim
dan Rasio Mol Dietanolamina:Asam Oleat ... 100
4.32 Respon Permukaan dan Kontur dari Plot Konsentrasi Enzim
dan Temperatur ... 102
4.33 Respon Permukaan dan Kontur dari Plot Temperatur dan Rasio
Mol Substrat ... 104
4.34 Pengaruh Jenis Pengaduk pada Putaran Motor 150 rpm ... 107
4.35 Pengaruh Jenis Pengaduk pada Putaran Motor 250 rpm ... 107
4.36 Pengaruh Putaran Motor Pengaduk pada Pengaduk Jenis A
(turbin lurus) ... 107
4.37 Pengaruh Putaran Motor Pengaduk pada Pengaduk Jenis B
(turbin lengkung 45o) ... 107
4.38 Pengamatan Recovery Enzim pada Sintesis
Lauroil-Dietanolamida ……… 109
4.39 Pengamatan Recovery Enzim pada Sintesis Lauroil-N-metil
glukamida ……….. 111
4.40 Pengamatan Recovery Enzim pada Sintesis
Oleoil-Dietanolamida ……… 111
4.41 Hasil Spektra FTIR Bahan Baku Dietanolamina ... 113
4.42 Hasil Spektra FTIR Bahan Baku Asam Laurat ... 114
4.43 Hasil Spektra FTIR Lauroil-dietanolamida pada 40oC, 24 jam,
rasio mol DEA/AL 1/2, enzim 10 % (b/b), pelarut n-heksan .... 116
4.44 Hasil Spektra FTIR Lauroil-dietanolamida pada 40oC, 24 jam,
rasio mol DEA/AL 2/1, enzim 10 % (b/b) pelarut n-heksan ... 117
4.45 Hasil Spektra FTIR Bahan Baku N-metil glukamida ... 118
4.46 Hasil Spektra FTIR Lauroil-N-metil glukamida pada 45oC, 48 jam, rasio mol MGL/AL 4/1, enzim 12 % (b/b) dan pelarut
tert-amil alkohol ... 120
4.47 Hasil Spektra FTIR Lauroil-N-metil glukamida pada 42,6oC, 48 jam, rasio mol MGL/AL 3/1, enzim 10 % (b/b) dan pelarut
Nomor Judul Halaman
4.48 Hasil Spektra FTIR Lauroil-N-metil glukamida pada 50 oC, rasio mol MGL:AL 3:1, enzim 10 % (b/b) dan pelarut tert-amil
alkohol, waktu reaksi 0 – 68 jam ... 123
4.49 Hasil Spektra 1H-NMR senyawa Lauroil-dietanolamida
menggunakan internal standar TMS dan pelarut CDCl3 ... 124
4.50 Hasil Spektra 1H-NMR senyawa Lauroil-N-metil glukamida
menggunakan internal standar TMS dan pelarut CDCl3 ……… 127
4.51 Hasil Spektra 1H-NMR senyawa Oleoil-dietanolamida
menggunakan internal standar TMS dan pelarut CDCl3 ……… 127
4.52 Hasil Spektra HPLC bahan baku N-metil glukamina
menggunakan fasa gerak metanol:air:TFA (80: 20: 0,3 v/v/v) .. 130
4.53 Hasil Spektra HPLC senyawa Lauroil-N-metil glukamina menggunakan fasa gerak metanol:air:TFA (80: 20: 0,3 v/v/v) pada konsentrasi Novozym 6%, rasio molar MGL:AL = 2:1
DAFTAR LAMPIRAN
Nomor Judul Halaman
1 Hasil Spektra FTIR ... 141
2 Hasil Analisis HPLC ... 145
3 Prosedur Analisis Sifat Fisika Kimia ... 163
4 Tabel Uji Statistik ... 165
DAFTAR SINGKATAN DAN LAMBANG
Singkatan Nama Pemakaian pertama
kali pada halaman
CCD Central Composite Design 37
DEA Dietanolamina 46
EP-A European Patent Application 2
FTIR Fourier Transform-Infra Red 40
HLB Hidrophile Lipophile Balance 12
HPLC High Performance Liquid Chromatography 6
MEAL Metil Ester Asam Lemak 5
MGL N-metil glukamina 46
MSAC Reaktor berpengaduk multi tahap (Multistage Mechanically Agitated Compartmented )
8
PKL Palm kernel olein 4
PKS Palm kernel stearin 4
PLU Propyl Laurate Units 40
RSM Metode Permukaan Sambutan (Response Surface Methodology)
6
T Temperatur 54
TFA Tri fluoro acetic acid 40
Lambang Nama Pemakaian pertama
kali pada halaman
Da Diameter impeler 51
n Kecepatan putar (put/detik) 51
Rea Bilangan Reynolds agitasi 50
ρ Densitas fluida (kg/m3) 51
μ Viskositas (kg/m.detik) 51
ABSTRAK
Optimasi sintesis dua jenis surfaktan alkanolamida yaitu lauroil-dietanolamida dan lauroil-N-metil glukamida, yang dapat digunakan sebagai formulasi pada bahan kosmetika dan farmasi diamati pada penelitian ini. Fraksi minyak inti sawit yaitu asam laurat diamidasi dengan dietanolamina menjadi lauroil-dietanolamida dan dengan N-metil glukamina menjadi lauroil-N-N-metil glukamida. Penelitian dilakukan menggunakan dua jenis enzim terimobilisasi yaitu lipase dari Rhizomucor miehei (Lipozym TL IM®) dan lipase dari Candida antarctica (Novozym 435®) serta sejumlah pelarut yaitu n-heksan, tert-butanol, tert-amilalkohol, dan isopropanol. Penelitian meliputi tiga tahap pekerjaan yaitu tahap pendahuluan, tahap optimasi dan tahap pengembangan proses. Pada tahap pendahuluan, variabel reaksi yang diamati adalah waktu reaksi, jenis dan konsentrasi enzim, jenis dan rasio pelarut, rasio molar substrat amina/asam laurat serta temperatur. Pada tahap optimasi, model regresi dan pengaruh interaksi dari konsentrasi Novozym, rasio molar substrat serta temperatur dioptimasikan untuk memperoleh respon konversi asam lemak dan persen yield yang maksimum. Optimasi dirancang mengikuti Rancangan Susunan Terpusat (CCD) dan dilakukan menggunakan Metode Permukaan Sambutan (RSM). Pada tahap pengembangan proses, dilakukan pengamatan penambahan amina bertahap, penerapan kondisi tanpa pelarut, recoveri enzim dan pembesaran skala sintesis pada bioreaktor multi-tahap. Hasil penelitian pendahuluan menunjukkan bahwa pada sintesis lauroil-dietanolamida, enzim Novozym dengan konsentrasi 10% (b/b AL), pelarut n-heksan dengan rasio pelarut 2:1 (v/b AL), rasio molar substrat (DEA/AL) 3:1, suhu 50oC dan waktu reaksi 24 jam memberikan hasil terbaik. Kondisi optimum yang diprediksi untuk sintesis lauroil-dietanolamida adalah rasio molar DEA:AL 3:1; konsentrasi Novozym, 10 % serta temperatur 50-55 oC, dan untuk sintesis lauroil-N-metil glukamida adalah rasio molar MGL:AL 1:1; konsentrasi Novozym, 8 % serta temperatur 50-55 oC. Reaksi pada kondisi optimum akan menghasilkan persen konversi asam laurat 73,05 % dan yield 77,82 % untuk lauroil-dietanolamida serta konversi asam laurat 64,52 % dan yield 97,59 % untuk sintesis lauroil-N-metil glukamida. Penambahan amina terbaik dilakukan secara 2-3 tahapan sedangkan penggunaan enzim hingga empat kali ulangan, masih memberikan hasil yang baik yang ditandai dengan kemampuan konversi asam laurat yang masih tinggi. Pembesaran skala sintesis menggunakan bioreaktor multi-tahap menunjukkan bahwa pada putaran motor 150 rpm (Rea 1618), pengaduk jenis B (paddle lengkung 45o) memberikan nilai persen konversi asam laurat yang lebih besar, manakala putaran motor 250 rpm (Rea 2697), secara keseluruhan pengaduk jenis A dan B memberikan perolehan persen konversi yang hampir sama. Untuk mengetahui terjadinya hasil reaksi amidasi dilakukan uji struktur dengan spektroskopi FT-IR dan 1H-NMR, serta untuk mengetahui nilai persen yield dilakukan analisa dengan HPLC. Selanjutnya dilakukan pengukuran HLB dan analisa sifat fisika lain dengan metode titrasi. Hasil penelitian ini diharapkan dapat menghasilkan surfaktan alkanolamida yang murah dan alami karena diperoleh dari bahan baku yang dapat diperbaharui dan diolah melalui proses yang dapat diterima secara ekologis.
ABSTRACT
The optimizations on the synthesis of two surfactants namely lauroyl-diethanolamide and lauroyl-N-methyl glucamide, which can be used in formulating cosmetics and pharmacy supplies, are studied. The fraction of palm kernel oil namely lauric acid was amidificationed with diethanolamide and N-methyl glucamine to form lauroyl-diethanoamide and lauroil-N-methyl glucamide, respectively. Study was carried out by using two immobilized enzymes namely lipase from Rhizomucor miehei (Lipozyme TL IM®) and lipase from Candida antarctica (Novozyme 435®), and a numbers of solvent namely n-hexane, tert-butanol, tert-amylalcohol and isopropanol. Study consists of three stages of work, i.e. preliminary stage, optimization stage, and development process stage. In the preliminary stage, the reaction variables observed were reaction time, enzyme’s type and concentration, solvent’s type and ratio, molar ratio of substrate (amine/lauric acid), and temperature. In the optimization stage, regression model and the interactions of Novozym concentration, molar ratio of substrate, and temperature were optimized to obtain response of lauric acid conversion and percentage of maximum yield. Optimization was carried out by utilizing the Central Composite Design (CCD) and Response Surface Methodology (RSM). In the development process stage, the frequent addition of amine was observed, the condition without solvent, enzyme recovery and synthesis scale up in multistage bioreactor were implemented. The results of preliminary stage show that in the synthesis of lauroyl-dietanolamide, the Novozym with concentration of 10% (b/b AL), n-hexane with solvent ratio 2:1 (v/b AL), molar substrate ratio (DEA/AL) 3:1, temperature of 50 oC and reaction time of 24 hours, give the best performance. The expected optimum condition in the synthesis of lauroyl-diethanolamide was at molar ratio DEA:AL 3:1; Novozym concentration of 10% at temperature of 50-55 oC, and in the synthesis of lauroyl-N-methyl glucamide was at molar ratio MGL:AL 1:1; Novozym concentration of 8% at temperature of 50-55
o
C. The reactions at the optimum condition produce the percentage of lauric acid convertion of 73.05% and yield of 77.85% for the synthesis of lauroyl-diethanolamide and the convertion of lauric acid of 64.5% and yield of 97.59% for the synthesis of lauroyl-N-methyl glucamide. The best addition of amine was done by 2-3 stages while the enzyme usage was up to 4 times of repetition, and it was indicated by the high conversion performance of lauric acid. The synthesis scale up using multi-stage bioreactor show that at motor rotation of 150 rpm (Rea 1618), stirrer type B (45o
paddle) gives higher percentage of lauryl acid conversion, while at motor rotation of 250 rpm (Rea 2697), in overall stirrer A and B gives similar result of lauryl acid
conversion. For the purpose of verifying of amidification reaction, spectroscopy FT-IR and 1H-NMR were carried out for structure testing while HPLC analysis was done for the magnitude of yield percentage. Moreover, the HLB measurement and the other analyses of physical property were done by titration method. The expectation output of the study in this research is producing the economic and natural alkanolamide surfactant because it is made of renewable raw materials and produced under ecologically acceptable process.
BAB I PENDAHULUAN
1.1 Latar Belakang
Surfaktan adalah suatu senyawa aktif penurun tegangan permukaan (surface active agent) yang sekaligus memiliki gugus hidrofilik dan gugus hidrofobik dalam satu struktur molekul yang sama. Senyawa ini dapat menurunkan tegangan antarmuka antara dua fasa cairan yang berbeda kepolarannya seperti minyak/air atau air/minyak. Sifat yang unik tersebut, menyebabkan surfaktan sangat potensial digunakan sebagai komponen bahan adhesif, bahan penggumpal, pembasah, pembusa, pengemulsi, dan bahan penetrasi serta telah diaplikasikan secara luas pada berbagai bidang industri proses yang menggunakan sistem multifasa seperti pada industri makanan, farmasi, kosmetika, tekstil, polimer, cat, detergen dan agrokimia (Johnson dan Fritz, 1989).
Seiring dengan meningkatnya kesadaran akan kesehatan dan lingkungan yang baik, permintaan surfaktan yang mudah terdegradasi dan berbasis tumbuhan juga semakin meningkat (Holmberg, 2001), maka diperlukan kajian untuk memperoleh surfaktan yang mempunyai dua kriteria tersebut yaitu diperoleh dari bahan baku yang dapat diperbaharui dan bersifat degradatif di alam sehingga dapat diterima secara ekologis. Salah satu surfaktan yang memenuhi kedua kriteria tersebut adalah surfaktan alkanolamida.
Alkanolamida dapat diperoleh dari hasil reaksi antara alkanolamina dengan asam lemak minyak nabati, dan banyak digunakan sebagai bahan pangan, kosmetika dan obat-obatan (Soledad, dkk. 2000). Surfaktan alkanolamida yang mempunyai ikatan amida banyak dikembangkan dalam industri pembuatan surfaktan karena ikatan amida secara kimia sangat stabil pada media yang bersifat alkali (Maugard, dkk. 1997).
Alkanolamida yang digunakan untuk formula pangan, kosmetika dan obat-obatan haruslah bebas dari bahan beracun, pelarut, asam lemak bebas, amina yang berlebih serta harus tidak berbau dan bentuknya menarik. Namun penelitian untuk memproduksi alkanolamida pada skala industri masih kurang karena penghilangan pelarut dan warna yang tidak diinginkan memerlukan tahapan yang rumit dan biaya yang tinggi.
suhu 150oC selama 6 - 12 jam (Maag, 1984; Herawan, 1999). Sintesis secara kimia memerlukan tahap reaksi yang rumit yaitu tahap proteksi dan deproteksi gugus hidroksil untuk mencegah terjadinya karbonasi amina dengan CO2 (Dolores, dkk. 2002). Sintesis pada suhu tinggi ini juga menghasilkan warna yang tidak diharapkan pada produk akhir. Selain itu, sintesis secara kimia menghasilkan produk samping berupa garam dan menggunakan pelarut bersifat toksik (DMF, metanol) yang harus dihilangkan dari proses agar diperoleh produk yang murni (Maugard, dkk. 1998; Par Tufvesson, dkk. 2007).
Sintesis alkanolamida menggunakan katalis kimia dari metil ester asam laurat dan N-metil glukamina telah dipatenkan pada European Patent Application (EP-A) nomor 285,768 tahun 1994 dengan judul Preparation of N-methyl-coconut fatty acid glucamide. Sintesis dilakukan di dalam skala laboratorium dengan mencampur 3 mol metil ester asam laurat minyak kelapa dengan 3 mol N-metil glukamina serta penambahan 3,3 gram katalis natrium metoksida secara bertahap. Temperatur reaksi adalah 135 oC dan metanol yang terbentuk dikondensasikan pada kondisi vakum pada 100 hingga 15 mbar. Setelah metanol dihilangkan, campuran reaksi dilarutkan dengan isopropanol, kemudian disaring dan dikristalkan.
Reaksi pembentukan lauroil-dietanolamida dari asam laurat dan dietanolamina dapat dilihat pada Gambar 1.1 di bawah ini.
Gambar 1.1 Reaksi Pembentukan Lauroil-dietanolamida dari Asam Laurat dan Dietanolamina
Asam laurat dipilih sebagai sumber asam lemak karena amida dari asam laurat banyak digunakan pada berbagai produk kosmetika dan obat-obatan (Sharma, dkk. 2005). Asam laurat banyak terdapat dalam minyak inti sawit, yang dihasilkan sebagai hasil samping pengolahan minyak sawit serta terdapat dalam jumlah besar dan berkesinambungan di Indonesia. Selain itu hasil samping reaksi amidasi dari amina dengan asam lemak adalah air yang lebih aman dan bukannya berupa metanol (Dolores, dkk. 2002). Air mudah dipisahkan dengan melarutkan campuran produk dengan aseton, sementara jika amida diperoleh dari reaksi antara metil ester asam laurat dengan amina, maka hasil samping metanol yang diperoleh harus dipisahkan dengan menguapkan metanol atau bekerja pada tekanan mendekati vakum (Maugard, dkk. 1998).
Pemilihan N-metil glukamina sebagai sumber amina pada penelitian ini didasarkan pada belum banyaknya hasil penelitian tentang sintesis alkanolamida dari N-metil glukamina (Maugard, dkk. 1998), sementara N-metil glukamina dapat diperoleh dari sumber terbarukan (Holmberg, 2001) dan surfaktan asam lemak N-metil glukamida yang dihasilkan merupakan salah satu surfaktan berbasis sugar dengan peluang pasar yang meningkat secara signifikan (Warwel, dkk. 2001). N-metil glukamina merupakan senyawa yang mempunyai banyak manfaat antara lain sebagai anti bakteri (Ee Lin Soo, dkk. 2003), mengatasi kerusakan sendi dan rasa nyeri (Maugard, dkk. 1997), serta
HO
N
OH
H
HO
CH3
O
10
+ H2O
HO
N
CH3
O
10
OH
+
HN C
H2O
CH3
O
10
OH
enzim,pelarut Dietanolamina Asam laurat
mampu mengikat lemak tanpa diikuti dengan pengikatan vitamin yang larut dalam lemak (Rismana, 2005). Demikian juga reaksi pembentukan lauroil-N-metil glukamida dari asam laurat dan N-metil glukamina terlihat pada Gambar 1.2 di bawah ini.
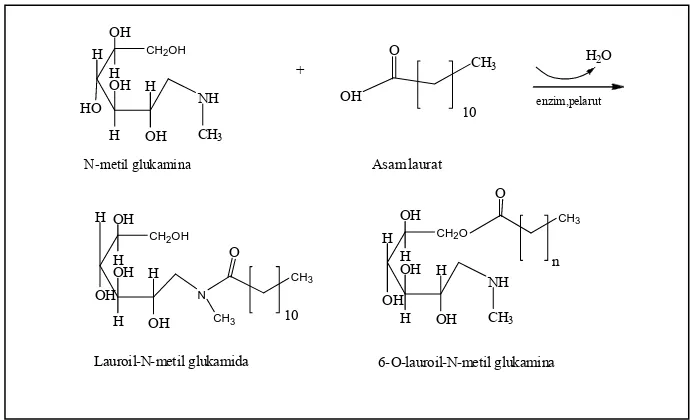
Gambar 1.2 Reaksi Pembentukan Lauroil-N-metil Glukamida dari Asam Laurat dan N-metil Glukamina
Sintesis alkanolamida secara enzimatik dipengaruhi oleh beberapa variabel antara lain, jenis dan konsentrasi enzim, jenis dan rasio pelarut, rasio molar bahan baku, temperatur dan waktu reaksi (Rahman, dkk. 2003; Kurniasih, 2008). Rahman, dkk. 2003 mengamati pengaruh variabel reaksi pada sintesis alkanolamida berkatalis lipase dari monoetanolamina dengan PKL (palm kernel olein) dan PKS (palm kernel stearin) menggunakan lipase dari Candida rugosa pada berbagai variasi pelarut organik (etil asetat, benzen, n-heksan, n-heptan, iso-oktan, n-dekana, dodekana dan n-heksadekana), rasio molar PKL atau PKS/monoetanolamina (1:1 hingga 1:20), waktu (12 hingga 96 jam) dan temperatur reaksi (30 hingga 60 oC). Mereka melaporkan bahwa yield monoetanolamida sangat bergantung pada pemilihan kondisi reaksi dan kondisi reaksi optimum diperoleh pada konsentrasi enzim 0,035 (b/b PKS atau PKL) menggunakan pelarut iso-oktan, waktu reaksi 72 jam, temperatur 40 oC, dengan yield 77,0% untuk PKL-monoetanolamida dan 39,0% untuk PKS-monoetanolamida.
Pengaruh jenis dan konsentrasi enzim telah diamati antara lain oleh Maugard, dkk. (1998), Infante dkk. (2004) dan Sharma, dkk. (2005). Mereka mengamati dua kelas enzim yang berfungsi sebagai biokatalis pada sintesis surfaktan alkanolamida yaitu protease dan lipase. Namun penggunaan protease dilaporkan tidak begitu berhasil
CH2OH
OH H HO OH H H H OH NH CH3 + OH O CH3 10
CH2OH
OH H OH OH H H H OH N CH3 CH3 O 10
CH2O
OH H OH OH H H H OH NH CH3 CH3 O n N-metil glukamina Asam laurat
Lauroil-N-metil glukamida 6-O-lauroil-N-metil glukamina H2O
karena protease spesifik untuk asam amino tertentu dan lebih sensitif pada media organik. Sebaliknya, lipase lebih spesifik karena sangat baik menghidrolisis ikatan N-H pada amina dan lipase terimobilisasi dapat bekerja pada suhu hingga 90 oC. Lipase terimobilisasi dengan rasio enzim terhadap substrat 0,01 hingga 0,15 telah banyak digunakan pada sintesis chiral amida (Soledad dan Gago, 1998), karbohidrat ester (Herawan, dkk. 1996, 1997), fatty amida (Maugard, dkk. 1997; Dolores, dkk. 2002; Par Tufvesson dkk. 2007) dan N-asil-asam amino (Ee Lin Soo, dkk. 2003,2004).
Jenis pelarut dan rasio mol bahan baku menentukan efisiensi dan kemoselektifitas reaksi enzimatik alkanolamida (Dolores, dkk. (2002); Par Tufvesson, dkk. (2007)). Rasio mol bahan baku juga menentukan kondisi asam basa reaksi atau pH yang sangat mempengaruhi perolehan alkanolamida (Maugard, dkk. 1998). Pengaruh jenis pelarut dan rasio mol bahan baku pada sintesis enzimatik alkanolamida telah diamati antara lain oleh Maugard, dkk. (1997) melalui reaksi transasilasi metil ester asam lemak (MEAL) dari minyak Corza dengan N-metil-glukamina. Reaksi dijalankan pada suhu 90oC dan tekanan 500 mBar menggunakan pelarut organik tert-amil alkohol
dan n-heksan dengan katalis lipase dari Candida antarctica (Novozym 435®). Dolores, dkk. (2002) juga mengamati pengaruh pelarut n-heksan dan tert-amil alkohol pada sintesis alkanolamida dari vanililamina dan asam oleat menggunakan enzim Novozym 435, serta menyimpulkan bahwa selektivitas reaksi bergantung kepada kelarutan produk di dalam pelarut dan pemilihan bahan pelarut sangat menentukan efisiensi proses. Sementara Rahman, dkk. (2003) mengamati pengaruh berbagai pelarut organik seperti etil asetat, benzene, heksan, heptane, iso-oktan, dekana, dodekana dan n-heksadekana pada sintesis alkanolamida dari monoetanolamin dengan PKL (palm kernel olein) menggunakan enzim lipase dan mengamati bahwa iso-oktan merupakan pelarut yang memberikan hasil terbaik. Rangkuman hasil pengamatan di atas diberikan pada Tabel 1.1 yang menyatakan pengaruh rasio mol bahan baku dan pelarut terhadap yield berbagai alkanolamida.
Tabel 1.1 Pengaruh Rasio Mol Bahan Baku dan Pelarut Terhadap Yield Berbagai Alkanolamida
Jenis substrat Rasio
mol
Pelarut Amida (%)
Ester (%)
Amida ester (%)
Asam oleat/N-metil glukamina 1) 2/1 n-heksan 50 20 30
Etil laurat/N-oktil glukamina1) 1/1 Tert-amil
alkohol
84 - -
MEAL/N-metil glukamina2) 1/1 Tert-amil
alkohol
80 5 15
Asam oleat/vanililamina3) 1/1 Tert-amil
alkohol
80 - -
PKL/monoetanolamina4) 1/1-1/15 Iso-oktan 77 - -
Asam laurat/etanolamina5) 2/1 Tanpa
pelarut
75 20 5
Sumber:
1)
Maugard, dkk.., (1997) ; 2)Maugard, dkk. (1998) ; 3)Dolores, dkk. (2002)
4)
Rahman, dkk. (2003) ; 5)Par Tufvesson, dkk. (2007)
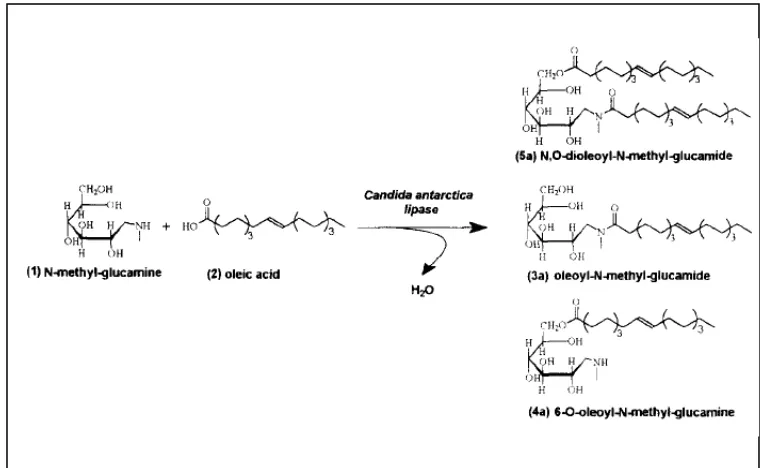
Kemoselektifitas lipase pada sintesis alkanolamida telah diamati dan ditemukan bahwa lipase mampu mengasilasi baik gugus amina maupun gugus alkohol (Soledad, dkk. 2000; Dolores, dkk. 2002). Kebanyakan lipase serentak mengkatalisis reaksi amidasi dan esterefikasi dari alkanolamina, hanya saja jika produk akhir yang diharapkan adalah alkanolamida, maka reaksi perlu dikontrol agar ester yang terbentuk dan migrasi asil dari alkohol ke amina dapat meningkatkan produk amida yang diperoleh. Maugard, dkk. (1998) yang mengamati reaksi amidasi asam oleat dengan N-metil glukamina, sebagaimana ditunjukkan pada Gambar 1.3 dan mengamati hasil analisa HPLC pada Gambar 1.4, menemukan bahwa waktu reaksi berperan mengontrol perolehan amida dimana setelah 130 jam reaksi, ester yang terbentuk akan menjadi amida-ester karena donor asil akan berikatan dengan atom N pada ester.
Dari hasil analisa HPLC pada Gambar 1.4 ditunjukkan bahwa berkurangnya asam oleat (2) sejalan dengan terbentuknya produk N-metil-glukamida (3a). Pada awal-awal reaksi, akan terbentuk amida (3a) dan ester (4a). Kemudian ester (4a) yang terbentuk sebahagian akan hilang diakhir reaksi. Maugard dkk. (1998) menemukan bahwa setelah 130 jam reaksi, 40% asam oleat akan bertransformasi dengan yield amida mencapai 80% dan menyimpulkan bahwa rasio asam/amina akan mengontrol baik efisiensi dan kemoselektivitas dari sintesis enzimatik ini.
dan yield alkanolamida yang maksimum. Beberapa peneliti yang telah mengamati optimasi sintesis surfaktan secara enzimatik, diantaranya Hamsaveni, dkk. (2001); Khrisna, dkk. (2001); Ee Lin Soo, dkk. (2003); Ramkrishna dan Swaminathan (2004) dan Rodrigues, dkk. (2006).
Gambar 1.3 Skema Reaksi Amidasi Asam Oleat dengan N-metil Glukamina oleh Maugard, dkk. (1998). (Keterangan: (1) Amina, (2) Asam Oleat, (3a) Amida, (4a) Ester, (5a) Amida-ester).
[image:34.595.193.419.513.761.2]Untuk meningkatkan perolehan alkanolamida dan juga meningkatkan efisiensi proses beberapa peneliti melakukan upaya pengembangan. Par Tufvesson, dkk. (2007) mengamati penggunaan kondisi tanpa pelarut, penambahan amina bertahap dan recoveri enzim, Masngut, dkk. (2007) mengamati aplikasi sintesis enzimatik pada bioreaktor berpengaduk multitahap, dan Maugard, dkk. (1998) mengamati sintesis alkanolamida menggunakan asam lemak tidak jenuh rantai panjang yaitu asam oleat.
Par Tufvesson, dkk. (2007) telah mengembangkan sintesis alkanolamida dengan beberapa cara yaitu sintesis tanpa pelarut, penambahan amina secara bertahap, dan recoveri enzim. Fokus utama penelitian mereka adalah pada optimasi yield dan efisiensi penggunaan enzim. Amidasi dari asam laurat dengan monoetanol amina dipilih sebagai model reaksi. Tekanan reaksi adalah pada tekanan atmosfer maupun vakum dengan suhu 90oC dan waktu reaksi 10 jam. Keadaan tersebut dipilih dengan harapan bahwa asam laurat akan melebur pada suhu tersebut. Par Tufvesson, dkk. (2007) menyimpulkan bahwa kondisi tanpa pelarut maupun penambahan amina secara bertahap dapat meningkatkan efisiensi proses. Disamping itu juga disimpulkan bahwa enzim lipase dapat digunakan berulang-ulang hingga 14 hari.
Perancangan bioreaktor yang baik perlu dilakukan agar sintesis alkanolamida secara enzimatik dapat berlangsung optimal pada skala yang lebih besar. Dalam perancangan bioreaktor beberapa hal harus dipertimbangkan seperti tingkat homogenitas yang tinggi, pengadukan yang tidak boleh merusak biokatalis serta konsumsi energi yang minimal. Bioreaktor yang tepat untuk itu adalah reaktor berpengaduk multi tahap (Multistage Mechanically Agitated Compartmented , MSAC) yang tersusun seri. Bioreaktor ini sesuai untuk reaksi yang memerlukan waktu tinggal yang panjang dan homogenitas yang tinggi (Goubet, dkk. 2002; Masngut, dkk. 2007), sehingga reaktor berpengaduk multitahap dipilih sebagai bioreaktor pada pembuatan surfaktan alkanolamida dari asam laurat dengan dietanolamina dan N-metil glukamina.
Penggunaan asam oleat telah banyak digunakan pada sintesis surfaktan karena asam oleat dapat diperoleh dalam jumlah besar dari turunan minyak nabati seperti minyak kelapa sawit. Maugard, dkk. (1998) yang mengamati sintesis alkanolamida menggunakan asam oleat mengamati bahwa wujud asam oleat yang cair menyebabkan asam oleat lebih mudah ditangani dan diinkorporasikan ke dalam suatu produk yang berbentuk cairan.
baik. Terbentuknya ester ini akan menyebabkan yield surfaktan alkanolamida yang dihasilkan menjadi rendah. Untuk itu diperlukan kajian untuk meningkatkan yield alkanolamida dengan mengoptimalkan kondisi reaksi dan selanjutnya pada kondisi optimal ini dicoba untuk menambahkan alkanolamina secara bertahap, menggunakan enzim secara berulang, aplikasi dalam bioreaktor dan menggunakan kondisi tanpa pelarut.
1.2 Perumusan Masalah
Agar diperoleh surfaktan alkanolamida yang mudah terdegradasi dan berbasis tumbuhan dengan yield yang lebih baik, maka perlu dikaji upaya-upaya yang dapat dilakukan untuk meningkatkan yield alkanolamida. Upaya-upaya yang dapat dilakukan antara lain dengan mengamati pengaruh variabel reaksi (jenis dan konsentrasi enzim, jenis dan rasio pelarut, temperatur, waktu reaksi, serta rasio molar amina/asam laurat) dan mengamati pengaruh interaksi serta kondisi optimum variabel reaksi. Upaya-upaya lain seperti menggunakan kondisi tanpa pelarut, penambahan amina bertahap, recoveri enzim, penggunaan asam lemak tidak jenuh rantai panjang dan aplikasi bioreaktor berpengaduk multitahap juga perlu untuk diamati. Oleh karena itu yang menjadi permasalahan adalah:
1) Bagaimana pengaruh jenis dan konsentrasi enzim, jenis dan rasio pelarut, temperatur, waktu reaksi, serta rasio molar amina/asam laurat, terhadap persen konversi asam laurat.
2) Bagaimana pengaruh interaksi dari variabel penelitian, model persamaan optimasi serta kondisi reaksi amidasi yang optimum untuk mendapatkan persen konversi asam laurat dan yield alkanolamida yang maksimum.
3) Bagaimana upaya meningkatkan perolehan alkanolamida dan efisiensi proses jika menggunakan kondisi tanpa pelarut, penambahan amina bertahap, recoveri enzim, penggunaan asam lemak tidak jenuh rantai panjang dan aplikasi bioreaktor berpengaduk multi-tahap.
1.3 Tujuan Penelitian
1) Tahap Pendahuluan bertujuan untuk mengetahui pengaruh jenis dan konsentrasi enzim, jenis dan rasio pelarut, temperatur, waktu reaksi serta rasio molar substrat terhadap persen konversi asam laurat.
2) Tahap Optimasi bertujuan untuk mengamati pengaruh interaksi dari variabel penelitian, menyusun model persamaan optimasi serta menentukan kondisi reaksi amidasi yang optimum menggunakan Metode Permukaan Sambutan (Response Surface Methodology, RSM) untuk mendapatkan persen konversi asam laurat dan yield alkanolamida yang maksimum. Variabel penelitian yang diamati adalah temperatur, konsentrasi enzim dan rasio molar substrat.
3) Tahap Pengembangan Proses bertujuan untuk meningkatkan perolehan alkanolamida dan efisiensi proses melalui penambahan amina bertahap, kondisi tanpa pelarut, recoveri enzim, penggunaan asam lemak tidak jenuh rantai panjang dan aplikasi bioreaktor berpengaduk multi-tahap. Pada bioreaktor diamati pengaruh putaran motor dan jenis pengaduk terhadap persen konversi asam laurat.
1.4 Hipotesis Penelitian
Hipotesis dari penelitian yang dilakukan adalah:
1) Surfaktan alkanolamida dapat disintesis melalui reaksi amidasi enzimatik antara dietanolamina dan N-metil glukamina dengan asam laurat. Jumlah asam laurat yang terkonversi menjadi alkanolamida dipengaruhi oleh jenis dan konsentrasi enzim, jenis dan rasio pelarut, temperatur, waktu reaksi serta rasio molar substrat.
2) Pengaruh interaksi dari variabel penelitian yaitu konsentrasi enzim, rasio molar substrat dan temperatur, model persamaan optimasi serta kondisi reaksi amidasi yang optimum dapat ditentukan menggunakan Metode Permukaan Sambutan. 3) Perolehan alkanolamida dan efisiensi proses dapat ditingkatkan melalui
penambahan amina secara bertahap, kondisi tanpa pelarut, recoveri enzim, penggunaan asam lemak tidak jenuh rantai panjang dan aplikasi bioreaktor berpengaduk multi-tahap.
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Surfaktan
Surfaktan merupakan suatu molekul yang sekaligus memiliki gugus hidrofilik dan gugus lipofilik sehingga dapat mempersatukan campuran yang terdiri dari air dan minyak. Surfaktan adalah bahan aktif permukaan. Aktifitas surfaktan diperoleh karena sifat ganda dari molekulnya. Molekul surfaktan memiliki bagian polar yang suka akan air (hidrofilik) dan bagian non polar yang suka akan minyak/lemak (lipofilik). Bagian polar molekul surfaktan dapat bermuatan positif, negatif atau netral. Sifat rangkap ini yang menyebabkan surfaktan dapat diadsorbsi pada antar muka udara-air, minyak-air dan zat padat-air, membentuk lapisan tunggal dimana gugus hidrofilik berada pada fase air dan rantai hidrokarbon ke udara, dalam kontak dengan zat padat ataupun terendam dalam fase minyak. Umumnya bagian non polar (lipofilik) adalah merupakan rantai alkil yang panjang, sementara bagian yang polar (hidrofilik) mengandung gugus hidroksil. (Jatmika, 1998)
Permintaas surfaktan di dunia internasional cukup besar. Pada tahun 2004, permintaan surfaktan sebesar 11,82 juta ton per-tahun dan pertumbuhan permintaan surfaktan rata-rata 3 persen per-tahun (Widodo, 2004). Penggunaan surfaktan sangat bervariasi, seperti bahan deterjen, kosmetik, farmasi, makanan, tekstil, plastik dan lain-lain. Beberapa produk pangan seperti margarin, es krim, dan lain-lain menggunakan surfaktan sebagai satu bahannya. Syarat agar surfaktan dapat digunakan untuk produk pangan yaitu bahwa surfaktan tersebut mempunyai nilai Hydrophyle Lypophyle Balance (HLB) antara 2-16, tidak beracun, serta tidak menimbulkan iritasi. Penggunaan surfaktan terbagi atas tiga golongan, yaitu sebagai bahan pembasah (wetting agent), bahan pengemulsi (emulsifying agent) dan bahan pelarut (solubilizing agent). Penggunaan surfaktan ini bertujuan untuk meningkatkan kestabilan emulsi dengan cara menurunkan tegangan antarmuka, antara fasa minyak dan fasa air. Surfaktan dipergunakan baik berbentuk emulsi minyak dalam air maupun berbentuk emulsi air dalam minyak.
kontinu atau medium dispersi. Berdasarkan jenisnya emulsi dibedakan menjadi dua yaitu:
1) Emulsi minyak dalam air (O/W), adalah emulsi dimana bahan pengemulsinya mudah larut dalam air sehingga air dikatakan sebagai fase eksternal.
2) Emulsi air dalam minyak (W/O), adalah emulsi dimana bahan pengemulsinya mudah larut dalam minyak.
Gugus hidrofilik pada surfaktan bersifat polar dan mudah bersenyawa dengan air, sedangkan gugus lipofilik bersifat non polar dan mudah bersenyawa dengan minyak. Di dalam molekul surfaktan, salah satu gugus harus lebih dominan jumlahnya. Bila gugus polarnya yang lebih dominan, maka molekul-molekul surfaktan tersebut akan diabsorpsi lebih kuat oleh air dibandingkan dengan minyak. Akibatnya tegangan permukaan air menjadi lebih rendah sehingga mudah menyebar dan menjadi fase kontinu. Demikian pula sebaliknya, bila gugus non polarnya lebih dominan, maka molekulmolekul surfaktan tersebut akan diabsorpsi lebih kuat oleh minyak dibandingkan dengan air. Akibatnya tegangan permukaan minyak menjadi lebih rendah sehingga mudah menyebar dan menjadi fase kontinu.
Penambahan surfaktan dalam larutan akan menyebabkan turunnya tegangan permukaan larutan. Setelah mencapai konsentrasi tertentu, tegangan permukaan akan konstan walaupun konsentrasi surfaktan ditingkatkan. Bila surfaktan ditambahkan melebihi konsentrasi ini maka surfaktan mengagregasi membentuk misel. Konsentrasi terbentuknya misel ini disebut Critical Micelle Concentration (CMC). Tegangan permukaan akan menurun hingga CMC tercapai. Setelah CMC tercapai, tegangan permukaan akan konstan yang menunjukkan bahwa antar muka menjadi jenuh dan terbentuk misel yang berada dalam keseimbangan dinamis dengan monomernya (Genaro, 1990).
Klasifikasi surfaktan berdasarkan muatannya dibagi menjadi empat golongan yaitu:
1) Surfaktan anionik yaitu surfaktan yang bagian alkilnya terikat pada suatu anion. Contohnya adalah garam alkana sulfonat, garam olefin sulfonat, garam sulfonat asam lemak rantai panjang.
3) Surfaktan nonionik yaitu surfaktan yang bagian alkilnya tidak bermuatan. Contohnya ester gliserin asam lemak, ester sorbitan asam lemak, ester sukrosa asam lemak, polietilena alkil amina, glukamina, alkil poliglukosida, mono alkanol amina, dialkanol amina dan alkil amina oksida.
4) Surfaktan amfoter yaitu surfaktan yang bagian alkilnya mempunyai muatan positif dan negatif. Contohnya surfaktan yang mengandung asam amino, betain, fosfobetain.
Surfaktan pada umumnya disintesis dari turunan minyak bumi, seperti linier alkilbensen sulfonat (LAS), alkil sulfonat (AS), alkil etoksilat (AE) dan alkil etoksilat sulfat (AES). Surfaktan dari turunan minyak bumi dan gas alam ini dapat menimbulkan pencemaran terhadap lingkungan, karena surfaktan ini setelah digunakan akan menjadi limbah yang sukar terdegradasi. Disamping itu, minyak bumi yang digunakan merupakan sumber bahan baku yang tidak dapat diperbaharui. Masalah inilah yang menyebabkan banyak pihak mencari alternatif surfaktan yang mudah terdegradasi dan berasal dari bahan baku yang dapat diperbaharui (Herawan, 1998; Warwel, dkk. 2001).
Penerapan bioteknologi pada sintesis surfaktan akhir-akhir ini mendapat perhatian yang besar. Bioteknologi dapat didefinisikan sebagai pemanfaatan jasad hidup dan proses biologis/kimia dalam suatu proses metabolisme untuk menghasilkan produk bernilai ekonomis lebih tinggi. Sejalan dengan definisi di atas serta didukung dengan jumlah minyak nabati sebagai pemasok bahan baku biosurfaktan maka penerapan bioteknologi pada sintesis biosurfaktan ini berpotensi besar untuk diaplikasikan.
Biosurfaktan mempunyai sifat yang mirip seperti surfaktan sintetik, akan tetapi biosurfaktan lebih rendah tingkat toksisitasnya, mudah terurai secara biologi, lebih efektif pada suhu, pH dan kadar garam yang berlebihan, dan lebih mudah disintesis. Di samping itu, sifat aktif permukaan yang dimilikinya berbeda dengan surfaktan yang disintesis secara kimia.
Biosurfaktan sebagian besar diproduksi oleh mikroorganisme seperti bakteri, ragi (khamir) dan kapang secara biotransformasi sel. Beberapa mikroba dapat menghasilkan surfaktan pada saat tumbuh pada berbagai substrat yang berbeda, mulai dari karbohidrat sampai hidrokarbon. Perubahan substrat seringkali mengubah juga struktur kimia dari produk sehingga akan mengubah sifat surfaktan yang dihasilkan. Pengetahuan mengenai surfaktan akan sangat berguna dalam merancang produk dengan sifat yang sesuai dengan aplikasi yang diinginkan. Beberapa mikroorganisme juga ada yang menghasilkan enzim dan dapat digunakan sebagai katalis pada proses hidrolisis, alkoholisis, kondensasi, asilasi atau esterifikasi. Proses ini digunakan dalam pembuatan berbagai jenis produk surfaktan termasuk monogliserida, fosfolipida dan surfaktan asam amino. (Herawan, 1998; Ee Lin Soo, dkk. 2003)
Biosurfaktan paling banyak digunakan pada produk-produk yang langsung berhubungan dengan tubuh manusia seperti kosmetika, obat-obatan dan makanan, selain itu ada juga yang digunakan pada pengolahan limbah untuk mengendalikan lingkungan (Herawan, 1998). Pada saat ini penggunaan biosurfaktan pada industri pangan dan non pangan (kimia) secara umum masih belum kompetitif karena masih tingginya biaya produksi. Namun demikian, masalah lingkungan yang diakibatkan oleh surfaktan sintetik memacu produksi dan aplikasi biosurfaktan untuk berkembang. Oleh sebab itu, agar biosurfaktan dapat bersaing dengan surfaktan kimia, harus ditemukan proses produksi yang lebih ekonomis. Kajian proses produksi biosurfaktan secara fermentasi maupun biotransformasi untuk mengurangi biaya produksi harus dilakukan, seperti upaya untuk mendapatkan perolehan (yield) yang tinggi, akumulasi produk serta penggunaan bahan baku yang murah atau malah tidak bernilai jual. Salah satu strategi untuk memproduksi biosurfaktan adalah dengan menggunakan bahan baku dari industri pertanian dan hasil sampingnya termasuk limbah yang dihasilkannya.
2.2 Surfaktan Alkanolamida
dalam reaksi amidasi sangat bervariasi seperti etanolamina dan dietanolamina, yang dibuat dengan mereaksikan amonia dengan etilen oksida.
Alkanolamina seperti etanolamina, jika direaksikan dengan asam lemak akan membentuk suatu alkanolamida dan melepaskan air. Alkanolamida merupakan kelompok surfaktan nonionik yang berkembang dengan pesat. Beberapa contoh surfaktan alkanolamida ditunjukkan pada Gambar 2.1.
Monoetanolamida Monoisopropanolamida Dietanolamida
Gambar 2.1 Beberapa Jenis Surfaktan Alkanolamida
Surfaktan alkanolamida tidak bermuatan atau tidak terjadi ionisasi daripada molekul. Keberadaan gugus metil amida didalam alkanolamida bermanfaat untuk meningkatkan kelarutan surfaktan (Burczyk, dkk. 2001). Disamping itu alkanolamida dapat digunakan pada rentang pH yang luas, biodegradabel, lembut dan bersifat non-iritasi, baik untuk kulit maupun mata. Surfaktan ini juga menghasilkan reduksi tegangan permukaan yang besar, toksisitas yang rendah dan pembusaan yang bagus serta stabil. Surfaktan alkanolamida juga sangat kompatibel dengan ketiga jenis surfaktan lainnya yaitu surfaktan anionik, kationik dan amfoterik. Sebagaimana surfaktan nonionik lainnya, alkanolamida menunjukkan performa yang baik seperti kelarutan yang tinggi, stabil terhadap berbagai enzim dan media yang alkali. Karena sifat-sifatnya tersebut maka surfaktan ini dapat digunakan sebagai bahan pangan, obat-obatan, kosmetika dan aplikasi industri serta dapat digunakan pada rentang penggunaan surfaktan anionik. Produk-produk yang menggunakan surfaktan alkanolamida diantaranya shampo non iritasi, sabun mandi cair, produk perawatan rambut, losion, cream, produk pembersih serta produk kosmetika, produk farmasi, biokimia dan biomedikal.
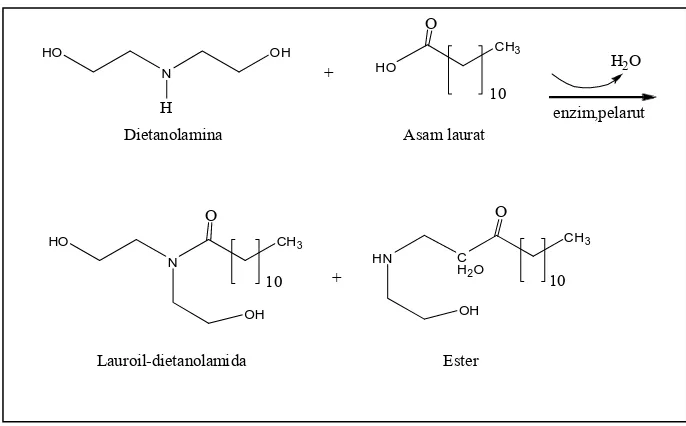
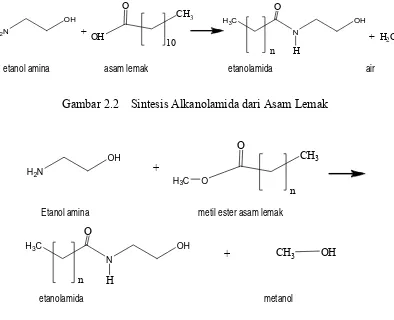
Pilawoska, dkk. (2004) menyebutkan bahwa alkanolamida asam lemak dapat diproduksi dengan dua cara, yaitu pada Gambar 2.2 sintesis alkanolamida dari asam laurat atau Gambar 2.3 sintesis alkanolamida dari ester asam. Pada reaksi pertama sebagai produk samping akan dihasilkan air, sedangkan pada reaksi kedua dihasilkan alkohol.
R N
OH O
H
R N
OH O
H CH3
R N
OH O
etanol amina asam lemak etanolamida air
Gambar 2.2 Sintesis Alkanolamida dari Asam Lemak
Etanol amina metil ester asam lemak
etanolamida metanol
Gambar 2.3 Sintesis Alkanolamida dari Ester Asam Lemak
Menurut Holmberg (2001) monoetanolamida dan dietanolamida digunakan secara luas sebagai surfaktan, penstabil dan pengembang busa. Meskipun monoetanolamida bersifat lebih efektif baik sebagai penstabil busa, pengental dan boster busa, namun karena berbentuk padatan berlilin menyebabkan sulit untuk diinkorporasikan karena titik cairnya yang tinggi. Ditambahkan bahwa diperlukan temperatur reaksi yang tinggi untuk menginkorporasikan monoetanolamida ke dalam campuran produk kosmetika. Sebaliknya, dietanolamida selain mampu menstabilkan busa juga dapat meningkatkan tekstur kasar busa dan dapat mencegah terjadinya proses penghilangan minyak yang berlebihan pada kulit dan rambut. Wujudnya yang cair menyebabkan dietanolamida lebih mudah ditangani dan diinkorporasikan ke dalam suatu produk kosmetika yang berbentuk cairan. Pemanfaatan turunan senyawa nitrogen ini dapat ditemukan pada pembuatan deterjen, foam-fire extinguisher, agen emulsifier, dan kosmetika.
Jenis surfaktan yang biasanya digunakan pada produk-produk kosmetika dan pangan adalah lemak/asam lemak yang berasal dari minyak kelapa, dan saat ini seluruhnya diimpor dari negara lain. Surfaktan alkanolamida yang berasal dari minyak
H2N
OH
+ OH
O
CH3
10
H3C
N
O
OH
H n
+ H2O
H2N
OH
+
O
O
CH3
H3C
n
H3C
N O
OH
H n
kelapa contohnya coconut dietanolamida. Coconut dietanolamida dimanfaatkan sebagai penstabil busa, bahan pendispersi, dan viscosity builder pada produk-produk toiletries dan pembersih seperti shampo, emulsifier, bubble bath, detergen bubuk dan cair, stabilizer skin conditioner dan sebagainya.
2.2.1 Dietanolamida
Dietanolamida pertama kali diperoleh dengan mereaksikan dua mol dietanolamina dengan satu mol asam lemak. Senyawa ini diberi nama Kritchevsky amida sesuai dengan nama penemunya. Bahan baku yang digunakan dalam produksi dietanolamida dapat berupa asam lemak, trigliserida atau metil ester. Dietanolamida biasanya diproduksi secara kimia konvensional pada temperatur 150oC selama 6-12 jam (Herawan, dkk. 1999). Dari hasil reaksi akan dihasilkan dietanolamida dan hasil samping berupa sabun amina. Kehadiran sabun amina ini, tentu saja akan menaikkan pH produk. Pada tahap pemurnian diperlukan pemisahan produk utama dengan sabun amina.
Dietanolamida merupakan salah satu surfaktan alkanolamida yang paling penting. Dietanolamida berfungsi sebagai bahan penstabil dan pengembang busa. Hal ini disebabkan karena adanya kotoran berminyak seperti sebum menyebabkan stabilitas busa sabun cair atau shampo akan berkurang secara drastis. Untuk mengatasi hal tersebut, diperlukan penstabil busa yang berfungsi untuk menstabilkan dan mengubah struktur busa agar diperoleh busa yang lebih banyak, pekat dengan buih yang sedikit. Pada pembuatan sabun, dietanolamida digunakan agar sabun menjadi lembut