PEMBERIAN GLUTAMIN, DEKSTRIN DAN KOMBINASINYA
SECARA IN OVO TERHADAP RESPON IMUN, PROFIL
DARAH DAN KOMPOSISI KARKAS AYAM
BROILER JANTAN
INTAN MUSTIKA HERFIANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam tesis saya yang berjudul: Pemberian Glutamin, Dekstrin dan Kombinasinya secara In Ovo terhadap Respon Imun, Profil Darah dan Komposisi Karkas Ayam Broiler Jantan, merupakan hasil karya saya sendiri atau hasil penelitian tesis saya sendiri, dengan bimbingan komisi pembimbing. Semua sumber data dan informasi atau pustaka yang digunakan dalam tesis ini telah dinyatakan dengan jelas dan lengkap dan dapat diperiksa kebenarannya. Tesis ini belum pernah diajukan dalam bentuk apa pun atau untuk memperoleh gelar pada program sejenis di perguruan tinggi lain.
Bogor, Desember 2007
Intan Mustika Herfiana
ABTRACT
INTAN MUSTIKA HERFIANA. The effect of Glutamine, Dextrin and Its Combination Through In Ovo Feeding on Immune Response, Blood Profiles and The Carcass Composition of Male Broiler Chicken. Under the supervisions of WIRANDA G. PILIANG, DEWI APRI ASTUTI and DESIANTO BUDI UTOMO.
In ovo feeding is a mechanism to feed embryos by injecting nutrient in the forms of liquid into the embryos amniotic fluid. This research was done to study the effect of dextrin, glutamine and its combination on immune response, blood profiles and the carcass composition of broiler chickens. The data were analyzed by a Completely Randomized Design followed by the Tukey Test. Two hundred DOC males were devided into four treatments and five replications, with 10 chicks in each replicate. The treatments used were the supplemention of glutamine liquid (P1), dextrin liquid (P2), the combination of glutamine and dextrin in liquid (P3), and NaCl 0.5% (P4) as placebo or control, that were given to the embryos at 18 days of the incubation period. The immune response were measured through the weight of thymus and bursal fabricius at the age of 14 days old and titer antibody. The first and second Newcastle Disease (ND) vaccines were applied at 5 and 21 days of age respectively. Before the vaccinations the titer antibody were measured at 4 and 20 days of age respectively. A week after the vaccinations the titer were measured at the age of 12 and 28 days. The vaccine against Infectious Bursal Disease (IBD) was applied at 13 days old. One day before and a week after the vaccination the titer antibody against IBD were measured.The blood profiles were measured through the amount of blood leucocytes and the percentage of heterophyl, lymphocyte, monocyte, eosinophil and basophil at the age of 7, 21 and 35 days old. The performances of broiler were measured through the quality of carcass ( the percentage of protein and lipid content in the dark and white meats) and the quantity of carcass at the age of 35 days old. The result showed that there was a highly significant difference (P< 0.01) on the monocytes percentage at 35 days old between the chickens given the treatments diet as compared to that of the chicken given the diet control. The ND titer at 4 days of age showed a highly significant difference (P< 0.01), where the chickens given glutamine in treatment gave the highest titer and the combination of glutamine and dextrin chickens gave the lowest titer. The lipid content of the dark meat at 35 days old also gave a highly significant difference (P< 0.01), where the chicken given dextrin in treatment gave the highest lipid content, and the placebo treatment gave the lowest lipid content. The thymus weight were significant different (P< 0.05), where the chickens given the combination of dextrin and glutamine treatment gave the highest score and the chickens of placebo treatment gave the lowest score. There were no significant difference on the total amount of leucocytes, the percentage of heterophyl, lymphocyte, eosinophil and basophil. The bursal weight, IBD titer, the protein content of the white and the dark meat and the lipid content of the white meat were not significantly different. It was concluded that in ovo feeding did not affect the immune response and the chicken performances.
RINGKASAN
INTAN MUSTIKA HERFIANA. Pemberian Glutamin, Dekstrin dan Kombinasinya secara In Ovo Terhadap Respon Imun, profil darah dan Komposisi Karkas Ayam Broiler Jantan. Dibimbing oleh WIRANDA G. PILIANG, DEWI APRI ASTUTI dan DESIANTO BUDI UTOMO.
In ovo feeding merupakan metode menyuntikkan nutrien berupa cairan ke dalam cairan amnion embrio. Penelitian ini dilakukan untuk mengetahui pengaruh pemberian dekstrin dan glutamin serta kombinasi dari keduanya secara in ovo
terhadap respon imun dan komposisi karkas ayam broiler. Penelitian ini menggunakan Rancangan Acak Lengkap dengan uji lanjut Tukey. Duaratus DOC jantan dibagi dalam empat perlakuan dan lima ulangan, sehingga tiap ulangan terdiri dari 10 ekor DOC. Empat perlakuan yang digunakan adalah Doc jantan yang menerima larutan glutamin (P1), larutan dekstrin (P2), larutan kombinasi dari glutamin dan dekstrin (P3) serta larutan NaCl 0.5% (P4) sebagai placebo atau kontrol, pada hari ke-18 inkubasi secara in ovo. Respon imun diukur melalui bobot relatif timus dan bursa pada umur 14 hari dan titer antibodi. Vaksin
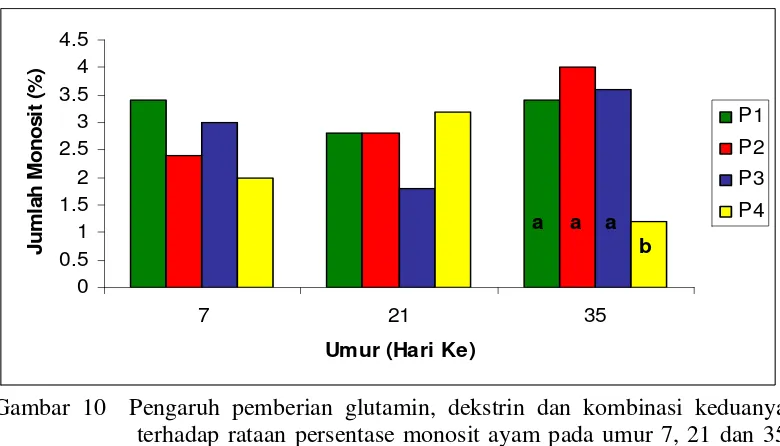
Newcastle disease (ND) diberikan dua kali yaitu pada umur 5 dan 21 hari. Titer antibodi terhadap ND diukur pada satu hari sebelum vaksin (umur 4 dan 20 hari) dan seminggu setelah vaksin (umur 12 dan 28 hari). Vaksin Infectious Bursal Disease (IBD) diberikan pada umur 13 hari. Titer antibodi terhadap vaksin IBD diukur sehari sebelum vaksin (umur 12 hari) dan seminggu setelah vaksin (umur 20 hari). Profil darah diukur melalui jumlah leukosit darah dan persentase heterofil, limfosit, monosit, eosinofil dan basofil pada umur 7, 21 dan 35 hari. Komposisi karkas diukur melalui kandungan protein dan lemak daging ayam bagian dada dan paha dan kuantitas karkas pada umur 35 hari. Hasil penelitian menunjukkan bahwa terjadi perbedaan sangat nyata (P<0.01) terhadap persentase monosit ayam umur 35 hari, antara ayam placebo dengan ayam perlakuan. Perbedaan sangat nyata (P<0.01) terjadi pada titer ND ayam umur 4 hari, antara ayam perlakuan glutamin dengan ayam perlakuan kombinasi glutamin dan dekstrin. Kadar lemak paha diketahui berbeda sangat nyata (P<0.01), antara ayam perlakuan dekstrin dengan ayam perlakuan NaCl 0.5% atau placebo. Perbedaan nyata (P<0.05) juga ditemukan pada bobot timus pada ayam dengan perlakuan kombinasi glutamin dan dekstrin yang memperoleh bobot tertinggi, dan ayam dengan perlakuan placebo yang memperoleh bobot terendah. Pada penelitian ini tidak ditemukan perbedaan yang nyata terhadap bobot relatif bursa, titer IBD, jumlah total leukosit, persentase heterofil, limfosit, eosinofil serta basofil, kadar protein daging dada dan paha serta kadar lemak daging dada. Disimpulkan dari hasil penelitian ini bahwa in ovo feeding tidak mempengaruhi respon imun dan performa ayam broiler.
@ Hak cipta milik IPB, tahun 2007
Hak cipta dilindungi undang-undang1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. pengutipan tidak merugikan kepentingan yang wajar IPB
PEMBERIAN GLUTAMIN, DEKSTRIN DAN KOMBINASINYA SECARA IN OVO TERHADAP RESPON IMUN, PROFIL DARAH DAN KOMPOSISI
KARKAS AYAM BROILER JANTAN
INTAN MUSTIKA HERFIANA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Ilmu Nutrisi dan Teknologi Pakan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Pemberian Glutamin, Dekstrin dan Kombinasinya secara In Ovo terhadap Respon Imun, Profil Darah dan Komposisi Karkas Ayam Broiler Jantan
Nama : Intan Mustika Herfiana
NIM : D051050011
Disetujui
Komisi Pembimbing
Prof. Ir. Wiranda G. Piliang, Ph.D., M.Sc Ketua
Dr. Ir. Dewi Apri Astuti, M.S. drh. Desianto Budi Utomo, Ph.D., M.Sc Anggota Anggota
Diketahui
Ketua Departemen Ilmu Nutrisi Dekan Sekolah Pascasarjana dan Teknologi Pakan
Dr. Ir. Idat Galih Permana, M.Sc Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penelitian yang berjudul “Pemberian Glutamin, Dekstrin dan Kombinasinya secara In Ovo terhadap Respon Imun, Profil Darah dan Komposisi Karkas Ayam Broiler Jantan” dapat berjalan dengan lancar dan dapat terselesaikan dengan baik. Penelitian ini sebagai salah satu syarat untuk menyelesaikan studi pada Program Studi Magister Ilmu Ternak, Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan terimakasih kepada Ibu Prof. Ir. Wiranda G. Piliang, Ph.D., M.Sc, Ibu Dr. Ir. Dewi Apri Astuti, MS, dan Bapak drh. Desianto Budi Utomo, Ph.D, selaku komisi pembimbing atas bimbingan, pengarahan, saran dan kesabaran serta ilmu yang diberikan selama proses penyusunan tesis ini. Disamping itu, penulis juga mengucapkan terimakasih kepada Ibu Dr. drh. Hera Maheswari M.Sc, selaku dosen penguji yang telah memberikan pengarahan, saran dan ilmu kepada penulis. Ucapan terima kasih kepada Bapak Dr. Ir. M. Ridla M.Sc selaku ketua program studi ilmu ternak, Bapak Dr. Ir. Nahrowi, M.Sc, dan staf lainnya yang telah membantu penulis selama mengikuti program magister.
Penulis juga ingin mengucapkan terimakasih kepada Pak Bagus, Mas Ipep, Mas Andi, Mbak Ina dan Mbak Erma serta seluruh karyawan Peternakan Charoen Pokphand, Cikupa, Tanggerang, atas bantuan, dukungan dan saran selama penulis menjalani penelitian. Rasa terimakasih juga penulis ucapkan kepada Mas Supri, Bang Anto, Bang Syarif, Risma, Bang Yajis, Pak Aris, Fera dan seluruh teman-teman Pascasarjana ilmu ternak dan pihak-pihak yang tidak tersebutkan namanya satu-persatu, yang telah sangat membantu dan memberikan saran dan dukungan moril sehingga penulis dapat menyelesaikan tesis ini.
Penulis juga ingin mengucapkan terimaksih kepada para sahabat tercinta, Lely, Diah, Yie dan Mas Jop yang telah sangat membantu dan mendukung penulis setiap saat, serta kasih sayang yang tiada habisnya. Oleh karena itu penulis selalu punya kekuatan baru untuk meyelesaikan tesis ini.
Terakhir, penulis mengucapkan terimakasih kepada Papah Fill, Mamih Rina, Mbak Udith, Mbak Delly, Mas Anton, Ayu dan Iogh atas cinta, perhatian, dukungan, pengertian dan kepercayaan yang diberikan, sehingga penulis tidak pernah kehilangan semangat dan kepercayaan diri untuk menyelesaikan studi dan penyusunan tesis ini. Penulis persembahkan tesis ini atas nama cinta kepada Keluarga tersayang.
Penulis berharap tesis ini dapat memberikan manfaat bagi semua pihak yang membacanya.
Bogor, Desember 2007
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 18 Desember 1981, sebagai anak ketiga dari lima bersaudara dari Ir. Moch. Fillhasny Junus dan Dr. Herla Rusmarilin, Ir., MS.
Pada tahun 1993 penulis menyelesaikan pendidikan di Sekolah Dasar Negeri Kaliasin III Surabaya. Penulis menyelesaikan pendidikan di Sekolah Menengah Pertama Hangtuah I Surabaya pada tahun 1996. Selanjutnya pada tahun 1999 menyelesaikan pendidikan di Sekolah Menengah Atas Negeri 3 Bogor dan pada tahun yang sama penulis melanjutkan pendidikan di Universitas Padjadjaran, Fakultas Peternakan, Jurusan Nutrisi dan Makanan Ternak melalui jalur UMPTN. Penulis lulus dari perguruan tinggi tersebut pada tahun 2004. Pada tahun 2005 penulis diterima sebagai mahasiswa Pascasarjana, program Magister Ilmu Ternak, Fakultas Peternakan, Institut Pertanian Bogor dengan minat studi ilmu nutrisi.
DAFTAR ISI
Perumusan Masalah Penelitian ... 5
Tujuan Penelitian ... 5
Hipotesa Penelitian ... 5
Kegunaan Penelitian ... 6
TINJAUAN PUSTAKA ... 7
Pengaruh In Ovo Feeding dan Early Feeding Terhadap Performa Ayam ... 7
Dextrin dan Glutamin... 13
Respon Imun ... 16
Newcastle Disease (ND)... 20
Infectious Bursal Disease (IBD) atau Gumboro... 21
Komposisi Karkas Ayam Broiler... 23
MATERI DAN METODA... 26
Waktu dan Tempat Penelitian ... 26
Halaman
HASIL DAN PEMBAHASAN... 39 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi Keduanya Terhadap Performa Sampai Umur 35 hari ... 39 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi Keduanya
Terhadap Leukosit dan Diferensiasinya... 44 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi
Keduanya Terhadap Limfosit... 47 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi
Keduanya Terhadap Heterofil ... 49 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi
Keduanya Terhadap Monosit ... 51 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi
Keduanya Terhadap Eosinofil... 52 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi
Keduanya Terhadap Basofil... 54 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi Keduanya Terhadap Rasio Heterofil/Limfosit ... 55 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi Keduanya Terhadap Berat Relatif Bursa dan Timus... 57 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi Keduanya Terhadap Titer ND dan IBD ... 64 Pengaruh Pemberian Glutamin, Dekstrin dan Kombinasi Keduanya Terhadap Kuantitas dan Kualitas Karkas... 68
KESIMPULAN DAN SARAN... 72
DAFTAR PUSTAKA ... 73
DAFTAR TABEL
Halaman
1. Sejarah Perkembangan Penelitian In Ovo Feeding...11
2. Perlakuan yang digunakan dalam penelitian...27
3. Tahap pengumpulan data yang dilakukan selama penelitian...33
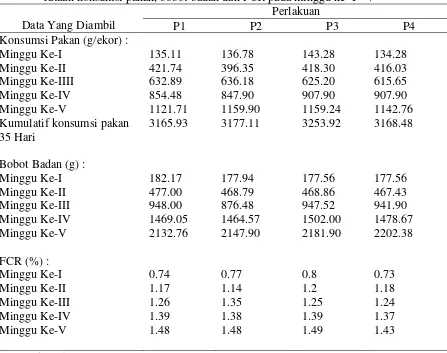
4. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan konsumsi pakan, bobot badan dan FCR pada minggu ke- I-V...39
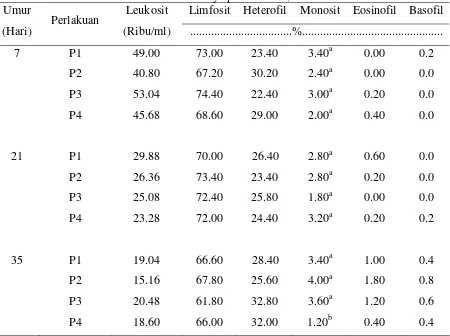
5. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan Leukosit dan diferensiasinya pada umur 7, 21 dan 35 hari ...45
6. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rasio Heterofil/Limfosit ayam Umur 7, 21 dan 35 hari...56
7. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan bobot relatif bursa dan timus umur 14 hari ...58
8. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan jumlah titer darah sebelum dan sesudah vaksin ND (Log 2n HAU) dan IBD (EU) pada ayam yang diberi in ovo feeding sesuai dengan perlakuan...65
9. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan persentase karkas, dada dan paha ayam ...69
DAFTAR GAMBAR
Halaman
1. Kerangka Pemikiran...4
2. Sistem Imun ...16
3. Alur penelitian yang dilakukan selama masa penelitian ...30
4. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan bobot badan pada minggu I-V ...40
5. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan konsumsi pakan pada minggu I-V...41
6. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan FCR pada minggu I-V ...42
7. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan jumlah leukosit ayam pada umur 7, 21 dan 35 hari...46
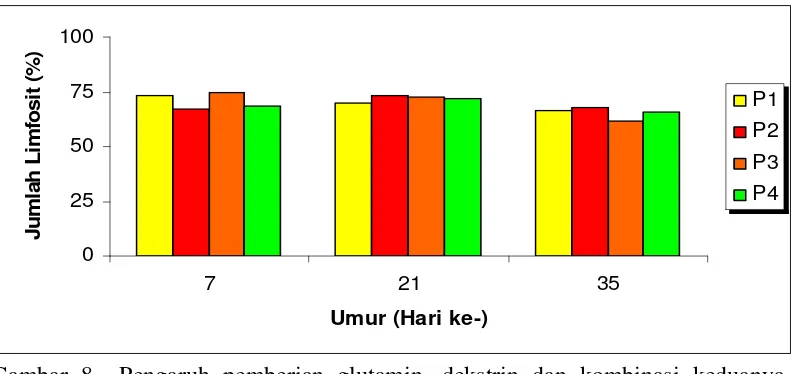
8. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan persentase limfosit ayam pada umur 7, 21 dan 35 hari ...48
9. Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan persentase heterofil ayam pada umur 7, 21 dan 35 hari ...49
10.Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan persentase monosit ayam pada umur 7, 21 dan 35 hari...51
11.Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan persentase eosinofil ayam pada umur 7, 21 dan 35 hari...53
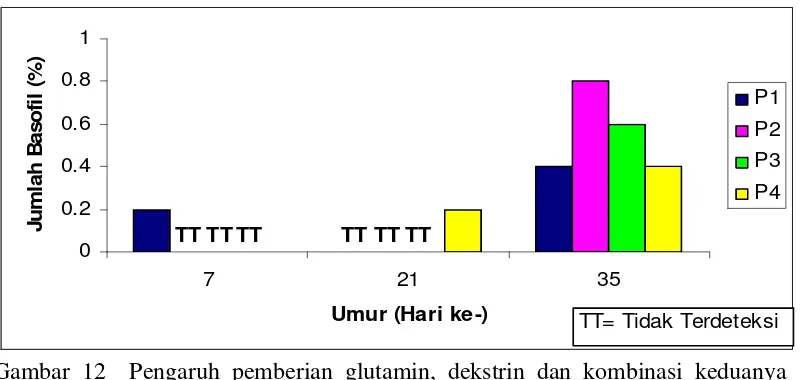
12.Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan persentase basofil ayam pada umur 7, 21 dan 35 hari...54
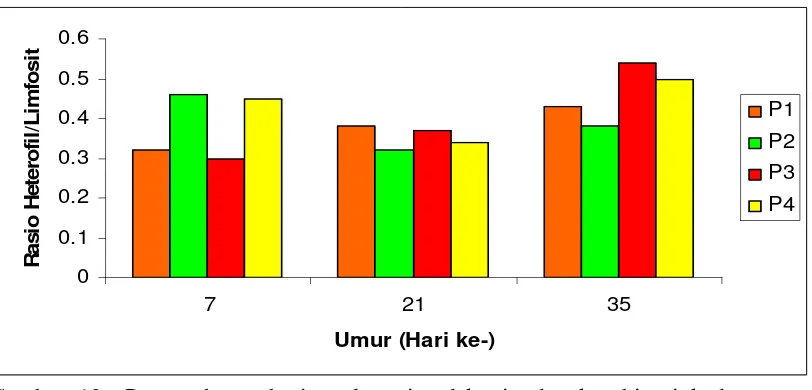
13.Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan rasio H/L ayam pada umur 7, 21 dan 35 hari ...57
14.Bursa fabrisius ayam perlakuan glutamin (P1) ...59
15.Bursa fabrisius ayam perlakuan dekstrin (P2) ...60
Halaman
17.Bursa fabrisius ayam perlakuan NaCl 0.5% (P4)...61
18.Pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya terhadap rataan titer IBD umur 12 dan 20 hari ...67
DAFTAR LAMPIRAN
Halaman
1. Hasil analisis statistik bobot badan ayam umur I dan II minggu ...79
2. Hasil analisis statistik bobot badan ayam umur III dan IV minggu...80
3. Hasil analisis statistik bobot badan ayam umur V minggu ...81
4. Hasil analisis statistik konsumsi pakan ayam minggu ke-I dan II ...82
5. Hasil analisis statistik konsumsi pakan ayam minggu ke-III dan IV ...83
6. Hasil analisis statistik konsumsi pakan ayam minggu ke-V ...84
7. Hasil analisis statistik Feed Conversion Ratio (FCR) minggu ke-I dan II....85
8. Hasil analisis statistik FCR minggu ke-III dan IV ...86
9. Hasil analisis statistik FCR minggu ke-V ...87
10.Hasil analisis statistik persentase bobot karkas...88
11.Hasil analisis statistik persentase bobot dada dan paha ...89
12.Hasil analisis statistik leukosit umur 7 dan 21 hari...90
13.Hasil analisis statistik leukosit umur 35 hari...91
14.Hasil analisis statistik persentase heterofil umur 7 dan 21 hari ...92
15.Hasil analisis statistik persentase heterofil umur 35 hari ...93
16.Hasil analisis statistik persentase limfosit umur 7 dan 21 hari ...94
17.Hasil analisis statistik persentase limfosit umur 35 hari ...95
18.Hasil analisis statistik persentase monosit umur 7 dan 21 hari...96
19.Hasil analisis statistik persentase monosit umur 35 hari...97
20.Hasil analisis statistik persentase eosinofil umur 7 dan 21 hari...98
Halaman
22.Hasil analisis statistik persentase basofil umur 7 dan 21 hari...100
23.Hasil analisis statistik persentase basofil umur 35 hari...101
24.Hasil analisis statistik bobot relatif bursa...102
25.Hasil analisis statistik bobot relatif timus ...103
26.Hasil analisis statistik titer ND umur 4 hari ...104
27.Hasil analisis statistik titer ND umur 12 dan 20 hari ...105
28.Hasil analisis statistik titer ND umur 28 hari ...106
29.Hasil analisis statistik titer IBD umur 12 dan 20 hari ...107
30.Hasil analisis statistik kadar protein daging bagian dada dan paha ...108
31.Hasil analisis kadar lemak daging bagian dada dan paha ...109
32.Hasil uju Tukey kadar lemak daging bagian paha ...110
33.Data temperatur lingkungan pada hari ke-1 sampai hari ke-35 ...111
PENDAHULUAN
Latar Belakang
Metode menyuntikkan nutrien berupa cairan ke dalam amnion embrio (in ovo feeding), menyebabkan embrio tersebut secara alami mengkonsumsi nutrien tersebut secara oral sebelum menetas (Uni et al. 2003). Pemberian suplemen berupa nutrien pada masa kritis pertumbuhan embrio dengan cara teknologi in ovo feeding dapat meningkatkan kualitas nutrisi embrio, yaitu diharapkan dapat memberikan keuntungan di lapangan antara lain: a) peningkatan efisiensi penggunaan pakan, b) meniadakan pertumbuhan tulang yang menyimpang, c) meningkatkan pertumbuhan otot terutama otot dada dan d) peningkatan respon imun terhadap antigen pencernaan serta e) menurunkan mortalitas dan
morbiditas pasca penetasan, sehingga dapat menekan biaya produksi per kilogram ayam pedaging (Tako et al. 2004).
Kemampuan in ovo feeding dalam menggertak respon imun baik secara humoral maupun selular membuka peluang pemanfaatan teknologi ini secara komersial untuk unggas. In ovo feeding ini diharapkan dapat menurunkan angka kematian yang banyak terjadi pada saat pengiriman DOC ke peternakan-peternakan komersial serta dapat meningkatkan tanggap kebal ayam tersebut selama masa pemeliharaan sampai panen, sehingga dapat menghasilkan ayam dengan berat panen yang lebih tinggi (Uni et al. 2005).
Terdapat banyak nutrien yang dapat digunakan dalam teknologi in ovo feeding. Dekstrin dapat digunakan sebagai bahan in ovo feeding untuk sumber glukosa yang sangat penting bagi masa pertumbuhan periode penetasan (Moran 1985). Glutamin digunakan sebagai bahan in ovo feeding karena digunakan sebagai bahan bakar utama untuk perkembangan sel-sel secara cepat seperti pada enterosit saluran pencernaan dan limfosit aktif (Newsholme & Calder 2002).
pedaging, sehingga penting untuk dilakukan program vaksinasi selama masa pemeliharaan. In ovo feeding diketahui dapat meningkatkan respon imun ayam. Pengujian respon imun pada penelitian ini dilakukan dalam berbagai macam cara. Salah satunya adalah pengukuran titer antibodi terhadap vaksin ND dan IBD yang diberikan, sehingga diharapkan dengan metode in ovo feeding ini dapat meminimalkan terjadinya penyebaran kedua penyakit ini pada saat pemeliharaan.
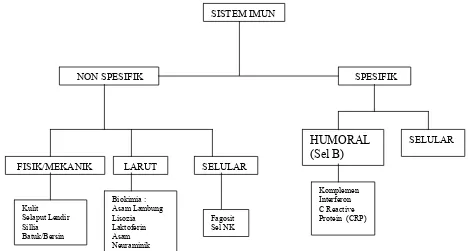
Respon imun dibagi menjadi dua, yaitu respon imun spesifik dan non spesifik. Respon imun non spesifik merupakan respon langsung dalam menghadapi serangan berbagai organisme terhadap antigen. Salah satu dari respon imun non spesifik adalah reaksi biokimia tubuh, heterofil dan makrofag. Respon imun spesifik adalah respon yang membutuhkan waktu untuk mengenal antigen terlebih dahulu sebelum memberikan responnya, dibagi menjadi respon imun humoral dan seluler. Respon imun humoral adalah sel-sel B yang menghasilkan antibodi, sedangkan respon imun seluler adalah sel-sel T yang berdiferensiasi didalam timus diantaranya adalah sel-sel T radang, heterofil, eosinofil, monosit dan basofil (Tizard 1987).
Meningkatnya respon imun pada ayam yang diberi in ovo feeding
diketahui juga dapat meningkatkan performa ayam sehingga dapat meningkatkan produksi ayam pada saat panen. Peningkatan produksi ayam tidak hanya dilihat dari kuantitasnya saja, tetapi kualitas karkas dari daging ayam tersebut juga dapat mempengaruhi nutrien manusia (Rogers et al. 2001). Dua komponen yang mendominasi metode analisis kimia daging adalah protein dan lemak. Protein dan lemak merupakan komponen yang sangat penting dalam nutrien manusia sehingga sangat berpengaruh terhadap bahan pangan manusia yang diantaranya adalah daging ayam. Komposisi kimiawi daging dipengaruhi oleh bangsa, pakan, umur, dan penggemukan serta komposisi karkas, diantaranya adalah pembentukan otot-otot tubuh, diantaranya white meat (daging dada) dan dark meat (daging Paha) (Lawrie 1979).
meningkatkan produksi pada saat panen yang dilihat melalui kuantitas karkas dan kadar protein dan lemak pada daging dada dan paha. Selain itu juga dapat dilihat nutrien yang terbaik untuk digunakan dalam in ovo feeding, dengan melihat respon imun ayam yaitu jumlah leukosit dan deferensiasinya, berat organ timus dan bursa, titer antibodi terhadap vaksin ND dan IBD.
18 Hari Inkubasi :
- Seleksi telur-telur fertil (Candling)
- Injeksi larutan Nutrien Ke Cairan amnion
Umur 1 hari : Bobot Badan Doc (Day Old Chick)
Yang Digunakan
4 hari : Titer Antibodi Terhadap Vaksin Newcastle Disease (ND)
Umur 5 hari : Vaksin ND Pertama
Umur 7 hari :
- Total Leukosit dan Diferensiasinya - Bobot Badan
- Konsumsi Pakan - Feed Conversion Ratio
Umur 12 hari :
- Titer Antibodi terhadap Vaksin ND - Titer Antibodi terhadap Vaksin Infectious
Bursal Disease (IBD)
Umur 14 hari : - Bobot Badan - Konsumsi Pakan - Feed Conversion Ratio - Bobot Bursa dan Timus
Umur 20 hari :
- Titer Antibodi terhadap Vaksin ND - Titer Antibodi terhadap Vaksin IBD
Umur 21 hari :
- Total Leukosit dan Diferensiasinya - Bobot Badan
- Konsumsi Pakan - Feed Conversion Ratio - Vaksin ND Kedua Umur 28 hari :
- Bobot Badan - Konsumsi Pakan - Feed Conversion Ratio
Umur 35 hari :
- Total Leukosit dan Diferensiasinya - Bobot Badan
- Konsumsi Pakan - Feed Conversion Ratio - Persentase Karkas - Persentase Dada - Persentase Paha
Umur 13 hari : Vaksin IBD Inkubasi selama 18 hari Telur tetas Ross 308
Perumusan Masalah Penelitian
Beberapa permasalahan yang timbul berdasarkan penelitian terdahulu dan yang timbul di lapangan, diantaranya adalah rentang waktu yang cukup lama yang dilalui anak ayam sebelum mendapat pakan pertama, dan penyebaran penyakit yang cepat sehingga banyak menimbulkan kematian dan menurunkan produksi. Berdasarkan permasalahan diatas, in ovo feeding diharapkan menjadi metode baru yang dapat mengurangi dampak dari rentang waktu yang cukup lama sebelum mendapatkan pakan pertama, sehingga dapat meningkatkan morbiditas dan mortalitas anak ayam tersebut.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian dekstrin dan glutamin serta kombinasi keduanya secara in ovo terhadap:
1. Profil darah yang diukur melalui jumlah leukosit darah dan diferensiasinya.
2. Respon imun, yang diukur melalui :
a. Berat timus. b. Berat bursa.
c. Titer antibodi yang diukur pada saat sebelum dan sesudah vaksin
Newcastle disease (ND).
d. Titer antibodi yang diukur pada saat sebelum dan sesudah vaksin
Infectious Bursal Disease (IBD).
3. Kuantitas dan kualitas karkas ayam broiler jantan.
Hipotesa
Berdasarkan kerangka pemikiran maka dapat diambil hipotesa :
H1 : Pemberian glutamin, dekstrin dan kombinasinya secara in ovo pada umur 18 hari inkubasi mempengaruhi jumlah leukosit dan diferensiasinya, bobot timus dan bursa, titer terhadap ND dan IBD, serta kuantitas dan kualitas ayam broiler jantan.
Kegunaan Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tambahan mengenai pengaruh pemberian glutamin, dekstrin dan kombinasi keduanya secara
TINJAUAN PUSTAKA
Pengaruh In Ovo dan Early Feeding Terhadap Performa Ayam
Beberapa hari sebelum dan sesudah penetasan merupakan periode kritis
untuk pertumbuhan dan ketahanan pada ayam broiler (pedaging) komersial. Anak
ayam yang baru menetas harus dapat beradaptasi terhadap perubahan metabolisme
nutrisi dari penggunaan yolk sebagai sumber nutrisi pada saat embrio, berubah
menjadi pakan komplit kaya nutrisi setelah penetasan. Pankreas dan enzim-enzim
pencernaan pada brush border harus sudah tersedia atau sudah tumbuh secara
maksimal untuk digunakan dalam proses pencernaan sehingga nutrisi pada pakan
tersebut dapat diserap di seluruh tubuh. Enzim pankreas terbentuk pada
masa-masa terakhir embrio sebelum menetas (Marchaim & Kulka 1967).
Pada penelitian yang telah dilakukan Noy dan Sklan (2001), dilaporkan
bahwa adanya makanan dalam saluran pencernaan anak ayam yang baru menetas
akan merangsang sekresi yolk ke dalam usus halus dan merangsang bahan-bahan
hidrofilik. Masa inkubasi yang lebih lama dari 21 hari pada proses penetasan
menyebababkan rendahnya status glikogen pada anak ayam. Pada masa ini banyak
embrio yang menggunakan glikogen sebagai energi untuk penetasan. Oleh sebab
itu, anak ayam itu harus membentuk glikogen melalui proses gluconeogenesis dari
protein tubuh untuk mendukung termogulasi post-hatch dan daya tahan tubuh. Hal
ini berlangsung sampai anak ayam tersebut dapat asupan makanan dan
memanfaatkan nutrien dari makanan tersebut. Setelah ayam menetas, terjadi
perubahan penggunaan pemanfaatan energi dari tubuh menjadi pemanfaatan
energi melalui makanan yang tercerna pada saluran pencernaan.
Intestine merupakan organ utama penyuplai nutrisi untuk tubuh. Semakin
cepat saluran pencernaan pada anak ayam dapat berfungsi dengan baik maka
semakin cepat pula anak ayam tersebut dapat mencerna dan menggunakan nutrisi
yang terdapat dalam makanan. Nutrisi tersebut dapat digunakan untuk tumbuh dan
berkembang sesuai dengan potensi genetik dari anak ayam (Uni & Ferket 2004).
Cadangan glikogen mulai disimpan kembali pada saat anak ayam yang
yang tersimpan dalam yolk sac secara maksimal (Rosebrough et al. 1978b).
Kurangnya jumlah glikogen dan albumin akan memaksa embrio untuk
menggunakan protein otot dalam jumlah besar. Hal ini akan menyebabkan
terhambatnya pertumbuhan embrio pada periode akhir inkubasi dan anak ayam
yang baru menetas (Uni et al. 2005).
Pertumbuhan saluran pencernaan dimulai selama inkubasi (Romanoff
1960), tetapi baru mulai berfungsi pada saat cairan amnion dikonsumsi secara oral
yaitu pada hari ke 16-17 masa inkubasi. Berat intestine (bagian dari berat embrio)
meningkat dari sekitar 1% pada 17 hari masa inkubasi menjadi 3.5% pada saat
menetas (Uni et al. 2003).
Anak ayam umur sehari yang mencerna makanan menunjukkan
peningkatan aktivitas total trypsin, amylase, dan lipase yang berkorelasi dengan
berat intestine dan berat badan (Noy & Sklan 2000). Broiler umur sehari yang
mendapatkan early feeding memiliki tingkat pertumbuhan saluran cerna yang
lebih tinggi termasuk luas permukaan villi yang lebih luas dan meningkatnya
jumlah sel villi usus (Gonzales et al. 2003).
Menyuntikkan nutrien ke dalam cairan amnion embrio menyebabkan
embrio tersebut secara alami mengkonsumsi nutrien tersebut secara oral sebelum
menetas. Penambahan nutrien pada masa pertumbuhan kritis dengan teknologi in
ovo dapat meningkatkan status nutrisi pada saat penetasan, sehingga dapat
mendatangkan beberapa keuntungan. Keuntungan yang dimadsud yaitu efisiensi
yang tinggi dalam pemanfaatan nutrisi makanan, menurunkan kematian pada
periode post hatch, serta meningkatkan respon imun pada saluran pencernaan dan
meningkatkan pertumbuhan otot terutama otot daging pada bagian dada (Uni et al.
2003).
Berbagai macam nutrien dapat digunakan sebagai bahan in ovo feeding.
Karbohidrat dapat digunakan untuk sumber glukosa, dimana sangat penting bagi
masa pertumbuhan periode penetasan (Moran 1985). Begitu pula dengan glutamin
yang dapat memberikan beberapa keuntungan yaitu yang paling penting adalah
menurunkan kematian periode post hatch. Glutamin juga diketahui dapat
meningkatkan pertumbuhan saluran pencernaan sehingga menghasilkan efesiensi
Pertumbuhan adalah perubahan dalam unit terkecil sel yang mengalami
pertambahan jumlah (hyperplasi) dan dengan pertumbuhan ukuran (hypertropi).
Pertumbuhan tubuh secara keseluruhan dinyatakan dengan pengukuran
pertambahan berat badan. Peningkatan berat badan dapat diketahui dengan cara
menimbang secara berulang-ulang dalam jangka waktu tertentu. Pertumbuhan
biasanya mulai perlahan-lahan kemudian berlangsung lebih cepat dan akhirnya
perlahan-lahan lagi atau berhenti sama sekali (Anggorodi 1990).
Pada penelitian sebelumnya diketahui bahwa terjadi peningkatan berat
badan sebanyak 5 gram pada anak ayam yang mengkonsumsi pakan 48 jam
setelah penetasan. Pada masa ini ukuran yolk menurun sekitar 60% untuk diubah
menjadi 1 gram lemak dan protein agar dapat dimanfaatkan oleh anak ayam
tersebut. Sebaliknya anak ayam yang tidak mengkonsumsi pakan segera setelah
penetasan (48 jam setelah penetasan) akan mengalami penurunan berat badan
sebanyak 3.5 gram. Pada periode ini yolk akan menurun lebih sedikit
dibandingkan dengan anak ayam sebelumnya sehingga dapat dikatakan bahwa
anak ayam tersebut lebih sedikit memanfaatkan lemak dan protein dari yolk
tersebut (Noy & Sklan 1999).
Baik buruknya pemeliharan ayam pada periode awal, sangat
mempengaruhi pertumbuhan pada periode selanjutnya. Pada 7 hari pertama pasca
penetasan, ayam mengalami perkembangan saluran pencernaan yang lebih cepat
dari pada organ-organ lain seperti tulang dada, otot kaki, dan bulu. Pada fase ini
ayam mempersiapkan kerangka tubuh untuk pertumbuhan selanjutnya. Pada fase
ini penting untuk diperhatikan karena akan mempengaruhi performa ayam
selanjutnya (Scott 2001).
Uni dan Ferket (2004) melaporkan bahwa pemberian karbohidrat yaitu
maltosa, sukrosa dan dekstrin secara in ovo feeding pada cairan amnion embrio
broiler dapat meningkatkan jumlah cadangan glikogen pada hati embrio dan pada
anak ayam yang baru menetas. Pada mukosa usus halus embrio ayam memiliki
kemampuan mencerna dan menyerap nutrisi yang terbatas pada waktu menjelang
menetas (Uni et al. 2003b). Kemampuan untuk absorbsi ini meningkat saat
makan sedini mungkin pada anak ayam setelah menetas akan menstimulasi
perkembangan saluran pencernaan sehingga dapat mempercepat morfologi
pertumbuhan usus halus. Hal ini dapat menghasilkan berat badan yang lebih tinggi
sehingga dapat memperpendek waktu yang diperlukan untuk mencapai berat
panen (Uni et al. 2003).
Penelitian yang dilakukan oleh Tako et al. (2004) yang berjudul “Effects
of In Ovo Feeding of Carbohydrates and β-Hydroxy-β-Methylbutyrate on The
Development of Chicken Intestine” memberikan hasil yang baik. Penelitian ini
menyuntikkan cairan karbohidrat (CHO) dan β-Hydroxy-β-Methybutyrate (HMB)
pada cairan amnion embryo ayam umur 17.5 hari. In ovo feeding dapat
meningkatkan pertumbuhan saluran pencernaan embrio dengan meningkatkan
ukuran villi dan meningkatkan kapasitas cerna disakarida usus (meningkatkan
aktivitas enzim pada brush border). Hal ini menyebabkan DOC yang menerima in
ovo feeding memiliki berat badan yang lebih berat sehingga menghasilkan
performa yang lebih baik (Tako et al. 2004).
Penelitian tentang in ovo feeding sudah banyak dilakukan, tetapi
penelitian-penelitian yang khusus menyangkut fungsinya sebagai penstimulir
kekebalan pada unggas dan pengaruhnya terhadap kualitas karkas masih belum
banyak diteliti. Berikut adalah beberapa penelitian in ovo feeding yang pernah
Tabel 1 Sejarah perkembangan penelitian inovo feeding
Tahun Peneliti Judul dan Hasil
1999 Ohta et al. Effect of Amino Acid Injection in Broiler Breeder Eggs on Embryonic Growth and Hatchability of Chicks. Lokasi injeksi: yolk. Umur : 7 hari inkubasi. Hasil: Pemberian asam amino secara in ovo mungkin merupakan suatu metode yang efektif untuk meningkatkan berat anak ayam saat menetas.
2001 Ohta et al. Optimum Site for In ovo Amino Acid Injection in Broiler Breeder Eggs.
Hasil : lokasi optimal penginjeksian cairan asam amino adalah kuning telur dan extra-embyonic coelom.
2001 Ohta et al. Embryo Growth and Amino Acid Concentration Profiles of Broiler Breeder Eggs, Embryos, and Chicks After In Ovo Administration of Amino Acids.
Lokasi injeksi: yolk. Umur: 7 hari inkubasi.
Hasil: Pemberian asam amino secara in ovo dapat meningkatkan konsentrasi asam amino embryo ayam.
2003 Z. Uni dan R. P. Ferket
Enhancement of Development of Oviparous Species by In Ovo Feeding. US Patent No. 6,592,878.
2003 Z. Uni dan R. P. Ferket
Methods For Early Nutrition and Their Potential.
Lokasi injeksi: Cairan amnion embryo ayam.Umur: 18 hari inkubasi. Nutrien: karbohidrat.
Hasil: Pemberian karbohidrat secara in ovo
meningkatkan berat DOC, berat ayam hingga umur 35 hari, meningkatkan tinggi villi dan level glycogen hati. Pemberian karbohidrat + protein secara in ovo
meningkatkan berat DOC, berat ayam hingga 14 hari dan berat otot DOC.
2004 E. Tako, R. P. Ferket dan Z. Uni
Effects of In Ovo Feeding of Carbohydrate and β
-Hydroxy-β-Methylbutyrate on The Development of
Chicken Intestine. Lokasi injeksi: cairan amnion
embryo.Umur injeksi : 17,5 hari.
Tahun Peneliti Judul dan Hasil
2005 Z. Uni, E. Tako, R. P. Ferket, dan O. Kedar
In Ovo Feeding Improves Energy Status of Late –
Term Chicken Embryos. Lokasi injeksi: cairan
amnion embryo. Umur: 17,5 hari.
Nutrient: karbohidrat + HMB.
Hasil: Pemberian karbohidrat + HMB secara in ovo
meningkatkan berat DOC, level glycogen hati dan ukuran otot dada.
2005 Ondulla T. Foye-Jackson
The Biochemical and Molecular Effects of Amnionic Nutrient Administration, “in ovo feeding” on Intestinal Development and Function and Carbohydrate Metabolism in Turkey Embryos and Poults. Coauthored by P. R. Ferket (advisor) and Z. Uni. Salah satu dari pemenang PSA Awards 2005.
2005 Z. Uni, R. P. Ferket, O.T Foye
The effects Of Amniotic Nutrient Administration “ In
Ovo Feeding” Arginine And/Or β-Hydroxy-β
-Methylbutyrate (HMB) On Insulin Like Growth Factors, Energy Metabolism & Growth In Turkey Poults.
Hasil : HMB dapat meningkatkan berat badan DOC sampai 14 hari.
HMB + Arg dapat meningkatkan plasma IGF-I dan IGF-II.
HMB, Arg dan HMB + Arg dapat meningkatkan Glukosa 6 phosphat.
HMB dan Arg dapat meningkatkan glikogen hati.
2006 A. Smirnov, E. Tako, R. P. Ferket dan Z. Uni
Mucin Gene Expression and Mucin Content in The Chicken Intestinal Goblet Cells Are Affected by In Ovo Feeding of Carbohydrates. Lokasi injeksi: cairan amnion embryo. Umur: 17,5 hari inkubasi. Nutrient: Karbohidrat.
Hasil: Pemberian karbohidrat secara in ovo memiliki efek thropic terhadap usus kecil , meningkatkan
mucin mRNA expression dan meningkatkan
perkembangan sel goblet usus.
2006 O. T. Foye, Z. Uni dan R. P. Ferket
Effect of In Ovo Feeding Egg White Protein, β
-Hydroxy-β-Methylbutyrate, and Carbohydrates on
Dekstrin dan Glutamin
Banyak nutrien yang dapat digunakan sebagai bahan in ovo feeding.
Karbohidrat dapat digunakan sebagai bahan in ovo feeding untuk sumber glukosa
yang sangat penting bagi masa pertumbuhan periode penetasan (Moran 1985).
Karbohidrat adalah komponen penting sebagai larutan in ovo feeding
karena berperan penting dalam perkembangan embrio stadium akhir, untuk keluar
dari cangkang telur ketika level karbohidrat yang terdapat dalam telur sebelum
menetas sangatlah sedikit (Christensen et al. 1993). Karbohidrat yang digunakan
umumnya mengandung glukosa, maltosa, sukrosa dan dekstrin serta digunakan
juga NaCl untuk aksi transport pada brush border (Gal Gerber et al. 2000).
Dekstrin merupakan grup karbohidrat yang mempunyai berat molekul
yang rendah dan lebih kompleks sebagai hasil dari hidrolisis pati. Dekstrin
mempunyai rumus bangun yang sama dengan karbohidrat, tetapi dengan panjang
rantai yang lebih pendek. Dekstrin merupakan zat yang larut dalam air dan
alkohol. Dekstrin yang dihasilkan dari pati jagung disebut dengan maltodekstrin.
Oligosakarida diatas ini memiliki rasa yang manis dimana biasanya digunakan
sebagai food additive. Dekstrin diketahui mudah dicerna dan diabsorbsi sebagai
glukosa (Groff et al. 2000).
Dekstrin yang digunakan untuk industri biasanya terbuat dari pati gandum,
tetapi di negara Amerika dan Eropa sudah beralih menggunakan dekstrin dari
jagung. Hal ini dilakukan karena dekstrin dari jagung ini mempunyai harga yang
lebih terjangkau dan mempunyai fungsi sebagai sumber karbohidrat yang mudah
diserap sebagai glukosa (Groff et al. 2000).
Glukoneogenesis merupakan proses menghasilkan glukosa yang berasal
dari sumber non-karbohidrat. Konversi alanin, glisin, serine, aspartat, dan
glutamat ke piruvat, oksaloasetat, terutama terdapat pada hati dan diketahui
menjadi lebih aktif selama proses embriogenesis dan ketika telah menetas
terutama pada saat tubuh kekurangan makanan (Sturkie 1976).
Glutamin merupakan asam amino alifatik bersifat polar tidak bermuatan,
merupakan amida dari asam glutamate, bersifat mudah larut dalam air karena
mempunyai gugus ekstra-NH2 yang bersifat polar. Glutamin diketahui menjadi
mempunyai dua grup ammonia, satu dari prekursornya yaitu glutamat dan yang
lainnya berasal dari ammonia bebas pada aliran darah (Antonio et al. 1999).
Glutamin merupakan asam amino non essensial dimana dapat berubah fungsi
menjadi essensial pada kasus-kasus peradangan tertentu (Newsholme 2001).
Glutamin merupakan asam amino bebas yang keberadaannya paling
banyak pada pembuluh darah. Glutamin menyumbang sekitar 50% dari pool α
-asam amino bebas didalam tubuh dan secara kuantitas merupakan -asam amino
paling penting yang terlibat dalam organ dalam transpor nitrogen. Sebenarnya
glutamin merupakan asam amino non-essensial, karena dapat disintesis pada
sel-sel dan jaringan-jaringan tubuh (Lund & Williamson 1985).
Meskipun banyak jaringan yang dapat mensintesa glutamin, tetapi hanya
jaringan tertentu saja yang dapat melepaskan glutamin ke pembuluh darah dalam
jumlah yang signifikan. Jaringan-jaringan ini diantaranya adalah paru-paru, otak,
otot-otot kerengka dan jaringan adiposa. Karena jumlahnya yang sangat banyak,
otot-otot kerangka diketahui sebagai organ yang paling penting dalam hal
memproduksi glutamin di dalam tubuh. Pada otot-otot kerangka glutamin terdapat
sekitar 60% dari total pool asam amino bebas. Organ-organ yang menggunakan
glutamin diantaranya adalah ginjal, hati, usus halus dan sel-sel dari sistem imun
(Newsholme & Calder 2002).
Pada penelitian Bartell dan Batal (2007) diketahui bahwa pemberian
glutamin sebesar 1% dapat meningkatkan penggunaan dan absorbsi nutrien karena
dapat meningkatkan tinggi villi sehingga mempunyai area yang lebih banyak
dalam pengguanaan nutrien. Ketika diberikan glutamin sebanyak 4% terjadi
penurunan performa yaitu menurunnya konsumsi pakan dan bobot badan, yang
diketahui sebagai indikasi dari efek toksik dari dosis glutamin yang diberikan
tersebut.
Glutamin mempunyai aturan metabolik yang berbeda-beda pada tiap-tiap
organ yang menggunakannya. Pada hati, kerangka karbon glutamin merupakan
prekursor untuk sintesis glukosa, sedangkan glutamin itu sendiri dapat digunakan
untuk sintesis asam-asam amino dan protein-protein yang lainnya, dengan
dapat digunakan sebagai prekursor untuk bagian glutamat dari glutathione,
dimana secara utama disintesis pada hati (Newsholme & Calder 2002) .
Glutamin berpartisipasi pada keseimbangan asam basa di ginjal,
mendonorkan nitrogen-nitrogen amida dan amino untuk bergabung dengan
proton-proton untuk membentuk ion-ion amonium yang akan di di eksresikan ke
urine. Kerangka karbon yang tidak terpakai dapat digunakan untuk menghasilkan
energi atau sebagai prekursor untuk sintesis glukosa (glukoneogenesis). Glutamin
merupakan sumber energi utama pada usus halus dan merupakan sumber energi
yang penting untuk sel-sel imun (Newsholme & Calder 2002).
Produksi glukosa dari nutrien non-karbohidrat diketahui sebagai
glukoneogenesis. Glutamin adalah salah satu substrat non karbohidrat yang paling
efisien karena dapat digunakan sebagai energi. Pada beberapa sel sekitar 30% dari
degradasi glutamin dapat di konversikan menjadi laktat dan karbondioksida, dan
2% lagi dapat digunakan untuk makromolekul. Pemanfaatan glutamin dapat
meningkat ketika glukosa menurun, bahkan pada beberapa kondisi sel-sel dapat
bertahan dan tumbuh pada keadaan glukosa rendah dengan penambahan glutamin
yang cukup. Glutamin dapat di metabolisme pada siklus urea, jalur sintesis protein
dan siklus krebs untuk energi serta produksi dari sitrat, laktat dan glukosa
(Antonio 1999).
Glutamin adalah vital untuk struktur saluran pencernaan dan
produksivitasnya dengan cara memperketat sistem imun, pertumbuhan mukosa
dan lubrikasi (Ardawi 1985). Glutamin merupakan prekursor yang penting untuk
sintesis asam amino, nukleotida, asam nukleat, gula-gula amino, protein-protein
dan banyak lagi molekul-molekul yang penting secara biologi (Souba 1993).
Aktivitas glutaminase pada semua organ lymphoid adalah tinggi, termasuk
lymp nodes, spleen, timus, Peyer’s patches dan sumsum tulang serta pada limfosit,
makrofag, serta heterofil. Aktivitas glutaminase meningkat pada popliteal lymph
node ketika merespon tantangan imun. Respon proliferasi limfosit tikus terhadap
mitogens T-cell tergantung dari kemampuan dari glutamin yaitu diketahui bahwa
ketika ketidakberadaan glutamin, sel-sel ini tidak dapat berproliferasi, tetapi
ketika konsentrasi glutamin pada medium kultur meningkat, maka proliferasi
Glutamin merupakan bahan bakar utama untuk perkembangan sel-sel
secara cepat seperti pada enterosit saluran pencernaan dan limfosit aktif
(Newsholme & Calder 2002). Pada penelitian Allee (2005), diketahui bahwa
pemberian suplementasi glutamin pada anak ayam sebanyak 1% pada pakan
setelah menetas dapat meningkatkan performa pertumbuhan, menurunkan angka
kematian dan mempunyai perkembangan intestinal yang lebih baik serta
mempunyai respons imun yang lebih tinggi.
Respon Imun
Sistem imun adalah semua mekanisme tubuh dalam mempertahankan
keutuhan tubuh sebagai perlindungan terhadap bahaya yang ditimbulkan dari
berbagai bahan dalam lingkungan hidup (Baratawidjaja 1991). Dijelaskan bahwa
sistem pertahanan meliputi sistem imun non-spesifik (innate/natural) dan sistem
imun spesifik (adaptive/acquired). Diperlihatkan pada Gambar 1 sistem imun
non-spesifik merupakan pertahanan tubuh terdepan dalam menghadapi serangan
berbagai mikroorganisme yang dapat memberikan respon langsung terhadap
antigen dan sistem ini telah berfungsi sejak lahir.
SISTEM IMUN
Sistem imun spesifik memerlukan waktu untuk mengenal antigen terlebih
dahulu sebelum dapat memberikan responnya. Dijelaskan oleh Tizard (1987)
bahwa respon imun sebagai akibat dari antigen pada kontak pertama dengan
sel-sel imun, dapat membentuk klon atau kelompok sel-sel yang disebut memory cells
yang dapat mengenali antigen yang bersangkutan. Bila kemudian ditemukan lagi
antigen yang sama, maka klon akan berproliferasi dan menimbulkan respon
sekunder spesifik yang berlangsung lebih cepat dan lebih intensif dibandingkan
dengan respon primer.
Tizard(1987) mengatakan bahwa terdapat dua kategori mayor dari respon
kekebalan yaitu respon yang melibatkan antibodi, yang disebut respon imun
humoral dan respon-respon yang bebas dari antibodi atau cell mediated immune
responses. Dijelaskan lebih lanjut bahwa pemanfaatan respon kekebalan sebagai
suatu sifat indikator resistensi penyakit yang memerlukan pengertian kontrol
genetik.
Unggas mengalami berbagai tekanan dalam hidupnya. Tekanan ini dapat
menyebabkan perubahan hormon, penurunan konsumsi pakan, menurunkan
metabolisme nutrisi dan menekan fungsi imun. Hal-hal inilah yang menyebabkan
peneliti meneliti berbagai cara untuk menekan dampak yang merugikan ini.
Nutrien diketahui dapat mempengaruhi respon unggas tersebut untuk memerangi
penyakit. Respon yang paling mudah diukur terhadap imunitas tubuh adalah
leukosit dan diferensiasinya.
Menurut Kimball (1983) darah adalah suspensi yang terdiri dari
elemen-elemen, atau sel-sel, dan plasma yaitu larutan yang mengandung berbagai molekul
organik dan anorganik. Ada tiga grup sel darah, yaitu sel darah merah atau
eritrosit, sel darah putih atau leukosit, keping-keping darah atau trombosit. Sel-sel
ini cukup besar sehingga dapat diamati dengan mikroskop biasa. Leukosit
berbentuk bola (spherical), dengan diameter 7-20 µm dan terdapat kurang dari 1%
volume darah total. Sel ini memiliki struktur internal, termasuk nukleus dan
mitokondria serta mempunyai fungsi melindungi badan dari infeksi.
Ada dua kelas leukosit yaitu yang mengandung granula dalam sitoplasma
nya (granulosit) dan agranulosit yang tidak mengandung granula. Granulosit dari
leukosit terdiri dari limfosit dan monosit. Profil leukosit menyempurnakan fungsi
leukosit dengan membungkusnya secara endositosis partikel-partikel asing yang
masuk dalam badan. Ketika melaksanakan fungsinya monosit dan heterofil ini
keluar melalui dinding kapiler di area terjadinya kerusakan jaringan, bila telah
bebas dalam jaringan mereka mulai fagositosis. Bakteri-bakteri atau partikel
lainnya ditelan di dalam vakuola-vakuola yang bersatu dengan lisosom, dimana
enzim-enzimnya dapat menghancurkan bakteri-bakteri tersebut. Biasanya
perlawanan berakhir dengan kematian sel darah putih (Kimball 1983).
Menurut Maxwell (1993) leukosit pada unggas mempunyai fungsi yang
berbeda-beda dalam tubuh. Monosit setelah matang berubah menjadi jaringan
makrofag. Makrofag atau monosit dalam bentuk matang mempunyai fungsi yang
penting dalam pertahanan, yaitu fagositosis terhadap parasit-parasit diluar sel
seperti virus dan beberapa bakteri atau bahkan terhadap benda-benda asing dalam
tubuh. Heterofil berfungsi sebagai pertahanan tubuh terhadap bakteri yang masuk
dengan cara fagositosis. Limfosit-limfosit biasanya tidak melakukan endositosis,
melainkan memerangi penyakit dengan ikut serta dalam pembentukan antibodi.
Antibodi adalah protein-protein yang dihasilkan apabila makromolekul asing
(antigen) masuk dalam badan. Limfosit berfungsi terhadap pengenalan dan
penghancuran dari berbagai tipe-tipe patogen dalam tubuh.
Eosinofil berfungsi sebagai pertahanan terhadap kutu-kutu dan protozoa.
Basofil pada unggas kurang diketahui fungsinya, tetapi pada manusia diketahui
berfungsi sebagai mediator respon awal terhadap infeksi. Secara normal
persentase eosinofil dan basofil dalam darah sangat rendah, tetapi tetap memegang
peranan penting dalam memerangi penyakit. Jumlah eosinofil dengan mencolok
meningkat dalam penyakit tertentu terutama yang disebabkan oleh cacing-cacing
parasit. Selama terjadi infeksi jumlah basofil juga meningkat. Bila basofil
meninggalkan darah, mereka berkembang menjadi sel-sel mast, dimana di tempat
terjadianya infeksi, sel-sel mast ini akan melepaskan histamin yang akan
meningkatkan aliran darah di daerah tersebut (Tizard 1987).
Zinkl (1986) mengatakan bahwa jumlah leukosit yang normal pada ayam
bekisar antara 12 000 sampai 30 000 per mm3. Jumlah leukosit meningkat seiring
bahwa persentase normal bagian-bagian leukosit pada ayam umur 1 minggu
kira-kira heterofil 24%, eosinofil 0%, basofil 0%, monosit 1% dan limfosit 75% dari
total leukosit. Untuk ayam umur 6 minggu kira-kira heterofil 26%, eosinofil 0%,
basofil 1%, monosit 3% dan limfosit 69% dari total leukosit (Hodges 1997).
Sistem imun pada unggas dapat dipengaruhi oleh beberapa hal,
diantaranya adalah anatomi pembentukan jaringan limpa, produksi mucus, sintesis
dari substansi aktif imunologi, perkembangbiakan sel dan aktivasi dan
perpindahan sel atogen yang mati pada intraselular dan regulasi dari proses imun.
Pada masa embrional, timus berasal dari ekstroderm, yakni perkembangan
dari kantong kerongkongan (pharynx) keempat. Secara anatomis timus ayam
terletak pada sisi kanan dan kiri saluran nafas. Pengembangan timus ayam dimulai
dari bagian posterior rahang bawah mencapai kelenjar tiroid di dalam rongga
(thorax). Jaringan timus seringkali berproliferasi pada kelenjar tiroid. Timus
merupakan regulator sel T yang bekerja pada sel-sel primitif yang berasal dari
sumsum tulang dan membuat sel-sel itu mampu secara imunologik bertindak
sebagai pembentuk antibodi tubuh (Tizard 1987).
Bursa fabricius terletak pada daerah dorsal kloaka. Bursa fabricius terdiri
dari sel-sel limfoid yang tersusun dalam kelompok-kelompok yang disebut folikel
limfoid. Pada bagian dalam ditemukan lumen yang dibatasi oleh deretan epitel
yang membungkus folikel limfoid. Setiap folikel limfoid terdiri dari korteks yang
berisi sel-sel limfosit, sel plasma dan makrofag, sedangkan bagian medula hanya
terdiri dari sel-sel limfosit. Bursa diketahui sebagai organ limfoid primer yang
fungsinya sebagai tempat pendewasaan dan deferensiasi bagi sel dari sistem
pembentuk antibodi. Timus dan bursa pada ayam mencapai ukuran maksimal
sekitar dua sampai tiga minggu sesudah menetas dan sesudahnya mengalami
inovulasi perlahan-lahan (Tizard 1987).
Unggas mengalami berbagai tekanan dalam hidupnya. Tekanan ini dapat
menyebabkan perubahan hormon, penurunan konsumsi pakan, menurunkan
metabolisme nutrisi dan menekan fungsi imun. Nutrien diketahui dapat
mempengaruhi repon unggas tersebut untuk memerangi penyakit. Timus
merupakan regulator sel T yang bekerja pada sel-sel primitif yang berasal dari
sebagai pembentuk antibodi tubuh. Sedangkan bursa diketahui sebagai organ
limfoid primer yang fungsinya sebagai tempat pendewasaan dan deferensiasi bagi
sel dari sistem pembentuk antibodi (Tizard 1987).
Perubahan-perubahan patologi anatomi yang terjadi sebagai akibat respon
terhadap perlakuan dapat dilihat dari berat relatif bursa dan timus. Melalui berat
relatif bursa dan timus dapat lebih terlihat jelas ada atau tidaknya efek in ovo
feeding terhadap respon imun yang dapat menandakan lebih bertahannya ayam
tersebut tehadap lingkungan sekitarnya.
Keterlambatan maturasi enzim-enzim yang mengontrol metabolisme yang
disebabkan oleh terlambatnya pemberian pakan pada masa post hatch (seperti
sistem de-iodinasi dan aktivasi jalur T3 serta retardasi perkembangan sistem
imun) akan terjadi pada anak kalkun yang terlambat menerima pakan ketika
menetas (Dibner 1999). Suplementasi nutrien yaitu β-hydroxybeta- methylbutyrate
(HMB) pada saat segera setelah penetasan diketahui dapat meningkatkan respon
mediasi T-sel terhadap mitogen, meningkatkan respon hipersensitivitas terhadap
mitogen, tetapi tidak mempengaruhi berat timus, bursa serta tidak berpengaruh
terhadap potensi fagositas makrofag. Selain hal ini juga diketahui bahwa
pemberian in ovo feeding segera setelah penetasan dapat meningkatkan respon
antibodi yaitu dengan cara meningkatkan IgG ( Uni & Ferket 2003).
Newcastle Disease (ND)
Newcastle Disease adalah salah satu penyakit pernafasan pada ayam yang
disebabkan oleh virus jenis paramyxovirus dengan penyebaran yang luas dan
angka kematian yang sangat tinggi, bahkan dapat mencapai seratus persen
(Gordon & Jordan 1982) di seluruh dunia dan dapat menyerang ayam pada
berbagai tingkat umur dan dapat terjadi setiap saat (Wiharto 1985).
Pencegahan infeksi akut terhadap ND virus telah dilakukan dengan
melaksanakan program vaksinasi secara teratur. Vaksinasi diartikan sebagai
tindakan memasukkan antigen ke dalam tubuh sehat dengan madsud agar
terbentuk kekebalan yang dapat melindungi individu yang bersangkutan terhadap
infeksi penyakit di alam (Tizard 1987). Ada dua jenis vaksin ND yaitu inaktif dan
bahan kimia, sedangkan vaksin aktif mengandung virus ND yang masih hidup
tetapi sifat keganasannya telah berkurang. Vaksin aktif sering digunakan dalam
pencegahan ND secara maksimal karena harga yang murah serta mampu
digunakan sebagai pelindung terhadap infeksi alam (Brugh & Siegel 1978).
Berdasarkan tingkat virulensinya, virus ND dibagi menjadi tiga tipe yaitu
lentogenik, mesogenik dan velogenik (National Acedamy Of Science 1971).
Terdapat tiga macam lentogenik yang dipakai sebagai bahan vaksin yaitu strain
V4, B1 Hitchner dan La Sota. Dari ketiga tipe tersebut ternyata strain La Sota
adalah jenis yang Paling Patogen (Wetsbury et al. 1984). Rombout et al. (1992)
mengatakan bahwa sel-sel limfosit pasca vaksinasi dengan ND strain La Sota
menunjukkan adanya penurunan jumlah limfosit yang terjadi tiga hari setelah
vaksinasi dan kemudian meningkat kembali pada enam sampai sepuluh hari
setelah vaksinasi.
Metode yang dapat digunakan untuk mengukur tingginya titer antibodi ND
didalam serum adalah mikrotitrasi, dengan diawali dengan uji aglutinasi (uji
Hemaglutinasi) untuk menentukan titer virus dalam satuan HA-unit. Setelah
dilakukan uji hemaglutinasi dilanjutkan dengan uji penghambatan aglutinasi (HI)
(Villegas 1987). Malole (1988) melaporkan bahwa uji HI dapat ditujukan untuk
mengukur tingginya titer antibodi yang terkandung di dalam serum untuk
menggambarkan tingkat kekebalan ayam setelah divaksinasi dengan vaksin ND.
Infectious Bursal Disease (IBD) atau Gumboro
Infectious Bursal Disease (IBD) atau Gumboro adalah penyakit menular
akut yang menyerang ayam muda 2.5 sampai 14 minggu yang ditandai khas
dengan pembengkakan bursa fabricius, proliferasi dan nekrosa sampai pendarahan
dari jaringan limfoid, degenerasi ginjal, diare, nafsu makan menurun, kelemahan
dan diikuti kematian (Parede et al. 2000).
Virus IBD mempunyai stabilitas yang tinggi terhadap lingkungan sehingga
virus ini masih bertahan dalam kandang yang sudah dibersihkan dan telah
disinfeksi. Untuk itu prinsip pencegahan dari penyakit ini adalah vaksinasi,
terutama pada ayam pedaging sangat dianjurkan karena umurnya hanya empat
Vaksin IBD intermediate strain dapat menimbulkan kerusakan pada bursa
baik pada ayam bukan ras (buras/kampung) maupun ayam komersial (ras) yang
digunakan sebagai hewan percobaan dan menimbulkan efek imunosupresif
terhadap vaksin ND pada kelompok hewan vaksinasi (Berg 2000).
Target organ dari virus IBD adalah bursa fabricius dan timus. Bursa
fabrisius secara spesifik sebagai sumber dari sel limfosit B pada unggas.
Penggunaan vaksin IBD aktif untuk vaksinasi pertama dan kedua menyebabkan
perubahan patologik pada bursa yang lebih berat dibandingkan dengan
penggunaan satu kali saja. Vaksin aktif menyebabkan kerusakan pada sel limfoid
bursa (Soejoedono 1998).
Ayam specific pathogen free (SPF) umur satu hari dan tiga minggu yang
divaksin dengan intermediate strain mengalami efek patogenik dan
imunosupresif, indeks bursa-body weight ratio dan bursa lesion score diperoleh
secara hispatologi. Hasil indeks bursa body weight ratio menurun pada ayam SPF
umur tiga minggu, sedangkan bursa lesion score lebih rendah menunjukkan
peningkatan pada ayam umur tiga minggu, demikian juga analisa serum
Netralisasi dan Uji Hambatan Aglutinasi cenderung meningkat (Mazariegos
1990). Kemampuan produksi antibodi akan membaik kembali dan repopulasi dari
pada folikel bursa ayam SPF umur satu minggu yang divaksin dengan
intermediate strain IBD (strain ganas) akan terlihat pada minggu ke tujuh pasca
vaksinasi (Kim 1999).
Salah satu metode pengukuran titer antibodi terhadap IBD adalah uji
ELISA (enzyme-linked immunosorbent assay). Pada ELISA tidak langsung untuk
melihat atau menemukan keberadaan antibodi. Akan tetapi melalui permukaan
polistiren yang digunakan untuk menyerap antigen protein. Pertama-tama tabung
polistiren dilapisi dengan antigen yakni dengan pengeraman antigen didalam
tabung semalam. Setelah antigen yang tidak terikat dicuci, serum yang diuji
ditambahkan ke tabung sehingga antibodi didalam serum akan terikat dengan
antigen pada dinding tabung. Pengeraman dan pencucian untuk menghilangkan
antibodi yang tidak terikat dilakukan setelah itu. Adanya antibodi yang terikat
diketahui dari penambahan antiglobulin terikat enzim. Antiglobulin ini diketahui
dihasilkan produk berwarna dalam tabung. Intensitas perubahan warna
proporsional dengan jumlah antiglobulin terikat enzim yang terikat, sebaliknya
proporsional dengan jumlah antibodi yang terdapat didalam serum yang diuji.
Warna yang dihasilkan dapat diukur secara visual atau untuk lebih baik dibaca
dalam spektrofotometer (Tizard 1987).
Komposisi Karkas Ayam Broiler
In ovo feeding diketahui dapat meningkatkan perkembangan saluran
pencernaan ayam. Selain itu in ovo feeding juga diketahui dapat meningkatkan
total glikogen hati pada embrio dan pada saat penetasan. In ovo feeding juga
diketahui dapat meningkatkan ukuran relatif otot dada (% dari berat badan ayam
broiler) (Uni & Ferket 2004).
Dengan meningkatnya glikogen hati dan persentase otot dada diharapkan
dapat juga meningkatkan status nutrisi pada saat panen bukan hanya
meningkatkan berat panen saja. Komposisi kimiawi daging dipengaruhi oleh
bangsa, pakan, umur, dan penggemukan (Lawrie 1979).
Komposisi karkas memegang peranan penting karena berhubungan dengan
jumlah jumlah otot, tulang, dan lemak. Otot memiliki nilai ekonomis yang paling
tinggi. Persentase karkas meningkat seiring dengan peningkatan bobot potong.
Nilai komersial karkas dapat ditentukan dari ukuran struktur dan komposisinya.
Sifat-sifat karkas untuk kepentingan komersial mengikuti bobot, penampilan luar,
komposisi kimia, proporsi jaringan utama karkas (daging, tulang, lemak) dan
ketebalan lemak (Rogers et al. 2001).
Komposisi kimiawi daging dipengaruhi oleh bangsa, pakan, umur dan
penggemukan (Lawrie 1979). Komposisi kimiawi daging ayam secara umum
terdiri dari air (65.99%), protein (18.6%), lemak (15.06%), abu (0.8%), substansi
non-protein soluble dan sedikit vitamin (Stadelman et al. 1988).
Air merupakan komponen daging yang terbesar, diikuti oleh protein,
lemak, karbohidrat, dan mineral. Air adalah konstituen utama cairan ekstraseluler.
Sejumlah konstituen kimia yang mudah larut terdapat di dalam air, termasuk
Protein merupakan komponen kimiawi di dalam tubuh yang sangat
penting, beberapa diantaranya sangat di perlukan untuk struktur dan fungsi reaksi
metabolik. Protein otot mempunyai hubungan yang erat dengan kadar air daging.
Protein otot mempunyai sifat hidrofilik, yaitu mengikat molekul-molekul air
daging. Protein terdiri dari serangkaian asam-asam amino yang berkaitan secara
kimiawi. Asam amino dapat dibedakan menjadi dua kelompok yaitu essensial dan
non essensial. Asam amino dapat pula berfungsi sebagai pembentuk cita rasa yang
terjadi apabila senyawa-senyawa yang larut dalam air dipanaskan maka akan
menghasilkan aroma daging (Rogers 2001).
Lemak adalah susunan gliserida terutama dari trigliserida, fosfolipid, dan
sterol terutama kolesterol. Sebagian lemak tubuh disimpan dalam depot lemak dan
lemak otot yang didominasi oleh lemak netral dalam bentuk gliserol dan
asam-asam lemak rantai panjang. Komposisi lemak daging di bagi menjadi dua kategori
yaitu berasal dari jaringan otot dan jaringan adiposa dengan komposisi yang
berbeda-beda. Peningkatan deposisi lemak dalam jaringan otot terjadi apabila
aktivitas otot menurun. Lemak berfungsi sebagai sumber energi lebih efektif
dibandingkan karbohidrat dan protein, disamping itu berperan sebagai pelarut
vitamin A, D, E dan K (Guyton 1997).
Karkas ayam pedaging diperoleh setelah ayam pedaging dipotong,
dikeluarkan darahnya, dibuang bulu, kepala dan lehernya serta saluran pencernaan
dan reproduksinya. Karkas ayam pedaging ini disebut juga eviscerated carcass
yang merupakan 73.7% dari bobot hidup ayam pedaging (broiler). Karkas terdiri
dari kulit, daging dan tulang. Daging pada karkas dapat dibagi menjadi daging
dada (21.67%), daging paha (16.8%), serta sayap (12.6%) (Rose 1997).
Daging dada memiliki warna yang lebih pucat dari daging paha karena
konsentrasi myoglobin yang lebih sedikit. Salah satu komposisi otot baik pada
dada maupun paha yang bernama myoglobin memegang peranan yang penting
dalam transpor oksigen. Otot-otot ini digunakan untuk periode aktifitas, yaitu
untuk berdiri dan berjalan. Oleh sebab itu butuh sumber energi yang konsisten dan
dalam hal ini oksigen yang dibawa oleh myoglobin digunakan untuk
menghasilkan kebutuhan akan energi. Myoglobin kaya akan pigmentasi protein,
Berdasarkan warnanya itulah daging dada disebut white meat dan daging paha
disebut dark meat (Rose 1997).
Dalam beberapa dekade ini telah ditemukan berbagai cara atau metode
pengukuran yang dapat digunakan untuk mengukur komposisi kimia daging
diatas. Pada tahun 1999 The Official Methods Of Analysis of AOAC international
mengeluarkan metode pengukuran secara proksimat yaitu kadar air, kadar abu,
kadar protein kasar dan kadar lemak kasar yang digunakan untuk pengukuran
MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di peternakan ayam, Tangerang, Cikupa, selama 35
hari. Inkubasi dan penyuntikan larutan nutrien ke dalam telur (in ovo) dilakukan di
hatchery Subang. Analisa darah untuk mengetahui jumlah leukosit dan diferensiasinya dilakukan di laboratorium Fisiologi FKH IPB. Analisa untuk
pengukuran titer antibodi terhadap vaksin ND dan IBD serta histopat bursa
dilakukan di laboratorium Animal Health Charoen Pokphand Indonesia,
sedangkan analisa proksimat daging ayam dilakukan di laboratorium Pusat
Penelitian Sumberdaya Hayati dan Bioteknologi IPB. Penelitian ini dilakukan
pada bulan Maret hingga Juli 2007.
Hewan Percobaan
Sebanyak 4100 butir telur tetas strain Ross 308 yang berasal dari flok dan
umur yang sama ditetaskan dengan inkubator merk Jamesaway di hatchery
Subang. Pada umur 18 hari inkubasi, setelah di candling terdapat 3280 telur yang ber-embrio (hidup), secara acak dibagi menjadi empat perlakuan dan sebanyak 0.8
ml gutamin, dekstrin, kombinasi glutamin dan dekstrin serta NaCl 0.5%,
diinjeksikan pada cairan amnion menggunakan syringe. Setelah menetas, DOC
diseleksi dan diambil 50 ekor jantan per perlakuan yang dibagi dalam lima
ulangan (10 ekor per ulangan) atau dengan jumlah total 200 ekor.
Bahan Penelitian
Penelitian ini menggunakan telur fertil strain Ross 308 yang berasal dari
umur dan flok yang sama. Larutan yang digunakanyaitu larutan dekstrin, larutan
glutamin, kombinasi larutan glutamin dan dekstrin serta larutan NaCl fisiologis
(0.5%) yang akan diinjeksikan ke dalam telur berumur 18 hari inkubasi dengan
menggunakan sebuah syringe. Penelitian ini juga menggunakan pakan broiler
starter produksi Charoen Phokphand Indonesia, kandang postal, mesin tetas,
penelitian ini antara lain alat bedah (gunting dan pinset), cawan petri, candling
telur dan timbangan.
Rancangan Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap dengan empat
perlakuan dan lima ulangan, sehingga penelitian ini memiliki 20 satuan
percobaan. Setiap satuan percobaan terdiri dari 10 ekor ayam, sehingga jumlah
seluruh ayam yang digunakan sebanyak 200 ekor. Analisis data yang di peroleh
diuji melalui perhitungan anova dengan model Rancangan Acak Lengkap.
Apabila dari hasil sidik ragam terdapat paling sedikit ada sepasang perlakuan yang
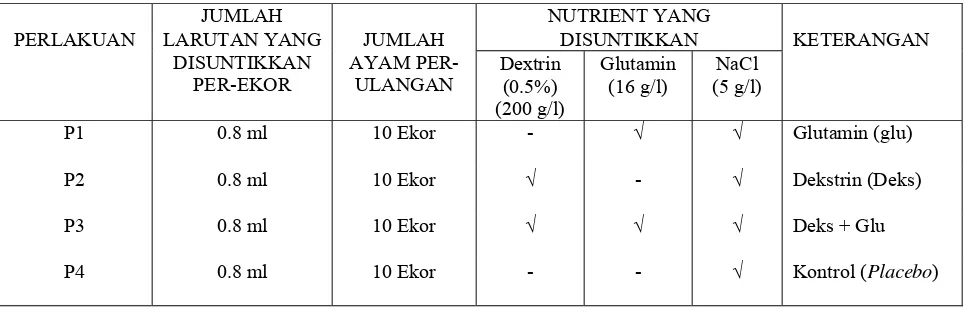
tidak sama maka dilanjutkan dengan Uji Tukey (Steel & Torrie 1991). Adapun Perlakuan yang dicobakan antara lain:
P1 = DOC jantan yang pada hari ke-18 inkubasi menerima larutan glutamin
secara in ovofeeding.
P2 = DOC jantan yang pada hari ke-18 hari inkubasi menerima larutan
dekstrin secara in ovofeeding.
P3 = DOC jantan yang pada hari ke-18 inkubasi menerima kombinasi larutan
dekstrin dan glutamin secara in ovo feeding.
P4 = DOC jantan yang pada hari ke-18 inkubasi menerima larutan NaCl
(0.5%) secara in ovo feeding. Perlakuan ini adalah kontrol atau
placebo.
Tabel 2 Perlakuan yang digunakan dalam penelitian