Lampiran 1. Bagan Penelitian
Keterangan :
P0 : Ceratocystis fimbriata
P1 : Ceratocystis fimbriata + Trichoderma koningii
P2 : Ceratocystis fimbriata + Trichoderma harzianum
S U P0
P2 P0
P0 P2 P1
P2 P1 P0
P1 P0 P1
P1 P2
P0
P2 P1
P2
P0 P1
P0
P2 P2
Lampiran 2. Gambar Bahan Penelitian
a. Ceratocystis fimbriata
b. Trichoderma koningii
c. : Trichoderma harzianum
Lampiran 3.
Data Pengamatan Diameter Koloni Jamur (cm) pada 4 HSI
Daftar Sidik Ragam
FK 350,370
KK 5,58%
Ket (tn) tidak nyata
Perlakuan Ulangan Total Rataan
I II III IV V VI VII VIII
P0 3,60 3,60 3,80 3,80 4,10 3,80 4,00 3,50 30,20 3,78 P1 P2 3,90 3,80 3,90 3,70 3,90 3,70 4,10 3,90 4,30 3,80 3,90 4,00 4,10 3,60 3,40 3,50 31,50 30,00 3,94 3,75 Total 11,300 11,200 11,400 11,800 12,200 11,700 11,700 10,400 91,70 11,46 Rataan 3,767 3,733 3,800 3,933 4,067 3,900 3,900 3,467 30,57 3,82
SK db JK KT F hit 0.05 0.01 Ket
Perlakuan 2 0,166 0,083 1,826 3,467 5,780 tn
Galat 21 0,954 0,045
Lampiran 4.
Data Pengamatan Diameter Koloni Jamur (cm) pada 6 HSI
Daftar Sidik Ragam
FK 608,027
KK 8,31 %
Ket (**) nyata
Perlakuan Ulangan Total Rataan
I II III IV V VI VII VIII
P0 5,80 5,70 5,90 5,50 6,00 5,20 5,20 5,40 44,70 5,59 P1 P2 5,10 4,60 5,10 4.70 4,50 4,90 5,10 5,00 5,20 4,70 4,90 4,90 5,10 4,20 3,40 4,70 38,40 37,70 4,80 4,71 Total 15,00 15,50 15,30 15,60 15,90 15,00 14,50 13,50 120,80 15,10 Rataan 5,17 5.17 5.10 5.20 5.30 5.00 4,83 4,50 40,27 5,03
SK Db JK KT F hit 0.05 0.01 Ket
Perlakuan 2 3,716 1,858 10,609 3,467 5,780 **
Galat 21 3,678 0,175
Total 23 7,393
Uji Jarak Duncan (UJD)
SY 0.15 -4.26 -4.33 -5.10
I 2 3 4
SSR 0.05 3.03 3.18 3.27 LSR 0.05 0.45 0.47 0.48
Perlakuan P2 P1 P0
Rataan 4.71 4.80 5.59
A
Lampiran 5.
Data Pengamatan Diameter Koloni Jamur (cm) pada 8 HSI
Daftar Sidik Ragam
FK 724,900
KK 9,42 %
Ket (**) nyata
Perlakuan Ulangan Total Rataan
I II III IV V VI VII VIII
P0 6,70 7,40 7,40 7,80 6,40 6,30 6,30 7,30 55,60 6,95 P1 P2 5,10 4,60 5,10 4,70 4,50 4,90 5,10 5,00 5,20 4,70 4,90 4,90 5,30 4,20 340 4,70 38,60 37,70 4,83 4,71 Total 16,40 17,20 16,80 17,90 16,30 1610 15,80 15,40 131,90 16,49 Rataan 5,47 5,73 5,60 5,97 5,43 5,37 5,27 5,13 43,97 5,50
SK db JK KT F hit 0.05 0.01 Ket
Perlakuan 2 25,426 12,713 47,472 3,467 5,780 **
Galat 21 5,624 0,268
Total 23 31,050
Uji Jarak Duncan (UJD)
SY 0.18 -4.16 -4.24 -6.35
I 2 3 4
SSR 0.05 3.03 3.18 3.27 LSR 0.05 0.55 0.58 0.60
Perlakuan P2 P1 P0
Rataan 4.71 4.83 6.95
a
Lampiran 6.
Data Pengamatan Luas Pertumbuhan Jamur (cm2) pada 4 HSI
Data Sidik Ragam
FK 2834,027
KK 16,84 %
Ket (tn) tidak nyata Perlakuan
Ulangan
Total Rataan
I II III IV V VI VII VIII
P0 11,20 11,10 12,30 11,10 12,60 12,60 12,80 9,10 92,80 11,60 P1 P2 13,40 7,10 13,00 10,90 10,20 12,00 11,80 11,40 12,30 10,50 10,50 10,70 10,50 8,60 5,70 9,40 87,40 80.80 10,93 2.60 Total 31,70 35,00 34,50 34,30 35,40 33,80 31,90 24,20 260,80
Rataan 10,57 11,67 11,50 11,43 11,80 11,27 10,63 8,07 10,87
SK db JK KT F hit 0.05 0.01 Ket
Perlakuan 2 9,343 4,672 1,395 3,467 5,780 tn
Galat 21 70,310 3,348
Total 23 79,653
Lampiran 7.
Data Pengamatan Luas Pertumbuhan Jamur (cm2) pada 6 HSI
Data Sidik Ragam
FK 7041,800
KK 16,76 %
Ket (**) sangat nyata
Perlakuan Ulangan Total Rataan
I II III IV V VI VII VIII
P0 20,00 23,80 24,10 21,50 21,60 19,70 21,50 18,80 171,00 21,38 P1 P2 19,60 12,30 15,30 13,40 14,60 16,70 15,90 16,90 17,30 16,30 15,70 18,10 16,10 10,60 6,50 14,80 121,00 108,10 15,13 14,89 Total 51,90 52,50 55,40 54,30 55,20 53,50 48,20 40,10 411,10
Rataan 17,30 17,50 18,47 18,10 18,40 17,83 16,07 13,37 17,13
SK db JK KT F hit 0.05 0.01 Ket
Perlakuan 2 216,551 108,275 13,143 3,467 5,780 **
Galat 21 172,999 8,238
Uji Jarak Duncan (UJD)
SY 1.01 -11.81 -11.90 -18.06
I 2.00 3.00 4.00
SSR 0.05 3.03 3.18 3.27
LSR 0.05 3.08 3.22 3.32
Perlakuan P2 P1 P0
Rataan 14.89 15.13 21.38
a
b
Lampiran 8.
Data Pengamatan Luas Pertumbuhan Jamur (cm2) pada 8 HSI
Data Sidik Ragam
FK 9576,015
KK 16,13 %
Ket (**) sangat nyata
Perlakuan Ulangan Total Rataan
I II III IV V VI VII VIII
P0 26,00 35,90 30,90 29,00 29,50 25,70 27,10 31,70 235,80 29,48 P1 P2 19,60 12,30 15,30 13,40 14,60 16,70 15,90 16,90 17,30 16,30 15,70 18,10 17,40 12,80 6,50 14,80 122,30 121,30 15,29 15,16 Total 57,90 64,60 62,20 61,80 63,10 59,50 57,30 53,00 479,40
Rataan 19,30 21,53 20,73 20,60 21,03 19,83 19,10 17,67 19,98
SK db JK KT F hit 0.05 0.01 Ket
Perlakuan 2 1083,063 541,531 52,137 3,467 5,780 **
Galat 21 218,123 10,387
Uji Jarak Duncan (UJD)
SY 1.14 -11.71 -11.67 -25.75
I 2.00 3.00 4.00
SSR 0.05 3.03 3.18 3.27
LSR 0.05 3.46 3.62 3.72
Perlakuan P2 P1 P0
Rataan 15.16 15.29 29.48
a
b
Lampiran 9.
Data Pengamatan Daerah Hambatan (%) pada 4 HSI
Data Sidik Ragam
FK 1102,686
KK 77,51 %
Ket (**) sangat nyata
Perlakuan Ulangan Total Rataan
I II III IV V VI VII VIII
P0 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00
P1 P2 10,00 21,05 5,00 11,77 0,00 5,88 15,79 5,26 5,56 15,79 5,88 15,79 15,79 15,79 13,33 0,00 71,35 91,33 8,92 11,42 Total 31,05 16,77 5,88 21,05 21,35 21,67 31,58 13,33 162,68
Rataan 10,35 5,59 1,96 7,02 7,12 7,22 10,53 4,44 6,78
SK Db JK KT F hit 0.05 0.01 Ket
Perlakuan 2 576,295 288,148 10,439 3,467 5,780 **
Galat 21 579,659 27,603
Uji Jarak Duncan (UJD)
SY 1.86 5.63 -3.02 -5.35
I 2.00 3.00 4.00
SSR 0.05 3.03 3.18 3.27 LSR 0.05 5.63 5.90 6.07
Perlakuan P0 P1 P2
Rataan 0.00 8.92 11.42
a
b
Lampiran 10.
Data Pengamatan Daerah Hambatan (%) pada 6 HSI
Data Sidik Ragam
FK 4595,212
KK 40,44 %
Ket (**) sangat nyata
Perlakuan Ulangan Total Rataan
I II III IV V VI VII VIII
P0 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00
P1 P2 18,18 31,82 17,39 28,57 19,05 26,92 27,27 18,18 22,73 23,81 23,81 4,76 15,79 23,81 13,33 16,67 157,55 174,54 19,69 21,82 Total 50,00 45,96 45,97 45,46 46,54 28,57 39,60 30,00 332,09
Rataan 16,67 15,32 15,32 15,15 15,51 9,52 13,20 10,00 13,84
SK db JK KT F hit 0.05 0.01 Ket
Perlakuan 2 2315,647 1157,824 36,977 3,467 5,780 **
Galat 21 657,549 31,312
Uji Jarak Duncan (UJD)
SY 1.98 6.00 -13.40 -15.35
I 2.00 3.00 4.00
SSR 0.05 3.03 3.18 3.27
LSR 0.05 6.00 6.29 6.47
Perlakuan P0 P1 P2
Rataan 0.00 19.69 21.82
a
b
Lampiran 11.
Data Pengamatan Daerah Hambatan (%) pada 8 HSI
Data Sidik Ragam
FK 4595,212
KK 40,44 %
Ket (**) sangat nyata
Perlakuan Ulangan Total Rataan
I II III IV V VI VII VIII
P0 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00
P1 P2 18,18 31,82 17,39 28,57 19,05 26,92 27,27 18,18 22,73 23,81 23,81 4,76 15,79 23,81 13,33 16,67 157,55 174,54 19,69 21,82 Total 50,00 45,96 45,97 45,46 46,54 28,57 39,60 30,00 332,09
Rataan 16,67 15,32 15,32 15,15 15,51 9,52 13,20 10,00 13,84
SK db JK KT F hit 0.05 0.01 Ket
Perlakuan 2 2315,647 1157,824 36,977 3,467 5,780 **
Galat 21 657,549 31,312
Uji Jarak Duncan (UJD)
SY 1.98 6.00 -13.40 -15.35
I 2.00 3.00 4.00
SSR 0.05 3.03 3.18 3.27
LSR 0.05 6.00 6.29 6.47
Perlakuan P0 P1 P2
Rataan 0.00 19.69 21.82
A
b
22
DAFTAR PUSTAKA
Alexopoulus, C. J. and C. W. Mims, 1979. Introductory Mycology. John Wiley and Sons. New York.
Agrios, G. N. 1989. Plant Pathology. Second Edition. Academic Press. New York. Budiman, H. 2012. Budidaya Karet Unggul Prospek Jitu Investasi Masa Depan.
Pustaka Baru Press. Yogyakarata.
Benhamou, N dan I. Chet. 1993. Hyphal Interactions Between Trichodermaharzianum and Rhizoctonia solani: Ultrastructu09re and Gold Cytochemistry of the Mycoparasitic process. Phytopathology 83: 1062- 1071
Djafarudin. 2000. Dasar-dasar Pengendalian Penyakit Tanaman. Bumi Aksara Jakarta.
. 2008. Dasar-dasar Pengendalian Penyakit Tanaman. Bumi Aksara Jakarta.
Dennis, C. and J. Webster. 1971. Antagonistic Properties of Marga Groups of Trichoderma. I. Production of Non-Volatile Antibiotics. Trans. Brit. Mycol. Soc. 57 (1): 25 – 39.
Direktorat Jenderal Perkebunan. 2014. Statistik Perkebunan Indonesia 2013-2015 (Karet). Direktorat Jenderal Perkebunan. 2014.
Direktorat Perlindungan Perkebunan. 2003. Pedoman Pengamatan dan Pengendalian Organisme Pengganggu Tanaman karet. Direktorat Jendral Bina Produksi Perkebunan. Departemen Pertanian. Jakarta. 35 hal.
Gholib. D., E. Kusumaningtyas. 2006. Penghambatan Pertumbuhan Fusarium moniliforme oleh Trichoderma viride. Seminar nasional Teknologi Peternakan dan Venteriner. 1018-1025.
Hartal, Misnawaty, I. Budi. 2010. Efektivitas Trichoderma sp. dan Gliocladium sp. Dalam Pengendalian Layu Fusarium Pada Tanaman Krisan. JIPI. 12(1):7-12(2010).
Heru, D.S dan A. Andoko. 2008. Petunjuk Lengkap Budidaya Karet Edisi Revisi. Agromedia Pustaka, Jakarta.
23
Migheli, Q. 1994. Fate of Nasib transformed Trichoderma harzianum on the phylloplane of tomato berubah Trichoderma harzianum pada phylloplane tomat plants. tanaman. Mol. Mol. Ecol. Ecol. 3: 153 -159. 3: 153 -159.
Mukarlina, S. Khotimah, R. Rianti. 2010. Uji Antagonis Trichoderma
harzianum Terhadap Fusarium spp. Penyebab Penyakit Layu pada
Tanaman Cabai (Capsicum annum) Secara In Vitro. J. Fitomedika. 7(2):80-85(2010).
Muksin. R., Rosmini, Johanis. P. 2013. Uji Antagonisme Trichoderma Terhadap Jamur Patogen Altenaria porri Penyebab Penyakit Bercak Ungu pada Bawang Merah secara In-Vitro. E-J. Agro 1(2): 140-144.
Nasaruddin dan Deasy., M. 2009. Produksi Tanaman Karet Pada Pemberian Stimulan Etephon. Jurusan Budidaya Tanaman Faperta Unhas Jl. Perintis Kemerdekaan KM 10 Tamalanrea, Makassar. Jurnal Agrisistem, Desember 2009, Vol. 5 No. 2 ISSN 1858-4330 91.
Rao, S, NSS. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. dalam Sundari. A., K. Siti., L. Riza. 2014. Daya Antagonis Jamur Trichoderma sp. Terhadap Jamur Diplodia sp. Penyebab Busuk Batang Jeruk Siam (Citrus nobilis). J. Protobiont. 3(2): 106-110.
Ratnasari, J., D., Isnawati, Evie, R. Uji Antagonis Cendawan Agens Hayati terhadap Cendawan Cercospora musae Penyebab Penyakit Sigatoka secara In Vitro. Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan AlamUniversitas Negeri Surabaya. ISSN: 2252-3979 http://ejournal.unesa.ac.id/index.php/lenterabio. LenteraBio Vol. 3 No. 2, Mei 2014: 129–135.
Rayendra, M. Penyembuhan Mouldy Rot Oleh Trichoderma koningii Ditinjau Dari Anatomi Kulit Pada bidang Sadap. Fakultas Pertanian USU. Medan. Sarsito WGS, D Mutiawari, B Indriastuti, BS Wibowo, A Fensionita, YF
Ahadiati, dan R Bustam, 2008. Patogen serangga dan agens antagonis pada tanaman padi: Eksplorasi, identifikasi dan perbaikan missal. Jakarta: Direktorat Jenderal Tanaman Pangan Direktorat Perlindungan Tanaman Pangan.
Salma, S dan L. Gunarto. 1999. Enzim Selulase dari Trichoderma spp. BuletinAgriBio Vol. (2) No. 2. Balai Penelitian Bioteknologi Tanaman Pangan. Badan Penelitian dan Pengembangan Pertanian Bogor.
Semangun, H. 1996. Pengantar Ilmu Penyakit Tumbuhan. Gadjah Mada University Press. Yogyakarta.
24
Semangun, H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. Gadjah Mada University Press. Yogyakarta.
Sastrosupadi, A. 2000. Rancangan Percobaan Praktis Bidang Pertanian. Kanisius, Jakarta.
Shehata, Fawzy, S dan Borollosy, A. M. 2008. Induction of Resistance Against Zuccini Yellow Mosaic Potyvirus and Growth Enhancement of Squash Plants Using Some Plant Growth Promoting Rhizobacteria. Australian Journal of Basic and Applied Scienes 2:174-182.
Soesanto. L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Raja Grafindo Persada. Jakarta.
Srilakhsmi. PR., R. P. Thakur., K. Satya Prasad. V. P Rao. 2001. Identification of Trichoderma species and Their Antagonistic Potential Against Aspergillus flavus in Goundnut. International Arachis Newaletter 21: 40-43.
Sundari. A. J. Siti. K. Riza. L. 2014. Daya Antagonis Jamur Trichoderma sp. Terhadap Jamur Diploida sp. Penyebab Penyakit Busuk Batang Jeruk Siam (Citrus nobilis). J. Protobiont 3(2): 106-110.
Supeno, B. 1999. Uji Patogenitas jamur Trichoderma harzianum yang Digunakan sebagai Agen Pengendali Hayati. Prosiding Kongres Nasional XV dan Seminar Nasional PFI Purwokerto. Hlm 48-51.
Syafiuddin, 1990. Penyakit Bidang Sadap Pada Tanaman Karet. Pusat Penelitian Perkebunan Sungei Putih. P.2.
Trianto dan G. Sumantri. 2003. Pengembangan Trichoderma harzianum untuk pengendalian OPT Pangan dan Hortikultura. Makalah. Lab. PHPT Wilayah Semarang.
9
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Pusat Penelitian Karet Sungei Putih, dengan ketinggian tempat ±80 m dpl. Penelitian ini dilaksanakan pada bulan April sampai dengan Desember 2015.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah biakan murni Ceratocystis fimbriata, Trichoderma koningii dan Trichoderma harzianum,media
Potato Dextrose Agar (PDA), alcohol 70 %, chlorox 1 %, air, kapas, plastik
transparan, spiritus, methyl blue.
Alat yang digunakan dalam penelitian ini adalah cawan petri, inkubator, Erlenmeyer, autoclaf, beaker glass, lampu bunsen, jarum inokulasi, object glass, deck glass, pipet, bore gabus, talenan, , timbangan analitik, laminar air flow, bunsen, gunting, mikroskop, spidol, kamera digital.
Metode Penelitian
Metode yang digunakan dalam penelitian ini adalah metode Rancangan Acak Lengkap Non-faktorial.
P0 : Ceratocystis fimbriata
P1 : Ceratocystis fimbriata + Trichoderma koningii P2 : Ceratocystis fimbriata + Trichoderma harzianum Jumlah ulangan diperoleh dengan menggunakan rumus :
t(r-1) ≥ 15 3(r-1) ≥ 15 3r-3 ≥ 15
10
3r ≥ 18
r ≥ 6
Banyak ulangan = 8
Jumlah unit percobaan = 3 x 8 = 24 Model linier yang digunakan adalah :
Yij = μ + Ti + εij
Dimana :
Yij = Respon atau nilai pengamatan dari perlakuan ke-i dan ulangan ke-j μ = Nilai tengah umum
Ti = Pengaruh perlakuan ke-i
Σij = Pengaruh galat percobaan dari perlakuan ke-i dan ulangan ke-j
Terhadap sidik ragam yang nyata, dilanjutkan analisis lanjutan dengan Uji Jarak Duncan (Sastrosupadi, 2000).
Pelaksanaan Penelitian
Pembuatan Media Potato Dextrose Agar
11
Penyediaan Ceratocystis fimbriata
Sumber inokulum diambil dari tanaman karet yang terserang penyakit Mouldy rot yang disebabkan oleh jamur Ceratocystis fimbriata dengan cara
menggores jarum inokulum pada bagian bidang sadap yang terserang penyakit Mouldy rot dan kemudian mengoleskannya secara zig-zag pada media cawan petri
yang berisi media PDA dan diinkubasi pada suhu 25 0C selama 1 minggu (Ratnasari, dkk, 2014). Setelah Jamur tumbuh diisolasi kembali untuk mendapatkan biakan murni (Supeno, 1999).
Penyediaan JamurTrichoderma
Jamur Antagonis yang digunakan diperoleh dari Laboratorium Balai Pusat Penelitian Karet Sungei Putih. Jamur antagonis dibiakkan di dalam media PDA sesuai dengan jumlah biakan yang dibutuhkan.
Uji Antagonisme Jamur Trichoderma terhadap Ceratocystis fimbriata
Uji antagonisme mengacu pada metode dua biakan (dual culture method) (Benhamou dan Chet, 1993). Pada medium PDA dalam petridis dilakukan inokulasi pada dua titik yang berbeda baik dengan jamur Trichoderma koningii dan Trichoderma harzianum. Jamur antagonis diinokulasikan setelah patogen berumur 2 hari. Kemudian diinkubasikan selama 8 hari pada suhu kamar. Pengamatan dilakukan setiap dua hari setelah inokulasi (hsi). Pada hari terakhir pengamatan dilihat penghambatan pertumbuhan Ceratocystis fimbriata oleh mikroorganisme antagonis.
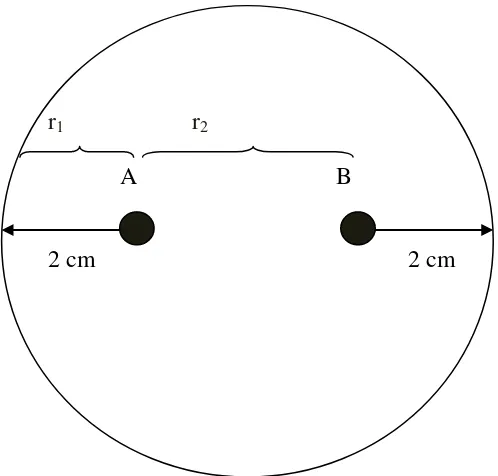
12
r1 r2
A B
2 cm 2 cm
Gambar 2. Uji antagonisme jamur Antagonis terhadap patogen
Keterangan:
A = Jamur Patogen
B = Jamur Antagonis
r1 = jari-jari koloni jamur patogenyang menjauhi jamur antagonis (cm)
r2 = jari-jari koloni jamur patogen yang mendekati jamur antagonis (cm)
Peubah Amatan Diameter Koloni
Dilakukan pengukuran diameter koloni patogen setiap 2 hari sampai 8 hsi
dengan cara mempolakan bentuk perkembangan koloni patogen pada cawan petri
menggunakan plastik transparan lalu digambar mengikuti pola perkembangan
koloni patogen tersebut. Kemudian diukur dengan menggunakan kertas
13
Luas Pertumbuhan
Pengukuran luas pertumbuhan koloni isolat patogen dilakukan dengan cara
menggambar pola pertumbuhan pada plastik transparan setiap 2 hari sampai 8 hsi
dan dihitung dengan menggunakan planimeter.
Daerah Hambatan (Inhibiting zone)
Pengamatan persentase daerah hambatan dilakukan setiap 2 hari sampai 8 hsi. Penghambatan pertumbuhan miselium jamur Ceratocystis fimbriata oleh jamur antagonis dihitung berdasarkan rumus yaitu:
��= �1− �2
�1 � 100 %
Keterangan :
IZ = persentase daerah hambatan (%)
r1 = jari-jari koloni jamur patogen yang menjauhi jamur antagonis (cm) r2 = jari-jari koloni jamur patogen yang mendekati jamur antagonis(cm)
(Muksin et al., 2013)
14
HASIL DAN PEMBAHASAN Diameter Koloni
Analisis sidik ragam menunjukkan bahwa perlakuan jenis Trichoderma berpengaruh sangat nyata terhadap diameter koloni. Hal ini dapat dilihat pada Tabel 1 dan Lampiran 3-5.
Tabel 1. Diameter jamur Ceratocystis fimbriata yang diaplikasikan bersama jamur antagonis di laboratorium (cm)
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji jarak duncan pada taraf 5%. P0: Ceratocystis fimbriata, P1: Ceratocystis fimbriata + Trichoderma koningii, P2: Ceratocystis fimbriata + Trichoderma harzianum
Tabel menunjukkan bahwa diameter koloni jamur pada pengamatan 6 Hsi dan 8 Hsi perlakuan tunggal yaitu P0 berbeda nyata dengan perlakuan kombinasi yaitu P1 dan P2. Hal ini dikarenakan pada perlakuan P0 tidak ada faktor yang menghambat pertumbuhan Ceratocystis fimbriata sedangkan pada perlakuan kombinasi pertumbuhan Ceratocystis fimbriata terhambat oleh jamur antagonis Trichoderma koningii dan Trichoderma harzianum. Sebab Jamur Trichoderma
mempunyai lebih dari satu cara untuk menghambat pertumbuhan patogen. Hal ini sesuai dengan literatur Soesanto (2008) yang menyatakan bahwa mekanisme penghambatan setiap mikroba antagonis adalah dapat berupa parasitisme langsung, persaingan nutrisi atau antibiosis dan persaingan ruang hidup.
Berdasarkan pengamatan diketahui bahwa jamur antagonis lebih cepat pertumbuhannya dibandingkan dengan Ceratocystis fimbriata dilihat dari
Perlakuan Pengamatan -
4Hsi 6 Hsi 8Hsi
P0 3,78 5,59a 6,95a
P1 3,94 4,80b 4,83b
15
rendahnya diameter Ceratocystis fimbriata pada P1 dan P2. Hal ini berarti jamur antagonis dapat menekan pertumbuhan patogen sesuai dengan pernyataan Amin, et al., (2011) yang menyatakan bahwa jamur yang tumbuh cepat mampu
mengungguli dalam penguasaan ruang dan pada akhirnya dapat menekan pertumbuhan jamur lawannya.
Berdasarkan pengamatan diketahui bahwa diameter koloni patogen pada perlakuan P1 4,83 cm tidak berbeda nyata dengan P2 4,71 cm. Hal ini dikarenakan jamur Trichoderma koningii dan Trichoderma harzianum sama-samabersifat antagonis terhadap jamur Ceratocystis fimbriata. Hal ini sesuai dengan literatur Hartal et al., (2010) yang menyatakan bahwa jamur Trichoderma sp. menekan pertumbuhan patogen dengan berkompetisi terhadap ruang tumbuh dan nutrisi. Dan menurut Salma dan Gunarto (1999) Trichoderma spp mempunyai kemampuan menghasilkan enzim selulase sehingga dapat merusak dinding sel patogen.
16
Luas Pertumbuhan Koloni
Analisis sidik ragam menunjukkan bahwa perlakuan Jenis Trichoderma sp. berpengaruh sangat nyata terhadap luas pertumbuhan koloni. Hal ini dapat dilihat pada Tabel 2 dan Lampiran 6-8.
Tabel 2. Luas pertumbuhan Ceratocystis fimbriata yang diaplikasikan bersama jamur antagonis di laboratorium (cm2)
Perlakuan Pengamatan -
4Hsi 6 Hsi 8Hsi
P0 11,60 21,38a 29,48a
P1 10,93 15,13b 15,29b
P2 10,08 13,51b 15,16b
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji jarak duncan pada taraf 5%.
P0: Ceratocystis fimbriata, P1: Ceratocystis fimbriata +
Trichoderma koningii, P2: Ceratocystis fimbriata + Trichoderma harzianum
Analisis sidik ragam menunjukkan bahwa pada pengamatan 6 Hsi dan 8 Hsi perlakuan P0 berbeda nyata dengan perlakuan P1 dan P2. Hal ini dikarenakan pada perlakuan P1 tidak ada faktor yang menghambat pertumbuhan Ceratocystis fimbriata sedangkan pada perlakuan kombinasi pertumbuhan Ceratocystis fimbriata terhambat oleh jamur antagonis sehingga luas pertumbuhannya rendah.
Hal ini sesuai dengan literatur Mukarlina et al., (2010) yang menyatakan bahwa di dalam media uji antagonis terjadi persaingan ruang tumbuh dan nutrisi yang disebabkan adanya kebutuhan cendawan-cendawan tersebut akan nutrisi yang terkandung di dalam media tersebut yaitu berupa karbohidrat, protein, asam aminno esensial dan elemen-elemen mikro.
17
memarasit dan menghasilkan pengaruh penghambatan. Hal ini sesuai dengan literatur Hartal et al., (2010) yang menyatakan bahwa Trichoderma mempunyai kemampuan menghasilkan toksin dalam menekan pertumbuhan patogen,
Berdasarkan pengamatan diketahui bahwa luas pertumbuhan koloni patogen pada perlakuan P1 15,29 cm tidak berbeda nyata dengan P2 15,16 cm. Hal ini dikarenakan jamur Trichoderma koningii dan Trichoderma harzianumsama-samabersifat antagonis terhadap jamur Ceratocystis fimbriata.
Hal ini sesuai dengan literatur Soesanto (2008) yang menyatakan bahwa Trichoderma sp menghambat pertumbuhan patogen dengan mekanisme antibiosis,
mikroparasitisme dan persaingan ruang hidup.
Daerah Hambatan (Inhibiting Zone)
[image:30.595.114.509.510.665.2]Analisis sidik ragam menunjukkan bahwa perlakuan uji antagonisme berpengaruh sangat nyata terhadap daerah hambatan. Hal ini dapat dilihat pada Tabel 3 dan Lampiran 6-9.
Tabel 3. Inhibiting Zone Ceratocystis fimbriata yang diaplikasikan bersama jamur antagonis di laboratorium (%)
Perlakuan Pengamatan -
4Hsi 6 Hsi 8Hsi
P0 0,00b 0,00b 0,00b
P1 8,92a 19,69a 19,69a
P2 11,42a 21.82 a 21,82a
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji jarak duncan pada taraf 5%. P0: Ceratocystis fimbriata, P1: Ceratocystis fimbriata + Trichoderma koningii, P2: Ceratocystis fimbriata + Trichoderma harzianum
Analisis sidik ragam menunjukkan bahwa persentase daerah hambatan pada perlakuan P1 tidak berbeda nyata terhadap perlakuan P2. Persentase hambatan yang lebih tinggi adalah 21,82% yaitu pada jamur Trichoderma harzianum dan yang lebih rendah adalah 19,69% yaitu jamur
18
Trichodermakoningii. Hal ini menunjukkan bahwa kedua jamur antagonis tersebut
dapat mengendalikan pertumbuhan patogen. Hal ini sesuai dengan literatur Purwantisari dan Rini (2009) yang menyatakan bahwa menkanisme yang terjadi pada uji antagonisme adalah antibiosis dan hiperparasit yang dapat diamati dengan terbentuknya zona bening sebagai zona penghambatan pertumbuhan bagi patogen.
Data pengamatan menunjukkan bahwa P0 berbeda nyata dengan P1 dan P2. Hal ini disebabkan bahwa pada perlakuan P0 tidak terdapat daerah hambatan karena tidak ada jamur antagonis yang menghambat pertumbuhan jamur Ceratocystis fimbriata. Hal ini sesuai dengan literatur Hartal et al., (2010) yang
menyatakan bahwa Trichoderma koningii dan Trichoderma harzianum memiliki tiga kemampuan untuk menghambat pertumbuhan dan perkembangan patogen yaitu dengan adanya antibiosis dan lisis, kompetisi ruang tumbuh dan nutrisi serta hiperparasit.
19
diduga karena jumlah antibiotik atau alkaloid yang dihasilkan oleh masing-masing jamur endofit berbeda.
Berdasarkan pengamatan diketahui bahwa persentase daya hambatan P2 lebih tinggi daripada P1 yang menyatakan bahwa persentase daya hambat Trichoderma harzianum lebih tinggi dibandingkan Trichoderma koningii. Hal ini
dikarenakan pertumbuhan Trichoderma harzianum lebih cepat sehingga mampu menghambat Ceratocystis fimbriata lebih cepat. Hal ini sesuai dengan literatur Nurzannah (2014) yang mengatakan bahwa setiap agen antagonis memiliki kecepatan pertumbuhan yang berbeda-beda.
20
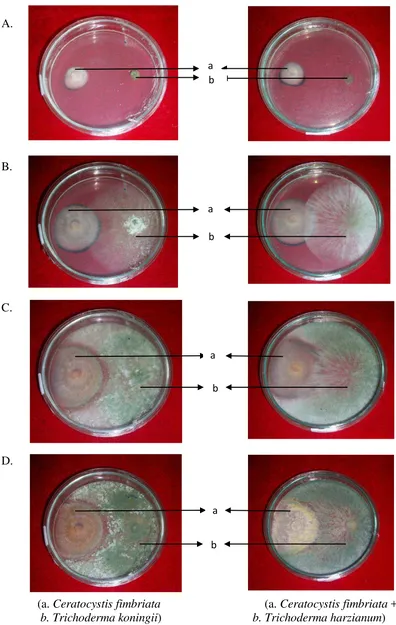
A.
B.
C.
D.
[image:33.595.112.508.69.694.2](a. Ceratocystis fimbriata (a. Ceratocystis fimbriata + b. Trichoderma koningii) b. Trichoderma harzianum)
Gambar 3. Pengujian Inhibiting Zone pada pengamatan 2 Hsi (A), 4 Hsi (B), 6 Hsi (C), 8 Hsi (D).
a
a
a
a b
b
b
21
KESIMPULAN DAN SARAN Kesimpulan
1. Pemberian jamur Trichoderma koningii dan Trichoderma harzianum dapat menekan diameter dan luas pertumbuhan jamur Ceratocystis fimbriata.
2. Jamur Trichoderma koningii dan Trichoderma harzianum berpengaruh sangat nyata terhadap daerah hambatan.
Saran
Perlu dilakukan penelitian lanjutan tentang penggunaan jamur Trichoderma koningii dan Trichoderma harzianum untuk mengendalikan
Ceratocystis fimbriata di lapangan.
4
TINJAUAN PUSTAKA Biologi Ceratocystis fimbriata.
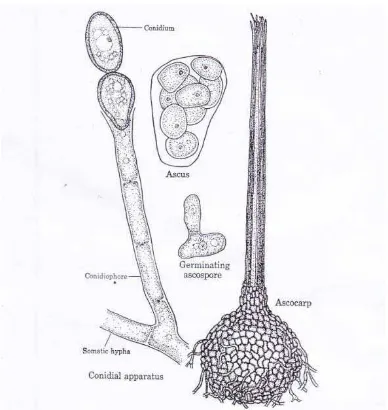
Menurut Alexopoulus dan Mims (1979), jamur Ceratocystis fimbriata dapat diklasifikasikan sebagai berikut, Kingdom : Myceteae, Divisi : Amastigomycota, Sub Divisi : Ascomycotina, Kelas : Ascomycetes, Ordo : Microascales, Famili : Ophiostomataceae, Genus : Ceratocystis, Spesies : Ceratocystis fimbriata.
[image:35.595.214.408.389.594.2]Jamur Ceratocystis fimbriata mempunyai hifa berwarna abu - abu keputihan. Ceratocystisfimbriata menyebabkan busuk mengapang (Mouldy rot) pada bidang sadapan karet. Penyadapan karet dapat menularkan busuk mengapang (Semangun, 1996 ).
Gambar 1 : Bagian- bagian jamur Ceratocystis fimbriata Sumber : Alexopoulus dan Mims (1979)
5
Jamur Ceratocystisfimbriata mempuyai peritesium kecil, berleher panjang, Dalam peritesium terdapat banyak askus berbentuk bulat telur atau bulat, mengandung 8 askospora bulat atau bulat telur, tidak berwarna. Askospora berukuran 4,5 - 8,7 x 3,5 - 4,7 µm. Hifa yang tumbuh dari askospora membentuk dua macam spora lain, yaitu konidium dan klamidiospora. Konidium tidak berwarna, ukurannya sangat variabel, rata-ratanya 20,8 x 5,3 µm. Klamidiospora bulat atau jorong, berwarna cokelat tua, sering pangkalnya agak menonjol, dengan ukuran 15,9 x 13,1 µm. (Semangun, 2000).
Gejala serangan
[image:36.595.220.430.528.686.2]Mula-mula pada kulit pulihan dekat dengan irisan sadapan terdapat bercak-bercak mengendap. Warna bercak cepat berubah menjadi hitam dan meluas, sehingga terjadi jalur hitam yang sejajar dengan irisan sadapan. Penyakit merusak bidang sadapan, sehingga pemulihan kulit terganggu dan menyulitkan penyadapan. Mouldy rot yang berat apabila tidak dirawat akan mengakibatkan luka-luka besar, sehingga bidang sadapan rusak sama sekali dan tidak mungkin disadap lagi (Semangun, 1996 ).
Gambar 2 : Gejala Serangan Ceratocystis fimbriata Sumber : Foto Lapangan
6
Secara anatomi jamur Ceratocystis fimbriata mempenetrasi jaringan kulit,
memadati vakuola-vakuola sel. Jamur menghasilkan haustoria yang berfungsi
menghisap cairan/isi sel menyebabkan sel menjadi kering dan mati. Sel-sel
terserang terlihat menjadi rusak dan merenggang (Rayendra, 1994).
Faktor yang mempengaruhi Penyakit Mouldy rot
Spora dan konidia jamur Ceratocystis fimbriata yang menyebabkan penyakit Mouldy rotdiproduksipada cuacalembab yang kemudian disebarkan
olehhujan, tetapi kebanyakanpenyebaran penyakit ini terletak pada penyadapan yang dilakukan oleh manusia. Penyebaran spora dapat juga melalui vektor yaitu kumbang (Westcott, 1971).
Suhu berpengaruh terhadap perkembangan daur hidup penyakit Mouldy rot. Suhu yang dingin akan mempercepat daur hidup patogen. Kelembaban juga
mempengaruhi tahap awal dan perkembangan penyakit tumbuhan. Kelembaban berpengaruh terhadap pembentukan dan lama bertahan hidup spora jamur dan penetrasi inang oleh tabung kecambah. Angin mempengaruhi pertumbuhan patogen dalam penyebarannya (Agrios, 1996).
Pengendalian
Untuk mencegah timbulnya penyakit diusahakan agar kebun tidak mempunyai kelembaban yang tinggi dengan memakai jarak tanam yang cukup lebar. Tidak menanam tanaman sela, dan membersihkan gulma dan tanaman penutup tanah di sekitar pangkal batang. Pisau sadap didesinfeksi dengan fungisida misalnya Izal 5% setelah selesai penyadapan (Semangun, 2000).
Aplikasi fungisida dapat dilakukan untuk mengendalikan penyakit Mouldy
7
Mouldy rot, yaitu : triadimefon 50-100%, sikloheksimid 0,3 %, karbendazim 0,5
5, prokloraz 0,4% (Semangun, 1996).
Mouldy rot menyerang kulit lunak yang telah disadap, maka beberapa
usaha untuk pencegahan penyakit Mouldy rot yang berkaitan dengan penyadapan adalah sebagai berikut :
- Khusus untuk daerah rawan Mouldy rot, penyadapan tidak terlalu dalam dan frekuensi sadap dapat diturunkan, agar pemulihan kulit berlangsung lebih cepat.
- Untuk menghindari penularan penyakit dari areal sakit ke areal sehat, penyadap yang menyadap pada areal sakit tidak diperkenankan menyadap ke areal sehat.
- Bila serangan penyakit telah mulai timbul, pisau sadap perlu dicelupkan dalam larutan fungisida atau formalin 2% setelah selesai penyadapan, agar penularan dapat dicegah (Syafiuddin, 1986 dalam Rayendra, 1994).
Jamur Trichoderma
Trichoderma sp. memiliki tiga kemampuan untuk menghambat pertumbuhan dan perkembangan patogen, yaitu dengan adanya (1) antibiosis dan lisis (2) kompetisi ruang tumbuh dan nutrisi serta (3) hiperparasit dengan kemampuan menghasilkan toksin. Cendawan antagonis tersebut merupakan kompetitor yang baik bagi cendawan patogen (Hartal et al., 2010).
Menurut Salma dan Gunarto (1999) Trichoderma sp.mempunyai kemampuan menghasilkan enzim selulase sehingga dapat merusak dinding sel kapang patogen pada kelompok jamur. Trichoderma sp. mengalami pertumbuhan yang agresif (Gholib dan Kusumaningtias, 2006). Selain itu kapang tanah
8
Trichoderma sp.mempunyai kemampuan melakukan pelilitan dan penetrasi hifa pathogen (Dennis & Webster, 1971 dalam Salma dan Gunarto, 1999). Mekanisme antibiosis tergantung dari jenis dan sifat tanah sebagai substrat tumbuhnya (Djafarudin, 2000).
Trichoderma merupakan jamur yang mengalami pertumbuhan dengan cepat mencapai diameter pertumbuhan 9 cm dalam waktu 5 hari. Hal ini dikarenakan pertumbuhan miselium jamur Trichoderma pada hari ke-3 dapat memproduksi berjuta-juta spora. Pada penelitian uji antagonisme, miselium jamur Trichoderma menuju ke arah patogen. Hal ini disebut dengan mekanisme mikroparasitisme, dengan terbentuknya cabang-cabang hifa jamur Trichoderma yang tumbuh menuju arah patogen hampir memenuhi cawan petri sehingga menutupi koloni jamur patogen (Sundari et al., 2014).
Di dalam media uji antagonis terjadi persaingan antar cendawan yang disebabkan adanya kebutuhan cendawan-cendawan akan nutrisi yang terkandung di dalam media untuk keberlangsungan hidupnya yaitu berupa karbohidrat,
PENDAHULUAN Latar Belakang
Karet merupakan salah satu komoditas perkebunan di Indonesia. Komoditas ini dibudidayakan relatif lebih lama daripada komoditas perkebunan lainnya. Tanaman ini diintroduksi pada tahun 1864. Dalam kurun waktu sekitar 150 tahun sejak dikembangkan pertama kalinya, luas areal perkebunan karet di Indonesia telah mencapai 3.262.291 ha (Heru dan Andoko, 2008).
Perbandingan luas areal perkebunan karet menurut status pengusahaan adalah Perkebunan Rakyat 85,10%, Perkebunan Besar Swasta 7,95%, Perkebunan Besar Negara 6,95%. Pada tahun 2013 volume ekspor 2.701.995 ton dengan nilai US$ 6.906.952 dan volume impor 24.527 ton dengan nilai US$ 52.045 (Direktorat Jenderal Perkebunan, 2014).
Pengembangan perkebunan karet memberikan peranan penting bagi perekonomian nasional, yaitu sebagai sumber devisa negara, sumber bahan baku industri, sumber pendapatan dan kesejahteraan masyarakat serta sebagai pengembangan pusat-pusat pertumbuhan perekonomian di daerah dan sekaligus berperan dalam pelestarian fungsi lingkungan hidup (Budiman, 2012).
Produksi lateks tanaman karet disamping ditentukan oleh keadaan tanah, pertumbuhan tanaman dan klon unggul, juga dipengaruhi oleh teknik dan manajemen penyadapan. Selama ini usaha peningkatan produksi lateks dilaksanakan melalui berbagai usaha, antara lain melaksanakan teknis budidaya yang baik seperti menanam klon unggul, pemupukan dengan dosis yang tepat dan
teratur serta sistem penanaman dan pemeliharaan yang baik (Nasaruddin dan Deasy, 2009).
2
Pengendalian secara hayati merupakan pengendalian suatu penyakit dengan menggunakan makhluk hidup yang bukan atau selain dari tanaman inang atau patogen yang menyebabkan penyakit tersebut. Tujuan pengendalian hayati adalah untuk mengurangi jumlah inokulum patogen, menekan kemampuan
patogen menginfeksi inangnya dan mengurangi keganasan patogen tersebut (Djafaruddin, 2008).
Pengendalian hayati dengan menggunakan mikroorganisme merupakan pendekatan alternatif yang perlu dikaji dan dikembangkan, sebab relatif aman serta bersifat ramah lingkungan. Telah banyak dilaporkan beberapa mikroorganisme antagonis memiliki daya antagonisme yang tinggi terhadap patogen tanaman dan dapat menekan perkembangan patogen tular tanah (soil borne pathogen). Mekanisme antagonis yang dilakukan adalah berupa persaingan
hidup, parasitisme, antibiosis dan lisis (Trianto dan Sumantri, 2003).
Trichoderma sp. merupakan agen antagonis yang banyak digunakan untuk
mencegah perkembangan beberapa patogen tanah. Migheli (1994) melaporkan penggunaan Trichoderma sp. secara tunggal atau bersama-sama dengan spesies Trichoderma sp. lain telah digunakan dalam mengendalikan beberapa penyakit.
Tujuan Penelitian
hPenelitian ini bertujuan untuk mengetahui daya antagonisme jamur Trichoderma koningii dan Trichoderma harzianumterhadap Ceratocystis
fimbriatadi Laboratorium.
Hipotesis Penelitian
Trichoderma koningii dan Trichoderma harzianumdapat menghambat
3
Kegunaan Penelitian
- Sebagai salah satu syarat untuk memperoleh gelar sarjana di program studi Agroekoteknologi Fakultas Pertanian, Universitas Sumatera Utara, Medan. - Memberikan informasi mengenai kemampuan jamur Trichoderma koningii
dan Trichoderma harzianum sebagai agen antagonis untuk menghambat pertumbuhan jamur Ceratocystis fimbriata.
ABSTRAK
Harif Nepen Marbun. 2016. “Uji Antagonisme Trichoderma koningii dan Trichoderma harzianum Terhadap Penyakit Bidang Sadap Tanaman Karet Mouldy rot (Ceratocystis fimbriata) di Laboratorium”,dibimbing oleh Hasanuddin dan Fatimah Zahara. Penelitian ini bertujuan untuk menguji daya antagonisme jamur Trichoderma koningii dan Trichoderma harzianum terhadap Ceratocystis fimbriatadi Laboratorium. Penelitian ini dilaksanakan di Balai Pusat Penelitian Karet Sungei Putih mulai bulan April sampai Desember 2015. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Non Faktorial dengan tiga perlakuan dan delapan ulangan. Hasil penelitian menunjukkan bahwa jamur Trichoderma koningii dan Trichoderma harzianum berpotensi sebagai agen hayati untuk mengendalikan jamur Ceratocystis fimbriata. Hasil yang diperoleh untuk mengendalikan Ceratocystis fimbriata pada daerah hambatan adalah Trichoderma koningii 19,69% dan Trichoderma harzianum21,82%.
ii
ABSTRACT
Harif Nepen Marbun. 2016. “Antagonism Test of Trichoderma koningii andTrichoderma harzianumAgainst Disease of Tapping Panels of Rubber Mouldy rot (Ceratocystis fimbriata) in Laboratory”,supervised by Hasanuddin and Fatimah Zahara. The objective of the research wasto test antagonism ability of Trichoderma koningii andTrichoderma harzianumto control Ceratocystis fimbriatain laboratory. The research was conducted at Laboratory of Research Agency of Rubber, Sungei Putih from April to December 2015. It was done by using Completely Randomized Design (CRD) non factorial with three treatments and eight replications. The results showed Trichoderma koningii andTrichoderma harzianumpotential as biological agents to control Ceratocystis fimbriata in vitro. The results to control Ceratocystis fimbriata is Trichoderma koningii 19,69% and Trichoderma harzianum21,82%.
Keywords: Ceratocystis fimbriata, Mouldy rot , Rubber, Trichoderma harzianum, Trichoderma koningii.
UJI ANTAGONISME JAMUR Trichoderma koningii DAN Trichoderma
harzianum TERHADAP PENYAKIT BIDANG SADAPMOULDY
ROTTANAMAN KARET(Ceratocystis fimbriata) DI LABORATORIUM
SKRIPSI
OLEH:
HARIF NEPEN MARBUN
100301143 / HAMA PENYAKIT TUMBUHAN
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
UJI ANTAGONISME JAMUR Trichoderma koningii DAN Trichoderma
harzianum TERHADAP PENYAKIT BIDANG SADAPMOULDY
ROTTANAMAN KARET (Ceratocystis fimbriata) DI LABORATORIUM
SKRIPSI
OLEH:
HARIF NEPEN MARBUN
100301143 / HAMA PENYAKIT TUMBUHAN
Skripsi Sebagai Salah Satu Syarat untuk Dapat Memperoleh Gelar Sarjana Pertanian di Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara, Medan.
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
2016
Judul : Uji Antagonisme JamurTrichoderma koningiidan Trichoderma harzianumTerhadap Penyakit Bidang
Sadap Tanaman KaretMouldy rot (Ceratocystis fimbriata) Di Laboratorium
Nama : Harif Nepen Marbun
Nim : 100301143
Program Studi` : Agroekoteknologi
Minat : Hama dan Penyakit Tumbuhan
Disetujui Oleh : Komisi Pembimbing
(Dr. Ir. Hasanuddin, MS )(Ir. Fatimah Zahara) Ketua Anggota
Mengetahui
Prof. Dr. Ir. T. Sabrina, MSc
i ABSTRAK
Harif Nepen Marbun. 2016. “Uji Antagonisme Trichoderma koningii dan Trichoderma harzianum Terhadap Penyakit Bidang Sadap Tanaman Karet Mouldy rot (Ceratocystis fimbriata) di Laboratorium”,dibimbing oleh Hasanuddin dan Fatimah Zahara. Penelitian ini bertujuan untuk menguji daya antagonisme jamur Trichoderma koningii dan Trichoderma harzianum terhadap Ceratocystis fimbriatadi Laboratorium. Penelitian ini dilaksanakan di Balai Pusat Penelitian Karet Sungei Putih mulai bulan April sampai Desember 2015. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Non Faktorial dengan tiga perlakuan dan delapan ulangan. Hasil penelitian menunjukkan bahwa jamur Trichoderma koningii dan Trichoderma harzianum berpotensi sebagai agen hayati untuk mengendalikan jamur Ceratocystis fimbriata. Hasil yang diperoleh untuk mengendalikan Ceratocystis fimbriata pada daerah hambatan adalah Trichoderma koningii 19,69% dan Trichoderma harzianum21,82%.
Kata kunci: Ceratocystis fimbriata, Karet, Trichoderma harzianum, Trichoderma koningii.
ABSTRACT
Harif Nepen Marbun. 2016. “Antagonism Test of Trichoderma koningii andTrichoderma harzianumAgainst Disease of Tapping Panels of Rubber Mouldy rot (Ceratocystis fimbriata) in Laboratory”,supervised by Hasanuddin and Fatimah Zahara. The objective of the research wasto test antagonism ability of Trichoderma koningii andTrichoderma harzianumto control Ceratocystis fimbriatain laboratory. The research was conducted at Laboratory of Research Agency of Rubber, Sungei Putih from April to December 2015. It was done by using Completely Randomized Design (CRD) non factorial with three treatments and eight replications. The results showed Trichoderma koningii andTrichoderma harzianumpotential as biological agents to control Ceratocystis fimbriata in vitro. The results to control Ceratocystis fimbriata is Trichoderma koningii 19,69% and Trichoderma harzianum21,82%.
iii
RIWAYAT HIDUP
Harif Nepen Marbun, lahir pada tanggal 06 Januari 1992 di Barus, Sumatera Utara yang merupakan anak pertama dari empat bersaudara, putra dari Bapak Alm. Jamian Marbun dan Ibu Masni Br. Tarihoran.
Tahun 2010 penulis lulus dari SMA Negeri 1 Sibolga dan pada tahun yang sama masuk di Fakultas Pertanian Universitas Sumatera Utara, melalui jalur SNMPTN. Penulis memilih minat Hama dan Penyakit Tumbuhan, Program Studi Agroekoteknologi. Selama perkuliahan penulis mendapatkan beasiswa Karya Salemba Empat (KSE).
Selama mengikuti perkuliahan, penulis adalah anggota HIMAGROTEK (Himpunan Mahasiswa agroekoteknologi) USU. Selain itu Penulis juga aktif dalam organisasi ekstrauniversitas sebagai Koordinasi di Unit Kegiatan Mahasiswa Kebaktian Mahasiswa Kristen Unit Pelayanan Fakultas Pertanian (UKM KMK UP FP USU). Penulis melaksanakan Praktek Kerja Lapangan (PKL) di PT. Perkebunan Nusantara IV (Persero) Unit Usaha Tanah Itam Ulu di Kabupaten Batu Bara Provinsi Sumatera Utara tahun 2013. Penulis melaksanakan penelitian di Balai Penelitian Karet Sei Putih pada tahun 2015.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa karena atas berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi ini.
Adapun judul dari skripsi ini adalah “Uji Antagonisme Jamur Trichoderma koningii dan Trichoderma harzianum Terhadap Penyakit Bidang
Sadap Mouldy rot Tanaman Karet (Ceratocystis fimbriata) Di Laboratorium” yang merupakan salah satu syarat untuk dapat memperoleh gelar sarjana pada Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara.
Penulis mengucapkan terimakasih kepada komisi pembimbing Dr. Hasanuddin selaku Ketua dan Fatimah Zahara, SP selaku Anggota serta
kepada Cici Dalimunthe, SP selaku pembimbing Laboratorium yang membimbing dan memberikan saran dan kritik serta berbagai masukan berharga kepada penulis mulai dari menetapkan judul hingga penyelesaian skripsi ini.
Penulis menyadari bahwa skripsi ini jauh dari kesempurnaan, untuk itu penulis mengharapkan kritik dan saran yang bersifat membangun demi perbaikan skripsi ini di masa yang akan datang. Akhir kata penulis mengucapkan terimakasih dan semoga skripsi ini bermanfaat bagi kita semua.
Medan, Maret 2016
v DAFTAR ISI
Hlm.
ABSTRAK ... i
ABSTRACT ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN Latar belakang ... 1
Tujuan penelitian ... 3
Hipotesa penelitian ... 3
Kegunaan penelitian ... 3
TINJAUAN PUSTAKA Biologi penyakit ... 4
Gejala serangan ... 5
Faktor yang mempengaruhi penyakit ... 6
Pengendalian ... 6
Jamur Trichoderma ... 7
BAHAN DAN METODE Tempat dan waktu penelitian ... 9
Bahan dan alat ... 9
Metode penelitian ... 9
Pelaksanaan penelitian ... 10
Pembuatan Media Potato Dextrose Agar ... 10
Penyediaan Ceratocystis fimbriata... 11
Penyediaan Jamur Trichoderma ... 11
Uji Antagonisme Trichoderma terhadap Ceratocystis fimbriata ... 11
Peubah amatan ... 12
Diameter koloni ... 12
Luas pertumbuhan koloni ... 13
Daerah hambatan (Inhibiting zone) ... 13
HASIL DAN PEMBAHASAN
Diameter koloni ... 16 Luas pertumbuhan Koloni ... 18 Daerah hambatan (Inhibiting Zone) ... 19
KESIMPULAN DAN SARAN
Kesimpulan ... 23 Saran ... 23
vii
DAFTAR TABEL
No. Hlm.
1. Diameter jamur Ceratocystis fimbriata yang diaplikasikan bersama jamur antagonis di Laboratorium (cm) ... 16 2. Inhibiting ZoneCeratocystis fimbriatayang diaplikasikan bersama jamur
antagonisdi laboratorium (%) ... 18 3. Luas pertumbuhanCeratocystis fimbriata yang diaplikasikan bersama
jamur antagonis di laboratorium (cm2) ... 19
DAFTAR GAMBAR
No. Hlm.
1. Bagian-bagian Ceratocystis fimbriata ... 4
2. Gejala Serangan Ceratocystis fimbriata ... 6
3. Uji antagonisme jamur Antagonis terhadap patogen ... 14
ix
DAFTAR LAMPIRAN
No. Hlm.
1. Bagan Penelitian ... 27
2. Gambar Bahan Penelitian ... 28
3. Data pengamatan diameter koloni 4 hsi... 29
4. Data pengamatan diameter koloni 6 hsi... 30
5. Data pengamatan diameter koloni 8 hsi... 32
6. Data pengamatan luas daerah hambatan 4 hsi ... 34
7. Data pengamatan luas daerah hambatan 6 hsi ... 35
8. Data pengamatan luas daerah hambatan 8 hsi ... 37
9. Data pengamatan daerah hambatan 4 hsi ... 39
10. Data pengamatan daerah hambatan 6 hsi ... 41
11. Data pengamatan daerah hambatan 8 hsi ... 43