Muhamad Iqbal Tafwid
Fakultas Kedokteran Universitas Lampung
Abstrak
Indonesia memiliki berbagai macam sumber daya alam yang berpotensi salah satunya adalah propolis. Propolis digunakan masyarakat luas untuk mengobati berbagai macam penyakit. Manfaatnya sebagai antioksidan. Etanol dapat menghasilkan radikal bebas jika dikonsumsi dan akan menggangu fungsi hati maupun ginjal. Senyawa flavonoid dan caffeic acid phenetyl ester (CAPE)
yang terkandung dalam propolis mampu mengurangi dampak akibat radikal bebas. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian propolis terhadap gambaran histopatologis ginjal tikus putih jantan dewasa (R Novergicus)
yang diinduksi etanol 50%. Penelitian eksperimental ini menggunakan metode rancangan acak terkontrol terhadap 25 ekor tikus yang dibagi menjadi lima kelompok, kontrol (K1), etanol 50% 0,01 ml/grBB (K2), etanol 50% 0,01 ml/grBB + propolis 0,00009 ml/grBB (K3), etanol 50% 0,01 ml/grBB + propolis 0,00026 ml/grBB (K4), etanol 50% 0,01 ml/grBB + propolis 0,00078 ml/grBB (K5) satu kali sehari, diberikan per oral terlebih dahulu propolis 2 jam sebelum pemberian etanol 50%. Pemeriksaan histopatologi, menunjukan etanol 50% mengalami perubahan terhadap gambaran histopatologis ginjal pada kelompok 2. Sedangkan pada kelompok 3, 4, 5 menunjukan perbaikan gambaran histopatologi bermakna pada uji Mann-Whitney (p<0,05). Perbaikan terlihat jelas pada kelompok 5. Dari penelitian ini disimpulkan bahwa terdapat pengaruh propolis terhadap perubahan gambaran histopatologis ginjal tikus yang diinduksi etanol 50%.
Muhamad Iqbal Tafwid
Medical Faculty of Lampung University
Abstract
Indonesia have a miscellaneous of potential natural resources, for exampales propolis,. propolis used by public to treated various diseases. Propolis has benefits as an antioxidant. Ethanol produced free radicals and would interfere with the function to the liver and renal. Flavonoids and caffeic acid phenetyl ester
(CAPE) contained in propolis were considered to reduce the effect of histopathological features on renal caused by free radicals. This study purposed to determine the effect of propolis on renal histopathological features on adult male white rats renal induced by 50% ethanol. This experimental research using a randomized controlled design to 25 rats were divided into five groups, group 1: control, group 2: 50% ethanol 0.01 ml / grBB, group 2: 50% ethanol 0.01 ml / grBB + propolis 0.00009 ml / grBB, group 3: 50% ethanol 0.01 ml / grBB + propolis 0.00026 ml / grBB, group 4: 50% ethanol 0.01 ml / grBB + propolis 0.00078 ml / grBB, given orally propolis first 2 hours before administration of 50% ethanol. The examinations showed results that 50% ethanol causes the changes of histopathological features in group 2. Group 3, 4, 5 showed a significant improvement in the histopathological features of the Mann-Whitney test (p <0.05). Improvement was evident in group 5. This study can be concluded that there was the effect of propolis on renal histopathological features on adult male white rats renal induced 50% ethanol.
A. Latar Belakang
Indonesia merupakan negara yang terkenal dengan kekayaan sumber daya
alamnya. Hal ini didukung oleh keadaan geografis Indonesia yang
beriklim tropis dengan curah hujan rata-rata tinggi sepanjang tahun. Hal
ini menjadi potensi untuk dikembangkannya sumber daya alam tersebut.
Beberapa tahun terakhir ini, terjadi suatu fenomena penggunaan propolis
yang berasal dari sarang lebah sebagai obat untuk menyembuhkan
berbagai macam penyakit. Menurut Winingsih, (2004). Dalam penelitian
Rika Yana, disebutkan bahwa propolis merupakan sejenis resin yang
dihasilkan oleh lebah. Pembentukan resin dilakukan dengan cara
mengumpulkan resin-resin dari berbagai macam tumbuhan, kemudian
resin ini bercampur dengan saliva dan berbagai enzim yang ada pada liur
lebah sehingga menjadikan resin tersebut berbeda dengan resin asalnya.
Bagi lebah, propolis berfungsi untuk melindungi seluruh sarang dan
tempat lebah ratu menyimpan telurnya sehingga telur terlindungi dari
hama seperti hama Bacilus larvae yang akan menyebabkan kebusukan
Penggunaan propolis sebagai obat sebenarnya sudah dilakukan sejak abad
XII. Orang-orang Yunani dan Romawi telah menggunakan propolis
sebagai obat untuk bengkak. Bagi orang Mesir kuno selain menggunakan
propolis sebagai obat juga digunakan sebagai perekat pada pembuatan
kano (Winigsih 2004).
Propolis mengandung sejumlah zat aktif seperti CAPE (caffeic acid
phenetyl ester) dan flavonoid yang memiliki bermacam-macam khasiat
salah satunya adalah efek antioksidan, yang dapat melindungi tubuh dari
radikal bebas. Radikal bebas yang umum adalah polusi dan kunsumsi
alkohol. Alkohol yang dikunsumsi dapat menimbulkan kerusakan sel pada
tubuh. Alkohol jika dikonsumsi secara berlebihan dan terus-menerus akan
mempunyai efek toksik terhadap tubuh baik secara langsung maupun
tidak langsung (Panjaitan, 2003).
Salah satu akibat konsumsi alkohol (etanol) berlebihan adalah
meningkatnya resiko gagal ginjal dan gagal fungsi hati. Mengkonsumsi
etanol sangat berbahaya karena reaksi kimia senyawa menyebabkan
gangguan fungsi dan kematian sel (nekrosis) pada sel tubulus proksimal.
Berdasarkan penelitian Gunawan (2010), pada hewan percobaan tikus
putih galur wistar, yang diberi alkohol 20%, 30%, 40% dan 50%
sebanyak 2 ml/hari selama 15 hari, ditemukan nekrosis sel tubulus
proksimal ginjal.
Seperti sebagian besar organ dalam tubuh ada sejumlah regulasi yang
alkohol dapat mengganggu kontrol ini. Efek tepat tergantung pada jumlah
alkohol yang absorbsi dan waktu dikonsumsi. Alkohol dapat mengubah
struktur dan fungsi ginjal serta merusak kemampuan ginjal untuk
mengatur volume, komposisi cairan dan elektrolit dalam tubuh.
Perubahan mikroskopis pada ginjal termasuk perubahan struktur
glomerulus, pembengkakan atau pembesaran ginjal dan meningkatnya
jumlah sel-sel lemak, protein dan air. Efek ini akan mengubah
kemampuan ginjal untuk berfungsi secara normal (Booggan, 2003).
B. Rumusan Masalah
Apakah terdapat pengaruh pemberian propolis terhadap perubahan
gambaran histopatologis ginjal Tikus putih jantan dewasa (R norvegicus)
yang dipapari etanol 50%
C. Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah:
Mengetahui pengaruh pemberian propolis terhadap perubahan
gambaran histopatologis ginjal Tikus putih jantan dewasa (R
D. Manfaat Penelitian
Dari hasil penelitian yang akan dilakukan diharapkan dapat bermanfaat
bagi peneliti dan juga bagi masyarakat luas. Adapun manfaat penelitian
ini adalah:
1. Bagi peneliti, sebagai suatu bentuk pengaplikasian disiplin ilmu yang
telah dipelajari selama perkuliahan sehingga dapat mengembangkan
khasanah keilmuan peneliti terutama pengetahuan mengenai pengaruh
pemberian propolis.
2. Bagi masyarakat, menjawab pertanyaan dan wawasan masyarakat
umum tentang kandungan dan manfaat dari propolis.
E. Kerangka Penelitian
1. Kerangka Teoritis
Pemberian alkohol pada mencit baik secara akut atau kronis menyebabkan
gangguan pada ginjal (nefron), yang menyebabkan peningkatan aktifitas
enzim katalase sehingga menimbulkan radikal bebas (stres oksidatif)
ditandai dengan kerusakan atau gangguan pada jaringan ginjal, yang
akibatnya terjadi gangguan pada ginjal (Herlina, 2011).
Propolis yang mengandung sejumlah zat aktif CAPE (Caffeic Acid
Phenethyl Ester) serta flavonoid memiliki khasiat sebagai antioksidan
Propolis atau lem lebah merupakan produk alami dari lebah madu yang
mempunyai potensi antioksidan yang tinggi (Gheldof dan kawan-kawan,
2002). Propolis mempunyai aktivitas antioksidan yang paling kuat dalam
melawan oksidan dan radikal bebas (radikal H2O2, O2●-, OH●)
dibandingkan dengan hasil produk lebah lainnya (Nakajima dan
kawan-kawan, 2009). Kandungan flavonoid di dalamnya dapat meredam efek
buruk radikal bebas (Mot dan kawan-kawan, 2009).
Penelitian di Jepang menunjukkan bahwa kandungan Caffeic acid yang
ada di dalam propolis mempunyai aktivitas antioksidan yang tinggi, yang
dapat meningkatkan ekspresi glucose-6-phospate dehydrogenase (G6PD)
yang didapat dari ekspresi gen antioksidan, lebih kuat dibandingkan
vitamin E. Caffeic acid mempunyai aktivitas antioksidan 4-6 kali lebih
kuat terhadap oksidan dan H2O2 dan radikal bebas O2●-, dibandingkan
vitamin C dan N-acetyl-cystein (NAC) (Nakajima dan kawan-kawan,
2009)
Gambar 1. Diagram Alur Kerangka teori (Herlina, 2011) Paparan Etanol (50%)
Radikal bebas↑
Perubahan gambaran histopatologi sel dan jaringan ginjal
Propolis mengandung : Flavonoid,Caffeic Acid Phenetyl Ester
(CAPE)
2. Kerangka Konsep
Gambar 2. Diagram Kerangka Konsep
F. Hipotesis
Hipotesis pada penelitian ini adalah terdapat pengaruh pemberian
propolis terhadap perubahan gambaran histopatologi ginjal tikus putih
jantan dewasa (R. Norvegicus) yang dipapari etanol 50%. Kontrol negatif (-)
Kontrol positif (+)
Propolis 0,00009 ml/grBB
Propolis 0,00026 ml/grBB
Propolis 0,00078 ml/grBB
Etanol
Gambaran perubahan histopatologis ginjal tikus putih
A. Ginjal
1. Anatomi Ginjal Mencit
Ginjal mencit merupakan sepasang organ yang berbentuk seperti
kacang yang terletak retroperitoneal (Gambar 3) di kedua sisi tulang
punggung. Keduanya tidak melekat langsung pada dinding tubuh
tetapi dilapisi jaringan lemak. Ginjal kanan lebih besar, lebih berat
dan terletak lebih anterior. Ginjal mencit jantan lebih berat dan lebih
besar. Bentuk dan ukuran ginjal bervariasi pada tiap galur, misalnya
pada galur C58, 10-20 % dari galur tersebut hanya mendapati satu
atau bahkan kedua ginjalnya mengecil atau hilang (Green dan
Gambar 3. Anatomi Ginjal Mencit (Cook, 2010)
Ginjal mencit mendatar dorsoventral dan memiliki luas cembung ke
arah lateral serta memiliki batas tengah pendek cekung. Cekungan
adalah hilus dimana pembuluh darah dan ureter bersatu. Ginjal terdiri
dari dua lapis yang dapat dilihat tanpa bantuan lensa jika ginjal
dibelah menjadi dua yaitu korteks dan medula. Korteks mengikuti
kontur perbatasan cembung dan medula seperti piramida yang luas
dengan dasar cembung. Puncak piramida adalah papila yang
dikelilingi oleh panggl, ujung anterior diisi corong seperti ureter
2. Histologi Ginjal
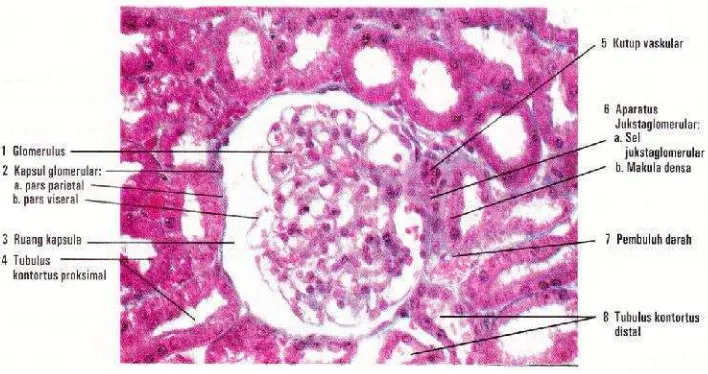
Ginjal diliputi oleh kapsula ginjal yang terdiri atas jaringan
penyambung padat. Bagian luar ginjal disebut korteks dan bagian luar
disebut medulla. Pada bagian medulla banyak terdapat nefron (unit
fungsional ginjal) yang terdiri dari korpus renal, tubulus kontortus
proksimal, ansa henle dan tubulus kontortus distalis. Setiap korpus
renal bergaris tengah kira-kira 200 µm dan terdiri atas seberkas
kapiler glomerulus yang dikelilingi oleh kapsula bowman (Junqueria,
2007)
Nefron merupakan satu kesatuan unit fungsional dari ginjal,
masing-masing ginjal manusia terdiri dari kurang lebih 1 juta nefron, setiap
nefron mempunyai dua komponen utama, yaitu: glomerulus (kapiler
gromelurus) dan tubulus (Guyton, 2004).
Nefron terdiri atas bagian yang melebar, korpuskulus renal; tubulus
kontortus proksimal, segmen tipis dan tebal ansa Henle; dan tubulus
kontortus distal. Pada kutub urinarius pada korpuskulus renal, epitel
gepeng dari lapisan parietal kapsul Bowman, berhubungan langsung
dengan epitel silidris dari tubulus kontortus proksimal. Tubulus ini
lebih panjang dari tubulus kontortus distal dan karenanya tampak
lebih banyak dekat korpuskulus renalis dalam labirin korteks. Tubulus
ini juga memiliki lumen lebar dan dikelilingi oleh kapiler peritubuler
Glomerulus adalah suatu organ epitelio-vaskuler yang dirancang
untuk filtrasi ultra dari plasma. Kecuali pada infundibulum yang
mengandung arteriol aferen dan eferen, glomerulus secara
keseluruhan tertutup oleh kapsula bowman yang berbentuk mangkok
dan dilapisi sel epitel parietal. Kapiler glomerulus dilapisi oleh
lapisan endothelium, berlubang pori-pori dengan diameter kurang
lebih 100 nm dan terletak pada membrana basalis. Di bagian luar
membran basalis adalah sel epitel visceral atau podosit (Robbins,
2007).
Tubulus proksimal berjalan berkelok-kelok dan berakhir sebagai
saluran yang lurus di medula ginjal (pars desendens Ansa Henle).
Tubulus kontortus proksimal terdapat banyak pada korteks ginjal
dengan diameter sekitar 60 μ m dan panjang sekitar 14 mm. Tubulus
kontortus proksimal terdiri dari pars konvulata yang berada di dekat
korpuskulus ginjal dan pars rekta yang berjalan turun di medulla dan
korteks, kemudian berlanjut menjadi lengkung Henle di medula
(Gartner dan Hiatt, 2007). Fungsi tubulus kontortus proksimal adalah
mengurangi isi filtrate glomerulus 80-85% dengan cara reabsorpsi
melalui transport dan pompa natrium. Glukosa, asam amino dan
protein seperti bikarbonat akan direasorpsi. Epitel yang melapisi
tubulus ini adalah selapis kuboid atau silindris yang menunjang dalam
mekanisme absorbsi dan ekskresi. Sel-sel epitel ini memiliki
sitoplasma asidofilik yang disebabkan oleh adanya mitokondria
dengan panjang sekitar 1 μ m, yang membentuk suatu brush border
(Junqueira, 2007).
Gambar 4. Korpuskulum renal dan tubulus renal (Eroschenko, 2003)
Pada kutub urinarius dari korpuskulus renal, epitel gepeng dari lapisan
parietal kapsula bowman berhubungan langsung dengan epitel
silindris dari tubulus kontortus proksimal. Tubulus lebih panjang dari
tubulus kontotus distal dan karenanya tampak lebih banyak dekat
korpuskulus renal dalam labirin korteks. Tubulus kontortus proksimal
dilapisi oleh epitel selapis kuboid atau silindris. Sel-sel epitel ini
memiliki sitoplasma asidofilik yang disebabkan oleh adanya
mitokondria panjang dalam jumlah besar. Apeks sel memiliki banyak
mikrovili dengan panjang kira-kira 1µm, yang membentuk suatu
brush border yang menambah luas permukaan penyerapan (Junqueria
Tubulus kontortus proksimal berlanjut sebagai ansa henle. Ansa henle
adalah struktur berbentuk huruf U terdiri atas ruas tebal desenden,
dengan struktur yang sangat mirip tubulus kontortus proksimal, ruas
tipis asenden dan ruas tebal asenden, yang strukturnya sangat mirip
tubulus kontortus distal. Di medulla bagian luar, ruas tebal desenden
dengan garis tengah luar sekitar 60 µm, secara mendadak menipis
sampai sekitar 12 µm dan berlanjut sebagai ruang tipis desenden.
Lumen ruas nefron ini lebar karena dindingnya terdiri atas sel epitel
gepeng yang intinya hanya sedikit menonjol ke dalam (Junqueria &
Carneiro, 2007).
Sedangkan menurut Robin & Kumar (2004), glomerulus dalam
keadaan normal secara keseluruhan tertutup oleh kapsula bowman
yang berbentuk mangkok dan dilapisi oleh endothelium berlubang
berpori-pori yang terletak pada membran basalis dan dibagian luar
membrane basalis adalah sel epitel visceral (podosit).
3. Fisiologi Ginjal
Dunia kedokteran biasa menyebutnya 'ren' (renal/kidney). Bentuknya
seperti kacang merah, berjumlah sepasang dan terletak di daerah
peritoneal. Ukurannya kira-kira 11x 6x 3 cm. Beratnya antara 120-170
gram. Struktur ginjal terdiri dari: kulit ginjal (korteks), sumsum ginjal
(medula) dan rongga ginjal (pelvis). Pada bagian kulit ginjal terdapat
jutaan nefron yang berfungsi sebagai penyaring darah. Setiap nefron
bergelung. Badan Malpighi tersusun oleh Kapsula Bowman yang
didalamnya terdapat Glomerolus (Guyton, 2002).
Berikut fungsi dari ginjal (Guyton, 2002):
a. Menyaring dan membersihkan darah dari zat-zat sisa metabolisme
tubuh.
b. Mengeksresikan zat yang jumlahnya berlebihan.
c. Reabsorbsi (penyerapan kembali) elektrolit tertentu yang dilakukan
oleh bagian tubulus ginjal.
d. Menjaga keseimbanganan asam basa dalam tubuh manusia.
e. Menghasilkan zat hormon yang berperan membentuk dan
mematangkan sel-sel darah merah (SDM) di sumsum tulang.
B. Propolis
Menurut (Suranto, 2004) propolis atau lem lebah adalah suatu zat yang
dihasilkan oleh lebah madu. Dikumpulkan oleh lebah dari pucuk
daun-daun yang muda untuk kemudian dicampur dengan air liurnya, digunakan
untuk menambal dan mensterilkan sarang. Propolis
bersifat disinfektaan (anti bakteri) yang membunuh semua kuman yang
masuk kesarang lebah. lebah meliputi sarangnya dengan propolis untuk
melindungi semua yang ada di dalam sarang tersebut dari serbuan
kuman, virus, atau bakteri, misal: ratu lebah, telur, bayi lebah, dan madu.
dalam membunuh kuman, terbukti dengan ditemukannya seekor tikus
dalam sarang lebah yang telah mati selama kurang lebih 5 tahun dalam
keadaan tidak membusuk.
Propolis adalah resin yang sering disebut sebagai bee glue karena
teksturnya lengket seperti lem. Propolis diproleh oleh lebah dengan cara
mengumpulkan resin-resin dari berbagai macam tumbuhan Karena
sumbernya bermacam-macam, maka warna, komposisi dan khasiat dari
propolis pun bervariasi. Warna propolis mulai dari kuning, coklat bahkan
transparan. Komposisi propolis kimia propolis terdiri dari flavonoid yang
meliputi hampir 50%, selain itu asam kafeat/ (CAPE)caffeic acid phnetyl
ester, asam ferulat dan mineral dalam jumlah kecil. Berikut beberapa
komposisi dari propolis:
Tabel 1. Komposisi propolis (Suranto, 2004)
Kelas komponen Grup Komponen Presentase(%)
Resin Flavonoid, Asam fenolat ester (CEPA) 45-55 Asam
lemak,lilin
Lilin lebah dan zat lain yang berasal dari tumbuhan
25-35
Minyak esensial Zat yang mudah menguap 10 Polen Protein (16 asam amino bebas,>1%) arginin,
dan prolin sebanyak 46%
5
Bahan organik dan mineral lain
14 mineral (besi, seng, keton, lakton, quinon, steroid, asam benzoic, vitamin, gula
5
1. Kandungan Senyawa Aktif Propolis
Komposisi kimia propolis masih kurang diketahui. Komposisi
aromanya yang berubah-ubah sesuai dengan sumber pohon, jenis
lebah, musim dan daerah geografis (Bankova, 2005).
Gambar 5. Struktur kimia propolis
Oleh karena kandungan aktif propolis dipengaruhi oleh letak
geografis dan sumber tumbuhan, maka terdapat perbedaan antara
propolis di Brasil dengan propolis di China. Propolis Brasil
terutama mengandung terpenoid, turunan prenylated. Propolis
China banyak mengandung flavonoid dan asam fenolat. Negara
lainnya yang terbukti mempunyai kandungan flavonoid tinggi pada
propolisnya adalah Argentina, Australia, Bulgaria, Hungaria, New
Zealand, dan Uruguay (Kumazawa dan kawan-kawan, 2004).
Bankova (2008) melaporkan adanya temuan kandungan kimia baru
pada propolis dari berbagai negara tergantung dari iklim daerahnya.
Komponen baru pada daerah beriklim sedang (temperate zone)
seperti di Eropa, Amerika Utara dan daerah non tropis di Asia,
Amerika Selatan, dan di New Zealand, konstituen utamanya adalah
disebut juga “propolis tipe poplar”, merupakan propolis yang
paling sering diteliti baik dari segi kandungan kimia maupun
farmakologis. Komponen baru pada daerah beriklim tropis dan
subtropis seperti Amerika Selatan banyak mengandung flavonoid
dan komponen terkait seperti flavones, falvonol, chalcone,
isoflavonoid, dan neoflavonoid. Melalui kajian lebih dalam lagi,
jenis spesifik kandungan aktif dari propolis yang pada banyak
penelitian mempunyai efek biologis adalah Artepillin-C, PM3
(3-[2-dimethyl-8-(3-methyl-2 butenyl)benzopyran]-6-propenoic acid),
CAPE (caffeic acid phenethyl ester), Propolin A, Propolin B, dan
Propolin C. Artepillin C (3,5-diprenyl-4-hydroxycinnamic acid)
diekstrak dari Propolis Brasil mempunyai berat molekul 300.40
dan memiliki efek antimikroba dan antitumor (Kimoto dan
kawan-kawan, 2006).
Flavonoid adalah kelompok substansi dari alam yang mempunyai
variasi struktur fenol dan banyak ditemukan pada buah, sayur,
biji-bijian, kulit batang, akar, bunga, teh dan anggur (wine). Flavonoid
dapat dibagi menjadi beberapa kelas berdasarkan struktur molekul
yaitu kelompok flavones, flavonones, cathechins, dan anthocyanins
(Manach dan kawan-kawan, 2005).
Jenis flavonones dan catechins merupakan kelompok flavonoids
yang terkuat dalam melindungi tubuh terhadap radikal bebas.
Quercetin merupakan contoh dari kelompok flavones yang banyak
Sedangkan kandungan aktif propolis Indonesia sudah diteliti oleh
Syamsudin dan kawan-kawan. (2009) yaitu meneliti kandungan
kimia propolis yang berasal dari tiga tempat yang berbeda di
Indonesia (Sukabumi, Batang dan Lawang) dan menemukan beberapa
bahan kandungan kimia yang pertama kali ditemukan dalam
propolis, diketahui bahwa propolis banyak mengandung polifenol
salah satunya adalah flavonoid yang merupakan zat yang
mempunyai aktifitas antioksidan.
2. Efek Kandungan Aktif Propolis
Komponen utama dari prolpolis adalah flavonoid dan asam fenolat,
termasuk caffeic acid phenetyl ester (CAPE) yang kandungannya
hampir 50% dari seluruh komposisi. Flavonoid hampir terdapat di
spesies bunga. Flavonoid merupakan salah satu golongan fenol alam
yang terbesar. Golongan flavonoid mencakup banyak pigmen yang
paling umum dan terdapat pada seluruh tumbuhan (Suranto, 2004).
Efek flavonoid yang terpenting adalah dapat menangkap radikal
bebas turunan oksigen reaktif. Penelitian in vitro juga
menunjukkan bahwa flavonoid mempunyai efek antiinflamasi,
antialergi, antivirus dan antikarsinogenik. Setiap grup flavonoid
mempunyai kapasitas sebagai antioksidan (Amic dan
kawan-kawan, 2003).
Kumazawa dan kawan-kawan. (2004) meneliti kandungan polifenol
Komponen antioksidan diidentifikasi dengan menggunakan analisis
HPLC/KCKT dan aktifitas antioksidan diukur dengan
menggunakan metode β-carotene bleaching dan 1,1-diphenyl-2
picrylhydrazyl (DPPH) free radical scavenging assays system.
Penelitian tersebut menemukan bahwa propolis dari negara
Argentina, Australia, Cina, Hungaria, dan New Zealand
mempunyai aktifitas antioksidan yang tinggi dan berkorelasi
dengan kandungan polifenol dan flavonoid yang dikandungnya.
Selain itu diteliti lebih jauh lagi jenis flavonoid yang mempunyai
efek antioksidatif yaitu caffeic acid, qurcetin, kaempferol,
phenethyl caffeate, cinnamyl caffeate, dan artepillin C.
Penelitian lainnya juga mendukung adanya korelasi antara
kandungan flavonoid pada propolis dengan aktifitas aktioksidan.
Dilakukan penelitian pada propolis Romania dan menemukan
adanya jenis flavonoid yang mempunyai aktifitas antioksidan yaitu
quercetin, rutin, caffeic acid, chrysin, apigenin dan kaempferol
(Coneac dan kawan-kawan, 2008).
Geckil dan kawan-kawan. (2005) juga membandingkan aktifitas
antioksidan pengkelat logam dari Propolis Turki dengan zat
antioksidan sintetik (BHA / butylated hydroxyanisole dan BHT /
butylated hydroxytoluene). Penelitian tersebut menemukan bahwa
ekstrak propolis baik ethanol based maupun water based
mempunyai efek metal chelating lebih baik dibanding BHA dan
propolis berbasis etanol lebih baik dibanding dengan berbasis air.
Seperti telah dijelaskan pada sub-bab sebelumnya, efek radikal
bebas dapat merusak sel tubuh termasuk protein sitoplasmik di dalam
DNA. Kejadian tersebut juga berhubungan dengan pertumbuhan
tumor dimana radikal bebas mungkin beraksi sebagai pembawa
pesan sekunder (secondary messengers) pada alur transduksi yang
mengatur proliferasi selular. Antioksidan dapat menghambat atau
menyingkirkan jumlah radikal bebas yang berlebihan sehingga
mengurangi kerusakan yang terjadi akibat radikal bebas. Jadi dengan
mengurangi peroksida di dalam sel oleh antioksidan akan
menghambat terjadinya proses karsinogenesis (Galvao dan
kawan-kawan, 2007).
3. Mekanisme Kerja Antioksidan
Dalam pengertian kimia, senyawa antioksidan adalah senyawa
pemberi electron (elektron donors). Secara biologis, pengertian
antioksidan adalah senyawa yang mampu menangkal atau meredam
dampak negatif oksidan dalam tubuh. Antioksidan bekerja dengan
cara mendonorkan satu elektronnya kepada senyawa yang bersifat
oksidan sehingga aktivitas senyawa oksidan tersebut dihambat,
termasuk enzim-enzim dan protein-protein pengikat logam
(Pangkahila, 2007).
a. Antioksidan Enzimatis, misalnya enzim superoksida dismutase
(SOD), katalase, dan glutation peroksidase.
b. Antioksidan Non Enzimatis
Antioksidan non enzimatis terdiri dari:
1) Antioksidan larut lemak, seperti -tokoferol, karotenoid,
flavonoid, quinon, dan bilirubin.
2) Antioksidan larut air, seperti asam askorbat, asam urat, protein
pengikat logam, dan protein pengikat heme. (Miyazaki dan
kawan-kawan,2000; Winarsi, 2007).
Antioksidan enzimatis dan non enzimatis tersebut bekerja sama
memerangi aktivitas senyawa oksidan dalam tubuh. Terjadinya stres
oksidatif dapat dihambat oleh kerja enzim-enzim antioksidan dalam
tubuh dan antioksidan non enzimatik (Miyazaki dan kawan-kawan,
2000; Winarsi, 2007).
Struktur molekul dari masing-masing kelompok flavonoid sel dan
jaringan tubuh selalu terpapar dengan efek perusakan yang
disebabkan oleh radikal bebas dan radikal bebas turunan oksigen atau
reactive oxygen species (ROS) yang normalnya terbentuk selama
metabolisme oksigen atau dinduksi oleh kerusakan eksogen. Radikal
bebas dapat menganggu fungsi selular dengan melakukan
peroksidasi lipid yang berakibat kerusakan membran sel.
sel, perubahan tekanan osmosis, menyebabkan pembengkakkan sel
dan berakhir pada kematian sel. Radikal bebas dapat menarik
bermacam-macam mediator inflamasi yang berkontribusi ke respon
inflamasi dan kerusakan jaringan. Dalam rangka mempertahankan diri
terhadap ROS, tubuh mempunyai beberapa mekanisme. Mekanisme
pertahananan antioksidan tubuh tediri dari enzim seperti superoksida
dismutase, katalase dan glutation peroksidase, dan juga non-enzim
seperti glutation, asam askorbat, dan α-tokoferol. Peningkatan
produksi ROS selama perlukaan menyebabkan komsumsi dan deplesi
komponen antioksidan alami tubuh. Flavonoid mempunyai efek
adiktif terhadap komponen antioksidan alami. Flavonoid dapat
menganggu lebih dari 3 sistem penghasil radikal bebas yang
berbeda, dan juga dapat meningkatkan fungsi antioksidan endogen.
Aktifitas Antioksidatif berikut adalah mekanisme antioksidan dari
flavonoid yaitu mengikat radikal secara langsung (direct radical
scanvenging), melalui nitrit oksida, xanthin oksidase, imobilisasi
leukosit, interaksi dengan sistem enzim lainnya (Nijveldt dan
kawan-kawan, 2001)
a. Menangkap Langsung Radikal Bebas (Direct Radical
Scavenging)
Flavonoid dapat mencegah perlukaan yang disebabkan oleh
radikal bebas. Flavonoids dapat menstabilkan ROS dengan
bereaksi dengan komponen radikal bebas yang reaktif. Oleh
radikal bebas akan dibuat tidak aktif, sesuai dengan reaksi
berikut (Nijveldt dan kawan-kawan, 2001)
Flavonoid(OH) + R*flavonoid (O*) + RH
R* adalah radikal bebas dan O* adalah radikal bebas oksigen.
Flavonoid yang selektif dapat secara langsung mengikat radikal
bebas, dimana flavonoid lainnya dapat mengikat ROS yang
disebut peroksinitrit (peroxynitrite) (Amic dan kawan-kawan,
2003)
b. Mengikat Nitrit Oksida
Beberapa jenis flavonoid, termasuk quercetin, dapat
mengurangi perlukaan iskemia-reperfusi (ischemia-reperfusion
injury) dengan mengganggu aktifitas sintesis nitrit oksida yang
dapat diinduksi. Nitrit oksida diproduksi oleh beberapa jenis sel
yang berbeda seperti sel endothelial dan makrofag. Produksi
nitrit oksida pada awalnya berguna untuk dilatasi pembuluh
darah, namun jika produksi nitrit oksida yang berlebihan oleh
makrofag dapat menyebabkan kerusakan oksidatif. Pada
keadaan ini, makrofag yang teraktivasi dapat menghasilkan
nitrit oksida dan superoksida anion yang berlebihan terus
Nitrit oksida akan bereaksi dengan radikal bebas dan dengan
demikian akan memproduksi peroksinitrit dalam jumlah besar
serta bersifat merusak. Ketika flavonoid digunakan sebagai
antioksidan, radikal bebas akan diikat oleh flavonoid sehingga
tidak dapat bereaksi lebih lama lagi dengan nitrit oksida dan
mengurangi kerusakan. Menariknya, nitrit oksida dapat
dianggap sebagai radikal bebas juga dan telah dilaporkan dapat
diikat juga oleh flavonoid. Oleh karena itu telah diperkirakan
bahwa pengikatan nitrit oksida mempunyai peranan dalam efek
terapeutik dari flavonoid. Silibin adalah salah satu flavonoid yang
dapat menghambat nitrit oksida (Nijveldt dan kawan-kawan,
2001).
c. Menghambat Xanthin Oksidase
Alur xanthin oksidase mempunyai implikasi penting sebagai
rute perlukaan oksidatif pada jaringan khususnya pada keadaan
iskemia-reperfusi. Xanthin dehidrogenase dan xanthin oksidase
terlibat dalam metabolisme xanthin menjadi asam urat. Xanthin
dehidrogenase adalah bentuk enzim yang muncul dalam
keadaan normal, namun konfigurasinya dapat berubah menjadi
xanthin oksidase pada keadaan iskemik. Xanthin oksidase
adalah sumber dari radikal bebas turunan oksigen reaktif.
Pada fase reperfusi (reoksigenasi), xanthin oksidase bereaksi
radikal bebas superoksida. Sedikitnya 2 jenis flavonoid,
quercetin dan silibin, menghambat xanthin oksida sehingga
menurunkan perlukaan oksidatif (Nijveldt dan kawan-kawan.
2001).
d. Imobilisasi Leukosit
Imobilisasi dan adhesi yang kuat leukosit ke sel endotel
adalah mekanisme lainnya yang bertanggung jawab untuk
terbentuknya radikal bebas turunan oksigen reaktif dan juga
terlepasnya oksidat sitotoksik, mediator inflamasi dan aktivasi
sistim komplemen. Dalam situasi normal, leukosit bergerak
dengan bebas sepanjang dinding endotel. Namun, selama
kondisi iskemia dan inflamasi, beberapa mediator turunan
endothelial utama dan faktor komlemen dapat meyebabkan
adhesi leukosit ke dinding endothelial, sehingga
mengimobilisasi leukosit selama reperfusi. Penurunan jumlah
leukosit yang imobilisaasi oleh flavonoid berhubungan dengan
total komplemen di serum dan merupakan mekanisme protektif
melawan kondisi yang berhubungan dengan inflamasi, seperti
perlukaan reperfusi. Beberapa flavonoid dapat mencegah
terhadinya degranulasi neutrofil tanpa mempengaruhi produksi
superoksida, efek hambat beberapa flavonoid pada degranulasi
sel mast ditunjukkan oleh karena modulasi reseptor kanal
kalsium dalam membran plasma (Nijveldt dan kawan-kawan,
e. Interaksi dengan Sistem Enzim Lainnya
Ketika ROS bereaksi dengan besi (Fe) maka menghasilkan
peroksidasi lipid. Flavonoid spesifik dapat menyingkirkan besi
(chelate iron) sehingga menghilangkan faktor penyebab
terjadinya radikal bebas. Quercetin diketahui mempunyai efek
iron-chelating dan iron-stabilizing. Flavonoid juga dapat
mengurangi aktivasi komplemen sehingga akan mengurangi
adhesi sel inflamasi ke dinding endothelial dan akhirnya
menghilangkan respon inflamasi. Gambaran lainnya flavonoid
adalah dapat mengurangi terlepasnya peroksidase. Pengurangan
ini dapat menghambat produksi ROS oleh netrofil. Efek
flavonoid lainnya adalah inhibisi metabolisme asam arakidonat.
Efek ini merupakan efek antiinflamasi dan antitrombogenik dari
flavonoid. Pelepasan asam arakidonat adalah awal dari respon
inflamasi. Neutrofil yang mengandung lipoksigenase
menghasilkan komponen kemotaksis dari asam arakidonat dan
juga merangsang pelepasan sitokin (Nijveldt dan kawan-kawan,
2001).
4. Dosis, Efek Samping, dan Toksisitas Propolis
Propolis mempunyai toksisitas oral akut yang rendah atau bahkan
tidak toksik. Pada penelitian dengan menggunakan mencit
membuktikan bahwa propolis tidak toksik dan mempunyai LD (lethal
konsentrasi yang aman untuk manusia adalah 1.4 mg/kg atau
hampir 70 mg/hari. Kadar NOEL (No Effect Level) pada mencit
adalah 1400 mg/kg (Hunter, 2006).
Penelitian pada tikus dengan pemberian dosis propolis yang
berbeda (1, 3, dan 6 mg/kg/hari), pelarut yang berbeda (air dan
etanol), dan variasi lama pemberian (30, 90, dan 150 hari)
didapatkan hasil tidak ada perbedaan yang bermakna dalam hal
total lipid, trigliserid, kolesterol, kolesterol-HDL, AST, dan LDH.
Propolis juga tidak mempengaruhi berat badan tikus setelah
pemberian (Sforcin, 2007).
Selain itu penelitian pada tikus yang dilakukan Decastro (1995),
tidak ada efek samping terlihat dalam pemberian oral dengan dosis
lebih tinggi dari 4000 mg/kg/hari selama dua minggu dan dosis
1400 mg/kg/hari dalam air minum selama 90 hari.
C. Etanol
Etanol merupakan salah satu dari kelompok campuran kimia organik
dengan sebuah hidrogen (H) yang melekat pada karbon digantikan oleh
sebuah hidroksil (OH), etanol, C2H2OH terbuat dari karbohidrat melalui
fermentasi dan secara sintetis dari ethylene atau acetylene, yang telah
digunakan dalam minuman dan sebagai pelarut, vehikulum, dan pengawet
Menurut Das dan kawan-kawan (2008) setelah mengkonsumsi minuman
beralkohol maka etanol dan hasil metabolitnya melewati ginjal dan
dieksresikan melalui urine, kadar etanol dan metabolitnya tersebut lebih
tinggi pada darah maupun hati. Sehingga etanol secara terus menerus
dapat merubah struktur dan fungsi ginjal dalam mengatur volume cairan
dan komposisi elektrolit dalam tubuh.
1. Efek Etanol Terhadap Tubuh
Etanol dapat menyebabkan perubahan perbandingan NAD+/NADH
dalam sel. Etanol di metabolisme enzim alkohol dehydrogenase
menjadi asetaldehid yang kemudian diubah kembali oleh enzim
alkohol dehydrogenase menjadi asetat. Reaksi-reaksi tadi dapat
membentuk molekul NADH yang meningkatkan kebutuhan oksigen
dan produksi ROS. Produksi asetaldehid juga dapat menyebabkan
pembentukan radikal bebas dan kerusakan sel beserta strukturnya
seperti membran sel dan mitokondria sehingga sel menjadi rusak dan
mengalami penurunan produksi ATP (Wu dan Cedebaum, 2004)
Radikal bebas adalah sekelompok bahan kimia baik berupa atom
maupun molekul yang memiliki elektron tidak berpasangan pada
lapisan luarnya. Radikal bebas sangat reaktif, maka mempunyai
spesifitas kimia yang rendah sehingga dapat bereaksi dengan berbagai
molekul lain seperti protein, lemak, karbohidrat dan Deoxi Nucleic
adalah radikal derivat dari oksigen yang disebut kelompok oksigen
reaktif (reactive oxygen species atau ROS) termasuk didalamnya
adalah triplet (3O2), tunggal (singlet/1O2), anion superoksida (O2-),
radikal hidroksil (-OH), nitrit oksida (NO-), peroksinitrit (ONOO- ),
asam hipoklorus (HOCl), hidrogen peroksida (H2O2), radikal alkoksil
(LO-) dan radikal peroksil (LO-2). Radikal yang mengandung
hidrogen hasil penyerangan atom H (H-) dan bentuk lain adalah
radikal mengandung sulfur yang diproduksi pada oksidasi glutation
menghasilkan radikal thiyl (R-S) (Proctor, 1984; Araujo, 1998).
Radikal bebas ini akan bereaksi dengan poly-unsaturated fatty acid’s
(PUFAs) atau asam lemak tidak jenuh ganda yang menyebabkan
terbentuknya lemak peroksida. Ketidakseimbangan antara produksi
senyawa oksigen reaktif dengan kemampuan pertukaran antioksidan
mengalami gangguan sehingga menggoyahkan rantai reduksi-oksidan
normal, hal ini mengakibatkan kerusakan oksidatif jaringan. Keadaan
ini diduga sebagai salah faktor pendorong timbulnya beberapa
penyakit (Wuryastuti, 2000).
Pengaruh penggunaan etanol dapat berupa penigkatan eksresi urin
akibat penghambatan sekresi hormon anti diuretik pada kelenjar
hipofisis posterior, pengaruh lainnya dapat terjadi inkontinesia urin
khususnya pada usia tua. Sedangkan pengguanaan etanol yang kronis
dapat menimbulkan retensi air dan garam yang disebabkan oleh
adanya gangguan pada volume ekstraseluler, asidosis metabolik,
hipophospatemia, hipokalsemia dan pada keadaan yang lebih buruk
dapat terjadi gagal ginjal akut (Barclay, 2008).
Salah satu penyebab nekrosis (jejas sel) adalah bahan kimia dan
obat-obatan, seperti: obat-obatan terapeutik misalnya acetaminophen dan
agen non-terapeutik misalnya timah dan alkohol (Stanley dan
Robbins, 2007).
Nekrosis (jejas ireversibel) adalah perubahan morfologik yang
mengikuti kematian sel pada jaringan atau organ hidup. Dua proses
penyebab perubahan morfologik dasar nekrosis adalah denaturasi
protein dan digesti enzimatik organel dan sitosol. Sel yang mengalami
nekrotik berwarna eosinofolik, seperti kaca (glassy), membran sel
pecah-pecah. Perubahan inti sel nekrotik adalah kariopiknosis (inti
kecil, padat), kariolisis (inti pucat, larut) dan karioreksis (inti pecah
menjadi beberapa gumpalan) (Robbins, 2007)
Semua organisme aerobik pada derajat tertentu dilengkapi dengan
sistem pertahanan yang mampu melindungi sel dari pengaruh
metabolit oksigen yang secara umum dikerjakan oleh beberapa
kelompok enzim protektif seperti: superoksida dismutase (SOD),
katalase, reduktase, glutation peroksidase serta antioksidan endogen
antara lain adalah seruloplasmin, transferin, asam askorbat, asam urat,
sistein, α-tokoferol dan α-karoten. Semua sistem perbaikan ini
mencegah akumulasi yang rusak akibat proses oksidatif (Wuryastuti,
Secara histopatologis, etanol dapat menyebabkan hipertrofi dari sel
epitel dan degenerasi sel tubulus-tubulus ginjal dengan penampakan
infiltrasi sel MN, dan pelebaran glomerulus namun perubahan
histologi yang paling sering didapatkan setelah pemberian etanol
adalah pelebaran kapiler yang dipenuhi eritrosit baik pada bagian
korteks maupun medulla (Brozoska, 2003).
2. Absorpsi dan distribusi Etanol
Setelah pemberian oral, etanol diabsorbsi dengan cepat dari lambung
dan usus halus ke dalam aliran darah dan terdistribusi ke dalam cairan
tubuh total (Fleming dan kawan-kawan., 2007). Tingkat absorbsi
paling tinggi pada saat lambung kosong. Adanya lemak di dalam
lambung menurunkan tingkat absorbsi alkohol (Chandrasoma dan
Taylor, 2005). Setelah minum alkohol dalam keadaan puasa, kadar
puncak alkohol di dalam darah dicapai dalam waktu 30 menit.
Distribusinya berjalan cepat, dengan kadar obat dalam jaringan
mendekati kadar di dalam darah. Volume distribusi dari etanol
mendekati volume cairan tubuh total (0,5-0,7 L/Kg) (Masters, 2002).
Alkohol didistribusikan di dalam tubuh (terutama dalam jaringan
adiposa), menyebabkan efek dilusi. Hal ini berkaitan dengan berat
badan dan menerangkan mengapa orang dengan obesitas memiliki
kadar alkohol yang lebih rendah dari pada orang yang kurus untuk
jumlah alkohol yang sama (Chandrasoma dan Taylor, 2005).
a. Kondisi lambung dalam keadaan kosong atau berisi
Pada lambung keadaan kosong, absorpsi sempurna terjadi dalam
waktu 1 atau 2 jam, tetapi pada lambung keadaan berisi penuh
makanan absorpsi terjadi sampai 6 jam. hal ini sangat penting
dalam pengaturan absorpsi etanol.
b. Komposisi larutan etanol yang diminum
Bir lebih lambat diabsorpsi daripada anggur (wine) dan anggur
lebih lambat daripada spritus. Hal ini karena minuman keras yang
mengandung karbon di absorpsi lebih cepat, karena senyawa
karbon dioksida dapat mengambil alih isi lambung. (Darmono,
2007)
Volume distribusi dari etanol mendekati volume cairan tubuh total
(0,5-0,71/kg). Pada sistem saraf pusat, konsentrasi etanol
meningkat dengan cepat. Otak mampu menampung sebagian besar
aliran darah dan etanol melewati membran biologi dengan cepat,
sehingga etanol sangat mudah menembus jaringan otak dan
plasenta. Selain itu, distribusi etanol antara alveolar paru dengan
darah sangat bergantung pada kecepatan difusi, tekanan gas dan
konsentrasi etanol dalam kapiler paru (Darmono, 2007; Masters,
A. Desain Penelitian
Penelitian ini merupakan penelitian eksperimental laboratorik yang
menggunakan metode rancangan acak lengkap dengan pola
Mann-Whitney. Penelitian ini menggunakan Tikus Putih (R. norvegicus) jantan
berumur 3-4 bulan dipilih secara acak menjadi 5 kelompok, digunakan
sebagai subjek penelitian.
B. Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Farmakologi Fakultas
Kedokteran Universitas Lampung. Penelitian dilaksanakan selama 14 hari
pada bulan Desember 2012. Perhitungan dosis propolis dilakukan di
laboratorium Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Lampung, sedangkan tempat penimbangan, pengukuran dan
pengamatan secara mikroskopis di lakukan di Laboratorium Patologi
C. Populasi dan Sampel
Populasi yang digunakan dalam penelitian ini adalah tikus putih (R
norvegicus) jantan dewasa galur Sprague Dawley berumur 3-4 bulan
yang diperoleh dari Fakultas Peternakan Institut Pertanian Bogor.
A. Klasifikasi Tikus Putih (R. norvegicus)
Hewan percobaan yang umum digunakan dalam penelitian ilmiah
adalah tikus. Tikus merupakan spesies pertama mamalia yang
didomestikasi untuk tujuan ilmiah karena memiliki daya adaptasi yang
baik. Tikus yang diproduksi sebagai hewan percobaan dan hewan
peliharaan adalah tikus putih (R. norvegicus). R. norvegicus
merupakan salah satu hewan percobaan yang paling sering digunakan
dalam penelitian, karena memiliki karakter fungsional yang baik
sebagai model bagi hewan mamalia (Hedrich, 2000).
Tabel 2. Klasifikasi tikus putih (R. norvegicus) (Myres dan Armitage 2004)
Kingdom Animalia
Filum Chordata
Kelas Mamalia
Ordo Rodentia
Subordo Sciurognathi
Famili Muridae
Sub-Famili Murinae
Genus Rattus
Spesies Rattus norvegicus
Galur/Strain Sprague Dawley
Sampel penelitian ini di tetapkan berdasarkan rumus Dahlan (2009). Pada
uji eksperimental ini, variabel yang diuji adalah numerik tidak
n = n = 2 ( Zα+ Z β) S x x
Dengan deviat baku alfa=Zα; deviat baku beta =Zβ; simpangan baku=S
dan perbedaan rerata gambaran mikroskopis ginjal diharapkan sebagai
( ).
Zα =1,96
Zβ =1,282
S = 0,459
( ) = 1, maka akan didapatkan hasil sebagai berikut:
n = n = 2 ( )
Maka jumlah minimal sampel perkelompok dibulatkan adalah 5 ekor tikus
per kelompok. Jadi sampel yang akan digunakan adalah berdasarkan
perhitungan, yaitu sejumlah 5 ekor tikus pada masing-masing kelompok
Kriteria inklusi:
a. Sehat (tidak tampak penampakan rambut kusam, rontok, atau botak,
dan bergerak aktif)
b. Memiliki berat badan sekitar 200-250 gram
c. Berjenis kelamin jantan
d. Berusia sekitar 3-4 bulan
Kriteria eksklusi :
a. Terdapat penurunan berat badan lebih dari 10 % setelah masa adaptasi
di laboratorium.
b. Mati selama pemberian perlakuan.
D. Bahan dan Alat Penelitian
1. Bahan Penelitian
Bahan penelitian yang digunakan yaitu: etanol 50% v/v dengan dosis
0,01 ml/grBB 1x sehari, larutan propolis dengan dosis 0,00009
ml/grBB 1x sehari, 0,00026 ml/grBB 1x sehari, dan 0,00078 ml/grBB
1x sehari, aquadest, tikus putih jantan dewasa galur Sprague Dawley,
pakan dan minum tikus dan larutan chloroform sebagai pembius
sebelum tikus di bedah.
2. Alat Penelitian
a. Neraca analitik Mettler Toledo dengan tingkat ketelitian 0,01 gr
untuk menimbang berat tikus dan ginjal tikus
b. Pigmomanometer dan timbangan electronic balance untuk
mengukur berat jenis dan dosis propolis
c. Spuit oral 1 cc dan 5 cc
d. Minor set untuk membedah perut tikus (laparotomi)
e. Kandang tikus
f. Botol minum tikus
g. Kapas
h. Alat untuk membuat preparat histologi (mikrotom, oven, cetakan
paraffin)
i. Alat untuk melihat histologi ginjal (deck glass, object glass,
mikroskop cahaya)
j. Larutan NaCl untuk mencuci ginjal Tikus putih setelah dilakukan
laparotomi
k. Tikus Putih (R. Norvegiccus)
E. Prosedur Penelitian
1. Prosedur Pemberian Dosis Propolis
Propolis yang digunakan dalam penelitian ini adalah propolis dari
salah satu merek dagang yaitu Mellia Nature Indonesia (MNI).
Penentuan dosis yang diberikan berdasarkan hasil konversi dari
manusia dengan berat badan 70 kg ke tikus dengan berat badan 200 gr
70 kg ke tikus dengan berat badan 200 gram adalah 0,018. Dosis
pemberian propolis pada orang dewasa dengan berat badan 70 kg
untuk pencegahan penyakit adalah 1-2 kali/hari 7 tetes. (anonymous,
2012).
1 tetes propolis setara dengan 0,03 mL, jadi 7 tetes propolis setara
dengan 0,21 mL. Pada penelitian ini akan menggunakan dosis 2
kali/hari 7 tetes yang setara dengan 0,42 mL propolis.
Dosis propolis pertama dan ketiga ditentukan berdasarkan standar
pengobatan herbal ASEAN, yaitu dosis paling rendah adalah 1/3 kali
dosis dan dosis paling tinggi adalah 3 kali dosis (Anonymous, 2006).
a. Untuk kelompok perlakuan I : 1/3 x 0,00026 ml/grBB = 0,00009
ml/grBB 1x sehari.
b. Untuk kelompok perlakuan II : 0,00026 ml/grBB 1x sehari.
c. Untuk kelompok perlakuan III : 3 x 0,00026 ml/grBB = 0,00078
ml/grBB 1x sehari.
Jadi, penelitian ini propolis sebanyak 0,00009 ml/grBB 1x sehari,
0,00026 ml/grBB 1x sehari, dan 0,00078 ml/grBB 1x sehari untuk
mengetahui adakah efek protektif dari pemberian propolis terhadap
ginjal tikus.
Dosis tikus = 0,042 mL x 70 kg x 0,018 = 2,94 x 0,018
2. Prosedur Pemberian Dosis Etanol
Dosis etanol yang digunakan dalam penelitian ini berdasarkan hasil
penelitian sebelumnya mengenai pemberian etanol kepada tikus.
Menurut penelitian Larasati (2011). Mengenai efek protektif madu
terhadap kerusakan hepar tikus yang diinduksi etanol. Dalam
penelitian tersebut, tikus Sprague dawley jantan diberikan etanol 50 %
(v/v) selama 14 hari dengan dosis 0,01 mL/grBB p.o. Pemberian
etanol 50% (v/v) dosis 0,01mL/grBB p.o tersebut menyebabkan sel
hati tikus mengalami nekrosis, fibrosis, infiltrasi sel inflamasi, dan
degenerasi lemak (Larasati, 2011).
Perhitungan volume pemberian etanol adalah 1 gram etanol sama
dengan 1 ml alkohol 100% (Schuckit, 1984). Jadi, jika konsentrasi
etanol yang diinginkan 50%, maka dalam 50% v/v 100 ml terdapat 50
gram etanol.
Dosis volume etanol tikus = × 100 = 10
Jadi, setiap tikus diberikan etanol 50% sebanyak 0,01 ml/grBB selama
14 hari 1,5 jam setelah pemberian propolis. Pemberian etanol 1,5 jam
setelah pemberian propolis agar lambung tikus telah kosong sehingga
3. Prosedur Perlakuan Penelitian
Prosedur perlakuan pada penelitian ini adalah:
a. Mengukur berat badan tikus sebelum perlakuan
b. Tikus sebanyak 25 dikelompokkan dalam 5 kelompok. Kelompok
I sebagai kontrol normal, dimana hanya diberikan aquades.
Kelompok II sebagai kontrol patologis, dimana diberikan etanol
50% 0,01 ml/grBB 1x sehari. Kelompok III adalah kelompok
perlakuan coba dengan dosis pemberian propolis 0,00009
ml/grBB 1x sehari, kelompok IV dengan dosis pemberian
propolis 0,00026 ml/grBB 1x sehari, dan kelompok V dengan
dosis pemberian propolis 0,00078 ml/grBB 1x sehari. Kemudian
selang 1,5 jam kelompok III, IV dan V diberikan induksi etanol
50% sebanyak 0,01 ml/grBB 1x sehari. Masing-masing diberikan
secara peroral selama 14 hari
c. Setelah 14 hari, perlakuan dihentikan
d. Pada hari ke-15 dinarkosis menggunakan kloroform
e. Kemudian dilakukan laparotomi, dan ginjal sebelah kanan dan
kiri diambil kemudian ditimbang untuk dibuat sediaan
mikroskopik dengan metode paraffin dan pewarnaan
Hematoksilin Eosin
f. Sampel ginjal tersebut kemudian difiksasi dengan formalin 10%.
Selanjutnya sampel ini di kirim ke lab patologi anatomi fakultas
kedokteran Unila untuk pembuatan sediaan mikrokopis jaringan
4. Prosedur Pembuatan Preparat Histopatologi (Akoso, 1999)
Adapun prosedur pembuatan preparat histologi, yaitu:
a. Fixation
Spesimen yang akan digunakan dalam larutan pengawet berupa
buffer formalin 10%
b. Trimming
Pada tahap trimming, specimen yang telah difiksasi kemudian
dipotong setebal 2-4 mm dan masukkan potongan jaringan
disesuaikan dengan ukuran dari besar kecilnya potongan. Setelah
itu, cuci dengan air mengalir.
c. Dehydration
Pada tahap ini dilakukan perendaman dalam alkohol 95% selama 2
jam. Kemudian potongan jaringan itu direndam dalam alkohol
absolut I selama 1 jam, 1 jam dalam alkohol absolut II, dan 1 jam
dalam alkohol absolut III
d. Clearing
Pada tahap clearing, dilakukan perendaman potongan jaringan
dalam sylol I. Setelah itu, direndam dalam xylol II dan xylol III.
e. Impregnation
Pada tahap impregnation, potongan jaringan diletakan dalam
paraffin I, kemudian dalam paraffin II dan paraffin III.
Masing-masing dilakukan selama 2 jam.
f. Embedding
Pada tahap ini sisa-sisa paraffin dibersihkan di dalam pan dengan
memanaskan pan beberapa saat di atas api dan diusap dengan
kapas. Lalu paraffin cair disiapkan dengan memasukkan cangkir
logam dan dimasukkan dalam oven dengan suhu di atas 58º C.
Kemudian paraffin cair dituangkan ke dalam pan, satu per satu
jaringan dipindahkan dariembedding cassetteke dasarpandengan
mengatur jarak satu dengan yang lainnya. Setelah itu, pan
diapungkan di dalam air. Bila pan telah dingin, paraffin yang
berisi jaringan tersebut dilepaskan dari pan dengan memasukkan
ke dalam suhu 4-6º C beberapa saat. Paraffin yang berisi jaringan
lalu dipotong sesuai letak jaringan yang ada menggunakan skapel
hangat. Kemudian diletakkan pada balok kayu dan pinggirnya
serta ujungnya dibuat sedikit meruncing. Blok paraffin siap
dipotong dengan mikrotom.
g. Cutting
Blok paraffin yang telah terbentuk didinginkan terlebih dahulu.
dingin. Dilakukan pemotongan kasar dan dilanjutkan pemotongan
halus dengan ketebalan 4-5 mikron. Setelah pemotongan, dipilih
lembaran jaringan yang paling baik, kemudian diapungkan di
dalam air dan kerutannya dihilangkan dengan cara menekan salah
satu sisi lembaran jaringan tersebut dengan ujung jarum dan sisi
lainnya ditarik menggunakan kuas yang runcing. Kemudian
lembaran jaringan tersebut dipindahkan ke dalam wadah water
bath selama beberapa detik sampai mengambang sempurna.
Lembaran tersebut diambil dengan slide bersih. Prosedur ini
dilakukan dengan gerakan menyendok. Lalu diletakan di tengah
atau pada sepertiga atas ataupun bawah. Usahakan jangan sampai
ada gelembung udara di bawah jaringan.
h. Staining(pewarnaan) dengan Harris Hematoksilin Eosin
Setelah jaringan melekat sempurna pada slide kemudian dipilih
yang terbaik. Selanjutnya secara berurutan slide dimasukkan ke
dalam zat kimia dibawah ini dengan waktu sebagai berikut :
1. Slide dimasukkan ke dalam xylol I, II, III. Masing-masing
dilakukan 5 menit.
2. Slide dimasukkan ke dalam alkohol absolut I, dan alkohol
absolut II. Masing-masing selama 5 menit.
4. Slide dimasukkan dalam bahan pewarna preparat harris
hematoksilin selama 20 menit, kemudian dicuci dengan
aquadest selama 1 menit.
5. Slide dimasukkan ke dalam acid alkohol sebanyak 2-3
celupan. Selanjutnya dimasukkan ke dalam aquadest selama 1
menit. Lalu slide dicuci dengan aquadest.
6. Slide dimasukkan ke dalam eosin selama 2 menit. Setelah itu,
dimasukkan ke dalam alkohol 96% I selama 2 menit, dan
alkohol 96% II selama 3 menit. Selanjutnya dicelupkan
kedalam alkohol absolut III dan alkohol absolut IV.
Masing-masing dilakukan selama 3 menit.
7. Slide dicelupkan ke dalam xylol IV. Lalu ke dalam xylol V.
Masing-masing dilakukan selama 5 menit.
i. Mounting
Setelah proses pewarnaan selesai, slide ditempatkan diatas kertas
tisu pada tempat datar. Slide diteteskan dengan bahan mounting
yaitu kanada balsam. Kemudian ditutup menggunakan cover glass.
Lakukan secara hati-hati agar tidak terbentuk gelembung udara
dibawah jaringan.
j. Pembacaan slide dengan mikroskop
Slide diperiksa di bawah mikroskop sinar dengan pembesaran
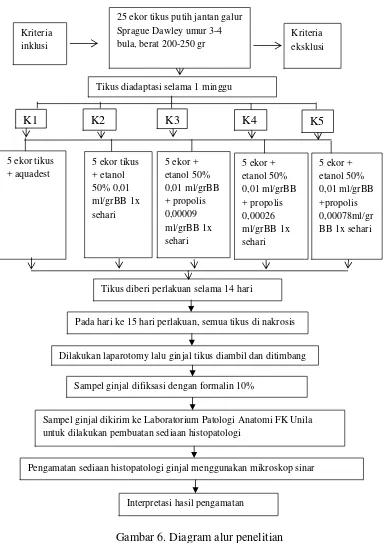
F. Alur penelitian
Gambar 6. Diagram alur penelitian 25 ekor tikus putih jantan galur
Sprague Dawley umur 3-4 bula, berat 200-250 gr Kriteria
inklusi
Kriteria eksklusi
Tikus diadaptasi selama 1 minggu
Tikus diberi perlakuan selama 14 hari 5 ekor + etanol 50% 0,01 ml/grBB + propolis 0,00026 ml/grBB 1x sehari 5 ekor +
etanol 50% 0,01 ml/grBB + propolis 0,00009 ml/grBB 1x sehari 5 ekor tikus
+ etanol 50% 0,01 ml/grBB 1x sehari 5 ekor tikus
+ aquadest 5 ekor +etanol 50%
0,01 ml/grBB +propolis 0,00078ml/gr BB 1x sehari
Pada hari ke 15 hari perlakuan, semua tikus di nakrosis
Interpretasi hasil pengamatan
Pengamatan sediaan histopatologi ginjal menggunakan mikroskop sinar Dilakukan laparotomy lalu ginjal tikus diambil dan ditimbang
Sampel ginjal difiksasi dengan formalin 10%
Sampel ginjal dikirim ke Laboratorium Patologi Anatomi FK Unila untuk dilakukan pembuatan sediaan histopatologi
K3 K4 K5
G. Identifikasi Variabel dan Definisi Operasional Variabel
1. Identifikasi Variabel
a. Variabel Independen
Variabel independen adalah dosis pemberian propolis.
b. Variabel Dependen
Variabel dependen adalah gambaran histopatologi padaginjal tikus.
2. Definisi Operasional Variabel
Untuk memudahkan penelitian dan agar penelitian tidak menjadi
Tabel 3. Definisi operasional
Variabel Definisi Skala
Dosis propolis Dosis efektif tengah propolis adalah 0,00026 mL/grBB 1x sehari
- Kelompok I (kontrol negatif ) = pemberian aquades - Kelompok II (kontrol positif ) = pemberian etanol
0,01 mL/gr BB 1x sehari
- Kelompok III (perlakuan coba) = pemberian propolis 0,00009 mL/grBB + etanol 0,01 mL/grBB 1x sehari - Kelompok IV (perlakuan coba) = pemberian propolis
0,00026 mL/grBB + etanol 0,01 mL/grBB 1x sehari - Kelompok V (perlakuan coba) = pemberian propolis
0,00078 mL/grBB + etanol 0,01 mL/grBB 1x sehari
Katagorik
Gambaran Histopatologi ginjal
Sediaan mikroskopik diamati secara langsung
Bagian yang diamati adalah perubahan histopatologis ginjal tikus dilihat dengan melakukan pengamatan sediaan histopatologi dengan menggunakan mikroskop cahaya dengan perbesaran 100x dan 400x pada 10 lapang pandang. Kerusakan tubulus proksimal ditandai dengan adanya pembengkakan sel.
a. Normal skor 0. Tidak ada perubahan gambaran histopatologis
b. Kerusakan ringan skor 1. Ditemukan adanya pelebaran pada vaskuler ginjal
c. Kerusakan sedang skor 2: Ditemukan adanya pelebaran tubulus proksimal
d. Kerusakan berat skor 3: Ditemukan adanya kerusakan pada epitel tubulus proksimal
• Data skor tersebut dibuat rata-rata untuk setiap tikus
H. Analisis Data
Hasil penelitian akan dianalisis apakah memiliki distribusi normal atau
tidak secara statistik dengan uji normalitas Shapiro-Wilk karena jumlah
sampel ≤50. Kemudian, dilakukan uji Levene untuk mengetahui apakah
dua atau lebih kelompok data memiliki varians yang sama atau tidak. Jika
varians data berdistribusi normal dan homogen, dilanjutkan dengan
metode uji parametrikone wayANOVA. Bila data tidak normal homogen
atau normal tidak homogen dilakukan transformasi selanjutnya bila
didapatkan nilai normal homogen, dilanjutkan dengan metode uji
parametrik, apabila ditemukan data tidak normal homogen atau normal
tidak homogen, dilakukan uji nonparametrik Kruskal-Wallis. Hipotesis
dianggap bermakna bilap <0,05. Jika pada uji ANOVA atau
Kruskal-Wallis menghasilkan nilai p <0,05, maka dilanjutkan dengan melakukan
analisis Mann-Whitney untuk melihat perbedaan antar kelompok
(Skripsi)
Oleh
MUHAMAD IQBAL TAFWID
PROGRAM STUDI PENDIDIKAN DOKTER UNIVERSITAS LAMPUNG
DAFTAR GAMBAR... DAFTAR TABEL... I. PENDAHULUAN
A. Latar Belakang ...
B. Rumusan Masalah ...
C. Tujuan Penelitian ...
D. Manfaar Penelitian ………..
E. Kerangka Penelitian ...
1. Kerangka Teoritis ……….
2. Kerangka Konsep ...
F. Hipotesis……….
II. TINJAUAN PUSTAKA
A. Ginjal ...
1. Anatomi GinjalTikus ………..
2. Histologi Ginjal………
3. Fisiologi Ginjal ………
B. Propolis ...
1. Kandungan Senyawa Aktif Propolis………
4. Dosis, dan Toksisitas Propolis ……….
C. Etanol ...
1. Efek Etanol Terhadap Tubuh………...
2. Absorbsi dan Distribusi Etanol ………
III. METODE PENELITIAN
A. Desain Penelitian ...
B. Tempat dan Waktu ...
C. Populasi dan Sampel ...
D. Bahan dan Alat Penelitian ...
1. Bahan Penelitian ………..
2. Alat Penelitian ………..
E. Prosedur Penelitian ...
1. Prosedur Pemberian Propolis ………...
2. Prosedur Pemberian Dosis Etanol ………
3. Prosedur Perlakuan Penelitian ……….
4. Prosedur Pembuatan PreparatHistopatologi ………
F. Alur Penelitian………..
G. Identifikasi Variabel dan Definisi Operasional ……….
1. Identifkasi Variabel ………..
2. Definisi Operasional Variabel ………..
IV. HASIL DAN PEMBAHASAN
A. Hasil ………
1. Rata-Rata Kerusakan Ginjal Tikus ………
2. Gambaran Histopatologi Ginjal Tikus ……….
a. Kelompok kontrol normal ………
b. Kelompok Kontrol Patologis ………...
c. Kelompok perlakuan etanol 50% 0,01 ml/grBB +
propolis 0,00009 ml/grBB 1x sehari ………
d. Kelompok perlakuan etanol 50% 0,01 ml/grBB +
propolis 0,00026 ml/grBB 1x sehari………
e. Kelompok perlakuan etanol 50% 0,01 ml/grBB +
propolis 0,00078 ml/grBB 1x sehari………
B. Pembahasan ………..
V. KESIMPULAN DAN SARAN ………
A. Kesimpulan ………..
B. Saran ……….
DAFTAR PUSTAKA
49
49
50
51
52
53
54
55
56
64
64
Tabel
1. Komposisi Propolis ...
2. Klasifikasi Tikus Putih (R Norvegicus) ...
3.Definisi Operasional ………...
Halaman
15
34
Gambar
1. Diagram alur Kerangka Teori ...
2. Kerangka konsep penelitian ...
3. Anatomi Ginjal Tikus ...
4. Histologi Ginjal ...
5. Struktur Kimia Propolis ...
6. Diagram alur penelitian ...
7. Diagram rata-rata skor gambaran ginjal tikus ……….
8. Histologi ginjal tikus kelompok kontrol normal………...
9. Histologi ginjal tikus kelompok kontrol patologis………..
10. Histopatologi ginjal tikus kelompok perlakuan etanol 50% 0,01
ml/grBB + propolis 0,00009 ml/grBB 1x sehari………...
11. Histopatologi ginjal tikus kelompok perlakuan etanol 50% 0,01
ml/grBB + propolis 0,00026 ml/grBB 1x sehari………...
12. Histopatologi ginjal tikus kelompok perlakuan etanol 50% 0,01
ml/grBB + propolis 0,00078 ml/grBB 1x sehari………..
Halaman
5
6
9
12
16
45
50
51
52
53
54
Amic, D D. Amic, D Besio, and N. Trinajstic. 2003. Structure-Radical Scavenging Activity Realtionships of Flavonoids. Croatica Chamica ActaCCACAA 78 (1) 55-61
Bankova V, Popova M. 2007. Propolis of stingless bee: a promising source of biologically active compounds. Pharmacognosy Reviews1: 88-92.
Barclay GA., Jamie B, Stephen S, Chris D, Eilish G. 2008. Adverse Physical Effects Of Alcohol Misuse.Royal College of Psychiatric.UK
Boggan, B. 2003, Alcohol, Chemistry and You. Effects of Ethyl Alcohol on Organ Function
Borrelli, F., Maffia, P., Pinto, L., Ianaro, A., Russo, A., Capasso, F., Ialenti, A. 2002.Phytochemical compounds involved in the anti-inflammatory effect
of propolis extract. Fitoterapia 73(1):53–63.
Brzóska, M. M., Moniuszko-Jakoniuk, J., Jurczuk, M. and Ga3a.yn-Sidorczuk, M. (2002) Cadmium turnover and changes of zinc and copper body status of rats continuously exposed to cadmium and ethanol.Alcohol and Alcoholism37, 213–221.
Burdock GA. 1998. Review of the biological properties and toxicity of bee propolis (propolis). Food and Chemical Toxicology36: 347-363.
Chandrasoma, P dan Taylor, C. R. 2005.Ringkasan Patologi Anatomi. EGC:
Jakarta
Dahlan, Muhamad sopiyudin (2009). Statistik untuk Kedokteran dan Kesehatan: Deskripif, Bivariat dan Multivariat, Dilengkapi dengan Menggunakan SPSS. Jakarta: Salemba Medika
Cadenas, E., Packer, L. 2002 (c). Expanded Caffeic Acid and Related Antioxidant Compound: Biochemical and Cellular Effects.Handbook of Antioxidants. Second edition. California : Marcel Dekker, Inc. p.
279-303.
Darmono. 2000. Toksisitas Alkohol. http://www.geocities.com/kuliah
farm/farmasi_forensik/alkohol.doc. Diakses Oktober 2012
Das, M., D.R. Bickers, and H. Mukhtar, 1984, Plant Fenols as in vitro Inhibitors of Glutathione S-Transferase, Biochem. Biophys. Res. Commun., 120
(2), 427-433.),
Decastro S & Higashi KO. 1995. Effect of different formulations of propolis on mice infected with Trypanossoma cruzi. J. Ethnopharmacol, 46:55-58.
Eroschenko, Victor P. 2003. Atlas Histologi di Flore dengan Korelasi Fungsional. Ahli Bahasa: Jan Tambayong. Jakarta: EGC.
Fleming, M., S.J. Mihic, dan R. A. Harris. 2007. Etanol.Dasar Farmakologi Terapi. EGC : Jakarta
Galvao J. 2007. Biological therapy using propolis as nutritional supelemen in cancer treatment.Int J Cancer Res, 3(1):43-53
Gartner J. P., Hiatt J. L. 2007. Color Text Book of Histology. 3th ed. Philadelphia: Elsevier Saunders, pp: 437-45.
Geckil H, Ates B, Durmaz G, Erdogan,S & Yilmaz I. 2005. Antioxidant, free radical scavenging and metal chelating characteristic of propolis.Am J Biochemist Biotech, 1(1):27-31.
Gray H.Anatomy of the human body, 27th edition. Philadelphia: Lea and Febiger.
1995
Gheldof, N., Wang, X.H., Engeseth, N.J. 2002.Identification and quantification
of antioxidant components of honeys from various floral sources.J Agric Food Chem50:5870–7.
Gunawan. 2010, Pengaruh Pemberian Alkohol Terhadap Derajat Nekrosis Ginjal Tikus Putih Galur Wistar. Perpustakaan Universitas Islam Sultan Agung Guyton AC, Hall JE. ; 2004. Buku ajar fisiologi kedokteran. Edisi 10. Jakarta:
EGC.
Hedrich HJ. 2000. History, Strains, and Models. Di dalam: Krinke Gj. The Laboratory Rats. California: Academic Press.
Herlina. 2011. Pengaruh Pemberian Vitamin E Terhadap Gambaran Histologis Testis dan Jumlah Sel Sperma Mencit (Mus musculus,L.) yang Dipapari
Tuak (Alkohol)
Junqueira LC, Carneiro J, Kelly RO.Histologi dasar. 8th ed. Jakarta: EGC; 2007
Khakim JL. 2007. Pengaruh Jus Buah Pepaya (Carica papaya) terhadap Kerusakan Histologis Lambung Mencit yang Diinduksi Aspirin.
Krell, R. 1996. Value-Added Produc t s From Bee keeping; FAO Agricultural Services Bullte in No. 1 2 4 .Food and Agriculture Organization of the United Nations Rome 1996.www.fao.org/docrep.htm. Diakses tanggal :
14 Januari 2013.
Kumazawa S, Hamasaka T & Nakayama T. 2004. Antioxidant activity of propolis of various geographic origins. Food chemist, 84:329-39.
Manggarwati, Andiana, F , Neni, Susilaningsih. 2010, UJi Toksisitas Subkronis Ekstrak Valerian Pada Tikus Wistar. Studi Terhadap Gambaran Mikroskopis Ginjal Kadar KreatininFakultas Universitas Diponegoro.
Masters, S. B. 2002.Farmakologi Dasar dan Klinik Katzung : Alkohol. Salemba
Medika: Jakarta
Mirzoeva, O.K., Calder, P.C. 1996. The effect of propolis and its components on eicosanoid production during the inflammatory response. Prostaglandins Leukot Fatty Aci