Kappaphycus alvarezii
ARIS MUNANDAR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
*Dengan ini saya menyatakan bahwa tesis berjudul “Purifikasi dan Karakterisasi Protein Antibakteri dan Antikanker dari Kapang Xylaria psidii KT30 yang Diisolasi dari Rumput Laut Kappaphycus alvarezii” adalah benar karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Aris Munandar
NIM C351110051
*
RINGKASAN
ARIS MUNANDAR. Purifikasi dan Karakterisasi Protein Antibakteri dan Antikanker dari Kapang Xylaria psidii KT30 yang Diisolasi dari Rumput Laut Kappaphycus alvarezii. Dibimbing oleh KUSTIARIYAH TARMAN, TATI NURHAYATI, dan APON ZAENAL MUSTOPA.
Protein kapang KT30 dapat menghambat bakteri Bacillus pumilus BTCCB530, Listeria sp. BTCC B693, Salmonella typhi P2KIM Collection, Staphylacoccus aureus P2KIM Collection, dan Pseudomonas sp. BTCC B675. Protein tersebut juga mempunyai aktivitas antikanker terhadap sel HeLa (kanker serviks) dengan IC50 264,7 μg/mL. Aktivitas antibakteri dan antikanker protein yang dihasilkan kapang KT30 masih belum optimal sehingga perlu dilakukan upaya untuk meningkatkan aktivitasnya secara bertahap dari optimasi pertumbuhan, purifikasi, dan karakterisasi protein tersebut.
Penelitian ini dibagi menjadi tiga tahap yaitu optimasi pertumbuhan kapang KT30, purifikasi protein, uji aktivitas antikanker dan karakterisasi protein. Optimasi pertumbuhan dilakukan dengan kombinasi perlakuan konsentrasi NaCl dan waktu panen. Pengendapan dilakukan dengan saturasi 60%-90% pada setiap 100 mL supernatan kapang KT30. Kromatografi filtrasi gel dilakukan dengan fase diam Sephadex G-50 dan fase gerak metanol 30%. Uji antibakteri dilakukan pada fraksi amonium sulfat, supernatan, dan fraksi protein untuk mendapatkan fraksi aktifnya. Uji antikanker terhadap sel Chang (sel hati) dan sel HeLa (kanker serviks) dilakukan dengan metode MTT sitotoksik. Kadar protein diuji menggunakan bicinchoninic acid (BCA) protein assay kit. Karakterisasi protein kapang KT30 meliputi bobot molekul dan stabilitas terhadap suhu, pH, enzim, inhibitor, dan detergen.
Pertumbuhan kapang KT30 paling optimum terdapat pada perlakuan NaCl 0% dengan waktu panen hari ke-15 dan memiliki aktivitas antibakteri terhadap bakteri Escherichia coli NBRC 14237 dan Bacillus subtilis BTCC 2530 dengan diameter zona hambat sebesar 2,33 mm dan 1,3 mm. Pengendapan protein kapang KT30 paling optimum terdapat pada konsentrasi amonium sulfat 90% dengan rendemen sebesar 1,67 g/100 mL. Fraksi amonium sulfat tersebut memiliki aktivitas antibakteri tertinggi terhadap bakteri E. coli dan B. subtilis dengan diameter zona hambat sebesar 2 mm. Fraksi protein 11 dan 12 dari kapang KT30 merupakan fraksi aktif dengan aktivitas antibakteri tertinggi terhadap B. subtilis dan E. coli sebesar 2 mm.
Hasil uji antikanker terhadap sel Chang dan sel HeLa menunjukkan bahwa protein KT30 bersifat tidak toksik. Berdasarkan perhitungan, nilai IC50 fraksi amonium sulfat 90% dan fraksi 11-12 adalah 670,86 dan 1451,68 µg/mL. Fraksi amonium sulfat 90% dan fraksi 11-12 memiliki kadar protein sebesar 9,013 dan 0,604 mg/mL. Fraksi 11-12 kapang KT30 memiliki bobot molekul masing-masing sebesar 23,42 kDa, 20,09 kDa, dan 14,33 kDa. Protein kapang KT30 stabil pada suhu 60°C setelah pemanasan 30 menit dan kisaran pH 6 – 12, serta enzim pepsin, tripsin, dan lisozim tapi tidak stabil terhadap inhibitor EDTA serta detergen tween 20, SDS, dan triton X-100.
SUMMARY
ARIS MUNANDAR. Purification and Characterization of Antibacterial and Anticancer Protein of Fungus Xylaria psidii KT30 Isolated from Kappaphycus alvarezii. Supervised by KUSTIARIYAH TARMAN, TATI NURHAYATI, and APON ZAENAL MUSTOPA.
The protein of an algicolous fungus KT30 inhibited Bacillus pumilus BTCC B530, Listeria sp. BTCC B693, Salmonella typhi P2KIM Collection, Staphylacoccus aureus P2KIM Collection, and Pseudomonas sp. BTCC B675. The protein also showed anticancer activity against HeLa cell line (cervical cancer) with IC50 264.7 μg/mL. Antibacterial and anticancer activities of protein were produced by fungus KT30 still less optimal, therefore it is necessary to improve the protein activity gradually from optimize of fungal growth, purification and characterization of protein were performed.
This research was carried out in three steps, including optimize of fungal growth, purification of protein, anticancer activity assay and characterization of the protein. Optimise of growth was done with combination of NaCl concentration and harvest day. Precipitation was done by with 60%-90% on each 100 mL supernatant of fungus KT30. Gel chromatography filtration was done by Sephadex G-50 with methanol 30% as mobile phase. Antibacterial activities was done on fraction ammonium sulfat, supernatant, and protein fraction to get active fraction. Anticancer against Chang cell line (liver cell) and HeLa cell line (cervical cancer) was done by MTT cytotoxic method. Protein concentration assay was done by bicinchoninic acid (BCA) protein assay kit. Characterization of protein of fungus KT30 including molecular weight, and stability to temperature, pH, enzyme, inhibitor, and detergent.
The optimal of fungal growth was obtained on NaCl 0% after 15 days cultivation and showed antibacterial activity against Escherichia coli NBRC 14237 and Bacillus subtilis BTCC 2530 with diameter of clear zones were 2.33 mm and 1.3 mm. The optimal protein precipitation showed after 90% saturation of ammonium sulfat with yield 1.67 g/100 mL. Fraction ammonium sulfat showed the highest antibacterial activity against E. coli and B. subtilis with diameter of clear zone 2 mm. Fractions 11 and 12 were the most active ones against B. subtilis and E. coli i.e 2 mm.
Anticancer assay showed protein of fungus KT30 was not toxic against Chang cell line and HeLa cell line. Based on calculation, IC50 value protein of fraction ammonium sulfat 90% and fractions 11-12 were 670.86 and 1451.68 µg/mL. The protein concentration of fraction ammonium sulfat 90% and fractions 11-12 were 9.013 and 0.604 mg/mL. Three bands were detected from the fractions 11-12 indicated molecular weights of 23.42 kDa, 20.09 kDa, and 14.33 kDa. The proteins of the fungus were stable on 60oC after 30 minutes of heating and pH 6-10. The proteins were stable on pepsin, trypsin, and lysozyme but not stable to EDTA, detergent, tween 20 SDS, and Triton X-100.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB
PURIFIKASI DAN KARAKTERISASI PROTEIN
ANTIBAKTERI DAN ANTIKANKER DARI KAPANG
Xylaria
psidii
KT30 YANG DIISOLASI DARI RUMPUT LAUT
Kappaphycus alvarezii
ARIS MUNANDAR
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Purifikasi dan Karakterisasi Protein Antibakteri dan Antikanker dari Kapang Xylaria psidii KT30 yang Diisolasi dari Rumput Laut Kappaphycus alvarezii
Nama : Aris Munandar NIM : C351110051
Disetujui oleh
Komisi Pembimbing
Ketua
Dr Kustiariyah Tarman, SPi, MSi
Dr Tati Nurhayati, SPi, MSi
Anggota Anggota
Dr A. Zaenal Mustopa, MSi
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Hasil Perairan
Dr Tati Nurhayati, SPi, M.Si Dr Ir Dahrul Syah, M.Sc, Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Shalawat serta salam semoga tercurahkan kepada Nabi Muhammad SAW beserta keluarga dan para sahabat-sahabatnya. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari sampai September 2013 ialah protein bioaktif, dengan judul Purifikasi dan Karakterisasi Protein Antibakteri dan Antikanker dari Kapang Xylaria psidii KT30 yang Diisolasi dari Rumput Laut Kappaphycus alvarezii. Penelitian ini merupakan bagian penelitian Pengembangan Protein Antikanker dari Kapang Endofit Indigenous Laut Indonesia Xylaria psidii KT30 yang didanai Kementrian Riset dan Teknologi melalui Program Insentif Riset Sinas (RD-2012-718; RD-2013-0552). Penulis mengucapkan terima kasih kepada:
1. Ibu Dr rer nat Kustiariyah Tarman, SPi, MSi, Ibu Dr Tati Nurhayati, SPi, MSi, dan Bapak Apon Zaenal Mustopa, MSi yang telah mengarahkan selaku komisi pembimbing
2. Ibu Dr Ir Linawati Hardjito, MS yang telah memberikan masukan selaku penguji luar komisi
3. Istri (Siti Nuralipah) dan Anakku (Khadafi Darul Alifi Maqbulah) tercinta atas do’a, kasih sayang, kesabaran, dan semangat yang diberikan
4. Bapak (Endang Supanda, SPd), Mamah (Popon Tursini, SPd), Abi (KH. Aan Andi), Umi (Hj. Wawat Fatmawati), Adik-adikku (Nie, Ani, Tengku, Bakar, Nawa, Ubah, dan Aulia) serta seluruh keluarga atas doa dan kasih sayangnya (keluarga besar yang luar biasa)
5. Ibu Linda Sukmarini, MEng, Ibu Rifqiyah Nurumami, MS, Bapak Muhammad Ridwan, SFarm, Bapak Erik Firdian, Bapak Kurniawan, Dwianty Putri Meitasari, SPt, Hana Nurullita Prestisia, SPi, Fakhrul Umam, Yunita Sari, Ike Rahmawati, SSi, Adyos Bobby Chandra, MSi, dan Aksar Chair Lages, SPi atas bantuan dan masukannya selama penelitian
6. Yulia Oktavia, Made Suhandana, Aulia Andhikawati, Patmawati, Aidil Fadlihamdi, dan Mita Gabriella Inthe atas bantuan dan masukannya selama penelitian dan penulisan
7. Pascasarjana THP 2011 dan 2010 atas bantuan dan dukungannya selama ini 8. Rektor Universitas Sultan Ageng Tirtayasa, Dekan Fakultas Pertanian, Ketua
Program Studi Perikanan, rekan-rekan di Fakultas Pertanian atas dukungannya, dan seluruh pihak yang telah membantu selama penelitian.
Semoga penulisan karya ilmiah ini dapat bermanfaat bagi penulis dan seluruh pihak.
Bogor, Februari 2014
DAFTAR ISI
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
1 PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan dan Manfaat Penelitian ... 3
2 OPTIMASI PERTUMBUHAN DAN AKTIVITAS ANTIBAKTERI KAPANG Xylaria psidii KT30 ... 4
Pendahuluan ... 4
Bahan dan Metode ... 5
Hasil dan Pembahasan ... 7
Simpulan ... 8
3 PURIFIKASI PROTEIN ANTIBAKTERI DARI KAPANG Xylaria psidii KT30 ... 10
Pendahuluan ... 10
Bahan dan Metode ... 11
Hasil dan Pembahasan ... 12
Simpulan ... 14
4 KARAKTERISASI DAN AKTIVITAS PROTEIN ANTIKANKER DARI KAPANG Xylaria psidii KT30 ... 15
Pendahuluan ... 15
Bahan dan Metode ... 15
Hasil dan Pembahasan ... 18
Simpulan ... 23
5 PEMBAHASAN UMUM ... 24
6 SIMPULAN UMUM DAN SARAN ... 27
Simpulan Umum ... 27
Saran ... 27
DAFTAR TABEL
2.1 Komposisi bahan dan estimasi jumlah bakteri pada standar McFarland ... 6
3.1 Rendemen protein fraksi amonium sulfat kapang X. psidii KT30 pada saturasi berbeda ... 12
4.1 Pembuatan larutan standar BSA dengan konsentrasi 20-2000 µg/mL 17
4.2 Konsentrasi separating dan stacking gel ... 17
4.3 Kadar protein kapang X. psidii KT30... 20
4.4 Stabilitas protein kapang X. psidii KT30 pda suhu, pH, detergen, inhibitor, dan enzim ... 22
DAFTAR GAMBAR
1 Kerangka pemikiran ... 32.1 Biomassa kapang Xylariapsidii KT30 yang ditumbuhkan pada media dengan salinitas berbeda ... 7
2.2 Aktivitas antibakteri X. psidii KT30 yang dikultur pada salinitas berbeda ... 9
3.1 Aktivitas antibakteri fraksi amonium sulfat dan supernatan kapang X.psidii KT30 pada saturasi yang berbeda ... 13
3.2 Aktivitas antibakteri fraksi protein kapang X. psidii KT30 terhadap bakteri patogen ... 14
4.1 Sel Chang dan HeLa pada uji antikanker ... 19
4.2 Bobot molekul protein kapang Xylaria psidii KT30 ... 21
5.1 Pertumbuhan kapang Xylaria psidii KT30 pada media berbeda ... 24
5.2 Protein fraksi amonium sulfat kapang Xylaria psidii KT30 ... 25
DAFTAR LAMPIRAN
1 Komposisi media PDA ... 332 Komposisi media PDB ... 33
3 Hasil uji statistik interaksi perlakuan konsentrasi NaCl dan waktu panen ... 33
4 Hasil uji statistik perbedaan amonium sulfat ... 34
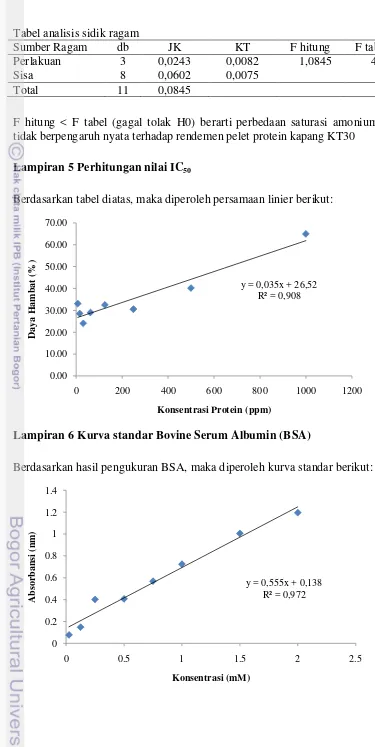
5 Perhitungan nilai IC50 ... 35
6 Kurva standar Bovine Serum Albumin (BSA) ... 35
7 Perhitungan bobot molekul ... 36
8 Aktivitas antibakteri kapang KT30 ... 36
1 PENDAHULUAN
Latar Belakang
Frekuensi infeksi yang disebabkan oleh mikroorganisme patogen di dunia semakin meningkat dan menjadi penyebab kematian terutama di negara berkembang (Khan et al. 2007;Mukhtar dan Ghori 2012). Agen antimikroba telah banyak ditemukan, tetapi mikroorganisme patogen menjadi semakin resisten. Menurut Kwong et al. (2010) agen infeksi memiliki potensi menginfeksi manusia pada bagian yang berbeda-beda. Bakteri Streptococcus pneumonia menjadi penyebab penyakit tertinggi diikuti oleh Escherichia coli dan Staphylacoccus aureus. Secara umum, infeksi bakteri pada perempuan jumlahnya lebih tinggi dibandingkan laki-laki. Selain infeksi mikroorganisme patogen, jenis penyakit yang semakin meningkat di dunia adalah kanker.
Penderita kanker di dunia pada tahun 2008 mencapai 12,662 juta dan 7,564 juta diantaranya meninggal dunia. Jenis kanker yang menyebabkan tingginya angka kematian pada perempuan adalah kanker leher rahim (serviks). Kanker serviks di dunia mencapai 530 ribu kasus (4,2%) dan di wilayah Asia Tenggara angka kematiannya mencapai 8,3% (Ferlay et al. 2010). Menurut WHO
(2008), 136 laki-laki dan 109 perempuan pada tiap 100 ribu populasi penduduk di Indonesia meninggal dunia akibat kanker. Prevalensi penyakit kanker di Indonesia mencapai 0,4% berdasarkan diagnosis oleh tenaga kesehatan. Pada
tahun 2004, kasus kanker serviks di Indonesia mencapai 3.818 (13%), dan 193 diantaranya meninggal dunia (BPPK 2008).
Kanker merupakan penyakit dimana kontrol pertumbuhan hilang dari satu atau lebih sel yang mengarah menjadi massa padat (Thurston 2006). Kanker
serviks disebabkan infeksi Human Papillomavirus (HPV) yang diawali dalam sel pada permukaan leher rahim. Pengendalian penyakit kanker serviks, skrining, dan pengobatan dilakukan berdasarkan prinsip-prinsip epidemiologik. Kebijakan pengendalian penyakit kanker di Indonesia diperkuat dengan terbitnya keputusan Menteri Kesehatan nomor 1163/Menkes/SK/X/2007 tentang kelompok kerja pengendalian penyakit kanker serviks dan payudara. Deteksi lesi-kanker menjadi kanker membutuhkan waktu sekitar 10 tahun sehingga dapat dilakukan pencegahan menjadi kanker (Dwipoyono 2009).
Pencegahan penyakit yang disebabkan infeksi mikroorganisme patogen dan kanker dapat dilakukan menggunakan bahan alam. Makro dan mikroorganisme menghasilkan metabolit sekunder yang memiliki aktivitas biologis. Menurut Soemiati (2009), sumber bahan alam dapat diperoleh dari biota laut misalnya kapang laut endofit. Kapang laut endofit memiliki aktivitas antibakteri dan antikanker sehingga dapat dijadikan sumber untuk bahan obat.
terhadap E. coli, Bacillus sp., Staphylacoccus aureus, dan Pseudomonas aeruginosa (Selim et al. 2012).
Hasil penelitian beberapa tahun terakhir juga menunjukkan adanya aktivitas antikanker dari kapang laut. Menurut Atalla et al. (2008) kapang Varicosporina ramulosa menghasilkan senyawa ergosterol yang efektif menghambat 50% sel kanker hati dan paru-paru pada konsentrasi 99,7 dan 74,9 μg/mL. Nursid et al.
(2010) melaporkan bahwa metabolit sekunder kapang MFW-01-08 dari ascidia
Aplidium longithorax memiliki aktivitas sitotoksik terhadap sel kanker payudara T47D dengan nilai IC50 sebesar 92,6 μg/mL. Kapang Emericella nidulans dilaporkan oleh Nursid et al. (2011) dapat memproduksi emestrin (C27H21N2S2) yang juga memiliki efek sitotoksik terhadap sel kanker payudara T47D dengan nilai IC50 sebesar 1,8 μg/mL.
Kapang endofit Xylaria psidii KT30 diisolasi dari rumput laut Kappaphycus alvarezii yang biasa dimanfaatkan sebagai penghasil karaginan. Kapang KT30 menghasilkan metabolit sekunder yang mempunyai aktivitas antibakteri dan antikanker. Ekstrak etil asetat dari kapang KT30 memiliki aktivitas antibakteri terhadap bakteri patogen pada manusia dan ikan. Kapang KT30 juga memiliki aktivitas antikanker terhadap human bladder carcinoma cell line 5637 (ATCC HTB-9) (kanker kandung kemih) dengan nilai IC50 sebesar 4 μg/mL (NaCl 0%) dan 14 μg/mL (NaCl 3%) (Tarman et al. 2011). Menurut Tarman et al. (2012), protein ekstraseluler yang diekstrak dari media kultur kapang KT30 juga memiliki aktivitas antibakteri dan antikanker. Protein kapang KT30 dapat menghambat bakteri Bacillus pumilus BTCC B530, Listeria sp. BTCC B693, Salmonella typhi
P2KIM Collection, Staphylacoccus aureus P2KIM Collection, dan
Pseudomonas sp. BTCC B675. Protein tersebut juga mempunyai aktivitas antikanker terhadap sel HeLa (kanker serviks) dengan IC50 264,7 μg/mL.
Protein memiliki aktivitas biologis sehingga dapat dijadikan sumber bahan obat alami. Protein tersebut berperan sebagai antibakteri, antifungal, dan antikanker (Rodrigues et al. 2009; Zheng et al. 2010). Aktivitas antibakteri dan antikanker protein yang dihasilkan kapang KT30 masih belum optimal sehingga perlu dilakukan upaya untuk meningkatkan aktivitas protein tersebut (Tarman
et al. 2012). Peningkatan aktivitas dari protein kapang KT30 dilakukan bertahap mulai dari optimasi pertumbuhan, purifikasi, dan karakterisasi protein tersebut.
Perumusan Masalah
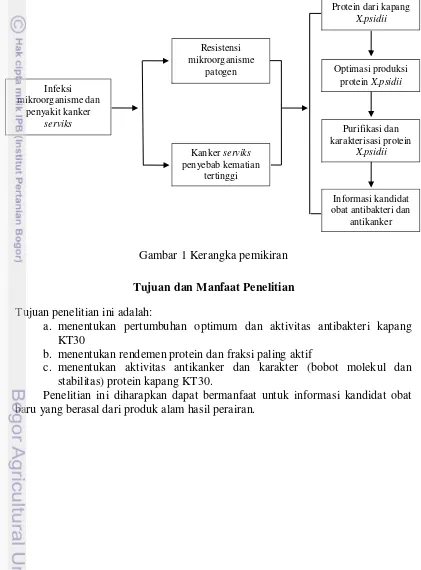
rendemen dan aktivitas yang tinggi. Protein yang dihasilkan kemudian dipurifikasi untuk mendapatkan protein yang murni. Protein tersebut dikarakterisasi untuk mengetahui sifatnya misal stabilitasnya terhadap suhu, pH, enzim, detergen, inhibitor, dan bobot molekulnya. Protein tersebut diuji antibakteri dan antikanker untuk mengetahui aktivitasnya. Perumusan masalah disajikan dalam kerangka pemikiran pada Gambar 1.
Gambar 1 Kerangka pemikiran
Tujuan dan Manfaat Penelitian
Tujuan penelitian ini adalah:
a. menentukan pertumbuhan optimum dan aktivitas antibakteri kapang KT30
b. menentukan rendemen protein dan fraksi paling aktif
c. menentukan aktivitas antikanker dan karakter (bobot molekul dan stabilitas) protein kapang KT30.
Penelitian ini diharapkan dapat bermanfaat untuk informasi kandidat obat baru yang berasal dari produk alam hasil perairan.
Infeksi mikroorganisme dan
penyakit kanker serviks
Resistensi mikroorganisme
patogen
Kanker serviks penyebab kematian
tertinggi
Protein dari kapang X.psidii
Optimasi produksi protein X.psidii
Purifikasi dan karakterisasi protein
X.psidii
Informasi kandidat obat antibakteri dan
2 OPTIMASI PERTUMBUHAN DAN AKTIVITAS
ANTIBAKTERI KAPANG
Xylaria psidii
KT30
Pendahuluan
Xylaria psidii KT30 merupakan kapang yang diisolasi dari rumput laut
Kappaphycus alvarezii BRKA-1 dari Desa Labuange, Kabupaten Barru, Sulawesi Selatan. Kapang KT30 menghasilkan pigmen berwarna merah yang dikeluarkan pada media berbeda dengan intensitas yang berbeda. Pigmen tersebut dapat terdeteksi pada panjang gelombang 518 nm (Tarman 2011). Klasifikasi X. psidii
adalah sebagai berikut (Rodger et al. 1992): Filum : Ascomycota
Ekstrak etil asetat dari kapang KT30 memiliki aktivitas dalam menghambat bakteri E. coli, B. subtilis, Pseudomonas aeruginosa, dan bakteri patogen pada ikan contohnya Vibrio anguillarum, Aeromonas salmonicida, dan Yersinia ruckeri. Kapang KT30 juga memiliki aktivitas antikanker terhadap kanker kandung kemih pada ekstrak etil asetat dari kultur air tawar dan laut (Tarman
et al. 2011).
Menurut Tarman et al. (2012) protein yang dihasilkan kapang KT30 memiliki aktivitas antibakteri dan antikanker. Aktivitas protein yang dihasilkan kapang tersebut masih belum optimal. Hasil tersebut menunjukkan adanya potensi protein dari kapang KT30 sebagai bahan obat terutama untuk antibakteri dan antikanker terhadap kanker serviks. Mikroorganisme patogen menyebabkan frekuensi infeksi di dunia semakin meningkat dan menjadi penyebab kematian terutama di negara berkembang (Khan et al. 2007; Mukhtar dan Ghori 2012). Kanker serviks merupakan salah satu jenis kanker yang menyebabkan kematian tertinggi terutama perempuan. Menurut Maliya (2004) di negara berkembang seperti Indonesia kematian yang disebabkan oleh kanker menduduki urutan atas bersama penyakit kardiovaskuler. Menurut Dwipiyono (2009) insiden penyakit kanker serviks di Indonesia terjadi pada ± 15/100.000 orang.
Bahan dan Metode
Tahapan penelitian ini dilaksanakan pada Bulan Januari - Maret 2013. Penelitian dilaksanakan di Laboratorium Protein Rekombinan, Vaksin, dan Sistem Pengantaran Terarah, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bioteknologi, Cibinong, Kabupaten Bogor.
Bahan yang digunakan dalam penelitian ini adalah isolat kapang X. psidii
KT30, Potato Dextrose Agar (PDA), Potato Dextrose Broth (PDB), Nutrient Broth (NB), Nutrient Agar (NA), NaCl, E. coli, B. subtilis, dan larutan NaCl 0,85%. Alat yang digunakan dalam penelitian ini adalah pH-meter (CyberScan ph510), timbangan (CHQ-DJ1002B), otoklaf (ES-315), laminar flow (ESCO), oven (Frolaibo SAS), petri, inkubator (NB-205V), dan orbital shaker (LIPI).
Kultur padat kapang KT30 (Gandjar et al. 2006)
Media yang digunakan untuk kultur padat adalah PDA (komposisi media PDA disajikan pada Lampiran 1). Media PDA sebanyak 3,9 g dilarutkan hingga 100 mL, lalu disterilkan pada otoklaf (121oC, 20 menit). Media PDA yang sudah steril dituang dalam cawan petri dan didiamkan hingga padat. Potongan hifa kapang KT30 diambil dan dimasukkan dalam cawan petri. Kapang KT30 diinkubasi pada suhu ruang selama ± 3-4 hari.
Kultur cair kapang KT30 (Gandjar et al. 2006)
Media yang digunakan untuk kultur cair adalah PDB (komposisi media PDA disajikan pada Lampiran 2). Media PDB sebanyak 2,4 g dilarutkan hingga 100 mL, lalu disterilkan dalam otoklaf. Potongan hifa kapang KT30 diambil dan dimasukkan dalam media PDB. Kultur cair dilakukan pada media dengan volume 5 mL dan 25 mL. Kultur cair kapang KT30 diinkubasi pada suhu ruang dan
orbital shaker dengan kecepatan 120 rpm selama ± 3-4 hari.
Optimasi pertumbuhan kapang KT30 (Gandjar et al. 2006)
Media yang digunakan untuk optimasi pertumbuhan adalah PDB dengan volume 50 mL. Kapang KT30 hasil kultur cair 25 mL disiapkan, hifa diambil dan dimasukkan ke dalam media PDB. Kapang KT30 diinkubasi pada suhu ruang dan
orbital shaker dengan kecepatan 120 rpm.
Optimasi pertumbuhan dilakukan dengan kombinasi perlakuan konsentrasi NaCl dan waktu panen. Konsentrasi NaCl yang digunakan pada media kultur adalah 0%, 1%, dan 3%, sedangkan panen dilakukan setiap 3 hari selama 21 hari (hari ke-3, 6, 9, 12, 15, 18, dan 21). Biomassa dan supernatan kapang KT30 dipisahkan dengan menggunakan kertas saring. Bobot biomassa ditimbang setelah pengeringan dengan oven pada suhu 60oC selama 24 jam (Handajani dan Purwoko 2008). Bobot biomassa dihitung berdasarkan persamaan berikut:
Bobot biomassa = bobot akhir −bobot awal
Keterangan:
Bobot awal : Bobot kertas saring
Bobot akhir : Bobot biomassa kering dan kertas saring
antibakteri adalah 114,31 μg/disc. kontrol positif yang digunakan adalah kloramfenikol dengan konsentrasi 30 μg/disc.
Uji aktivitas antibakteri (Lay 1994, Wooton 2013)
Bakteri yang digunakan dalam uji aktivitas antibakteri adalah Bacillus subtilis BTCC 2530 dan Escherichia coli NBRC 14237. Pada inokulasi, bakteri ditambahkan sebanyak 5 μL dari stok bakteri dalam 5 mL media NB (beef extract
0,3%, pepton 1%, NaCl 0,5%). Bakteri diinkubasi pada suhu 37oC dengan kecepatan shaker 150 rpm selama ± 16 jam. Bakteri diencerkan dengan menggunakan standar McFarland 2 (6 x 108 CFU/mL) dan diukur pada spektrofotometri (600 nm).
Standar McFarland digunakan untuk melakukan perbandingan visual dari densitas bakteri pada media. Standar McFarland dapat dibuat dari dua larutan yaitu 1% barium klorida (BaCl2) encer dan 1% asam sulfat (H2SO4) encer dengan komposisi sesuai dengan standar. Komposisi bahan dan estimasi jumlah bakteri pada standar McFarland dapat dilihat pada Tabel 2.1.
Tabel 2.1 Komposisi bahan dan estimasi jumlah bakteri pada standar McFarland
0,5 1 2 3
1% Barium klorida (mL) 0,05 0,1 0,2 0,3
1% Asam sulfat (mL) 9,95 9,9 9,8 9,7
Estimasi kepadatan bakteri x 108 CFU/mL 1,5 3 6 9
Bakteri yang sudah disesuaikan dengan standar McFarland ditambahkan sebanyak 3 mL ke dalam 17 mL NA (beef extract 0,3%, pepton 1%, NaCl 0,5%, dan bakto agar 2%), dan didiamkan hingga padat. Kertas cakram (diameter 6 mm) yang sudah ditambahkan 20 μL sampel dimasukkan dalam media NA. Inkubasi dilakukan pada suhu 37oC selama ±24 jam, kemudian zona hambat yang dihasilkan diukur diameternya dalam mm, setelah dikurangi diameter kertas cakram.
Analisis data
Rancangan yang digunakan untuk optimasi pertumbuhan adalah rancangan acak lengkap (RAL) pola faktorial dengan 3 kali ulangan. Perlakuan terdiri dari 2 faktor percobaan yaitu konsentrasi NaCl dengan taraf 0%, 1%, 3% dan waktu panen dengan taraf 3, 6, 9, 12, 15, 18, dan 21 hari. Menurut Mattjik (2002), model umum RAL pola faktorial adalah:
Yijk = μ+ Ai+ Bj + (AB)ijk +∈ijk Keterangan:
Yijk : Respon pengaruh perlakuan faktor A pada taraf i dan perlakuan faktor B pada taraf j ulangan ke-k
µ : Pengaruh rata-rata umum
Ai : Pengaruh perlakuan faktor A pada taraf i Bj : Pengaruh perlakuan faktor B pada taraf j
(AB)ij : Pengaruh interaksi faktor A pada taraf ke-i dengan perlakuan faktor B ke-j
Hasil dan Pembahasan
Optimasi pertumbuhan kapang X. psidii KT30 dilakukan pada konsentrasi NaCl yang berbeda selama 21 hari. Pertumbuhan yang dihasilkan kapang KT30 memiliki perbedaan pada tiap perlakuan NaCl dan waktu panen. Perbedaan pada tiap perlakuan ditunjukkan oleh bobot biomassa kapang KT30 yang berbeda. Biomassa kapang KT30 yang ditumbuhkan pada media dengan salinitas yang berbeda dapat dilihat pada Gambar 2.1. Kapang KT30 pada tiap perlakuan mengalami fase pertumbuhan eksponensial sampai hari ke-6. Berdasarkan hasil perhitungan menurut Jouncey and Ross (1982), laju pertumbuhan spesifik (specific growth rate) paling tinggi terdapat pada perlakuan NaCl 0% yaitu sebesar 64,62%. Laju pertumbuhan spesifik perlakuan NaCl 1% dan 3% masing-masing adalah 43,61% dan 59,17%. Perlakuan NaCl 0% menghasilkan bobot biomassa paling tinggi yaitu 0,96 g/50 mL. Bobot biomassa pada waktu panen selanjutnya relatif sama karena sudah mengalami fase stasioner.
Kapang KT30 pada perlakuan NaCl 0% dapat tumbuh lebih baik dibandingkan perlakuan lainnya. Hal ini diduga karena X. psidii merupakan kapang terestrial yang pertama kali diisolasi dari buah jambu (Psidium guajava) yang berasal dari Hawai (Rodger et al. 1992). Menurut Chasanah et al. (2012), beberapa kapang terestrial dapat beradaptasi juga dengan lingkungan laut dan masih tumbuh pada konsentrasi 4% NaCl. Jingjing et al. (2011) melaporkan bahwa kapang yang habitatnya bukan dari laut dapat tumbuh pada konsentrasi NaCl 3%, tapi pertumbuhannya lambat pada NaCl 6%. Kapang KT30 yang diisolasi dari rumput laut Kappaphycus alvarezii memiliki kemampuan adaptasi tersebut.
Gambar 2.1 Biomassa kapang Xylaria psidii KT30 yang ditumbuhkan pada media dengan salinitas berbeda. −♦− NaCl 3%, −■− NaCl 1%, −▲− NaCl 0%
Hasil uji statistik (Lampiran 3) menunjukkan bahwa interaksi antara konsentrasi NaCl dan waktu panen berpengaruh nyata (p<0,05) terhadap bobot biomassa kapang KT30. Kondisi lingkungan secara signifikan mempengaruhi
karakteristik kultur kapang yang meliputi bobot biomassa, diameter koloni, jumlah spora, dan warna (Zain et al. 2009). Habitat laut memiliki peran yang kuat dalam adaptasi kapang terhadap konsentrasi garam. Kapang laut ada yang bersifat fakultatif, dapat tumbuh pada garam dengan konsentrasi rendah dan karena pengaruh lingkungan, ada yang terbawa ke laut sehingga bersifat halotoleran setelah beradaptasi (Jingjing et al. 2011).
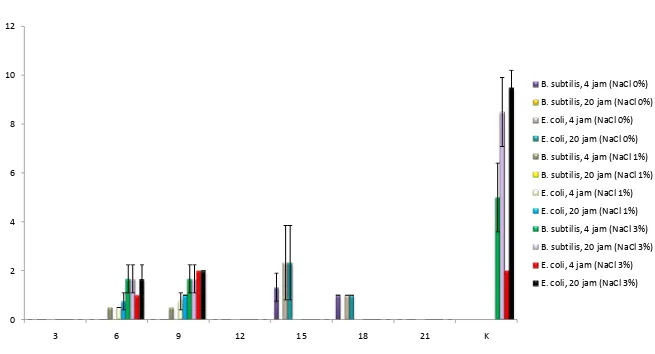
Metabolit sekunder yang dihasilkan oleh organisme dipengaruhi oleh faktor lingkungan. Metabolit sekunder yang telah diisolasi dan dikarakterisasi dari kapang genus Xylaria adalah chitochalasins, phytotoxins, xyloketals, cyclopeptides, lactones, xanthones, sesquiterpenes, dan turunan aromatik (Song et al. 2012). Supernatan hasil penyaringan kapang KT30 diuji antibakteri. Aktivitas antibakteri kapang X. psidii KT30 yang dikultur pada salinitas berbeda dapat dilihat pada Gambar 2.2.
Aktivitas antibakteri kapang KT30 paling tinggi terdapat pada perlakuan NaCl 0% dengan waktu panen 15 hari. Diameter zona hambat yang dihasilkan terhadap bakteri E. coli dan B. subtilis pada perlakuan tersebut adalah 2,33 mm dan 1,33 mm. Aktivitas antibakteri pada perlakuan NaCl 1% paling tinggi pada waktu panen 9 hari yang memiliki diameter zona hambat 1 mm terhadap E. coli
dan 0,5 mm terhadap B. subtilis, sedangkan pada perlakuan NaCl 3%, aktivitas antibakteri tertinggi terdapat pada waktu panen 9 hari dengan diameter zona hambat 2 mm terhadap E. coli dan 1,67 mm terhadap B. subtilis. Hasil tersebut sesuai dengan aktivitas antibakteri dari ekstrak etil asetat kapang KT30 yang dilaporkan Tarman et al. (2011). Aktivitas antibakteri tertinggi dari ekstrak etil asetat terhadap E. coli terdapat pada kultur air tawar (NaCl 0%). Aktivitas antibakteri ekstrak etil asetat dari kapang KT30 terhadap bakteri B. subtilis
terdapat pada kultur air laut (3%).
Senyawa metabolit sekunder yang dihasilkan kapang, biasanya dipanen setelah memasuki fase stasioner (Gandjar et al. 2006). Pada saat fase tersebut, metabolit sekunder dihasilkan sebagai pertahanan diri. Kapang KT30 yang dikultur dengan NaCl 0% memiliki aktivitas antibakteri tertinggi pada waktu panen hari ke-15, dimana pertumbuhannya telah mengalami fase stasioner. Sedangkan menurut Miao et al. (2006), tingkat salinitas kapang berada pada batas toleransi dari inangnya, konsentrasi NaCl di luar toleransi dapat meningkatkan efek stres pada kapang tersebut. Efek stres tersebut biasanya diikuti dengan produksi metabolit sekunder sebagai pertahanan diri. Oleh karena itu, kapang KT30 dengan perlakuan NaCl 3% memiliki aktivitas tertinggi pada waktu panen hari ke-9. Hal tersebut menunjukkan pola adaptasi dengan menghasilkan metabolit sekunder sebagai pertahanan diri pada saat pertumbuhannya dalam fase eksponensial.
Simpulan
Gambar 2.2 Aktivitas antibakteri kapang X. psidii KT30 yang dikultur pada salinitas berbeda
0 2 4 6 8 10 12
3 6 9 12 15 18 21 K
B. subtilis, 4 jam (NaCl 0%)
B. subtilis, 20 jam (NaCl 0%)
E. coli, 4 jam (NaCl 0%)
E. coli, 20 jam (NaCl 0%)
B. subtilis, 4 jam (NaCl 1%)
B. subtilis, 20 jam (NaCl 1%)
E. coli, 4 jam (NaCl 1%)
E. coli, 20 jam (NaCl 1%)
B. subtilis, 4 jam (NaCl 3%)
B. subtilis, 20 jam (NaCl 3%)
E. coli, 4 jam (NaCl 3%)
3 PURIFIKASI PROTEIN ANTIBAKTERI DARI KAPANG
Xylaria psidii
KT30
Pendahuluan
Protein terdiri dari asam amino yang mengandung unsur C, H, O, dan N. Pada umumnya asam amino bersifat larut dalam air, tidak larut dalam pelarut organik, dapat membentuk ion positif dan negatif (ion amfoter) (Poedjiadi 1994). Protein dapat berperan dalam reaksi biokimia, hormon, antibiotik, vaksin, dan bahan obat. Pada saat ini, belum banyak yang mengeksplorasi senyawa protein sebagai bahan obat pada penyakit manusia maupun hewan. Protein memiliki beberapa keunggulan diantaranya dapat diterima baik oleh tubuh, efek sampingnya relatif sedikit, dan dapat dikloning gennya sehingga dapat diproduksi secara besar-besaran (Arifudin 2001).
Protein memiliki aktivitas biologis sebagai antibakteri, antifungi, dan antikanker. Protein bioaktif dapat diisolasi dari beberapa biota laut dan kapang yaitu spons, moluska, ascidia, rumput laut, mikroalga, serta kapang Clitocybe sinopica dan Cordyceps militaris (Park et al. 2009; Zheng et al. 2010; Anand et al. 2012). Menurut Tarman et al. (2012), protein dari kapang Xylaria psidii KT30 memiliki aktivitas antibakteri dan antikanker, namun aktivitasnya masih rendah. Protein kapang KT30 hasil pengendapan memiliki aktivitas antibakteri dengan kisaran diameter zona hambat 7-8 mm, sedangkan aktivitas antikankernya memiliki nilai IC50 450,8 µg/mL. Oleh karena itu, untuk meningkatkan aktivitas protein kapang KT30 maka harus dilakukan proses pemurnian.
Pemurnian protein merupakan tahap yang harus dilakukan untuk mempelajari sifat dan fungsi protein. Protein dapat dipisahkan dari molekul lainnya berdasarkan ukuran, kelarutan, muatan dan afinitas ikatannya (Winarno 2008). Tahapan metode yang digunakan untuk pemurnian protein adalah pengendapan dan kromatografi filtrasi gel. Tahap awal pemurnian protein kapang KT30 dilakukan melalui pengendapan dengan amonium sulfat. Bobot protein yang dihasilkan berbeda pada saturasi amonium sulfat yang berbeda. Oleh karena itu, harus dilakukan optimasi pengendapan dengan amonium sulfat untuk mendapatkan bobot protein yang paling optimum. Pengendapan protein dengan amonium sulfat dapat menyebabkan dehidrasi lingkungan mikro dari molekul protein. Ion-ion dari garam, misalnya ion sulfat (SO42-) akan menarik dan mengikat molekul air dari koloid air. Pada saturasi yang rendah, ion-ion akan mengisi lingkungan molekul protein sehingga protein melarut yang disebut salting in. Pada saturasi tinggi terjadi peningkatan muatan listrik yang akan menarik molekul air dari koloid protein sehingga interaksi hidrofobik diantara sesama molekul protein akan menurunkan kelarutan sehingga terjadi salting out yang menyebabkan protein mengendap (Rosenberg 1996).
gel tersebut. Gel yang biasa digunakan adalah Sephadex, Bio gel, Agarose, Sepharose, dan Sytaragel (Adnan 1997). Fraksi protein diuji antibakteri untuk mendapatkan fraksi aktifnya. Tujuan tahapan penelitian ini adalah untuk menentukan rendemen protein dan fraksi paling aktif.
Bahan dan Metode
Tahapan penelitian ini dilaksanakan pada Bulan Maret - Juli 2013. Penelitian dilaksanakan di Laboratorium Protein Rekombinan, Vaksin, dan Sistem Pengantaran Terarah, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bioteknologi, Cibinong, Kabupaten Bogor.
Bahan yang digunakan dalam penelitian ini adalah isolat kapang X. psidii
KT30, amonium sulfat, 10 mM bufer Tris-HCl pH 7,4, Sephadex G-50, akuades, metanol 30%, Nutrient Broth (NB), Nutrient Agar (NA), E. coli, B. subtilis, dan larutan NaCl 0,85%. Alat yang digunakan dalam penelitian ini adalah pH-meter (CyberScan ph510), timbangan (CHQ-DJ1002B), hot plate (Cimarec-HP914515), sentrifugasi (Z326K), kolom resin, inkubator (NB-205), autoklaf (ES-315), dan petri.
Pengendapan protein kapang KT30
Kultur produksi kapang KT30 dipanen setelah diinkubasi sesuai dengan hasil optimasi. Panen dilakukan dengan memisahkan biomassa (miselium) dan supernatan kapang KT30 melalui penyaringan dengan kertas saring. Supernatan kapang KT30 yang diperoleh kemudian diendapkan dengan amonium sulfat ((NH4)2SO4).
Pengendapan dilakukan berdasarkan metode Scopes (1994) dengan saturasi 60%, 70%, 80%, dan 90% pada setiap 100 mL supernatan kapang KT30. Amonium sulfat ditambahkan secara perlahan ke dalam supernatan pada kondisi diaduk dengan magnetik stirer hingga akhir konsentrasinya dan supernatan diendapkan semalam pada suhu 4oC. Supernatan kemudian disentrifugasi 10.000 rpm selama 30 menit pada suhu 4oC. Hasil sentrifugasi berupa pelet dan supernatan, pelet yang diperoleh dilarutkan dengan 10 mM bufer Tris-HCl pH 7,4 dengan perbandingan 1:1. Pelet dan supernatan protein kapang KT30 diuji antibakteri dengan metode difusi agar (Lay 1994). Konsentrasi fraksi amonium sulfat (pelet) adalah 180,25 µg/disc, dan kontrol positif yang digunakan adalah kloramfenikol dengan konsentrasi 30 µg/disc.
Kromatografi filtrasi gel protein kapang KT30 (Jin et al. 2013)
Fraksi amonium sulfat dimurnikan melalui kromatografi filtrasi gel yang dilakukan pada suhu 4oC. Kolom yang digunakan dalam kromatografi filtrasi gel adalah Sephadex G-50 sebagai fase diam, dan fase gerak yang digunakan adalah metanol 30%. Kolom yang digunakan dicuci terlebih dahulu dengan menggunakan akuades steril. Fraksi protein yang dihasilkan ditampung dalam
Analisis data
Rancangan yang digunakan untuk optimasi pengendapan adalah rancangan acak lengkap (RAL) sederhana dengan 3 kali ulangan. Menurut Mattjik (2002), model umum RAL sederhana adalah:
Yij = μ+ Ai+∈ij
Keterangan:
Yij : Respon percobaan karena pengaruh A taraf ke-i, ulangan ke-j µ : Pengaruh rata-rata umum
Ai : Pengaruh taraf ke-i
∈ij : Pengaruh kesalahan percobaan karena pengaruh perlakuan ke-i, ulangan ke-j
Hasil dan Pembahasan
Hasil pengendapan protein kapang KT30
Panen kultur produksi kapang KT30 dilakukan dengan memisahkan miselium dan supernatannya menggunakan kertas saring. Pengendapan dengan amonium sulfat tujuannya adalah untuk memekatkan dan memurnikan protein dari supernatan kapang KT30. Optimasi pengendapan protein dilakukan pada kapang KT30 dengan NaCl 0% dan waktu panen hari ke-15. Hal ini dilakukan berdasarkan aktivitas antibakteri dan rendemen pelet protein yang dihasilkan pada perlakuan tersebut lebih tinggi dibandingkan dengan NaCl 3% dengan waktu panen hari ke-9. Optimasi pengendapan dengan amonium sulfat dilakukan dengan saturasi 60%-90%. Rendemen protein fraksi amonium sulfat kapang X. psidii
KT30 pada saturasi yang berbeda dapat dilihat pada Tabel 3.1.
Tabel 3.1 Rendemen protein fraksi amonium sulfat kapang
X. psidii KT30 pada saturasi berbeda
Saturasi Amonium
Keterangan: volume supernatan untuk pengendapan adalah 100 mL
Hasil uji statistik (Lampiran 4) menunjukkan bahwa perbedaan saturasi amonium sulfat tidak berpengaruh nyata (p>0,05) terhadap rendemen protein fraksi amonium sulfat kapang KT30. Rendemen protein fraksi amonium sulfat tertinggi dihasilkan pada saturasi amonium sulfat 90% sebesar 1,67 g/100 mL (1,67%). Menurut Wang (2006), kelarutan protein tergantung pada konsentrasi amonium sulfat dalam larutan. Konsentrasi amonium sulfat tidak boleh menurun dalam larutan agar protein dapat mengendap, maka harus dilakukan pengadukan selama proses pengendapan berlangsung.
menunjukkan aktivitas antibakteri fraksi amonium sulfat dan supernatan kapang
X. psidii KT30 pada saturasi yang berbeda. Fraksi amonium sulfat 90% memiliki aktivitas antibakteri tertinggi dengan diameter zona hambat 2 mm terhadap bakteri
B. subtilis dan E. coli. Fraksi amonium sulfat dengan saturasi 60%-80% memiliki aktivitas yang relatif kecil terutama pada bakteri E. coli, sedangkan supernatan 60%-90% memiliki aktivitas relatif stabil terhadap bakteri E. coli dan B. subtilis
dengan diameter zona hambat yang berkisar pada 0,5-2 mm. Hasil pengendapan dengan saturasi amonium sulfat 90% akan digunakan pada tahap selanjutnya karena memiliki aktivitas antibakteri paling tinggi.
Protein antibakteri memiliki implikasi yang besar terhadap inangnya karena dapat melindungi dari kerusakan parah akibat infeksi oleh bakteri. Protein antibakteri memiliki karakteristik fisiologi dan biokimia yang berbeda tergantung dari organisme yang diisolasinya (Zheng et al. 2010). Malik et al. (2008) menyatakan protein bioaktif yang memiliki aktivitas antibakteri biasanya diisolasi
pada fase eksponensial akhir atau stasioner. Protein bioaktif yang dilepaskan ke lingkungan secara perlahan dan terus menerus dapat mencegah kolonisasi
ruang yang berdekatan dengan pesaing. Mikroorganisme laut yang menghasilkan protein antibiotik dapat berkontribusi untuk proses inaktivasi alami mikroorganisme pada lingkungan laut.
Gambar 3.1 Aktivitas antibakteri fraksi amonium sulfat dan supernatan kapang X.psidii KT30 pada saturasi yang berbeda
Fraksi aktif protein kapang KT30
Fraksi amonium sulfat 90% kapang X. psidii KT30 dimurnikan melalui kromatografi filtrasi gel. Prinsip pemurnian dengan filtrasi gel adalah pemisahan protein berdasarkan ukuran partikel dan sangat baik digunakan pada tahap akhir pemurnian. Fase diam yang digunakan adalah Sephadex G-50 dan fase geraknya adalah metanol 30%. Menurut Ratnakomala (2009), fase gerak yang digunakan pada kromatografi filtrasi gel menggunakan Sephadex G-50 biasanya menggunakan larutan bufer. Penggunaan bufer sebagai eluen memberikan hasil pemisahan yang kurang baik. Hal ini dikarenakan protein tersebut banyak mengandung gugus hidrofobik yang memiliki kelarutan yang rendah pada eluen
berupa bufer. Interaksi hidrofobik dapat dikurangi dengan penambahan senyawa organik seperti metanol, etanol, dan asetonitril.
Volume fraksi amonium sulfat yang dimasukkan ke dalam kolom adalah 1 mL, fraksi yang dihasilkan juga ditampung dengan volume yang sama. Laju alir yang dibutuhkan untuk menampung fraksi yang dihasilkan adalah 2 menit/mL. Fraksi yang dihasilkan kemudian diuji antibakteri. Aktivitas antibakteri fraksi protein kapang X. psidii KT30 dapat dilihat pada Gambar 3.2.
Aktivitas antibakteri dari fraksi protein kapang KT30 terhadap bakteri
B. subtilis dihasilkan pada fraksi 8-16. Hasil tersebut menunjukkan adanya puncak utama pada fraksi 11 dan 12 yang menghasilkan diameter zona hambat sebesar 2 mm. Aktivitas antibakteri dari fraksi protein kapang KT30 terhadap E. coli
terdapat pada fraksi 8, 10-13, dan 16. Secara keseluruhan, fraksi 11-12 memiliki aktivitas antibakteri tertinggi dibandingkan dengan fraksi aktif yang lainnya.
Gambar 3.2 Aktivitas antibakteri fraksi protein kapang X. psidii KT30 terhadap bakteri patogen (□) B. subtilis dan (■) E. coli
Hasil pemurnian dengan kromatografi filtrasi gel menunjukkan pemisahan yang baik dari protein dari kapang KT30. Hal tersebut ditunjukkan terpisahnya molekul protein dengan bobot molekul yang berbeda. Pemurnian secara parsial dengan kromatografi filtrasi gel menggunakan Sephadex G-50 dapat menghasilkan protein yang berperan sebagai antibakteri. Penelitian Huang et al.
(2006) menunjukkan bahwa protein dari kepiting bakau (Scylla serrata) memiliki aktivitas antibakteri terhadap Micrococcus leuteus. Minn et al. (1998) juga melaporkan bahwa protein antibakteri bullfrog (Rana catesbiana) dari hasil pemurnian memiliki aktivitas terhadap B. subtilis, E. coli, Staphylacoccusaureus,
Serratia sp., Streptococcus mutans, dan Streptococcustypimurium.
Simpulan
Pengendapan protein kapang KT30 paling optimum terdapat pada konsentrasi amonium sulfat 90% dengan rendemen sebesar 1,67 g/100 mL. Fraksi amonium sulfat tersebut memiliki aktivitas antibakteri tertinggi terhadap bakteri
E. coli dan B. subtilis dengan diameter zona hambat sebesar 2 mm. Fraksi protein 11 dan 12 dari kapang X. psidii KT30 merupakan fraksi paling aktif dengan aktivitas antibakteri tertinggi terhadap B. subtilis dan E. coli sebesar 2 mm.
4 AKTIVITAS ANTIKANKER DAN KARAKTERISASI
PROTEIN DARI KAPANG
Xylaria psidii
KT30
Pendahuluan
Kanker merupakan penyakit dimana kontrol pertumbuhan hilang dari satu atau lebih sel yang mengarah menjadi massa padat (Thurston 2006). Jenis kanker yang menyebabkan tingginya angka kematian pada perempuan adalah kanker leher rahim (serviks). Menurut WHO (2008), kasus kanker serviks di negara berkembang memiliki angka yang lebih tinggi dibandingkan negara maju. Berdasarkan wilayahnya, kasus kanker serviks tertinggi terdapat di wilayah Afrika, diikuti wilayah Asia Tenggara.
Kapang Xylaria psidii KT30 menghasilkan protein yang memiliki aktivitas antikanker terhadap kanker serviks (Tarman et al. 2012). Aktivitas antikanker protein kapang KT30 tersebut masih rendah sehingga perlu dilakukan optimasi pertumbuhan dan pemurnian untuk menghasilkan aktivitas yang lebih tinggi. Selain diuji aktivitas antikanker, karakterisasi protein fraksi amonium sulfat kapang KT30 juga dilakukan untuk mengetahui sifat-sifatnya. Karakterisasi protein yang biasa dilakukan meliputi bobot molekul dan stabilitas terhadap suhu, pH, enzim, inhibitor, dan detergen.
Penelitian mengenai aktivitas dan karakterisasi antikanker dari protein kapang jumlahnya masih sangat terbatas. Park et al. (2009) melaporkan bahwa protein dengan bobot molekul 12 kDa dari kapang Cordyceps sinensis bersifat sitotoksik terhadap sel kanker payudara dan kandung kemih. Hasil penelitian Zheng et al. (2010) menunjukkan bahwa protein kapang Clytocibe sinopica
memiliki bobot molekul 44 kDa, stabil pada suhu 20-60oC dan pH 4-9. Berdasarkan penelitian yang telah dilakukan, bobot molekul protein bioaktif bervariasi pada tiap sampel, misalnya Scylla serrata 10,8 kDa dan bullfrog
3,691 kDa.
Pengukuran kadar protein pada kapang KT30 juga dilakukan untuk mengetahui konsentrasi protein yang dihasilkan. Konsentrasi protein berkaitan dengan aktivitas biologis yang dihasilkan oleh kapang KT30. Pengukuran dilakukan pada setiap tahap pemurnian protein mulai dari supernatan hingga fraksi aktifnya. Tujuan tahap penelitian ini adalah untuk menguji aktivitas antikanker dan menentukan karakter (bobot molekul dan stabilitas) protein kapang KT30.
Bahan dan Metode
Tahapan penelitian ini dilaksanakan pada Bulan Mei - September 2013. Penelitian dilaksanakan di Laboratorium Protein Rekombinan, Vaksin, dan Sistem Pengantaran Terarah, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bioteknologi, Cibinong, Kabupaten Bogor dan Laboratorium Mikrobiologi dan Imunologi, Pusat Studi Satwa Primata (PSSP), Institut Pertanian Bogor.
Bahan yang digunakan pada penelitian ini adalah akrilamid, sukrosa, amonium persulfat (APS), N,N,N´,N´-tetrametiletilendiamina (TEMED), bufer SDS, loading dye 2x, larutan fixing (etanol 30% dan asam asetat 10%), larutan
larutan asam asetat 10%, sel HeLa (kanker serviks), sel Chang (sel hati),
Dulbecco’s Modified Eagle’s Medium (DMEM), Fetal Bovine Serum (FBS), penicillin, streptomycin, Phosphate Buffer Saline (PBS), MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromid), 10% SDS (Sodium Dodecyl Sulfate) dalam 0,01% HCl, Dimethyl Sulfoxide (DMSO), Nutrient Broth (NB), Nutrient Agar (NA), Escherichia coli, Bacillussubtilis, dan larutan NaCl 0,85%, pepsin, tripsin, lisozim, EDTA, tween 20, dan triton X-100.
Alat yang digunakan dalam penelitian ini adalah comb, alat elektroforesis (ATTO), thermometer (Taylor), 96-well plate, ELISA reader (Spectramax 250),
hemocytometer (Reicuel), timbangan (CHQ-DJ1002B), autoklaf (Tomy ES-315),
hot plate (Cimarec-HP914515), petri, inkubator (NB-205 V), dan
spektrofotometri (Gene Quant).
MTT sitotoksik (CCRC 2009)
Prinsip metode MTT adalah terjadinya reduksi garam kuning tetrazolium MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromid) oleh sistem reduktase. Suksinat tetrazolium yang termasuk dalam rantai respirasi dalam mitokondria sel-sel yang hidup membentuk kristal formazan berwarna ungu dan tidak larut air. Penambahan reagen stopper (bersifat detergenik) akan melarutkan kristal berwarna ini yang kemudian diukur absorbansinya menggunakan ELISA reader. Intensitas warna ungu yang terbentuk proporsional dengan jumlah sel hidup. Jika intensitas warna ungu semakin besar, maka berarti jumlah sel hidup semakin banyak.
Sel normal dan kanker yang digunakan dalam penelitian ini adalah sel Chang (sel hati) dan HeLa (kanker serviks). Sel Chang dan HeLa dikultur pada inkubator (37oC, CO2 5%) dengan media Dulbecco’s Modified Eagle’s Medium
(DMEM) yang mengandung 10% Fetal Bovine Serum (FBS), penicillin (100 unit/mL), dan streptomycin sulfat (10 μg/mL) selama 24 jam. Komposisi DMEM adalah garam anorganik, asam amino, vitamin, D-glukosa, asam piruvat,
phenol red, L-glutamin. Sel Chang dan HeLa yang telah confluent, kemudian dicuci dan dipanen.
Sel Chang dan HeLa dikultur dalam 96-well plate dengan kepadatan 104 sel/100 μL pada setiap sumur, lalu diinkubasi selama 24 jam (37oC, CO2 5%). Setiap sumur dicuci dengan 100 μL PBS. Sel tersebut kemudian diberi perlakuan dengan berbagai konsentrasi dari sampel (triplo) dan kontrol sel yang berisi media kultur dan sel. Setelah 24 jam, sel dicuci dengan 100 μL PBS, dan ditambahkan dengan 0,01 mL MTT per sumur. Plate diinkubasi pada suhu 37oC dalam kondisi CO2 5% selama 4 jam, lalu ditambahkan 10% SDS dalam 0,01% HCl sebagai stopper. Setelah diinkubasi, absorbansi diukur pada 595 nm menggunakan ELISA reader dan dibandingkan dengan kontrol. Jumlah sel yang hidup dihitung untuk mengetahui konsentrasi IC50 dengan menggunakan persamaan berikut:
% ���ℎ����= (������������� − ���������)
������������� � 100%
Kadar protein kapang KT30 (PIERCE 2003)
larutan standar BSA dengan konsentrasi 20-2000 µg/mL dapat dilihat pada Tabel 4.1. Working reagent dibuat dengan mencampurkan reagent A dan B (50:1). Protein kapang KT30 sebanyak 0,1 mL ditambahkan 2 mL working reagent yang dibuat sebelumnya, dan diinkubasi pada suhu 37oC selama 30 menit. Absorbansi sampel protein kapang KT30 di ukur pada panjang gelombang 562 nm.
Tabel 4.1 Pembuatan larutan standar BSA dengan konsentrasi 20-2000 µg/mL
Tabung Volume Dilusi (μL) Volume dan Sumber BSA (μL)
Analisis SDS-PAGE dilakukan dalam 4 tahap yaitu pembuatan gel
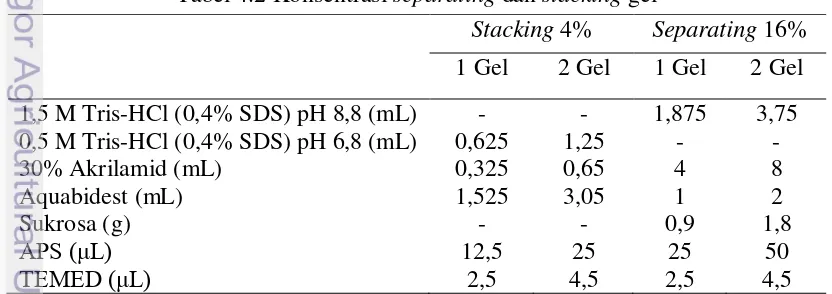
separating dan stacking, persiapan sampel, running gel, dan pewarnaan gel. Pada tahap awal, gel separating dan stacking disiapkan dengan komposisi sesuai dengan Tabel 4.2. Gel separating dibuat dalam kaca pencetak, lalu ditambahkan akuades hingga penuh dan didiamkan selama 30–60 menit. Stacking gel dibuat dalam pencetak hingga penuh, lalu dipasangkan comb, dan didiamkan ± 30 menit.
Sampel dan loading dye 2x dengan perbandingan 1:4 disiapkan untuk preparasi sampel. Air dipanaskan pada hot plate, lalu sampel dimasukkan ke dalam penangas air (± 95oC) selama 15 menit dengan tujuan denaturasi protein. Sampel diangkat, lalu disentrifugasi dan ditunggu hingga dingin. Pada tahap
running gel, pasang gel pada alat elektroforesis dan ditambahkan bufer SDS. Sampel dimasukkan dengan volume 10 μL, lalu diatur kondisi running
sesuai dengan tipe gel, SDS-PAGE dimulai pada 30 V dan dipertahankan tegangan hingga sampel setelah melewati stacking gel. Setelah selesai running
gel, gel dikeluarkan dengan hati-hati untuk dilakukan pewarnaan gel. Pewarnaan gel dilakukan dengan metode silver staining menggunakan kit.
Tabel 4.2 Konsentrasi separating dan stacking gel
Stabilitas suhu, pH, enzim, inhibitor dan detergen (Todorov et al. 2007)
Uji stabilitas suhu terhadap protein Fraksi amonium sulfat 90% kapang KT30 dilakukan dengan dipanaskan pada suhu 40oC, 60oC, 80oC, dan 100oC selama 10, 30, dan 60 menit. Fraksi amonium sulfat 90% kapang KT30 kemudian diuji antibakteri dengan metode Lay (1990). Uji stabilitas pH terhadap Fraksi amonium sulfat 90% kapang KT30 dilakukan dengan ditambahkan 90 µL bufer dengan pH 2, 4, 6, 8, 10, dan 12, kemudian diinkubasi selama 60 menit pada suhu 4oC dan diuji antibakteri. Enzim yang digunakan pada uji stabilitas enzim terhadap fraksi amonium sulfat kapang KT30 adalah lisozim, tripsin, dan pepsin. Fraksi amonium sulfat 90% kapang KT30 ditambahkan enzim (1 mg/mL) dan diinkubasi pada suhu 37oC selama 2 jam, kemudian fraksi amonium sulfat kapang KT30 diuji antibakteri. Uji stabilitas detergen dan inhibitor terhadap fraksi amonium sulfat 90% kapang KT30 dilakukan menggunakan SDS, tween 20, triton X-100, dan EDTA. Fraksi amonium sulfat tersebut ditambahkan detergen (1%) diinkubasi pada suhu 37oC selama 5 jam, kemudian protein kapang KT30 tersebut diuji antibakteri.
Hasil dan Pembahasan
Aktivitas antikanker protein kapang KT30
Uji antikanker protein kapang X. psidii KT30 dilakukan pada sel normal (sel Chang) dan sel kanker (sel HeLa). Pengobatan kanker dengan kemoterapi dan radioterapi memberikan efek samping terhadap sel normal. Oleh karena itu, pengobatan dianjurkan menggunakan senyawa yang memiliki jalur penyerangan hanya terhadap sel kanker. Hal ini berkaitan dengan penyesuaian dosis obat sehingga hanya sel kanker yang mati dan tidak menyerang sel normal didekatnya (Gomes et al. 2010).
Hasil uji antikanker terhadap sel Chang menunjukkan bahwa protein KT30 bersifat tidak toksik. Inhibisi fraksi amonium sulfat 90% dengan konsentrasi 500 dan 1.000 ppm mencapai 3,30% dan 19,78%, sedangkan pada fraksi 11-12 tidak ada inhibisi terhadap sel Chang. Hasil tersebut berarti protein KT30 aman digunakan sebagai bahan obat. Sel Chang pada uji antikanker dapat dilihat pada Gambar 4.1. Haglund (2011) menyatakan bahwa toksisitas agen antikanker biasanya mempengaruhi sel misalnya sel pembentuk darah, sel epithelium, hati, dan ginjal. Dalam pengembangan obat, antikanker baru harus memiliki efek klinis yang baik dan toksisitasnya rendah terhadap sel normal.
Berdasarkan hasil uji antikanker protein kapang KT30 terhadap sel HeLa, fraksi amonium sulfat 90% dan fraksi 11-12 bersifat tidak toksik. Menurut National Cancer Institute (NCI), suatu senyawa memiliki potensi sebagai antikanker apabila memiliki nilai IC50≤ 20 µg/mL. Berdasarkan perhitungan yang disajikan pada Lampiran 5, nilai IC50 fraksi amonium sulfat 90% dan fraksi 11-12 adalah 670,86 dan 1451,68 µg/mL. Sel HeLa pada uji antikanker dapat dilihat pada Gambar 4.1. Hasil uji antikanker protein KT30 pada media NaCl 0% selama 15 hari tersebut masih rendah dibandingkan dengan penelitian terdahulu. Tarman
Sampel Konsentrasi (ppm)
125 250 500 1000
Pelet protein (Sel Chang)
Fraksi 11-12 (Sel Chang)
Pelet protein (Sel HeLa)
Fraksi 11-12 (Sel HeLa)
(Kontrol Sel Chang)
(Kontrol Sel HeLa)
Gambar 4.1 Sel Chang dan HeLa pada uji antikanker
Berdasarkan hasil tersebut, maka protein yang dibutuhkan untuk membunuh 50% sel HeLa jumlahnya banyak, tetapi tidak bermasalah karena protein kapang KT30 tidak bersifat toksik terhadap sel normal. Pengunaan protein sebagai bahan obat memiliki keunggulan yaitu dapat diterima dengan baik oleh tubuh dan efek sampingnya sedikit (Arifudin et al. 2001). Aktivitas protein antikanker dari kapang Cordyceps militaris (CMP) juga dilaporkan oleh Park et al. (2009). CMP memiliki nilai IC50 9,3 µM untuk kanker payudara dan 8,1 µM untuk kanker kandung kemih. Hasil tersebut menunjukkan bahwa kapang merupakan sumber protein baru yang dapat diaplikasikan dalam bidang biologi dan pengobatan.
Kadar protein kapang KT30
Kadar protein kapang KT30 dihitung pada setiap tahap pemurnian yang meliputi ekstrak kasar (supernatan), fraksi amonium sulfat 90%, dan fraksi protein hasil kromatografi filtrasi gel. Fraksi protein yang dihitung kadar proteinnya adalah fraksi 11-12 karena memiliki aktivitas antibakteri paling tinggi dibandingkan fraksi lainnya. Tabel 4.3 menunjukkan kadar protein kapang
umumnya, protein yang mengendap pada saturasi amonium sulfat tinggi adalah protein dengan bobot molekul rendah (Widyarti 2006).
Tabel 4.3 Kadar protein kapang X. psidii KT30
Sampel Volume
Fraksi 11-12 memiliki kadar protein sebesar 0,604 mg/mL, nilai tersebut lebih tinggi dibandingkan dengan protein dari kapang Cordyceps militaris (CMP). Park et al. (2009) melaporkan bahwa CMP memiliki kadar protein sebesar 0,2 mg/mL. CMP diperoleh dari hasil pemurnian dengan metode kromatografi penukar ion dan filtrasi gel. Haghbeen et al. (2004) juga melaporkan mengenai kadar protein dari jamur komersial. Fraksi protein dari hasil kromatografi filtrasi gel memiliki kadar protein sebesar 0,394 mg/mL dengan total protein sebesar 10,4 mg.
Bobot molekul protein kapang KT30
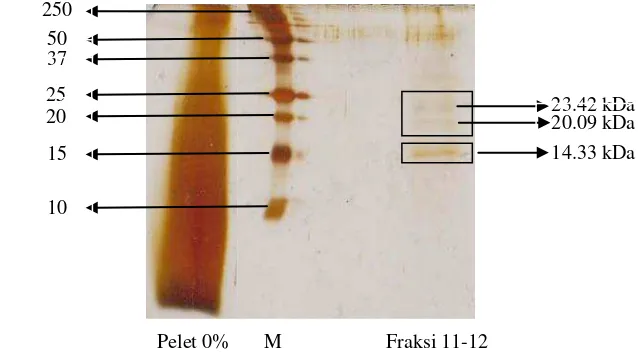
Bobot molekul protein kapang X. psidii KT30 dilakukan dengan metode SDS-PAGE. Konsentrasi gel pemisah (separating) yang digunakan adalah 18%. Sampel yang digunakan untuk analisis bobot molekul adalah fraksi amonium sulfat 90% dan fraksi aktif hasil pemurnian. Marka (penanda) yang digunakan adalah protein standard dual color (Bio-rad) dengan rentang 10-250 kDa. Bobot molekul protein kapang X. psidii KT30 dapat dilihat pada Gambar 4.2. Berdasarkan hasil SDS-PAGE, fraksi 11-12 menunjukkan adanya 3 pita protein yang dominan. Berdasarkan hasil perhitungan pada Lampiran 7, pita ke-1 memiliki bobot molekul 23,42 kDa, pita ke-2 20,09 kDa, dan pita ke-3 14,33 kDa. Bobot molekul protein yang dihasilkan pada setiap organisme sangat bervariasi, misalnya protein yang dihasilkan kapang Cordyceps militaris (CMP) memiliki bobot molekul 12 kDa pada gel 15 % (Park et al. 2009). Kapang
Clitocybe sinopica memiliki bobot molekul 44 kDa dari hasil pemurnian dengan kromatografi filtrasi gel menggunakan kolom Superdex 75. Fraksi protein tersebut memiliki aktivitas antibakteri terhadap Pseudomonas batatae, Erwinia herbicola, E. coli, dan Staphylococcus aureus (Zheng et al. 2010). Selain dari kapang, protein bioaktif juga diisolasi dari kepiting bakau (Scylla serrata) dan kodok raksasa/bullfrog (Rana catesbiana). Huang et al. (2006) melaporkan protein antibakteri dari S.serrata yang dihasilkan memiliki bobot molekul 10,8 kDa, dan berhasil diidentifikasi dari database protein sebagai scygonadin. Berdasarkan hasil penelitian Minn et al. (1998), bullfrog menghasilkan dua protein antibakteri yang teridentifikasi dengan nama bullfrog Pepsinogen a-derived Antimicrobial Peptide
Gambar 4.2 Bobot molekul protein kapang X. psidii KT30
Stabilitas suhu, pH, enzim, inhibitor dan detergen protein kapang KT30
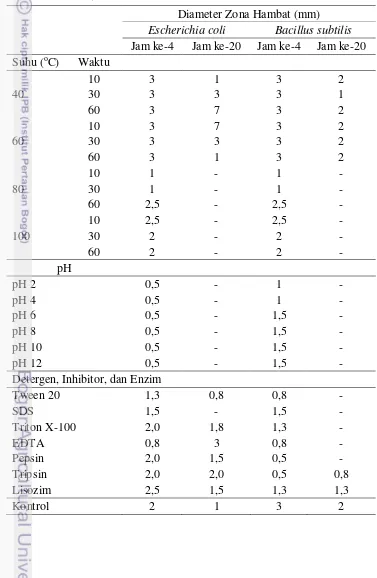
Aktivitas protein sebagai antibakteri dan antikanker dipengaruhi oleh beberapa faktor yaitu suhu, pH, inhibitor, konsentrasi, substrat, ion logam, dan faktor lainnya. Oleh karena itu dilakukan karakterisasi protein kapang KT30 untuk mengetahui kondisi optimumnya. Stabilitas protein kapang X. psidii KT30 terhadap suhu, pH, detergen, inhibitor, dan enzim dapat dilihat pada Tabel 4.4.
Aktivitas antibakteri dari protein kapang KT30 relatif sama pada suhu 40°C dan 60°C. Aktivitasnya optimum pada suhu 60°C setelah pemanasan 30 menit dengan diameter zona hambat sebesar 3 mm terhadap E. coli dan 2 mm terhadap
B. subtilis. Hasil tersebut sesuai dengan penelitian Ivanova et al. (1998) yang menyatakan bahwa protein yang diisolasi Streptococcus thermophilus 81, aktivitasnya optimum pada suhu 60°C. Pada suhu diatas 60°C, aktivitas antibakterinya relatif menurun. Menurut Malik et al. (2008), penurunan aktivitas biologi setelah pemanasan terjadi karena perubahan struktur kimia protein akibat adanya denaturasi pada suhu yang tinggi.
Protein kapang KT30 memiliki aktivitas antibakteri pada kisaran pH 6-12. Aktivitas antibakterinya menurun dibawah pH 6. Hasil tersebut sesuai dengan laporan Zheng et al. (2010), protein yang diproduksi dari kapang Clitocybe sinopica memiliki kisaran pH yang sama. Kisaran pH yang luas (asam-basa) menunjukkan ketahanan terhadap pH yang luas sehingga dapat dilakukan pengembangan sebagai bahan obat. Profil dari aktivitas pH menggambarkan pH pada saat memberi dan menerima proton pada sisi aktif protein pada tingkat ionisasi yang diinginkan. Pada kisaran pH tertentu dapat menyebabkan protein terdenaturasi yang menyebabkan kehilangan aktivitas biologisnya (Lehninger 1993).
Protein kapang KT30 cenderung tidak stabil terhadap detergen tween 20, SDS, dan triton X-100 yang ditandai turunnya aktivitas antibakteri dibandingkan dengan kontrol. Hal ini ditandai dengan turunnya aktivitas antibakteri protein kapang KT30 yang hanya mampu menghambat bakteri E.coli. Stabilitas protein kapang KT30 terhadap EDTA cenderung tidak stabil karena aktivitasnya hanya ada pada bakteri E. coli. Protein kapang KT30, sisi aktifnya dihambat oleh EDTA yang berperan sebagai inhibitor. Hasil penelitian menunjukkan bahwa protein
kapang KT30 aktivitasnya stabil terhadap enzim pepsin, lisozim, dan tripsin terutama pada bakteri E. coli. Menurut Ivanova et al. (1998), hasil tersebut menunjukkan bahwa sisi aktif pada protein tidak dipengaruhi oleh enzim pepsin, lisozim, dan tripsin. Sifat resisten terhadap enzim tersebut menunjukkan tidak ada bagian yang terlepas dari protein yang diperlukan untuk aktivitas biologisnya (Malik et al. 2008).
Tabel 4.4 Stabilitas protein kapang X. psidii KT30 pada suhu, pH, detergen, inhibitor, dan enzim
Diameter Zona Hambat (mm)
Escherichia coli Bacillus subtilis
Simpulan
5 PEMBAHASAN UMUM
Kapang Xylaria psidii KT30 ditumbuhkan pada media PDA dan PDB. Optimasi pertumbuhan dilakukan pada media PDB 50 mL dan diinkubasi pada suhu ruang dengan kecepatan 120 rpm selama 21 hari. Kapang Xylaria psidii
KT30 pada media PDA dan PDB dapat dilihat pada Gambar 5.1. Pertumbuhan kapang KT30 optimal pada media dengan konsentrasi NaCl 0%. Kapang KT30 mengalami fase eksponensial hingga hari ke-6, bobot biomassanya mengalami penurunan pada hari ke-9 karena memasuki fase stasioner yaitu fase dimana jumlah sel baru dan mati seimbang. Biomassa kapang KT30 bobotnya relatif stabil pada kisaran 0,80-0,86 g/50mL hingga waktu panen hari ke-21.
(a) (b)
Gambar 5.1 Pertumbuhan kapang Xylaria psidii KT30 pada media berbeda (a) PDA dan (b) PDB
Supernatan kapang KT30 diuji antibakteri untuk mengetahui aktivitas biologisnya. Supernatan dari hasil kultur pada NaCl 0% selama 15 hari memiliki aktivitas paling tinggi terhadap bakteri Escherichia coli dan Bacillus subtilis. Metabolit sekunder diproduksi oleh kapang sebagai respon terhadap kondisi stres dari lingkungannya. Produksi metabolit sekunder melimpah pada saat kapang mengalami fase stasioner. Pada dasarnya, metabolit sekunder digunakan oleh kapang sebagai pertahanan diri (Gandjar et al. 2006; Miao et al. 2006).
Kapang KT30 yang dikultur pada media NaCl 0% dengan waktu panen 15 hari digunakan pada tahap selanjutnya yaitu pengendapan protein. Pemisahan supernatan dan miselium dilakukan dengan penyaringan menggunakan kertas saring. Pengendapan paling optimal terdapat pada saturasi amonium sulfat 90% yang menghasilkan pelet protein dengan bobot 1,67 g/100 mL. Gambar 5.2 menunjukkan protein fraksi amonium sulfat sebelum dan sesudah dilarutkan bufer Tris-HCl pH 7,4.
10 kDa atau kurang. Antimikroba tersebut memberikan reaksi yang cepat dan langsung terhadap serangan mikroorganisme (Kim dan Ravichandran 2010).
Fraksi amonium sulfat 90% kapang KT30 dimurnikan dengan kromatografi filtrasi gel. Fraksi 11-12 yang dihasilkan dari protein kapang KT30 paling aktif sebagai antibakteri. Menurut Hoskin dan Ramamoorthy (2008) protein antibakteri selain dapat membunuh bakteri patogen juga dapat bersifat bakteriosidal terhadap sel kanker. Pada pH netral, protein antibakteri ada yang bersifat kationik dengan muatan (+2) – (+9) yang dapat bersifat antikanker dengan mengganggu membran sel kanker yang bermuatan negatif. Muatan positif protein tersebut akan menempel pada membran sel sehingga menjadi terganggu. Jika konsentrasi dinaikkan maka protein yang menempel pada sel kanker akan menyebabkan kerusakan membran sel.
(a) (b)
Gambar 5.2 Protein fraksi amonium sulfat kapang Xylaria psidii KT30 (a) sebelum dan (b) sesudah dilarutkan bufer Tris-HCl pH 7.4
Hasil uji antikanker protein kapang Xylaria psidii KT30 terhadap sel normal hati (sel Chang) dan sel kanker serviks (sel HeLa) bersifat tidak toksik. Nilai IC50 pelet protein (amonium sulfat 90%) dan fraksi 11-12 kapang KT30 adalah 670,86 dan 1451,8 µg/mL. Aktivitas sitotoksik dikategorikan ke dalam empat kelompok yaitu (a) ≤ 20 µg/mL berarti paling aktif, (b) 21-100 µg/mL berarti aktif, (c) 101-1.000 µg/mL berarti lemah, dan (d) > 101-1.000 µg/mL berarti tidak aktif (Omar et al.
2010). Berdasarkan kategori tersebut maka aktivitas antikanker pelet protein (amonium sulfat 90%) kapang KT30 terhadap sel kanker serviks termasuk kategori lemah, sedangkan fraksi 11-12 termasuk kategori tidak aktif.
Karakterisasi protein kapang Xylaria psidii KT30 dilakukan untuk mengetahui bobot molekul dan stabilitasnya terhadap suhu, pH, enzim, inhibitor, dan detergen. Hasil SDS-PAGE menunjukkan tiga pita yang dominan pada protein kapang KT30 dengan bobot molekul pita ke-1 23,42 kDa, pita ke-2 20,09 kDa, dan pita ke-3 14,33 kDa. Protein kapang KT30 aktivitasnya optimum pada suhu 60°C setelah pemanasan 30 menit, kisaran pH 6-12, serta stabil terhadap enzim pepsin, tripsin, dan lisozim. Protein tersebut tidak stabil terhadap inhibitor EDTA serta detergen, tween 20, SDS, dan triton X-100.
6 SIMPULAN UMUM DAN SARAN
Simpulan Umum
Pertumbuhan kapang X. psidii KT30 paling optimum terdapat pada perlakuan NaCl 0% dengan waktu panen hari ke-15 dan memiliki aktivitas antibakteri terhadap bakteri E. coli dan B. subtilis dengan diameter zona hambat sebesar 2,33 mm dan 1,3 mm. Pengendapan protein kapang KT30 paling optimum
terdapat pada saturasi amonium sulfat 90% dengan rendemen sebesar 1,67 g/100 mL. Fraksi protein 11 dan 12 dari kapang KT30 merupakan fraksi
paling aktif dengan aktivitas antibakteri tertinggi terhadap B. subtilis dan E. coli
sebesar 8 mm.
Protein kapang KT30 tidak toksik terhadap sel Chang dan memiliki aktivitas terhadap sel HeLa dengan nilai IC50 670,86 µg/mL pada fraksi amonium sulfat 90% dan 1451,8 µg/mL pada fraksi 11-12. Fraksi 11-12 kapang KT30 memiliki 3 pita protein dengan bobot molekul masing-masing sebesar 23,42 kDa, 20,09 kDa, dan 14,33 kDa. Protein kapang KT30 stabil pada suhu 60°C setelah pemanasan 30 menit, kisaran pH 6-12, serta enzim pepsin, tripsin, dan lisozim. Protein kapang KT30 tidak stabil terhadap inhibitor EDTA serta detergen tween 20, SDS, dan triton X-100.
Saran
DAFTAR PUSTAKA
Adnan M. 1997. Teknik Kromatografi untuk Analisis Bahan Makanan. Yogyakarta (ID): Penerbit Andi.
Arifudin, Patong R, Ahmad A. 2001. Penelusuran protein bioaktif dalam makroalga sebagai bahan antibakteri dan antijamur. Mar. Chim Acta. 2(2): 11-18.
Anand TP, Chellaram C, Kuberan G, Archana H. 2012. Bioactive peptides from marine sources-a review. IJID. 1(S8): 61-64.
Atalla MM, Zeinab HK, Eman RH, Amani AY, Abeer AA. 2008. Production of some biologically active secondary metabolites from marine-derived fungus
Varicosporina ramulosa. Mal. J. Microbiol. 4(1): 14-24.
[BPPK] Badan Penelitian dan Pengembangan Kesehatan. 2008. Riset Kesehatan Dasar (RISKESDAS) 2007. Jakarta (ID): Depatemen Kesehatan.
Bharathidasan R and Panneerselvam A. 2011. Antibacterial activity and bioactive compounds analysis of mangrove endophytic fungi Penicillium janthinellum, Aspergillus conicus and Phomosis sp. IJPRD. 4(04): 159-168.
[CCRC] Cancer Chemoprevention Research Center. 2009. Uji Sitotoksik Metode MTT. Yogyakarta (ID): Universitas Gajah Mada.
Chasanah E, Pratitis A, Mangunwardoyo W. 2012. Identification and cultivation of MFW 23-08 isolated from marine sponges for bioactive compound production. Squalen. 7(2): 59-66.
Dwipiyono B. 2009. Kebijakan pengendalian penyakit kanker (serviks) di Indonesia. Indones J Cancer. 3(3): 109-116.
Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. 2010. GLOBOCAN 2008, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 10. Lyon (FR): International Agency for Research on Cancer [Internet]. [diunduh Jun 11 2012]. Tersedia pada: http://www.globocan.iarc.fr.
Gandjar I, Sjamsuridzal W, dan Oetari A. 2006. Mikologi Dasar dan Terapan. Jakarta (ID): Penerbit Obor.
Gomes A, Bhattacarjee P, Mishra R, Biswas AK, Dasgupta SC, Giri B, Debnath A, Gupta SD, Das T, Gomes A. 2010. Anticancer potential of animal venoms and toxins. Indian J EXP BIOL. 48: 93-103.
Haghbeen K, Jazi FR, Karkhane AA, Borojerdi SS. 2004. Purification of tyrosinase from edible mushroom. Iran J Biotechnol. 3(2): 189-194.
Haglund C. 2011. Integrating efficacy and toxicity in preclinical anticancer drug development [disertasi]. Uppsala (SE): Uppsala University.