GAMBARAN PEWARNAAN IMUNOHISTOKIMIA S100
PADA MENINGIOMA DI RSUP. H. ADAM MALIK
MEDAN
TESIS
PENELITI : GATOT AJI PRIHARTOMO
NIM : 077102002
PROGRAM MAGISTER KEDOKTERAN KLINIK
DEPARTEMEN ILMU BEDAH SARAF
KATA PENGANTAR
Dengan mengucapkan Bismillahirrahmaanirrahiim, saya sampaikan rasa
syukur kehadirat Allah SWT karena dengan rahmat dan karunia-Nya saya dapat
menyelesaikan tesis ini sebagai salah satu syarat dalam menyelesaikan
pendidikan untuk memperoleh gelar Magister Kedokteran Klinik dalam bidang
Ilmu Bedah Saraf Fakultas Kedokteran Universitas Sumatera Utara Medan.
Berkat dukungan dan bimbingan dari berbagai pihak, akhirnya tesis ini
dapat diselesaikan. Untuk itu, perkenankanlah penulis menyampaikan ucapan
terima kasih dan penghargaan setinggi-tingginya kepada:
Yang terhormat Rektor Universitas Sumatera Utara, Bapak Prof. Dr. Dr.
Sjahril Pasaribu, DTM&H, M.Sc (CTM), Sp.A(K) dan mantan rektor Prof. Dr.
Chairuddin Panusunan Lubis, DTM&H, Sp.A(K) yang telah memberikan
kesempatan kepada penulis untuk mengikuti Program Pendidikan Magister
Kedokteran Klinik di Departemen Ilmu Bedah Saraf Fakultas Kedokteran
Universitas Sumatera Utara.
Yang terhormat Bapak Dekan Fakultas Kedokteran Universitas Sumatera
Utara Prof. DR. Dr. Gontar Alamsyah Siregar, Sp.PD-KGEH yang telah memberikan
kesempatan kepada penulis Program Pendidikan Magister Kedokteran Klinik di
Departemen Ilmu Bedah Saraf Fakultas Kedokteran Universitas Sumatera Utara.
Yang terhormat Bapak Direktur Rumah Sakit Umum Pusat H. Adam Malik
Medan, dr. Lukmanul Hakim Nasution, SpKK yang telah memberikan kesempatan
kepada penulis untuk belajar dan bekerja di Rumah Sakit ini.
Yang terhormat Prof. Dr. Iskandar Japardi, Sp.BS(K) sebagai Kepala
Departemen Ilmu Bedah Saraf Fakultas Kedokteran Universitas Sumatera Utara /
RSUP. H. Adam Malik Medan yang telah memberikan kesempatan, bimbingan
dan arahan sejak penulis mengikuti pendidikan di Departemen Ilmu Bedah Saraf
FK.USU/RSUP. H. Adam Malik Medan.
Yang terhormat Prof. Dr. Abdul Gofar Sastrodingrat, Sp.BS(K) sebagai
sehingga menimbulkan rasa percaya diri, baik dalam keahlian, maupun
pengetahuan umum lainnya.
Yang terhormat Prof. Dr. Abdul Gofar Sastrodingrat, Sp.BS(K) sebagai
pembimbing utama tesis, Prof. Dr. Iskandar Japardi, Sp.BS(K) sebagai
pembimbing kedua tesis yang telah banyak memberikan petunjuk, perhatian
serta bimbingannya sehingga penulis dapat menyelesaikan tesis Magister ini.
Penulis mengucapkan terima kasih dan penghargaan setinggi-tingginya atas
waktu dan bimbingan yang telah diberikan selama dalam penelitian dan
penulisan tesis ini.
Yang terhormat, dr. Sufida, Sp.A sebagai pembimbing dalam bidang
Patologi Anatomi tesis ini dan Laboratorium Patologi Anatomi Murni Teguh
Memorial Hospital sebagai salah satu tempat penelitian tesis ini.
Yang terhormat, Dr. dr. Arlinda Sari Wahyuni, M.Kes. penulis
menyampaikan rasa terima kasih yang setinggi-tingginya atas bimbingan dan
bantuan di bidang metodologi penelitian dalam pengolahan data tesis ini.
Ucapan terima kasih yang sebesar-besarnya saya tujukan kepada semua
guru-guru di Departemen Ilmu Bedah Saraf FK.USU/RSUP. H. Adam Malik Medan,
Prof. Dr. Adril Arsyad Hakim, Sp.S, Sp.BS(K), Dr. dr. Ridha Dharma Jaya, Sp.BS, Dr.
dr. Rr. Suzy Indharthy, Sp.BS, M.Kes. yang telah memberikan bimbingan, ilmu
dan pengetahuan di bidang Ilmu Bedah Saraf yang bermanfaat bagi penulis di
kemudian hari.
Yang mulia dan tercinta Ayahanda dr. H. Suparmono Sjoekoer, SpB dan
ibunda Hj. Lastini, ananda sampaikan rasa hormat dan terima kasih yang tak
terhingga serta penghargaan yang setinggi-tingginya atas kasih sayang yang telah
diberikan dan dilimpahkan kepada ananda sejak dalam kandungan, dilahirkan,
dibesarkan dan diberi pendidikan yang baik serta diberikan suru tauladan yang
baik hingga menjadi landasan kokoh dalam menghadapi kehidupan. Yang
tercinta ayah mertua, Ir. H. Abdullah dan Ibu mertua Hj. Soraya yang selama ini
telah memberikan kasih sayang, bimbingan dan restu untuk selalu menuntut
ampunilah dosa kedua orang tua hamba serta sayangilah mereka sebagaimana
mereka menyayangi hamba sewaktu kecil, dan sayangi jualah kedua mertua
hamba sebagaimana mereka menyayangi hamba. Amin, amin, ya rabbal ‘alamin.
Kepada istriku tercinta, dr. Sylvia Sahfitri dan buah hati kami Keisya Alika
Syifa yang sangat kusayangi. Tiada kata yang lebih indah yang Papi sampaikan
selain ucapan terima kasih yang setulus-tulusnya atas pengorbanan yang tiada
tara, cinta, kasih sayang, kesabaran, ketabahan, pengertian, doa dan dorongan
semangat yang tiada henti-hentinya kalian berikan untuk Papi, sehingga
pendidikan magister ini dapat selesai pada waktunya.
Kepada adik-adikku tercinta, Dadi Pribadi, S.Kom, Sheila, S.Ked dan Alya
Adelia, Mas mengucapkan terima kasih atas limpahan kasih sayang dan tak
henti-hentinya memberikan doa, bantuan serta dorongan semangat kepada Mas
selama menjalani pendidikan ini.
Kepada seluruh kerabat dan handai taulan yang tidak dapat saya
sebutkan satu persatu, yang telah memberikan doa dan dorongan semangat,
saya mengucapkan terima kasih yang sebesar-besarnya.
Yang tercinta teman-teman sejawat residen yang mengikuti pendidikan
Magister dan Spesialis yang telah bersama-sama, baik suka maupun duka, saling
membantu sehingga terjalin persaudaraan yang erat. Saya doakan semoga kita
semua diberikan kemudahan dan keberhasilan, sehingga ilmu yang kita dapat
selama pendidikan ini bisa kita pergunakan untuk menolong orang banyak, amin.
Akhirnya izinkanlah penulis memohon maaf yang setulus-tulusnya atas
segala kesalahan dan kekurangan selama mengikuti pendidikan ini. Semoga
segala doa, bantuan, dorongan, petunjuk yang diberikan kepada saya selama
mengikuti pendidikan kiranya mendapat balasan yang berlipat ganda dari Allah
SWT, Yang Pemurah, Maha Pengasih dan Maha Penyayang, amin, amin ya rabbal
‘alamin.
Hormat saya,
DAFTAR ISI
Berbagai Gen Spesifik ... 13
3.8.Identifikasi Variabel ... 27
3.9.Defenisi Operasional ... 27
3.10.Rencana Pengolahan dan Analisa Data ... 28
BAB 4. HASIL PENELITIAN DAN PEMBAHASAN ... 29
4.1. Hasil Penelitian ... 29
4.1.1.Distribusi Berdasarkan Jenis Kelamin ... 29
4.1.2.Distribusi Berdasarkan Usia ... 29
4.1.3.Distribusi Berdasarkan Lokasi Tumor ... 30
4.1.4.Distribusi Berdasarkan Grade WHO ... 31
4.1.5.Distribusi Berdasarkan Jenis Histopatologi Tumor ... 31
4.1.6.Distribusi Berdasarkan Rekurensi Tumor ... 32
4.1.8.Distribusi Staining Intensity S100 Berdasarkan Jenis Kelamin ... 33
4.1.9. Distribusi Staining Intensity S100 Berdasarkan Usia ... 33
4.1.10.Distribusi Staining Intensity S100 Berdasarkan Lokasi Tumor 34
4.1.11.Distribusi Staining Intensity S100 Berdasarkan Grade WHO ... 35
4.1.12. Distribusi Staining Intensity S100 Berdasarkan Jenis Histopatologi ... 36
4.1.13.Distribusi Staining Intensity S100 Berdasarkan Rekurensi Tumor ... 37
4.2. Pembahasan ... 37
BAB 5. SIMPULAN DAN SARAN ... 39
5.1. Simpulan ... 39
5.2. Saran ... 39
DAFTAR PUSTAKA ... 40
DAFTAR SINGKATAN
SSP : Susunan Saraf Pusat
WHO : World Health Organization
EMA : Epithelial Membrane Antigen
GFAP : Glial Fibrilary Acidic Protein
MRI : Magnetic Resonance Imaging
Zn2+ : Zinc 2+
Cu2+ : Cuprum 2+
Ca2+ : Calcium 2+
RAGE : Receptor for Advanced Glycation Endproduct
IRMA : Immunoradiometric Assay
ELISA : Enzyme Linked Immunosorbent Assay
CNS : Central Nervous System
TBI : Traumatic Brain Injury
DAFTAR TABEL
Halaman
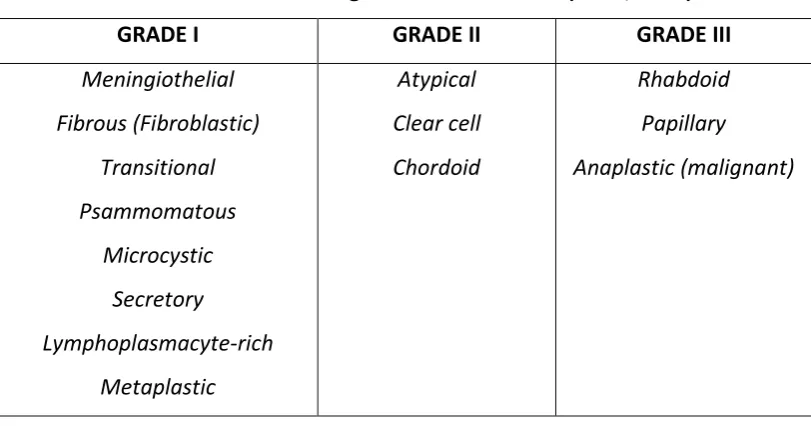
Tabel 2.1. Grading Meningioma Menurut WHO ... 8
Tabel 2.2. Simpson Grading Sistem ... 11
Tabel 2.3. Anggota S100 Protein Family dan Lokasinya pada Berbagai Gen Spesifik ... 14
Tabel 2.4. Hubungan Antara Anggota S100 Protein Family dan Beberapa Jenis Kanker ... 18
Tabel 4.1. Distribusi Berdasarkan Jenis Kelamin ... 29
Tabel 4.2. Analisa Deskriptif Berdasarkan Usia ... 30
Tabel 4.3. Distribusi Berdasarkan Lokasi Tumor ... 31
Tabel 4.4. Distribusi Berdasarkan Grade WHO ... 31
Tabel 4.5. Distribusi Berdasarkan JenisHistopatologi Tumor ... 32
Tabel 4.6. Distribusi Berdasarkan Rekurensi Tumor ... 32
Tabel 4.7. Distribusi Staining Intensity S100 dengan Meningioma ... 33
Tabel 4.8. Distribusi Staining Intensity S100 Berdasarkan Jenis Kelamin ... 33
Tabel 4.9. Distribusi Staining Intensity S100 Berdasarkan Usia ... 34
Tabel 4.10. Distribusi Staining Intensity S100 Berdasarkan Lokasi Tumor ... 35
Tabel 4.11. Distribusi Staining Intensity S100 Berdasarkan Grade WHO ... 36
Tabel 4.12. Distribusi Staining Intensity S100 Berdasarkan Jenis Histopatologi ... 36
DAFTAR GAMBAR
Halaman
Gambar 2.1. Struktur Dimer Protein S100 ... 13
Gambar 2.2. Gen S100 yang Terdapat pada Kromosom 1q21 ... 15
Gambar 2.3. Kerangka Konsep Penelitian ... 22
ABSTRAK
Tujuan: Studi ini menjelaskan dan mendeskripsikan ekspresi pewarnaan
imunohistokimia S100 pada meningioma.
Metode: Dari Pebruari 2010 sampai Pebruari 2013 diperoleh 31 spesimen sampel dari
31 pasien meningioma yang telah dilakukan operasi pengangkatan tumor di RSUP. H.
Adam Malik Medan. Spesimen ini sebelumnya telah dilakukan pewarnaan dasar
hematoxylin eosin dan telah dikonfirmasi dengan pewarnaan imunohistokimia Epithelial Membrane Antigene(EMA) sebagai meningioma. Slide yang representatif dibuat parafin blok dan selanjutnya dilakukan pewarnaan imunohistokimia S100. Staining intensity (SI)
dihitung skornya dari skala 0-3 (dari yang tidak menyerap warna sampai yang paling kuat
menyerap warna). Kemudian dilihat karakteristik jenis kelamin, usia, lokasi tumor,
grading meningioma World Health Organization (WHO), jenis histopatologi, dan rekurensi tumor dari spesimen meningioma yang mengekspresikan pewarnaan
imunohistokimia S100.
Hasil: Tiga puluh satu spesimen meningioma diklasifikasikan gradingnya menurut kriteria
WHO: benign 28/31 (90,3%), atypical 2/31 (6,5%) dan anaplastic 1/31 (3,2%). Ketiga
kriteria ini diklasifikasikan lagi menurut jenis histopatologinya. Meningothelial
meningioma merupakan jenis histopatologi yang paling banyak 17/31 (54,8%).Dari
keseluruhan spesimen sampel, hanya 11/31 (35,5%) spesimen yang mengekspresikan
pewarnaan S100, sisanya 20/31 (64,5%) tidak mengekspresikan pewarnaan S100. Dari
11 spesimen yang mengekspresikan pewarnaan S100, meningioma benign
mengekspresikan 8/28 (28,6%) dan fibroblastic meningioma merupakan jenis histopatologi yang paling kuat mengekspresikan S100 (+3).
Kesimpulan: Secara umum, hasil yang diperoleh dari studi ini sesuai dengan yang
dijelaskan oleh literatur sebelumnya. Namun perlu dilakukan studi lebih lanjut dengan
jumlah sampel yang lebih banyak dan merata dari setiap grading meningioma agar dapat
dianalisis hubungan antara grading meningioma WHO dengan derajat ekspresi
ABSTRACT
Objective: This study explores and describe the S100 immunohistochemical staining in
meningioma.
Methods: From February 2010 to February 2013 obtained 31 sample specimens from 31
patients who had meningioma undergo tumor removal surgery in the Adam Malik
General Hospital Medan. This specimen has previously been carried out basic
hematoxylin eosin staining and was confirmed as meningioma by Epithelial Membrane
Antigene (EMA) imunohystochemistry staining. Representative slides are made of
paraffin blocks and then performed S100 immunohistochemical staining. Staining
intensity (SI) was score on scale 0-3 (from no staining to strong staining). Then viewed
the characteristics of gender, age, location of tumor, World Health Organization (WHO)
meningioma grade, histopathologic type, and tumor recurrence of meningioma
specimens that express S100 immunohistochemical staining.
Results: Thirty-one specimens of meningioma classified according to WHO criteria:
benign 28/31 (90.3%), atypical 2/31 (6.5%) and anaplastic 1/31 (3.2%). These three
criteria are classified according to histopathologic type. Meningothelial meningioma is
the most widely histopathological types 17/31 (54.8%). Of the overall sample specimens,
only 11/31 (35.5%) specimens expressed S100 immunohistochemical staining, the
remaining 20/31 (64.5%) did not express. Of the 11 specimens that express S100
staining, benign meningiomas express 8/28 (28.6%) and fibroblastic meningiomas are
the most strong S100 immunohistochemical staining( +3) between all the
Conclusion: In general, the results obtained from this study correspond by previous
literature. However, further studies need to be conducted with a large sample and
evenly from each meningioma grade in order to analyze the correlation between WHO
ABSTRAK
Tujuan: Studi ini menjelaskan dan mendeskripsikan ekspresi pewarnaan
imunohistokimia S100 pada meningioma.
Metode: Dari Pebruari 2010 sampai Pebruari 2013 diperoleh 31 spesimen sampel dari
31 pasien meningioma yang telah dilakukan operasi pengangkatan tumor di RSUP. H.
Adam Malik Medan. Spesimen ini sebelumnya telah dilakukan pewarnaan dasar
hematoxylin eosin dan telah dikonfirmasi dengan pewarnaan imunohistokimia Epithelial Membrane Antigene(EMA) sebagai meningioma. Slide yang representatif dibuat parafin blok dan selanjutnya dilakukan pewarnaan imunohistokimia S100. Staining intensity (SI)
dihitung skornya dari skala 0-3 (dari yang tidak menyerap warna sampai yang paling kuat
menyerap warna). Kemudian dilihat karakteristik jenis kelamin, usia, lokasi tumor,
grading meningioma World Health Organization (WHO), jenis histopatologi, dan rekurensi tumor dari spesimen meningioma yang mengekspresikan pewarnaan
imunohistokimia S100.
Hasil: Tiga puluh satu spesimen meningioma diklasifikasikan gradingnya menurut kriteria
WHO: benign 28/31 (90,3%), atypical 2/31 (6,5%) dan anaplastic 1/31 (3,2%). Ketiga
kriteria ini diklasifikasikan lagi menurut jenis histopatologinya. Meningothelial
meningioma merupakan jenis histopatologi yang paling banyak 17/31 (54,8%).Dari
keseluruhan spesimen sampel, hanya 11/31 (35,5%) spesimen yang mengekspresikan
pewarnaan S100, sisanya 20/31 (64,5%) tidak mengekspresikan pewarnaan S100. Dari
11 spesimen yang mengekspresikan pewarnaan S100, meningioma benign
mengekspresikan 8/28 (28,6%) dan fibroblastic meningioma merupakan jenis histopatologi yang paling kuat mengekspresikan S100 (+3).
Kesimpulan: Secara umum, hasil yang diperoleh dari studi ini sesuai dengan yang
dijelaskan oleh literatur sebelumnya. Namun perlu dilakukan studi lebih lanjut dengan
jumlah sampel yang lebih banyak dan merata dari setiap grading meningioma agar dapat
dianalisis hubungan antara grading meningioma WHO dengan derajat ekspresi
ABSTRACT
Objective: This study explores and describe the S100 immunohistochemical staining in
meningioma.
Methods: From February 2010 to February 2013 obtained 31 sample specimens from 31
patients who had meningioma undergo tumor removal surgery in the Adam Malik
General Hospital Medan. This specimen has previously been carried out basic
hematoxylin eosin staining and was confirmed as meningioma by Epithelial Membrane
Antigene (EMA) imunohystochemistry staining. Representative slides are made of
paraffin blocks and then performed S100 immunohistochemical staining. Staining
intensity (SI) was score on scale 0-3 (from no staining to strong staining). Then viewed
the characteristics of gender, age, location of tumor, World Health Organization (WHO)
meningioma grade, histopathologic type, and tumor recurrence of meningioma
specimens that express S100 immunohistochemical staining.
Results: Thirty-one specimens of meningioma classified according to WHO criteria:
benign 28/31 (90.3%), atypical 2/31 (6.5%) and anaplastic 1/31 (3.2%). These three
criteria are classified according to histopathologic type. Meningothelial meningioma is
the most widely histopathological types 17/31 (54.8%). Of the overall sample specimens,
only 11/31 (35.5%) specimens expressed S100 immunohistochemical staining, the
remaining 20/31 (64.5%) did not express. Of the 11 specimens that express S100
staining, benign meningiomas express 8/28 (28.6%) and fibroblastic meningiomas are
the most strong S100 immunohistochemical staining( +3) between all the
Conclusion: In general, the results obtained from this study correspond by previous
literature. However, further studies need to be conducted with a large sample and
evenly from each meningioma grade in order to analyze the correlation between WHO
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Meningioma adalah suatu tumor jinak yang terjadi pada selaput otak
susunan saraf pusat. Meningioma berasal dari arachnoid cap cells, suatu lapisan
neuroektodermal yang membentuk lapis luar dari selaput araknoid dan vili
araknoid. Tumor ini terjadi sekitar 20% dari semua tumor primer intrakranial
dengan insiden yang telah dilaporkan sebesar 4,4 per 100.000 orang per tahun
dan terdiagnosis pada rata-rata penderita berumur 63 tahun (Marwin, 2010).
Meningioma merupakan tumor jinak dengan prognosis yang baik, pemahaman
akan sifat neurobiologis tumor akan mengakibatkan perbaikan umum pelayanan
kesehatan.
Sampai saat ini, ekspresi protein S100 diyakini hanya terbatas pada sel
glial dalam sistem saraf pusat (SSP). Namun, beberapa peneliti telah
menunjukkan distribusi protein S100 diluar SSP yaitu, protein S100 secara
immunohistokimia terlokalisasi dalam sel-sel stellata dari adenohipofisis, dalam
sel-sel satelit dorsal root ganglion dan medula adrenal, dalam melanosit dan
sel-sel di kulit, dalam sel-sel-sel-sel kondrosit dan sel-sel-sel-sel kelenjar getah bening retikular dan
spleen. Disisi lain, melanoma ganas, granular sel myoblastoma dan malignant
histiocytosis juga ditemukan mengandung protein S100 selain tumor glial dan
schwannoma. Dengan demikian, protein S100 tidak dianggap benar-benar
sebagai protein spesifik pada SSP, tetapi umumnya dipercaya bahwa sel-sel yang
disebutkan diatas, terlepas dari jaringan normal atau ganas, berasal dari
neuroektoderm dan mesenkim.
Ekspresi pewarnaan histokimia S100 pada meningioma tertentu tidak
terduga. Meningioma biasanya dianggap mewakili tumor yang timbul dari
meningen. Para embriolog menjelaskan bahwa sel dari leptomening berasal dari
neural crest, sedangkan sel-sel lain dari meningen adalah sel fibroblas yang
mudah untuk memahami mengapa meningioma memiliki berbagai penampilan
histologis, dan mengapa meningioma sering merupakan bagian dari displasia
herediter dari neural shets yang dikenal sebagai penyakit Von Recklinghausen
(Tabuchi, 1984).
Pewarnaan imunohistokimia S100 merupakan pewarnaan standar untuk
melanoma dan schwannoma. Pewarnaan imunohistokimia S100 cukup jarang
digunakan untuk menegakkan diagnosis meningioma. Penulis juga belum
mendapatkan suatu literatur yang spesifik menggambarkan karakteristik
meningioma (grade, jenis histopatologi dll.) dengan ekspresi pewarnaan S100.
1.2. Perumusan Masalah
Berdasarkan uraian dalam latar belakang masalah di atas, dirumuskan
pertanyaan penelitian sebagai berikut “Bagaimanakan gambaran/ekspresi
pewarnaan imunohistokimia S100 pada pasien meningioma di Rumah Sakit
Umum Pusat Haji Adam Malik Medan?”
1.3. Tujuan Penelitian
1.3.1. Tujuan Umum
Untuk mengetahui gambaran/ekspresi pewarnaan imunohistokimia S100
pada meningioma
1.3.2 Tujuan Khusus
1. Untuk mengetahui karakteristik demografi (jenis kelamin dan usia) penderita
meningioma di RSUP H. Adam Malik Medan pada periode Pebruari 2010 –
Pebruari 2012.
2. Untuk mengetahui karakteristik penderita meningioma (lokasi tumor, grade
WHO, jenis histopatologi, rekurensi tumor) di RSUP H. Adam Malik Medan
3. Untuk mengetahui karakteristik gambaran/ekspresi pewarnaan
imunohistokimia S100 pada penderita meningioma di RSUP H. Adam Malik
Medan pada periode Pebruari 2010 – Pebruari 2012.
4. Untuk mengetahui karakteristik gambaran/ekspresi pewarnaan
imunohistokimia S100 dengan jenis kelamin di RSUP H. Adam Malik Medan
pada periode Pebruari 2010 – Pebruari 2012.
5. Untuk mengetahui karakteristik gambaran/ekspresi pewarnaan
imunohistokimia S100 dengan usia di RSUP H. Adam Malik Medan pada
periode Pebruari 2010 – Pebruari 2012.
6. Untuk mengetahui karakteristik gambaran/ekspresi pewarnaan
imunohistokimia S100 dengan lokasi tumor di RSUP H. Adam Malik Medan
pada periode Pebruari 2010 – Pebruari 2012.
7. Untuk mengetahui karakteristik gambaran/ekspresi pewarnaan
imunohistokimia S100 dengan grade WHO di RSUP H. Adam Malik Medan
pada periode Pebruari 2010 – Pebruari 2012.
8. Untuk mengetahui karakteristik gambaran/ekspresi pewarnaan
imunohistokimia S100 dengan jenis histopatologi di RSUP H. Adam Malik
Medan pada periode Pebruari 2010 – Pebruari 2012.
9. Untuk mengetahui karakteristik gambaran/ekspresi pewarnaan
imunohistokimia S100 dengan PTEI di RSUP H. Adam Malik Medan pada
periode Pebruari 2010 – Pebruari 2012.
10. Untuk mengetahui karakteristik gambaran/ekspresi pewarnaan
imunohistokimia S100 dengan rekurensi tumor di RSUP H. Adam Malik
Medan pada periode Pebruari 2010 – Pebruari 2012.
1.4 Manfaat Penelitian
1. Mendapatkan gambaran/ekspresi pewarnaan imunohistokimia S100 pada
2. Hasil penelitian ini diharapkan akan memberikan kontribusi ilmiah dalam
penanganan meningioma dan akan bermanfaat untuk meningkatkan upaya
peningkatan kesehatan masyarakat khususnya dalam bidang bedah saraf.
3. Sebagai bahan masukan untuk penelitian selanjutnya mengenai pewarnaan
BAB 2
TINJAUAN PUSTAKA
2.1. Meningioma
2.1.1. Sejarah dan Definisi
Meningioma adalah sebuah penamaan yang diberikan oleh Harvey
Cushing pada tahun 1922 untuk mendeskripsikan suatu tumor jinak pada selaput
otak susunan saraf pusat (Al-Rodhan dan Laws, 1991).
Pada abad 18 dan 19 meningioma hanya dapat terdiagnosa pada pasien
bila pasien tersebut mengalami perubahan pada tulang tengkorak yang
didekatnya, sehingga tampak pada inspeksi maupun palpasi. Hanya sedikit usaha
pembedahan yang dilakukan untuk mengangkat lesi ini, dan hanya sedikit saja
yang menguntungkan pasien. Dari 13 operasi yang dilakukan antara tahun 1743
dan 1896, 9 pasien mengalami kematian.
Pada 1894 John Cleland, seorang profesor anatomy di Glasgow
menemukan bahwa dua tumor meningioma yang ditemukannya di ruang diseksi,
berasal dari arachnoid dan bukan duramater. Pada 1915 pendapat ini kembali
ditegaskan oleh Cushing dan Weed (Louis et al, 2000).
Tumor ini kemudian telah mendapatkan berbagai penamaan termasuk
fungoid tumor, sarcoma, cylindroma, endothelioma, dan fibroma. Cushing
mengajukan nama mengiothelioma sebagai usaha untuk menjelaskan tumor ini
berdasarkan jaringan yang terlibat. Cushing berusaha untuk menghindarkan
nama histologis karena pada saat tersebut komposisi tumor masih belum jelas,
dia juga berusahan menghindarkan penggunaan nama berdasar letak anatomis
karena tumor ini dapat terdapat pada daerah yang sangat bervariasi. Kemudian
Cushing lebih memilih untuk menggunakan nama meningioma (Chou dan Miles,
2.1.2. Epidemiologi
Pada penelitian di Rochester, Minnesota, Amerika Serikat, yang dilakukan pada
tahun 1935 hingga 1977, meningioma terdistribusi sebanyak 40%, tetapi
penelitian epidemiologi tahun 1985 di negara yang sama melaporkan 20% dari
tumor intrakranial adalah meningioma dengan insiden kejadian meningioma
yang semakin meningkat seiring dengan pertambahan usia, sebesar 4,4 per
100.000 orang pertahun. Meningioma terdiagnosis pada rata-rata penderita
berumur 63 tahun (Marwin et al, 2010) dengan predominasi perempuan
terhadap laki-laki dengan rasio sebesar 2 : 1. Pada anak-anak, meningioma kerap
terjadi 1% hingga 4% dari semua tumor otak. Umur rata-rata pada saat
terdiagnosis adalah 11,6 tahun, dibandingkan dengan umur 6,3 tahun untuk
tumor-tumor intrakranial lainnya pada anak (Otsuka et al, 2004; Al-Mefty et al,
2011).
2.1.3. Patologi
Meningioma biasanya berbentuk globular dan berkapsul. Tumor ini
melekat pada dura dan dapat menekan jaringan otak yang berdekatan tanpa
menginvasinya. Walaupun invasi dura dan sinus biasa terjadi, meningioma
biasanya mudah dipisahkan dari pia mater (Al-Mefty et al, 2011). Meningioma
berasal dari lapisan neuroektodermal yang membentuk arachnoid cap cells, yang
membentuk lapisan luar dari selaput araknoid dan vili araknoid. Seiring dengan
pertambahan umur, kelompok-kelompok arachnoid cap cell akan menjadi lebih
jelas, membentuk whorls dan psammoma bodies yang identik dengan
meningioma (Psammos dalam bahasa Yunani memiliki pengertian ‘pasir’).
Meningioma memiliki tampilan mesenkimal (sel berbentuk spindle dan produksi
stroma kolagen) dan epitelial (sitologi bulat atau poligonal, adanya sejumlah
intracellular junctions, ekspresi epithelial membrane antigen (EMA) dan
fungsi-fungsi sekresi seperti kelenjar, yang dapat digunakan untuk membantu diagnosis
membedakan meningioma dengan arachnoid cap cells matur (Marwin et al,
Pada gambaran struktur ultra yang tampak pada mikroskop elektron,
meningioma memiliki gambaran yang menyerupai vili arachnoid normal:
interdigitasi yang prominen dari membran plasma, filamen intermediate
sitoplasma yang sangat banyak dan secara imunohistokimia konsisten dengan
vimentin, dijumpainya hemidesmosome, dan deposit interselular fokal yang
terdiri dari material granular yang kaya elektron. Arachnoid dan sel meningioma
terhubung oleh epithelial cadhenrins (E-cadherins), yang merupakan molekul
adhesi yang tergantung Ca2+, dan keduanya mengekspresikan
gluotathione-independent prostaglandin D2 synthase.
Gambaran histologi meningioma meningothelial (syncytial) memiliki ciri
sel yang tersusun rapat dengan batas sitoplasma yang tidak jelas.
2.1.4. Klasifikasi
Pada tahun 2000, WHO mengklasifikasikan meningioma pada bagian
tumor-tumor dari susunan saraf pusat (Tumors of the nervous system) di bawah
bagian tumor dari meninges dan sub-bagian tumor dari sel-sel meningothelial.
WHO mengenal tiga derajat berdasarkan kriteria patologinya dan risiko rekurensi
serta pola pertumbuhannya (Al-Mefty et al, 2011).
Menurut klasifikasi WHO, meningioma dibagi menjadi 3 grade, yaitu
Jinak (Benign : Grade I), Atipikal (Atypical : Grade II), dan Ganas (Malignant :
Grade III). (Tabel 2.1). Meningioma meningothelial, meningioma fibrous
(fibroblastik), meningioma transisional, meningioma psammomatous,
meningioma angiomatosa, meningioma mikrokistik, meningioma sekretorik,
meningioma lymphoplasmacyte-rich, meningioma metaplastik diklasifikasikan
sebagai grade I. Meningioma chordoid, meningioma clear-cell, meningioma
atypical diklasifikasikan sebagai grade II. Meningioma papillary, meningioma
rhabdoid, meningioma anaplastik diklasifikasikan sebagai grade III. Distribusi
meningioma intrakranial adalah sebagai berikut: convexity (35%), para sagittal
infratentorial (13%), dan lain-lain (4%) (Otsuka, 2004; Louis, 2000; Marwin et al,
2010).
Lokasi umum meningioma primer dari urutan paling sering adalah
parasagital, cavernous, tubercullum sellae, lamina cribrosa, foramen magnum,
zona torcular, tentorium cerebelli, sudut serebelopontin, dan sinus sigmoid.
Meningioma dengan frekuensi lebih rendah dapat terjadi di medula spinalis,
intraventricular, orbita (optic nerve sheath dan foramina opticum), intraoseus
(tulang temporal petrosa), pineal, ekstrakalvaria, dan ektopik (cavum nasi, sinus
paranasal, glandula parotis, paru-paru, glandula adrenal, dan mediastinum (Chou
dan Miles, 1991; Otsuka, 2010).
Selain yang telah disebutkan di atas, berdasarkan Bitzer et al (1998),
lokasi meningioma dapat diklasifikasikan berdasarkan lokasinya pada
konveksitas, falx, sphenoid wing, frontobasal, temporobasal, supraselar,
tentorial, infratentorial, dan lainnya.
Berdasarkan pola pertumbuhannya, meningioma dapat tumbuh sebagai
suatu masa (en masse) atau tumbuh memanjang seperti karpet (en plaque).
Varian en plaque pada awalnya dideskripsikan oleh Cushing sebagai suatu
karakteristik tipikal meningioma sphenoid ridge, yang dapat juga disebut sebagai
“hyperostosing en plaque meningiomas”. Deskripsi ini kemudian direvisi oleh
Bonnal pada tahun 1980, dengan tipe-tipe dari meningioma sphenoid ridge
adalah : en masse, invading en plaque, dan invading en masse. En masse adalah
meningioma globular klasik, meningioma invading en plaque didefinisikan
sebagai tumor berbentuk seperti karpet dengan adanya abnormalitas tulang,
sedangkan meningioma en masse didefinisikan sebagai bentuk antara dari en
masse klasik dan meningioma invading en plaque dengan perlekatan dura yang
Tabel 2.1. Grade meningioma menurut WHO (Louis, 2000)
Secara mikroskopis, meningioma fibroblastic menunjukkan gambaran sel
spindel yang memanjang dan tersusun berlapis-lapis. Stroma terdiri dari serat
reticulin dan kolagen. Meningioma transitional merupakan kombinasi tipe
meningothelial dan fibroblastic. Tipe ini memiliki ciri kumparan selular, yang
dipisahkan oleh sel spindel yang memanjang. Variasi pada histologi meningioma
dapat menunjukkan mutasi pada lokus genetik yang berbeda, dimana loss of
heterozytosity pada kromosom 22 lebih umum dijumpai pada tipe fibroblastic
dibanding varian meningothelial (Chou dan Miles, 1991).
Banyak varian meningioma lain yang telah dilaporkan termasuk
psammomatous, angiomatous, microcystic (humid), xanthomatous, lipoblastic,
myxoid (myxomatous), osteoblastic, chondroblastic, secretory, melanotic,
lymphofollicular, chordoid, hemangiopericytic, oncocytic, dan papillary. Tidak
semua istilah untuk varian ini digunakan pada saat ini.
Meningioma atypical berhubungan dengan angka rekurensi yang lebih
tinggi dan pertumbuhan yang lebih agresif. Kriteria yang digunakan untuk
mendiagnosa meningioma atipikal tidak tergantung pada subtipe meningioma.
Meningioma atipikal menunjukkan gambaran peningkatan aktifitas mitosis atau
tiga atau lebih gambaran berikut: peningkatan selularitas, sel kecil dengan rasio
tak berpola atau sheetlike growth, dan fokus nekrosis. Untuk varian ini,
peningkatan aktifitas mitosis telah dideskripsikan sebagai empat atau lebih
mitosis per 10 kali pembesaran kuat (high power field). (Otsuka, 2010).
Definisi pasti dari meningioma maligna dan anaplastik masih menjadi
perdebatan. Satu ciri khusus yang tidak diragukan lagi menjadi ciri meningioma
maligna adalah: metastasis ekstraneural jauh. Tempat tersering yang menjadi
metastase meningioma adalah liver, paru, pleura, dan lymph nodes.
Pemeriksaan epithelial membrane antigen (EMA) adalah positif pada 80%
meningioma. Hasil pewarnaan S-100 adalah cukup bervariasi. Meningioma juga
mengekspresikan marker untuk fibroblasts (vimentin) dan sel epitel (EMA dan
cytokeratins). Antileu7, merupakan antibody yang ditemuaka pada schwannoma,
tidak ditemukan pada meningioma. Glial fibrillary acidic protein (GFAP) juga
negatif pada meningioma. Meningioma meningothelial dan syncytial
mengekspresikan E-cadherin. (Talacchi et al, 2011).
2.1.5. Radiologi
Foto polos pada meningioma menunjukkan tiga temuan khas:
hyperostosis, peningkatan gambaran vaskularisasi, dan kalsifikasi. Pada CT non
kontras, meningioma secara tipikal menunjukkan gambaran isodense sampai
sedikit hyperdense. Kalsifikasi dapat dijumpai. Meningioma biasanya menyangat
kontras dengan homogen dan kuat. Tumor ini berbatas tegas dan biasanya
terletak pada struktur tulang atau pun dura. Manifestasi perubahan tulang yang
sering dijumpai adalah hyperostosis. Sekitar 15% meningioma benigna memiliki
gambaran yang tidak khas, termasuk nekrosis sentral atau dijumpainya kavitasi
kista (cystic meningioma). Edema peritumoral yang mengelilingi meningioma
bervariasi. Dura mater yang melekat dapat menunjukkan penyangatan kontras,
temuan ini dikenal sebagai dural tail.
Pada T1WI MRI, 60% meningioma adalah isointense dan 30% lainnya
sedikit hypointense dibandingkan dengan gray matter. Pada T2WI, tumor
Gambaran hyperintense pada T2WI mengindikasikan tingginya kandungan air,
sering dijumpai pada meningioma meningothelial, vaskular, atau yang agresif.
2.1.6. Terapi pembedahan dan rekurensi tumor
Terapi definitif satu-satunya untuk meningioma adalah reseksi bedah
total. Semakin sedikit tumor yang tersisa, akan memberikan kesempatan
rekurensi tumor yang lebih kecil. Pada 1957 Simpson memperkenalkan lima
tingkatan klasifikasi untuk reseksi bedah pada meningioma (Tabel 2.2.).
Tabel 2.2. Simpson Grading Sistem (Simpson, 1957)
GRADE DESCRIPTION 10 Years Recurrence
I Macroscopically complete tumor remofal with excision of the tumor’s dural attachment and any abnormal bone
9 %
II Macroscopically complete tumor removal with coagulation of its dural attachment
19%
III Macroscopicallay complete removal of the intradural tumor without resection of coagulation of its dural attachment or extradural extension
29%
IV Subtotal removal of the tumor 40% V Simple decompression of the tumor
Rekurensi untuk grade I adalah sekitar 10%; tumor dengan grade II
memiliki angka rekurensi dua kali lebih tinggi. Angka rekurensi tumor jauh lebih
tinggi sesuai dengan Simpson grade. Reseksi tumor yang menyertakan reseksi
tambahan pada dura mater sejauh 2 cm dikenal sebagai grade 0. Pada satu studi
disebutkan bahwa tidak dijumpai rekurensi pada pasien yang mendapatkan
reseksi dengan Simpson grade 0. (Talacchi et al, 2011)
2.1.7. Prognosis
Meningioma memiliki prognosis yang berbeda pada setiap klasifikasi atau
derajatnya. Invasi parenkim otak dan lokasi anatomi akan memengaruhi
pada ala sphenoidalis atau invasi struktur yang penting seperti sinus venosus
akan menimbulkan kesulitan dalam total removal dari tumor sehingga
menimbulkan angka rekurensi yang tinggi. Walaupun meningioma yang berbatas
tegas dapat diangkat secara keseluruhan, meningioma yang memiliki ekstensi ke
ruang subdural (10% kasus) akan sulit untuk direseksi seluruhnya, seperti pada
meningioma en plaque. Selain dari invasi parenkim dan lokasi anatomi, rekurensi
juga kerap terjadi pada meningioma yang memiliki profil ganas, seperti pada pola
hemangiopericytic atau papiler. Kriteria selular keganasan adalah adanya mitosis,
peningkatan selularitas, polimorfisme inti sel, dan nekrosis fokal. Indeks mitosis
yang tinggi juga salah satu aspek yang mengarah pada keganasan (Al-Mefty et al,
2011).
2.2. Protein S100
Anggota dari ‘S100 protein family’ merupakan protein multifungsional
dengan berbagai peran dalam proses selular. Protein S100 bekerja dengan
perantaraan ikatan kalsium, walaupun nampaknya Zn2+ dan Cu2+ juga memiliki
peranan dalam aktifitas biologis protein ini.
Anggota ‘S100 protein family’ yang paling banyak dipelajari adalah
protein S100B, yang memiliki aktifitas neurotropik (pada konsentrasi fisiologis)
atau neurotoksik (pada konsentrasi tinggi). Ekspresi protein ini baik pada serum
maupun pada pewarnaan imunohistokimia dijumpai pada berbagai kelainan
klinis. Ekspresi imunohistokimia protein ini telah secara umum dikenal sebagai
petanda untuk tumor schwannoma dan melanoma.
2.2.1. Struktur dan Fungsi Protein S100
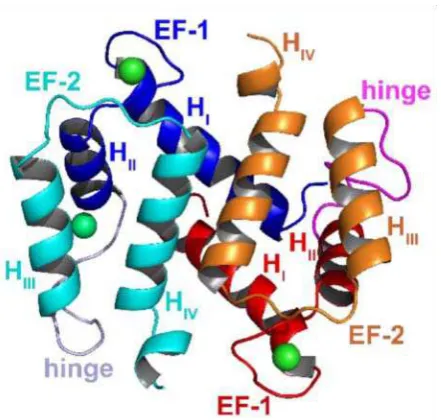
‘S100 protein family’ memiliki subgrup lengan EF pengikat Ca2+. Protein
ini disebut S100 dikarenakan kelarutannya dalam ammonium sulfat pada pH
normal sebesar 100%. Protein ini pertama kali diidentifikasi oleh B.W.Moore
pada 1965 (Moore, 1965).
Protein S100 merupakan protein asam berukuran kecil, 10-12kDa, dan
region’ dengan panjang yang bervariasi dan juga domain N- dan C- terminal.
Berbeda dengan gen S100 yang sangat banyak terdapat pada vertebrata, protein
ini tidak dijumpai pada invertebrata. Sampai sekarang ini terdapat paling sedikit
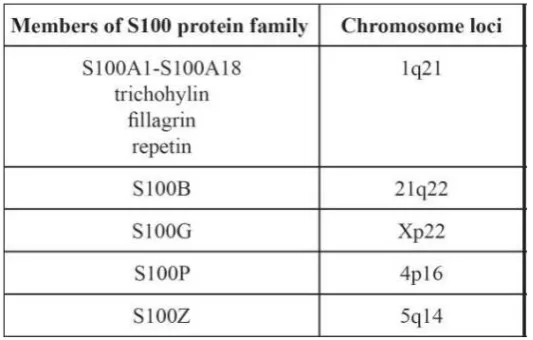
25 protein yang telah teridentifikasi sebagai anggota S100 protein family, dimana
21 diantaranya memiliki gen pada kromosom lokus 1q21. Kelompok gen ini
dikenal sebagai kompleks diferensiasi epidermal (Marenholz, 2004; Donato,
2003).
Gambar 2.1. Struktur dimer protein S100. Protein S100 dapat dijumpai dalam
bentuk homodimer, heterodimer, dan oligodimer. Setiap monomer terdiri dari
dua lengan EF yang dihubungkan oleh hinge region (Heizmann, 2002).
2.2.2. Anggota dari S100 protein family dan lokasinya pada berbagai gen
spesifik
Keluarga protein S100 merupakan protein multifungsional yang
diekspresikan pada banyak jaringan. Interaksi protein S100 dengan berbagai
dengan berbagai protein efektor dalam sel berperan dalam berbagai proses
selular seperti kontraksi, motilitas, diferensiasi dan pertumbuhan sel, progresi
sitoskeleton, proteksi sel terhadap kerusakan sel oksidatif, fosforilasi protein dan
sekresi (Santamaria, 2006).
Variasi fungsi protein S100 ini nampaknya disebabkan oleh:
1. Diversifikasi yang luas pada anggota protein S100 (25 anggota pada
manusia)
2. Perbedaan ikatan metal ion yang berbeda-beda pada setiap protein S100
3. Distribusi ruang pada kompartemen intraselular spesifik atau
kompartemen ekstraselular
4. Kemampuan protein S100 untuk membentuk homodimer dan
heterodimer non kovalen, sehingga memungkinkan pertukaran subunit
S100
Protein S100 tidak memiliki kapasitas katalis intrinsik. Protein ini secara
umum memiliki cara kerja yang mirip dengan calmodulin dan troponin C, yang
mengalami perubahan struktur dan memodulasi aktifitas biologis melalui ikatan
kalsium (Ikura 1996).
Tabel 2.3. Anggota S100 protein familly dan lokasinya pada berbagai gen
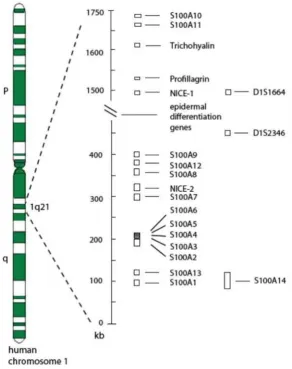
Gambar 2.2. Gen S100 yang terdapat pada kromosom 1q21. Kebanyakan gen
S100 pada manusia terletak pada kompleks diferensiasi epidermal pada
kromosom 1q21, yang merupakan area yang rentan terhadap penyusunan
ulang. Protein S100B, S100P, S100Z dan S100G terletak pada kromosom 21q22,
4p16, 5q14 dan Xp22 (Heizmann, 2002).
S100B yang merupakan salah satu protein pada S100 protein family yang
paling banyak dipelajari, interaksi protein ini dengan RAGE (Receptor for
Advanced Glycation Endproduct) telah terdokumentasi (Donato, 2007; Donato et
al., 2008; Leclerc et al., 2009).
S100B secara spesifik terdapat dalam jumlah yang besar di otak dan
diekspresikan oleh astrosit, oligodendrosit, dan sel Schwann. Protein ini diduga
menghasilkan efek neurotropik dan neurotoksik yang tergantung pada
konsentrasinya pada sel neuron (Donato et al., 2008).
S100 juga mengaktifasi microglia, dan mungkin berperan dalam
patogenesis kelainan neurodegeneratif. S100B diekspresikan berlebih pada
astrositoma dan glioblastoma (Camby et al., 1999), schwannoma dan melanoma
(Salama et al., 2008).
2.2.3 Metode dan Pengukuran
Protein S100 dapat dideteksi dengan berbagai metoda analisa seperti
immunoradiometric assay (IRMA), mass spectroscopy, western blot, ELISA
(enzyme linked immunosorbent assay), electrohemiluminence dan PCR
kuantitatif, dapat mendeteksi perubahan ekspresi imunohistokimia atau pada
serum dengan sensitifitas tinggi, sehingga dapat menjadi alat ukur penting pada
diagnosa klinis (Sangtec Medical, 2000).
Protein S100B (homodimer dari subunitβ) memiliki berat molekul sebesar
21kD dan dikodekan dari lengan panjang kromosom 21 (21q22.3). Waktu paruh
dari S100B adalah sekitar 30 menit. Peningkatan kadar serum protein S100
secara persisten mengindikasikan adanya pelepasan secara terus menerus dari
jaringan yang terlibat. Protein S100 dieliminasi melalui ginjal (Wild, 2001).
Penyakit yang berhubungan dengan perubahan ekspresi protein S100
dapat diklasifikasikan dalam 4 kategori.
1. Kelainan Neurologis
Sebagaimana GFAP (glial fibrillary acidic protein), protein S100B
diproduksi oleh astrosit pada CNS, peningkatan ekspresi protein ini menandakan
adanya aktifitas astrosit (Steiner, 2007).
Protein S100B lebih tidak spesifik dibandingkan dengan GFAP, dimana
protein ini terdapat pada berbagai jenis sel neural. Efek autokrin protein ini pada
astrosit (upregulation dari IL-6, ekspresi TNF-alpha) dimediasi melalui interaksi
Sekresi S100B merupakan proses awal respon sel glia terhadap cedera
metabolik (kekurangan oksigen, serum, glukosa). Hubungan antara kondisi stress
(cedera otak, gangguan sawar darah otak, iskemik) dan kadara serum S100
nampaknya tergantung glucocorticoid (Scaccianoce, 2004).
Traumatic brain injuries (TBI) result in an increase in S100B levels in blood
and CSF.
Cedera otak traumatik akan mengakibatkan peningkatan kadar S100 pada
serum dan juga pada cairan serebrospinal. Setelah terjadinya cedera otak
traumatik, terjadi peningkatan konsentrasi S100B dan S100A1B pada 31% dan
48% pasien, tanpa hubungan yang signifikan dengan tanda dan gejala gangguan
kognitif.
S100B juga dihasilkan oleh jaringan ekstraserebral, terutama sel lemak
dan kondrosit, oleh karena itu interpretasi peningkatan kadar serum S100B
sebagai marker cedera otak harus dilakukan secara berhati-hati.
Kenaikan kadar serum S100B tergantung pada integritas sawar darah
otak. Oleh karena itu peningkatan dini S100 setelah cedera otak traumatik
berhubungan baik dengan gangguan sawar darah otak maupun ekspresi aktif dari
jaringan otak yang terlibat pada reaksi inflamasi sistemik.
Peranan S100 pada cedera otak merupakan bidang yang sedang diteliti
secara luas, beberapa studi menunjukkan indikasi bahwa S100B dapat
menurunkan cedera neuronal dan/atau berperan dalam proses perbaikan
neuron setelah cedera otak traumatik, memicu penyembuhan luka pada trauma
dan memiliki aktifitas tropik parakrin pada jaringan disekitarnya (Sedaghat,
2008).
2. Kelainan Neoplastik
Terdapat berbagai tumor yang menunjukkan ekspresi protein S100;
antara lain S100B, S100A2, S100A4, S100A6, dan S100P (Hsieh, 2003).
S100-RAGE signalling pathway memainkan peranan penting dalam
RAGE rendah akan mengalami akselerasi apoptosis, penurunan aktifasi NFκB dan
secara signifikan mengakibatkan gangguan proliferasi (Semov, 2005).
Peningkatan kadar S100A4 (metastasin) berhubungan dengan survival
rate yang rendah pada pasien dengan kanker payudara, dan pada tikus terbukti
menginduksi metastase. Peningkatan konsentrasi serum S100A4 juga ditemukan
pada tumor esofagus dan kolon, pankreas, paru, kandung kemih dan
berhubungan dengan hasil akhir yang lebih buruk dan aktifitas tumor yang lebih
agresif (Semov, 2005).
Terdapat sekresi S100B yang tinggi pada melanoma maligna, yang
berhubungan dengan stadium dan prognosa tumor. Kadar serum S100B
digunakan sebagai petanda untuk deteksi dini dan rekurensi tumor (Von, 1996).
Hubungan antara anggota S100 protein family dan beberapa jenis kanker
tampak pada tabel 2.4.
Tabel 2.4. Hubungan antara anggota S100 protein family dan beberapa jenis
kanker
Walaupun pada kebanyakan kasus peranan protein S100 pada kanker
masih belum diketahui dengan jelas, pola ekspresi spesifik protein ini dapat
gen supressor tumor p53 dan menghambat fosforilasi, sehingga mengakibatkan
down regulation p53 yang tergantung kalsium.
Berbagai studi telah dilakukan untuk mengetahui peranan p53 wild type
pada neoplasma yang berhubungan dengan S100B melalui inhibisi interaksi p53
dan S100B.
Protein S100 lain menghasilkan efek berbeda terhadap aktifitas p53
(S100A2 memicu aktifitas transkripsi p53, dan sebagainya)
3. Kelainan Jantung
S100A1 secara spesifik diekspresikan dalam konsentrasi tinggi pada
miokardium mamalia, dimana protein ini memodulasi kontraktilitas jantung
melalui interaksi protein ini dengan filamen kontraktil dan dengan protein pada
retikulum sarkoplasma (Ehlermann, 2000).
Kombinasi Skala Koma Glasgow (<6 poin) dengan peningkatan
konsentrasi serum dari NSE (>65ng/mL) dan S100 (> 1.5μg/l) pada 48-72 jam setelah resusitasi kardiopulmonar pada pasien yang mengalami cardiac arrest,
merupakan faktor prediktor hasil akhir neurologis dan gangguan kognitif dengan
spesifitas 100% (sensitifitas 42%) (Ekmektzoglou, 2007; Grubb, 2007).
Peningkatan S100 sendiri meningkatkan risiko kematian dan persistent
vegetative state sebesar 12,6 kali lipat (Carrier, 2006).
4. Penyakit Inflamasi
S100A8, S100A9, dan S100Al2, diekspresikan secara predominan pada sel
fagosit dan berhubungan kuat dengan fungsi proinflamasi. Protein-protein ini
disekresikan terutma pada tempat inflamasi. Konsentrasi serum dari protein
S100 berhubungan dengan aktifitas penyakit inflamasi; seperti rheumatoid
arthritis, bronkhitis kronis, dan sistik fibrosis (Foell, 2004).
S100A7, S100A8, S100A9, dan S100A12 mengalami proses upregulation
pada lesi psoriasis aktif dan berbagai penyakit inflamasi epidermis lain,
Peningkatan kadar S100B pada urin yang ditemukan pada bayi baru lahir
dengan gangguan pertumbuhan dalam rahim pada minggu pertama sesudah
kelahiran berhubungan dengan tingkat kerusakan otak. Kadar S100B
berhubungan dengan derajat gangguan neurologis bayi tersebut (Florio, 2006).
2.2.4. S100 dan Meningioma
Marker diagnostik meningioma terpenting adalah imunoreaktifitas
membaran terhadap EMA (Epithelial Membrane Antigen) (Abramovich, 1999;
Burger 2007)
Dari subtipe dasar meningioma, pewarnaan imunohistokimia EMA
mungkin lebih jelas pada tipe meningothelial dan transisional dibandingkan pada
tipe fibrous.
Sekitar 20% meningioma reaktif terhadap pewarnaan S100, dimana
meningioma tipe fibrous merupakan varian yang paling reaktif terhadap
pewarnaan ini. (Burger, 2007; Sav 2010)
Dari semua anggota keluarga S100, hanya ekspesi S100A5 yang
berhubungan dengan nilai prognostik signifikan terhadap rekurensi tumor.
Analisa regresi Cox menunjukkan nilai prognostik yang signifikan ini independen
terhadap usia pasien. Kombinasi dari usia pasien dan pewarnaan S100A5
memungkinkan identifikasi kelompok pasien yang memiliki risiko tinggi
mengalami rekurensi tumor. Hancq S et al menyimpulkan bahwa S100A5
mungkin memiliki peranan terhadap rekurensi meningioma grade I WHO yang
telah direseksi total (Hancq, 2004).
Dijumpainya protein S100 pada beberapa tipe meningioma bukan
merupakan hal yang tidak terduga. Spesimen baru meningioma kadang-kadang
menunjukkan jejak atau reaksi positif terhadap protein S100 pada
microcomplement fixation assay.
Meningioma secara umum dianggap merupakan tumor yang berasal dari
berasal dari sel neural crest embryo, sementara sel meningen lain adalah
fibroblast yang berasal dari jaringan mesenkim disekitarnya. Penjelasan ini
memudahkan pengertian mengapa meningioma memiliki berbagai tampilan
histologi, dan mengapa meningioma sering menjadi bagian kelainan displasia sel
selubung saraf yang dikenal sebagai penyakit von Recklinghausen
(Neurofibromatosis tipe I).
Alasan mengapa distribusi protein S100 yang berbeda diantara subgrup
meningioma belum dapat dimengerti sepenuhnya. Peneliti menduga sel glia yang
terletak berdekatan dengan meningioma mungkin terlibat dalam pembentukan
tumor dan mengalami stimulasi untuk proliferasi oleh sel tumor. Namun
tampaknya teori ini tidak sesuai dengan sifat meningioma yang tumbuh lambat,
globular, dan sangat jarang menginfiltrasi jaringan otak.Teori lain menyebutkan
meningioma yang berasal dari prekursor non neuronal mungkin mensintesa
protein S100 de novo sebagai akibat ekspresi gen yang berubah menjadi maligna.
Teori ini juga memiliki kelemahan karena kenyataannya meningioma adalah
tumor yang secara biologis bersifat jinak.
Teori histogenesis menjelaskan bahwa meningioma terdiri dari berbagai
tumor dengan berbagai histogenesis yang berbeda. Meningioma yang
menunjukkan ekspresi protein S100 dapat berasal baik dari komponen
neuroectodermal maupun mesenkim.
Beberapa penulis menduga bahwa beberapa sel pada pachymeninx
mungkin dapat mensekresikan protein S100, karena studi imunohistokimia
sebelumnya gagal menunjukkan protein S100 disekresikan oleh leptomeninx.
(Tabuchi, 1984)
Pewarnaan imunohistokimia S100 yang positif dijumpai pada 40%
meningioma chordoid. Reaktifitas terhadap S100 mungkin dapat
2.3. Kerangka Konseptual
Gambar 2.3. Kerangka konsep penelitian
Ekspresi S100 pada meningioma 1. Karakteristik Jenis Kelamin
2. Karakteristik Usia
3. Karakteristik Lokasi Tumor 4. Karakteristik grade WHO 5. Karakteristik Jenis
Histopatologi
BAB 3
METODOLOGI PENELITIAN
3.1. Desain
Penelitian ini menggunakan metode penelitian deskriptif retrospektif
yang dimaksudkan untuk mendeskripsikan gambaran/ekspresi pewarnaan
imunohistokimia S100 dari pasien yang sebelumnya telah terdiagnosis sebagai
penderita meningioma di RSUP HAM pada perioda Pebruari 2010 - Pebruari
2013.
3.2. Tempat dan Waktu
Penelitian dilakukan di RSUP. H. Adam Malik Medan dan laboratorium
patologi anatomi RS. Murni Teguh, Medan, Sumatera Utara, dilaksanakan mulai
bulan Juni – Juli 2013.
3.3. Populasi dan Sampel
3.3.1. Populasi
Populasi target adalah penderita meningioma
Populasi terjangkau adalah penderita meningioma yang menjalani operasi
pengangkatan tumor di RSUP. H. Adam Malik Medan.
3.3.2. Sampel
Sampel adalah populasi terjangkau yang memenuhi kriteria inklusi dan
eksklusi. Sampel diambil dengan tekhnik total sampling, yaitu seluruh spesimen
meningioma dari pasien-pasien meningioma intrakranial dan spine yang telah
menjalani operasi pengangkatan tumor di RSUP. H. Adam Malik Medan dari
Pebruari 2010 – Pebruari 2013, dengan hasil pemeriksaan histopatologi jaringan
sesuai dengan gambaran meningioma. Dalam periode ini diperoleh total sampel
3.4. Kriteria Inklusi dan Eksklusi
3.4.1. Kriteria Inklusi
Penderita tumor intrakranial dan spine yang menjalani operasi untuk
pengangkatan masa tumor, dengan hasil pemeriksaan histopatologi sesuai
dengan gambaran meningioma.
3.4.2. Kriteria Eksklusi
Pasien yang menderita tumor intrakranial dan/atau spine selain
meningioma.
3.5. Persetujuan / Informed Consent
Sampel diambil dari spesimen yang telah dilakukan blok parafin oleh
seorang patologist dari pasien-pasien yang telah terdiagnosis menderita
meningioma sehingga tidak membutuhkan informed consent.
3.6. Etika Penelitian
Penelitian ini juga disetujui oleh Komite Etis Kesehatan dari Fakultas
Kedokteran Universitas Sumatera Utara.
3.7. Cara Kerja dan Alur Penelitian
3.7.1. Cara Kerja
Sampel
Seluruh spesimen blok parafin meningioma yang sebelumnya telah
dilakukan pewarnaan dasar hematoxylin-eosin dan dikonfirmasi sebagai suatu
meningioma dari Pebruari 2010 – Pebruari 2013 dikumpulkan dan dilakukan
pencatatan data-data pasien yang diperoleh dari rekam medik pasien dan
assessmen departemen bedah saraf. Data yang dicatat meliputi jenis kelamin,
Pewarnaan imunohistokimia S100
Proses pewarnaan memakan waktu selama ± 270 menit dengan rincian
sebagai berikut:
• Blok parafin dari spesimen meningioma dipotong dengan microtome
dengan ketebalan 3 micron
• Slide hasil potongan microtome dipanaskan pada hotplate dengan suhu
60 0
• Dehidrasi dengan alkohol absolut, 80% dan 70% selama 2 menit C selama 60 menit
• Kemudian slide dibilas dengan air mengalir (keran) selama 2 menit
• Bilas lagi dengan aquades selama 5 menit
• Masukkan slide kedalam TRS yang sudah dihangatkan
• Masukkan kedalam microwave samsung TDS dengan kondisi sebagai
berikut: 800 watt panaskan selama 2,5-3 menit dan 100 watt panaskan
selama 10 menit
• Setelah itu dinginkan slide selama 20 menit
• Slide dibilas lagi dengan wash buffer (WB)/PBS-T selama 5 menit
• Kemudian bloking dengan DAKO FLEX Peroxidase selama 5 menit
• Bilas dengan wash buffer (WB)/PBS-T selama 5 menit
• Antibodi primer selama 20-60 menit
• Bilas dengan wash buffer (WB)/PBS-T selama 5 menit
• DAKO FLEX HRP selama 20 menit
• Bilas dengan wash buffer (WB)/PBS-T selama 5 menit
• DAKO FLEX DAB + SUBSTRAT selama 5 menit
• Bilas dengan air mengalir (keran) selama 5 menit
• Hematoxylin selama 2 menit
• Bilas dengan air mengalir (keran) selama 5 menit
• Dihidrasi dengan alkohol 70%, 80% dan absolut selama 2 menit
• Xylene 2 kali selama 2 menit
• Mounting medium dan coverslip
Penilaian staining intensity (SI)
Staining intensity dinilai dengan melakukan pengamatan slide dibawah
mikroskop dengan interpretasi sebagai berikut:
• Pewarnaan negatif (0) adalah apabila pada gambaran mikroskopis
jaringan tumor tidak menyerap warna sama sekali.
• Pewarnaan positif satu (+1) adalah apabila pada gambaran mikroskopis
terdapat <25% jaringan tumor yang menyerap warna
• Pewarnaan positif dua (+2) adalah apabila pada gambaran mikroskopis
terdapat 25-75% jaringan tumor yang menyerap warna.
• Pewarnaan positif tiga (+3) adalah apabila pada gambaran mikroskopis
terdapat >75% jaringan tumor yang menyerap warna. (Samson W, 2004)
3.7.2. Alur Penelitian
Seluruh spesimen blok parafin meningioma yang sebelumnya telah
dilakukan pewarnaan dasar hematoxylin-eosin dan dikonfirmasi sebagai suatu
meningioma dilakukan pewarnaan imunohistokimia S100. Setelah dilakukan
pewarnaan, staining intensity (SI) dihitung skornya dari skala 0-3 (dari yang tidak
Gambar 3.1. Bagan alur penelitian
3.8. Identifikasi Variabel
Variabel bebas Skala
Mengioma Nominal
Variabel tergantung Skala
Pewarnaan histokimia S100 Ordinal
3.9. Definisi Operasional
• Meningioma adalah tumor yang berasal dari arachnoid cap cell yang
terdapat pada selaput arachnoid yang melapisi seluruh permukaan otak
(Louis et al, 2000).
• S-100 adalah suatu famili protein calcium – binding, dimerik, berat
molekul 9 – 13 kDa. S100A1 (α) dan S-1OOB (β) merupakan spesies
senyawa protein pertama ditemukan oleh Moore pada tahun 1965 dari
preparat jaringan otak sapi. Nama S100 karena substrat larut 100% dalam
larutan ammonium sulfat (Kilby et al., 1996, Smith and Shaw 1998, Korfias
et al., 2006).
Meningioma
S100
Pewarnaan Negatif /
Negative Staining
• Pewarnaan negatif (0) adalah apabila pada gambaran mikroskopis
jaringan tumor tidak menyerap warna sama sekali.
• Pewarnaan positif satu (+1) adalah apabila pada gambaran mikroskopis
terdapat <25% jaringan tumor yang menyerap warna
• Pewarnaan positif dua (+2) adalah apabila pada gambaran mikroskopis
terdapat 25-75% jaringan tumor yang menyerap warna.
• Pewarnaan positif tiga (+3) adalah apabila pada gambaran mikroskopis
terdapat >75% jaringan tumor yang menyerap warna. (Samson W, 2004)
3.10. Rencana Pengolahan dan Analisa Data
Data medis dan demografis dianalisa secara deskriptif dalam bentuk tabel
distribusi frekuensi atau diagram dan persentase untuk data kategori dan data
BAB 4
HASIL PENELITIAN DAN PEMBAHASAN
4.1. HASIL PENELITIAN
Sampel penelitian diambil dari bulan Pebruari 2010 sampai dengan bulan
Pebruari 2013. Dalam kurun waktu tersebut diperoleh 31 spesimen dari dari
pasien-pasien meningioma intrakranial dan spinal yang telah menjalani operasi
pengangkatan tumor di RSUP. H. Adam Malik Medan dengan hasil pemeriksaan
histopatologi jaringan sesuai dengan gambaran meningioma. Dari spesimen
meningioma yang telah dilakukan blok parafin tersebut dilakukan pewarnaan
imunohistokimia S100. Pemeriksaan imunohistokimia EMA juga dilakukan pada
spesimen-spesimen ini untuk lebih memastikan diagnosis meningioma. Hasil
lengkap data penderita dapat dilihat pada lampiran.
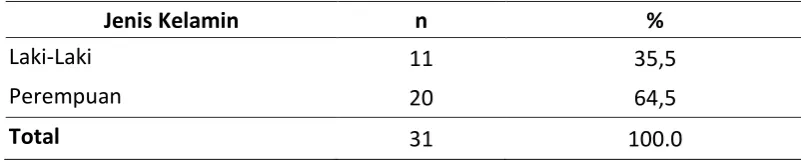
4.1.1 Distribusi Berdasarkan Jenis Kelamin
Setelah dilakukan pendataan dan memasukkan data tersebut ke dalam
tabel, didapatkan sampel berjenis kelamin perempuan lebih banyak
dibandingkan dengan sampel laki-laki, dimana sampel perempuan sebanyak 20
(64,5%) kasus dan laki-laki sebanyak 11 (35,5%) kasus.
Tabel 4.1. Distribusi Berdasarkan Jenis Kelamin
Jenis Kelamin n %
Laki-Laki 11 35,5
Perempuan 20 64,5
Total 31 100.0
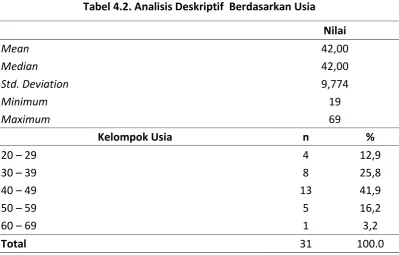
4.1.2. Distribusi Berdasarkan Usia
Setelah dilakukan analisis deskriptif terhadap usia didapati bahwa mean
adalah 42 ± 9,77 tahun dengan nilai minimal 19 tahun dan maksimal 69 tahun.
Terhadap sampel dilakukan klasifikasi usia berdasarkan dekade
kehidupan. Kejadian meningioma memiliki frekuensi kejadian terbanyak pada
kelompok usia 40 – 49 tahun sebanyak 13 (41,9%) kasus. Sedangkan frekuensi
kejadian yang paling sedikit ada pada kelompok usia 60-69 sebanyak 1 (3,2%)
kasus
Tabel 4.2. Analisis Deskriptif Berdasarkan Usia
Nilai
Mean 42,00
Median 42,00
Std. Deviation 9,774
Minimum 19
Maximum 69
Kelompok Usia n %
20 – 29 4 12,9
30 – 39 8 25,8
40 – 49 13 41,9
50 – 59 5 16,2
60 – 69 1 3,2
Total 31 100.0
4.1.3. Distribusi Berdasarkan Lokasi Tumor
Terhadap sampel dilakukan klasifikasi berdasarkan lokasi terjadinya
meningioma. Setelah dilakukan tabulasi diperoleh frekuensi terbanyak adalah
pada konveksitas dan parasagital meningioma dengan masing-masing 8 (25,8%)
Tabel 4.3. Distribusi Berdasarkan Lokasi Tumor
Lokasi Tumor n %
Convexity 8 25,8
Parasagital 8 25,8
Sphenoid Ridge 2 6,5
Falx 1 3,2
Tuberculum Sellae 3 9,7
Foramen Magnum 1 3,2
Petroclival 1 3,2
Enplaque 1 3,2
Olfactory groove 1 3,2
Spine 3 9,7
Posterior Fossa 2 6,5
Total 31 100.0
4.1.4. Distribusi Berdasarkan Grade WHO
Berdasarkan grade WHO, diperoleh frekuensi terbanyak adalah tipe
meningioma benign sebanyak 28 (90,3%) kasus. Diikuti oleh atypical sebanyak 2
(6,5%) kasus dan anaplastic sebanyak 1 (3,2%) kasus.
Tabel 4.4. Distribusi Berdasarkan Grade Tumor
Grade WHO n %
Benign 28 90,3
Atypical 2 6,5
Anaplastic 1 3,2
Total 31 100.0
4.1.5. Distribusi Berdasarkan Jenis Histopatologi Tumor
Berdasarkan jenis histopatologi tumor, diperoleh frekuensi terbanyak
transitional meningioma 3 (15%) kasus, fibroblastic meningioma 2 (10%) kasus,
dan atypical meningioma 1 (5%) kasus.
Tabel 4.5. Distribusi Berdasarkan Jenis Histopatologi Tumor
Jenis Histopatologi n %
Meningothelial 17 54,8
Fibroblastic 4 12,9
Psammomatous 2 6,5
Transitional 4 12,9
Secretory 1 3,2
Atypical 2 6,5
Anaplastic 1 3,2
Total 31 100.0
4.1.6. Distribusi Berdasarkan Rekurensi Tumor
Berdasarkan rekurensi tumor, didapati 4 (12,9%) orang penderita yang
mengalami rekurensi meningioma.
Tabel 4.6. Distribusi Berdasarkan Rekurensi Tumor
Rekurensi n %
Ya 4 12,9
Tidak 27 87,1
Total 31 100.0
4.1.7. Distribusi Staining Intensity S100 pada Meningioma
Dari seluruh sampel meningioma yang diberi pewarnaan imunohistokimia
S100, didapatkan hasil 20 sampel (64,5%) memiliki SI 0 atau tidak menyerap
warna, 7 sampel meningioma (22,6%) memiliki SI +3, 1 sampel meningioma
Tabel 4.7. Distribusi Staining Intensity S100 pada Meningioma
4.1.8. Distribusi Staining Intensity S100 Berdasarkan Jenis Kelamin
Dari jenis kelamin laki-laki, 5 orang tidak menunjukan intensitas
pewarnaan pada protein S100, 3 orang menunjukkan intensitas pewarnaan +1
dan 3 orang lainnya menunjukkan intensitas pewarnaan +3. Sedangkan jenis
kelamin perempuan, 15 orang tidak menunjukkan intensitas pewarnaan protein
S100, 1 orang menunjukkan intensitas pewarnaan +2 dan 4 lainnya menunjukkan
intensitas pewarnaan +3.
Tabel 4.1.8. Distribusi Staining Intensity S100 Berdasarkan Jenis Kelamin
SI Pewarnaan S100 Total
0 +1 +2 +3
4.1.9. Distribusi Staining Intensity S100 Berdasarkan Usia
Setelah dilakukan cross tabulation antara SI dan usia diperoleh hasil dari 4
kasus kelompok umur 20-29, 1 kasus tidak menunjukkan intensitas pewarnaan,
dan 3 kasus menunjukkan intensitas pewarnaan kuat. Pada kelompok usia 30-39,
5 kasus tidak menunjukkan intensitas pewarnaan, 2 kasus menunjukkan
sedang. Pada kelompok usia 40-49, 11 kasus tidak menunjukkan intensitas
pewarnaan, dan 2 kasus menunjukkan intensitas pewarnaan kuat. Pada
kelompok usia 50-59, 3 kasus tidak menunjukkan intensitas pewarnaan, dan 2
kasus menunjukkan intensitas pewarnaan kuat. Sedangkan pada kelompok usia
60-69, 1 orang menunjukkan intensitas pewarnaan sedikit.
Tabel 4.1.9. Distribusi Staining Intensity S100 Berdasarkan Usia
SI Pewarnaan S100 Total
0 +1 +2 +3
4.1.10. Distribusi Staining Intensity S100 Berdasarkan Lokasi Tumor
Setelah dilakukan cross tabulation antara SI dan lokasi tumor diperoleh
data dari 8 kasus meningioma convexity yang tidak menunjukkan intensitas
pewarnaan sebanyak 6 kasus, yang menunjukkan intensitas pewarnaan sedikit
sebanyak 1 kasus dan yang paling kuat intensitas pewarnaannya sebanyak 1
kasus. Pada meningioma parasagital, dari total 8 kasus yang tidak menunjukkan
intensitas pewarnaan sebanyak 6 kasus dan yang menunjukkan intensitas
pewarnaan sedikit sebanyak 2 kasus. Dua kasus sphenoid ridge meningioma,
semuanya menunjukkan intensitas pewarnaan kuat. Satu kasus falx meningioma
juga menunjukkan intensitas pewarnaan kuat. Tiga kasus meningioma
tuberculum sella, tidak ada yang menunjukkan intensitas pewarnaan. Satu kasus
foramen magnum dan petroclival meningioma menunjukkan intensitas
menunjukkan intensitas pewarnaan kuat, 1 kasus menunjukkan intensitas
pewarnaan sedang dan 1 kasus lagi menunjukkan intensitas pewarnaan kuat dan
dari 2 kasus posterior fossa meningioma keduanya tidak menunjukkan intensitas
pewarnaan S100.
Tabel 4.1.10. Distribusi Staining Intensity S100 Berdasarkan Lokasi Tumor
SI Pewarnaan S100 Total
0 +1 +2 +3
4.1.11. Distribusi Staining Intensity S100 Berdasarkan Grade WHO
Setelah dilakukan cross tabulation antara SI dan grade WHO diperoleh
data dari 28 kasus meningioma benign, 20 kasus tidak menunjukkan intensitas
pewarnaan S100, 1 kasus menunjukkan intensitas pewarnaan yang sedikit, 1
kasus menunjukkan intensitas pewarnaan sedang dan 6 kasus menunjukkan
intensitas pewarnaan kuat. Dari 2 kasus atypical meningioma, keduanya
menunjukkan intensitas pewarnaan sedikit dan dari 1 kasus anaplastic
Tabel 4.1.11. Distribusi Staining Intensity S100 Berdasarkan Grade WHO
SI Pewarnaan S100 Total
0 +1 +2 +3
Grade WHO Benign 20 1 1 6 28
Atypical 0 2 0 0 2
Anaplastic 0 0 0 1 1
Total 20 3 1 7 31
4.1.12. Distribusi Staining Intensity S100 Berdasarkan Jenis Histopatologi
Dari semua sampel meningioma, hanya 11 (35,48%) sampel yang
menunjukkan intensitas pewarnaan terhadap protein S100. Dari semua jenis
histopatologi hanya fibroblastic, secretory dan atypical meningioma yang
menunjukkan intensitas pewarnaan yang kuat (+3) terhadap protein S100.
Tabel 4.12. Distribusi Staining Intensity S100 Berdasarkan Jenis Histopatologi
SI Pewarnaan S100 Total
0 +1 +2 +3
Histopatolo
gi
Meningothelial 15 1 0 1 17
Fibroblastic 0 0 0 4 4
Psammomatou
s
2 0 0 0 2
Transitional 3 0 1 0 4
Secretory 0 0 0 1 1
Atypical 0 2 0 0 2
Anaplastic 0 0 0 1 1