FRAKSINASI PROTEIN ANTIKANKER DARI
KAPANG LAUT Xylaria psidii KT30 DAN
SITOTOKSISITASNYA TERHADAP SEL HeLa
MITA GEBRIELLA INTHE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Fraksinasi Protein Antikanker dari Kapang Laut Xylaria psidii KT30 dan Sitotoksisitasnya Terhadap Sel HeLa adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2013
Mita Gebriella Inthe
RINGKASAN
MITA GEBRIELLA INTHE. Fraksinasi Protein Antikanker dari Kapang Laut
Xylaria psidii KT30 dan Sitotoksisitasnya Terhadap Sel HeLa. Dibimbing oleh KUSTIARIYAH TARMAN dan MEGA SAFITHRI.
Kanker serviks merupakan kanker penyebab kematian kedua terbesar pada wanita di Indonesia setelah kanker payudara. Salah satu upaya pengobatan kanker dapat dilakukan dengan memanfaatkan senyawa dari bahan alam. Salah satu mikroorganisme yang mempunyai potensi sebagai antikanker adalah kapang endofit. Kapang endofit dari lingkungan laut dapat diisolasi dari rumput laut, lamun, spons, dan mangrove. Xylaria psidii KT30 adalah kapang yang diisolasi dari rumput laut dan dapat menghasilkan protein antikanker.
Tujuan penelitian ini adalah untuk memperoleh fraksi protein ekstraseluler dari kapang laut X. psidii KT30 dan menentukan sitotoksisitasnya terhadap sel Chang dan sel HeLa. Penelitian ini dilakukan dalam tiga tahapan. Tahap pertama kultivasi kapang laut X. psidii KT30 menggunakan media Potato Dextrose Agar (PDA) dan Potato Dextrose Broth (PDB) dan isolasi protein kapang dengan metode pengendapan menggunakan ammonium sulfat 90%. Tahap kedua uji toksisitas dengan Brine Shrimp Lethality Test (BSLT). Tahap ketiga fraksinasi protein dengan kromatografi DEAE Sephadex A-50 dan uji sitotoksisitas pada sel Chang (ATCC CCL 13) dan sel HeLa (ATCC CCL 2).
Kapang laut X. psidii KT30 menghasilkan rendemen protein ekstraseluler sebesar 0,090%. Nilai LC50 protein kasar 104,95 ppm. Fraksinasi protein kapang laut Xylaria psidii KT30 menghasilkan lima puncak fraksi protein yang terdiri dari fraksi I (tabung ke-2 sampai ke-12), fraksi II (tabung ke-13 sampai ke-49), fraksi III (tabung ke-50 sampai ke-61), fraksi IV (tabung ke-62 sampai ke-72), dan fraksi V (tabung ke-73 sampai ke-100). Penentuan bobot molekul protein dengan SDS-PAGE pada fraksi terpilih didapatkan tiga band dengan bobot molekul yaitu 23,99, 32,88, dan 37,30 kDa.
SUMMARY
MITA GEBRIELLA INTHE. Fractination of anticancer protein from a marine fungus Xylaria psidii KT30 and their cytotoxicity against HeLa cell line. Supervised by KUSTIARIYAH TARMAN and MEGA SAFITHRI.
Cervical cancer is the most common death cause of cancer in Indonesia after human breast cancer. One of the efforts of cancer treatment is the utilization of natural product. Some microorganism have potential as anticancer such as endophytic fungi. Endophytic fungi from the marine habitats can be isolated from seaweeds, seagrasses, sponges, and mangroves. Xylaria psidii KT30 is fungus from seaweed that can produce anticancer protein.
This study aimed to obtain protein fraction from Xylaria psidii KT30 and determine their toxicity against Chang and HeLa cells. The research was carried out in 3 stages. Phase 1 Xylaria psidii KT30 was cultivated in Potato Dextrose Agar (PDA) and Potato Dextrose Broth (PDB) medium, the metabolites was extracted using 90% of ammonium sulfate. Phase 2 the toxicity was determined by Brine Shrimp Lethality Test (BSLT). Phase 3 was the final stage, the fractionation process was conducted using DEAE Sephadex A-50 column chromatography and cytotoxic assay using Chang (ATCC CCL 13) and HeLa (ATCC CCL 2) cells.
Xylaria psidii KT30 yielded 0,090% of extracellular protein. The results revealed that LC50 of protein extract was 104,95 ppm. Fractionation of protein produced five protein fraction groups comprised of fraction I (2-12), fraction II (13-49), fraction III (50-61), fraction IV (62-72), and fraction V (73-100). Based on the results of SDS-PAGE, the molecular weight of selected fractions were 23,99; 32,88 and 37,30 kDa.
Cytotoxicity assay results in Chang cells showed that the crude extract and fractions of selected proteins (F3.1, F3.2, and F4) was not active against normal cells with inhibition less than 50%, while in IC50 value of HeLa cell protein fractions F3.1, F3.2 and F4 against cervical cancer cells (HeLa) in this study could not be determined because in highest concentration (1080 mg/mL) did not produce % inhibition more than 50% of the HeLa cells. The results revealed that IC50 of the crude extract proteins of marine fungus was 69,89 μg/mL.
©
Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
FRAKSINASI PROTEIN ANTIKANKER DARI
KAPANG LAUT Xylaria psidii KT30 DAN
SITOTOKSISITASNYA TERHADAP SEL HeLa
MITA GEBRIELLA INTHE
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis :
Nama :
NIM :
Disetujui oleh Komisi Pembimbing
Diketahui oleh
Tanggal Ujian: 30 Oktober 2013 Tanggal Lulus: Fraksinasi Protein Antikanker dari Kapang Laut
Xylaria psidii KT30 dan Sitotoksisitasnya Terhadap Sel Hela Mita Gebriella Inthe
C351110161
Dr Kustiariyah Tarman, SPi MSi Ketua
Dr Mega Safithri, SSi MSi Anggota
Ketua Program Studi Teknologi Hasil Perairan
Dr Tati Nurhayati, SPi MSi
Dekan Sekolah Pascasarjana
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas segala rahmat dan karunia-Nya sehingga tesis dengan judul “Fraksinasi Protein
Antikanker dari Kapang Laut Xylaria psidii KT30 dan Sitotoksisitasnya
Terhadap Sel HeLa”ini dapat diselesaikan.
Kesuksesan penulis mengikuti pendidikan di Sekolah Pascasarjana IPB ini tidak lepas dari dukungan berbagai pihak. Penulis menyampaikan banyak terima kasih yang setulusnya kepada:
1 Dr Kustiariyah Tarman, SPi MSi selaku ketua komisi pembimbing dan Dr Mega Safithri, SSi MSi. sebagai anggota komisi pembimbing atas kesediaan waktu untuk membimbing, memberikan arahan dan masukan selama penyusunan tesis ini.
2 Dr Tati Nurhayati, SPi MSi selaku Ketua Program Studi Teknologi Hasil Perairan.
3 Bapak dan Ibu staf pengajar, staf administrasi dan laboran Program Studi Teknologi Hasil Perairan yang telah banyak membantu dan kerjasamanya yang baik selama penulis menempuh studi.
4 Direktorat Jenderal Pendidikan Tinggi (DIKTI) atas Beasiswa Pendidikan yang diberikan selama penulis kuliah dan Menteri Riset dan Teknologi yang telah mendanai penelitian penulis melalui Program Insentif Riset Sinas (RD-2013-0552)
5 Keluarga besar penulis, papa, mama, Desryani, Dean Anugrah serta Sandro Takalalumang atas motivasi, doa dan semangat selama penulis menempuh studi.
6 Teman-teman S2 THP 2011, 2010 dan 2012 atas kerjasama yang baik selama studi.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Semoga karya ilmiah ini membawa manfaat bagi seluruh civitas IPB khususnya dan masyarakat Indonesia umumnya.
Bogor, November 2013
DAFTAR ISI
2 FRAKSINASI PROTEIN ANTIKANKER KAPANG LAUT
Xylaria psidii KT30 Pendahuluan Bahan dan Metode Hasil dan Pembahasan Simpulan
3 SITOTOKSISITAS PROTEIN KAPANG LAUT Xylaria psidii
DAFTAR TABEL
DAFTAR GAMBAR
DAFTAR LAMPIRAN
1 Komposisi gel penahan dan pemisah SDS-PAGE2 Hasil uji BSLT protein kasar kapang laut Xylaria psidii KT30 3 Persentase rendemen protein fraksi terpilih kapang laut X. psidii
KT30
1 Diagram alir tahapan penelitian
2 Kapang laut Xylaria psidii KT30 dalam media padat PDA 3 Kapang laut Xylaria psidii KT30 dalam media cair PDB
4 Hasil fraksinasi protein kapang laut Xylaria psidii
KT30 menggunakan kromatografi kolom DEAE Sephadex A-50 5 Hasil SDS-PAGE
6 Perlakuan konsentrasi protein terhadap sel Chang 7 Perlakuan konsentrasi protein terhadap sel HeLa 8 Morfologi sel Chang
1 Data rendemen pelet kapang endofit Xylaria psidii KT30 2 Data hasil uji senyawa bioaktif pada sel Chang
1 PENDAHULUAN
Latar Belakang
Biota laut merupakan kekayaan alam yang sangat melimpah. Berbagai upaya telah dilakukan manusia untuk mengetahui bahan atau senyawa yang terkandung dalam biota laut. Upaya ini menunjukkan hasil dengan adanya kandungan senyawa bioaktif baru (novel compounds) yang tidak ditemukan pada biota darat. Sejak tahun 1970-an, perhatian mulai tertuju pada penemuan obat-obatan dari laut. Sebagai gambaran, lebih dari 10.000 senyawa bioaktif telah berhasil diisolasi dari biota laut dan sekitar 300 paten dari senyawa tersebut telah berhasil dipublikasi selama kurun waktu 30 tahun (1969-1999) (Yan 2004).
Salah satu mikroorganisme sumber utama metabolit sekunder adalah kapang endofit (Strobel dan Daisy 2003). Saat ini, kapang endofit dengan keragaman metabolit serta bioaktivitasnya yang tinggi sangat menarik untuk diteliti. Beberapa metabolit kapang endofit menunjukkan aktivitas antibakteri, antifungi, hormon pertumbuhan tanaman, dan insektisida (Tan dan Zou 2001). Metabolit sekunder dari isolat kapang endofit dapat pula digunakan sebagai obat antikanker dan autoimun (Hasan et al. 2007). Salah satu kapang yang memiliki aktivitas biologis adalah Xylaria sp. Metabolit sekunder dari isolat kapang endofit Xylaria sp. dapat digunakan sebagai obat antikanker dan autoimun (Paulus et al. 2006; Hasan et al. 2007; Romero et al. 2008; Xu et al. 2008; Pongcharoen et al. 2008; Chen et al. 2009; Silva et al. 2010; Yin et al. 2011; Wu 2011; Song et al. 2012).
Senyawa bioaktif antikanker yang akan digunakan sebagai produk farmasi antikanker harus diujikan terlebih dahulu dengan uji sitotoksik. Uji sitotoksik merupakan salah satu pengembangan metode untuk memprediksi keberadaan senyawa yang bersifat toksik pada sel (Kurnijasanti et al. 2008). Penelitian Tarman et al. (2011) menunjukkan bahwa 5 dari 11 isolat kapang endofit yang diisolasi dari makroalga, kayu, dan moluska, memiliki potensi sebagai sumber bahan bioaktif. Hasil ekstraksi dari Xylaria psidii (KT30) dan
Mycelium sterilium (KT31) menunjukkan aktivitas antibakteri dan sitotoksik tetapi dalam aktivitas minor (Tarman et al. 2011). Setelah tahap praskrining terhadap senyawa antikanker, maka perlu dilanjutkan dengan uji sitotoksisitas menggunakan sel kanker secara in vitro.
Diantara jenis kanker yang ada, kanker serviks (leher rahim) merupakan kanker yang menempati posisi pertama diantara sepuluh kanker primer yang diderita wanita di Indonesia dengan presentase yang besar yaitu 28,66% (Wijaya 2011). Sel kanker leher rahim (sel HeLa) terjadi akibat infeksi
Berbagai alternatif dilakukan untuk pengobatan kanker seperti pembedahan atau operasi, radiasi, dan kemoterapi. Perbedaan pemberian pengobatan sangat tergantung pada stadium kanker, jenisnya, dan kondisi umum penderita itu sendiri. Namun, dalam prosesnya setiap pengobatan yang dilakukan memiliki efek samping yang dirasakan oleh penderita kanker serviks, misalnya terjadinya penurunan sel-sel darah (akan kembali normal sekitar seminggu kemudian), infeksi (ditandai dengan demam, rasa panas saat buang air kecil, menggigil dan luka yang memerah, bengkak, dan rasa hangat), anemia, pendarahan seperti mimisan, rambut rontok, kulit gatal dan kering, mual dan muntah, dehidrasi dan
tekanan darah rendah, sembelit atau konstipasi, diare, dan gangguan syaraf (Anica et al. 2011).
Sampai sekarang belum ditemukan obat yang memenuhi kriteria terapi yang optimal terhadap para penderitanya, sehingga perlu dikembangkan obat baru yang mempunyai efek terapi yang baik (Heti 2009). Xylaria psidii KT30 adalah salah satu jenis kapang yang dapat menghasilkan protein antikanker, akan tetapi fraksi aktif dari protein antikanker tersebut serta sitotoksisitasnya belum diketahui.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mendapatkan fraksi aktif dan menentukan sitotoksisitas protein kapang laut Xylaria psidii KT30 terhadap sel Chang dan sel HeLa.
Manfaat Penelitian
Manfaat penelitian ini adalah sebagai informasi ilmiah untuk pengembangan farmasi obat antikanker baru dan pengembangan komoditas hasil perairan khususnya untuk jenis kapang laut.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah:
1 Melakukan fraksinasi protein antikanker yang terdiri dari kultivasi, isolasi protein kasar, purifikasi dengan kromatografi penukar ion, dan penentuan bobot molekul dengan SDS-PAGE dari kapang laut Xylaria psidii KT30. 2 Melakukan uji toksisitas protein kasar dengan metode BSLT dan uji
2 FRAKSINASI PROTEIN ANTIKANKER KAPANG LAUT
Xylaria psidii KT30
Pendahuluan
Latar belakang
Indonesia dikenal sebagai negara bahari dengan luas 75% berupa lautan, memiliki kekayaan yang melimpah sumber daya hayati. Sumber daya hayati laut terdiri dari tumbuhan misalnya alga serta hewan misalnya ikan, moluska, karang lunak, spons, ekinodermata, askidin dan tunikata. Beberapa jenis hewan tertentu merupakan sumber vitamin, protein dan mineral. Selain hewan dan tumbuhan air, mikroorganisme laut juga dilaporkan menghasilkan senyawa bioaktif yang dapat digunakan dalam bidang farmasi (Ma’at 2003).
Kecenderungan pemakaian bahan alam terutama tumbuhan, hewan, dan mikroorganisme sebagai obat-obatan semakin meningkat, karena mahalnya obat sintetik dan berbagai efek sampingnya yang merugikan. Salah satu mikroorganisme yang berpotensi untuk dimanfaatkan adalah kapang laut. Berbagai penelitian telah membuktikan bahwa tanaman menghasilkan senyawa aktif yang berkhasiat sebagai obat. Senyawa aktif yang dihasilkan diantaranya adalah protein bioaktif, yang biasanya digunakan sebagai protein pertahanan bagi tanaman inangnya (Cragg dan Newman 2009)
Protein bioaktif menarik perhatian para peneliti karena dapat dikembangkan potensinya sebagai senyawa toksik pada imunotoksin. Protein dikonjugasikan dengan antibodi untuk mengenali sel target sehingga tidak menyerang sel lainnya. Imunotoksin digunakan untuk perlakuan penyakit pada manusia misalnya kanker, AIDS, dan penyakit generatif (Minami et al.1992).
Penyakit kanker merupakan penyakit yang menjadi salah satu ancaman utama terhadap kesehatan karena merupakan penyebab kematian kedua setelah penyakit jantung. Setiap tahunnya sekitar 7,6 juta orang di seluruh dunia meninggal karena kanker. Kanker serviks menduduki peringkat kedua yang diderita oleh perempuan. Setiap tahunnya sekitar 53.000 kasus kanker serviks terjadi, sebanyak 85% kasus kanker serviks berasal dari negara berkembang (Asiancancer 2012). Menurut Sistem Informasi Rumah Sakit (SIRS) tahun 2008, kanker serviks merupakan jenis kanker tertinggi kedua di Indonesia dengan persentasi pasien rawat inap sebesar 10,3%. Yayasan Kanker Indonesia tahun 2006 menerangkan berdasarkan patologi di 13 center, kanker serviks menempati urutan pertama dengan angka 16%, yang kemudian disusul dengan kanker payudara 15%.
Bahan dan Metode
Waktu dan tempat penelitian
Penelitian ini dilaksanakan pada bulan Januari sampai dengan September 2013. Penelitian ini dilakukan di Laboratorium Mikrobiologi Hasil Perairan, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Institut Pertanian Bogor.
Bahan dan alat
Bahan utama yang digunakan dalam penelitian ini adalah kapang laut KT30 koleksi Kustiariyah Tarman. Bahan yang digunakan untuk kultur kapang laut adalah media Potato Dextrose Broth (PDB), Potato Dextrose Agar
(PDA), NaCl, dan akuades. Bahan yang digunakan dalam proses pengendapan protein adalah amonium sulfat dan Tris HCl 10 mM pH 7,4.
Alat-alat yang digunakan dalam penelitian ini adalah labu Erlenmeyer, timbangan digital MC Series, pH meter HM Digital, shaker Gemmy VRN 360, hot plate MS 400, magnetic stirrer, kertas saring, spektrofotometer CECIL series 2, inkubator MILLIPORE, cawan petri, dan sentrifus HIMAC CR 21 G.
Metode penelitian
Penelitian ini dilakukan melalui beberapa tahap, yaitu kultivasi kapang laut
X. psidii KT30 menggunakan media PDA dan PDB, isolasi protein menggunakan ammonium sulfat 90%, fraksinasi protein kasar dengan kromatografi penukar ion. Tahap selanjutnya penentuan bobot molekul dengan SDS-PAGE dan dilanjutkan dengan uji toksisitas dengan metode BSLT. Data dianalisis dengan metode Rancangan Acak Lengkap (RAL) dengan 3 kali ulangan dan jika berpengaruh nyata maka diuji lanjut menggunakan uji Duncan (Steel and Torrie 1993). Secara ringkas tahapan penelitian tersebut disajikan dalam bentuk diagram alir yang disajikan pada Gambar 1.
Kultivasi kapang laut Xylaria psidii KT30
Gambar 1 Diagram alir tahapan penelitian Kapang laut
X. psidii KT30
Kultivasi kapang laut
Penyaringan
Pengendapan (amonium sulfat 90%)
Supernatan
Sentrifuse (10.000 rpm, 30menit)
Supernatan Pelet
Pelet
Uji toksisitas (Bioassay) (BSLT)
Fraksinasi protein dengan kromatografi penukar ion
Isolasi protein kapang laut Xylaria psidii KT30
Koleksi supernatan digunakan sebagai ekstrak kasar yang proteinnya diendapkan menggunakan amonium sulfat yaitu 90% (Munandar 2013). Penambahan amonium sulfat ke dalam tabung Erlenmeyer yang berisi supernatan dilakukan sedikit demi sedikit dengan selang waktu 5 menit setiap penambahan amonium sulfat. Penyimpanan hasil pengendapan dilakukan selama satu malam. Proses berikutnya adalah pengaturan pH hasil pengendapan sampai pH 7,4 diikuti sentrifugasi supernatan hasil pengendapan pada kecepatan 10.000 rpm selama 30 menit. Koleksi pelet hasil sentrifugasi didilusi menggunakan Tris HCL 10 Mm pH 7,4, sedangkan supernatan diambil sebanyak 1,5 mL. Pelet hasil dilusi dan supernatan yang dikoleksi digunakan untuk uji aktivitas antikanker.
Fraksinasi protein dengan kromatografi (Ustadi et al. 2005)
Tahap pemurnian pertama dilakukan dengan kromatografi penukar ion dengan bahan pengelusi bufer B (bufer gel pemisah, Tris-HCl pH 7,4). Sebanyak 75 mL larutan TrisCl pH 7,4 dan 4 mL larutan SDS 10% (b/v) ditambahkan dengan akuades hingga volume total 100 mL. Matriks menggunakan kolom DEAE Sephadex A-50 (30.0 x 30.0 cm) dengan laju aliran 1 mL/menit. Jumlah volume tiap fraksi ditampung sebanyak 5 mL. Masing-masing fraksi diuji konsentrasi protein dengan spektrofotometer uv =280 nm dan diuji aktivitasnya tiap fraksi dengan metode BSLT.
Penentuan bobot molekul dengan SDS-PAGE (Rosenberg 1996)
Metode SDS-PAGE (sodium dodecyl sulphate-polyacrylamide gel electrophoresis) yang dikerjakan dalam penelitian ini menggunakan 4%
stacking gel dan 8% gel akrilamida. Metode ini menggunakan matriks dari gel yang disusun oleh akrilamida dan N,N’-metilen-bis-akrilamida yang berpolimerisasi melalui mekanisme radikal bebas dengan bantuan katalisator N,N,N’N,
-tetramethylene-diamine (TEMED) dan inisiator ammonium persulfate (APS). Komposisi pembuatan gel penahan dan pemisah SDS-PAGE dapat dilihat pada Tabel 1.
Tabel 1 Komposisi gel penahan dan pemisah SDS-PAGE
Komponen Gel pemisah (8%) Gel penahan (4%)
pengembang kemudian dicuci dengan akuabidestilata. Gel yang telah dicuci ditambahkan larutan perak nitrat selama 30 menit kemudian dicuci lagi dengan akuabides 2 x 20 detik dan ditambahkan larutan campuran Na2CO3 dan formal jam di bawah penerangan lampu TL 20 watt.
Pengamatan dilakukan setelah 24 jam dengan melihat jumlah
Artemia salina yang mati pada tiap konsentrasi. Penentuan harga LC50 dalam µg/mL atau ppm dilakukan menggunakan analisis probit dengan program MINITAB.
Hasil dan Pembahasan
Kultivasi kapang laut Xylaria psidii KT30
Kapang Xylaria psidii KT30 merupakan kapang endofit yang diisolasi dari makroalga Kappaphycus alvarezii (Tarman 2011). Kapang laut yang digunakan dalam penelitian ini diperoleh dari isolat yang ditumbuhkan dalam medium padat PDA. Kapang tersebut diremajakan dan diinokulasikan pada media cair PDB. Medium PDB merupakan medium yang sangat cocok untuk pertumbuhan kapang karena terdapat banyak pati dan nitrogen yang berasal dari asam amino yang terdapat pada kentang (Kumala dan Muhammad 2008).
Prekultur kapang diawali dengan kultivasi pada medium PDB 50 mL sebagai masa adaptasi selama seminggu. Miselium kapang yang telah tumbh dipindahkan pada medium PDB 350 mL serta ditambahkan NaCl 3% dan diaduk dengan bantuan shaker selama sembilan hari dengan kecepatan 120 rpm. Pertumbuhan kapang pada media padat terlihat dari benang-benang putih yang mengelilingi keping inokulan. Miselium akan bertambah banyak dan mengikat keping-keping tersebut menjadi suatu bentuk yang padat terjalin kuat oleh hifa-hifa miselium.
Pertumbuhan kapang pada media cair ditandai dengan adanya miselium yang berbentuk bulat dan berwarna putih yang melayang pada media. Hal ini sesuai dengan Pratomo (2006) bahwa ketika ditumbuhkan dalam media PDB miseliumnya akan tampak berwarna putih, lama-kelamaan warna miselium berubah menjadi coklat muda sampai tua, sel-sel miselium biasanya panjang.
Biomassa tidak digunakan karena protein target selama masa pertumbuhan telah disekresikan ke dalam medium pertumbuhan. Morfologi kapang X. psidii KT30 dalam media padat dan cair dapat dilihat pada Gambar 2 dan Gambar 3.
Gambar 2 Kapang laut Xylaria psidii KT30 dalam media padat PDA
Gambar 3 Kapang laut Xylaria psidii KT30 dalam media cair PDB
Isolasi protein kapang laut Xylaria psidii KT30
Isolasi protein kapang laut pada penelitian ini menggunakan teknik sentrifugasi dan melalui pengendapan. Teknik sentrifugasi digunakan untuk memisahkan protein dengan sel kapang. Prinsip utama sentrifugasi adalah memisahkan substansi berdasarkan berat jenis molekul dengan cara memberikan gaya sentrifugal sehingga substansi yang lebih berat akan berada di dasar, sedangkan substansi yang lebih ringan akan terletak di atas. Teknik pengendapan menggunakan penambahan amonium sulfat dengan konsentrasi 90% (Munandar 2013).
Protein kasar hasil penyaringan kemudian dipresipitasi dengan menggunakan amonium sulfat. Metode presipitasi dibagi menjadi 2 grup utama, yakni (1) metode kelarutan protein dikurangi dan presipitasi dilakukan dengan mengubah beberapa sifat fisika-kimia pelarut, misalnya pH, konstanta dielektrik, kekuatan ionik, dan tersedianya air dan (2) Metode presipitasi protein yang disebabkan oleh interaksi diantara protein dan agen presipitasi (Sivasankar 2005). Rendemen yang dihasilkan untuk protein kasar adalah 0,090%.
bermuatan sama. Penambahan amonium sulfat pada konsentrasi kejenuhan tertentu menyebabkan interaksi air pada protein tertentu menurun dan protein akan saling berinteraksi, beragregrat dan akhirnya mengendap. Fenomena ini dikenal sebagai salting out. Protein yang mengendap pada konsentrasi kejenuhan amonium sulfat tinggi adalah protein dengan bobot molekul rendah (Widyarti 2006).
Kenaikan kelarutan protein akan meningkatkan kekuatan ion larutan. Molekul air yang berikatan dengan ion-ion garam semakin banyak yang menyebabkan penarikan selubung air yang mengelilingi permukaan protein sehingga mengakibatkan protein saling berinteraksi kemudian mengendap (Bisswanger 2004). Proses penyaringan menghasilkan supernatan kapang yang kemudian dimurnikan melalui proses pengendapan. Supernatan yang dihasilkan dari proses penyaringan adalah sebanyak 300 mL. Sebelum diendapkan, supernatan disesuaikan pH-nya sampai pH 7,4. Hasil pengendapan disentrifugasi untuk memisahkan antara ekstrak kasar dengan media.
Tingkat toksisitas (Bioassay)hasil pengendapan
Senyawa bioaktif antikanker yang akan digunakan untuk produk antikanker harus diujikan terlebih dahulu dengan uji toksisitas. Uji toksisitas merupakan salah satu pengembangan metode untuk memprediksi keberadaan senyawa yang bersifat toksik pada sel (Kurnijasanti et al. 2008). Salah satu metode uji toksisitas adalah Brine Shrimp Lethality Test (BSLT) yang digunakan untuk praskrining terhadap senyawa yang diduga berkhasiat sebagai antitumor
(Widyastuti 2008). Hewan uji yang digunakan dalam BSLT adalah
Artemia salina L.
Tujuan utama tahapan ini adalah untuk mengetahui protein kasar yang dihasilkan oleh kapang laut X. psidii KT30 yang paling berpotensi. Selain itu, tujuannya adalah mengetahui konsentrasi yang dapat membunuh dari setengah populasi Artemia salina. Nilai tersebut menggambarkan bioaktivitas metabolit yang dihasilkan dari kapang laut X. psidii KT30. Semakin kecil nilai konsentrasi yang dapat membunuh setengah populasi larva maka akan semakin tinggi bioaktivitasnya, begitu pula sebaliknya. Data hasil uji BSLT protein kasar kapang laut X. psidii KT30 disajikan pada Tabel 2.
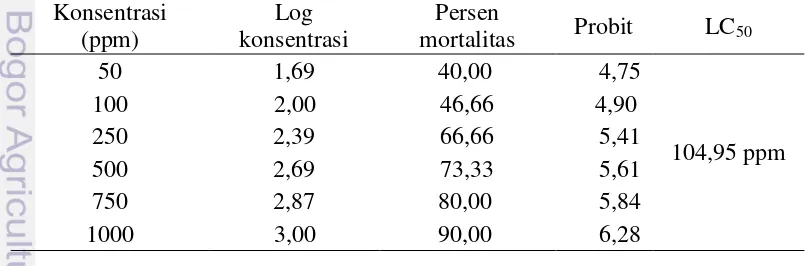
Tabel 2 Data hasil uji BSLT protein kasar kapang laut Xylaria psidii KT30 Konsentrasi
akan menyebabkan semakin besarnya persentase kematian. Persamaan regresi hubungan antara log konsentrasi dengan mortalita Artemia salina dari protein kasar kapang laut Xylaria psidii KT30 yaitu Y= 1,094x + 2,789, Y menunjukkan konsentrasi mortalitas, X menunjukkan log konsentrasi dan R menunjukkan koefisien korelasi antara X dan Y. Persamaan regresi Y= 1,094x + 2,789 menunjukkan bahwa setiap penambahan konsentrasi sebanyak 1 log (5 ppm) menyebabkan kenaikan mortalitas probit sebesar 1,094. Berdasarkan persamaan tersebut diperoleh nilai koefisen korelasi (R2) sebesar 0,984.
Nilai LC50 adalah konsentrasi yang dapat menyebabkan kematian 50% populasi Artemia salina yang digunakan dalam penelitian. Nilai LC50 dapat dihitung dengan menggunakan regresi linear. Nilai LC50 protein kasar kapang laut
Xylaria psidii KT30 yang dihasilkan dari perhitungan sebesar 104,95 ppm. Menurut Meyer et al. (1982) suatu ekstrak tanaman dianggap sebagai bioaktif apabila ekstrak tersebut memiliki nilai LC50 lebih kecil atau sama dengan 1.000 mg/L. Nilai tersebut menunjukkan bahwa protein kasar dari kapang laut
Xylaria psidii KT30 termasuk dalam kategori toksik. Beberapa hasil penelitian terhadap senyawa bioaktif yang diuji dengan Artemia salina (BSLT) menunjukkan adanya korelasi spesifik terhadap uji antikanker bila mempunyai LC50 < 1.000 ppm.
Komponen toksik yang terdapat pada protein kasar jika diberikan pada
A. salina dapat menyebabkan kematian hewan tersebut. Artemia salina
merupakan pemakan bahan-bahan organik sehingga komponen-komponen dari ekstrak yang akan terakumulasi terus menerus di dalam tubuh A. salina. Zat tersebut akan masuk kemudian distribusikan dan ditranslokasi ke seluruh badan, kadarnya akan meningkat seiring dengan waktu dan akan menyebabkan kematian pada A. salina (Abatzopolulos et al. 2010).
Fraksinasi protein kapang laut Xylaria psidii KT30
Fraksinasi protein merupakan suatu langkah awal yang penting untuk mendapatkan komponen biologis suatu protein dalam upaya memahami fungsi biologisnya. Ada beberapa faktor yang harus diketahui sebelum melakukan fraksinasi protein ataupun memisahkan suatu protein tunggal dari suatu campuran protein antara lain berat molekul, muatan, serta sifat hidrofobiknya. Berdasarkan faktor-faktor tersebut metode dalam purifikasi protein terbagi menjadi dua yakni metode kromatografi dan non-kromatografi. Metode non-kromatografi dalam hal ini antara lain elektroforesis, presipitasi, serta filtrasi membran (Sanagi 2001).
Penelitian ini menggunakan matriks DEAE Sephadex A-50. Matriks ini termasuk dalam golongan fungsional diethylaminoethyl, terbuat dari dextran, sejenis polisakarida. Dextran termasuk dalam golongan penukar ion yang lemah. Kode A-50 adalah penukar ion dengan kapasitas 50, artinya jumlah 50 muatan dan potensi muatannya per unit berat atau miliequivalen grup ion per milligram berat kering matrik (Boyer 2000).
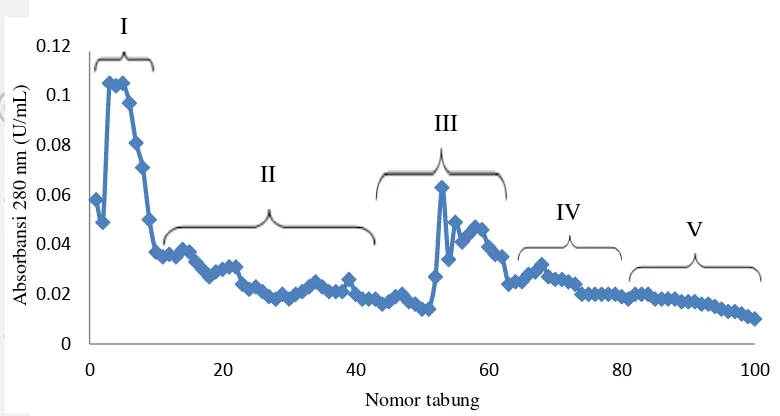
absorbansi menghasilkan lima puncak fraksi protein yang terdiri dari fraksi I (tabung ke-2 sampai ke-12), fraksi II (tabung ke-13 sampai ke-49), fraksi III (tabung ke-50 sampai ke-61), fraksi IV (tabung ke-62 sampai ke-72), dan fraksi V (tabung ke-73 sampai ke-100).
Gambar 4 Hasil fraksinasi protein kapang laut Xylaria psidii KT30menggunakan kromatografi kolom DEAE Sephadex A-50
Fraksi protein kapang laut X. psidii KT30 kemudian dikeringkan dengan metode pengeringan beku (Freezedry) dan dihitung rendemennya. Fraksi yang memiliki rendemen tertinggi adalah fraksi F3.1 (tabung ke-53), F3.2 (tabung ke-60), dan F4 (tabung ke-69). Data hasil rendemen disajikan pada Tabel 3.
Tabel 3 Persentase rendemen protein fraksi terpilih kapang laut X. psidii KT30
Hasil Jumlah (%)
Fraksi F3.1 3,7
Fraksi F3.2 2,7
Fraksi F4 1,8
Penentuan bobot molekul dengan SDS-PAGE
Gambar 5 Hasil SDS-PAGE ( M (marker), CE (protein kasar), F3.1 (tabung ke-53), F3.2 (tabung ke-60), F4 (tabung ke-69) )
Hasil penentuan bobot molekul dapat dilihat dari Gambar 5 pada fraksi protein terpilih F3.1, F3.2, dan F4 menghasilkan tiga band dengan bobot molekul 23,99; 32,8, dan 37,30 kDa. Hal ini menunjukkan bahwa isolasi dan purifikasi yang dilakukan belum optimal, sehingga perlu dilakukan pemurnian lebih lanjut dengan metode yang lainnya. Berdasarkan bobot molekulnya, protein kapang laut
X. psidii KT30 termasuk dalam golongan protease (Barret et al. 2004). Protease dari mikroorganisme memperlihatkan bobot molekul dari 18 kDa sampai 126 kDa (Rao et al. 1998). Penelitian lain yang dilakukan oleh Hu et al. 2012 terhadap kapang Xylaria hypoxylon menyatakan monomer protein terestimasi sebesar 43 kDa. Protease kapang X. psidii KT30 menunjukkan bobot molekul yang lebih rendah dibandingkan dengan bobot molekul dari kapang Xylaria hypoxylon,
namun lebih tinggi dibandingkan protease dari jamur Pleurotus eryngii sebesar 11,8 kDa (Wang dan Ng 2001), Pleurotus citrinopileatus sebesar 18 kDa (Cui et al. 2007), dan Helvella lacunosa sebesar 33,5 kDa (Zhang et al. 2010). Berdasarkan penelitian yang telah dilaporkan sebelumnya, maka protease yang dihasilkan dari kapang laut X. psidii KT30 menunjukkan jenis protein yang baru.
Simpulan
1 Protein kasar kapang laut Xylaria psidii KT30 dikategorikan senyawa toksik dengan nilai LC50 104,9 ppm.
3 SITOTOKSISITAS PROTEIN KAPANG LAUT
Xylaria psidii KT30 TERHADAP Sel Chang dan Sel HeLa
Pendahuluan
Latar belakang
Kanker leher rahim atau disebut juga kanker serviks adalah sejenis kanker yang 99,7% disebabkan oleh human papilloma virus (HPV) onkogenik, yang menyerang leher rahim. Jumlah kematian akibat kanker serviks di dunia diperkirakan lebih dari 300.000 per tahun, dan banyak dari mereka yang meninggal adalah ibu-ibu muda. Tingkat morbiditas kanker leher rahim di
Indonesia menempati posisi pertama dibandingkan dengan kanker yang lain (Canavan dan Doshi 2000).
Kanker leher rahim terjadi jika sel-sel yang ada di daerah tersebut membelah secara tak terkendali dan menjadi abnormal. Jika sel-sel tersebut terus membelah, maka akan terbentuk suatu massa jaringan yang disebut tumor. Tumor dapat bersifat jinak atau ganas. Jika tumor tersebut menjadi ganas, maka keadaannya disebut sebagai kanker leher rahim (Lio 2006).
Pengobatan kanker yang umum dilakukan saat ini adalah dengan cara kemoterapi. Kemoterapi adalah terapi kimia dengan menggunakan zat-zat kemoterapi untuk menekan pertumbuhan kanker. Zat-zat kimia yang digunakan dapat dari hasil sintesis kimia, semisintetik, fitokimia, bioaktif hewan dan dari mikroorganisme (Taneja et al. 2005).
Metode kemoterapi dilakukan dengan cara memberikan obat dalam bentuk senyawa kimia untuk membunuh sel-sel kanker dalam tubuh pasien. Kemoterapi dapat diberikan melalui mulut atau injeksi, kadang-kadang dapat juga langsung pada bagian tubuh yang terkena kanker. Kebanyakan kemoterapi diberikan secara infus melalui pembuluh darah vena. Namun, teknik kemoterapi di samping membunuh sel-sel kanker juga dapat mengakibatkan rusaknya sel-sel normal yang kebetulan menyerap obat tersebut. Efek samping pengobatan ini cukup berat, misalnya mual, muntah, rambut rontok, dan lain-lain (Anica et al. 2011).
Operasi bedah merupakan pilihan efektif untuk tipe kanker yang tidak terikat erat pada jaringan tubuh lainnya, serta sel-sel kankernya terbungkus dalam satu kesatuan. Namun, teknik pembedahan ini menjadi kurang menguntungkan pada jenis kanker terbuka karena dapat meninggalkan sisa-sisa sel kanker yang dapat tumbuh kembali di kemudian hari. Teknik operasi bedah juga tidak dapat digunakan untuk jenis kanker yang sudah bermetastasis. Saat ini dengan mahalnya obat kemoterapi sintetik dan meningkatnya kasus penyakit kanker maka pengobatan kanker difokuskan pada komponen fitokimia dan bioaktif dari mikroba dan hewan yang berpotensi menekan pertumbuhan sel normal atau reaksi metabolik (Kumaran et al. 2009).
satu jenis kapang yang dapat menghasilkan protein antikanker. Sitotoksisitas kapang laut X. psidii KT30 belum diketahui sehingga penelitian ini bertujuan untuk menentukan sitotoksisitas protein kapang laut X. psidii KT30 terhadap sel Chang (sel normal) dan sel HeLa.
Bahan dan Metode
Tempat penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi Hasil Perairan Teknologi Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) Institut Pertanian Bogor, Laboratorium Mikrobiologi dan Imunologi Pusat Studi Satwa Primata (PSSP) Institut Pertanian Bogor.
Bahan dan alat
Bahan utama yang digunakan dalam penelitian ini adalah kapang laut
Xylaria psidii KT30. Pengujian sitotoksisitas digunakan bahan antara lain sel kanker serviks (HeLa ATCC CCL 2), sel hati normal (Chang ATCC CCL 13), Doxorubicin, Fetal Bovine Serum (FBS), Media Rosewall Park Memorial Institute (RPMI) 1640, 3-(4-,5 dimethylthiazol-2-yl)-2,5-difenil tetrazolium bromida (MTT), larutan SDS 10%, HCl, kristal formazan, dan Phosphate Buffered Saline (PBS). Alat-alat yang digunakan dalam penelitian ini adalah tabung reaksi,
micropipet, well plate, inkubator MILLIPORE, microplate reader C-MAG HS Series H24 dan sentrifus HIMAC CR 21 G.
Metode penelitian
Uji sitotoksisitas ekstrak protein kapang laut Xylaria psidii KT30 terhadap
sel Chang (Hseu et al. 2006)
Pembuatan media sel kanker (LCAG 2009)
Media DMEM bubuk dimasukkan ke dalam botol steril dan ditambahkan 3,7 gram NaHCO3, antibiotik penisilinstreptomisin 1%, dan 10% FBS, kemudian dihomogenisasi dan ditambahkan akuabides sampai larutan media menjadi 1000 mL.
Persiapan kultur sel Chang (Li et al. 2011)
Sel Chang ditumbuhkan dalam flask yang berisi media DMEM. Sel yang telah tumbuh (menempel pada dinding flask), kemudian medianya dibuang dan sel HeLa dalam flask dibilas dengan larutan PBS. Enzim tripsin ditambahkan sebanyak 5 mL, lalu dinkubasikan selama 5 menit, kemudian ditambahkan media DMEM. Suspensi tersebut disentrifuse pada kecepatan 700g selama 5 menit. Supernatan yang diperoleh dibuang dan pelet (sel Chang) yang diperoleh
dimasukkan ke dalam tiap sumur sebanyak 96 sumur. Kultur sel tersebut diinkubasi selama 24 jam (over night) dalam inkubator CO2.
Sitotoksisitas protein
Kultur sel Chang yang telah diinkubasi selama 24 jam medianya dibuang, kemudian dilanjutkan dengan penambahan sampel protein dari kapang laut
X. psidii KT30. Sampel protein yang diuji yaitu protein kasar dan protein fraksi terpilih. Tahap awal perlakuan sampel protein adalah dengan membuat stok larutan sampel dengan konsentrasi masing-masing 10.000 ppm, yang dibuat dengan cara melarutkan 10 mg sampel protein dengan 50 μL DMSO, kemudian ditambah dengan 950 μL DMEM. Masing-masing larutan sampel protein diencerkan dengan menambahkan DMEM untuk mendapatkan konsentrasi akhir pada microplate. Konsentrasi yang digunakan pada semua sampel adalah 7, 16, 32, 75, 150, 250, 500, dan 1.000 ppm. Sumur microplate yang berisi sel Chang dari tahap sebelumnya (kultur sel Chang), ditambahkan 100 μL larutan sampel protein yang uji di atas sebagai perlakuan, dan ditambahkan 100 μL DMEM sebagai kontrol negatif. Campuran dalam microplate tersebut diinkubasi selama 48 jam dalam inkubator CO2.
Uji sitotoksisitas dengan MTT (CCRC 2000)
Sel Chang yang telah diinkubasi 48 jam, dimasukkan garam tetrazolium 5 mg/mL sebanyak 10 μL tiap sumur. Warna campuran menjadi kuning. Inkubasi selama 4 jam pada inkubator CO2. Setelah diinkubasi dan telah terbentuk kristal formazan, larutan ekstrak dibuang. Kristal formazan yang terbentuk dilarutkan dengan 100 μL etanol 96% pada tiap sumur. Warna larutan menjadi ungu. Nilai absorban dari formazan yang terbentuk diukur dengan microplate reader pada panjang gelombang 595 nm. Semua perlakuan dilakukan triplo.
Uji sitotoksisitas ekstrak protein kapang laut Xylaria psidii KT30 terhadap
sel HeLa (Hseu et al. 2006)
Pembuatan media sel kanker (LCAG 2009)
Media DMEM bubuk dimasukkan ke dalam botol steril dan ditambahkan 3,7 gram NaHCO3, antibiotik penisilinstreptomisin 1%, dan 10% FBS, kemudian dihomogenisasi dan ditambahkan akuabides sampai larutan media menjadi 1.000 mL.
Persiapan kultur sel HeLa (Li et al. 2011)
Sel HeLa ditumbuhkan dalam flask yang berisi media DMEM, setelah sel tumbuh (menempel pada dasar flask), media dibuang dan sel HeLa dalam flask
Sitotoksisitas protein
Kultur sel HeLa yang telah diinkubasi selama 24 jam medianya dibuang, kemudian dilanjutkan dengan perlakuan ekstrak. Protein yang diuji meliputi protein kasar dan protein fraksi terpilih. Tahap awal perlakuan sampel adalah dengan membuat stok larutan sampel protein dengan konsentrasi masing-masing 10.000 ppm yang dibuat dengan cara melarutkan 10 mg sampel protein dengan 50 μL DMSO, kemudian ditambah dengan 950 μL DMEM. Masing-masing larutan sampel protein kemudian diencerkan dengan menambahkan DMEM untuk mendapatkan konsentrasi akhir pada microplate. Konsentrasi yang digunakan pada sampel yang diuji meliputi protein kasar, protein fraksi terpilih adalah 30, 60, 90, 180, 270, 360, 720, dan 1080 ppm. Sumur microplate yang berisi sel HeLa dari tahap sebelumnya (kultur sel HeLa), ditambahkan 100 μL larutan sampel protein yang uji di atas sebagai perlakuan dan ditambahkan 100 μL DMEM sebagai kontrol negatif. Campuran dalam microplate tersebut diinkubasi selama 48 jam dalam inkubator CO2.
Uji sitotoksisitas dengan MTT (CCRC 2000)
Sel HeLa yang telah diinkubasi 48 jam, dimasukkan garam tetrazolium 5 mg/mL sebanyak 10 μL tiap sumur. Campuran garam tetrazolium yang berwarna kuning diinkubasi selama 4 jam pada inkubator CO2. Larutan ekstrak dibuang setelah terbentuk kristal formazan. Kristal formazan yang terbentuk dilarutkan dengan 100 μL etanol 96% pada tiap sumur. Warna larutan menjadi ungu. Nilai absorban dari formazan yang terbentuk diukur dengan microplate reader pada panjang gelombang 595 nm. Semua perlakuan dilakukan triplo.
Analisis Data
Data yang diperoleh dari uji sitotoksisitas dengan MTT berupa nilai absorban tiap sumur, kemudian nilai absorban tersebut dikonversi menjadi % inhibisi dengan menggunakan rumus (Zhang et al. 2005):
% Inhibisi = A kontrol−A sampel x 100%. A kontrol
Analisis statistik untuk membandingkan inhibisi tiap ekstrak dilakukan dengan menggunakan One-Way ANOVA dengan SPSS. Jika terdapat perbedaan yang nyata, maka analisis dilanjutkan dengan uji Duncan menggunakan program SPSS.
Hasil dan Pembahasan
Sitotoksisitas protein kapang laut Xylaria psidii KT30 pada sel Chang
Uji sitotoksisitas dalam penelitian ini dilakukan untuk melihat seberapa besar tingkat sitotoksisitas protein kasar, protein F3.1, F3.2, dan F4 kapang laut
Xylaria psidii KT30 terhadap sel normal (Chang) dan sel HeLa. Uji sitotoksisitas awal dilakukan terhadap sel Chang. Sel Chang adalah kultur sel yang diisolasi dari hati manusia.
tetrazolium MTT berwarna kuning menjadi kristal formazan berwarna biru keungguan (Basmal et al. 2009). Metode perubahan warna tersebut digunakan untuk mendeteksi adanya proliferasi sel. Sel yang mengalami proliferasi, mitokondria akan menyerap MTT sehingga sel-sel tersebut akan berwarna ungu akibat terbentuknya kristal tetrazolium (formazan). Konsentrasi formazan yang berwarna ungu dapat ditentukan secara spektrofotometri visibel dan berbanding lurus dengan jumlah sel hidup. Semakin besar absorbansi menunjukkan semakin banyak jumlah sel yang hidup (Depamede et al. 2009).
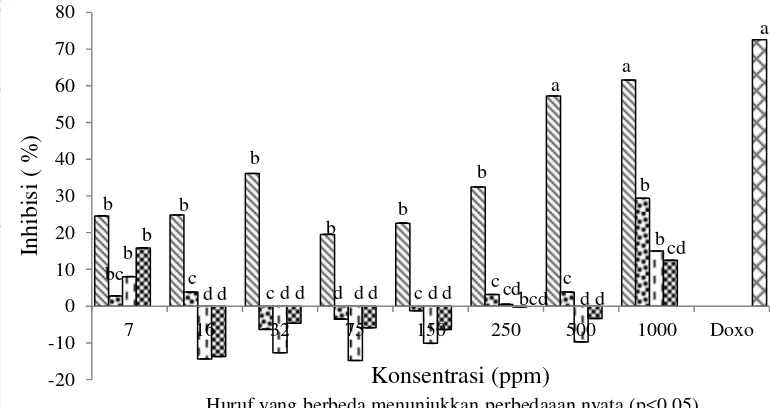
Gambar 6 Pengaruh konsentrasi protein terhadap sel Chang (protein kasar , fraksi F3.1 , fraksi F3.2 , fraksi F4 ,dan doxo )
Gambar 6 menunjukkan hasil fluktuatif antara penambahan konsentrasi sampel protein kasar dan fraksi terpilih terhadap persen inhibisi sel Chang. Protein kasar pada konsentrasi 500 dan 1.000 ppm serta kontrol positif (doxorubicin) menunjukkan hasil yang berbeda nyata, sedangkan sampel protein kasar dan fraksi protein terpilih pada konsentrasi 7, 16, 32, 75, 150 dan 250 ppm tidak berbeda nyata terhadap persen inhibisi sel Chang.
Persen inhibisi tertinggi (61,53%) pada sel Chang terlihat pada protein kasar konsentrasi 1.000 ppm, sedangkan pada fraksi terpilih (F3.1, F3.2 dan F4) pada konsentrasi 1.000 ppm hanya memiliki persen inhibisi berturut-turut 29,39%, 15,01%, dan 15,01%.
Nilai IC50 semua konsentrasi protein kasar dan protein fraksi F3.1, F3.2 dan F4 hasil fraksinasi dari kapang laut Xylaria psidii KT30 pada penelitian ini tidak bisa ditentukan karena pada konsentrasi ekstrak terbesar (1.000 ppm) tidak menghasilkan % inhibisi lebih dari 50% terhadap sel Chang. Nilai IC50 protein kasar dan protein fraksi terpilih kapang laut terhadap sel Chang disimpulkan lebih dari 1.000 μg/mL.
Doxorubicin digunakan sebagai kontrol positif. Doxorubicin merupakan salah satu agen kemoterapi yang sudah digunakan sebagai obat antikanker (Arafa et al. 2005). Kontrol positif (doxorubicin) dengan konsentrasi 3 ppm menunjukkan persen inhibisi sebesar 72,52% terhadap sel Chang. Jika dibandingkan dengan kontrol positif yang digunakan maka fraksi F4 kapang laut
-20
X. psidii KT30 masih memiliki persen inhibisi yang lebih rendah dalam membunuh sel normal sehingga lebih aman untuk digunakan sebagai agen antikanker. Heti (2009) melaporkan bahwa terapi dikatakan berhasil baik bila dosis yang digunakan dapat mematikan sel tumor yang ganas dan tidak mengganggu sel normal yang berproliferasi.
Sitotoksisitas protein kapang laut Xylaria psidii KT30 pada sel HeLa
Sel kanker merupakan sel abnormal yang telah mengalami transformasi dari sel normalnya. Sel kanker dapat digunakan sebagai model biologi untuk menentukan sifat-sifat biologisnya dan analisis obat-obatan sebagai agen antikanker. Penelitian resistensi obat kanker menggunakan sel kanker dapat digunakan untuk mempelajari mekanisme pengaturan resistensi obat-obatan untuk penyakit kanker (Arya et al. 2011).
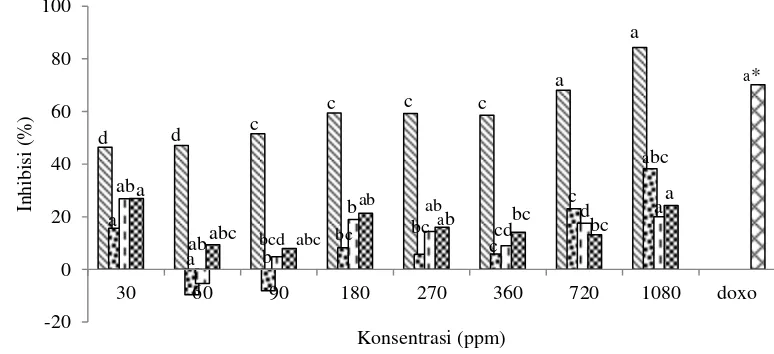
Gambar 7 Pengaruh perlakuan konsentrasi protein terhadap sel HeLa (protein kasar , fraksi F3.1 , fraksi F3.2 , fraksi F4 , dan doxo*(Suci 2013 ) )
Gambar 7 menunjukkan hasil fluktuatif antara penambahan konsentrasi sampel protein kasar dan fraksi terpilih terhadap persen inhibisi sel HeLa. Protein kasar pada konsentrasi 720 dan 1.080 ppm serta kontrol positif (doxorubicin) menunjukkan hasil yang berbeda nyata, sedangkan pada sampel protein kasar dan fraksi terpilih pada konsentrasi 30, 60, 90, 180, 270, dan 360 tidak berbeda nyata terhadap % inhibisi sel HeLa (< 0.05).
Nilai IC50 semua konsentrasi protein fraksi F3.1, F3.2 dan F4 hasil fraksinasi dari kapang laut Xylaria psidii KT30 pada penelitian ini tidak bisa ditentukan karena pada konsentrasi terbesar (1.080 ppm) tidak menghasilkan persen inhibisi lebih dari 50% terhadap sel HeLa. Pada konsentrasi 30 ppm, fraksi F4 telah membunuh sel HeLa sebesar 26,85%. Suci (2013) melaporkan bahwa doxorubicin dengan konsentrasi 3 ppm menunjukkan persen inhibisi sebesar 70,13% terhadap sel HeLa. Jika dibandingkan dengan persen inhibisi sampel protein kasar dan protein fraksi F3.1 dan F3.2 maka fraksi F4 lebih berpotensi
Berdasarkan National Cancer Institute (2012), nilai ini menunjukkan aktivitas antikanker protein hasil fraksinasi X. psidii KT30 sangat lemah terhadap sel HeLa, sedangkan protein kasar protein kapang laut memiliki nilai IC50 69,89 μg/mL (Tabel 4). Sitotoksisitas protein fraksi terpilih yang rendah terhadap sel HeLa karena proses fraksinasi yang dilakukan belum optimal sehingga belum menghasilkan senyawa tunggal. Sel HeLa diduga bersifat resisten terhadap
senyawa-senyawa bioaktif yang terdapat dalam protein kapang laut
X. psidii KT30. Kumala (2010) melaporkan kapang endofit isolat 1.3.11 yang diisolasi dari Brucea javanica terbukti bersifat sitotoksik terhadap sel kanker payudara MCF-7 dan T47D dengan IC50 berturut-turut 48 μg/mL dan 68 μg/mL dan menunjukkan sinergisme dengan doxorubicin dalam pemacuan apoptosis. Tabel 4 Data hasil uji sitotoksisitas ekstrak kasar kapang laut X. psidii KT30
terhadap sel HeLa Konsentrasi
(ppm) % Inhibisi
Log
konsentrasi Probit IC50
30 46,36 1,47 4,90
60 47,01 1,77 4,92
90 51,53 1,95 5,03
180 59,45 2,25 5,23 69,89 μg/mL
270 59,12 2,43 5,23
360 58,48 2,55 5,20
720 68,01 2,85 5,47
1080 84,32 3,03 5,99
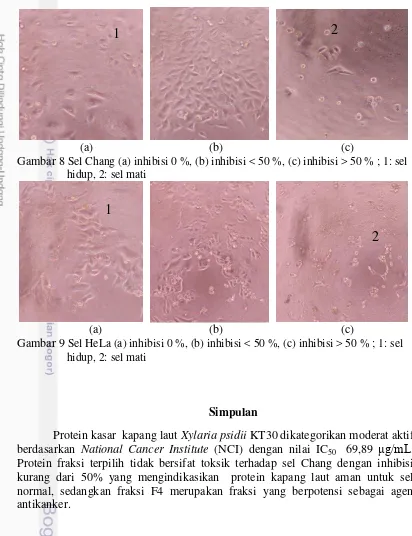
Morfologi sel Chang dan sel HeLa diamati dibawah mikroskop (Gambar 8 dan 9). Bentuk sel Chang dan sel HeLa yang tanpa perlakuan tampak melekat pada bagian permukaan tempat tumbuh sel, selain itu sel juga masih berbentuk
(a) (b) (c)
Gambar 8 Sel Chang (a) inhibisi 0 %, (b) inhibisi < 50 %, (c) inhibisi > 50 % ; 1: sel hidup, 2: sel mati
(a) (b) (c)
Gambar 9 Sel HeLa (a) inhibisi 0 %, (b) inhibisi < 50 %, (c) inhibisi > 50 % ; 1: sel hidup, 2: sel mati
Simpulan
Protein kasar kapang laut Xylaria psidii KT30 dikategorikan moderat aktif berdasarkan National Cancer Institute (NCI) dengan nilai IC50 69,89 μg/mL. Protein fraksi terpilih tidak bersifat toksik terhadap sel Chang dengan inhibisi kurang dari 50% yang mengindikasikan protein kapang laut aman untuk sel normal, sedangkan fraksi F4 merupakan fraksi yang berpotensi sebagai agen antikanker.
PEMBAHASAN UMUM
Kanker merupakan penyakit degeneratif yang mematikan. WHO
(World Health Organization) (2012) memprediksi kasus kanker dunia yang menyebabkan kematian akan mengalami 13,1 juta jiwa Tahun 2030. Sebagian besar penyakit kanker disebabkan oleh lingkungan dan gaya hidup. Faktor lingkungan yang menyebabkan kanker antara lain polusi, asap rokok, radiasi, dan infeksi organisme. Faktor gaya hidup yaitu kebiasaan merokok, konsumsi alkohol, makanan yang mengandung bahan tambahan pangan yang karsinogenik, dan makanan berlemak trans serta obesitas (Jemal 2011).
1
2
1
Kanker serviks atau kanker leher rahim merupakan salah satu penyakit yang paling banyak terjadi bagi wanita. Setiap jam, satu wanita meninggal di Indonesia karena kanker serviks atau kanker mulut rahim ini. Fakta menunjukkan bahwa jutaan wanita di dunia terinfeksi Human Papilloma Virus (HPV) (Rasyid 2008). Kanker serviks atau kanker mulut rahim terjadi di bagian organ reproduksi seorang wanita.
Kanker terjadi karena adanya perubahan mendasar dalam fisiologi sel yang akhirnya tumbuh menjadi malignan serta mempunyai ciri -ciri umum sebagai berikut: (1) mandiri dalam signal pertumbuhan, (2) tidak peka terhadap signal anti pertumbuhan, (3) menghindari apoptosis, (4) memiliki potensi replikasi yang tidak terbatas , (5) angiogenesis, (6) invasi dan metastase ke jaringan lain. Oleh karena itu, target pengembangan obat antikanker diarahkan pada induksi/pemacuan apoptosis. Apoptosis merupakan program bunuh diri dari sebuah sel. Program ini memiliki peran yang penting untuk menjaga homeostatis perkembangbiakan sel dan dengan adanya disregulasinya bisa berakibat timbulnya macam-macam penyakit. Salah satu peran pentingnya adalah untuk membatasi proliferasi sel yang tidak diperlukan yang akan dapat menyebabkan kanker. Pada sel kanker program apoptosis ini telah mengalami gangguan sehingga sel akan mengalami metastasis (Manahan dan Wierberg 2002).
Teknologi untuk terapi kanker misalnya pembedahan, radiasi, terapi hormon dan kemoterapi banyak dikembangkan saat ini, tapi pengobatan ini memerlukan biaya yang mahal dan memiliki efek samping yang tidak baik bagi tubuh. Oleh karena itu, perlu dikembangkan suatu pengobatan yang dapat mengobati kanker dengan kemampuan mengobati yang kuat dan tanpa efek samping.
Pengembangan teknologi produksi senyawa aktif dari bahan alami merupakan teknologi yang memiliki prospek yang baik. Salah satu bahan alami yang dapat digunakan untuk menghasilkan senyawa obat dalam skala besar adalah yang diekstrak dari kapang endofit. Penggunaan kapang endofit dapat meningkatkan efisiensi produksi senyawa antikanker, masa berkembang biak kapang endofit yang relatif singkat dengan laju pertumbuhan yang tinggi memungkinkan produksi senyawa antikanker dan penginduksi apoptosis semakin efisien dalam jumlah besar. Kapang laut Xylaria psidii KT30 merupakan salah satu kapang yang dapat menghasilkan protein antikanker (Tarman et al. 2011).
Senyawa bioaktif antikanker yang akan digunakan untuk produk antikanker harus diujikan terlebih dahulu dengan uji sitotoksisitas. Uji sitotoksisitas merupakan salah satu pengembangan metode untuk memprediksi keberadaan senyawa yang bersifat toksik pada sel (Kurnijasanti et al. 2008). Uji toksisitas menggunakan metode BSLT menunjukkan kapang laut X. psidii KT30 bersifat toksik dengan nilai LC50 104,95 ppm.
Saat dosis kumulatif doxorubicin mencapai 550 mg/mL, risiko efek samping pada jantung meningkat, termasuk gagal jantung, pelebaran
cardiomyopathy dan kematian. Efek kardiotoksik dari doksorubisin ditunjukkan oleh penurunan fosforilasi oksidatif di mitokondria. Oksigen reaktif yang muncul dari interaksi doksorubisin dan besi dapat merusak myocytes (sel jantung), hilangnya myofibrillar dan cytoplasmic vacuolization (Chabner et al. 2008).
Protein kapang laut X. psidii KT30 dikatakan aman terhadap sel normal dengan hasil persen inhibisi kurang dari 50%, sedangkan pada fraksi F4 dengan bobot molekul 23,99 kDa, 32,88 kDa, dan 37,30 kDa merupakan fraksi terpilih yang berpotensi digunakan sebagai agen antikanker.
Mekanisme kerja senyawa aktif dalam penghambatan ploriferasi sel kanker dapat melalui berbagai cara, antara lain apoptosis (kematian terprogram), nekrosis, penghambatan siklus sel, kegagalan ribosom untuk mensintesis protein, atau menghambat siklus sel. Sebagai contoh Xyloketal B dari kapang Xylaria sp. menginduksi apoptosis HUVEC untuk menghambat ox-LDL (oxidatively modified low-density lipoprotein) (Chen et al. 2009).
Perubahan morfologi seluler bisa disebabkan oleh apoptosis yang terjadi pada sel. Mekanisme apoptosis ini sering digunakan untuk menjelaskan mekanisme antikanker yang ditimbulkan oleh berbagai senyawa obat. Sel Chang dan sel HeLa yang mengalami inhibisi karena diinduksi oleh protein kapang laut ini mungkin mengalami mekanisme apoptosis yang mengakibatkan terjadinya perubahan pada morfologi selnya. Perubahan morfologi seluler akibat mekanisme apoptosis ini dapat terjadi dalam beberapa tahapan, yaitu penyusutan densitas sel, kondensasi dan fragmentasi kromatin sel, serta fragmentasi inti sel (Wyllie 2010).
Simpulan dan Saran
Simpulan
Bobot molekul fraksi terpilih yaitu 23,99 kDa, 32,88 kDa, dan 37,30 kDa. Fraksi terpilih dari kapang laut X. psidii KT30 tidak bersifat toksik terhadap sel Chang, sedangkan fraksi F4 merupakan fraksi terpilih yang berpotensi sebagai agen antikanker sel HeLa.
Saran
DAFTAR PUSTAKA
Anica HK, Domagoj I, Duje L, Nevenka K, Nada O, Sanja K, Vesna B. 2011. Synergistic effects of Irinotecan and flavonoids on Ehrlich Ascites tumour-bearing mice. Basic & Clinical Pharmacology & Toxicology. 109:343– 349.doi: 10.1111/ j.1742-7843.2011.00735.x.
Arafa HM, Abd-ellah MF, Hafez HF. 2005. Abatement by Naringenin of doxorubicin-induced cardiac toxicity in Rats. J EgyptianNational Cancer Inst. 14(4):230-291.
Arya V, Kashyap CP, Bandana T, Shikha S, Sweta K, Pritti V, Swati S. 2011. Human cancer cell lines-A brief communication. J Chem Pharm Res. 3(6): 514-520.
[ATCC] American Type Culture Collection. 2012. HeLa (ATCC-CCL2). [internet]. [diunduh pada 2013 Sept 13]. Tersedia pada: http://www.atcc.org/products/all/CCL-2.aspx.
Abatzopolulos T, Beardmore J, Clegg J, Sorgeloos P. 2010. Artemia basic and applied biology. Kluwer Academis Publishers.
Basmal J, Amini S, Sugiyono, Murniyati. 2009. Seminar Nasional Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan. Jakarta (ID).
Bisswanger H. 2004. Practical Enzymology. Germany (DE): Wiley-VCH Pr. Boyer RF. 2000. Modern Experimental Biochemistry. San Fransisco: Addison
Wesley Longman Pr.
Canavan TP, Doshi NR. 2000. Cervical Cancer. AmFam Physician. 61:1369-76. Carballo JL, Hernadez-Inda ZL, Perez P, Garcia-Gravalos MD. 2002. A
comparison between two brine shrimp assay to detect in vitro cytotoxicity in marine natural product (methodology article). Bioorganic Mar Chem Biotech. 2(1):1-5.
[CCRC] Cancer Chemoprevention Research Center. 2000. Prosedur tetap uji sitotoksik metode MTT. Yogyakarta (ID): Fakultas Farmasi, Universitas Gajah Mada.
Chabner BA, Lynch TJ and Longo DL. 2008. Harrison’s: Manual of Oncology. New York: Mc Graw-Hill Companies Inc.
Chen WL, Qian Y, Meng Wei F, Pang JY, Lin YC, Guan YY, Chen SP, Liu J, Pei Z, Wang GL. 2009. A novel marine compound xyloketal B protects againt oxidized LDL-induced cell injury in vitro. Biochemical Pharmacology. 78:941-950. doi:10.1016/j.bcp.2009.05.029.
Cragg GM , Newman DJ. 2009. Nature: a vital source of leads for anticancer drug development. Phytochem Rev. 8:313-331. doi: 10.1007/s11101-009- 9123-y.
Cui L, Liu QH, Wang HX, dan Ng TB. 2007. An alkaline protease from fresh fruiting bodies of the edible mushroom Pleurotus citrinopileatus. Applied Microbiology and Biotechnology. 75(1):81–85.
Depamede SN, Rosyidi A. 2009. Penghambatan proliferasi limfosit mencit Balb/C oleh ekstrak testis sapi bali: Peran TGF-β. Media Peternakan. 32(2):95-103.
Freshey IR. 2000. Culture of Animal Cells. 4th edition. A manual basic technique. New York: John Wiley and sons inv.
Gandjar I, Sjamsuridzal W, Zoetari A. 2006. Mikologi Dasar dan Terapan. Jakarta (ID): Yayasan Obor Indonesia. hlm 20-60.
Hasan AEHA. 2007. Novel natural products from endophytic fungi of Egyptian medicinal plants-chemical and biological characterization [disertasi]. Jerman: University Dusseldorf.
Hseu YC, Chang WH, Chen CS, Liao JW, Huang CJ, Lu FJ, Chia YC, Hsu HK, Wu JJ, Yang HL. 2008. Antioxidant activities of Toona Sinensis leaves extracts using different antioxidant models. Food Chem Toxicol. 46:105– 114.
Heti D. 2009. Uji sitotoksik ekstrak etanol 70% Herba Sisik Naga (Drymoglossum piloselloides Presl.) terhadap sel T47D. Fakultas Farmasi
Universitas Muhamadiyah Surakarta. Surakarta.
Hu QX, Zhang GQ, Zhang RY, Hu DD, Wang HX, Nq TB. 2012. A novel aspartic protease with HIV-1 reverse transcriptase inhibitory activity from fresh fruiting bodies of the wild mushroom Xylaria hypoxylon. J Biomed Biotechnol. 728975. doi: 10.1155/2012/728975.
Itharat A, Ooraikul B. 2007. Research on Thai medicinal plants for cancer treatment. Di dalam: Acharya SN, Thomas JE, editor. Advances in Medicinal Plant Research. Ed ke-2. Kerala: Research Signpost. hlm 287-314.
Kumala S, Muhammad G. 2008. Isolasi dan penapisan kapang endofit tanaman Secang sebagai penghasil senyawa antibakteri. J Ilmu Kefarmasian Indonesia. 21(2):15-17.
Kumaran RS, Muthumary J, Hur BK. 2009. Isolation and identification of an anticancer drug, taxol from Phyllosticta tabernaemontanae, a leaf spot fungus of an angiosperm, Wrightia tinctoria. J Microbiol. 47(1):40-49. doi: 10.1007/s12275-008-0127-x.
Kurnijasanti R, Hamid IS, Rahmawati K. 2008. Efek sitotoksik in vitro dari ekstrak buah mahkota dewa (Phaleria marcocapra ) terhadap kultur sel kanker mienoma. J Medika Eksakta.7(1):48-54.
Laemmli UK. 1970. Cleavage of structural protein during the assembly of the head of bacteriophage T4. Nature. 227:680-685.
[LCAG] Lonza Cologne AG. 2009. Amaxa® Cell Line Nucleofector® Kit R for HeLa Cells [ATCC® CCL-2™]. Jerman (DE): Lonza Cologne AG.
Liao JB. 2006. Viruses and human cancer. Yale Journal of Biology and Medicine. 79:115-122.
Li K, Li Q, Zhang T, Han Z, Li J, Liu Z, Zheng F. 2011. Procyanidins from
Pinus koraiensis bark inhibits HeLa cell growth by inducing apoptosis and reducing survivin protein expression. Afr J Biotechnol. 10(40):7766-7771. Latundra I, Ahmad A. 2012. Isolasi dan karakterisasi protein bioaktif dari
beberapa jenis spons sebagai agen antimikroba [paper]. Makassar : Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Hasanuddin. hlm 1-10.
Ma’at S. 2003. Tanaman obat untuk pengobatan kanker. J Bahan Alam Indonesia. 2(4):146-149.
Manahan D, Wienberg RA. 2002. The Hallmarks of Cancer Cell. 100:57-70. Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nochols DE, Mc Laughlin JL.
1982. Brine shrimp : a convinient general bioassay for active plant convinient. J Medical Plant Res. 45:31-34.
Michael M, Doherty MM. 2005. Tumoral drug metabolism: overview and its implication for cancer therapy. J Of Clin Oncol. 23:205-229. doi: 10.1200/JCO.2005.02.120.
Minami Y, Ankara Y, Funatsu G. 1992. Isolation and characteization of two momors, ribosome-inactivating protein from the seed of bitter gourd (Momordica charantina). Biosci Biotech Biochem. 56(9) :1470–1471. Munandar A. 2013. Purifikasi dan karakterisasi dari kapang Xylaria psidii KT30
yang diisiolasi dari rumput laut Kappaphycus alvarezii. [Tesis]. Bogor(ID): Institut Pertanian Bogor.
[NCI] National Cancer Institute (US). 2012. Cervical Cancer.
Paulus BP, Gadek P. 2006. Successional pattern of microfungi in fallen leaves of
Ficus pleurocarpa (Moraceae) in an Australian tropical rain forest.
Biotropica. 38(1):42-51.doi: 10.1111/j.1744-7429.2006.00110.x.
Pratomo R. 2006. Pengaruh macam, pH, dan penggoyangan media terhadap pertumbuhan cendawan Rhizoctonia sp. [skripsi]. Bogor: Budidaya Hutan, Fakultas Kehutanan, Institut Pertanian Bogor.
Rasyid A. 2008. Biota Laut sebagai sumber obat-obatan. Oseana. 33:11-18. Rao MB, Tanksale AM, Ghatge MS, dan Deshpande VV. 1998. Molecular and
biotechnological aspects of microbial proteases. Microbiology and Molecular Biology Reviews. 6(3):597–635.
Romero CJ, Barria EO, Arnold AE, Rios LC. 2008. Activity againts Plasmodium falciparum of Lactones isolated from the endophytic fungus Xylaria sp.
Pharmaceutical Biology. 46:1-4. doi: 10.1080/13880200802215859.
Rosenberg IM. 1996. Protein analysis and Purification : Benchtop technique. Boston: Birkhauser.
Sanagi MS. 2001. Teknik Pemisahan dalam Analisis Kimia. Melaka (ID): Percetakan Surya.
Silva GH, Oliveira CM, Teles HL. Pauletti PM, Gamboa IC, Silva DHS, Bolzani VSB, Young MCM, Neto CMC, Pfenning LH, Berlinck RGS, Araujo AR. 2010. Sesquterpenes from Xylaria sp. An endophytic fungus associated with Piper aduncum (Piperaceae). Phytochemistry Letters. 3:164-167. doi:10.1016/j.phytol.2010.07.001.
Simanjuntak P. 2011. Indonesia Gudang Mikroba Antikanker dan Antidiabetes. [Internet]. [diunduh 2013 Jan 05] tersedia pada: http://www.bioteklipi.go.id/index.php/news/biotek/755indonesia-gudang-mikroba-antikanker-dan-antidiabetes-?PHPSESSID= 275d90261df7e8 2c864cb9992fb7a347.
Sivasankar A. 2005. Biotechnology and Fermentation Process. Mumbai (IN): Rachana Enterprises.
Shoeb M. 2006. Anticancer agents from medical plants. J Pharmacol. 1:35-41. doi: 10.3329/bjp.v1i2.486.
Song YX, Wang J, Huang H, Ma L, Wang J, Gu Y, Liu L, Lin YC. 2012. Four eremophilane sesquietrpenes from the mangrove endophytic fungus
Xylaria sp. BL321. Mar Drugs. 10:340-348. doi: 10.3390/md10020340. Strobel GA, Daisy B. 2003. Bioprospecting for microbial endophytes and their
natural products. Microbiol Mol Biol Rev. 67(4):491–502. doi:10.1128/MMBR.67.4.491-502.2003.
Sukandar, Radiastuti N, Jayanegara I, Hudaya A. 2010. Karakterisasi senyawa aktif antibakteri ekstrak air bunga kecombrang (Etlingera elatior) sebagai bahan pangan fungsional. Valensi. 2(1):333-339.
Tan RX, Zou WX. 2001. Endophytes: A rich source of functional metabolites. Natural Product Report. 18:448-459.
Taneja A, RajaramS, Agarwal S, Singh KC, Goei N. 2005. Quick cycle neoadjuvant chemotheraphy in aquamous cell carcinoma of cervix. Indian J Pharmacol. 37: 320-324.
Tarman K. 2011. Biological and chemical investigations of Indonesian marine-derived fungi and their secondary metabolites [disertasi]. Greifswald: Universität Greifswald.
Tarman K, Lindequist , Wende K, Porzel A, Arnold, Ludger A. 2011. Isolation of a new natural product and cytotoxic and antimicrobial activities of
Paulus BP, Gadek P. 2006. Successional pattern of microfungi in fallen leaves of
Ficus pleurocarpa (Moraceae) in an Australian tropical rain forest.
Biotropica. 38(1):42-51. doi: 10.1111/j.1744-7429.2006.00110.x.
Pongcharoen W, Rukachaisirikul V, Phongpainchit S, Kuhn T, Pelzing M, Sakayaroj J, Taylor WC. 2008. Metabolites from the endophytic fungus
Xylaria sp. PSU-D14. Phytochemistry. 69:1900-1902. doi: 10.1016/j.phytochem.2008.04.003.
Prayitno A. 2005. Ekspresi Protein p53, Rb, danc-myc pada Kanker Serviks Uteri dengan Pengecatan Immuno histokimia. Biodiversitas. 6(3):157-159. Wang H dan Ng TB. 2001. Pleureryn, a novel protease from fresh fruiting bodies
of the edible mushroom Pleurotus eryngii. Biochemical and Biophysical Research Communications. 289(3):750–755.
Wattanapitayakul SK, Chularojmontri L, Herunsalee A, Charuchongkolwongse S, Niumsakul S, Bauer JA. 2005. Screening of antioxidants from medicinal plants for cardioprotective effect against doxorubicin toxicity. Basic Clin. Pharmacol. Toxicol. 96:80-87.
Widyarti S. 2006. Prinsip-Prinsip Dasar Analisis Biologi Molekuler. Laboratorium Biologi Molekuler. Malang (ID): Universitas Brawijaya Pr. hlm 34-36.
Widyastuti S. 2008. Uji toksisitas ekstrak daun iprih (Ficus glabella Blume) terhadap Artemia salina Leach dan profil kromatografi lapis tipis. Jurusan Farmasi Universitas Muhamadiyah Surakarta.