SINTESIS GLISERIL 9,10-DIHIDROKSI STEARAT DARI MONO
GLISERIDA OLEAT CAMPURAN YANG DIPEROLEH
MELALUI REAKSI ESTERIFIKASI DENGAN
MENGGUNAKAN KATALIS NaOH
SKRIPSI
DEWI PRATIWI
070802036
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
SINTESIS GLISERIL 9,10-DIHIDROKSI STEARAT DARI MONO
GLISERIDA OLEAT CAMPURAN YANG DIPEROLEH
MELALUI REAKSI ESTERIFIKASI DENGAN
MENGGUNAKAN KATALIS NaOH
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DEWI PRATIWI
070802036
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : SINTESIS GLISERIL 9,10-DIHIDROKSI STEARAT DARI MONOGLISERIDA OLEAT CAMPURAN YANG DIPEROLEH MELALUI REAKSI
ESTERIFIKASI DENGAN MENGGUNAKAN KATALIS NaOH
Kategori : SKRIPSI
Nama : DEWI PRATIWI
No Induk Mahasiswa : 070802036
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Januari 2013
Komisi Pembimbing :
Pembimbing II, Pembimbing I,
Drs. Darwis Surbakti, MS
NIP. 195307071983031001 NIP. 195307041980031002 Dr. Adil Ginting, M.Sc
Diketahui/Disetujui oleh
Departemen Kimia F.MIPA USU Ketua,
PERNYATAAN
SINTESIS GLISERIL 9,10-DIHIDROKSI STEARAT DARI
MONOGLISERIDA OLEAT CAMPURAN YANG DIPEROLEH MELALUI REAKSI ESTERIFIKASI DENGAN MENGGUNAKAN KATALIS NaOH
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2013
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus, atas berkat dan penyertaanNya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini sesuai dengan rencana dan kehendakNya. Banyak hal sebagai pembelajaran dan pembentukan diri yang penulis rasakan setiap waktu, sehingga semakin melihat dan merasakan kebaikan dan kebesaranNya.
Dengan rasa hormat penulis mengucapkan terimakasih kepada bapak Dr. Adil Ginting, M.Sc selaku pembimbing I serta bapak Drs. Darwis Surbakti, MS selaku pembimbing II yang telah memberikan arahan serta dukungan selama melakukan penelitian dan penyusunan skripsi ini. Terimakasih kepada ibu Dr. Rumondang Bulan, MS dan bapak Drs. Albert Pasaribu, M.Sc selaku ketua dan sekretaris Departemen Kimia FMIPA-USU Medan. Kepada seluruh staf ahli Laboratorium Kimia Organik/Proses Kimia F.MIPA USU, bapak Prof. Dr. Jamaran Kaban, M.Sc , bapak Dr. Mimpin Ginting, MS , ibu Dra. Herlince Sihotang, M.Si , ibu Dr. Juliati Tarigan, M.Si , ibu Dr. Cut Fatimah Zuhra, M.Si dan ibu Helmina Sembiring M.Si yang telah banyak membantu dan memberikan arahan selama melakukan penelitian, serta kepada seluruh staf dan dosen FMIPA-USU yang telah membimbing penulis dalam menyelesaikan perkuliahan. Penulis juga mengucapkan terimakasih yang tak terhingga kepada ayahanda dan ibunda tercinta, Drs. Lasman Purba dan Erli Kristina br Ginting yang selalu memberikan dukungan doa, kasih sayang dan materil, kepada adik tersayang Theo Sam Joseph Purba dan kepada yang terkasih Roy Marananndo atas dukungan dan perhatiannya. Tidak lupa juga penulis ucapkan terimakasih untuk para sahabat, Silorida br Tarigan, Stephanus Pasaribu, Ira Flora Purba, Bahtiar Lubis, Cristy Halomoan, Nova Maria, William Singarimbun, Pahala Simbolon, Sarwedi Situngkir dan Best Avesta yang selalu memberikan bantuan dan semangat, juga kepada seluruh asisten Laboratorium Kimia Organik : Samuel, Deny, Sion, Mutiara, Bayu, Egi, Rimenda, Despita, Naomi, Sophia, Dian dan Yabes, serta kepada seluruh teman seangkatan 2007 dan adik-adik stambuk 2008, 2009 dan 2010 yang tidak dapat penulis sebutkan namanya satu per satu. Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan karena keterbatasan penulis. Semoga skripsi ini dapat bermanfaat bagi penelitian dan kemajuan Ilmu Pengetahuan Alam demi pengembangan Bangsa dan Negara.
Medan, Januari 2013 Penulis
ABSTRAK
Senyawa polihidroksi dari turunan asam lemak telah banyak dimanfaatkan sebagai
bahan surfaktan untuk formulasi dalam makanan, kosmetik maupun obat-obatan.
Dalam penelitian ini, dilakukan sintesis gliseril 9,10-dihidroksi stearat dari epoksidasi,
diikuti hidolisis monogliserida campuran dengan katalis NaOH. Esterifikasi asam
oleat dengan gliserol menggunakan katalis NaOH yang berlangsung dalam suasana
nitrogen pada temperatur 200°C menghasilkan campuran monogliserida dan
digliserida yang telah dianalisis dengan kromatografi gas. Epoksidasi terhadap hasil
esterifikasi menggunakan asam performat yang direfluks pada suhu 40-45°C selama 2
jam dilanjutkan dengan hidrolisis menghasilkan senyawa gliseril 9,10-dihidroksi
stearat. Konformasi struktur senyawa gliseril 9,10- dihidroksi stearat yang diperoleh,
diuji melalui analisa spektroskopi FT-IR dan melalui metode titrasi dengan
menentukan harga bilangan asam dan bilangan penyabunan diperoleh harga HLB
ABSTRACT
Polyhydroxy compounds of fatty acid derivatives have been widely used as surfactants
for the formulation ingredients in foods, cosmetics and medicines. In this study,
carried out the synthesis of glyceryl mono stearate 9.10 dihydroxy epoxidation
followed by a mixture of monoglycerides with NaOH as a catalyst. Esterification of
oleic acid using NaOH catalyst that took place in an atmosphere of nitrogen at a
temperature of 200 ° C produces gliserolat consisting of a mixture of monoglycerides,
diglycerides and esters which have been analyzed completely by gas chromatography.
Epoxidation use performat the refluxed acid at a temperature of 40-45 ° C for 2 h
followed by hydrolysis produces polyol compounds from a mixture of
monoglycerides. Conformational structure of the polyol is derived from the reaction
products were tested by analysis of FT-IR spectroscopy and by titration method to
determine the cost of acid number and saponification numbers obtained HLB price of
DAFTAR ISI
1.2. Permasalahan 3
1.3. Pembatasan Masalah 3
1.4. Tujuan Penelitian 3
1.5. Manfaat Penelitian 3
1.6. Lokasi Penelitian 4
1.7. Metodologi Penelitian 4
BAB 2. TINJAUAN PUSTAKA
2.1. Oleokimia 5
2.2. Asam Lemak 6
2.2.1 Asam Oleat 8
2.3. Esterifikasi 10
2.3.1Ester Asam Lemak 12
2.4. Gliserol 14
2.5. Monogliserida dan Digliserida 15
2.6. Epoksida 17
2.7. Poliol 19
2.8. Katalis 20
2.9. Emulsifier 21
2.10. Kromatograsi Gas 22
2.11. Spektroskopi Inframerah 24
BAB 3. METODE PENELITIAN
3.1. Alat 26
3.2. Bahan 27
3.3. Prosedur Penelitian 28
3.3.1.1 Pembuatan Larutan KOH-Alkohol 0,5N 28
3.3.1.2 Pembuatan Larutan KOH 0,5N 28
3.3.1.3 Pembuatan Larutan HCl 0,1N 28
3.3.1.4 Pembuatan Larutan H2C2O4
3.3.1.5 Pembuatan Larutan Indikator Fenolptalein 1% 28
0,1N 28
3.3.1.6 Pembuatan Alkohol Netral 29
3.3.1.7 Pembuatan Larutan KI 10% 29
3.3.1.8 Pembuatan Larutan Na2S2O3
3.3.1.9 Pembuatan Larutan KOH 0,1N 29
0,1N 29
3.3.1.4 Pembuatan Larutan Asam Sitrat 10% 29 3.3.2. Pembuatan Monogliserida oleat campuran 30 3.3.3. Pembuatan Gliseril 9,10 dihidroksi stearat 30
3.3.4. Prosedur Analisis 31
3.3.4.1 Analisis Bilangan Penyabunan 31
3.3.4.2 Analisis Bilangan Asam 31
3.3.4.3 Penentuan Harga HLB 32
3.3.4.4 Analisis Bilangan Iodin 32
3.4. Bagan Penelitian 33
3.4.1. Pembuatan Monogliserida oleat campuran 33 3.4.2. Pembuatan Gliseril 9,10 dihidroksi stearat 34
BAB 4. HASIL DAN PEMBAHASAN
4.1. Hasil 35
4.1.1. Pembuatan Monogliserida oleat campuran 35 4.1.2. Pembuatan Gliseril 9,10 dihidroksi stearat 37
4.2. Pembahasan 38
4.2.1. Pembuatan Monogliserida oleat campuran 38 4.2.2. Pembuatan Gliseril 9,10 dihidroksi stearat 40
BAB 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan 42
5.2. Saran 42
DAFTAR PUSTAKA 43
DAFTAR TABEL
Halaman
Tabel 2.1. Diagram alur oleokimia 6
Tabel 2.2. Kondisi optimum katalis dalam proses esterifikasi kimia 11
Tabel 2.3. Nilai HLB dan aplikasinya 22
Tabel 4.1. Persen komposisi hasil reaksi esterifikasiasam oleat dengan 37
DAFTAR GAMBAR
Halaman
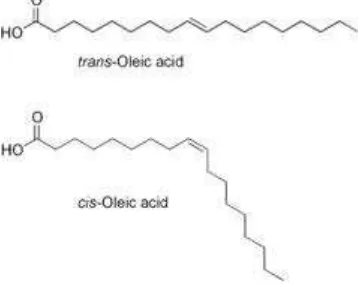
Gambar 2.1 Struktur trans dan cis asam oleat 8
Gambar 2.2 Struktur gliserol 14
Gambar 2.3 Struktur ά dan β monogliserida 15
Gambar 2.4 Reaksi epoksidasi terhadap gugus olein pada senyawa alkena 19
Gambar 4.1. Kromatogram hasil esterifikasi asam oleat dengan katalis 36
NaOH
Gambar 4.2. Spektrum FT-IR hasil esterifikasi asam oleat dengan katalis 36
NaOH
Gambar 4.3. Spektrum FT-IR senyawa gliseril 9,10 dihidroksi stearat 38
Gambar 4.4. Reaksi esterifikasi asam oleat menggunakan katalis NaOH 40
DAFTAR LAMPIRAN
Halaman
Lampiran A. Standar Kromatografi Total 49
Lampiran B. Kromatogram hasil esterifikasi asam oleat
menggunakan katalis NaOH 50
Lampiran C. Spektrum FT-IR Asam Oleat 51
Lampiran D. Spektrum FT-IR hasil esterifikasi asam oleat
menggunakan Katalis NaOH 52
Lampiran F. Spektrum FT-IR hasil epoksidasi dan hidrolisis
monogliserida campuran 53
Lampiran F. Data penentuan bilangan iodin 54
ABSTRAK
Senyawa polihidroksi dari turunan asam lemak telah banyak dimanfaatkan sebagai
bahan surfaktan untuk formulasi dalam makanan, kosmetik maupun obat-obatan.
Dalam penelitian ini, dilakukan sintesis gliseril 9,10-dihidroksi stearat dari epoksidasi,
diikuti hidolisis monogliserida campuran dengan katalis NaOH. Esterifikasi asam
oleat dengan gliserol menggunakan katalis NaOH yang berlangsung dalam suasana
nitrogen pada temperatur 200°C menghasilkan campuran monogliserida dan
digliserida yang telah dianalisis dengan kromatografi gas. Epoksidasi terhadap hasil
esterifikasi menggunakan asam performat yang direfluks pada suhu 40-45°C selama 2
jam dilanjutkan dengan hidrolisis menghasilkan senyawa gliseril 9,10-dihidroksi
stearat. Konformasi struktur senyawa gliseril 9,10- dihidroksi stearat yang diperoleh,
diuji melalui analisa spektroskopi FT-IR dan melalui metode titrasi dengan
menentukan harga bilangan asam dan bilangan penyabunan diperoleh harga HLB
ABSTRACT
Polyhydroxy compounds of fatty acid derivatives have been widely used as surfactants
for the formulation ingredients in foods, cosmetics and medicines. In this study,
carried out the synthesis of glyceryl mono stearate 9.10 dihydroxy epoxidation
followed by a mixture of monoglycerides with NaOH as a catalyst. Esterification of
oleic acid using NaOH catalyst that took place in an atmosphere of nitrogen at a
temperature of 200 ° C produces gliserolat consisting of a mixture of monoglycerides,
diglycerides and esters which have been analyzed completely by gas chromatography.
Epoxidation use performat the refluxed acid at a temperature of 40-45 ° C for 2 h
followed by hydrolysis produces polyol compounds from a mixture of
monoglycerides. Conformational structure of the polyol is derived from the reaction
products were tested by analysis of FT-IR spectroscopy and by titration method to
determine the cost of acid number and saponification numbers obtained HLB price of
BAB I
PENDAHULUAN
1.1 Latar Belakang
Monogliserida dan digliserida mempunyai sifat hidrofilik karena gugus hidroksil
bebas yang dimilikinya dan bersifat hidrofobik karena adanya residu asam lemak.
Monogliserida dan digliserida larut parsial dalam air dan dalam lemak, sehingga
monogliserida dan digliserida merupakan zat pengemulsi yang baik. Monogliserida
dan digliserida biasanya ditambahkan sebagai shorterning dan pengelmulsi dalam
beberapa produk makanan (Potter, 1986).
Untuk memperoleh senyawa monogliserida telah dilakukan melalui reaksi
gliserolisis terhadap lemak maupun metil ester asam lemak, baik secara kimiawi
maupun secara enzimatis. Suarti (2008) telah membuat senyawa monogliserida
melalui reaksi gliserolisis campuran minyak inti sawit dan stearin untuk pembuatan
shortening dengan menggunakan katalis natrium metoksida.
Noureddini (2004) mengatakan bahwa monogliserida dan digliserida dapat
dibuat dari semua senyawa gliserida baik yang berasal dari lemak maupun minyak.
Senyawa gliserida tersebut direaksikan dengan gliserol dan menggunakan katalis
natrium / kalium gliserolat yang dibuat dari NaOH / KOH dan gliserol. Reaksi
dilakukan pada suhu 220-250oC dalam tekanan atmosfir.
Epoksidasi terhadap ikatan rangkap asam lemak tidak jenuh dari beberapa
minyak nabati telah dilakukan dan juga telah diterapkan dalam skala industri. Saat ini
minyak nabati yang memiliki kandungan asam lemak tidak jenuh tinggi (Goud,et al,
2006).
Salah satu produk epoksida yang dapat dihasilkan menggunakan minyak
nabati sebagai bahan bakunya adalah senyawa polihidroksi trigliserida. Polihidroksi
trigliserida merupakan senyawa turunan dari minyak atau lemak yang memiliki gugus
hidroksil lebih dari dua. Senyawa polihidroksi trigliserida ini banyak digunakan
sebagai bahan pembuatan poliuretan, bahan aditif untuk plastik, pelumas, surfaktan
dan lain-lain sehingga kebutuhan akan senyawa ini menjadi sangat tinggi.
Senyawa polihidroksi trigliserida ini dihasilkan melalui reaksi hidroksilasi.
Reaksi hidroksilasi meliputi dua tahap reaksi, yaitu reaksi epoksidasi pembentukan
cincin epoksida (oksiran) dan diikuti reaksi pembentukan cincin oksiran. Senyawa
trigliserida tidak jenuh yang terkandung dalam minyak nabati ini diepoksidasi
menggunakan asam peroksi, yang terbuat dari asam karboksilat dan hidrogen
peroksida (Gan, 1992).
Adanya ikatan π pada senyawa organik seperti halnya asam lemak tidak jenuh
melalui reaksi epoksidasi dilanjutkan dengan hidrolisis akan menghasilkan senyawa
poliol (Fessenden,,R.J,1994).
Ikatan π pada metil resinoleat dari minyak jarak juga telah berhasil
diepoksidasi dan dilanjutkan dengan alkoksilasi untuk menghasilkan senyawa metil
[9-(2,3-dihidroksipropoksi)-10,12-dihidroksioktadekanoat] (Ocha,2009).
Berdasarkan uraian di atas, maka peneliti tertarik untuk menghasilkan poliol
gliseril 9,10 dihidroksi stearat campuran yang berasal dari monogliserida campuran
yang diperoleh dari reaksi esterifikasi antara gliserol dengan asam oleat menggunakan
katalis NaOH. Dimana gliseril 9,10-dihidroksi stearat campuran yang dihasilkan
1.2 Permasalahan
1. Apakah senyawa gliseril 9,10-dihidroksi stearat campuran dapat dihasilkan
melalui hidrolisis terhadap epoksida dari monogliserida oleat campuran.
2. Berapakah nilai HLB dari hasil yang diperoleh.
1.3 Pembatasan Masalah
Permasalahan dibatasi pada :
1. Monogliserida oleat campuran yang digunakan diperoleh melalui reaksi
esterifikasi antara asam oleat dengan gliserol menggunakan katalis NaOH.
2. Epoksidasi terhadap monogliserida campuran dilakukan dengan menggunakan
asam performat dan katalis H2SO4
3. Analisis hasil dilakukan dengan menggunakan GC, IR, Bilangan Iodin dan
HLB
(p).
4. Penentuan harga HLB dilakukan dengan metode titrasi dengan menentukan
harga bilangan asam dan bilangan penyabunan.
5. Penentuan harga bilangan iodin dilakukan dengan metode Wijs.
1.4 Tujuan Penelitian
1. Untuk menghasilkan senyawa gliseril 9,10-dihidroksi stearat campuran melalui
hidrolisis senyawa epoksida dari monogliserida oleat campuran.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat digunakan sebagai sumber informasi salah satu
pemanfaatan asam oleat bagi industri oleokimia dalam menghasilkan gliseril
9,10-dihidroksi stearat sebagai bahan untuk surfaktan.
1.6 Lokasi Penelitian
Penelitian dilakukan di Laboratorium Kimia Organik F.MIPA-USU Medan, analisa
kandungan gliserida dengan kromatografi gas dilakukan di Pusat Penelitian Kelapa
Sawit (PPKS), analisa FT-IR dilakukan di Laboratorium Bea Cukai Belawan dan
analisa bilangan iodin dilakukan di salah satu laboratorium kimia Perusahaan Swasta
di Medan.
1.7 Metodologi Penelitian
Penelitian ini merupakan eksperimen laboratorium, dimana bahan-bahan yang
digunakan dalam penelitian ini merupakan produk-produk dari E’Merck, seperti :
asam oleat, NaOH pellet, dietil eter, asam formiat, n-heksan, dan asam sulfat. Gliserol
yang digunakan diperoleh dari PT SOCI, pabrik pengolahan minyak nabati. Pada
penelitian dilakukan sintesis gliseril 9,10-dihidroksi stearat dari hidolisis epoksida
monogliserida oleat campuran. Epoksida monogliserida oleat campuran diperoleh
melalui reaksi esterifikasi antara asam oleat dengan gliserol menggunakan katalis
NaOH yang dilanjutkan epoksidasi dengan asam performat dan katalis H2SO4 (p) pada kondisi refluks 40-45°C selama 2 jam. Hasil yang diperoleh ditentukan harga
HLB, bilangan iodin dan selanjutnya konformasi struktur diuji melalui analisa
BAB II
TINJAUAN PUSTAKA
2.1 Oleokimia
Oleokimia merupakan bagian dari ilmu kimia yang mempelajari tentang proses
pengolahan asam lemak dan gliserol serta derivatnya, baik yang dihasilkan dari
minyak atau lemak maupun hasil sintesis dari produksi etilena dan propilena secara
industri petrokimia.
Oleokimia mencakup pengertian sebagai proses pembuatan asam lemak dan
turunannya serta proses pengolahannya dari berbagai reaksi sintesis kimia, sehingga
menghasilkan produk yang dapat digunakan untuk kebutuhan manusia (Richtler, et al
, 1984).
Oleokimia alami merupakan senyawa kimia yang berasal dari minyak dan
lemak tumbuh-tumbuhan yang diperoleh dengan cara saponifikasi diikuti hidrolisis
sehingga menghasilkan asam lemakbebas dan gliserol. Dari asam lemak ini, dapat
dibuat turunan asam lemak seperti alkohol asam lemak, amina asam lemak dan
lain-lain. Sedangkan oleokimia sintesis berasal dari petrokimia, misalnya pembuatan
alkohol asam lemak dari etilena serta gliserol dari propilena (Austin, 1985).
Bahan oleokimia yang dihasilkan dari produk petrokimia yang diolah dari
hasil minyak bumi dan gas alam merupakan bahan yang tidak dapat diperbaharui,
sehingga diperkirakan tidak dapat bersaing dengan bahan yang berasal dari hasil
pertanian yang dapat diperbaharui. Hingga saat ini, umumnya sebagian produk
oleokimia digunakan sebagai surfaktan pada produk-produk kosmetika, obat-obatan,
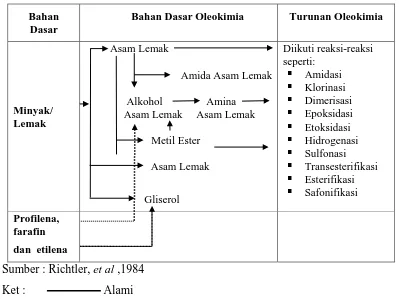
Diagram alir dari oleokimia dapat dilihat pada tabel di bawah ini.
Tabel 2.1 Diagram alur Oleokimia
Bahan Dasar
Bahan Dasar Oleokimia Turunan Oleokimia
Minyak/
Asam lemak adalah asam organik yang terdapat sebagai ester trigliserida
atau lemak, baik berasal dari hewan maupun tumbuhan. Asam ini adalah asam
karboksilat yang mempunyai rantai karbon panjang, dengan rumus umum :
O
R – C – OH
dimana R adalah rantai rantai karbon yang jenuh atau yang tidak jenuh, dan terdiri atas
4 sampai 24 buah atom karbon. Rantai karbon yang jenuh ialah rantai karbon yang
tidak mengandung ikatan rangkap, sedangkan yang mengandung ikatan rangkap
leburnya. Apabila dibandingkan dengan asam lemak jenuh, asam lemak tidak jenuh
mempunyai titik lebur lebih rendah. Asam oleat mempunyai rantai karbon yang sama
panjang dengan asam stearat, akan tetapi suhu kamar asam oleat berupa zat cair. Di
samping itu, makin banyak jumlah ikatan rangkap, makin rendah titik leburnya. Hal
ini tampak pada titik lebur asam linoleat yang lebih rendah dari titik lebur asam oleat
(Poedjiadi, 2006).
Asam lemak dapat dibedakan menjadi asam lemak jenuh dan asam lemak tak
jenuh. Asam lemak jenuh hanya mempunyai ikatan tunggal di antara atom-atom
karbon penyusunnya, sementara asam lemak tak jenuh memiliki paling sedikit satu
ikatan rangkap di antara satu atom-atom penyusunnya (Tambun, 2006).
Asam-asam lemak tidak jenuh berbeda dalam jumlah dan posisi ikatan
rangkapnya dan berbeda dengan asam lemak jenuh dalam bentuk molekul
keseluruhannya. Asam lemak tidak jenuh biasanya terdapat dalam bentuk cis,
walaupun sebagian kecil dalam bentuk trans. Asam lemak bentuk cis mempunyai titik
cair yang lebih rendah dibandingkan dengan bentuk trans dengan panjang rantai yang
sama. Panjang rantai karbon juga mempengaruhi titik cair. Pada asam lemak jenuh,
titik cair akan semakin meningkat dengan semakin panjangnya rantai karbon. Pada
asam lemak tidak jenuh, titik cair akan semakin menurun dengan bertambahnya
iakatan rangkap, sehingga asam lemak jenuh mempunyai titik cair yang lebih tinggi
dibandingkan dengan asam lemak tidak jenuh dengan jumlah atom karbon yang sama.
Posisi asam lemak pada molekul trigliserida juga mempengaruhi titik cair minyak dan
lemak. Posisi asam lemak yang simetris dalam molekul trigliserida mempunyai titik
cair yang lebih tinggi dibandingkan dengan posisi yang tidak simetris (Seager dan
Slabough, 1994).
Asam lemak dengan jumlah atom C lebih dari 12 tidak larut dalam air dingin
maupun air panas, tetapi dengan jumlah rantai atom karbon yang pendek bersifat larut
dalam air. Demikian juga sifat kelarutan garam dari asam lemak yang mempunyai
berat molekul rendah dan tak jenuh lebih mudah larut dalam alkohol dari pada garam
Sifat fisik dan fisiologi asam lemak ditentukan oleh panjang rantai dan
derajat ketidakjenuhan. Semakin panjang rantai atom karbon, maka titik cair asam
lemak semakin tinggi. Semakin tinggi derajat ketidakjenuhan asam lemak, maka titik
cairnya semakin rendah , serta asam lemak yang berstruktur trans mempunyai titik cair
yang lebih tinggi daripada yang berstruktur cis (Ketaren, 2006).
Keberadaan ikatan rangkap pada asam lemak tak jenuh menjadikannya
memiliki dua bentuk, yaitu cis dan trans. Semua asam lemak nabati alami hanya
memiliki bentuk cis. Asam lemak trans hanya diproduksi oleh sisa metabolisme
hewan atau dibuat secara sintetis. Akibat polarisasi atom H, asam lemak cis memiliki
rantai yang melengkung. Asam lemak trans karena atom H-nya berseberangan, tidak
mengalami efek polarisasi yang kuat dan rantainya tetap relatif lurus (Tambun, 2006).
2.2.1 Asam Oleat
Asam oleat atau asam heptadekana-8,1-karboksilat merupakan penyusun dari
lemak-lemak tanaman atau hewan. Asam oleat dapat dipisahkan dari zat tersebut dengan cara
hidrolisis. Sebagian asam oleat berada bersama-sama dengan asam stearat dan asam
palmitat. Sruktur asam oleat adalah CH3(CH2)7CH=CH(CH2)7COOH. Asam oleat membentuk cis karena mempunyai titik lebur yang rendah dan mempunyai panas
pembakaran yang lebih tinggi (Sastrohamidjojo, 2005).
Asam oleat dapat dihasilkan dari fraksinasi asam lemak yang diperoleh dari
proses pengubahan minyak menjadi asam lemak. Dalam hal ini proses yang digunakan
adalah proses hidrolisa. Asam Oleat dapat juga dihasilkan dari fraksinasi asam lemak
yang diperoleh dari hidrolisis lemak. Dalam industri asam oleat banyak digunakan
sebagai surface active, emulsifier, dan dalam produk-produk kosmetika.
Sifat-sifat fisika dan kimia asam oleat adalah sebagai berikut :
a. Sifat Kimia :
larut dalam pelarut organik seperti alkohol
bersifat hidrolisis
tidak stabil pada suhu kamar
Asam lemak bebas 2,5-2,4 %
b. Sifat Fisika :
berat molekul : 280,45 (kg/mol)
titik leleh : 16,3 0C
titik didih : 285 0C
indeks bias : 1,4565
spesifik gravity : 0,917-0,919 (25 0C)
densitas : 0,8910 gr/ml
tidak larut dalam air
mudah terhidrogenasi
merupakan asam lemak tak jenuh
Asam oleat, asam linoleat dan linolenat biasanya terdapat bersama dengan
asam lemak lain seperti asam laurat, asam miristat, asam palmitat, asam stearat dan
asam lemak lainnya. Asam lemak tidak jenuh tersebut dapat diubah ke berbagai
bentuk turunannya antara lain dalam pembentukan ester asam lemak dengan poliol
seperti sorbitol, manitol dan sebagainya untuk membentuk surfaktan. Ester asam
lemak dengan poliol tersebut memiliki sifat surfaktan karena disamping memiliki
gugus ester juga masih memiliki gugus hidroksil sehingga terjadi keseimbangan antara
Penelitian tentang asam oleat telah banyak dikembangkan, misalnya dalam
pembuatan bahan bakar alternatif (biodiesel). Asam oleat dikonversi menjadi produk
biodiesel di unit reaksi penambahan alkohol dan katalis, kemudian dimurnikan di unit
pemisahan (Kusmiyati, 2008).
2.3 Esterifikasi
Esterifikasi adalah suatu reaksi ionik yang merupakan gabungan dari reaksi adisi dan
reaksi penataan ulang eliminasi. Esterifikasi juga dapat didefenisikan sebagai reaksi
antara asam karboksilat dan alkohol. Esterifikasi dapat dilakukan dengan
menggunakan katalis enzim (lipase) dan asam anorganik (asam sulfat dan asam
klorida), dengan berbagai variasi alkohol biasanya methanol, etanol, propanol,
1-butanol, amyl alkohol dan lain-lain. Asam anorganik yang digunakan sebagai katalis
akan menyebabkan asam karboksilat mengalami konjugasi, sehingga asam konjugat
dari asam karboksilat tersebutlah yang aan berperan sebagai substrat (Ozgulsun,
2008).
Cara lain dalam pembuatan ester adalah dengan melewatkan HCl ke dalam
campuran reaksi tersebut dan direfluks. Cara ini dikenal dengan nama metode
Fischer-Speier. Esterifikasi tanpa katalis dapat juga dilakukan dengan satu molekul asam
karboksilat dan satu pereaksi secara berlebih. Pertambahan hasil juga dipengaruhi oleh
dehidrasi yang artinya menarik air yang terbentuk sebagai hasil samping reaksi. Air
dapat dipisahkan dengan cara menambahkan pelarut yang bersifat non polar seperti
misalnya benzene dan kloroform, sehingga air yang terbentuk akan segera terikat pada
pelarut yang digunakan atau dengan menambahkan molecular sieves (Yan, 2001).
Esterifikasi asam karboksilat dengan alkohol merupakan reaksi reversibel. Bila
asam karboksilat diesterkan, digunakan alkohol berlebih. Untuk membuat reaksi
kebalikannya, yakni hidrolisis berkataliskan asam dari ester menjadi asam karboksilat
digunakan air berlebihan. Kelebihan air ini akan menggeser kesetimbangan kea rah
Reaksi esterifikasi ini dapat terjadi secara acak ataupun terarah. Secara
umum reaksi esterifikasi dapat terjadi secara batch, semi continuously atau
continuously. Reaksi ini akan berjalan dengan empat tahapan, yaitu : perlakuan
minyak awal, penambahan katalis, terjadi reaksi dan deaktivasi enzim. Reaksi terjadi
acak mengikuti hukum kemungkinan hingga komposisi yang terbentuk seimbang.
Reaksi ini dapat terjadi pada suhu tinggi ataupun rendah. Secara komersial, reaksi ini
berlangsung pada suhu tinggi 249°C tanpa katalis, atau pada suhu rendah dengan
penambahan katalis metal alkali. Proses esterifikasi umumnya dipengaruhi beberapa
faktor, yaitu : suhu, lama pengadukan, jenis substrat, konsentrasi katalis dan
perbandingan metanol dan asam lemak (Hui,1996).
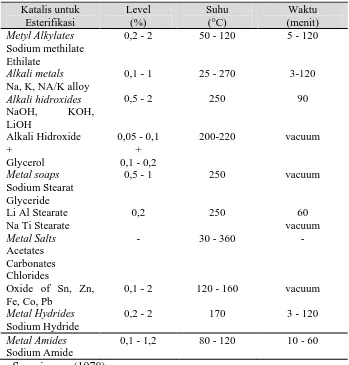
Tabel 2.2 Kondisi Optimum Katalis Dalam Proses Esterifikasi Kimia.
Katalis untuk
Penggunaan katalis dalam reaksi esterifikasi akan berpengaruh terhadap
peningkatan laju reaksi yang terjadi. Katalis yang digunakan dalam reaksi esterifikasi
dapat berupa katalis kimia maupun katalis enzimatis. Kedua jenis katalis ini memiliki
kelebihan dan kekurangan. Penggunaan katalis kimia saat ini lebih banyak digunakan
dikarenakan katalis kimia memiliki kelebihan antara lain mudah penanganannya,
harganya yang murah, mudah dipisahkan dan dapat digunakan dalam konsentrasi
relatif rendah. Walaupun begitu penggunaan katalis kimia memiliki beberapa
kekurangan, antara lain terjadinya variasi produk yang beragam karena gugus asil
terdistribusi dengan acak. Selain itu diketahui juga bahwa produk hasil sintesis secara
kimiawi memiliki rendemen yang rendah, warna yang gelap dan flavour yang kurang
baik (Bornscheuer, 1995).
2.3.1 Ester Asam Lemak
Ester asam lemak di alam terdapat dalam bentuk ester antara gliserol dengan asam
lemak ataupun terkadang ada gugus hidroksilnya yang teresterkan tidak dengan asam
lemak tetapi denga phospat seperti pada phospolipida. Ester asam lemak sering
dimodifikasi baik untuk bahan makanan maupun untuk bahan oleokimia seperti
surfaktan, aditif, dan deterjen (Endo, et al, 1997). Ester asam lemak yang paling
sederhana adalah ester antara metanol dengan asam lemak yang dikenal luas sebagai
metil ester asam lemak pada industri oleokimia. Metil ester asam lemak ini dapat
dihasilkan melalui transesterifikasi secara metanolisis terhadap ester asam lemak
dengan gliserol (Manurung, 2008).
Ester asam lemak sering dimodifikasi, baik untuk bahan makanan maupun
untuk surfaktan, aditif dan detergen. Senyawa ester dapat dibentuk beberapa cara,
c. Alkoholisis
O O
R-C-OR’ + R”-OH R-C-OR” + R’-OH
d. Asidolisis
O O O O
R-C-OR’ + R”-C-OH R”-C-OR’ + R-C-OH
(Gandhi, 1997)
Ester merupakan turunan dari asam karboksiat, dimana dapat dibentuk melalui
reaksi langsung antara suatu asam karboksilat dengan alkohol, yang disebut dengan
reaksi esterifikasi (Shreve, 1956)
Yang dikelompokkan sebagai ester asam lemak meliputi :
a. Ester karboksilat tunggal dengan panjang rantai karbon mulai dari C6 sampai C20
b. Ester asam lemak yang hanya mengandung karbon, hidrogen dan oksigen. .
Ester asam lemak sering dimodifikasi untuk digunakan sebagai bahan
makanan, surfaktan, polimer, sintesis, zat aditif, bahan kosmetik dan kebutuhan lain.
Metil ester asam lemak yang merupakan bagian dari pada ester asam lemak mono
alkohol merupakan zat antara dalam industri oleokimia, di samping dapat digunakan
sebagai bahan bakar biodiesel (Ozgul, 1993).
Banyak senyawa ester yang terdapat di alam memiliki aroma, seperti metal
butanoat yang merupakan minyak dalam buah nanas dan isopentil asetat yang terdapat
dalam buah pisang. Senyawa ester sintetis dalam industri digunakan untuk berbagai
macam produk, seperti dialkil ftalat sebagai plastizer (menjadikan plastic rapuh),
2.4 Gliserol
Gliserol merupakan suatu trihidroksi alkohol yang terdiri atas 3 atom karbon. Jadi tiap
atom karbon mempunyai gugus-OH. Satu molekul gliserol dapat mengikat satu, dua,
tiga molekul asam lemak dalam bentuk ester, yang disebut monogliserida, digliserida
dan trigliserida.
Sifat fisik dari gliserol :
Merupakan cairan tidak berwarna
Tidak berbau
Cairan kental dengan rasa yang manis
Densitas 1,261
Gliserol dengan bentuk gunting Gliserol dengan bentuk sisir
Gambar 2.2 Struktur Gliserol
Gliserol merupakan senyawa yang telah banyak digunakan di berbagai
industri, baik industri pangan ataupun non pangan seperti industri kosmetik. Gliserol
saat ini sering digunakan sebagai pelarut, pemanis, sabun cair, bahkan sebagai bahan
tambahan industri bahan peledak. Gliserol juga dapat digunakan sebagai komponen
anti beku atau lazim disebut cryoprotectan dan sumber nutrisi pada kultur fermentasi
dalam produksi antibiotika (Lindsay, 1985). Pada industri oleokimia dapat
ditransformasi melalui interesterifikasi membentuk monogliserida dan digliserida
2.5 Monogliserida dan Digliserida
Sintesis monogliserida dan digliserida dapat dilakukan dengan beberapa metode,
diantaranya adalah esterifikasi langsung, reaksi gliserolisis dan dapat dilakukan secara
enzimatis.
Monogliserida adalah mono ester gliserol dengan asam lemak yang
merupakan gliserida sederhana, karena hanya satu gugus hidroksi pada gliserol yang
diganti oleh asam lemak. Berdasarkan posisi asam lemak yang diikatnya
monogliserida terdiri dari α-monogliserida dan β-monogliserida. Sedangkan berdasarkan asam lemak yang diikatnya monogliserida dapat terdiri dari beberapa
jenis misalnya gliseril monostearat, gliseril monooleat dan lain-lain. Monogliserida
mudah sekali berisomerisasi yaitu perubahan bentuk dari β-monogliserida menjadi α
-monogliserida. α-monogliserida mudah berubah menjadi β-monogliserida dalam
suasana asam, basa atau panas menjadi bentuk α-monogliserida yang lebih stabil (Martin, 1953).
Gambar 2.3 Struktur ά dan β Monogliserida.
Monogliserida sangat banyak ditemukan dalam ekstrak sel dan merupakan
monoester asam lemak dari gliserol. Monogliserida pertama kali disintesis pada tahun
1853 dan baru pada tahun 1960 monogliserida dibuat dalam skala industi melalui
reaksi gliserolisis trigliserida. Berdasarkan jenis substratnya, pembentukan
monogliserida dapat dilakukan dengan berbagai cara yaitu reaksi esterifikasi langsung
gliserol, melalui transesterifikasi metil ester asam lemak dengan gliserol, melalui
reaksi hidrolisis trigliserida atau lemak dan melalui reaksi kondensasi asam lemak
dengan gliserol atau dengan senyawa-senyawa turunannya (Awang, 2004).
Monogliserida merupakan komponen yang tersusun oleh satu rantai asam
lemak yang diesterifikasi ke rantai gliserol, sehingga monogliserida bagian gugus
hidroksil bebas, yang merupakan hidrofilik dan gugus ester asam lemak yang
merupakan gugus hidrofobik. Karena sifat afinitas gandanya atau sering disebut
amphifilik tersebut, monogliserida dapat digunakan sebagai emulsifier. Monogliserida
dengan satu gugus asam lemak dan dua gugus hidroksil bebas pada gliserol
membuatnya bersifat seperti lemak dan air (Potter, 1986). Monogliserida dapat
disentesis melalui beberapa metode yaitu hidrolisis selektif terhadap trigliserida,
esterifikasi asam lemak atau ester asam lemak dengan gliserol dan gliserol dengan
lemak /minyak (Bornscheuer, 1995).
Monogliserida dapat diperoleh secara alami dan sintesis. Secara alami
monogliserida hanya dalam jumlah kecil saja yaitu hasil hidrolisa lemak atau minyak
oleh enzim lipase selama penyimpanan.Dalam industri, monogliserida biasanya dibuat
dengan dua cara, yaitu dengan cara gliserolisis (reaksi antara gliserol dengan
lemak/minyak) dan reaksi esterifikasi langsung antara asam lemak dengan gliserol.
Esterifikasi langsung dapat menggunakan katalis, misalnya NaOH dan dapat juga
menggunakan protective group, misalnya asetonasi menggunakan aseton sebagai
protective group (Brahmana, 1989).
Digliserida atau diasilgliserida (DAG) adalah ester dari gliserol, dimana dua
gugus hidroksil gliserol teresterifikasi oleh asam lemak. Digliserida terdapat secara
alami pada beberapa minyak dan lemak dengan jumlah berkisar ± 5%.
Diasilgliserida telah luas digunakan sebagai pengemulsi pada pembuatan
makanan. Metode tradisional untuk memproduksi digliserida adalah melalui reaksi
interesterifikasi trigliserida dengan gliserol menggunakan katalis alkali seperti
natrium/kalium hidroksida, natrium metoksida atau kalium asetat. Diasilgliserida juga
(Flickinger dan Matuso, 2005). Sintesis 1,3-diasilgliserida dengan hasil cukup besar
menggunakan enzim lipase yang spesifik bekerja pada posisi 1 dan 3 gliserol telah
dapat dilakukan. Enzim lipase yang digunakan berasal dari Chromobacterium
viscosum, Rhizopus delemar dan Rhizomucor miehei dengan donor aslinya berasal
dari asam lemak bebas, alkil ester asam lemak dan vinil ester. Keseluruhan reaksi
dilakukan dalam pelarut n-heksan, dietil eter atau t-BuOMe (Maki, et al , 2002)
2.6 Epoksida
Epoksida ialah eter siklik dengan cincin beranggota tiga yang mengandung satu atom
oksigen (Hart,2003). Epoksida ini mudah terkena serangan nukleofilik karena
elektronegativitas oksigen yang menyebabkan terpolarisasinya ikatan C-O (Bresnick,
2002). Penamaan epoksida disebut dengan oksirana. Senyawa oksida pada sintesa
organik merupakan zat antara yang potensial dimanfaatkan untuk beragam bentuk
senyawa dengan berbagai keperluan sehingga penelitian tentang epoksidasi baik
kondisi reaksi, keberlanjutan hasil reaksi maupun manfaat hasil reaksi terus
dikembangkan (Wisewan, 1983).
Epoksidasi terhadap ikatan rangkap adalah salah satu modifikasi kimia
terhadap berbagai senyawa yang memiliki ikatan π. Berdasarkan pada kereaktifan
yang tinggi dari cincin oksiran epoksida dapat dipakai sebagai zat antara untuk
menghasilkan berbagai senyawa kimia, yakni alkohol, alkanol amin, senyawa
karbanil, ester, dan bahan polimer.
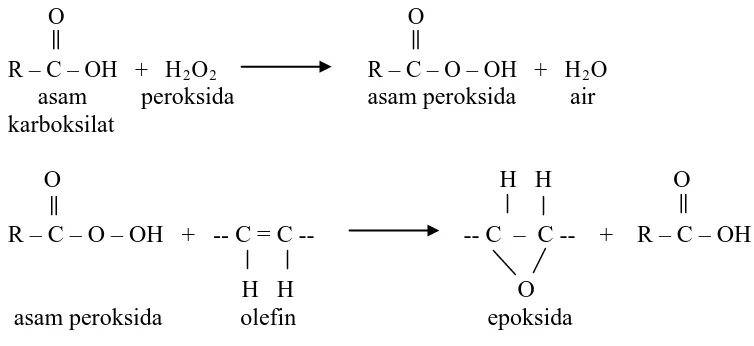
Senyawa epoksidasi mengandung gugus oksiran yang dibentuk melalui
reaksi epoksidasi antara asam peroksi dengan olefinat atau senyawa aromatik tidak
jenuh. Reaksi epoksidasi dapat dilakukan melalui dua cara yaitu pembentukan asam
peroksi yang selanjutya digunakan untuk reaksi epoksidasi dan reaksi epoksidasi
secara in-situ. Proses epoksidasi yang dilakukan secara in-situ lebih aman jika
dibandingkan dengan reaksi epoksidasi melalui pembentukan asam peroksi. Selain itu
juga pada reaksi epoksidasi dengan cara tersebut akan dihasilkan dua fase dalam
asam peroksi mengoksidasi ikatan rangkap, sehingga terjadi pemutusan ikatan
rangkap dan pembentukan gugus oksiran (Nasution, 2006).
Minyak nabati yang memiliki kandungan asam lemak tidak jenuh merupakan
sumber menarik untuk diperbaharui dalam menghasilkan produk baru yang berguna
tetapi kereaktifannya perlu ditingkatkan melalui penambahan gugus fungsi kedalam
molekul asam lemaknya, dengan demikian dengan berbagai reaksi kimia dan biokimia
telah dilakukan berbagai cara pengubahan menjadi produk yang lebih berharga.
Sejalan dengan reaksi tersebut, epoksida memegang peranan penting karena minyak
maupun ester asam lemak yang terepoksidasi dapat digunakan untuk membuat
senyawa-senyawa yang berbeda fungsinya dalam industri seperti plastizer, stabilizer,
resin, PVC, polyester, poliuretan, resin epoksi, dan pelapisan permukaan (Carlson dan
Chang, 1985).
Metode yang umum digunakan untuk mensintesis epoksida adalah reaksi
alkena dengan asam peroksida dan prosesnya dinamakan epoksidasi. Peroksida
merupakan sumber elektrofilik oksigen dan bereaksi dengan nukleofilik ikatan dari
alkena (Riswiyanto, 2002).
Ada empat teknik yang dapat digunakan untuk menghasilkan epoksida dari
molekul olefin, yaitu :
1. Epoksida dengan asam perkarboksilat yang sering digunakan dalam industri dan
dapat dipercepat dengan bantuan katalis atau enzim.
2. Epoksida dengan peroksida organik dan anorganik, termasuk epoksidasi alkali
dengan hidrogen peroksida nitril dan epoksida yang dikatalisis logam transisi.
3. Epoksida dengan halohidrin, menggunakan asam hipohalogen, dengan garamnya
sebagai reagen dan epoksida olefin dengan defisiensi elektron ikatan rangkap.
4. Epoksida dengan menggunakan molekul oksigen, untuk minyak nabati jarang
digunakan, karena dapat menyebabkan degradasi dari minyak menjadi senyawa
Epoksidasi dari minyak nabati merupakan hal yang penting dan sangat
berguna terutama dalam hal sebagai stabilisator dan plastisasi bahan polimer.
Berdasarkan pada kereaktifan yang tinggi dari cincin oksiran, epoksida juga dapat
dipakai untuk berbagai jenis bahan kimia yaitu alkohol, glikol, alkanolamin, senyawa
karbonil, senyawa olefin, dan polimer seperti poliester, poliuretan (Goud, et al, 2006)
Adapun reaksinya adalah sebagai berikut :
O O
Gambar 2.4 Reaksi Epoksidasi Terhadap Gugus Olefin Pada Senyawa Alkena
2.7 Poliol
Poliol merupakan senyawa organik yang memiliki gugus hidroksil lebih dari satu.
Dalam industri material sangat luas digunakan baik sebagai bahan pereaksi maupun
aditif. Senyawa poliol dapat diperoleh langsung di alam, seperti amilum, selulosa,
sukrosa dan lignin.
Gugus hidroksi pada senyawa organik dapat meningkatkan sifat hidrofil
karena disamping gugus fungsi yang aktif bereaksi dengan berbagai pereaksi untuk
menghasilkan senyawa baru, juga dapat berinteraksi baik melalui dipol-dipol yang
terbentuk maupun melalui ikatan hidrogen dengan gugus hidrofil dari senyawa lain.
hidroksil yang terikat baik sebagai ester, eter dapat mengubah senyawa tersebut
menjadi lipofil. Adanya sifat hidrofil dan lipofil menyebabkan senyawa poliol banyak
digunakan sebagai surfaktan dalam makanan, kosmetik maupun keperluan farmasi,
seperti obat-obatan (Jung, et al, 1998).
Beberapa minyak nabati diupayakan dalam pembuatan poliol dengan
memanfaatkan asam lemak tidak jenuh terutama oleat, linoleat maupun linolenat.
Seperti halnya pembuatan poliol dari minyak kacang kedelai melalui proses ozonolisis
katalitik dan dihasilkan komposisi gliserida yang baru, yang mana komponen
utamanya adalah rantai 2-hidroksi nonanoat dari gugus hidroksil yang baru. Senyawa
yang terbentuk berupa campuran mono, di dan trigliserida yang memiliki gugus
hidroksi.
Kebutuhan poliol yang cukup meningkat dikembangkan dalam industri
oleokimia. Pada awalnya telah dimanfaatkan risinoleat dari minyak jarak sebagai
sumber poliol dalam bentuk trigliserida yang komposisi utamanya adalah gliserol
tririsinoleat. Bahan poliol dari sumber minyak nabati dikembangkan melalui
transformasi ikatan π pada asam lemak tidak jenuh, baik sebagai trigliserida maupun
bentuk asam lemak dan juga alkil asam lemak, melalui proses kimia seperti ozonolisis,
epoksidasi, hidroformulasi dan metathesis (Goud, et al, 2002).
2.8 Katalis
Katalis adalah suatu zat yang mengakibatkan reaksi lebih cepat mencapai
kesetimbangan. Katalis berpengaruh untuk mengubah kecepatan konversi
(pengubahan) substrat menjadi produk dalam suatu reaksi. Katalis tidak akan
mengubah nilai ketetapan kesetimbangan, dan tidak mengalami perubahan apapun.
Menurut teori kecepatan reaksi absolute, peranan katalis adalah menurunkan energi
aktivasi (Cotton dan Wilkinson, 1989)
Berdasarkan sifat campuran reaksi maka katalis dapat dibagi menjadi 2 jenis,
pada fasa yang sama disebut katalis homogen, dan bila katalis berada pada fasa yang
berbeda dari reaktannya dikatakan sebagai katalis heterogen.
Pada pembuatan monogliserida secara gliserolisis, jumlah gliserol yang
dicampurkan pada minyak berkisar 25-40% dan ditambah katalis sebesar 0,05-0,2%.
Katalis yang banyak digunakan adalah NaOH, tapi disamping itu, dapat juga
digunakan KOH (Stirton, 1964)
Pada proses esterifikasi langsung, gliserol direaksikan dengan asam-asam
lemak seperti asam oleat, linoleat, stearat, laurat dan lain-lain dalam suasana vakum
pada suhu 180°C katalis yang digunakan adalah NaOH. Reaksi terjadi dalam dua
tingkatan. Pertama molekul asam lemak menyebar secara acak antara ketiga gugus
OH dari gliserol yang menghasilkan trigliserida, dan tingkatan kedua adalah campuran
antara gliserolisis dan esterifikasi. Kesetimbangan reaksi dicapai setelah pemanasan
berlangsung selama 1-4 jam. Pada akhir kesetimbangan reaksi, baik secara gliserolisis
maupun esterifikasi langsung, campuran yang dihasilkan tidak seluruhnya merupakan
monogliserida, tetapi terdiri dari campuran digliserida dan trigliserida
(Choudhury,1962).
2.9 Emulsifier
Emulsifier adalah bahan yang berfungsi untuk mengurangi tegangan permukaan
diantara dua fase yang tidak saling bercampur, sehingga dapat bersatu dan berbentuk
emulsi (Dziezak, 1988). Emulsifier biasanya berupa ester yang memiliki gugus
hidrofilik dan lipofilik.
Emulsifier terbagi menjadi tiga yaitu emulsifier ionik, nonionik dan
ampoterik. Emulsifier ionik ini merupakan emulsifier yang mempunyai muatan yang
dibagi menjadi dua bagian yaitu emulsifier kationik dan anionik. Emulsifier ampoterik
merupakan emulsifier yang memiliki baik gugus anoin maupun kation sehingga
tergantung pada pH. Sedangkan emulsifier nonionik yaitu emulsifier yang tidak
segmen lipofilik dan hidrofilik seperti monogliserida dan digliserida. Cara kerja
emulsifier ini dengan menurunkan tegangan permukaan antara dua fase kemudian
akan menstabilkan produk ( Kamel, 1991).
Emulsifier dapat diklasifikasikan berdasarkan nilai HLB. Nilai tersebut
menunjukkan ukuran keseimbangan dan regangan gugus hidrofilik (menyukai air atau
polar) dan gugus lipofilik (menyukai minyak atau non polar) dari dua fase yang
diemulsikan. Emulsifier yang mempunyai nilai HLB rendah biasanya diaplikasikan ke
dalam produk emulsi water in oil (w/o), sedangkan emulsifier dengan nilai HLB
tinggi sering digunakan dalam produk emulsi oil in water.
Klasifikasi emulsifier berdasarkan nilai HLBnya dapat dilihat pada tabel di bawah ini.
Tabel 2.3 Nilai HLB dan Aplikasinya
Nilai HLB Aplikasi
3-6 Emulsifier w/o
7-9 Wetting agent
8-18 Emulsifier o/w
13-15 Detergen
15-18 Stabilizer
Sumber : Becker (1983)
2.10 Kromatografi Gas
Kromatografi gas merupakan suatu metode analisis yang didasarkan pemisahan fisik
zat organik atau anorganik yang stabil pada pemanasan dan mudah diatsirikan. Pada
kromatografi gas sampel diuapkan di dalam gerbang suntik dan selanjutnya
mengalami pemisahaan fisik di dalam kolom setelah dielusi dengan gas pembawa
yang lembam ( Mulja, 1995). Dalam kromatografi gas, fase bergeraknya adalah gas
dan zat terlarut terpisah sebagai uap. Pemisahan tercapai dengan partisi sampel antara
fase bergerak dan fase diam berupa cairan dengan titik didih tinggi (tidak mudah
Dikenal dua macam metode kromatografi gas yaitu :
1. Kromatografi Gas Padat (KGP)
Dimana sebagai fase diam adalah butiran-butiran adsorben padat dan fase
gerak adalah gas. Mekanisme pemisahan komponen sampel adalah perbedaan
sifat fisik adsorbs oleh fase diam. Ada beberapa kelemahan pada KGP yaitu
adsorbs fase diam terhadap komponen-komponen sampel bersifat
semipermanen terutama terhadap molekul yang aktif atau molekul yang polar.
Disamping itu KGP seringkali memberikan bentuk kromatogram yang berekor
dan efektivitas pemisahaan komponen sangat dipengaruhi bobot molekul. KGP
lebih efektif untuk pemisahaan komponen-komponen dengan massa molekul
relatif rendah.
2. Kromatografi Gas Cair (KGC)
Pada KGC sebagai fase gerak adalah gas yang lembam dan fase diam adalah
cairan yang disalutkan tipis pada permukaan butiran padat sebagai pendukung.
Mekanisme pemisahannya adalah perbedaan partisi komponen-komponen
sampel di antara fase gas dan fase cair ( Mulja, 1995).
Kromatografi gas (KG) merupakan metode pilihan untuk pemisahaan dan
analisis kuantitatif asam-asam lemak. Untuk meningkatkan volatilitasnya dan untuk
meningkatkan efesiensi pemisahan, asam-asam lemak pada umumnya diderivatisasi
sebelum dilakukan analisis secara KG. Metilasi merupakan metode derivatisasi yang
paling sering digunakan karena sederhana dan biayanya murah. Kolom kapiler lebih
dipilih untuk analisis asam-asam lemak ini karena mempunyai kapasitas pemisahaan
yang lebih tinggi. Metilasi dilakukan dengan BF3 10 % dalam metanol. Kolom kapiler silica lebur ( CP Sil 88,50 x 0,25 mm i.d; ketebalan lapisan 0,20 mikron) digunakan
untuk pemisahaan secara isothermal. Suhu kolom bervariasi antara 155oC – 185oC; suhu lubang injeksi dan suhu detector dipertahankan pada suhu 250oC. Helium digunakan sebagai gas pembawa (tekanan inlet 120 kPa). Urutan retensi metal ester
asam lemak tergantung pada suhu kolom (Rohman, 2008).
Kromatografi gas merupakan metode yang tepat dan cepat untuk
memisahkan campuran yang sangat rumit. Waktu yang dibutuhkan beragam.
tambat), yang khas pada kondisi yang tepat. Waktu tambat adalah waktu yang
menunjukkan berapa lama suatu senyawa tertahan dalam kolom. Kekurangan alat ini
adalah tidak mudah memisahkan campuran dalam jumlah yang besar (Mc Nair, 1988).
Waktu yang menunjukkan berapa lama suatu senyawa tertahan di kolom disebut
waktu tambat, yang diukur mulai saat penyuntikan sampai terjadi elusi (Gritter, 1991).
Hampir setiap campuran kimia, mulai dari bobot molekul rendah sampai
tinggi, dapat dipisahkan menjadi komponen-komponennya dengan beberapa metode
kromatografi. Sifat- sifat yang harus dimiliki cuplikan agar dapat dipisahkan dengan
kromatografi, antara lain :
1. Kecenderungan molekul untuk melarut dalam cairan (kelarutan)
2. Kecenderungan molekul untuk melarut pada permukaan serbuk halus
(adsorpsi)
3. Kecenderungan molekul untuk menguap atau berubah ke keadaan uap
(keatsirian) (Willet, 1987)
2.11 Spektroskopi Inframerah
Energi dari kebanyakan vibrasi molekul berhubungan dengan daerah vibrasi molekul
yang dideteksi dan diukur pada spektrofotometer inframerah. Spektra di daerah merah
dapat dipergunakan untik mempelajari sifat-sifat bahan. Perubahan struktur yang
sedikit saja, dapat memberikan perubahan yang dapat diamati pada spektogram
panjang gelombang vs transmitansi. Perubahan ini sangat spesifik dan merupakan
sidik jari suatu molekul, dengan membandingkan spektogram yang dihasilkan oleh
bahan yang diuji terhadap bahan yang sudah diketahui secara kualitatif.
Penerapan secara kualitatif dapat dilakukan dengan membandingkan fungsi
peak (% transmitan) pada panjang gelombang terkait yang dihasilkan oleh zat-zat
yang diuji dan zat standart. Spekrta inframerah terutama ditujukan untuk senyawa
Spektra inframerah biasanya merupakan spektrofotometer berkas ganda dan
terdiri dari empat bagian utama, yaitu sumber cahaya, monokromator, kisi difraksi dan
detektor.
1. Sumber cahaya
Sumber cahaya berfungsi untuk memberikan panjang gelombang yang
dibutuhkan untuk analisa. Berbagai tipe sumber inframerah digunakan sesuai
dengan kebutuhannya.
2. Monokromator
Monokromator berfungsi untuk mengurangi spektrum sinar menjadi berbagai
spektra sesuai dengan urutan panjang gelombang yang dianalisa, yang diperoleh
melalui sebuah slit (celah) panjang gelombang.
3. Sampel ditempatkan pada sebuah sel yang dibuat khusus. Syarat umum dari sel
untuk sampel ini adalah transparan terhadap panjang gelombang yang
digunakan. Berarti sel untuk inframerah harus transparan terhadap sinar
inframerah. Umumnya sel ini terbuat dari NaCl yang memiliki sifat kekerasan
yang mudah larut dalam air.
4. Detektor
Detektor yang digunakan juga bermacam-macam sesuai dengan tipe
instrumennya. Untuk spektrofotometer infra double beam, data pengukuran
transmitans dari sampel diolah dan ditampilkan dalam bentuk spektogram
(grafik) yang menggambarkan hubungan antara frekuensi dan persen (%)
transmitans. Spektogram ini berguna untuk identifikasi secara kualitatif.
Alat-alat yang modernkebanyakan menggunakan detektor “thermopile”. Dasar kerja
thermopile adalah sebagai berikut : Jika 2 kawat logam yang berbeda
dihubungkan antara ujung kepala dan ekor, akan menyebabkan adanya arus yang
mengalir dalam kawat. Arus yang mengalir akan sebanding dengan intensitas
BAB III
METODOLOGI PENELITIAN
3.1 Alat
Alat-alat yang digunakan dalam penelitian ini antara lain :
Nama Alat Ukuran Merck
Alat Vakum Fisons
Beaker Glass 100 ml Pyrex
Hotplate stirrer Thermolyne
Kertas Saring
Kondensor Pyrex
Labu leher dua 250 ml Pyrex
Labu takar 250 ml Pyrex
Neraca Analitis Mettler PM 480
Pengaduk magnetic Thermolyne
Rotarievaporator Heidolph
Statif dan Klem
Tabung CaCl2 Pyrex
Tabung Iodine
3.2Bahan
Bahan - bahan yang digunakan dalam penelitian ini antara lain :
Akuades -
Amilum p.a E’Merck
Asam Formiat 90% p.a E’Merck
Asam Klorida 37% p.a E’Merck
Asam Oksalat (s) p.a E’Merck
Asam Oleat p.a E’Merck
Asam Sitrat (s) p.a E’Merck
Asam Sulfat 98% p.a E’Merck
CaCl2 Anhidrat p.a E’Merck
Dietil eter p.a E’Merck
Gliserol PT SOCI
Hidrogen Peroksida 30% p.a E’Merck
Iodin p.a E’Merck
Kalium Hidroksida (pellet) p.a E’Merck
Kalium Iodida p.a E’Merck
Metanol
n-heksana p.a E’Merck
Natrium Hidroksida (pellet) p.a E’Merck
Natrium Sulfat Anhidrat p.a E’Merck
Natrium Tiosulfat p.a E’Merck
Nitrogen PT Aneka Gas
3.3Prosedur Penelitian
3.3.1 Pembuatan Reagen dan Standarisasi
3.3.1.1Pembuatan Larutan KOH-Alkohol 0,5N
Ditimbang KOH sebanyak 7,0125 gram dan dilarutkan dengan alkohol dalam labu
takar 250 mL sampai garis batas dan distandarisasi dengan menggunakan larutan
H2C2O4 0,5N dan indikator fenolftalein.
3.3.1.2 Pembuatan Larutan KOH 0,5N
Ditimbang KOH sebanyak 4,5 gram dan dilarutkan dengan akuades dalam labu takar
250 mL sampai garis batas dan distandarisasi dengan menggunakan larutan H2C2O4 0,5N dan indikator fenolftalein.
3.3.1.3Pembuatan Larutan HCl 0,1N
Diukur sebanyak 2,07 mL larutan HCl 37% lalu diencerkan dengan akuades dalam
labu takar 250 mL sampai garis batas dan distandarisasi dengan menggunakan larutan
Na2CO3 0,1N.
3.3.1.4Pembuatan Larutan H2C2O4 0,1N
Ditimbang 1,575 gram H2C2O4.2H2O lalu dimasukkan ke dalam labu takar 250 ml dan diencerkan dengan akuades sampai garis tanda.
3.3.1.5Pembuatan Larutan Indikator Fenolftalein 1%
Ditimbang 1 gram fenolptalein dan dilarutkan dengan alkohol dalam labu takar 100
3.3.1.6Pembuatan Alkohol Netral
Ke dalam 200 mL alkohol 96% ditambahkan 4 tetes indikator fenolftalein dan ditetesi
dengan larutan KOH 0,1N hingga menjadi larutan merah muda.
3.3.1.7Pembuatan Larutan KI 10%
Ditimbang 10 gram Kristal KI, dilarutkan dengan akuades dalam labu takar 100 ml
sampai garis batas.
3.3.1.8Pembuatan Larutan Na2S2O3 0,1N
Ditimbang 6,25 gram Kristal Na2S2O3.5H2O, dilarutkan dengan akuades dan diencerkan dalam labu takar 250 ml sampai garais batas. Distandarisasi dengan
larutan K2Cr2O7 0,1N menggunakan indikator amilum mengikuti titrasi secara iodometri.
3.3.1.9Pembuatan Larutan KOH 0,1N
Dipipet 50 ml larutan KOH 0,5N kemudian diencerkan dengan akuades dalam labu
takar 250 ml sampai garis batas. Distandarisasi dengan larutan H2C2O4 0,1N menggunakan indikator fenolftalein.
3.3.1.10 Pembuatan Larutan Asam Sitrat 10%
Ditimbang kristal sebanyak 10 gram dan dilarutkan dengan akuades dalam labu takar
3.3.2 Pembuatan Monogliserida Oleat Campuran
Ke dalam labu leher dua dimasukkan 120 ml gliserol dan 1 gram NaOH pellet.
Dirangkai alat refluks yang dilengkapi dengan tabung CaCl2. Kemudian dipanaskan sampai pada suhu 120oC sambil diaduk selanjutnya melalui corong penetes ditesteskan sebanyak 50 ml asam oleat secara perlahan- lahan. Direfluks pada suhu
200oC dalam keadaan vakum dengan gas N2 selama 5 jam. Hasil reaksi didinginkan pada suhu kamar, kemudian dimasukkan kedalam corong pisah dan diekstraksi dengan
75 ml dietil eter. Fase dietil eter ditambahkan dengan larutan asam sitrat 10%
sebanyak 20 mL dan dicuci dengan akuades sebanyak 2 kali masing- masing sebanyak
10 ml. Kemudian diuapkan pelarutnya dengan menggunakan rotarievaporator. Hasil
yang diperoleh dianalisis melalui analisis spektroskopi FT-IR, dilanjutkan analisis
KGC, bilangan iodine dan harga HLB.
3.3.3 Pembuatan Senyawa Gliseril 9,10- Dihidroksi Stearat
Ke dalam labu leher dua dimasukkan 30 ml HCOOH 90% dan 15 mL H2O2 30% sambil diaduk. Dirangkai alat refluks yang dilengkapi dengan tabung CaCl2. Kemudian ditambahkan 1 mL H2SO4 (p) secara perlahan-lahan melalui corong penetes dan diaduk selama 1 jam pada suhu 40-45°C. Setelah itu ditambahkan 30 mL
monogliserida campuran melalui corong penetes dan direfluks kembali selama 2 jam
pada suhu 40-45°C. Hasil refluks dimasukkan ke dalam corong pisah dan diamkan
selama 1 malam. Lapisan atas diekstraksi dengan 50 mL dietil eter, kemudian dicuci
dengan NaOH 2N dan akuades sebanyak 2 kali masing- masing sebanyak 10 ml.
Lapisan eter dikeringkan dengan Na2SO4 anhidrat dan disaring. Filtrat yang diperoleh dirotarievaporasi dan selanjutnya, hasil yang diperoleh dianalisis melalui analisis
3.3.4 Prosedur Analisis
3.3.4.1 Analisis Bilangan Penyabunan
Analisis ini dilakukan terhadap monogliserida oleat campuran dan gliseril
9,10-dihidroksi stearat.
Ditimbang ± 0,3 gram sampel dan dimasukkan ke dalam Erlenmeyer. Ditambahkan 25
mL larutan KOH-alkohol 0,5N kemudian dipanaskan hingga mendidih. Didinginkan
dan ditambah 3 tetes indikator fenolftalein, kemudian dititrasi dengan larutan HCl
0,1N hingga warna merah muda hilang.
Dicatat volume HCl 0,1N yang terpakai dan dihitung bilangan penyabunan dengan
rumus :
(Vblanko – Vsampel) x N HCl x 56,1
Bil.Penyabunan =
Massa sampel (gr)
3.3.4.2 Analisis Bilangan Asam
Analisis ini dilakukan terhadap monogliserida oleat campuran dan gliseril
9,10-dihidroksi stearat.
Ditimbang ± 0,3 gram sampel dan dimasukkan ke dalam Erlenmeyer. Ditambahkan 10
mL larutan isopropil alkohol. Erlenmeyer tersebut ditutup dengan plastik dan
dipanaskan sampai mendidih. Larutan tersebut didinginkan dan ditambahkan 3 tetes
indikator fenolftalein, kemudian dititrasi dengan larutan KOH 0,1N sampai terbentuk
warna merah muda.
Dicatat volume KOH 0,1N yang terpakai dan dihitung bilangan asam dengan rumus :
V KOH x N KOH x 56,1
Bil.Asam =
3.3.4.3Penentuan Harga HLB
Analisis ini dilakukan terhadap monogliserida oleat campuran dan gliseril
9,10-dihidroksi stearat.
Harga HLB dapat diperoleh dari bilangan asam dan bilangan penyabunan dari
senyawa ester dengan menggunakan rumus :
S
HLB = 20 1 –
A
Dimana : S = Bilangan penyabunan
A = Bilangan asam
3.3.4.4Analisis Bilangan Iodin
Analisis ini dilakukan terhadap monogliserida oleat campuran dan gliseril
9,10-dihidroksi stearat.
Ditimbang sampel sebanyak ± 0,3 gram ke dalam Erlenmeyer 250 ml yang bertutup,
lalu ditambahkan 20 ml sikloheksana, kemudian dikocok/diguncang untuk
memastikan sampel telah benar-benar larut. Ditambahkan 25 ml larutan Wijs ke
dalamnya, kemudian ditutup dan dikocok agar campuran benar-benar bercampur.
Disimpan bahan tersebut dalam ruang gelap selama ± 30 menit. Diambil bahan
tersebut dari tempat penyimpanan dan ditambahkan 25 ml larutan KI10% dan 150 ml
air. Dititrasi dengan larutan Na2S2O4
Dicatat volume Na
0,1N sampai warna kuning hampir hilang
(kuning pucat). Ditambahkan 1-2 ml indikator amilum ke dalamnya dan dititrasi
kembali sampai warna biru hilang.
2S2O4
(Vblanko – Vsampel) x N Na
0,1N yang terpakai dan dihitung bilangan iodin dengan
rumus :
2S2O4 Bil.Iodin =
x 12,69
3.4 Bagan Penelitian
3.4.1 Pembuatan Monogliserida Oleat Campuran
120 mL gliserol
dimasukkan ke dalam labu leher dua
ditambahkan 1 gr NaOH pellet
dirangkai alat refluks dilengkapi dengan tabung CaCl2 anhidrous
dipanaskan sampai suhu 120oC sambil diaduk
dengan magnetik stirer
ditambahkan 50 mL asam oleat melalui corong penetes
direfluks kembali pada suhu 200oC dalam keadaan vakum dengan gas N2 selama 5 jam
campuran
didinginkan pada suhu kamar
dimasukkan ke dalam corong pisah
diekstraksi dengan 75 mL dietil eter
lapisan atas lapisan bawah
ditambahkan asam sitrat 10% sebanyak 20 mL
dicuci dengan aquadest sebanyak 2 kali masing-masing 10 mL
lapisan atas lapisan bawah
diuapkan dengan rotarievaporator pada suhu 33oC
hasil destilat
3.4.2 Pembuatan Gliseril 9,10-dihidroksi Stearat
30 mL HCOOH 90%
dimasukkan ke dalam labu leher dua
ditambah 15 mL H2O2 30% setetes demi setetes
ditambahkan 1 mL H2SO4 (p) setets demi setetes melalui corong penetes sambil diaduk
diaduk pada suhu 40-45oC selama 1 jam dirangkai alat refluks dilengkapi dengan tabung CaCl2 anhidrous
ditambahkan 30 mL monogliserida oleat campuran
campuran
diaduk pada suhu 40-45oC selama 2 jam
didiamkan selama 1 malam
lapisan atas
dimasukkan ke dalam corong pisah
lapisan bawah
ditambah 50 mL dietil eter
dicuci dengan 10 mL NaOH 2N
dicuci dengan aquadest sebanyak 2 kali masing-masing 10 mL
lapisan atas lapisan bawah
dikeringkan dengan Na2SO4 anhidrous
disaring
filtrat residu
dirotarievaporasi
hasil
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Pembuatan Monogliserida Oleat Campuran
Esterifikasi asam oleat dengan katalis NaOH, dengan waktu reaksi selama 5 jam
dalam temperatur 200°C menghasilkan monogliserida dan digliserida. Hasil analisis
melalui Kromatografi Gas Cair detektor FID (Flame Ionization Detector), kolom
DB-5HT (15m x 0,25m) dengan gas pembawa He, suhu injektor dan detektor 380°C
diperoleh kromatogram (Gambar 4.1) dengan komposisi seperti pada Tabel 4.1
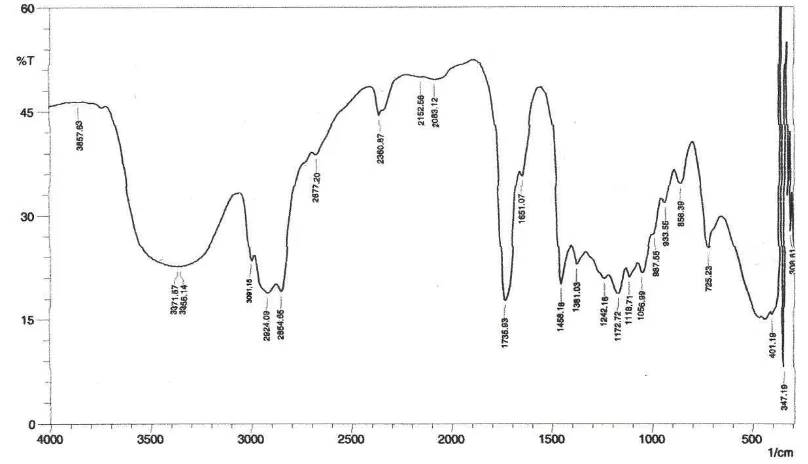
Hasil analisis FT-IR dari produk gliserolisis asam oleat dengan katalis NaOH
diperoleh spektrum dengan puncak-puncak vibrasi pada daerah bilangan gelombang
Gambar 4.1 Kromatogram hasil esterifikasi asam oleat dengan katalis NaOH
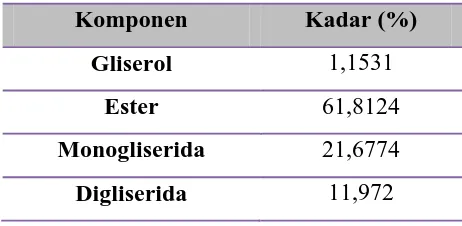
Tabel 4.1 Persen komposisi hasil reaksi esterifikasi asam oleat dengan katalis NaOH
Komponen Kadar (%)
Gliserol 1,1531
Ester 61,8124
Monogliserida 21,6774
Digliserida 11,972
4.1.2 Pembuatan Senyawa Gliseril 9,10-dihidroksi stearat
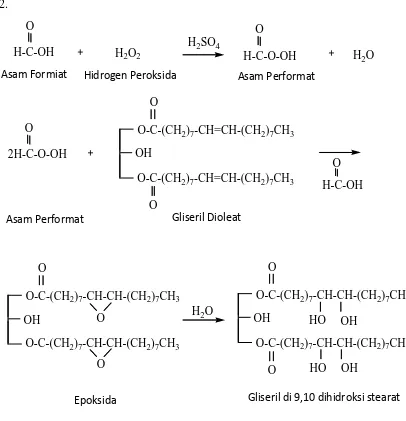
Pembuatan senyawa gliseril 9,10 dihidroksi stearat campuran diperoleh melalui
epoksidasi monogliserida campuran dengan asam performat yang dilanjutkan dengan
hidrolisis. Asam performat yang digunakan diperoleh dari reaksi antara HCOOH 90%
dengan H2O2 30% menggunakan katalis H2SO4 (p) yang selanjutnya diikuti penambahan hasil gliserolisis yang direfluks pada suhu 40-45°C. Dalam hal ini, ikatan
π dari monogliserida campuran yang tidak jenuh akan membentuk cincin epoksida dan
selanjutnya diikuti hidrolisis menghasilkan senyawa gliseril 9,10 dihidroksi stearat.
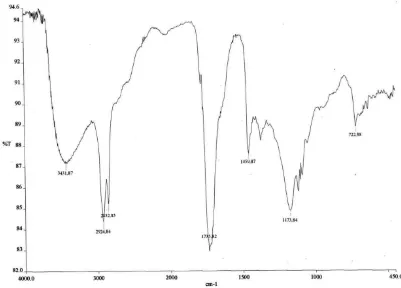
Hasil analisis FT-IR dari produk gliseril 9,10 dihidroksi stearat campuran diperoleh
Gambar 4.3 Spektrum FT-IR senyawa gliseril 9,10-dihidroksi stearat
4.2 Pembahasan
4.2.1 Pembuatan Monogliserida Oleat Campuran
Esterifikasi terhadap asam oleat dengan menggunakan katalis NaOH pada suhu 200°C
menghasilkan campuran monogliserida dan digliserida. Hasil esterifikasi yang
dihasilkan dianalisa dengan spektroskopi FT-IR dan dilanjutkan analisis KGC untuk
menghitung kadar dari monogliserida dan digliserida yang dihasilkan.
Berdasarkan hasil analisis FT-IR terhadap hasil gliserolisis asam lemak
menggunakan katalis NaOH diperoleh spektrum (Gambar 4.2) dengan puncak
serapan pada bilangan gelombang 3371 cm-1 sampai 3356 cm-1 menunjukkan vibrasi stretching O-H pada monogliserida dan digliserida maupun gliserol yang tidak habis
menunjukkan vibrasi stretching =C-H (alkena) yang didukung oleh puncak serapan
C=C pada bilangan gelombang 1651 cm-1. Pada bilangan gelombang 2924 cm-1 dan 2854 cm-1 menunjukkan vibrasi stretching C-H sp3 asimetrik dan simetrik untuk -CH2- yang didukung oleh vibrasi bending C-H sp3 pada bilangan gelombang 1458 cm-1 dan 1361 cm-1. Puncak serapan pada bilangan gelombang 1735 cm-1 menunjukkan adanya gugus C=O dari ester yang didukung oleh puncak serapan C-(C=O)-C pada bilangan
gelombang 1172 cm-1. Puncak serapan pada bilangan gelombang 725 cm-1 menunjukkan adanya alkil rantai panjang –(CH2)n dimana (n≥4).
Harga bilangan iodin dari senyawa monogliserida oleat campuran yang diperoleh
sebesar 79,01 (lampiran F). Hasil penentuan harga HLB monogliserida oleat
campuran adalah sebesar 9,08 (lampiran G)
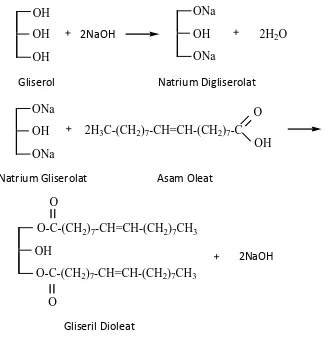
Adapun reaksi dari pembuatan mono dan digliserida oleat adalah sebagai berikut :
2H3C-(CH2)7-CH=CH-(CH2)7-C
Gambar 4.4 Reaksi esterifikasi asam oleat menggunakan katalis NaOH
4.2.2 Pembuatan senyawa gliseril 9,10-dihidroksi stearat.
Monogliserida campuran yang diperoleh selanjutnya diepoksidasi dengan asam
performat, kemudian dilanjutkan dengan reaksi hidrolisis sehingga dihasilkan senyawa
gliseril 9,10-dihidroksi stearat.
Asam formiat dan hidrogen peroksida direaksikan membentuk senyawa
performat dengan bantuan katalis H2SO4 (p), selanjutnya diikuti penambahan monogliserida oleat campuran dan direfluks pada suhu 40-45°C selama 2 jam. Dalam
hal ini, ikatan π dari monogliserida oleat campuran yang tidak jenuh pada atom C9,10 akan membentuk cincin epoksida dan selanjutnya dihidrolisis menghasilkan senyawa
Berdasarkan hasil FT-IR terhadap hasil epoksidasi dan hidrolisis dari
monogliserida campuran diperoleh spektrum (Gambar 4.3) dengan puncak serapan
pada bilangan gelombang 3431 cm-1 yang merupakan serapan khas gugus OH. Pada daerah ini, sebelum diepoksidasi belum ditemui puncak serapan tersebut dan yang
ditemui adalah pada daerah 3091 cm-1 (C-H sp2) serta pada daerah 1651 cm-1 (C=C) yang menunjukkan bahwa masing-masing ikatan π pada monogliserida oleat
campuran telah dioksidasi dan berubah menjadi bentuk diol. Pada bilangan gelombang
2924 - 2852cm-1 dan menunjukkan serapan khas dari vibrasi stretching C-H sp3 yang didukung oleh puncak vibrasi pada daerah bilangan gelombang 1459 – 1415 cm-1 yang menunjukkan serapan khas dari vibrasi bending C-H sp3. Pada bilangan gelombang 1735 cm-1 menunjukkan serapan khas gugus karbonil (C=O) dan bilangan gelombang pada daerah 1173 cm-1 menunjukkan serapan khas gugus C-O-C yang menunjukkan adanya ester.
Senyawa gliseril 9,10 dihidroksi stearat memiliki bilangan iodin sebesar 30,74.
Penurunan bilangan iodin ini menunjukkan adanya penurunan ikatan rangkap dan
terjadi reaksi oksidasi terhadap ikatan rangkap atom C9,10 pada senyawa gliseril oleat, serta didukung oleh kenaikan harga HLB dari senyawa gliseril 9,10 dihidroksi stearat
Adapun reaksi dari pembuatan gliseril 9,10-dihidroksi stearat adalah sebagai berikut :
2.
Gliseril di 9,10 dihidroksi stearat H2O
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Senyawa gliseril 9,10-dihidroksi stearat campuran dapat disintesis dari asam
oleat melalui reaksi esterifikasi, epoksidasi yang diikuti dengan hidrolisis.
2. Harga HLB dari senyawa gliseril 9,10-dihidroksi stearat campuran adalah
sebesar 11,02 dan dapat digunakan sebagai bahan pengemulsi o/w.
5.2 Saran
1. Diharapkan kepada peneliti selanjutnya agar memisahkan monogliserida dan
digliserida yang diperoleh.
2. Diharapkan kepada peneliti berikutnya untuk melakukan sintesis poliol dengan