KONSTRUKSI DAN EKSPRESI PROTEIN FUSI
ANTI-EGFRvIII
scFv::HPRmut SEBAGAI KANDIDAT
IMUNOTOKSIN PADA
Pichia
.pastoris
YULIAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
iii
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Konstruksi dan Ekspresi Protein Fusi Anti-EGFRvIII scFv::HPRmut Sebagai Kandidat Imunotoksin pada Pichia pastorisadalah benar karya saya bersama pembimbing dan belum diajukan
dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Lembaga Ilmu Pengetahuan Indonesia.
Bogor, Juni 2014
Yuliawati
iv
RINGKASAN
YULIAWATI. Konstruksi dan Ekspresi Protein Fusi anti-EGFRvIII scFv::HPRmut sebagai kandidat imunotoksin pada Pichia pastoris. Dibimbing
oleh RETNO DAMAYANTI SOEJOEDONO dan ASRUL MUHAMAD FUAD. Reseptor faktor pertumbuhan epidermal (epidermal growth factor receptor, EGFR) varian III atau dikenal sebagai EGFRvIII adalah varian mutan
dari EGFR normal yang mengalami delesi sebanyak 267 asam amino (ekson -2 sampai 7). Delesi ini mengakibatkan sebagian besar domain ekstraselular pada EGFR hilang dan terbentuk epitope baru pada ujung-N yang spesifik dan sangat potensial sebagai molekul target pada beberapa jenis sel tumor. Varian mutan ini umumnya ditemui pada beberapa jenis tumor padat termasuk glioblastoma (GBM), kanker payudara, rahim, prosat, otak (medulloblastoma), dan paru-paru.
Antibodi atau fragmen antibodi anti-EGFRvIII scFv memiliki aktifitas spesifik yang mampu mengenali epitope EGFRvIII tersebut dan akan mengalami endositosis ke dalam sel setelah berikatan dengan reseptor ini. Human pancreatic ribonuclease (HPR) dapat bersifat sitotoksik bila masuk ke dalam sel karena
kemampuannya untuk mendegradasi RNA. Aktivitas ribonuklease tersebut akan menghambat proses biosintesis protein di dalam sel hingga mengakibatkan kematian sel. Penelitian ini bertujuan untuk mengkonstruksi suatu imunotoksin konjugat dari antibodi untai tunggal (scFv) anti-EGFRvIII yang difusi dengan
human pancreatic ribonuclease (HPR) mutan dengan dan tanpa protein penanda
GFP dan diekspresikan pada Pichia pastoris.Varian GFP yang digunakan adalah
EGFP (enhanced green fluorescent protein).
Gen anti-EGFRvIII-scFv dan GFP disubklon ke dalam vektor pPICZαA di
bawah kontrol dari promoter AOX1 (PAOX1) yang bersifat indusibel dan difusi
dengan sinyal sekresi MF-α (mating factor-α), menghasilkan plasmid pPICZα
-scFv dan pPICZα-scFv-GFP. Sekuen gen diverifikasi dan plasmid tersebut
digunakan pada subkloning berikutnya. Selanjutnya gen HPR di subklon pada ujung-3’ dari gen scFv dan scFv::GFP, menghasilkan konstruk fusi gen
scFv::HPR dan scFv::GFP::HPR. Plasmid rekombinan pPICZ-scFv-HPR dan
pPICZ-scFv-GFP-HPR telah berhasil dikonstruksi dan urutan sekuen
nukleotidanya telah diverifikasi. Kedua konstruk plasmid tersebut dilinearisasi menggunakan enzim SacI sebelum digunakan untuk transformasi. P. pastoris
SMD1168H digunakan sebagai sel inang untuk transformasi dengan teknik elektroporasi. Kedua konstruk fusi gen tersebut berhasil ditransformasi dan diekspresikan padaP. pastoris. Sel transforman diseleksi pada medium YPD yang
mengandung zeocin untuk mendapatkan klon transforman yang stabil dan memiliki banyak salinan gen target.
Efisiensi transformasi dari konstruk scFv::HPR dan scFv::GFP::HPR masing-masing adalah 54 dan 110 cfu/µg DNA. P. pastoristransforman diseleksi
lebih lanjut pada media yang mengandung zeocin dari konsentrasi 100 sampai 1000 µg/ml. Ekspresi protein rekombinan dianalisis dengan mikroskop fluoresen, SDS PAGE dan western blot. P. pastoris yang ditransformasi dengan fusi gen
v
SDS-PAGE. Protein rekombinan tersebut telah berhasil diisolasi dan dipurifikasi menggunakan metode kromatografi afinitas dengan estimasi yield sebesar 15,85
mg protein per liter kultur.
Kata kunci: EGFRvIII, HPR (human pancreatic ribonuclease), imunotoksin
vi
SUMMARY
YULIAWATI. Construction and Expression of Anti-EGFRvIII scFv::HPRmut Fusion Protein as an Immunotoxin Candidate inPichia pastoris. Under Direction
of RETNO DAMAYANTI SOEJOEDONO and ASRUL MUHAMAD FUAD.
Epidermal growth factor receptor variant III (EGFRvIII) is a mutant of EGFR lacking 267 amino acids (exon-2 through 7) within its extracellular domain, resulting in the formation of a new epitope as a tumor-specific target. This mutant variant is commonly found in glioblastoma multiform (GBM), breast, ovarian, prostate, and lung carcinomas. Antibodies or antibody fragments (eg. scFv) EGFRvIII with specific activity against this receptor that are internalized into the cell after receptor binding. Human pancreatic ribonuclease (HPR) can be cytotoxic due to their inherent ability to degrade RNA, causing cell death via inhibition of protein synthesis. The aim of this research is to construct, clone, and express an immunotoxin-based conjugate combining an anti-EGFRvIII single chain variable fragment (scFv) with an HPRmut (human pancreatic ribonuclease mutant variant) with or without protein marker GFP inPichia pastoris. The GFP
variant used were EGFP (enhanced green fluorescent protein).
The anti-EGFRvIII scFv and GFP genes were subcloned into pPICZαA
vector downstream of the methanol inducible promotor PAOX1 and fused with MF-α (mating factor-α)signal peptide., resulting pPICZα-scFv andpPICZα-scFv-GFP
plasmids. Plasmid sequence was verified and the correct one was used for the next subcloning. The HPR gene was subcloned at the 3’-end of scFv and scFv::GFP
fusion, resulting scFv::HPR and scFv::GFP::HPR fusion constructs. Recombinant plasmids pPICZ-scFv-HPR and pPICZ-scFv-GFP-HPR have been successfully
constructed and their sequences were verified. Both recombinant plasmids were linearized using SacI enzyme before they were used for transformation. P. pastoris SMD1168H was used as the host for transformation, which was carried
using electroporation method. Both constructs have been successfully transformed and expressed in P. pastoris. Transformed cells were selected on YPD medium
containing zeocin to select genetically stable clones having multicopy gene integration.
Transformation efficiencies of both constructs, scFv::HPR and scFv::GFP::HPR, were 54 and 110 cfu/µg DNA respectively. Transformed P. pastoris clones were further screened on zeocin media at concentration from 100
up to 1000 µg/ml. Recombinant protein expression was analyzed with fluorescent microscope, SDS-PAGE, and western blot.P. pastoristransformants derived from
a fusion construct containing GFP emits green fluorescent signal which shows that GFP has been correctly expressed. The fusion protein was successfully expressed and secreted from P. pastoris as shown from SDS-PAGE and
immunoblotting analyses. The fusion protein has been isolated and purified using affinity chromatography method with a yield estimation of 15.85 mg protein per liter of culture.
Keywords: EGFRvIII, HPR (human pancreatic ribonuclease), immunotoxin
vii
© Hak Cipta Milik IPB, Tahun 2014 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan LIPI
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
KONSTRUKSI DAN EKSPRESI PROTEIN FUSI ANTI
EGFRvIII
scFv::HPRmut SEBAGAI KANDIDAT
IMUNOTOKSIN PADA
Pichia
.pastoris
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
x
xi
Judul Tesis : Konstruksi dan Ekspresi Protein Fusi anti-EGFRvIII
..scFv::HPRmut ...sebagai kandidat imunotoksin pada Pichia ..pastoris
Nama : Yuliawati NIM : P051100201
Disetujui oleh
Komisi Pembimbing
Prof Dr drh Retno D. Soejoedono, MS Ketua
Dr Asrul Muhamad Fuad, MSi Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Dekan Sekolah Pascasarjana
xii PRAKATA
Puji syukur kepada Allah SWT atas segala rahmat, karunia, dan petunjuk-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih pada penelitian yang dilaksanakan di laboratorium Protein Rekombinan dan Sistem Pengantaran Terarah, Pusat Penelitian Bioteknologi-LIPI Cibinong-Bogor, dari bulan Maret 2012 sampai dengan bulan Maret 2014 ini adalah konstruksi dan ekspresi protein rekombinan dengan judul Konstruksi dan Ekspresi Protein Fusi Anti-EGFRvIII scFv::HPRmut Sebagai Kandidat Imunotoksin pada Pichia pastoris.
Terimakasih penulis ucapkan kepada Ibu Prof Dr drh Retno Damayanti Soejoedono MS dan Bapak Dr Asrul Muhamad Fuad, MSi selaku pembimbing yang telah banyak memberikan saran dan bimbingan; Kepada Bapak Dr Asrul Muhamad Fuad, MSi atas izin penggunaan fasilitas dan bantuan dana penelitian; kepada Kementrian Riset dan Teknologi atas bantuan dana beasiswa; kepada Ibu Dr drh Ni Luh Putu Ika Mayasari selaku penguji luar komisi pada ujian tesis; kepada Kepala Pusat Penelitian Bioteknologi LIPI atas izin, bantuan dan dukungan yang telah diberikan selama penulis menunaikan tugas belajar. Disamping itu ucapan terimakasih disampaikan kepada teman-teman laboratorium: Dian Fitria, Ami, Yona dan Prety atas bantuannya selama pelaksanaan penelitian. Serta tidak lupa juga pada rekan-rekan P.S. Bioteknologi angkatan 2010 atas kebersamaan dan persahabatan selama penulis menuntut ilmu di PS Bioteknologi hingga menyelesaikan studi. Ungkapan terima kasih juga disampaikan untuk ibu, mamah, apa, suami, dan keluarga atasdo’a,kasih sayang,
pengertian, semangat dan dukungan dalam menyelesaikan penelitian ini. Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2014
xiii
2.1 Anti EGFRvIII-scFv...4
2.2 Human Pancreatic Ribonuclease(HPR)...6
2.3 Imunotoksin dan Sistem Penyampaian Obat Berbasis Antibodi Konjugat………...……….…….… 7
2.4 Green Fluorescent Protein(GFP) ...9
2.5 Pichia pastorisdan vektor ekspresi pPICZ...9
3 BAHAN DAN METODE...13
3.1 Bahan ... 13
3.2 Metode Penelitian ...14
3.2.1 Subkloning gen anti-EGFRvIIIscFvke dalam plasmid PICZαA ...14
3.2.2 Subkloning genGFPke dalam plasmidpPICZα-scFv...14
3.2.3 Subkloning gen HPR ke dalam plasmid pPICZα-scFv dan pPICZα-scFv-GFP ...14
3.2.4 TransformasiP. pastorisdan seleksi sel transforman ...15
3.2.5 SeleksiP. pastoristransforman ...15
3.2.6 Ekspresi protein padaP. pastoristransforman ...16
3.2.7 Pengujian insersi fusi gen pada genomPichia...16
3.2.8 Pengamatan sel dengan mikroskop fluoresen...16
3.2.9 Analisis ekspresi protein rekombinan dengan teknik imunoblotting (slot blot) dan SDS PAGE...17
3.2.10 Purifikasi protein rekombinan menggunakan kromatografi kolom afinitas ...17
4 HASIL DAN PEMBAHASAN ...19
4.1 Konstruksi Protein Fusi anti-EGFRvIIIscFvdengan HPRmut...19
4.1.1 Subkloning gen anti-EGFRvIIIscFvke dalam plasmid pPICZαA...19
4.1.2 Subkloning genHPRke dalam plasmidpPICZα-scFv...19
4.1.3 Transformasi dan seleksiP. pastoris...21
xiv
4.2.1 Subkloning genGFPke dalam plasmidpPICZα-scFv...23
4.2.2 Subkloning genHPRke dalam plasmidpPICZα-scFv-GFP...25
4.2.3 Transformasi, seleksi dan analisisP. pastoris...27
5 SIMPULAN DAN SARAN...33
5.1 Simpulan...33
5.2 Saran...33
DAFTAR PUSTAKA... 34
LAMPIRAN ... 40
xv
DAFTAR TABEL
Halaman
xvi
DAFTAR GAMBAR
Halaman
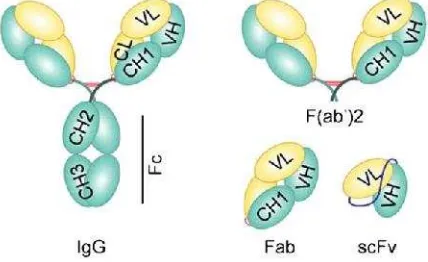
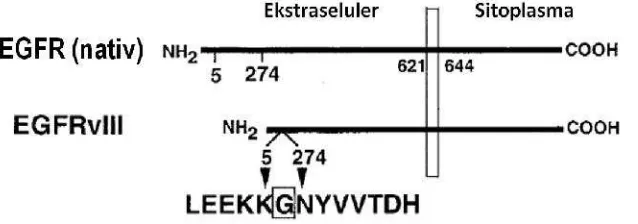
1. Struktur antibodi dan fragmen antibodi yang dapat dimanfaatkan untuk aplikasi terapetik (Petersonet al.2008)………..…... 4 2. Skema Struktur Protein pada EGFR Wild-type dan EGFRvIII (Kuan et
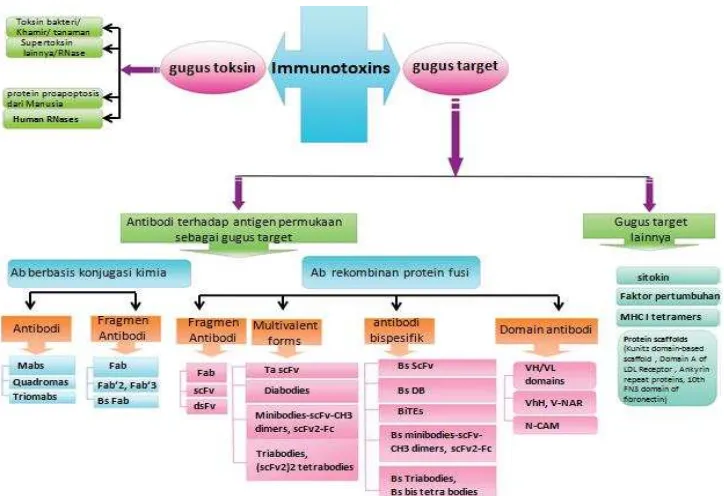
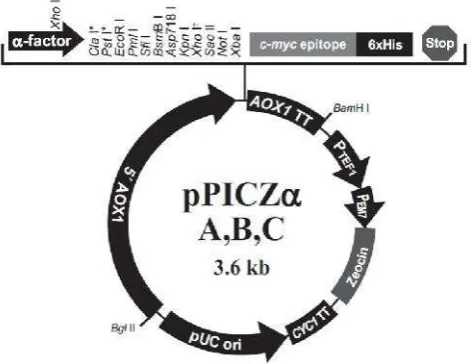
al. 2001)………... 5 3. Format konstruksi imunotoksin (Madhumathi & Verma 2012)…..…... 8 4. Peta vektor pPICZα(Invitrogen 2010)………...…….….. 11
5. Peta konstruksi fusi gen scFv danHPR dan HPRdi dalam plasmidpPICZα -scFv-pPICZα-scFv-GFP-HPR………...…….. 13 6. Elektroforegram hasil PCR untuk seleksi plasmid rekombinan pPICZ
-scFv-HPR padaE. colitransforman………... 19 7. Elektroforegram hasil PCR koloni dan digesti plasmid untuk seleksi
plasmid rekombinan mengandung fusi gen
scFv::HPR.………... 20 8. Peta konstruksi fusi gen scFv::HPR dalam plasmid pPICZα
-scFv... 21 9. Uji kestabilan genetik dan seleksi insersi gen ganda pada koloni yeast
transforman pada media YPDAzeo, dengan konsentrasi zeocin bertingkat………... 22 10. Elektroforegram hasil PCR koloni untuk konfirmasi insersi fusi gen
scFv::HPRdalam genomP. pastoristransforman………..….. 23 11. Elektroforegram hasil PCR untuk seleksi plasmid rekombinan pPICZ
-scFv-GFP padaE. colitransforman………..……. 24 12. Peta konstruksi fusi gen scFv::GFP dalam plasmid pPICZα
-scFv-GFP... 24 13. Elektroforegram hasil PCR dan hasil digesti enzimatik untuk konfirmasi
orientasi dan insersi gen HPR dalam plasmid
rekombinan... 25 14. Peta konstruksi fusi gen HPR dalam plasmid pPICZα–scFv–
GFP.……..……….…… 26 15. Uji kestabilan genetik dan seleksi insersi gen ganda pada koloni yeast
transforman pada media YPD-agar zeocin, dengan konsentrasi zeocin bertingkat………... 27 16. Elektroforegram hasil PCR koloni dari beberapa klon yeast transforman
untuk konfirmasi integrasi fusi gen scFv::GFP::HPR dalam genom P.
pastoris.……….. 28
17. Pengamatan P. pastoris transforman dan non-transforman dengan
xvii
(lajur kanan)... 18. Ekspresi protein khimera scFv::EGFP::HPR dari beberapa klon P.
pastoris transforman, dianalisis dengan metode slot-blot dan
elektroforesis gelSDS PAGE………. 30 19. Isolasi dan purifikasi protein fusi rekombinan scFv::GFP::HPR dari
xviii
DAFTAR LAMPIRAN
Halaman
1. Kromatogram sekuen gen scFv-EGFRvIII primer Forward... 40 2. Kromatogram sekuen gen scFv-EGFRvIII primer
Reverse... 40 3. Komposisi Media... 41 4. Komposisi Larutan Stok dan Dapar... 43
5. KromatogramReverse sekuen gen fusi gen scFv::HPR Primer ……….…….…... 47 6. Penentuan Efisiensi Transformasi ... 47 7. Kromatogram sekuen gen fusi gen scFv::GFP Primer
3
1 PENDAHULUAN
1.1. Latar Belakang
Kanker merupakan salah satu penyakit tidak menular yang menjadi masalah kesehatan masyarakat baik di dunia maupun di Indonesia. Pada tahun 2008 tercatat 12,7 juta orang di seluruh dunia menderita kanker dan 7,6 juta orang diantaranya meninggal dunia (International Union Against Cancer/ UICC, 2010). Pengobatan kanker secara konvensional dilakukan dengan cara operasi, radiasi dan kemoterapi. Pada umumnya pengobatan kanker secara konvensional tersebut kurang spesifik membunuh sel tumor. Kemoterapi secara umum menimbulkan efek samping yang tidak nyaman bagi pasien. Terapi kanker dapat ditingkatkan dengan cara deteksi dini, operasi pengangkatan masa tumor padat, penggunaan radioterapi, dan agen sitotoksik. Namun pendekatan terapi yang benar-benar efektif masih kurang. Salah satu cara dalam meningkatkan efektivitas dan efisiensi kemoterapi dapat dilakukan melalui penyampaian obat secara terarah. Penyampaian obat secara terarah dapat dilakukan melalui beberapa cara seperti menggunakan protein antibodi atau fragmen antibodi yang mengenali sel tumor tertentu secara spesifik yang dikonyugasikan dengan suatu senyawa aktif yang dapat membunuh sel seperti senyawa radioaktif (isotop), molekul aktif prodrugs,
atau senyawa toksin yang bersifat sitotoksik. Molekul konyugat tersebut akan secara selektif membunuh sel tumor dan menghindari sel-sel normal yang bukan menjadi sel target (Kuanet al.2001).
Fragmen antibodi untai tunggal (single chain antibodi, scFv) merupakan
bagian dari molekul antibodi yang terdiri atas daerah variabel untai ringan (VL) dan variabel untai berat (VH) dan dihubungkan dengan suatu peptida penghubung (linker). Molekul scFv ini berukuran jauh lebih kecil (30 kD) dibandingkan
dengan molekul antibodi utuh (misal IgG 150 kD). Karena ukurannya yang kecil, diharapkan molekul scFv dapat menembus jaringan sel tumor lebih baik (Sun et al. 2003). Molekul scFv menunjukkan farmakokinetik yang cepat, spesifisitas
yang tinggi terhadap molekul target dan imunogenitas yang rendah pada hewan model. Selain itu, studi autoradiografi menunjukkan bahwa scFv dapat menembus lebih luas dan homogen ke dalam tumor daripada molekul antibodi utuh atau fragmen antibodi lain yang lebih besar. Sifat ini penting untuk radioimunoterapi (Kuanet al.2000, Ahmadet al. 2012).
2
Faktor pertumbuhan epidermal reseptor varian III (EGFRvIII) adalah varian mutan yang paling umum ditemui dalam sejumlah tumor padat termasuk glioblastoma (GBM), kanker payudara, kanker otak (medulloblastoma), dan
kanker rahim. EGFR vIII jarang ditemukan pada jaringan normal. Varian reseptor ini merupakan varian mutan dari EGFR normal yang mengalami delesi ekson-2 sampai ekson-7. Delesi tersebut mengakibatkan sebagian besar domain ekstraselular hilang dan terbentuknya susunan asam amino yang baru pada ujung
–N dari reseptor tersebut. Asam amino glisin terbentuk pada sambungan fusi
antara ekson 1 dan ekson 8. Fusi antara ekson 1 dan 8 serta pembentukan glisin menciptakan antigen baru yang spesifik dari varian mutan EGFR tersebut. Varian mutan ini dikenal sebagai varian EGFRvIII (Guptaet al.2010).
Terapi kanker terarah selain dapat menggunakan antibodi spesifik tumor juga dapat menggunakan antibodi konyugat yang dikonyugasi dengan senyawa atau molekul aktif lain yang bersifat sitotoksik, seperti radionuklida (Ibritomomomab tiuxetan, Tostitumomab), prodrugs (Gemtuzumab ozogamicin),
molekul kecil antikanker (doxirubicin, taxol, dsb) atau toksin baik berasal dari tanaman, mikroba atau hewan (holotoxin, hemitoxin, pseudomonas exotoxin, diptheria toxin, Onconase) (Kuan,et al., 2001).
Salah satu strategi alternatif untuk penyampaian obat secara terarah dapat dilakukan dengan dasar imunotosin. Imunotoksin berarti molekul antibodi atau fragmen antibodi (seperti scFv) yang difusi atau dikonyugasi dengan suatu molekul toksin. Penelitian mengenai imunoterapi berbasis imunotoksin banyak
dikembangkan saat ini. Salah satunya adalah ‘imunoRNase’ (IR) yang
menggunakan molekul ribonuklease (RNase) sebagai senyawa aktif (toksin) (Lorenzo et al. 2004). Salah satu jenis RNase yang akan digunakan dalam
penelitian ini adalah human pancreatic RNase (HP-RNase atau HPR). RNase
pada sel normal tidak bersifat sitotoksik, namun akan menjadi toksik ketika memasuki sel target kanker, yaitu sel yang permukaannya menampilkan epitop yang dikenali oleh bagian dari antibodi (Rybak & Newton 1999).
HPR merupakan agen terapi yang sangat menjanjikan untuk manusia dibandingkan dengan RNase lain karena bersifat imunogenik yang rendah sehingga lebih potensial (Gaur et al. 2001; Lorenzo et al. 2004; Castro, et al.
2011). Maka dari itu digunakan HPR mutan varian sitotoksik yang terjaga stabilitas konformasinya serta memiliki aktifitas ribonuklease yang tinggi namun penghambatan oleh RI-nya rendah. Seperti penelitian yang telah dilakukan Gaur
et al. (2001) dan Leland et al. (2001) yang membuat HPR mutan dengan
mensubtitusi asam amino pada loop 1 RNase permukaan yang menjaga stabilitas konformasi dan aktivitas ribonukleolitiknya namun mengurangi penghambatan oleh RI.
Green flouresent protein (GFP) adalah alat yang ampuh untuk tes berbasis
3
Pichia pastoris dipilih untuk produksi protein khimera. P. pastoris
merupakan khamir metilotropik yang dapat memproduksi protein dari sel tunggal dan mampu tumbuh dengan kepadatan yang tinggi pada media yang sederhana. Teknologi fermentasi ini membentuk dasar dari sistem ekspresi yang efisien dengan promoter AOX1 yang diinduksi menggunakan metanol apabila vektornya terintegrasi ke dalam genom P. pastoris. Keuntungan utama dari penggunaan P. pastoris adalah menghasilkan protein intraseluler yang sangat tinggi,
menghasilkan tingkat sekresi yang tinggi ke media, fermentasinya menghasilkan kepadatan sel yang tinggi, stabil secara genetik dan menghasilkan protein dalam jumlah yang besar untuk studi analitis (Hames & Higgins 1999). Peterson et al.
(2006) melaporkan bahwa insubilitas scFv dapat diatasi dengan diekspresikan pada khamir metilotropik P. pastoris. Ekspresi berbasis khamir memberikan
pelipatan scFv (dan Fab) yang tepat dengan level yang tinggi, yang dipulihkan melalui satu langkah kromatografi menggunakan tag afinitas kecil (seperti his-tag). Keuntungan lain dari diekspresikannya scFv dengan sistem ekspresi pada P. pastoris adalah kemampuannya dalam mengekspresikan protein terapetik pada
organisme yang bebas dari virus hewan dan kontaminasi endotoksin sehingga dapat diaplikasikan tidak hanya untuk obat namun untuk aplikasi bioteknologi lainnya (Joostenet al.2003).
Beberapa penelitian telah dilakukan untuk mengkonstruksi imunoRNase scFv anti-ErbB-2 dan HP-RNase yang semuanya berasal dari manusia dan diuji secarain vivodanin vitro. HPR tersebut juga memiliki stabilitas yang tinggi serta
sitotoksik yang selektif pada sel target saja (Lorenzo et al. 2004). Hal tersebut
didukung oleh penelitian yang dilakukan Borriello et al. (2011) bahwa format
scFv-Fc-RNase adalah yang paling sesuai dari produksi generasi baru immunoRNase untuk aplikasi terapi. Efektivitas immunoRNase ditingkatkan untuk membunuh sel kanker agar lebih efisien, yaitu dengan merekonstruksi RNase manusia asli dengan varian mutannya agar lebih sitotoksik tahan terhadap RI.
1.2. Tujuan Penelitian
Penelitian ini bertujuan mengkonstruksi imunotoksin konjugat dari antibodi untai tunggal (scFv) anti-EGFRvIII yang difusi dengan varian mutan
human pancreatic ribonuclease(HPR) mutan dengan dan tanpa penanda GFP dan
2 TINJAUAN PUSTAKA
2.1 Anti EGFR varian III-scFv
Sebuah strategi besar dalam teknologi rekayasa antibodi adalah pembentukan antibodi dari molekul untai tunggal (fragmen scFv). Molekul ini dibuat dari penggabungan antara domain VH dan VL dari mAb (antibodi monoklonal) dengan suatu peptida penghubung fleksibel, yang memungkinkan rekonstitusi dari asosiasi VH/VL seperti molekul aslinya (Gambar 1). Dengan demikian sebuah fragmen antibodi dapat diproduksi dalam bentuk molekul untai tunggal dan spesifitas antigeniknya tetap dipertahankan. Karena ukurannya yang relatif kecil dibandingkan dengan molekul antibodi utuh, fragmen scFv rekombinan memiliki beberapa sifat menguntungkan seperti kemampuan penetrasi terhadap sel tumor lebih tinggi, waktu tinggal dalam plasma lebih cepat, waktu retensi lebih rendah pada jaringan non-target, dan retensi dari sel tumor lebih rendah. Hal tersebut merupakan fitur yang ideal untuk tujuan radioimunodiagnostik. Selain untuk diagnosis tumor, molekul scFv dapat digunakan untuk pengembangan protein khimera immunotoksin dengan merekayasa domain pengikatan antigen yang difusi dengan suatu agen sitotoksik, seperti senyawa obat anti-kanker, radioisotop, atau protein toksin (Binyaminet al.
2006).
Gambar 1 Struktur antibodi dan fragmen antibodi yang dapat dimanfaatkan untuk aplikasi terapetik (diadopsi dari Petersonet al.2008)
Beberapa faktor pertumbuhan dan reseptornya memiliki peranan penting dalam proses pembelahan, proliferasi dan diferensiasi sel. Kemungkinan untuk mengganggu berlangsungnya proses tersebut menjadikan reseptor faktor pertumbuhan sebagai target terapi yang sangat menarik (Kuanet al. 2001). Salah
satu molekul reseptor yang sangat menarik untuk dipelajari adalah Epidermal Growth Factor Receptor (EGFR). Molekul EGFR ditemukan pada awal tahun
1970-an, merupakan suatu reseptor glikoprotein yang berinteraksi dengan
Epidermal Growth Factor(EGF) maupun Transforming Growth Factor-α (TGF -α). Berat molekul EGFR adalah sekitar 170 kDa dan merupakan anggota dari
5
Moscatelloet al.(1995) menunjukkan bahwa EGFR dijumpai pada hampir
semua sel normal. Apabila EGFR digunakan sebagai molekul target dalam penyampaian obat secara terarah maka pengobatan yang dilakukan dapat menyebabkan efek samping yaitu rusaknya sel-sel yang bukan target. Selain itu pengobatan ini juga dapat merusak kekebalan tubuh, dan tubuh menjadi toleran terhadap pengobatan ini. Oleh karena itu diperlukan suatu molekul target yang lebih spesifik yang hanya terdapat pada sel kanker. Salah satu varian mutan EGFR adalah EGFRvIII yang telah mengalami mutasi pada bagian ekstraselularnya. Mutasi yang terjadi adalah delesi 801 pasang basa yang terdapat pada ekson 2-7 pada mRNA. Delesi tersebut mengakibatkan hilangnya asam amino 6-273 pada domain ekstraselular EGFR serta menghasilkan residu glisin pada fusi antara exon-1 dan exon-8. Delesi tersebut mengakibatkan munculnya epitop baru pada daerah ujung-N varian mutan EGFR tersebut, yaitu LEEKKGNYVVTDH (Gambar 2). Delesi tersebut mengakibatkan ukuran molekul EGFRvIII menjadi 145 kDa. Varian mutan EGFR ini tetap memiliki kemampuan untuk terekspresi pada permukaan membran sel karena mutasi terjadi setelah signal peptida (Kuan
et al.2001).
Gambar 2 Skema Struktur Protein pada EGFR Wild-type dan EGFRvIII (diadopsi dari Kuanet al. 2001)
Perbedaan struktur EGFR dengan EGFRvIII dapat dilihat pada Gambar 2. Molekul EGFRvIII bersifat unik dan hanya ditemukan pada sel tumor yang mengalami mutasi tersebut. Oleh karena itu reseptor mutan ini dapat dijadikan sebagai molekul target ideal untuk terapi antikanker. Pendekatan terapi kanker dengan memanfaatkan keunikan dari reseptor mutan EGFR tersebut dapat dikembangkan. Molekul EGFRvIII ditemukan pada permukaan sel beberapa jenis tumor dan dapat dikenali oleh antibodi spesifik anti-EGFRvIII. Molekul EGFRvIII umumnya ditemukan pada sel kanker paru-paru (16%), kanker payudara (78%), dan kanker ovarium (73%). Sedangkan pada kanker prostat ekspresi EGFRvIII meningkat seiring dengan bertambahnya sel kanker. Ekspresi EGFRvIII tidak ditemukan pada sel normal (Pedersen et al. 2001, Gupta et al.
6
2.2Human Pancreatic Ribonuclease(HPR)
Ribonuklease terdiri atas grup enzim heterogen yang mengkatalisis ikatan fosofodiester pada RNA. Beberapa jenis ribonuklease bersifat sitotoksik dan berukuran kecil (10-28 kDa) seperti bovine seminal ribonuclease (BS-RNase), onconaseand amphinase (Benitoet al. 2005; Ardelt et al. 2009). Enzim tersebut
homolog dengan human pancreatic ribonuclease (HPR atau HP-RNase atau
RNase1). Ribonuklease dapat dikelompokkan sebagai toksin karena kemampuannya dalam mendegradasi RNA dan mengakibatkan kematian sel karena menghambat sintesis protein pada sel. Sifat toksisitas RNase diakibatkan oleh aktifitas enzimatik, yaitu kemampuan memotong ikatan fosfodiester pada untai RNA. Ribonuklease mengikat membran sel yang bermuatan negatif, memasuki sel dengan cara endositosis dan mentranslokasi ke sitosol untuk menghindari inhibitor protein ribonuklease dan mendegradasi RNA (Ardelt et al.
2009).
Pada dasarnya RNase tidak bersifat toksik dan tidak mengganggu aktivitas fisiologis. Namun, jika RNase mengalami internalisasi atau difusi dengan suatu molekul ligan atau fragmen antibodi spesifik kemudian mengalami endositosis, maka RNase tersebut akan bersifat sitotoksik. Keunikan sifat dari RNase ini menyebabkan perkembangan penelitian mengenai imunoRNase dengan human pancreatic ribonuclease (HPR atau RNase1) sebagai gugus pembunuh sel.
Penelitian secara in vitro membuktikan bahwa rute intraseluler yang tepat ke
sitosol dan ketahanan terhadap penghambatan oleh inhibitor RNase (RI) merupakan faktor penting yang menentukan keberhasilan imunoRNase konjugat (Mathew & Verma 2009).
Telah terbukti bahwa ribonuklease yang bersifat tidak toksik seperti RNase1 dan angiogenin dapat menjadi sitotoksik jika secara artifisial disalurkan ke badan golgi dengan keberadaan asam retinoik. Setelah mengikat reseptor dan terjadi internalisasi, RNase konjugat terpotong dan dilepaskan secara efisien ke sitosol dan menjadi sitotoksik. Fusi varian RNase yang resisten terhadap RNase inhibitor dengan ligan yang selektif untuk proses endositosis yang efisien ke dalam sitosol merupakan strategi untuk pengembangan imunotoksin yang potensial (Mathew & Verma 2009).
Ekspresi HPR terjadi diberbagai jaringan yang memiliki aktivitas enzimatik dan biologis yang penting, seperti pemotongan untai tunggal RNA, untai ganda RNA, dan untai ganda hibrid RNA–DNA, proses pembentukan RNA, regulasi
homeostasis pembuluh darah, penonaktifan HIV, aktivasi sel dendrit yang belum matang dan induksi produksi sitokin, dan lebih lanjut lagi menunjukkan agen anti-tumor yang potensial (Kövéret al.2000).
7
lain melalui substitusi beberapa asam amino pada RNase 1 dipermukaan simpul untuk menjaga stabilitas konformasi dan aktivitas ribonukleolitik namun mengurangi penghambatan oleh RI (Lelandet al. 2001).
Tabel 1 Struktur primer dari pre-protein HPR dan posisi mutasi pada HPR mutan (diadopsi dari Lelandet al. 2001)
2.3 Imunotoksin dan Sistem Penyampaian Obat Berbasis Antibodi Konjugat
Imunotoksin merupakan protein toksin yang terkonyugasi dengan suatu ligan pengikat. Imunotoksin terdiri dari sekurangnya dua domain yang fungsional, satu untuk mengenali sel target dan yang lainnya untuk membunuh sel setelah terinternalisasi. Imunotoksin pertama kali dipostulatkan oleh Paul Ehrlichs seratus tahun yang lalu yang digambarkan sebagai peluru ajaib (magic-bullets). Strategi
imunotoksin yang digunakan untuk pengobatan kanker dan berbagai gangguan autoimun telah berhasil digunakan. Sejak diketahui adanya keterbatasan pada toksin bakteri, fungi, dan tanaman seperti masalah toksisitas dan imunogenisitas, penelitian terkait imunotoksin yang seluruh bagiannya berasal dari manusia menjadi objek baru yang banyak dipelajari. Perkembangan metode rekayasa antibodi telah memunculkan berbagai format baru imunotoksin (Gambar 3, Madhumathi & Verma 2012).
Secara klasik, imunotoksin diciptakan melalui konjugasi secara kimia antara antibodi dengan protein toksin utuh. Konstruksi yang lebih selektif dilakukan dengan menggunakan protein toksin tanpa domain pengikat alaminya. Protein imunologis yang lebih kecil dari antibodi monoklonal (mAbs), seperti faktor pertumbuhan (growth factors) dan sitokin, umumnya dikonjugasi secara kimia
8
Gambar 3. Format konstruksi imunotoksin (diadopsi dari Madhumathi & Verma 2012).
Molekul EGFRvIII tidak dapat lagi mengikat ligan naturalnya seperti EGF atauTGFαkarena mutasi yang terjadi pada domain pengikatan ligan. Oleh karena
itu antibodi anti-EGFRvIII diperlukan sebagai ligan untuk mengenali molekul target (EGFRvIII). Salah satu kendala dalam terapi antitumor menggunakan antibodi adalah kemampuan penetrasi yang rendah dari molekul antibodi ke dalam jaringan sel tumor. Permasalahan ini dapat diatasi dengan mengurangi ukuran dari molekul antibodi yang digunakan, seperti menggunakan fragmen antibodi. Fragmen antibodi ini dapat dihasilkan dari proses pemotongan enzimatis seperti Fab dan F(ab')2, atau melalui teknik rekayasa genetika untuk menghasilkan scFv
dan sc(Fv)2 (Pedersen et al. 2001). Fragmen antibodi ini berperan sebagai ligan
spesifik sehingga terapi bersifat lebih selektif pada sel kanker.
Sitotoksisitas yang selektif merupakan salah satu tujuan penargetan obat terarah. Protein toksin yang berasal dari tanaman seperti risin, saporin, dan protein antivirus pokeweed (PAP), bekerja secara selektif dengan
menonaktifkan ribosom dan menghambat sintesis protein. Toksin yang berasal dari bakteri seperti toksin difteri (DT), eksotoksin Pseudomonas (PE) bekerja
secara spesifik dengan melakukan ribosilasi ADP (adenosin difosfat) pada protein EF2 (elongation factor 2) sehingga menghambat sintesis protein. Jenis-jenis
toksin tersebut telah dilaporkan difusi dengan suatu antibodi atau ligan pengikat reseptor sehingga menghasilkan suatu senyawa sitotoksik dengan target khusus yang disebut immunotoksin (Pastan et al. 2007). Strategi ini menjadi ide untuk
9
2.4Green Fluorescent Protein(GFP)
Green fluorescence protein (GFP) adalah protein yang ditemukan pada
ubur-ubur (Aequorea victoria) oleh Osamu Shimomura pada tahun 1962 pada saat
meneliti aequorin. Gen GFP berhasil diklon pertama kali pada tahun 1992 oleh
Prasher dan kemudian diketahui terdiri dari 238 asam amino. Ketiga residu asam amino yaitu serin-tirosin-glisin pada posisi 65-67 berperan sebagai gugus kromofor yang menjadikan GFP dapat berfluoresensi (Tsien 1998).
Protein GFP telah diketahui bersifat non toksik dan dapat diekspresikan dalam jumlah yang cukup tinggi pada berbagai organisme yang berbeda dan sama sekali tidak berpengaruh pada efek fisiologinya. Ketika GFP difusikan dengan suatu protein target yang sedang diteliti maka protein tersebut dapat diekspresikan dan tetap aktif. Di sisi lain GFP sendiri tetap berfluoresensi.
Karena sifatnya tersebut, GFP memiliki peranan yang sangat penting dalam penelitian di bidang biologi. GFP dapat digunakan sebagai penanda dalam mempelajari proses-proses yang terjadi di dalam sel seperti proses transfer protein, mempelajari organel-organel yang terikat pada membran sel dan juga bermanfaat dalam proses pencitraan sel serta jaringan (Bell et al. 2007, Yang et al. 1996, Feilmeieret al. 2000, Huanget al. 2006).
Selain dapat diekspresikan pada E.coli dan Caenorhabditis elegans, GFP
juga berhasil diekspresikan pada ragi Sacharomyces cerevisiae dan sel mamalia
(Tsienet al, 1998). Pada saat yang bersamaan juga diketahui bahwa GFP berhasil
diekspresikan pada Drosophila melanogaster. Penemuan-penemuan tersebut
menunjukkan bahwa GFP dapat diekspresikan pada keempat jenis organisme model sehingga GFP dapat digunakan sebagai penanda genetik universal dalam penelitian di bidang biologi. Tavaré et al. (2001) mereview penggunaan penanda
GFP untuk mempelajari sinyal intraseluler. Keuntungan utama dari GFP adalah kemampuannya dalam menunjukkan fluoresensi intrinsik tanpa membutuhkan senyawa lain, dimana untuk sebagian besar protein fluorescent lainnya diperlukan adanya kofaktor. GFP dapat digunakan untuk lokalisasi dan distribusi protein secara langsung dalam sel hidup dan real time menggunakan mikroskop
fluoresensi. GFP juga dapat dimanfaatkan dalam mempelajari metabolisme lipid, interaksi protein-protein dalam sel hidup, dan memantau sifat fisikokimia lain dari protein dalam sel.
2.5Pichia pastorisdan vektor ekspresi pPICZα
10
yang dihasilkan bebas dari kontaminasi, stabil dan memiliki aktivitas biologis (Daly & Hearn 2005).
Pichia merupakan khamir metilotropik yang sudah lama dipelajari dan
dikembangkan menjadi suatu sistem yang berhasil dalam memproduksi berbagai protein heterolog. Sistem ekspresi P. pastoris sangat populer digunakan karena
beberapa faktor yang menarik seperti : (a) teknik rekayasa molekuler yang relatif mudah dilakukan dan kesamaan karakteristik dengan Saccharomyces cerevisiae;
(b) kemampuan P. pastoris untuk memproduksi protein heterolog dengan tinggi
secara intraseluler maupun ekstraseluler; (c) kemampuan melakukan modifikasi pasca-translasi seperti glikosilasi, pembentukan ikatan disulfida dan proses proteolitik; (d) tersedianya kit komersial untuk sistem ekspresi (Cereghino & Cregg 2000; Balamuruganet al. 2007; Liet al.2007).
Galur P. pastoris telah terbukti menjadi salah satu sistem yang baik dan
terstandar yang digunakan untuk produksi protein rekombinan secara komersial. Salah satu keuntungan dari sistem ini adalah adanya promotor AOX1. Promoter ini memiliki karakteristik transkripsi untuk mengatur ekspresi protein heterolog.
P. pastoris telah memiliki metode yang mapan untuk dimanipulasi baik secara
klasik maupun melalui rekayasa genetika. P. pastoris telah digunakan untuk
memproduksi protein dalam skala besar dengan kepadatan sel yang tinggi dalam kultur fermentor, sehingga menjadi sistem acuan yang banyak digunakan untuk tujuan meningkatkan ekspresi protein rekombinan. Sistem ekspresi P. pastoris
telah dikenal aman dan murah untuk produksi skala laboratorium dan industri (Balamuruganet al. 2007).
Glikosilasi merupakan salah satu proses penting pascatranslasi dalam sintesis protein. Peran glikosilasi protein diantaranya untuk pelipatan protein, perakitan oligomer, menjaga stabilitas struktur, transduksi sinyal spesifik, proses pengenalan dan sekresi, dan glikoproteinclearance (Liet al. 2007). Glikoprotein
yang dihasilkan dariP. pastorisberpotensi untuk memicu respon imun, namun P. pastoris dapat mensekresikan protein heterolog yang memiliki pola glikosilasi
yang menyerupai manusia (humanizing). Pola glikosilasi yang mirip seperti
ukuran dan posisi dari glikosida akan mempengaruhi aktivitas protein. Banyak penelitian terkait glikoprotein yang diproduksi padaP. pastorisyang menjelaskan
hubungan struktur dan fungsi dari N-glikan sehingga akan mempercepat aplikasi terapi pada manusia (Patricket al.2005).
GalurP. pastoris SMD1168 (his4 pep4) merupakan galur defisien protease.
Galur ini terbukti efektif dalam meminimalisasi degradasi ekspresi protein heterolog. Hal ini terlihat pada kultur fermentor yang menghasilkan kombinasi antara densitas sel yang tinggi dan persentase yang rendah dari sel yang lisis menghasilkan konsentrasi yang relatif tinggi dari protease vakuolar. Pemilihan vektor ekspresi yang resisten terhadap zeocin untuk menghasilkan strain tanpa aktifitas protease A (Invitrogen 2010).
Penggunaan P. pastoris sebagai sistem ekspresi protein rekombinan
mempertimbangkan beberapa faktor. Salah satunya yaitu sistem pengekspresi yang lebih kompleks, dapat mengekspresikan gen tandem, dan dapat digunakan untuk penelitian multi salinan gen. Beberapa aspek seperti faktor genetik dan fisiologis dariPichia sehingga digunakan sebagai inang pengekspresi diantaranya
11
yang efisien, sinyal translasi, translokasi yang ditentukan oleh sinyal sekresi, pengolahan dan pelipatan protein dalam retikulum endoplasma dan badan golgi. PAOX1 adalah promotor dari gen AOX1 (alcohol oxidase 1) yang banyak
digunakan. PAOX1 sangat direpresi dengan keberadaan sumber karbon seperti
glukosa, gliserol, etanol dan sebagian besar sumber karbon lainnya, namun dapat diinduksi secara kuat oleh kehadiran metanol. Alkohol oksidase merupakan enzim pertama dari jalur asimilasi metanol yang mengkatalisis oksidasi terhadap formaldehida. Pichia memiliki dua gen penyandi alkohol oksidase, yaitu AOX1
dan AOX2. Sekitar 85% dari aktivitas alkohol oksidase diatur oleh gen AOX1, sedangkan sisanya oleh gen AOX2. Konsentrasi enzim alkohol oksidase bisa mencapai 30% dari protein total sel pada saat tumbuh pada media yang mengandung metanol (Valero 2013).
Vektor ekspresi pPICZα dapat memproduksi protein rekombinan secara
ekstraseluler pada P. pastoris dengan tingkat ekspresi yang tinggi (Gambar 4).
Vektor ini mengandung beberapa komponen seperti promotor AOX1 (5’AOX1),
sinyal sekresi factor-, situs restriksi unik, penanda protein (protein tag) yaitu c-myc dan 6xHis, sekuen terminasi transkripsi (AOX1 TT), gen resistensi terhadap
zeocin, dan sekuen replikasi DNA pada E. coli (pUC ori). Promotor AOX1
(PAOX1) dapat diinduksi oleh metanol dan fragmen ini juga merupakan target
integrasi plasmid pada lokus promotor AOX1. Sinyal sekresi faktor-α
memungkinkan sekresi protein secara efisien dariPichia. Situs restriksi yang unik
digunakan untuk penyisipan gen ke dalam vektor. Penanda protein c-mycepitope
berfungsi untuk deteksi protein rekombinan. Penanda polihistidin (6xHis) berfungsi untuk deteksi dan purifikasi protein rekombinan. AOX1 TT merupakan
sinyal terminasi transkripsi yang memungkinkan prosesing mRNA secara efisien serta poliadenilasi. Promotor TEF1 merupakan promoter gen faktor transkripsi
elongasi 1 (berasal dari Saccharomyces cerevisiae) yang mendorong ekspresi gen Sh ble di Pichia untuk resistansi terhadap zeocin. EM7 (promoter sintetik untuk
prokariot) merupakan promotor konstitutif yang mendorong ekspresi genSh bledi E. coliuntuk resistansi zeocin.
Gambar 4 Peta vektor pPICZα(Invitrogen 2010)
Gen Sh ble(Streptoalloteichus hindustanus bleomycin) merupakan gen resistansi
12
pUC origin memungkinkan replikasi DNA plasmid pada E. coli. Situs restriksi SacI,PmeI, atauBstX I merupakan situs restriksi yang unik yang memungkinkan
linearisasi dari vektor pada lokus AOX1 agar integrasi plasmid ke dalam genom
Pichiadapat berlangsung secara efisien (Invitrogen, 2010).
Pichiatelah digunakan secara luas sebagai sel inang untuk produksi protein
rekombinan dalam skala besar. Banyak protein yang penting dalam farmasi berupa suatu glikoprotein (mengandung O- atau N-glikosilasi), sehingga memerlukan sel inang untuk ekspresi protein yang dapat menghasilkan oligosakarida yang terikat pada molekul protein. Jalur N-glikosilasi pada P. pastorisdapat direkayasa tanpa mengorbankan kelangsungan hidup sel inang. Hal
ini karena sel itu sendiri harus menggunakan N-glikosilasi untuk sintesis dinding selnya. Pola glikosilasi pada P. pastoris memiliki potensi untuk dimodifikasi
melalui rekayasa genetika untuk menghasilkan kompleks N-linked oligosakarida
3 BAHAN DAN METODE
3.1 BahanMikroorganisme yang digunakan dalam penelitian ini adalah Escherichia coli TOP 10 F’, E.coli DH5α, dan Pichia pastoris SMD 1168H. Plasmid yang digunakan adalah pPICZαA (Invitrogen), pJ201-scFv (DNA 2.0), pEGFP-1(Clontech). Semua primer DNA yang digunakan dalam penelitian dipesan dari 1st Base (Tabel 2). Gen anti-EGFRvIII scFv dan HPRmut dibuat secara sintetik oleh DNA 2.0. Peta konstruksi plasmid pPICZ-scFv-HPR dan pPICZ-scFv-GFP-HPR disajikan pada Gambar 5.
Tabel 2 Primer yang digunakan untuk konstruksi fusi gen dan analisis vektor rekombinan.
HPRmut-F 5’- AGTGCTATCCTCCACTGA AGC-3’
HPRmut-R 5’-AAAGAGTCTTGTGCTAAAAAGTTTCAA-3’
Gambar 5 Peta konstruksi fusi gen scFv danHPRdi dalam plasmidpPICZα -scFv-HPR (A) danpPICZα-scFv-GFP-HPR (B). 5'AOX1 = promoter alkohol oksidase; α-faktor = sinyal sekresi; scFv = anti-EGFRvIII scFv; GFP = green fluorescent protein (gen reporter); HPR = human pancreatic ribonuclease (RNase); L= Linker; c-myc = epitop myc; 6xHis =
14
3.2 Metode Penelitian
Penelitian ini dilakukan melalui dua tahap, yaitu : a) konstruksi protein fusi, b) ekspresi protein fusi pada P. pastoris. Protein fusi dilakukan dengan 2
konstruk, yaitu 1) anti-EGFRvIII scfv dengan HPRmut, 2) anti-EGFRvIII scFv
-GFP dengan HPRmut.
3.2.1 Subkloning gen anti-EGFRvIIIscFvke dalam plasmid pPICZαA
Gen scFv anti-EGFR-vIII (Weber, 2009) terintegrasi dalam vektor pJ201. Untuk keperluan kloning, gen scFv diamplifikasi dengan teknik PCR dengan dua tahap PCR. Tahap pertama menggunakan primer VH101-F dan VL101-R. Pada tahap kedua, fragmen gen tersebut diamplifikasi kembali menggunakan pasangan primer yang mengandung situs restriksi XhoI yaitu VH-101-F-NdeXho dan
VL101-R-NdeXho. Fragmen gen tersebut kemudian dipotong menggunakan
enzim XhoI dan dielektroforesis. Selanjutnya gen diisolasi dan dipurifikasi dari
gel agarosa. Gen scFv diklon ke vektor ekspresi pPICZα pada situs XhoI tepat
setelah sekuen sinyal sekresi faktor-α dan menghasilkan plasmid rekombinan pPICZα-scFv. Selanjutnya plasmid ini dianalisis dan disekuen. Analisis sekuen dilakukan oleh penyedia jasa sekuensing. Satu klon plasmid dengan sekuen yang benar digunakan untuk subkloning berikutnya, yaitu klon pPICZ-scFv no 41 (Lampiran 1 dan 2).
3.2.2 Subkloning genGFPke dalam plasmidpPICZα-scFv
Gen GFP diisolasi dari plasmid pEGFP-1 (Clontech) menggunakan teknik
PCR dengan dua tahap PCR. Tahap pertama menggunakan pasangan primer EGFP-F dan EGFP-R. Pada tahap kedua, fragmen gen tersebut diamplifikasi kembali menggunakan pasangan primer yang mengandung situs restriksi ClaI
yaitu EGFP-F-G4S-ClaI dan EGFP-R-ClaI. Fragmen DNA hasil PCR dipurifikasi dengan kit kolom purifikasi DNA (GeneAid). Fragmen gen GFP dan plasmid pPICZα-scFv dipotong dengan enzimClaI (Thermo). Fragmen DNA hasil potong
dipurifikasi kembali dengan teknik gel elektroforesis, dan diekstraksi dari gel dengan kit kolom purifikasi DNA dari gel. Gen GFP dan plasmid pPICZα-scFv diligasi dan ditransformasi ke dalam E. coli TOP10 F' menurut protokol umum
biologi molekuler. E. coli transforman diseleksi pada medium LS-LB (Low Salt -Luria Broth, Lampiran 3) agar yang mengandung zeocin (25 µg/ml). E. coli
transforman dianalisis dengan teknik PCR koloni. Klon yang positif mengandung DNA sisipan selanjutnya dianalisis, plasmid rekombinan diekstraksi dan dianalisis urutan nukleotida.
3.2.3 Subkloning genHPRke dalam plasmidpPICZα-scFvdan pPICZα-scFv-GFP
Gen HPRmut (Leland et al. 2001) terintegrasi dalam pJ912: 72500, dibuat
secara sintetik oleh DNA 2.0 Inc. Untuk keperluan kloning, genHPRmutdiisolasi
15
gen tersebut diamplifikasi kembali menggunakan pasangan primer yang mengandung situs restriksiXbaI yaitu HPRmut-F-G4S-Xba dan
HPRmut-R-Xba-mod. Amplifikasi menggunakan PCR dilakukan dengan total volume 50 µl, yang mengandung 1 µl DNA cetakan, 20 pmol primer, 0.2 mM dNTPs, 0.4 µl Phire hot start DNA polimerase (Thermo), dan dH2O. Fragmen gen HPRmut dan plasmid
pPIC-scFv-GFP dipotong dengan enzim XbaI (Thermo). Fragmen DNA hasil
potong dielektroforesis, dipurifikasi dan diekstraksi dari gel dengan kit kolom purifikasi DNA (GeneAid). GenHPRmutdan plasmid pPICZα-scFv-GFP diligasi dan ditransformasi ke dalam E. coli TOP10 F' menurut protokol umum biologi
molekuler (Ausubel, 2002). E. coli transforman diseleksi pada medium LS-LB
agar dan zeocin (25 µg/ml), Lampiran 2. E. coli transforman dianalisis dengan
teknik PCR koloni menggunakan pasangan primer AOX1-F dan AOX1-R. Volume reaksi PCR adalah 20 µl, terdiri dari 1 µl DNA cetakan, 20 pmol primer, 0.2 mM dNTPs, 0.5 µl Dream Taq DNA polimerase (Thermo), dan dH2O. Klon
yang positif mengandung DNA sisipan selanjutnya dianalisis untuk menentukan orientasi gen dengan cara PCR menggunakan pasangan primer HPRmut-F dan AOX1-R. Plasmid rekombinan yang diperoleh dianalisis potong menggunakan enzim restriksiXbaI (Thermo) dan dianalisis urutan nukleotidanya (di1stBase).
3.2.4 TransformasiP.pastorisdan seleksi sel transforman
Plasmid rekombinan pPICZαA-scFv-GFP-HPR dilinierisasi dengan enzim SacI (Thermo). Transformasi pada sel khamir dilakukan dengan teknik
elektroporasi dilakukan berdasarkan protokol dari Invitrogen dengan beberapa modifikasi. Sebanyak 0,5 μ g DNA yang telah dilinierisasi dengan enzim SacI dimasukkan ke dalam 60 μ L sel kompeten P. pastoris strain SMD1168H dalam
kuvet elektroporasi (2 mm gap), diinkubasi dalam es selama 2 menit. Campuran sel dan DNA dalam kuvet selanjutnya diberi kejut listrik menggunakan Gene
Pulser ΙΙ (Bio-Rad, Hercules, CA) dengan kondisi sebagai berikut: tegangan (V)
2.5 kV, kapasitor (C) 50 μ F, tahanan (R) 200 Ω . Koloni hasil transformasi
diseleksi dalam media seleksi YPDS agar zeo (Yeast ekstrak pepton dektrosa sorbitol agar, Lampiran 2) yang mengandung 100 μ g/ml zeocin (Invitrogen).
3.2.5 SeleksiP.pastoristransforman
Seleksi sel P. pastoris transforman yang stabil dilakukan dengan cara
16
3.2.6 Ekspresi protein padaP. pastoristransforman
Setelah dilakukan proses seleksi, selanjutnya dilakukan uji ekspresi protein rekombinan dari beberapa galur transforman berdasarkan prosedur pada manual
Pichia Expression Kit versi G (Invitrogen). Kultur P. pastoris transforman dan
non-transforman (nt) masing-masing ditumbuhkan pada media agar miring YPDAzeo dan YPDA. Satu ose kultur galur transforman dan galur non-transforman masing-masing ditumbuhkan dalam 2 ml media YPD cair yang mengandung zeocin atau tanpa zeocin. Kultur diinkubasi pada suhu 30°C dengan agitasi 250 rpm selama 24 jam. Kultur yang telah tumbuh selanjutnya diinokulasikan ke dalam 25 ml media produksi BMGY (1% ekstrak khamir, 2% pepton, 100 mM dapar potassium fosfat pH 6.0, 1.34% YNB, 4×10-5% biotin, 1% gliserol, Lampiran 2).
Kultur diinkubasi pada suhu 30°C dengan agitasi 250 rpm selama 24 jam. Setelah 24 jam kultur dipanen, biomasa sel dipisah dari media BMGY dan dipindahkan ke dalam media induksi BMMY (1% ekstrak khamir, 2% pepton, 100 mM dapar potassium fosfat pH 6.0, 1.34% YNB, 4×10-5 % biotin, 0.5% metanol). Biomassa sel (pelet) dan media kultur (supernatan) dipisahkan dengan cara sentrifugasi (5000 rpm, 15 menit, 4°C). Media kultur disingkirkan sedang biomasa sel diresuspensi dengan 5 ml media BMMY. Suspensi sel dipindahkan ke dalam 25 ml media BMMY yang baru dengan nilai OD600 awal = 1. Metanol
ditambahkan dengan konsentrasi 0,5% (v/v) ke dalam kultur setiap 24 jam selama 3 hari. Kultur diinkubasi pada suhu 30°C dengan agitasi 250 rpm selama 2 hari. Pengambilan contoh dilakukan setiap 24 jam setelah diinduksi dengan metanol dan OD600nmsel diukur. Kultur sel transforman dipanen dengan cara sentrifugasi
(10.000 rpm, 15 menit, suhu 4°C). Biomasa sel disimpan pada suhu –20°C dan
medium kultur bebas sel (supernatan) disimpan pada suhu 4°C untuk digunakan dalam analisis protein lebih lanjut. Sampel protein dianalisis dengan SDS-PAGE dan imunobloting (slot blot atau western blot).
3.2.7 Pengujian insersi fusi gen pada genomPichia
Pichia transforman dianalisis dengan teknik PCR koloni untuk mengetahui
insersi fusi gen. Koloni PCR terhadap fusi gen scFv::HPR dilakukan menggunakan 2 reaksi PCR masing-masing menggunakan pasangan primer VH101F/VL101R dan HPR F/HPR R. Sedangkan untuk fusi gen scFv::GFP::HPR menggunakan pasangan primer VH101-F dan HPRmut-R. Volume reaksi PCR adalah 25 µl, terdiri dari 4 µl DNA cetakan, 2× PCRbuffer, 75 pmol primer, 1 µl
3G Plant polimerase (KAPA), dan dH2O. Siklus PCR ditetapkan 40 siklus.
3.2.8 Pengamatan sel dengan mikroskop fluoresen
Sel P. pastoristransforman mengandung gen GFP yang terfusi dengan gen
antibody (scFv) dan gen HPR. Konstruksi fusi gen tersebut terintegrasi ke dalam
17
methanol, dilakukan menggunakan mikroskop fluoresen (Carl Zeiss, Apotome-2) dengan perbesaran 40×. Sel diamati menggunakan filter FITC.
3.2.9 Analisis ekspresi protein rekombinan dengan teknik imunoblotting (slot blot) dan SDS PAGE
Analisis protein dilakukan terhadap protein ekstraseluler yang dihasilkan. Analisis protein rekombinan dilakukan menggunakan metode slot blot dan SDS-PAGE. Komposisi gel akrilamid dan larutan dapar SDS PAGE pada Lampiran 4. Supernatan sel kultur dipanen dengan cara disentrifugasi kemudian dipresipitasi dengan larutan TCA (trichloro acetic acid). Sampel protein rekombinan dianalisis
menggunakan teknikslot blot. Sampel proein ditransfer ke membran nitroselulosa
melalui proses vaccum. Setelah itu membran diinkubasi dengan 5% susu bebas
lemak (blocking) yang dilarutkan dalam PBS (phospate buffered saline)-Tween20
selama 1 jam. Kemudian membran dicuci (washing) dengan PBS-Tween20
selama 5 menit diulang 3 kali. Membran diinkubasi dengan 2 µl antibodi primer (anti-His) dalam 10% susu bebas lemak dalam PBS-Tween20 selama 1 jam. Setelah itu, membran dicuci dengan PBS-Tween20 selama 5 menit sebanyak 3 kali. Membran diinkubasi kembali dengan antibodi sekunder (anti-mouse IgG) dalam 10% susu bebas lemak selama 1 jam. Membran dicuci kembali dengan PBS-Tween20 selama 5 menit sebanyak 3 kali. Untuk proses deteksi membran diinkubasi dengan larutanstainingyang mengandung substrat alkaline peroxidase.
3.2.10 Purifikasi protein rekombinan menggunakan kromatografi kolom afinitas
Sampel protein rekombinan pada medium kultur bebas sel (supernatan) dipekatkan menggunakan amonium sulfat. Sebanyak 70 ml sampel dipresipitasi dengan amunium sulfat dengan konsentrasi saturasi 80%. Sampel ditempatkan pada labu erlenmeyer, ditambahkan 37,3 gr ammonium sulfat sedikit-demi-sedikit serta diaduk sampai larut dengan batang pengaduk magnet pada suhu 4°C. Setelah larut seluruhnya, sampel protein diinkubasi selama semalam pada suhu 4°C. Sampel dipindahkan ke dalam tabung sentrifus dan disentrifugasi (10.000 rpm, 10 menit, 4°C). Supernatan disingkirkan, sedang endapan protein (pellet) dilarutkan dengan 1ml dapar fosfat 50mM pH 7,4. Sampel hasil presipitasi (1,5ml) didialisis menggunakan tabung dialisis dengan pori 3.500 Da (Spectra/Por®Dialysis Membrane) terhadap dapar fosfat 50mM pH 7,4.
Purifikasi dengan kromatografi afinitas dilakukan metode IMAC (immobilized-metal affinity chromatography). Beberapa persiapan dilakukan
18
diendapkan kemudian dibilas untuk purifikasi protein rekombinan. Aliran sampel (FT) ditampung. Selanjutnya matriks dibilas dengan 5×CV dapar pencuci. Fraksi
washing (W) ditampung dan difraksinasi setiap 1×CV (w1, w2, w3, w4, w5).
Kemudian sampel dielusi dengan dapar elusi yang mengandung 100 mM imidazol. Fraksi elusi (E) ditampung setiap 1×CV (e1 – e8). Protein hasil
4 HASIL DAN PEMBAHASAN
4.1 Konstruksi Protein Fusi anti-EGFRvIIIscFvdengan HPRmut
4.1.1 Subkloning gen anti-EGFRvIIIscFvke dalam plasmid pPICZαA
Plasmid pPICZα yang mengandung gen anti-EGFRvIIIscFv (pPICZα
A-scFv-41) telah berhasil dikonstruksi dan dan dilaporkan Hertati (2013). Gen scFv
diinsersikan pada situs XhoIsetelah sinyal sekresi mating factor-α (MF-α) untuk
sekresi protein rekombinan keluar sel. Plasmid pPICZα-scFv telah diverifikasi
dengan teknik sekuensing dan selanjutnya digunakan dalam kontruksi fusi protein antibodi. Plasmid ini digunakan untuk mengkonstruksi fusi protein scFv::HPR. Fusi protein scFv::HPR memiliki ukuran yang relatif kecil sehingga diharapkan dapat bekerja efektif dalam penargetan terhadap sel atau jaringan tumor. Plasmid
pPICZα-scFv klon no.41 telah dikonfirmasi baik dari ukuran plasmid, sekuen gen,
dan posisi gen dalam plasmid. Selanjutnya klon plasmid ini digunakan dalam subkloning gen berikutnya. Vektor pPICZα dipilih dan digunakan karena
diharapkan dapat mengekspresikan dan mensekresikan protein fusi rekombinan yang sangat kompleks yang dikonstruksi dalam penelitian ini pada sel inang P. pastoris. Protein fusi scFv::HPR sangat kompleks karena masing-masing domain
protein fusi tersebut memiliki lebih dari satu ikatan disulfida.
4.1.2 Subkloning genHPRke dalam plasmidpPICZα-scFv
Gen HPR telah berhasil disisipkan ke dalam plasmid pPICZα yang
mengandung gen anti-EGFRvIII scFv. Seleksi koloni transforman dilakukan
dengan metode PCR koloni terhadap 100 koloni transforman dengan pasangan primer HPR-F dan HPR-R untuk mendeteksi gen HPR yang terinsersi dalam plasmid.
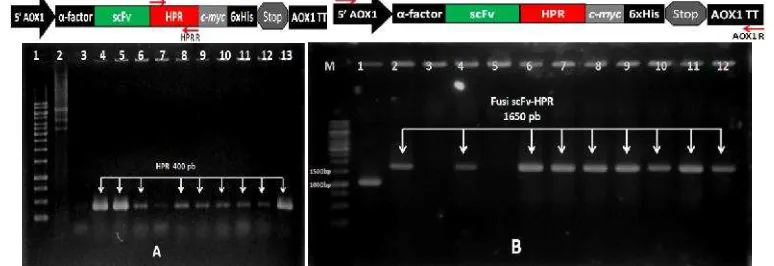
Gambar 6 Elektroforegram hasil PCR untuk seleksi plasmid rekombinan pPICZ
-scFv-HPR pada E. coli transforman. A. Analisis PCR koloni untuk
seleksi genHPRmenggunakan primer HPR-F dan HPR-R. 1= penanda
DNA; 2= kontrol negatif; 3-13= klon E. colitransforman. Klon positif
ditunjukkan dengan adanya pita DNA berukuran 400 pb. B. Analisis PCR koloni untuk seleksi fusi gen scFv::HPR menggunakan primer
AOX-F dan AOX-R. M= penanda DNA; 1= kontrol negatif; 2-12= E. coli transforman. Klon positif ditunjukkan dengan adanya pita DNA
20
Sampel yang positif menghasilkan produk PCR sekitar 400 pb (Gambar 6A). Hasil dari PCR koloni didapatkan 90 dari 100 koloni positif tersisip gen
HPR. PCR koloni juga dilakukan untuk konfirmasi bahwa fusi gen scFv::HPR
telah terbentuk dengan menggunakan pasangan primer AOX1-F dan AOX1-R. Koloni yang diuji sebanyak 90 klon hasil PCR koloni sebelumnya. Klon yang positif menghasilkan produk PCR sekitar 1650 pb (Gambar 6B). Hasil analisis menunjukkan bahwa73 dari 90 koloni positif mengandung fusi genscFv::HPR.
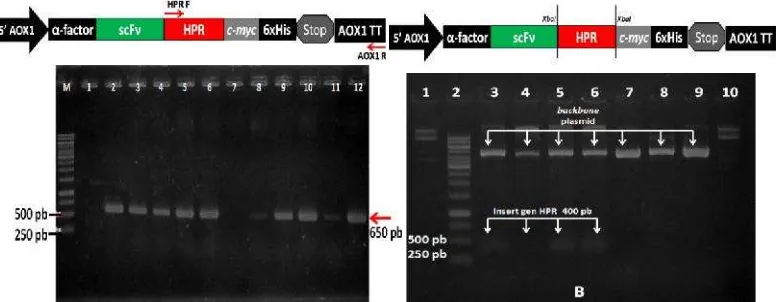
Orientasi genHPRdalam plasmid diperiksa dengan teknik PCR dan analisis
restriksi. Analisis PCR menggunakan pasangan primer HPR-F dan AOX1-R terhadap 73 klon yang diduga telah terinsersi gen HPR. Klon yang mengandung
gen sisipan dengan orientasi yang benar menghasilkan pita berukuran sekitar 650pb (Gambar 7A). Dari hasil analisis diperoleh 42 koloni yang positif. Analisis restriksi menggunakan enzim XbaI menghasilkan 8 klon positif yang terpotong
(Gambar 7B).Selanjutnya tiga dari delapan klon tersebut dianalisis lebih lanjut terhadap urutan nukleotidanya. Satu klon dengan urutan nukleotida yang benar telah diperoleh, yaitu klon scFv-HPR44 (Lampiran5). Riccio et al. (2012),
melaporkan menggunakan teknik yang sama untuk mengkonstruksi fusi RNase dan fragmen antibodi dengan ErbB2 receptor sebagai molekul targetnya yaitu
ERB–HP-DDADD-RNase. Konstruk tersebut di subklon ke dalam vektor
pET22b+ dan diekspresikan pada E. coli BL21(DE3). Molekul imunoRnase ini
dilaporkan mampu menunjukkan aktivitas biologis baik pada domain antibodi maupun domain RNasenya.
Gambar 7 Elektroforegram hasil PCR koloni (A) dan digesti plasmid (B) untuk seleksi plasmid rekombinan mengandung fusi gen scFv::HPR. A.
Analisis PCR koloni untuk konfirmasi orientasi gen HPR
menggunakan primer HPR-F dan AOX-R. M= penanda DNA; 1= kontrol negatif; 2-12= E. coli transforman. Klon positif ditunjukkan
dengan adanya pita DNA berukuran 650 pb. B. Analisis restriksi plasmid rekombinan menggunakan enzim XbaI.; 1= kontrol negatif;
2= penanda DNA; 3-10: plasmid rekombinan. Klon yang positif ditunjukkan dengan adanya potongan DNA berukuran 400 pb.
Gen HPR telah berhasil difusikan pada ujung-C dari scFv pada plasmid
pPICZα-scFv. Gambar 8 menunjukkan peta konstruksi fusi genscFv::HPRdalam
21
sekresi faktor- (factor-). Sebuah linker (L) atau peptida penghubung
ditempatkan diantara fragmen antibodi dan gen HPR yang dimaksudkan untuk
memberikan ruang yang cukup bebas dan meminimalkan kendala hambatan sterik diantara kedua domain tersebut. Fragmen scFv ditempatkan pada ujung-N dari HPR agar lebih mudah dijangkau daripada posisi diujung-C. Posisi relatif fragmen antibodi dan HPR ini sama dengan penelitian yang dilakukan oleh Lorenzo et al.
(2004) yang memfusi fragmen anti-ErbB2 scFv dengan HPR dan penelitian
Riccio et al. (2012) yang membuat protein khimera anti-ErbB2 scFv Erbicindan
HPR.
Gambar 8 Peta konstruksi fusi gen scFv::HPR dalam plasmid pPICZα-scFv.
5’AOX1= promoter alkohol oksidase; α-faktor = sinyal sekresi; scFv=
fragmen antibodi; L= linker, GGGSIDSRGGGGS; HPR= human pancreatic ribonuclease; c-myc= penanda myc; 6×His= polihistidin tag; STOP= kodon stop; AOX1TT= sekuen terminator alkohol
oksidase.
4.1.3 Transformasi dan seleksiP.pastoris
Plasmid pPICZα-scFv-HPR rekombinan dengan sekuen yang telah
dikonfirmasi dilinierisasi dengan enzim SacIkemudian ditransformasi ke dalam P. pastoris SMD1168H. Protein rekombinan yang diekspresikan merupakan
preprotein dari fusi protein yang mengandung sinyal sekresi faktor-αdan sekuen
penanda myc epitope dan 6×His tag pada ujung-C. Dari hasil transformasi
diperoleh 27 koloni independen P. Pastoris transforman dengan efisiensi
transformasi sebesar 0,54 x 102 cfu/µg DNA.Perhitungan efisiensi transformasi dapat dilihat pada Lampiran 6. Efisiensi transformasi tersebut termasuk sangat rendah dibandingkan dengan tingkat efisiensi yang disebutkan dalam referensi bisa mencapai 103 sampai 104cfu/µg DNA (Invitrogen 2010). Faktor-faktor yang
menyebabkan rendahnya tingkat efisiensi transformasi diantaranya yaitu jumlah DNAyang rendah, banyaknya pengotor dalam DNA, volume DNA yang berlebih, penghambatan transformasi dari proses ligasi, sel kompeten yang kurang baik, bahan kimia yang digunakan untuk sel kompeten yang kurang baik, teknik elektroporasi yang tidak sesuai, sel yang digunakan untuk kompeten sel yang kurang baik pertumbuhannya dan atau pertumbuhannya terlalu tinggi (Hornstein 2012). Pada eksperimen transformasi ini jumlah DNA yang digunakan hanya 500 ng. Jauh lebih sedikit dari jumlah DNA yang disarankan, yaitu antara 1 sampai 5g (Invitrogen 2010).
22
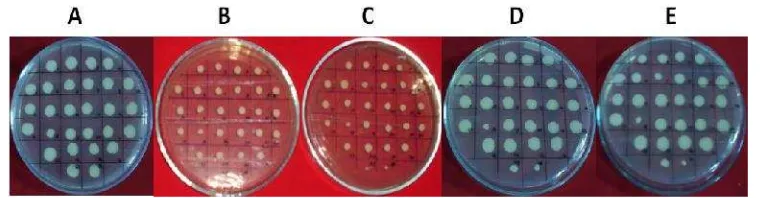
Gambar 9 Uji kestabilan genetik dan seleksi insersi gen ganda pada koloni yeast transforman pada media YPDAzeo, dengan konsentrasi zeocin bertingkat: 0 µg/ml (A), 100 µg/ml (B), 200 µg/ml (C), 500 µg/ml (D), dan 1000 µg/ml (E).
Analisis multikopi gen dilakukan dengan menumbuhkan koloni transforman tunggal pada media YPDAzeo yang mengandung zeocin 100, 200, 500, dan 1000µg/ml (Gambar 9). Sebagai kontrol digunakan media YPDA tanpa zeocin. Klon-klon transforman yang dihasilkan memiliki kemungkinan beragam dalam jumlah salinan gen atau plasmid yang terintegrasi ke dalam DNA genom. Untuk menguji klon-klon yang mengandung jumlah salinan gen beragam, klon transforman tersebut diidentifikasi dengan menumbuhkan transforman tersebut pada medium yang mengandung antibiotik zeocin secara bertingkat. Semua koloni transforman tumbuh baik pada media kontrol dan media dengan zeocin 100 µg/µl. Pada konsentrasi zeocin 200 dan 500 µg/ml beberapa koloni mulai terlihat terhambat pertumbuhannya danhanya sekitar 93% dari jumlah klon tersebut yang tumbuh dengan baik.Sedangkan pada konsentrasi zeocin 1000 µg/ml, hanya sekitar 70% dari klon transforman tersebut yang dapat tumbuh dengan baik.Dalam penentuan jumlah salinan gen, Nordén et al. (2011) mengemukakan bahwa
terdapat variasi dalam toleransi terhadap antibiotik. Hal tersebut dikarenakan adanya perbedaan dalam jumlah gen rekombinan diantara klon transforman Dengan asumsi bahwa gen Sh ble yang tergabung pada rasio yang sama dengan
fragmen gen target, diperkirakan 1 salinan gen Sh ble (gen resistensi zeocin)
merupakan syarat minimum untuk dapat tumbuh pada konsentrasi zeocin 100 µg/ml, 4 salinan gen untuk tumbuh pada konsentrasi 500 µg/ml dan 9 salinan gen untuk tumbuh pada konsentrasi 1000 µg/ml. Klon dengan salinan gen Sh ble
sebanyak 17 salinan juga dilaporkan pada klon tarnsforman yang mampu tumbuh pada konsentrasi zeocin sebesar 2000 µg/ml (Nordénet al. 2011).
Plasmid pPICZα yang mengandung fusi gen scFv::HPR telah berhasil
diintegrasikan ke dalam genom P. pastoris. Analisis terhadap genom DNA
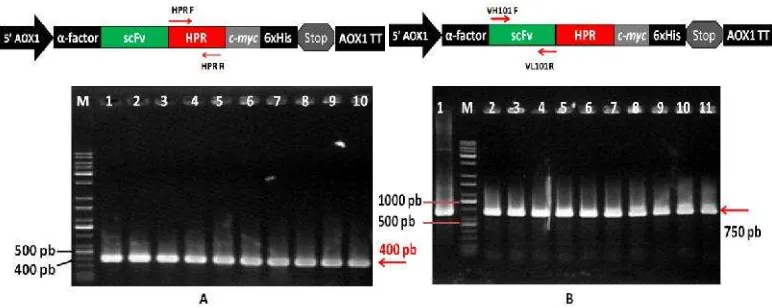
transforman dilakukan dengan metode PCR koloni terhadap 10 klon P. pastoris
transforman. Dua pasang primer digunakan untuk konfirmasi integrasi gen HPR
dan scFv dalam genom P. pastoris, yaitu pasangan primer HPR-F / HPR-R dan
VH101-F / VH101-R. Hasil PCR koloni dari 10 transformanP. pastoristersebut
menunjukkan bahwa semua klon yang dianalisis memberikan pita DNA berukuran 400 pb (Gambar 10A) dan 750 pb (Gambar 10B). Pita berukuran 400 pb adalah genHPR, sedangkan pita berukuran 750 pb adalah gen scFv. Dari hasil PCR ini
23
Gambar 10 Elektroforegram hasil PCR koloni untuk konfirmasi insersi fusi gen
scFv::HPR dalam genom P. pastoris transforman. A. PCR koloni
menggunakan pasangan primer HPR-F dan HPR-R. M= penanda DNA; 1-10= galur P. pastoris transforman. Galur transforman yang
positif mengandung gen HPRmemberikan pita DNA berukuran 400
pb. B. PCR koloni menggunakan pasangan primer VH101-F dan VL101-R. M= penanda DNA; 1= kontrol positif; 2-11= galur P. pastoris transforman. Galur transforman yang positif mengandung
genscFvmemberikan pita DNA berukuran 750 pb.
4.2 Konstruksi Protein Fusi anti-EGFRvIIIscFv-GFP dengan HPRmut
4.2.1 Subkloning genEGFPke dalam plasmidpPICZα-scFv
PlasmidpPICZαAyang mengandung genanti-EGFRvIII scFv(pPICZα-scFv
klon no.41) yang digunakan untuk mengkonstruk plasmid pPICZα-scFv-HPR
digunakan juga untuk mengkonstruksi fusi protein scFv::GFP. Klon yang telah mengandung plasmid pPICZα-scFv-GFP digunakan untuk mengkonstruksi fusi
protein scFv::GFP::HPR. Fusi gen tersebut mengandung sekuen peptida penghubung (linker) fleksibel yang pendek (G4S)ndiantara scFv dengan GFP dan
antara GFP dengan HPR, dengan n kelipatan 2 atau 1. Sekuen peptida penghubung tersebut diintroduksi melalui primer dengan teknik PCR. Peptida penghubung (G4S) digunakan karena peptida ini memiliki karakteristik
menguntungkan seperti dapat memberikan fleksibilitas struktur protein fusi. Huang & Shusta (2006) menggunakan peptida penghubung yang sama untuk fusi scFv atau scTCR dengan GFP, namun mereka menggunakan triplet G4S.
Penggunaan peptida penghubung ini pada fusi protein scFv::GFP yang
diekspresikan pada S. Cerevisiae menunjukkan hasil yang lebih baik dan
membentuk struktur yang tepat dibandingkan dengan fusi protein yang sama namun tanpa peptida penghubung meskipun protein tersebut juga bisa diekspresikan (Huang & Shusta, 2006).
Gen GFP telah berhasil diklon ke dalam plasmid pPICZα-scFv pada situs ClaI menghasilkan plasmid rekombinan pPICZα-scFv-EGFP. Sebanyak 115
koloni E. coli transforman di seleksi menggunakan PCR koloni menggunakan