ISOLASI DAN UJI ANTAGONIS BAKTERI RESISTEN ANTIBIOTIK DARI TAMBAK UDANG TERHADAP BAKTERI PENYEBAB PENYAKIT
VIBRIOSIS
TESIS
Mariany Razali 087030016 Biologi / Mikrobiologi
PROGRAM MAGISTER BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ISOLASI DAN UJI ANTAGONIS BAKTERI RESISTEN ANTIBIOTIK DARI TAMBAK UDANG TERHADAP BAKTERI PENYEBAB PENYAKIT
VIBRIOSIS
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Magister Sains dalam Program Studi Biologi pada Program Magister Biologi
Universitas Sumatera Utara
Oleh
MARIANY RAZALI O87030016
BIOLOGI/MIKROBIOLOGI
PROGRAM MAGISTER BIOLOGI UNIVERSITAS SUMATERA UTARA
Judul Tesis : ISOLASI DAN UJI ANTAGONIS BAKTERI
RESISTEN ANTIBIOTIK DARI TAMBAK UDANG TERHADAP BAKTERI PENYEBAB PENYAKIT VIBRIOSIS
Nama Mahasiswa : Mariany Razali Nomor Pokok : 087030016 Program Studi : Biologi Konsentrasi : Mikrobiologi
Menyetujui Komisi Pembimbing
Prof. Dr. Dwi Suryanto, M.Sc
Ketua Anggota
Prof. Dr. Erman Munir, M.Sc
Ketua Program Studi Dekan
Telah diuji pada Tanggal 27 April 2011
PANITIA PENGUJI
Ketua : Prof. Dr. Dwi Suryanto, M.Sc Anggota : Prof. Dr. Erman Munir, M.Sc
Isolasi dan Uji Antagonis Bakteri Resisten Antibiotik Dari Tambak Udang Terhadap Bakteri Penyebab Penyakit Vibriosis
ABSTRAK
Telah dilakukan isolasi dan uji antagonis bakteri resisten antibiotik dari tambak udang. Hasil uji resistensi antibiotik menunjukkan sebanyak 15 isolat bakteri bersifat resisten terhadap beberapa antibiotik antara lain terhadap 25 μg amoksisilin, 15 µg eritromisin, 25 µg sulfametoksazol /trimetropim, dan 30 μg kloramfenikol. Pengujian antagonis isolat bakteri resisten terhadap bakteri penyebab penyakit vibriosis terdiri dari 3 tahap dengan masing-masing 3 ulangan. Pengujian antagonis isolat bakteri resisten antibiotik terhadap Vibrio sp. menunjukkan isolat sp2 memiliki zona hambat tertinggi yaitu 15,17 mm. Pengujian patogenitas 15 isolat bakteri resisten antibiotik terhadap larva udang dilakukan dengan metode perendaman. Hasil menunjukkan semua isolat tidak bersifat patogen terhadap larva udang pada konsentrasi isolat 108cfu/ml. Pengujian antagonis isolat bakteri resisten antibiotik terhadap Vibrio sp. dalam pemeliharaan larva udang menunjukkan isolat sp2 mampu menghambat serangan penyakit vibriosis sebesar 96% selama 96 jam perendaman dan mencegah terbentuknya kolonisasi Vibrio sp. pada permukaan tubuh larva udang.
Kata kunci: bakteri resisten antibiotik, Vibrio sp., larva udang.
Isolation and Antagonistic Test of Antibiotic Resistant Bacterial from Shrimp Ponds to Vibriosis Causing Bacteria
ABSTRACT
A study isolation and antagonistic assay of antibiotic resistant bacteria of shrimp ponds has been carried out. Resistency test showed that fifteen isolates were resistant to 25 μg amoxicillin, 15 µg erythromycin, 25 µg sulphamethaxazole/ trimethropim, and 30 μg chloramphenicol. Assay antagonistic of the resistance bacterial isolates to Vibrio sp. causal agent of vibriosis was conducted in 3 steps with 3 replications. The result showed that sp2 inhibited growth of Vibrio sp. with inhibition zone of 15,17 mm. Assay of pathogenicity of the isolates were done by soaking into bacterial solution. All isolates were not pathogen to shrimp larvae at concentration of 108cfu/ml. Assay antagonism of the isolates in hatchery showed that sp2 was able to reduce vibriosis of shrimp larvae by 96% after 96 hours of soaking the shrimp larvae, and prevented Vibrio sp. colonization on the surface on shrimp larvae body.
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas limpahan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan penulisan tugas akhir dalam bentuk tesis yang berjudul “Isolasi Dan Uji Antagonis Bakteri Resisten Antibiotik Dari Tambak Udang Terhadap Bakteri Penyebab Penyakit Vibriosis”. Tesis ini dimaksudkan untuk melengkapi sebagian persyaratan dalam mendapatkan gelar Magister Sains pada Program Magister Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
Penulisan tesis ini tidak akan selesai tanpa dukungan dari banyak pihak. Oleh karena itu pada kesempatan ini penulis ingin mengucapkan terimakasih dan penghargaan yang setinggi-tingginya kepada yang terhormat Bapak Prof. Dr. Dwi Suryanto, M.Sc selaku dosen pembimbing 1 dan Bapak Prof. Dr. Erman Munir, M.Sc. selaku dosen pembimbing 2 yang telah banyak memberikan bimbingan, motivasi, arahan, dan waktunya kepada penulis dalam menyelesaikan tesis ini. Semoga Allah SWT membalas setiap kebaikan yang telah diberikan dengan yang kebaikan lebih baik lagi. Amin. Kepada Bapak Dr. Ir. Edi Batara Mulya, S. MS dan Bapak Dr. Ir. Yunasfi, M.Si selaku dosen penguji terima kasih atas kritikan dan saran yang sangat membangun dalam penyelesaian tesis ini. Kepada Bapak Prof. Dr. Syafruddin Ilyas, M. Biomed. selaku Ketua Program Studi Magister Biologi terima kasih atas bantuan yang telah diberikan. Penulis juga mengucapkan terima kasih kepada seluruh Staf Dosen Departemen Biologi yang telah mendidik dalam perkuliahan.
kepercayaan dan kesabaran yang telah diberikan, ananda tersayang M. Habibie Mustafa dan Mufida Shayna Aziza atas pengertiannya, adinda tercinta Roslina, Ismar, dan Faisal terima kasih atas bantuan dan kasih sayang yang diberikan kepada Habibie dan Aziza selama ini.
Kepada teman-teman mikrobiologi angkatan ’08 Siti, Sari, dan Vivi semoga persahabatan dan persaudaraan yang sudah terjalin selama ini akan berlangsung selamanya. Adik-adik asisten mikrobiologi Ami, Nikmah, Asril, Mirza, Yanti terima kasih atas kerjasamanya selama ini.
Akhirnya penulis berharap semoga karya ini dapat bermanfaat sebagaimana mestinya.
Medan, April 2011
RIWAYAT HIDUP
DAFTAR ISI Halaman ABSTRAK ABSTRACT KATA PENGANTAR RIWAYAT HIDUP DAFTAR ISI DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN BAB I PENDAHULUAN
1.1 Latar Belakang 1.2 Perumusan Masalah 1.3 Tujuan Penelitian 1.4 Hipotesis Penelitian 1.5 Manfaat Penelitian BAB II TINJAUAN PUSTAKA
2.1 Budidaya Udang 2.2 Penyakit Udang 2.3 Bakteri Vibrio sp.
2.4 Penggunaan Antibiotik Pada Budidaya Perairan 2.5 Pengaruh Penggunaan Antibiotik Pada Budidaya
Perairan
2.6 Mekanisme Bakteri Resisten Terhadap Antibiotik BAB III METODE PENELITIAN
3.1 Waktu dan Tempat 3.2 Alat dan Bahan
3.3 Isolasi Bakteri dari Sampel Air, Udang, dan Tanah 3.4 Uji Sensitivitas Bakteri Terhadap Antibiotik 3.5 Karakterisasi Bakteri Resisten Antibiotik 3.6 Isolasi Bakteri Vibrio sp.
3.7 Uji Patogenitas Bakteri Resisten Antibiotik Terhadap Larva Udang
3.8 Uji Daya Hambat Bakteri Resisten Terhadap Vibrio sp. Secara In Vitro
3.9 Uji Tantang Bakteri Resisten Antibiotik Terhadap Vibrio
sp. Pada Pemeliharaan Larva Udang
3.10 Rancangan Penelitian dan Analisis Data 3.11 Pengamatan Dengan Scanning Electron Microscopy
BAB IV HASIL DAN PEMBAHASAN
4.1 Isolat Bakteri Resisten Antibiotik
4.2 Kemampuan Bakteri Resisten Antibiotik Menghambat Pertumbuhan Vibrio sp. Secara In Vitro
4.3 Kemampuan Bakteri Resisten Antibiotik Menghambat Pertumbuhan Bakteri Vibrio sp. Pada Larva Udang PL9 BAB V KESIMPULAN DAN SARAN
DAFTAR PUSTAKA
14 15 16 16
16
17
17 18 18 19 19
23
DAFTAR TABEL
No. Judul Halaman
1.
2.
3.
4.
Hasil uji bakteri resisten antibiotik terhadap beberapa jenis antibiotik
Karakteristik morfologi sel dan uji biokimia 15 bakteri resisten antibiotik
Hasil uji DMRT kemampuan bakteri resisten antibiotik menghambat pertumbuhan Vibrio sp. secara in vitro
Hasil uji DMRT kemampuan bakteri resisten antibiotik menghambat pertumbuhan bakteri Vibrio sp. pada larva udang PL9
19
22
23
DAFTAR GAMBAR
No. Judul Halaman
1. Scanning Electron Microscopy larva udang pada pembesaran 7500x
DAFTAR LAMPIRAN
No. Judul Halaman
1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16.
Alur kerja isolasi bakteri resisten antibiotik Pembuatan larutan standar McFarland 108
Alur kerja uji sensitivitas bakteri terhadap beberapa jenis antibiotik
cfu/ml
Alur kerja isolasi bakteri patogen Vibrio sp.
Alur kerja uji patogenitas bakteri resisten antibiotik terhadap larva udang PL10
Alur kerja uji daya hambat bakteri resisten antibiotik terhadap
Vibrio sp. secara in vitro
Alur kerja uji tantang bakteri resisten antibiotik terhadap Vibrio
sp. pada pemeliharaan larva udang PL9
Alur kerja uji khitinase bakteri patogenVibrio sp.
Diameter hasil uji sensitivitas bakteri resisten terhadap beberapa jenis antibiotik
Analisis statistik dengan menggunakan SPSS Versi 16
Kemampuan isolat sp2 menghambat pertumbuhan patogen Vibrio
sp. secara in vitro
Isolat sp6 pada uji resistensi terhadap beberapa jenis antibiotik Lokasi pengambilan sampel pada tambak udang di Kabupaten Serdang Bedagai
Pengujian isolat bakteri resisten antibiotik terhadap Vibrio sp. di lokasi pembibitan udang Kabupaten Serdang Bedagai
Hasil uji biokimia beberapa isolat bakteri resisten antibiotik Proses sebagian preparasi sampel larva udang untuk SEM
17. 18.
Isolasi dan Uji Antagonis Bakteri Resisten Antibiotik Dari Tambak Udang Terhadap Bakteri Penyebab Penyakit Vibriosis
ABSTRAK
Telah dilakukan isolasi dan uji antagonis bakteri resisten antibiotik dari tambak udang. Hasil uji resistensi antibiotik menunjukkan sebanyak 15 isolat bakteri bersifat resisten terhadap beberapa antibiotik antara lain terhadap 25 μg amoksisilin, 15 µg eritromisin, 25 µg sulfametoksazol /trimetropim, dan 30 μg kloramfenikol. Pengujian antagonis isolat bakteri resisten terhadap bakteri penyebab penyakit vibriosis terdiri dari 3 tahap dengan masing-masing 3 ulangan. Pengujian antagonis isolat bakteri resisten antibiotik terhadap Vibrio sp. menunjukkan isolat sp2 memiliki zona hambat tertinggi yaitu 15,17 mm. Pengujian patogenitas 15 isolat bakteri resisten antibiotik terhadap larva udang dilakukan dengan metode perendaman. Hasil menunjukkan semua isolat tidak bersifat patogen terhadap larva udang pada konsentrasi isolat 108cfu/ml. Pengujian antagonis isolat bakteri resisten antibiotik terhadap Vibrio sp. dalam pemeliharaan larva udang menunjukkan isolat sp2 mampu menghambat serangan penyakit vibriosis sebesar 96% selama 96 jam perendaman dan mencegah terbentuknya kolonisasi Vibrio sp. pada permukaan tubuh larva udang.
Kata kunci: bakteri resisten antibiotik, Vibrio sp., larva udang.
Isolation and Antagonistic Test of Antibiotic Resistant Bacterial from Shrimp Ponds to Vibriosis Causing Bacteria
ABSTRACT
A study isolation and antagonistic assay of antibiotic resistant bacteria of shrimp ponds has been carried out. Resistency test showed that fifteen isolates were resistant to 25 μg amoxicillin, 15 µg erythromycin, 25 µg sulphamethaxazole/ trimethropim, and 30 μg chloramphenicol. Assay antagonistic of the resistance bacterial isolates to Vibrio sp. causal agent of vibriosis was conducted in 3 steps with 3 replications. The result showed that sp2 inhibited growth of Vibrio sp. with inhibition zone of 15,17 mm. Assay of pathogenicity of the isolates were done by soaking into bacterial solution. All isolates were not pathogen to shrimp larvae at concentration of 108cfu/ml. Assay antagonism of the isolates in hatchery showed that sp2 was able to reduce vibriosis of shrimp larvae by 96% after 96 hours of soaking the shrimp larvae, and prevented Vibrio sp. colonization on the surface on shrimp larvae body.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Udang merupakan sumber protein hewani yang bermutu tinggi dan produksinya mampu menambah devisa bagi negara dari sektor perikanan. Secara komersial budidaya udang di Indonesia telah dilakukan sekitar tahun 1980 kemudian pada tahun 1984 mulai dibudidayakan secara intensif yang diawali di Jawa Timur. Produksi udang terus bertambah seiring dengan meningkatnya permintaan konsumen dunia terutama dari negara-negara Amerika Serikat, Jepang, dan Eropa Barat. Meningkatnya jumlah produksi udang Indonesia telah membawa nama negara ini sebagai salah satu negara terbesar pengekspor udang di dunia setelah Thailand, Equador, India, dan RRC. Adapun jenis udang yang dikembangkan hampir 80% berasal dari famili Penaeidae yaitu Pacific White Shrimp dan Giant Tiger Prawn
(Wickins & Lee 2002).
Pada tahun 1992 produksi udang di Indonesia mengalami penurunan secara dramatis yaitu dari 140.000 mt tahun 1991 menjadi 80.000 mt tahun 1993. Hal ini mungkin disebabkan manajemen air yang tidak baik (Supriyadi & Rukhyani 1992) sehingga dapat meningkatkan terjadinya serangan penyakit. Salah satu penyakit yang menyerang udang adalah penyakit vibriosis yang disebabkan oleh beberapa bakteri
Vibrio sp.
digunakan mampu bertahan dalam lingkungan perairan setelah digunakan beberapa bulan dan berpotensi sebagai pencemar (Le et al. 2005), dapat mempengaruhi komunitas mikroba di lingkungan sekitarnya, kualitas produk udang, dan mengawali terjadinya resistensi bakteri terhadap antibiotik sehingga menyebabkan penurunan efisiensi antibiotik dalam mengatasi infeksi pada hewan maupun manusia (Hektoen et al. 1995; Tendencia et al. 2001). Individu-individu yang bersifat resisten terhadap antibiotikdiasosiasikan dengan penggunaan antibiotik (McPhearson et al. 1991).
Hasil riset menyatakan bahwa bakteri resisten terhadap trimetropim dan sulfametoksazol sering ditemukan antara lain pada area tambak udang di Vietnam (Le et al. 2005), India (Manjuhsa et al. 2005), dan beberapa tambak udang di Philipina (Tendencia et al. 2001). Baticados (1990) melaporkan bahwa strain luminous dari Vibrio harveyi dan V. splendidus yang diisolasi dari larva udang memiliki resistensi terhadap eritromisin, kanamisin, penisillin G, dan streptomisin.
Kehadiran antibiotik di lingkungan aquatik dapat menyebabkan resistensi pada bakteri patogen maupun non patogen dan bakteri yang telah resisten juga mampu mentransfer gen-gen resisten terhadap mikroba yang berada disekitarnya. Sebagai contoh ketika terjadi wabah penyakit kolera di Equador tahun 1991. Penyakit ini mulai mewabah dari para pekerja di tambak udang, dimana multi-drug resisten hadir dalam vibrio non-kolera yang patogen terhadap udang. Strain V. cholera 01 yang semula peka terhadap 12 agens antimikrobial di Equador menjadi resisten terhadap berbagai antibiotik. Gen resisten ini telah ditransfer terhadap V. cholera 01 dari vibrio lain yang resisten (Defoirt et al. 2007; Angulo 1999; Weber et al. 1994).
parahaemolyticus (Kusman 2007)
1.2 Perumusan Masalah
. Dampak negatif yang diakibatkan oleh penggunaan antibiotik menyebabkan banyak dilakukan upaya untuk mencari metode yang lebih baik. Beberapa alternatif yang telah dilakukan dalam upaya untuk mendapatkan agens biokontrol antara lain; penggunaan spesies rumput laut sebagai antibakterial terhadap bakteri patogen pada udang windu (Izzati 2007), merangsang kekebalan nonspesifik udang melalui penggunaan vaksin dan imunostimulan (Devaraja et al. 1998), penggunaan bakteri asal laut sebagai biokontrol (Muliani et al.
2003), penggunaan vitamin C, E dan β 1,3 glucan sebagai imunomodulator (Kanagu
et al. 2010), pengembangan biofilm V. alginolyticus untuk immunostimulan pada udang (Sharma et al. 2010), menggunakan terapi bakteriofag yang dapat membunuh vibrio dan tidak merusak mikroba yang bukan target (Karusanagar et al. 2005), penggunaan bakteri probiotik Bacillus S11 yang dipasangkan dengan ozonisasi (Moriarty 1999) dan genus Pseudoalteromonas sebagai biokontrol terhadap Vibrio
(Isnansetyo et al. 2009).
Hasil yang diperoleh dari berbagai penelitian tersebut, menunjukkan penggunaan biokontrol merupakan prospek yang menjanjikan karena lebih ramah lingkungan dan berkelanjutan. Oleh karena itu perlu dilakukan penelitian untuk mencari bakteri biokontrol dan prosedur penerapan yang efektif serta konsisten dalam menanggulangi penyakit vibriosis pada udang windu.
Berdasarkan uraian di atas perumusan masalah pada penelitian ini sebagai berikut:
1. Apakah bakteri resisten antibiotik dapat diperoleh pada tambak udang?
2. Bagaimana efektivitas bakteri resisten antibiotik dalam menghambat pertumbuhan bakteri patogen Vibrio sp. penyebab vibriosis?
3. Apakah bakteri resisten antibiotik mampu menurunkan serangan penyakit vibriosis pada larva udang windu (Penaeus monodon)?
1.3 Tujuan Penelitian
Penelitian ini dilakukan bertujuan antara lain :
1. Untuk mendapatkan isolat bakteri yang resisten terhadap beberapa antibiotik yang umum digunakan pada tambak udang.
2. Untuk menguji aktivitas bakteri resisten antibiotik terhadap patogen udang yaitu
Vibrio sp.
3. Untuk mengetahui kemampuan bakteri resisten antibiotik dalam menurunkan serangan penyakit vibriosis pada larva udang.
1.4 Hipotesis Penelitian
1. Bakteri yang bersifat resisten antibiotik diperoleh dari tambak udang. 2. Bakteri resisten antibiotik mampu menghambat pertumbuhan Vibrio sp.
3. Bakteri resisten antibiotik mampu menurunkan serangan penyakit vibriosis pada larva udang.
1.5 Manfaat Penelitian
Setelah dilakukan penelitian ini maka diharapkan dapat diperoleh manfaat antara lain: 1. Mendapatkan isolat bakteri resisten antibiotik yang potensial sebagai agen
pengendali hayati terhadap penyakit vibriosis dalam tambak udang.
BAB II
TINJAUAN PUSTAKA
2.1 Budidaya Udang
Bisnis aquakultur khususnya budidaya udang (tambak udang) dirancang untuk meningkatkan dan memproduksi udang laut untuk konsumsi. Lokasi yang cocok untuk budidaya udang adalah daerah sepanjang pantai (beberapa meter dari permukaan air laut) dengan suhu rata-rata 28-32○C. Daerah pasang surut dengan fluktuasi pasang surut 2-3 meter dan salinitas 25-30 ppt. Tanah yang ideal untuk budidaya udang adalah yang bertekstur liat atau liat berpasir, karena dapat menahan air dan tanah kemudian tanah lebih mudah dipadatkan serta tidak pecah-pecah. Tipe budidaya udang dapat dikategorikan atas tipe ekstensif dengan hasil panen 1.000 kg/ha, semi-intensif dan intensif dengan hasil panen 500-15.000 kg/ha, serta super intensif dengan 10.000-50.000 kg/ha hasil panen (Wickins & Lee 2002).
2.2 Penyakit Udang
Dalam proses budidaya udang pengendalian terhadap penyakit telah dilakukan sejak awal pembibitan (hatchery). Udang yang sehat dicirikan secara fisiologis normal dan secara fisik dapat terlihat dari pola nafsu makan, pertumbuhan, kebersihan, dan kelengkapan organ serta jaringan tubuh. Penyakit pada umumnya terjadi pada bulan kedua pemeliharaan, terutama pada tambak yang sejak awal mengalami kesulitan menumbuhkan fitoplankton. Penyakit kronis dapat mengakibatkan gangguan pertumbuhan dan menurunkan kualitas udang, sedangkan penyakit yang bersifat akut dapat menyebabkan kematian. Beberapa penyakit yang menyerang jenis udang penaied diakibatkan virus, bakteri, jamur, parasit, dan faktor abiotik lainnya. Akibat serangan patogen ini pada udang sekitar 15-20 tahun terakhir telah menyebabkan kerugian secara ekonomi (Wickins & Lee 2002).
Beberapa bakteri yang bersifat patogen pada aquakultur antara lain berasal dari beberapa spesies Vibrio, Beneckea, Pseudomonas, Aeromonas, dan Rickettsia. Vibriosis adalah salah satu penyakit yang menyerang udang, kerang-kerangan, dan ikan pada semua fase kehidupan. Vibriosis disebabkan oleh beberapa bakteri spesies
Vibrio sp. juga menyebabkan penyakit kaki merah pada fase juvenile hingga udang dewasa yang menyebabkan mortalitas hingga 95% selama musim panas. Penyakit nekrosis pada bola mata udang disebabkan V. cholera. Sedangkan infeksi oleh V. harveyi dan V. splendidus menyebabkan luminescense pada postlarva, juvenil, dan dewasa. Infeksi pada post larva menunjukkan pengurangan motilitas, reduksi fototaksis dan kekosongan usus. Pada kondisi salinitas yang tinggi vibriosis disebabkan oleh spesies V. harveyi. Dalam beberapa kasus Vibrio sp. hanya menyebabkan penyakit ketika organisme inang mengalami penekanan sistem imun atau stress dengan frekuensi infeksi sering terjadi pada kondisi lingkungan yang buruk dan suhu panas (Alderman 1998).
Virus merupakan salah satu agens yang dapat menyebabkan kematian masal pada semua fase kehidupan udang hingga pada produk yang telah dibekukan. Ada beberapa jenis virus yang menyebabkan masalah pada budidaya udang yaitu RNA
rhabdovirus, yellow head virus (YHV), ssRNA taura syndrome virus (TSV), DNA parvovirus yang menyebabkan white spot syndrome virus (WSSV), dan DNA penaeid baculolike virus yang menginfeksi hypodermal dan haematopoietic necrosis virus
Penyakit asal jamur sistemik pada periode larva maupun post larva dapat menyebabkan angka kematian yang serius pada P. monodon. Penyakit serius yang disebabkan oleh jamur salah satunya Aphanomyces astaci yang menyebabkan plak pada udang karang (crayfish) di Eropa dan Australia. Juvenil dan udang dewasa dapat diinfeksi oleh Fusarium sp. yang menyebabkan lesi atau abrasi pada kutikulanya. Respons inang terhadap infeksi menghasilkan daerah dark melanised yang dikarakterisasi seperti black gill disease. Beberapa fungi menghasilkan toksin yang menghambat osmoregulasi dan meningkatkan kematian udang pada saat moulting (Wickins & Lee 2002).
Pada udang Penaeid, protozoa menyebabkan cotton or milk shrimp disease
(tubuh tidak dapat tembus cahaya atau buram). Mikrosporidia tidak selalu menyebabkan kematian, namun menyebabkan pertumbuhan udang yang relatif rendah. Infeksi secara langsung terjadi pada udang karena mengkonsumsi spora yang menempel pada lapisan eksoskleton. Setelah fungi membentuk plak, infeksi yang disebabkan protozoa menjadi serius dan telah mempengaruhi kehidupan udang karang (crayfish) di seluruh dunia. Protozoa ini juga sering ditemukan pada saluran pencernaan udang penaeid tetapi tidak berbahaya. Infeksi histopagus dapat terjadi pada Crustaceae laut dan air tawar (Wickins & Lee 2002).
2.3 Bakteri Vibrio sp.
Vibrio sp. merupakan bakteri yang tergolong famili Vibrionaceae bersifat Gram negatif, biasanya berbentuk batang, bergerak, mesofilik, kemoorganotropik, fakultatif anaerob, dan umumnya oksidase positif. Vibrio sp. tumbuh baik pada suhu 15○C sampai 30○C (Thompson et al. 2004). Vibrio sp. dapat dijumpai dalam jumlah yang melimpah di lingkungan aquatik dan berasosiasi dengan eukariotik (Barbieri et al.
Formasi biofilm Vibrio sp. pada eksoskleton Crustaceae atau organisme laut yang lain merupakan strategi untuk bertahan dalam kondisi kelaparan dan ketika mendapat tekanan dari lingkungan. Dalam biofilm bakteri Vibrio sp. dapat memperangkap dan menyerap nutrien, resisten terhadap antibiotik serta berasosiasi dengan baik terhadap bakteri lain atau inangnya. Vibrio cholera menempel pada permukaan dengan menggunakan flagel dan pili secara adhesi (Wai et al. 1999).
Beberapa Vibrio sp. merupakan bakteri patogen terhadap hewan-hewan perairan. Bakteri V. anguillarum, V. salmonicida, dan V. vulnificus merupakan patogen terhadap beberapa spesies ikan sedangkan V. harveyi merupakan patogen utama pada udang contohnya pada Litopenaeus vannamei dan P. monodon. Kematian massal pada fase larva dan juvenil P. monodon diasosiasikan dengan luminous Vibrio
sp. Mortalitas yang disebabkan Vibrio sp. pada ikan dan udang sangat sering terjadi pada fase larva secara tiba-tiba(Austin et al. 2003).
Dalam siklus nutrisi Vibrio sp. berperan penting dalam mengambil bahan organik terlarut. Vibrio sp. menyediakan asam lemak tak jenuh rantai panjang esensial pada rantai makanan aquatik. Vibrio sp. juga dapat mendegradasi kitin, yaitu sebuah homopolimer N-acetyl-glucosamin gula amino yang banyak ditemui di lautan (Cottrell & Kirchman 2003). Beberapa Vibrio sp. juga mampu mendegradasi senyawa toksik polisiklik hidrokarbon aromatik yang mencemari sedimen laut (Svitil et al.
1997).
Vibrio sp. dapat memproduksi antibiotik diantara bakteri laut yang lain. Komponen inhibitor yang dihasilkan Vibrio sp. tertentu mampu mereduksi jumlah organisme lain contohnya Alfaproteo-bacteria dan Alteromonas (Long & Azam 2001). Menurut Sharma et al. (2010) spesies V. alginolyticus ternyata memiliki potensial sebagai imunostimulan terhadap udang sehingga spesies ini dapat digunakan sebagai agen biokontrol pada budidaya udang dan dapat mengurangi penggunaan antibiotik.
2.4Penggunaan Antibiotik Pada Budidaya Perairan
Hingga saat ini belum ada antibiotik yang didesain khusus untuk mengatasi penyakit pada hewan perairan sehingga penggunaan antibiotik di perairan harus hati-hati. Beberapa faktor yang harus dipertimbangkan adalah keamanan produk, integritas lingkungan, keamanan target, dan keamanan bagi pengelola komponen. Adapun beberapa jenis antibiotik yang diizinkan penggunaannya di perairan adalah oksitetrasiklin, florfenikol, sarafloksasin, eritromisin, dan sulfanamid sedangkan yang dilarang penggunaannya di perairan antara lain; kloramfenikol, enrofloksasin, spectinomisin, dan rimfapim (Serrano 2005).
2.5 Pengaruh Penggunaan Antibiotik Pada Budidaya Perairan
Secara umum setelah panen, lahan tambak yang telah digunakan memiliki limbah yang tidak habis terbuang yaitu berupa sisa pakan dan antibiotik. Kehadiran antibiotik dalam air dan sedimen lingkungan potensial mempengaruhi flora normal, plankton, dan hewan sekitarnya, menyebabkan perubahan diversitas mikrobiota dan keseimbangan ekologi (Cabello 2006). Hal ini disebabkan karena jumlah substansi antibiotik yang masuk atau dideposit pada suatu lingkungan dapat terdistribusi pada lingkungan yang berbeda dan dapat mengawali terjadinya resistensi (Serrano 2005).
Residu antibiotik pada produk hewan yang menggunakan antibiotik dalam kurun waktu yang lama dapat menyebabkan alergi dan toksisitas yang sulit di diagnosa (Cabello 2006), mempengaruhi flora normal saluran pencernaan (menekan pertumbuhan flora normal), tumbuhnya mikroorganisme yang tidak diinginkan, pengembangan gen resisten pada bakteri enteric yang patogen, kolonisasi resisten mengganggu atau merubah aktivitas enzim metabolisme dari flora normal pencernaan (Serrano 2005).
2.6 Mekanisme Bakteri Resisten Terhadap Antibiotik
lain ada strain bakteri yang resisten pada beberapa klas agens antibiotik yang disebut dengan multidrug resistance (didefenisikan sebagai resisten terhadap ≥ 3 klas antibiotik (Jawetz et al. 1996).
Bakteri yang peka terhadap agen antimikrobial dapat memperoleh resistensi melalui mutasi spontan yang menyebabkan antara lain (1) perubahan protein target yang berikatan pada antibakterial dengan memodifikasi atau mengeliminasi binding site (contohnya: merubah protein 2b penicillin-binding dalam pneumococci yang menghasilkan penisillin resisten), (2) upregulating produksi enzim yang menonaktifkan agen antimikrobial (contohnya: eritromisin ribosomal metilase dalam staphyloccus), (3) down regulating atau merubah saluran protein membran luar yang diperlukan obat-obatan untuk masuk ke dalam sel, (4) upregulating pump yang memaksa obat-obatan keluar dari sel (contohnya: effluxs fluoroquinolons dalam
Staphylococcus aureus) (Tenover 2006).
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan April sampai Nopember 2010 di Laboratorium Mikrobiologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara dan Pusat Pembibitan Udang (hatchery) Serdang Bedagai, Sumatera Utara. Penyiapan preparat untuk Scanning Microscopy Electron (SEM) dilakukan di Laboratorium Bidang Zoologi Puslit Biologi, LIPI Cibinong.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah: cawan petri, tabung reaksi, rak tabung reaksi, botol winkler, gelas ukur, pipet serologi, karet penghisap, spatula,
hockey stick, autoklaf, bunsen, oven, mikroskop cahaya, jangka sorong, aerator,
blower, pH meter, refraktometer, global positioning system, mortal, wadah plastik, dan scanning electron microscopy (SEM, JSM-5310LV).
Bahan-bahan yang digunakan dalam penelitian ini antara lain: sampel air, tanah, dan udang dari tambak udang disekitar Kab. Serdang Bedagai. Media Nutrien Agar (NA), Mueller Hilton Agar (MHA), Thiosulfate-Citrat-Bile-Sucrose-Agar
(TCBSA), larutan fisiologis, akuades, alkohol 70%, reagen untuk pewarnaan Gram, media-media uji Biokimia (TSIA, TCA, SIM, glukosa, H2O2
- Lokasi 1 : Tambak Aktif pada N: 03
3%, gelatin), aluminium foil, kapas, cakram berisi antibiotik, larutan standar McFarland, dan kertas saring.
Sampel air, udang, dan tanah untuk isolasi bakteri resisten diambil dari 4 lokasi tambak udang di Kab. Serdang Bedagai, yaitu :
- Lokasi 2 : Tambak Nonaktif N : 03○34.264’ E : 099○07.200’- N : 03○34.293’ E : 099○
- Lokasi 3 : Tambak Aktif Dinas Perikanan dan Kelautan Sialang Buah N: 03
07.161’, ketinggian 14 mdpl (100 m dari tepi Pantai Sialang Buah).
○33.924’ E: 099○06.893’- N: 03○33.917’ E: 099○
- Lokasi 4 : Tambak non aktif N: 03
06.887’, ketinggian 14 mdpl (1000 m dari tepi Pantai Sialang Buah).
○33.528, E: 099○06.826 - N: 03○33.534, E: 099○
Larva udang windu stadium post larva diperoleh dari hatchery di lokasi Desa Sentang, Teluk Mengkudu, Serdang Bedagai, Sumatera Utara. Isolat murni Vibrio sp. diperoleh dari tambak PT. Budi, Serdang Bedagai dengan menggunakan media TCBSA.
06.832, ketinggian 6 mdpl (3000 m dari tepi Pantai Sialang Buah).
3.3 Isolasi Bakteri dari Sampel Air, Udang dan Tanah
Sampel untuk isolasi bakteri berasal dari air, udang, dan tanah/lumpur tambak dikumpulkan dari 4 tambak berbeda. Air tambak yang diambil sebanyak 100 ml, sampel udang sebanyak 5 ekor dengan berat rata-rata 10-15 g/ekor dan tanah diambil secukupnya dari 5 titik yang berbeda dalam tambak (tiap-tiap sudut dan tengah).
Sampel air sebanyak 0,1 ml disebarkan pada media NA yang dilarutkan dengan menggunakan air tambak kemudian diinkubasi selama 24-72 jam pada suhu 30±2○
suhu 30±2○C. Masing-masing koloni dengan sifat fisik yang berbeda di kultur kembali pada media NA untuk digunakan selanjutnya.
Sampel tanah sebanyak 1 g dihomogenisasi dalam 10 ml air tambak steril. Sampel yang telah homogen diencerkan hingga 10-4. Sebanyak 0.1 ml sampel yang diencerkan disebarkan pada media NA kemudian diinkubasi selama 24-72 jam pada suhu 30±2○
3.4 Uji Sensitivitas Bakteri Terhadap Antibiotik
C. Masing-masing koloni yang berbeda dipisahkan dan dipurifikasi pada media NA berikutnya (Tendencia et al. 2001). Alur kerja isolasi bakteri resisten antibiotik dari tambak udang dapat dilihat pada Lampiran 1 (hlm 34).
Uji sensitivitas bakteri terhadap antibiotik menggunakan metode difusi agar. Isolat uji disesuaikan kepadatan populasinya dengan menggunakan standar McFarland 108 cfu/ml. Alur kerja pembuatan standar McFarland dapat dilihat pada lampiran 2 (hlm 35). Media yang digunakan untuk pengujian adalah MHA yang dilarutkan dengan air tambak. Suspensi bakteri yang telah standar kemudian diinokulasi pada media MHA menggunakan cotton swab. Setelah ± 10 menit cakram yang berisi antibiotik (ukuran diameter disk 6 mm) diletakkan pada permukaan agar yang telah diinokulasi dengan bakteri yang akan diuji.
Cakram antibiotik yang digunakan antara lain; 25 μg amoksisilin, 25 μg sulfametoksazol/trimetropim, 30 μg kloramfenikol, dan 15 μg eritromisin. Selanjutnya kultur diinkubasi selama 24-48 jam pada suhu 30±2○C. Setelah diinkubasi zona hambat diukur dengan menggunakan jangka sorong (Tendencia et al.
3.5 Karakterisasi Bakteri Resisten Antibiotik
Isolat bakteri resisten terhadap antibiotik dikultur pada media NA kemudian kultur yang berumur ± 24 jam diidentifikasi menggunakan uji biokimia secara sederhana. Uji biokimia yang dilakukan antara lain pewarnaan Gram, uji sitrat, uji katalase, uji motilitas, uji gelatin, dan uji TSIA.
3.6 Isolasi Bakteri Vibrio sp.
Vibrio sp.diisolasi dari sampel air tambak udang PT. Budi, Serdang Bedagai. Media yang digunakan adalah TCBSA. Inkubasi dilakukan pada suhu 30±2○
3.7 Uji Patogenitas Bakteri Resisten Antibiotik Terhadap Larva Udang
C selama 24-48 jam. Isolat yang diperoleh dikarakterisasi di Laboratorium Mikrobiologi FMIPA, Universitas Sumatera Utara. Alur kerja isolasi bakteri Vibrio sp. dapat dilihat pada Lampiran 4 (hlm37).
3.8 Uji Daya Hambat Bakteri Resisten Antibiotik terhadap Vibrio sp. Secara In
Vitro
Bakteri Vibrio sp.ditumbuhkan pada media NA selama 24 jam. Koloni tunggal yang tumbuh diambil kemudian disuspensi dalam larutan fisiologis sampai mencapai jumlah sel 108cfu/ml lalu disebarkan pada media MHA. Cakram kosong steril ditetesi dengan biakan bakteri resisten sebanyak 10-20 μl (dengan jumlah sel 108cfu/ml) kemudian diletakkan pada media MHA yang berisi isolat Vibrio sp. dan diinkubasi selama 24-48 jam pada suhu 30±2○C. Zona hambat diukur dengan penggaris pada dua posisi, selanjutnya dirata-ratakan. Pengujian dilakukan dengan 3 ulangan (Muliani et al. 2002). Alur kerja uji daya hambat bakteri resisten terhadap Vibrio sp. secara in vitro dapat dilihat pada Lampiran 6 (hlm 39).
3.9 Uji Tantang Bakteri Resisten Antibiotik Terhadap Bakteri Vibrio sp. Pada
Pemeliharaan Larva Udang
Uji tantang pada penelitian ini menggunakan bakteri resisten dan Vibrio sp. dengan jumlah sel 108
a. Perlakuan 1, yaitu larva udang tanpa diinokulasi bakteri (kontrol negatif)
cfu/ml. Uji tantang dilakukan dalam wadah berkapasitas 2 liter yang disi dengan 1 liter air laut dan ditebari larva udang PL9 sebanyak 20 ekor/wadah. Penelitian ini terdiri atas beberapa perlakuan, yaitu:
b. Perlakuan 2, yaitu larva udang diinokulasi dengan Vibrio sp. (dengan jumlah sel 108
c. Perlakuan 3, yaitu larva udang yang diinokulasi dengan Vibrio sp. dan isolat resisten antibiotik, masing-masing bakteri dengan jumlah sel 10
cfu/ml) (kontrol positif).
8
Untuk menjaga ketersediaan oksigen setiap wadah dilengkapi dengan aerasi. Suhu air dalam wadah pemeliharaan sebesar 35
cfu/ml.
3.10 Rancangan Penelitian dan Analisis Data
Penelitian dilakukan dengan menggunakan Rancangan Acak Lengkap masing-masing dengan tiga ulangan. Pengamatan larva udang yang mati diamati dalam tiap wadah dilakukan tiap 12 jam selama 96 jam perendaman bakteri kandidat biokontrol (Muliani et al. 2002). Data yang diperoleh dianalisis dengan metode Analysis of Variance (ANOVA) dan dilanjutkan dengan uji Duncan pada α = 0,05% (Gomez &
Gomez 1984 menggunakan SPSS versi 16).
3.11 Pengamatan dengan Scanning Electron Microscopy
Sampel larva udang dari isolat sp2, kontrol positif, dan kontrol negatif yang telah diberi perlakuan pada uji tantang masing-masing direndam dalam larutan caccodylate buffer kemudian setelah 2 jam larutan caccodylate dibuang. Setelah itu sampel ditambah dengan larutan glutaraldehid 2% kemudian setelah 2 jam larutan glutaraldehid dibuang lalu direndam dengan larutan tannic acid 2% selama 1 malam. Setelah itu dilakukan dehidrasi dengan alkohol pada konsentrasi yang bertingkat (direndam dalam alkohol 50% selama 5 menit, alkohol 70% selama 20 menit, alkohol 85% selama 20 menit dilakukan dalam suhu 4○C, alkohol 95% selama 20 menit, ditambahkan alkohol absolut selama 10 menit, dan direndam dalam tersier-butanol selama 10 menit) setiap pergantian konsentrasi pelarut, pelarut sebelumnya dibuang terlebih dahulu. Sampel dibekukan dalam tersier butanol dan dikeringkan dengan alat
freeze drying. Sampel kering ditempel diatas stub dan dibalut dengan ion coater. Stub
BAB IV
HASIL DAN PEMBAHASAN
4.1 Isolat Bakteri Resisten Antibiotik
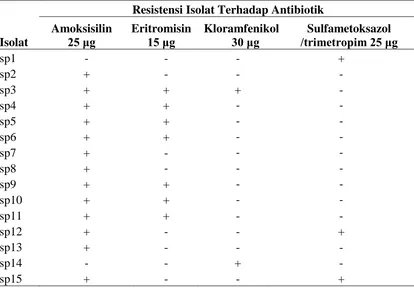
[image:37.612.114.528.341.629.2]Isolasi bakteri dari sampel air, udang, dan tanah memperoleh 54 isolat bakteri, 15 isolat (27,8%) diantaranya menunjukkan sifat resisten terhadap beberapa antibiotik. Jumlah isolat bakteri yang resisten terhadap antibiotik 25 μg amoksisilin sebanyak 13 (80%), 15 μg eritromisin sebanyak 7 (47%), 25 μg sulfametoksazol/trimetropim sebanyak 3 (20%) dan 30 μg kloramfenikol sebanyak 2 (13%) (Tabel 1).
Tabel 1. Hasil uji bakteri resisten antibiotik terhadap beberapa jenis antibiotik.
Isolat
Resistensi Isolat Terhadap Antibiotik
Amoksisilin
25 μg Eritromisin 15 μg Kloramfenikol 30 μg /trimetropim 25 μgSulfametoksazol
sp1 - - - +
sp2 + - - -
sp3 + + + -
sp4 + + ‐ ‐
sp5 + + ‐ ‐
sp6 + + ‐ ‐
sp7 + - ‐ ‐
sp8 + ‐ ‐ ‐
sp9 + + ‐ ‐
sp10 + + ‐ ‐
sp11 + + - -
sp12 + - - +
sp13 + - - -
sp14 - - + -
sp15 + - - +
Keterangan : + : Resisten, - : Tidak resisten
paling sedikit. Banyaknya isolat yang resisten terhadap amoksisilin mengindikasikan frekuensi dan volume penggunaan antibiotik yang lebih intensif pada tambak udang. Keberadaan isolat yang bersifat resisten terhadap antibiotik selain disebabkan karena frekuensi dan volume penggunaan antibiotik juga dipengaruhi oleh faktor-faktor lain seperti residu antibiotik di lingkungan dan sejarah penggunaan antibiotik (Anderson & Levin 1999). Informasi yang diperoleh dari pemilik tambak udang menyatakan bahwa tambak tradisional yang digunakan untuk memperoleh isolat bakteri resisten tidak menggunakan antibiotik. Sehingga keberadaan bakteri resisten pada tambak ini diduga berasal dari saluran pencernaan udang yang diperoleh ketika udang dalam fase pembibitan (hatchery)(Tendencia et al. 2001).
Rendahnya jumlah isolat yang resisten antibiotik terhadap kloramfenikol mungkin disebabkan karena frekuensi penggunaan yang sedikit dan adanya larangan dari pemerintah Indonesia untuk menggunakan kloramfenikol pada industri aquakultur (hewan yang akan dikonsumsi manusia). Kloramfenikol merupakan antibiotik spektrum luas yang dapat bersifat bakteriostatik dan menyebabkan aplastic anemia jika dikonsumsi dalam jangka panjang (Somjetlerdcharoen 2002).
Isolat bakteri resisten terhadap antibiotik dari tambak udang yang diperoleh pada penelitian ini memiliki karakteristik yang tidak jauh berbeda dengan yang diperoleh dari tambak udang di tempat yang berbeda antara lain Vietnam, India dan Pilipina (Tendencia et al. 2001; Manjusha 2005; Le et al. 2005). Umumnya bakteri resisten yang diisolasi dari tambak udang bersifat Gram negatif antara lain
Aeromonas, Pseudomonas, V. harveyi, V. mimicus, V. vulnificus, V. spelindus
(Tendencia et al. 2001), V. proteolyticus, V. alginolyticus, V. anguillarum, V. nereis, V. damsela, V. charchariaeae (Manjusha et al. 2005), V. agarivorans, Listonella anguillarum, Escherichia coli, dan beberapa bakteri Gram positif berbentuk batang yaitu antara lain; Bacillus cereus, B. anthracis, B. atrophaeus, B. mojavensis (Le et al.
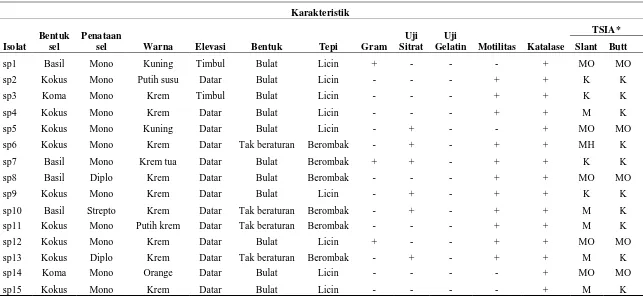
Hasil penelitian menunjukkan bahwa bakteri gram negatif lebih banyak ditemukan resisten dibandingkan dengan bakteri gram positif. Berdasarkan pengujian biokimia diperoleh isolat bakteri resisten umumnya bersifat gram negatif dan berbentuk batang pendek, semua isolat mampu menghidrolisis H2O2 dan gelatin, positif motilitas kecuali sp1, sp5, sp14, dan sp15 (Tabel 2).
Kemampuan bakteri dalam menghasilkan resistensi terhadap beberapa antibiotik dapat terjadi melalui 2 aspek yakni aspek biokimia dan aspek genetik. Mekanisme yang dilakukan bakteri gram negatif dalam menghasilkan resistensi mungkin melalui aspek biokimia yaitu dengan memompa (efflux pump) dan merubah permeabilitas membran luar. Hal ini disebabkan karena beberapa antibiotik yang menyerang bakteri gram negatif awalnya masuk kedalam membran luar melalui porin (Dzidic et al. 2008). Sehingga dengan perubahan permeabilitas membran luar maka beberapa antibiotik tidak mampu mencapai target yang diinginkan atau dapat menyebabkan penurunan penyerapan konsentrasi antibiotik untuk membunuh atau menghambat pertumbuhan bakteri.
Tabel 2. Karakteristik morfologi sel dan uji biokimia 15 isolat bakteri resisten antibiotik
Karakteristik
Isolat
Bentuk sel
Penataan
sel Warna Elevasi Bentuk Tepi Gram
Uji Sitrat
Uji
Gelatin Motilitas Katalase
TSIA*
Slant Butt
sp1 Basil Mono Kuning Timbul Bulat Licin + - - - + MO MO
sp2 Kokus Mono Putih susu Datar Bulat Licin - - - + + K K
sp3 Koma Mono Krem Timbul Bulat Licin - - - + + K K
sp4 Kokus Mono Krem Datar Bulat Licin - - - + + M K
sp5 Kokus Mono Kuning Datar Bulat Licin - + - - + MO MO
sp6 Kokus Mono Krem Datar Tak beraturan Berombak - + - + + MH K
sp7 Basil Mono Krem tua Datar Bulat Berombak + + - + + K K
sp8 Basil Diplo Krem Datar Bulat Berombak - - - + + MO MO
sp9 Kokus Mono Krem Datar Bulat Licin - + - + + K K
sp10 Basil Strepto Krem Datar Tak beraturan Berombak - + - + + M K
sp11 Kokus Mono Putih krem Datar Tak beraturan Berombak - - - + + M K
sp12 Kokus Mono Krem Datar Bulat Licin + - - + + MO MO
sp13 Kokus Diplo Krem Datar Tak beraturan Berombak - + - + + M K
sp14 Koma Mono Orange Datar Bulat Licin - - - - + MO MO
sp15 Kokus Mono Krem Datar Bulat Licin - - - - + M K
4.2 Kemampuan Bakteri Resisten Antibiotik Menghambat Pertumbuhan
Vibrio sp. Secara In vitro
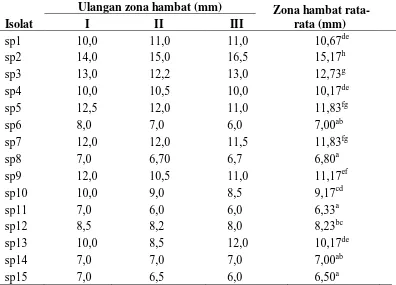
Hasil analisis yang diperoleh menunjukkan bahwa setiap isolat bakteri resisten menghasilkan zona hambat yang berbeda nyata terhadap pertumbuhan patogen
Vibrio sp. Isolat sp2 menunjukkan zona hambat yang terbesar dan berbeda secara signifikan dengan isolat resisten lainnya (Tabel 3). Untuk uji DMRT kemampuan bakteri resisten antibiotik menghambat pertumbuhan Vibrio sp. secara in vitro
[image:41.595.114.510.324.609.2]selengkapnya dapat dilihat pada Lampiran 10a (hlm 44).
Tabel 3. Hasil uji DMRT kemampuan bakteri resisten antibiotik menghambat pertumbuhan Vibrio sp. secara in vitro.
Isolat
Ulangan zona hambat (mm) Zona hambat
rata-rata (mm)
I II III
sp1 10,0 11,0 11,0 10,67de
sp2 14,0 15,0 16,5 15,17h
sp3 13,0 12,2 13,0 12,73g
sp4 10,0 10,5 10,0 10,17de
sp5 12,5 12,0 11,0 11,83fg
sp6 8,0 7,0 6,0 7,00ab
sp7 12,0 12,0 11,5 11,83fg
sp8 7,0 6,70 6,7 6,80a
sp9 12,0 10,5 11,0 11,17ef
sp10 10,0 9,0 8,5 9,17cd
sp11 7,0 6,0 6,0 6,33a
sp12 8,5 8,2 8,0 8,23bc
sp13 10,0 8,5 12,0 10,17de
sp14 7,0 7,0 7,0 7,00ab
sp15 7,0 6,5 6,0 6,50a
Keterangan: Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%.
Hasil uji secara in vitro menunjukkan beberapa isolat seperti sp2, sp3, dan sp7 memiliki zona hambat yang cukup luas juga yaitu berturut-turut 15,17 mm, 12,73 mm, dan 11,83 mm sedangkan isolat sp11 memiliki zona hambatan yang terendah. Kemampuan isolat sp2, sp3 dan sp7 dalam menghambat pertumbuhan
memproduksi senyawa metabolit sekunder yang bersifat toksin terhadap patogen
Vibrio sp. Pengujian lebih lanjut dilakukan untuk memastikan metabolit sekunder yang berperan.
4.3 Kemampuan Bakteri Resisten Antibiotik Menghambat Pertumbuhan
Bakteri Vibrio sp. Pada Larva Udang PL9
[image:42.595.115.511.416.731.2]Hasil perhitungan terakhir (96 jam perendaman) menunjukkan jumlah kumulatif kematian larva udang setelah pemberian bakteri resisten berbeda-beda pada setiap isolat. Hasil analisis statistik yang diperoleh menunjukkan bahwa isolat yang berbeda menyebabkan jumlah kematian yang berbeda nyata (Tabel 4). Untuk uji DMRT kemampuan isolat resisten terhadap Vibrio sp. dalam pemeliharaan larva udang PL9 selengkapnya dapat dilihat pada Lampiran 10b (hlm 46).
Tabel 4. Hasil uji DMRT kemampuan isolat resisten antibiotik terhadap Vibrio
sp. dalam pemeliharaan larva udang PL9.
Isolat Jumlah larva mati (%)
sp1 5b (23)
sp2 1a
sp3 (3) 12ef sp4 (55) 9de sp5 (47) 9cde sp6 (43) 13fg sp7 (67) 18g sp8 (78) 13fg sp9 (65) 16g sp10 (72) 9de sp11 (47) 6bc sp12 (32) 7bcd sp13 (35) 10e sp14 (52) 7bcd sp15 (33) 8cde Kontrol + (42) 14g Kontrol - (75) 4b (22)
Jumlah larva udang yang hidup pada perlakuan dari hari pertama sampai hari keempat terus berkurang. Jumlah kematian larva tertinggi ditemukan pada perlakuan dengan isolat sp7 (78%) kemudian diikuti kontrol positif sebesar 75%. Sedangkan jumlah kematian larva terkecil terlihat hanya pada perlakuan isolat sp2 sebesar 3%. Hal ini menunjukkan isolat sp2 memiliki kemampuan menurunkan serangan penyakit vibriosis.
Pada kontrol positif (dengan penambahan Vibrio sp.) menunjukkan persentase jumlah kematian larva udang sebesar 75% dan pada kontrol negatif (tanpa pemberian isolat resisten dan bakteri Vibrio sp.) sebesar 22%. Kematian pada kontrol negatif diduga karena larva udang mengalami penurunan sistem imun sehingga faktor lingkungan mudah mempengaruhi kelangsungan hidupnya. Sedangkan pada kontrol positif selain mengalami penurunan sistem imun, larva udang juga mendapat serangan dari patogen Vibrio sp. sehingga jumlah kematian larva tinggi.
Kemampuan bakteri resisten antibiotik untuk menghambat pertumbuhan
Vibrio sp. secara in vitro dan pada uji tantang dengan menggunakan larva udang menunjukkan hasil yang berbeda. Pada uji in vitro terlihat isolat sp7 mampu menghambat pertumbuhan Vibrio sp. dengan diameter zona hambat sebesar 11,83 mm sedangkan pada uji tantang menggunakan larva udang isolat sp7 menyebabkan jumlah kematian larva (vibriosis) yang terbesar yaitu 78%. Hal ini menunjukkan bahwa selain bakteri patogen yang menyebabkan kematian ada faktor lingkungan yang turut mempengaruhi kelangsungan hidup larva udang, antara lain pH, oksigen terlarut, perubahan suhu, kadar ammonia, nitrat dan sistem imun. Kualitas air tambak yang tidak baik dapat menjadikan larva udang rentan terhadap infeksi (Supamattaya et al. 2000). Kepadatan populasi, suhu air yang tinggi, dan pertukaran air yang sedikit akan meningkatkan faktor virulensi dari
Tingkat kematian larva udang pada perlakuan dengan isolat sp2 hanya 3% atau lebih kecil bila dibandingkan dengan kontrol negatif. Hal ini mengindikasikan bahwa isolat sp2 selain mampu menghambat pertumbuhan
Vibrio sp. secara in vitro, isolat sp2 juga diduga mampu meningkatkan sistem imun larva udang sehingga faktor lingkungan yang bersifat merugikan dapat diminimalisir pengaruhnya bagi kelangsungan hidup larva udang tersebut. Pada wadah pemeliharaan yang berisi isolat resisten selain sp2 memperlihatkan keadaan larva udang yang semakin hari semakin terlihat lemah (berenang dengan lambat) dan berwarna kemerahan.
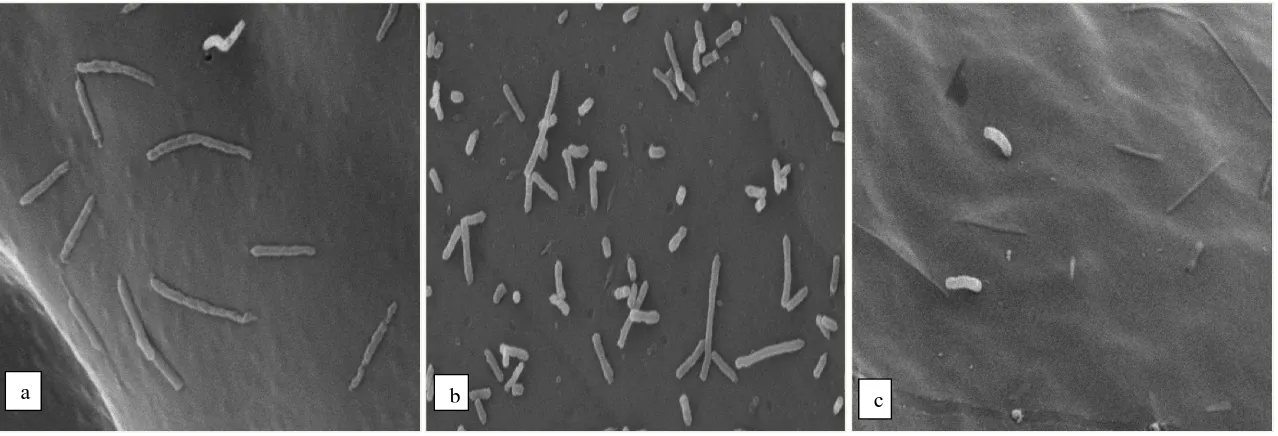
Pengamatan dengan scanning electron microscopy menunjukkan bahwa pada kontrol negatif (tanpa pemberian bakteri) terlihat permukaan tubuh larva udang tidak mengalami kerusakan yang signifikan dan kelihatan beberapa bakteri menempel dipermukaan tubuh larva yang diduga merupakan flora normal larva udang (Gambar 1a), sedangkan pada kontrol positif (dengan pemberian Vibrio sp.) kelihatan pada permukaan tubuh larva mengalami kerusakan dan terbentuk kolonisasi bakteri Vibrio sp. (Gambar 1b).
Kerusakan pada permukaan tubuh udang disebabkan karena Vibrio sp.
Isolat sp2 diduga mampu memproduksi enzim pemecah acyl homoserine lactone (AHL)sehingga mencegah tercapainya quorum sensing bakteri Vibrio sp. pada permukaan larva udang. Aktivitas enzim pemecah AHL ini pertama kali ditemukan pada Bacillus sp. 240B1 hasil isolasi dari tanah dan dikarakterisasi sebagai AHL-lactonase yang menghidrolisis ikatan lactone dan mengkode gen
aiiA (Dong & Zhang, 2005). Variovorax paradoxus dapat menggunakan AHL sebagai sumber energi dan nitrogen (Leadbetter & Greenberg, 2000), Ralstonia
strain XJ12B (Lin et al. 2003; Hu et al. 2003), Pseudomonas strain PAI-A dan P. aeruginosa PAO1 (Huang et al. 2003) mampu memproduksi enzim AHL-acylase yang menghidrolisis ikatan ke gugus amida (Dong & Zhang, 2005). Sejauh ini enzim pemecah AHL ini sudah digunakan untuk mengurangi virulensi patogen
Erwinia carotovora pada tanaman tembakau (Dong 2000), mengurangi gejala penyakit akar layu pada kentang (Dong et al. 2004) dan P. aeuginosa pada manusia (Molina et al. 2003).
Hasil pengamatan di lapangan terlihat bahwa keadaan air pemeliharaan pada wadah yang berisi isolat sp2 dan Vibrio sp. terlihat lebih bersih jika dibandingkan air pemeliharaan pada kontrol positif maupun kontrol negatif. Hal ini diduga larva udang yang sehat akan melakukan aktivitas metabolisme (misalnya: pola makan, gerak) yang baik sehingga kerusakan-kerusakan pada organ tubuh larva serta sisa-sisa pakan tidak menambah pencemaran pada air pemeliharaan.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat disimpulkan bahwa:
1. Dari tambak udang berhasil diisolasi 15 bakteri yang bersifat resisten terhadap beberapa antibiotik dengan kemampuan menghambat Vibrio sp. secara in vitro yang berbeda-beda.
2. Isolat sp2 diduga mampu menghasilkan senyawa metabolit sekunder yang efektif dalam menghambat pertumbuhan Vibrio sp. pada uji in vitro dengan zona hambat sebesar 15,17 mm, mampu mencegah terbentuknya kolonisasi atau pelekatan Vibrio sp. pada permukaan larva udang, dan mampu menghambat perkembangan serangan penyakit vibriosis sebesar 96% dengan persentase kematian larva udang hanya sebesar 3%.
5.2. Saran
DAFTAR PUSTAKA
Alderman DJ, Hasting TS. 1998. Antibiotic use in aquaculture: Development of antibiotic resistance-potencial for consumer health risk. J Food Sci Technol 33: 139-155.
Anderson IG, Shamsudin MN, Shariff M. 1998. Bacterial septicemia in juveniles tiger shrimp (Penaeus monodon) cultured in Malaysian brackishwater ponds.Asian Fis Sci2: 93-108.
Anderson DI, Levin BR. 1999. The biological cost of antibiotic resistance. Curr Opin Microbiol25 : 489-493.
Angulo F. 1999. Use of Antimicrobial Agents in Aquaculture: Potential for Public Health Impact. Public Health Service. Departement of Health and Service. CDC.18 october 00/apr00/04110/c000019.pdf).
Austin B, Pride AC, dan Rhodie GA. 2003. Association of a bacteriophage with virulence in Vibrio harveyi.J Fish Dis 26:55-58.
Barbieri E, Falzano, Fiorentini, Pianetti A, Baffone, Fabbri A, Matarrese, Casierra, Katouli, Kuhn I, Mollby R, Brusscolini, Donelli G. 1999. Occurrence, diversity, and pathogenicity of halophilic Vibrio spp. and non-O1 Vibrio cholerae from estuarine waters along the italian adriatic coast. J Appl Environ Microbiol 65: 2748-2753.
Baticados MCL, Lavila-Pitogo CR, Cruz-Lazierda ER, de la Pena LD, Sunaz NA. 1990. Studies on the chemical control of luminous bacteria Vibrio harveyi
and Vibrio splendidus isolated from diseased Penaeus monodon larvae and rearing water. Dis Aquat Org 9: 133-139.
Cabello EC. 2006. Heavy use of prophylactic antibiotics in aquaculture: a growing problem for human and animal health and for the environment. J Environ Microbiol8: 1137–1144.
Cottrell MT, Kirchman DL. 2003. Contribution of major bacterial groups to bacterial biomass production (thymidine and leucine incorporation) in the delaware estuary. J Limnol Oceanografi 48: 168-178.
Defoirt T, Nico B, Patrick S, Willy V, Peter B. 2007. Alternatives to antibiotics to control bacterial infections: luminescent vibriosis in aquaculture as an Example. Rev Trends Biotech10: 472-478.
Dong YH, Zhang LH. 2005. Quorum sensing and quorum quenching enzymes. J Microbiol43: 101-109.
Dong YH, Zhang XF, Xu JL, Zhang LH. 2004. Insecticidal Bacillus thuringiensis
silences Erwinia carotovora virulence by a new form of microbial antagonism signal interference. Appl Environ Microbiol70: 954-960. Dong YH, Xu ZL, Li XZ, Zhang LH. 2000. AiiA, an enzyme that inactivates the
acylhomoserine lactone quorumsensing signal and attenuates the virulence of Erwinia carotovora. Proc Natl Acad. Sci USA 97: 3526-3531.
Devaraja TN, Otta SK, Shubha G, Karunasagar I, Tauro P. 1998. Immunostimulation of shrimp through oral administration of Vibrio
bacteria and yeast glucan. Di dalam: Flegel TW (ed). Advances in shrimp biotechnology. Bangkok: National Center for Genetic Engineering and Biotechnology: 167-170.
Direktorat Jenderal Perikanan Daerah. 2010. Statistik Perikanan 2005. Direktorat Jenderal Perikanan Serdang Bedagai.
Dzidic S, Suskovic J, Kos B. 2008. Antibiotic resistance mechanisms in bacteria: biochemical and genetic aspects.Food Technol Biotechnol 46: 11–21. Farzanfar A. 2006. The use probiotics in shrimp aquaculture. FEMS Imonol Med
Microbiol48: 149-158.
Gomez KA, Gomez AA. 1984. Statistical procedures for agricultural research.
Wiley IEEE.
Hektoen H, Berge JA, Hormazabal V, Yndeslad M. 1995. Persistence of antibacterial agents in marine sediment. Aquaculture133 :175-84.
Henke JM, Bassler BL. 2004. Quorum sensing regulates type III secretion Vibrio harveyi and Vibrio parahemolyticus. J Bacteriol 186: 3794-3805.
Hu JY, Yang F, Lin YH, Zhang HB, Ong SL, Dong JL, Xu WJ, Ng, Zhang LH. 2003. Microbial diversity and prevalence of virulent pathogens in biofilms developed in a water reclamation system. Res Microbiol 154: 623-629. Huang JJ, Han LH, Zhang, dan Leadbetter JR. 2003. Utilization of
acyl-homoserine lactone quorum signals for growth by a soil pseudomonad and
Hugo WB, Russel AD. 1998. Pharmaceutical microbiology. edisi ke enam Blackwell science Ltd London.181-184.
Isnansetyo A, Indah I, Muhtadi, Shofihar, Rudi KH, Triyanto, Jaka W. 2009. A potential bacterial biocontrol agent, strain S2V2 against pathogenic marine Vibrio in aquaculture. World J Microbiol Biotechnol25:1103–1113.
Izzati M. 2007. Skreening potensi antibakteri pada beberapa spesies rumput laut terhadap bakteri patogen pada udang windu. Bioma 9(2): 62-67.
Jawetz M, Adelberg. 1996. Mikrobiologi kedokteran. Edisi 20. EGC Jakarta: 151-160.
Kanagu L, Senthilkumar P, Stella C, Jaikumar M. 2010. Effect vitamin C, E and β 1,3 Glucans Immunomodulator in P. monodon Diseases Management. J Sci Res6(5): 537-543.
Karunasagar IM, Vinod B, Kennedy A, Vijay A, Deevanjali K, Umes, Karunasagar I. 2005. Biocontrol of bacterial pathogens in aquaculturewith emphasis on phage therapy. Dis Asian Aquaculturev :535-542.
Kusman. 2007. Antibiotik ancam ekspor udang Indonesia. Tersedia pada
. [ 7 April 2009].
Leadbetter JR, Greenberg EP. 2000. Metabolism of acylhomoserine lactone quorum-sensing signals by Variovorax paradoxus. J Bacteriol 182: 6921-6926.
Le TX, Munekage Y, Kato Si. 2005. Antibiotic resistance in bacteria from shrimp farming in mangrove areas. Sci Environ 349 :95-105.
Lin YH, Xu JL, Hu J, Wang LH, Ong SL, Leadbetter JR, Zhang LH. 2003. Acyl-homoserine lactone acylase from Ralstonia strain XJ12B represents a novel and potent class of quorum-quenching enzymes. Mol Microbiol 47: 849-860.
Long RA, Azam F. 2001. Antagonistic interactions among marine pelagic bacteria. J Appl Environ Microbiol67: 4975-4983.
Manjusha S, Sarita GB, Elyas KK, Chandrasekaran M. 2005. Multiple antibiotic resistance of Vibrio isolates from coastal and brackish water areas. J Biochem and Biotech1: 201-206.
Molina L, Constantinescu F, Michel L, Reimmann C, Duffy B, De´fago G. 2003. Degradation of pathogen quorum-sensing molecules by soil bacteria: a preventive and curative biological control mechanism. FEMS Microbiol Ecol45: 7181.
Moriarty DJW. 1999. Diseases control in shrimp aquaculture with probiotic bacteria, proceeding of the 8th
Muliani, Suwanto A, Hala Y. 2003. Isolasi dan karakterisasi bakteri asal laut sulawesi untuk biokontrol penyakit vibriosis pada larva udang windu (Penaeus monodon Fab.).Hayati10: 6-11.
international symposium on microbial ecology. Atlantic Canada Society for Microbial Ecology. Halifax, Canada.
Oxley AP, ShiptonW, Owens L, McKay D. 2002. Bacterial flora from the gut of the wild and cultured banana prawn, Penaeus merguiensis. J Appl Microbiol 93: 214-223.
Rao VA. 2000. Vibriosis in Shrimp Aquaculture. Review Article.
Serrano PH. 2005. Responsible use of antibiotics in aquaculture. FAO Fisheries Technical Paper. Food and Agriculture Organization of The United Nations, Rome.
Sharma KSR, Shankar KM, Sathyanarayana ML, Patil RR, Swamy HDN, Rao S. 2010. Development of biofilm of Vibrio alginolyticus for oral immunostimulation of shrimp. Aquacult Int19: 421-430.
Somjetlerdcharoen A. 2002. Chloramfenicol concerns in shrimp culture. Aquatic Medicine1: 1-2.
Supamattaya K, Chittiwan V, Booyaratpalin M. 2000. Immunological factors in black tiger shrimp (Penaeus monodon) Fabricius. Article Aquatic Animal Health Research Center, Thailand.
Supriyadi H, Rukyani A. 1992. The use of chemical in aquaculture in Indonesia. Research Intitute for FreshWater Fisheries Sukamandi West Java, Indonesia.
Suyanto SR, Mujiman A. 2001. Budidaya udang windu. Cetakan 13. Jakarta: Penebar swadaya: 12-17.
Steel RGD, Torrie JH. 1960. Principles and procedures of statistics. McGraw. New York
Taga ME, Bassler BL. 2003. Chemical communication among bacteria. PNAS100
: 14549–14554
Tendencia AE, Leobert D, de la pena. 2000. Antibiotic resistance of bacteria from shrimp ponds. Aquaculture 195: 193-204.
Tenover CF. 2006. Mechanisms of antimicrobial resistance in bacteria. J Medic 119: S3-S10.
Thompson LP, Lida T, Swing J. 2004. Biodiversity of Vibrios. J Microbiol and Mol Biol Rev68: 403-431.
Wai SN, Mizunoe, Yoshida S. 1999. How Vibrio cholera survive during starvation. FEMS Microbiol Lett180: 123-131.
Weber JT, Mintz ED, Canizares R, Semiglia A, Gomez I, Sempertegu R, davilla A, Greene KD, Puhri ND, Cameron DN, Tenover FC, Barreti TJ, Bean NH, Ivey C, Tauxe RV, Blake PA. 1994. Epidemic cholera in Ecuador: multidrug-resistance and transmission by water and seafood. Epidemiol Infect112: 1-11.
LAMPIRAN 1. Alur kerja isolasi bakteri resisten antibiotik
‐ Ditimbang sebanyak 1 g
‐ Dihomogenkan dalam 10 ml dalam aquadest steril.
Sampel Tanah Sampel Air Sampel Udang
- Ditimbang sebanyak 1 g - Dihomogenkan dalam 10 ml
aquadest steril.
‐ Dipipet 1ml
‐ Ditambah aquadest steril 9 ml
‐ Dihomogenkan.
Konsentrasi 10-1
‐ Dilanjutkan pengenceran sampai 10-4
Konsentrasi 10-4
‐ Dipipet 100 µl
‐ Disebarkan pada media NA
‐ Diinkubasi pada suhu 30±2○C selama 24-48 jam
Kultur campuran bakteri kandidat resisten antibiotik
‐ Disubkultur masing-masing ke media NA
LAMPIRAN 2. Pembuatan larutan standar McFarland 108 cfu/ml
0,048 M BaCl2
0,36 N H2SO4
‐ Diambil sebanyak 0,5 ml ‐ Diambil sebanyak 99,5 ml
Hasil
- Dihomogenkan kedua larutan
‐ Diukur densitas suspensi dengan
menggunakan spektrofotometer (nilai absorbansinya 625nm ± 0,13)
LAMPIRAN 3. Alur kerja uji sensitivitas bakteri terhadap beberapa jenis antibiotik
- Diambil dengan jarum ose
- Disuspensi kedalam larutan fisiologis (NaCl 0,9%) - Dibandingkan dengan larutan McFarland (108 - Disebarkan pada media MHA
cfu/ml)
- Diletakkan cakram yang berisi antibiotik - Diinkubasi pada T; 30±2○C selama 24-48 jam Isolat murni tanah Isolat murni udang Isolat murni air
Zona Hambat
-Diukur pada 2 posisi dengan jangka sorong
LAMPIRAN 4. Alur kerja isolasi bakteri patogen Vibrio sp.
Air Tambak PT. BUDI
- Diambil sebanyak 0,1 ml - Disebarkan pada media TCBSA
- Diinkubasi pada T: 30±2○C selama 24-48 jam
Isolat tunggal
- Dikarakterisasi secara morfologi, pewarnaan gram dan uji biokimia sederhana
LAMPIRAN 5. Alur kerja uji patogenitas bakteri resisten antibiotik terhadap larva udang windu PL10
Bakteri resisten antibiotik
Suspensi bakteri kandidat biokontrol dengan kepekatan 50 X
- Diambil dengan ose
- Dimasukkan dalam 5 ml air laut - Dihomogenkan
- Diambil sebanyak 9,9 ml air laut - Dihomogenkan
- Disesuaikan kekeruhannya sesuai dengan standar Mc Farland (108 cfu/ml)
- Sebanyak 10 ml (108 cfu/ml) ditambah pada pemeliharaan yang berisi 1 l air laut dan 20 ekor larva.
- Direndam selama 96 jam - Dihitung jumlah larva yang mati
LAMPIRAN 6. Alur kerja uji daya hambat bakteri resisten antibiotik terhadap Vibrio sp. secara in vitro
Bakteri resisten antibiotik Vibrio sp.
- Masing-masing disubkultur selama ± 24 jam pada media NA - Diambil dengan jarum ose
- Masing-masing dilarutkan dalam larutan fisiologis (NaCl 0,9%) - Dihomogenkan dan disesuaikan kekeruhannya dengan
standar McFarland (108 cfu/ml)
Suspensi bakteri resisten antibiotik
Suspensi bakteri Vibrio sp.
- Ditetesi sebanyak10-20μl pada cakram steril dipermukaan media MHA yang berisi isolat
Vibrio sp.
- Disebarkan dengan cotton
swab pada permukaan media MHA
Hasil
- Diinkubasi pada T: 30±2○C selama 24-48 jam
- Diukur zona hambat yang terbentuk dengan jangka sorong
LAMPIRAN 7. Alur kerja uji tantang bakteri resisten antibiotik terhadap Vibrio sp. pada pemeliharaan larva udang PL 9
Wadah berkapasitas 2 liter
Uji tantang Kontrol positif Kontrol negatif
Hasil Hasil Hasil
- Ditambah 5 ml suspensi Bakteri Resisten Antibiotik
- Ditambah 5 ml suspensi Vibrio sp.
- Dihitung jumlah larva yang mati setelah 96 jam
- Ditambah 10 ml suspensi Vibrio sp. - Dihitung jumlah larva mati setelah 96 jam
perendaman Vibrio sp.
- Dihitung jumlah larva
yang mati setelah 96 jam - Dimasukkan air laut steril 1 liter
Lampiran 8. Alur kerja uji khitinase bakteri patogen Vibrio sp.
Vibrio sp.
‐ Diambil dengan ose.
‐ Kemudian dihomogenkan dalam larutan fisiologis 0,9% hingga kekeruhannya sesuai dengan standar McFarland 108cfu/ml
‐ Ditetesi sebanyak ±20μl pada cakram
steril.
‐ Cakram diletakkan pada media yang
mengandung khitin.
‐ Diinkubasi pada T: 30±2○C selama 24-48 jam
‐ Diamati diameter zona bening disekitar
LAMPIRAN 9. Diameter hasil uji sensitivitas bakteri resisten terhadap beberapa jenis antibiotik
Isolat
Sumber
isolat A K E ST
sp1 Udang 21,0 33,0 35,0 7,0
sp2 Udang 9,0 22,0 23,0 14,0
sp3 Udang 6,0 9,0 13,0 21,0
sp4 Udang 6,0 33,0 11,0 27,0
sp5 Udang 6,0 28,0 13,0 20,5
sp6 Air 6,0 26,0 14,0 15,0
sp7 Air 6,0 25,2 15,0 20,5
sp8 Air 7,0 32,5 20,0 23,0
sp9 Air 13,0 15,0 9,50 15,0
sp10 Air 12,0 21,0 13,0 22,5
sp11 Tanah 15,0 28,0 6,0 25,0
sp12 Tanah 7,5 27,0 18,0 10,0
sp13 Tanah 6,0 23,0 21,0 23,0
sp14 Tanah 15,5 10,9 22,5 25,0
sp15 Tanah 6,0 25,0 17,5 6,0
Keterangan: A: 25μg Amoksisilin, K: 30 μg Kloramfenikol, E: 15 μg Eritromisin, dan ST : 25 μg Sulfametoksazol/Tritmetropim.
Diameter Zona Hambat Standar Antibiotik
Jenis antibiotik
Konsentrasi cakram
antibiotik Diameter zona hambat (mm)
Sensitif Intermediate Resisten
Amoksisilin 25 μg ≥ 15 12 s/d 14 ≤ 11
Kloramfenikol 30 μg ≥ 18 13 s/d 17 ≤ 12
Eritromisin 15 μg ≥ 23 14 s/d 22 ≤ 13
Sulfametoksazol/Trimetropim 25 μg ≥ 16 11 s/d 15 ≤ 10 Sumber: Clinical and Laboratory Standards Institute (CLSI, formerly NCCLS)
Lampiran 10. Analisis statistik dengan menggunakan SPSS 16
a. Pengaruh isolat bakteri resisten antibiotik dalam menghambat
pertumbuhan Vibrio sp. secara in vitro.
ANOVA
Zona Hambat JK DB KT Fhitung Sig.
Perlakuan Galat Total 296.019 17.613 313.632 14 30 44 21.144
.587 36.014 .000
Deskriptif
Zona Hambat
ISOLAT
N Mean Std. Deviasi Std. Error
95% Confidence
Interval for Mean
Minimum Maksimum Batas bawah Batas atas
Zona Hambat
Duncan
Isolat N
Subset for alpha = 0.05
1 2 3 4 5 6 7 8
sp11 3 6.3333
sp15 3 6.5000
sp8 3 6.8000
sp6 3 7.0000 7.0000
sp14 3 7.0000 7.0000
sp12 3 8.2333 8.2333
sp10 3 9.1667 9.1667
sp4 3 10.1667 10.1667
sp13 3 10.1667 10.1667
sp1 3 10.6667 10.6667
sp9 3 11.1667 11.1667
sp5 3 11.8333 11.8333
sp7 3 11.8333 11.8333
sp3 3 12.7333
sp2 3 15.1667
Sig. .351 .071 .146 .141 .154 .097 .184 1.000
b. Pengaruh isolat bakteri resisten antibiotik terhadap pertumbuhan Vibrio sp. dalam pemeliharaan larva udang PL9
ANOVA
LARVA MATI JK DB KT Fhitung Sig.
Perlakuan Galat Total 808.980 72.000 880.980 16 34 50 50.561
2.118 23.876 .000
Deskriptif
LARVA MATI
ISOLAT
N Rataan
Std.
Deviasi Std. Error
95% Confidence
Interval for Mean
Minimum Maksimum Batas
bawah
Batas
atas
sp1 3 4.6667 .57735 .33333 3.2324 6.1009 4.00 5.00
sp2 3 1.0000 1.73205 1.00000 -3.3027 5.3027 .00 3.00
sp3 3 11.0000 2.00000 1.15470 6.0317 15.9683 9.00 13.00
sp4 3 9.3333 .57735 .33333 7.8991 10.7676 9.00 10.00
sp5 3 8.6667 2.08167 1.20185 3.4955 13.8378 7.00 11.00
sp6 3 13.3333 1.52753 .88192 9.5388 17.1279 12.00 15.00
sp7 3 15.6667 .57735 .33333 14.2324 17.1009 15.00 16.00
sp8 3 13.0000 2.00000 1.15470 8.0317 17.9683 11.00 15.00
sp9 3 14.3333 1.52753 .88192 10.5388 18.1279 13.00 16.00
sp10 3 9.3333 1.52753 .88192 5.5388 13.1279 8.00 11.00
sp11 3 6.3333 1.15470 .66667 3.4649 9.2018 5.00 7.00
sp12 3 7.0