Irma Suraya 08 0405 001
Universitas Sumatera Utara
PRA RANCANGAN PABRIK
PEMBUATAN BIOHIDROGEN DARI LIMBAH CAIR
PABRIK KELAPA SAWIT DENGAN FERMENTASI
ANAEROBIK PADA KONDISI TERMOFILIK UNTUK
KAPASITAS PRODUKSI 371,3771 TON/HARI
SKRIPSI
Diajukan untuk Memenuhi Persyaratan
Ujian Sarjana Teknik Kimia
DISUSUN OLEH:
IRMA SURAYA
NIM: 080405001
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
MEDAN
Irma Suraya 08 0405 001
Universitas Sumatera Utara
PRA RANCANGAN PABRIK
PEMBUATAN BIOHIDROGEN DARI LIMBAH CAIR PABRIK
KELAPA SAWIT DENGAN FERMENTASI ANAEROBIK PADA
KONDISI TERMOFILIK UNTUK KAPASITAS PRODUKSI
371,3771 TON/TAHUN
TUGAS AKHIR
Diajukan Untuk Memenuhi Persyaratan Ujian Sarjana Teknik Kimia
Oleh:
IRMA SURAYA
08 0405 001
Telah Diperiksa / Disetujui,
Dosen Pembimbing I Dosen Pembimbing II
Dr. Eng. Ir. Irvan, M.Si Ir. Bambang Trisakti, MT NIP : 19680820 199501 1 001 NIP : 19660925 199103 1 003
Dosen Penguji I Dosen Penguji II Dosen Penguji III
Ir. Bambang Trisakti, MT Dr. Ir. Taslim, M.Si Dr.Eng.Rondang Tambun, ST,MT NIP : 19660925 199103 1 003 NIP :19650115 199003 1 002 NIP: 19720612 200012 1 001
Mengetahui, Koordinator Tugas Akhir
Ir. Renita Manurung, MT NIP. 19681214 199702 2 002
DEPARTEMEN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA MEDAN
Irma Suraya 08 0405 001
Universitas Sumatera Utara
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas segala limpahan nikmat yang telah diberikan berupa nikmat iman, kesehatan dan rizki, sehingga Penulis dapat menyelesaikan Tugas Akhir ini dengan judul “Pra Rancangan Pabrik Pembuatan Biohidrogen dari Limbah Cair Pabrik Kelapa Sawit dengan Fermentasi Anaerobik pada Kondisi Termofilik untuk Kapasitas Produksi 371,3771 Ton/Tahun.”
Pra rancangan pabrik ini disusun untuk melengkapi tugas-tugas dan merupakan salah satu syarat untuk menempuh ujian sarjana pada Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara
Terima kasih dan hormat penulis sampaikan kepada kedua orang tua penulis, Ayahanda Muslim dan Ibunda Maryati yang senantiasa mendukung dan mendoakan penulis dalam menyelesaikan amanah sebagai seorang anak, khususnya dalam melaksanakan studi dan proses pengerjaan tugas akhir ini.
Terima kasih banyak juga penulis sampaikan kepada dosen pembimbing penulis yaitu Bapak Dr.Eng.Ir.Irvan, M.Si dan Bapak Ir.Bambang Trisakti, MT yang dengan sabar dan tabahnya dalam membimbing penulis dalam menyelesaikan tugas akhir ini.
Selain itu, penulis juga mengucapkan terima kasih kepada :
1. Ibu Ir. Renita Manurung, MT selaku Koordinator Tugas Akhir Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara.
2. Bapak Dr.Ir.Taslim, M.Si sebagai dosen penguji II dan Bapak Dr.Eng.Rondang Tambun,ST,MT sebagai dosen penguji III atas kritik dan sarannya untuk perbaikan tugas akhir ini.
3. Seluruh Staf Pengajar dan Pegawai Departemen Teknik Kimia yang telah memberikan ilmu dan pengalaman yang sangat berharga kepada Penulis.
Irma Suraya 08 0405 001
Universitas Sumatera Utara
5. Hari Tiarasti atas kerja sama, bantuan dan kesabarannya sebagai sahabat dan partner setia Penulis selama melaksanakan Kerja Praktek, Penelitian dan Tugas Akhir ini.
6. Rekan seperjuangan yang disatukan oleh aqidah dan dakwah atas segala bentuk dukungannya selama kuliah ataupun tugas akhir serta adik-adik di lingkaran cahaya yang turut mendukung dan mendoakan penulis yang tidak bisa disebutkan satu persatu.
7. Aminah,Indri,Afiifah,Ayu,Yuli,Lina,Febri,Ana dan semua teman-teman stambuk 2008 Tekim USU serta rekan LPPM atas segala bentuk dukungannya.
8. Teman seperjuangan satu kos Elfi dan Ayu atas semangat yang diberikan kepada penulis.
Semoga Tugas Akhir ini dapat bermanfaat bagi setiap pembacanya. Penulis menyadari masih terdapat kekurangan dalam Tugas Akhir ini, segala kritik dan saran yang bersifat membangun penulis terima dengan lapang dada untuk perbaikan selanjutnya. Terima kasih.
Medan, Oktober 2012
Penulis
Irma Suraya 08 0405 001
Universitas Sumatera Utara
I N T I S A R I
Pada saat ini, sumber energi yang yang masih banyak dikonsumsi konsumen adalah yang berasal dari unrenewable, sedangkan permintaan semakin meningkat. Sehingga di dunia terjadi krisis energi dan berusaha mencari sumber energi alternatif ataupun terbarukan. Salah satu energi tersebut adalah Biohidrogen yang dapat diolah dari biomassa yang kaya akan karbohidrat. Selain itu, biohidrogen merupakan bahan bakar yang ramah lingkungan, karena pembakarannya hanya menghasilkan gas tunggal yaitu H2O. Indonesia merupakan negara yang menghasilkan Limbah Cair Kelapa Sawit yang besar, oleh karena itu potensi untuk memanfaatkan limbah tersebut menjadi biohidrogen sangat besar, sehingga hal ini mendorong untuk dibuatnya suatu pra rancangan pabrik pembuatan biohidrogen dengan tujuan untuk memenuhi permintaan konsumen terhadap energi dan turut berperan dalam mengembangkan green technology.
Biohidrogen diproduksi 371,3771 ton/tahun dengan 365 hari kerja dalam 1 tahun. Lokasi pabrik direncanakan di daerah Tebing Tinggi, Sumatera Utara dengan luas areal 13.250 m2. Tenaga kerja yang dibutuhkan berjumlah 178 orang dengan bentuk badan usaha Perseroan Terbatas (PT) yang dipimpin oleh seorang direktur dengan struktur organisasi sistem garis dan staf.
Hasil analisa ekonomi Pabrik Pembuatan Biohidrogen ini adalah sebagai berikut :
- Total Modal Investasi : Rp 435.177.243.449,-- Total Biaya Produksi : Rp 287.408.335.886,- - Hasil Penjualan : Rp 459.777.004.440 - Laba Bersih : Rp 120.109.763.718,-
- Profit Margin (PM) : 37,3 %
- Break Even Point (BEP) : 52,28 %
- Return on Investment (ROI) : 27,6 %
- Pay Out Time (POT) : 3,62 tahun
- Return on Network (RON) : 46 %
- Internal Rate of Return (IRR) : 43,53
Irma Suraya 08 0405 001
Universitas Sumatera Utara
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
INTISARI ... ii
DAFTAR ISI ... iii
DAFTAR GAMBAR ... vii
Irma Suraya 08 0405 001
Universitas Sumatera Utara
2.8.1 Biofotolisis Langsung ... II-14 2.8.2 Biofotolisis Tak Langsung ... II-15 2.8.3 Photo Fermentation (Fermentasi Cahaya) ... II-16 2.8.4 Dark Fermentation (Fermentasi Gelap) ... II-16 2.8.5 Proses HYVOLUTION ... II-18 2.9 Deskripsi Proses dan Sifat – Sifat Bahan Baku dan Produk ... II-19
2.9.1 Deskripsi Proses Pembuatan Biohidrogen dari Fermentasi Limbah Cair Pabrik Kelapa Sawit ... II-19 2.9.2 Sifat – Sifat Bahan Baku dan Produk ... II-22 2.9.2.1 Natrium Hidroksida (NaOH) ... II-22 2.9.2.2 Ferro Klorida (FeCl2) ... II-23 2.9.2.3 Natrium Posfat Dihidrat (Na2HPO4.2H2O) ... II-23 2.9.2.4 Dikalium Posfat (K2HPO4) ... II-23 2.9.2.5 Natrium Nitrat (NaNO3) ... II-24 2.9.2.6 Natrium Klorida (NaCl) ... II-24 2.9.2.7 Magnesium Diklorida Heksahidrat
Irma Suraya 08 0405 001
Universitas Sumatera Utara
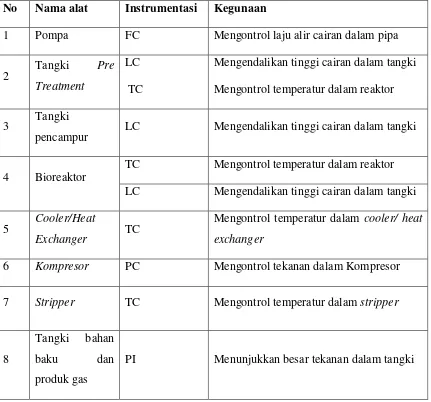
6.2.4 Pengendalian ... VI-4 6.2 Tujuan Pengendalian ... VI-4 6.3 Penggunaan Instrumentasi pada Pra Rancangan Pabrik
Pembuatan Biohidrogen ... VI-5 6.4 Keselamatan Kerja Pabrik ... VI-7 6.5 Keselamatan Kerja pada Pabrik Pembuatan Biohidrogen dari
Irma Suraya 08 0405 001
Universitas Sumatera Utara
7.6.4 Unit Pengolahan Limbah dengan Sistem Activated
Irma Suraya 08 0405 001
Universitas Sumatera Utara
Irma Suraya 08 0405 001
Universitas Sumatera Utara
DAFTAR GAMBAR
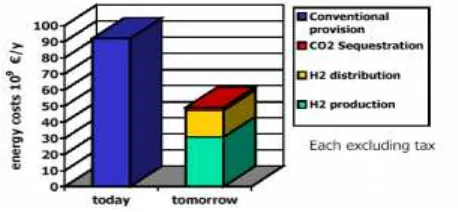
Gambar 2.1 Flowsheet Proses HYDROFORM-C Mahler Gas ... II-11 Gambar 2.2 Flowsheet Proses HYDROFORM-M Mahler Gas ... II-12 Gambar 2.3 Flowsheet Proses HYDROSWING-GMahler Gas ... II-12 Gambar 2.4 Perbandingan Biaya Energi Sekarang dan Masa Depan
Menggunakan Biohidrogen di Jerman ... II-13 Gambar 2.5 Mobil Toyota Konsep Bahan Bakar Hidrogen ... II-14 Gambar 2.6 Flowsheet Proses Pembentukan Hidrogen dengan PHF ... II-16 Gambar 2.7 Flowsheet Proses Pembentukan Hidrogen dengan THF ... II-18 Gambar 2.8 Skema Proses HYVOLUTION ... II-18 Gambar 6.1 Empat Elemen pada Sistem Pengendalian ... VI-3 Gambar 8.1 Tata Letak Pabrik Biohidrogen ... VIII-5 Gambar 8.2 Tata Letak Pabrik Pembuatan Biohidrogen dari LCPKS... VIII-9 Gambar 9.1 Bagan Struktur Organisasi Perusahaan Pabrik Pembuatan
Biohidrogen ... IX-17 Gambar LD.1 Sketsa Sebagian Bar Screen (Tampak Atas)... LD-2 Gambar LD.2 Grafik Entalpi dan Temperatur Cairan pada Cooling Tower LD-32 Gambar LD.3 Kurva 1/(Hy*-Hy) terhadap Hy ... LD-33 Gambar LD.1 Sketsa Sebagian Bar Screen (Tampak Atas)... LD-2 Gambar LE.1 Hasil Regresi Koefisien Korelasi Harga Indeks
Marshall dan Swift ... LE-5 Gambar LE.2 Harga Peralatan Tangki Penyimpanan (Storage) dan
Irma Suraya 08 0405 001
Universitas Sumatera Utara
DAFTAR TABEL
Tabel 2.1 Komposisi Kimia Limbah Cair POME ... II-9 Tabel 2.2 Karakteristik Limbah POME dan Baku Mutu Limbah ... II-10 Tabel 3.1 Neraca Massa pada Tangki Pre-Treatment (M-103) ... III-1 Tabel 3.2 Neraca Massa pada Tangki Pencampur(M-107) ... III-1 Tabel 3.3 Neraca Massa pada Reaktor Biohidrogen (R-201) ... III-2 Tabel 3.4 Neraca Massa pada Reaktor Biogas (R-203) ... III-2 Tabel 3.5 Neraca Massa pada Absorber Desulfurisasi (T-301) ... III-3 Tabel 3.6 Neraca Massa pada Bioreaktor Desulfurisasi (R-303) ... III-3 Tabel 3.7 Neraca Massa pada Clarifier (S-306) ... III-3 Tabel 3.8 Neraca Massa pada Kolom Absorber CO2 (T-308) ... III-4 Tabel 3.9 Neraca Massa pada Stripper (T-313) ... III-4 Tabel 3.10 Neraca Massa pada PSA (T-316) ... III-4 Tabel 4.1 Neraca Energi pada Tangki Pre-Treatment (M-103) ... IV-1 Tabel 4.2 Neraca Panas pada Tangki Pencampur(M-107) ... IV-1 Tabel 4.3 Neraca Panas pada Reaktor Biohidrogen (R-201) ... IV-2 Tabel 4.4 Neraca Energi pada Reaktor Biogas (R-203) ... IV-2 Tabel 4.5 Neraca Panas pada Cooler (E-207) ... IV-3 Tabel 4.6 Neraca Panas pada Absorber Desulfurisasi (T-301) ... IV-3 Tabel 4.7 Neraca Energi pada Bioreaktor Desulfurisasi (R-303) ... IV-4 Tabel 4.8 Neraca Energi pada Absorber CO2 (T-308) ... IV-4 Tabel 4.9 Neraca Energi Pada Heat Exchanger (E-310) ... IV-5 Tabel 4.10 Neraca Energi Stripper (T-313) ... IV-5 Tabel 4.11 Neraca Energi pada Cooler (E-311)... IV-5 Tabel 4.12 Neraca Energi pada Cooler (E-404)... IV-6 Tabel 4.13 Neraca Energi pada Cooler (E-315)... IV-6 Tabel 4.14 Neraca Energi pada Cooler (E-407)... IV-6 Tabel 6.1 Jenis Variabel Pengukuran dan Controller yang Digunakan ... VI-2 Tabel 6.2 Daftar Penggunaan Instrumentasi pada Pra Rancangan Pabrik
Irma Suraya 08 0405 001
Universitas Sumatera Utara
Tabel 6.3 Jumlah Peralatan Pencegah Kebakaran... VI-9 Tabel 6.4 Jumlah Peralatan Perlindungan Diri ... VI-12 Tabel 7.1 Kebutuhan Uap Sebagai Media Pemanas ... VII-1 Tabel 7.2 Kebutuhan Air Pendingin Pada Alat ... VII-2 Tabel 7.3 Pemakaian Air Untuk Berbagai Kebutuhan ... VII-4 Tabel 7.4 Kualitas Air Sungai Padang ... VII-5 Tabel 7.5 Syarat Air Umpan Ketel Uap ... VII-8 Tabel 7.6 Kebutuhan Daya pada Unit Proses ... VII-12 Tabel 7.7 Kebutuhan Daya pada Unit Utilitas ... VII-13 Tabel 7.8 Spesifikasi Pompa Limbah... VII-24 Tabel 7.9 Spesifikasi Pompa Utilitas ... VII-27 Tabel 8.1 Perincian Luas Tanah ... VIII-8 Tabel 9.1 Pembagian Shift Karyawan ... IX-10 Tabel 9.2. Jumlah Karyawan dan Kualifikasinya ... IX-11 Tabel 9.3 Proporsi Gaji Karyawan per 1 Shift ... IX-13 Tabel LB.1 Nilai Kontribusi Unsur Atom ... LB-1 Tabel LB-2 Kapasitas Panas Beberapa Senyawa pada 298 K (J/mol.K) ... LB-2 Tabel LB-3 Data Kapasitas Panas (J/mol.K) untuk Fasa Gas ... LB-3 Tabel LB.4 Data Kapasitas Panas (J/mol.K) untuk Fasa Cair ... LB-3 Tabel LB.5 Panas Reaksi Pembentukan(kkal/mol) ... LB-4 Tabel LB.6 Tabel Kontribusi Gugus dengan Metode Benson et al ... LB-4 Tabel LB.7 Perhitungan Energi yang Masuk ke dalam Tangki
Pre-Treatment (M-103) ... LB-5 Tabel LB.8 Perhitungan Energi yang Keluar dari Tangki
Pre-Treatment (M-103) ... LB-6 Tabel LB.9 Perhitungan Energi yang Masuk ke dalam Tangki
Pencampur (M-107) ... LB-7 Tabel LB.10 Perhitungan Energi yang Keluar dari Tangki
Irma Suraya 08 0405 001
Universitas Sumatera Utara
Tabel LB.14 Perhitungan Energi yang Keluar dari Bioreaktor (R-203) ... LB-12 Tabel LB.15 Entalpi gas dan cairan keluar kompressor (JC-206) ... LB-14 Tabel LB.16 Entalpi gas dan cairan keluar Cooler (E-207) ... LB-14 Tabel LB.17 Neraca Energi pada Cooler (E-207)... LB-16 Tabel LB.18 Perhitungan energi masuk ke dalam Absorber (T-301) ... LB-17 Tabel LB.19 Perhitungan energi keluar dari Absorber (T-301) ... LB-17 Tabel LB.20 Perhitungan energi keluar dari Absorber (T-301) ... LB-18 Tabel LB.21 Neraca energi pada Absorber (T-301) ... LB-18 Tabel LB.22 Perhitungan energi masuk Bioreaktor (R-303) ... LB-21 Tabel LB.23 Perhitungan energi keluar dari Bioreaktor (R-303) ... LB-21 Tabel LB.24 Perhitungan energi keluar dari Absorber (T-308) ... LB-24 Tabel LB.25 Neraca energi pada Absorber (T-301) ... LB-24 Tabel LB.26 Neraca Energi pada Heat Exchanger (E-310)... LB-27 Tabel LB.27 Neraca energi pada Stripper (T-313) ... LB-29 Tabel LB.28 Neraca energi pada Cooler (E-311) ... LB-31 Tabel LB.29 Entalpi gas output kompressor (JC-403) ... LB-32 Tabel LB.30 Entalpi gas output Cooler (E-404) ... LB-32 Tabel LB.31 Neraca energi pada Cooler (E-404) ... LB-33 Tabel LB.32 Entalpi gas dan cairan output kompressor (JC-314) ... LB-34 Tabel LB.33 Entalpi gas dan cairan output Cooler (E-315) ... LB-34 Tabel LB.34 Neraca energi pada Cooler (E-315) ... LB-35 Tabel LB.35 Entalpi gas output kompressor (JC-406) ... LB-36 Tabel LB.36 Entalpi gas output Cooler (E-407) ... LB-36 Tabel LB.37 Neraca energi pada Cooler (E-407) ... LB-37 Tabel LD.1 Perhitungan Entalpi dalam Penentuan Tinggi Menara
Irma Suraya 08 0405 001
Universitas Sumatera Utara
Irma Suraya 08 0405 001
Universitas Sumatera Utara
BAB I
PENDAHULUAN
1.1Latar Belakang
Kelangkaan bahan bakar minyak, yang disebabkan oleh kenaikan harga minyak dunia yang signifikan, telah mendorong pemerintah untuk mengajak masyarakat mengatasi masalah energi bersama-sama, salah satunya adalah dengan cara penghematan energi. Penghematan ini sebetulnya harus telah digerakkan sejak dahulu karena pasokan bahan bakar yang berasal dari minyak bumi adalah sumber energi fosil yang tidak dapat diperbarui (unrenewable), sedangkan permintaan naik terus, demikian pula harganya sehingga tidak ada stabilitas keseimbangan antara permintaan dan penawaran. Salah satu jalan untuk menghemat bahan bakar minyak (BBM) adalah dengan mencari sumber energi alternatif yang dapat diperbarui
(renewable) (Rahman, 2005). Untuk antisipasi dalam memenuhi pasokan akan
kebutuhan energi, maka salah satu tantangan adalah mencari alternatif energi terbarukan yang ramah lingkungan misalnya : bioetanol, bio-diesel,bio-hidrogen (Bio-H2), bio-butandiol (Bio-BD) (Chang dkk., 2002).
Irma Suraya 08 0405 001
Universitas Sumatera Utara
Gas hidrogen (H2) mempunyai gravimetrik densitas energi yang paling tertinggi diantara beberapa bahan bakar dan cocok terhadap elektrokimia dan proses pembakaran untuk konversi energi tanpa menghasilkan emisi karbon yang telah memberikan konstribusi pada polusi lingkungan dan perubahan iklim. Sekarang ini, sebagian besar H2 diproduksi dengan cara elektrolisa air atau perubahan dari metan. Teknologi produksi H2 secara bio (Bio-H2) memberikan pendekatan yang lebar terhadap produksi H2 termasuk biofotolisis langsung, biofotolisis tidak langsung, foto fermentasi dan fermentasi gelap. Fermentasi tanpa menggunakan cahaya ini merupakan salah satu energi bersih masa depan untuk menuju sasaran tanpa limbah dikarenakan dapat dipakainya limbah pertanian dan limbah industri sebagai substrat mikroorganisma (Mahyudin dan Koesnandar, 2006).
Biomassa dari limbah yang dapat dimanfaatkan untuk biohidrogen ini adalah Limbah Cair Kelapa Sawit. Pabrik pengolahan kelapa sawit menghasilkan limbah cair dalam jumlah yang besar, yaitu berkisar antara 600-700 liter/ton tandan buah segar (TBS) (Naibaho, 1996). Saat ini diperkirakan jumlah limbah pabrik kelapa sawit (PKS) di Indonesia mencapai 28,7 juta ton limbah cair/tahun dan 15,2 juta ton limbah padat (TKKS)/tahun (Mahajoeno, 2011). Jumlah LCPKS yang besar dan kandungan bahan organiknya yang tinggi (80%) (DITJEN PPHP,2006), menjadi peluang besar bagi industri ini dalam pemanfaatan limbah untuk menghasilkan produk lain, salah satunya adalah pemanfaatan LCPKS untuk menghasilkan biohidrogen.
Konsumsi hidrogen terbesar adalah untuk membuat ammonia (49%), untuk pemurnian minyak bumi (37%), untuk memproduksi metanol (8%) dan untuk lainnya (6%). Rencana di masa yang akan datang hidrogen digunakan sebagai bahan bakar mesin transportasi dan menggunakan Proton Exchange Membrane Fuel Cell
Irma Suraya 08 0405 001
Universitas Sumatera Utara
1.2Perumusan Masalah
Adapun yang menjadi rumusan masalah dalam pra rancangan pabrik pembuatan biohidrogen dari limbah cair kelapa sawit dengan fermentasi anaerobik pada kondisi termofilik yaitu :
1. Bagaimana memanfaatkan limbah cair kelapa sawit (LCPKS) yang jumlahnya semakin melimpah untuk dimanfaaatkan menjadi produk yang memiliki nilai ekonomi lebih tinggi dan ramah lingkungan berupa gas hidrogen.
2. Bagaimana memenuhi kebutuhan gas hidrogen dalam dunia Industri di Indonesia.
1.3Tujuan Pra Rancangan Pabrik
Ada beberapa tujuan pembuatan pra rancangan pabrik pembuatan biohidrogen dari limbah cair kelapa sawit dengan fermentasi anaerobik pada kondisi termofilik yaitu :
1. Untuk memberikan informasi awal tentang kelayakan pendirian pabrik pembuatan biohidrogen dari limbah cair kelapa sawit dengan fermentasi anaerobik pada kondisi termofilik.
2. Untuk memberikan informasi tentang perkiraan tata rancang pabrik dan biaya yang diperlukan dalam pembuatan biohidrogen dari limbah cair kelapa sawit dengan fermentasi anaerobik pada kondisi termofilik.
1.4Manfaat Pra Rancangan Pabrik
Irma Suraya 08 0405 001
Universitas Sumatera Utara
BAB II
TINJAUAN PUSTAKA
2.1
Pengertian Biohidrogen
Biohidrogen adalah gas hidrogen yang dihasilkan oleh aktivitas mikroorganisme seperti ganggang hijau, cyanobacteria, atau mikroorganisme fermentasi. Ganggang hijau dan cyanobacteria menggunakan energi sinar matahari untuk menghasilkan H2 dari air, sementara bakteri fermentasi bersifat heterotrof (Das dan Veziroglu, 2001). Produksi hidrogen dari sumber daya terbarukan dengan fermentasi adalah metode yang lebih menjanjikan di antara alternatif proses produksi hidrogen yang lain. Sesuai dengan pembangunan berkelanjutan dan masalah minimisasi limbah, produksi hidrogen biologis, yang dikenal sebagai "teknologi hijau" telah menerima banyak perhatian dalam beberapa tahun terakhir dikarenakan membutuhkan energi yang sedikit dan dapat dikombinasikan dengan proses pengolahan limbah cair. Hidrogen tidak berbau, tidak berwarna, tidak berasa, dan tidak beracun ketika digunakan sebagai bahan bakar karena tidak menghasilkan polutan tetapi menghasilkan air sebagai produk tunggal. Dibandingkan dengan bahan bakar fosil, hidrogen menghasilkan energi sebesar 122 kJ/g, 2,75 kali lebih besar dibandingkan dengan bahan bakar hidrokarbon (Mei Ling Chong dkk.,2009).
Irma Suraya 08 0405 001
Universitas Sumatera Utara
2.2 Sejarah Biohidrogen
Hidrogen pertama kali diisolasi pada pertengahan tahun 1600 oleh Robert Boyle, yang menjatuhkan paku besi ke dalam asam sulfat, disebut gas H2 dikenal sebagai “udara buatan” (Busby,2005). Kurang lebih 100 tahun kemudian, pada tahun 1766, Henry Cavendish mengidentifikasi hidrogen sebagai elemen kimia ( disebut sebagai udara yang mudah terbakar) dan menjelaskan sifat-sifat dari gas tersebut, seperti densitas dan berat molar. Cavendish juga menunjukkan bahwa pembakaran H2 di udara menghasilkan air mengoreksi kesalahan dari ide yang menyatakan air sebagai elemen dasar. Pada tahun 1783, Antoine-Laurent Lavoisier mengenal oksigen sebagai komponen dari air, dan memberikan hidrogen nama modernnya (penghasil air). Pada akhir tahun 1700 dan awal tahun 1800, hidrogen digunakan pada udara panas balon penerbangan, dan sebagai bahan bakar pada salah satu mesin pembakaran internal yang pertama. Hidrogen juga merupakan komponen yang kaya pada “kotagas” digunakan untuk tujuan pemanasan dan penerangan (Busby, 2005). Pada tahun 1920 dan 1930, penelitian hidrogen sangat aktif dan beberapa aplikasi utilitas pemindahan H2 dikembangkan, dari zeppelin dirigibles hingga kereta api , bus dan kapal laut (Hoffmann, 2002). Kemajuan teknologi H2 dihentikan setelah perang dunia kedua disebabkan rendahnya harga minyak dan bensin. Perhatian pada energi H2 kembali meningkat pada tahun 1970 selama krisis energi, tetapi berkurang setelah harga minyak merosot tajam (Hoffmann, 2002). Pada tahun 1990, perhatian H2 kembali meningkat dengan pertumbuhan kecemasan publik pada dampak negatif bahan bakar fosil terhadap lingkungan dunia (Benemann, 1996).
Irma Suraya 08 0405 001
Universitas Sumatera Utara
2.3 Faktor yang Mempengaruhi Proses Anaerobik
Aktivitas metabolisme mikroorganisme penghasil hidrogen tergantung pada faktor:
2.3.1 Temperatur
Temperatur mempengaruhi aktivitas bakteri penghasil hidrogen dan laju produksi (Nath et al, 2006). Reaksi fermentasi gelap hidrogen dapat dioperasikan pada temperatur yang berbeda : mesofilik (25-40oC), termofilik (40-65 oC), ekstrim termofilik (65-80 oC), atau hipertermofilik (>80 oC) (Levin et al,2004). Kebanyakan percobaan fermentasi gelap menggunakan temperatur sebesar 35-55 oC. Proses ekstrim termofilik memberikan sejumlah keuntungan dibandingkan dengan termofilik dan mesofilik. Pertama, produksi hidrogen lebih tinggi pada kondisi ekstrim termofilik daripada kondisi mesofilik dan termofilik. Telah dilaporkan bahwa fermentasi anaerobik hidrogen secara ekstrim termofilik dapat menghasilkan produksi hidrogen yang lebih banyak dan laju produksi hidrogen yang lebih tinggi daripada fermentasi hidrogen secara mesofilik (Van Groenestijin dkk., 2002). Telah dilaporkan juga bahwa pada kondisi ekstrim termofilik (70 oC), hasil hidrogen mencapai maksimum secara teoritis yaitu 4 mol hidrogen per mol glukosa, sedangkan pada kondisi mesofilik dan termofilik normalnya adalah kurang dari 2 mol hidrogen per mol glukosa (Van Niel dkk., 2002). Kedua, ekstrim termofilik memiliki kemampuan memusnahkan patogen yang lebih baik pada digested residu
yang ditunjukkan pada temperatur tinggi (Sah Istrom, 2003). Ketiga, meminimalisasi kontaminasi oleh pengkonsumsi hidrogen, seperti metanogen. Hellenbeck (2005), melaporkan bahwa pada fermentasi dengan temperatur tinggi lebih disukai secara termodinamik bagi reaksi penghasil hidrogen karena temperatur yang tinggi menghasilkan peningkatan entropi, dan menjadikan fermentasi gelap hidrogen lebih berenergi sementara utilitas proses hidrogen berdampak negatif dengan kenaikan temperatur (Amend dan Shock, 2001). Bakteri ekstrim termofilik menunjukkan toleransi yang lebih baik pada tekanan parsial hidrogen yang tinggi yang akan menyebabkan pergantian metabolik pada cara penghasil nonhidrogen, seperti produksi pelarut (Niel dkk., 2003).
Irma Suraya 08 0405 001
Universitas Sumatera Utara
menemukan produksi hidrogen sebesar 19,3-96,0 mL/ gVSyang ditambahkan dari fraksi individu HSW seperti nasi dan wortel oleh pengolahan batch secara mesofilik. Valdez- Vazquez dkk. (2005) melaporkan bahwa 95 ml H2/ gVSyang ditambahkan diperoleh secara berturut-turut dengan menggunakan CSTR semi kontinyu. Dawei Liu (2008) menemukan produksi hidrogen sebesar 43 ml H2/ gVSyang ditambahkan dari fermentasi HSW secara mesofilik, dan juga menemukan bahwa produksi hidrogen sebesar 100-250 ml H2/ gVSyang ditambahkan dapat dipenuhi pada kondisi ekstrim termofilik.
2.3.2 Derajat Keasaman (pH)
Derajat keasaman memiliki efek terhadap aktivasi enzim mikroorganisme, karena setiap enzim aktif hanya pada kisaran pH yang bersifat spesifik dan mempunyai aktivitas maksimum pada pH optimalnya (Lay dkk., 1997). Penelitian hidrogen telah mengakui bahwa pH adalah salah satu kunci faktor yang mempengaruhi produksi hidrogen. Fermentasi hidrogen bersifat sensitif terhadap pH dan pokok dari produk akhir (Craven, 1998). Telah banyak penelitian untuk memproduksi hidrogen dari limbah padat. Hasilnya mengindikasi bahwa kontrol pH merupakan hal yang sangat penting untuk memproduksi hidrogen. Telah dilaporkan juga bahwa dibawah pH yang tidak optimal proses fermentasi hidrogen digantikan oleh produksi pelarut (Temudo dkk., 2007), atau memperlama fasa lag (Liang, 2003). Produksi laktat selalu diobservasi bersamaan dengan perubahan parameter lingkungan yang terjadi secara tiba-tiba, seperti pH, HRT, dan temperatur, yang mengindikasikan biakan bakteri tidak beradaptasi dengan kondisi lingkungan yang baru (Temudo dkk., 2007). Liu dkk. (2006) menemukan bahwa pada fermentasi gelap hidrogen secara mesofilik memiliki pH optimal sekitar 5-5,5.
Irma Suraya 08 0405 001
Universitas Sumatera Utara
(2004) melaporkan produksi hidrogen dari sludge hidrolisat kertas dengan biakan murni Caldicellulosiruptor saccharolyticus pada pH 7,2. Dari keseluruhan penelitian ini mengindikasi bahwa kebanyakan bakteri ekstrim termofilik penghasil hidrogen lebih menyukai pH netral sebagai pH optimum. Penelitian biakan campuran bakteri ekstrim termofilik yang diadaptasi dari pupuk juga melaporkan bahwa pH optimum adalah 7 (Yokoyama dkk., 2007). Dawei Liu (2008) juga menemukan bahwa biakan campuran bakteri ekstrim termofilik penghasil hidrogen yang diadaptasi dari pupuk dan pengolahan substrat HSW mempunyai pH optimum 7.
2.3.3 HRT
HRT juga merupakan parameter yang penting bagi proses fermentasi gelap. Pada sistem CSTR, HRT yang singkat digunakan untuk membersihkan metanogen yang tumbuh lambat dan memilih bakteri penghasil asam (Chen dkk., 2001), sementara laju cairan yang terlalu tinggi dapat menyebabkan hidrolisis limbah organik yang buruk (Han dan Shin, 2004). Pada sistem CSTR, Kim dkk. (2004) melaporkan bahwa HRT yang singkat (< 3 hari) akan menghasilkan produksi hidrogen karena metanogen membutuhkan lebih dari HRT 3 hari. Normalnya pada proses anaerobik, pH dan HRT adalah pasangan parameter : HRT yang singkat menghasilkan pH yang rendah. Antara pH dan HRT telah didemonstrasikan sebagai cara yang efektif untuk memisahkan bakteri penghasil hidrogen dan archaea
pengkonsumsi hidrogen pada kondisi mesofilik dan termofilik (Oh dkk., 2004). Meskipun efek pH dan HRT saling berhubungan tidak ada penelitian resmi yang telah mengisolasi efek dari kedua parameter ini secara terpisah (Dawei Liu, 2008).
Bagi fermentasi HSW pada temperatur ekstrim termofilik, HRT harus tidak boleh kurang dari 2 hari, jika tidak akan dihasilkan hidrolisis dan pembersihan bakteri metanogen yang buruk. Diindikasi juga bahwa metanogen masih dapat tumbuh dan mengkonsumsi hidrogen (Dawei Liu, 2008).
2.3.4Tekanan Parsial Hidrogen dan Karbondioksida
Akumulasi hidrogen dan karbondioksida dapat menyebabkan penekanan
Irma Suraya 08 0405 001
Universitas Sumatera Utara
a. Tekanan Parsial Hidrogen
Konsentrasi hidrogen pada fasa cair berhubungan dengan tekanan parsial
hidrogen yang merupakan salah satu kunci faktor yang mempengaruhi produksi hidrogen
(Hawkes dkk., 2002). Tekanan parsial H2 (pH2) adalah faktor yang sangat penting
terutama bagi sintesis H2 secara kontinyu (Hawkws dkk., 2007). Alur sintesis hidrogen
bersifat sensitif bagi konsentrasi H2 dan merupakan penghambat produk akhir karena
meningkatnya konsentrasi H2 menyebabkan sintesis H2 berkurang dan alur metabolik
berganti menjadi produksi substrat seperti laktat, etanol, aseton, butanol, atau alanin
(Tamagnini et al., 2002). Sintesis H2 secara kontinyu membutuhkan pH2 sebesar 50 kPa
pada temperatur 60oC (Lee dan Zinder, 1998). 20 kPa pada temperatur 70oC (Van Niel
dkk., 2002), dan 2 kPa pada temperatur 98 oC dibawah kondisi standart (Levin dkk., 2004).
b. Tekanan Parsial Karbondioksida
Pada kasus karbondioksida, konsentrasi H2 yang tinggi dapat menyebabkan
produksi fumarat atau suksinat, yang berkontribusi mengkonsumsi elektron, sehingga
produksi hidrogen berkurang (Tanisho dkk., 1998). Tanisho et al. Juga melaporkan bahwa penghilangan CO2 dapat meningkatkan produksi hidrogen pada fermentasi gelap.
Setelah CO2 dihilangkan, produksi hidrogen meningkat dua kali semula. Terlebih lagi
ketika CO2 dihilangkan dari cairan dengan sparging gas argon dan gas hidrogen,
dibandingkan tekanan parsial hidrogen, tekanan parsial CO2 memiliki efek penghambat
yang lebih besar pada proses fermentasi gelap.
Belakangan ini gas CH4 digunakan sebagai sparging gas untuk menghilangkan
hidrogen dan karbondioksida dari cairan. Gas sparging menghasilkan peningkatan yang
signifikan terhadap produksi hidrogen (88%). Mizuno dkk. (2000) melaporkan bahwa produksi hidrogen meningkat sebesar 68% setelah mengalami sparging dengan gas N2.
2.3.5 Konsentrasi Asam Organik
Konsentrasi asam organik yang tinggi telah dilaporkan menghasilkan penurunan
gradien pH dan menyebabkan penghambatan total dari fungsi keseluruhan metabolik sel
(Jones dan Woods,1986). Konsentrasi total antara asam asetat atau butirat dan bentuk
tidak terpisahkan dari asam-asam ini dapat menghambat proses fermentasi gelap
Irma Suraya 08 0405 001
Universitas Sumatera Utara
Suatu pendekatan yang lengkap mengenai penghambatan produksi H2
diobservasi oleh Van Ginkel dan Logan (2005) dengan menambahkan asam asetat
untuk memberikan konsentrasi asam yang tak terpisahkan pada reaktor 63 mM, yang
terjadi pada pH 5,5 dan penambahan 165mM asetat. Mereka melaporkan bahwa alur
fermentasi berubah dari asam organik dan hidrogen menjadi pelarut yang tidak
terdeteksi.Dilaporkan juga bahwa konsentrasi keseluruhan asetat adalah inhibitor yang
kuat pada fermentasi hidrogen. Van Niel dkk. (2003) melaporkan bahwa konsentrasi asetat tak terpisah tidak serius menghambat produksi hidrogen pada pH 6,5 dan 7,2 serta
pada temperatur 70oC oleh biakan murni Caldicellulosiruptor saccharolyticus, dan
konsentrasi total asetat adalah penghambat utama bagi fermentasi ekstrim termofilik
hidrogen. Huang dkk. (1998) menggunakan Coltridium formicoaceticum untuk memfermentasi fruktosa pada pH 7,6 dan temperatur 37oC. Mereka menemukan
konsentrasi asetat keseluruhan (bukan konsentrasi asetat tak terpisah) memiliki efek
penghambatan nonkompetitif bagi fermentasi hidrogen. Nakashimada dkk. (1999) menemukan bahwa fermentasi hidrogen dihambat secara keseluruhan oleh konsentrasi
total asetat sebesar 25mM pada pH 6,5 pada bakteri hiper termofilik penghasil hidrogen.
2.3.6 Senyawa Anorganik
a. Konsentrasi Fe
Hidrogenase adalah enzim yang penting karena mereka terlibat langsung dalam produksi hidrogen hidrogen selama proses fermentasi. Telah dilaporkan bahwa seiring meningkatnya konsentrasi besi, produksi hidrogen meningkat secara signifikan (Lee dkk., 2001).
Dalam proses produksi fermentasi hidrogen, Fd, sebuah protein besi-belerang, fungsi utamanya adalah sebagai pembawa elektron dan terlibat dalam oksidasi piruvat untuk asetil-Ko A dan CO2 dan pengurangan proton molekul H2 (Lee dkk., 2001). Vanacova et dkk. (2001) menunjukkan bahwa besi dapat menginduksi perubahan metabolik dan menjadi terlibat dalam ekspresi protein Fe-S dan non-Fe-S yang beroperasi dalam hidrogenase.
b. C/N Ratio
Irma Suraya 08 0405 001
Universitas Sumatera Utara
meningkatkan produksi hidrogen dalam fermentasi hidrogen mesofilik dari limbah lumpur. Pada rasio C/N 47, produksi hidrogen adalah 5 kali lebih tinggi dari yang di C/N rasio 40 (Lin dan Lay 2004).
2.4 Tahapan-Tahapan Pembentukan Biohidrogen
2.4.1 Pretreatment
Pretreatment membantu mempercepat tahapan hidrolisis, sehingga
mengurangi laju tahapan dan meningkatkan pencernaan anaerobik untuk
memperbesar produksi gas hidrogen (H. Koku dkk., 2002). Beberapa prosedur pre
treatment di antaranya ialah dengan pemanasan, penggunaan bahan kimia seperti
asam atau alkali, pembekuan, dan sebagainya dilakukan terhadap biakan campuran
untuk menyeleksi bakteri asidogenik penghasil H2 (S.M. Kotay dan D. Das, 2010).
2.4.2 Hidrolisis
Bahan organik secara enzimatis diuraikan oleh enzim ekstraselular (selulosa, amilase, proteinase, dan lipase) mikroorganisme. Bakteri mendekomposisi rantai panjang karbohidrat, protein dan lemak menjadi bagian yang lebih pendek. Sebagai contoh, polisakarida diubah menjadi monosakarida. Protein dibagi menjadi peptida dan asam amino (Aryati, 2010).
2.4.3 Asidifikasi
Bakteri penghasil asam, terlibat dalam langkah kedua, menkonversi hasil fermentasi menjadi asam asetat (CH3COOH), hidrogen (H2) dan karbon dioksida (CO2). Bakteri ini bersifat anaerobik dan dapat tumbuh di bawah kondisi asam. Untuk menghasilkan asam asetat, mereka membutuhkan oksigen dan karbon. Untuk ini, mereka menggunakan oksigen larut dalam larutan atau oksigen terikat.. Setelah itu, terjadi penguraian senyawa dengan berat molekul yang rendah menjadi alkohol, asam organik, asam amino, karbon dioksida, hidrogen sulfida, dan metana (Aryati, 2010).
2.5 Limbah Cair Pabrik Kelapa Sawit (LCPKS)
Selama proses ekstraksi crude palm oil (CPO), pabrik akan menghasilkan limbah cair yang disebut dengan limbah cair pabrik kelapa sawit (LCPKS). LCPKS umumnya bersuhu tinggi (60-75oC), berwarna kecoklatan, mengandung padatan terlarut dan tersuspensi berupa koloid dan residu minyak dengan kandungan
Irma Suraya 08 0405 001
Universitas Sumatera Utara
dibuang ke perairan, maka akan sangat berpotensi mencemari lingkungan, sehingga harus diolah terlebih dahulu sebelum dibuang (Santoso, 2009).
Komposisi kimia limbah cair POME dan komposisi asam amino limbah cair segar disajikan pada Tabel 2.2 berikut.
Tabel 2.1 Komposisi Kimia Limbah Cair POME
Komponen % Berat Kering
Ekstrak dengan ether 31.60
Protein (N x 6,25) 8.20
Serat 11.90
Ekstrak tanpa N 34.20
Abu 14.10
P 0.24
K 0.99
Ca 0.97
Mg 0.30
Na 0.08
Energi (kkal / 100 gr) 454.00
Sumber : Siregar, 2009
Parameter yang menggambarkan karakteristik limbah terdiri dari sifat fisik, kimia, dan biologi. Karakteristik limbah berdasarkan sifat fisik meliputi suhu, kekeruhan, bau, dan rasa, berdasarkan sifak kimia meliputi kandungan bahan organik, protein, BOD, chemical oxygen demand (COD), sedangkan berdasakan sifat biologi meliputi kandungan bakteri patogen dalam air limbah (Siregar, 2009).
Berdasarkan Keputusan Menteri Negara Lingkungan Hidup ada 6 (enam) parameter utama yang dijadikan acuan baku mutu limbah meliputi :
a. Tingkat keasaman (pH), ditetapkannya parameter pH bertujuan agar mikroorganisme dan biota yang terdapat pada penerima tidak terganggu, bahkan diharapkan dengan pH yang alkalis dapat menaikkan pH badan penerima.
b. BOD, kebutuhan oksigen hayati yang diperlukan untuk merombak bahan organik. Semakin tinggi nilai BOD air limbah, maka daya saingnya dengan mikroorganisme atau biota yang terdapat pada badan penerima akan semakin tinggi.
c. COD, kelarutan oksigen kimiawi adalah oksigen yang diperlukan untuk
Irma Suraya 08 0405 001
Universitas Sumatera Utara
d. Total suspended solid (TSS), menggambarkan padatan melayang dalam cairan
limbah. Pengaruh TSS lebih nyata pada kehidupan biota dibandingkan dengan
total solid. Semakin tinggi TSS, maka bahan organik membutuhkan oksigen
untuk perombakan yang lebih tinggi.
e. Kandungan total nitrogen, semakin tinggi kandungan total nitrogen dalam cairan limbah, maka akan menyebabkan keracunan pada biota.
f. Kandungan oil and grease, dapat mempengaruhi aktifitas mikroba dan merupakan pelapis permukaan cairan limbah sehingga menghambat proses oksidasi pada saat kondisi aerobic (Siregar, 2009).
Adapun karakteristik dari limbah POME yang dihasilkan dapat dilihat pada Tabel 2.2 di bawah ini:
Tabel 2.2 Karaktersitik Limbah POME dan Baku Mutu Limbah
Parameter Komposisi
BOD5 (mg/L) 23000-26000
COD (mg/L) 42500-55700
Soluble COD (mg/L) 22000-24000 TVFAs (mg acetic acid/l) 2500-2700
SS (mg/L) 16500-19500
Oil and grease (mg/L) 4900-5700
Total N (mg/L) 500-700
pH 3,8-4,4
Sumber : Zinatizadeh, dkk., 2007
Berdasarkan data di atas, ternyata semua parameter limbah cair POME berada diatas ambang batas baku mutu limbah. Jika tidak dilakukan pencegahan dan pengolahan limbah, maka akan berdampak negatif terhadap lingkungan seperti pencemaran air yang mengganggu bahkan meracuni biota perairan, menimbulkan bau, dan menghasilkan gas metan dan CO2 yang merupakan emisi gas penyebab efek rumah kaca yang berbahaya bagi lingkungan (Siregar, 2009).
2.6 Perusahaan Yang Memproduksi Hidrogen
Irma Suraya 08 0405 001
Universitas Sumatera Utara
biohidrogen merupakan gas alternatif yang dikembangkan dari biogas dan lebih ramah lingkungan.
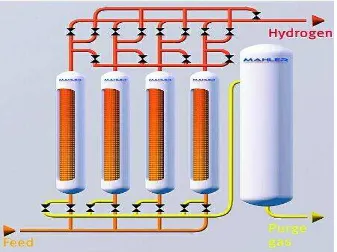
Adapun salah satu perusahaan yang memproduksi hidrogen yaitu Mahler AGS dengan 4.500 cabang dan dibangung di seluruh dunia sejak 1950. Mahler AGS adalah produsen yang sangat dihormati untuk generasi pembuatan hidrogen, oksigen dan nitrogen. Mahler AGS memproduksi sistem generasi yang hemat biaya, aman dan terpercaya dan menyediakan teknik untuk pemurnian dan pemulihan gas dan limbah dari proses gas tersebut. Mahler gas ini terletak di Stuttgart, Jerman.
Untuk memproduksi hidrogen, perusahaan ini menggunakan 2 proses teknologi yaitu HYDROFORM-C dan HYDROFORM-M. HYDROFORM-C berdasarkan pada proses steam reforming gas alam, LPG atau nafta. Proses ini menawarkan pelanggan kualitas dan keamanan yang maksimum, serta kemampuan efisien untuk memenuhi kebutuhan hidrogen 100-10.000 Nm3/jam pada kemurnian hingga 99,999 + persen volum (Mahler AGS, tanpa tahun).
Gambar 2.1 Flowsheet proses HYDROFORM-C Mahler Gas (Mahler AGS, tanpa tahun)
Mahler AGS telah berhasil mengoperasikan selama bertahun-tahun di bidang
methanol reforming untuk pembentukan hidrogen. Pemurnian bahan baku hidrogen
Irma Suraya 08 0405 001
Universitas Sumatera Utara
[image:30.595.153.490.445.697.2]yang memberikan langkah pemurnian secara terpisah. Perusahaan ini menawarkan proses yang efisien untuk methanol reforming dalam kuantitas 100-4.000 Nm3/jam hidrogen dengan kemurnian 99,999 + persen volume.
Gambar 2.2 Flowsheet proses HYDROFORM-M Mahler Gas (Mahler AGS, tanpa tahun)
Proses pemurnian hidrogen dilakukan secara terpisah dengan sistem HYROSWING.
Irma Suraya 08 0405 001
Universitas Sumatera Utara
2.7 Aplikasi Gas Hidrogen
Sejumlah besar H2 diperlukan dalam industri petrokimia dan kimia. Penggunaan terbesar H2 adalah untuk memproses bahan bakar fosil dan dalam pembuatan ammonia. Konsumen utama dari H2 di kilang petrokimia meliputi hidrodealkilasi, hidrodesulfurisasi, dan penghidropecahan (hydrocracking). H2 memiliki beberapa kegunaan yang penting. H2 digunakan sebagai bahan hidrogenasi, terutama dalam peningkatan kejenuhan dalam lemak tak jenuh dan minyak nabati (ditemukan di margarin), dan dalam produksi metanol. Ia juga merupakan sumber hidrogen pada pembuatan asam klorida. H2 juga digunakan sebagai reduktor pada bijih logam (Chemistry Operation, 2003).
Selain digunakan sebagai pereaksi, H2 memiliki penerapan yang luas dalam bidang fisika dan teknik. Ia digunakan sebagai gas penameng di metode pengelasan seperti pengelasan hidrogen atomic (Ahmet,2003; Specialty Welds, 2007). H2 digunakan sebagai pendingin rotor di generator pembangkit listrik karena ia mempunyai konduktivitas termal yang paling tinggi di antara semua jenis gas. H2 cair digunakan di riset kriogenik yang meliputi kajian superkonduktivitas (Walter, 2003). Oleh karena H2 lebih ringan dari udara, hidrogen pernah digunakan secara luas sebagai gas pengangkat pada kapal udara balon (Mathew, 2004).
[image:31.595.206.435.583.689.2]Baru-baru ini hidrogen digunakan sebagai bahan campuran dengan nitrogen (kadangkala disebut forming gas) sebagai gas perunut untuk pendeteksian kebocoran gas yang kecil. Aplikasi ini dapat ditemukan di bidang otomotif, kimia, pembangkit listrik, kedirgantaraan, dan industri telekomunikasi (Mathias, 2004). Hidrogen adalah zat aditif (E949) yang diperbolehkan penggunaanya dalam ujicoba kebocoran bungkusan makanan dan sebagai antioksidan (European Union, tanpa tahun).
Irma Suraya 08 0405 001
Universitas Sumatera Utara
[image:32.595.112.528.158.423.2]Hidrogen sebagai bahan bakar memiliki kemampuan mendorong kendaraan yang setara dengan bensin. Hanya saja, kelemahannya terletak pada biaya yang tinggi untuk memproduksi sel bahan bakar itu sendiri serta investasi untuk menyiapkan stasiun bahan bakar untuk menyalurkan bahan bakar hydrogen (Pamungkas, 2012).
Gambar 2.5 Mobil Toyota Konsep Bahan Bakar Hidrogen (Pamungkas, 2012)
2.8 Proses Integrasi Produksi Biohidrogen
Terdapat 5 macam sistem biohidrogen yaitu :
2.8.1 Biofotolisis Langsung
Fotosintesis memproduksi hidrogen dari air adalah suatu proses secara biologi yang memanfaatkan cahaya matahari, menghasilkan energi kimia dengan reaksi sebagai berikut :
2H2O 2H2 + O2
Irma Suraya 08 0405 001
Universitas Sumatera Utara
hidrogenase. Hidrogenase mengkombinasi proton (H+) dalam medium dengan elektron untuk membentuk dan menghasilkan H2. Dengan begitu, mikroalga hijau mampu secara genetik, enzimatik, metabolik, dan transport elektron menuju ke photoproduce gas H2. Sintesis H2 memungkinkan elektron melalui rantai transport elektron, yang mendukung sintesis ATP.
Proses fotosintesis alga mengoksidasi H2O dan meningkatkan O2. Energi cahaya diabsorbsi oleh fotosistem II (PSII) menghasilkan electron yang ditransfer ke ferredoxin, lalu menggunakan energi cahaya diabsorbsi oleh fotosistem I (PSI). Hidrogenase reversible menerima elektron secara langsung dari ferredoxin yang telah dikurangi untuk menghasilkan H2. Karena enzim hidrogenase yang bertanggung jawab pada evolusi molekuler H2 adalah sangat sensitive terhadap O2, produksi fotosintesis dari H2 dan O2 haruslah sementara dan/atau terpisah.
Dalam 2 fase proses, selama fotosintesis normal (fase1),CO2 pertama tercampur dalam substrat yang kaya H2, diikuti dengan generasi cahaya tengah dari molekuler H2 saat mikroalga dierami di bawah kondisi anaerob (fase 2). Fase 2 dari dua tahap proses dapat dicapai dengan inkubasi mikroalga dalam medium yang tidak mengandung sulfur. Contoh kultur alga hijau adalah Chlamydomonas reinhardtii. 2.8.2 Biofotolisis Tak Langsung
Cyanobacteria dapat juga mensintesis dan meningkatkan H2 melalui jalur
fotosintesis mengikuti proses sebagai berikut : 12H2O + 6CO2 C6H12O6 + 6O2 C6H12O6 + 12H2O 12H2 + 6CO2
Cyanobacteria (disebut juga blue-green algae, cyanophyceae, or
cyanophytes) adalah suatu grup besar dari mikroorganisme photoautotrophic.
Cyanobacteria mengandung pigmen fotosintesis, seperti klorofil, karotenoid, dan
Irma Suraya 08 0405 001
Universitas Sumatera Utara
mengoksidasi dan sintesis H2. Produksi hidrogen dengan Cyanobacteria telah diteliti lebih dari 3 dekade dan terungkap bahwa efisien fotokonversi dari H2O menjadi H2 dipengaruhi oleh banyak faktor (Sirosiris, 2010).
2.8.3 Photo Fermentation (Fermentasi Cahaya)
Langkah photo fermentation (PHF) adalah proses yang berbasis cahaya, yang mengubah asam-asam organik menjadi hidrogen dan CO2.
Foto-sintetik bakteri Rhodobacter sphaeroides OU 001 digunakan untuk fermentasi cahaya. Reaktor beroperasi dengan kondisi terbaik sekitar 30°C dan bekerja pada konsentrasi substrat 40 mM dengan konversi 60% dari hasil teoritis sesuai dengan reaksi berikut:
[image:34.595.115.528.465.662.2]Konsentrasi yang sangat rendah dan sangat tinggi adalah pada waktu retensi (10 hari) yang diperlukan untuk mengoperasikan fermentor secara kontinu. Kondisi ini menyebabkan volume besar yang diperlukan untuk fermentor. Karena dimensi, variasi pH tidak dapat dikontrol secara lokal, sehingga buffer yang tinggi (garam fosfat kalium) konsentrasi 20 mM diperlukan dalam kaldu fermentasi (Foglia dkk., 2011).
Irma Suraya 08 0405 001
Universitas Sumatera Utara
2.8.4 Dark Fermentation (Fermentasi Gelap)
Fermentasi termofilik (THF) atau gelap merupakan langkah fermentasi anaerobik di mana bakteri termofilik ekstrim (Caldicellulosiruptor saccharolyticus)
bekerja pada suhu 70 ° C. Pada langkah ini, gula diubah menjadi hidrogen, CO2 dan asam organik, menurut reaksi di bawah ini:
Untuk pentosa:
Untuk heksosa:
Untuk sukrosa:
Fermentasi yang terbaik terus beroperasi pada konsentrasi substrat yang rendah dari 10/l g gula dan pH 6,5. Air pengenceran diasumsikan pada 20° C. Untuk mempertahankan pH konstan, pH controller otomatis digunakan, dengan menggunakan basa (KOH) sebagai dasar untuk menyesuaikan perubahan pH, yang disebabkan oleh pembentukan asam organik selama langkah fermentasi.
Untuk menghindari penghambatan hidrogen vakum diterapkan pada fermentor termofilik (0,55 bar) untuk menurunkan tekanan parsial hidrogen dan meningkatkan desorpsi hidrogen dari kaldu fermentasi.
Irma Suraya 08 0405 001
[image:36.595.118.525.85.295.2]Universitas Sumatera Utara
Gambar 2.7 Flowsheet Proses Pembentukan hydrogen dengan THF (Foglia dkk., 2011)
2.8.5 Proses HYVOLUTION
Proses ini terdiri dari empat langkah utama yaitu : pre-treatment (PTR),PHF, THF dan gas upgrade. Berikut skema dari proses HYVOLUTION.
Gambar 2.8 Skema Proses HYVOLUTION (Foglia dkk., 2011)
Dari berbagai proses teknologi yang ada, maka metode fermentasi gelap (THF) yang paling cocok untuk diterapkan. Hal ini disebabkan keunggulan produksi H2 melalui fermentasi gelap adalah :
1. Tidak memerlukan energi matahari
2. Berbagai limbah/tanaman energi dapat digunakan 3. Teknologi reaktor yang sederhana
[image:36.595.114.522.387.601.2]Irma Suraya 08 0405 001
Universitas Sumatera Utara
2.9 Deskripsi Proses dan Sifat-Sifat Bahan Baku dan Produk
2.9.1 Deskripsi Proses Pembuatan Biohidrogen dari fermentasi limbah cair pabrik kelapa sawit
Berdasarkan kajian literatur yang telah dipaparkan sebelumnya, berikut ini dijelaskan deskripsi proses atau rancangan pembuatan biohidrogen dari fermentasi limbah cair pabrik kelapa sawit. Pertama, LCPKS ditampung di bak penampung (Bk-101). Lalu, dilakukan pre treatment (M-103) yang juga berfungsi untuk menonaktifkan aktivitas bakteri metanagenasi yang menghasilkan metana, sehingga dapat memperbesar produksi hidrogen. Banyak metode yang digunakan untuk pre
treatment ini, diantaranya dengan penambahan bahan kimia berupa 1 M H2SO4 10%
ke dalam LCPKS (acid pre-treatment), 1 M NaOH 10% (alkaline pre-treatment) ataupun menggunakan heat treatment dengan cara LCPKS dipanaskan pada suhu 80oC selama 1 jam tanpa penambahan bahan kimia. Berdasarkan penelitian, hidrogen yang paling tinggi diperoleh dengan perlakuan yang efektif untuk LCPKS adalah menggunakan alkaline-heat pre-treatment (chemical heat) (Syafawati dkk., 2012). Oleh karena itu, pre treatment yang akan dilakukan pada rancangan ini dengan menggunakan 1 M NaOH 10% dan dipanaskan pada suhu 80oC selama 1 jam.
Selanjutnya LCPKS yang sudah dilakukan pre treatment dimasukkan ke dalam tangki pencampur (M-107), dimana LCPKS akan ditambahkan nutrisi. Penambahan nutrisi berfungsi sebagai strategi untuk meningkatkan pertumbuhan bakteri yang menghasilkan hidrogen. Berdasarkan penelitian, dengan penambahan nutrisi N,P dan Fe meningkatkan produksi hidrogen. Konsentrasi Fe yang diperlukan adalah 257 mg/L LCPKS, rasio C/N yaitu 74 dan rasio C/P yaitu 559 (Sompong dkk., 2007). Namun, penambahan ini juga harus disesuaikan dengan karakteristik dari LCPKS yang akan diumpankan. Jika rasio C:N:P sudah memenuhi berdasarkan yang disebutkan diatas, maka tidak perlu ditambahkan lagi. Hal ini disebabkan, kelebihan nutrisi juga menyebabkan keracunan, sehingga bisa menyebabkan mikroorganisme tidak bisa berfungsi untuk memproduksi hidrogen.
Tahap selanjutnya yaitu fermentasi. Reaktor yang digunakan yaitu Continue
Stirred Tank Reactor (CSTR). CSTR dianggap praktis dan ekonomis untuk industri
Irma Suraya 08 0405 001
Universitas Sumatera Utara
mudah mengatur keasaman dan suhu serta memberikan pencampuran yang homogen antara substrat dan biomassa aktif (Li dan Fang, 2007; Hawkes dkk., 2007).
Pada sistem CSTR, Kim dkk., (2004) melaporkan bahwa HRT yang singkat (< 3 hari) akan menghasilkan produksi hidrogen karena metanogen membutuhkan lebih dari HRT 3 hari. Normalnya pada proses anaerobik, pH dan HRT adalah pasangan parameter : HRT yang singkat menghasilkan pH yang rendah. Antara pH dan HRT telah didemonstrasikan sebagai cara yang efektif untuk memisahkan bakteri penghasil hidrogen dan archaea pengkonsumsi hidrogen pada kondisi mesofilik dan termofilik (Oh dkk., 2004). Oleh karena itu, kondisi yang digunakan pada rancangan ini yaitu kondisi termofilik dengan temperatur 60oC, pH 5,5 dan HRT 2 hari (Sompong dkk., 2007). Reaksi yang terjadi pada reaktor yaitu :
(C5H10O5)n H2(g) + CO2(g) + H2S(g) + C2H4O2(i)+ C4H8O2(l) Hidrogen
(Dawei Liu,2008)
H2S yang terbentuk dari hasil pembusukan oleh mikroorganisme pada fasa cair terionisasi menjadi fasa gas (Speece, R.E., 1996). Selain gas yang dihasilkan, akan diperoleh juga beberapa asam terutama asam asetat dan asam butirat pada
effluent. Nilai COD yang dihasilkan juga masih tinggi (Sompong dkk., 2007). Oleh
karena itu, dapat dilakukan proses anaerobik untuk menghasilkan biogas di bioreaktor biogas (R-203) dengan HRT 6 hari, suhu 55oC dan tekanan atmosfer. Biogas yang terbentuk langsung bisa dimanfaatkan untuk energi listrik pembuatan biohidrogen, sedangkan effluent ditampung di bak penampung (BK-205).
Biohidrogen yang dihasilkan terdiri dari 61% H2, 85 ppm H2S dan selebihnya adalah CO2 (Sompong dkk., 2007). Maka, harus dilakukan pemurnian hidrogen. Proses pemurnian yang pertama kali dilakukan yaitu desulfurisasi. Untuk merancang proses yang ekonomis, maka rancangan ini menggunakan biodesulfurisasi.
Biodesulfurisasi ini mempunyai beberapa keuntungan diantaranya prosesnya aman karena semua H2S terserap, tidak menggunakan bahan kimia yang mahal, menggunakan tekanan atmosfer dan produk akhirnya adalah elemen sulfur yang dapat dimanfaatkan kembali. Inokulum yang digunakan yaitu Thioalkalivibrio dan
Thioalkalimicrobium. Lalu ditambahkan medium yang terdiri dari 0,66 mol/L Na+
dan 1,34 mol/L K+ sebagai karbonat. Selanjutnya, medium juga terdiri dari (dalam
Irma Suraya 08 0405 001
Universitas Sumatera Utara
g/L dari air demineralisasi) : 1 K2HPO4; 0,83 NaNO3; 6 NaCl ; 0,2 MgCl2.6H2O. Inokulum dan medium dimasukkan kedalam bioreaktor desulfurisasi (R-303) yang beroperasi pada suhu 35oC dan tekanan atmosfer serta diumpankan juga oksigen (O2) sehingga terjadi reaksi berikut ini :
H2S(l) + 2 1
O2(g) S(s) + H2O(l) (Van den Bosch,2007) Sebelum diumpankan ke absorber (T-301), gas harus masuk pada tekanan tinggi yaitu 85 bar (83,89 atm) agar gas H2S menjadi cair. Oleh karena itu gas dinaikkan tekanannya oleh kompressor (JC-206). Suhu keluar dari compressor yaitu 149,78oC. Sedangkan kondisi mikroba berada pada suhu 35 oC, oleh karena itu campuran gas dan cairan didinginkan terlebih dahulu oleh cooler (E-207). Campuran gas dan cairan tersebut diumpankan ke bagian bawah absorber sedangkan medium dan mikroba yang sudah dibiakkan dari bioreaktor masuk dari bagian atas absorber. Sehingga H2S terserap sempurna, maka pada bagian atas absorber menghasilkan H2 dan CO2 sedangkan produk bagian bawah yang berfase cairan dan mengandung sulfur dikembalikan ke reaktor dan dilanjutkan ke clarifier (S-306), dengan tujuan mengendapkan sulfur yang terbentuk. Cairan akan diumpankan kembali ke reaktor (Van den Bosch dkk., 2007).
Untuk memperoleh H2 dalam konsentrasi yang tinggi, gas yang dihasilkan dari
absorber biodesulfurisasi dialirkan ke unit pemisahan CO2 yaitu ke absorber (T-308)
untuk memisahkan sebagain besar gas CO2 dengan larutan K2CO3. Unit ini terdiri atas 2 bagian, yaitu: CO2 absorber yang berfungsi untuk mengabsorbsi CO2 dan beroperasi pada tekanan 1 atm 72 oC, serta unit CO2 stripper yang berfungsi untuk melepaskan CO2 dan beroperasi pada tekanan 1 atm 112 0C. Pada CO2 absorber, campuran gas keluaran dialirkan menuju bagian bawah tangki. CO2 diserap menggunakan larutan K2CO3 30% berat untuk mengabsorpsi gas CO2 yang masuk pada bagian atas kolom tangki. Pada CO2 absorber pertama-tama gas CO2 akan berikatan dengan larutan K2CO3 membentuk larutan KHCO3 (Reina, 2011). Reaksi yang terjadi pada absorber :
Irma Suraya 08 0405 001
Universitas Sumatera Utara
temperatur 112oC dan dialirkan menuju stripper (T-313). Pada kolom stripper
menggunakan steam karena reaksi yang terjadi bersifat endotermik dan temperaturnya dijaga konstan pada 112oC dan tekanan 1 atm. Pada kolom stripper
terjadi reaksi yang berlawanan pada absorber yaitu melepaskan CO2.
2KHCO3 CO2 + K2CO3 + H2O Hr = 6,43 kkal/mol ( Reina,2011) Gas CO2 yang terlepas akan keluar menuju CO2 plant dari bagian atas
stripper, sedangkan larutan K2CO3 (benfield) yang telah dipisahkan dipompakan
kembali menuju bagian atas absorber.
Gas keluaran kolom absorber yang mengandung H2 dan CO2 dalam jumlah sangat kecil akan melewati kolom (Pressure Swing Absorption) PSA (T-316) untuk menghasilkan gas hidrogen dengan kemurnian tinggi. Pada purifikasi/pemurnian hidrogen, unit PSA digunakan untuk memisahkan hidrogen dari komponen lainnya dalam aliran gas yang diubah, yang terdiri atas CO2. Kemurian hidrogen yang dihasilkan dari unit PSA dapat lebih besar mencapai 99,99%. Perbandingan tekanan minimum diantara gas umpan dan pemurnian dari PSA adalah sekitar 4:1. Tekanan mutlak dari gas umpan dan pemurniannya juga merupakan hal yang penting dalam hubungannya untuk menghasilkan gas hidrogen. Tekanan umpan yang optimum untuk aplikasi penyulingan adalah sekitar 215 – 415 psia. Tekanan gas pemurnian pada umumnya adalah sekitar 17 – 30 psia untuk memperoleh produksi yang tinggi dari hidrogen (Leiby, 1994). Dalam rancangan untuk analisis ini, tekanan gas umpan PSA adalah 294 psia atau 20 atm dan tekanan off-gas adalah 29,38 psia atau 2 atm. Pada akhirnya, hidrogen akan dikirim menuju saluran pipa dan kemudian produk hidrogen akan dikompresi dari tekanan 20 atm menuju 30 atm dan disimpan pada suhu 40 oC (Yolanda, 2011).
2.9.2 Sifat-Sifat Bahan Baku dan Produk 2.9.2.1 Natrium Hidroksida (NaOH)
Fungsi : sebagai alkali treatment untuk menonaktifkan aktivitas bakteri metanogenesis dan sebagai agen penetral pH.
1. Berat molekul : 39,9971 gr/mol 2. Titik lebur : 318 0C
Irma Suraya 08 0405 001
Universitas Sumatera Utara
4. Kelarutan dalam air : 111 gr/100 ml pada 20 0C 5. Densitas : 2,1 gr/cm3
6. Larut dalam air, etanol dan metanol 7. Padatan putih
8. Tidak berbau
(Atkins dan Paula, 2006 ; MSDS Certified lye, 2008)
2.9.2.2 Ferro Klorida (FeCl2)
Fungsi: sebagai sumber Fe untuk nutrisi mikroba. 1. Berat molekul : 126,751 gr/mol
2. Titik lebur : 677 0C 3. Titik didih : 10230C
4. Kelarutan dalam air : 64,4 gr/100 ml pada 10 0C 5. Densitas : 3,16 gr/cm3
6. Agen flokulan dalam pengolahan air limbah buangan 7. Tidak larut dalam tetrahidrofuran
8. Merupakan padatan paramagnetik berwarna putih (Wilkinson, 1963; Egon, 2005; Lide, 2005)
2.9.2.3 Natrium Posfat Anhidrat (Na2HPO4.2H2O)
Fungsi: sebagai sumber P nutrisi mikroba. 1. Berat molekul : 177,99 gr/mol
2. Titik lebur : 243 0C
3. Kelarutan dalam air : 100 gr/100 ml pada 50 0C 4. Tidak berbau
5. Padatan berwarna putih
6. Mudah terlarut dalam air dingin dan air panas 7. Reaktif dengan agen oksidasi, asam dan alkali (MSDS Sciencelab, 2010)
2.9.2.4 Dikalium Posfat (K2HPO4)
Irma Suraya 08 0405 001
Universitas Sumatera Utara
1. Berat molekul : 174,2 gr/mol 2. Titik lebur : >465 0C
3. Kelarutan dalam air : 149,25 gr/100 ml pada 20 0C 4. Tidak berbau
5. Padatan berwarna putih 6. Mudah larut dalam air garam
7. pH larutan dikalium posfat hampir netral (Lide, 2005)
2.9.2.5 Natrium Nitrat (NaNO3)
Fungsi: sebagai salah satu komponen medium dari mikroba desulfurisasi. 1. Berat molekul : 84,9947 gr/mol
2. Titik lebur : 308 0C
3. Kelarutan dalam air : 91,2 gr/100 ml pada 25 0C 4. Tidak berbau
5. Padatan berwarna putih 6. Mudah larut dalam air garam
7. pH larutan dikalium posfat hampir netral (Lide, 2005)
2.9.2.6 Natrium Klorida (NaCl)
Fungsi: sebagai salah satu komponen medium dari mikroba desulfurisasi. 1. Berat molekul : 58,44 gr/mol
2. Titik lebur : 8010C 3. Titik Didih : 14130C
4. Kelarutan dalam air : 359 g/L 5. Tidak berbau
6. Padatan berwarna putih
7. Larut dalam ammonia dan gliserol 8. Tidak Larut dalam HCl
Irma Suraya 08 0405 001
Universitas Sumatera Utara
2.9.2.7 Magnesium Diklorida Heksahidrat (MgCl.6H2O)
Fungsi: sebagai salah satu komponen medium dari mikroba desulfurisasi. 1. Berat molekul : 203,31 gr/mol
2. Titik lebur : 1180C
3. Kelarutan dalam air : 157 g/100 mL pada 20 0C 4. Densitas : 1,569 g/cm3
5. Padatan berwarna putih
6. Larut dalam air dingin, air panas dan metanol 7. Tidak Larut dalam dietil eter dan n-oktanol (Lide, 2005)
2.9.2.8 Kalium Hidroksida (KOH)
Fungsi: sebagai salah satu komponen medium dari mikroba desulfurisasi. 1. Berat molekul : 56,1056 gr/mol
2. Titik lebur : 4060C 3. Titik didih : 13270C
4. Kelarutan dalam air : 121 g/100 mL pada 25 0C 5. Densitas : 2,044 g/cm3
6. Padatan berwarna putih 7. Tidak Berbau
8. Tidak Larut dalam eter dan cairan amonia 9. Larut dalam alkohol dan gliserol
(Lide, 2005 ; Schultz dkk. ; 2005)
2.9.2.9 Oksigen (O2)
Fungsi: sebagai oksidator untuk H2S di proses desulfurisasi, sehingga terbentuk sulfur.
Irma Suraya 08 0405 001
Universitas Sumatera Utara
4. Densitas : 1,429 g/L pada suhu 00C dan 101,325 kPa 5. Fase gas
6. Tidak Berbau
7. Oksigen lebih larut dalam air dibandingkan nitrogen (Emsley, 2001)
2.9.2.10 Kalium Karbonat (K2CO3)
Fungsi : sebagai campuran larutan absorben. 1. Berat molekul : 138,205 gr/mol
2. Titik lebur : 891 0C 3. Densitas : 2,29 gr/cm3
4. Kelarutan dalam air : 112 g / 100 ml pada 200 C 5. Tidak larut didalam alkohol
6. Berwarna putih
7. Berupa padatan berbentuk serbuk (MSDS ScienceLab,2010)
2.9.2.11 Air (H2O)
Fungsi: sebagai absorben gas karbondioksida (CO2) di dalam kolom Absorber dan komponen dalam medium desulfurisasi.
Irma Suraya 08 0405 001
Universitas Sumatera Utara
(MSDS ScienceLab,2012)
2.9.2.12 Karbon Dioksida (CO2)
Fungsi : merupakan salah satu komponen di dalam biogas dan salah satu produk hasil fermentasi biohidrogen.
1. Berat Molekul : 44,01 g/mol 2. Temperatur kritis : 31oC 3. Tekanan kritis : 73,825 bar 4. Densitas kritis : 464 kg/m3 5. Fasa padat
• Densitas padat : 1562 kg/m3 • Panas laten : 196,104 kJ/kg 6. Fasa cair
• Densitas cair : 1032 kg/m3 • Titik didih : -78,5oC
• Panas laten uap : 571,08 kJ/kg • Tekanan uap : 58,5 bar
7. Fasa gas
• Densitas gas : 2,814 kg/m3 • Spesifik graviti : 1,521
• Spesifik volume : 0,547 m3/kg • CP : 0,037 kJ/mol.K
• CV : 0,028 kJ/mol.K
• Viskositas : 0,0001372 poise • Kelarutan : 1,7163 vol/vol (Lide,2005)
2.9.2.9 Gas Hidrogen (H2)
Fungsi: sebagai produk utama.
Irma Suraya 08 0405 001
Universitas Sumatera Utara
2. Titik lebur : -259,14 oC (1 atm) 3. Titik didih : -252,87 oC (1 atm) 4. Densitas : 0,08988 g/L (0C, 1 atm) 5. Densitas kritis : 0,08988 g/L (0C, 1 atm) 6. Kalor peleburan : 0,117 kJ/mol
7. Kalor penguapan : 0,904 kJ/mol 8. Kapasitas panas : 28,836 J/mol K 9. Temperatur kritis : 32,19 K
10.Tekanan kritis : 1,315 MPa (Wiberg dkk.,2001)
2.9.2.10Sulfur (S)
Fungsi: sebagai produk biodesulfurisasi
1. Berat molekul : 32,065 gr/gmol 2. Titik lebur : 115,21oC 3. Titik didih : 444,6oC 4. Kalor peleburan : 1,727 kJ/mol 5. Kalor penguapan : 45 kJ/mol 6. Kapasitas panas : 22,75 J/mol K 7. Temperatur kritis : 1.314 K 8.Tekanan kritis : 20,7 Mpa 9. Sulfur tidak larut dalam air.
Irma Suraya 08 0405 001
Universitas Sumatera Utara
Keterangan : BK-101 = Bak Umpan POME BK-205 = Bak Penampung Akhir C-105 = Belt conveyor (NaOH) C-109 = Belt conveyor (FeCl2) C-111 = Belt conveyor (Na2HPO4.2H2O) C-401 = Scew conveyor (Sulfur) E-207 = Cooler E-310 = Heat Exchanger E-311 = Cooler E-315 = Cooler E-404 = Cooler E-407 = Cooler J-102 = Pompa LCPKS J-106 = Pompa Pre-treatment
J-112 = Pompa Umpan Reaktor Fermentasi Hidrogen Berpengaduk J-202 = Pompa Umpan Reaktor Fermentasi Biogas Berpengaduk J-204 = Pompa Bak Penampung Akhiri
J-302 = Pompa Keluaran Absorber Desulfurisasi J-305 = Pompa Keluaran Reaktor Desulfurisasi J-307 = Pompa Keluaran Settler J-309 = Pompa Keluaran Absorber CO2 J-312 = Pompa Keluaran Stripper
JC-206 = Kompressor Produk Gas Keluaran Reaktor Biohidrogen JC-403 = Kompressor Gas CO2
JC-314 = Kompressor Produk Absorber CO2 JC-406 = Kompressor Gas H2 L-104 = Gudang Penyimpanan NaOH L-108 = Gudang Penyimpanan FeCl2 L-110 = Gudang Penyimpanan Na2HPO4.2H2O M-103 = Tangki Pre-treatment M-107 = Tangki Pencampur LCPKS dan Nutrisi R-201 = Reaktor Fermentasi Biohidrogen R-203 = Reaktor Fermentasi Biogas R-303 = Bioreaktor Desulfurisasi S-306 = Clarifier T-301 = Kolom Absorber H2S T-308 = Kolom Absorber CO2 T-313 = Kolom Stripper T-316 = Kolom PSA TK-304 = Tangki O2 TK-402 = Tangki Sulfur TK-405 = Tangki Gas CO2 TK-408 = Tangki Gas H2
Instrumentasi FC = Flow Control PC = Pressure Control TC = Tempeartur Controler TI = Temperatur Indikator LI = Level Indikator
M-103 R-201 T-313 E-404 JC-406 E-407 R-303 BK-205 J-106 M-107 J-112
J-202 32 S-306 J-307 19 BK-101 FC J-102 1 L-104 FC
Steam, saturated 150oC Air Pendingin 30oC
FC FC 6 8 9 J-204 FC Generator 7 PC 11 R-203 J-302 FC 16 FC PC 22 PC FC C-401 TK-402 LI FC 15 Flare PC PC FC L-108 L-110 T-316 31 PC PC FC
Kondensat, 150oC
TC TC TC TC TC 2 3 4 5 14 18 25 23 26 20 24 27 28 21 29 30 33 34 C-105 C-109 C-111 JC-206 E-207 T-301 J-305 T-308 J-309 E-310 J-312 E-311 JC-403 E-315 JC-314 12
Air Pendingin Bekas, 60oC
10 TC LC LC TC LC TC TC TC PI PI TK-405 TK-408 17 FC TK-304 LI
13 DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK UNIVERSITAS SUMATERA UTARA
MEDAN
DIAGRAM ALIR PRA RANCANGAN PABRIK PEMBUATAN BIOHIDROGEN DARI LIMBAH CAIR KELAPA SAWIT DENGAN FERMENTASI ANAEROBIK PADA KONDISI TERMOFILIK UNTUK KAPASITAS PRODUKSI 371,3771 TON TBS/TAHUN
Skala : Tanpa Skala Tanggal Tanda Tangan Digambar Nama : Irma Suraya
1. Nama :
NIP : 19680820 199501 1 001 Diperiksa/
Disetujui 2. Nama :
NIP : 19660925 199103 1 003 NIM : 080405001
Dr. Eng. Ir. Irvan, Msi
Irma Suraya 08 0405 001
Universitas Sumatera Utara
BAB III
NERACA MASSA
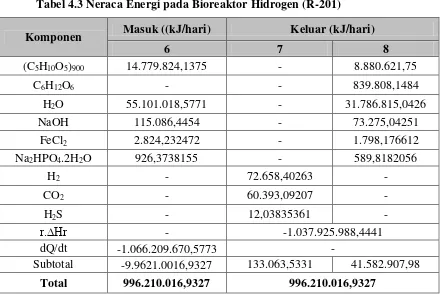
3.1 Tangki Pre-Treatment (M-103)
Tabel 3.1 Neraca Massa pada Tangki Pre-Treatment(M-103)
Komponen Masuk (kg/hari)
Keluar (kg/hari)
1 2 3
(C5H10O5)900 204.608,2192 - 204.608,2192 H2O 239.227,3972 - 239.227,3972 NaOH - 1.775,3425 1.775,3425
Total 445.610,9589 445.610,9589
3.2 Tangki Pencampur (M-107)
Tabel 3.2 Neraca Massa pada Tangki Pencampur (M-107)
Komponen
Masuk (kg/hari)
Keluar (kg/hari)
3 4 5 6
(C5H10O5)900 204.608,2192 - - 204.608,2192
H2O 239.227,3972 - - 239.227,3972
NaOH 1.775,3425 - - 1.775,3425
FeCl2 - 82,9973 - 82,9973
Na2HPO4.2H2O - - 15,1969 15,1969
Irma Suraya 08 0405 001
Universitas Sumatera Utara
3.3 Bioreaktor Hidrogen (R-201)
Tabel 3.3 Neraca Massa pada Bioreaktor Hidrogen (R-201)
Komponen
Masuk
(kg/hari) Keluar (kg/hari)
6 7 8
(C5H10O5)900 204.608,2192 - 193.050
H2O 239.227,3972 - 217.239,4421
C6H12O6 - - 18.256,03743
NaOH 1.775,3425 - 1.775,3425
FeCl2 82,9973 - 82,9973
Na2HPO4.2H2O 15,1969 15,1969
H2 - 1.018,4900 -
H2S - 2,4126 -
CO2 - 14.269,2344 -
Total 445.709,1531 15.290,1370 430.419,0161
445.709,1531 445.709,1531
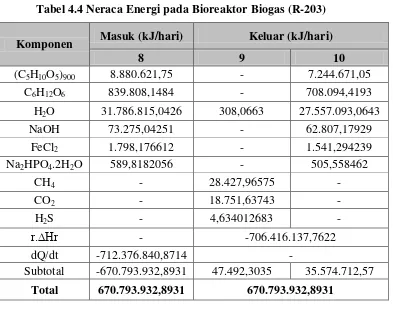
3.4 Bioreaktor Biogas (R-203)
Tabel 3.4 Neraca Massa pada Bioreaktor Biogas (R-203)
Komponen
Masuk
(kg/hari) Keluar (kg/hari)
8 9 10
(C5H10O5)900 193.050 - 183.735
H2O 217.239,4421 - 219.862,27
C6H12O6 18.256,03743 - 17.958,2657
NaOH 1.775,3425 - 1.775,3425
FeCl2 82,9973 - 82,9973
Na2HPO4.2H2O 15,1969