PENGARUH PEMBERIAN EKSTRAK UMBI UBI JALAR UNGU
(Ipomoea batatas L.) TERHADAP AKTIVITAS GLUTATION
PEROKSIDASE (GPX) DAN HISTOPATOLOGI HEPAR MENCIT (Mus musculus L.) YANG DIBERI PERLAKUAN
LATIHAN FISIK MAKSIMAL
TESIS
Oleh: AYU ELVANA
127008013/BM
PROGRAM STUDI MAGISTER ILMU BIOMEDIK
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH PEMBERIAN EKSTRAK UMBI UBI JALAR UNGU
(Ipomoea batatas L.) TERHADAP AKTIVITAS GLUTATION
PEROKSIDASE (GPX) DAN HISTOPATOLOGI HEPAR MENCIT (Mus musculus L.) YANG DIBERI PERLAKUAN
LATIHAN FISIK MAKSIMAL
TESIS
Diajukan Sebagai Salah Satu Syarat untuk Memperoleh Gelar Magister Biomedik dalam Program Studi Magister Ilmu Biomedik
Fakultas Kedokteran Universitas Sumatera Utara
Oleh: AYU ELVANA
127008013/BM
PROGRAM STUDI MAGISTER ILMU BIOMEDIK
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
Judul Tesis : Pengaruh Pemberian Ekstrak Umbi Ubi Jalar Ungu (Ipomoea batatas L.) terhadap Aktivitas Glutation Peroksidase (Gpx) dan Histopatologi Hepar Mencit
(Mus musculus L.) yang Diberi Perlakuan Latihan
Fisik Maksimal Nama Mahasiswa : Ayu Elvana Nomor Pokok : 127008013 Program Studi : Biomedik
Disetujui Komisi Pembimbing
(Dr. Ir. Herla Rusmarilin, MP) (Prof. Dr. Ramlan Silaban, M.Si)
Ketua Anggota
Ketua Program Studi Dekan
(dr. Yahwardiah Siregar, Ph.d) (Prof. dr. Gontar A Siregar, Sp.PD, KGEH)
Telah diuji pada
Tanggal : 17 April 2015
PANITIA PENGUJI TESIS
Ketua : Dr. Ir. Herla Rusmarilin, MP
Anggota : 1. Prof. Dr. Ramlan Silaban, M.Si
ABSTRAK
Latihan fisik dapat meningkatkan sistem pertahanan antioksidan organisme, tetapi periode yang panjang dan berat pada latihan akan mengganggu keseimbangan oksidan ataupun antioksidan. Keseimbangan antara radikal bebas dengan kemampuan antioksidan alami tubuh akan terganggu yang akhirnya akan menyebabkan kerusakan jaringan. Glutation peroksidase yang rendah berkorelasi dengan gangguan yang berhubungan dengan radikal bebas. Salah satu komponen flavonoid dari tumbuh-tumbuhan yang dapat berfungsi sebagai antioksidan adalah zat warna alami yang disebut antosianin. Tumbuhan ubi jalar ungu (Ipomea batatas L.) yang umbinya mengandung antosianin cukup tinggi.
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian ekstrak umbi ubi jalar ungu (ipomoea batatas l.) terhadap aktivitas glutation peroksidase (gpx) dan perubahan histopatologi hepar mencit (mus musculus) yang diberi perlakuan latihan fisik maksimal. Penelitian dilakukan dengan desain control group post test only secara in vivo terhadap 24 ekor mencit putih jantan (Mus musculus L), strain DD Webster. Dibagi atas 6 kelompok terdiri dari : P1 (kontrol), P2 (Latihan fisik maksimal selama 60menit), P3 (ekstrak 0,5ml), P4 (latihan fisik maksimal selama 60menit + 0,5ml ekstrak), P5 (latihan fisik maksimal selama 60menit + 1ml ekstrak), P6 (latihan fisik maksimal + 1,5ml ekstrak). Jika data berdistribusi normal dan homogen maka dilakukan uji ANOVA. Jika data tidak maka dilakukan uji Kruskal-Wallis. Untuk melihat adanya perbedaan antara kelompok kontrol dengan perlakuan akan dilakukan uji Post-Hoc. Semua analisa data dilakukan dengan menggunakan software SPSS 19. Dalam penelitian ini untuk keputusan uji statistik diambil taraf nyata 5% (p = 0,05).
Hasil penelitian menunjukkan bahwa rerata aktivitas enzim GPx pada kelompok P5 merupakan aktivitas enzim GPx paling tinggi yaitu 19,39±7,06, kemudian diikuti secara berurut oleh P4 (7,05±8,19), P1 (6,58±7,04), P3 (4,50±4,31), P6 (3,03±1,98), dan P2 (1,84±0,92) merupakan aktivitas enzim GPx yang paling rendah. diperoleh nilai p = 0.024 yang artinya terdapat perbedaan bermakna nilai aktivitas enzim GPx antar kelompok karna P<0,05. Histopatologi hepar menunjukkan bahwa P1 normal (100%), P2 memiliki kerusakan A3 (100%) , P3 memiliki kerusakan A1 (50%) dan A2 (50%), P4 memiliki kerusakan A1 (25%) dan A2 (75%), P5 memiliki kerusakan A1 (25%) dan A2 (75%) dan P6 memiliki kerusakan yang sama dengan P2 yaitu A3 (100%). diperoleh nilai P = 0,001 yang artinya terdapat perbedaan bermakna gambaran histopatologi hepar mencit antar kelompok perlakuan dengan kelompok kontrol.
Pada penelitian ini menunjukkan bahwa pemberian ekstrak dapat meningkatkan aktivitas enzim GPx secara signifikan tetapi tidak pada histopatologi hepar.
ABSTRACT
Physical exercise can increase defense system organisms antioxidant, but for a long periods and exhaustive exersice will make imbalance of oxidant or an antioxidant. The balance between free radical to the ability of endogenous antioxidant will be disrupted that will eventually lead to tissue damage. The low of Gluthatione peroxides had a corelation of free radical disorders. One component of the flavonoid antioxidant is that could serve as a natural dyestuff called anthocyanin. Purple sweet potat (Ipomea batatas L.) Containing high of anthocyanin's.
The aim of this research was to determine the usefulness of purple sweet potato extract (Ipomoea batatas L.) of gluthathione peroxides activity (GPx)and histopathological hepar of male mice (Mus musculus L.) which had been given maximal physical activity.
This experimental research laboratory with the design of the post test only control group. The male mice research’s subject (Mus musculus L.) Strain DD Webster, aged 6-8 weeks with 25-35 grams, obtained from the Natural Science USU. Subjects were divided into six groups, those are : P1 (control), P2 (maximal physical activity during 60 minutes), P3 (extract 0,5ml), P4 (maximal physical activity during 60 minutes + 0,5ml ekstrak), P5 (maximal physical activity during 60 minutes + extract 1ml), P6 (maximal physical activity during 60 minutes + extract 1,5ml). Then, there were normality and homogeneity tests of data, if the result of research are normally distributed and homogeneous there will be an ANOVA test (p <0.05) continued by a Post Hoc test with mann whitney analysis of 5%, when the data were not normally distributed and homogeneous, followed by the kruskall-wallis (p <0.05). All data was used by software SPSS 19.
The research shown that average of GPx activity in P5 was the highest activity enzyme of GPx 19,39±7,06, continuosly to P4 (7,05±8,19), P1 (6,58±7,04), P3 (4,50±4,31), P6 (3,03±1,98), dan P2 (1,84±0,92) as the lower activity enzyme of GPx. p = 0.024 it shown that the GPx activity enzyme had a significant different between groups in this research. Histopatology of hepar shown that P1 as a normal (100%), P2 had a damage A3 (100%) , P3 had a damage of A1 (50%) and A2 (50%), P4 had a damage of A1 (25%) and A2 (75%), P5 had a damage of A1 (25%) dan A2 (75%) dan P6 had a damage as like as P2 that A3 (100%). P value was 0,001 it shown that there a significant difference between control group with the others group.
This research has shown that extract of purple sweet potato (Ipomea batatas L.) could increased the significant GPx activity but could not to fix damaged of hepar histopatology.
KATA PENGANTAR
Puji syukur penulis ucapkan kehadirat Allah SWT atas rahmah dan
berkah-Nya sehingga penulis dapat menyelesaikan penelitian dengan judul
”Pengaruh Pemberian Ekstrak Umbi Ubi Jalar Ungu (Ipomoea Batatas L.)
Terhadap Aktivitas Glutation Peroksidase (Gpx) Dan Histopatologi Hepar Mencit
(Mus Musculus) yang diberi Perlakuan Latihan Fisik Maksimal”. Tesis ini
merupakan salah satu syarat dalam rangka menyelesaikan program pendidikan
Magister Ilmu Biomedik pada Fakultas Kedokteran, USU Medan.
Selama proses pelaksanaan penelitian hingga selesainya tesis ini, penulis
memperoleh banyak dukungan dan bantuan dari berbagai pihak. Pada kesempatan
ini penulis ingin mengucapkan terima kasih kepada:
1. Bapak Prof.Dr.dr.Syahril Pasaribu, DTM&H, MSc(CTM), Sp.A (K) sebagai
Rektor USU Medan beserta seluruh jajarannya.
2. Bapak Prof. dr. Gontar A. Siregar, Sp.PD, KGEH, sebagai Dekan Fakultas
Kedokteran USU Medan beserta seluruh jajarannya.
3. Ibu dr. Yahwardiah Siregar, Ph.D, sebagai Ketua Program Studi Ilmu
Biomedik, Fakultas Kedokteran, USU Medan beserta seluruh jajarannya.
4. Ibu Dr. Ir. Herla Rusmarilin dan Bapak Prof. Dr. Ramlan Silaban, M.Si. yang
bersedia meluangkan waktu, masukan dan pemikiran sebagai dosen
pembimbing selama penyusunan tesis ini.
5. Dosen pembanding, Ibu dr.Ricke Loesnihari, M.Ked (Clin-Path), Sp.PK (K)
dan dr.Esther R.D. Sitorus, Sp.PA yang bersedia meluangkan waktu dan
6. Ketua Prodi Magister Biologi FMIPA, Bapak Prof. Dr. Drs. Syafruddin Ilyas,
M.Biomed yang telah memberikan izin penelitian hewan coba di FMIPA dan
masukan dalam penyelesaian tesis ini serta para assisten Laboratorium
pemeliharaan hewan FMIPA USU.
7. Ibu dr.Fitriani Lumongga, Sp.PA dan Bapak dr. Delyuzar, M.Ked (PA),
Sp.PA(K) yang telah memberikan bimbingan dalam pengamatan histopatologi
untuk penyelesaian tesis ini.
8. Ibu dr.Putri Chairani Eyanoer, Ms.Epi, Ph.D. beserta staff yang telah
membimbing penulis untuk menyelesaikan interpretasi data dalam tesis ini.
9. Kedua orang tua, papa (Revan ED, S.H.) mama (Elita) yang telah memberikan
kasih sayang, dukungan dan doa sepenuhnya kepada penulis selama
penyelesaian tesis ini. Dan juga seluruh keluarga yang telah mendoakan.
10.Kakak dr. Rika Nailuvar Sinaga, sahabat sekaligus kakak dan partner dalam
penelitian ini.
11.Seluruh teman - teman seangkatan dan seperjuangan penulis (Biomedik 2012)
yang selalu kompak, ceria dan saling mendukung dalam menyelesaikan studi
bersama.
Penulis mengharapkan kritik dan saran yang membangun untuk kesempurnaan
tesis ini. Demikian tesis ini disampaikan semoga dapat bermanfaat bagi ilmu
pengetahuan.
Medan, April 2015
Penulis
DAFTAR RIWAYAT HIDUP
DATA PRIBADI
Nama Lengkap : Ayu Elvana
Tempat /tanggal lahir : Padang, 27 Juni 1989
Jenis Kelamin : Perempuan
Status Perkawinan : Belum Menikah
Agama : Islam
Pendidikan Terakhir : Sarjana Pendidikan, Jurusan Biologi
PENDIDIKAN FORMAL
· SD YAPENA 45 Medan, berijazah tahun 2001. · SMP Negeri 34 Medan, berijazah tahun 2004. · SMA Negeri 2 Medan, berijazah tahun 2007. · Universitas Negeri Medan, berijazah tahun 2011.
KONTAK
Alamat : Jl. Sakti Lubis Gg. Tukang Besi No. 27c, Kelurahan Sitirejo II, Kecamatan Medan Amplas, Kode Pos 20219, Medan.
Telepon / HP : 085296442089
Email : [email protected]
Riwayat Pekerjaan
DAFTAR ISI
1.5. Hipotesis Penelitian 8
BAB II TINJAUAN PUSTAKA
2.1. Latihan Fisik 9
2.1.1. Respon fisiologis terhadap latihan fisik 10
2.2. Radikal Bebas 13
2.2.1. Struktur kimia 16
2.2.2. Sumber radikal bebas 17
2.2.3. Tipe radikal bebas dalam tubuh 19
2.2.4. Pertahanan sel terhadap radikal bebas 20
2.3. Glutation Peroksidase (GPx) 23
2.4. Ubi Jalar 27
2.4.1. Ubi Jalar Ungu 30
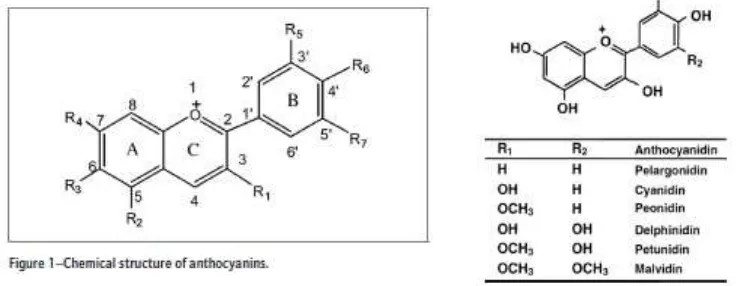
2.5. Antosianin 32
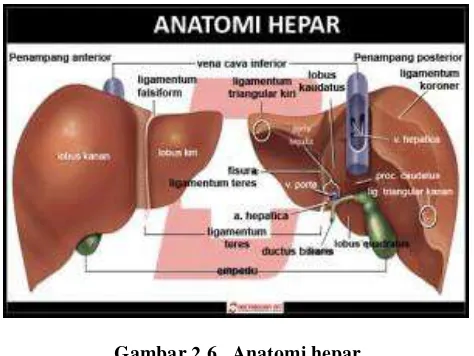
2.6. Hati/ Hepar 35
2.6.1. Anatomi dan Fisiologi Hepar 36
2.6.2. Mikroskopis Kerusakan Hepar 39
2.6.3. Metabolisme Antioksidan dalam Hepar 40
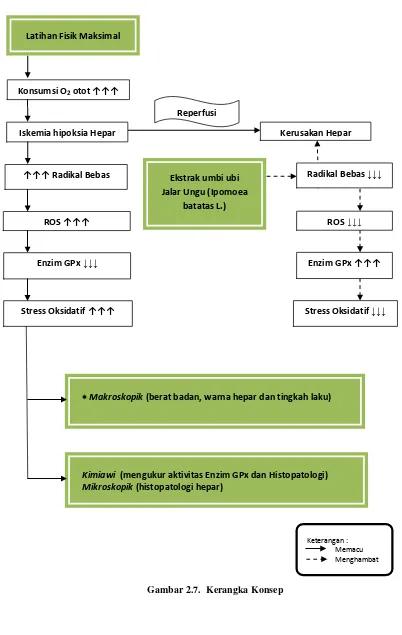
2.7. Kerangka konsep 42
BAB III METODOLOGI PENELITIAN
3.1. Desain penelitian 43
3.2. Lokasi dan Waktu Penelitian
3.2.1. Lokasi 43
3.2.2. Waktu 43
3.3.1. Populasi 45
3.3.2. Sampel 45
3.4. Variabel Penelitian
3.4.1. Variabel independent (bebas) 45
3.4.2. Variabel dependent (terikat) 46
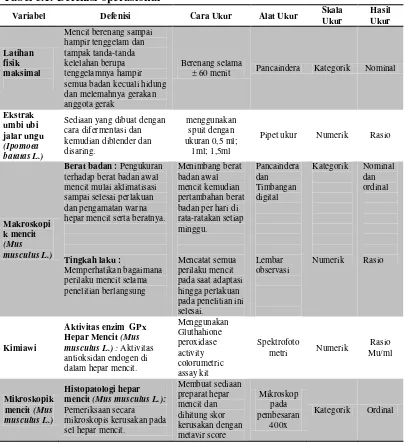
3.5. Defenisi Operasional 46
3.6. Etika Penelitian 47
3.7. Alat dan Bahan Penelitian
3.7.1. Alat-alat yang Dipergunakan Dalam Penelitian 47 3.7.2. Bahan-bahan yang Dipergunakan Dalam Penelitian 47
3.8. Prosedur Penelitian 48
3.9. Prosedur Pelaksanaan Penelitian dan Pengamatan
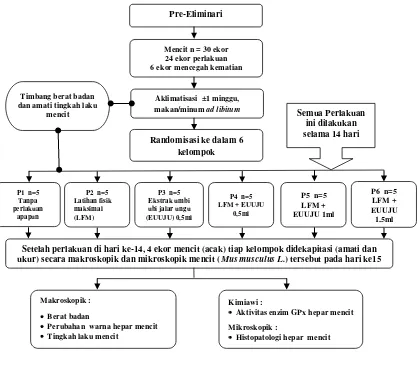
3.9.1. Pre-Eliminari 50
3.9.2. Pembuatan ekstrak umbi ubi jalar ungu (Ipomoea batatas L.)
3.9.2.1.Pembuatan Ekstrak 51
3.9.2.2.Penentuan Kadar Antosianin 52
3.9.3. Pemeliharaan Hewan Coba 52
3.9.4. Perlakuan Latihan Fisik Hewan Coba 53
3.9.5. Pembedahan Mencit 53
3.9.7.1. Enzim Gluthation Peroksidase (GPx) 55 3.9.8. Mikroskopik
3.9.8.1. Histopatologi Hepar 56
3.10. Analisa Data 60
BAB IV HASIL DAN PEMBAHASAN
4.1. Hasil dan Pembahasan Penelitian 61
4.1.1. Hasil dan Pembahasan Kadar Antosianin dan Kandungan Gizi yang Terkandung dalam Ekstrak Umbi Jalar Ungu
(Ipomoea batatas L.) yang Digunakan untuk Penelitian 61 4.1.2. Makroskopik
4.1.2.1. Hasil dan Pembahasan Berat Badan Mencit 64 4.1.2.2. Hasil dan Pembahasan Tingkah Laku Mencit 68 4.1.2.3. Hasil dan Pembahasan Warna Organ Hepar Mencit 74 4.1.3. Kimiawi
4.1.3.1. Hasil dan Pembahasan Aktivitas Enzim Glutation
Peroksidase pada Organ Hepar Mencit 74
4.1.4. Mikroskopik
4.1.4.1. Hasil dan Pembahasan Gambaran Histopatologi
BAB V KESIMPULAN DAN SARAN
5.1. Kesimpulan 86
5.2. Saran 87
DAFTAR PUSTAKA 88
DAFTAR GAMBAR
Halaman
Gambar 2.1. Struktur kimia radikal bebas 16
Gambar 2.2. Enzim-enzim pertahanan antioksidan 20
Gambar 2.3. Mekanisme katalisis h2o2 oleh glutation peroksidase 26
Gambar 2.4. Ubi jalar ungu 31
Gambar 2.5. Struktur antosianin dan klasifikasinya 33
Gambar 2.6. Anatomi hepar 36
Gambar 2.7. Kerangka konsep 43
Gambar 3.1. Alur perlakuan penelitian 49
Gambar 3.2. Mencit berenang hingga kelelahan 50
Gambar 3.3. Algorithm for evaluation of histological activity 57 Gambar 3.4. Gambaran normal lobulus hati (perbesaran 100x)
(sumber : eroschenko, 2003) 59
Gambar 3.5. Gambaran nekrosis lobuilus hati, (perbesaran 100x)
(sumber : musthofiyah, 2008 ) 59
Gambar 4.1. Gambar ubi jalar ungu yang digunakan dalam penelitian 62 Gambar 4.2. Grafik perubahan berat badan mencit rerata per-minggu 65 Gambar 4.3. Perbedaan tingkah laku masing-masing kelompok setiap
harinya selama 14 hari perlakuan 68
Gambar 4.4. Mencit yang dipergunakan dalam penelitian 70
Gambar 4.5. Warna hepar mencit penelitian 74
DAFTAR TABEL
Halaman
Tabel 2.1. Antioksidan dan Enzim Pembersih (Scavenging) 22 Tabel 2.2. Ubi Jalar Juga Mengandung Berbagai Antioksidan 29
Tabel 3.1. Defenisi Operasional 46
Tabel 3.2. Hasil Perhitungan Berat Badan dan Waktu Pre-Eliminari 51
Tabel 3.3. Metavir Histologic Activity Score 58
Tabel 3.4. Metavir Histologic Activity Criteria 58
Tabel 3.5. Metavir Fibrosis Score 58
Tabel 4.1. Kandungan gizi umbi ubi jalar ungu (Ipomoea batatas L.) 62 Tabel 4.2. Perubahan berat badan per-minggu mencit selama perlakuan 64 Tabel 4.3. Perbedaan rerata berat badan mencit setelah perlakuan 65 Tabel 4.4. Perbedaan tingkah laku masing-masing kelompok setiap
harinya selama 14 hari perlakuan 68
Tabel 4.5. Perbedaan nilai P tingkah laku mencit selama 14 hari
Perlakuan 70
Tabel 4.6. Hasil rerata nilai aktivitas enzim glutation peroksidase (GPx) di hepar mencit (Mus musculus L.) setelah perlakuan selama
14 hari 74
DAFTAR SINGKATAN
GPX : Gluthathione peroxides CAT : Catalase
SOD : Superoksid dismutase GSH : Glutation tereduksi GSSG : Glutation teroksidasi
Se : Selenium
P1 : Kontrol yang tidak diberikan perlakuan apapun P2 : Latihan fisik maksimal selama 60 menit
P3 : Ekstrak sebanyak 0,5 ml selama 14 hari
P4 : Latihan fisik maksimal selama 60 menit + ekstrak umbi ubi jalar ungu sebanyak 0,5 ml setiap harinya selama 14 hari.
P5 : Latihan fisik maksimal selama 60 menit + ekstrak umbi ubi jalar ungu sebanyak 1 ml setiap harinya selama 14 hari
ABSTRAK
Latihan fisik dapat meningkatkan sistem pertahanan antioksidan organisme, tetapi periode yang panjang dan berat pada latihan akan mengganggu keseimbangan oksidan ataupun antioksidan. Keseimbangan antara radikal bebas dengan kemampuan antioksidan alami tubuh akan terganggu yang akhirnya akan menyebabkan kerusakan jaringan. Glutation peroksidase yang rendah berkorelasi dengan gangguan yang berhubungan dengan radikal bebas. Salah satu komponen flavonoid dari tumbuh-tumbuhan yang dapat berfungsi sebagai antioksidan adalah zat warna alami yang disebut antosianin. Tumbuhan ubi jalar ungu (Ipomea batatas L.) yang umbinya mengandung antosianin cukup tinggi.
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian ekstrak umbi ubi jalar ungu (ipomoea batatas l.) terhadap aktivitas glutation peroksidase (gpx) dan perubahan histopatologi hepar mencit (mus musculus) yang diberi perlakuan latihan fisik maksimal. Penelitian dilakukan dengan desain control group post test only secara in vivo terhadap 24 ekor mencit putih jantan (Mus musculus L), strain DD Webster. Dibagi atas 6 kelompok terdiri dari : P1 (kontrol), P2 (Latihan fisik maksimal selama 60menit), P3 (ekstrak 0,5ml), P4 (latihan fisik maksimal selama 60menit + 0,5ml ekstrak), P5 (latihan fisik maksimal selama 60menit + 1ml ekstrak), P6 (latihan fisik maksimal + 1,5ml ekstrak). Jika data berdistribusi normal dan homogen maka dilakukan uji ANOVA. Jika data tidak maka dilakukan uji Kruskal-Wallis. Untuk melihat adanya perbedaan antara kelompok kontrol dengan perlakuan akan dilakukan uji Post-Hoc. Semua analisa data dilakukan dengan menggunakan software SPSS 19. Dalam penelitian ini untuk keputusan uji statistik diambil taraf nyata 5% (p = 0,05).
Hasil penelitian menunjukkan bahwa rerata aktivitas enzim GPx pada kelompok P5 merupakan aktivitas enzim GPx paling tinggi yaitu 19,39±7,06, kemudian diikuti secara berurut oleh P4 (7,05±8,19), P1 (6,58±7,04), P3 (4,50±4,31), P6 (3,03±1,98), dan P2 (1,84±0,92) merupakan aktivitas enzim GPx yang paling rendah. diperoleh nilai p = 0.024 yang artinya terdapat perbedaan bermakna nilai aktivitas enzim GPx antar kelompok karna P<0,05. Histopatologi hepar menunjukkan bahwa P1 normal (100%), P2 memiliki kerusakan A3 (100%) , P3 memiliki kerusakan A1 (50%) dan A2 (50%), P4 memiliki kerusakan A1 (25%) dan A2 (75%), P5 memiliki kerusakan A1 (25%) dan A2 (75%) dan P6 memiliki kerusakan yang sama dengan P2 yaitu A3 (100%). diperoleh nilai P = 0,001 yang artinya terdapat perbedaan bermakna gambaran histopatologi hepar mencit antar kelompok perlakuan dengan kelompok kontrol.
Pada penelitian ini menunjukkan bahwa pemberian ekstrak dapat meningkatkan aktivitas enzim GPx secara signifikan tetapi tidak pada histopatologi hepar.
ABSTRACT
Physical exercise can increase defense system organisms antioxidant, but for a long periods and exhaustive exersice will make imbalance of oxidant or an antioxidant. The balance between free radical to the ability of endogenous antioxidant will be disrupted that will eventually lead to tissue damage. The low of Gluthatione peroxides had a corelation of free radical disorders. One component of the flavonoid antioxidant is that could serve as a natural dyestuff called anthocyanin. Purple sweet potat (Ipomea batatas L.) Containing high of anthocyanin's.
The aim of this research was to determine the usefulness of purple sweet potato extract (Ipomoea batatas L.) of gluthathione peroxides activity (GPx)and histopathological hepar of male mice (Mus musculus L.) which had been given maximal physical activity.
This experimental research laboratory with the design of the post test only control group. The male mice research’s subject (Mus musculus L.) Strain DD Webster, aged 6-8 weeks with 25-35 grams, obtained from the Natural Science USU. Subjects were divided into six groups, those are : P1 (control), P2 (maximal physical activity during 60 minutes), P3 (extract 0,5ml), P4 (maximal physical activity during 60 minutes + 0,5ml ekstrak), P5 (maximal physical activity during 60 minutes + extract 1ml), P6 (maximal physical activity during 60 minutes + extract 1,5ml). Then, there were normality and homogeneity tests of data, if the result of research are normally distributed and homogeneous there will be an ANOVA test (p <0.05) continued by a Post Hoc test with mann whitney analysis of 5%, when the data were not normally distributed and homogeneous, followed by the kruskall-wallis (p <0.05). All data was used by software SPSS 19.
The research shown that average of GPx activity in P5 was the highest activity enzyme of GPx 19,39±7,06, continuosly to P4 (7,05±8,19), P1 (6,58±7,04), P3 (4,50±4,31), P6 (3,03±1,98), dan P2 (1,84±0,92) as the lower activity enzyme of GPx. p = 0.024 it shown that the GPx activity enzyme had a significant different between groups in this research. Histopatology of hepar shown that P1 as a normal (100%), P2 had a damage A3 (100%) , P3 had a damage of A1 (50%) and A2 (50%), P4 had a damage of A1 (25%) and A2 (75%), P5 had a damage of A1 (25%) dan A2 (75%) dan P6 had a damage as like as P2 that A3 (100%). P value was 0,001 it shown that there a significant difference between control group with the others group.
This research has shown that extract of purple sweet potato (Ipomea batatas L.) could increased the significant GPx activity but could not to fix damaged of hepar histopatology.
BAB I PENDAHULUAN
1.1. Latar belakang
Banyak orang menginginkan tubuh yang sehat dan ideal, sehingga banyak
orang berusaha untuk melakukan olah raga secara teratur. Beberapa orang berpikir
bahwa semua jenis olahraga baik bagi tubuh mereka, tetapi mereka tidak tahu
kalau sebenarnya olahraga itu, terutama bila dilakukan dengan cara yang salah,
dapat membahayakan kesehatan mereka (Fillophy, 2014).
Latihan fisik dan atau olahraga merupakan upaya untuk meningkatkan
derajat kesehatan. Latihan fisik dan atau olah raga merupakan sebagian kebutuhan
pokok dalam kehidupan sehari-hari karena dapat meningkatkan kebugaran yang
diperlukan dalam melakukan tugasnya (www.depkes.go.id, 2014). Latihan fisik
untuk kebugaran dan ketahanan tubuh diminati banyak orang. American College
and Sports Medicine merekomendasikan latihan-latihan untuk mencapai
kebugaran kardiorespirasi dan kerampingan tubuh dengan memperhatikan
frekwensi, intensitas, lamanya dan macam aktivitas (Sastradipradja, 2014).
Maraknya pusat kebugaran mempermudah orang dewasa yang ingin
menurunkan berat badan dan meningkatkan kesehatan tubuh dengan cara
berolahraga. Dengan harapan timbunan lemak bisa cepat terbakar dan mencapai
kesehatan dan kebugaran tubuh yang optimal, mereka memanfaatkan beragam alat
dan fasilitas olahraga dalam jangka waktu yang lama. Banyak orang yang hanya
mereka. Beberapa orang bahkan dilaporkan cidera, dan yang paling parah sampai
meninggal dunia, akibat melakukan olahraga yang berlebihan (Fillophy, 2014).
Latihan fisik yang teratur akan memberikan efek yang menguntungkan
dalam pencegahan dari berbagai penyakit seperti diabetes melitus, hipertensi,
kanker, obesitas, osteoporosis dan kematian dini. Tetapi jika melakukan latihan
fisik secara berat dan berlebihan apalagi bagi seseorang yang tidak biasa
melakukannya, hasilnya tidak baik untuk tubuh. Menurut Kirschvink et al. (2008)
walaupun latihan meningkatkan sistem pertahanan antioksidan organisme, periode
yang panjang dan berat pada latihan akan mengganggu keseimbangan oksidan
ataupun antioksidan. (Es cribano et al., 2010).
Selama latihan fisik maksimal, pengeluaran radikal bebas terutama
superoksida dapat meningkat dalam mitokondria, atau pusat-pusat energi di dalam
sel saat sel tubuh menggunakan oksigen untuk menghasilkan energi, sel-sel tubuh
dapat membentuk molekul reaktif (mudah bereaksi) yang disebut radikal bebas.
Molekul-molekul radikal bebas tidak stabil karena kekurangan elektron pada salah
satu atomnya. Molekul tidak stabil ini akan aktif mencari-cari pasangan elektron
untuk atom yang kekurangan elektron tersebut. Ia akan sangat aktif untuk bereaksi
dengan molekul-molekul yang ada di sekitarnya. Reaksi radikal bebas dengan
molekul yang ada dalam tubuh ini seringkali merugikan sel-sel tubuh (Cooper,
2001).
Dalam kondisi tertentu, radikal bebas dapat melebihi sistem pertahanan
tubuh, kondisi ini disebut sebagai stress oksidatif (Agarwal et al, 2005). Pada
alami tubuh akan terganggu yang akhirnya akan menyebabkan kerusakan
jaringan. Produksi ROS oleh karena latihan fisik maksimal memperoleh respon
yang berbeda, bergantung tipe dari organ jaringan dan tingkat dari antioksidan
endogennya masing-masing (Daniel, et al, 2010).
Tubuh memiliki mekanisme proteksi yang menetralkan radikal bebas yang
terbentuk, antara lain dengan adanya enzim-enzim superoksida dismutase (SOD),
katalase, dan glutathion peroksidase (GPx) (Winarsi, 2007). Glutation
peroksidase intraseluler berpotensi mengubah molekul hidrogen peroksida dengan
cara mengoksidasi glutation bentuk tereduksi mencegah lipid membran dan
unsur-unsur sel lainnya dari kerusakan oksidasi, dengan cara merusak molekul hidrogen
peroksida dan lipid hidroperoksida. Menurut Delmas-Beauvieaux, et al. (1996)
melaporkan bahwa enzim glutation peroksidase mendekomposisikan H2O2 lebih
kuat dibandingkan dengan enzim katalase. Aktivitas enzim glutation peroksidase
mampu mereduksi 70% peroksida organik dan lebih dari 90% H2O2 (Winarsi,
2007).
Pada saat latihan fisik maksimal terjadi peningkatan konsumsi oksigen
sampai 20 kali, bahkan dalam otot dapat mencapai 100 kali, hal ini akan
menyebabkan gangguan homeostasis intraselluler (Ji, 1999; Thirumalai et al,
2011). Penggunaan oksigen yang berlebih ini dapat memicu pembentukan radikal
bebas di berbagai jaringan tubuh. (Cooper, 2001). Menurut Gomez-Gabrera,et al.
(2008) ketika latihan sangat memakan tenaga maka ini akan menyebabkan stres
aliran darah dan metabolisme menurun secara signifikan pada hati dan ginjal
selama latihan (Radak et al, 2013).
Latihan intensif yang tinggi pada 75% dan 90% VO2max menyebabkan
peningkatan parameter biokimia dalam hati dan pankreas dapat menyebabkan
perubahan histopatologi (Lima et al., 2013). Penelitian yang dilakukan oleh
Rachmani menunjukkan adanya perbedaan yang signifikan antara gambaran
nekrosis sel hepar kelompok kontrol negatif dan kelompok kontrol positif (p <
0.05) pada mencit yang di induksi menjadi stress oksidatif. Hal ini sesuai dengan
penelitian Jawi et al. (2006), dimana terjadi peningkatan jumlah nekrosis sel hepar
mencit yang diberi latihan fisik maksimal bila dibandingkan dengan kelompok
kontrol tanpa perlakuan latihan fisik maksimal. Nekrosis sel hepar tejadi akibat
adanya stress oksidatif (Rachmani, 2009).
Dalam hepar dan sel darah merah terdapat glutation peroksidase dengan
konsentrasi tinggi, sedangkan jantung, ginjal, paru-paru, adrenal, lambung, dan
jaringan adipose mengandung kadar glutation peroksidase dalam kadar sedang,
glutation peroksidase kadar rendah sering ditemukan dalam otak, otot, testis, dan
lensa mata (Sugianto, 2011).
Antioksidan gluthation peroksidase (GPx) bekerja dengan cara
menggerakkan H2O2 dan lipid peroksida dibantu dengan ion logam-logam transisi
(Simanjuntak, 2012). Glutation peroksidase yang rendah berkorelasi dengan
gangguan yang berhubungan dengan radikal bebas (Judge et al., 2005).
Meningkatnya konsentrasi dari GSH, GSH-Px dan CAT mengurangi resiko dari
cribano, et al. 2010). Aktivitas enzim ini juga dapat diinduksi oleh antioksidan
sekunder isoflavon (Chen et al., 2002).
Peningkatan prevalensi penyakit degeneratif di Indonesia, memotivasi para
peneliti pangan dan gizi Indonesia untuk mengeksplorasi senyawa-senyawa
antioksidan yang berasal dari sumber alami (Simanjuntak, 2012). Selain vitamin E
dan vitamin C ternyata beberapa flavonoid yang terdapat pada tumbuh-tumbuhan
memiliki khasiat antioksidan. Polcomy et al. (2001), menyatakan bahwa aktivitas
antioksidan dari senyawa alamiah yang berasal dari tanaman seperti flavonoid
disebabkan adanya gugus hidroksil pada struktur molekulnya.
Aktivitas antioksidan flavonoid tergantung pada struktur molekulnya
terutama gugus prenil (CH3)2C=CH-CH2-. Dalam penelitian menunjukkan bahwa
gugus prenil flavonoid dikembangkan untuk pencegahan atau terapi terhadap
penyakit-penyakit yang diasosiasikan dengan radikal bebas. Salah satu komponen
flavonoid dari tumbuh-tumbuhan yang dapat berfungsi sebagai antioksidan adalah
zat warna alami yang disebut antosianin (Simanjuntak, 2012). Berdasarkan hasil
penelitian Sugianto (2011) menyimpulkan bahwa pemberian jus delima merah
(Punica granatum) yang mengandung antosianin dapat meningkatkan kadar
glutation peroksidase darah mencit (Mus Musculus) dengan latihan fisik
maksimal (Sugianto, 2011).
Berdasarkan hasil penelitian dari Fakultas Pertanian Unud di Bali ditemukan
tumbuhan ubi jalar ungu (Ipomea batatas L.) yang umbinya mengandung
antosianin cukup tinggi yaitu berkisar antara 110mg-210 mg/100gram (Suprapta,
maupun dalam bentuk sirup dapat melindungi jaringan hati dari pengaruh radikal
bebas akibat latihan fisik maksimal pada mencit. Pemberian ekstrak umbi ubi
jalar ungu (Ipomea batatas L.) yang mengandung antosianin dapat mengurangi
pengaruh radikal bebas terhadap jaringan hati mencit, terlihat dari menurunnya
AST (aspartate transaminase) dan ALT (alanine aminotransaminase)
dibandingkan tanpa pemberian ekstrak (Jawi, 2007).
Penelitian yang dilakukan oleh Rachmani memberikan hasil secara
histopatologi tampak bahwa tingkat nekrosis paling banyak ditemukan pada
mencit yang diberi perlakuan latihan fisik maksimal tanpa suplementasi ekstrak
umbi lpomoea batatas. Penurunan tersebut diduga disebabkan oleh kandungan
antosianin pada daun lpomoea batatas yang berfungsi sebagai scavenger radikal
bebas sehingga dapat mengurangi terjadinya kerusakan pada sel hepar (Rachmani,
2009).
Meskipun beberapa penelitian dilaporkan bahwa ekstrak umbi ubi jalar
ungu (Ipomea batatas L.) merupakan salah satu antioksidan yang baik, belum ada
penelitian yang melaporkan apakah ekstrak umbi ubi jalar ungu (Ipomea batatas
L.) mempengaruhi aktivitas enzim gluthation peroksidase (GPx) dan histopatologi
hepar pada mencit (Mus musculus) yang mengalami stress oksidatif setelah latihan
fisik maksimal. Berdasarkan hal tersebut maka peneliti ingin meniliti ―Pengaruh
Pemberian Ekstrak Umbi Ubi Jalar Ungu (Ipomoea batatas L.) terhadap Aktivitas
Enzim Glutation Peroksidase (Gpx) dan Histopatologi Hepar Mencit (Mus
1.2. Perumusan Masalah
Berdasarkan uraian di atas maka peneliti merumuskan masalah penelitian
berikut ini : Bagaimana pengaruh pemberian ekstrak umbi ubi jalar ungu
(Ipomoea batatas L.) terhadap aktivitas enzim glutation peroksidase (GPx) dan
histopatologi hepar mencit (Mus musculus) yang diberi perlakuan latihan fisik
maksimal.
1.3. Tujuan Penelitian 1.3.1. Tujuan Umum
Mengetahui bagaimana pengaruh pemberian ekstrak umbi ubi jalar ungu
(Ipomoea batatas L.) terhadap aktivitas enzim glutation peroksidase (GPx) dan
histopatologi hepar mencit (Mus musculus) yang diberi perlakuan latihan fisik
maksimal.
1.3.2. Tujuan Khusus
a. Mengetahui kadar antosianin dan kandungan gizi yang terkandung dalam
ekstrak umbi ubi jalar ungu (Ipomoea batatas L.) yang digunakan untuk
penelitian
b. Mengetahui perbedaan berat badan mencit (Mus musculus) antar kelompok
setelah perlakuan selama 14 hari
c. Mengetahui perbedaan tingkah laku mencit (Mus musculus) setiap harinya
d. Mengetahui perbedaan aktivitas enzim glutation peroksidase (GPx) antar
kelompok setelah perlakuan selama 14 hari
e. Mengetahui perbedaan histopatologi hepar mencit (Mus musculus) antar
kelompok setelah perlakuan selama 14 hari
1.4. Manfaat penelitian
Hasil penelitian ini diharapkan dapat bermanfaat sebagai :
a. Informasi ilmiah bagi ilmu kesehatan serta ilmu kedokteran untuk
meminimalisasikan dampak negatif radikal bebas.
b. Dapat dijadikan referensi bagi peneliti-peneliti selanjutnya untuk meneruskan
penelitian sejenis dan dapat mengembangkannya.
1.5.Hipotesis Penelitian
Hipotesis dalam penelitian ini adalah : Pemberian Ekstrak Umbi Ubi Jalar
Ungu (Ipomoea batatas L.) dapat Meningkatkan Aktivitas Enzim Glutation
Peroksidase (GPx) dan Menurunkan Kerusakan Hepar Mencit (Mus musculus)
BAB II
TINJAUAN PUSTAKA
2.1. Latihan Fisik
Menurut Caspersen, (1985) di dalam Yudianto (2014) istilah " latihan fisik"
dan "aktivitas fisik" seringtertukar penggunaannya. Aktiv
itas fisik diartikan pada gerakan tubuh yang dihasilkan oleh otot rangka
yang mengeluarkan energi, yang pada masing-masing orang bervariasi (diukur
oleh kilokalori). Latihan fisik adalah subkategori dari aktivitas fisik yang
direncanakan, terstruktur, berulang, dan bermanfaat dalam arti untuk perbaikan
atau pemeliharaan dari satu atau lebih komponen kebugaran fisik pada seseorang.
Latihan kondisi fisik adalah proses memperkembangkan kemampuan Aktivitas
gerak jasmani yang dilakukan secara sistematik dan ditingkatkan secara progressif
untuk mempertahankan atau meningkatkan derajat kebugaran jasmani agar
tercapai kemampuan kerja fisik yang optimal(Yudianta, 2014).
Olahraga yang teratur dan tepat dapat mempertahankan kebugaran fisik.
Kondisi lingkungan yang memadai dan takaran pelatihan yang tepat untuk setiap
individu meliputi frekuensi, intensitas, tipe dan waktu sangat mendukung untuk
mendapatkan hasil yang maksimal dan resiko yang minimal pada pelatihan
olahraga. Frekuensi pelatihan yang dianjurkan 3-4 kali seminggu dengan
intensitas 72%-87% dari denyut jantung maksimal (220-umur) dengan variasi 10
denyut permenit. Tipe pelatihan yang dianjurkan adalah kombinasi dari latihan
pemanasan selama 15 menit dan diakhiri oleh pendinginan selama 10 menit
(Pangkahila, 2009).
Saat latihan fisik akan terjadi peningkatan konsumsi oksigen. Peningkatan
ini akan mencapai maksimal saat penambahan beban kerja tidak mampu lagi
meningkatkan konsumsi oksigen. Hal ini dikenal dengan konsumsi oksigen
maksimum (VO2 max). Sesudah VO2 max tercapai, kerja ditingkatkan dan
dipertahankan hanya dalam waktu singkat dengan metabolisme anaerob pada otot
yang latihan. Secara teoritis, VO2 max dibatasi oleh cardiac output, kemampuan
sistem respirasi untuk membawa oksigen darah, dan kemampuan otot yang
bekerja untuk menggunakan oksigen. Faktanya, pada orang normal (kecuali atlet
pada yang sangat terlatih), cardiac output adalah faktor yang menentukan VO2
max (Vander et al., 2001).
2.1.1. Respon fisiologis terhadap latihan fisik
Manfaat latihan fisik akan hilang bila latihan fisik dilakukan sampai
kelelahan. Latihan fisik maksimal yang melelahkan, terutama bila dilakukan
sekali-sekali, dapat menyebabkan kerusakan struktur atau reaksi inflamasi pada
otot. Kerusakan ini, berhubungan dengan, paling tidak sebagian diantara
kerusakan tersebut diakibatkan oleh oksidan yang dihasilkan oleh latihan fisik
(Thirumalai et al., 2011).
Organisme aerobik menghasilkan ROS selama respirasi normal dan
inflamasi. Latihan dapat membuat ketidakseimbangan antara oksidan dan
antioksidan, yang dikenal dengan sebutan stres oksidatif. stress oksidatif
kerusakan enzim, reseptor protein, membran lipida, dan DNA (Leeuwenburgh, et
al., 2001).
Menurut Ji (2003), selama Aktivitas fisik maksimal, konsumsi oksigen
seluruh tubuh meningkat sampai 20 kali, sedangkan konsumsi oksigen pada
serabut otot diperkirakan meningkat 100 kali lipat, sebagian kecil dari oksigen
tersebut ±2-4% akan dirubah menjadi superoksida melalui transport elektron.
Pelaku olahraga dengan intensitas tinggi (Olahraga berat), menghasilkan
radikal bebas dalam jumlah besar. Bila terjadi over training maka produksi radikal
bebas meningkat melebihi kemampuan antioksidan exogen. Tetapi orang yang
berlatih, khususnya terlatih dalam lingkup Olahraga Kesehatan, lebih tahan
terhadap stress oxidative, kecuali bila olahraga demikian berat dan lama yang
memerlukan pemakaian glikogen otot yang tinggi.
Peningkatan konsumsi oksigen oleh tubuh selama berolahraga berat dapat
meningkat sepuluh sampai dua puluh kali atau lebih. Dibawah stress yang tinggi,
dalam serat otot terjadi peningkatan penggunaan oksigen diatas kebutuhan
normal. Peningkatan oksigen yang luar biasa ini dapat memicu pelepasan radikal
bebas, yang akan terlibat dalam proses oksidasi lemak membran sel otot. Proses
tersebut disebut peroksidasi lipid dan menyebabkan sel menjadi lebih mudah
mengalami proses penuaan atau kerusakan lain (Cooper, 2001)
Latihan fisik berat dapat meningkatkan konsumsi oksigen, karena terjadi
peningkatan metabolism didalam tubuh. Peningkatan penggunaan oksigen
terutama oleh otot-otot yang berkontraksi, menyebabkan terjadi peningkatan
Species). Oksigen yang digunakan dalam proses metabolisme tubuh saat aktivitas
fisik berat, dapat menyebabkan peningkatan produksi radikal bebas yang bersifat
sangat reaktif terhadap sel atau komponen sel sekitarnya (Chevion et al, 2003).
Mekanisme pembentukan oksidan selama olahraga : (1)Kebocoran
elektron, Pada olahraga berat konsumsi oksigen dapat meningkat 10-20 kali
istirahat atau lebih. Sedangkan serabut otot yang paling terbebani (paling aktif)
dapat mengkonsumsi O2 100-200 kali normal. Pemakaian O2 yang luar biasa
banyak ini memicu pembebasan oksidan dalam jaringan itu dan dapat melelahkan
mitokondria yang merupakan pusat pembentukan energi; (2)Ischaemic
refurfusion, Pada olahraga berat, darah yang menuju ke organ-organ yang tidak
aktif misalnya hepar, ginjal, lambung dan usus, dialihkan ke otot-otot yang aktif
(tungkai dan jantung). Hal ini menyebabkan terjadinya kekurangan O2 (hypoxia)
secara akut pada organ-organ tersebut. Bila olahraga dihentikan, darah akan
dengan cepat mengalir kembali ke organ-organ tersebut. Proses ini disebut
sebagai ―reperfusion” dan hal ini dikaitkan dengan terbebaskannya oksidan dalam
jumlah besar. Hal demikian juga pada otot yang terlibat dalam olahraga berat
(overload) terutama bila mendekati atau mencapai tingkat exhaustion (Cooper,
2001).
Meningkatnya metabolisme aerobik selama latihan merupakan sumber
utama dari stress oksidatif. Pada otot, mitokondria adalah salah satu sumber
penting dari reaktif intermediet yaitu, Superoksida (O2•-), hidrogen peroksida
(H2O2), dan kemungkinan juga hidroksil radikal (HO•). Latihan membuat
dan hampir pada tingkat tiga, bahkan pada saat istirahat. Latihan akut pada subjek
yang tidak terlatih dapat menyebabkan stres oksidatif. Namun secara terus
menerus dalam beberapa periode menginduksi pencegahan pada kerusakan
oksidatif (Leeuwenburgh, et al., 2001).
2.2. Radikal Bebas
Reaksi oksidasi terjadi setiap saat. Ketika kita bernapas pun terjadi reasksi
oksidasi. Reaksi ini mencetuskan terbentuknya radikal bebas yang sangat aktif,
yang dapat merusak struktur serta fungsi sel. Namun, reaktivitas radikal bebas itu
dapat dihambat oleh sistem antioksidan yang melengkapi sistem kekebalan tubuh.
Seringkali pengertian oksidan dan radikal bebas dianggap sama karena keduanya
memiliki kemiripan sifat. Kedua jenis senyawa ini juga memiliki aktivitas yang
sama dan memberikan akibat yang hampir sama, meskipun melalui proses yang
berbeda. Sebagai contoh, dampak reaksi H2O2 (sebagai oksidan) dan radikal bebas
hidroksil (OH•) terhadap glutation (GSH) (Winarsi, 2007).
a) H2O2 + GSH GSSG + H2O
b) OH• + H2O H2O + GS•
Radikal bebas
c) GS• + GS• GSSG
Radikal bebas adalah molekul oksigen yang tidak stabil dan molekul tidak
stabil lain mengandung satu atau lebih electron bebas (elektron yang tidak
berpasangan = unpaired electron). Adanya satu atau lebih elektron bebas
menyebabkan senyawa itu menjadi sangat reaktif. Peran merusak dari radikal
Dalam tubuh terdapat molekul oksigen yang stabil dan yang tidak stabil.
Molekul oksigen yang stabil, sangat penting untuk memelihara kehidupan. Yang
tidak stabil termasuk golongan radikal bebas. Sejumlah tertentu radikal bebas
diperlukan untuk kesehatan, tetapi kelebihan radikal bebas bersifat merusak dan
sangat berbahaya. Fungsi radikal bebas dalam tubuh adalah melawan radang,
membunuh bakteri dan mengatur tonus otot polos dalam organ tubuh dan
pembuluh darah (Araújo, et al. 2011).
Produksi radikal bebas yang terlalu banyak terjadi oleh adanya berbagai
faktor misalnya: sinar ultra violet (terdapat dalam sinar matahari), kontaminan
dalam makanan (zat warna textile yang dipergunakan untuk mewarnai makanan),
polusi udara (pencemaran udara oleh asap pabrik dan kendaraan bermotor), asap
rokok, insektisida (dalam pertanian dan rumah tangga) dan olahraga berat, serta
berbagai bentuk stress psikis (Sharma, 2010).
Radikal bebas merupakan salah satu bentuk senyawa oksigen reaktif, yang
secara umum diketahui sebagai senyawa yang memiliki elektron yang tidak
berpasangan. Senyawa ini terbentuk dalam tubuh, dipicu oleh bermacam-macam
faktor. Radikal bebas ini terbentuk, misalnya, ketika komponen makanan diubah
menjadi bentuk energi melalui proses metabolisme. Pada proses metabolisme ini,
sering kali terjadi kebocoran elektron. Dalam kondisi demikian, mudah sekali
terbentuk radikal bebas, seperti anion superoksida, hidroksil, dan lain-lain.
Radikal bebas juga dapat terbentuk dari senyawa lain yang sebenarnya bukan
radikal bebas, tetapi mudah berubah menjadi radikal bebas misalnya, hidrogen
diistilahkan sebagai senyawa oksigen reaktif/ Reactive Oxygen Species (ROS)
(Winarsi, 2007).
Senyawa oksigen reaktif berasal dari oksigen (O2) pada reaksi siklus
Krebs. Siklus Krebs atau disebut juga siklus asam sitrat atau TCA (Tricarboxilic
Acid Cycle) terjadi didalam mitokondria sel dimana asetil KoA (asetat aktif)
dioksidasi menghasilkan CO2, membebaskan ekuivalen hydrogen yang akhirnya
membentuk air dan menghasilkan ATP. ATP merupakan senyawa sumber energy
bebas untuk jaringan bagi manusia yang dibentuk melalui proses fosforilasi
oksidatif (Mayes 1998). Reaksi yang tejadi adalah sebagai berikut:
2NADH + 2H+ + O2 2 NAD+ + H2O + ATP
Pada reaksi diatas terjadi reduksi O2 menjadi H2O sbb
O2 + 4H+ + 4e- H2O
Pada proses tersebut reduksi O2 menjadi H2O merupakan pengalihan 4
elektron. Bila pengalihan elektron berjalan kurang sempurna maka akan terbentuk
senyawa-senyawa oksigen berbahaya. Molekul oksigen sekarang dikatakan
mempunyai diradikal karena memiliki dua elektronyang tidak berpasangan tapi
keduanya terletak pada orbital yang berbeda dan menunjukkan angka kuantum
putaran yang sama dan memiliki putaran sejajar (Halliwel, 2001).
Akibatnya oksigen tidak sereaktif radikal hidroksil. Disamping itu akan
terjadi senyawa-senyawa oksigen reaktif seperti O2` (Superoksida). H2O2 (Hidrogen
Peroksida), ROO (radikal peroksil) dan OH` (radikal hidroksil). Ion superoksida,
radikal peroksil, hidrogen peroksida dan radikal peroksida dan radikal hidroksil
oksigen. Molekul oksigen akan menjadi sangat reaktif bila kedua elektron tunggal
disatukan dalam satu orbital dengan putaran yang berlawanan dengan perpindahan
ini satu orbital menjadi kosong dan mudah diisi oleh sepasang elekton dengan
putaran yang berlawanan disebut singlet oksigen (Oenzil, 2014).
2.2.1. Struktur kimia
Dalam rangka mendapatkan stabilitas kimia, radikal bebas tidak dapat
mempertahankan bentuk asli dalam waktu lama dan segera berikatan dengan
bahan sekitarnya. Radikal bebas akan menyerang molekul stabil yang terdekat dan
mengambil elektron, zat yang terambil elektronnya akan menjadi radikal bebas
juga sehingga akan memulai suatu reaksi berantai, yang akhirnya terjadi
kerusakan sel tersebut (Droge, 2002). Gambar 2.1. dibawah ini menunjukkan
bagaimana bentuk dari struktur kimia penyusun radikal bebas tersebut.
Gambar 2.1. Struktur kimia radikal bebas (Sumber : Arief, 2014)
Radikal bebas dapat terbentuk in-vivo dan in-vitro secara : (1)Pemecahan
sistem biologi karena memerlukan tenaga yang tinggi dari sinar ultraviolet, panas,
dan radiasi ion; (2)Kehilangan satu elektron dari molekul normal; (3)Penambahan
elektron pada molekul normal. Pada radikal bebas elektron yang tidak
berpasangan tidak mempengaruhi muatan elektrik dari molekulnya, dapat
bermuatan positif, negatif, atau netral (Arief, 2014).
2.2.2. Sumber radikal bebas
Oksigen untuk metabolisme aerobik digunakan sekitar 95-98 %, sisanya
2-5 % akan berubah menjadi radikal bebas endogen. Sumber radikal bebas yang lain
berasal dari lingkungan berupa asap rokok, bahan kimia karsinogen dan radiasi.
Radikal bebas merupakan molekul yang memiliki elektron yang tidak
berpasangan pada orbit luarnya sehingga bersifat tidak stabil dan reaktif. Sifat
tersebut akan memudahkan radikal bebas untuk bereaksi dengan molekul lain
untuk mencapai stabil (Halliwel, 2001).
Jenis-jenis radikal bebas yang dihasilkan oleh tubuh dan radikal bebas dari
lingkungan berupa: (1)Reactive Oxygen Spesies (ROS) terdiri dari radikal bebas;
superoksida anion (O2•), hidroksil (OH•), alkoksil (RO•), peroksil (RO2•), serta
senyawa bukan radikal yang berfungsi sebagai pengoksidasi atau senyawa yang
mudah mengalami perubahan senyawa radikal seperti hidrogen peroksida (H2O2),
ozon (O3)dan HOCl, (2) Reactive Nitrogen Spesies (RNS) terdiri dari radikal
bebas : nitrooksida (NO2•), peroksinitrit (ONOO•), dan senyawa bukan radikal
seperti HNO2 dan N2O4 Produksi berlebih dari NO• dapat menyebabkan stroke
Sumber radikal bebas, baik endogenus maupun eksogenus terjadi melalui
sederetan mekanisme reaksi antara lain : pembentukan awal radikal bebas
(inisiasi), terbentuknya radikal baru (propagasi), dan tahap terakhir (terminasi)
yaitu pemusnahan atau pengubahan menjadi radikal bebas stabil dan tak reaktif.
Sumber radikal bebas endogen ini sangat bervariasi, dapat melewati autoksidasi,
oksidasi enzimatik, fagositosis dalam respirasi, transpor elektron di mitokondria,
oksidasi ion-ion logam transisi, atau melalui iskemik (Simanjuntak, 2012).
Keberadaan radikal bebas dalam tubuh merupakan suatu hal yang
fisiologis, karena tubuh akan mengimbangi dengan antioksidan endogen.
Kerusakan oksidatif sel terjadi jika jumlah antioksidan yang dihasilkan tidak
mampu mengimbangi jumlah radikal bebas yang ada. Perlindungan sel dari
kerusakan oksidatif dapat menggunakan tambahan antioksidan dari makanan
berupa vitamin E, vitamin A dan vitamin C yang larut air (Halliwel, 2001).
Autoksidasi adalah senyawa yang mengandung ikatan rangkap, hidrogen
alilik, benzilik atau tersier yang rentan terhadap oksidasi oleh udara. Contohnya
lemak yang memproduksi asam butanoat, berbau tengik setelah bereaksi dengan
udara. Oksidasi enzimatik menghasilkan oksidan asam hipoklorit. Sekitar 70-90
% konsumsi O2 oleh sel fagosit diubah menjadi superoksida, bersama dengan
radikal OH serta HOCl membentuk H2O2 dengan bantuan bakteri. Oksigen dalam
sistem transpor elektron menerima satu elektron membentuk superoksida. Ion
logam transisi, yaitu Co dan Fe memfasilitasi produksi oksigen singlet dan
OH- + Fe3 +. Secara singkat, xantin oksidase selama iskemik menghasilkan superoksida dan asam urat (Simanjuntak, 2012).
2.2.3. Tipe radikal bebas dalam tubuh
Radikal bebas terpenting dalam tubuh adalah radikal derivat dari oksigen
yang disebut kelompok oksigen reaktif (reactive oxygen species/ROS), termasuk
didalamnya adalah triplet (3O2), tunggal (singlet/1O2), anion superoksida (O2-•), radikal hidroksil (-OH•), nitrit oksida (NO-•), peroksinitrit (ONOO-•), asam
hipoklorus (HOCl•), hidrogen peroksida (H2O2•), radikal alkoxyl (LO-•), dan
radikal peroksil (LO-2•). Radikal bebas yang mengandung karbon (CCL3-) yang
berasal dari oksidasi radikal molekul organik. Radikal yang mengandung hidrogen
hasil dari penyerangan atom H. Bentuk lain adalah radikal yang mengandung
sulfur yang diproduksi pada oksidasi glutation menghasilkan radikal thioyl (R-S-).
Radikal yang mengandung nitrogen juga ditemukan, misalnya radikal
fenyldiazine (Arief, 2014).
Efek oksidatif radikal bebas dapat menyebabkan peradangan dan penuaan
dini. Lipid membran sel berubah menjadi lipid peroksida yang mempercepat
penuaan. Pembentukan lipid peroksida dan malondialdehid merupakan reaksi
berantai yang bersifat reaktif, senyawa tersebut dapat bereaksi kembali dengan
molekul sekitarnya. Radikal bebas dapat meningkatkan kadar LDL (low density
lipoprotein) yang menjadi penyebab penimbunan kolesterol pada dinding
pembuluh darah atau disebut dengan aterosklerosis. Penurunan suplai darah atau
iskemik karena penyumbatan pembuluh darah serta penyakit Parkinson
bebas dengan DNA yang memicu terbentuknya zat karsinogenik. Zat tersebut
dapat mengubah bentuk susunan DNA atau mutasi DNA (Simanjuntak, 2012).
2.2.4. Pertahanan sel terhadap radikal bebas
Sifat reaktif yang tersebar dari sistem pembentukan radikal dalam sel
menyebabkan evolusi mekanisme pertahanan terhadap efek perusakan suatu
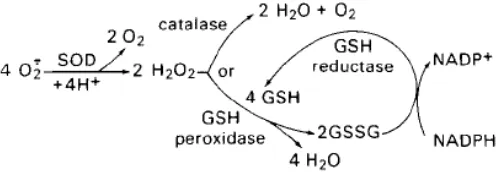
bahan teroksidasi kuat. SOD (superoksida dismutase dan katalase) mengkatalisasi
dismutasi dari superoksida dan hidrogen peroksida. GSH (glutation) peroksidase
mereduksi peroksida hidrogen dan organik menjadi air dan alkohol (Arief, 2014).
GSH S-transferase melakukan pemindahan residu glutation menjadi
metabolit elektrofilik reaktif dari xenobiotic. Produksi glutation teroksidasi
(GSSG) direduksi secara cepat oleh reaksi yang menggunakan NADPH yang
dihasilkan dari berbagai sistem intraseluler, diantaranya hexose-monophosphate
shunt. Berbagai isoenzim organel spesifik dari dismutase superoksida juga
ditemukan. SOD Zn, Cu merupakan sitoplasmik, sedangkan enzim Zn, Mn
mitokondrial. Isoenzim ini tidak ditemukan dalam cairan ekstraseluler. Gambar
2.2. dibawah ini menunjukkan Aktivitas enzim intraseluler tersebut.
Gambar 2.2. Enzim-enzim pertahanan antioksidan (Sumber : Arief, 2014)
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau
menginaktivasi berkembangnya reaksi oksidasi, dengan cara mencegah
terbentuknya radikal. Antioksidan juga merupakan senyawa yangn dapat
menghambat reaksi oksidasi, dengan mengikat radikal bebas dan molekul yang
sangat reaktif. Akibatnya kerusakan sel akan dihambat (Winarsi, 2007) .
Beberapa bahan tereduksi juga bekerja sebagai antioksidan, reduksi
kelompok radikal aktif seperti radikal peroksi dan hidroksi menjadi bentuk yang
kurang reaktif misalnya air. Seperti halnya pembangkitan kembali oksigen singlet.
Penggabungan tersebut juga mengakhiri reaksi radikal berantai. Pertahanan
antioksidan kimiawi bagai pedang bermata dua. Pertama, saat bahan tereduksi
menjadi radikal maka derivat radikalnya juga terbentuk. Sehingga, jika suatu
radikal sangat tidak stabil, reaksi radikal berantai mungkin akan berlanjut. Kedua,
bahan tereduksi dapat mereduksi oksigen menjadi superoksida atau peroksida
merupakan radikal hidroksil dalam reaksi auto-oksidasi. Ascorbat dan asam urat
dapat berfungsi sebagai anti oksidan, ikut serta secara langsung dalam
auto-oksidasi, baik melalui reduksiaktifator oksigen lain seperti rangkaian logam
transisi atau quinone, atau bertindak sebagai kofaktor enzim (Inoue, 2001).
Proses tersebut dapat melibatkan kemampuan askorbat untuk
depolimerisasi DNA, hambatan Na+/K+ ATPase otak, potensiasi toksisitas paraquat, dan sebagai mediator peroksidasi lemak. Juga mempunyai kontribusi
kelainan patofisiologi dari metabolisme purin. Sifat yang sesungguhnya campuran
pro atau antioksidan untuk bahan pereduksi khusus adalah integrasi kompleks dari
beberapa faktor. Pada kasus zat pembersih radikal hidroksil, produk dari interaksi
Radikal yang terbentuk tersebut cukup stabil dan dalam konsentrasi cukup tinggi
namun dapat terjadi mekanisme seperti pada glutation dan superoksida. pH sangat
mempengaruhi reduksi langsung oksigen menjadi superoksida oleh senyawa
sulfidril, sedangkan faktor lokal lainnya seperti konsentrasi molar dari molekul
oksigen juga punya peranan penting (Arief, 2014).
Oksigen singlet dan bagian triplet molekul yang tereksitasi mungkin
disempurnakan melalui interaksi bersama sistem konjugasi sistem diene seperti
yang ditemukan pada karoten, tokoferol, atau melanin. Seperti antioksidan
pereduksi, senyawa tersebut dapat juga menghasilkan jenis elektron aktif dan
mungkin juga penyakit (Inoue, 2001). Tabel 2.1. dibawah ini menunjukkan
berbagai jenis antioksidan dan enzim pembersih dalam menangkal radikal bebas
beserta lokasinya di dalam tubuh.
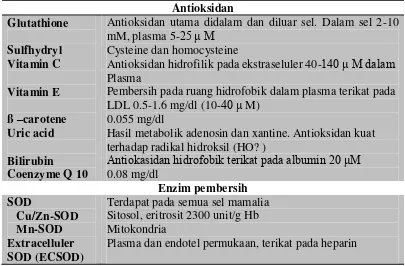
Tabel 2.1. Antioksidan dan enzim pembersih (scavenging) Antioksidan
Antioksidan hidrofilik pada ekstraseluler 40-140 μ M dalam Plasma
Pembersih pada ruang hidrofobik dalam plasma terikat pada LDL 0.5-1.6 mg/dl (10-40 μ M)
0.055 mg/dl
Hasil metabolik adenosin dan xantine. Antioksidan kuat terhadap radikal hidroksil (HO? )
Antiokasidan hidrofobik terikat pada albumin 20 μM
0.08 mg/dl
Catalase
Antioksidan kuat 0.5 mM dalam plasma Aktivitas feroksidase 15-60 mg/dl plasma Membersihkan Fe bebas 200-400 mg/dl
Metalothionein Membersihkan logam berat
Radikal bebas memiliki reaktivitas yang sangat tinggi. Hal ini ditunjukkan
oleh sifatnya yang segera menarik atau menyerang elektron di sekelilingnya.
Senyawa radikal bebas juga dapat mengubah suatu molekul menjadi suatu radikal
baru. Jika senyawa radikal baru tersebut bertemu dengan molekul lain, akan
terbentuk radikal baru lagi, dan seterusnya sehingga akan terjadi reaksi berantai
(chain reactions). Reaksi ini akan berlanjut terus dan akan berhenti apabila
reaktivitasnya diredam (quenched) oleh senyawa yang bersifat antioksidan seperti
glutation (Winarsi, 2007).
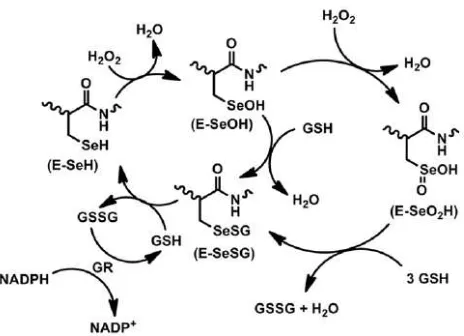
2.3. Glutation Peroksidase (GPx)
Glutation Peroksidase (GPx) merupakan selenoenzyme yang berfungsi
sebagai antioksidan. Glutation peroksidase (GPx, EC 1.11.1.9) adalah enzim yang
berperan penting dalam melindungi organisme dari kerusakan oksidatif dan
mengandung selenium (Se) pada sisi aktifnya. Kerja enzim ini mengubah molekul
hidrogen peroksida (yang dihasilkan SOD dalam sitosol dan mitokondria) dan
berbagai hidro serta lipid peroksida menjadi air (Muges et al., 2001).
Glutation peroksidase adalah enzim yang mengandung selenium sebagai
glutathione peroksidase terdiri dari 4 atom selenium yang terikat sebagai
selenocystein. Glutation peroksidase dapat membentuk pertahanan terhadap
oksidan atau radikal bebas didalam tubuh dan mencegah kerusakan sel dengan
cara mengkatalisa peroksida menjadi air dan oksigen. Karena kemampuannya
inilah maka enzim ini disebut sebagai antioksida. Enzim glutathione peroksidase
banyak terdapat di hepar, ginjal otot, dan plasma, terutama pada sitosol dan
mitokondria. Aktivitas enzim GPx yang paling besar berada pada hepar sebesar
65,6 %, eritrosit 21,2%, dan otot sebesar 6,1% (Boylan, 2006).
GSH-Px
2GSH + H2O2 --- GSSG +2H2O
Glutation peroksidase adalah enzim intraseluler yang terdispersi dalam
sitoplasma, namun aktivitasnya juga ditemukan dalam mitokondria. Glutation
peroksidase ekstraseluler (secara genetik berbeda dari bentuk intraseluler)
terdeteksi dalam berbagai jaringan. Glutation peroksidase sebagai ensim
antioksidan bekerja sebagai peredam (quenching) radikal bebas. Glutation
peroksidase juga berperan dalam metabolism xenobiotik yang ditemukan dalam
kadar milimolar dalam sel (Sen, 1999).
Dalam hepar dan sel darah merah terdapat glutation peroksidase dengan
konsentrasi tinggi, sedangkan jantung, ginjal, paru-paru, adrenal, lambung, dan
jaringan adipose mengandung kadar gluatation peroksidase dalam kadar sedang.
Glutation peroksidase kadar rendah sering ditemukan dalam otak, otot, testis, dan
Glutation peroksidase intraseluler berpotensi mengubah molekul hidrogen
peroksida dengan cara mengoksidasi glutation bentuk tereduksi mencegah lipid
membran dan unsur-unsur sel lainnya dari kerusakan oksidasi, dengan cara
merusak molekul hidrogen peroksida dan lipid hidroperoksida. Menurut
Delmas-Beauvieaux, et al. (1996) melaporkan bahwa enzim glutation peroksidase
mendekomposisikan H2O2 lebih kuat dibandingkan dengan enzim katalase. Agar
enzim bisa bekerja, selalu diperlukan adanya substrat, misalnya glutation, yang
merupakan substrat enzim glutation peroksidase (Winarsi, 2007).
H2O2 yang terbentuk juga dapat diubah menjadi radikal hidroksil (OH).
Jika tidak dinetralisir, OH akan merusak lipid dan DNA. Dalam keadaan normal ,
radikal bebas yang terbentuk dapat dinetralisir oleh antioksidan. Bila kadar
oksigen reactive species (ROS) yang toksik melebihi pertahanan antioksidan
maka akan terjadi suatu keadaan yang disebut stress oksidatif. Pada keadaan ini
maka kelebihan radikal bebas dapat bereaksi dengan sel lipida,protein, dan asam
nukleat sehingga menimbulkan kerusakan lokal bahkan sampai disfungsi organ.
Reactive oxygen species (ROS) berperan dalam mencetuskan terjadinya penyakit
vaskulopati, seperti aterosklerosis, hipertensi dan stenosis (Murray, 2009). Pada
Gambar 2.3. ini dapat dilihat bagaimana berjalanannya mekanisme katalisis H2O2
Gambar 2.3. Mekanisme katalisis h2o2 oleh glutation peroksidase (Sumber : Bhabak, 2013)
Glutation peroksidase juga berperan dalam metabolisme xenobiotik dan
sintesis leukotrien, yang ditemukan dalam kadar milimolar dalam sel. Aktivitas
enzim glutation peroksidase mampu mereduksi 70% peroksida organik dan lebih
dari 90% H2O2. Aktivitas enzim ini juga dapat di induksi oleh antioksidan
sekunder isoflavon. Senyawa flavonoid banyak ditemukan dalam sayur-sayuran
dan buah-buahan, dan dilaporkan sebagai antioksidan berpotensi lebih kuat
dibandingkan dengan vitamin C dan E (Prior, 2003).
Kesempurnaan kerja sistem enzim antioksidan sepenuhnya diperankan
oleh tiga macam enzim (SOD, CAT, GPx). Namun yang perlu dipahami adalah,
antioksidan seluler tidak dapat bekerja secara individual tanpa dukungan asupan
antioksidan sekunder dari bahan pangan. Jadi, diperlukan konsumsi bahan
makanan yang kaya akan komponen antioksidan dalam jumlah memadai, agar
menekan kerusakan sel yang berlebihan dan mempertahankan status antioksidan
seluler (Winarsi, 2007).
Senyawa-senyawa polifenol seperti flavonoid dan antosianin mampu
menghambat reaksi oksidasi melalui mekanisme radical scavenging dengan cara
menyumbangkan satu elektron pada elektron yang tidak berpasangan dalam
radikal bebas sehingga banyaknya radikal bebas menjadi berkurang (Polcomy et
al., 2001). Selain sebagai scavenger, senyawa flavonoid dengan kandungan
anthosianin dalam tumbuhan Ipomoea batatas diduga berfungsi sebagai
antioksidan dengan cara menghambat langkah propagasi, yaitu memutus rantai
autoksidasi atau disebut juga Chain-breaking antioxidants (Rachmani, 2009).
2.4. Ubi Jalar
Ubi jalar dikenal hampir di seluruh wilayah Indonesia. Ubi jalar memiliki
nama daerah ubi jawa (Sumatera Barat), gadong jalur (Batak), ketela (Jakarta),
ketela rambat (Jawa), katila (Dayak), watata (Sulawesi Utara). Ubi jalar (Ipomoea
batatas) merupakan tanaman yang dipercaya berasal dari Benua Amerika dan
telah tersebar hampir di seluruh dunia. Di Asia, negara produsen ubi jalar terbesar
adalah Cina. Umbi dari tanaman ubi jalar merupakan salah satu dari sumber
karbohidrat terpenting di dunia terutama Asia dan Afrika (SEAFAST, 2012).
Di Indonesia, pengembangan ubi jalar belum mendapat perhatian serius,
sebagaimana tercermin dari luas tanam yang fluktuatif dengan produktivitas yang
baru mencapai 9,5 t umbi/ha. Padahal di tingkat penelitian, ubi jalar mampu
memberi hasil hingga 40 t/ha.Senjang hasil ini disebabkan oleh berbagai tanaman
jalar tidak hanya diarahkan pada hasil tinggi, tetapi juga mengedepankan kualitas
gizi, di antaranya protein dan betakaroten (Truong, 2010).
Ubi jalar merupakan bahan pangan lokal sumber karbohidrat, berdasarkan
warna umbinya dapat dibedakan menjadi 3 jenis, yaitu ubi jalar putih, kuning,
merah/jingga hingga ungu (Budiman, 2014). Berdasarkan warna umbi, ubi jalar
dibedakan menjadi beberapa golongan sebagai berikut :
1. Ubi jalar putih, yakni ubi jalar yang memilki daging umbi berwarna putih,
misalnya, varietas tembakur putih, varietas tembakar ungu, varietas Taiwan
dan varietas MLG 12659-20P.
2. Ubi jalar kuning, yaitu jenis ubi jalar yang memilki daging umbi berwarna
kuning, kuning muda atau putih kekuningan. Misalnya, varietas lapis 34,
varietas South Queen 27, varietas Kawagoya, varietas Cicah 16 dan varietas
Tis 5125-27.
3. Ubi jalar oranye yaitu jenis ubi jalar yang memiliki daging umbi berwarna
jingga hingga jingga muda. Misalnya, varietas Ciceh 32, varietas mendut dan
varietas Tis 3290-3.
4. Ubi jalar ungu yakni ubi jalar yang memiliki daging umbi berwarna ungu
hingga ungu muda (Juanda, et al. 2000)
Winarno dan Laksmini (1973) menyebutkan bahwa warna kuning pada
umbi disebabkan adanya pigmen karoten, sedangkan warna ungu disebabkan
adanya pigmen antosianin. Perbedaan warna daging umbi tersebut menyebabkan
perbedaan sifat sensoris, fisik dan kimia umbi maupun produk olahannya.
kering bervariasi dari 16 hingga 40% dibanding ubi jalar segar. Sukrosa umumnya
terdapat pada umbi dalam bentuk segar. Kadar maltosa pada ubi jalar meningkat
saat ditanak, karena aktivitas enzim beta-Amilase (Takagi et al., 1996).
Berdasarkan penelitian Marsono dkk (2002), ubi jalar sebagai sumber
karbohidrat memiliki indeks glikemik 54. Nilai indeks glikemik (IG) < 55
termasuk kelompok yang rendah, IG 55-70 sedang, dan >70 tinggi, jadi IG ubi
jalar termasuk rendah. Tepung ubi jalar mengandung serat makanan yang relatif
tinggi disertai dengan indeks glikemik yang rendah, artinya, tepung ubi jalar atau
makanan berbasis tepung ubi jalar lebih lamban dicerna dan lamban
meningkatkan kadar gula darah (SEAFAST, 2012). Pada tabel 2.2. terlihat jelas
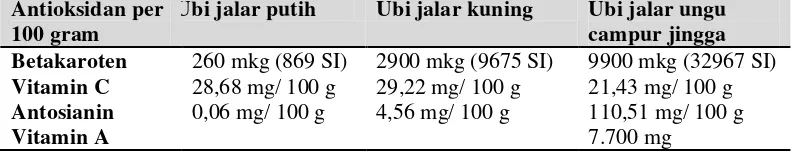
perbedaan kadar antosianin pada ketigas jenis ubi, terlihat jelas bahwa ubi jalar
ungu lah yang memiliki kadar antosianin tertinggi.
Tabel 2.2. Ubi jalar juga mengandung berbagai antioksidan :
Antioksidan per 100 gram
Ubi jalar putih Ubi jalar kuning Ubi jalar ungu campur jingga Betakaroten 260 mkg (869 SI) 2900 mkg (9675 SI) 9900 mkg (32967 SI)
Vitamin C 28,68 mg/ 100 g 29,22 mg/ 100 g 21,43 mg/ 100 g
Antosianin 0,06 mg/ 100 g 4,56 mg/ 100 g 110,51 mg/ 100 g
Vitamin A 7.700 mg
Dari ketiga jenis ubi jalar yang paling tinggi kadar antosianinnya adalah
ubi jalar ungu. Ubi jalar ungu merupakan umbi-umbian yang mengandung
senyawa antioksidan paling komplet (Budiman, 2014). Sekelompok antosianin
yang tersimpan dalam ubi jalar mampu menghalangi laju perusakan sel radikal