PENGARUH PEMBERIAN EKSTRAK ETANOL
DAUN KELOR (
Moringa oleifera
Lam.) TERHADAP
PERUBAHAN JUMLAH TROMBOSIT PADA MENCIT
YANG DIBERI METOTREKSAT
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NIZALIA
NIM 101501016
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH PEMBERIAN EKSTRAK ETANOL
DAUN KELOR (
Moringa oleifera
Lam.) TERHADAP
PERUBAHAN JUMLAH TROMBOSIT PADA MENCIT
YANG DIBERI METOTREKSAT
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NIZALIA
NIM 101501016
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PENGARUH PEMBERIAN EKSTRAK ETANOL
DAUN KELOR (
Moringa oleifera
Lam.) TERHADAP
PERUBAHAN JUMLAH TROMBOSIT PADA MENCIT
YANG DIBERI METOTREKSAT
OLEH:
NIZALIA
NIM 101501016
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 10 Oktober 2014
Pembimbing I,
Aminah Dalimunthe, S.Si., M.Si., Apt. NIP 197806032005012004
Pembimbing II,
Drs. Saiful Bahri, M.S., Apt. NIP 195208241983031001
Drs. Rasmadin Mukhtar, M.S., Apt. NIP 194909101980031002
Drs. Suryadi Achmad, M.Sc., Apt. NIP 195109081985031002
Medan, Oktober 2014 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Pengaruh Pemberian Ekstrak Etanol Daun Kelor (Moringa oleifera Lam.) Terhadap Perubahan Jumlah Trombosit Pada Mencit yang Diberi Metotreksat”. Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyampaikan terima kasih yang sebesar-besarnya Kepada Bapak Dekan Fakultas Farmasi Prof. Dr. Sumadio Hadisahputra, Apt., yang telah memberikan fasilitas kepada penulis sehingga dapat menyelesaikan pendidikan. Kepada Ibu Aminah Dalimunthe, S.Si., M.Si., Apt., dan Bapak Drs. Saiful Bahri, M.S., Apt., yang telah membimbing penulis dengan sabar sehingga penulisan skripsi ini dapat diselesaikan. Kepada Bapak Dr. Edy Suwarso, S.U., Apt., Bapak Drs. Rasmadin Mukhtar, M.S., Apt., dan Bapak Drs. Suryadi Achmad, M.Sc., Apt., selaku dosen penguji yang telah memberikan saran, arahan, kritik dan masukan kepada penulis dalam penyelesaian skripsi ini. Kepada Ibu Khairunnisa, S.Si., M.Pharm., Ph.D., Apt., selaku penasehat akademik yang telah memberikan nasehat dan arahan kepada penulis selama masa perkuliahan dan Bapak/Ibu Pembantu Dekan, Bapak dan Ibu staf pengajar Fakultas Farmasi USU atas ilmu yang telah diberikan
Ibunda Irmawati atas doa dan dukungan baik moril maupun materil, kepada kakak dan keenam adik tersayang Yetti Oseva, Merri Asiska, Fera Yunita, Zahratul Ulya, Nazarul Fahrezi, dan Rizkina Aulia Ramadhani, serta kerabat-kerabat, sahabat, dan teman-teman Farmasi Klinis dan Komunitas stambuk 2010 atas motivasi dan segala bantuan dalam penyelesaian skripsi ini.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari kesempurnaan. Untuk itu penulis mengharapkan kritik dan saran yang membangun dari semua pihak demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya di bidang Farmasi.
Medan, 10 Oktober 2014 Penulis,
Nizalia
PENGARUH PEMBERIAN EKSTRAK ETANOL DAUN KELOR (Moringa oleifera Lam.) TERHADAP
PERUBAHAN JUMLAH TROMBOSIT PADA MENCIT YANG DIBERI METOTREKSAT
Abstrak
Kemoterapi metotreksat memiliki efek samping depresi sumsum tulang yang dapat berakibat trombositopenia (trombosit < 150.000 per mm3). Daun kelor memiliki komponen aktif senyawa flavonoid berupa quersetin yang dapat meningkatkan proliferasi dan diferensiasi megakariosit dalam sumsum tulang, sehingga dapat meningkatkan jumlah trombosit. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia dan ekstrak etanol daun kelor serta pengaruh ekstrak etanol daun kelor terhadap perubahan jumlah trombosit pada mencit yang diberi metotreksat.
Penelitian ini menggunakan metode eksperimental, meliputi pembuatan ekstrak etanol daun kelor secara maserasidengan pelarut etanol 96%, karakterisasi dan skrining fitokimia simplisia dan ekstrak, kemudian dilanjutkan dengan pengujian ekstrak etanol daun kelor terhadap jumlah trombosit pada mencit yang diinduksi metotreksat. Hewan percobaan terdiri dari 30 ekor mencit dibagi dalam 5 kelompok mencit, yaitu kelompok normal/blanko (K0), kelompok K1 diberi suspensi CMC Na 0,5% bb selama 10 hari, kelompok K2 diberi metotreksat dosis 1,3 mg/kg bb pada hari ke-6 sampai hari ke-10, kelompok K3 diberi suspensi ekstrak etanol daun kelor dosis 100 mg/kg bb selama 10 hari + metotreksat dosis 1,3 mg/kg bb pada hari ke-6 sampai hari ke-10, dan kelompok K4 diberi suspensi ekstrak etanol daun kelor dosis 200 mg/kg bb selama 10 hari + metotreksat dosis 1,3 mg/kg bb pada hari ke-6 sampai hari ke-10. Pada hari ke-11, dilakukan pengambilan darah melalui ekor. Kemudian dilakukan pemeriksaan jumlah trombosit menggunakan alat hemositometer. Hasil pengukuran ini dianalisis secara statistik menggunakan program SPSS. Data dianalisis dengan uji One way
ANAVA dan dilanjutkan dengan uji post hoc Tukey HSD untuk melihat perbedaan antar perlakuan.
Karakteristik simplisia daun kelor diperoleh kadar air 6,65%, kadar abu total 9,69%, kadar abu tidak larut asam 0,97%, kadar sari larut air 29,59%, dan kadar sari larut etanol 12,64%. Sedangkan karakteristikekstrak etanol daun kelor, kadar air 18,96%, kadar abu total 0,45%, dan kadar abu tidak larut asam 0,21%. Skrining fitokimia simplisia dan ekstrak etanol daun kelor mengandung senyawa golongan flavonoida, alkaloid, steroid/triterpenoid, saponin, dan tanin. Hasil penelitian menunjukkan bahwa terdapat perbedaan signifikan terhadap perubahan jumlah trombosit antar kelompok dengan p = 0,000 (p < 0,05). Berdasarkan penelitian dapat disimpulkan bahwa pemberian ekstrak etanol daun kelor dosis 100 mg/kg bb pada mencit yang diinduksi metotreksat sudah dapat meningkatkan jumlah trombosit menjadi normal, yaitu sebesar 439.000 ± 52.379,39 per mm3.
EFFECT OFETHANOL EXTRACT OF
MORINGA (Moringa oleifera Lam.) LEAVES TO CHANGES IN PLATELET COUNTS IN MICE GIVEN METHOTREXATE
Abstract
Methotrexate chemotherapy has side effects of bone marrow depression which may result in thrombocytopenia (platelet counts < 150,000 per mm3). Moringa leaves have an active component in the form quersetin flavonoid compounds that can increase the proliferation and differentiation of megakaryocytes in the bone marrow, thus increasing the number of platelets. The purpose of this study was to determine the characteristics of crude drugs and ethanol extracts of moringa leaves as well as the effect of ethanol extract of moringa leaves to changes in platelet counts in mice given methotrexate.
This research uses experimental methods, including the manufacture of ethanol extract of moringa leaves by maceration with 96% ethanol, characterization and phytochemical screening of crude drugs and extracts, followed by testing ethanol extract of moringa leaves the platelet count in mice induced methotrexate. The experimental animals consisted of 30 mice were divided into 5 groups of mice, the normal group/blanko (K0), K1 group was given suspension of CMC Na 0.5% bw for 10 days, the K2 group was given methotrexate dose of 1.3 mg/kg bw in day 6 to day 10, groups of K3 given suspension of ethanol extract of moringa leaves dose of 100 mg/kg bw for 10 days + methotrexate dose of 1.3 mg/kg bw on day 6 to day 10, and K4 given suspension of ethanol extract of moringa leaves dose group 200 mg/kg bw for 10 days + methotrexate dose of 1.3 mg/kg bw on day 6 to day 10. On day 11, blood sampling is done through the tail. Then examined the platelet count using a hemocytometer. The results of these measurements were statistically analyzed using SPSS. Data were analyzed by One way ANOVA followed by Tukey HSD's post hoc test to see the differences between treatments.
Characteristics of moringa leaf botanicals derived water content of 6.65%, 9.69% total ash content, acid insoluble ash content of 0.97%, the levels of water-soluble extract 29.59%, and levels of ethanol water-soluble extract 12.64%. While ethanol extract of moringa leaves characteristics, moisture content 18.96%, 0.45% total ash content, and acid insoluble ash content of 0.21%. Phytochemical screening of crude drugs and classes of compounds containing ethanol extract of moringa leaves flavonoida, alkaloids, steroids/ triterpenoids, saponins, and tannins. The results showed that there were significant differences in the changes in platelet counts between groups with p = 0.000 (P < 0.05). Based on the research it can be concluded that the administration of ethanol extract of moringa leaves of 100 mg/kg bw in mice induced methotrexate has been increasing the platelet counts to normal at 439,000 ± 52379.39 per mm3.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
DAFTAR SINGKATAN ... xv
BAB I PENDAHULUAN ... 1
1.1 . Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Diagram Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1.1 Sejarah Tumbuhan ... 6
2.1.2 Sistematika Tumbuhan ... 6
2.1.3 Nama Asing ... 7
2.1.4 Nama Daerah ... 7
2.1.5 Morfologi Tumbuhan ... 7
2.1.6 Kandungan Kimia ... 8
2.1.7 Khasiat Tumbuhan ... 8
2.2 Ekstraksi ... 9
2.3 Metotreksat ... 11
2.4 Darah ... 12
2.5 Hemopoiesis ... 12
2.6 Trombosit ... 14
2.6.1 Definisi Trombosit ... 14
2.6.2 Pembentukan Trombosit ... 15
2.6.3 Struktur Trombosit ... 16
2.6.4 Fungsi Trombosit ... 17
2.7 Kelainan Trombosit Kuantitatif ... 17
2.7.1 Trombositopenia ... 17
2.7.2 Trombositosis ... 18
2.8 Pemeriksaan Trombosit dengan Cara Manual (Hemositometer) 19 BAB III METODE PENELITIAN ... 22
3.1 Alat dan Bahan ... 22
3.1.1 Alat - alat ... 22
3.2 Hewan Percobaan ... 23
3.3 Identifikasi Tumbuhan ... 23
3.4 Pembuatan Pereaksi ... 23
3.5 Pengumpulan dan Pembuatan Simplisia ... 25
3.5.1 Pengumpulan Sampel ... 25
3.5.2 Pembuatan Simplisia ... 25
3.6 Karakterisasi Simplisia dan Ekstrak ... 26
3.6.1 Pemeriksaan Makroskopik ... 26
3.6.2 Pemeriksaan Mikroskopik ... 26
3.6.3 Penetapan Kadar Air ... 26
3.6.4 Penetapan Kadar Sari Larut dalam Air ... 27
3.6.5 Penetapan KadarSari Larut dalam Etanol ... 27
3.6.6 Penetapan KadarAbu Total ... 28
3.6.7 Penetapan Kadar Abu Tidak LarutAsam ... 28
3.7Pemeriksaan Skrining Fitokimia Serbuk Simplisia dan Ekstrak 28
3.7.1 Pemeriksaan Alkaloida ... 28
3.7.2 Pemeriksaan Flavonoida ... ... 29
3.7.3 Pemeriksaan Tanin ... 29
3.7.4 Pemeriksaan Glikosida ... 29
3.7.5 Pemeriksaan Saponin ... 30
3.7.6 Pemeriksaan Steroida/Triterpenoida ... 30
3.8 Tahapan Persiapan Percobaan ... 30
3.8.1 Pembuatan Ekstrak Etanol Daun Kelor ... 30
3.8.3 Pembuatan Suspensi Metotreksat 0,025% ... 31
3.8.4Pembuatan Suspensi Ekstrak Etanol Daun Kelor 1% ... 31
3.9 Tahap pengujian ... 32
3.10 Pemeriksaan Trombosit ... 33
3.11 Analisis Statistik ... 33
BAB IV HASIL DAN PEMBAHASAN ... 35
4.1 Hasil Identifikasi Tumbuhan ... 35
4.2 Hasil Karakterisasi Simplisia dan Ekstrak ... 35
4.3 Hasil Skrining Fitokimia Simplisia dan Ekstrak ... 38
4.4 Hasil Pengujian Ekstrak Etanol Daun Kelor Terhadap Jumlah Trombosit Mencit ... 39
BAB V KESIMPULAN DAN SARAN ... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
Halaman Tabel 4.1Hasil Karakterisasi Simplisia dan Ekstrak Etanol Daun Kelor 36 Tabel 4.2Hasil Skrining Fitokimia Simplisia dan Ekstrak Etanol
Daun Kelor ... 38 Tabel 4.3Hasil Rata-Rata Perhitungan Jumlah Trombosit Mencit (per mm3)
DAFTAR GAMBAR
Halaman
Gambar 1.1 Diagram Kerangka Pikir Penelitian ... 5
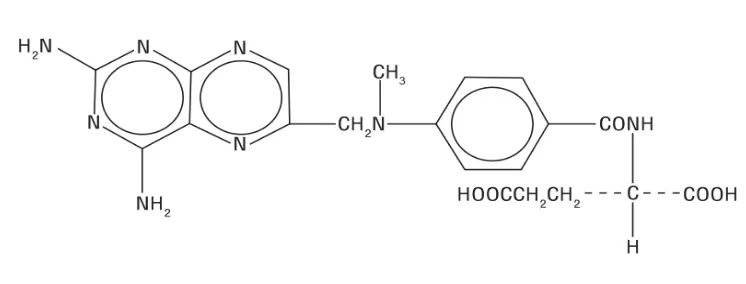
Gambar 2.1 Struktur Metotreksat ... 11
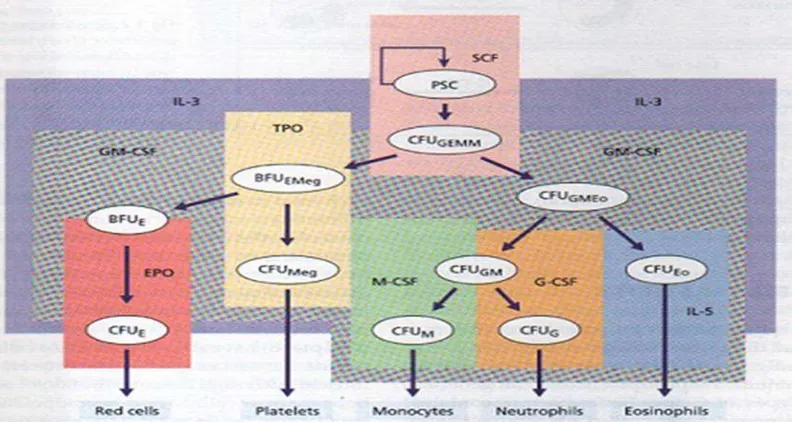
Gambar 2.2 Peran Faktor Pertumbuhan dan Hemopoiesis Normal ... 13
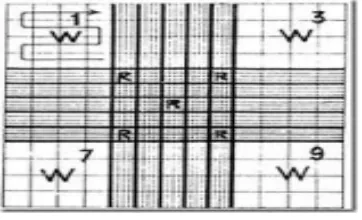
Gambar 2.3 Kamar Hitung Improved Neubauer ... 21
DAFTAR LAMPIRAN
Halaman Lampiran 1. Hasil Persetujuan Etik Penelitian ... 49 Lampiran 2. Hasil Identifikasi Tumbuhan ... 50 Lampiran 3. Karakteristik Tumbuhan Kelor (Moringa oleifera Lam.) 51 Lampiran 4. Hasil Pemeriksaan Mikroskopik Daun Kelor ... 53 Lampiran 5. Perhitungan Hasil Pemeriksaan Karakterisasi Simplisia 55 Lampiran 6. Perhitungan Hasil Pemeriksaan Karakterisasi Ekstrak ... 60 Lampiran 7. Bagan Kerja Penelitian ... 63 Lampiran 8. Bagan Pembuatan Ekstrak ... 64 Lampiran 9. Bagan Alur Perlakuan Terhadap Mencit ... 65 Lampiran 10. Bagan Kerja Pengambilan Darah dan Pemeriksaan
DAFTAR SINGKATAN
5-HT 5-hidroxitriptamin
ADP Adenosine Diphosphate
ANAVA Analisis Variansi
ATP Adenosine Triphosphate
bb berat badan
bw body weight
BFU-E Burst Forming Unit-Erytroid
BFU-EMeg Burst Forming Unit-Erytroid Megakaryocyte
CFU Colony Forming Unit
CFU-E Colony Forming Unit-Erytroid
CFU-Eo Colony Forming Unit-Eosinophil
CFU-G Colony Forming Unit-Granulocyte
CFU-GEMM Colony Forming Unit-Granulocyte Erytroid Monocyte Megakariocyte
CFU-GM Colony Forming Unit- Granulocyte Monocyte
CFU-GMEo Colony Forming Unit-Granulocyte Monocyte Eosinophil
CFU-M Colony Forming Unit-Monocyte
CFU-Meg Colony Forming Unit-Megakariocyte
CSF Colony Stimulating Factor
DIT Drug InducedThrombocytopenia
DNA Deoxynucleic Acid
EEDK Ekstrak Etanol Daun Kelor
G-CSF Granulocyte-Colony Stimulating Factor
GM-CSF Granulocyte Macrophage-Colony Stimulating Factor
GP Glikoprotein
HSD Honestly Significant Different
IL Interleukin
M-CSF Monocyte-Colony Stimulating Factor
MTX Metotreksat
NF-κβ Nuclear Factor Kappa-beta
NO Nitric Oxide
PDGF Platelet Derived Growth Factor
PSC Pluripotent Stem Cell
RNA Ribonucleic Acid
ROS Reactive Oxygen Species
SCF Stem Cell Factor
SPSS Statistical Product and Service Solution
THFA Tetrahydrofolate Acid
TNF-α Tumour Necrosis Factor-alpha
TPO Trombopoietin
PENGARUH PEMBERIAN EKSTRAK ETANOL DAUN KELOR (Moringa oleifera Lam.) TERHADAP
PERUBAHAN JUMLAH TROMBOSIT PADA MENCIT YANG DIBERI METOTREKSAT
Abstrak
Kemoterapi metotreksat memiliki efek samping depresi sumsum tulang yang dapat berakibat trombositopenia (trombosit < 150.000 per mm3). Daun kelor memiliki komponen aktif senyawa flavonoid berupa quersetin yang dapat meningkatkan proliferasi dan diferensiasi megakariosit dalam sumsum tulang, sehingga dapat meningkatkan jumlah trombosit. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia dan ekstrak etanol daun kelor serta pengaruh ekstrak etanol daun kelor terhadap perubahan jumlah trombosit pada mencit yang diberi metotreksat.
Penelitian ini menggunakan metode eksperimental, meliputi pembuatan ekstrak etanol daun kelor secara maserasidengan pelarut etanol 96%, karakterisasi dan skrining fitokimia simplisia dan ekstrak, kemudian dilanjutkan dengan pengujian ekstrak etanol daun kelor terhadap jumlah trombosit pada mencit yang diinduksi metotreksat. Hewan percobaan terdiri dari 30 ekor mencit dibagi dalam 5 kelompok mencit, yaitu kelompok normal/blanko (K0), kelompok K1 diberi suspensi CMC Na 0,5% bb selama 10 hari, kelompok K2 diberi metotreksat dosis 1,3 mg/kg bb pada hari ke-6 sampai hari ke-10, kelompok K3 diberi suspensi ekstrak etanol daun kelor dosis 100 mg/kg bb selama 10 hari + metotreksat dosis 1,3 mg/kg bb pada hari ke-6 sampai hari ke-10, dan kelompok K4 diberi suspensi ekstrak etanol daun kelor dosis 200 mg/kg bb selama 10 hari + metotreksat dosis 1,3 mg/kg bb pada hari ke-6 sampai hari ke-10. Pada hari ke-11, dilakukan pengambilan darah melalui ekor. Kemudian dilakukan pemeriksaan jumlah trombosit menggunakan alat hemositometer. Hasil pengukuran ini dianalisis secara statistik menggunakan program SPSS. Data dianalisis dengan uji One way
ANAVA dan dilanjutkan dengan uji post hoc Tukey HSD untuk melihat perbedaan antar perlakuan.
Karakteristik simplisia daun kelor diperoleh kadar air 6,65%, kadar abu total 9,69%, kadar abu tidak larut asam 0,97%, kadar sari larut air 29,59%, dan kadar sari larut etanol 12,64%. Sedangkan karakteristikekstrak etanol daun kelor, kadar air 18,96%, kadar abu total 0,45%, dan kadar abu tidak larut asam 0,21%. Skrining fitokimia simplisia dan ekstrak etanol daun kelor mengandung senyawa golongan flavonoida, alkaloid, steroid/triterpenoid, saponin, dan tanin. Hasil penelitian menunjukkan bahwa terdapat perbedaan signifikan terhadap perubahan jumlah trombosit antar kelompok dengan p = 0,000 (p < 0,05). Berdasarkan penelitian dapat disimpulkan bahwa pemberian ekstrak etanol daun kelor dosis 100 mg/kg bb pada mencit yang diinduksi metotreksat sudah dapat meningkatkan jumlah trombosit menjadi normal, yaitu sebesar 439.000 ± 52.379,39 per mm3.
EFFECT OFETHANOL EXTRACT OF
MORINGA (Moringa oleifera Lam.) LEAVES TO CHANGES IN PLATELET COUNTS IN MICE GIVEN METHOTREXATE
Abstract
Methotrexate chemotherapy has side effects of bone marrow depression which may result in thrombocytopenia (platelet counts < 150,000 per mm3). Moringa leaves have an active component in the form quersetin flavonoid compounds that can increase the proliferation and differentiation of megakaryocytes in the bone marrow, thus increasing the number of platelets. The purpose of this study was to determine the characteristics of crude drugs and ethanol extracts of moringa leaves as well as the effect of ethanol extract of moringa leaves to changes in platelet counts in mice given methotrexate.
This research uses experimental methods, including the manufacture of ethanol extract of moringa leaves by maceration with 96% ethanol, characterization and phytochemical screening of crude drugs and extracts, followed by testing ethanol extract of moringa leaves the platelet count in mice induced methotrexate. The experimental animals consisted of 30 mice were divided into 5 groups of mice, the normal group/blanko (K0), K1 group was given suspension of CMC Na 0.5% bw for 10 days, the K2 group was given methotrexate dose of 1.3 mg/kg bw in day 6 to day 10, groups of K3 given suspension of ethanol extract of moringa leaves dose of 100 mg/kg bw for 10 days + methotrexate dose of 1.3 mg/kg bw on day 6 to day 10, and K4 given suspension of ethanol extract of moringa leaves dose group 200 mg/kg bw for 10 days + methotrexate dose of 1.3 mg/kg bw on day 6 to day 10. On day 11, blood sampling is done through the tail. Then examined the platelet count using a hemocytometer. The results of these measurements were statistically analyzed using SPSS. Data were analyzed by One way ANOVA followed by Tukey HSD's post hoc test to see the differences between treatments.
Characteristics of moringa leaf botanicals derived water content of 6.65%, 9.69% total ash content, acid insoluble ash content of 0.97%, the levels of water-soluble extract 29.59%, and levels of ethanol water-soluble extract 12.64%. While ethanol extract of moringa leaves characteristics, moisture content 18.96%, 0.45% total ash content, and acid insoluble ash content of 0.21%. Phytochemical screening of crude drugs and classes of compounds containing ethanol extract of moringa leaves flavonoida, alkaloids, steroids/ triterpenoids, saponins, and tannins. The results showed that there were significant differences in the changes in platelet counts between groups with p = 0.000 (P < 0.05). Based on the research it can be concluded that the administration of ethanol extract of moringa leaves of 100 mg/kg bw in mice induced methotrexate has been increasing the platelet counts to normal at 439,000 ± 52379.39 per mm3.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Trombosit atau platelet bukan merupakan sel, melainkan pecahan granular sel, berbentuk piringan, dan tidak berinti. Trombosit adalah bagian terkecil dari unsur seluler sumsum tulang dan sangat penting peranannya dalam hemostasis dan pembekuan darah (Sherwood, 2001).
Trombositopenia didefinisikan sebagai jumlah trombosit dibawah 150.000 per mm3. Jumlah trombosit normal dalam darah tepi adalah 150.000 – 450.000 per mm3. Trombositopenia disebabkan oleh penurunan pembentukan trombosit, dekstruksi trombosit dan keadaan-keadaan defisiensi. Agen-agen kemoterapik, khususnya yang bersifat toksik terhadap sumsum tulang juga akan menekan pembentukan trombosit (Baldy, 1994; Widmann, 1995).
terdapat 964 artikel berisi laporan kasus DIT yang melibatkan 1316 pasien dan 281 jenis obat (Setiabudy, 2009).
Menurut penelitian Sundaryono (2011), flavonoid terbukti dapat mempengaruhi kenaikan jumlah trombosit dan memiliki bioaktivitas sebagai antikanker, antivirus, antibakteri, antiradang, dan antialergi. Kandungan senyawa flavonoid pada ekstrak etanol batang betadin mampu menaikkan trombosit sebesar 813.000 per mm3.
Salah satu tanaman yang mengandung flavonoid adalah tanaman kelor (Moringa oleifera Lam.). Kelor mengandung komponen flavonoid yang paling banyak, yaitu quercetin dan kaempferol. Hampir seluruh bagian dari tanaman ini dapat dimanfaatkan sebagai obat berkhasiat. Namun masyarakat Indonesia lebih banyak memanfaatkannya untuk keperluan mistik, tanaman pagar, dan hanya sedikit yang memanfaatkannya sebagai sayuran (Mardiana, 2013).
Menurut penelitian yang telah dialkukan oleh Wihastuti, dkk., (2007), ekstrak daun kelor dapat menghambat aktifasi NF-κβ (Nuclear Factor Kappa-beta) dan menurunkan ekspresi protein TNF-α (Tumour Necrosis Factor-alpha) pada proses peradangan penyebab aterosklerosis. Penurunan ini disebabkan oleh efek antioksidan kuat quersetin yang mampu mengikat radikal bebas (Gugliotta dan Baccarani, 2011).
Efek ekstrak etanol daun kelor juga dibuktikan dalam menurunkan leukopenia secara signifikan pada mencit yang diinduksi siklofosfamid pada dosis subletal. Kandungan daun kelor seperti vitamin dan fenolik mampu mengembalikan ukuran dan berat normal limpa dan timus. Selain itu, pemberian ekstrak etanol daun kelor juga meningkatkan parameter darah seperti sel darah putih dan persen neutrofil (Gupta, et al., 2010).
Berdasarkan uraian di atas, peneliti tertarik untuk meneliti apakah pemberian daun kelor dalam bentuk ekstrak mampu meningkatkan trombosit pada mencit putih yang dijadikan trombositopenia dengan induksi metotreksat.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka perumusan masalah penelitian ini adalah:
a. apakah karakteristik simplisia dan ekstrak etanol daun kelor yang diteliti memenuhi persyaratan mutu simplisia dan ekstrak?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis penelitian ini adalah:
a. karakteristik simplisia dan ekstrak etanol daun kelor dapat diketahui dan memenuhi standar.
b. ekstrak etanol daun kelor memiliki pengaruh terhadap perubahan jumlah trombosit pada mencit yang diberi metotreksat.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui: a. karakteristik simplisia dan ekstrak etanol daun kelor.
b. pengaruh ekstrak etanol daun kelor terhadap perubahan jumlah trombosit pada mencit yang diberi metotreksat.
1.5 Manfaat Penelitian
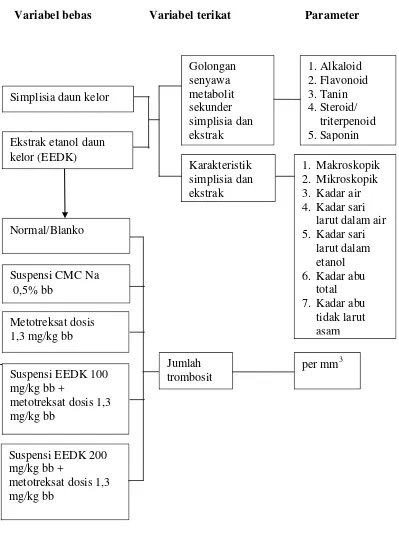
1.6 Kerangka Pikir
Adapun kerangka pikir penelitian ini dapat dilihat pada Gambar 1.1 berikut.
Variabel bebas Variabel terikat Parameter
Gambar 1.1 Diagram Kerangka Pikir Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Sejarah Tumbuhan
Kelor (Moringa oleifera Lam.) merupakan tanaman yang berasal dari dataran sepanjang sub Himalaya, yaitu India, Pakistan, Bangladesh, dan Afghanistan. Kelor dibudidayakan dan telah beradaptasi dengan baik di luar jangkauan daerah asalnya, termasuk bagian barat, timur, dan selatan Afrika, Asia tropis, Amerika Latin, Karibia, Florida, dan Kepulauan Pasifik (Fahey, 2005).
Di Indonesia, kelor dikenal berupa pohon dengan tinggi 5 – 10 m. Batang kayu getas sehingga mudah patah. Namun, kayunya dibungkus dengan kulit yang tidak mudah terpotong selain menggunakan benda tajam. Percabangan tanaman jarang dan tumbuh memanjang. Cabang menghasilkan tangkai daun yang banyak sehingga tanamannya terlihat rimbun (Mardiana, 2013).
2.1.2 Sistematika Tumbuhan
Sistematika tanaman kelor adalah sebagai berikut. (Integrated Taxonomic Information System, 2013):
Kingdom : Plantae
Famili : Moringaceae Genus : Moringa
Species : Moringa oleifera Lam. 2.1.3 Nama Asing
Selama berabad-abad, tanaman kelor telah dibawa ke berbagai daerah, mulai dari wilayah semi-tropis hingga tropis. Kini kelor dikenal di 82 negara dengan 210 nama yang berbeda, diantaranya horse radish tree, drumstick tree, benzolive tree (Inggris), mlonge (Tanzania), marango (Nikaragua), moonga
(India), mulangay (Filipina), nebeday (Senegal), sajna (Bangladesh), dan sebagainya. Berdasarkan manfaatnya, tumbuhan ini dikenal dengan mother’s best friend, miracle vegetable, dan miracle tree (Mardiana, 2013).
2.1.4 Nama Daerah
Penanaman kelor di Indonesia tersebar di seluruh daerah, mulai dari Aceh hingga Meurauke. Oleh karena itu, tanaman kelor dikenal berbagai daerah, seperti
murong (Aceh), munggai (Sumatera Barat), kilor (Lampung), kelor (Jawa Barat dan Jawa Tengah), marongghi (Madura), kiloro (Bugis), parongge (Bima),
kawona (Sumba), dan kelo (Ternate) (Mardiana, 2013). 2.1.5 Morfologi Tumbuhan
cm, lebar 4 mm sampai 1 cm, ujung daun tumpul, pangkal daun membulat, dan tepi daun rata, susunan pertulangan menyirip, pemukaan atas dan bawah halus; bunga berwarna putih agak krem, menebar aroma khas; buah berbentuk segitiga memanjang berwarna cokelat setelah tua; biji berbentuk bulat, ketika muda berwarna hijau terang dan berubah berwarna cokelat kehitaman ketika polong matang dan kering Bagian kayu warna cokelat muda atau krem berserabut (Anwar, et al., 2007).
2.1.6 Kandungan Kimia
Hasil penelitian menunjukkan bahwa daun kelor banyak mengandung nutrisi dan senyawa kimia, antara lain: protein (27%), kaya vitamin A dan C, zat besi, kalsium, fosfor, alkaloid, flavonoid, alkaloid, glikosida, saponin/triterpenoid, polisakarida, asam amino, serta kandungan polifenol lainnya (Gaikwad, et al., 2011). Selain itu, daun kelor juga mengandung nitril glikosida, yaitu niazirin dan niazirinin; three mustard oil glycosides, seperti 4 [(4'-O-acetyl-α -L-rhamnosyloxy) benzyl] isotiosianat, niaziminin A ,dan niaziminin B; asam-asam fenolik, seperti asam gallat, klorogenik, asam ferulat, dan asam ellagat; flavonoid (kaempferol, quercetin dan rutin) dan karotenoid (terutama lutein and β-karoten)
(Pandey, et al., 2012). 2.1.7 Khasiat Tumbuhan
kulit batang digunakan untuk pelancar haid, flu, dan sariawan. Ramuan daun kelor dapat membantu penyembuhan pembengkakan limpa, penurun gula darah, dan meningkatkan nafsu makan. Selain itu, daun juga bersifat diuretik serta dapat menangani panas dalam, anemia, dan mempelancar air susu ibu. Berbagai penelitian yang telah dilakukan seperti antioksidan, urolitiasis, hepatoprotektor, immunomodulator, hipokolesterolemik (penurun kolesterol), dan hipoglikemik (penurun gula darah) (Mardiana, 2013). Secara tradisional daun kelor juga digunakan sebagai obat malaria, penyembuh luka, antiasma, antiinflammasi, antiarthritis dan analgesik, antitiroid, antimikroba, antitumor, antipiretik, anafilaksis, antiulser, antifertilitas, antiplasmodial, antihipertensi (Pandey, et al., 2012).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair (Ditjen POM, 2000). Hasil dari ekstraksi disebut dengan ekstrak, yaitu sediaan
pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian sehingga memenuhi baku yang telah ditetapkan (Ditjen POM a, 1995).
Menurut Ditjen POM (2000), metode ekstraksi dengan menggunakan pelarut dapat dibagi ke dalam dua cara, yaitu :
1. Cara dingin
a. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna yang umumnya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) secara terus-menerus sampai diperoleh ekstrak (perkolat).
2. Cara Panas
Ekstraksi menggunakan pelarut dengan cara panas terdiri dari: a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
b. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti
d. Infundasi
Infundasi adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96 – 98oC) selama waktu tertentu (15 – 20 menit).
e. Dekoktasi
Dekoktasi adalah infus pada waktu yang lebih lama (30 menit) dan temperatur sampai titik didih air.
2.3 Metotreksat
Gambar 2.1 Struktur Metotreksat (Ditjen POM a, 1995).
Metotreksat merupakan derivat pteridin yang menghambat reduksi asam folat menjadi asam tetrahydrofolat (THFA) dengan jalan pengikatan pada enzim reduktase. THFA mempunyai peranan penting bagi sintesa DNA dan pembelahan sel. Antagonis folat ini adalah sitostatikum pertama yang efektif pada leukemia akut dan kanker. Pengobatan pada kanker biasanya dikombinasi dengan asam folinat untuk menghindari efek sampingnya yang hebat (Tan dan Rahardja, 2007).
rambut, dan demam. Dosis untuk pengobatan kanker tergantung dari jenis dan keadaan pasien, yaitu oral 5 – 30 mg sehari selama 5 hari. Setelah istirahat 2 – 3 minggu dapat diulang lagi 3 – 5 kali. Dosis untuk psoriasis dan rematik: oral, i.m. atau i.v. 15 – 25 seminggu. Pada dosis rendah ini imunosupresi bersifat ringan, namun perlu dilakukan monitoring darah secara teratur (Tan dan Rahardja, 2007).
2.4 Darah
Darah merupakan komponen esensial makhluk hidup, mulai dari binatang primitif sampai dengan manusia. Dalam keadaan fisiologik, darah selalu berada dalam pembuluh darah sehingga dapat menjalankan fungsinya sebagai: (a) pembawa oksigen (oxsygen carrier); (b) mekanisme pertahanan tubuh terhadap infeksi; dan (c) mekanisme hemostasis. Darah terdiri atas 2 komponen utama, yaitu:
a. Plasma darah: bagian cair darah yang sebagian besar terdiri atas air, elektrolit, dan protein darah.
b. Butir-butir darah (blood corpuscles), yang terdiri atas: 1) eritrosit: sel darah merah (SDM) – red blood cell (RBC) 2) leukosit: sel darah putih (SDP) – white blood cell (WBC) 3) trombosit: butir pembeku – platelet (Bakta, 2003).
2.5 Hemopoiesis
Hemopoiesis atau hematopoiesis ialah proses pembentukan darah. Tempat hemopoiesis pada manusia berpindah-pindah sesuai umur (Bakta, 2003), yaitu:
a. yolk sac : umur 0 – 3 bulan intrauterine
c. sumsum tulang : umur 4 bulan intrauterin – dewasa
Hemopoiesis bermula terjadi dari suatu sel induk primitif yang disebut sebagai pluripotent stem cell yang dapat menimbulkan berbagai jalur sel yang terpisah. Sel induk yang berperan penting pada hemopoiesis adalah sel induk hemopoietik. Sel induk hemopoietik ialah sel-sel yang akan berkembang menjadi sel-sel darah, termasuk sel darah merah, sel darah putih, keping darah, dan juga beberapa sel dalam sumsum tulang seperti fibroblast. Satu sel induk mampu menghasilkan 106 sel yang matang setelah 20 kali pembelahan sel. Sel induk pluripotent memiliki beberapa sifat, antara lain: (a) self renewal: kemampuan memperbarui diri sehingga tidak akan pernah habis meskipun terus membelah; (b) proliferatif: kemampuan membelah atau memperbanyak diri; dan (c) diferensiatif: kemampuan untuk mematangkan diri menjadi sel-sel dengan fungsi tertentu (Bakta, 2003). Gambar skematik susunan sel induk hemopoietik dapat dilihat pada Gambar 2.2.
Menurut sifat kemampuan diferensiasinya, sel induk hemopoietik dapat dibagi menjadi:
a. Pluripotent (totipotent) stem cell: sel induk yang mempunyai kemampuan untuk menurunkan seluruh jenis sel-sel darah.
b. Committed stem cell: sel induk yang mempunyai komitmen untuk
berdiferensiasi melalui salah satu garis keturunan sel (cell line). Sel induk yang termasuk golongan ini ialah sel induk mieloiddan sel induk limfoid.
c. Oligopotent stem cell: sel induk yang dapat berdiferensiasi menjadi hanya beberapa jenis sel, misalnya CFU-GM (Colony Forming Unit
-Granulocyte/Monocyte) yang dapat berkembang hanya menjadi sel-sel
granulosit dan sel-sel monosit.
d. Unipotent stem cell: sel induk yang hanya mampu berkembang menjadi satu jenis saja. Contoh: CFU-E (Colony Forming Unit-Erythrocyte) hanya dapat menjadi eritrosit, CFU-G (Colony Forming Unit-Granulocyte) hanya mampu berkembang menjadi sel-sel granulosit.
2.6 Trombosit
2.6.1 Definisi Trombosit
pengeluaran isi trombosit. Aktivitas trombosit penting pada proses awal pembekuan darah (hemostasis) dan akan berakhir dengan pembentukan sumbat trombosit. Normalnya, dua pertiga total trombosit berada di sirkulasi darah, sementara sepertiga lainnya berada di organ limpa (Hoffbrand, et al., 2005).
2.6.2 Pembentukan Trombosit
Trombosit dihasilkan di dalam sumsum tulang melalui fragmentasi sitoplasma megakariosit. Prekursor megakariosit, megakarioblast, muncul melalui proses diferensiasi dari sel induk hemopoietik. Megakariosit mengalami pematangan melalui replikasi inti endomitotik yang sinkron. Volume sitoplasma akan bertambah besar sejalan dengan bertambahnya lobus inti menjadi dua kali lipat. Pada stadium inti delapan, sitoplasma akan menjadi granular dan melepaskan trombosit. Setiap megakariosit akan menghasilkan 4000 trombosit. Trombosit yang beredar dalam sirkulasi darah merupakan hasil keseimbangan antara produksi trombosit di sumsum tulang serta distribusi pada darah tepi dan limpa (Hoffbrand, et al., 2005).
hemopoietik adalah glikoprotein yang dihasilkan oleh sel stroma dalam sumsum tulang, limfosit T, hati dan ginjal. Beberapa di antaranya, yaitu faktor perangsang koloni (CSF), IL-3 3), IL-6 6), dan IL-11 (Interleukin-11) (Hoffbrand, et al., 2005).
Interleukin-3 (IL-3) merupakan sitokin yang dihasilkan oleh limfosit T yang mampu merangsang trombositopoesis dengan menstimulasi progenitor megakariosit. IL-11 dapat meningkatkan jumlah megakariosit dan jumlah trombosit dalam sirkulasi darah. IL-6 dan IL-3 berperan dalam pematangan megakariosit dan secara tidak langsung meningkatkan produksi trombopoietin oleh hati (Hoffbrand, et al., 2005).
2.6.3 Struktur Trombosit
Secara ultrastruktur trombosit dapat dibagi atas:
1. Zona perifer terdiri atas glikokalik (suatu membran ekstra yang terletak di bagian paling luar), di dalamnya terdapat membran plasma dan lebih dalam lagi terdapat sistem kanal terbuka. Membran trombosit mengandung glikoprotein yang berfungsi sebagai reseptor. Glikoprotein (GP) penting untuk reaksi adhesi dan agregasi trombosit yang merupakan kejadian awal yang mengarah pada pembentukan sumbat trombosit selama hemostasis. Adhesi pada kolagen difasilitasi oleh GPIa. GPIb dan GPIIb//IIIa penting dalam perlekatan trombosit pada faktor von Willebrand (vWF) dan pada perlekatan pada subendotel vaskular. GPIIb/IIIa juga merupakan reseptor untuk fibrinogen yang penting dalam agregasi trombosit.
3. Zona organela terdiri atas granula padat elektron (electron dense bodies), mitokondria, granula-α dan organela (lisosom dan retikulum endoplasmik). Granula padat lebih sedikit dan mengandung ADP, ATP, 5-hidroksitriptamin (5-HT atau serotonin), dan kalsium. Granula-α berisi antagonis heparin
(platelet factor 4, PF4), β-tromboglobulin, vWF, faktor pertumbuhan yang berasal dari trombosit/PDGF (platelet-derived growth factor), dan faktor pembekuan lain. Organel spesifik lain meliputi lisosom yang mengandung enzim hidrolitik (Hoffbrand, et al., 2005).
2.6.4 Fungsi Trombosit
Peran trombosit dalam hemostasis antara lain berperan pada proses adhesi pada jaringan subendotel, memicu agregasi pada tempat terjadinya kerusakan pembuluh darah, memicu proses koagulasi pada permukaan fosfolipid. Selain itu trombosit juga berperan melepaskan substansi biokimia yang penting dalam hemostasis (Hoffbrand, et al., 2005).
2.7 Kelainan Trombosit Kuantitatif
Kelainan trombosit kuantitatif (gangguan jumlah trombosit), dapat dibagi menjadi 2, yaitu: trombositopenia dan trombositosis.
2.7.1 Trombositopenia
Trombositopenia didefinisikan sebagai jumlah trombosit yang kurang dari batas bawah nilai rujukan (< 150.000 per mm3). Keadaan ini dapat disebabkan oleh penurunan produksi trombosit, peningkatan dekstruksi, dan distribusi tidak normal.
a. Depresi selektif megakariosit karena obat, bahan kimia, atau infeksi virus. b. Sebagai bagian dari bone marrow failure umum, seperti anemia aplastik,
leukemia akut, radioterapi, obat sitotoksik, anemia megaloblastik, karsinoma, dan lain-lain.
2. Peningkatan dektruksi trombosit. a. Autoimun (idiopatik)
b. Akibat induksi obat c. Infeksi HIV, virus malaria 3. Distribusi tidak normal.
Sindrom hiperspleinism: dimana terjadi pooling trombosit dalam limpa (Bakta, 2003).
Pada umumnya manifestasi klinis trombositopenia terjadi jika jumlah trombosit di bawah 100.000 per mm3 yang disertai dengan leukemia atau penyakit hati. Perdarahan yang lama akibat trauma ringan ditemukan pada jumlah trombosit kurang dari 50.000 per mm3. Petekie adalah manifestasi utama yang ditemukan bila jumlah kurang dari 30.000 per mm3. Perdarahan mukosa, jaringan dalam dan intrakranial ditemukan bila jumlah trombosit kurang dari 20.000 per mm3 (Baldy, 1994).
2.7.2 Trombositosis
sumber cadangan (limpa). Peningkatan jumlah trombosit melebihi 1 juta per mm3 dapat menyebabkan perdarahan atau trombosis.
2.8 Pemeriksaan Trombosit dengan Cara Manual (Hemositometer)
Salah satu pemeriksaan laboratorium pada trombosit adalah hitung jumlah trombosit menggunakan alat hemositometer yang terdiri dari kamar hitung, kaca penutup, dan pipet. Mutu kamar hitung serta pipet-pipet harus memenuhi syarat ketelitian tertentu.
1) Kamar hitung.
Kamar hitung yang sebaiknya dipakai ialah yang memakai garis bagi
Improved Neubauer. Luas seluruh bidang yang dibagi adalah 9 mm2 dan bidang ini dibagi menjadi sembilan “bidang besar” yang luasnya masing-masing 1 mm2. Bidang besar dibagi lagi menjadi 16 ”bidang sedang” yang luasnya masing-masing 1/4 x 1/4 mm2. Bidang besar yang letaknya di tengah-tengah dibagi menjadi 25 bidang dan tiap bidang itu dibagi lagi menjadi 16 “bidang kecil”. Dengan demikian jumlah bidang kecil itu seluruhnya 400 buah, masing-masing luasnya 1/20 x 1/20 mm2.Tinggi kamar hitung, yaitu jarak antara permukaan yang bergaris-garis dan kaca penutup yang berpasangan adalah 1/10 mm.Maka volume di atas tiap-tiap bidang menjadi sebagai berikut.
1 bidang kecil `= 1/20 x 1/20 x1/10 =1/4000 mm3 1 bidang sedang = 1/4 x 1/4 x 1/10 =1/160 mm3 1 bidang besar = 1 x 1 x 1/10 = 1/10 mm3
2) Kaca penutup.
Kaca penutup digunakan adalah kaca penutup khusus dan lebih tebal dari kaca penutup biasa. Hanya dalam keadaan darurat kaca penutup biasa boleh dipakai. Kaca penutup untuk menghitung jumlah trombosit dengan teknik fase kontrast lebih tipis daripada yang dipakai untuk mikroskop biasa.
3) Pipet.
Pipet Thoma yang digunakan untuk pengenceran eritrosit maupun trombosit (pipet eritrosit) terdiri dari sebuah pipa kapiler yang bergaris bagi dan membesar pada salah satu ujung menjadi bola. Dalam bola tersebut terdapat sebutir kaca merah. Pada pertengahan pipa kapiler itu terdapat garis bertanda ”0,5” dan pada bagian atasnya, yaitu dekat bola, terdapat garis bertanda “1,0”. Pada bagian atas bola juga terdapat garis bertanda “101”. Angka-angka tersebut tidak menandakan satu volume yang mutlak melainkan perbandingan volume. Hal yang paling penting dan menentukan ialah pengenceran darah yang terjadi dalam pipet. Seandainya lebih dulu diisap darah sampai garis tanda “0,5” kemudian cairan pengencer (Ress Ecker) sampai garis tanda “101”, maka darah dalam bola pipet diencerkan 200 kali (Gandasoebrata, 1985).
Ress Ecker berfungsi sebagai pengencer darah (pelarut) dan pemberi warna pada platelet. Kandungan dari Ress Ecker ini adalah Natrium sitrat yang berfungsi sebagai pencegah koagulasi, memelihara sel darah merah, menyediakan gravitasi spesifik yang rendah; formalin sebagai fiksatif; Brilliant crecyl blue
eritrosit serta bentuk bulat, lonjong atau tersebar atau bergerombol (Pal dan Pal, 2005). Trombosit dihitung dalam 25 bidang sedang yang terletak di bidang basar paling tengah. Hitung jumlah trombosit dapat diperoleh dari rumus jumlah trombosit = (n x F)/Vb (Gandasoebrata, 1985).
Keterangan:
N = jumlah trombosit yang dihitung F = faktor pengenceran
Vb = volume bidang yang di hitung
Gambar 2.3 Kamar Hitung Improved Neubauer (Gandasoebrata, 1985). Keterangan:
BAB III
METODE PENELITIAN
Metode yang digunakan pada penelitian ini adalah metode eksperimental. Prosedur yang dilakukan meliputi pengumpulan dan pengolahan bahan tumbuhan, pembuatan ekstrak etanol daun kelor (Moringa oleifera Lam.), karakterisasi simplisia dan ekstrak, skrining fitokimia simplisia dan ekstrak, tahapan persiapan bahan pengujian, dan tahapan pengujian terhadap jumlah trombosit secara manual menggunakan alat hemositometer. Data dianalisis dengan uji statistik menggunakan metode One Way ANAVA (Analisis Variansi), selanjutnya dilanjutkan dengan uji Post Hoc Tuckey HSD (Honestly Significant Different).
3.1 Alat dan Bahan
3.1.1 Alat-alat
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas laboratorium, blender, kertas saring, label, lemari pengering, lumpang dan mortir, neraca analitik, neraca hewan, oral sonde, pipet tetes, rak tabung reaksi, rotary evaporator, spuit 1 ml, stamfer, vial, vorteks, waterbath, seperangkat alat hemositometer (bilik hitung Improved Neubauer, pipet eritrosit, kaca penutup), seperangkat alat penentuan kadar air, oven listrik, cawan penguap, dan mikroskop. 3.1.2 Bahan-bahan
pekat, raksa (II) klorida, bismut (III) nitrat, besi (III) klorida, timbal (II) asetat, kalium iodida, kloralhidrat, asam asetat anhidrida, natrium hidroksida, amil alkohol, natrium sulfat anhidrat, serbuk magnesium.
3.2 Hewan Percobaan
Hewan yang digunakan pada penelitian ini adalah mencit jantan (Mus musculus) berumur 6 – 8 minggu dengan bobot badan 25 – 30 g yang diperoleh dari Laboratorium Farmakologi Fakultas Farmasi Universitas Sumatera Utara (USU). Hewan ini diaklimatisasi selama 1 (satu) minggu dengan tujuan untuk menyeragamkan makanan dan hidupnya dengan kondisi yang serba sama sehingga dianggap memenuhi syarat untuk penelitian.
3.3 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan oleh Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor, Indonesia.
3.4 Pembuatan Pereaksi
3.4.1 Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat ditambahkan dengan air suling hingga diperoleh 100 ml(Ditjen POM a, 1995).
3.4.2 Pereaksi Natrium Hidroksida 2 N
3.4.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM a, 1995).
3.4.3 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml, pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM a, 1995).
3.4.4 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida, dilarutkan dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air suling hingga volume larutan 100 ml (Ditjen POM a, 1995).
3.4.5 Pereaksi Besi (III) Klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air secukupnya hingga diperoleh larutan 100 ml (Ditjen POM a, 1995).
3.4.6 Pereaksi Liebermann-Burchard
3.4.7 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml (Ditjen POM a, 1995).
3.4.8 Pereaksi Timbal (II) Asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida sebanyak 100 ml (Ditjen POM a, 1995).
3.4.9 Pereaksi Asam Sulfat 2 N
Sebanyak 5,4 ml larutan asam sulfat pekat diencerkan dengan air suling sampai 100 ml (Ditjen POM a, 1995).
3.4.10 Larutan Kloralhidrat
Sebanyak 8 gram kristal kloralhidrat ditimbang lalu dilarutkan dalam 10 ml air suling (Ditjen POM a, 1995).
3.5 Pengumpulan dan Pembuatan Simplisia
3.5.1 Pengumpulan Sampel
Bahan yang digunakan dalam penelitian ini adalah daun kelor yang diambil dari Desa Juli, Kecamatan Kota Juang, Kabupaten Bireuen, Provinsi Nanggroe Aceh Darussalam. Daun yang diambil sebagai sampel adalah daun kelor yang tidak terlalu muda dan tidak terlalu tua.
3.5.2 Pembuatan Simplisia
lemari pengering sampai daun kering. Simplisia yang telah kering ditimbang, kemudian diblender menjadi serbuk, lalu dimasukkan ke dalam kantung plastik dan disimpan pada suhu kamar.
3.6 Karakterisasi Simplisia dan Ekstrak
Pemeriksaan karakterisasi simplisia dan ekstrak meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air, penetapan kadar abu total, penetapan kadar abu tidak larut asam, penetapan kadar sari larut air, penetapan kadar sari larut etanol.
3.6.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan cara mengamati warna, bentuk, ukuran dan tekstur dari simplisia.
3.6.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik terhadap simplisia dilakukan dengan cara menaburkan serbuk simplisia di atas kaca objek yang telah diteteskan dengan larutan kloralhidrat dan ditutup dengan kaca penutup kemudian diamati di bawah mikroskop.
3.6.3 Penetapan Kadar Air
besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (Ditjen POM b, 1995).
3.6.4 Penetapan Kadar Sari Larut dalam Air
Sebanyak 5 g serbuk simplisia/ekstrak dimaserasi selama 24 jam dalam 100 ml air kloroform (2,5 ml kloroform dalam air suling sampai 1000 ml) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama kemudian dibiarkan selama 18 jam dan disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan dalam oven pada suhu 105oC sampai diperoleh bobot konstan. Kadar sari yang larut di dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM b, 1995).
3.6.5 Penetapan Kadar Sari Larut dalam Etanol
3.6.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk simplisia/ekstrak yang telah ditimbang seksama dimasukkan dalam krus porselen yang telah dipijar dan ditara, kemudian diratakan. Krus dipijarkan perlahan-lahan hingga arang habis, kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu total dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM b, 1995).
3.6.7 Penetapan Kadar Abu Tidak Larut Asam
Abu yang telah diperoleh dari penetapan kadar abu total dididihkan dalam 25 ml asam klorida 2 N selama 5 menit. Bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring, dipijarkan hingga bobot tetap kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM b, 1995).
3.7 Pemeriksaan Skrining Fitokimia Simplisia dan Ekstrak
3.7.1 Pemeriksaan Alkaloida
Serbuk simplisia/ekstrak ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut:
a. filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Mayer akan terbentuk endapan berwarna putih atau kuning.
b. filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Bouchardat akan terbentuk endapan berwarna coklat-kehitaman.
Alkaloida dinyatakan positif jika terjadi endapan atau paling sedikit dua atau tiga dari percobaan di atas (Ditjen POM b, 1995).
3.7.2 Pemeriksaan Flavonoida
Sebanyak 10 g serbuk simplisia/ekstrak ditambahkan 10 ml air, dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah, kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.7.3 Pemeriksaan Tanin
Sebanyak 0,5 g serbuk simplisia/ekstrak disari dengan 10 ml air suling, disaring lalu filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida. Terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.7.4 Pemeriksaan Glikosida
hati-hati 2 ml asam sulfat pekat terbentuk cincin warna ungu pada batas kedua cairan menunjukkan adanya ikatan gula (Ditjen POM b, 1995).
3.7.5 Pemeriksaan Saponin
Sebanyak 0,5 g simplisia/ekstrak dimasukkan ke dalam tabung reaksi dan ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, timbul busa yang mantap tidak kurang dari 10 menit setinggi 1 – 10 cm. Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak hilang menunjukkan adanya saponin (Ditjen POM b, 1995).
3.7.6 Pemeriksaan Steroida/Triterpenoida
Sebanyak 1 g simplisia/ekstrak dimaserasi dengan 20 ml eter selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa dalam cawan penguap ditambahkan 2 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat. Timbul warna ungu atau merah kemudian berubah menjadi hijau biru menunjukkan adanya steroida/triterpenoida (Harborne, 1987).
3.8 Tahapan Persiapan Percobaan
3.8.1 Pembuatan Ekstrak Etanol Daun Kelor
sebanyak 100 bagian. Bejana ditutup, dibiarkan ditempat sejuk, terlindung dari cahaya, selama 2 hari. Kemudian endapan dipisahkan. Hasil maserat yang diperoleh dikumpulkan dan dipekatkan dengan bantuan alat rotary evaporator
sehingga diperoleh ekstrak etanol (Ditjen POM, 1979). 3.8.2 Pembuatan Suspensi CMC Na 0,5%
Sebanyak 0,5 g CMC ditaburkan dalam lumpang yang berisi 10 ml akuades panas. Didiamkan selama 15 menit hingga diperoleh massa yang transparan. Setelah dikembangkan, digerus hingga terbentuk gel lalu diencerkan dengan sedikit air. Kemudian dimasukkan ke dalam labu takar 100 ml. Volumenya dicukupkan dengan akuades hingga garis tanda (Anief, 1997).
3.8.3 Pembuatan Suspensi Metotreksat 0,025%
Suspensi Metotreksat 0,025% dibuat dengan cara menggerus 1 tablet metotreksat (2,5 mg) di dalam lumpang. Kemudian ditambahkan sedikit larutan CMC 0,5%, digerus sampai homogen. Dituang ke dalam labu tentukur 10 ml, kemudian dicukupkan volumenya dengan larutan CMC 0,5% sampai garis tanda. 3.8.4 Pembuatan Suspensi Ekstrak Etanol Daun Kelor 1%
3.9 Tahap pengujian
Sebelum diberi perlakuan mencit ditimbang dengan bobot rata-rata mencit 20 g. Hewan uji di bagi menjadi 5 kelompok. Pada tiap mencit diberi dengan dosis yang berbeda. Untuk mendapatkan data yang valid dilakukan pengulangan menggunakan rumus Federer (Kusriningrum, 1989).
(n - 1) (t - 1) ≥ 15 (n - 1) (5 - 1) ≥ 15 4n – 4 ≥ 15 4n ≥ 15 + 4
n ≥ 19/4 = 4,5
Adapun perlakuan terhadap hewan uji pada masing-masing kelompok, yaitu:
1. Kelompok blanko: tidak diberi perlakuan/normal.
2. Kelompok 1: Kontrol negatif yaitu mencit diberi suspensi CMC Na 0,5% bb secara per oral selama 10 hari.
3. Kelompok 2: Kontrol positif yaitu mencit pada hari ke-6 sampai hari ke-10 diberikan Metotreksat 1,3 mg/kg bb secara per oral.
4. Kelompok 3: Kelompok perlakuan dengan pemberian suspensi ekstrak etanol daun kelor dosis 100 mg/kg bb selama 10 hari lalu pada hari ke-6 sampai hari ke-10 diberikan Metotreksat 1,3 mg/kg bb secara per oral.
Pada hari ke-11 dilakukan pengambilan sampel darah dari ekor mencit. Kemudian dilakukan pemeriksaan hitung trombosit dengan menggunakan alat hemositometer.
3.10 Pemeriksaan Trombosit
Pengamatan sel trombosit digunakan alat hemositometer. Hisap larutan pengencer (Larutan Rees Ecker) sampai angka 1, lalu buang cairan tersebut. Ekor mencit dilukai dengan pisau steril sehingga mengeluarkan darah. Tetes darah pertama dibuang, tetes darah berikutnya dihisap dengan hemositometer sampai batas 0,5. Hisap larutan Rees Ecker sampai angka 101, kemudian suspensi dikocok selama 2 – 3 menit. Kamar hitung dan gelas penutup dibersihkan, kemudian gelas penutup dipasang di atas kamar hitung. Tetes pertama dibuang terlebih dahulu, lalu campuran diteteskan pada kamar hitung dan dibiarkan selama 2 menit. Pengamatan dilakukan di bawah mikroskop. Perhitungan trombosit dilakukan bidang berukuran 1 x 1 mm3. Jumlah trombosit dihitung dengan persamaan:
Jumlah trombosit/mm3 = jumlah trombosit x 2000 (Gandasoebrata, 1985).
3.11 Analisis Statistik
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan oleh Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor, Indonesia, menunjukkan bahwa tumbuhan yang digunakan adalah Kelor (Moringa oleifera Lam.), suku Moringaceae. Hasil identifikasi dapat dilihat pada Lampiran 2 halaman 50.
4.2 Hasil Karakterisasi Simplisia dan Ekstrak
Pemeriksaan karakteristik daun kelor secara makroskopik dilakukan untuk mengetahui ciri-ciri fisik simplisia suatu tumbuhan, seperti bentuk, bau dan rasa. Hasil pemeriksaan makroskopik daun kelor segar memiliki bentuk helai daun bulat telur, panjang 1 – 2 cm, lebar 1 – 2 cm, tipis lemas, ujung dan pangkal tumpul, tepi rata, susunan pertulangan menyirip, pemukaan atas dan bawah halus, daun majemuk, helai daun berwarna hijau muda hingga hijau tua, bertangkai panjang; daun beraroma khas; rasanya agak sedikit pahit. Gambar hasil pemeriksaan makroskopik daun kelor dapat dilihat pada Lampiran 3 halaman 51.
pada jaringan parenkim, epidermis atas dengan mesofil, rambut penutup, dan stomata anomositik. Gambar hasil pemeriksaan mikroskopik daun kelor dapat dilihat pada Lampiran 4 halaman 53.
Menurut Ditjen POM (2000), standarisasi suatu simplisia dan ekstrak adalah pemenuhan terhadap persyaratan sebagai bahan obat dan menjadi penetapan nilai untuk berbagai parameter produk. Hasil pemeriksaan karakterisasi simplisia dan ekstrak etanol daun kelor terlihat pada Tabel 4.1.
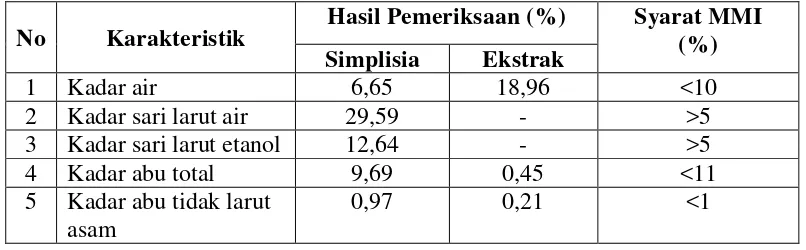
Tabel 4.1 Hasil karakterisasi simplisia dan ekstrak etanol daun kelor
No Karakteristik Hasil Pemeriksaan (%) Syarat MMI (%) Simplisia Ekstrak
Ekstraksi serbuk daun kelor dilakukan dengan cara maserasi menggunakan etanol 96%, ekstrak cair (maserat) dari 500 g serbuk simplisia daun kelor yang dimaserasi, dipekatkan dengan menggunakan rotary evaporator sehingga diperoleh ekstrak kental sebanyak 52,48 gram (Rendemen 10,496%).
besarnya kandungan air dalam ekstrak. Kandungan air yang tinggi dapat berpengaruh terhadap pertumbuhan bakteri dan jamur sehingga menyebabkan ketidakstabilan sediaan obat dan terurainya zat aktif selama penyimpanan sehingga ekstrak tersebut harus disimpan di dalam lemari pendingin.
Penetapan kadar sari yang larut dalam air dan etanol dilakukan untuk mengetahui jumlah senyawa yang dapat tersari dalam air dan dalam etanol dari suatu simplisia. Hasil karakterisasi simplisia daun kelor menunjukkan kadar sari yang larut dalam air sebesar 29,59%; sedangkan kadar sari yang larut dalam etanol sebesar 12,64%. Kadar sari yang larut dalam air lebih besar dari kadar sari yang larut dalam etanol karena senyawa bersifat polar lebih banyak larut di dalam pelarut air daripada etanol, dan senyawa yang tidak larut di pelarut air akan larut di dalam pelarut etanol.
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral internal (abu fisiologis) yang berasal dari jaringan tanaman itu sendiri, dan eksternal (abu non-fisiologis) yang merupakan residu dari luar seperti pasir dan tanah yang terdapat di dalam sampel atau dari sisa setelah pembakaran (Ditjen POM b, 2000; WHO, 1992). Kadar abu tidak larut asam untuk menentukan jumlah silika, khususnya pasir yang ada pada simplisia dengan cara melarutkan abu total dalam asam klorida (WHO, 1992).
Kadar abu total yang tinggi menunjukkan adanya zat anorganik logam-logam (Ca, Mg, Fe, Cd dan Pb) yang sebagian mungkin berasal dari pengotoran. Kadar logam berat yang tinggi dapat membahayakan kesehatan, oleh sebab itu perlu dilakukan penetapan kadar abu total dan kadar abu tidak larut asam untuk memberikan jaminan bahwa ekstrak tidak mengandung logam berat tertentu melebihi nilai yang ditetapkan.
Berdasarkan tabel di atas, simplisia daun kelor yang digunakan telah memenuhi standar karakterisasi simplisia berdasarkan standar Materia Medika Indonesia jilid VI. Standar karakterisasi ekstrak belum tercantum dalam monografi, sehingga hasil karakterisasi ekstrak yang diperoleh dalam penelitian ini dapat digunakan sebagai acuan karakteristik ekstrak etanol daun kelor.
4.3 Hasil Skrining Fitokimia Simplisia dan Ekstrak
Skrining fitokimia terhadap serbuk simplisia dan ekstrak etanol daun kelor dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang terdapat di dalamnya. Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol etanol daun kelor dapat dilihat pada Tabel 4.2.
Tabel 4.2 Hasil skrining fitokimia simplisia dan ekstrak etanol daun kelor
No Golongan Senyawa Hasil Pemeriksaan Simplisia Ekstrak
1 Alkaloid + +
2 Flavonoid + +
3 Tanin + +
4 Saponin + +
5 Steroid/triterpenoid + +
6 Glikosida + +
Hasil skrining menunjukkan bahwa simplisia daun kelor mengandung senyawa golongan alkaloid, flavonoid, tanin, saponin, glikosida, dan steroid/triterpenoid. Demikian juga hasil skrining ekstrak etanol daun kelor menunjukkan adanya senyawa golongan alkaloid, flavonoid, tanin, saponin, steroid/triterpenoid dan glikosida. Pelarut etanol sangat efektif untuk mengikat senyawa-senyawa seperti lemak, alkaloid, polifenol, dan glikosida (Filho, 2006).
4.4 Hasil Pengujian Ekstrak Etanol Daun Kelor Terhadap Jumlah Trombosit Mencit
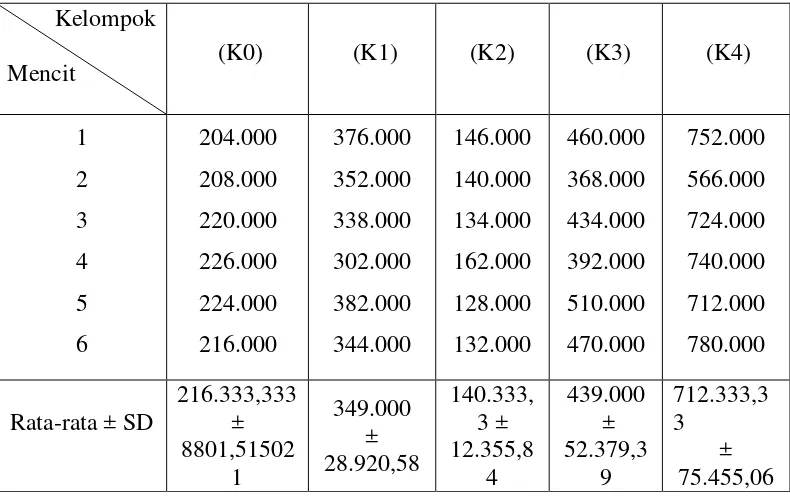
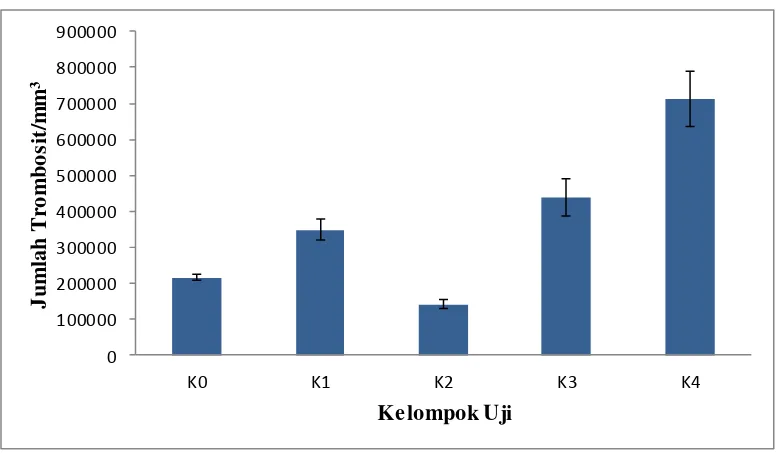
Hasil perhitungan jumlah trombosit pada kelompok perlakuan K0, K1, K2, K3, dan K4 per mm3 dapat diamati dalam Tabel 4.3 dan Gambar 4.1.
Tabel 4.3 Hasil rata-rata perhitungan jumlah trombosit mencit (per mm3) setelah perlakuan 10 hari
K2 : Metotreksat dosis 1,3 mg/kg bb
0
Gambar 4.1 Grafik hasil rata-rata perhitungan jumlah trombosit mencit (per mm3) setelah perlakuan 10 hari
Keterangan:
K 0 : Blanko/normal K 1 : CMC Na 0,5% bb
K 2 : Metotreksat dosis 1,3 mg/kg bb
K 3 : Suspensi EEDK dosis 100 mg/kg bb + Metotreksat dosis 1,3 mg/kg bb K 4 : Suspensi EEDK dosis 200 mg/kg bb + Metotreksat dosis 1,3 mg/kg bb
kesehatan, stress, dan suhu tubuh, sedangkan secara eksternal berupa akibat infeksi kuman, patah tulang, dan perubahan suhu lingkungan.
Pada kelompok 1 (kontrol), yang diberikan suspensi pembawa CMC Na 0,5%, diperoleh jumlah trombosit sebesar 349.000 ± 28.920,58 per mm3. Hasil ini menunjukkan perbedaan signifikan p = 0,000 (p < 0,05) dibandingkan kelompok blanko. Karboksimetilselulosa (CMC) adalah turunan selulosa yang dapat digunakan dalam formulasi pemberian obat dan menunjukkan aktivitas antioksidan yang mampu menangkap ROS (Reactive Oxygen Spesies) dan menghambat pembentukan O2- (Sjahrial, 2013). Aktivitas antioksidan dapat menurunkan sintesis NO (Nitric Oxide) yang berlebihan sehingga meningkatkan hemostasis. NO adalah suatu zat yang dilepaskan oleh sel endotel yang berperan dalam menginhibisi agregasi trombosit dan memperpanjang waktu perdarahan (Brunton, et al., 2008). Kadar NO yang tinggi dapat bereaksi dengan sejumlah radikal anion superoksidan (O2-). menghasilkan radikal bebas anion peroksinitrit (ONOO-) yang sitotoksik. Radikal bebas ini berpotensi menimbulkan peroksidasi lipid sehingga menyebabkan kerusakan sel yang sangat serius (Gunawijaya dan Arhana, 2000; Nijveldt, et al., 2001).
Hasil analisis statitistik jumlah trombosit pada kelompok 1 (kontrol) dan blanko berbeda signifikan dibandingkan dengan kelompok 2 yang diberi metotreksat 1,3 mg/kg bb. Penurunan trombosit yang diperoleh sebesar 140.333,33 ± 12.355,84 per mm3 . Hal ini menunjukkan bahwa metotreksat dapat menyebabkan supresi sumsum tulang, sehingga terjadi penurunan produksi trombosit. Metotreksat bekerja menghambat dihidrofolat reduktase sehingga mengganggu sintesis DNA, RNA, dan protein yang pada akhirnya akan mengganggu proliferasi sel, termasuk sel hemopoietik (Nafrialdi dan Gan, 2009; Lo, et al., 2011).
Dibandingkan antara kelompok 2 dengan kelompok 3, yaitu terdapat perbedaan secara signifikan dengan p = 0,000 (p < 0,05). Hal ini menunjukkan bahwa pemberian ekstrak etanol daun kelor dengan dosis 100 mg/kg bb terhadap mencit yang diberi metotreksat efektif dalam menstimulasi proliferasi sel-sel hemopoietik di sumsum tulang. Mekanisme stimulasi tersebut menunjukkan peningkatan jumlah CFU (Colony Forming Unit). Komponen yang berperan dalam trombopoiesis antara lain CFU megakariosit dan trombopoietin (Hoffbrand, et al., 2005).
biasanya tidak menyebabkan gangguan seperti perdarahan atau trombosis , kecuali jika jumlah trombosit telah melebihi 1 juta per mm3 (Baldy, 1994).
Dibandingkan antara kelompok 3 dengan kelompok 4, yaitu terdapat perbedaan secara signifikan dengan p = 0,000 (p < 0,05). Hal ini menunjukkan bahwa besarnya perbedaan efek sebanding dengan peningkatan dosis pada ekstrak etanol daun kelor. Hal ini karena banyaknya kandungan asam amino serin dan threonin di dalam ekstrak etanol daun kelor yang diperlukan untuk proliferasi sel. Salah satunya ialah membentuk trombopoietin yang berfungsi dalam proses maturasi megakariosit menjadi trombosit (Sundaryono, 2011).
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
Berdasarkan tujuan penelitian, maka dapat disimpulkan:
a. Hasil pemeriksaan karakterisasi simplisia daun kelor diperoleh kadar air 6,65%, kadar abu total 9,69%, kadar abu tidak larut asam 0,97%, kadar sari larut air 29,59%, kadar sari larut etanol 12,64%, sedangkan ekstrak etanol daun kelor diperoleh kadar air 18,96%, kadar abu total 0,45%, kadar abu tidak larut asam 0,21%. Golongan senyawa kimia yang terdapat dalam simplisia dan ekstrak etanol daun kelor adalah alkaloid, flavonoid, steroid/triterpenoid, saponin, tanin, dan glikosida.
b. Pemberian ekstrak etanol daun kelor dosis 100 mg/kg bb mampu meningkatkan jumlah trombosit mencit yang diinduksi metotreksat dosis 1,3 mg/kg bb menjadi 439.000 ± 52.379,39 per mm3.
5.2Saran
DAFTAR PUSTAKA
Anief, M. (1997). Ilmu Meracik Obat, Teori dan Praktek. Yogyakarta: Gadjah Mada University. Halaman 110.
Anwar, F., Latif, S., Ashraf, M., dan Gilani, A.H. (2007). Moringa oleifera A Food Plant With Multiple Medicinal Uses. Phytother. Res. 21(1): 17-125. Baldy, C.M. (1994). Pembekuan. Di dalam: Patofisiologi Konsep Klinis Proses-Proses Penyakit. Penerjemah: Peter Anugerah. Edisi keempat. Jakarta: EGC. Halaman 264-272.
Brunton, L., Parker, K., Blumenthal, D., dan Buxton, I. (2008). Goodman dan
Gilman’s Manual of Pharmacology dan Therapeutics. Singapore:
McGraw-Hill Medical. Halaman 259.
Ditjen POM. (1979). Farmakope Indonesia. Edisi ketiga. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 33.
Ditjen POM a. (1995). Farmakope Indonesia. Edisi keempat. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 7, 969 - 971, 1033.
Ditjen POM b. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 299-305, 333-340.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan kesatu. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 10-11, 17, 31-32.
Fahey, J.W. (2005). Moringa oleifera: A Review of the Medical Evidence for Its Nutritional, Therapeutic, and Prophylactic Properties. Part 1. Trees for Life J. 1(1): 1-33.
Farnsworth, P. (1966). Biological and Phytochemical Screening of Plants. Journal of Pharmaceutical Sciences. 55(3): 256-263.
Filho, M. (2006). Bioactive Phytocompounds: New Approaches in the Phytosciences. Editor: Iqbal Ahmad, Farrukh Aqil dan Mohammad Owais. Jerman: Wiley-VCH. Halaman 9-10.
Gaikwad, S.B., Mohan, G.K., dan Reddy, K.J. (2011). Moringa oleifera Leaves: Immunomodulation In Wistar Albino Rats. International Journal of Pharmacy and Pharmaceutical Sciences. 3(5): 426-430.