i
IMA WIJAYANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
iii
Dengan ini saya menyatakan bahwa tesis yang berjudul “Pengaruh Penambahan Komponen Fenolik Teroksidasi terhadap Karakteristik Gel Surimi Ikan Lele Dumbo (Clarias Gariepinus)” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2012
Ima Wijayanti
v
IMA WIJAYANTI. Adding Effect of Phenolic Compound on the Gel Properties of Catfish (Clarias gariepinus) Surimi. Supervised by JOKO SANTOSO and AGOES M. JACOEB.
Catfish (Clarias gariepinus) has potential as raw material of surimi because the production is abundant. However, research is needed to enhance the gel strength of catfish surimi. The effect of leaching times on the proximate composition and gel properties of catfish surimi were studied. Three times of leaching produced better characteristics of the gel rather than leaching 1 and 2 times. Commercial tannic acid and tea leaf extract were added in producing surimi gel. Ethanol extracts from tea leaves powder 100 mesh size used in surimi since had higher total phenol content (47.34 mg/g) than 60 mesh. The effects of different oxidised phenolic compounds (tannic acid (K) and tea leaf extract (T) at different levels (0–0.50%) of protein content) on the properties of gels from catfish (Clarias gariepinus) surimi were investigated. Gels with addition of 0.50% tannic acid and 0.4% tea extract increased in WHC by 27.27 % and 20.5% and decreased in EMC by 34.55% and 44.85% respectively. The highests deformation, gel strength and breaking force had been reached by 0.5% tannic acid and 0.4% tea leaf extract. Whiteness decreased slightly with the increasing of phenolic concentration. Tannic acid 0.5% and tea leaf extract 0.4% gave the best textural properties on gel surimi. Result of sensory evaluation indicated that addition of oxidised phenolic compounds had positive impact in folding test and teeth cutting test however there were no effect in taste of surimi gels. Gels with addition of all oxidised phenolics exhibited fibrillar structures which were more compact in compared to control. Optimum concentration of phenolic compound to enhance catfish surimi gel are 0.5 % for tannic acid and 0.4% for tea leaf extract.
vii
terhadap Karakteristik Gel Surimi Ikan Lele Dumbo (Clarias gariepinus). Dibimbing oleh JOKO SANTOSO and AGOES M. JACOEB.
Budidaya lele cukup mudah sehingga terus dikembangkan di Indonesia dan termasuk komoditas yang dikembangkan pada kebijakan minapolitan. Bertambahnya jumlah ikan lele hasil budidaya bisa menjadi pilihan sebagai bahan
baku bagi produk olahan hasil perikanan misalnya surimi. Teknologi pengolahan surimi dari bahan baku ikan air tawar masih terus dikembangkan karena kualitas gel yang dihasilkan masih rendah. Penambahan komponen fenolik teroksidasi pada surimi telah dikaji pada beberapa spesies ikan laut, namun demikian penggunaannya pada ikan air tawar belum pernah dilakukan. Penambahan komponen fenolik teroksidasi pada surimi ikan lele diharapkan menjadi salah satu alternatif untuk meningkatkan kualitas gel. Penelitian ini bertujuan memperoleh teknologi pembuatan surimi dari ikan lele dengan penambahan komponen fenol teroksidasi untuk peningkatan kekuatan gel. Penelitian dilakukan dalam 3 tahap, yaitu penentuan frekuensi pencucian terbaik dalam pembuatan surimi, ekstraksi fenol dari daun teh serta penentuan jenis fenol dan konsentrasi yang ditambahkan pada surimi lele.
Frekuensi pencucian yang dicobakan dalam penelitian ini adalah 1x, 2x, 3x dan 4x. Frekuensi pencucian berpengaruh nyata terhadap komposisi kimia dan karakteristik gel surimi lele. Frekuensi pencucian meningkatkan kandungan air, menurunkan kadar protein, lemak dan mineral surimi lele. Nilai WHC dan deformasi meningkat seiring bertambahnya frekuensi pencucian. Kekuatan gel dan pH cenderung meningkat seiring dengan bertambahnya frekuensi pencucian meskipun secara statistika tidak berbeda nyata. Pencucian 3 kali memberikan hasil karakteristik gel lebih baik dibandingkan pencucian 1 dan 2 kali.
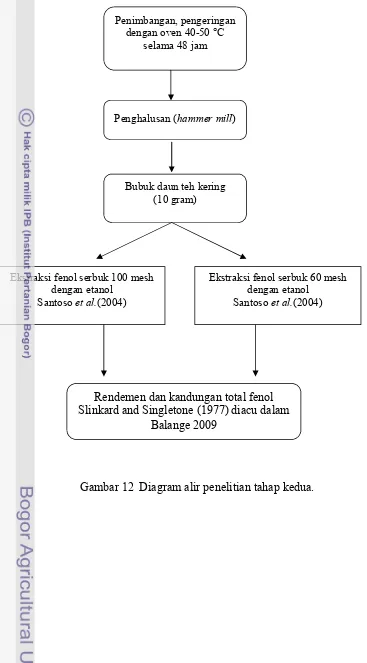
Ekstraksi fenol dilakukan pada daun teh kering yang telah dihaluskan menjadi serbuk dengan ukuran berbeda (100 mesh dan 60 mesh). Ekstraksi dengan kandungan total fenol terbaik akan diaplikasikan pada surimi lele. Kandungan total fenol terbaik dihasilkan pada ekstrak dari serbuk dengan ukuran 100 mesh yaitu 47,34 mg tanin/g bubuk kering atau setara dengan 4,73%.
viii
berpengaruh nyata pada tingkat kesukaan (hedonic scale). Gel dengan penambahan fenol teroksidasi baik pada asam tanat komersial maupun ekstrak teh menunjukkan struktur serat yang lebih kompak dan lebih halus dibanding kontrol. Gel dengan penambahan asam tanat teroksidasi (K) dan ekstrak teh (T) pada konsentrasi 0,4% dan 0,5% menunjukkan struktur mikro yang terbaik.
Penambahan senyawa fenol teroksidasi pada surimi lele berpengaruh nyata terhadap karakteristik gel surimi lele dibandingkan kontrol. Konsentrasi optimum yang dapat digunakan untuk meningkatkan karakteristik gel surimi lele adalah 0,5% pada asam tanat dan 0,4% pada ekstrak teh.
ix
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
xi
IMA WIJAYANTI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister sains
pada Program Studi Teknologi Hasil perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
xiii
Lele Dumbo (Clarias gariepinus)
Nama : Ima Wijayanti
NRP : C351100011
Program Studi : Teknologi Hasil Perairan
Disetujui
Komisi Pembimbing
Dr.Ir.Joko Santoso, M.Si Dr.Ir.Agoes M.Jacoeb,Dipl-Biol Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana, Teknologi Hasil Perairan Institut Pertanian Bogor
Dr.Tati Nurhayati, S.Pi,M.Si Dr. Ir. Dahrul Syah, M.Sc. Agr
xv
melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penulisan tesis ini. Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Teknologi Hasil Perairan yang berjudul Pengaruh Penambahan Komponen Fenolik Teroksidasi terhadap Karakteristik Gel Surimi Ikan Lele Dumbo (Clarias gariepinus).
Pada kesempatan ini, penulis menyampaikan terima kasih kepada:
1. Dr. Ir. Joko Santoso, M.Si selaku ketua komisi pembimbing yang telah memberikan arahan, saran dan motivasi kepada penulis dalam menyelesaikan penulisan tesis. Terima kasih atas ilmu yang Bapak berikan, semoga bermanfaat bagi saya pribadi maupun institusi tempat saya bekerja.
2. Dr. Ir. Agoes M. Jacoeb, Dipl. Biol sebagai anggota komisi pembimbing yang telah membimbing dan memberi masukan serta motivasi kepada penulis dalam menyelesaikan tesis.
3. Dr. Tati Nurhayati, S.Pi, M.Si selaku ketua program S2 Teknologi Hasil Perairan IPB dan Dr. Ir. Bustami Ibrahim, M.Sc sebagai penguji luar komisi atas masukan dan saran untuk perbaikan penulisan tesis.
4. Direktorat Jenderal Pendidikan Tinggi atas kesempatan dan beasiswa yang diberikan kepada penulis untuk melanjutkan studi S2.
5. Seluruh staf pengajar program studi Teknologi Hasil Perairaan FPIK IPB, terima kasih atas ilmu dan pengalaman yang diberikan selama penulis studi S2.
6. Suamiku tercinta, Setianto yang telah sabar serta penuh pengertian dan kasih sayang mendukung penulis untuk melanjutkan tugas belajar meskipun harus jauh dari keluarga. Putri kami Delisha yang menjadi semangat penulis untuk segera menyelesaikan studi.
7. Ibu (Purwati) dan Ayah (Sugiharto) serta adik-adik (Priyo, Nana, Anto dan Vivi), terima kasih untuk doa yang selalu mengiringi dan kasih sayang yang tidak terputus serta dukungan selama ini.
8. Ibu mertua (Darmi), Bapak mertua (Suwardi) dan adik Nia, terima kasih atas doa dan dukungannya serta telah menjaga putri kami dengan penuh kasih sayang selama penulis menjalankan studi.
9. Prof. Dr. Ir. YS. Darmanto, M.Sc dan Dr. Ir. Tri Winarni, M.Sc (Ketua dan Sekretaris Laboratorium THP FPIK UNDIP) atas segala dukungan selama penulis penelitian serta seluruh staf pengajar THP FPIK UNDIP atas doa dan motivasinya.
xvi bantuan yang diberikan.
13. Teman-teman sekelas THP 2010 (Mbak Yenni, Mbak Nani, Vivi, Tyas, Fikri, Wiwit, Dewi, Eka, Tia, Pak Agus, Kak Leny dan Usi Kristin) terima kasih atas kebersamaan kita selama ini, semoga jalinan silaturahmi kita tetap terjaga.
Penulis menyadari masih ada kekurangan di dalam penyusunan tesis ini, meskipun demikian semoga karya ilmiah ini bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Juli 2012
xvii
Penulis dilahirkan di Jepara, pada tanggal 5 April 1981. Penulis adalah anak pertama dari tiga bersaudara keluarga Bapak Sugiharto dan Ibu Purwati. Pada tahun 1999, setelah menyelesaikan pendidikan Sekolah Menengah Umum di SMU Negeri 1 Jepara, penulis diterima di Universitas Diponegoro melalui Ujian Masuk Perguruan Tinggi Negeri (UMPTN). Penulis menyelesaikan pendidikan sarjana (S1) di Universitas Diponegoro pada Program Studi Pemanfaatan Sumberdaya Perikanan, Fakultas Perikanan dan Ilmu Kelautan pada tahun 2004.
xix
2.4 Sifat Fungsional Protein... 13
2.4.1 Pembentukan gel/gelasi (gelation)... 14
2.4.2 Water holding capacity (WHC) ... 16
2.5 Surimi... 16
2.5.1 Standar kualitas surimi... 18
2.6 Faktor yang Berpengaruh pada Kualitas Surimi ... 20
2.6.1 Spesies... 20
2.6.2 Kematangan seksual atau musim ... 20
2.6.3 Kesegaran atau rigor ... 21
2.6.4 Faktor pengolahan... 22
2.7 Bahan Penguat Gel pada Surimi ... 22
2.7.1 Air ... 23
2.7.2 Pati ... 23
2.7.3 Protein aditif... 24
2.7.4 Hidrokoloid ... 25
2.7.5 Senyawa kimia food grade... 25
2.8 Texture Profile Analysis... 26
2.9 Senyawa Fenolik ... 29
2.9.1 Metabolisme senyawa fenol... 31
2.9.2 Asam tanat... 32
2.10 Oksidasi Senyawa Fenolik ... 33
2.10.1 Oksidasi enzimatik komponen fenolik... 33
2.10.2 Auto oksidasi komponen fenolik (non enzimatik) ... 35
xx
3.1 Waktu dan Tempat... 41
3.2 Bahan dan Alat ... 41
3.2.1 Bahan ... 41
3.2.2 Alat ... 41
3.3 Tahapan Penelitian ... 42
3.3.1 Persiapan bahan ... 42
3.3.2 Penelitian tahap 1... 42
3.3.3 Penelitian tahap 2... 43
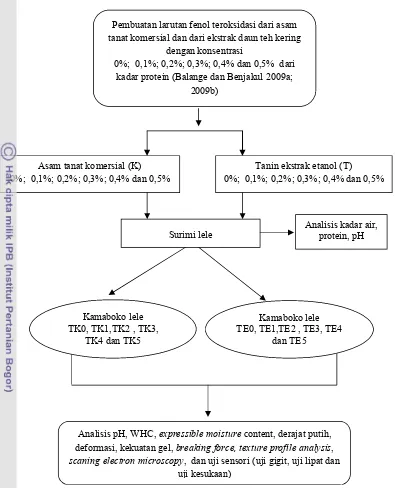
3.3.4 Penelitian tahap 3... 44
3.4 Persiapan Gel (Kamaboko)... 44
3.5 Prosedur Analisis ... 48
3.5.1 Analisis fisik ... 48
3.6 Rancangan Percobaan dan Analisis Data ... 54
4 HASIL DAN PEMBAHASAN ... 57
4.1 Pengaruh Frekuensi Pencucian terhadap Kualitas Surimi Lele... 57
4.1.1 Komposisi kimia... 57
4.2 Ekstrak Fenol dari Daun Teh... 70
4.3 Pengaruh Penambahan Senyawa Fenol Teroksidasi pada Surimi Lele ... 72
4.3.1 Nilai organoleptik dan komposisi kimia ikan segar ... 73
4.3.2 pH ... 74
4.3.3 Protein larut garam ... 75
xxi
4.3.8 Sensorik... 89
4.3.9 Scanning electron microscope(SEM) ... 91
5 SIMPULAN DAN SARAN ... 95
5.1 Simpulan ... 95
5.2 Saran... 95
DAFTAR PUSTAKA ... 97
xxiii
1 Standar mutu surimi berdasar pengujian kamaboko ... 19
2 Persyaratan mutu dan keamanan pangan surimi beku ... 19
3 Komposisi polifenol pada teh hijau dan teh hitam (% berat/berat)... 40
4 Lembar pengujian uji lipat ... 53
5 Lembar pengujian uji gigit ... 53
6 Lembar penilaian uji kesukaan/hedonik... 54
7 Komposisi kimia ikan lele segar ... 58
8 Komposisi kimia surimi dengan frekuensi pencucian berbeda... 59
9 Komposisi kimia kamaboko dengan frekuensi pencucian berbeda ... 59
10 Nilai water holding capacitydan expressible moisture contentgel surimi
dengan frekuensi pencucian yang berbeda... 65
11 Nilai deformasi dan kekuatan gel (gel strength) surimi lele ... 68 12 Kadar air, rendemen dan total fenol serbuk daun teh ... 71
13 Nilai organoleptik ikan lele segar ... 73
14 Komposisi kimia ikan segar dan surimi lele ... 74
15 Komposisi asam amino ikan lele dumbo (Clarias gariepinus)... 77 16 Nilai water holding capacity(WHC) dan expressible moisture content
(EMC) gel surimi dengan penambahan jenis fenol teroksidasi dan
konsentrasi yang berbeda ... 78
17 Nilaitexture profile analysis(TPA) gel surimi lele dengan penambahan
jenis fenol teroksidasi dan konsentrasi berbeda... 84
18 Nilai warna gel surimi dengan dengan penambahan jenis fenol teroksidasi dan konsentrasi berbeda ... 87
19 Nilai uji lipat, uji gigit dan tingkat kesukaan terhadap gel surimi dengan
xxv
Halaman 1 Ikan lele dumbo (Clarias gariepinus)... 7 2 Molekul miosin (King 2011)... 11
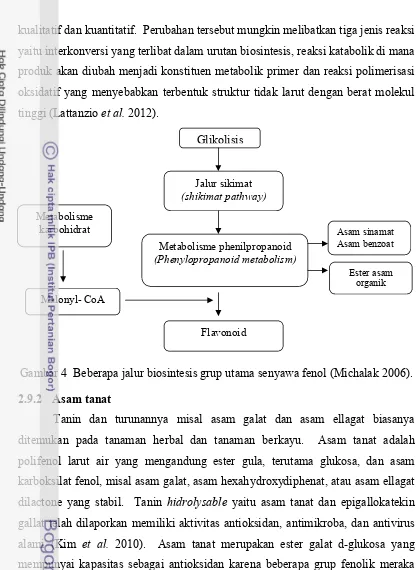
3 Kurva texture profile analysisGF Texturometer(Bourne 2002)... 27 4 Beberapa jalur biosintesis grup utama senyawa fenol (Michalak 2006) ... 32
5 Oksidasi sebuah ortho-difenol menjadi kuinon (Prigent 2005 diacu dalam
Balange 2009) ... 34
6 Mekanisme kresolase dan katekolase dari polifenol oksidase (Matheis dan Whitaker 1984 diacu dalam Balange 2009)... 35 7 Oksidasi 1,4-dihidroksibenzena menjadi -kuinon (Vermerris dan Nicholson
2006)... 35
8 Auto oksidasi katekol membentuk dimer yang berbeda (Vermerris dan
Nicholson 2006) ... 36
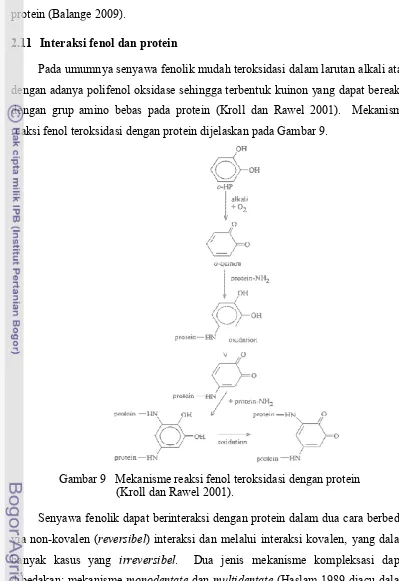
9 Mekanisme reaksi fenol teroksidasi dengan protein (Kroll dan Rawel 2001) 37
10 Mekanisme monodentatedan multidentate(Haslam 1989 diacu dalam
Balange 2009) ... 38
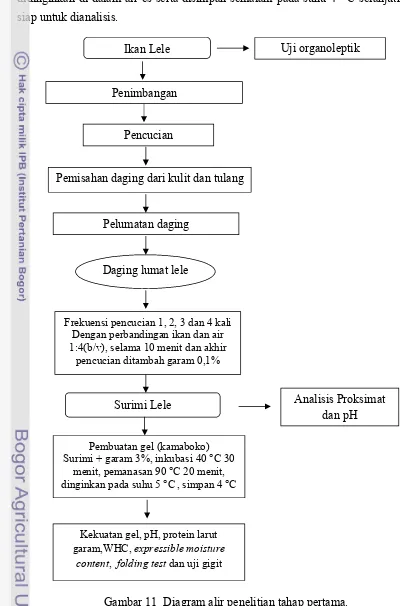
11 Diagram alir penelitian tahap pertama ... 45
12 Diagram alir penelitian tahap kedua ... 46
13 Diagram alir penelitian tahap ketiga ... 47
14 Nilai pH surimi dengan frekuensi pencucian berbeda ... 63
15 Nilai pH kamaboko dengan frekuensi pencucian berbeda... 63
16 Nilai protein larut garam gel surimi dengan pencucian berbeda ... 67
17 Nilai uji lipat gel surimi lele dengan frekuensi pencucian berbeda ... 69
18 Nilai uji gigit gel surimi lele dengan frekuensi pencucian berbeda... 70
19 Nilai pH gel surimi dengan penambahan jenis fenol teroksidasi dengan
konsentrasi berbeda ... 75 20 Nilai protein larut garam gel surimi dengan penambahan jenis fenol
teroksidasi dengan konsentrasi berbeda ... 76
21 Nilai deformasi gel surimi dengan penambahan jenis fenol teroksidasi
dengan konsentrasi berbeda ... 80
22 Kekuatan gel kamaboko dengan penambahan jenis fenol teroksidasi
dengan konsentrasi berbeda ... 81 23 Nilai breaking forcegel surimi dengan penambahan jenis fenol teroksidasi
dengan konsentrasi berbeda ... 82
24 Scanning electron microscopy(SEM) gel surimi dengan penambahan
xxvii
xxviii
19 Analisis ragam pH kamaboko dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...126
20 a. Analisis ragam protein larut garam kamaboko dengan jenis dan
konsentrasi fenol teroksidasi yang berbeda ...127 b. Uji beda protein larut garam kamaboko pada level konsentrasi ...127
21 a. Analisis ragam WHC kamaboko dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...128 b. Uji beda WHC kamaboko dengan jenis dan konsentrasi fenol teroksidasi yang berbeda ...128 22 a. Analisis ragam EMC gel surimi dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...129 b. Uji beda EMC gel surimidengan jenis dan konsentrasi fenol teroksidasi yang berbeda ...129 23 a. Analisis ragam deformasi gel surimi dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...130 b. Uji beda deformasi kamaboko pada level konsentrasi... 130 24 a. Analisis ragam gel strengt gel surimi dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...131 b. Uji beda gel strength gel surimi dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...131 25 a. Analisis ragam break forcegel surimi dengan jenis dan konsentrasi
fenol teroksidasi yang berbeda ...132 b. Uji beda break forcegel surimi dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...132
26 a. Analisis ragam hardnessgel surimi dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...133 b. Uji beda hardnessgel surimi pada level konsentrasi...133 27 Analisis ragam cohesivenessgel surimi dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...134 28 a. Analisis ragam springinessgel surimi dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...135 b. Uji beda springinessgel surimi dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...135 29 a. Analisis ragam adhesive forcegel surimi dengan jenis dan konsentrasi
fenol teroksidasi yang berbeda ...136 b. Uji beda adhesive forcegel surimi dengan jenis dan konsentrasi fenol
teroksidasi yang berbeda...136
30 a. Analisis ragam gumminessgel surimi dengan jenis dan konsentrasi fenol teroksidasi yang berbeda...137 b. Uji beda gumminessgel surimi dengan jenis dan konsentrasi fenol
xxix
32 a. Analisis ragam Lightness(L*) gel surimi dengan jenis dan konsentrasi
fenol teroksidasi yang berbeda ... 139 b. Uji beda Lightness(L*)gel surimi pada level konsentrasi ... 139 33 a. Analisis ragam redness/greennes(a*) gel surimi dengan jenis dan
konsentrasi fenol teroksidasi yang berbeda... 140 b. beda redness/greennes(a*) gel surimi dengan jenis dan konsentrasi
fenol teroksidasi yang berbeda ... 140 34 a. Analisis ragam yellowness/blueness(b*) gel surimi dengan jenis dan
konsentrasi fenol teroksidasi yang berbeda... 141 b. Uji beda yellowness/blueness(b*) gel surimi pada level konsentrasi... 141 35 a. Analisis nonparametrik Kruskal Wallis uji lipat gel surimi dengan
jenis dan konsentrasi fenol teroksidasi yang berbeda ... 142 b. Uji beda Multiple Comparison pada uji lipat gel surimi ... 143 36 a. Analisis nonparametrik Kruskal Wallis uji gigit gel surimi dengan
jenis dan konsentrasi fenol teroksidasi yang berbeda ... 145 b. Uji beda Multiple Comparison pada uji gigit gel surimi... 146 37 a. Analisis nonparametrik Kruskal Wallis uji kesukaan gel surimi dengan
1. PENDAHULUAN
1.1 Latar Belakang
Produksi perikanan nasional pada tahun 2009 mencapai 9,8 juta ton dan
hingga akhir tahun 2010 ditaksir mencapai 10,83 juta ton atau mencapai 100,56%
dari target sebesar 10,76 juta ton. Sektor perikanan budidaya memberi kontribusi
peningkatan terbesar yakni 50,55% (KKP 2011). Lele termasuk dari 10 jenis
komoditas unggulan yang dibudidayakan dan termasuk komoditas yang
dikembangkan pada kebijakan minapolitan (Ditjen Perikanan Budidaya KKP
2009).
Meningkatnya jumlah ikan lele hasil budidaya diharapkan dapat menjadi
alternatif sumber protein hewani. Permasalahan sekarang dan masa depan adalah
kurangnya alternatif pemanfaatan ikan lele hasil budidaya. Keadaan ini akan
mengakibatkan adanya penahanan panen atau penundaan panen bagi sebagian
petani atau pengusaha budidaya ikan, menunggu giliran pemasaran bagi ikan
segarnya (Hustiany 2005). Bertambahnya jumlah ikan lele hasil budidaya bisa menjadi pilihan sebagai bahan baku bagi produk olahan hasil perikanan. Dengan
demikian ikan tersebut tidak hanya dijual segar namun dapat diolah lebih lanjut
menjadi produk diversifikasi sehingga dapat memberikan nilai tambah.
Salah satu diversifikasi produk olahan hasil perikanan adalah surimi.
Surimi adalah lumatan daging ikan, yang dicuci untuk menghilangkan sebagian
besar lemak, darah, enzim dan protein sarkoplasma serta distabilkan dalam
kondisi beku dengan menambahkan cryoprotectant (Balange dan Benjakul 2009a). Surimi adalah protein miofibril yang distabilisasi dan diperoleh dari
daging ikan yang telah dibuang tulangnya, dicuci dengan air serta dicampur
dengan cryoprotectant. Surimi merupakan produk intermediate yang digunakan dalam berbagai variasi produk, mulai dari produk kamaboko tradisional di Jepang
sampai sebagai substitusi atau pengganti shellfish/kerang-kerangan (Park dan Morrissey 2000).
Bahan baku surimi biasanya dari spesies ikan laut yang berdaging putih,
(Priachantus tayenus) dan beloso (Saurida tumbil). Namun spesies-spesies tersebut mulai mengalami overfishing. Produksi ikan air tawar cukup besar
dengan nilai komersialnya masih rendah. Oleh karena itu ikan air tawar
berpotensi sebagai bahan baku surimi. Teknologi pengolahan surimi dari bahan
baku ikan air tawar masih terus dikembangkan karena kualitas gel yang dihasilkan
masih rendah.
Wang et al. (2001) melaporkan bahwa pembentukan gel surimi dari
Japannese common carp lebih rendah dibandingkan dengan surimi dari Alaska pollack. Demikian pula pada surimi dari silver carp, grass carp dan common carp(Luo et al.2001). Namun demikian beberapa perlakuan, misalnya pencucian dan penggunaan bahan tambahan (TGase, bovine plasma, protein kedelai, putih
telur), dapat meningkatkan kualitas gel kamaboko pada Japannese common carp. Li dan Xia (2010) membuktikan kekuatan gel ikan mas (silver carp) dapat ditingkatkan dengan penambahan kitosan. Rendahnya kualitas gel surimi dari
ikan tawar juga disebabkan adanya fenomena modori oleh enzim endogenous serin proteinase. Penambahan soybean tripsin inhibitorpada crucian carpdapat menurunkan aktivitas enzim tersebut (Jiang et al. 2006). Hossain et al. (2004) menyatakan bahwa surimi dari silver carp dan pangasius (ikan patin) dapat diproduksi dengan penambahan 0,1% NaCl pada proses pencucian dalam waktu
10 menit. Gel yang kuat dapat diperoleh dengan penambahan garam 3% serta
dengan pemanasan dua tahap.
Usaha untuk meningkatkan kekuatan gel surimi banyak dilakukan.
Penambahan zat pengoksidasi pada proses pencucian dapat meningkatkan kualitas
gel surimi terutama pada ikan dengan kualitas rendah (Patcharat et al. 2006). Penggunaan temperatur settingmedium (25 °C) pada beberapa spesies ikan tropis dapat meningkatkan kekuatan gel ketika waktu setting dinaikkan (Benjakul et al.
2003). Selain itu berbagai bahan ditambahkan untuk memperbaiki kekuatan gel
pada surimi. Penambahan gelatin ikan dapat meningkatkan kualitas gel Alaska Pollock(Briones et al. 2009); isolat protein kedelai 10% meningkatkan kekuatan gel silver carp yang diinkubasi pada suhu 50 °C selama 60 menit (Luo et al.
2008); penambahan kalsium klorida 0,4% meningkatkan sifat mekanis gel pada
gel surimi cumi-cumi yang berkualitas rendah (Otero et al. 2010); pada konsentrasi 1% konjak glukomanan dapat mengurangi denaturasi protein surimi
grass carpyang disimpan pada -18 °C (Xiong et al. 2009).
Senyawa fenolik merupakan senyawa yang memiliki satu atau lebih grup
hidroksil yang terikat secara langsung pada sebuah cincin aromatik fenol dalam
cincin karbon. Meskipun demikian grup hidroksil fenol dipengaruhi oleh
keberadaan cincin aromatik. Karena merupakan cincin aromatik, hidrogen dari
hidroksil fenolik bersifat labil dan membuat fenol bersifat asam lemah. Senyawa
polifenol didefinisikan sebagai senyawa yang memiliki grup hidroksil fenolik
lebih dari satu yang melekat pada satu atau lebih cincin benzena (Vermerris dan
Nicholson 2009). Polifenol terdistribusi luas sebagai komponen minor tetapi
berfungsi penting pada jaringan tanaman, berada pada jaringan yang keras atau
kaku misalnya pada sekam dari butir-butir sereal, dinding sel buah (apel, anggur),
biji kopi, daun teh dan umbi akar (kentang) (Naczk dan Shahidi 2004 diacu dalam
Balange dan Benjakul 2009a).
Oksidasi senyawa fenolik dapat menghasilkan kuinon (Balange 2009).
Autooksidasi mengacu pada pembentukan struktur ikatan silang (cross-linked) sebagai akibat dari terpapar cahaya dan oksigen. Di bawah pengaruh cahaya,
oksigen dapat memisahkan proton dan menghasilkan radikal. Hal ini mungkin
terjadi jika proton berdekatan dengan ikatan rangkap, karena elektron radikal
dapat terdelokalisasi sehingga menurunkan energi. Mengingat sifat aromatiknya,
senyawa fenolik mudah teroksidasi secara otomatis. Radikal yang dihasilkan
kemudian dapat bereaksi dengan radikal lain untuk membentuk dimer (Vermerris
dan Nicholson 2009). Kuinon dapat membentuk sebuah dimer dalam satu sisi
reaksi atau bereaksi dengan asam amino atau dengan sisi rantai sulfhidril dari
polipeptida untuk membentuk kovalen ikatan C-N atau C-S dengan regenerasi
hidrokuinon. Selanjutnya bisa direoksidasi dan mengikat polipeptida dengan
cepat menghasilkan sebuah ikatan silang (Balange dan Benjakul 2009a).
Penggunaan komponen fenolik teroksidasi sebagai bahan untuk
meningkatkan kekuatan gel pada surimi telah dilakukan pada surimi dari ikan
kembung dan ikan mata besar. Penambahan komponen asam ferulat, asam kafeat,
0,15%, 0,05% dan 0,05% pada surimi ikan mata besar menunjukkan peningkatan
gel yang signifikan dibanding kontrol (Balange dan Benjakul 2009a). Pada ikan
berdaging merah misalnya kembung (Rastrelliger kanagurta) penambahan komponen fenol teroksidasi meningkatkan breaking force hingga 70,3% dibanding kontrol (Balange dan Benjakul 2009b). Penambahan asam tanat
teroksidasi sampai 0,2% menunjukkan pembentukan agregasi natural actomiosin
(NAM) ketika diinkubasi pada temperatur 40 °C (Balange Benjakul 2009c).
Balange dan Benjakul (2009c) melaporkan bahwa komponen fenolik bereaksi
dengan protein menghasilkan ikatan silang sehingga mampu meningkatan
kekuatan gel dari surimi.
Tanin merupakan komponen fenolik yang terdapat pada kulit dan buah
beberapa tanaman. Ekstraksi tanin pada kayu kiam telah digunakan untuk
meningkatkan kekuatan gel surimi ikan mackerel. Konsentrasi 0,30% tanin kayu
kiam yang dikestrak dengan air meningkatkan breaking force 134,81% dan
deformation 52,6%, sedangkan pada konsentrasi 0,15% tanin yang diekstrak dengan etanol meningkatkan breaking force dan deformation masing masing 136,09% dan 54,96% (Balange 2009). Daun teh dikenal mengandung komponen
fenolik yang cukup tinggi. Bajaj dan Devsharma (1977) melaporkan bahwa daun
teh hijau mengandung tanin 23%. Teh banyak dimanfaatkan sebagai minuman
kesehatan dengan aktivitas antioksidan tinggi terutama yang dimanfaatkan adalah
pucuk daunnya, sedangkan daun teh tua belum banyak dimanfaatkan.
Penggunaan ekstrak tanin pada daun teh sebagai agen pembentuk ikatan silang
dengan protein ikan belum dilakukan.
1.2 Perumusan Masalah
Permasalahan ketersediaan bahan baku pada pembuatan surimi di Indonesia
disebabkan oleh menurunnya jumlah ikan hasil tangkapan akibat overfishing. Selain itu ikan yang berasal dari laut bersifat musiman, sehingga stock untuk
bahan baku tergantung dari musim ikan yang ada. Sekarang ini budidaya ikan air
tawar terus ditingkatkan di Indonesia sehingga produksinya semakin meningkat.
Oleh arena itu penggunaan ikan air tawar hasil budidaya sebagai bahan baku
Jepang dan Cina mulai mengembangkan surimi dari beberapa ikan air tawar hasil
budidaya misal ikan mas dan nila.
Dibandingkan dengan ikan air laut, tekstur ikan air tawar lebih berair,
sehingga untuk bahan baku surimi diperlukan cara pengolahan yang baik untuk
meningkatkan kualitas gelnya. Lele salah satu jenis ikan air tawar yang
produksinya cukup melimpah sehingga dapat digunakan sebagai alternatif bahan
baku surimi. Namun pembuatan surimi dari ikan tersebut belum banyak dikaji.
Sebagai usaha untuk meningkatkan kualitas surimi telah dikembangkan
teknologi ingredientmisalnya penambahan air, pati, protein additive, hidrokoloid dan komponen bahan kimia food grade (Park 2000); komponen fenol teroksidasi (Balange dan Benjakul 2009a). Penambahan komponen fenolik teroksidasi pada
surimi telah dikaji pada beberapa spesies ikan laut yakni ikan kembung dan ikan
mata besar. Namun demikian penggunaannya pada ikan air tawar belum pernah
dilakukan. Penambahan komponen fenolik teroksidasi pada surimi ikan lele
diharapkan menjadi salah satu alternatif untuk meningkatkan kualitas gel yang
dihasilkan.
1.3 Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk memperoleh teknologi pembuatan
surimi dari ikan lele dengan penambahan komponen fenol teroksidasi untuk
peningkatan kekuatan gel. Tujuan khusus penelitian ini adalah :
(1) menentukan frekuensi pencucian terbaik dalam pembuatan surimi ikan
lele;
(2) menentukan kandungan total fenol pada ekstraksi daun teh dengan etanol
dengan ukuran serbuk yang berbeda;
(3) menentukan jenis dan konsentrasi fenolik teroksidasi yang terbaik pada
pembuatan surimi dari ikan lele.
Manfaat penelitian ini adalah dapat mengoptimalkan pemanfaatan ikan lele
menjadi produk bernilai tambah melalui teknologi pembuatan surimi. Sebagai
sumber informasi bahwa komponen fenol teroksidasi dapat digunakan untuk
1.4 Hipotesis Penelitian
Hipotesis yang akan diuji dalam penelitian ini adalah :
(1) Frekuensi pencucian berpengaruh terhadap karakteristik surimi dari
pengkomposisian ikan lele.
(2) Ukuran serbuk berpengaruh terhadap nilai kandungan fenol total daun teh
kering.
(3) Jenis dan konsentrasi komponen fenolik teroksidasi berpengaruh terhadap
2. TINJAUAN PUSTAKA
2.1 Ikan Lele Dumbo (Clarias gariepinus)
Ikan lele memiliki bentuk tubuh memanjang, agak bulat, kepala gepeng,
tidak bersisik, mempunyai 4 pasang kumis, mulut besar, warna kelabu sampai
hitam (Gambar 1). Lele dumbo banyak ditemukan di rawa-rawa dan sungai di
Afrika, terutama di dataran rendah sampai sedikit payau. Ikan ini mempunyai
alat pernapasan tambahan yang disebut arborescent, sehingga mampu hidup dalam
air yang oksigennya rendah. Lele dumbo termasuk ikan karnivora, namun pada
usia benih lebih bersifat omnivora. Induk lele dumbo sudah dapat dipijahkan
setelah berumur 2 tahun dan dapat memijah sepanjang tahun (Margolang 2009).
Klasifikasi ikan lele menurut Beaufort (1965) diacu dalam Suyanto (1999)
adalah sebagai berikut :
Filum : Chordata
Subfilum : Vertebrata
Kelas : Pisces
Subkelas : Teleostei
Ordo : Ostariophysi
Subordo : Siluroidea
Famili : Clariidae
Genus : Clarias
Spesies : Clarias gariepinus
Lele merupakan jenis ikan konsumsi air tawar dengan tubuh memanjang
lain: ikan kalang (Padang), ikan maut (Gayo, Aceh), ikan pintet (Kalimantan Selatan), ikan keling (Makasar), ikan cepi (Bugis), ikan lele atau lindi (Jawa
Tengah). Sedang di negara lain dikenal dengan nama mali (Afrika), plamond
(Thailand), ikan keli(Malaysia), gura magura (Srilangka), ca tre trang (Jepang). Dalam bahasa Inggris disebut pula catfish, siluroid, mudfish dan walking catfish
(Prihatman 2000).
Ikan lele tidak pernah ditemukan di air payau atau air asin. Habitatnya di
sungai dengan arus air yang perlahan, rawa, telaga, waduk, sawah yang tergenang
air. Ikan lele bersifat noctural, yaitu aktif bergerak mencari makanan pada malam
hari. Pada siang hari, ikan lele berdiam diri dan berlindung di tempat-tempat
gelap. Di alam ikan lele memijah pada musim penghujan (Prihatman 2000).
Olayemi et al. (2011) melaporkan bahwa ikan lele dumbo (Clarias gariepinus) segar dengan ukuran rata-rata 332,48 gram mempunyai kandungan air 78,7%; protein 16,24%; lemak 0,5%; abu 1,33% dan karbohidrat 0,92%. Ikan lele
ini termasuk dalam kategori berprotein tinggi (15-20%) dan berlemak rendah
(<5%).
2.2 Struktur Daging Ikan
Daging ikan dibagi menjadi tiga tipe yaitu daging yang bergaris
melintang/lurik, daging polos dan otot jantung. Daging ikan hampir seluruhnya
terdiri dari daging bergaris melintang yang dibentuk oleh serabut-serabut daging.
Daging ikan bergaris melintang dibagi menjadi dua berdasarkan warnanya yaitu
daging putih dan daging merah (Adawayah 2008).
Warna merah pada daging ikan disebabkan adanya gurat sisi (lateral line)
yang padat saraf. Saraf tersebut dilapisi dengan lemak dan dialiri
pembuluh-pembuluh darah dan banyak mengandung lemak serta mioglobin. Perbedaan
warna pada daging ikan disebabkan adanya kandungan pigmen daging yang
dikenal dengan mioglobin (Adawayah 2008).
Otot/daging yang terletak di bagian punggung dan perut, merupakan
jaringan pengikat yang terbanyak, dan tersusun oleh segmen-segmen yang disebut
miomer atau miotoma yang tampak seperti garis-garis zigzag. Miotoma
sebenarnya merupakan jaringan pengikat, sedangkan miosepta adalah jaringan
miotoma-miotoma. Penyusun miotoma adalah satu bendel daging yaitu
endomiosin yang merupakan sel otot/daging ikan. Satu sel daging ikan tersusun
oleh benang-benang halus yang disebut miofibril. Antara miofibril satu dengan
lainnya terdapat cairan sel yang disebut sarkoplasma (Hadiwiyoto 1993).
2.3 Protein Ikan
Protein ikan, misal kebanyakan otot daging bahan pangan lainnya
diklasifikasikan menjadi tipe sarkoplasma, miofibril, dan stroma. Protein
sarkoplasma, terutama albumin menyusun kira-kira 30% dari total protein otot.
Proporsi sarkoplasma yang besar tersebut tersususun atas haemoprotein. Daging
anjing laut terdiri dari 10% mioglobin dan haemoglobin, akibatnya dagingnya
berwarna sangat gelap. Protein miofibril dalam daging terdiri dari miosin, aktin,
aktomiosin dan troponin dan berjumlah 40-60% dari kandungan total protein ikan.
Protein otot yang terakhir adalah stroma yang merupakan penyusun bahan
kolagen (Shahidi dan Botta 1994).
2.3.1 Sarkoplasma
Protein sarkoplasma terdiri dari protein larut air yang disebut miogen.
Protein ini dapat diperoleh dengan cara yang sederhana yaitu dengan melakukan
pressing pada daging ikan atau melalui ekstraksi dengan larutan garam berkekuatan ion rendah. Kandungan protein sarkoplasma pada ikan bervariasi
tergantung pada spesies ikan, tetapi pada umumnya lebih tinggi pada ikan pelagis
misalnya sarden dan mackerel, dan rendah pada ikan demersal misal ikan kakap
(Suzuki 1981). Keberadaan jumlah mioglobin, haemoglobin, dan cytochrome C
yang lebih besar pada daging merah menyebabkan kecenderungan daging
berwarna lebih gelap. Lebih jauh lagi, spesies ikan dari perairan/laut dingin
mengandung protein dengan karakteristik tertentu yang berfungsi sebagai protein
antibeku (antifreeze protein) dan glikoprotein yang termasuk dalam grup sarkoplasma (Shahidi dan Botta 1994).
Protein sarkoplasma kebanyakan mempunyai berat molekul yang rendah,
pH isoelektrik yang tinggi dan struktur yang globular. Karakteristik fisik tersebut
kemungkinan bertanggung jawab terhadap kelarutan protein yang tinggi pada air
bertanggung jawab terhadap proses pembusukan ikan setelah mati. Enzim ini
terdiri dari golongan enzim glikolisis dan hidrolisis. Berbagai enzim proteinase
ditemukan pada fraksi sarkoplasma yang mungkin bertindak sebagai katalisator
dalam degradasi komponen nitrogen jaringan daging. Aktivitas enzim ini
tergantung pada spesies ikan, tipe jaringan otot, faktor musim, dan lingkungan
(Shahidi dan Botta 1994).
Konformasi, denaturasi termal, dan sifat reologi dinamis protein
sarkoplasma sangat dipengaruhi oleh pH. Protein sarkoplasma ikan patin
mengalami unfolding dan terkena residu hidrofobik lebih besar pada pH yang sangat basa (10-12) dibandingkan pada pH asam (pH 2-3). Interaksi hidrofobik
protein sarkoplasma meningkat pada pH sangat asam (pH 2-4). Selain itu,
pembentukan ikatan disulfida sangat baik pada kondisi asam (pH 2-4) maupun
basa (pH 10-12). Denaturasi panas protein sarkoplasma pada pH 7,0 terjadi pada
suhu yang relatif tinggi 67,7 dan 85,8 °C (Tadpitchayangkoon 2010).
2.3.2 Protein miofibrilar
Protein miofibrilar adalah protein yang membentuk miofibril yang terdiri
dari miosin, aktin dan protein regulasi misal tropomiosin, troponin dan aktinin
(Suzuki 1981). Menurut Nakai dan Modler (2000), berdasarkan peranannya
dalam fisiologis dan struktur jaringan hidup, protein miofibril dapat dibagi
menjadi 3 kelompok yaitu:
1) Protein kontraktil utama, termasuk di dalamnya adalah miosin dan aktin yang
bertanggung jawab secara langsung pada kontraksi otot dan sebagai
rangka/kekuatan bagi protein miofibril.
2) Protein regulasi, terdiri dari tropomiosin, troponin kompleks dan beberapa
protein minor lainnya yang terlibat dalam inisiasi dan kontrol pada kontraksi.
3) Protein sitoskeletal/rangka, termasuk diantaranya titin atau konektin,
C-protein, desmin dan beberapa komponen minor lainnya, protein ini
menyediakan struktur pendukung dan bisa berfungsi untuk menjaga deretan
miofibril.
Kandungan potein miofibrilar sebesar 66-77% dari total protein daging
ikan dan berperan penting dalam pembentukan gel dan koagulasi ketika daging
lebih tinggi dibandingkan daging mamalia (Suzuki 1981). Protein ini dapat
diekstrak dari ikan dengan menggunakan larutan garam dengan kekuatan ion
0,3-1 Debye. Protein miofibrilar mengalami perubahan selama proses rigor
mortis, resolusi rigor mortis dan penyimpanan beku dalam waktu yang lama.
Tekstur produk perikanan dan kemampuan pembentukan gel pada daging lumat
dan surimi juga dipengaruhi oleh kondisi tersebut (Shahidi dan Botta 1994).
Protein miofibril terutama terdiri dari miosin rantai berat (myosin heavy chain) (MHC) (200 kDa) dan aktin (42 kDa) serta protein kecil lainnya, misalnya α
-aktinin (100 kDa) dan tropomiosin (34 kDa) (Cao et al.2006).
2.3.2.1 Miosin
Miosin adalah fraksi protein miofibril yang paling besar pada daging ikan
dan memberi kontribusi sebesar 50-60% dari jumlah total. Molekul miosin
terdiri dari 2 rantai berat (heavy chains) (200 dan 240 kD) yang berhubungan secara non kovalen dengan 2 pasang rantai ringan (light chains) (16-28 kD) (Shahidi dan Botta 1994).
Setengah karboksil terminal dari rantai berat terdiri dari kumparan
melingkar-urutan yang membentuk homodimerizes untuk membentuk batang
yang panjang yang biasanya diakhiri dengan segmen non-heliks pendek (Hodge
et al. 1992 diacu dalam Wang 2011) dan memiliki dua kepala globular yang terpasang pada salah satu terminal yang terbentuk oleh amino-terminal MHCs
(myosin heavy chains) dan MyLCs (myosin light chains) (Wang 2011). Gambar 2 menjelaskan molekul miosin yang terdiri dari rantai ringan LMM (light meromyosin) dan rantai berat HMM (heavy meromyosin).
Pemecahan myosin heavy chain (MHC) diketahui sebagai penyebab utama fenomena modori (degradasi gel pada produk jeli ikan yang disebabkan oleh suhu
sekitar 55 °C. Myiosin heavy chain berperan penting dalam pembentukan gel. Degradasi MHC biasanya disebabkan oleh enzim endogenous proteinase.
Myiosin heavy chain lebih mudah terdegradasi oleh endogenous proteinase dibandingkan protein miofibril yang lain (Cao et al.2006).
2.3.2.2 Aktin
Aktin menyusun kurang lebih 22% dari massa miofibril dengan berat
molekul 42.000 dalton. Biasanya, dalam jaringan otot aktin dikaitkan dengan
troponin dan tropomiosin kompleks. Protein miofibrilar ini juga terdiri dari
sebuah sisi pengikat miosin (miosin binding site), yang memungkinkan untuk membentuk kompleks miosin yang bersifat sementara selama kontraksi otot atau
kompleks aktin miosin yang permanen selama rigor mortis di dalam post mortem
(Xiong 1997 diacu dalam Balange 2009). Bentuk monomer aktin disebut G-aktin
dan setelah polimerisasi, filamen aktin terbentuk dan disebut sebagai F-aktin. Dua
F-aktin dalam bentuk heliks disebut super heliks (Foegeding et al. 1996 diacu dalam Balange 2009).
Di dalam otot, aktomiosin berada dalam bentuk aktin dan miosin. Aktin
dan miosin mudah diekstrak dari daging ikan dengan larutan garam karena
keduanya bergabung membentuk aktomiosin di dalam larutan (Suzuki 1981).
Yongsawatdigul dan Sinsuwan (2007) melaporkan bahwa gelasi aktomiosin ikan
nila dipengaruhi oleh ion Ca2+ melalui 2 cara yang berbeda. Pertama, Ca2+
mengaktifkan endogenous TGase yang mendorong pembentukan ikatan silang ε-(γ-glutamil)lisin. Kedua, Ca2+ menyebabkan struktur aktomiosin terbuka (unfolding myosin) dan mengakibatkan meningkatnya permukaan hidrofobik. Keduanya berperan penting dalam pembentukan gel pada suhu seting 40 °C dan
meningkatkan tekstur gel pada ikan.
2.3.3 Stroma
Sebagaimana protein miofibrilar, protein stroma juga merupakan protein
struktural dan terdiri dari jaringan yang menghubungkan sel otot, bundel serat dan
otot. Protein ini juga menyediakan struktur pendukung dalam pembentukan
Residu dari ekstraksi protein sarkoplasma dan miofibril adalah stroma yang
terdiri dari kolagen dan elastin pada jaringan ikat. Stroma larut dalam larutan HCl
dan NaOH dan memberi kontribusi 10% dari protein kasar (crude muscle protein). (Shahidi dan Botta 1994). Stroma ini sering disebut protein jaringan pengikat
yang banyak terdapat pada miosepta dan endomiosin, tetapi ada pula yang
terdapat pada sarkolema atau bagian-bagian tubuh yang lain tapi jumlahnya tidak
banyak. Kolagen dan elastin merupakan protein jaringan pengikat yang berguna
untuk mempertahankan struktur fisik. Jika kolagen dipanaskan dalam air, maka
kolagen dapat berubah menjadi gelatin. Penyusun kolagen adalah asam-asam
amino penyusun protein, tetapi tidak mengandung triptopan, sistin dan sistein.
Meskipun demikian protein stroma tidak larut walaupun dalam cairan berkekuatan
ion tinggi. Protein stroma banyak terdapat pada daging merah daripada daging
putih (Hadiwiyoto 1993).
Kandungan kolagen tergantung pada spesies, kebiasaan makan dan tingkat
kematangan ikan. Pada umumnya, daging ikan terdiri dari 0,2 sampai 2,2%
kolagen (Sato et al. 1986 diacu dalam Shahidi dan Botta 1994). Meskipun kandungan kolagen yang lebih tinggi akan memberi kontribusi pada kekerasan
daging, namun pada ikan tidak cukup berarti. Akan tetapi, pada beberapa spesies
cumi-cumi dapat meningkatkan tekstur keras dan kenyal pada proses pemanasan
(Shahidi dan Botta 1994).
2.4 Sifat Fungsional Protein
Protein adalah komponen fungsional dasar dari berbagai produk olahan
makanan yang berprotein tinggi dan menentukan sifat tekstur, sensorik dan nutrisi
bahan pangan. Bahan pangan menghasilkan berbagai jenis protein yang berbeda
struktur, sifat fisik, kimia dan fungsionalnya serta derajat sensitifnya terhadap
panas dan perlakuan lainnya. Sifat fungsional protein merupakan sifat fisikokimia
protein yang mempengaruhi perilaku di dalam sistem bahan pangan selama
persiapan, proses, penyimpanan, konsumsi dan menyumbangkan sifat kualitas dan
sensorik pada sistem bahan pangan. Sifat fungsional protein yang paling penting
dalam aplikasi pangan adalah hidrofilik, contohnya kelarutan protein, swelling
(gelling capacity); hidrofilik-hidrofobik, contohnya emulsifikasi dan foaming; hidrofobik, contohnya fat binding properties(Zayas 1997).
Sifat fungsional protein dapat diartikan sebagai sifat fisikokimia protein
selama proses yang mempengaruhi kualitas dan stabilitas produk akhir makanan.
Pada proses pengolahan daging, fungsionalitas protein biasanya dijelaskan dalam
istilah hidrasi, sifat permukaan, ikatan dan kinerja rheologi. Sifat fungsional
protein ini ditentukan oleh interaksi antara protein, lemak, air dan komponen
makanan lainnya atau oleh faktor lingkungan. Kemampuan untuk membentuk gel
yang kompak dan untuk mengemulsi lemak adalah dua hal terpenting dalam sifat
fungsional protein pada proses pengolahan makanan yang berbahan baku daging
(Nakai dan Modler 2000).
2.4.1 Pembentukan gel/gelasi (gelation)
Kemampuan pembentukan gel (gelling capacity) protein bahan pangan merupakan sebuah atribut fungsional yang penting dalam produksi makanan.
Gelling capacity adalah kriteria yang sering digunakan untuk mengevaluasi protein makanan. Karakteristik dari beberapa bahan pangan khususnya tekstur
dan juicinessditentukan oleh kemampuan pembentukan gel (gelling capacity) dari protein (Zayas 1997).
Pembentukan struktur gel protein dapat terjadi di bawah kondisi yang
mengganggu struktur protein alami yang tersedia dimana konsentrasi protein,
kondisi termodinamika dan kondisi lainnya optimal untuk pembentukan matriks
tersier. Teknik proses pangan yang paling penting berhubungan dengan gelasi
protein melibatkan kation divalent (kalsium) dan atau perlakuan panas. Gel akan
terbentuk ketika sebagian dari protein terbuka/tidak terlipat (unfolded) menjadi ruas-ruas polipeptida yang tidak berbelit (uncoiled) kemudian bereaksi pada titik tertentu membentuk sebuah jaringan ikatan silang tiga dimensi. Sebagian protein
yang tidak berlipat (unfolding) dengan sedikit perubahan struktur sekunder diperlukan untuk pembentukan gel/gelasi. Terbentuknya bagian yang tidak
terlipat dari struktur alaminya bisa berhubungan dengan beberapa faktor,
pemanasan dan perlakuan asam, basa dan urea (Zayas 1997).
Gelasi protein adalah proses fisikokimia yang terjadi karena interaksi
dihasilkan jaringan tiga dimensi viskoelastis yang mampu menahan air dalam
jumlah besar. Gelasi protein daging biasanya disebabkan oleh panas, sebagai
contoh terjadi pada proses pengolahan daging selama pemasakan dan didahului
dengan pendinginan. Pembentukan matriks gel hasil dari ikatan silang atau
agregasi dari polipeptida yang tidak terlipat melalui interaksi hidrofobik dan
elektrostatik, jembatan/ikatan disulfida dan ikatan hidrogen (Nakai dan Modler
2000).
Proses gelasi tergantung pada pembentukan jaringan tiga dimensi protein
sebagai hasil interaksi antara protein dengan protein dan protein dengan pelarut
(solvent). Interaksi dan gelasi ini dipercepat pada konsentrasi protein yang tinggi karena kontak intermolekuler lebih kuat. Gel dengan kekuatan dan stabilitas yang
tinggi dapat dibentuk sebagai hasil ikatan silang yang memberikan sifat fluiditas,
elastisitas dan aliran gel. Pembentukan gel adalah sebuah hasil dari ikatan
hidrogen, interaksi hidrofobik dan ionik, kekuatan Van der Waals dan ikatan
kovalen disulfida (Zayas 1997).
Struktur gel protein bertanggung jawab pada pola pemecahan yang disebut
sebagai tekstur makanan. Misalnya, kekerasan (hardness), dianggap sebagai kekuatan menggigit yang diperlukan untuk menyebabkan suatu bahan menjadi
patah merupakan atribut sensorik umum pada makanan dengan struktur gel, misal
keju, makanan penutup berbahan gelatin, tahu dan daging olahan (surimi, sosis
dan lain-lain). Fungsionalitas protein untuk gelasi terdiri dari a) kondisi untuk
gelasi termasuk konsentrasi protein dan faktor-faktor untuk meningkatkan
interaksi antarmolekul; b) interaksi protein dengan komponen lain misal polimer
di atas atau di bawah binodal; dan c) interaksi protein dan protein yang mengarah
ke fase mikro atau sistem fase tunggal. Kondisi tersebut tergantung pada ukuran
dan bentuk protein, titik isoelektrik, jenis interaksi antarmolekul dan distribusi
struktural bermuatan, asam amino hidrofobik dan lainnya, serta kondisi pelarut
(Foegeding dan Davis 2011).
Gelasi adalah sifat fungsional penting dari protein ikan yang
mempengaruhi sifat rheologi dan tekstur produk perikanan. Pembentukan gel
melibatkan denaturasi parsial protein diikuti dengan agregasi ireversibel yang
otot dan berperan penting dalam pembentukan gel pada ikan dan produk daging.
Selama pemanasan pada kecepatan 1 °C/menit, miosin silver carp
(Hypophthalmichthys molitrix) membentuk gel hanya pada pH 5,5-7,5, tetapi tidak pada pH 8,0 dan pH 9,0. Ketika pH dinaikkan, kecepatan gelasi dan
kekuatan gel menurun dan WHC meningkat. Pemanasan menyebabkan
transformasiα-heliks menjadi β-sheet dan β-turn. Transformasi berperan penting
dalam proses gelasi. Gel kompak dan seragam diperoleh pada pH 7,0 sementara
terjadi penurunan dalam susunan tiga dimensi ketika pH diubah (Liu et al.2010).
2.4.2 Water holding capacity(WHC)
Water holding capacity (WHC) atau kapasitas mengikat air pada makanan dapat diartikan sebagai kemampuan untuk menahan air yang ada di
dalam makanan tersebut maupun yang ditambahkan selama aplikasi gaya,
tekanan, sentrifugasi atau panas.Water holding capacitymerupakan sifat fisik dan kemampuan suatu struktur makanan untuk mencegah air terlepas dari struktur tiga
dimensi protein dan merupakan kemampuan protein menahan air dalam melawan
gaya berat secara fisika maupun fisikokimia (Zayas 1997).
Mekanisme WHC berpusat pada protein dan struktur yang mengikat dan
memerangkap air, khususnya protein miofibril. Terdapat bukti nyata yang
menunjukkan efek langsung dari pH, kekuatan ionik, dan oksidasi pada
kemampuan protein miofibril dan sel-sel otot untuk menahan air. Secara bebas,
jelas bahwa faktor yang sama (penurunan pH, kekuatan ionik, oksidasi) juga
mempengaruhi proteolitis protein sitoskeletal kunci dalam post mortem otot.
Variasi WHC pada pH dan suhu penyimpanan sebagian disebabkan oleh variasi
proteolisis dan berakibat pada penyusutan sel otot serta mobilisasi air ke ruang
ekstraseluler (Lonergan dan Lonergan 2005).
2.5 Surimi
Surimi adalah daging ikan yang dihilangkan kulit, tulang dan isi perut
secara mekanis yang dicuci dengan air atau larutan garam pada suhu 5-10 °C dan
dengan penambahan cryoprotectant (Lee 1984 diacu dalam Shahidi dan Botta 1994). Pembuangan protein larut air termasuk enzim, haemoprotein dan
50-60%. Kandungan bahan kolagen sebagaimana protein miofibril kandungannya
lebih besar pada surimi dibandingkan pada daging ikan. Meskipun demikian,
komposisi asam amino surimi yang dihasilkan kemungkinan sama dengan bahan
awal sebagaimana dilaporkan pada surimi dari anjing laut (Synowiecki et al.1992 diacu dalam Shahidi dan Botta 1994).
Surimi dapat diproduksi dari ikan air laut maupun ikan air tawar,
termasuk daging putih maupun daging merah misalnya Alaska pollock, blue whiting, croaker, beloso, sardin, nila dan mata besar. Biasanya spesies tertentu yang digunakan karena alasan mudah penangkapannya dan murah harganya.
Penggunaan spesies alternatif untuk memperoleh surimi dengan kualitas
pembentukan gel yang baik merupakan salah satu tujuan industri perikanan
(Nopianti et al.2011).
Industri surimi dunia terutama menggunakan ikan Alaska pollock untuk produksi surimi, yang mencapai 50-60% produksi total surimi dunia, tetapi
proporsi tersebut secara berkelanjutan berkurang. Sejak tahun 1991, usaha untuk
menggunakan spesies lain telah sukses dilakukan dengan pengembangan teknik
dan pemasaran di Jepang. Sekarang ini, sejumlah spesies yang berbeda telah
digunakan dalam produksi surimi secara komersial. Spesies ikan yang paling
cocok untuk pembuatan surimi adalah ikan daging putih dengan kandungan lemak
rendah (Park dan Morrissey 2000).
Permintaan dunia akan protein ikan meningkat lebih cepat dibandingkan
persediaan sumberdaya yang ada. Permintaan tersebut menyebabkan overfishing,
terlebih pada spesies yang biasa digunakan sebagai bahan baku surimi oleh sebab
itu dibutuhkan campur tangan pemerintah untuk mencegah eksploitasi berlebihan
spesies tersebut. Spesies ikan daging merah mencapai 40-50% dari total
tangkapan dunia. Hal tersebut menimbulkan ketertarikan untuk menggunakan
spesies ini yang jumlahnya cukup besar, harganya murah, berlemak dan
merupakan ikan pelagik yang cukup tersedia untuk pangan manusia. Namun
demikian diperlukan cara dan biaya yang efektif untuk meningkatkan kualitas
bahan (Park dan Morrissey 2000).
Metode pembuatan surimi beku menurut Suzuki (1981) terdiri dari
daging ikan, pencucian dengan air dan pembuangan air, penyaringan dan
pelumatan, penambahan anti denaturasi, pengemasan, pembekuan dan
penyimpanan.
Teknologi surimi telah berkembang secara luas. Berbagai usaha nyata
telah dilakukan untuk mengembangkan produk baru, misalnya teknologi baru
untuk penanganan air limbah; penggunaan spesies lain; pengawetan produk
berbasis surimi; penggunaan berbagai cryoprotectant dan peningkatan pembentukan gel (Nopianti et al.2011).
2.5.1 Standar kualitas surimi
Kualitas produk surimi terjamin oleh standar praktis masing-masing
perusahaan sesuai dengan spesifikasi yang diinginkan konsumen/pelanggan.
Produsen dan konsumen bekerja sama untuk memastikan kualitas surimi yang
diinginkan. Banyak pelanggan melakukan inspeksi dan audit langsung pada
pemasok. Praktek ini rutin dilakukan dalam industri dan termasuk fokus pada
traceabilitydari semua produk (Anonim 2012).
Dari berbagai review yang telah dipublikasikan menunjukkan kriteria
mutu surimi diantara perusahaan di Jepang tidak seragam. Terdapat dua asosiasi
besar di Jepang yang mempunyai standar surimi berbeda yaitu All-Japan Frozen
Fish Meat Association (AJFFMA) dan Hokaido Surimi Association (HSA).
All-Japan Frozen Fish Meat Association (AJFFMA) membagi mutu surimi menjadi
6 kelas sedangkan HSA 4 kelas. Kadar air surimi yang ditetapkan oleh standar
AJFFMA adalah 79-82%, sedangkan HSA 75-78%. Alasan perbedaan kadar air
tersebut kemungkinan disebabkan perbedaan jumlah cryoprotectant yang ditambahkan yaitu 5% untuk skala AJFFMA dan 10% untuk skala HSA (Lanier
1992).
Kriteria untuk penentuan kelas mutu surimi yang diproduksi di laut
maupun di darat telah ditetapkan oleh Surimi Workshop di Seattle pada tahun
1984. Tingkatan standar mutu kualitas surimi berdasar pengujian kamaboko
Tabel 1 Standar mutu surimi berdasar pengujian kamaboko
Tingkatan Mutu (Grade)
Dengan penambahan pati Tanpa penambahan pati
Kekuatan
1 >900 10 >60 >680 10 >46
2 >900 10 >59 >680 10 >45
3 >850 >8,5 >58 >640 8,5 >43
4 >700 >7,5 >55 >520 7,5 >38
5 >600 >7,0 >52 >440 7,0 >35
6 >450 >6,5 >50 >310 6,5 >32
Sumber : Lanier (1992)
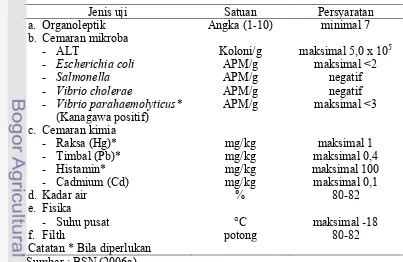
Spesifikasi mutu surimi beku di Indonesia ditetapkan oleh Badan Standar
Nasional (BSN) dengan menyusun Standar Nasional Indonesia tentang surimi
beku (SNI 01-2694.1-2006) yang merupakan revisi SNI 01-2694-1992.
Penyusunan standar tersebut dalam rangka memberikan jaminan mutu dan
keamanan pangan komoditas ikan segar yang akan dipasarkan di dalam dan di
luar negeri (BSN 2006a). Spesifikasi standar surimi beku SNI 01-2694.1-2006
tidak menetapkan kekuatan gel sebagai salah satu jenis uji dalam persyaratan
mutu. Persyaratan mutu dan keamanan pangan surimi beku berdasarkan
SNI 01-2694.1-2006 disajikan pada Tabel 2.
Tabel 2 Persyaratan mutu dan keamanan pangan surimi beku
Jenis uji Satuan Persyaratan
a. Organoleptik Angka (1-10) minimal 7
b. Cemaran mikroba
- Suhu pusat °C maksimal -18
f. Filth potong 80-82
2.6 Faktor yang Berpengaruh pada Kualitas Surimi 2.6.1 Spesies
Sifat fungsional dan komposisi surimi sangat beragam tergantung pada
spesies yang digunakan. Sifat fungsional surimi tergantung dari komposisi tetapi
tidak dapat secara umum diprediksi melalui analisis komposisi. Oleh sebab itu
pengolah harus memahami hubungan antara fungsi fisikokimia ikan dan sifat
fungsional dan komposisi surimi (Park dan Morrissey 2000).
Surimi dari beberapa ikan tropis misalnya threadfin bream (Nemipterus bleekeri), big eye snapper (Priacanthus tayenus), baracuda (Sphyraena jello) dan
bigeye croacker(Pennahai macrophthalamus) mempunyai sifat gel yang berbeda ketika dilakukansettingpada suhu medium (Benjakul et al. 2003).
Surimi dari ikan berdaging merah atau berlemak tinggi misalnya sarden,
kembung dan salmon memerlukan tahapan tertentu untuk menghilangkan
pengaruh minyak dan hemeprotein (mioglobin dan hemoglobin). Pada pembuatan
surimi dari daging merah dianjurkan menambahkan NaHCO3 0,1-0,5% pada
proses awal pencucian (Park dan Morrissey 2000).
Fukuda et al. (2001) melaporkan surimi dari ikan air tawar antara lain silver carp(Hypopthalmichthys molitri),big head carp(Aristichthys nobilis), grass carp
(Ctenopharyngodon idellus), common carp(Cyprinus carpio), blunt snout bream
(Megalobrama amblycephala), chinnese snake head (Ophicephalus argus) dan nila (Tilapia nilotica) mempunyai nilai kekuatan gel yang berbeda.
2.6.2 Kematangan seksual atau musim
Komposisi kimia ikan bervariasi terhadap perubahan musim penangkapan.
Alaskan Fisheries Development diacu dalam Park dan Morrissey (2000)
melaporkan bahwa komposisi ikan Alaska pollockbervariasi berdasarkan musim. Hasil pengamatan menunjukkan kandungan protein tertinggi (19%) terjadi pada
bulan November dan terendah (16%) di bulan Mei, sementara kandungan air
tertinggi (82,3%) di bulan Juli dan terendah (80,2%) di bulan November.
Demikian pula terjadi pada spesies ikan yang lain misalnya Pacific waiting
dengan kandungan air tertinggi (84,5%) di bulan April dan terendah (80-82%) di
akhir bulan Oktober. Protein terendah (14-15%) terekam pada bulan April
lemak cenderung stabil (0,5-1,5%) sampai bulan Agustus dan mulai meningkat
(1,5-2,5%) di bulan Oktober (Park dan Morrissey 2000).
Secara umum, ikan yang dipanen selama periode mencari makan
menghasilkan kualitas surimi tertinggi. Selama musim tersebut daging ikan
mengandung air dan pH terendah namun kandungan protein tertinggi, sedangkan
ikan yang dipanen selama atau sesudah masa pemijahan menghasilkan surimi
dengan kualitas terendah. Pada musim tersebut kandungan pH lebih tinggi dan
cenderung mempertahankan lebih banyak air. Sebagai konsekuensinya, sukar
menghilangkan air berlebih pada proses pencucian daging. Untuk memudahkan
penghilangan air berlebih tersebut, karakteristik jaringan otot harus diubah dengan
menurunkan nilai pH atau meningkatkan salinitas pada pencucian akhir (Park dan
Morrissey 2000).
2.6.3 Kesegaran atau rigor
Kekuatan pembentukan gel surimi utamanya tergantung pada spesies dan
kesegaran ikan yang akan diproses dan keduanya saling berkaitan. Kemampuan
pembentukan gel beberapa spesies ikan menurun dengan mudah seiring dengan
penurunan kesegaran ikan bahkan tidak terbentuk gel segera setelah proses rigor
berakhir (Chen et al. 2001).
Perubahan biokimia dan biofisika selama perkembangan rigor mortis
menyebabkan perubahan yang nyata pada sifat fungsional protein otot. Ikan
sebaiknya segera diproses sesegera mungkin setelah melalui rigor. Sebelum
melewati fase ini, kurang dari 5 jam pada kasus surimi Alaska pollock sukar menghilangkan bau amis, beberapa membran dan kontaminan lainnya yang
akhirnya berpengaruh pada kualitas produk (Pigot 1986 diacu dalam Park dan
Morrissey 2000).
Kesegaran ikan dianggap sebagai faktor penting yang menentukan kualitas
surimi (Benjakulet al. 2002; MacDonald et al. 1990 diacu dalam Benjakul et al.
2005). Ikan segar atau yang disimpan dengan es biasanya digunakan untuk
produksi surimi di seluruh dunia. Akibat sebagai eksploitasi sumberdaya yang
berlebih, armada perikanan harus melakukan perjalanan jarak jauh, yang
menyebabkan bahan baku yang diperoleh berkualitas lebih rendah. Tanpa
terkait dengan degradasi dan denaturasi protein miofibril. Sebagai akibatnya,
kualitas surimi yang diperoleh rendah (Benjakul et al. 2002; Benjakulet al. 2003
diacu dalam Benjakul et al. 2005).
Chen et al. (2001) melaporkan bahwa surimi ikan silver carp dengan beberapa variasi kesegaran yang dipanaskan pada suhu 60 °C selama 10 menit,
breaking strength gel mencapai maksimum, namun nilainya menurun seiring dengan penurunan kualitas kesegaran ikan.
2.6.4 Faktor pengolahan
Faktor ekstrinsik yang berpengaruh terhadap kualitas surimi menurut Park
dan Morrissey (2000) antara lain: pemanenan dan penanganan ikan, air, waktu dan
temperatur pencucian, siklus pencucian dan rasio air pencucian, pH, dan salinitas.
Beberapa faktor di dalam penangkapan ikan dapat pula berpengaruh pada
kualitas produk akhir, termasuk kondisi cuaca di laut, metode penangkapan,
ukuran alat tangkap, pemberian garam dan temperatur ikan setelah penangkapan.
Faktor-faktor tersebut saling berkaitan dan terkadang susah untuk
mempertimbangkan pentingnya setiap faktor secara terpisah (Park dan Morrissey
2000).
Secara teoritis air dengan kesadahan rendah mengandung mineral dalam
jumlah minimal misalnya Ca2+, Mg2+, Fe2+ dan Mn2+ direkomendasikan untuk
pencucian surimi. Air dengan kesadahan tinggi dapat menyebabkan kerusakan
kualitas tekstur dan warna selama penyimpanan beku. Mineral Ca2+ dan Mg2+
bertanggung jawab pada perubahan tekstur sementara Fe2+ dan Mn2+ berpengaruh terhadap perubahan warna (Park dan Morrissey 2000).
2.7 Bahan Penguat Gel pada Surimi
Sifat fungsional utama surimi dari seafood adalah warna, rasa dan tekstur. Pengendalian warna dan rasa relatif lebih mudah, sementara penambahan aditif
yang berpengaruh terhadap sifat tekstur produk kebanyakan tidak linear, oleh
karena itu lebih susah mengendalikan tekstur dibanding lainnya.
Konsekuensinya, terdapat kisaran yang luas pada sifat tekstur ini. Bahan aditif
utama yang digunakan untuk mengembangkan dan memodifikasi karakteristik
2.7.1 Air
Penambahan air pada surimi dibutuhkan untuk menjaga penerimaan tekstur
dan meminimalkan biaya bahan baku. Sifat polar dari air menyokong gugus
residu hidrofobik di dalam rantai polipeptida yang terlipat untuk meminimalkan
entropi sebagai hasil dari terpaparnya residu hidrofobik dengan air di permukaan.
Air juga memberi kontribusi pada stabilitas konformasional molekul protein
sebelum pemanasan dan bisa menjadi dasar untuk ikatan intermolekul ketika sisi
hidrofobik pada molekul protein yang berdekatan terpapar pada permukaan
selama proses pemanasan. Dengan demikian air berfungsi untuk menyebarkan
molekul protein miofibril, sehingga memungkinkan jaringan yang lebih diperluas
untuk memperkuat bentuk ikatan protein-protein selama pemanasan (Park 2000).
Air sering kali tidak dianggap sebagai sebuah bahan makanan di beberapa
negara. Oleh karena itu, di negara-negara Asia tidak ditemukan air terdaftar
sebagai bahan di dalam label makanan. Namun di kebanyakan negara barat, air
adalah bahan terbesar kedua di dalam surimi seafood(Park 2000).
2.7.2 Pati
Pati berperan penting dalam pembentukan struktur jaringan gel surimi-pati
dan oleh karena itu pati merupakan bahan aditif fungsional penting di dalam
surimi seafood. Sumber pati yang paling umum digunakan adalah terigu, jagung, kentang, maizena jagung dan tapioka. Fungsi pati-pati tersebut berbeda. Pati
dengan amilose tinggi misalnya jagung, terigu dan kentang, membentuk gel yang
agak rapuh, sedangkan pati dengan kandungan amilopektin yang tinggi misalnya
tapioka dan maizena membentuk gel yang lekat dan kompak (Park 2000).
Pati biasa ditambahkan pada surimi untuk meningkatkan sifat tekstur dari
gel ikan. Selama gelatinisasi pati, beberapa perubahan terjadi. Perubahan ini
termasuk pembengkakan granula, pemisahan daerah kristal, meningkatnya
viskositas dan pemisahan granul. Gelatinisasi pati di dalam surimi selama proses
pemanasan telah dilaporkan dapat meningkatkan elastisitas gel. Gel daging ikan
dengan tambahan pati 0,5% menunjukkan nilai modulus yang lebih tinggi pada
suhu 80 °C dibanding pada suhu 90 °C (Kong et al. 1999).