PEMROFILAN METABOLIT TABAT BARITO
(
Ficus deltoidea
) MENGGUNAKAN UPLC-QTOF-MS/MS
NURMAIDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pemrofilan Tabat Barito (Ficus deltoidea) Menggunakan UPLC-QTOF-MS/MS adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NURMAIDA. Pemrofilan Tabat Barito (Ficus deltoidea) Menggunakan UPLC-QTOF-MS/MS. Dibimbing oleh LATIFAH K DARUSMAN dan MOHAMAD RAFI.
Ficus deltoidea dengan nama lokal tabat barito termasuk dalam famili Moraceae. Tumbuhan ini banyak mengandung senyawaan fenolik yang umumnya bersifat sebagai antioksidan. Komponen kimia yang telah teridentifikasi dalam tabat barito termasuk dalam golongan polifenol (tanin, proantosianin), flavonoid, saponin dan triterpenoid. Pada kajian ini dilakukan pemrofilan metabolit daun tabat barito dengan UPLC-QTOF-MS/MS untuk mengidentifikasi senyawa-senyawa fenolik didalamnya. Kami menggunakan dua cara ekstraksi yaitu maserasi dan ultrasonikasi dengan dua pelarut yang berbeda yaitu metanol dan etanol untuk mengekstrak komponen kimia dalam tabat barito. Sebagai data tambahan kami juga melakukan pengujian kapasitas antioksidan dari masing– masing ekstrak yang dibuat dan kaitannya dengan jumlah metabolit yang terekstrak.
Sampel daun tabat barito yang digunakan berasal dari Desa Cikaniki Gunung Halimun, Jawa Barat. Teknik ekstraksi maserasi dengan metanol (MM), maserasi etanol (ME), ultrasonikasi metanol (UM) dan ultrasonikasi etanol (UE) digunakan untuk mengekstrak dan mengetahui keragaman metabolit pada daun F. deltoidea. Penentuan aktivitas antioksidan menggunakan metode 2,2-difenil-1-pikrilhidrazina (DPPH).
Sebanyak 70 metabolit teridentifikasi dengan menggunakan UPLC-QTOF-MS/MS dengan mode ion negatif. Perbedaan metabolit yang terkandung dalam setiap ekstrak yang berbeda, yaitu 45 metabolit dengan MM, 64 metabolit dengan UM, 42 metabolit dengan UE dan 41 metabolit dengan ME. Enam belas senyawa metabolit dapat teridentifikasi secara tentatif lebih lanjut setelah dikonfirmasi dengan MS/MS. Senyawa-senyawa yang teridentifikasi tersebut termasuk ke dalam golongan flavonoid dan asam fenolat. Selain itu dilakukan pula pengujian aktivitas antioksidan menggunakan metode DPPH pada tiap jenis ekstrak yang dihasilkan untuk mengetahui potensi antioksidannya. Aktivitas metabolit yang teridentifikasi paling banyak terdapat pada ekstrak UM dengan nilai IC50 71.9302
ppm. Hal ini diduga karena jumlah metabolit yang teridentifikasi paling banyak terdapat pada ekstrak UM.
SUMMARY
NURMAIDA. Metabolite Profiling of Ficus deltoidea Using UPLC-QTOF-MS/MS). Supervised by LATIFAH K DARUSMAN and MOHAMAD RAFI.
Ficus deltoidea, locally known as Tabat Barito is belongs to Moraceae family. This plant contains many phenolic compounds and mostly in general exhibit antioxidants activity. The chemical components that have been identified in tabat barito are included in the polyphenols class (tannins, proantosianin), flavonoids, saponins and triterpenoid. In this study, metabolite profiling on tabat barito leaves was conducted by UPLC-QTOF-MS/MS to identify its phenolic compounds. We used maceration and ultrasonication methods and methanol and ethanol solvents to extract the chemical components in the tabat barito leaves. As an additional data we also tested the antioxidant capacity of each extract created and its connection with a number of metabolites extracted.
Tabat barito leaves samples was obtained from Cikaniki village, Mount Halimun Sukabumi National Park. Extraction by maceration technique with methanol (MM) and; ethanol (ME) also by; sonication technique with methanol (UM) and ethanol (UE) were used to extract the tabat barito metabolites.
A total of 70 metabolites were identified by using UPLC-QTOF-MS/MS with negative ion mode. There are different amounts of metabolites contained in each extract, 45 metabolites in MM, 64 metabolites in UM, 42 metabolites in UE and 41 metabolites in ME. Sixteen metabolites could be further identified tentatively as confirmed by MS/MS. The identified compounds were belongs to the class of flavonoid and phenolic acid. In addition, we also conducted an antioxidant activity assay using DPPH method on each type of extract to determine its potency as antioxidant. The highest antioxidant activity is from UM with IC50 71.9302 ppm. This condition probably occured by metabolites identified
were mostly contained in UM extract.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
PEMROFILAN METABOLIT TABAT BARITO (
Ficus
deltoidea
) MENGGUNAKAN UPLC-QTOF-MS/MS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Pemrofilan Metabolit Tabat Barito (Ficus deltoidea) Menggunakan UPLC-QTOF-MS/MS
Nama : Nurmaida NIM : G451120091
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Latifah K. Darusman, MS Ketua
Dr Mohamad Rafi, MSi Anggota
Diketahui oleh
Ketua Program Studi Kimia
Prof Dr Dyah Iswantini, MAgr
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 6 November 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan YME atas segala kasih dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Judul penelitian ini adalah Pemrofilan Metabolit Tabat Barito (Ficus deltoidea) Menggunakan UPLC-QTOF-MS/MS.
Terima kasih penulis ucapkan kepada Prof. Dr. Latifah K Darusman, MS dan Dr. Mohamad Rafi, MSi selaku pembimbing, serta Rudi Heryanto, MSi, yang telah banyak memberikan saran dan masukan. Selain itu, penghargaan penulis sampaikan kepada staf Salina Febriany, S.Si, staf dan laboran Laboratorium Kimia Analitik Departemen Kimia (Nunung Nuryanti, Eman Suherman dan Edi Suhendar), yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada Alm. Bapak, Ibu, serta seluruh keluarga atas segala doa dan kasih sayangnya juga teman-teman (Dewi Angraini, Irly Ryalina, Mazdhani, Andriawan Subekti, Dhian Eka wijaya dan Wahyu Setiaji).
Semoga karya ilmiah ini bermanfaat
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 TINJAUAN PUSTAKA 2
Tabat Barito (Ficus deltoidea) 2
Ekstrasi 3
Metabolomik 4
UPLC QTOF-MS 5
Antioksidan 6
3 METODE 8
Bahan 8
Alat 8
Prosedur Analisis Data 8
4 HASIL DAN PEMBAHASAN 9
Ekstrak daun Tabat Barito 9
Aktivitas Antioksidan Tabat Barito 10
Identifikasi Komposisi daun Tabat Barito dengan UPLC-QTOF MS/MS 11
Identifikasi Golongan Flavonoid 13
Identifikasi Asam Fenolat 15
5 SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 16
LAMPIRAN 20
DAFTAR TABEL
1 Hasil kadar air dan rendemen daun tabat barito 10
2 Hasil aktivitas dengan meode DPPH 11
3 Penetapan puncak metabolit dalam ekstrak daun tabat barito 13
menggunakan LC-MSMS pada mode ionisasi negatif
DAFTAR GAMBAR
1 Daun Tabat Barito 22 Prinsip penangkapan H oleh DPPH 7
3 Kromatogram daun ekstrak dari tabat barito 13
4 Struktur flavonoid dan asam fenolat ekstrak daun tabat barito 13
5 MS/MS dari Puncak 23 ekstrak daun tabat barito(A) dan standar Luteolin 15
DAFTAR LAMPIRAN
1 Diagram alir penelitian 212 Kadar air daun tabat barito 22
3 Rendemen ekstrak daun tabat barito 23
4 Aktivitas antioksidan dan ekstrak daun tabat barito 24
5 Identifikasi metabolit ekstrak daun tabat barito pada 4 perlakuan 26
6 Identifikasi senyawa Vicenin-2 pada waktu retensi 3.91 dan 4.02 menit 27
7 Identifikasi senyawa Skaftoside pada waktu retensi 4.25 menit 28
8 Identifikasi senyawa Luteolin pada waktu retensi 6.59 menit 29
9 Identifikasi senyawa Orientin pada waktu retensi 4.39 menit 30
10 Identifikasi senyawa Viteksin pada waktu retensi 4.86 menit 31
11 Identifikasi senyawa Galokatekin pada waktu retensi 3.22 menit 32
12 Identifikasi senyawa Katekin pada waktu retensi 3.53 menit 33
1
PENDAHULUAN
Latar Belakang
Ficus deltoidea dengan nama lokal tabat barito termasuk ke dalam famili Moraceae yang banyak tumbuh di Asia Tenggara. Tanaman ini telah banyak dikaji untuk mengetahui aktivitas biologisnya seperti antioksidan (Hakiman et al. 2009, Sirisha et al. 2010, Abdullah et al. 2011), antihipertensi (Shafaei et al. 2013), antiadipogenik (Woon et al. 2013), antimikroba (Samah et al. 2012), antidiabetes (Choo et al. 2012), antikanker serviks (Mat Akhir et al. 2011), antiinflamasi (Abdullah et al. 2009) dan antiinosiseptif (Sulaiman et al. 2008). Telah diketahui bahwa tabat barito mengandung senyawaan fenolik yang umumnya bersifat sebagai antioksidan (Sirisha et al. 2010). Komponen kimia yang ada dalam tabat barito termasuk kedalam golongan polifenol (tanin, proantosianin), flavonoid, saponin dan triterpenoid (Wei et al. 2011, Woon et al. 2012, Shafaei et al. 2013). Senyawaan flavonoid yang telah teridentifikasi yaitu (-)epikatekin/(+)katekin, epiafzelekin/(+)afzelekin, (-)epigalokatekin, luteolin, apigenin (Omar et al. 2011), viteksin, isoviteksin (Choo et al. 2012) dan asam kafeat (Ramamurthy et al. 2014).
Keberadaan komponen kimia dalam suatu tanaman dapat diidentifikasi melalui pendekatan metabolomik. Kajian metabolomik dapat digunakan untuk melihat profil metabolit sekunder dalam tanaman yang umumnya berjumlah puluhan bahkan ratusan metabolit. Pemrofilan metabolit yang termasuk dalam kajian metabolomik telah banyak digunakan untuk menggambarkan profil metabolit sekunder tanpa melalui proses isolasi yang sangat panjang (Farag et al. 2014). Cara ini telah diterapkan pada tabat barito yang tumbuh di Malaysia, dimana ekstrak menggunakan air mendidih selama 1 jam dianalisis menggunakan HPLC dengan detektor PDA dan fluoresens dengan pengionisasi menggunakan ion spray dan teridentifikasi beberapa senyawa yang termasuk dalam golongan flavonoid dan proantosianidin (Omar et al. 2011). Pemrofilan metabolit juga telah dilakukan pada jenis Ficus lainnya yaitu F. lyrata dengan menggunakan UPLC-PDA-QTOF/MS, dimana ekstrak dengan teknik pengering beku menggunakan nitrogen cair selanjutnya diaduk dalam metanol 100% dan teridentifikasi senyawa golongan flavonoid, asam fenolat, asam lemak dan spingolipid (Farag et al. 2014).
2
liquid chromatography quadrupole time of flight mass spectrometry (UPLC– QTOF-MS/MS) telah dilaporkan memberikan pemrofilan yang lebih sensitif dan selektif dibandingkan dengan metode kromatografi lainnya (Grata et al. 2009). LC-MS/MS dengan penganalisis massa quadrupole time of flight (QTOF) dapat diterapkan untuk mendeteksi senyawa dengan kisaran yang luas dengan jumlah sampel yang dibutuhkan sedikit. Sebagai tambahan, QTOF-MS mengizinkan pembentukan informasi massa dengan ketelitian dan ketepatan yang tinggi sehingga penentuan kemungkinan struktur lebih sedikit. Lebih lanjut, penggunaan pemasangan QTOF-MS, dapat mengonfirmasi komponen yang belum dikenal (Li et al. 2009).
Tujuan Penelitian
Tujuan penelitian ialah menggunakan UPLC-QTOF-(MS/MS) untuk pemprofilan metabolit daun tabat barito asal Indonesia dengan dua cara ekstraksi yaitu secara maserasi dan ultrasonikasi dan dua pelarut yang berbeda yaitu metanol dan etanol 70%, untuk mengetahui banyaknya komponen kimia yang terekstrak. Sebagai data tambahan, kami juga melakukan pengujian kapasitas antioksidan dari masing–masing ekstrak yang dibuat dan kaitannya dengan jumlah metabolit yang terekstrak.
Manfaat Penelitian
Manfaat yang diperoleh dari penelitian ini adalah tersedianya informasi mengenai profil senyawa kimia ekstrak daun tabat barito yang diperoleh dari bahan baku dan metode ekstraksi dan evaluasi khasiatnya sebagai antioksidan.
Ruang Lingkup Penelitian
Subyek penelitian ini adalah identifikasi senyawa aktif atau metabolit pada daun tabat barito dengan UPLC-QTOF-MS/MS menggunakan piranti lunak Mzmine, versi 2.1 dan berasal dari Bioinformatics Publication. Obyek penelitian adalah sampel daun tabat barito dari Gunung Halimun, Indonesia.
2
TINJAUAN PUSTAKA
Tabat Barito (
Ficus deltoidea
)
Tabat barito (Gambar 1) merupakan tanaman perdu yang termasuk dalam keluarga Moraceae. Daunnya bewarna hijau sampai coklat kekuningan dengan bintik-bintik dipermukaannya (Yuliani 2000). Tabat barito di Kalimantan selatan banyak terdapat di kabupaten Hulu Sungai Selatan dan kabupaten Balangan, tepatnya di daerah pegunungan Meratus dengan ketinggian antara 200-350 m diatas permukaan laut. Tabat barito diklasifikasikan dalam kingdom plantae, divisi Spermatophyta, sub divisi Angiospermae, kelas Dicotyledonae, ordo Urticales, famili Moraceae dan genus Ficus.
3
Gambar 1 Tabat barito (F. deltoidea).
Dalam pengobatan tradisional, daun tabat barito biasa digunakan untuk mengatasi penyakit darah tinggi, sakit kepala, demam, diabetes dan pemulihan pascapersalinan. Hal inilah yang menarik banyak peneliti, terutama di Asia Tenggara, untuk mengkaji lebih luas khasiat tanaman ini. Beberapa kajian ilmiah telah melaporkan potensi ekstrak polar daun tabat barito sebagai antihipertensi (Shafaei et al. 2013), antiadipogenik (Woon et al. 2013), antimikroba (Samah et al. 2012), antidiabetes (Choo et al. 2012), antikanker serviks (Mat Akhir et al. 2011), antioksidan (Sirisha et al. 2010), antiinflamasi (Abdullah et al. 2009) dan antiinosiseptif (Sulaiman et al. 2008). Ekstrak polar daun tabat barito diketahui mencakup berbagai jenis senyawa, di antaranya secara umum tergolong ke dalam senyawa saponin, tanin, flavonoid, polifenol, triterpenoid dan proantrosianin (Wei et al. 2011, Woon et al. 2012, Shafaei et al. 2013). Dalam kajian yang lebih spesifik, Choo et al. (2012) menyebutkan bahwa di dalam ekstrak metanol terdapat senyawa viteksin dan isoviteksin. Senyawa lain yang telah berhasil diisolasi dan diidentifikasi dalam ekstrak metanol tabat barito di antaranya moretanol (Lip et al. 2009), lupeol (Suryati et al. 2011), fenol, 2,4-bis (dimetilbenzil)-6-tert-butilfenol (Wei et al. 2011), flavan-3-ol, oligomer proantosianidin, flavon-C-glikosida, galokatekin, epigalokatekin, katekin, asam 4-p-kumarolinkuinat, serta luteolin dan apigenin (Omar et al. 2011).
Ekstraksi
Ekstraksi yaitu proses transfer solut dari suatu fase ke fase lainnya berdasarkan perbedaan konstanta distribusi. Ekstraksi dilakukan untuk menarik komponen kimia yang terdapat dalam bahan alam karena adanya perpindahan komponen ke dalam pelarut pada lapisan antar muka yang berdifusi. Beberapa teknik ekstraksi yang sering digunakan yaitu maserasi dan ultrasonikasi.
4
Ekstraksi ultrasonikasi menggunakan gelombang ultrasonik dengan frekuensi 20 KHz–500 MHz (Thompson & Doraiswamy. 1999). Prinsip ekstraksi ultrasonikasi yaitu membentuk suhu tinggi lokal dan meningkatkan gerakan mekanika antarmuka zat padat dan zat cair. Manfaat yang diperoleh dari ultrasonik yaitu acoustic streaming dan acoustic cavitation (Van Iersel 2008). Acoustic streaming adalah gelombang suara yang dipindahkan ke dalam cairan membentuk gerakan cairan searah dengan propagasi gelombang longitudinal (Dolatowski et al. 2007). Hal ini menyebabkan semakin tipisnya lapisan batas antara cairan dan partikel sehingga meningkatkan kemampuan penetrasi pelarut seiring meningkatnya difusibilitas dan pelarut senyawa aktif dalam sel. Pada akhirnya meningkatkan laju perpindahan panas, massa dan efisiensi ekstraksi (Li et al. 2010).
Pada siklus ekspansi akan dihasilkan energi ultrasonik yang cukup kuat, sehingga terjadi pembentukan gelembung dan kavitasi dalam cairan (Özcan. 2006). Gelembung yang terbentuk memiliki permukaan area lebih besar sehingga meningkatkan difusi gas yang berakibat pada pertumbuhan ukuran gelembung. Sampai titik tertentu, saat energi ultrasonik tidak cukup lagi untuk mempertahankan fase uap dalam gelembung udara, sehingga terjadi kondensasi secara cepat dengan molekul-molekul bertabrakan dengan keras dan membentuk gelombang kejut pada daerah dengan suhu dan tekanan tinggi, mencapai 5500 °C dan 50 MPa (Dolatowski et al. 2007). Perubahaan suhu dan tekanan yang disebabkan oleh kavitasi (pecahnya gelembung gas) dapat merusak dinding maupun membran sel partikel (Usaquén-Castro et al. 2006).
Pada proses ekstraksi, pelarut yang digunakan adalah pelarut polar yaitu metanol dan etanol 70 %. Etanol 70 % memiliki kepolaran yang lebih tinggi dari metanol, sehingga diharapkan mampu menyari senyawa yang mempunyai aktivitas antioksidan yang lebih polar seperti polifenol, flavonoid dan saponin. Kedua pelarut ini mampu menarik senyawa fenolik yang berpotensi sebagai antioksidan.
Metabolomik
Metabolomik merupakan anggota dalam kajian "omik" yang digunakan untuk analisis kualitatif dan kuantitatif senyawa kimia dalam sel. Analisis metabolomik mencakup identifikasi dan kuantisasi semua metabolit yang memiliki massa lebih rendah dari 1000 Da.
Metabolom menggambarkan jumlah total metabolit, yaitu molekul kecil dari keseluruhan metabolit non peptida dalam sel atau organisme yang dibutuhkan untuk pertumbuhan. Molekul kecil ini merupakan metabolit sekunder yang dibutuhkan untuk pertumbuhan dan berperan dalam kelangsungan hidup serta adaptasi terhadap perubahan lingkungan. Keberadaan metabolit sekunder dipengaruhi faktor internal dan faktor eksternal. Dimana faktor internal diantaranya, genetik, kondisi kesehatan tanaman dan umur, sedangkan faktor eksternal yaitu lingkungan. Contoh metabolit sekunder diantaranya senyawa golongan fenolik dan flavanoid.
5 analisis kuantitatif metabolit yang berpartisipasi dalam metabolism. Pemrofilan metabolit merupakan analisis kelompok metabolit tertentu yang memberikan informasi fisiologi langsung dan data yang dapat diintegrasikan dalam model metabolisme, berikutnya sidik jari metabolit memberikan informasi berdasarkan jejak metabolit yang dihasilkan oleh sel dan digunakan untuk pengelompokkan sampel yang berbeda seperti menggunakan analisis gerombol.
Analisis metabolomik akan mencakup tiga bagian yaitu penyiapan sampel, akuisisi data analisis dan pengolahan data. Dalam metabolomik, akuisisi data dapat diterapkan untuk analisis yang ditargetkan dan yang tidak ditargetkan. Analisis metabolomik target ditujukan untuk mengukur tingkat metabolit yang dikenali. Sementara metabolit non target mengukur semua metabolit, baik molekul atau ion, dalam kisaran nilai massa tertentu. Metabolomik non target memiliki keunggulan, yaitu memberikan peluang teridentifikasinya metabolit baru (Vinayavekhin & Saghatelian. 2010). Teknik analisis yang dapat digunakan untuk menganalisis metabolit, yaitu NMR, LC-MS, GC-MS dan CE-MS. Salah satu teknik yang umum digunakan untuk analisis metabolit adalah kromatografi cair yang ditandem dengan spektroskopi massa (LC-MS). Tandem ini ditujukan untuk memudahkan dalam proses mengidentifikasi senyawa kimia dalam suatu tanaman, yang merupakan sistem kompleks dari puluhan hingga ratusan metabolit.
UPLC-QTOF-(MS/MS)
Kromatografi cair-spektrometer massa (LC-MS) merupakan gabungan kromatografi cair dan spektrometri massa (MS). Kromatografi cair berfungsi untuk memisahkan senyawa atau campuran senyawa berdasarkan kepolarannya sedangkan spektrometri massa berperan untuk mengidentifikasi senyawa berdasarkan berat molekulnya. Prinsip spektrometri massa yaitu menghasilkan ion yang berasal dari senyawa anorganik maupun organik, memisahkan ion-ion berdasarkan rasio massa terhadap muatan (m/z) dan dapat mendeteksi ion-ion secara kualitatif maupun kuantitatif melalui nilai hubungan m/z dan kelimpahannya.
Spektrometri massa terdiri dari sumber ion, penganalisa massa dan detektor. Pada penelitian ini, sumber ion yang digunakan ESI, merupakan metode ionisasi untuk mendapatkan berat molekul dari senyawa metabolit dengan teknik spray. Molekul yang terdeteksi merupakan ion dalam bentuk tetesan (droplet) agar tidak saling menempel. Ion yang terdeteksi dapat berupa [M+H]-, [M-H]-, analit dengan tambahan seperti Na+, K+, H3O+, NH4+ dan molekul dari fase gerak,
seperti asetonitril atau metanol. Kation-kation yang sering terbentuk dalam metode ESI adalah ion pseudomolekul hasil adisi antara analit dengan proton (H)+. Oleh karena itu, nilai m/z dalam spektra akan sering bernilai (M+H)+ atau (2M+H)+, dengan M adalah bobot molekul analit (Kazakevich & Lobrutto. 2007). Teknik ionisasi tekanan atmosfir akan menghasilkan molekul ion M+ atau M-, molekul terprotonasi [M +H]+, ionisasi molekul sederhana [M+Na]+ dan ion yang mewakili kehilangan molekul sederhana seperti kehilangan air [M+H-H2O]+.
6
fragmentasi analit, proses dapat dilakukan pada tekanan atmosfer dan pengionan yang digunakan baik pengionan positif atau negatif. Pengionan positif akan membuat analit menjadi terprotonasi atau menjadi kation, sedangkan pengionan negatif akan membuat analit menjadi anion atau mengalami deprotonasi (Kazakevich and Lobrutto. 2007). Prinsip kerja ESI, terbentuknya droplet campuran pelarut dan analit yang bermuatan listrik karena dilewatkan melalui celah sempit yang berpotensial listrik tinggi (4-5 kV).
Penganalisa massa yang digunakan quadrupole time of flight, terdiri dari quadrupole dan time of flight (TOF). Kelebihan TOF yaitu dapat diterapkan untuk semua ion pada waktu yang sama menyebabkan ion akan dipercepat menyusuri tabung penerbangan dimana ion yang lebih ringan tiba pada detektor paling awal sehingga fragmentasi ion ditentukan oleh waktu kedatangan mereka. Analisis massa memiliki kisaran luas dan sangat akurat sehingga TOF banyak menjadi pilihan dalam analisa metabolik. QTOF-MS memungkinkan analisis MS/MS dan menyediakan massa akurat untuk kedua prekursor dan produk ion dan dapat mengidentifikasi massa lebih teliti dibandingkan penganalisa massa lain (Lacorte dan Alba. 2006). Kemampuan penganalisa massa QTOF, yaitu dapat mendeteksi berat molekul sampai dengan 4 desimal dengan menggunakan pendekatan rumus empiris berdasarkan pembacaan berat molekul secara akurat.
Antioksidan
Antioksidan merupakan zat yang dapat menghambat atau mencegah oksidasi. Antioksidan juga merupakan senyawa yang dapat menyumbangkan satu atau lebih elektron kepada radikal bebas. Tubuh manusia tidak mempunyai cadangan antioksidan dalam jumlah berlebih, sehingga jika terjadi paparan radikal bebas, tubuh membutuhkan antioksidan dari luar. Adanya kekhawatiran akan kemungkinan efek samping yang belum diketahui dari antioksidan sintetik menyebabkan antioksidan alami menjadi alternatif yang sangat dibutuhkan (Saija et al. 1995). Senyawa golongan fenolik dan flavonoid merupakan antioksidan alami. Flavonoid dapat mencegah kerusakan yang disebabkan oleh radikal bebas. Flavonoid dioksidasi oleh radikal bebas menghasilkan bentuk radikal yang lebih stabil berdasarkan reaksi:
Flavonoid (OH) + R• → Flavonoid (O•) + RH
dengan R• adalah radikal bebas dan O• adalah radikal bebas oksigen (Nijveldt et al. 2001). Antioksidan mendonorkan radikal H• dari cincin aromatiknya untuk mengurangi radikal bebas yang bersifat toksik menghasilkan radikal fenolik –O• yang terstabilkan dan membuatnya tidak toksik. Mekanisme reaksi lain yang terjadi melibatkan reaksi reduksi flavonoid dan oksidasi radikal. Reaksi ini berjalan secara bersamaan. Elektron ditransfer dari senyawa pereduksi ke senyawa pengoksidasi.
7 mudah, sederhana, cepat, sensitif, dan hanya membutuhkan sedikit sampel (Koleva et al. 2002).
Metode uji antioksidan DPPH didasarkan pada reaksi penangkapan atom hidrogen dari senyawa antioksidan oleh DPPH (reduksi DPPH) (Gambar 2). Reagen DPPH berperan sebagai radikal bebas yang direndam oleh senyawa antioksidan yang terkandung dalam sampel. Selanjutnya, DPPH akan tereduksi menjadi senyawa 2,2-difenil-1-pikrilhidrazina(DPPH-H). Reduksi DPPH menjadi DPPH-H menyebabkan perubahan warna dari ungu menjadi kuning (Lupea et al. 2006). Perubahan warna uji sebanding dengan jumlah hidrogen radikal yang diambil oleh radikal bebas.
Daya inhibisi (IC50) dihitung berdasarkan pengurangan absorbans DPPH
terhadap absorbans sampel uji. Nilai IC50 sebagai parameter aktivitas antioksidan,
merupakan konsentrasi yang dibutuhkan untuk menghambat aktivitas radikal bebas (serapan radikal bebas) sebanyak 50% (Molyneux 2004). Nilai IC50 dari
masing-masing sampel diperoleh berdasarkan persamaan garis yang dihasilkan dari hubungan antara persen inhibisi dan konsentrasi.
Gambar 2 Prinsip penangkapan H oleh DPPH (Lupea et al. 2006).
Semakin rendah nilai IC50 suatu bahan semakin tinggi aktivitas
antioksidannya. Konsentrasi sampel untuk menghambat 50% radikal bebas DPPH hanya dibutuhkan sedikit. Menurut Zuhra (2008), suatu senyawa dikatakan sebagai antioksidan sangat kuat apabila nilai IC50 bernilai 0-50 ppm, kuat jika IC50
bernilai 50–100 ppm, sedang jika IC50 bernilai 100–150 ppm, dan lemah jika nilai
IC50 bernilai 151–200 ppm.
8
3
METODE
Metode penelitian yang dilaksanakan meliputi analisis kualitatif dan kuantitaif. Tahapan analisis yang dilakukan dengan pengambilan sampel tabat barito, proses ekstraksi, analisis dengan UPLC-QTOF-(MS/MS) dan pengolahan data dengan Mzmine versi 2.1, (Syngenta, Inggris) dan Masslynk versi 4.1, (Waters, Amerika Serikat) (Lampiran 1).
Bahan
Sampel daun tabat barito diperoleh dari Desa Cikaniki, Taman Nasional Gunung Halimun-Salak Sukabumi, metanol (Merck, Jerman), etanol (Merck, Jerman), dan radikal 2,2-difenil-1-pikrilhidrazil (Merck, Jerman).
Alat
Penenentuan aktivitas antioksidan menggunakan pembaca Elisa (Epoch – Biotek, Winooski, USA), sementara pemrofilan metabolit dilakukan dengan menggunakan LC-MS -QTOF (G2-S-QTOF, Jerman), ultrasonikasi US-3 38 kHZ (As one, Osaka-Jepang) dan rotary evaporator (Heidolph WB 2000, Schwabach-Jerman).
Prosedur Analisis Data Penyiapan Bahan Baku
Sampel tabat barito yang digunakan pada penelitian diambil pada bulan Juli tahun 2014. Sampel daun tabat barito yang digunakan dalam penelitian dicuci hingga bersih, diiris dan dikeringkan pada suhu 40 ºC. Daun kering tersebut kemudian dihaluskan dan disimpan.
Penetapan Kadar Air (AOAC 2005)
Cawan porselen dikeringkan pada suhu 105 °C selama 30 menit, lalu ditempatkan di dalam desikator dan ditimbang massanya. Setelah itu, simplisia daun tabat barito ditimbang sebanyak 5 gram dan dimasukkan ke dalam cawan porselen. Contoh beserta cawan dioven pada suhu 105 ºC sampai bobot konstan. Setelah dioven, dimasukkan ke dalam desikator kemudian ditimbang. Prosedur dilakukan berulang kali sampai didapat bobot tetap dengan selisih kurang dari 1 mg. Pekerjaan dilakukan triplo dan kadar air ditentukan dengan persamaan dibawah ini:
Kadar air (%) = 100%
Keterangan: A = bobot contoh awal (g) B = bobot contoh kering (g). Ekstraksi (BPOM 2005 yang dimodifikasi)
9 menggunakan gelombang ultrasonikasi 42 kHz. Setelah itu, ekstrak disaring sehingga diperoleh filtrat dan residu. Filtrat dipekatkan hingga diperoleh ekstrak UM dan ekstrak etanol UE.
Aktivitas Antioksidan dengan Metode DPPH
Uji perendaman radikal bebas DPPH dilakukan dengan mengikuti metode (Salazar et al. 2009). Setiap ekstrak dilarutkan kembali dalam etanol hingga diperoleh larutan masing-masing ekstrak dengan konsentrasi 100 μg/mL, 50 μg/mL, 25 μg/mL, 12.5 μg/mL, 6.25 μg/mL dan 3.125 μg/mL. Setelah itu, sebanyak 100 μL dari setiap larutan uji tersebut ditambahkan 100 μL larutan DPPH 125 µM dalam etanol. Campuran selanjutnya diaduk dan diinkubasi pada suhu 37 ºC selama 30 menit. Setelah itu, absorbans setiap larutan uji dibaca menggunakan pembaca Elisa pada panjang gelombang 517 nm.
Identifikasi Komponen Kimia dengan UPLC-QTOF-MS/MS
Identifikasi komponen kimia daun tabat barito dilakukan dengan cara melarutkan tiap-tiap ekstrak ke dalam metanol kemudian disaring dengan saringan milipore yang berukuran 0.45 mikron. Selanjutnya sebanyak 5 µL filtrat diinjeksikan ke instrument UPLC-QTOF-MS/MS. Spektrometri massa menggunakan sumber ionisasi ESI dan penganalisis massa QTOF, system Xevo G2-S TOF dengan mode ionisasi negatif. Kondisi MS : suhu kapiler 120 ºC, gas pengabut 50 L/Jam, sumber tegangan +2.9 kV, modus full scan dari m/z 100-1000 pada suhu 41ºC, kolom Acquity UPLC HSS C18 1.8 µm x 2.1x150 mm dengan eluen 5mM ammonium format (A) dan 0.1 % asam format dalam asetonitril (B), laju alir eluen 0.4 mL/menit, sistem elusi isokratik pada menit 0-0.5 dengan perbandingan 95:5, menit ke 0.5-15 elusi linier gradien eluen A dari 95% hingga 5%, menit 15-17 elusi isokratik dengan perbandingan 5:95 dan menit 17-20 elusi linier gradien eluen A dari 5% hingga 95%.
Pemrosesan Data Kromatogram UPLC-QTOF-MS/MS
Data kromatogram yang dihasilkan dikonversi menjadi format NetCDF untuk mempermudah dalam mengolah data dengan MZmine. Data kromatogram dari masing-masing ekstrak tabat barito dikumpulkan dan diolah melalui beberapa tahap yaitu, filtering, baseline peak, peak detection, deisotope, aligment, gap filling, normalisasi dan identifikasi (Gambar 4). Hasil yang diperoleh merupakan data mass array dari kromatogram masing-masing ekstrak yang meliputi 3 variabel yaitu m/z, waktu retensi, dan intensitas puncak
4
HASIL DAN PEMBAHASAN
Ekstrak Daun Tabat Barito
10
diberikan menyebabkan suhu tinggi dan meningkatkan gerakan mekanik antar sampel dan pelarut. Hasil yang sama juga diperlihatkan pada maserasi etanol (ME) dan ultrasonikasi etanol (UE) dengan perbedaan rendemen sekitar 2 % dan rendemen daun tabat barito ditunjukkan pada Tabel 1.
Perbandingan hasil rendemen di antara dua pelarut menunjukkan bahwa rendemen dengan pelarut etanol selalu lebih tinggi dibandingkan dengan metanol. Kepolaran komponen yang terekstrak dari kedua pelarut menunjukkan hasil yang berbeda karena perbedaan kepolaran pelarutnya. Pelarut etanol 70% memiliki kepolaran yang lebih tinggi dibandingkan dengan metanol. Hal ini menunjukkan metabolit dalam daun tabat barito banyak mengandung komponen polar. Namun mengingat kecilnya perbedaan kepolaran kedua pelarut tersebut, terekstraknya komponen yang sama juga dimungkinkan. Ragam komponen hanya dapat ditentukan melalui identifikasi lebih lanjut.
Aktivitas Antioksidan Tabat Barito
Besarnya aktivitas antioksidan ekstrak daun tabat barito ditunjukkan dengan nilai IC50 (Tabel 1). Semakin rendah nilai IC50 suatu bahan maka semakin tinggi
nilai antioksidannya. Ekstrak daun tabat barito pada 4 perlakuan memiliki potensi aktivitas antioksidan yang kuat karena mempunyai IC50 dibawah 200 ppm.
Aktivitas antioksidan yang tertinggi dimiliki oleh ekstrak UM dengan rendemen yang dihasilkan paling kecil. Hal ini menunjukkan bahwa teknik UM dalam mengekstrak komponen yang berpotensi sebagai antioksidan lebih besar dibandingkan teknik yang lain. UM dapat mengekstrak komponen kimia polar lebih banyak. Sehingga aktivitas antioksidan tabat barito dipengaruhi terhadap komponen-komponen yang polar seperti, flavonoid dan fenolik (Ramamurthy et al. 2014).
Potensi antioksidan yang paling kecil terdapat pada teknik UE dengan rendemen yang cukup besar (24%). Meskipun komponen yang terekstrak lebih banyak dibandingkan UM akan tetapi jumlah komponen polarnya lebih sedikit. Hal ini menyebabkan penurunan aktivitas meskipun diberikan dengan teknik menggunakan gelombang ultrasonik. Hasil yang berbeda diperlihatkan pada teknik maserasi. Teknik ME memiliki potensi aktivitas antioksidan yang lebih tinggi dibandingkan MM.
Tabel 1. Kadar air dan rendemen daun tabat barito Perlakuan Pelarut Rerata
11 Identifikasi Metabolit Daun Tabat Barito dengan UPLC-QTOF-
MS/MS
Informasi mengenai komposisi metabolit daun tabat barito, profil metabolit non target dari sampel dilakukan dengan teknik ekstraksi dan pelarut yang berbeda. Komponen kimia berbagai teknik dianalisis dengan UPLC-QTOF-MS/MS menggunakan fase gerak asetonitril dan asam format dengan elusi gradien kemudian dilanjutkan identifikasi berdasarkan pola fragmentasi setiap komponen tersebut. Ekstrak-ekstrak yang dibuat dalam penelitian ini memberikan profil kromatogram yang hampir mirip (Gambar 3). Setiap puncak dalam kromatogram merepresentasikan komponen tertentu. Puncak-puncak yang muncul dengan waktu retensi yang sama dari setiap ekstrak menunjukkan komponen yang sama.
Gambar 3 Kromatogram daun dari ekstrak MM (a), ME (b), UM (c) dan UE (d) tabat barito
Walaupun kromatogram setiap ekstrak yang diperoleh hampir mirip tetapi jika dilihat secara detail, setiap kromatogram memiliki pola puncak yang khas. Hal ini menunjukkan bahwa setiap ekstrak mengandung komponen yang berbeda satu sama lain. Lebih lanjut, analisis massa dari setiap puncak akan memberikan puncak fragmentasi yang banyak.
12
kompleks sehingga menyulitkan dalam proses data. Kompleksitas data tersebut dapat diatasi dengan menggunakan program MZmine. Pada proses ini data yang besar dan kompleks akan menjadi data yang lebih sederhana dengan menghilangkan pengaruh geseran garis dasar (background) dan noise atau derau pada kromatogram.
Data hasil analisis dengan LC-MS diubah ke dalam bentuk NetCDF agar lebih mudah diolah dalam program Mzmine. Pada program dilakukan beberapa tahapan yaitu, filtering, koreksi baseline, peak detections, deisotope, aligment, gap filling dan normalisasi. Data massa selanjutnya digunakan untuk identifikasi komponen metabolit dalam setiap ekstrak. Komponen metabolit daun tabat barito dari keempat perlakuan diperoleh sebanyak 70 metabolit. Jumlah metabolit yang terkandung dari masing-masing perlakuan berbeda, yaitu 45 metabolit dengan MM, 64 metabolit dengan UM, 42 metabolit dengan UE dan 41 metabolit dengan ME (Lampiran 5). Selanjutnya tiap metabolit dilakukan konfirmasi dengan fragmen yang dihasilkan dari MS. Pola pemecahan MS akan diperoleh puncak dasar yang sama dengan senyawa dugaan dari hasil MZmine. Langkah berikutnya, konfirmasi menggunakan pola fragmen pada MS/MS dan dibandingkan dengan literatur. Sebanyak 16 senyawa dapat diidentifikasi dalam golongan flavanoid, asam fenolat dan asam lemak Tabel 3.
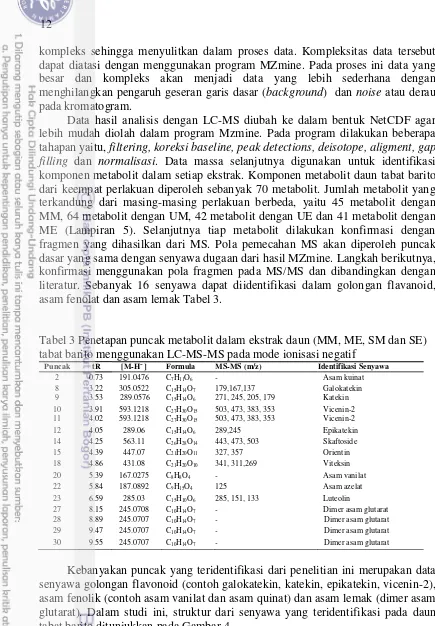
Tabel 3 Penetapan puncak metabolit dalam ekstrak daun (MM, ME, SM dan SE) tabat barito menggunakan LC-MS-MS pada mode ionisasi negatif
Puncak tR [M-H¯ ] Formula MS-MS (m/z) Identifikasi Senyawa
13
Schaftoside
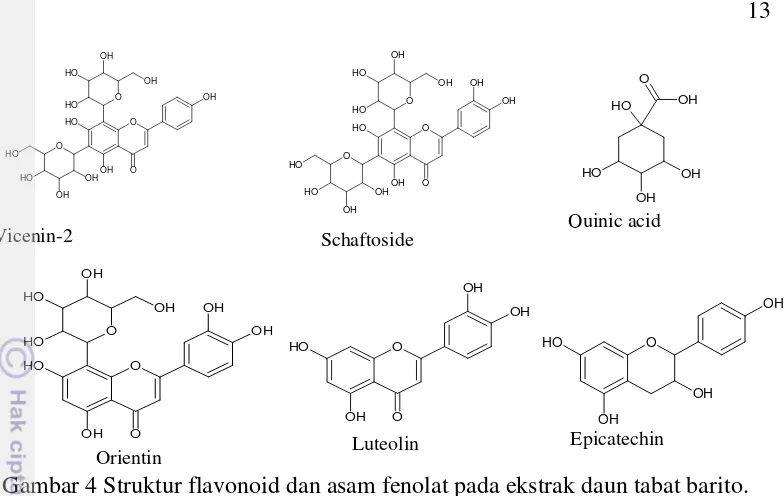
Gambar 4 Struktur flavonoid dan asam fenolat pada ekstrak daun tabat barito. Identifikasi Senyawa Golongan Flavonoid
Keberadaan Flavonoid dari tabat barito telah dilaporkan oleh beberapa peneliti sebelumnya (Omar et al. 2011, Sheu et al. 2005, Veber et al. 2008). Beberapa senyawa flavonoid dalam daun tabat barito, umumnya menunjukkan puncak ion molekul spektrum MSn dengan fragmen M-90 dan M-120 yang mengindikasikan adanya pembelahan C-glikosida. Kajian sebelumnya menunjukkan bahwa luteolin dan apigenin glikosida yang terdapat dalam Ficus adalah dari jenis C-glikosida (Omar et al. 2011). Puncak 10 dan 11 dikarakterisasi [M-H]- pada m/z 593 dengan ion fragmen m/z 503 H-90]¯ ) dan m/z 473 ([M-H-120]¯ ) menunjukkan teridentifikasinya apigenin-6,8-C-diglukosida (vicenin-2) (Han et al. 2008). Selain itu fragmentasi yang khas dari C-glukosilflavon ditunjukkan dengan puncak MS/MS m/z 383 (apigenin + 113) dan m/z 353 (apigenin + 83). Perbandingan intensitas relatif diamati sinyal fragmen dengan m/z 383 lebih tinggi dari m/z 473. Hal ini menandakan adanya aglikon apigenin (Benayad et al. 2014) (Lampiran 6). Spektrum puncak pada waktu retensi 4.25 (senyawa 14) dengan puncak dasar m/z 563 teridentifikasi sebagai senyawa apigenin-6-C-glukosida-8-C-arabinosida (skaftosida). Secara umum, 6-C-pentosil-8-C-heksosil mengawali substitusi untuk kelimpahan yang lebih tinggi dari ion m/z 473 [M-H-90]- ke m/z 443 [M-H-120]- (Figueirinha et al. 2008). Ion m/z 503 [M-H-60]- berasal dari pembelahan C-pentosil, sedangkan ion [M-H-120]- berasal dari pembelahan heksosil, dan lebih lanjut substitusi glikosil pada posisi C6 dari flavon menghasilkan puncak dasar (Lampiran 7).
Keberadaan luteolin pada waktu retensi 6.59 (puncak 23) dapat dijelaskan dengan membandingkan spektrum ion produk dengan literatur standar luteolin (Rabaneda et al. 2003). Gambar 5 (A) menunjukkan spektrum ekstrak daun tabat barito pada puncak 23 dan spektrum untuk standar (Gambar 5 (B)) menggambarkan keberadaan luteolin (Lampiran 8).
14
dengan waktu retensi 4.39 menit diperoleh dengan puncak dasar [M-H]¯ pada m/z 447. Senyawa awal diduga sebagai isoorientin atau orientin. Pola fragmen yang dihasilkan pada m/z 357 [M-H-90]¯ dan m/z 327 [M-H-120]¯ menunjukkan bahwa mono-C-glikosilasi berada di posisi 8. Hilangnya 120 dan 90 yang teramati merupakan pecahan lintas cincin di unit gula. Senyawa 15 ditandai sebagai luteolin 8-C-glukosil yang dikenal sebagai orientin (Rabaneda et al. 2003). Perbedaan dengan isoorientin ialah ion m/z 429 [M-H-18]¯ tidak ada dalam spektrum orientin (Tala et al. 2013) (Lampiran 9).
Hal yang sama dilakukan untuk identifikasi puncak 18. Senyawa viteksin (apigenin-8-C-glukosida) dan isoviteksin (apigenin-6-C-glukosida) pada m/z 431 menunjukkan adanya kehilangan 90 (m/z 341) dan 120 (m/z 311) sebagai ion karakteristik dalam MS/MS. Tidak adanya ion m/z 413 dan 353 akan membedakan spektrum viteksin dengan isoviteksin. Selain itu, aglicone terdeprotonasi (m/z 269) memiliki kelimpahan relatif 5%. Hal tersebut menunjukan bahwa senyawa pada puncak 18 merupakan senyawa viteksin (Rabaneda et al. 2003) (Lampiran 10).
Galokatekin yang termasuk dalam golongan flavan-3-ol terdeteksi pada puncak 8 dengan waktu retensi 3.22 (m/z 305). Pola pemecahan MS² menghasilkan m/z 179 [M-H-126]¯ , 167 [M-H-138]¯ , dan 137 [M-H-168]¯ (Tala et al. 2013) (Lampiran 11). Puncak 9 dan 12 teridentifikasi senyawa katekin dan epikatekin yang menghasilkan molekul terdeprotonasinya [M-H]¯ pada (m/z 289). Senyawa (epi) katekin dengan puncak ion terdeprotonasinya [М-H]¯ terjadi pada m/z 289 dan ion terfragmentasi pada m/z 271, 245, 205 dan 179. Ion pada m/z 205 diperoleh karena hilangnya cincin A dari flavonoid yang diamati, sedangkan ion
1
1
2
(B)
15 pada m/z 245 merupakan hasil dari kehilangan CO2 atau divalen -CH2-CHOH-
(Negri et al. 2012). Fragmen pada m/z 271 dan m/z 179 adalah hasil dari kehilangan air, yaitu cincin B dari molekul flavonoid (Savic et al. 2014).
Identifikasi Asam Fenolat
Derivatif terbentuk dari interaksi asam sinamat hidroksi dengan suatu asam fenolat yaitu asam kuinat dan berkontribusi terhadap rasa asam pada tanaman (Pink et al. 1994). Puncak 2 ditandai oleh [M-H]¯pada m/z 191.0476. Fragmen dominan dari 191 menunjukan rumus molekul C7H11O6 untuk asam
kuinat di MSn (asam fenolat) (Farag et al. 2014). Asam quinat teridentifikasi pada pelarut etanol di kedua teknik ekstraksi. Asam fenolat lainnya diidentifikasi dalam studi ini meliputi asam vanilat (20) dan asam azelat (22), semua terlihat dari data [M-H]- (Tabel 3).
5
SIMPULAN DAN SARAN
Simpulan
Pemrofilan metabolit daun tabat barito menggunakan UPLC-QTOF-MS/MS yang terdeteksi dengan teknik ekstraksi MM, ME, UM dan UE dengan MZmine sebanyak 70 metabolit. Komponen metabolit dengan teknik ultrasonikasi metanol (UM) memberikan nilai aktivitas antioksidan yang besar. Hal ini telihat dari jumlah metabolit yang dihasilkan dari tiap-tiap perlakuan, yaitu MM sebanyak 45 metabolit, ME 41 metabolit, UM 64 metabolit dan UE 42 metabolit. Sebanyak 16 senyawa metabolit yang dapat diidentifikasi lebih lanjut setelah dikonfirmasi dengan MS/MS termasuk dalam golongan flavanoid, asam fenolat dan asam lemak.
Saran
16
DAFTAR PUSTAKA
Abdullah Z, Hussain K, Ismail Z, Ali RM. 2009. Anti-inflammatory Activity of Standardised Extracts of Leaves of Three Varieties of Ficus deltoidea. International Journal of Pharmaceutical and Clinical Research. 1(3):100-105.
Abdullah Z, Hussain K, Zhari I, Rasadah MA, Mazura P, Jamaludin F, Sahdan R. 2011. Evaluation of extracts of leaf of three Ficus deltoidea varieties for antioxidant activities and secondary metabolites. Pharmacog Research. 1:216-223.
[AOAC] Association of Official Analytical Chemist. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington:The Association of Official Analytical Chemist, Inc.
Benayad Z, Cordovés CG, Es-Safi NE. 2014. Characterization of Flavonoid Glycosides from Fenugreek (Trigonella foenum-graecum) Crude Seeds by HPLC–DAD–ESI/MS Analysis. International Journal of Molecular Sciences. 15:2066-2068.
[BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia. 2005. Jakarta : BPOM RI.
Choo CY, Sulong NY, Man F, Wong TW. 2012. Vitexin and isovitexin from the leaves of Ficus deltoidea with in-vivo α-glucosidase inhibition. Journal Ethnopharm.142:776-781.
Dolatowski, ZJ, Stadnik J, Stasiak D. 2007. Applications of Ultrasound in Food Technology. Acta Science Polymer Technology. 6(3): 89–99.
Farag MA, Abdelfattah MS, Badr SEA, Wessjohann LA. 2014. Profiling the chemical content of Ficus lyrata extracts via UPLC-PDA-QTOF-MS and chemometrics. Natural Product Research. 28(19):1549-1456.
Fiehn O. 2002. Metabolomic: The link between genotypes and phenotypes. Plant Molecular Biology. 48:155-171.
Figueirinha A, Paranhos A, Perez-Alonso JJ, Santos-Buelga C, Batista MT. 2008. Cymbopogon citratus leaves: Characterisation of flavonoids by HPLC-PDA ESI/MS/MS and approach to their potential as a source of bioactive polyphenols. Food Chemistry. 110:718-728.
Grata E, Guillarme D, Glauser G, Boccard J, Carrupt PA, Veuthey JL, Rudaz S, Wolfender JL. 2009. Metabolite profiling of plant extracts by ultra-high-pressure liquid chromatography at elevated temperature coupled to time-of-flight mass spectrometry. Journal Chromatography A. 1216:5660–5668. Hakiman M & Maziah M. 2009. Nonezymatic and enzymatic antioxidant
activities in aqueous extract of different Ficus deltoidea accessions. Jounal of Medicinal Plants Research. 3:120–131.
Han J, Ye M, Qiao X, Xu M, Wang BR, Guo DA. 2008. Characterization of phenolic compound in the Chinese herbal drug Artemisia annua by liquid chromatography coupled to electrospray ionization mass spectrometry. Journal of Pharmaceutical and Biomedical Analysis. 47:516-525.
17 Kazakevich Y & Lobrutto. 2007. Introduction HPLC for Pharmaceutical Scientist.
New Jersey: John Willley & Sons. Inc. 18-19.
Khairan, Jenie Umar A, Sudibyo Retno S. 2009. Fragmentation Studies of ∆6,7 -Anhidroeritromisin-A by Liquid Chromatography-Mass Spectroscopy (LCMS). Indonesia Journal Chemical. 9(3): 491 - 499.
Koleva I, van Beek T, Linnssen JPH, De Groot A, Evstarieva LN. 2002. Screening of plant extracts for antioxidant activity: a comparative study on three testing methods: Phytochemical Analysis 13:494-500.
Lacorte S & Alba ARF. 2006. Time Of Flight Mass Spectrometry Applied To The Liquid Chromatographic Analysis Of Pesticides In Water And Food. Mass Spectrometry Reviews. 25: 866– 880.
Lee J, Jung Y, Shin JH, Kim HK, Moon BC, Ryu DH, Hwang GS. 2014. Secondary Metabolite Profiling of Curcuma Species Grown at Different Locations Using GC/TOF and UPLC/Q-TOF MS. Molecules. 19:9535-9551. Li SL, Song JZ, Choi FFK, Qiao CF, Zhou Y. 2009. Chemical profiling of Radix
paeoniae evaluated by ultra-performance liquid chromatography/photo-diode-array/quadrupole time-of-flight mass spectrometry. Jounal Pharmaceutical and Biomedical Analysis. 49:253-266.
Li S. 2010. Effects of Ultrasonic-assistant Extraction Parameters on Total Flavones Yield of Selaginella doederleinii and its Antioxidant Activity. Journal of Medicinal Plants Research. 4 (17): 1743–1750.
Lip JM, Hisham DN, Zaidi JA. 2009. Isolation and identification of moretenol from Ficus deltoidea leaves. Journal of Tropical Agriculture and Food Science. 2:195–201.
Lupea AX, Chambire D, Iditoiou C, Szabro MR. 2006. Short communication improved DPPH determination for antioxidant activity spectrophotometric assay. Chemistry Pap. 3:214-216.
Mat Akhir NA, Chua LS, Majid FA dan Sarmidi MR. 2011. Cytotoxicity of Aqueous and Ethanolic Extracts of Ficus deltoidea on Human Ovarian Carcinoma Cell Line. British Jounal of Medicine & Meddical Research. 1(4): 397-409.
Meloan CE. 1999. Chemical Separation. New York (US): John Willey Interscience.
Molyneux P. 2004. The use of stable free radical dyphenilpicryl-hydrazil (DPPH) for estimating antioxidant activity. Journal of Science Technology. l:211-219. Negri G, Santi D, dan Tabach R. 2012. Chemical composition of hydroethanolic
extracts from Siparuna guianensis, medicinal plant used as anxiolytics in Amazon region. Revista Brasileira de Farmacognosia. (22):1024-1034. Nijveldt R. 2001. Flavanoids: a Review of probable mechanisms of action and
potential application. American Journal Clinical Nutrition. 74:418-425 Omar MH, Mullen W, Crozier A. 2011. Identification of proanthocyanidin dimers
and trimers, flavone C-glycosides and antioxidants in Ficus deltoidea, a Malaysian herbal tea. Journal of Agricultural and Food Chemistry. 4:1363– 1369.
18
Pink D, Naczk M, Baskin K, Shahidi F. 1994. Theoretical-analysis of ultraviolet-visible spectra of various phenolic-acid fractions of canola. Journal of Agricultural and Food Chemistry. 42(6):1317-1322.
Rabaneda FS, Ja´uregui O, Casals I, Lacueva CA, Pulido MI and Ravent’os RM. 2003. Liquid chromatographic/electrospray ionization tandem mass spectrometric study of the phenolic composition of cocoa. Journal of Mass Spectrometry. 38(1): 35-42.
Ramamurthy S, Kumarappan C, Dharmalingam SR and Sangeh JK. 2014. Phytochemical, Pharmacological and Toxicological Properties of Ficus deltoidea: A Review of a Recent Research. Annual Research & Review in Biology.4(14): 2357-2371.
Rameshkumar A ,Sivasudha T, Jeyadevi R, Sangeetha B, Aseervatham GSB, Maheshwari M. 2013 Profiling of phenolic compounds using UPLC– Q-TOF-MS/MS and nephroprotective activity of Indian green leafy vegetable Merremia emarginata (Burm f.). Food Research International. 50(1):94–10, 42:1317-1322.
Saija A, Scalese M, Lanza M, Marzullo D, Bonina F, Castelli F. 1995. Flavonoids as antioxidant agents: importance of their interaction with biomembranes. Free Radical Biology and Medicine. 19(4):481-486.
Salazar AR, Alejandro RLL, Lopez AJ, Alicia AGB, Waksman TN. 2011. Antimicrobial and antioxidant activities of plants from northeast of Mexico. Evidence Based Complement and Alternative Medicine.1-6
Samah O ABD, Zaidil NTA, Sulel AB. 2012. Antimicrobial activity of Ficus deltoidea Jack (Mas Cotek). Journal of Pharmaceutical Sciences. 25(3):675-678.
Savić IM, Nikolić VD, Savić IM, Nikolić LB, Jović MD, Jović MD. 2014. The Qualitative Analysis Of The Green Tea Extract Using ESI-MS Method. Advanced Technologies 3(1):30-37
Shafaei A, Aisha A, Muslim NS, Nassar ZD, Ismail Z, Majid AM. 2013. Angiotensin converting enzyme inhibitory effect of Ficus deltoidea Jack standardized leaf extracts. Medicinal Chemistry. 3:4.
Sheu YW, Chiang LC, Chen IS, Chen YC, Tsai IL. 2005. Cytotoxic flavonoids and new chromenes from Ficus formosana. Planta Medica. 71:1165–1177. Sirisha N, Sreenivasulu M, Sangeeta K, Chetty CM. 2010. Antioxidant properties
of Ficus species- A Review. International Journal of Pharm Tech Research. 2(4):2174-2182.
Sulaiman MR, Hussain MK, Zakaria ZA, Somchit MN, Moin S, Mohamad AS, Israf DA. 2008. Evaluation of the antinociceptive activity of Ficus deltoidea aqueous extract. Fitoterapia. 79:557-561.
Suryati, Nurdin H, Dachriyanus, Lajis MN. 2011. 3β, Germanicyl cinnamate of tabat barito leaves (Ficus deltoideus Jack). International Journal Engineering and Science. 2(3):63-66.
19 Thompson LH & Doraiswamy LK. 1999. Sonochemistry Science and Engineering. Industrial and Engineering Chemistry Research. 38:1215–1249. Usaquén CXM. Rubio M, Baquero HA, and Martínez GG. 2006.
Ultrasound-assisted Extraction of Polyphenols from Red-grape (Vitis vinifera) Residues. IUFoST 1315–1324.
Van Iersel M.M. 2008. Sensible Sonochemistry [disertasi]. Eindhoven (NL): Technical University of Eindhoven.
Veberic R, Colaric M, Stampar F. 2008. Phenolic acids and flavonoids of fig fruit (Ficus carica L.) in the northern Mediterranean region. Food Chemistry. 106:153–157.
Vinayavekhin N and Saghatelian A. 2010. Untargeted metabolomics. Molecule Biology. Chapter 30, Unit-24.
Wei LS, Wee W. 2011. Characterization of antioxidant, antimicrobial, anticancer property and chemical composition of Ficus deltoidea Jack leaf extract. Journal of Biologically Active Products from Nature. 1:1-6.
Woon SM, seng YW, Ling APK, CHYE SM, KOH Rhum Yian. 2013. Anti- adipogenic effect of Ficus deltoidea var deltoidea and var. angustifolia on 3T3-L1 adipocytes. Journal of Zheijang University-SCIENCE B (Biomedicine & Biotechnology). 15 (3):295-302.
Yuliani S. 2000. Tabat barito (Ficus deltoidea Jack). Dalam Tumbuhan Obat Indonesia. Penggunaan dan khasiatnya. Pustaka.
20
Lampiran 1 Diagram alir penelitian
Sonikasi dengan pelarut MeOH & EtOH Maserasi dengan pelarut
MeOH & EtOH
Ekstrak (MM & ME)
Analisis LC-MS Uji aktivitas antioksidan
Identifikasi Senyawa
Profil metabolit daun tabat barito
Simplisia daun Tabat Barito
21
Lampiran 2 Kadar air daun tabat barito Ulangan Bobot
cawan(g)
Bobot sampel (g)
Bobot akhir(g)
Kadar air Kadar Air (%)
1 4.5402 1.9996 6.4274 0.0562 5.62
2 4.6323 1.9917 6.5154 0.0545 5.45
3 4.4927 1.9916 6.3780 0.0534 5.34
Rerata 5.47±0.1427
Contoh Perhitungan:
Penentuan kadar air (ulangan 1)
Penentuan rerata kadar air
%
Penentuan standar deviasi
22
Lampiran 3 Rendemen Ekstrak daun tabat barito
Perlakuan n Bobot cawan (g)
Bobot Sampel (g)
Bobot Akhir (g)
Rendemen (%)
Rerata ± SD
Maserasi metanol
1 37.348 10.0017 39.1474 19.02 20.19 ± 1.27
2 38.2067 10.0022 40.1006 20.02
3 36.8767 10.0022 38.9152 21.54
Maserasi etanol
1 37.3359 10.0031 37.3359 24.83 26.00 ± 1.06
2 36.6152 10.0072 39.0986 26.23
3 37.6462 10.0044 40.1942 26.92
Ultrasonikasi metanol
1 37.9427 10.0069 37.9427 17.58 17.39 ± 0.17
2 36.8458 10.003 38.4772 17.24
3 37.4181 10.005 39.0593 17.34
Ultrasonikasi etanol
1 37.4166 10.0069 37.4166 24.04 23.89 ± 1.78
2 36.7935 10.0034 38.8793 22.04
3 36.069 10.0032 38.4917 25.60
Contoh perhitungan:
Penentuan rendemen ekstrak teknik maserasi metanol ulangan 1
23
Lampiran 4 Aktivitas Antioksidan Ekstrak daun tabat barito
Perlakuan Konsentrasi
(ppm)
Absorban Ulangan IC50 ± SD
1 2 3
MM 3.125 0.372 0.371 0.364 85.98405 ± 3.2580
6.25 0.351 0.362 0.341
12.5 0.336 0.339 0.344
25 0.294 0.296 0.296
50 0.245 0.237 0.229
100 0.192 0.192 0.180
ME 3.125 0.362 0.368 0.357 80.7468 ± 3.0811
6.25 0.344 0.341 0.348
12.5 0.318 0.324 0.316
25 0.292 0.299 0.280
50 0.225 0.262 0.234
100 0.173 0.174 0.170
UM 3.125 0.323 0.360 0.357 71.9302 ± 0.8639
6.25 0.349 0.343 0.341
12.5 0.316 0.315 0.305
25 0.288 0.281 0.274
50 0.216 0.212 0.214
100 0.158 0.156 0.158
UE 3.125 0.371 0.364 0.355 88.3656 ± 3.6622
6.25 0.360 0.355 0.319
12.5 0.342 0.345 0.337
25 0.310 0.296 0.299
50 0.247 0.237 0.231
100 0.197 0.196 0.183
Contoh perhitungan:
24
IC50 diperoleh ketika % inhibisi (y) = 50 Y = 0.455x + 9.734
50 = 0.455x + 9.734 X = 88.4967 ppm
25 Lampiran 5 Identifikasi metabolit ekstrak daun tabat barito pada 4 perlakuan
26
27 Lampiran 7 Identifikasi senyawa skaftosida pada waktu retensi 4.25 menit
28
Lampiran 8 Identifikasi senyawa luteolin pada waktu retensi 6.59 menit
Pola Pemecahan :
m/z 285 O O
H
OH O
OH
OH
C7H4O4
-152
m/z 133
CH OH
OH
-134 C8H6O2
OH O
H
OH O
29 Lampiran 9 Identifikasi senyawa orientin pada waktu retensi 4.39 menit
30
Lampiran 10 Identifikasi senyawa viteksin pada waktu retensi 4.86 menit
Pola Pemecahan:
O -O
O H
O H
OH O
m/z 431
O -O
O H
O H
O H
OH O
O -O
O OH OH O H
O H
O H
OH O
m/z 341
O -O
O H
O H
OH O
31 Lampiran 11 Identifikasi senyawa galokatekin pada waktu retensi 3.22 menit
Pola Pemecahan:
m/z 305
O OH
OH
OH OH
O H
OH
C7H6O3
-138
O OH OH
O H
m/z179
-168 C8H8O4
O OH
O H
m/z137
O OH OH
O H
m/z179 -126
32
Lampiran 12 Identifikasi senyawa katekin pada waktu retensi 3.53 menit
Pola Pemecahan :
C2H4O
-44
-90 C3H6O3
O
OH OH
OH O H
OH
m/z 289
O
OH O H
O OH
m/z 245
C H2
C H2
O
O OH
m/z 205
OH OH OH
33 Lampiran 13 Identifikasi senyawa epikatekin pada waktu retensi 4.05 menit
Pola Pemecahan :
m/z 289 O O
H
OH
OH OH OH
C2H4O
-44
C2H4O
-30
-90 C3H6O3
O O
H
OH
O
OH
m/z 245
C H2
C H2
O
O
OH
m/z 205
OH OH OH
34
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta tanggal 28 September 1976 sebagai anak ke-4 dari 5 bersaudara dari pasangan Djadiaman Sianturi (alm) dan Rengsina br Nababan. Saat ini penulis bertempat tinggal di Jl. Kol. Sutomo 3, RT 07/RW 06 No. 57 B, Jakarta Timur.
Penulis bekerja di Balai Besar Uji Standar Karantina Pertania, Badan Karantina Pertanian sejak Tahun 2005 dan ditempatkan sebagai pejabat fungsional Pengawas Mutu Hasil Pertanian di Jakarta. Tugas belajar disponsori dari Badan Penyuluh Sumber Daya Manusia Pertanian.