UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL(DPPH) DAN PENETAPAN KANDUNGAN
FENOLIK TOTAL FRAKSI AIR EKSTRAK METANOL DAUN SIRIH (Piper betle L.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Rollando
NIM: 088114127
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL(DPPH) DAN PENETAPAN KANDUNGAN
FENOLIK TOTAL FRAKSI AIR EKSTRAK METANOL DAUN SIRIH (Piper betle L.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Rollando
NIM: 088114127
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
Persetujuan Pembimbing
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL(DPPH) DAN PENETAPAN KANDUNGAN
FENOLIK TOTAL FRAKSI AIR EKSTRAK METANOL DAUN SIRIH (Piper betle L.)
Skripsi yang diajukan oleh: Rollando
NIM: 088114127
Telah disetujui oleh:
Pembimbing Utama
iv
HALAMAN PERSEMBAHAN
Contra vim mortis est medicamen in hortis
“ada obat di kebun yang dapat menanggulangi kekuatan
kematian”
Gutta cavat lapidem non vi, sed saepe cadendo; sic homo fit sapiens bis non, sed saepe legendo
“Batu berlubang bukan karena kekuatan yang
dashyat tapi akibat tetesan air yang
berulangkali; Begitu pula manusia menjadi
bijak bukan karena satu dua kali tapi karena
kerapkali membaca''
Ite Inflammate Omnia
“Pergilah dan kobarkanlah dunia”
Kupersembahkan skripsi ini untuk: TUHAN YESUS KRISTUS SANG PENYELAMAT, PELINDUNG DAN MAHAKARYA. TERIMA KASIH ATAS SEMUA YANG ENGKAU BERIKAN HINGGA SAAT INI.
MAMA DAN PAPA TERCINTA YANG MERAWAT DAN MENDIDIK AKU
DARI KECIL HINGGA SAAT INI. ADIK-ADIK AKU YANG AKU SAYANGI.
“CINTA KU UNTUK KALIAN TAK BISA TERUKUR SELAMANYA”
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini
tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan
dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila di kemudian hari ditemukan indikasi plagiarisme dalam naskah ini,
maka saya bersedia menanggung segala sanksi sesuai peraturan perundang-undangan
yang berlaku.
Yogyakarta, 12 November 2011
Penulis
vi
LEMBAR PERYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma:
Nama : Rollando Nomor Mahasiswa : 088114127
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya berjudul:
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI AIR EKSTRAK METANOL DAUN SIRIH (Piper betle L.)
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pengkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama saya tetap mencantumkan nama saya sebagai penulis.
Dengan demikian peryataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 12 November 2011 Yang menyatakan
vii PRAKATA
Puji Syukur kepada Tuhan atas semua berkat dan penyertaan-Nya kepada
penulis sehingga penulis dapat menyelesaikan skripsi yang berjudul “UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI AIR EKSTRAK METANOL DAUN SIRIH (Piper betle L.)”
ini dengan baik. Laporan akhir ini disusun untuk memenuhi salah satu persyaratan
utnuk memperoleh gelar Sarjana Strata 1 Program Studi Ilmu Farmasi (S.Farm).
Penulis banyak mengalami kesulitan dan masalah dalam menyelesaikan
laporan ini. Tetapi dengan adanya bantuan dari berbagai pihak, akhirnya penulis
dapat menyelesaikan laporan akhir ini. Oleh karena itu, dengan segala kerendahan
hati penulis ingin mengucapkan terima kasih atas segala bantuan yang telah diberikan
kepada:
1. Ipang Djunarko,M.Sc.,Apt., selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma.
2. Prof.Dr.C.J. Soegihardjo,Apt., selaku Dosen Pembimbing yang telah memberikan
bantuan dan bimbingan selama rancangan, pengusulan skripsi, saat dilakukan
penelitian dan selama penulisan skripsi dengan kesabaran dan penuh perhatian.
3. Yohanes Dwiatmaka,M.Si., selaku Dosen Penguji yang menguji sekaligus
viii
4. Lucia Wiwid Wijayanti,M.Si., selaku Dosen Penguji yang menguji sekaligus
memberi arahan, kritik, dan saran yang membangun bagi penulis.
5. C.M Ratna Rini Nastiti, selaku Dosen Pembimbing Akademik yang telah
mendidik dan memberi nasihat positif.
6. Segenap laboran Laboratorium Farmakognosi-Fitokimia (Mas Wagiran) dan
Kimia Analisis Instrumen (Om Bimo) atas segala bantuan selama penulis
melakukan penelitian di laboratorium Laboratorium Farmakognosi-Fitokimia dan
Kimia Analisis Instrumen.
7. Valentinus Widyawan, Aldo Sahala, Angela Vita , Antonius Pandu W., tim DPPH
yang kompak, saling mengisi kekurangan dan hebat. Tanpa kalian skripsi ini tidak
akan selesai.
8. Albert dan Pandu, kalian teman terhebat yang aku miliki.
9. Teman-teman FST 2008, atas kerjasama, doa, semangat, kritik, saran, kegilaan,
canda tawa dan segala masukannya.
9. Lois Monica Hilson, atas kasih, perhatian, dukungan, doa, semangat dan segala
masukannya
10. Sepupu aku, Aldo Kristian dan Andry Suhendra.
11. Nikop, Alex, Ai, Toke, Yu, Hengky, Agoes atas yang nilai kehidupan yang telah
dijalani bersama.
12. Semua pihak yang telah memberikan bantuan dan dukungan yang tidak dapat
ix
Penulis menyadari bahwa dalam penulisan skripsi ini banyak kesalahan dan
kekurangan mengingat keterbatasan kemampuan dan pengetahuan penulis. Untuk itu
penulis mengharapkan saran dan kritik yang membangun dari semua pihak. Akhir
kata semoga laporan ini dapat berguna bagi pembaca.
Yogyakarta,12 November 2011
x DAFTAR ISI
Halaman
HALAMAN JUDUL……….. i
HALAMAN PERSETUJUAN PEMBIMBING………. ii
HALAMAN PENGESAHAN……… iii
HALAMAN PERSEMBAHAN………. iv
PERYATAAN KEASLIAN PENULIS……….. v
LEMBAR PERYATAAN PERSETUJUAN PUBLIKASI KARYA……. vi
PRAKATA………. vii
DAFTAR ISI……….. x
DAFTAR TABEL……….. xv
DAFTAR GAMBAR……….. xvii
DAFTAR LAMPIRAN………... xix
INTISARI………... xx
ABSTRACT………... xxi
BAB I PENGANTAR………. 1
A. Latar Belakang……… 1
1. Permasalahan………. 5
2. Keaslian Penelitian……… 6
3. Manfaat penelitian……….... 7
xi
BAB II PENELAAHAN PUSTAKA……….. 8
A. Sirih………... . 8
1. Nama tumbuhan……… 8
2. Sistematika tumbuhan……….. 8
3. Gambaran umum sirih……… 9
4. Kandungan kimia sirih……….. 10
B. Senyawa Fenolik………... 11
C. Metode Folin-Ciocalteu……… 13
D. Radikal Bebas……… 14
E. Antioksidan……… 14
F. Metode DPPH ………... 16
G. Ekstraksi………. 17
H. Validasi Metode Analisis……… 19
I. Spekrofotometri Visibel………. 21
J. Landasan Teori………... 23
K. Hipotesis……….. 24
BAB III METODOLOGI PENELITIAN………. 25
A. Jenis dan Rancangan Penelitian………. 25
B. Variabel……….. 25
1. Variabel bebas………... 25
xii
3. Variabel pengacau terkendali……… . 25
4. Variabel pengacau tak terkendali……….. . 25
C. Definisi Operasional………. 26
D. Bahan dan Alat Penelitian………. . 26
1. Bahan penelitian……… . 26
2. Alat penelitian………... 27
E. Tatacara Penelitian……… 27
1. Determinasi tanaman……… 27
2. Pengumpulan bahan……….. 28
3. Preparasi daun sirih……….. 28
4. Pembuatan larutan pembanding dan uji……… 29
5. Uji pendahuluan………... 30
6. Optimasi metode uji aktivitas antioksidan………... 31
7. Uji aktivitas antioksidan……….. 32
8. Optimasi metode penetapan kandungan fenolat total……….. 33
9. Penetapan kandungan fenolat total……….. 34
F. Analisis Hasil……….. 35
BAB IV HASIL DAN PEMBAHASAN……… 37
A. Hasil Determinasi Tanaman………. 37
B. Hasil Pengumpulan Bahan……….. 37
xiii
1. Hasil ekstraksi sampel………. 41
2. Hasil fraksinasi ekstrak………. 47
D. Hasil Uji Pendahuluan………... 50
1. Uji pendahuluan senyawaan fenolik……… 50
2. Uji pendahuluan aktivitas antioksidan……… 51
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan……….. 53
1. Penentuan Operating Time (OT)……… . 53
2. Penentuan panjang gelombang maksimum ( λ maks)……… . 55
F. Hasil Validasi Metode Uji Aktivitas Antioksidan………... 57
1. Lineritas metode uji antioksidan………. 60
2. Akurasi metode uji antioksidan………... 61
3. Presisi metode uji antioksidan……….... . 63
3. Spesifisitas metode uji antioksidan………. 64
G. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH…………. 65
H. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total………… 79
1. Penentuan operating time (OT)………... 79
2. Penentuan panjang gelombang maksimum………... 80
I. Hasil Validasi Metode Penetapan Kandungan Fenolat Total………… . 81
1.Akurasi metode penetapan kandungan fenolik total……… 82
2. Presisi metode penetapan kadar kandungan fenolik total……… 83
xiv
4.Spesifisitas metode penetapan kandungan fenolik total………... 85
J. Hasil Penetapan Kandungan Fenolik Total………. 85
BAB V KESIMPULAN DAN SARAN……… 90
A. Kesimpulan……….. 90
B. Saran……… 90
DAFTAR PUSTAKA……… 91
LAMPIRAN……… 97
BIOGRAFI PENULIS……… 141
xv
DAFTAR TABEL
Halaman Tabel I. Kriteria nilai akurasi yang masih dapat diterima
menurut APVMA (2004)……… 20
Tabel II. Kriteria Nilai Presisi yang Masih dapat Diterima
menurut APVMA (2004) ……… 20
Tebel III . Hasil Scanningpanjang gelombang maksimum DPPH..… 56
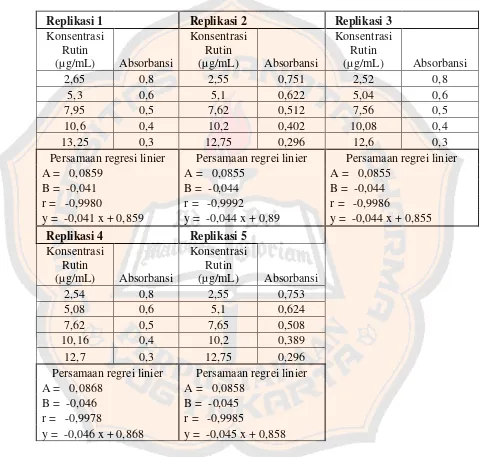
Tabel IV. Hasil pengukuran absorbansi seri baku rutin yang
direaksikan dengan radikal DPPH………... 58
Tabel V. Hasil pengukuran absorbansi seri fraksi air ekstrak
metanolik daun sirih yang direaksikan dengan DPPH... … 59
Tabel VI. Nilai perolehan kembali (% recovery) uji aktivitas
antioksidan rutin……….. 61
Tabel VII. Nilai perolehan kembali (% recovery) uji aktivitas
antioksidan fraksi air……… 62
Tabel VIII. Nilai CV uji aktivitas antioksidan rutin……….... 63
Tabel IX. Nilai CV uji aktivitas antioksidan fraksi air………,,,,,…… 63
Tabel X. Hasil aktivitas antioksidan rutin dengan menggunakan
metode DPPH……….. ……... 73
Tabel XI. Hasil aktivitas antioksidan fraksi air ekatrak metanolik
daun sirih dengan metode DPPH……… 74
xvi
daun sirih……….. 75
Tabel XIII. Tingkat kekuatan antioksidan senyawa uji dengan
metode DPPH (Ariyanto,2006)……….. 76
Tabel XIV. Hasil scanning panjang gelombang penetapan kandungan
fenolik total pada tiga konsentrasi asam galat………... 80
Tabel XV. Hasil pengukuran absorbansi baku asam galat………..…... 81
Tabel XVI. Nilai perolehan kembali (% recovery) penetapan kandungan
fenolik total………...………….. 83
Tabel XVII. Nilai CV penetapan kandungan fenolik total……….. 83
Tabel XVIII. Nilai r penetapan kandungan fenolik total……….. 84
Tabel XIX. Kadar asam galat dengan absorbansinya setelah
direaksikan dengan pereaksi Folin-Ciocalteu yang
diukur dengan panjang gelombang
750 nm………. 87
xvii
DAFTAR GAMBAR
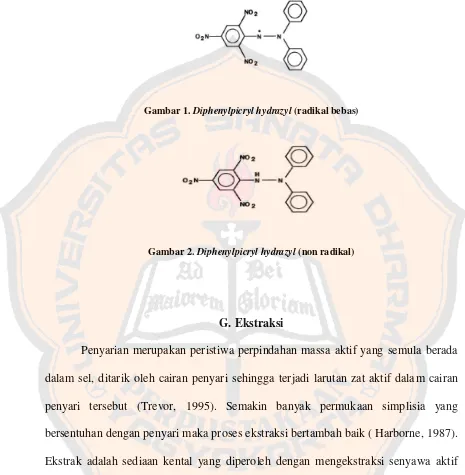
Halaman Gambar 1. Diphenylpicryl hydrazyl (radikal bebas)……….. 17
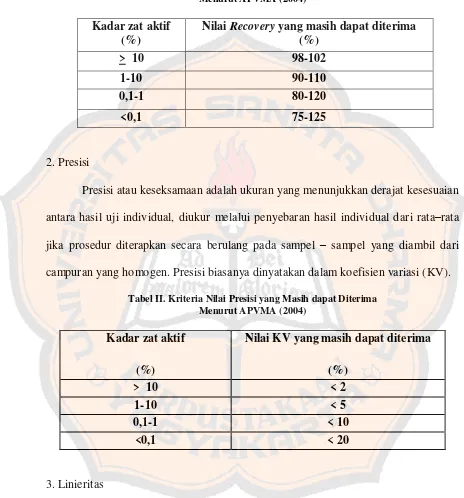
Gambar 2. Diphenylpicryl hydrazyl (non radikal)………. 17
Gambar 3. Skema jalannya penelitian……… 36
Gambar 4. Blangko (A), Fraksi air + Folin-Ciocalteu (B),
Asam galat + Folin Ciocalteu (C)……….…… 51
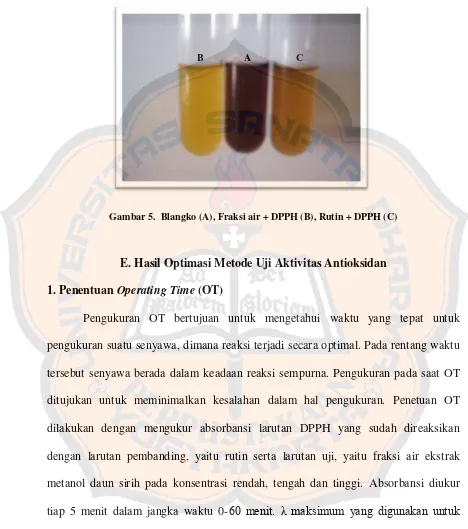
Gambar 5. Blangko (A), Fraksi air + DPPH (B), Rutin + DPPH (C)… 53
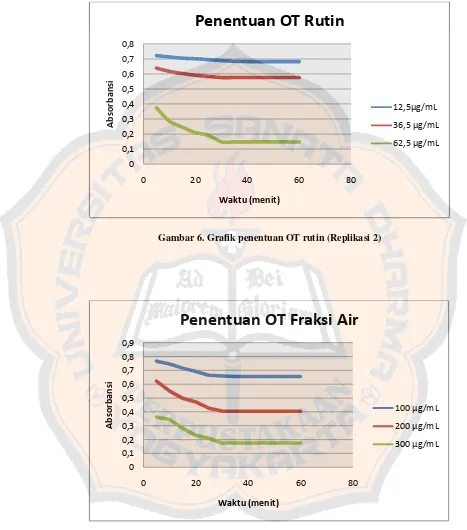
Gambar 6. Grafik penentuan OT rutin (Replikasi 2)……… 54
Gambar 7. Grafik Penetuan OT Fraksi Air (Replikasi 2)………. 54
Gambar 8. Reaksi antara radikal DPPH dengan senyawa
antioksidan (Nisizawa,2005)……….. 66
Gambar 9. Struktur Rutin………... 67
Gambar 10. Mekanisme penghambatan radikal bebas DPPH (•R)
oleh senyawa rutin………. 68
Gambar 11. Struktur katekol……….. 69
Gambar 12. Mekanisme penghambatan radikal bebas DPPH (•R)
oleh senyawa katekol……….. 70
Gambar 13. Struktur pirokatekin………. 71
Gambar 14. Mekanisme penghambatan radikal bebas DPPH (•R)
oleh senyawa pirokatekin……… 71
xviii
Gambar 16. Kurva persamaan regresi linier aktivitas antioksidan
fraksi air ekstrak metanolik daun sirih………. 75
Gambar 17. Histogram nilai IC50 rutin dan fraksi air ekstrak metanolik daun sirih………. 77
Gambar 18. Grafik penentuan OT Asam Galat………. 79
Gambar 19. Struktur molekul asam galat……….. 86
xix
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat determinasi tanaman sirih………. 97
Lampiran 2. Gambar tanaman sirih dari kebun obat Merapi Farma KM 21,5 Kaliurang……… 98
Lampiran 3 . Perhitungan rendemen……… 99 Lampiran 4. Data penimbangan untuk pengujian aktivitas antioksidan……… 100
Lampiran 5. Data konsentrasi bahan untuk pengujian aktivitas antioksidan……….. 101
Lampiran 6. Scanning larutan pengkoreksi untuk pengujian aktivitas antioksidan……… 105
Lampiran 7. Optimasi metode uji aktivitas antioksidan………….. 113
Lampiran 8. Uji aktivitas antioksidan menggunakan radikal DPPH……… 120
Lampiran 9. Perhitungan nilai IC50 rutin dan fraksi air ekstrak metanol daun sirih……… 124
Lampiran 10. Penimbangan uji kandungan fenolik total……… 126
Lampiran 11. Scanning kontrol asam galat……… 127
Lampiran 12. Optimasi penentuan kandungan fenolik total……….. 128
Lampiran 13. Penentuan kandungan fenolik total………. 132
xx INTISARI
Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan dan menetapkan kandungan fenolik total dari fraksi air ekstrak metanol daun sirih. Pengujian aktivitas antioksidan dilakukan secara kualitatif maupun kuantitatif menggunakan radikal 1,1-diphenyl-2-picrylhydrazyl (DPPH). Prinsip metode DPPH adalah penurunan intensitas absorbansi larutan DPPH sebanding dengan kenaikan konsentrasi senyawa antioksidan dan dinyatakan dengan Inhibition Concentration 50 (IC50 ), yang menyatakan konsentrasi suatu senyawa antioksidan untuk menghasilkan
penangkapan 50% radikal bebas. Penentuan kandungan fenolik total dilakukan dengan pereaksi Folin-Ciocalteu dengan menggunakan baku standar asam galat. Kandungan fenolik total dinyatakan dengan massa ekivalen asam galat. Prinsip metode ini adalah senyawa fenolik teroksidasi dan pereaksi Folin-Ciocalteu tereduksi menjadi larutan berwarna biru yang dapat diukur dengan spektrofotometer visibel pada panjang gelombang 750 nm.Hasil penelitian menunjukkan bahwa fraksi air ekstrak metanolik daun sirih mempunyai nilai IC50 sebesar 45,628 ± 1.,474 µg/mL
dan kandungan fenolik total sebesar 6,971 ± 0,167 mg ekivalen asam galat per gram fraksi air ekstrak metanol daun sirih.
xxi ABSTRACT
This research was conducted to determine the antioxidant activity and determine the total phenolic content of the water fraction of methanol extracts of betel leaf.Test of the antioxidant activity conducted qualitatively and quantitatively using a radical 1.1-diphenyl-2-picrylhydrazyl (DPPH). The principle of method is to decrease the intensity of the absorbance of DPPH that is comparable with the increase in the concentration of antioxidant compounds and is expressed as Inhibition Concentration 50 (IC50), which states the concentration of an antioxidant compound
to produce a 50% scavenging of free radicals.Determination of total phenolic content carried by the Folin-Ciocalteu reagent using gallic acid standard raw. The content of total phenolic acids expressed as equivalent mass of Gallic acid. The principle of this method is the oxidation reduction reaction, oxidized phenolic compounds and Folin-Ciocalteu reagent would be reduced to be a blue solution which can be measured by visible spectrophotometer at a wavelength of 750 nm.The results showed that the fraction of water extract of betel leaf metanolik have IC50 of 45,628 ± 1,474 µg/mL
and total phenolic content of 6,971 ± 0,167 mg gallic acid equivalents per gram of water fraction of methanol extract of betel leaf.
1
PENGANTAR A. Latar Belakang
Secara alami, dalam tubuh manusia terbentuk radikal bebas secara terus
menerus, hal ini bisa disebabkan proses metabolisme sel normal manusia maupun
respon imun terhadap pengaruh dari luar tubuh seperti cahaya ultraviolet, asap pabrik,
asap kendaraan, asap rokok maupun efek dari pemanasan global (global warming).
Radikal bebas adalah atom atau molekul yang tidak stabil dan sangat reaktif karena
mengandung satu atau lebih elektron tidak berpasangan pada orbital terluarnya.
Untuk mencapai kestabilan atom atau molekul, radikal bebas akan bereaksi dengan
molekul disekitarnya untuk memperoleh pasangan elektron. Radikal bebas akan
sangat reaktif menyerang molekul-molekul alami tubuh seperti lipoprotein, asam
lemak tak jenuh, protein, serta unsur DNA tubuh termasuk karbohidrat (Prakash,
2001; Frei ,1994; Trevor ,1995). Reaksi ini akan berlangsung terus menerus dalam
tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit seperti kanker,
jantung, katarak, penuaan dini, serta penyakit degeneratif lainnya. Oleh karena itu,
tubuh memerlukan suatu substansi penting, yaitu antioksidan yang mampu
menangkap radikal bebas tersebut sehingga tidak dapat menginduksi suatu penyakit
(Kikuzaki et al.,2002; Sibuea, 2003; dan Halliwell, 2000).
Cara pertahanan terbaik untuk mencegah kerusakan akibat radikal bebas
adalah meningkatkan pertahanan tubuh dengan olahraga, mengatur pola makan, dan
senyawa yang dapat menangkal radikal bebas, senyawa antioksidan dapat
memberikan elektron ( electron donor ). Dengan kata lain antioksidan merupakan
senyawa yang dapat menghambat reaksi oksidasi dengan mengikat radikal bebas
yang mengakibatkan kerusakan sel oleh radikal bebas dapat dihambat ( Kim et al.,
2002). Paling sedikit ada empat sumber antioksidan yaitu enzim (superoksid
dismutase, glutation peroksidase dan katalase), molekul besar (albumin,
ceruloplasmin, feritin), molekul kecil ( asam askorbat, asam urat, tokoferol,
karotenoid, polifenol, dan hormon (estrogen, angiotensin, melatonin) (Prior et al.,
2005).
Di dalam tubuh kita terdapat senyawa antioksidan, yaitu senyawa yang
dapat menetralkan radikal bebas, seperti: enzim SOD (Superoksid Dismutase) dan
katalase. Antioksidan juga dapat diperoleh dari asupan makanan yang banyak
mengandung vitamin C, vitamin E dan betakaroten serta senyawa fenolik. Bahan
pangan yang dapat menjadi sumber antioksidan alami, seperti rempah-rempah, coklat,
biji-bijian, buah-buahan, sayur-sayuran seperti buah tomat, pepaya, jeruk, dan
sebagainya (Prakash, 2001; Frei ,1994; Trevor , 1995).
Antioksidan sintesis biasa digunakan ke dalam formulasi makanan untuk
mengurangi oksidasi lemak yang menyebabkan ketengikan, toksisitas, dan destruksi
biomolekul makanan (Decker,1998). Antioksidan sintesis yang digunakan seperti
tert-butyl hydroquinone (tBHQ), butyl hydroxyl anisol (BHA) dan propil galat (PG)
dapat menyebabkkan kanker melalui mutasi DNA (Malkinson, 1999; Gharavi,
Haggaty, dan El-Kadi, 2007). Usaha untuk mencari senyawa antioksidan baru yang
aman dan efektif berkembang selama beberapa tahun terakhir. Banyak penelitian
yang menunjukkan bahwa senyawa antioksidan dalam tumbuhan dapat dihubungkan
dengan pencegahan stres oksidatif dan penyakit karena penuaan (Zou et al., 2004).
Hal inilah yang menyebabkan adanya penelitian eksplorasi secara intensif sumber
antioksidan alam yang berasal dari tumbuhan.
Indonesia sebagai negara tropis memiliki beraneka ragam tumbuhan yang
dapat dimanfaatkan sebanyak-banyaknya untuk kepentingan manusia. Masyarakat
Indonesia sejak zaman dahulu telah mengenal tumbuhan yang mempunyai khasiat
obat atau menyembuhkan berbagai macam penyakit. Tanaman yang berkhasiat obat
tersebut dikenal dengan sebutan tanaman obat tradisional (Thomas, 1993). Sirih
(Piper betle L.) termasuk tanaman obat yang sering digunakan, ini karena khasiatnya
untuk menghentikan pendarahan, sariawan, gatal-gatal, dan lain-lain. Ekstrak daun
sirih digunakan sebagai obat kumur dan batuk. Ekstrak daun sirih juga berkhasiat
sebagai antijamur pada kulit. Khasiat obat ini karena senyawa aktif yang
dikandungnya terutama adalah minyak atsiri (Noorcholies et al.,1997; Djatmiko et
al., 1998; Moeljatno, 2003).
Minyak atsiri merupakan minyak yang mudah menguap dan mengandung
aroma atau wangi yang khas (Sastroamidjojo, 1988). Minyak atsiri dari daun sirih
komponen paling banyak dalam minyak atsiri yang memberi bau khas pada sirih.
Persenyawaan fenol ini diketahui memiliki aktivitas antioksidan (Zou et al ,2004).
Senyawa-senyawa polifenol mampu menghambat autooksidasi melalui mekanisme
penangkapan radikal (radikal scavenging) dengan cara menyumbangkan satu elektron
yang tidak berpasangan pada radikal bebas sehingga banyaknya radikal bebas
menjadi berkurang dan energinya menjadi lebih rendah (Pokorny et al., 2001).
Senyawaan fenolat minyak atsiri dari daun sirih terdiri dari kavikol, katekol,
pirokatekin, karvakol, estargaol, eugenol, dan sineol. Akan tetapi, tetap terdapat
perbedaan komposisi maupun jumlah senyawa bioaktif dalam sirih sebagai akibat
pembibitan pada daerah yang berbeda (Wangcharoen dan Morasuk, 2007a). Dilihat
dari strukturnya senyawa-senyawa tersebut larut dalam pelarut polar, sehingga pada
fraksinasi digunakan pelarut polar (Noorcholies et al., 1997; Moeljatno, 2003).
Dalam penentuan aktivitas antioksidan telah diketahui bahwa senyawa yang
menyebabkan aktivitas tersebut berupa senyawa fenolik. Kesimpulan ini diperoleh
karena terdapat hubungan yang langsung antara aktivitas antioksidan suatu tumbuhan
dengan kandungan total fenoliknya (Aqil, Ahmad, dan Mehmood, 2006). Maka
penelitian ini bertujuan untuk mengetahui aktivitas antioksidan dan kandungan total
fenolik dari sirih.
Pemilihan penggunaan ekstrak metanol didasarkan dari adanya senyawa
fenolik yang lebih larut dalam pelarut polar, karena mayoritas senyawa fenolik
gula, oleh karena itu merupakan senyawa polar yang larut dalam pelarut polar seperti
etanol, metanol, butanol, aseton, air dan lain-lain (Markham, 1988). Pemilihan fraksi
air didasarkan dari strukturnya senyawa-senyawa tersebut larut dalam pelarut polar,
sehingga pada fraksinasi digunakan pelarut polar (Noorcholies et al., 1997;
Moeljatno, 2003).
Metode yang digunakan untuk menentukan aktivitas antioksidan dalam
penelitian ini adalah metode DPPH. Tujuan metode ini adalah untuk meneliti
parameter konsentrasi yang ekuivelen memberikan 50% efek aktivitas antioksidan
(IC50). Uji DPPH (1,1-diphenyl-2-picrylhydrazyl) adalah suatu metode kolorimetri
yang cepat, efektif dan sensitif untuk memperkirakan aktivitas antiradikal. Uji kimia
ini telah digunakan secara luas pada penelitian fitokimia untuk menguji aktivitas
penangkap radikal dari ekstrak atau senyawa murni (Widodo et al, 2004). Pada
penentuan kandungan fenolik total digunakan metode Folin-Ciocalteau. Metode ini
umum digunakan sebagai standar penentuan kandungan fenolik total setara massa
ekivalen asam galat pada uji aktivitas antioksidan sumber tumbuhan (Aqil et al.,
2006).
1. Permasalahan
b. Berapakah kandungan fenolik total fraksi air ekstrak metanol daun sirih yang
dinyatakan dengan massa ekivalen asam galat ?
2. Keaslian penelitian
Sejauh pengamatan penulis, penelitian tentang uji aktivitas antioksidan daun
sirih pernah dilakukan oleh :
1 . KY Pin et al., 2010, dengan judul “Antioxidant and anti-inflammatory activities of
Extracts of betel leaves (Piper betle L. ) from solvents with different polarities”.
Penelitian ini menggunakan daun sirih yang diperoleh dari hutan di Selangor dan
dibentuk dalam bentuk serbuk untuk diekstrak dengan air, etanol,etil asetat dan
n-heksana dengan ekstraksi dengan alat Soxlet dan diujikan dengan metode
xanthine oxidase superoxide scavenging assay (SOD assay) dan KCKT.
2. Suratmo, 2008, dengan judul “ Potensi Ekstrak Daun Sirih Merah (Piper
crocatum) Sebagai Antioksidan ”. Penelitian ini menggunakan daun sirih merah
yang diawali dengan melakukan ekstraksi bertahap dengan pelarut n-heksana, etil
asetat dan etanol, dilanjutkan dengan identifikasi komponen dari ketiga ekstrak
dengan GC-MS dan uji aktivitas antioksidan dengan metode DPPH (2,2
-diphenyl-1-picrylhydrazyl).
Perbedaan antara penelitian ini dengan penelitian sebelumnya adalah bahwa
dalam penelitian ini daun sirih dipanen dari Kebun Obat “MERAPI FARMA” daerah
diolah untuk mendapatkan fraksi air dari ekstrak metanol daun sirih kemudian diuji
aktivitas antioksidan menggunakan radikal DPPH dan ditetapkan kandungan fenolik
totalnya dengan menggunakan instrumen spektrofotometer UV-VIS.
3. Manfaat penelitian
a. Manfaat teoritis. Penelitian ini diharapkan dapat memberikan pengetahuan
tentang aktivitas antioksidan fraksi air ekstrak metanol daun sirih dengan
menggunakan radikal bebas DPPH yang dinyatakan dengan IC50.
b. Manfaat praktis. Penelitian ini diharapkan dapat memberikan informasi
tentang aktivitas antioksidan daun sirih sehingga bisa dimanfaatkan untuk
pemeliharaan kesehatan manusia dan olahan sediaan farmasi untuk menangkal
radikal bebas.
B. Tujuan Penelitian
1. Tujuan umum : menguji aktivitas antioksidan menggunakan radikal bebas DPPH
fraksi air ekstrak metanol daun sirih.
2. Tujuan khusus: mengetahui nilai aktivitas antioksidan fraksi air ekstrak metanol
daun sirih dengan menggunakan radikal bebas DPPH yang dinyatakan dengan IC50
dan mengetahui nilai kandungan fenolik total fraksi air ekstrak metanol daun sirih
8 BAB II
PENELAAHAN PUSTAKA A.Sirih
1. Nama tumbuhan
Nama latin : Piper betle Linn. (Dalimartha,1999).
Sinonim : Chavica auriculata Miq. ; C. betle Miq. (Dalimartha,1999).
Nama daerah : Jawa: suruh, sedah; Sunda: seureuh; Aceh: ranub, Batak Karo
belo; Lampung: cambia, Dayak: uwit, Bali : uwit base, Bima: nahi, Bugis : gapura
,Flores : mota, Sentani: afo. ( Muhlisah, 1999)
Common name : Assamese/Urdu/Hindi/Odia/Bengali: Paan , Sanskrit :
Tambula, Nagavalli, Tamil: Vetrilai,Tamalapaku , Marathi: Vidyache pan,
Kannada: veeleyada yele Malayala: Vettila , Malaysia : daun sirih, Philippine : Ikmo.
(Liao et al., 1999)
2. Sistematika tumbuhan
Berikut sistematika tumbuhan sirih:
Kingdom : Plantae
Division : Magnoliophyta
Class : Magnoliopsida
Order : Piperales
Family : Piperaceae
Genus : Piper
3. Gambaran umum sirih
Sirih merupakan tanaman menjalar dan merambat pada batang pohon di
sekelilingnya dengan daunnya yang berbentuk jantung, berujung runcing, tumbuh
bersilang-seling, bertangkai, teksturnya agak kasar dan mengeluarkan bau jika
diremas. Batangnya berwarna cokelat kehijauan, berbentuk bulat dan berkerut. Sirih
hidup subur dengan ditanam di daerah tropis dengan ketinggian 300-1000 m di atas
permukaan laut terutama di tanah yang banyak mengandung bahan organik dan air.
Sirih merupakan tumbuhan obat yang sangat besar manfaatnya (Fathilah, 2003).
Dalam farmakologi Cina, sirih dikenal sebagai tanaman yang memiliki sifat
hangat dan pedas. Secara tradisional, daun sirih telah digunakan untuk
menyembuhkan mata merah atau iritasi dengan merendam daun sirih dalam air
mendidih di wadah dan digunakan setelah air agak dingin. Daun sirih juga digunakan
untuk menghentikan perdarahan akibat mimisan dengan menggulung daun sirih
menyerupai rokok dan ujungnya yang runcing dimasukkan ke dalam lubang hidung
( Fathilah, 2003).
Penggunaan ekstrak daun sirih untuk berkumur dianjurkan jika mukosa mulut
mengalami pembengkakan, membersihkan nafas yang berbau (halitosis) akibat gigi
gangren serta untuk menghentikan darah dan membersihkan luka pencabutan gigi
4. Kandungan kimia sirih
Daun sirih memiliki aroma yang khas, yaitu rasa pedas dan tajam. Rasa dan
aroma yang khas tersebut disebabkan oleh kavikol dan bethelphenol yang terkandung
dalam minyak atsiri. Selain itu itu, faktor lain yang menentukan aroma dan rasa daun
sirih adalah jenis sirih itu sendiri, umur sirih, jumlah sinar matahari yang sampai ke
bagian daun dan kondisi dedaunan bagian atas tumbuhan (Fathilah, 2005).
Daun sirih mengandung minyak atsiri di mana komponen utamanya terdiri
atas fenol dan senyawa turunannya seperti kavikol, kavibetol, karvakol, eugenol, dan
allilpyrocatechol yang bertanggungjawab terhadap aktivitas antioksidan (Fathilah,
2006). Selain minyak atsiri, daun sirih juga mengandung karoten, tiamin, riboflavin,
asam nikotinat, vitamin C, tannin, gula, pati dan asam amino (Shun et al, 2007).
Kandungan eugenol dalam daun sirih mempunyai sifat antifungal ( Fathilah, 2006).
Daun sirih yang sudah dikenal sejak tahun 600 SM ini mengandung zat antiseptik
yang dapat membunuh bakteri sehingga banyak digunakan sebagai antibakteri dan
antijamur (Shun et al, 2007). Hal ini disebabkan oleh turunan fenol, yaitu kavikol
dalam sifat antiseptiknya lima kali lebih efektif dibandingkan fenol biasa. Dengan
sifat antiseptiknya, sirih sering digunakan untuk menyembuhkan kaki yang luka dan
mengobati pendarahan hidung mimisan ( Fathilah, 2006).
Dalam fraksi etanol ekstrak n-heksana etanol daun sirih ditemukan kavikol,
kavibetol, karvakol, eugenol, dan allilpyrocatechol yang memilik aktivitas antistres
suatu organisme meningkat, sehingga dapat menghasilkan radikal bebas. Radikal
bebas dapat merusak biomembran, hasil dari peningkatan peroksidasi lipid. Selama
proses ini stres oksidatif dapat diminimalkan dengan senyawa adaptogen atau
antioksidan (Kelanje, 2007).
B. Senyawa Fenolik
Senyawaan fenol ialah senyawaan aromatik yang mengandung satu atau lebih
gugus hidroksil yang terikat langsung pada cincin aromatiknya. Fenol dapat diperoleh
dari sumber alami seperti batubara dan tumbuhan, ataupun dibuat secara sintetis.
Destilasi batubara menghasilkan fraksi asam yang merupakan campuran senyawa
fenol, yaitu fenol, kresol, dan naftol. Fenol dengan struktur yang lebih kompleks
biasa diperoleh dari tumbuhan (Torselle, 1981).
Tumbuhan kayu tertentu menghasilkan guaiacol yang bisa membentuk
katekol. Hidrolisis tanin menghasilkan asam galat. Beberapa tumbuhan mengandung
minyak atsiri yang komponen utamanya biasanya eugenol dan timol. Senyawa fenol
lain yang terdapat dalarn tumbuhan ialah asam vanilat, kumarin, dan asam
klorogenat. Seperti halnya alkaloid, senyawa fenol tertentu bisa terdapat pada
tumbuhan dengan genus yang sarna. Sebagai contoh, kumarin terdapat pada
Ageratum strictum (Quijano dkk., 1981) dan Ageratum conyzoides (Shivani dkk.,
Senyawa fenol umumnya larut dalam air (Simpson, 1985). Furanokumarin,
salah satu turunan kumarin, lebih larut dalarn lemak (Harborne, 1973). Senyawa fenol
dapat menyerap sinar ultraviolet dan sifat ini dimanfaatkan pada deteksinya. Di
bawah sinar ultraviolet, senyawa ini menampakan warna kuning, ungu atau biru.
Kisaran panjang gelombang sinar ultaviolet yang diserap ialah 200 - 350 nm. Pada
umumnya, senyawa fenol mempunyai dua puncak serapan, walaupun ada pula yang
mempunyai tiga bahkan empat puncak serapan. Contohnya, asam p-kumarat
menunjukkan puncak serapan pada 227 dan 310 nm, asarn ferulat pada 235 dan 324
nm, flavon luteolin pada 225, 268 dan 350 nm, dan kumarin pada 212, 274, 282 dan
312 nm (Appleguist, 1982)
Reaksi yang terjadi pada fenol dapat melalui gugus hidroksilnya atau dengan
menggantikan atom hidrogen pada cincin aromatiknya. Sifat lainnya yang menarik
ia1ah fenol mampu mengkompleks protein sehingga beberapa enzim dapat dihambat.
Sifat ini menguntungkan proses ekstraksi, karena dapat diharapkan selarna ekstraksi
tidak terjadi reaksi enzimatik. Tetapi, fenol peka terhadap oksidasi dan ini bisa
menyebabkan perubahan fenol selama ekstraksi (Simpson, 1985).
Sejauh ini, senyawa fenolik tumbuhan merupakan golongan mayoritas
senyawa yang bertindak sebagai antioksidan atau penangkapan radikal bebas. Hal ini
menjadi sangat beralasan untuk mendeterminasi jumlah kandungan fenolik total pada
ekstrak tanaman yang telah dipilih (Veeru, Kishkar, dan Meennakashi, 2009).
memberikan atom hidrogennya melalui proses transfer elektron, sehingga senyawa
fenolik berubah menjadi radikal fenoksil. Radikal fenoksil ini terstabilkan oleh
resonansi ( Brunneton, 1999).
C. Metode Folin-Ciocalteu
Senyawa fenolik dalam suatu sampel dapat diukur dengan metode
Folin-Ciocalteu (Verru et al., 2009). Metode ini menggunakan reagen fenol asam
fosfomolibdat-fosfotungstat yang biasa disebut reagen fenol Folin-Ciocalteu. Prinsip
metode Folin-Ciocalteu adalah oksidasi gugus fenolik hidroksil. Pereaksi ini
mengoksidasi fenolat (garam alkali), mereduksi asam heteropoli menjadi suatu
kompleks molibdenum-tungsten (Mo-W). Fenolat hanya terdapat pada larutan basa,
tetapi pereaksi Folin-Ciocalteu dan produknya tidak stabil pada kondisi basa. Selama
reaksi berlangsung, gugus fenolik-hidroksil bereaksi dengan pereaksi
Folin-Ciocalteu, membentuk kompleks fosfotungstat-fosfomolibdat berwarna biru. Warna
biru yang terbentuk akan semakin pekat setara dengan konsentrasi ion fenolat yang
terbentuk, artinya semakin besar konsentrasi senyawa fenolik maka makin banyak ion
fenolat yang akan mereduksi asam heteropoli sehingga warna biru yang dihasilkan
semakin pekat (Singleton dan Rossi, 1965). Intensitas warna biru yang terbentuk
proporsional dengan jumlah senyawa yang dapat mereduksi dan dapat dideteksi
dengan spektrofotometer dengan rentang panjang gelombang 500-700 (Abdul-Fadl,
D. Radikal Bebas
Radikal bebas merupakan atom atau molekul yang sifatnya sangat tidak stabil
karena mempunyai satu elektron atau lebih yang tidak berpasangan, sehingga untuk
memperoleh pasangan elektron senyawa ini sangat reaktif dan merusak jaringan.
Radikal bebas yang terbentuk cenderung untuk mengadakan reaksi berantai yang bila
terjadi dalam tubuh dapat menimbulkan kerusakan-kerusakan yang serius (Percival,
1998). Untuk mencapai kestabilan atom atau molekul, radikal bebas akan bereaksi
dengan molekul di sekitarnya untuk memperoleh pasangan elektron. Reaksi seperti
ini berlangsung terus menerus dalam tubuh dan bila tidak dihentikan maka akan
menimbulkan penyakit seperti kanker, jantung, katarak, penuaan dini, serta penyakit
degeneratif lainnya (Andayani, Lisawati, dan Maemunah, 2008).
E. Antioksidan
Antioksidan merupakan suatu senyawa yang berperan dalam menghambat
oksidasi yang diperantarai oksigen. Senyawa antioksidan memegang peranan penting
dalam pertahanan tubuh terhadap penyakit. Hal tersebut disebabkan senyawa
antioksidan dapat mencegah pengaruh buruk yang disebabkan oleh senyawa radikal
bebas (Percival, 1998).
Sistem antioksidan dibagi menjadi dua kelompok, yaitu kelompok enzimatik
dan non-enzimatik. Antioksidan enzimatik terdiri dari superoxide dismutase (SOD),
vitamin A, provitamin A (β-karoten), dan vitamin C. Antioksidan enzimatik secara
alamiah dihasilkan oleh tubuh, sedangkan antioksidan non-enzimatik diperoleh dari
luar tubuh (Fouad, 2005).
Sumber-sumber antioksidan dapat dikelompokkan menjadi dua kelompok,
yaitu antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesis reaksi kimia)
dan antioksidan alami (antioksidan hasil ekstraksi bahan alami). Beberapa contoh
antioksidan sintetik telah sering digunakan, antara lain adalah butil hidroksi anisol
(BHA), butil hidroksi toluen (BHT), propil galat, tert-butil hidoksiquinon (tBHQ)
(Fouad, 2005).
Pada saat ini penggunaan bahan pengawet dan antioksidan sintetis tidak
direkomendasikan oleh Badan Pengawas Obat dan Makanan (BPOM) karena diduga
dapat menimbulkan penyakit kanker (carcinogen agent). Seperti penggunaan tBHQ
pada dosis tinggi menyebabkan kanker otak, hal ini dikarenakan terbentuknya radikal
semikuinon anion dan ROS yang menyerang sel otak. Begitu pula dengan BHT dan
BHA, dalam konsentrasi tinggi dapat menginduksi tumor pada perut dan liver hewan
uji. Karena itu, perlu dicari alternatif lain, yaitu bahan pengawet dan antioksidan
alami yang bersumber dari bahan alam. Bahan pengawet dan antioksidan alami ini
hampir terdapat pada semua tumbuh-tumbuhan dan buah-buahan tersebar di seluruh
F. Metode DPPH
Pada percobaan ini, uji aktivitas antiradikal menggunakan metode DPPH (1,1
-diphenyl-2-picrylehydrazyl). Metode DPPH adalah suatu metoda kolorimetri yang
efektif dan cepat untuk memperkirakan aktivitas antiradikal. Uji kimia ini secara luas
digunakan dalam penelitian produk alami untuk isolasi antioksidan fitokimia dan
untuk menguji seberapa besar kapasitas ekstrak dan senyawa murni dalam menyerap
radikal bebas (Molyneux, 2003).
Molekul 1,1-diphenyl-2-picryl-hydrazyl (DPPH) merupakan suatu radikal
bebas yang stabil dengan adanya delokalisasi elektron bebas pada molekul tersebut.
Delokalisasi ini menyebabkan peningkatan warna violet, yang ditunjukkan dengan
pita absorpsi dalam larutan etanol pada panjang gelombang 517 nm. Saat larutan
DPPH dicampurkan dengan substansi yang dapat memberikan hidrogen radikal, akan
menyebabkan terjadinya bentuk tereduksi dengan pemudaran warna violet
(Molyneux, 2003).
Salah satu parameter yang telah diketahui sebagai interpretasi hasil dari
metode DPPH yang dilakukan adalah “inhibit concentration50” atau nilai IC50. Nilai
ini didefinisikan sebagai konsentrasi substrat yang menyebabkan 50% hilangnya
aktivitas DPPH. Nilai aktivitas antioksidan diketahui melalui nilai IC50 yang
dihasilkan, bahwa semakin tinggi aktivitas antioksidan suatu senyawa, maka semakin
Gambar 1. Diphenylpicryl hydrazyl (radikal bebas)
Gambar 2. Diphenylpicryl hydrazyl (non radikal)
G. Ekstraksi
Penyarian merupakan peristiwa perpindahan massa aktif yang semula berada
dalam sel, ditarik oleh cairan penyari sehingga terjadi larutan zat aktif dalam cairan
penyari tersebut (Trevor, 1995). Semakin banyak permukaan simplisia yang
bersentuhan dengan penyari maka proses ekstraksi bertambah baik ( Harborne, 1987).
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif
dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan ( Dirjen POM, 1995). Untuk
metode ekstraksi yang cepat dan teliti. Pemilihan metode ekstraksi tergantung pada
sumber bahan alami dan senyawa yang akan diisolasi tersebut (Harborne, 1987).
Maserasi merupakan cara penyarian yang sederhana, dilakukan dengan cara
merendam serbuk simplisia dalam cairan penyari. Pada saat proses maserasi, cairan
penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang
mengandung zat aktif, zat aktif akan larut dan karena adanya perbedaan konsentrasi
antara larutan zat aktif di dalam sel dengan yang di luar sel, maka larutan yang pekat
didesak keluar. Peristiwa tersebut berulang sehingga terjadi keseimbangan
konsentrasi antara larutan di luar sel dan didalam sel. Maserasi umumnya digunakan
untuk simplisia yang tidak keras, dan tidak kompak (Depkes, 1986).
Remaserasi adalah modifikasi cara penyarian maserasi. Pada proses
remaserasi cairan penyari dibagi dua. Seluruh serbuk simplisia dimaserasi dengan
cairan penyari pertama, sesudah diendap tuangkan dan diperas, ampas dimaserasi lagi
dengan cairan penyari yang kedua (Depkes, 1986).
Ekstraksi cair-cair didasarkan pada distribusi zat terlarut dengan perbandingan
tertentu antara dua zat pelarut yang tidak saling bercampur. Batasannya adalah zat
terlarut dapat ditransfer pada jumlah yang berbeda dalam kedua fase terlarut. Teknik
ini dapat digunakan untuk kegunaan prepratif, pemurnian, pemisahan serta analisis
pada semua kerja (Trevor, 1995).
Menentukan cara efisien untuk memindahkan suatu zat kepelarut yang kedua,
dengan menggunakan sejumlah volume tertetu pelarut kedua, hasilnya kurang efisien
bila dibandingkan dengan beberapa kali ekstraksi menggunakan volume yang sama.
Hal ini sesuai rumus :
x
n=x
0(
𝑫𝑽 𝑫𝑽+𝒗)
n
dimana D adalah koefisien distribusi antara dua pelarut,xn adalah bobot zat yang
tertinggal pada pelarut 1, x0 adalah bobot zat yang terlarut pada pelarut 1, V adalah
volume pelarut 1, dan v adalah volume pelarut 2, serta n adalah banyaknya ekstraksi
yang dilakukan (n kali) (Basset, Denney, Jeffery dan Medham, 1991).
H. Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter
tertentu, berdasarkan percobaan laboratorium, untuk membuktikan bahwa parameter
tersebut memenuhi persyaratan dalam penggunaannya (Harmita, 2004). Parameter
parameter yang digunakan untuk validasi diantaranya adalah sebagai berikut.
1. Akurasi
Akurasi atau kecermatan adalah ukuran yang menunjukkan derajat kedekatan
hasil analisis dengan kadar analit yang sebenarnya. Akurasi dinyatakan sebagai
Tabel I. Kriteria Nilai Akurasi yang Masih dapat Diterima Menurut APVMA (2004)
Kadar zat aktif (%)
Nilai Recovery yang masih dapat diterima (%)
Presisi atau keseksamaan adalah ukuran yang menunjukkan derajat kesesuaian
antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata–rata
jika prosedur diterapkan secara berulang pada sampel – sampel yang diambil dari
campuran yang homogen. Presisi biasanya dinyatakan dalam koefisien variasi (KV).
Tabel II. Kriteria Nilai Presisi yang Masih dapat Diterima Menurut APVMA (2004)
Kadar zat aktif Nilai KVyang masih dapat diterima
(%) (%)
Linieritas merupakan kemampuan suatu metode (pada rentang tertentu) untuk
mendapatkan hasil uji yang secara langsung proporsional dengan konsentrasi
4. Spesifisitas
Spesifisitas suatu metode adalah kemampuannya yang hanya mengukur zat
tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin
ada dalam matriks sampel. Selektivitas metode ditentukan dengan membandingkan
hasil analisis sampel yang mengandung cemaran, hasil urai, senyawa sejenis,
senyawa asing lainnya atau pembawa placebo dengan hasil analisis sampel tanpa
penambahan bahan-bahan tadi. Penyimpangan hasil merupakan selisih dari hasil uji
keduanya (Harmita, 2004).
5. LOD (limit of detection) dan LOQ (limit of quantitation)
Limit of detection (LOD) adalah jumlah terkecil analit dalam sampel yang
dapat dideteksi dan masih memberikan respon signifikan dibandingkan dengan
blanko. Limit of quantitation (LOQ) merupakan kuantitas terkecil analit dalam
sampel yang masih dapat memenuhi kriteria akurasi dan presisi. LOD dan LOQ dapat
dihitung secara statistik melalui garis regresi linier dari kurva kalibrasi (Harmita,
2004).
I. Spekrofotometri Visibel
Spektrofotometri visibel adalah salah satu teknik analisis fisika-kimia yang
mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik pada
(2003), absorbansi DPPH terjadi dengan baik pada daerah cahaya tampak (visible),
oleh sebab itu digunakan spektrofotometri visibel untuk pengukuran absorbansinya.
Interaksi antara senyawa yang mempunyai gugus kromofor dengan radiasi
eleektromagnetik pada daerah UV-Vis (200-800 nm) akan menghasilkan transisi
elektromagnetik dan spektra absorbansi elektromagnetik. Jumlah radiasi
elektromagnetik yang diserap akan sebanding dengan jumlah molekul penyerapnya,
sehingga spektra absorbansi dapat digunakan untuk analisis kuantitatif (Fessenden
dan Fessenden, 1995).
Bila suatu molekul senyawa organik menyerap sinar UV atau tampak maka di
dalam molekul tersebut terjadi perpindahan (transisi elektron) dari berbagai jenis
tingkat energi orbital dari molekul tersebut (Sastrohamidjojo, 2001). Absorbsi cahaya
oleh suatu molekul merupakan suatu bentuk interaksi antara gelombang cahaya
(foton) dan atom atau molekul. Proses absorbsi cahaya UV-Vis berkaitan dengan
promosi elektron dari satu orbital molekul dengan tingkat energi elektronik tertentu
ke orbital lain dengan tingkat energi elektronik yang lebih tinggi.
Secara umum, ada tiga macam distribusi elektron dalam suatu senyawa
organik, yaitu orbital pi (π), sigma (σ) dan elektron tidak berpasangan (n). Apabila
radiasi elektromagnetik mengenai molekul, maka akan terjadi eksitasi elektron ke
tingkat energi yang lebih tinggi yang dikenal sebagai orbital elektron antibonding
J. Landasan Teori
Radikal bebas adalah atom atau molekul yang tidak stabil dan sangat reaktif
sehingga untuk mencapai kestabilan atom atau molekul, radikal bebas akan bereaksi
dan sangat reaktif menyerang molekul-molekul alami tubuh seperti lipoprotein, asam
lemak tak jenuh, protein, serta unsur DNA tubuh termasuk karbohidrat sehingga
menimbilkan penyakit seperti kanker, jantung, katarak, penuaan dini, serta penyakit
degeneratif lainnya. Antioksidan sintetis seperti penggunaan tBHQ ,BHT dan BHA,
dalam konsentrasi tinggi dapat menginduksi tumor dan kanker oleh karena itu tidak
direkomendasikan oleh Badan Pengawas Obat dan Makanan (BPOM).
Daun sirih yang sudah dikenal sejak tahun 600 SM mengandung zat
antiseptik yang dapat membunuh bakteri sehingga banyak digunakan sebagai
antibakteri dan antijamur. Senyawa fenolik yan terdapat pada daun sirih berupa
ditemukan kavikol, kavibetol, karvakol, pirokatekin, eugenol, dan allilpyrocatechol.
Aktivitas antioksidan dari senyawa fenolik didapatkan dengan cara mereduksi radikal
bebas untuk tidak terjadinya reaksi samping yang merugikan.
Metode DPPH adalah suatu metoda kolorimetri yang efektif dan cepat untuk
memperkirakan aktivitas antiradikal dalam uji antioksidan. Molekul 1,1-diphenyl
-2-picryl-hydrazyl (DPPH) merupakan suatu radikal bebas yang stabil dengan adanya
delokalisasi elektron bebas pada molekul tersebut. Delokalisasi ini menyebabkan
etanol pada panjang gelombang 517 nm. Keberadaan senyawa antioksidan dapat
mengubah warna larutan DPPH dari ungu menjadi kuning.
Senyawa fenolat dalam suatu sampel dapat diukur dengan metode
Folin-Ciocalteu. Metode ini menggunakan reagen fenol asam fosfomolibdat-fosfotungstat
Prinsip metode Folin-Ciocalteu adalah oksidasi gugus fenolik hidroksil. Selama
reaksi belangsung, gugus fenolik-hidroksil bereaksi dengan pereaksi Folin-Ciocalteu,
membentuk kompleks fosfotungstat-fosfomolibdat berwarna biru. Warna biru yang
terbentuk akan semakin pekat setara dengan konsentrasi ion fenolat yang terbentuk.
K. Hipotesis
Fraksi air ekstrak metanol daun sirih mempunyai aktivitas antioksidan
menggunakan radikal bebas DPPH. Kadar fenolat dalam fraksi air ekstrak metanol
25 BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental rancangan acak
sederhana karena subjek uji diberi perlakuan.
B. Variabel
1. Variabel bebas berupa konsentrasi fraksi air ekstrak metanolik daun sirih .
2. Variabel tergantung berupa aktivitas antioksidan (%IC) dan kandungan fenolik
total fraksi air ekstrak metanolik daun sirih.
3. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu pemanenan,
umur daun yang dipanen, cara panen, cara pengeringan dan pembuatan simplisia,
dan jumlah (g) daun segar yang digunakan. cahaya matahari
4. Variabel pengacau tak terkendali berupa, cuaca atau musim, dan curah hujan,
C. Definisi Operasional
1. Daun sirih adalah daun (folium) dari tanaman sirih yang dipanen dari kebun obat
“MERAPI FARMA” daerah KM 21,5 Kaliurang, Cangkringan, Sleman,
Yogakarta dengan bentuk daun oval, dengan diameter ± 6 cm, berwarna hijau,
batang merambat bercabang, daun ketiga dari pucuk sampai pangkal cabang.
2. Ekstrak daun sirih adalah ekstrak kental yang diperoleh dari hasil maserasi dengan
metanol dan telah mengalami tahap uji kualitas ekstrak.
3. Fraksi air adalah hasil fraksi ekstak metanol daun sirih dengan menggunakan air
yang telah difraksinasi menggunakan wasbensin dan etil asetat.
4.Persen inhibition concentration (%IC) adalah persen yang menyatakan kemampuan
fraksi air ekstrak metanolik daun sirih untuk menangkap radikal DPPH.
5. inhibition concentration 50 (IC50) adalah nilai konsentrasi fraksi air ekstrak
metanolik daun sirih yang menghasilkan penangkapan 50% radikal DPPH.
D. Bahan dan Alat Penelitian 1. Bahan penelitian
Bahan yang digunakan dalam penelitian ini antara lain: daun sirih (Piper betle
L.) yang berasal dari Kebun Obat “MERAPI FARMA” daerah KM 21,5 Kaliurang,
Cangkringan, Sleman, Yogakarta. Bahan kima kualitas farmasetis (CV. General
metanol. Bahan kualitas pro analitik Sigma Chem. Co., USA meliputi rutin, DPPH ,
reagen Folin-Ciocalteu, asam galat. Bahan kualitas teknis Brataco Chemica, yaitu:
wasbensin dan etil asetat dan aluminium foil.
2. Alat penelitian
Alat-alat yang digunakan dalam penelitian ini berupa vortex (junke & kunkel),
spektrofotometer UV-VIS (Perkin Elmer Lamda 20), blender, corong, Buchner, oven,
mikropipet 10-1000 µL; 1-10 mL (Acura 825, Socorex), neraca analitik (Scaltec SBC
22, BP 160P), vacuum rotary evaporator (Junke & Kunkel), waterbath (labo-tech,
Heraceus), tabung reaksi bertutup, dan alat-alat gelas yang lazim digunakan di
laboratorium analisis (Pyrex-Germany dan Iwaki).
E. Tatacara Penelitian
1. Determinasi tanaman
Determinasi tanaman sirih dilakukan di Laboratorium
Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma menurut van Steenis (1980).
2. Pengumpulan bahan
Daun sirih diperoleh dari kebun obat “MERAPI FARMA” daerah KM 21,5
bulan Mei. Pemanenan dilakukan pada tanaman yang sebelum berbunga saat pagi
hari.
3. Preparasi daun sirih
Sebanyak 1 kg daun sirih segar, dibersihkan ,dan dihaluskan dengan blender.
Ketika dihaluskan, daun tersebut ditambahkan sedikit cairan penyari (metanol).
Simplisia yang telah dihaluskan ditimbang sebanyak 30 gram dan dituang kedalam
bejana maserasi, ditambah metanol sampai terendam sempurna, dan dicampur
homogen. Campuran dimasersi pada suhu ruangan selama dua hari. Filtrat diperoleh
melalui penyaringan dengan corong Buchner. Ampas penyaringan diremaserasi
dengan metanol secukupnya selama 2 hari. Kemudian disaring. Lalu hasil
penyaringan filtrat diuapkan pelarutnya hingga diperoleh ekstak metanol daun sirih.
Ekstrak metanol daun sirih ditambahkan 300 mL air hangat dan di ekstraksi
cair-cair menggunakan wasbensin dengan perbandingan larutan ekstrak wasbensin
(1:1 v/v), kemudian didiamkan hingga terpisah sempurna. Fase air akan berada pada
paling bawah, sedangkan fase washbensin berada pada bagian atas.
Dari hasil partisi diperoleh dua fraksi, yaitu fraksi wasbensin dan fraksi air.
Selanjutnya, fraksi air diekstraksi cair-cair lagi menggunakan etil asetat dengan
perbandingan larutan fraksi air-etil asetat (1:1 v/v) sehingga didapatkan fraksi air dan
dan waterbath hingga didapakan ekstrak kental. Lalu hasil fraksi tersebut digunakan
analisis lebih lanjut.
4. Pembuatan larutan pembanding dan uji
a. Pembuatan larutan DPPH
Sejumlah DPPH dilarutkan ke dalam metanol p.a sehingga diperoleh
larutan DPPH dengan konsentrasi 0,4 mM. Larutan tersebut ditutup dengan
alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan stok rutin
Sebanyak 2,5 mg rutin dilarutkan dengan metanol p.a sampai 10,0 mL.
c. Pembuatan larutan pembanding
Diambil sebanyak 0,5; 1,0; 1,5; 2,5; 3,0 mL larutan stok rutin, kemudian
ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi larutan
standar rutin sebesar 12,5; 25,0; 37,5; 50,0; dan 62,5 μg/mL.
d. Pembuatan larutan uji
i. Larutan uji untuk aktivitas antioksidan
Sejumlah 25,0 fraksi air ditimbang dan di ad metanol p.a sampai 25,0
mL. Diambil sebanyak 1,0; 1,5; 2,0; 2,5; 3,0 mL larutan tersebut, kemudian
ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi
ii. Larutan uji untuk penentuan kandungan fenolik total
Sebanyak 7,5 mg fraksi airt ditimbang, lalu ditambahkan metanol p.a
sampai diperoleh konsentrasi larutan uji sebesar 750,0 µg/mL.
e. Pembuatan larutan asam galat
Dibuat larutan asam galat dengan konsetrasi 500 µg/mL dalam akuades :
methanol p.a (1:1). Diambil sebanyak 1,0; 1,5; 2,0; 2,5; dan 3,0 mL larutan
tersebut, kemudian ditambahkan akuades : metanol p.a (1:1) sampai 10,0 mL,
sehingga diperoleh konsentrasi larutan baku asam galat sebesar 50; 75; 100; 125;
dan 150 µg/mL.
5. Uji pendahuluan
a. Uji fenolik
Sejumlah 0,5 mL larutan uji 750,0 µg/mL dan larutan pembanding asam
galat 150,0 µg/mL ditambahkan 2,5 mL pereaksi fenol Folin-Ciocalteu yang telah
diencerkan dengan akuades (1:10 v/v) kedalam tabung reaksi. Diamkan selama 10
menit. Tambahkan 7,5 mL larutan natrium karbonat 1 M. Kemudian amati warna
larutan tersebut.
b. Uji pendahuluan aktivitas antioksidan
Sebanyak 1 mL larutan DPPH dimasukan ke dalam masing-masing tiga
tabung reaksi. Ditambahkan masing-masing dengan 1 mL metanol p.a, larutan
tersebut ditambahkan dengan 3 mL metanol p.a. Larutan tersebut kemudian
divortex selamam 30 detik. Setelah 30 menit, amati warna pada larutan tersebut.
6. Optimasi metode uji aktivitas antioksidan
a. Penentuan operating time (OT)
Sebanyak 1 mL larutan DPPH dimasukan kedalam masing-masing tiga
labu ukur 5 mL, ditambahkan masing-masing dengan 1 mL larutan pembanding
rutin 12,5; 37,5 dan 62,5 μg/mL. Selanjutnya larutan tersebut ditambahkan
dengan metanol p.a hingga tanda batas. Larutan tersebut kemudian divortex
selama 30 detik. Setelah itu dibaca absorbansinya denga spektrofotometer
visibel pada panjang gelombang 517 nm selama 1 jam. Dilakukan demikian
juga untuk larutan uji 100; 200; 300 μg/mL.
b. Penentuan panjang gelombang serapan maksimum
Pada 3 labu ukur 10 mL, dimasukan masing-masing 0,5; 1,0; 1,5 mL
larutan DPPH. Ditambahkan larutan tersebut dengan metanol p.a hingga tanda
batas sehingga konsentrasi DPPH menjadi 0,020; 0,040; dan 0,080. Larutan
tersebut kemudian divortex selama 30 detik. Diamkan selama OT. Lalu
dilakukan scanning panjang gelombang serapan maksimum dengan
spektrofotometer visibel pada panjang gelombang 400-600 nm.
7. Uji aktivitas antioksidan
Uji aktivitas antioksidan ditentukan dengan menggunakan metode
a. Pengukuran absorbansi larutan DPPH (kontrol)
Pada labu ukur 10 mL, dimasukan sebanyak 2 mL larutan DPPH.
Ditambahan larutan tersebut dengan metanol p.a hingga tanda batas. Kemudian
larutan tersebut dibaca absorbansinya pada saat OT dan panjang gelombang
maksimum. Pengerjaan dilakukan sebanyak 5 kali. Larutan ini digunakan sebagai
kontrol untuk menguji larutan pembanding dan uji.
b. Pengukuran absorbansi larutan pembanding dan uji
Sebanyak 1 mL larutan DPPH dimasukkan ke dalam tabung reaksi
bertutup kemudian ditambah dengan 1 mL larutan pembanding dan uji pada
berbagai seri konsentrasi telah dibuat. Selanjutnya larutan tersebut ditambah
dengan metanol p.a hingga tanda batas. Larutan tersebut kemudian divortex
selama 30 detik dan diamkan selama OT. Larutan dibaca absorbansinya dengan
spektrofotometer visibel pada panjang gelombang maksimum hasil optimasi.
Pengujian dilakukan dengan 5 kali replikasi.
c. Validasi metode uji aktivitas antioksidan
Hasil dari prosedur 7 a dan b, divalidasi akurasi (% recovery), presisi (%CV)
spesipisitas (spektra kontrol), dan linearitas (nilai r).
% Recovery = 𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑟𝑢𝑡𝑖𝑛 𝑎𝑡𝑎𝑢 𝑓𝑟𝑎𝑘𝑠𝑖 𝑎𝑖𝑟𝑡𝑒𝑟𝑢𝑘𝑢𝑟
𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑟𝑢𝑡𝑖𝑛 𝑎𝑡𝑎𝑢 𝑓𝑟𝑎𝑘𝑠𝑖 𝑎𝑖𝑟𝑡𝑒𝑟𝑢𝑘𝑢𝑟 x 100%
% CV = 𝑆𝑡𝑎𝑛𝑑𝑎𝑟 𝐷𝑒𝑣𝑖𝑎𝑠𝑖 𝑆𝐷 𝑘𝑜𝑛𝑠𝑒𝑡𝑟𝑎𝑠𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟
d. Estimasi aktivitas antioksidan
Hasil dari prosedur 7 a dan b, dihitung nilai % IC dan IC50 untuk rutin dan
fraksi air ekstrak metanol daun sirih.
8. Optimasi metode penetapan kandungan fenolat total
Optimasi metode penetapan kandungan fenolat total ditentukan dengan
menggunakan metode spektrofotometri sesuai dengan penelitian Nusarini ( 2007).
a. Penentuan OT
Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 μg/mL ditambahkan
dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10 v/v).
Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Setelah itu,
dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang 750
nm selama 30 menit.
b. Penentuan panjang gelombang maksimum
Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 μg/mL ditambahkan
dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:1 v/v).
Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Diamkan
selama OT,absorbansinya dibaca pada λ maksimum dengan spektrofotometer visibel
9. Penetapan kandungan fenolat total
a. Pembuatan kurva baku asam galat
Sebanyak 0,5 mL larutan asam galat 50; 75; 100; 125; dan 150 μg/mL
ditambah dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:1
v/v). Larutan selanjutnya ditambah dengan 4,0 mL natrium karbonat 1M. Setelah OT,
absorbansinya dibaca pada λ maksimum terhadap blanko yang terdiri atas akuades :
metanol p.a (1:1), reagen Folin-Ciocalteu dan larutan natrium karbonat 1M.
Pengerjaan dilakukan 5 kali.
b. Validasi metode penetapan kandungan fenolik total
Hasil dari prosedur 9 a , divalidasi akurasi (%recovery), presisi (%CV),
spesipisitas (spektra kontrol), dan linearitas (nilai r).
% Recovery = 𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑟𝑢𝑡𝑖𝑛 𝑎𝑡𝑎𝑢 𝑓𝑟𝑎𝑘𝑠𝑖 𝑎𝑖𝑟𝑡𝑒𝑟𝑢𝑘𝑢𝑟
𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑟𝑢𝑡𝑖𝑛 𝑎𝑡𝑎𝑢 𝑓𝑟𝑎𝑘𝑠𝑖 𝑎𝑖𝑟 𝑡𝑒𝑟𝑢𝑘𝑢𝑟 x 100%
% CV = 𝑆𝑡𝑎𝑛𝑑𝑎𝑟 𝐷𝑒𝑣𝑖𝑎𝑠𝑖 𝑆𝐷 𝑘𝑜𝑛𝑠𝑒𝑡𝑟𝑎𝑠𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟
𝑟𝑎𝑡𝑎 −𝑟𝑎𝑡𝑎𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟 x 100%
c. Estimasi kandungan fenolik total larutan uji
Diambil 0,5 mL larutan uji 750 μg/mL, lalu masing-masing dimasukan ke
dalam labu takar 10,0 mL dan dilanjutkan sebagaimana perlakuan pada pembuatan
kurva baku asam galat . Kandungan fenolik total dinyatakan sebagai gram ekivalen
F. Analisis Hasil
Aktivitas penangkapan radikal DPPH (%) dihitung dengan rumus :
Absorbansi (larutan kontrol) – Absorbansi sampel (larutan pembanding/uji) X 100%
Absorbansi larutan kontrol
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 mengunakan
persamaan regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun
pembanding, sedangkan sumbu y adalah %IC. Lalu dianalisis secara statistik untuk
menentukan ada atau tidak adanya perbedaan bermakna antara IC50 larutan
pembanding dan larutan uji.
Uji kandungan fenolik total menghasilkan nilai mg ekivalen asam galat dalam
per g fraksi air. Nilai tersebut didapatkan dari analisis regresi linier dengan data kurva
.
Gambar 3. Skema Jalannya Penelitian
Pembuatan ekstrak metanolik daun sirih Pengumpulan bahan
Ekstraksi cair-cair dengan wasbensin dan air
37 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi merupakan syarat pertama dan langkah awal yang dilakukan
dalam suatu penelitian dengan menggunakan tanaman. Determinasi tanaman ini
bertujuan untuk mengetahui dan memastikan kebenaran identitas tanaman yang akan
digunakan dalam penelitian serta untuk menghindari terjadinya kesalahan dalam
pengambilan sampel untuk analisis fitokimia. Dari hasil determinasi yang dilakukan
di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata
Dharma pada tanggal 27 Mei 2011 dengan acuan van Steenis (1981), telah dibuktikan
bahwa tanaman yang digunakan untuk penelitian adalah tanaman sirih (Piper betle
L.). Pembuktian dikuatkan dengan surat determinasi (lampiran 1) tanaman yang
dikeluarkan oleh Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
B. Hasil Pengumpulan Bahan
Daun sirih diperoleh dari tempat budidaya tanaman obat organik “MERAPI
FARMA” pada tanggal 26 Mei 2011 di KM 21,5 daerah Kaliaurang, Cangkringan,