ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
KEDONDONG LAUT (Nothopanax fruticosum (L.) Miq)
SKRIPSI
NICHOLAS SIBURIAN
070802040
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
KEDONDONG LAUT (Nothopanax fruticosum (L.) Miq)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
NICHOLAS SIBURIAN
070802040
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI SENYAWA FLAVONOIDA DARI DAUN
TUMBUHAN KEDONDONG LAUT (Nothopanax fruticosum (L.) Miq)
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM UNIVERSITAS SUMATERA UTARA
Disetujui di
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN KEDONDONG LAUT (Nothopanax fruticosum (L.) Miq)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja Saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Mei 2011
PENGHARGAAN
Puji dan Syukur Saya panjatkan kepada Tuhan Yesus Kristus Juruselamat manusia, karena hanya oleh kasih dan karunianya Saya dapat menyelesaikan tugas akhir ini.
Ucapan terima kasih Saya sampaikan kepada Bapak Drs. Albert Pasaribu, MSc dan Ibu Sovia Lenny, MSi selaku dosen pembimbing, yang telah banyak memberikan Saya arahan, ilmu, dan bimbingan dalam penelitian ini. Ucapan terima kasih yang sebesar-besarnya Saya sampaikan kepada kedua orang tua tercinta, Ayah Saya G.Siburian, SH dan Ibu Saya M.Silitonga, SH yang selalu setia mendukung Saya dalam penelitian ini. Ucapan terima kasih juga saya sampaikan kepada Ibu Dr. Rumondang Bulan, MS selaku Ketua Departemen Kimia dan Bapak Drs. Albert Pasaribu, MSc selaku Sekretaris Departemen Kimia, Bapak Dekan, dan seluruh Bapak/Ibu Dosen pengajar Departemen Kimia. Terima kasih secara khusus Saya ucapkan kepada Tulang dan Nantulang Saya, Ir.Antoni Haris Silitonga dan Ir.Dorette F.J.Marbun yang telah banyak membantu Saya sampai dengan selesainya penelitian ini. Terima kasih juga Saya ucapkan kepada kakak Saya Molehet Margaretha Siburian,SP dan abang Saya William Siburian yang selalu mendukung dan memberi semangat bagi Saya. Terima kasih juga kepada teman-teman Kimia Angkatan 2007, rekan-rekan Asisten Laboratorium Kimia Bahan Alam FMIPA USU (Kak Saulina, Kak Rony, Kak Ika, Tria, Lisbeth, Burton, Christou, Monojaya, Pelita, Sondang, dan Christin), teman-teman alumni SMA N 1 Medan, dan juga teman/saudara/kerabat yang tidak bisa Saya sebutkan satu persatu.
ABSTRAK
ISOLATION OF FLAVONOID COMPOUND FROM THE LEAVES OF KEDONDONG LAUT PLANT (Nothopanax fruticosum (L.) Moq)
ABSTRACT
DAFTAR ISI
Bab 1 Pendahuluan
1.1Latar Belakang 1
Bab 2 Tinjauan Pustaka
2.1 Tumbuhan Kedondong Laut 5
2.1.1 Morfologi Tumbuhan Kedondong Laut 5 2.1.2 Sistematika Tumbuhan Kedondong Laut 5 2.1.3 Manfaat Tumbuhan Kedondong Laut 6 2.1.4 Kandungan Kimia Tumbuhan Kedondong Laut 6
2.2 Senyawa Flavonoida 7
2.2.1 Klasifikasi Senyawa Flavonoida 7
2.2.2 Flavonoida O-glikosida 16
2.2.3 Flavonoida C-glikosida 17
2.3 Kromatografi 17
2.3.1 Kromatografi Lapisan Tipis 19
2.3.2 Kromatografi Kolom 19
2.4 Teknik Spektroskopi 20
2.4.1 Spektrofotometri Inframerah (FT-IR) 20 2.4.2 Spektrofotometri Ultra Violet-Visible (UV) 21 2.4.3 Spektrofotometri Resonansi Magnetik Inti Proton(1H-NMR) 22 Bab 3 Metodologi Penelitian
3.1 Alat-alat 24
3.2 Bahan 25
3.3 Prosedur Penelitian 26
3.3.1 Penyediaan Sampel 26
3.3.2 Uji Skrining Fitokimia 26
Daun Tumbuhan Kedondong Laut 27 3.3.4 Analisis Kromatografi Lapis Tipis 28 3.3.5 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom 28
3.3.6 Analisis Kristal Hasil Isolasi 29
3.3.6.1 Uji Kemurnian Hasil Isolasi dengan Kromatografi
Lapis Tipis 29
3.3.6.2 Uji Reaksi Warna terhadap Kristal Hasil Isolasi
Dengan Perekasi Flavonoida 30
3.3.6.3 Penentuan Titik Lebur 30
3.3.7. Analisis Spektroskopi Kristal Hasil Isolasi 30 3.3.7.1 Uji Kristal Hasil Isolasi dengan Spektrofotometri
UV 30
3.3.7.2 Uji Kristal Hasil Isolasi dengan Spektrofotometri
Infra merah 30
3.3.7.3 Uji Kristal Hasil Isolasi dengan Spektrofotometri Resonansi Magnetik Inti (1H-NMR) 31 3.4 Bagan Tes Uji (Skrining Fitokimia) terhadap Daun Tumbuhan
Kedondong Laut 32
3.4.1. Bagan Penelitian 33
Bab 4 Hasil dan Pembahasan
DAFTAR LAMPIRAN
Lampiran A. Gambar Daun Tumbuhan Kedondong Laut (Nothopanax
fruticosum (L.) Miq) 41
Lampiran B. Surat Determinasi Daun Tumbuhan Kedondong Laut (Nothopanax fruticosum (L.) Miq) 42
Lampiran C1. Kromatografi Lapisan Tipis Ekstrak Etil Asetat Daun Kedondong Laut (Nothopanax fruticosum (L.) Miq) 43 Lampiran C2. Harga Rf Kromatografi Lapisan Tipis Ekstrak Etil Asetat Daun Kedondong Laut (Nothopanax fruticosum (L.) Miq) 44 Lampiran D1. Kromatografi Lapisan Tipis Senyawa Hasil Isolasi Melalui Penampakan Noda dengan Pereaksi FeCl3 45
Lampiran D2. Kromatografi Lapisan Tipis Senyawa Hasil Isolasi Melalui Metode 2 Dimensi 46
Lampiran E. Spektrum UV Senyawa Hasil Isolasi Fraksi 5-35 47
Lampiran E.1 Spektrum UV Senyawa Pembanding Flavonoida mirisetin-3-O-α-L-ramnopiranosida dan kuersetin-3-O-α-L-ramnopiranosida 48
Lampiran E.2 Spektrum Serapan UV-Visible Jenis-Jenis Flavonoida 49
Lampiran F. Spektrum FT-IR Senyawa Hasil Isolasi Fraksi 5-35 50
Lampiran G. Spektrum 1H-NMR Senyawa Hasil Isolasi Fraksi 5-35 51
DAFTAR TABEL
ABSTRAK
ISOLATION OF FLAVONOID COMPOUND FROM THE LEAVES OF KEDONDONG LAUT PLANT (Nothopanax fruticosum (L.) Moq)
ABSTRACT
BAB 1
PENDAHULUAN
1.1.Latar Belakang
Tumbuhan yang mengandung senyawa flavonoida biasanya mempunyai khasiat seperti mengobati stroke, rematik, mastitis, sakit jantung, melancarkan ASI, mengobati sembelit, borok, mengobati flu, rematik, dan kanker (Santoso, 2008)
Salah satu tumbuhan yang terdapat di Indonesia dan dapat dijadikan obat adalah tumbuhan kedondong laut (Nothopanax fruticosum (L.) Miq). Daun tumbuhan ini bermanfaat untuk meluruhkan air seni, obat sakit kepala, rematik, dan digunakan dalam mengobati sistem saraf. (Belardo et al, 1995)
Penelitian tentang tumbuhan kedondong laut juga telah pernah dilakukan oleh sekelompok peneliti dari Laboratorium Kimia Organik Universitas Brawijaya Malang. Kedondong laut merupakan salah satu tanaman obat yang berkhasiat untuk meningkatkan kekebalan tubuh, antibakteri, antidisentri, dan untuk mengobati diuretik.
Kedondong laut dikenal sebagai puding (Melayu), kedondong laut (Sunda dan Java), kedundung pethedan (madura), bombu (Makasar), keudem rintek (Minahasa), gurabati (Ternate), dan dewu papua (Ambon).
Dari hasil skrining fitokimia diketahui bahwa di dalam tumbuhan kedondong laut juga terdapat senyawa golongan tanin dan flavonoida, yang memiliki aktivitas sebagai antioksidan dan anti radang.
Selain itu, di dalam tumbuhan kedondong laut juga mengandung senyawa aktif saponin triterpenoid. Untuk isolasi senyawa saponin dari tumbuhan kedondong laut dilakukan dengan melakukan ekstraksi dengan metanol, dilanjutkan dengan dietil eter dan n-butanol. Senyawa yang sejauh ini berhasil diisolasi antara lain 3-O-β-D-Glukopiranosil (1→2) β-D-Glukopiranosil, 3-O-β-D-ramnopiranosil (1→2) -β-D-ramnopiranosil (1→3)
-β-D-glukopiranosil, dan 3-O-β-D-glukopiranosil. (Masruri et al, 2007)
1.2. Permasalahan
Permasalahan dalam penelitian ini adalah apakah kandungan senyawa flavonoida yang terdapat dalam daun tumbuhan kedondong laut dapat diisolasi dengan menggunakan metode isolasi flavonoida yang sudah ada.
1.3. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengisolasi dan mengidentifikasi senyawa flavonoida yang terdapat dalam daun tumbuhan kedondong laut.
1.4. Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam dan bidang Farmasi dari senyawa flavonoida yang terkandung dalam daun tumbuhan kedondong laut.
1.5. Lokasi Penelitian
1.6. Metodologi Penelitian
Dalam penelitian isolasi senyawa flavonoida ini, digunakan tumbuhan kedondong laut, berupa rajahan daun tumbuhan yang kering sebanyak 900 gram. Tahap awal dilakukan test uji pendahuluan, yaitu skrining fitokimia dengan menggunakan pereaksi-pereaksi untuk senyawa flavonoida: FeCl3 1%, NaOH 10%, Mg-HCl, dan H2SO4 pekat.
Kemudian dilakukan tahapan isolasi yaitu: - Ekstraksi Maserasi
- Ekstraksi Partisi
- Analisis Kromatografi Lapis Tipis - Analisis Kromatografi Kolom - Analisis Kristal Hasil Isolasi
BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Kedondong Laut
2.1.1. Morfologi Tumbuhan Kedondong Laut
Kedondong laut adalah jenis tumbuhan yang banyak terdapat di Papua dan biasa ditanam sebagai tanaman pagar di pekarangan rumah. Tumbuhan ini juga banyak terdapat di Filipina, dan diduga berasal dari Malaya, tetapi sekarang telah tersebar di hampir seluruh negara tropis.
Kedondong laut merupakan jenis tanaman semak tegak, dengan tinggi 1 sampai 2,5 meter, memiliki daun kelipatan 3 yang berbentuk seperti bulu burung, dengan bagian atas yang memendek dengan panjang 5 sampai 10 cm. Bagian bawah daun tumbuhan ini lebih besar dari bagian atasnya, dan memiliki bentuk yang tajam serta bergerigi. Daun tumbuhan kedondong laut juga memiliki aroma yang khas. (Belardo et al, 1995).
2.1.2. Sistematika Tumbuhan Kedondong Laut
Dalam sistematika (taksonomi), tumbuhan kedondong laut dapat diklasifikasikan sebagai berikut :
Kingdom : Plantae
Ordo : Apiales Famili : Araliaceae Genus : Nothopanax
Spesies : Nothopanax fruticosum (L.) Miq
Nama umum tumbuhan adalah kedondong laut. Tumbuhan ini dikenal masyarakat Indonesia dengan nama daerah yaitu: Puding (Melayu), Kedongdong laut (Sunda), Kadungdung petedhan (Madura), Bombu (Makasar), Keudem rintek (Minahasa), Gurabati (Ternate), dan Dewu papua (Ambon). (Masruri et al, 2007)
2.1.3. Manfaat Tumbuhan Kedondong Laut
Daun tumbuhan kedondong laut bermanfaat untuk menyembuhkan luka dengan cara dicampur dengan garam. Akar dari kedondong laut digunakan sebagai obat untuk meluruhkan air seni, obat sakit kepala, rematik, dan digunakan dalam mengobati sistem saraf. (Belardo et al, 1995)
2.1.4. Kandungan Kimia Tumbuhan Kedondong Laut
Dari literatur diketahui, daun tumbuhan kedondong laut mengandung flavonoida, steroida dan triterpenoida, saponin, tanin, asam p-hidroksi benzoat, dan asam vanilat.(Istyawati, 1994)
Selain itu, tumbuhan kedondong laut juga mengandung 3-O-β-D-Glukopiranosil (1→2) β-D-Glukopiranosil, 3-O-β-D-ramnopiranosil (1→2) -β-D-ramnopiranosil (1→3)
2.2. Senyawa Flavonoida
Senyawa flavonoida adalah senyawa yang mengandung C15 terdiri atas dua inti fenolat yang dihubungkan dengan tiga satuan karbon. Struktur dasar flavonoida dapat digambarkan sebagai berikut:
C C C
Kerangka dasar senyawa flavonoida
(Sastrohamidjojo, 1996)
2.2.1. Klasifikasi Senyawa Flavonoida
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu:
1. Flavonol
Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida, dan aglikon flavonol yang umum kaemferol, kuersetin, dan mirisetin yang berkhasiat sebagai antioksidan dan antiinflamasi. Flavonol lain yang terdapat di alam bebas kebanyakan merupakan variasi struktur sederhana dari flavonol.
O OH
OH O
OH
OH
2. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugusan 3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi warnanya. Flavon terdapat juga sebagai glikosidanya lebih sedikit daripada jenis glikosida pada flavonol. Flavon yang paling umum dijumpai adalah apigenin dan luteolin. Luteolin merupakan zat warna yang pertama kali dipakai di Eropa. Jenis yang paling umum adalah 7-glikosida dan terdapat juga flavon yang terikat pada gula melalui ikatan karbon-karbon. Contohnya luteolin 8-C-glikosida. Flavon dianggap sebagai induk nomenklatur kelompok senyawa flavonoida.
O OH
OH O
OH
Struktur Flavon
3. Isoflavon
O OH
OH O
OH
Struktur Isoflavon
4. Flavanon
Flavanon terdistribusi luas di alam. Flavanon terdapat di dalam kayu, daun, da bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah jeruk; dua glikosida yang paling lazim adalah neringenin dan hesperitin, terdapat dalam buah jeruk.
O OH
OH
OH
O
Struktur Flavanon
5. Flavanonol
O
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu. Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncharia gambir dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasat sebagai antioksidan.
O OH
OH
OH
OH
OH
Struktur Leukoantosianidin
8. Antosianin
Antosianin merupakan pewarna yang paling penting dan tersebar luas dalam tumbuhan. Pigmen yang berwarna kuat dan larut dalam air ini adalah penyebab hampir semua warna merah jambu, merah marak, ungu, dan biru dalam daun, bunga, dan buah pada tumbuhan tinggi. Secara kimia semua antosianin merupakan turunan suatu struktur aromatik tunggal yaitu sianidin, dan semuanya terbentuk dari pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi atau glikosilasi.
O
OH
9. Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna dengan sinar UV bila dikromatografi kertas. Aglikon flavon dapat dibedakan dari glikosidanya, karena hanya pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam pengembang air.
OH
OH
OH OH
O
Struktur Khalkon
(Harborne, 1996)
10. Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan briofita. Dalam larutan basa senyawa ini berwarna merah ros dan tampak pada kromatografi kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah menjadi merah jingga bila diberi uap amonia. (Robinson, 1995).
O O
Menurut Harborne (1996), dikenal sekitar sembilan kelas flavonoida di mana semua flavonoida, menurut strukturnya, merupakan turunan senyawa induk flavon dan semuanya mempunyai sejumlah sifat yang sama yakni:
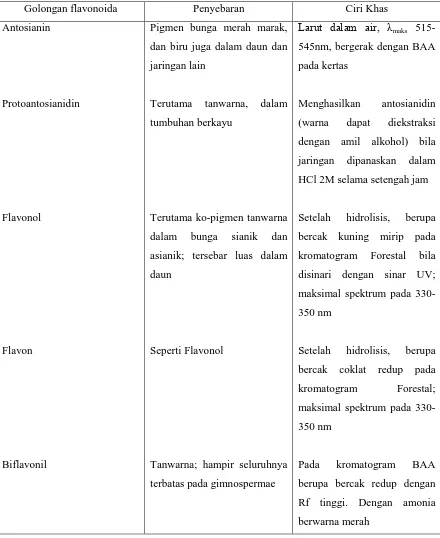
Tabel 1. Klasifikasi Senyawa Flavonoida menurut Harborne
Golongan flavonoida Penyebaran Ciri Khas
Antosianin
Protoantosianidin
Flavonol
Flavon
Biflavonil
Pigmen bunga merah marak,
dan biru juga dalam daun dan
jaringan lain
Terutama tanwarna, dalam
tumbuhan berkayu
Terutama ko-pigmen tanwarna
dalam bunga sianik dan
asianik; tersebar luas dalam
daun
Seperti Flavonol
Tanwarna; hampir seluruhnya
terbatas pada gimnospermae
Larut dalam air, λmaks 515-545nm, bergerak dengan BAA
pada kertas
Menghasilkan antosianidin
(warna dapat diekstraksi
dengan amil alkohol) bila
jaringan dipanaskan dalam
HCl 2M selama setengah jam
Setelah hidrolisis, berupa
bercak kuning mirip pada
kromatogram Forestal bila
disinari dengan sinar UV;
maksimal spektrum pada
330-350 nm
Setelah hidrolisis, berupa
bercak coklat redup pada
kromatogram Forestal;
maksimal spektrum pada
330-350 nm
Pada kromatogram BAA
berupa bercak redup dengan
Rf tinggi. Dengan amonia
Khalkon dan auron
Tanwarna; dalam daun buah
(terutama dalam Citrus)
Tanwarna; seringkali dalam
akar, hanya terdapat dalam
satu suku, Leguminosae
Seperti flavonol
Maksimal spektrum 370-410
nm
Berwarna merah kuat dengan
Mg/HCl; kadang-kadang
sangat pahit
Bergerak pada kertas dengan
pengembang air; tak ada uji
warna yang khas
Mengandung gula yang terikat
melalui ikatan C-C; bergerak
dengan pengembang air, tidak
seperti flavon biasa
Ada tiga kelompok flavonoida yang amat menarik perhatian dalam fisiologi tumbuhan, yaitu antosianin, flavonol, dan flavon. Antosianin (dari bahasa Yunani anthos, bunga dan kyanos, biru-tua) adalah pigmen berwarna yang umumnya terdapat di bunga berwarna merah, ungu, dan biru. Pigmen ini juga terdapat di bagian tumbuhan lain, misalnya, buah tertentu, batang, daun, dan bahkan akar. Sering flavonoida terikat di sel epidermis. Warna sebagian besar buah dan banyak bunga adalah akibat dari antosianin, walaupun warna beberapa tumbuhan lainnya, seperti tumbuhan tomat dan beberapa bunga kuning, karena karetonoid. Warna cerah daun musim gugur disebabkan terutama oleh timbunan antosianin pada hari cerah dan dingin, walaupun karotenoid kuning atau jingga merupakan pigmen terbesar di daun musim gugur pada beberapa spesies.
mengandung jenis lain dari flavonoida. Beberapa macam antosianin terdapat di tumbuhan tingkat tinggi, dan sering lebih dari satu macam terdapat di bunga tertentu atau organ lain. Mereka dijumpai dalam bentuk glikosida, biasanya mengandung satu atau dua unit glukosa atau galaktosa yang tertempel pada gugus hidroksil di posisi 5 cincin A. Bila gula dihilangkan, maka bagian sisa molekul, yang masih berwarna, dinamakan antosiandin.
Antosianidin biasanya dinamakan menurut tumbuhan asal senyawa tersebut diperoleh pertama kali. Antosianidin paling umum adalah sianidin yang mula-mula diisolasi dari bunga-jagung biru Centaura cyanus. Antosianidin lainnya, pelagonidin, dinamakan menurut geranium merah cerah genus Pelargonium. Antosianidin ketiga, delfinidin, namanya diperoleh dari genus Delphinium. Ketiga antosianidin itu berbeda hanya dalam jumlah gugus hidroksil yang tertempel pada cincin B dari bentuk dasar flavonoida. Antosianidin penting lainnya antara lain peonidin ungu (di petunia), dan pigmen lembayung-muda (keunguan) malvidin yang pertama kali ditemukan di salah satu anggota Malvaceae (suku mallow). (Salisbury, 1995)
Dalam tumbuhan, aglikon flavonoida (yaitu flavonoida tanpa gula terikat) terdapat dalam berbagai bentuk struktur. Semuanya mengandung 15 atom karbon dalam inti dasarnya, yang terusun dalam konfigurasi C6-C3-C6, yaitu dua cincin aromatik yang
dihubungkan oleh satuan tiga atom karbon yang dapat atau tak dapat membentuk cincin ketiga. Agar mudah, cincin diberi tanda A, B, dan C; atom karbon dinomori menurut sistem penomoran yang menggunakan angka biasa untuk cincin A dan C, serta angka ‘beraksen’ untuk cincin B tetapi perhatkan sistem penomoran yang dimodifikasi untuk khalkon.
gugus hidroksil atau inti flavonoida; isoprenilasi gugus hidroksil atau inti flavonoida; metilenasi gugus orto-dihidroksil; dimerisasi (pembentukan biflavonoid); pembentukan bisulfat; dan yang terpenting, glikosilasi gugus hidroksil (pembentukan flavonoid O-glikosida) atau inti flavonoida (pembentukan flavonoida C-O-glikosida). Jadi cakupan
flavonoida yang sudah diketahui luas sekali, dan daftar varian yang telah diketahui telah diperbarui.
2.2.2. Flavonoida O-glikosida
2.2.3. Flavonoida C-glikosida
Gula dapat juga terikat pada atom karbon flavonoida dan dalam hal ini gula tersebut terikat langsung pada inti benzen dengan suatu ikatan karbon-karbon yang tahan asam (bandingkan dengan O-glikosida. Glikosida yang demikian disebut C-glikosida. Sekarang gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoida. Jenis gula yang terlibat ternyata jauh lebih sedikit ketimbang jenis gula pada O-glikosida, biasanya dari jenis glukosa yang paling umum (misalnya viteksin, orientin),
dan juga galaktosa (misalnya 8-C-galaktosida), ramnosa (misalnya violantin), xilosa (misalnya visenin-1), dan arabinosa (misalnya skaftosida). Jenis aglikon flavonoida yang terlibat pun sangat terbatas. Jadi, walau pun isoflavon, flavanol kadang-kadang terdapat dalam bentuk C-glikosida, sebegitu jauh hanya flavon C-glikosida yang paling lazim ditemukan. Seperti O-glikosida, C-glikosida ternyata sering mengalami O-glikosilasi lebih lanjut pada hidroksil gula atau fenol) atau mengalami asilasi (biasanya pada hidroksil gula). (Markham, 1988)
2.3. Kromatografi
mempengaruhi antara beberapa sifat secara cergas pendekatan terbaik ialah pertama-tama dengan memperhatikan keadaan pegun.
Pemisahan secara kromatografi dilakukan dengan cara mengotak-atik langsung beberapa sifat fisika umum dari molekul. Sifat utama yang terlibat ialah:
- Kecenderungan molekul untuk melarut dalam cairan (kelarutan)
- Kecenderungan molekul untuk melekat pada permukaan serbuk halus (adsorbsi, penjerapan)
- Kecenderungan molekul untuk menguap atau berubah ke keadaan uap (keatsirian)
Pada sistem kromatografi, campuran yang akan dipisahkan ditempatkan dalam keadaan demikian rupa sehingga komponen-komponennya harus menunjukkan dua dari ketiga sifat tersebut. Hal ini melibatkan dua sifat berlainan, misalnya penjerapan dan kelarutan, misalnya kelarutan di dalam dua cairan yang tidak bercampur.
Walaupun kromatografi melibatkan proses saling mempengaruhi antara beberapa sifat ialah pertama-tama dengan memperlihatkan pegun. Misalnya memasukkan senyawa ke dalam corong pisah yang berisi dua pelarut yang masing-masing mempunyai kelarutan yang terbatas dalam pelarut pasangannya (misalnya eter dan air), senyawa itu cenderung terdistribusi atau terpartisi di antara kedua cairan itu atau fase bergantung kepada sifat kelarutannya.
2.3.1. Kromatografi Lapisan Tipis
Nilai utama KLT pada penelitian flavonoida ialah sebagai cara analisis cepat yang memerlukan bahan sangat sedikit. Tulisan mengenai cara KLT sendiri sudah banyak. Demikian pula mengenai manfaatnya dalam analisis flavonoida.
Menurut pengalaman pengarang, KLT terutama berguna untuk tujuan berikut: 1. Mencari pelarut untuk kromatografi kolom;
2. Analisis fraksi yang diperoleh dari kromatografi kolom;
3. Menyigi arah atau perkembangan reaksi seperti hidrolisis atau metilasi; 4. Identifikasi flavonoida secara re-kromatografi;
5. Isolasi flavonoida murni skala kecil.
Penjerap dan pengembang yang digunakan umumnya sama dengan penjerap dan pengembang yang telah dibahas secara rinci untuk KKt dan kromatografi kolom dan cara untuk mendeteksi bercak sebagian besar seperti yang telah diikhtisarkan untuk KKt. Pelat KLT dari plastik terutama dianjurkan karena tembus sinar UV (untuk mendeteksi bercak) dan dapat dipotong dengan mudah menjadi sebarang ukuran.
Pelat KLT selulose dapat dibuat dengan menggunakan penyaput KLT baku (misalnya Camag, Corning, dll). Selulose mikrokistal Merck, yaitu ‘Avicel’ terutama sangat cocok untuk keperluan ini dan disaputkan paling baik sampai ketebalan 0,25 cm (agar lapisan tidak retak). Untuk menyaput lima pelat 20 x 20 cm, 20 g selulose sudah cukup (diaduk kuat-kuat dengan H2O 70 ml selama 5 menit).
2.3.2. Kromatografi Kolom
ujung, dan ukurannya sedemikian rupa sehingga nisbah garis tengah terhadap panjang kolom dalam rentang 1 : 10 sampai 1 : 30. Ukuran (volum) yang diperlukan untuk suatu pemisahan dapat dihitung secara kasar bila bobot campuran flavonoida diketahui. Pada umumnya kita menganggap bahwa untuk pemisahan yang didasarkan pada partisi (yaitu kromatografi pada selulose dan silika), nisbah cuplikan terhadap kemasan kolom harus dalam rentang 1 : 50 sampai 1 : 500; nisbah 1 : 500 cocok untuk campuran rumit dan nisbah 1 : 50 untuk campuran sederhana. Pada kolom poliamida (dan sampai taraf tertentu kolom silika), pengisian cuplikan dalam rentang 1 : 50 umumnya memuaskan.
Kemasan kolom harus dipilih dari jenis yang dipasarkan khusus untuk kromatografi kolom karena ukuran partikel penting. Jika partikel terlalu kecil, laju aliran pengelusi mungkin terlalu lambat, sedangkan bila terlalu besar, mungkin pemisahan komponen secara kromatografi tidak baik. Kemasan niaga biasanya dalam rentang 100 – 300 mesh. (Markham, 1988)
2.4. Teknik Spektroskopi
Spektroskopi adalah studi mengenai antaraksi cahaya dengan atom dan molekul. Radiasi cahaya atau elektromagnet dapat dianggap menyerupai gelombang atau korpuskular. Beberapa sifat fisika cahaya paling baik diterangkan dengan ciri gelombangnya, sedangkan sifat lain diterangkan dengan sifat partikel. Jadi, cahaya dapat dikatakan bersifat ganda. (Creswell, 1981)
2.4.1. Spektrofotometri Infra Merah (FT-IR)
memungkinkan kimiawan memperoleh informasi tentang struktur yang berguna serta mendapatkan acuan bagi peta umum frekuensi gugus yang khas.
Pancaran infra-merah yang kerapannya kurang daripada 100 cm-1 (panjang gelombang lebih daripada 100 µm) diserap oleh sebuah molekul organik dan diubah menjadi energi putaran molekul. Penyerapan itu tercatu dan dengan demikian spektrm rotasi molekul terdiri dari garis-garis yang tersendiri.
Pancaran infra-merah di julat antara 10.000 – 10 cm -1 (1 – 100 µm), diserap oleh sebuah molekul organik dan diubah menjadi getaran energi molekul. Penyerapan ini juga tercatu, namun spektrum getaran tampak bukan sebagai garis-garis melainkan berupa pita-pita. Hal itu disebabkan perubahan energi getaran tunggal selalu disertai sejumlah perubahan energi putaran. Dengan pita getaran putaran yang khususnya terletak antara 4000 cm-1 dan 666 cm-1 X (2,5 – 1,5 µm) inilah kimiawan organik berkepentingan. Kerapatan atau panjang gelombang penyerapan bergantung pada massa nisbi, tetapan gaya ikatan dan geometri (tata-ruang) atom-atomnya.
Letak pita dalam spektrum infra-merah disajikan sebagai bilangan gelombang atau panjang gelombang. Satuan bilangan gelombang (cm-1, kebalikan sentimeter) lebih sering dipakai karena secara langsung berbanding dengan energi getarannya dan karena kebanyakan radas mutakhir berskala linear dalam cm-1. Panjang gelombang dicatat dalam mikrometer (µm, 10-6 meter) walaupun buku-buku lama menyebutnya mikron (µ).
Serapan khas dan daerah serapan akan dituliskan dalam cm-1, dengan µm yang sesuai mengikutinya (biasanya di dalam tanda kurung).
2.4.2. Spektrofotometri Ultra Violet-Visible (UV)
dari elektron dalam orbital tingkat dasar ke orbital yang berenergi lebih tinggi di dalam keadaan tereksitasi. Untuk beberapa struktur serapan elektronik tidak terjadi di dalam daerah ultra ungu. Dalam praktek, spektrometri ultra ungu sebahagian besar dibatasi pada sistem konyugasi. Suatu keuntungan dari serapan ultra ungu adalah selektifitasnya: gugus yang khas dapat dikenal di dalam molekul dengan kerumitan yang bervariasi luas. Sebahagian besar dari molekul yang relatif rumit kemungkinan bening di dalam ultra ungu karena itu kita mungkin memperoleh suatu spektra yang sama dengan molekul lain yang jauh lebih sederhana. Jadi, spektrum dari kholest-4en-4-on sangat mirip dengan spektrum dari mesitil oksida. Serapan dihasilkan dari bagian enon yang terkonyugasi dari kedua senyawa.
Suatu spektrum ultra ungu diperoleh secara langsung dari suatu alat yang secara sederhana memetakan panjang gelombang dari suatu serapan terhadap intesitas serapan (adsorbans atau transmitans). Datanya seringkali diubah menjad suatu grafik dari panjang gelombang terhadap serapan molar (Єmaks atau log Єmaks). Penggunaan serapan molar
sebagai satuan dari intensitas serapan mempunyai keuntungan bahwa semua harga intensitas dikembalikan kepada bilangan dari jenis serapan.
2.4.3. Spektrofotometri Resonansi Magnetik Inti Proton (1H-NMR)
Spektrometri talunan magnet inti (TMI) pada dasarnya ialah suatu bentuk spektrometri serapan, berkerabat dengan spektrometri infra-merah atau ultra-ungu. Pada keadaan yang tepat, suatu cuplikan dapat menyerap elektromagnet di daerah frekuensi-radio sesuai ciri cuplikannya. Serapannya merupakan fungsi inti-inti tertentu dalam molekul. Suatu spektrum TMI terbentuk dari aluran kerapan puncak.
sesungguhnya tidak sesederhana itu. Inti agak tertabir oleh awan elektron yang berbeda kerapatan sesuai lingkungannya. Perbedaan ini menyebabkan beda letak serapan, biasanya dalam julat sekitar 750 Hz dalam medan yang bersangkutan dengan harga 60 MHz atau kira-kira 1250 Hz dalam medan 100 MHz. Ciri spektrometri TMI dayapisah tinggi ialah kesanggupannya membedakan masing-masing puncak serapan itu.
BAB 3
METODOLOGI PENELITIAN
3.1. Alat-Alat
1. Kolom Kromatografi 24/40 (2mm) Pyrex
2. Neraca analitis Mettler PM 480
3. Kertas saring biasa
4. Rotarievaporator Büchi R-114
18.Statif dan Klem
19.Melting point apparatus Fisher Johns 20.Botol vial
21.Plat KLT 22.Chamber KLT 23.Lampu UV
24.Spektrofotometer UV WL SCAN/0
25.Spektrofotometer IR Shimadzu
26.Spektrometer 1H-NMR Delta2_NMR
3.2. Bahan
3.3. Prosedur Penelitian
3.3.1. Penyediaan Sampel
Sampel yang diteliti adalah 900 gram daun tumbuhan kedondong laut (Nothopanax fruticosum (L.) Miq) yang diperoleh dari Kecamatan Patumbak, Kabupaten Deli Serdang,
Provinsi Sumatera Utara.
3.3.2. Uji Skrining Fitokimia
Dilakukan uji pendahuluan (skrining fitokimia) terhadap daun tumbuhan kedondong laut (Nothopanax fruticosum (L.) Miq) untuk mengetahui senyawa flavonoida yang terkandung di dalamnya. Uji pendahuluan secara kualitatif dengan reaksi warna.
Prosedur :
1. Uji Busa
Dimasukkan 10 gram daun tumbuhan kedondong laut (Nothopanax fruticosum (L.)
Miq) yang telah dikeringkan dan dipotong-potong kecil ke dalam erlenmeyer, lalu
ditambahkan metanol sampai terendam seluruhnya. Dipanaskan lalu disaring dan dimasukkan ekstrak daun tumbuhan kedondong laut ke dalam tabung reaksi. Selanjutnya ditambahkan dengan aquadest, etanol, dan HCl 2N lalu dikocok. Hasil tes menunjukkan tidak terbentuknya busa yang berarti tidak terdapat gula.
2. Skrining Fitokimia
Dimasukkan 10 gram daun tumbuhan kedondong laut (Nothopanax fruticosum (L.)
Miq) yang telah dikeringkan dan dipotong-potong kecil ke dalam erlenmeyer, lalu
ditambahkan metanol sampai terendam seluruhnya. Dipanaskan lalu disaring dan dimasukkan ekstrak daun tumbuhan kedondong laut ke dalam tabung reaksi. Ditambahkan masing-masing dengan pereaksi
a. Tabung I : ditambah dengan FeCl3 menghasilkan larutan hitam
d. Tabung IV : ditambah dengan H2SO4 (p) menghasilkan larutan merah
3.3.3. Prosedur Untuk Memperoleh Senyawa Kimia dari Ekstrak Daun Tumbuhan Kedondong Laut
Daun tumbuhan kedondong laut yang telah dikeringkan dan dipotong-potong kecil ditimbang sebanyak 900 gram, kemudian dimaserasi dengan metanol sebanyak 8 liter selama ± 48 jam, kemudian disaring dan dipekatkan dengan menggunakan alat rotarievaporator sehingga terbentuk ekstrak pekat metanol. Ekstrak pekat metanol tersebut dipartisi berulang-ulang dengan menggunakan n-heksana sebanyak 36 kali. Lalu diambil lapisan metanol dan dipekatkan. Lapisan metanol yang diperoleh kemudian dipekatkan dengan rotarievaporator sampai seluruh metanol menguap, dan terbentuk padatan yang bebas metanol. Padatan tersebut kemudian ditambah dengan etil asetat dan diaduk. Etil asetat kemudian disaring dan diambil filtratnya dan dipekatkan dengan rotarievaporator sampai terbentuk ekstrak pekat etil asetat sebanyak 30,06 gram.
3.3.4. Analisis Kromatografi Lapis Tipis
Analisis dengan kromatografi lapis tipis dimaksudkan untuk mencari perbandingan pelarut yang sesuai di dalam pemisahan senyawa dengan meningkatkan kepolarannya dalam kromatografi kolom. Pelarut yang digunakan adalah campuran pelarut kloroform : metanol (9:1 ; 8:2 ; 7:3 ; 6:4 ; 5:5 ; 4:6 ; 3:7 ; 2:8 ; 1:9) v/v, sehingga diperoleh perbandingan pelarut kloroform : metanol yang sesuai untuk kromatografi kolom.
Pelarut yang sesuai didasarkan kepada jumlah bercak atau noda yang terpisah dengan baik dalam kromatografi lapis tipis.
Prosedur:
dijenuhkan, kemudian ditutup. Setelah dielusi, dikeluarkan dari bejana dan dikeringkan. Noda yang terbentuk diamati dengan sinar ultraviolet dan difiksasi dengan FeCl3 1%.
Kemudian dihitung dan dicatat harga Rf. Yang memberikan pemisahan bercak noda yang baik adalah perbandingan pelarut kloroform : metanol (8:2) v/v yang memberikan empat noda dengan harga Rf yaitu 0,245 ; 0,415 ; 0,622 ; dan 0,830.
3.3.5. Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
Dilakukan isolasi senyawa flavonoida terhadap total flavonoida yang telah diperoleh dengan menggunakan kromatografi kolom. Dimana sebagai fase diam yaitu silika gel 60 GF (0,063-0,200 mm) E.Merck.Art.7734 dan fase gerak yaitu pelarut kloroform 100% dengan campuran pelarut kloroform : metanol (90 : 10 ; 80 : 20 ; 70 : 30 ; 60 : 40 ; 50 : 50 ; 40 : 60 ; 30 : 70 ; 20 : 80 ; 10 : 90) v/v.
Prosedur :
Dibersihkan peralatan kromatografi kolom, dibilas dengan metanol, dikeringkan, dan dirangkai. Kemudian silika gel 60 GF (0,063-0,200 mm) E.Merck.Art.7734 sebanyak 300 gram dibuburkan dengan pelarut metanol, diaduk sampai homogen dan dimasukkan ke dalam kolom kromatografi. Lalu dielusi dengan metanol 100% hingga bubur silika gel memadat dan homogen. Dimasukkan sampel flavonoida sebanyak 10 gram yang telah dibuburkan dengan silika gel ke dalam kolom kromatografi yang telah diaktifkan. Sampel dibiarkan turun hingga memadat. Kemudian dielusi dengan pelarut kloroform 100% dan diatur aliran fraksi yang keluar dari kolom kromatografi bergerak secara kontinu dan ditampung tiap fraksi dalam botol vial masing-masing sebanyak 13 ml.
3.3.6. Analisis Kristal Hasil Isolasi
3.3.6.1. Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis
Uji kemurnian kristal dilakukan dengan menggunakan kromatografi lapis tipis, dimana fase diam yang digunakan adalah Kieselgel 60 F254 (0,2 mm) E.Merck.Art 554 dan fase
gerak kloroform : metanol 80 : 20 v/v. Prosedur:
Kristal yang diperoleh dilarutkan dengan metanol, lalu ditotolkan pada plat KLT.
1. Dimasukkan larutan fase gerak kloroform : metanol (80 : 20 v/v) dalam bejana kromatografi lapis tipis yang telah dijenuhkan. Plat yang telah ditotolkan sampel dimasukkan ke dalam bejana kromatografi tersebut dan dibiarkan hingga pelarut naik sampai batas atas yang telah ditentukan dalam plat tipis.
2. Dikeluarkan plat dari bejana kromatografi, lalu dikeringkan dan dilihat bercak noda di bawah lampu UV, kemudian difiksasi dengan FeCl3 yang memberikan
bercak noda berwarna hitam yang menunjukkan bahwa senyawa flavonoida positif.
3. Dikeringkan hingga terbentuk kristal. Dari kristal yang terbentuk tersebut diperoleh kristal berbentuk seperti berwarna kuning dan hasil bercak noda dari KLT yang telah dilakukan diperoleh lebih dari satu bercak noda.
4. Dimurnikan dengan etil asetat sebanyak 5 kali, kemudian diuapkan hingga terbentuk kristal.
Dilakukan uji kemurnian terhadap kristal yang sudah dimurnikan dengan menggunakan kromatografi lapis tipis, dengan cara :
- Dimasukkan larutan fase gerak kloroform : metanol (80 : 20 v/v) dalam bejana kromatografi lapis tipis yang telah dijenuhkan. Plat yang telah ditotolkan sampel dimasukkan ke dalam bejana kromatografi tersebut dan dibiarkan hingga pelarut naik sampai batas atas yang telah ditentukan dalam plat tipis.
bercak noda tunggal berwarna hitam yang menunjukkan bahwa senyawa flavonoida positif.
3.3.6.2. Uji Reaksi Warna terhadap Kristal Hasil Isolasi dengan Pereaksi Flavonoida
Dilarutkan kristal hasil isolasi secukupnya ke dalam botol vial, lalu diteteskan menjadi 4 larutan ke dalam plat tetes.
1. Larutan pertama ditetesi dengan FeCl3 menghasilkan larutan berwarna hitam
2. Larutan kedua ditetesi dengan Mg-HCl menghasilkan larutan berwarna merah muda 3. Larutan ketiga ditetesi dengan NaOH 10% menghasilkan larutan berwarna hijau 4. Larutan ketiga ditetesi dengan H2SO4 menghasilkan larutan berwarna merah
3.3.6.3. Penentuan Titik Lebur
Kristal hasil isolasi yang telah murni dimasukkan ke dalam melting point apparatus, lalu diamati pada suhu berapa kristal melebur.
3.3.7 Analisis Spektroskopi Kristal Hasil Isolasi
3.3.7.1. Uji Kristal Hasil Isolasi dengan Spektrofotometer Ultra Violet-Visible (UV)
Analisis kristal hasil isolasi dengan alat spektrofotometer Ultra Violet Visible (UV) dilakukan di Pusat Penelitian Kimia LIPI Serpong – Tangerang. (Lampiran E)
3.3.7.2. Uji Kristal Hasil Isolasi dengan Spektrofotometer Infra Merah
3.3.7.3. Uji Kristal Hasil Isolasi dengan Spektrometer Resonansi Magnetik Inti Proton 1H-NMR
3.4. Bagan Tes Uji Pendahuluan (Skrining Fitokimia) terhadap Daun Tumbuhan Kedondong Laut
Diekstraksi maserasi dengan pelarut metanol
Disaring
Diuapkan dengan rotarievaporator
Dibagi dalam 4 tabung reaksi
Ditambahkan Ditambahkan Ditambahkan Ditambahkan FeCl3 1% NaOH 10% Mg-HCl H2SO4 (p)
10 gram daun tumbuhan kedondong laut (Nothopanax fruticosum (L.)Miq kering halus
Ekstrak pekat metanol
Tabung Tabung Tabung III Tabung IV
3.4.1. Bagan Penelitian
Ekstak metanol Residu
Ekstrak pekat metanol
Lapisan n-heksana Lapisan metanol
Fraksi Etil Asetat
900 gram daun tumbuhan kedondong laut (Nothopanax fruticosum (L.)Miq kering halus
Residu Ekstrak Pekat Metanol Hasil Negatif
Fraksi 1-4 Fraksi 5-35 Fraksi 40-60 Fraksi 80-90
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Dari hasil uji pendahuluan (skrining fitokimia) yang dilakukan terhadap daun tumbuhan kedondong laut (Nothopanax fruticosum (L.) Miq) menunjukkan bahwa daun tumbuhan kedondong laut mengandung senyawa flavonoida. Dimana pereaksi-pereaksi yang digunakan menunjukkan:
1. FeCl3 1% menghasilkan larutan berwarna hitam
2. Mg-HCl menghasilkan larutan berwarna merah muda 3. H2SO4 (p) menghasilkan larutan berwarna merah
4. NaOH 10% menghasilkan larutan berwarna hijau
Hasil isolasi senyawa flavonoida dari daun tumbuhan kedondong laut (Nothopanax fruticosum (L.) Miq) diperoleh dengan menggunakan fase gerak kloroform : metanol
(80:20) v/v pada fraksi (5-35) berwarna kuning, berbentuk jarum dengan titik lebur = 195-196oC, dan Rf = 0,591
Hasil analisis Spektrofotometer Ultra Violet-Visible (UV) dari kristal hasil isolasi memberikan serapan sebagai berikut: (Lampiran E)
Hasil analisis Spektrofotometer Infra Merah (FT-IR) dari kristal hasil isolasi memberikan pita-pita serapan pada daerah bilangan gelombang (cm-1) sebagai berikut (lampiran F) :
1. Pada bilangan gelombang 3419,79 – 3219,19 cm -2. Pada bilangan gelombang 2916,37 – 2752,42 cm -3. Pada bilangan gelombang 1656,85 cm-1
4. Pada bilangan gelombang 1602,85cm-1 dan 1496,76 cm-1 5. Pada bilangan gelombang 1122,57 cm-1
6. Pada bilangan gelombang 860,25 cm-1 dan 769,60 cm-1
Hasil analisis spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR) memberikan pergeseran kimia pada daerah (ppm) sebagai berikut (Lampiran G) :
1. Pergeseran kimia pada daerah δ=1,29 ppm 2. Pergeseran kimia pada daerah δ=3,43-3,93 ppm 3. Pergerseran kimia pada daerah δ=4,09 ppm 4. Pergeseran kimia pada daerah δ=6,26 ppm 5. Pergeseran kimia pada daerah δ=6,5 ppm 6. Pergeseran kimia pada daerah δ=7,09 ppm
7. Pergeseran kimia pada daerah δ=7,38 ppm dan δ=7,45 ppm 8. Pergeseran kimia pada daeah δ=9,8-12,5 ppm
4.2. Pembahasan
Dari hasil uji skrining fitokimia yang dilakukan terhadap ekstrak metanol daun tumbuhan kedondong laut menunjukkan bahwa tumbuhan tersebut positif mengandung senyawa flavonoida.
Dari uji titik lebur yang dilakukan dengan menggunakan alat Fisher Johns terhadap kristal hasil isolasi dari 3 kali perlakuan menunjukkan titik lebur kristal yang sama yaitu 195-196oC. Hal ini menunjukkan bahwa kristal yang diperoleh sudah murni. Hal ini juga dibuktikan dengan analisis KLT yang menunjukkan hanya satu noda tunggal pada kristal.
Dari hasil interpretasi Spektrum UV memberikan serapan pada pita I dengan panjang gelombang 358,0 nm dan pada pita II dengan panjang gelombang 254,5 nm. Serapan pita I dan pita II tersebut menunjukkan bahwa senyawa kristal hasil isolasi sesuai dengan penampakan spektrum serapan senyawa pembanding flavonoida yaitu flavonol.
Spektrum UV kristal senyawa yang diperoleh juga bersesuaian dengan spektrum UV pembanding (Lampiran E.1) dari senyawa mirisetin-3-O-α-L-ramnopiranosida dan kuersetin-3-O-α-L-ramnopiranosida. (Daniel Rinaldo et al, 2006)
Dari hasil interpretasi Spektrum Infra Merah diperoleh pita serapan sebagai berikut:
1. Pada bilangan gelombang 3419,79 – 3219,19 cm-1 puncak melebar (broad) menunjukkan adanya vibrasi ulur (stretch) alkohol -OH
2. Pada bilangan gelombang 2916,37 – 2752,42 cm-1 puncak sedang menunjukkan adanya vibrasi ulur (stretch) –CH alifatis
3. Pada bilangan gelombang 1656,85 cm-1 puncak kuat menunjukkan adanya vibrasi karbonil (C=O) dari keton
4. Pada bilangan gelombang 1602,85cm-1 dan 1496,76 cm-1 puncak sedang menunjukkan adanya vibrasi ikatan rangkap C=C dari cincin
5. Pada bilangan gelombang 1122,57 cm-1 menunjukkan adanya vibrasi tekuk (bend) dari C-O-C
Dari hasil interpretasi Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut Aseton diperoleh data:
1. Pergeseran kimia pada daerah δ=1,29 ppm puncak singlet menunjukkan proton-proton dari gugus metil (–CH3)
2. Pergeseran kimia pada daerah δ=3,43-3,93 ppm puncak multiplet menunjukkan proton-proton dari gugus samping dari proton C-3 cincin C senyawa flavonoida (diduga gugus ramnopiranosida) (Lampiran H.1)
3. Pergerseran kimia pada daerah δ= 4,09 ppm puncak singlet menunjukkan proton H-1 gugus samping senyawa flavonoida (Lampiran H.3)
4. Pergeseran kimia pada daerah δ=6,26 ppm puncak singlet menunjukkan proton H-6 pada cincin A flavonoida (Lampiran H.1 dan Lampiran H.2)
5. Pergeseran kimia pada daerah δ=6,5 ppm puncak singlet menunjukkan proton H-8 pada cincin A flavonoida (Lampiran H.1)
6. Pergeseran kimia pada daerah δ=7,09 ppm puncak singlet menunjukkan proton H-5’ pada cincin B flavonoida (Lampiran H.2)
7. Pergeseran kimia pada daerah δ=7,38 ppm dan δ=7,45 ppm puncak singlet menunjukkan proton-proton pada H-2’ dan H-6’ pada cincin B flavonoida
(Lampiran H.1)
8. Pergeseran kimia pada daerah δ=9,8-12,5 ppm puncak singlet menunjukkan adanya proton OH pada C-3 cincin C,serta C-5 dan C-7 pada cincin A
O
Kerangka Senyawa Flavonoida Jenis Flavonol
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Dari hasil uji skrining fitokimia dengan pereaksi dengan pereaksi flavonoida menunjukkan bahwa daun tumbuhan kedondong laut (Nothopanax fruticosum (L.)
Miq) mengandung senyawa flavonoida.
2. Isolasi senyawa flavonoida dari ekstrak metanol daun tumbuhan kedondong laut (Nothopanax fruticosum (L.) Miq) yang diperoleh dari fraksi kloroform-metanol (80 : 20) v/v sebanyak 51 mg kristal murni, berbentuk jarum berwarna kuning dengan titik lebur 195-196oC.
3. Dari data dan pembahasan hasil identifikasi Spektroskopi UV, Spektroskopi FT-IR, Spektroskopi 1H-NMR menunjukkan bahwa kristal hasil isolasi dari daun tumbuhan kedondong laut (Nothopanax fruticosum (L.) Miq) adalah senyawa flavonoida jenis flavonol.
5.2. Saran
DAFTAR PUSTAKA
Belardo, Oliveros, Luz., 1995. Phillipine Journal of Science, Flora de Filipinas. Vol. 124, no.2
Creswell, C.J., 1981. Analisis Spektrum Senyawa Organik. Edisi kedua. Bandung: Penerbit ITB.
Gritter, R.J., 1991. Pengantar Kromatografi. Terbitan Kedua. Terjemahan Kosasih Padmawinata. Bandung: Penerbit ITB.
Harborne, J. B., 1996. Metoda Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan. Terbitan ke-2. Terjemahan Kosasih Padmawinata dan Iwang Soediro. Bandung: Penerbit ITB.
Istyawati, A., dkk. 1994. Telaah Fitokimia Daun Kedondong Laut. Skripsi. Bandung, Indonesia: Sekolah Farmasi ITB
Markham, K. R., 1988. Cara Mengidentifikasi Flavonoid. Bandung: Penerbit Institut Teknologi Bandung
Masruri, Elvina, D.I., Kristianingsih., Edi P.U., Rahman, M.F., Rurini, R.. 2007. Identification Of Triterpenoide Compound from Polyscias fruticosa Harm. (Araliaceae) Root Bark. Life 45-47
Rinaldo, D., Silva, M.A., Rodrigues, C.M., Calvo, T.R., Sannomiya, M., Santos, L.C., Vilegas,W., Kushima,H, Lima,C.A.H, Brito,A.R.M.S, 2006. Preparative separation of flavonoids from the medicinal plant Davilla elliptica St. Hill. by high-speed counter-current chromatography. Quím. Nova. vol.29 no.5
Robinson, T., 1995. Kandungan Organik Tumbuhan Tinggi. Edisi ke-4. Terjemahan Kosasih Padmawinata. ITB Press. Bandung
Salisbury, F.B., 1995. Fisiologi Tumbuhan. Edisi Keempat. Jilid Dua. Bandung: Penerbit ITB.
Santoso,H. B., 2008. Ragam dan Khasiat Tanaman Obat, Sehat Alami dari Halaman Asri. Yogyakarta : AgroMedia Pustaka
Sastrohamidjojo, H., 1996. Sintesis Bahan Alam. Cetakan Pertama. Yogyakarta: Gadjah Mada University Press.
Lampiran B. Surat Determinasi Daun Tumbuhan Kedondong Laut (Nothopanax
Lampiran C.1.Kromatografi Lapisan Tipis Ekstrak Etil Asetat Daun Tumbuhan Kedondong Laut (Nothopanax fruticosum (L.) Miq)
I II III IV V VI VII VIII IX
E E E E E E E E E
Keterangan:
Fase diam : Kieselgel 60 F254 (E.Merck.Art 554)
E : Ekstrak etil asetat dari daun tumbuhan kedondong laut I : Fase gerak kloroform : metanol (9:1 v/v)
Lampiran C.2. Harga Rf Kromatografi Lapisan Tipis Ekstrak Etil Asetat Daun Tumbuhan Kedondong Laut (Nothopanax fruticosum (L.) Miq)
No. Fase Gerak Jumlah Noda Warna Noda Rf
Kloroform : Metanol (9:1 v/v)
Kloroform : Metanol (8:2 v/v)
Kloroform : Metanol (7:3 v/v)
Kloroform : Metanol (6:4 v/v)
Kloroform : Metanol (5:5 v/v)
Kloroform : Metanol (4:6 v/v)
Kloroform : Metanol (3:7 v/v)
Kloroform : Metanol (2:8 v/v)
Lampiran D1. Kromatografi Lapisan Tipis Senyawa Hasil Isolasi Melalui Penampakan Bercak dengan Fiksasi FeCl3
Dengan eluen kloroform : metanol (80:20 v/v)
Kristal fraksi 5-35
Rf = 0,591
Keterangan :
Fase diam : Kieselgel 60 GF (0,063-0,200 mm) E.Merck.Art.7734 Fase gerak : kloroform : metanol (80:20 v/v)
Lampiran D2. Kromatografi Lapisan Tipis Senyawa Hasil Isolasi Melalui Metode 2 Dimensi
Dengan eluen kloroform : metanol (80:20 v/v)
kristal fraksi 5-35
Keterangan:
Fase diam : Kieselgel 60 GF (0,063-0,200 mm) E.Merck.Art.7734 Fase gerak : kloroform : metanol (80:20 v/v)
Lampiran E.1 Spektrum Ultra Violet-Visible (UV) Senyawa Pembanding (Flavonoida Mirisetin-3-O-α-L-ramnopiranosida dan Kuersetin-3-O-α-L-ramnopiranosida)
Lampiran H. Spektrum 1H-NMR Senyawa Pembanding Flavonoida
1. Spektrum RMI-1H rutin (eter TMS) dalam CCl4