KULTIVAR GRANOLA
JOAN JOULANDA GRACE KAILOLA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Pengaruh Konsentrasi Nitrogen dan Sukrosa terhadap Produksi Umbi Mikro Kentang Kultivar Granola adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
JOAN JOULANDA GRACE KAILOLA. The Effect of Nitrogen Concentra– tion and Sucrose on Potato Microtuber Production of c.v Granola Under direction of WINARSO DRAJAD WIDODO and GUSTAAF ADOLF WATTIMENA.
The problem of potato production in Indonesia is the production of high quality virus free propagules. The virus free potato propagules is derived from microtuber through tissue culture methods. The experiments was conducted in two steps : the first steps was the production of shoot on semisolid medium and the second steps was the addition of liquid medium. The first and the second medium has the same treatment combination of nitrogen and sucrose. The experiment was arranged in Completely Randomized Design consist of two factor. The first factor was nitrogen concentration (30, 60, 90 and 120 mM) and the second factor was sucrose concentration (30, 45, 60, 75 and 90 g/l). The result showed there was an optimum concentration of sucrose and combination between nitrogen and sucrose on the number of shoots, number of tubers and percentage of tuber dry weight. The treatment of 60 mM nitrogen and 60 g/l sucrose produced the highest numbers of qualified microtubers.
JOAN JOULANDA GRACE KAILOLA. Pengaruh Konsentrasi Nitrogen dan Sukrosa terhadap Produksi Umbi Mikro Kentang Kultivar Granola. Dibimbing oleh WINARSO DRAJAD WIDODO dan GUSTAAF ADOLF WATTIMENA.
Salah satu masalah dalam budidaya kentang di Indonesia adalah penyediaan bibit melalui pengembangan propagul kentang bermutu. Usaha untuk mendapatkan bibit kentang yang berkualitas baik dapat dilakukan melalui teknik kultur jaringan berupa umbi mikro. Komposisi media merupakan salah satu faktor yang mempengaruhi produksi umbi mikro. Tujuan penelitian ini adalah untuk mengetahui konsentrasi nitrogen yang optimum untuk pertumbuhan stek dan pengumbian mikro kentang, mengetahui konsentrasi sukrosa yang optimum untuk pertumbuhan stek dan pengumbian mikro kentang dan mengetahui kombinasi antara konsentrasi nitrogen dan sukrosa yang optimum untuk pertumbuhan stek dan pengumbian mikro kentang. Penelitian ini terdiri dari dua tahap percobaan: pertama pengaruh konsentrasi nitrogen dan sukrosa pada pertumbuhan stek mikro kentang dan kedua pengaruh konsentrasi nitrogen dan sukrosa pada pengumbian mikro kentang. Percobaan dilakukan dengan Rancangan Acak Lengkap yang terdiri atas 2 faktor. Faktor pertama adalah konsentrasi nitrogen dengan 4 taraf ( 30, 60, 90 dan 120 mM). Faktor kedua adalah konsentrasi sukrosa dengan 5 taraf ( 30, 45, 60, 75 dan 90 g/l). Data diuji dengan Sidik ragam (uji F), uji beda nilai tengah menggunakan DMRT dan uji Polinomial Orthogonal.
Hasil penelitian menunjukkan bahwa interaksi antara konsentrasi nitrogen dan sukrosa berpengaruh nyata terhadap jumlah buku 4 MST, jumlah akar 4 MST, jumlah umbi 8 MSP, bobot basah umbi 8 MSP, ukuran (diameter) umbi 8 MSP dan persentase bobot kering umbi 8 MSP. Konsentrasi nitrogen sebagai faktor tunggal berpengaruh nyata terhadap bobot basah planlet 4 MST, persentase bobot kering planlet 4 MST, panjang ruas 4 MST dan tinggi tanaman 4 MST. Konsentrasi sukrosa sebagai faktor tunggal berpengaruh nyata terhadap jumlah tunas 4 MST, bobot basah planlet 4 MST, persentase bobot kering planlet 4 MST, panjang ruas 4 MST dan tinggi tanaman 4 MST.
menghasilkan jumlah umbi terbanyak dan memenuhi kriteria umbi mikro untuk bibit. Kombinasi ini menghasilkan 6.4 umbi/botol dengan bobot basah umbi 214.54 mg/umbi, ukuran (diameter) umbi 5.57 mm/umbi dan persentase bobot kering umbi 17.64%.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
KULTIVAR GRANOLA
JOAN JOULANDA GRACE KAILOLA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Agronomi dan Hortikultura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NRP : A252070011
Disetujui Komisi Pembimbing
Dr. Ir.Winarso D.Widodo, M.S. Prof. Dr. Ir. Gustaaf A.Wattimena,M.Sc. Ketua Anggota
Diketahui
Ketua Mayor Agronomi dan Dekan Sekolah Pascasarjana Hortikultura
Dr.Ir. Munif Ghulamahdi, M.S. Dr.Ir. Dahrul Syah, M.Sc. Agr.
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus atas kasih dan anugerah-Nya sehingga penelitian serta penulisan tesis ini dapat diselesaikan.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Dr Ir. Winarso D.Widodo, M.S. dan Prof. Dr. Ir. Gustaaf A. Wattimena, M.Sc. atas bimbingan dan pengarahannya selama kegiatan penelitian dan penulisan tesis ini.
2. Dr. Dewi Sukma S.P., M.Si. atas kesediaannya menjadi penguji luar komisi. 3. Dr. Ir. Munif Ghulamahdi, M.S. (Koordinator Mayor Agronomi dan
Hortikultura) atas waktu dan masukan yang diberikan selama ujian akhir tesis ini.
4. Kepala Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Lembaga Penelitian dan Pemberdayaan Masyarakat Institut Pertanian Bogor atas fasilitas yang diberikan selama pelaksanaan penelitian.
5. Rektor Universitas Pattimura yang telah memberikan ijin kepada penulis untuk melanjutkan studi pada Sekolah Pascasarjana Institut Pertanian Bogor. 6. Yayasan Dana Beasiswa Maluku (YDBM) dan Yayasan Tahija di Jakarta atas
bantuan dana dalam rangka penyelesaian penelitian dan penulisan tesis. 7. Staf Laboratorium Biologi Molekuler dan Seluler Tanaman Pusat Penelitian
Sumberdaya Hayati dan Bioteknologi Lembaga Penelitian dan Pemberdayaan Masyarakat Institut Pertanian Bogor atas bantuannya selama pelaksanaan penelitian.
8. Rekan-rekan mahasiswa Pascasarjana (S2/S3) tahun 2007/2008 dan 2008/2009 Mayor AGH, PBT dan ITB atas bantuan moril maupun fisik serta kebersamaannya, khususnya rekan-rekan angkatan seperjuangan : Arrin, Odit, Mba Pien, Aries, Mba Puji, Usi Enny, Leo, Syukur, Mba Dian dan Tisna. 9. Rekan-rekan Persatuan Mahasiswa Maluku (PERMAMA) di Bogor atas
bantuan dan doanya.
Mengakhiri lembaran ini penulis ingin menyampaikan terima kasih yang mendalam kepada Mama, Papa (alm), Usi Eda, Bung Okto (Nyongkai), untuk segala kasih, perhatian, bantuan dan doa yang telah penulis terima selama ini kiranya Tuhan Yesus Putra Allah yang Maha Kudus senantiasa memberkati kita semua. Penulis berharap semoga karya ilmiah ini bermanfaat dan dapat memperkaya khasanah ilmu pengetahuan.
Bogor, Agustus 2011
Penulis dilahirkan di Ambon pada tanggal 23 Januari 1979 dari Bapak Markus Christian Kailola (alm) dan Ibu Susana Sophia Kailola/Alfons. Penulis merupakan anak ketiga dari tiga bersaudara. Tahun 1996 penulis lulus dari SMA Negeri 1 Ambon dan pada tahun yang sama lulus seleksi masuk Universitas Pattimura Ambon melalui jalur PSSB (Program Seleksi Siswa Berprestasi), penulis memilih Program Studi Agronomi, Fakultas Pertanian.
Halaman
Perumusan Masalah dan Kerangka Pemikiran……… 3
Tujuan Penelitian………. 4
Hipotesis Penelitian………. 4
TINJAUAN PUSTAKA……….. 6
Botani Tanaman Kentang……… 6
Perbanyakan Kentang Secara In Vitro………. 7
Perbanyakan Kentang dengan Umbi Mikro………. 8
Sukrosa………. 12
Nitrogen………... 13
Zat Pengatur Tumbuh……….. 15
BAHAN DAN METODE……… 19
Tempat dan Waktu………... 19
Bahan dan Alat………. 19
Metode Penelitian……… 19
Pelaksanaan Penelitian………. 22
Pengamatan Penelitian………. 24
HASIL DAN PEMBAHASAN………... 26
Hasil………. 26
Jumlah Tunas………. 26
Jumlah buku………... 26
Bobot Basah Planlet dan Persentase Bobot Kering ……… 28
Jumlah akar……… 28
Panjang Ruas……….. 30
Tinggi Tanaman………. 30
Waktu Pembentukan Umbi……… 32
Kecepatan dan Keseragaman Pembentukan Umbi………. 32
Jumlah Umbi……….. 34
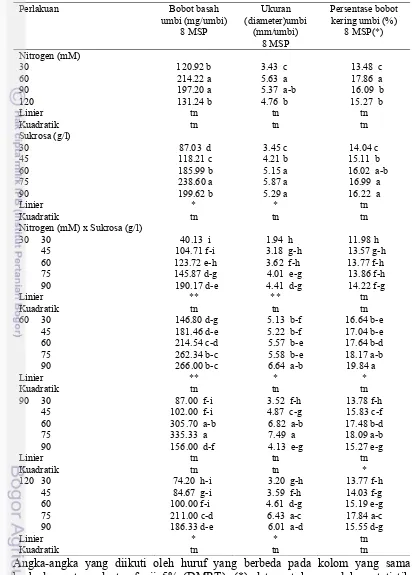
Bobot Basah Umbi, Ukuran (Diameter) Umbi dan Persentase Bobot Kering Umbi……… 37
Pembahasan………. 39
SIMPULAN DAN SARAN………. 47
DAFTAR PUSTAKA……….. 48
Halaman 1. Pengaruh konsentrasi nitrogen dan sukrosa terhadap jumlah tunas dan
jumlah buku……… 27
2. Pengaruh konsentrasi nitrogen dan sukrosa terhadap bobot basah planlet, persentase bobot kering planlet dan jumlah akar... ……… 29
3. Pengaruh konsentrasi nitrogen dan sukrosa terhadap panjang ruas dan tinggi tanaman………... 31
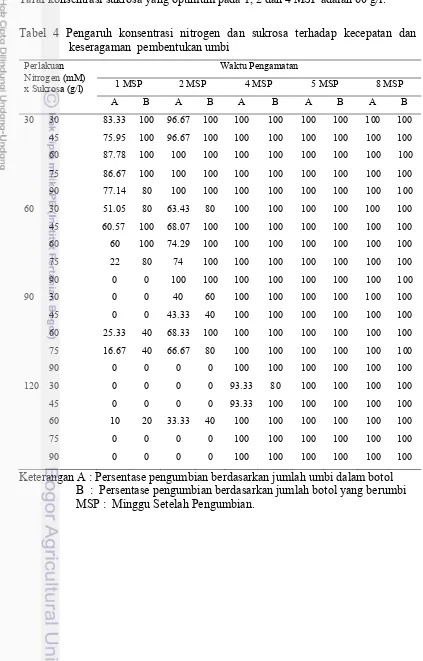
4. Pengaruh konsentrasi nitrogen dan sukrosa terhadap kecepatan dan keseragaman pembentukan umbi……….... 33
5. Pengaruh konsentrasi nitrogen dan sukrosa terhadap jumlah umbi……… 35
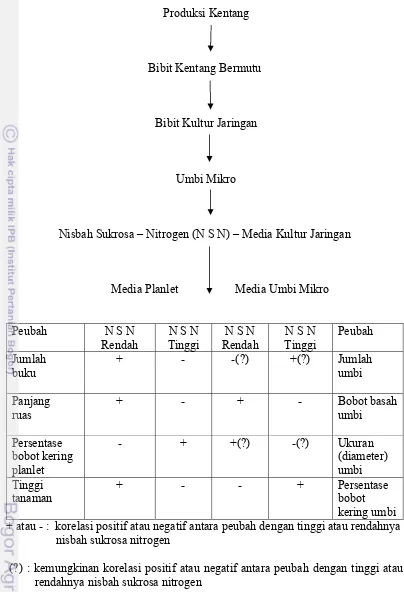
Halaman 1. Kerangka pemikiran pengaruh konsentrasi nitrogen dan sukrosa terhadap
produksi umbi mikro kentang kultivar granola………. 5
1. Rekapitulasi hasil sidik ragam peubah pertumbuhan stek mikro dan
pengumbian mikro kentang……… 54
2. Komposisi media Murashige dan Skoog (MS) (1962)……….... 55
3. Sidik ragam jumlah tunas 2 MST dan 4 MST……… 56
4. Sidik ragam jumlah buku 2 MST dan 4 MST……… 56
5. Sidik ragam bobot basah planlet 4 MST………. 57
6. Sidik ragam persentase bobot kering planlet 4 MST……….. 57
7. Sidik ragam jumlah akar 2 MST dan 4 MST………... 58
8. Sidik ragam panjang ruas 2 MST dan 4 MST……… 59
9. Sidik ragam tinggi tanaman 2 MST dan 4 MST………. 59
10. Sidik ragam jumlah umbi pada 1 – 8 MSP (Trans √x + 0.5)……….. 60
11. Sidik ragam bobot basah umbi 8 MSP……… 62
12. Sidik ragam ukuran umbi 8 MSP……… 62
13. Sidik ragam persentase bobot kering umbi 8 MSP………. 62
14. Rekapitulasi persamaan regresi peubah pertumbuhan stek mikro dan pengumbian mikro kentang……… 63
15. Matriks korelasi pertumbuhan stek mikro dan pengumbian mikro kentang……… 69
16. Penampilan umbi mikro pada 8 minggu setelah pengumbian……… 71
Latar Belakang
Kentang (Solanum tuberosum L.) di Indonesia merupakan salah satu
komoditas sayuran yang mendapat prioritas pengembangan, karena dapat
digunakan sebagai sumber karbohidrat, bergizi tinggi terutama vitamin dan
mineral dan mempunyai potensi dalam diversifikasi pangan. Permintaan pasar
terhadap kentang dalam beberapa tahun terakhir ini cenderung meningkat sejalan
dengan berkembangnya jumlah penduduk yang menggunakan kentang sebagai
sayuran sehari-hari dan berkembangnya industri pengolahan makanan
(Karjadi 2002). Secara umum produksi kentang di Indonesia masih relatif rendah,
yaitu 1.060.579 ton dengan luas panen 66.508 ha dan produktivitas 15.95 ton/ha
(BPS 2010), sedangkan produktivitas kentang negara subtropis seperti USA dan
Belanda sudah mencapai 37.40 ton/ha dan 45.10 ton/ha (Rubatsky & Yamaguchi
1998).
Kendala penting produksi kentang di Indonesia adalah ketersediaan
kultivar standar yang sesuai dengan lingkungan di Indonesia, bibit kentang masih
diimpor dari luar negeri, dan adanya beberapa penyakit yang sukar dikendalikan
seperti virus (PVX, PVY, PVLR), hawar daun, layu bakteri dan nematoda, yang
dapat tertular melalui bibit (seed borne disease). Penyakit-penyakit seed borne
akan terakumulasi sepanjang terus diperbanyak secara vegetatif dengan umbi
(konvensional). Oleh karena itu terdapat dua masalah utama yang harus segera
diatasi dalam budidaya kentang yaitu : (1) masalah ketersediaan bibit melalui
pengembangan propagul kentang bermutu dan (2) masalah hama dan penyakit
melalui perakitan kultivar unggul (Purwito et al. 1995, Wattimena 2000). Apabila
petani menggunakan bibit impor maka 40–50% dari total biaya produksi kentang
sudah dikeluarkan hanya untuk pengadaan bibit. Kondisi ini mengakibatkan
petani yang umumnya berkemampuan ekonomi rendah tidak mungkin
melakukannya sehingga untuk memenuhi kebutuhan bibitnya, petani
mempergunakan bibit lokal yang kurang bermutu (Wattimena et al. 1983,
Usaha untuk mendapatkan bibit kentang yang berkualitas baik dapat
dilakukan melalui teknik kultur jaringan. Teknik ini dapat menyediakan bibit yang
bebas pathogen, seragam dan tidak tergantung musim. Wattimena et al.
(1983) memperkenalkan dua teknik dalam produksi propagula melalui
perbanyakan mikro yaitu dengan stek mikro dan umbi mikro. Umbi mikro
memiliki beberapa keunggulan dibandingkan stek mikro karena lebih mudah
ditangani, dapat ditransportasikan dalam jarak jauh tanpa mengurangi
viabilitasnya serta lebih tahan bila dipindahkan ke media non aseptik (Wattimena
et al. 1983, Wang & Hu 1982).
Beberapa penelitian telah dilakukan untuk melihat pengaruh media yang
digunakan terhadap produksi umbi mikro antara lain Wattimena et al. (2001),
Kailola (2002) menggunakan media pengumbian MS cair + sukrosa 90 g/l +
cycocel 600 mg/l + air kelapa 15% dengan konsentrasi aspirin 30 mg/l
menghasilkan bobot basah umbi tertinggi yaitu 236.60 mg/umbi. Mustika (2005)
melakukan percobaan pada kultivar Granola diperoleh jumlah umbi terbanyak
7.8 umbi dengan diameter 5.37 mm, diameter umbi diatas 5 mm 55.03%, bobot
basah umbi 179.82 mg, bobot basah umbi diatas 100 mg 47.08% dan persentase
bobot kering umbi tertinggi 20.17% dihasilkan oleh media dengan 30 mg/l
coumarin dan 60 mM nitrogen. Stallknecht et al. (1979) mendapatkan persentase
pengumbian sebesar 15–20% pada media MS yang diinduksi coumarin dengan
konsentrasi N yang tinggi (60 mM N/l) sedangkan pada media Katsura dengan
konsentasi N rendah (2.5 mM N/l) menghasilkan persentase pengumbian sebesar
95–100%. Penghambatan pengumbian yang diinduksi coumarin oleh N tinggi
dapat dimodifikasi dengan menaikkan karbohidrat misalnya pada media Katsura
dengan N 15 mM dan sukrosa yang dinaikkan dari 6-12% mengakibatkan
persentase pengumbian menjadi 100%. Menurut Wattimena (1983) unsur hara
nitrogen pada media pertunasan maupun pengumbian secara in vitro sangat
mempengaruhi proses pembentukan umbi mikro dan kualitas umbi mikro yang
diinduksi oleh coumarin.
Penelitian tentang pengaruh nitrogen dan sukrosa pada media pertunasan
dan pengumbian yang sama belum pernah dilakukan. Secara umum penggunaan
umbi mikro yang besar tetapi memiliki persentase pengumbian yang rendah, hal
ini dapat diimbangi dengan pemberian sukrosa sehingga menghasilkan persentase
pengumbian dan bobot kering umbi yang tinggi. Diharapkan dengan
memanipulasi konsentrasi nitrogen dan sukrosa pada media pertunasan dan
pengumbian maka akan dihasilkan umbi mikro yang besar dengan bobot kering
dan persentase pengumbian yang tinggi sehingga dapat digunakan sebagai umbi
bibit G0. Bibit G0 harus mempunyai mutu prima yang dapat ditanam pada umur
fisiologi bibit yang optimal sehingga diharapkan dapat meningkatkan produksi
kentang rata-rata nasional (Wattimena 2000). Penelitian tentang manipulasi
konsentrasi nitrogen dan sukrosa perlu dilakukan dalam rangka meningkatkan
ketersediaan bibit bermutu. Penelitian ini menggunakan kultivar Granola karena
pada saat ini kultivar kentang yang banyak dibudidayakan petani adalah kultivar
Granola. Keunggulan kultivar Granola adalah berumur genjah (90 hari), hasil
tinggi, agak tahan terhadap penyakit hawar daun, resisten terhadap virus kentang
PVX dan PVY dan agak tahan terhadap penyakit layu bakteri. Kelemahan kultivar
Granola adalah kandungan air tinggi sekitar 85% sehingga tidak cocok untuk
kentang olahan (Warnita 2006).
Perumusan Masalah dan Kerangka Pemikiran
Kentang adalah salah satu sumber makanan pokok harapan kedepan yang
bergizi dengan perbandingan kalori dan gizi yang berimbang. Kebutuhan yang
meningkat akan kentang segar maupun olahan baik untuk pasar domestik maupun
ekspor memberi peluang peningkatan produksi kentang di Indonesia. Dari segi
budidaya tanaman kentang memiliki dua masalah utama yang harus segera diatasi
yaitu masalah penyediaan bibit melalui pengembangan propagul kentang bermutu
dan masalah hama dan penyakit melalui perakitan kultivar unggul.
Usaha untuk mendapatkan bibit kentang yang berkualitas baik dapat
dilakukan melalui teknik kultur jaringan. Keunggulan teknik kultur jaringan
tanaman adalah dapat menghasilkan propagul tanaman dalam jumlah banyak dan
dalam waktu yang singkat bebas hama dan penyakit (sistemik dan non sistemik)
serta sama dengan induknya. Kultur jaringan kentang dapat berupa stek mikro
Komposisi media merupakan salah satu faktor yang mempengaruhi
produksi umbi mikro. Menurut Wattimena (1983) unsur hara nitrogen pada media
pertunasan maupun pengumbian secara in vitro sangat mempengaruhi proses
pembentukan umbi mikro dan kualitas umbi mikro yang diinduksi oleh coumarin.
Penelitian tentang pengaruh nitrogen dan sukrosa pada media pertunasan
dan pengumbian yang sama belum pernah dilakukan. Secara umum penggunaan
konsentrasi nitrogen yang tinggi pada media pengumbian akan menghasilkan
umbi mikro yang besar tetapi memiliki persentase pengumbian yang rendah, hal
ini dapat diimbangi dengan peningkatan konsentrasi sukrosa yang diharapkan
dapat menghasilkan persentase pengumbian dan bobot kering umbi yang tinggi.
Diharapkan dengan memanipulasi konsentrasi nitrogen dan sukrosa pada media
pertunasan dan pengumbian maka akan dihasilkan umbi mikro yang besar dengan
bobot kering dan persentase pengumbian yang tinggi sehingga dapat digunakan
sebagai umbi bibit G0. Kerangka pemikiran pengaruh konsentrasi nitrogen dan
sukrosa terhadap produksi umbi mikro kentang kultivar Granola disajikan pada
gambar 1.
Tujuan Penelitian
Tujuan penelitian yaitu: (1) Mengetahui konsentrasi nitrogen yang
optimum untuk pertumbuhan stek dan pengumbian mikro kentang,
(2) Mengetahui konsentrasi sukrosa yang optimum untuk pertumbuhan stek dan
pengumbian mikro kentang, (3) Mengetahui kombinasi antara konsentrasi
nitrogen dan sukrosa yang optimum untuk pertumbuhan stek dan pengumbian
mikro kentang.
Hipotesis Penelitian
Hipotesis yang diajukan dalam penelitian ini adalah (1) Terdapat
konsentrasi nitrogen yang optimum pada pertumbuhan stek dan pengumbian
mikro kentang, (2) Terdapat konsentrasi sukrosa yang optimum pada
pertumbuhan stek dan pengumbian mikro kentang, (3) Terdapat kombinasi antara
konsentrasi nitrogen dan sukrosa yang optimum pada pertumbuhan stek dan
Produksi Kentang
Bibit Kentang Bermutu
Bibit Kultur Jaringan
+ atau - : korelasi positif atau negatif antara peubah dengan tinggi atau rendahnya
nisbah sukrosa nitrogen
(?) : kemungkinan korelasi positif atau negatif antara peubah dengan tinggi atau rendahnya nisbah sukrosa nitrogen
TINJAUAN PUSTAKA
Botani Tanaman Kentang
Kentang merupakan tanaman herba dikotil dan bersifat semusim atau
annual (Nonnecke 1989). Tanaman kentang termasuk dalam famili Solanaceae
dengan genus Solanum dan spesies Solanum tuberosum L. Tanaman kentang
berasal dari benua Amerika Selatan. Beberapa spesies kentang liar terdapat di
wilayah pegunungan Andes mulai dari Kolombia sampai Chilli, tanaman ini
menyebar ke seluruh dunia melalui Eropa dan menjadi salah satu bahan pangan
penting dunia (Smith 1986).
Nonnecke (1989) mengemukakan bahwa perbanyakan suatu kultivar
kentang umumnya adalah melalui umbi. Apabila dikehendaki perubahan pada
suatu tipe, maka perbanyakan dilakukan melalui biji. Permadi et al. (1989)
menyatakan bahwa tanaman kentang biasanya diperbanyak dari umbi (vegetatif)
sehingga sifat tanaman generasi berikutnya sama dengan induknya. Penanaman
dengan biji dilakukan untuk menciptakan varietas-varietas baru.
Kentang memiliki bentuk perakaran tunggang dengan banyak akar lateral
dan adventisius. Akar muncul dari buku batang yang terletak di dalam tanah
(Edmond et al. 1977). Nonnecke (1989) menyatakan bahwa akar pada kentang
memiliki peranan yang lebih kecil dalam penyimpanan fotosintat dibandingkan
kebanyakan tanaman lainnya karena umbi merupakan tempat penyimpanan hasil
fotosintesis daun, menggantikan peranan penting akar sebagai tempat makanan.
Menurut Edmond et al. (1977) terdapat dua tipe batang pada tanaman
kentang. Batang yang di atas permukaan tanah (aerial) bentuknya angular
berwarna hijau kemerahan atau hijau keunguan tergantung varietas. Batang yang
berada di dalam tanah terdiri dari stolon dan umbi.
Nonnecke (1989) mengemukakan bahwa pada fase perkembangan, bentuk
batang tegak lurus tetapi dengan bertambahnya umur tanaman, batang menjadi
tergeletak dan terlentang. Pada mulanya batang lunak dan padat, tetapi kemudian
berkembang menjadi bersegi (angular) dan berongga. Permadi et al. (1989)
menyatakan bahwa batang tanaman kentang berongga dan tidak berkayu kecuali
pertama tanaman kentang berupa daun tunggal, kemudian daun-daun berikutnya
muncul berupa daun-daun majemuk dengan anak daun primer dan anak daun
sekunder. Daun menyirip majemuk dengan lembar daun bertangkai memiliki
ukuran, bentuk dan tekstur yang beragam (Rubatzky & Yamaguchi 1998).
Bunga tanaman kentang adalah zygomorph dan berjenis kelamin dua
(Tjitrosoepomo 1997). Bunga berwarna putih, merah jambu sampai keunguan
tergantung varietas. Daun kelopak, daun mahkota dan benang sari masing-masing
berjumlah lima buah dengan satu buah putik yang mempunyai sebuah bakal buah
yang beruang dua (Smith 1986). Menurut Nonnecke (1989) bunga kentang tidak
menghasilkan nektar madu sehingga tidak didatangi lebah, angin merupakan
perantara penyerbukan.
Thompson dan Kelly (1957) menyatakan bahwa umbi merupakan hasil
pembengkakan dari ujung stolon, tetapi tidak semua stolon dapat membentuk
umbi. Menurut Sunarjono (1975) ukuran stolon tergantung pada varietas kentang.
Ukuran stolon bisa pendek sehingga seolah-olah tidak berstolon. Menurut
Edmond et al. (1977) umbi kentang merupakan batang yang berfungsi sebagai
bagian penyimpanan cadangan makanan dengan kandungan tepung yang cukup
tinggi. Umbi berada di ujung stolon dengan ciri pendek, gemuk dan berdaging.
Menurut Permadi et al. (1989) umbi akan terputus dari stolon pada saat stolon
mengering bersamaan dengan matinya tanaman.
Perbanyakan Kentang Secara In Vitro
Ketersediaan bibit kentang bermutu merupakan salah satu masalah dalam
peningkatan produksi kentang di Indonesia. Penyediaan bibit kentang bermutu
sangat terbatas karena perbanyakan kentang yang lambat dan adanya penyakit
yang menyerang bibit sehingga menurunkan hasil panen kentang
(Vander Zaag & Wei 1991). Bibit impor terbatas dengan harganya mahal.
Pemenuhan kebutuhan bibit ini terpaksa menggunakan bibit lokal yang kurang
bermutu (Wattimena 1992).
Cara perbanyakan tanaman melalui teknik kultur jaringan atau
mikropropagasi merupakan salah satu alternatif pemecahan masalah dalam
menghasilkan propagul tanaman dalam jumlah banyak, dalam waktu yang singkat,
bebas hama dan penyakit (sistemik dan nonsistemik) serta sama dengan induknya
(Wattimena 2000).
Penerapan teknik kultur jaringan didasarkan pada prinsip bahwa tanaman
dapat ditumbuhkan dan diperbanyak secara in vitro dari sekelompok sel atau
sebagian kecil jaringan tanaman dalam media aseptik, yang nutrisi dan keadaan
lingkungannya terkendali dengan baik, sehingga dapat dihasilkan tanaman baru
yang mampu tumbuh pada media non aseptik (Winata 1987).
Wattimena (2000) menyatakan bahwa pembibitan mikropropagasi kentang
untuk subtitusi propagul umbi biasa harus memenuhi beberapa kriteria yaitu :
(1) bibit mikropropagasi tersebut sangat diperlukan, (2) harus menguntungkan
baik dalam produksi propagulnya maupun dalam sistem budidaya kentang
(cost effective), (3) sistem distribusi yang memenuhi persyaratan kuantitas dan
kualitas, serta (4) sistem yang dapat beradaptasi terhadap sistem transportasi dan
penanganan di Indonesia.
Perbanyakan Kentang dengan Umbi Mikro
Pada dasarnya umbi kentang merupakan modifikasi batang dengan sumbu
utama yang memendek dan bagian lateralnya terhambat (Artschwager 1924 dalam
Slater 1963). Umbi kentang dianggap penting karena 75–85% bahan kering total
yang diproduksi tanaman diakumulasi di dalam umbi (Ivins & Bremner 1964
dalam Cutter 1978). Di lapang umbi terbentuk pada stolon yaitu cabang-cabang
aksilar dari batang yang tumbuh di bawah tanah. Pada kondisi tertentu umbi dapat
tumbuh pada setiap mata tunas aksilar (Werner 1954 dalam Cutter 1978).
Berdasarkan prinsip tersebut, dengan proses penginduksian yang sesuai,
setiap mata tunas aksilar pada ketiak daun dari tunas yang ditumbuhkan secara
in vitro mampu menghasilkan umbi. Pembentukan umbi secara in vitro
(umbi mikro) dapat terjadi pada ketiak daun dari tunas eksplan (sesil/duduk) dan
pada pucuk atau ketiak daun dari tunas samping yang baru terbentuk (terminal
serta aksilar). Umbi mikro berukuran kecil (beberapa mm sampai lebih dari
morfologis umbi mikro identik dengan umbi yang diproduksi di lapang
(Wattimena 1983, Wang & Hu 1985).
Persiapan umbi mikro sampai siap pindah lapang terdiri dari 4 fase yaitu:
(1) produksi tunas mikro selama 4 minggu, (2) produksi umbi mikro selama
8 minggu, (3) pertunasan umbi mikro selama 8–16 minggu dan (4) pembuatan
semai (seedling) selama 4–6 minggu. Di daerah tropis seperti di Indonesia dapat
ditanam umbi mikro yang telah bertunasan secara langsung di lapang asal panjang
tunas sudah mencapai 1 cm atau lebih. Di USA (iklim dingin) hal itu tidak dapat
dilakukan karena pada waktu tanam suhu tanah masih dingin dan tunas umbi
mikro itu tidak sanggup untuk tumbuh ke permukaan tanah Wattimena (1992).
Menurut Wattimena (2000) keuntungan dari penggunaan propagul umbi
mikro adalah : (1) propagul umbi mikro yang berasal dari eksplan bebas penyakit
akan menghasilkan umbi mikro bebas penyakit, (2) umbi mikro akan
menghasilkan tanaman yang seragam dan umur panen sama dengan propagul
umbi biasa, (3) kebutuhan umbi mikro hanya 4–5 kg per hektar dibandingkan
dengan umbi biasa yang memerlukan 1–2 ton bibit per hektar, (4) mudah dalam
penyimpanan, transportasi dan penanganan, (5) mudah memenuhi persyaratan
karantina untuk lalu lintas propagul baik dalam maupun luar negeri.
Disamping keuntungan yang telah disebut, propagul umbi mikro juga
mempunyai kelemahan antara lain : (1) keadaan cekaman pada awal pertumbuhan
lebih berdampak negatif dibandingkan dengan propagul umbi biasa, (2) masa
dormansi yang panjang dan pecah dormansi tidak serentak. Lamanya waktu
dormansi tergantung dari genotipe dan retardan yang digunakan. Penggunaan
retardan paclobutrazol memperpanjang masa dormansi. Kultivar-kultivar berumur
genjah mempunyai dormansi yang lebih pendek dibanding dengan
kultivar-kultivar berumur dalam, (3) produksi umbi mikro sampai panen memerlukan
waktu yang lebih lama (12 minggu) dibandingkan dengan stek mikro (4 minggu).
Ongkos produksi per satuan propagul pun pada umbi mikro 3 kali lebih mahal
dari stek mikro. Penelitian mengenai umbi mikro perlu dilanjutkan terutama
didalam produksi secara masal. Sistem produksi dengan mempergunakan media
cair, maupun sistem satu jenis atau dua jenis media membuka peluang untuk
Pembentukan umbi terbagi menjadi dua tahap, yaitu : (1) induksi
pengumbian dan (2) pembesaran atau pertumbuhan umbi. Tahap pembesaran
umbi merupakan tanda pertama yang dapat dilihat dari terjadinya induksi
pengumbian (Chapman 1958). Menurut Plaisted (1957) dalam Slater (1963),
pembesaran umbi terjadi terutama karena meningkatnya jumlah sel di dalam umbi
dan bukan karena peningkatan ukuran sel.
Keberhasilan pengumbian kentang tergantung dari ketepatan memilih
proses-proses yang dapat memanipulasi tahap induksi pengumbian dan tahap
pembesaran atau pertumbuhan umbi (Ewing 1981). Di dalam kultur in vitro,
keberhasilan pembentukan umbi dapat tercapai dengan pemilihan eksplan, media
tumbuh dan kondisi lingkungan yang tepat (Hussey 1980, Locy 1984, Wang & Hu
1985).
Pemilihan eksplan yang tepat akan mempengaruhi keberhasilan
pengumbian kentang secara in vitro. Ukuran, sumber atau letak dan umur
fisiologis eksplan perlu diperhatikan. Secara umum, semakin kecil ukuran eksplan
semakin kecil daya hidupnya. Letak eksplan pada tanaman juga berpengaruh,
misalnya ujung pucuk apikal merupakan eksplan yang lebih baik dari ujung pucuk
aksilar (Locy 1984). Sel-sel yang telah mengalami diferensiasi lanjut lebih sukar
ditumbuhkan daripada sel-sel yang masih bersifat meristematis (Winata 1987).
Eksplan untuk pembentukan umbi mikro kentang dapat berupa tunas umbi
yang teretiolasi atau stolon apikal (Palmer & Smith 1969, 1970, Stallknecht &
Farnsworth 1979, 1982), stek berbuku tunggal, yang berasal dari lapang atau dari
kultur in vitro (Roca et al. 1979, Hussey & Stacey 1981,Wattimena 1983,Estrada
et al. 1986) atau tunas berakar yang ditumbuhkan di dalam kultur in vitro (Wang
& Hu 1985). Menurut Stallknecht dan Farnsworth (1979), penggunaan jaringan
yang besar, seperti stolon apikal dan stek mikro, dapat memberikan hasil
pengumbian yang lebih kompleks. Wang dan Hu (1985) berpendapat bahwa
kondisi optimum dari faktor-faktor yang mempengaruhi pengumbian dapat
berbeda tergantung jenis jaringan eksplan dan kultivar yang digunakan. Setiap
eksplan yang digunakan untuk proses pengumbian secara in vitro terdiri dari
dapat didorong untuk membentuk tunas, stolon, atau umbi in vitro tergantung dari
komposisi media dan kondisi lingkungan tumbuh (Chapman 1958).
Media kultur jaringan merupakan campuran dari unsur hara makro, unsur
hara mikro, karbon (gula), vitamin, asam amino dan zat pengatur tumbuh
(Winata 1988). Pertumbuhan tanaman kultur jaringan sangat dipengaruhi oleh
komposisi media ini. Media yang sering digunakan untuk kultur in vitro kentang
adalah media MS (Murashige dan Skoog).
Suhu dan cahaya merupakan dua faktor eksogen yang dapat
mempengaruhi pertumbuhan dan morfogenesis dalam kultur jaringan (George &
Sherrington 1984). Kedua faktor tersebut juga mempengaruhi pertumbuhan
vegetatif dan pengumbian kentang dalam kultur in vitro. Menurut Madec (1963)
dan Ewing (1981), fotoperiode dan suhu mempengaruhi keseimbangan atau rasio
dari zat pengatur tumbuh yang berperan dalam pengumbian kentang seperti
giberelin dan sitokinin, serta ketersediaan karbohidrat yang dibutuhkan untuk
inisiasi dan pertumbuhan umbi.
Hussey (1980) serta Wang dan Hu (1985) menyatakan bahwa suhu yang
umum digunakan dalam pertumbuhan tunas mikro kentang adalah 15–25oC.
Untuk pengumbian secara in vitro, suhu optimum yang konstan memberikan hasil
produksi umbi mikro yang lebih tinggi daripada bila perbedaan suhu siangnya
tinggi dan suhu malamnya rendah (Wang & Hu 1982). Menurut Stallknecht dan
Farnsworth (1982), pada suhu yang < 15oC serta > 30oC pembentukan umbi mikro
akan terhambat. Suhu optimum yang dibutuhkan dalam pembentukan umbi dalam
kultur in vitro adalah 18–20oC (Wang & Hu, 1985). Untuk produksi tunas mikro
kentang digunakan suhu 20–25oC, sedangkan untuk produksi umbi mikro
digunakan suhu 15–20oC (Wattimena et al. 1983).
Cahaya mempengaruhi proses morfogenesis, diferensiasi, dan
embriogenesis somatik (Wang & Hu, 1982). Untuk pertumbuhan tunas in vitro
kentang dibutuhkan cahaya dengan intensitas sebesar 1000–5000 luks (Wang &
Hu 1985) serta panjang hari sekitar 16 jam per hari (Hussey 1980, Wang & Hu
1985) atau penyinaran terus-menerus (Wattimena et al. 1983).Wang dan Hu
(1985) berpendapat bahwa pembentukan umbi mikro kentang memerlukan
menggunakan keadaan gelap terus-menerus selama masa inkubasi (8 minggu) di
dalam media pengumbian.
Sukrosa
Karbohidrat merupakan sumber energi untuk sel-sel tanaman dalam kultur
yang belum dapat melaksanakan fotosintesis. Karbohidrat yang terpenting dan
biasa digunakan adalah sukrosa. Menurut Prawiranata et al. (1994) sukrosa dan
pati merupakan bentuk karbohidrat cadangan yang penting dalam sel tumbuhan.
Selain itu sukrosa merupakan bentuk senyawa organik utama yang
ditransportasikan ke dalam sel tumbuhan. Senyawa organik tersebut berperan
dalam menghasilkan energi dalam proses respirasi dan sebagai bahan pembentuk
sel baru.
Menurut Gautheret dalam George dan Sherrington (1984) sumber
karbohidrat yang paling baik yaitu dalam bentuk sukrosa, glukosa, maltosa dan
rafinosa. Pierik (1987) menyatakan bahwa gula yang dijual di supermarket terdiri
dari sukrosa 99.94%, air 0.02%, rafinosa, fruktosa dan glukosa 0.04%.
Untuk pertumbuhan tunas mikro yang baik dibutuhkan sukrosa sebesar
2–3% (Roca et al. 1979, Hussey & Stacey 1981, Wang & Hu 1982, Wattimena
1983). Menurut Wang dan Hu (1985), konsentrasi sukrosa untuk pengumbian
kentang secara in vitro harus lebih tinggi dari konsentrasi sukrosa yang umum
digunakan. Untuk pengumbian kentang di lapang, karbohidrat yang akan
diakumulasi di dalam umbi merupakan hasil fotosintesa pada kondisi lingkungan
yang intensitas cahayanya tinggi. Intensitas cahaya yang tinggi seperti di lapang
tidak dapat diterapkan di dalam ruang inkubasi kultur, karena suhu di dalam botol
kultur akan meningkat melebihi batas maksimum yang dapat diterima oleh tunas
in vitro. Dengan demikian, karbohidrat yang dibutuhkan untuk pengumbian
in vitro disediakan dari penambahan sukrosa di dalam media. Konsentrasi sukrosa
yang umum digunakan sekitar 6–8% (Palmer & Smith 1969, Wattimena 1983,
Estrada et al. 1986). Hasil penelitian Puspitaningtyas (1988) dan Meilinda (1990)
menunjukkan bahwa konsentrasi sukrosa 9% memberikan pengaruh yang terbaik
terhadap jumlah, ukuran dan bobot basah umbi. Selanjutnya Wattimena (1992)
tunas bila dalam kondisi gelap. Penggunaan sukrosa dalam media pembibitan
in vitro ditujukan untuk menciptakan ketahanan bibit mikro kentang tersebut.
Menurut Haryadi (1993) sukrosa merupakan karbohidrat cadangan yang penting
dalam sel tumbuhan. Pada awal pertumbuhan atau fase vegetatif karbohidrat
dibutuhkan untuk pembentukan akar, batang dan daun.
Nitrogen
Unsur nitrogen (N) merupakan unsur yang paling banyak berperan pada
fase pertumbuhan vegetatif dan pengumbian kentang. Unsur N media dipenuhi
dalam bentuk nitrat (NO3-) dan amonium (NH4+). Konsentrasi nitrat biasanya
antara 25–40 mM dan konsentrasi amonium antara 2–20 mM (Gamborg & Shyluk
1981). Pada kultur jaringan tanaman kentang tidak dapat tumbuh dalam bentuk
nitrat atau amonium saja (Winarso 1986). Pertumbuhan yang terbaik adalah dalam
perbandingan 1:1, 2:1 atau 3:1 (nitrat:amonium). Perbandingan 3:1 menunjukkan
pertumbuhan kentang lebih vigor (Mahasin 1988). Perbandingan unsur N dalam
media Murashige dan Skoog adalah 2:1 (Wattimena 1995). Media MS
menyediakan 60 mM dalam bentuk nitrat dan amonium, masing-masing sebanyak
40 mM dan 20 mM.
Pembentukan umbi mikro tidak hanya dipengaruhi komposisi media
pengumbian tetapi juga oleh jumlah nitrogen yang digunakan untuk pertunasan.
Konsentrasi nitrogen pada media pertunasan berpengaruh terhadap keadaan
fisiologis dari tunas yang ditumbuhkan secara in vitro sehingga akan
mempengaruhi pembentukan umbi mikro. Wattimena (1983) menyatakan bahwa
tunas mikro kentang dapat tumbuh dengan baik pada konsentrasi N tinggi
(60–120 mM) dan pada konsentrasi N rendah (6 mM) pertumbuhan tunas sangat
terhambat.
Respon tanaman terhadap nitrogen juga dipengaruhi oleh kultivar
(genotipe), sehingga pertumbuhan tanaman dengan kultivar tertentu akan berbeda
dibandingkan kultivar lain pada konsentrasi N yang sama. Misalnya kultivar
Red Pontiac memberikan respon pertumbuhan yang tinggi terhadap peningkatan
konsentrasi N di dalam media dari 6–60 mM dibandingkan dengan kultivar
konsentrasi N rendah (4 mM) dan konsentrasi N tinggi (60 mM) pada media
pengumbian atau sebaliknya akan lebih baik daripada produksi umbi pada media
pertunasan dan pengumbian dengan konsentrasi N tinggi (60 mM), untuk ketiga
kultivar tersebut di atas. Tidak semua kultivar tanaman kentang dapat tumbuh
dengan baik pada media pertunasan yang konsentrasi N-nya rendah. Padahal
untuk memperoleh produksi umbi mikro dengan kualitas tinggi dibutuhkan tunas
mikro yang berkualitas tinggi sebagai sumber eksplan(Wattimena 1983).
Pemberian N secara berlebihan juga dapat menimbulkan masalah, yaitu
menurunnya kandungan karbohidrat dan kualitas umbi (Thompson & Kelly 1957).
Peningkatan N akan meningkatkan kandungan protein umbi yang diikuti dengan
menurunnya kandungan karbohidrat, akibatnya kandungan bahan kering
cenderung menurun. Konsentrasi N tinggi (60 mM) baik pada media eksplan
maupun media pengumbian dapat menghambat translokasi coumarin sehingga
pembentukan umbi terhambat. Akan tetapi konsentrasi N rendah (2.5 mM) akan
menginduksi pengumbian sampai 95–100% (Stallknecht & Farnsworth 1979).
Selain itu juga dikemukakan bahwa penghambat pembentukan umbi oleh
konsentrasi N tinggi dapat diatasi dengan meningkatkan konsentrasi karbohidrat
(sukrosa) dalam media. Wattimena (1995) mendapatkan konsentrasi nitrogen yang
tepat yaitu 15 mM untuk menghasilkan respon terbaik pada jumlah umbi, ukuran
umbi, bobot basah dan persentase bahan kering umbi mikro yang diiinduksi oleh
coumarin dan kinetin pada keempat taraf pH yang digunakan ( 4.7, 5.7, 6.7 dan
7.7). Meilinda (1990) mengemukakan bahwa pembentukan umbi dihambat oleh
konsentrasi nitrogen yang tinggi (60 mM) dapat diatasi dengan menambahkan
Zat Pengatur Tumbuh
Menurut Wattimena (1988) zat pengatur tumbuh (ZPT) merupakan
senyawa organik yang dapat digunakan untuk memodifikasi pertumbuhan dan
perkembangan tanaman dan diarahkan untuk perbaikan komponen hasil yang
mendukung produksi. ZPT ini menentukan perkembangan tanaman, baik alamiah
maupun sintetik. Selanjutnya Abidin (1993) menyatakan bahwa zat pengatur
tumbuh pada tanaman merupakan senyawa bukan hara yang dalam jumlah sedikit
dapat mendukung, menghambat dan merubah proses fisiologis tanaman. Menurut
Wattimena (1992) terdapat 6 kelompok ZPT, yaitu auksin, giberelin, sitokinin,
asam absisi (ABA), etilen dan retardan. Senyawa-senyawa poliamin (putresin,
spermidin, spermin), polifenolik dan alkohol berantai panjang (triakontanol)
sering digolongkan ke dalam ZPT. Fitokrom walaupun bukan ZPT tetapi
mempunyai pengaruh yang sama dengan ZPT, hanya fitokrom bukan senyawa
organik tetapi jenis pigmen tumbuhan.
Setiap proses morfogenesis ada ZPT yang menghambat dan ada ZPT yang
mendorong, praktek pemberian ZPT untuk proses morfogenesis suatu organ
adalah pemberian ZPT yang mendorong dan senyawa atau ZPT yang menghambat
ZPT penghambat, pada proses pembentukan umbi mikro, sitokinin adalah
pendorong dan giberelin adalah penghambat, karena itu pemberian ZPT untuk
pengumbian in vitro terdiri dari sitokinin, retardan dan inhibitor (coumarin),
retardan sebagai penghambat biosintesis giberelin dan inhibitor sebagai antagonis
terhadap proses penghambatan dari giberelin (Wattimena 1992).
Menurut Suryowinoto dalam Haryadi dan Pamenang (1983) air kelapa yang
baik untuk campuran kultur jaringan adalah kelapa muda yang dagingnya
(endospermanya) sudah berwarna putih tetapi masih dapat disendok. Secara
alamiah air kelapa memberi makan pada embrio. Air kelapa merupakan sumber
unsur hara dan sebagai stimulasi pertumbuhan (Scully 1967). Kemampuan air
kelapa untuk menyokong pertumbuhan jaringan tanaman mula-mula didapatkan
oleh Van Overbeck pada tahun 1944 pada potongan embrio Datura stramonium
(Winata 1995) yang memerlukan faktor untuk pertumbuhannya dan keperluan ini
medium aseptik, jaringan tanaman Datura stramonium menjadi tanaman lengkap.
Air kelapa dikenal sebagai salah satu sumber sitokinin (Letham 1974).
George dan Sherrington (1984) menyatakan beberapa penelitian yang telah
dilakukan memperlihatkan hasil bahwa penambahan air kelapa dapat
meningkatkan pertumbuhan jaringan dalam kultur, baik mendorong pertumbuhan
kalus dan kultur suspensi maupun morfogenesis. Pengaruh air kelapa yang
mendorong pertumbuhan dapat juga disebabkan karena air kelapa dapat
menyangga perubahan pH media. Makin besar konsentrasi air kelapa perubahan
pH media makin menurun (Mandang 1993). Burnet dan Ibrahim (1973) dalam
George dan Sherrington (1984) mendapatkan bahwa penambahan 20% air kelapa
(1/5 bagian dari volume media) diperlukan untuk inisiasi dan pertumbuhan kalus
pada beberapa spesies jeruk dalam media MS (Murashige dan Skoog). Rangan
(1974) dalam George dan Sherrington (1984) memperoleh peningkatan
pertumbuhan Panicum miliaceum yang ditumbuhkan dalam media MS yang
menggunakan 2.4-D dan air kelapa 15%. Steward dan Chaplin (1951) dalam
George dan Sherrington (1984) menunjukkan adanya kerjasama sinergisme antara
2.4-D dan air kelapa dalam menstimulasi pertumbuhan jaringan umbi kentang.
Wattimena (1995) menyatakan bahwa konsentrasi air kelapa 15% adalah yang
optimum pada pengumbian in vitro kentang.
Air kelapa telah diketahui sebagai sumber zat pengatur tumbuh yang kaya,
bagi perkembangan embrio. Salah satu zat tumbuh diantaranya yaitu sitokinin
endogen (Prawiranata et al. 1994). Sitokinin diperlukan dalam pengumbian
kentang secara in vitro. Menurut Wattimena (1983), zat pengatur tumbuh sitokinin
dibutuhkan jika proses pengumbian terjadi dalam keadaan gelap tanpa cahaya.
Sitokinin bekerja dengan memobilisasi hasil metabolisme ke arah lokasi dimana
umbi dibentuk. Palmer dan Smith (1969) mengemukakan bahwa pati aktif dan
sintesa protein dibutuhkan oleh umbi yang sedang terbentuk. Efek mobilitas
sitokinin akan membuat substrat-substrat esensial tersedia untuk proses tersebut.
Peran lain sitokinin dalam pengumbian adalah kemampuannya dalam merangsang
pembelahan sel sepanjang sumbu longitudinal yang berakibat adanya
pembengkakan umbi. Selain sitokinin air kelapa mengandung IAA (Indole Acetic
Air kelapa memiliki pH 4.8–5.3 (Thampan 1981). Hal ini disebabkan
kandungan asam organik yang dijumpai pada air kelapa, dimana asam organik
berfungsi sebagai buffer terhadap perubahan pH (Wattimena et al. 1990).
Beberapa zat pada air kelapa meliputi asam amino, asam nukleat, asam organik,
purin, gula alkohol, gula, vitamin, zat tumbuh dan mineral. Gula yang merupakan
sumber karbohidrat terdapat di dalam air kelapa meliputi sukrosa, glukosa,
fruktosa dan manitol (George & Sherrington 1984). Gula dan alkohol berfungsi
sebagai sumber energi. Gula alkohol yang terkandung dalam air kelapa (inositol)
dalam jumlah 100 mg/l selalu diberikan karena dapat memperbaiki pertumbuhan
tanaman in vitro (Wattimena et al. 1990).
Menurut Dicks (1979) dalam Wattimena (1988) retardan merupakan
senyawa organik sintetik yang bila diberikan pada tanaman yang responsif akan
menghambat perpanjangan sel pada meristem sub apikal, mengurangi
perpanjangan batang tanpa mempengaruhi pertumbuhan dan perkembangan daun
atau tanpa mendorong pertumbuhan yang abnormal. Selanjutnya Wattimena
(1988) menyatakan bahwa pengaruh fisiologis retardan antara lain : menghambat
perpanjangan sel, memperpendek ruas tanaman, mempertebal batang, mencegah
kerebahan, menghambat etiolasi, mempertinggi perakaran stek, menghambat
senescence, memperpanjang masa simpan, meningkatkan pembuahan, membantu
perkecambahan dan pertunasan. Menurut Wattimena (1992) retardan memiliki
kemampuan menghambat biosintesis giberelin sehingga dikenal sebagai anti
giberelin. Pada tanaman kentang terdapat giberelin alami (Okazawa 1973). Untuk
menginisiasi proses pengumbian, kandungan giberelin harus diturunkan, sehingga
pemberian retardan dapat menstimulasi proses pengumbian. Paclobutrazol
merupakan zat penghambat tumbuh yang mempunyai rumus kimia
(2RS. 3RS)-1-(4-chlorophenil)-4.4-dimethyl-2-(1H-1.2.4-triazol-1-yl)pentan-3-ol
dengan rumus empirik C15H20ClN3O. Paclobutrazol merupakan salah satu retardan
dengan senyawa triazol. Mekanisme kerjanya adalah dengan menghambat
oksidasi kaurene menjadi asam kaurenoat, sehingga akan menghambat biosintesis
giberelin. Penghambat biosintesis giberelin endogen tersebut akan mengakibatkan
Aspirin atau asam asetil salisilat merupakan salah satu turunan asam
salisilat (SA). Sintesis asam asetil salisilat berasal dari esterifikasi asam salisilat
dan asam asetat. Aspirin di dalam media kultur jaringan secara otomatis
dihidrolisis menjadi asam salisilat. Asam salisilat dan coumarin memiliki jalur
biosintesis yang sama sehingga penggunaan aspirin diharapkan dapat mensubtitusi
penggunaan coumarin (Metraux & Raskin 1992). Asam salisilat merupakan
hormon tumbuh tanaman yang memiliki pengaruh fisiologis dalam menstimulasi
pembungaan karena menghambat biosintesis etilen dan menginduksi sifat resisten
terhadap patogen dalam jaringan tanaman yang berhubungan dengan reaksi
hipersensitif (HR) dengan menginduksi protein pathogenesis-related (PR)
(Raskin 1995).
Aspirin merupakan nama dagang dari asam asetil salisilat
(Acetyl Salicyllic Acid) yang mengalami hidrolisis secara spontan bila mengalami
kontak dengan suatu larutan. Di dalam kultur in vitro tanaman kentang,
peningkatan aspirin dari 10 mg/l sampai 30 mg/l meningkatkan keseragaman
pembentukan umbi mikro dan bobot basah umbi. Pada kultivar AD 12 bobot
basah umbi terbaik dihasilkan oleh interaksi air kelapa 15% dengan aspirin
30 mg/l dan mepiquat 30 mg/l ((Wattimena et al. 2001, Pulungan 2004).
Penggunaan asam salisilat untuk pengumbian kentang didasarkan pada
coumarin yang dapat menginduksi pembentukan umbi kentang dengan
penggunaan N pada media pengumbian sekitar 4–15 mM. Coumarin dan asam
salisilat mempunyai prazat yang sama yaitu asam sinamat (Wattimena 1988).
Menurut Hahlbrock dan Scheel (1989) dari biosintesisnya yang melalui
jalur shikimat – fenilalanin – asam benzoat – asam salisilat, terlihat bahwa asam
salisilat termasuk ke dalam kelompok fenolik yang berfungsi untuk pembentukan
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Biologi Molekuler dan Seluler
Tanaman Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Lembaga
Penelitian dan Pemberdayaan Masyarakat Institut Pertanian Bogor, pada bulan
Januari sampai dengan Mei 2010.
Bahan dan Alat
Bahan tanaman yang digunakan adalah stek mikro kentang hasil
perbanyakan in vitro dari kultivar Granola yang merupakan koleksi Laboratorium
Biologi Molekuler dan Seluler Tanaman. Media dasar adalah media MS
(Murashige dan Skoog). Bahan lain yang digunakan yaitu agar-agar sebagai bahan
pemadat, aquades, gula, air steril, spirtus, alkohol 70%, betadine, plastik, karet
gelang, tissue.
Alat-alat yang digunakan meliputi labu takar, gelas ukur, pipet, pengaduk,
timbangan, pH meter, timbangan analitik, kompor listrik, panci masak, botol
kultur, autoklaf, sprayer, laminar air flow cabinet, cawan petri, gunting, pinset,
lampu spritus (bunsen), spidol permanen, rak kultur yang dilengkapi dengan
lampu fluorescence untuk perbanyakan stek mikro, kain hitam untuk pengumbian,
oven, desikator dan kamera untuk dokumentasi.
Metode Penelitian
Penelitian ini terdiri dari dua tahap percobaan yaitu : 1) Pengaruh
konsentrasi nitrogen dan sukrosa pada pertumbuhan stek mikro kentang dan
2) Pengaruh konsentrasi nitrogen dan sukrosa pada pengumbian mikro kentang,
sistem pengumbian yang digunakan adalah sistem dua media yaitu padat-cair.
Gambar 2 Bagan alur penelitian.
Tahap 1 : Pengaruh Konsentrasi Nitrogen dan Sukrosa pada Pertumbuhan Stek Mikro Kentang
Percobaan ini menggunakan rancangan perlakuan faktorial yang disusun
secara acak lengkap dengan asumsi setiap satuan percobaan mendapatkan
lingkungan yang sama di laboratorium kultur jaringan. Faktor yang diteliti terdiri
dari dua faktor yaitu konsentrasi nitrogen dan konsentrasi sukrosa. Faktor pertama
adalah nitrogen (N), terdiri dari 4 taraf konsentrasi yaitu 30 mM (N1), 60 mM
(N2), 90 mM (N3) dan 120 mM (N4). Faktor kedua adalah sukrosa (S), terdiri
dari 5 taraf konsentrasi yaitu 30 g/l, 45 g/l, 60 g/l, 75 g/l dan 90 g/l. Pada
masing-masing perlakuan diulang 10 kali sehingga terdapat 200 satuan percobaan. Satu
satuan percobaan adalah satu botol kultur yang terdapat 4 eksplan. Persiapan eksplan 8 minggu
Pengaruh konsentrasi nitrogen dan sukrosa pada pertumbuhan stek mikro kentang 4 minggu
N = 30 mM, 60 mM, 90 mM, dan 120 mM S = 30 g/l, 45 g/l, 60 g/l, 75 g/l dan 90 g/l
(Tahap 1)
Pengaruh konsentrasi nitrogen dan sukrosa pada pengumbian mikro kentang 8 minggu
N = 30 mM, 60 mM, 90 mM, dan 120 mM S = 30 g/l, 45 g/l, 60 g/l, 75 g/l dan 90 g/l
Model statistik linier yang digunakan dalam rancangan menurut Mattjik
dan Sumertajaya (2002) yaitu :
Yijk = µ + αi + βj + (αβ)ij + εijk, dengan
Yijk = nilai pengamatan perlakuan konsentrasi nitrogen ke-i, perlakuan
konsentrasi sukrosa ke-j dan ulangan ke-k
µ = rataan umum ke-i dan perlakuan konsentrasi sukrosa pada taraf ke-j
εijk = pengaruh galat percobaan perlakuan konsentrasi nitrogen ke-i, perlakuan konsentrasi sukrosa ke-j dan ulangan ke-k
Tahap 2 : Pengaruh Konsentrasi Nitrogen dan Sukrosa pada Pengumbian Mikro Kentang
Percobaan ini menggunakan rancangan perlakuan faktorial yang disusun
secara acak lengkap dengan asumsi setiap satuan percobaan mendapatkan
lingkungan yang sama di laboratorium kultur jaringan. Faktor yang diteliti terdiri
dari dua faktor yaitu konsentrasi nitrogen dan konsentrasi sukrosa. Faktor pertama
adalah nitrogen (N), terdiri dari 4 taraf konsentrasi yaitu 30 mM (N1), 60 mM
(N2), 90 mM (N3) dan 120 mM (N4). Faktor kedua adalah sukrosa (S), terdiri
dari 5 taraf konsentrasi yaitu 30 g/l, 45 g/l, 60 g/l, 75 g/l dan 90 g/l. Pada
masing-masing perlakuan diulang 5 kali sehingga terdapat 100 satuan percobaan. Satu
satuan percobaan adalah satu botol kultur yang terdapat 4 planlet.
Model statistik linier yang digunakan dalam rancangan menurut Mattjik
dan Sumertajaya (2002) yaitu :
Yijk = µ + αi + βj + (αβ)ij + εijk, dengan
Yijk = nilai pengamatan perlakuan konsentrasi nitrogen ke-i, perlakuan
konsentrasi sukrosa ke-j dan ulangan ke-k
αi = pengaruh perlakuan konsentrasi nitrogen pada taraf ke-i; i = 1, 2, 3, 4
βj = pengaruh perlakuan konsentrasi sukrosa pada taraf ke-j; j = 1, 2, 3, 4, 5
(αβ)ij = pengaruh interaksi perlakuan konsentrasi nitrogen pada taraf ke-i dan perlakuan konsentrasi sukrosa pada taraf ke-j
εijk = pengaruh galat percobaan perlakuan konsentrasi nitrogen ke-i, perlakuan konsentrasi sukrosa ke-j dan ulangan ke-k
Data hasil pengamatan dianalisis dengan analisis sidik ragam pada taraf
5% dan jika berpengaruh nyata maka dilakukan uji beda nilai tengah dengan uji
wilayah berganda Duncan (Duncan’s Multiple Range Test-DMRT) pada taraf 5%
dan polinomial orthogonal dengan menggunakan program SAS versi 9.12.
Pelaksanaan Penelitian Sterilisasi Botol dan Alat
Botol kultur dicuci bersih dengan menggunakan deterjen, kemudian
disterilisasi di dalam autoklaf dengan suhu 121oC dan tekanan 17.5 psi selama
1 jam. Peralatan yang digunakan untuk menanam seperti gunting, pinset, cawan
petri disterilisasi dengan cara yang sama seperti sterilisasi botol kultur.
Pembuatan media pertunasan atau perbanyakan stek mikro kentang
Media pertunasan atau perbanyakan menggunakan media Murashige dan
Skoog (MS), yang dibuat dari larutan dengan kode A, B, C, D, E, F, G dan H
yaitu larutan yang berisi garam-garam anorganik dan vitamin dari media MS yang
dicampur berdasarkan jenis garamnya (Lampiran 2). Khusus untuk konsentrasi
larutan A dan B yang mengandung nitrogen dibuat sesuai perlakuan yaitu 30 mM
(N1) dipipet 10 ml/l, 60 mM (N2) dipipet 20 ml/l, 90 mM (N3) dipipet 30 ml/l
dan 120 mM (N4) dipipet 40 ml/l. Konsentrasi media larutan yang lainnya dipipet
dalam volume tertentu sesuai dengan konsentrasi yang dibutuhkan setelah itu
ditambahkan myo-inositol, sukrosa dibuat sesuai perlakuan yaitu 30 g/l, 45 g/l,
60 g/l, 75 g/l dan 90 g/l, CAP dan vitamin. Larutan media diaduk merata dan
Pengukuran pH dilakukan dengan menggunakan pHmeter. Selanjutnya larutan
media ditambah agar-agar dan dimasak hingga mendidih. Setelah itu media
dimasukkan ke dalam botol kultur yang telah disterilisasi sebanyak 20 ml setiap
botol. Botol yang telah diisi media ditutup dengan plastik, dan diikat dengan karet
gelang, lalu disterilisasi kembali pada tekanan 17.5 psi selama 30 menit,
kemudian media tersebut disimpan selama 3 hari sebelum digunakan.
Perbanyakan stek mikro kentang
Penanaman stek mikro dilakukan pada laminar air flow cabinet yang telah
disemprot alkohol 70%. Stek mikro dipindahkan ke dalam cawan petri yang berisi
air steril dan betadine, kemudian dipotong menjadi stek mikro buku tunggal. Pada
setiap botol ditanam potongan stek mikro dengan posisi mendatar sebanyak
4 eksplan (1 buku setiap eksplan). Botol yang sudah berisi potongan stek mikro
ditutup kembali dengan plastik dan diikat dengan karet gelang. Setelah itu botol
diletakkan di atas rak kultur dengan fotoperiode 24 jam perhari dan suhu ruang
kultur 15-20oC.
Pengumbian
Media pengumbian yaitu media MS cair yang memiliki konsentrasi
nitrogen yang dibuat sesuai perlakuan yaitu 30 mM (N1) dipipet 10 ml/l, 60 mM
(N2) dipipet 20 ml/l, 90 mM (N3) dipipet 30 ml/l dan 120 mM (N4) dipipet
40 ml/l. Sukrosa dibuat sesuai perlakuan yaitu 30 g/l, 45 g/l, 60 g/l, 75 g/l dan
90 g/l, kemudian ditambah air kelapa 15%, paclobutrazol 10 ppm dan aspirin
30 mg/l. Media pengumbian dimasukkan ke dalam botol kultur yang berisi tunas
in vitro dari media pertunasan yang telah berumur 4 minggu. Botol ditutup
kembali dengan plastik dan diikat dengan karet gelang. Setelah itu botol
diletakkan di atas rak kultur dan sekelilingnya ditutup dengan kain berwarna
hitam yang tidak tembus cahaya dengan suhu ruang kultur 15-20oC. Setelah
8 minggu diberikan media pengumbian, umbi dipanen dengan mengeluarkan
Pengamatan Penelitian
Peubah-peubah yang diamati pada penelitian ini meliputi :
Tahap 1 : Pengaruh konsentrasi nitrogen dan sukrosa pada pertumbuhan stek mikro kentang
a. Jumlah tunas Dihitung berdasarkan banyaknya tunas yang muncul pada planlet, diamati pada 2 dan 4 minggu setelah tanam.
b. Panjang ruas dihitung dengan menggunakan rumus : y
Keterangan : y = panjang ruas, diamati pada 2 dan 4 minggu setelah tanam. c. Jumlah buku Pengamatan dilakukan dengan menghitung banyaknya buku
pada eksplan, diamati pada 2 dan 4 minggu setelah tanam.
d. Tinggi tanaman Pengamatan dilakukan dengan mengukur tinggi tanaman dari luar botol kultur dimulai dari permukaan media sampai ujung tanaman, pada
2 dan 4 minggu setelah tanam.
e. Jumlah akar Pengamatan dilakukan dengan menghitung banyaknya akar yang tumbuh pada setiap eksplan, diamati pada 2 dan 4 minggu setelah tanam.
f. Bobot basah planlet Pengamatan dilakukan dengan menimbang planlet 4 minggu setelah tanam pada masing-masing perlakuan dari seluruh ulangan
dengan neraca analitik kemudian nilainya dirata-ratakan.
g. Persentase bobot kering planlet Planlet dibungkus dalam kantong kertas, kemudian dikeringkan dalam oven pada suhu 60oC selama 1 minggu sampai
bobot keringnya konstan. Selanjutnya planlet dimasukkan ke dalam desikator
dan ditimbang. Setelah itu dihitung persentase bobot keringnya dengan
menggunakan rumus :
y %
Tahap 2 : Pengaruh konsentrasi nitrogen dan sukrosa pada media pengumbian mikro kentang
a. Waktu pembentukan umbi Diamati setiap minggu dengan melihat umbi pertama yang terbentuk dari planlet dalam botol kultur.
b. Kecepatan dan Keseragaman pembentukan umbi (persentase pengumbian) Kecepatan dan keseragaman pembentukan umbi dihitung dalam persen baik per eksplan maupun per botol dengan asumsi jumlah umbi waktu
panen adalah 100%.
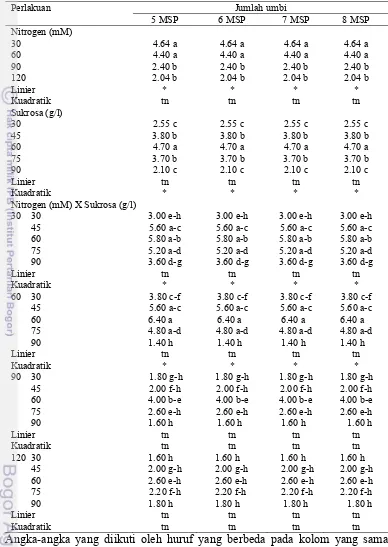
c. Jumlah umbi per botol Umbi diamati setiap minggu dengan cara menghitung jumlah umbi yang terbentuk dalam botol kultur.
d. Ukuran umbi Ukuran umbi dihitung dengan mengukur rataan ukuran umbi berdasarkan diameter (mm) dari bobot basah (mg/umbi).
e. Bobot basah umbi per botol Pengamatan dilakukan dengan menimbang umbi yang telah dipanen (8 MSP) pada masing-masing perlakuan dari seluruh
ulangan dengan neraca analitik kemudian nilainya dirata-ratakan.
f. Persentase bobot kering umbi Umbi dibungkus dalam kantong kertas (4 umbi terbesar setiap ulangan), kemudian dikeringkan dalam oven pada suhu
60oC selama 1 minggu sampai bobot keringnya konstan. Selanjutnya umbi
dimasukkan ke dalam desikator dan ditimbang. Setelah itu dihitung persentase
bobot keringnya dengan menggunakan rumus:
y %
Hasil
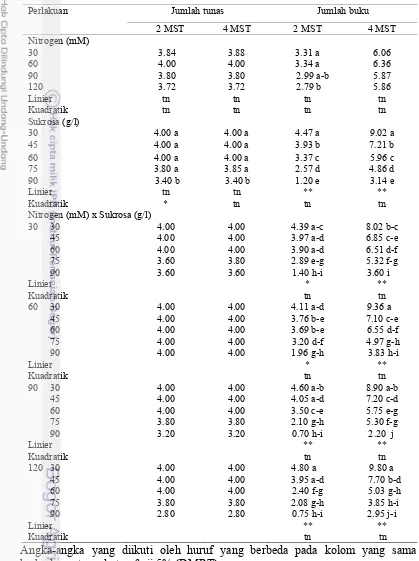
Jumlah Tunas
Tidak terdapat pengaruh konsentrasi nitrogen serta interaksi antara
konsentrasi nitrogen dan sukrosa terhadap jumlah tunas, tetapi sangat dipengaruhi
oleh konsentrasi sukrosa (Lampiran 1). Peningkatan konsentrasi sukrosa lebih
dari 75 g/l akan menurunkan jumlah tunas pada umur 2 dan 4 MST. Jumlah tunas
sebesar 4.05 tunas dihasilkan oleh konsentrasi sukrosa optimum 45.36 g/l pada
2 MST ( Tabel 1, Lampiran 14 nomor 1).
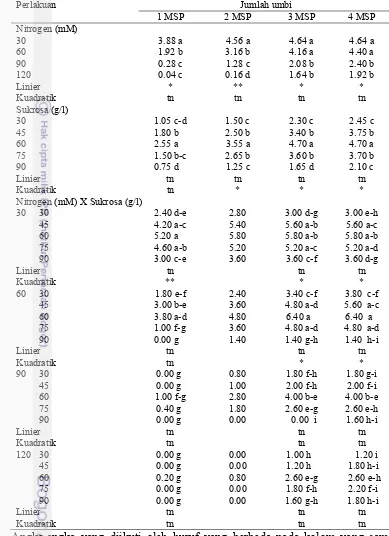
Jumlah Buku
Pengaruh konsentrasi nitrogen pada 2 MST, konsentrasi sukrosa pada
2 MST dan 4 MST serta interaksi antara konsentrasi nitrogen dan sukrosa pada
2 MST dan 4 MST adalah nyata terhadap jumlah buku (Lampiran 1). Jumlah buku
tertinggi pada 2 MST dihasilkan oleh konsentrasi nitrogen 60 mM yaitu
3.34 buku. Peningkatan konsentrasi sukrosa dari 30 g/l sampai dengan 90 g/l
cenderung menyebabkan penurunan jumlah buku, dimana jumlah buku tertinggi
dihasilkan oleh konsentrasi sukrosa 30 g/l yaitu 4.47 buku pada 2 MST dan
9.02 buku pada 4 MST. Interaksi antara konsentrasi nitrogen 120 mM dan sukrosa
30 g/l menghasilkan jumlah buku tertinggi yaitu 4.80 buku pada 2 MST dan
9.80 buku pada 4 MST. Pada 2 MST dan 4 MST semakin tinggi konsentrasi
sukrosa jumlah buku semakin sedikit. Pada taraf konsentrasi nitrogen 30 mM
sampai dengan 120 mM peningkatan taraf konsentrasi sukrosa dari 30 g/l sampai
dengan 90 g/l nyata menurunkan jumlah buku (Tabel 1, Lampiran 14 nomor 2, 3,
Tabel 1 Pengaruh konsentrasi nitrogen dan sukrosa terhadap jumlah tunas dan jumlah buku
Angka-angka yang diikuti oleh huruf yang berbeda pada kolom yang sama berbeda nyata pada taraf uji 5% (DMRT).
Perlakuan Jumlah tunas Jumlah buku
2 MST 4 MST 2 MST 4 MST
Nitrogen (mM) x Sukrosa (g/l)
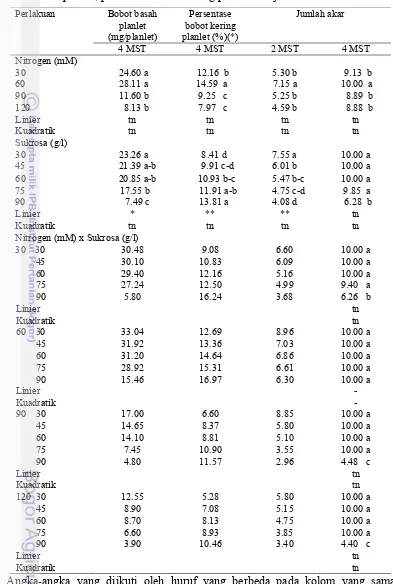
Bobot Basah Planlet dan Persentase Bobot Kering Planlet
Tidak terdapat interaksi antara konsentrasi nitrogen dan sukrosa terhadap
bobot basah planlet dan persentase bobot kering planlet tetapi sangat dipengaruhi
oleh konsentrasi nitrogen maupun sukrosa (Lampiran 1). Konsentrasi nitrogen
60 mM menghasilkan bobot basah planlet dan persentase bobot kering planlet
tertinggi yaitu 28.11 mg/planlet dan 14.59%. Bobot basah planlet tertinggi
dihasilkan oleh konsentrasi sukrosa 30 g/l yaitu 23.26 mg/planlet sebaliknya
persentase bobot kering planlet tertinggi diperoleh pada konsentrasi sukrosa 90 g/l
yaitu 13.81%. Semakin tinggi konsentrasi sukrosa menurunkan bobot basah
planlet sebaliknya meningkatkan persentase bobot kering planlet karena semakin
banyak karbohidrat yang disimpan (Tabel 2, Lampiran 14 nomor 12 dan 13).
Jumlah Akar
Pengaruh konsentrasi nitrogen, konsentrasi sukrosa pada 2 MST dan
4 MST serta interaksi antara konsentrasi nitrogen dan sukrosa pada 4 MST adalah
nyata terhadap jumlah akar (Lampiran 1). Jumlah akar tertinggi dihasilkan oleh
konsentrasi nitrogen 60 mM yaitu 7.15 akar pada 2 MST dan 10.00 akar pada
4 MST. Konsentrasi sukrosa 30 g/l menghasilkan jumlah akar tertinggi yaitu
7.55 akar pada 2 MST sedangkan pada 4 MST konsentrasi sukrosa 30 g/l sampai
dengan 75 g/l menghasilkan jumlah akar tertinggi yaitu 10.00 akar dan 9.85 akar.
Interaksi antara konsentrasi nitrogen dan sukrosa pada 4 MST menghasilkan
jumlah akar tertinggi 10.00 akar dan 9.40 akar yaitu pada konsentrasi nitrogen
30 mM dan sukrosa 30 g/l sampai dengan 75 g/l, konsentrasi nitrogen 60 mM dan
sukrosa 30 g/l sampai dengan 90 g/l, konsentrasi nitrogen 90 mM dan sukrosa
30 g/l sampai dengan 75 g/l serta konsentrasi nitrogen 120 mM dan sukrosa 30 g/l
sampai dengan 75 g/l. Pada 2 MST peningkatan konsentrasi sukrosa menurunkan
Tabel 2 Pengaruh konsentrasi nitrogen dan sukrosa terhadap bobot basah planlet, persentase bobot kering planlet dan jumlah akar
Angka-angka yang diikuti oleh huruf yang berbeda pada kolom yang sama berbeda nyata pada taraf uji 5% (DMRT); (*) data untuk pengolahan statistik ditransformasi ke Arcsin√persen.
Perlakuan Bobot basah
planlet
Nitrogen (mM) x Sukrosa (g/l)
Panjang Ruas
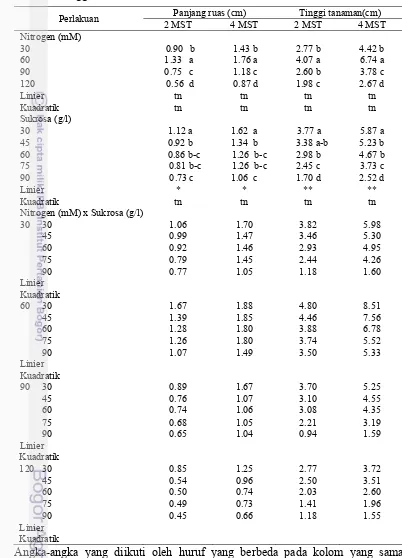
Perlakuan konsentrasi nitrogen yang digunakan memberikan pengaruh
yang nyata terhadap panjang ruas, demikian juga dengan perlakuan konsentrasi
sukrosa, sedangkan interaksi antara konsentrasi nitrogen dan sukrosa memberikan
pengaruh yang tidak nyata terhadap panjang ruas (Lampiran 1). Panjang ruas
tertinggi dihasilkan dari konsentrasi nitrogen 60 mM yaitu 1.33 cm pada 2 MST
dan 1.76 cm pada 4 MST, sedangkan untuk sukrosa panjang ruas tertinggi
dihasilkan oleh konsentrasi 30 g/l yaitu 1.12 cm pada 2 MST dan 1.62 cm pada
4 MST. Peningkatan konsentrasi sukrosa menyebabkan panjang ruas semakin
pendek (Tabel 3, Lampiran 14 nomor 15 dan 16).
Tinggi Tanaman
Pengaruh konsentrasi nitrogen pada 2 MST dan 4 MST demikian juga
dengan konsentrasi sukrosa pada 2 MST dan 4 MST adalah nyata terhadap tinggi
tanaman (Lampiran 1). Tanaman tertinggi dihasilkan oleh konsentrasi nitrogen
60 mM yaitu 4.07 cm pada 2 MST dan 6.74 cm pada 4 MST. Tanaman tertinggi
dihasilkan oleh konsentrasi sukrosa 30 g/l yaitu 3.77 cm pada 2 MST dan 5.87 cm
pada 4 MST. Peningkatan konsentrasi sukrosa menyebabkan tanaman semakin
Tabel 3 Pengaruh konsentrasi nitrogen dan sukrosa terhadap panjang ruas dan tinggi tanaman
Perlakuan Panjang ruas (cm) Tinggi tanaman(cm)
2 MST 4 MST 2 MST 4 MST
Nitrogen (mM) x Sukrosa (g/l)
30 30 1.06 1.70 3.82 5.98
Angka-angka yang diikuti oleh huruf yang berbeda pada kolom yang sama berbeda nyata pada taraf uji 5% (DMRT).
Waktu Pembentukan Umbi
Pada minggu pertama setelah diberikan media pengumbian, umbi telah
terbentuk kecuali pada konsentrasi nitrogen 60 mM dan sukrosa 90 g/l,
konsentrasi nitrogen 90 mM dan sukrosa 30 g/l, konsentrasi nitrogen 90 mM dan
sukrosa 45 g/l umbi baru terbentuk pada 2 minggu setelah pengumbian. Untuk
konsentrasi nitrogen 120 mM dan sukrosa 30 g/l, konsentrasi nitrogen 120 mM
dan sukrosa 45 g/l, konsentrasi nitrogen 120 mM dan sukrosa 75 g/l serta
konsentrasi nitrogen 120 mM dan sukrosa 90 g/l umbi baru terbentuk pada
3 minggu setelah pengumbian. Konsentrasi nitrogen 90 mM dan sukrosa 90 g/l
umbi baru terbentuk pada 4 minggu setelah pengumbian. Hal ini menunjukkan
bahwa konsentasi nitrogen yang rendah 30 mM dengan taraf konsentrasi sukrosa
30 g/l sampai dengan 90 g/l pembentukan umbi lebih cepat.
Kecepatan dan Keseragaman Pembentukan Umbi
Keberhasilan proses pengumbian dapat dilihat dari kecepatan dan
tingkat keseragaman pembentukan umbi. Persentase pengumbian dihitung
berdasarkan dua cara, yaitu (1) kecepatan tumbuh umbi mikro berdasarkan jumlah
umbi mikro yang terbentuk dibagi dengan jumlah umbi mikro pada minggu
terakhir pengamatan ( 8 MSP) pada setiap botol dengan asumsi jumlah botol pada
8 MSP adalah 100% dan (2) Keseragaman tumbuh umbi mikro yang didapat dari
perhitungan jumlah botol yang telah berumbi dalam satu perlakuan. Perhitungan
kecepatan pembentukan umbi diperlukan untuk menentukan perlakuan yang
mempercepat pengumbian sedangkan keseragaman pembentukan umbi digunakan
untuk melihat tingkat keseragaman pengumbian dalam satu perlakuan.
Dalam penelitian ini pembentukan umbi mikro sudah terbentuk pada
1 MSP dan terus meningkat hingga 5 MSP (Tabel 4). Pada perlakuan dengan
menggunakan konsentrasi nitrogen 30 mM dengan berbagai taraf konsentrasi
sukrosa kecepatan pengumbian sudah mencapai lebih dari 50% pada 1 MSP.
Untuk keseragaman pengumbian sudah mencapai 100% pada 1 MSP, kecuali pada
konsentrasi nitrogen 30 mM dan sukrosa 90 g/l. Pada 2 MSP konsentrasi nitrogen
keseragaman pengumbian yang lebih tinggi dibandingkan perlakuan lainnya.
Taraf konsentrasi sukrosa yang optimum pada 1, 2 dan 4 MSP adalah 60 g/l.
Tabel 4 Pengaruh konsentrasi nitrogen dan sukrosa terhadap kecepatan dan keseragaman pembentukan umbi
Perlakuan